Рутений, свойства атома, химические и физические свойства
Рутений, свойства атома, химические и физические свойства.
Ru 44 Рутений
101,07(2) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d7 5s1
Рутений — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 44. Расположен в 8-й группе (по старой классификации — побочной подгруппе восьмой группы), пятом периоде периодической системы.
Атом и молекула рутения. Формула рутения. Строение атома рутения
Изотопы и модификации рутения
Свойства рутения (таблица): температура, плотность, давление и пр.
Физические свойства рутения
Химические свойства рутения. Взаимодействие рутения. Химические реакции с рутением
Получение рутения
Применение рутения
Таблица химических элементов Д.И. Менделеева
Атом и молекула рутения.
 Формула рутения. Строение атома рутения:
Формула рутения. Строение атома рутения:Рутений (лат. Ruthenium, назван в честь России) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ru и атомным номером 44. Расположен в 8-й группе (по старой классификации – побочной подгруппе восьмой группы), пятом периоде периодической системы.
Рутений – металл. Относится к группе переходных металлов, а также к драгоценным, цветным металлам и металлам платиновой группы.
Рутений обозначается символом Ru.
Как простое вещество рутений при нормальных условиях представляет собой металл серебристо-белого цвета.
Молекула рутения одноатомна.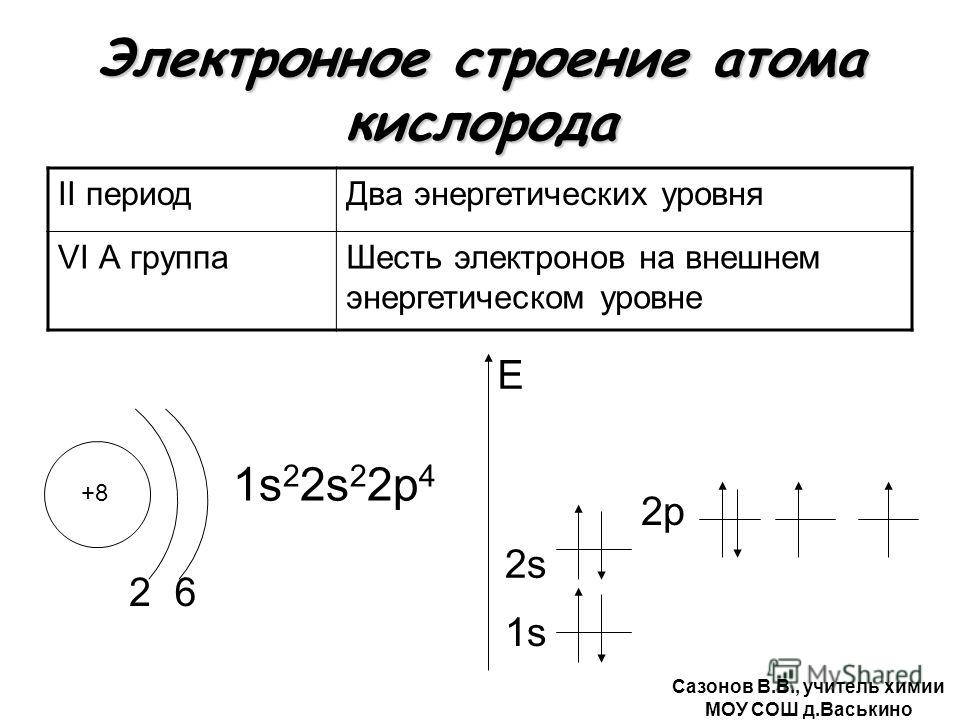
Химическая формула рутения Ru.
Электронная конфигурация атома рутения 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d7 5s1. Потенциал ионизации (первый электрон) атома рутения равен 710,18 кДж/моль (7,36050 (5) эВ).
Строение атома рутения. Атом рутения состоит из положительно заряженного ядра (+44), вокруг которого по пяти оболочкам движутся 44 электрона. При этом 41 электрон находится на внутреннем уровне, а 2 электрона – на внешнем. Поскольку рутений расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома рутения на 4d-орбитали находится четыре спаренных и три неспаренных электрона. На внешнем энергетическом уровне атома рутения на s-орбитали находится один неспаренный электрон. В свою очередь ядро атома рутения состоит из 44 протонов и 57 нейтронов. Рутений относится к элементам d-семейства.
На внешнем энергетическом уровне атома рутения на s-орбитали находится один неспаренный электрон. В свою очередь ядро атома рутения состоит из 44 протонов и 57 нейтронов. Рутений относится к элементам d-семейства.
Радиус атома рутения (вычисленный) составляет 178 пм.
Атомная масса атома рутения составляет 101,07(2) а. е. м.
Рутений является единственным платиновым металлом, который обнаруживается в составе живых организмов.
Рутений, свойства атома, химические и физические свойства
Изотопы и модификации рутения:
Свойства рутения (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Рутений |
| 102 | Прежнее название | |
| 103 | Латинское название | Ruthenium |
| 104 | Английское название | Ruthenium |
| 105 | Символ | Ru |
| 106 | Атомный номер (номер в таблице) | 44 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, драгоценный, цветной металл, металл платиновой группы |
| 109 | Открыт | Карл-Эрнст Карлович Клаус, Россия, 1844 г. |
| 110 | Год открытия | |
| 111 | Внешний вид и пр. | Серебристо-белый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 9,9·10-8 % |
| 120 | Содержание в морях и океанах (по массе) | 7,0·10-11 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 4,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 5,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000081 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 101,07(2) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d7 5s1 |
| 203 | Электронная оболочка | K2 L8 M18 N15 O1 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 178 пм |
| 205 | Эмпирический радиус атома* | 130 пм |
| 206 | Ковалентный радиус* | 146 пм |
| 207 | Радиус иона (кристаллический) | Ru3+ 82 (6) пм, Ru4+ 76 (6) пм, Ru5+ 70,5 (6) пм, Ru7+ 52 (4) пм, Ru8+ 50 (4) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 44 электрона, 44 протона, 57 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 8-ая группа (по старой классификации – побочная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, 0, +1, +2, +3, +4, +5, +6, +7, +8 |
| 302 | Валентность | II, III, IV, V, VI, VII, VIII |
| 303 | Электроотрицательность | 2,2 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 710,18 кДж/моль (7,36050 (5) эВ) |
| 305 | Электродный потенциал | Ru2+ + 2e– → Ru, Eo = +0,45 В, Ru3+ + e– → Ru2+ Ru3+ + 3e– → Ru, Eo = +0,38 В |
| 306 | Энергия сродства атома к электрону | 100,96(3) кДж/моль (1,04638(25) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 12,45 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 10,65 г/см3 (при температуре плавления 2334 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 2334 °C (2607 K, 4233 °F) |
| 403 | Температура кипения* | 4150 °C (4423 K, 7502 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 38,59 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 619 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,238 Дж/г·K (при 0-25 °C) |
| 410 | Молярная теплоёмкость* | 24,06 Дж/(K·моль) |
| 411 | Молярный объём | 8,17057 см³/моль |
| 412 | Теплопроводность | 117 Вт/(м·К) (при стандартных условиях), 117 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Гексагональная плотноупакованная
|
| 513 | Параметры решётки | a = 2,706 Å, c = 4,282 Å |
| 514 | Отношение c/a | 1,582 |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-18-8 |
Примечание:
205* Эмпирический радиус атома рутения согласно [1] и [3] составляет 134 пм.
206* Ковалентный радиус рутения согласно [1] и [3] составляет 146±7 пм и 125 пм соответственно.
401* Плотность рутения согласно [3] и [4] составляет 12,41 г/см
402* Температура плавления рутения согласно [4] составляет 2250 °С (2523,15 K, 4082 °F).
403* Температура кипения рутения согласно [3] и [4] составляет 4077 °C (4350 K, 7371 °F) и 4200 °C (4473,15 K, 7592 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) рутения согласно [4] составляет 24 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) рутения согласно [4] составляет 602 кДж/моль.
410* Молярная теплоёмкость рутения согласно [3] составляет 24 Дж/(K·моль).
Физические свойства рутения:
Химические свойства рутения.
 Взаимодействие рутения. Химические реакции с рутением:
Взаимодействие рутения. Химические реакции с рутением:
Получение рутения:
Применение рутения:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
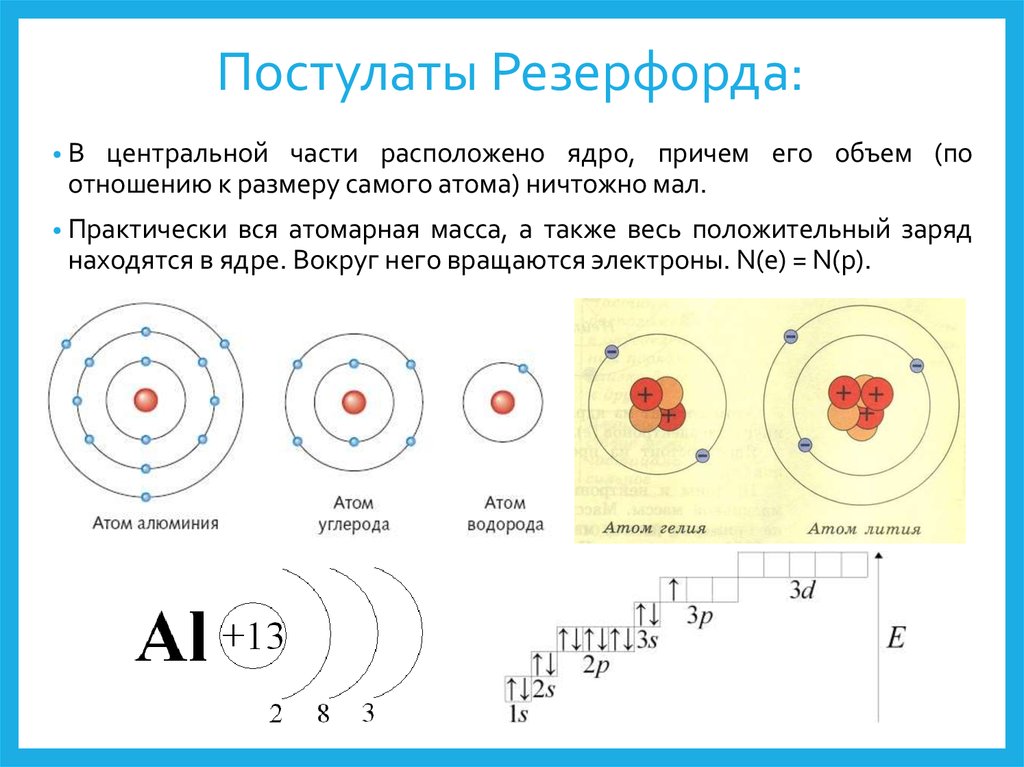
- 13. Алюминий
- 14. Кремний
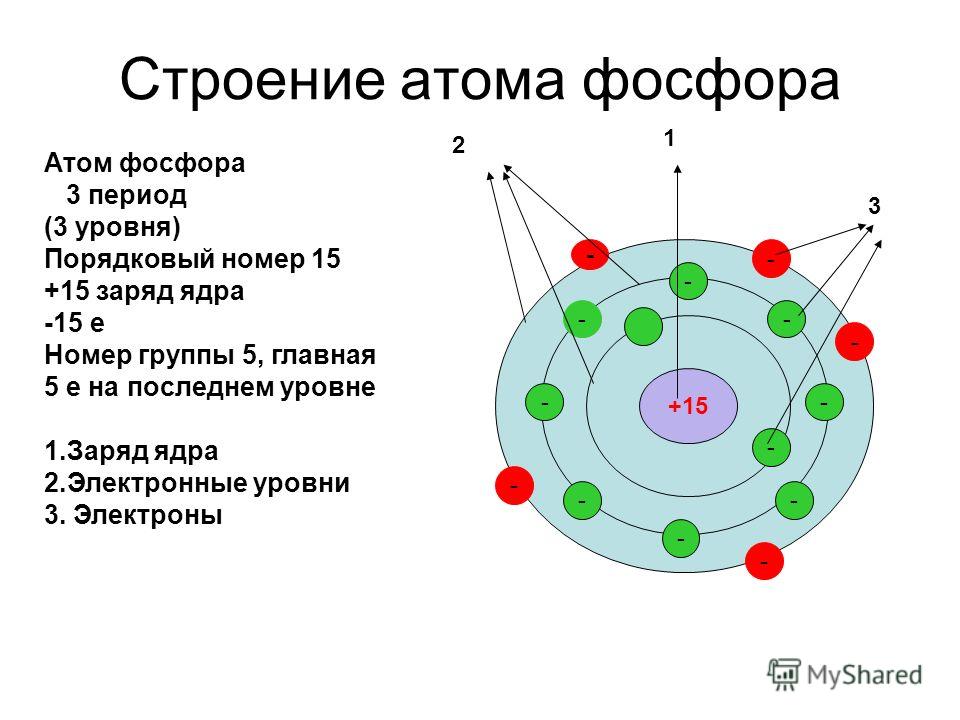
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28.
 Никель
Никель - 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62.
 Самарий
Самарий - 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95.
 Америций
Америций - 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Ruthenium
- https://de.wikipedia.org/wiki/Ruthenium
- https://ru.wikipedia.org/wiki/Рутений
- http://chemister.
 ru/Database/properties.php?dbid=1&id=254
ru/Database/properties.php?dbid=1&id=254 - https://chemicalstudy.ru/ruteniy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
рутений атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле рутения рутений
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 1 018
2 Строение рутения
В
периодической системе Д. И. Менделеева
рутений имеет порядковый номер 44 и
характеризуется атомной массой, равной
107,07 .
И. Менделеева
рутений имеет порядковый номер 44 и
характеризуется атомной массой, равной
107,07 .
Рутений состоит из следующих стабильных изотопов: Ru96, Ru98, Ru100, Ru101, Ru102, Ru104
На основании результатов исследования рентгеновских эмиссионных спектров рутения и теоретических расчетов установлено следующее распределение электронов в электронных оболочках атома рутения
Рисунок 1 – Распределение электронов в электронных оболочках атома рутения
Подобная структура электронных оболочек позволила отнести рутений, равно как и другие металлы платиновой группы, к переходным элементам.
Наиболее
полную информацию о свойствах Металла
можно получить с помощью представления
о поверхности Ферми, о ее форме,
площади, плотности состояний. Форма и
топологические особенности поверхности
Ферми определяются взаимодействием
электронных волн с атомными плоскостями
кристалла и числом валентных электронов.
Экспериментальное построение поверхности Ферми основано на изучении ряда физических свойств металла.
Поверхность Ферми рутения состоит из шести л истов. Сечения которых плоскостями симметрии зоны Бриллюэна показаны на рис. 1, а. На рис. 1, б, в представлена объемная модель поверхности Ферми. Видно, что имеются три замкнутые дырочные поверхности эллипсоидальной формы центрированные в точках L, V и Г (лист ) зоны Бриллюэна, и две замкнутые электронные поверхности с центром в Г (Г2 и Г3). Кроме замкнутых поверхностей имеется открытая (многосвязная) дырочная поверхность, представляющая собой совокупность дырочных полостей, центрированных в точке М и соединенных друг с другом «шейками» через К и L.
Рисунок 2 – Модель поверхности ферми рутения
Дырочные
эллипсоиды, центрированные в точке L лежат
внутри шеек и касаются их поверхности
в направлении А зоны Бриллюэна.
Число дырок внутри замкнутых дырочных листов L, V, Г и дырок, ограниченных открытой многосвязной поверхностью в пределах одной зоны Бриллюэна, равно числу электронов внутри замкнутых электронных листов Г2 и Г3.
Результаты измерений магнитосопротивления и эффекта Холла монокристалла Ru хорошо согласуются с предложенной моделью поверхности Ферми.
2.2 Кристалическая структура рутения
Рутений обладает гексагональной плотноупакованной решеткой типа Mg (A3). Координационное число К=12. Пространственная группа – дигексагональная, бипирамидальная, элементарная ячейка содержит два атома. Данные измерений постоянных пространственной решетки а и с приведены в таблице 3
Таблица 3 – Данные измерений постоянных пространственной решетки
а, | с, | с/а | t,˚C |
2,7058 | 4,2819 | – | 27 |
2,706 | 4,2837 | – | – |
2,7058±0,0001 | 4,281 | 1,63204±0,00002 | 21,8 |
2,7015 | 4,276 | 1,5828 | – |
2,670 | 4,273 | – | До 1600 |
2,7004 | 4,273 | – | 25 |
2,6987±0,0005 | – | 1,5833±0,0005 | 18 |
2,6986 | – | 1,5834 | 18 |
2,7056 | – | 1,582 | 20 |
Сопоставление полученных данных с
идеальной гексагональной плотной
упаковкой, где отношение с/а = 1,633,
показывает, что решетка рутения несколько
сжата в одном направлении.
При повышении температуры постоянные решетки увеличиваются. Исследование этой зависимости проведено в интервале температур 20-600°С. Для начальной и конечной температур исследованной области получены следующие значения:
Таблица 4 – Начальная и конечная температура
20˚C | 600˚C | |
a | ||
c | 4,2985 |
Температурная зависимость периодов решетки рутения в интервале от 0 до 2200°С приведена в работе. В работе представлены данные об изменении периодов решетки рутения при изменении давления; температура эксперимента 25°С
Таблица 5 – Изменение периодов решетки при изменении давления
, бар | 0 | 50 | 100 | 150 | 200 | 250 | 300 | 350 | 400 |
V/ | 1000 | 0,985 | 0,985 | 0,956 | 0,943 | 0,931 | 0,919 | 0,909 | 0,901 |
c | 4,275 | 4,235 | 4,236 | 4,215 | 4,195 | 4,177 | 4,163 | 4,152 | 4,144 |
a | 2,700 | 2,688 | 2,677 | 2,652 | 2,652 | 2,640 | 2,628 | 2,618 | 2,608 |
c/a | 1,584 | 1,584 | 1,582 | 1,582 | 1,582 | 1,582 | 1,584 | 1,586 | 1,589 |
При электронографическом исследовании
рутения, осажденного восстановлением
из раствора, на коллодиевой мембране
обнаружена новая кубическая модификация
металла. Она имеет гранецентрированную
решетку с периодом а, равным 3,82 .
Она имеет гранецентрированную
решетку с периодом а, равным 3,82 .
Энергия решетки рутения , составляющая 1184 ккал/моль , была высчитана по уравнению
-U=IV+S (1)
где: I – ионизационный потенциал = 1;
V — металлическая валентность;
S—теплота сублимации.
Энергия активации самодиффузии в кристалле была рассчитана по уравнению
E=3,15· (2)
где: – температура плавления;
а – плотность упаковки, составляющая 73%;
E=108 ккал/моль.
Решение задачи
Задача 10
-
Реакция разложения карбоната двухвалентного металла: MCO3 → MO + CO2↑, т.е. потеря массы приходится на CO2. Следовательно, остальные 64,9% – это оксид металла, и M(MO)/M(CO2)=64,9/35,1 ⇒ M(MO)=44,0·64,9/35,1=81,4 а.
 е.м. Отсюда M (M) = 65.4 и М = Zn.
е.м. Отсюда M (M) = 65.4 и М = Zn. -
ZnO+ 2HCl → ZnCl2+ H2O; ZnO+ 2NaOH + H2O → Na2[Zn(OH)4].
-
nH2O: M(Zn(NO3)2·nH2O)/M(Zn(NO3)2) = 100% / 63,7% = (189,4 + 18n) / 189,4; n=6.
-
Процентная концентрация фактически дана в условии задачи: ω=63,7%; смас=63,7/(100/1,4)=0,892г/мл; смол = смас/M(Zn(NO3)2)=0,00471 моль/мл.
-
Zn(NO3)2→ ZnO + 2NO2↑+ ½O2↑. ν(газов)=pV/RT=1·2,76/(0.082·673)=0,05моль=> ν (NO2) = 0.04 моль, ν (O2) = 0.01 моль, ν (Zn(NO3)2) = 0.02 моль, или3,79 г.
Задача 100
Масса смеси составит 3,5*106*0,584 = 2044000 г или 2044 кг. Пропана в смеси 0,58*2044 = 1185,5 кг или 1185,5/44 = 26,94 кмоль. Бутана в смеси 0,42*2044 = 858,5 кг или 858,5/58 = 14,80 кмоль. Мольное отношение пропан/бутан составляет 1,82, общее количество молекул в цистерне газовоза (26,94 + 14,80)*103*6,02*1023 = 2,51*1028, атомов (26,94*11 + 14,80*14)*103*6,02*1023 = 3,03*1029 шт. Объем газообразной смеси при н.у. равен (26,94 + 14,80)*103*22,4 = 935*103 л или 935 м3, что в 935/3,5 = 267 раз больше объема жидкости.
Пропана в смеси 0,58*2044 = 1185,5 кг или 1185,5/44 = 26,94 кмоль. Бутана в смеси 0,42*2044 = 858,5 кг или 858,5/58 = 14,80 кмоль. Мольное отношение пропан/бутан составляет 1,82, общее количество молекул в цистерне газовоза (26,94 + 14,80)*103*6,02*1023 = 2,51*1028, атомов (26,94*11 + 14,80*14)*103*6,02*1023 = 3,03*1029 шт. Объем газообразной смеси при н.у. равен (26,94 + 14,80)*103*22,4 = 935*103 л или 935 м3, что в 935/3,5 = 267 раз больше объема жидкости.
- С3Н8 + 5О2 = 3СО2 + 4Н2О(ж) (DrQ0= 3*393,5 + 4*241,8 – 103,9 = 2043,8 кДж/моль).
С4Н10 + 6,5О2 = 4СО2 + 5Н2О(ж) (DrQ0= 4*393,5 + 5*241,8 – 126,2 = 2656,8 кДж/моль). - При сгорании всей смеси, содержащейся в газовозе, выделится 26,94*103*2043,8 + 14,80*103*2656,8 = (55060 + 39321)*103 кДж = 94,4*106 кДж тепла.

- Масса бензина (октана) 3,5*106*0,703 = 2460500 г или 2460,5 кг. Его количество 2460,5/114 = 21,58 кмоль. Теплота сгорания: С8Н18 + 12,5О2 = 8СО2 + 9Н2О(ж) (DrQ0= 8*393,5 + 9*241,8 – 249,9 = 5074,3 кДж/моль). Количество тепла, которое выделится при сгорании всего бензина 21,58*103*5074,3 = 109,5*106 кДж. Получается, что приобретать пропан-бутановую смесь выгоднее в 94,4*106/3 : 109,5*106/5 = 1,44 раза.
- СН3-СH2-CH(СН3)-CH2-CH2-CH2-CH3(3-метилгептан) – 8 монохлорпроизводных; а) (СН3)3С-С(СН3)3 (2,2,3,3-тетраметилбутан) – 1; б) СН3-CH2-СH2-CH(СН3)-CH2-CH2-CH3(4-метилгептан) – 5.
Задача 101
1. Поскольку при сжигании Х были получены только углекислый газ и вода, Х могло содержать углерод, водород и кислород. Найдем количество образовавшихся при сгорании Х веществ: n(СО2) = 10,08 / 22,4 = 0,45 моль; n(Н2О) = 3,6 /18 = 0,2 моль. Следовательно, количество углерода и водорода, содержащееся в сжигаемой навеске Х равно: n(С) = 0,45 моль; n(Н) = 0,4 моль; n(О) = (6,6 – (0,45 × 12 + 0,4 × 1)) / 16 = 0,05 моль. Установим простейшую формулу соединения Х: С : Н : О = 0,45 : 0,4 : 0,05 = 9 : 8 : 1, т.е. С9Н8О. Поскольку плотность паров соединения Х по воздуху не превышает 5, его молярная масса не должна превышать 5 × 29 = 145 г/моль. Молярная масса вещества, имеющего формулу С9Н8О (совпадающую с простейшей) равна 132 г/моль, следовательно, соединение Х имеет молекулярную формулу С9Н8О.
Поскольку при сжигании Х были получены только углекислый газ и вода, Х могло содержать углерод, водород и кислород. Найдем количество образовавшихся при сгорании Х веществ: n(СО2) = 10,08 / 22,4 = 0,45 моль; n(Н2О) = 3,6 /18 = 0,2 моль. Следовательно, количество углерода и водорода, содержащееся в сжигаемой навеске Х равно: n(С) = 0,45 моль; n(Н) = 0,4 моль; n(О) = (6,6 – (0,45 × 12 + 0,4 × 1)) / 16 = 0,05 моль. Установим простейшую формулу соединения Х: С : Н : О = 0,45 : 0,4 : 0,05 = 9 : 8 : 1, т.е. С9Н8О. Поскольку плотность паров соединения Х по воздуху не превышает 5, его молярная масса не должна превышать 5 × 29 = 145 г/моль. Молярная масса вещества, имеющего формулу С9Н8О (совпадающую с простейшей) равна 132 г/моль, следовательно, соединение Х имеет молекулярную формулу С9Н8О.
2-3. Поскольку соединение содержит один атом кислорода, оно может быть спиртом, альдегидом, кетоном или простым эфиром. Х реагирует с аммиачным раствором оксида серебра(I), при нагревании его с гидроксидом меди(II) наблюдается выпадение красного осадка. Эти реакции указывают на наличие альдегидной группы в составе Х (Х можно отнести к классу альдегидов).
Т.к. вещество Х обесцвечивает бромную воду, оно может содержать в составе молекулы кратные связи (Х можно отнести к непредельным соединениям). Поскольку при окислении перманганатом калия образуется бензойная кислота (Х можно отнести к ароматическим соединениям), единственным соединением, которое удовлетворяет всем условиям, является 3‑фенилпропеналь (коричный альдегид).
3.Уравнения описанных в условии задачи реакций:
4. Коричный альдегид может существовать в виде цис- и транс-изомеров.
Задача 102
1. Рассмотрим схему превращений, основанную на применении этилена в качестве исходного соединения. Этилен при окислении, в присутствии металлического серебра в качестве катализатора окисляется кислородом до этиленоксида (соединение V). Более старым способом его получения является хлорирование этилена в водном растворе, с образованием 2-хлорэтанола (Б), который далее обрабатывают гидроксидом кальция при нагревании. Другим важным мономером, получаемым из этилена, является винилхлорид (III), который образуется при пиролизе 1,2-дихлорэтана (А). Промышленным методом получения 1,2-дихлорэтана является нагревание этилена со смесью хлороводорода и кислорода в присутствии катализатора. При нагревании этилена с уксусной кислотой в присутствии кислорода воздуха образуется винилацетат (IV). Этот процесс имеет сложный многостадийный характер и представляет собой одну из модификаций Вакер-процесса.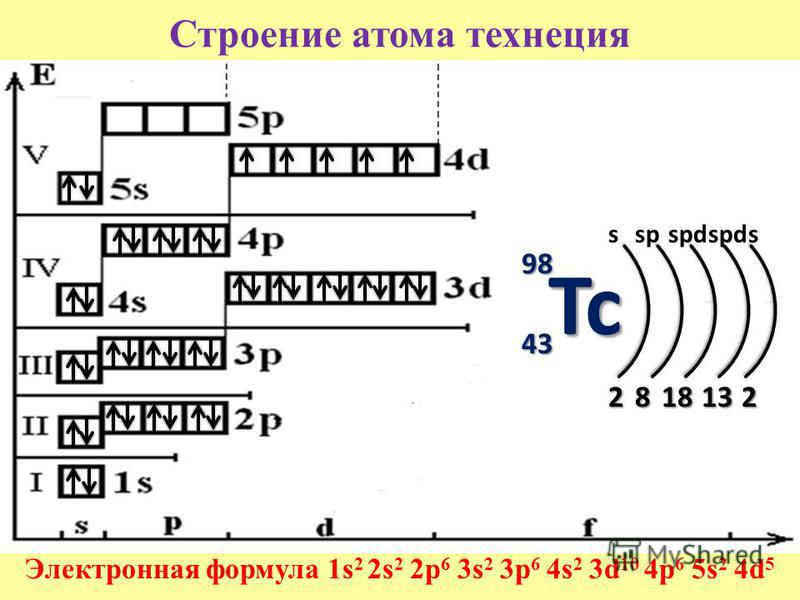
Рассмотрим вторую схему превращений. На первой стадии пропилен в условиях кислотного катализа присоединяет воду, образуя изопропиловый спирт (В), который далее превращается в ацетон (Г). Следующая стадия представляет собой реакцию нуклеофильного присоединения синильной кислоты к ацетону с образованием соответствующего циангидрина (Д). При неполном гидролизе нитрильной группы получается амид Е, который при нагревании с метанолом дает метилметакрилат (V).
- Решение задачи 103
- Решение задачи 104
- Решение задачи 105
- Решение задачи 11
Рутений – информация об элементе, свойства и использование
Перейти к основному содержанию
У вас не включен JavaScript. Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Пожалуйста, включите JavaScript, чтобы получить доступ ко всем функциям сайта.
Перейти к родию >
| Группа | 8 | Температура плавления | 2333°С, 4231°F, 2606 К |
| Период | 5 | Температура кипения | 4147°С, 7497°F, 4420 К |
| Блок | д | Плотность (г см −3 ) | 12. 1 1 |
| Атомный номер | 44 | Относительная атомная масса | 101.07 |
| Состояние при 20°С | Твердый | Ключевые изотопы | 101 Россия, 102 Россия, 104 Россия |
| Электронная конфигурация | [Кр] 4d 7 5s 1 | Номер КАС | 7440-18-8 |
| ChemSpider ID | 22390 | ChemSpider — бесплатная база данных химической структуры. | |
Название элемента происходит от латинского названия России. Стилизованный кириллический текст основан на советско-российском флаге примерно 19 века.21.
Блестящий серебристый металл.
Появляется множество новых применений рутения. Большинство из них используется в электронной промышленности для чип-резисторов и электрических контактов. Оксид рутения используется в химической промышленности для покрытия анодов электрохимических элементов для производства хлора. Рутений также используется в катализаторах для производства аммиака и уксусной кислоты. Соединения рутения могут использоваться в солнечных элементах, которые превращают световую энергию в электрическую.
Рутений является одним из наиболее эффективных отвердителей для платины и палладия, и его сплавляют с этими металлами, чтобы сделать электрические контакты более устойчивыми к износу. Он используется в некоторых ювелирных изделиях в виде сплава с платиной.
Он используется в некоторых ювелирных изделиях в виде сплава с платиной.
Биологическая роль рутения неизвестна. Оксид рутения(IV) очень токсичен.
Рутений — один из самых редких металлов на Земле. Встречается в природе в несвязанном виде; однако чаще он встречается в сочетании с другими платиновыми металлами в минералах пентландите и пироксините. Его получают в промышленных масштабах из отходов рафинирования никеля.
Элементы и история периодической таблицы
Польский химик Енджей Снядецкий исследовал платиновые руды из Южной Америки и в мае 1808 года открыл новый металл, который он назвал вестим. Однако когда французские химики попытались повторить его работу, они не смогли найти его в имевшейся у них платиновой руде. Когда Снядецкий узнал об этом, он решил, что ошибся, и отозвал свой иск.
Затем, в 1825 году, Готфрид Осанн из Дерптского университета (ныне Тарту) на Балтийском море исследовал некоторое количество платины в Уральских горах и сообщил о находке три новых элемента, которые он назвал плюранием, полинием и рутением.
В то время как первые два никогда не подлежали проверке, третий был подлинным, и в 1840 году Карл Карлович Клаус из Казанского университета извлек, очистил и подтвердил, что это новый металл. Он сохранил имя Осанна — рутений.
| Атомный радиус, несвязанный (Å) | 2.13 | Ковалентный радиус (Å) | 1,36 |
| Сродство к электрону (кДж моль −1 ) | 101. 31 31 | Электроотрицательность (шкала Полинга) | 2.2 |
| Энергии ионизации (кДж моль −1 ) | 1 ст 710,18 2 -й 1617.09 3 рд 2746,94 | ||
| Общие степени окисления | 8, 6, 4 , 3, 2, 0, -2 | ||||
| Изотопы | Изотоп | Атомная масса | Естественное изобилие (%) | Период полураспада | Режим распада |
| 96 Ру | 95,908 | 5,54 | > 3,1 x 10 16 г | β+β+ | |
| 98 Ру | 97,905 | 1,87 | – | – | |
| 99 Ру | 98,906 | 12,76 | – | – | |
| 100 Ру | 99,904 | 12,6 | – | – | |
| 101 Ру | 100. 906 906 | 17.06 | – | – | |
| 102 Ру | 101.904 | 31,55 | – | – | |
| 104 Ру | 103. 905 905 | 18,62 | – | – | |
|
|
| Удельная теплоемкость (Дж кг -1 К -1 ) | 238 | Модуль Юнга (ГПа) | Неизвестный | |||||||||||
| Модуль сдвига (ГПа) | Неизвестный | Объемный модуль (ГПа) | Неизвестный | |||||||||||
| Давление пара | ||||||||||||||
| Температура (К) |
| |||||||||||||
| Давление (Па) |
| |||||||||||||
| Слушайте подкаст о рутении |
Стенограмма: (Промо) Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Крис Смит Привет, добро пожаловать на эту неделю Химия в ее стихии, я Крис Смит. В этом выпуске мы сталкиваемся лицом к лицу с химическим веществом, получившим название элемента знатока. Он получил Нобелевскую премию как катализатор, это мышца, стоящая за износоустойчивыми электрическими контактами, и он может даже помочь вам красиво писать, если только вы не врач, и в этом случае вы, вероятно, уже безнадежны. Вот Джонатан Стид. Джонатан Стид Остановите пресловутого «обывателя» и спросите его, что такое рутений, и, скорее всего, он не сможет вам ответить. По сравнению с «более сексуальными элементами», которые известны всем, как углерод и кислород, рутений, честно говоря, немного неясен. На самом деле, даже если бы ваш прохожий был в лабораторном халате и шел по улице очень близко к химическому факультету университета, он все равно мог бы немного не знать об этом таинственном металле. Как я хрипло вспомнил в ответ на первый вопрос, заданный мне в моей кандидатской диссертации. экзамене, название «рутений» происходит от Ruthenia, латинского слова Русь, исторической области, которая включает в себя современные западную Россию, Украину, Беларусь, а также части Словакии и Польши. Название было впервые предложено Готфридом Осанном в 1828 году, который считал, что идентифицировал металл, и это имя было сохранено земляком Осанна (а в 1844 году официальным первооткрывателем рутения) Карлом Клаусом в честь места его рождения в Тарту, Эстония; на тот момент в составе Российской империи. Популярность рутения на химических факультетах университетов во второй половине двадцатого века в немалой степени объясняется его относительной дешевизной. Редкость металлов платиновой группы (которые часто встречаются вместе) делает их все дорогими, но в отличие от платины, родия и палладия, которые используются, например, в автомобильных каталитических нейтрализаторах, рутений исторически не был так востребован. Действительно, в течение многих лет металлургическая компания Johnson Matthey использовала кредитную схему, по которой они давали начинающим исследователям около 100 г трихлорида рутения для экспериментов в надежде, что химики найдут новое применение этому материалу. Схема ссуд действовала и для более дорогих металлов, таких как родий, но только в небольших банках по 5 г. Приятной особенностью кредитной схемы было то, что химики собирали металлосодержащие остатки своих экспериментов и возвращали полученный черный вонючий шлам компании для извлечения металлов. Итак, начиная с 1960-х годов, когда область металлоорганической химии ворвалась в сознание химиков, многие люди проводили много исследований с элементом знатока. Оказывается, рутений действительно заслуживает элегантного описания Уилкинсона. Несмотря на то, что сам по себе этот элемент представляет собой ничем не примечательный, довольно твердый белый металл, он образует широкий спектр интересных соединений, которые, кажется, обладают идеальным балансом между реакционной способностью и стабильностью, что делает их в целом полезными, но простыми в обращении. Как и все металлы платиновой группы, комплексы рутения являются хорошими катализаторами. Переведите часы вперед, в 2005 год, когда Ив Шовен, Боб Граббс и Дик Шрок были удостоены Нобелевской премии по химии «за разработку метода метатезиса в органическом синтезе»; эта награда в области синтетической химии стала настоящим стимулом для «котлов». Это своего рода нишевое приложение – совсем немного в нужном месте, о чем, я думаю, говорил Уилкинсон. На самом деле, чем тщательнее вы смотрите, тем больше вы находите маленьких кусочков рутения, укрепляющих основу технологии. Из-за своей твердости рутений используется в сплавах с другими металлами платиновой группы для изготовления износостойких электрических контактов, и существует огромный интерес к тонкопленочной микроэлектронике на основе рутения, поскольку на металле можно легко нанести рисунок. Если вы любите перьевые ручки, скорее всего, вы писали рутениевым сплавом. Знаменитая перьевая ручка Parker 51 оснащена пером Ru с 1944 года; перо из 14-каратного золота с содержанием 96,2% рутения и 3,8% иридия. Один из моих любимых в зоопарке экзотических комплексов рутения — ион Крейтца-Таубе — два атома рутения, окруженные молекулами аммиака и соединенные молекулой пиразена (представьте себе бензол, но с парой атомов азота). Это был первый действительно делокализованный комплекс со смешанной валентностью. Из общего заряда вы знаете, что один из ионов рутения должен иметь заряд +3, а другой — +2, но просто невозможно определить, какой из них какой. Для всего мира он ведет себя так, как если бы два металла имели плюс два с половиной заряда каждый, хотя заряды бывают только единицами! Это соединение породило целую область химии «смешанной валентности» и сегодня является частью чрезвычайно интересной области молекулярной электроники. Итак, когда вы думаете о химии и смотрите еще один документальный фильм о жизненно важном значении углерода или водородной экономики, подумайте о редких, очищенных элементах, таких как рутений, которые предназначены только для знатоков. Крис Смит Вот почему я не могу читать свои собственные записи – возможно, Bic нужно начать добавлять немного рутения в свои ролики. Это был Джонатан Стид из Даремского университета. В следующий раз к вещам, которые повсюду чайники и бойлеры – но есть и некоторые преимущества. Карен Фолдс Кальций обычно попадает в воду, когда она течет мимо карбоната кальция из известняка и мела или сульфата кальция из других месторождений полезных ископаемых. Хотя некоторым людям не нравится вкус, жесткая вода, как правило, не вредна для здоровья. Хотя это делает ваш чайник пушистым! Интересно, что вкус пива (что-то дорогое моему сердцу) кажется связанным с концентрацией кальция в используемой воде, и утверждается, что хорошее пиво должно иметь концентрацию кальция выше, чем в жесткой водопроводной воде. Крис Смит И, что более важно, концентрация алкоголя не менее 10%. Здесь нет южных мягкотелых, большое спасибо. Карен Фолдс расскажет историю о кальции в программе «Химия в ее элементах», которая выйдет на следующей неделе. Я Крис Смит, большое спасибо за внимание и до свидания. (Промо) Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists.com. Дополнительную информацию и другие эпизоды химии в ее стихии можно найти на нашем веб-сайте chemistryworld.org/elements. (окончание акции) |
Нажмите здесь, чтобы посмотреть видео о рутении
Learn Chemistry: ваш единственный путь к сотням бесплатных учебных ресурсов по химии.
Изображения и видео Visual Elements
© Murray Robertson 1998-2017.
W.M. Haynes, ed., CRC Handbook of Chemistry and Physics , CRC Press/Taylor and Francis, Boca Raton, FL, 95th Edition, Internet Version 2015, по состоянию на декабрь 2014 г. 3 906 & Chemical Constants, Kaye & Laby Online, 16-е издание, 1995 г. Версия 1.0 (2005 г.), по состоянию на декабрь 2014 г.
Дж. С. Курси, Д. Дж. Шваб, Дж. Дж. Цай и Р. А. Драгосет, Атомные веса и изотопные композиции (версия 4.1) , 2015 г., Национальный институт стандартов и технологий, Гейтерсберг, Мэриленд, по состоянию на ноябрь 2016 г.
TL Cottrell, The Strengths of Chemical Bonds , Butterworth, London, 1954.
John Emsley, Nature’s Building Blocks: An AZ Guide to the Elements , Oxford University Press, New York, 2nd, New York, 2nd. Издание 2011 г.
Издание 2011 г.
Национальный ускорительный центр Томаса Джефферсона — Управление научного образования, It’s Elemental — The Periodic Table of Elements, по состоянию на декабрь 2014 г.
Периодическая таблица видео, по состоянию на декабрь 2014 г.
Частично получены из материалов, предоставленных Британской геологической службой © NERC.
Исторический текст
Элементы 1-112, 114, 116 и 117 © Джон Эмсли 2012. Элементы 113, 115, 117 и 118 © Королевское общество химии 2017.
Podcasts
, созданные The Nake Scients Scientists. .
Создано видеожурналистом Брэди Хараном, работающим с химиками Ноттингемского университета.
Загрузите наше бесплатное приложение Периодической таблицы для мобильных телефонов и планшетов.
Исследуйте все элементы
Рутений – Атомный номер – Атомная масса – Плотность рутения
Автор
Атомный номер рутения
Рутений представляет собой химический элемент с атомным номером 44 , что означает, что в атомной структуре 44 протона и 44 электрона. Химический символ для рутения — Ru .
Поскольку количество электронов отвечает за химическое поведение атомов, атомный номер идентифицирует различные химические элементы.
Как атомный номер определяет химическое поведение атомов?
Атомная масса рутения
Атомная масса рутения 101,07 ед.
Обратите внимание, что каждый элемент может содержать больше изотопов. Следовательно, эта результирующая атомная масса рассчитывается на основе встречающихся в природе изотопов и их распространенности.
Следовательно, эта результирующая атомная масса рассчитывается на основе встречающихся в природе изотопов и их распространенности.
Единицей измерения массы является атомная единица массы (а.е.м.) . Одна атомная единица массы равна 1,66 х 10 -24 грамма. Одна унифицированная атомная единица массы равна 9.0017 приблизительно равна массе одного нуклона (либо одного протона, либо нейтрона) и численно эквивалентна 1 г/моль.
Для 12 C атомная масса точно равна 12u, так как по ней определяется единица атомной массы. Для других изотопов изотопная масса обычно отличается и обычно находится в пределах 0,1 ед от массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в основном ядерном состоянии равна 62,9.1367 г. н.э.
Различие между массовым числом и изотопной массой, известное как дефект массы, объясняется двумя причинами: Это увеличивает массу ядер с большим количеством нейтронов, чем протонов, относительно шкалы единиц атомной массы, основанной на 12 C с равным количеством протонов и нейтронов.
Число атомной массы определяет прежде всего атомную массу атомов. Массовое число различно для каждого изотопа химического элемента.
Как атомная масса определяет плотность материалов?
Плотность рутения
Плотность рутения 12,37 г/см 3 .
Типичные плотности различных веществ при атмосферном давлении.
Плотность определяется как масса на единицу объема . Это интенсивное свойство , которое математически определяется как масса, деленная на объем:
ρ = m/V
Другими словами, плотность (ρ) вещества представляет собой общую массу (m) этого вещества. вещества, деленное на общий объем (V), занимаемый этим веществом. Стандартная единица СИ – килограммов на кубический метр ( кг/м 3 ). Стандартной английской единицей измерения является масса фунтов на кубический фут ( фунтов/фут 3 ).
вещества, деленное на общий объем (V), занимаемый этим веществом. Стандартная единица СИ – килограммов на кубический метр ( кг/м 3 ). Стандартной английской единицей измерения является масса фунтов на кубический фут ( фунтов/фут 3 ).
See also: What is Density
See also: Densest Materials of the Earth
Ruthenium – Properties Summary
| Element | Ruthenium |
|---|---|
| Atomic Number | 44 |
| Символ | Ru |
| Element Category | Transition Metal |
| Phase at STP | Solid |
| Atomic Mass [amu] | 101.07 |
| Density at STP [g/cm3] | 12.37 |
| Электронная конфигурация | [KR] 4D7 5S1 |
| Возможные состояния окисления | +3 |
| Электронно -сродство0019 | |
| Electronegativity [Pauling scale] | 2. 2 2 |
| 1st Ionization Energy [eV] | 7.3605 |
| Year of Discovery | 1844 |
| Discoverer | Klaus, Karl Karlovich |
| Термические свойства | |
| Температура плавления [шкала Цельсия] | 2334 |
| Температура кипения [шкала Цельсия] | 4150 |
| Thermal Conductivity [W/m K] | 117 |
| Specific Heat [J/g K] | 0.238 |
| Heat of Fusion [kJ/mol] | 24 |
| Heat of Vaporization [kJ/mol] | 595 |
Ruthenium in Periodic Table
| Hydrogen1H | Helium2He | ||||||||||||||||||
| Lithium3Li | Beryllium4Be | Boron5B | Carbon6C | Nitrogen7N | Oxygen8O | Fluorine9F | Neon10Ne | ||||||||||||
| Sodium11Na | Magnesium12Mg | Aluminium13Al | Silicon14Si | Phosphorus15P | Sulfur16S | Chlorine17Cl | Argon18Ar | ||||||||||||
| Potassium19K | Кальций20Ca | Скандий21Sc | Титан22Ti | Ванадий23V | Chromium24Cr | Manganese25Mn | Iron26Fe | Cobalt27Co | Nickel28Ni | Copper29Cu | Zinc30Zn | Gallium31Ga | Germanium32Ge | Arsenic33As | Selenium34Se | Bromine35Br | Krypton36Kr | ||
| Rubidium37Rb | Strontium38Sr | Yttrium39Y | Цирконий40Zr | Ниобий41Nb | Молибден42Mo | Technetium43Tc | Ruthenium44Ru | Rhodium45Rh | Palladium46Pd | Silver47Ag | Cadmium48Cd | Indium49In | Tin50Sn | Antimony51Sb | Tellurium52Te | Iodine53I | Xenon54Xe | ||
| Caesium55Cs | Barium56Ba | Lanthanum57La | Гафний72Hf | Тантал73Ta | Вольфрам74W | Рений75Re | Osmium76Os | Iridium77Ir | Platinum78Pt | Gold79Au | Mercury80Hg | Thallium81Tl | Lead82Pb | Bismuth83Bi | Polonium84Po | Astatine85At | Radon86Rn | ||
| Francium87Fr | Radium88Ra | Actinium89Ac | Rutherfordium104Rf | Дубний105Db | Сиборгий106Sg | Борий107Bh | Hassium108Hs | Meitnerium109Mt | Darmstadtium110Ds | Roentgenium111Rg | Copernicium112Cn | Nihonium113Nh | Flerovium114Fl | Moscovium115Mc | Livermorium116Lv | Tennessine117Ts | Oganesson118Og | ||
| Cerium58Ce | Praseodymium59Pr | Неодим60Nd | Прометий61Pm | Samarium62Sm | Europium63Eu | Gadolinium64Gd | Terbium65Tb | Dysprosium66Dy | Holmium67Ho | Erbium68Er | Thulium69Tm | Ytterbium70Yb | Lutetium71Lu | ||||||
| Thorium90Th | Protactinium91Pa | Uranium92U | Нептуний-93Np | Плутоний-94Pu | Америций-95Am | Curium96Cm | Berkelium97Bk | Californium98Cf | Einsteinium99Es | Fermium100Fm | Mendelevium101Md | Nobelium102No | Lawrencium103Lr | ||||||
–
–
–
report this ad
Ru Ruthenium Element Информация: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура рутения
Структура рутения в твердом состоянии Простая гексагональная .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | b | c |
|---|---|---|
| 270,59 пм | 270,59 пм | 428,15 пм |
и углы между ними Решетка углов и углов (альфа, бета).
| alpha | beta | gamma |
|---|---|---|
| π/2 | π/2 | 2 π/3 |
The positions of the atoms inside the unit cell are described by the набор атомных позиций ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп.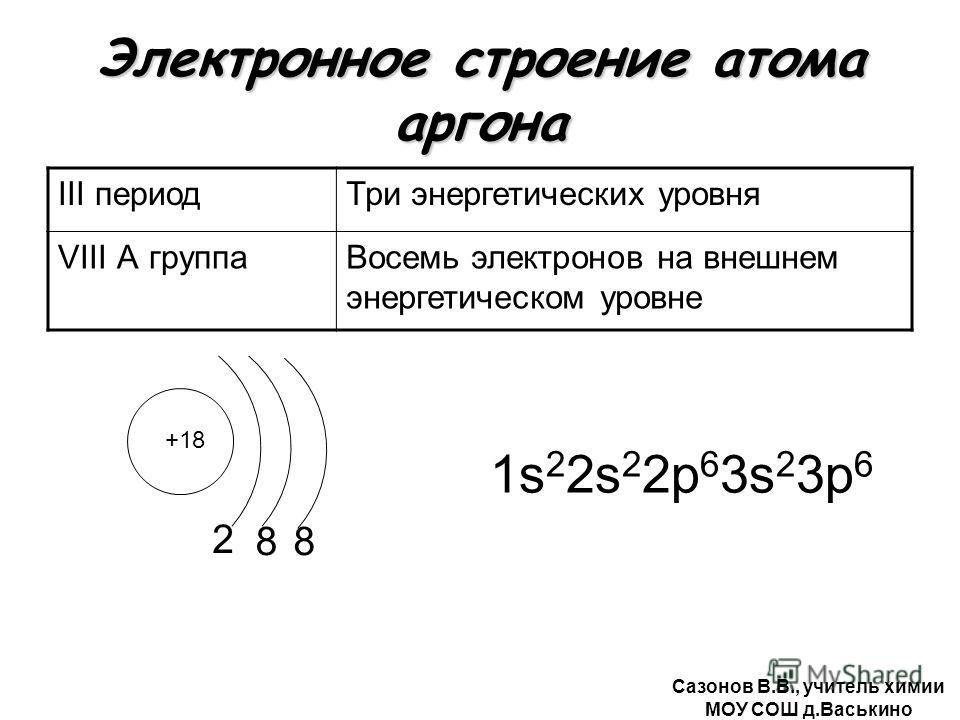 Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если считать киральными копиями различными).
Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если считать киральными копиями различными).
Ruthenium Atomic and Orbital Properties
Ruthenium atoms have 44 electrons and the electronic shell structure is [2, 8, 18, 15, 1] with Atomic Term Символ (Квантовые числа) 5 F 5 .
| Атомный номер | 44 |
| Число электронов (бесплатно) | 44 |
| Количество протонов | 44 |
| МАССОВЫЙ НОМЕР | 101 |
| Номер нейтронов | 57 |
| SLOCK STRUCT 1 | |
| Electron Configuration | [Kr] 4d7 5s1 |
| Valence Electrons | 4d7 5s1 |
| Valence (Valency) | 6 |
| Основные степени окисления | 3, 4 |
| Степени окисления | -4, -2, 0, 1, 2, 3, 4, 5, 6, 7, 8 | AtomicTerms ) | 5 F 5 |
ROHR ATOMIC ELECTRONIC ELECTRONIAL ELERTERNIME ABLINGERINE -ABERELENMILE
 СОЗДАНИЕ ЭЛЕКТРОНАЯ ЭЛЕКТРОНАЯ СОЗДАНИЯ.1343
СОЗДАНИЕ ЭЛЕКТРОНАЯ ЭЛЕКТРОНАЯ СОЗДАНИЯ.1343Сокращенная электронная конфигурация основного состояния нейтрального атома рутения [Kr] 4d7 5s1. Часть конфигурации рутения, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Kr]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4d7 5s1, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального рутения
Полная электронная конфигурация основного состояния атома рутения. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d7 5s1 Правило.
 …
…Атомная структура рутения
Атомный радиус рутения составляет 178 пм, а его ковалентный радиус равен 126 пм.
| Вычисленный атомный радиус | 178 пм (1,78 Å) |
| Радиус Эмпирический радиус | 130 вечера (1,3 Å) |
| Атом | 8,1706 CM3/моли |
| COVLE 8.1706 CM3/моли | |
| COVLE 8.1706 CM3/моли | |
| COVLER COVLIOD COVLE Радиус WAALS | – |
| Нейтронный сечение | 2,6 |
| АБрапбция нейтрона | 0,0009 |
Atomic Spectrum Ruthen
2Atomic Spectrum
2.
 1343
1343Рутений Химические свойства: Энергия ионизации рутения и сродство к электрону
Сродство к электрону рутения составляет 101,3 кДж/моль.
| Valence | 6 |
| Electronegativity | 2.2 |
| ElectronAffinity | 101.3 kJ/mol |
Ionization Energy of Ruthenium
Refer to table below for Ionization energies of Ruthenium
| Ionization energy number | Enthalpy – kJ/mol |
|---|---|
| 1st | 710.2 |
| 2nd | 1620 |
| 3rd | 2747 |
Ruthenium Physical Properties
Физические свойства рутения см. в таблице ниже.0015
Elastic Properties
| Young Modulus | 447 |
| Shear Modulus | 173 GPa |
| Bulk Modulus | 220 GPa |
| Коэффициент Пуассона | 0,3 |
Твердость рутения.
 Испытания для измерения твердости элемента
Испытания для измерения твердости элемента| Твердость по шкале Мооса | 6,5 МПа | ||||||||||||||||||||||
| Твердость Vickers | – | ||||||||||||||||||||||
Бринелл. См. Таблицу ниже для электрических свойств Ofruthenium
Ruthenium Heat and Conduction Properties
Ruthenium Magnetic Properties
Optical Properties of Ruthenium
Акустические свойства рутения
|
Refer to table below for Thermal properties of Ruthenium
| Melting Point | 2607 K (2333.85°C, 4232.929999999999 °F) |
| Boiling Point | 4423 K (4149.85°C, 7501.7300000000005 °F) |
| Critical Temperature | – |
| Superconducting Point | 0.49 |
Enthalpies of Ruthenium
| Heat of Fusion | 25,7 кДж/моль |
| Тепло испаривания | 580 кДж/моль |
| Hep of Hebustion | – |
 87 и 120 нуклонов. Рутений имеет 7 стабильных естественных изотопов.
87 и 120 нуклонов. Рутений имеет 7 стабильных естественных изотопов.Изотопы рутения – Природные стабильные изотопы: 100Ru, 101Ru, 102Ru, 104Ru, 96Ru, 98Ru, 99RU.
| Isotope | Z | N | Isotope Mass | % Abundance | T half | Decay Mode |
|---|---|---|---|---|---|---|
| 87Ru | 44 | 43 | 87 | Synthetic | ||
| 88Ru | 44 | 44 | 88 | Synthetic | ||
| 89Ru | 44 | 45 | 89 | Synthetic | ||
| 90Ru | 44 | 46 | 90 | Synthetic | ||
| 91Ru | 44 | 47 | 91 | Synthetic | ||
| 92Ru | 44 | 48 | 92 | Synthetic | ||
| 93Ru | 44 | 49 | 93 | Synthetic | ||
| 94Ru | 44 | 50 | 94 | Synthetic | ||
| 95Ru | 44 | 51 | 95 | Synthetic | ||
| 96Ru | 44 | 52 | 96 | 5.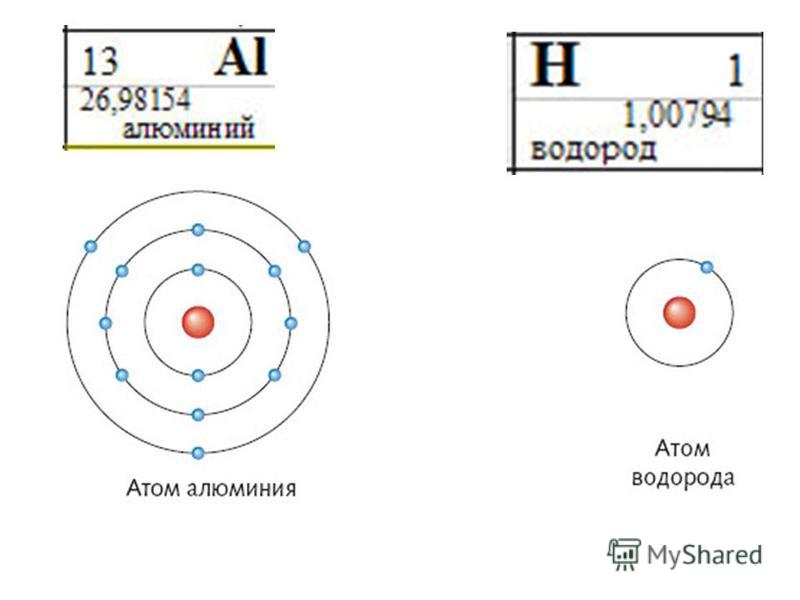 |

 Никель
Никель Самарий
Самарий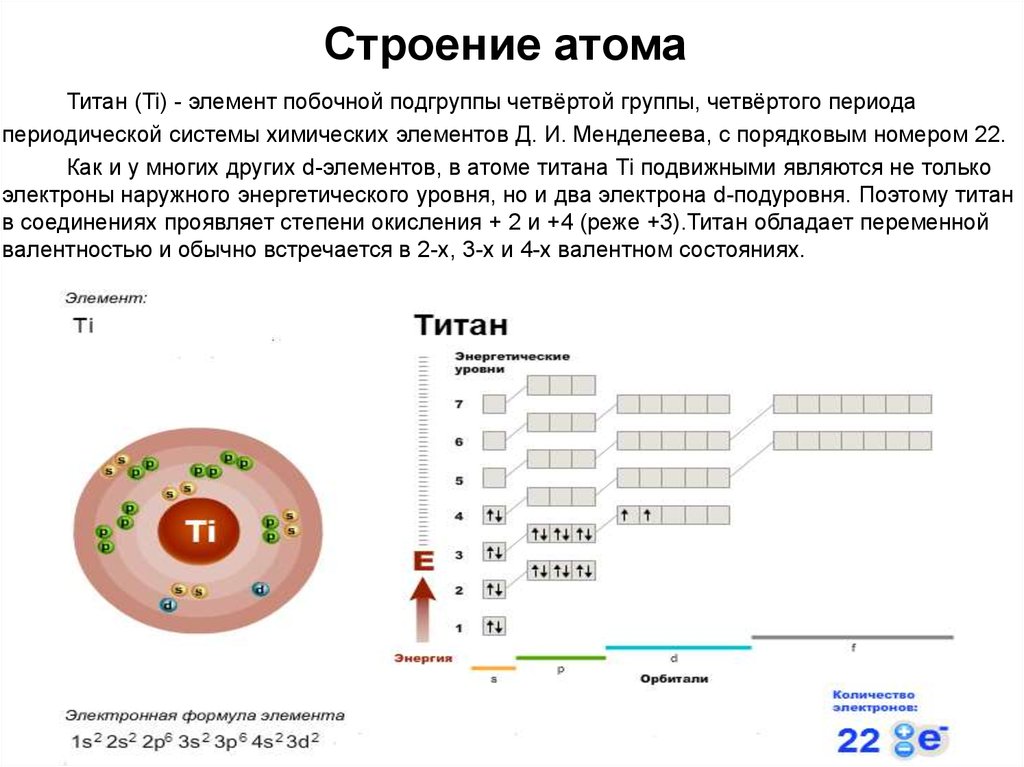 Америций
Америций ru/Database/properties.php?dbid=1&id=254
ru/Database/properties.php?dbid=1&id=254 е.м. Отсюда M (M) = 65.4 и М = Zn.
е.м. Отсюда M (M) = 65.4 и М = Zn.
 Однако так было не всегда. Двадцать или тридцать лет тому назад целые поколения химиков защитили целые докторские диссертации по химии металлов так называемой «платиновой группы», одним из которых является рутений. Как один из тех химиков, занимающихся изучением рутения, я обязан распространить информацию об элементе, однажды описанном одним из отцов современной неорганической химии, сэром Джеффри Уилкинсоном, как «элемент для знатоков».
Однако так было не всегда. Двадцать или тридцать лет тому назад целые поколения химиков защитили целые докторские диссертации по химии металлов так называемой «платиновой группы», одним из которых является рутений. Как один из тех химиков, занимающихся изучением рутения, я обязан распространить информацию об элементе, однажды описанном одним из отцов современной неорганической химии, сэром Джеффри Уилкинсоном, как «элемент для знатоков».
 Хотя это была реакция на родий, которая заставила всегда яркого Уилкинсона носиться по своей лаборатории, размахивая пенящейся пробиркой и крича «Кто хочет получить докторскую степень?», Конечно, казалось правдой, что доктора философии. нужно было всего лишь кипятить любой из металлов платиновой группы с как можно большим количеством органических материалов и анализировать завораживающее изобилие полученных соединений.
Хотя это была реакция на родий, которая заставила всегда яркого Уилкинсона носиться по своей лаборатории, размахивая пенящейся пробиркой и крича «Кто хочет получить докторскую степень?», Конечно, казалось правдой, что доктора философии. нужно было всего лишь кипятить любой из металлов платиновой группы с как можно большим количеством органических материалов и анализировать завораживающее изобилие полученных соединений. И какой из металлов платиновой группы лежит в основе элегантной каталитической системы Граббса для этой фантастически полезной современной реакции образования углерод-углеродных связей? Оказывается, это крутой карбеновый комплекс скромного рутения, который делает все правильно.
И какой из металлов платиновой группы лежит в основе элегантной каталитической системы Граббса для этой фантастически полезной современной реакции образования углерод-углеродных связей? Оказывается, это крутой карбеновый комплекс скромного рутения, который делает все правильно. Соединения рутения также обладают хорошими оптическими и электронными свойствами. Как и его более легкий близкий родственник железо, рутений легко образует ряд оксидов, включая некоторые экзотические полиметаллические соединения с кислородными мостиками. Один из таких материалов, рутениевый красный, представляет собой краситель, используемый для окрашивания отрицательно заряженных биомолекул, таких как нуклеиновые кислоты, в микроскопии. Комплексы рутения также обладают значительным потенциалом в качестве противоракового лечения.
Соединения рутения также обладают хорошими оптическими и электронными свойствами. Как и его более легкий близкий родственник железо, рутений легко образует ряд оксидов, включая некоторые экзотические полиметаллические соединения с кислородными мостиками. Один из таких материалов, рутениевый красный, представляет собой краситель, используемый для окрашивания отрицательно заряженных биомолекул, таких как нуклеиновые кислоты, в микроскопии. Комплексы рутения также обладают значительным потенциалом в качестве противоракового лечения.
 000067
000067