Строение атома углерода, свойства и схема элемента
4.1
Средняя оценка: 4.1
Всего получено оценок: 533.
4.1
Средняя оценка: 4.1
Всего получено оценок: 533.
Углерод (С) – шестой элемент периодической таблицы Менделеева с атомным весом 12. Элемент относится к неметаллам и имеет изотоп 14С. Строение атома углерода лежит в основе всей органической химии, т. к. все органические вещества включают молекулы углерода.
Атом углерода
Положение углерода в периодической таблице Менделеева:
- шестой порядковый номер;
- четвёртая группа;
- второй период.
Опираясь на данные из таблицы, можно заключить, что строение атома элемента углерода включает две оболочки, на которых расположено шесть электронов. Валентность углерода, входящего в состав органических веществ, постоянна и равна IV. Это значит, что на внешнем электронном уровне находится четыре электрона, а на внутреннем – два.
Из четырёх электронов два занимают сферическую 2s-орбиталь, а оставшиеся два – 2p-орбиталь в виде гантели. В возбуждённом состоянии один электрон с 2s-орбитали переходит на одну из 2p-орбиталей. При переходе электрона с одной орбитали на другую затрачивается энергия.
Таким образом, возбуждённый атом углерода имеет четыре неспаренных электрона. Его конфигурацию можно выразить формулой 2s12p3. Это даёт возможность образовывать четыре ковалентные связи с другими элементами. Например, в молекуле метана (СН4) углерод образует связи с четырьмя атомами водорода – одна связь между s-орбиталями водорода и углерода и три связи между p-орбиталями углерода и s-орбиталями водорода.
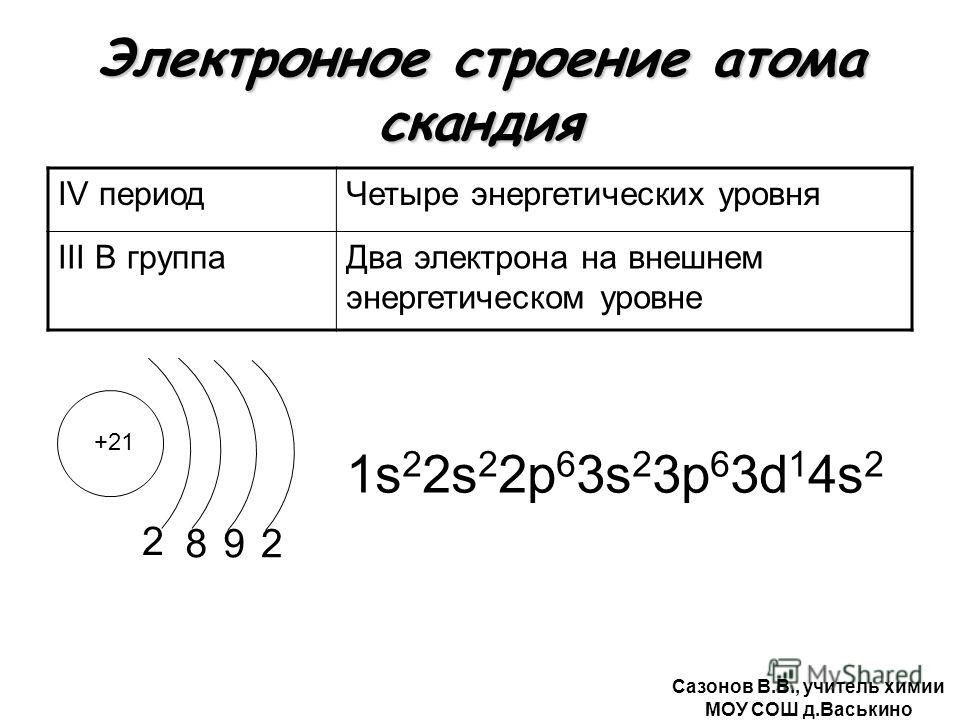
Схему строения атома углерода можно представить в виде записи +6C)2)4 или 1s22s22p2.
Рис. 2. Строение атома углерода.Физические свойства
Углерод встречается в природе в виде горных пород. Известно несколько аллотропных модификаций углерода:
- графит;
- алмаз;
- карбин;
- уголь;
- сажа.

Все эти вещества отличаются строением кристаллической решётки. Наиболее твёрдое вещество – алмаз – имеет кубическую форму углерода. При высоких температурах алмаз превращается в графит с гексагональной структурой.
Рис. 3. Кристаллические решётки графита и алмаза.Химические свойства
- Са + 2С → СаС2;
- Cr + C → CrC;
- 3Fe + C → Fe3C.
Также реагирует с оксидами металлов:
- 2ZnO + C → 2Zn + CO2;
- PbO + C → Pb + CO;
- SnO2 + 2C → Sn + 2CO.
При высоких температурах углерод реагирует с неметаллами, в частности с водородом, образуя углеводороды:
С + 2Н2 → СН4.
С кислородом углерод образует углекислый газ и угарный газ:
- С + О2 → СО2;
- 2С + О2 → 2СО.

Угарный газ также образуется при взаимодействии с водой:
C + H2O → CO + H2.
Концентрированные кислоты окисляют углерод, образуя углекислый газ:
- 2H2SO4 + C → CO2 + 2SO2 + 2H2O;
- 4HNO3 + C → CO2 + 4NO2 + 2H2O.
Активность углерода возрастает при нагревании. При низких температурах элемент относительно стабилен.
Что мы узнали?
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Natasha Zolotareva
5/5
Даниил Шкарин
5/5
Оценка доклада
4. 1
1
Средняя оценка: 4.1
Всего получено оценок: 533.
А какая ваша оценка?
«Строение атома или «пудинг с изюмом»
Cookie-файлы
Этот сайт использует файлы cookie. Собранная при помощи cookie информация не может идентифицировать вас, однако может помочь нам улучшить работу нашего сайта. Продолжая использовать сайт, вы даете согласие на обработку файлов cookie.
Хорошо
Подробнее
Медиа-центр
Новости
О РУДН
Лекция: «Строение атома или «пудинг с изюмом»
О РУДН
07 октября 2017
7 октября 2017г. с 11.00-12.40 состоится лекция: «Строение атома или «пудинг с изюмом».Лекция включает 3 раздела:1) Строение атома по уровням, подуровням, орбиталям.2) Периодический закон и периодическая система химических элементов3) Химическая связь, валентность.Спикер: Михаил Алексеевич Рябов, кандидат химических наук, доцент кафедры общей химииМесто проведения: ул.
7 октября 2017г. с 11.00-12.40 состоится лекция: «Строение атома или «пудинг с изюмом».
Лекция включает 3 раздела:
1) Строение атома по уровням, подуровням, орбиталям.
2) Периодический закон и периодическая система химических элементов
3) Химическая связь, валентность.
Спикер: Михаил Алексеевич Рябов, кандидат химических наук, доцент кафедры общей химии
Место проведения: ул.Орджоникидзе, д.3, факультет физико-математических и естественных наук, зал № 2
Контакты:
Анатолий Петрович Фищук
e-mail: [email protected]
тел: 8 916 653 75 57
Мария Алексеевна Войченкова
e-mail: [email protected]
тел: 8 916 197 03 16 160
Предыдущая новость
07 октября 2017
фестиваль «День науки – 2017»
Следующая новость
07 октября 2017
фестиваль «День науки – 2017»
РУДН вошёл в топ-10 самых влиятельных вузов России
Рейтинговое агентство RAEX выпустило второй рейтинг влиятельности вузов России. В новом списке представлено 75 высших учебных заведений. Проект входит в экосистему образовательных рейтингов «Три миссии университета» и выпускается при поддержке Российского Союза ректоров и Ассоциации составителей рейтингов.
В новом списке представлено 75 высших учебных заведений. Проект входит в экосистему образовательных рейтингов «Три миссии университета» и выпускается при поддержке Российского Союза ректоров и Ассоциации составителей рейтингов.
О присоединении ФГАОУ ДПО «ГИНФО» к РУДН
Уважаемые работники и обучающиеся РУДН! Администрация РУДН уведомляет вас, что приказом Министерства науки и высшего образования Российской Федерации от 28 сентября 2022 г. № 935 принято решение о реорганизации РУДН в форме присоединения к нему федерального государственного автономного образовательного учреждения дополнительного профессионального образования «Государственный институт новых форм обучения» (ФГАОУ ДПО «ГИНФО», ОГРН 1027739411226, ИНН 7725045717, КПП 772501001, адрес: 115280, г. Москва, ул. Автозаводская, д. 16, стр. 5).
РУДН на 4 месте по количеству вхождений в топ-10 рейтинга «Эксперт»
Российский университет дружбы народов представлен во всех 16 предметных рейтингах и в пяти из шести предметных срезов рейтинга аналитического центра «Эксперт». Лучшие результаты РУДН продемонстрировал по направлениям: «Экология» и «Сельское хозяйство и биологические науки» — 1 место. «Математика», «Химия», «Искусственный интеллект», «Возобновляемая Энергетика» входит в топ-5 предметного рейтинга. Всего в 2022 году проранжировано 152 университета (137 в 2021 году).
Лучшие результаты РУДН продемонстрировал по направлениям: «Экология» и «Сельское хозяйство и биологические науки» — 1 место. «Математика», «Химия», «Искусственный интеллект», «Возобновляемая Энергетика» входит в топ-5 предметного рейтинга. Всего в 2022 году проранжировано 152 университета (137 в 2021 году).
Атомная структура
Атомная структураАтомная теория: Вещества и элементы состоят из небольших единиц, называемых атомами. Материю можно было бы разделить на эти фундаментальные единицы и не далее.
Демокрит. Древнегреческий философ, отстаивавший атомистическую теорию материи.
Лавуазье. Провел классический эксперимент с оксидом ртути. Нагревая оксид ртути (HgO) и позволяя ему разлагаться на составные элементы, он обнаружил, что составные элементы ртуть и выделяющийся газ (кислород) всегда соединяются в одних и тех же весовых соотношениях, образуя соединение. В этом случае весовое отношение Hg к O всегда составляло 12,5 к 1,9.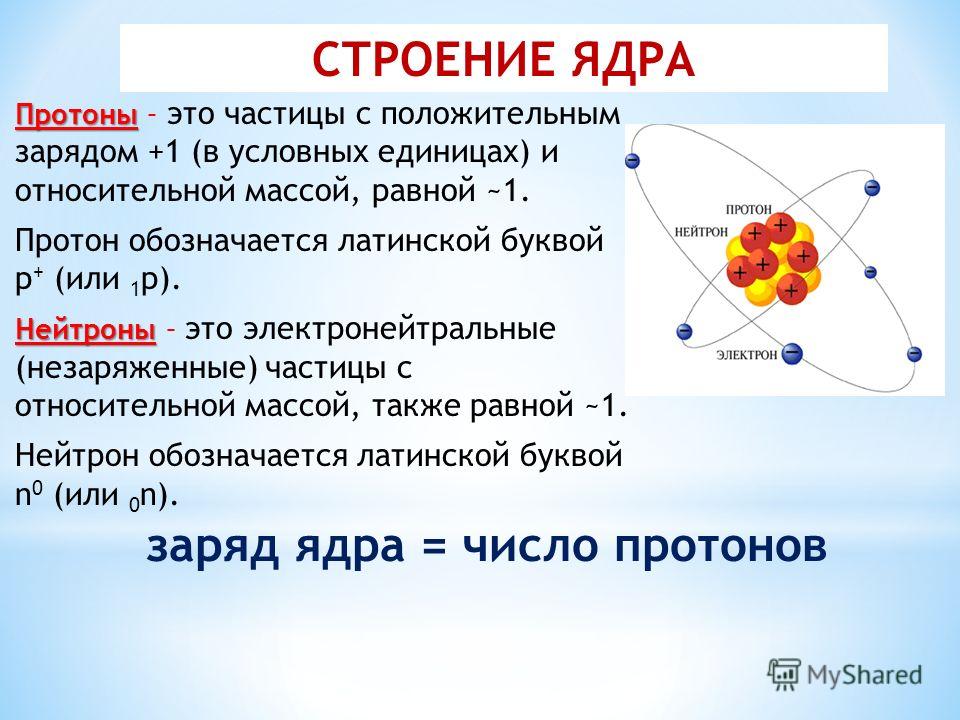
Дальтон. Формализовал открытие Лавуазье в «Закон определенных пропорций»: Когда атомы объединяются, образуя определенное соединение, они всегда соединяются в одних и тех же весовых соотношениях.
Закон Авогадро. Газы (в идеальных условиях) соединяются, образуя соединения в тех же объемных соотношениях; равные объемы газов при одинаковых условиях температуры и давления содержат одинаковое количество частиц.
Менделеев. Открыл периодичность свойств элементов.
Периодическая таблица элементов. Элементы расположены в семействах, упорядоченных по возрастанию атомного номера (количества протонов в ядре).
Броуновское движение. Дергающееся движение микроскопических частиц видно только под микроскопом с большим увеличением. Он был открыт биологом Робертом Брауном в 1827 году. Он обусловлен молекулярным движением молекул жидкости, в которой находится взвешенная частица. Эйнштейн проанализировал и объяснил это явление в 1905.
Дж. Дж. Томсон. Изучал недавно изобретенную электронно-лучевую трубку (экран телевизора — это электронно-лучевая трубка). Он показал, что атомы можно разделить на отрицательные (которые он назвал электронами) и положительные компоненты. Он постулировал модель «сливового пудинга» для атомов. Он рассчитал отношение заряда к массе электрона e/m путем тщательных наблюдений за кривизной электронного пучка в электронно-лучевых трубках в магнитном поле.
Милликен. Он рассчитал заряд электрона с помощью своего знаменитого эксперимента с каплей масла. Он измерил статический электрический заряд микроскопических капель масла, балансируя капли между заряженными пластинами.
Эрнест Резерфорд. В классическом эксперименте он бомбардировал тонкий лист золотой фольги альфа-частицами (ядра He: 2 протона + 2 нейтрона). Он обнаружил, что частицы отскакивают от чего-то плотного в фольге. Из этого эксперимента он постулировал, что атомы образованы небольшим плотным положительно заряженным ядром, вокруг которого вращаются отрицательно заряженные электроны.
Мария и Пьер Кюри. Проделал большую работу по исследованию радиоактивности. Мари — первая женщина, получившая Нобелевскую премию. Они открыли два новых элемента: полоний и радий — последний назван в честь радиоактивного свечения, видимого в темноте.
Нильс Бор. Разработал современную квантово-механическую модель атома.
Электронные орбитали. Области вокруг ядер атомов, где находится электронная «волна вероятности». Они заменяют модель электронных орбит Резерфорда, которая, согласно законам электромагнетизма Максвелла, была бы неустойчивой.
Энергетические уровни и спектры. Когда электроны перескакивают с одной орбитали на другую, они испускают или поглощают излучение фиксированными единицами, называемыми квантами.
Макс Планк. Обнаружил, что электромагнитное излучение испускается фиксированными единицами или пакетами, которые он назвал квантами.
Гейзенберг. Сформулировал принцип неопределенности.
Принцип неопределенности. Принцип гласит, что существуют определенные «дополнительные» количества частиц, такие как положение и импульс. Эти величины соотносятся так, что произведение погрешностей измерения должно быть больше постоянной Планка.
Вернуться к указателю классных заметок.
Вернуться к содержанию.
Структура атома — красивая химия
От атомной теории к квантовой механике
Атомная теория существует уже давно. Однако с момента своего создания древнегреческими философами в V веке до нашей эры и до возрождения такими учеными, как Бойль и Ньютон в эпоху Возрождения, атомная теория казалась более актуальной для философии и физики, но не очень полезной для объяснения химических свойств материи.
В начале 19 века теория химических элементов Лавуазье и закон постоянной пропорции химических соединений Пруста легли в основу атомной теории Дальтона. В 1803 году Дальтон ясно описал свою теорию в своей записной книжке: 1) Химические элементы состоят из очень маленьких неделимых атомов. 2) Все атомы элемента одинаковы, атомы разных элементов различны, и разница заключается в весе атома. 3) Соотношения различных атомов в соединениях представляют собой простые числовые соотношения, такие как 1 : 2 или 2 : 3. Теория Дальтона дала четкое микроскопическое объяснение закону постоянной пропорции Пруста, и она была быстро принята химиками. Позже, с развитием аналитической химии, были определены все атомные массы и химические формулы соединений.
2) Все атомы элемента одинаковы, атомы разных элементов различны, и разница заключается в весе атома. 3) Соотношения различных атомов в соединениях представляют собой простые числовые соотношения, такие как 1 : 2 или 2 : 3. Теория Дальтона дала четкое микроскопическое объяснение закону постоянной пропорции Пруста, и она была быстро принята химиками. Позже, с развитием аналитической химии, были определены все атомные массы и химические формулы соединений.
Открытие электрона в конце 19 века аннулировало неделимость атома Дальтона. В начале 20 века было предложено множество моделей внутреннего строения атома. В 1913 году Бор представил революционный квантовый атом, основанный на модели ядра Резерфорда и квантовой теории Планка. С помощью модели Бора спектр излучения атомарного водорода можно прекрасно объяснить с помощью очень простых математических уравнений. Модель Бора была триумфом квантовой теории в начале 20 века. Позднее создание квантовой механики полностью изменило наше представление об атомном мире. Сегодня ученые продолжают исследования строения атома. Физики-ядерщики работают над такими проблемами, как расположение протонов и нейтронов внутри ядра и каков предельный размер ядра. Теперь мы знаем, что протоны и нейтроны состоят из еще более мелких основных частиц (кварков). Проводя высокоэнергетические эксперименты в великолепных ускорителях частиц, физики элементарных частиц теперь ищут основные частицы материи и излучения (такие как видимый свет), чтобы ответить на главный вопрос: откуда берется материя?
Сегодня ученые продолжают исследования строения атома. Физики-ядерщики работают над такими проблемами, как расположение протонов и нейтронов внутри ядра и каков предельный размер ядра. Теперь мы знаем, что протоны и нейтроны состоят из еще более мелких основных частиц (кварков). Проводя высокоэнергетические эксперименты в великолепных ускорителях частиц, физики элементарных частиц теперь ищут основные частицы материи и излучения (такие как видимый свет), чтобы ответить на главный вопрос: откуда берется материя?
Верхняя диаграмма: волна де Бройля.
Теория атома Дальтона. Греческие философы впервые представили примитивную атомистическую теорию в V веке до нашей эры. После эпохи Возрождения ученые, такие как Бойль и Гук, снова взялись за атомистическую теорию или п-что и использовали ее для объяснения природных явлений. Дальтон впервые подробно изложил свою атомную теорию в 1803 году. Два основных различия между его теорией и предыдущими: 1) разные элементы состоят из разных атомов, 2) разные атомы имеют разный вес. В начале 1919 веке теория Дальтона получила широкое признание среди химиков, что способствовало развитию химии на теоретическом уровне. В своей книге «Новая система химической философии », опубликованной в 1808 году, Дальтон разработал круговой символ для каждого элемента, известного в его время, и использовал комбинацию этих символов для обозначения соединений (выше). Поскольку было трудно определить точные атомные массы, атомные отношения Дальтона для многих соединений были неверными. Здесь мы показываем только несколько его составных представлений с правильным соотношением атомов. [Ссылка на рисунок: Далтон, Дж. Новая система химической философии (1808 г.)].
В начале 1919 веке теория Дальтона получила широкое признание среди химиков, что способствовало развитию химии на теоретическом уровне. В своей книге «Новая система химической философии », опубликованной в 1808 году, Дальтон разработал круговой символ для каждого элемента, известного в его время, и использовал комбинацию этих символов для обозначения соединений (выше). Поскольку было трудно определить точные атомные массы, атомные отношения Дальтона для многих соединений были неверными. Здесь мы показываем только несколько его составных представлений с правильным соотношением атомов. [Ссылка на рисунок: Далтон, Дж. Новая система химической философии (1808 г.)].
Ранние модели строения атома. Атомы Дальтона представляют собой неделимые твердые сферы. Однако с тех пор, как Томсон открыл электрон в 1897 году, новые экспериментальные данные заставили ученых понять, что атомы могут иметь сложную внутреннюю структуру. В начале 20 века появилось много атомных моделей. Четыре из них представлены на рисунке выше, причем красный и синий цвета обозначают положительные и отрицательные заряды соответственно. Модель динамида, предложенная Ленардом в 1903 атом представляет собой пустую оболочку с динамидами в центре. Динамид состоит из одного положительного заряда и одного отрицательного заряда, соединенных вместе. Модель Сатурна, предложенная Хантаро Нагуока в 1904 году, атом похож на Сатурн, с электронами, вращающимися вокруг положительно заряженной сферы в центре. В модели сливового пудинга, предложенной Дж. Дж. Томсоном в 1904 г., атом состоит из положительно заряженной оболочки и электронов, встроенных в оболочку. В модели ядра, предложенной Резерфордом в 1911 году, атом состоит из положительно заряженного ядра в центре и электронов, движущихся вокруг него. Ядро очень маленькое, но содержит почти всю массу атома. [Ссылка на рисунок: Ихде, А. Дж. Развитие современной химии (1964)]
Четыре из них представлены на рисунке выше, причем красный и синий цвета обозначают положительные и отрицательные заряды соответственно. Модель динамида, предложенная Ленардом в 1903 атом представляет собой пустую оболочку с динамидами в центре. Динамид состоит из одного положительного заряда и одного отрицательного заряда, соединенных вместе. Модель Сатурна, предложенная Хантаро Нагуока в 1904 году, атом похож на Сатурн, с электронами, вращающимися вокруг положительно заряженной сферы в центре. В модели сливового пудинга, предложенной Дж. Дж. Томсоном в 1904 г., атом состоит из положительно заряженной оболочки и электронов, встроенных в оболочку. В модели ядра, предложенной Резерфордом в 1911 году, атом состоит из положительно заряженного ядра в центре и электронов, движущихся вокруг него. Ядро очень маленькое, но содержит почти всю массу атома. [Ссылка на рисунок: Ихде, А. Дж. Развитие современной химии (1964)]
Квантовый атом Бора. В 1913 году Бор предложил новую квантовую модель атома, которая была одной из самых революционных теоретических моделей в истории науки. Квантовый атом Бора похож на микроскопическую солнечную систему с серией электронных орбиталей, вращающихся вокруг положительно заряженного ядра в центре. Каждая орбиталь характеризуется определенной энергией, причем орбитали с более низкой энергией ближе к ядру, а орбитали с более высокой энергией дальше от ядра. Электрон должен принадлежать определенной орбитали с такой же энергией, что и орбиталь. Электрон может переходить с одной орбитали на другую только в том случае, если он поглощает (с низкоэнергетической орбитали на высокоэнергетическую) или излучает (с высокоэнергетической орбитали на низкоэнергетическую) фотон и энергия фотона равна разность энергий двух орбиталей. Модель Бора дала прекрасное объяснение атомному спектру водорода (выше мы показали соответствующий электронный переход серий Лаймана, Бальмера и Пашена в спектре водорода) и заложила основу для теории химической связи Льюиса. В 1922 декабря Бор был удостоен Нобелевской премии по физике за вклад в квантовую модель атома.
Квантовый атом Бора похож на микроскопическую солнечную систему с серией электронных орбиталей, вращающихся вокруг положительно заряженного ядра в центре. Каждая орбиталь характеризуется определенной энергией, причем орбитали с более низкой энергией ближе к ядру, а орбитали с более высокой энергией дальше от ядра. Электрон должен принадлежать определенной орбитали с такой же энергией, что и орбиталь. Электрон может переходить с одной орбитали на другую только в том случае, если он поглощает (с низкоэнергетической орбитали на высокоэнергетическую) или излучает (с высокоэнергетической орбитали на низкоэнергетическую) фотон и энергия фотона равна разность энергий двух орбиталей. Модель Бора дала прекрасное объяснение атомному спектру водорода (выше мы показали соответствующий электронный переход серий Лаймана, Бальмера и Пашена в спектре водорода) и заложила основу для теории химической связи Льюиса. В 1922 декабря Бор был удостоен Нобелевской премии по физике за вклад в квантовую модель атома. [Ссылка на рисунок: Бор, Н. Фил. Маг. 26, 1 (1913)]
[Ссылка на рисунок: Бор, Н. Фил. Маг. 26, 1 (1913)]
Атомные орбитали квантовой механики. Хотя квантовая модель Бора успешно объяснила некоторые свойства атомов водорода и других одноэлектронных ионов, таких как ион He, она была очень ограничена для многоэлектронных атомов. С 1920 по 1930 г. де Бройль, В. Гейзенберг, И. Шредингер и другие физики создали квантовую механику, ставшую фундаментальной теорией для понимания атомного и молекулярного мира. В квантовой механике атомная орбиталь интерпретируется как возможность нахождения электрона вокруг ядра, которую можно рассчитать с помощью элегантного уравнения Шредингера. Чтобы сделать эти абстрактные математические понятия более интуитивными, химики обычно используют графику для представления атомных орбиталей. Для указанных выше орбиталей 3D-поверхности выбираются на основе изоповерхностей, внутри которых вероятность появления электрона равна 90%. (Ссылка на рисунок: трехмерные модели атомной орбиты доктора С.