Строение атома селена (Se), схема и примеры
Общие сведения о строении атома селена
Относится к элементам p-семейства. Неметалл. Обозначение – Se. Порядковый номер – 34. Относительная атомная масса – 78,96 а.е.м.
Электронное строение атома селена
Атом селена состоит из положительно заряженного ядра (+34), внутри которого есть 34 протона и 45 нейтронов, а вокруг, по трем орбитам движутся 34 электрона.
Рис.1. Схематическое строение атома селена.
Распределение электронов по орбиталям выглядит следующим образом:
+34Se)2)8)18)6;
1s22s22p63s23p63d104s24p4.
Внешний энергетический уровень атома селена содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Каждый валентный электрон атома селена можно охарактеризовать набором из четырех квантовых чисел:
|
Подуровень |
n |
l |
ml |
s |
|
s |
4 |
0 |
0 |
+1/2 |
|
s |
4 |
0 |
0 |
-1/2 |
|
p |
4 |
1 |
-1 |
+1/2 |
|
p |
4 |
1 |
-1 |
-1/2 |
|
p |
4 |
1 |
0 |
+1/2 |
|
p |
4 |
1 |
1 |
+1/2 |
Наличие двух неспаренных электронов свидетельствует о том, что степень окисления селена равна +2.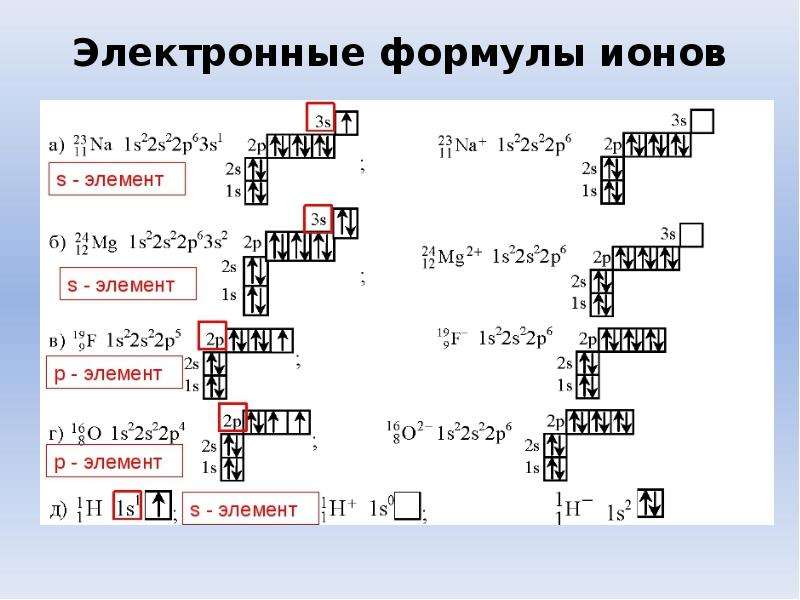 Так как на четвертом уровне есть вакантные орбитали 4d-подуровня, то для атома селена характерно наличие возбужденного состояния:
Так как на четвертом уровне есть вакантные орбитали 4d-подуровня, то для атома селена характерно наличие возбужденного состояния:
Именно поэтому для селена также характерна степень окисления +4.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Селен электронное строение – Справочник химика 21
Таким образом, можно ввести понятие о полной и неполной электронной аналогии. Полными электронными аналогами называются элементы, которые имеют сходное электронное строение во всех степенях окисления, чем и определяется близкое подобие их химических свойств. Например, в рассматриваемой VI группе периодической системы полными электронными аналогами являются кислород и сера [01 [He] 2s 2p [S] [Ne] Зs Зp селен, теллур и полоний [Se] [A V>nKr] 4d >5s 5p [Ро] [XeVЧf 5d %sЩp а также хром, молибден и вольфрам [Сг] [Ar] 3d 4s [Мо] [Kr] 4d 5si [Wl [Xe] 4f Sd 6s . У полония и вольфрама
Например, в рассматриваемой VI группе периодической системы полными электронными аналогами являются кислород и сера [01 [He] 2s 2p [S] [Ne] Зs Зp селен, теллур и полоний [Se] [A V>nKr] 4d >5s 5p [Ро] [XeVЧf 5d %sЩp а также хром, молибден и вольфрам [Сг] [Ar] 3d 4s [Мо] [Kr] 4d 5si [Wl [Xe] 4f Sd 6s . У полония и вольфрама Строение внешней электронной оболочки атома Кислород Сера Селен Теллур [c.452]
Таким образом, можно ввести представление о полной и неполной электронной аналогии. Полными электронными аналогами называются элементы, которые имеют сходное электронное строение во всех степенях окисления, чем и объясняется близкое подобие их химических свойств. Например, в рассматриваемой VI группе Периодической системы полными электронными аналогами являются кислород и сера [О] — [ У28 2р [8] — [Ке] 03823р , селен, теллур и полоний [8е]34 [Аг]183 104524р4 [Те]52 – [Щ Чё Ъз Ър -, [Ро] – [Хе] Ч Ъ %8Чр, а также хром, молибден и вольфрам [Сг] — [Аг]> 3 [ У] — [Хе]5 4/ 5(/ бв2 У полония и вольфрама в отличие от остальных элементов присутствует внутренняя завершенная 4/оболочка, наличие которой проявляется в лантаноидном сжатии.
Полупроводниками называются вещества, занимающие по электропроводимости промежуточное положение между проводниками и изоляторами (диэлектриками). В настоящее время в полупроводниковых приборах и аппаратах применяются главным образом три полупроводниковых элемента — германий, кремний и селен. Эти элементы, как и все проводники — металлы, имеют кристаллическую структуру, но в строении их кристаллических решеток имеется существенная разница. У проводников кристаллические решетки состоят главным образам из атомов, потерявших один электрон.
На основании приведенных данных можно считать твердо установленным экстремум значений проводимости, магнитной восприимчивости, плотности и микротвердости у стекол системы мышьяк—селен, содержащих 9 ат. % мышьяка. Наличие экстремальных значений характеристических величин свидетельствует о существенном изменении структуры стеклообразных сплавов в этой области составов. Л инимальное значение магнитной восприимчивости у стекол, содержащих -9ат. % мышьяка, связано с изменением степени деформации валентных электронных облаков в химических связях As—Se и Se—Se. Это изменение обусловлено статистическим распределением трехмерных пространственных структурных единиц образующегося AsaSes в структуре стеклообразного селена. В таких стеклообразных сплавах с максимально неупорядоченным строением затрудняется сквозной перенос носителей заряда, для них получены заниженные значения плотности и микро-твердости. Перенос носителей заряда с конца оборванной цепи на соседнюю цепь в таких стеклообразных сплавах требует преодоления значительного активационного барьера.
В состав больщей части органических ингибиторов входит, по крайней мере, одна полярная группа с атомом азота, серы или кислорода, а в некоторых случаях — селена или фосфора, то есть элементов, имеющих на внешней орбите неподеленные пары электронов, способных поэтому к активному донорно-акцептор-ному взаимодействию. Использование органических соединений, содержащих кратные (двойные и тройные) связи, обусловлено наличием п-связей, для которых характерны высокая поляризуемость и способность к взаимодействию с металлом. При равной стабильности ингибирующих соединений эффективность функционального атома в адсорбционных процессах изменяется в последовательности селен > сера > азот > кислород, что связано с меньшей электроотрицательностью элементов слева [4]. Кроме того, адсорбция поверхностно-активных органических веществ растет с увеличением их молекулярной массы и дипольного момента, более эффективными ингибиторами оказываются органические соединения асимметричного строения.
Наконец, при наличии малого энергетического зазора (рис. 54, б) валентные электроны, приобретающие под внешним воздействием, например, теплового, светового облучения дополнительную энергию (возбуждаются, как в атоме, см. рис. 8), оказываются способными преодолевать запрещенную зону (происходит перескок валентных электронов в зону проводимости), В результате повышается электронная проводимость вещества, что используется в технике (например, в фотодиодах). Вещества, электронное строение которых характеризуется узкими запрещенными энергетическими зонами, называются полупроводииками . К ним относятся, в первую очередь, кремний, германий, селен и теллур, а также некоторые соединения, например GaAs, InP, ZnTe.
Строение галоидпроизводных. Шестифтористые сера, селен и теллур изучались методом диффракции электронов авторами Броквей и Паулинг (1933 г.) и Браун и Нок (1933 г. ). Эта проблема представляет значительный интерес. Несомненны правильная октаэдрическая структура этих молекул, а также факт постоянства всех междуатомных расстояний в каждой молекуле. В табл. 33 приводятся наблюдаемые значения и вычисленные в предположении аддитивности междуатомных расстояний. [c.172]
). Эта проблема представляет значительный интерес. Несомненны правильная октаэдрическая структура этих молекул, а также факт постоянства всех междуатомных расстояний в каждой молекуле. В табл. 33 приводятся наблюдаемые значения и вычисленные в предположении аддитивности междуатомных расстояний. [c.172]
Дальнейшее различие между кислородом и серой, также связанное с больишм стремлением серы образовывать ковалентные связи, состоит в том, что связи 8 — 8 образуются легче, чем связи О — О. Эти элементы, а также селен и теллур, образуют двухатомные молекулы. Молекула Оз не содержит двойной связи (0 = 0), так как твердый кислород парамагнитен (практически все другие молекулярные кристаллы диамагнитны) наличие магнитного момента показывает, что эта молекула содержит два неспаренных электрона. В нормальном состоянии атомы молекулы Од, вероятно, связаны одной двухэлектронной и двумя трехэлектронными связями, причем оставшаяся орбита каждого атома занята парой свободных электронов 0-]—]—г О . Молекулы Зд, ЗСз и Тез имеют, повидимому, одинаковое строение, так же как и молекула 30, о которой известно, что она образуется при пропускании электрического разряда через смесь паров ЗОз и серы.. [c.345]
Молекулы Зд, ЗСз и Тез имеют, повидимому, одинаковое строение, так же как и молекула 30, о которой известно, что она образуется при пропускании электрического разряда через смесь паров ЗОз и серы.. [c.345]
Селен
| Селен | |
|---|---|
| Атомный номер | 34 |
| Внешний вид простого вещества |
Мягкий неметалл, похожий на серу |
| Свойства атома | |
|
Атомная масса (молярная масса) |
78,96 а. е. м. (г/моль) |
| Радиус атома | 140 пм |
|
Энергия ионизации (первый электрон) |
940,4 (9,75) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s2 4p4 |
| Химические свойства | |
| Ковалентный радиус | 116 пм |
| Радиус иона | (+6e) 42 (-2e) 191 пм |
|
Электроотрицательность (по Полингу) |
2,55 |
| Электродный потенциал | 0 |
| Степени окисления | 6, 4, -2 |
| Термодинамические свойства простого вещества | |
| Плотность | 4,79 г/см³ |
| Молярная теплоёмкость | 25,4[1]Дж/(K·моль) |
| Теплопроводность | 0,52 Вт/(м·K) |
| Температура плавления | 490 K |
| Теплота плавления | 5,23 кДж/моль |
| Температура кипения | 958,1 K |
| Теплота испарения | 59,7 кДж/моль |
| Молярный объём | 16,5 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=4,364 c=4,959 Å |
| Отношение c/a | 1,136 |
| Температура Дебая | 90 K |
| Se | 34 |
| 78,96 | |
| 4s2 4p4 | |
| Селен | |
Селен — химический элемент с атомным номером 34 в периодической системе, обозначается символом Se (Selenium), хрупкий блестящий на изломе неметалл чёрного цвета (устойчивая аллотропная форма, неустойчивая форма — киноварно-красная).
Элемент открыт Й. Я. Берцелиусом в 1817. Небольшое поествование Берцелиуса об открытии элемента: Велись научные работы вместе с Готлибом Ганом — анализировали и исследовали метод, который применяют для производства серной кислоты в Грипсхольме. Мы обнаружили в серной кислоте осадок, частью красный, частью светло-коричневый. Этот осадок, опробованный с помощью паяльной трубки, издавал слабый редечный запах и образовывал свинцовый королёк. Согласно Клапроту, такой запах служит указанием на присутствие теллура. Ган заметил при этом, что на руднике в Фалюне, где собирается сера, необходимая для производства кислоты, также ощущается подобный запах, указывающий на присутствие теллура. Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило меня исследовать осадок. Приняв намерение отделить теллур, я не смог, однако, открыть в осадке никакого теллура. Тогда я собрал всё, что образовалось при получении серной кислоты путём сжигания фалюнской серы за несколько месяцев, и подверг полученный в большом количестве осадок обстоятельному исследованию. Я нашёл, что масса (то есть осадок) содержит до сих пор неизвестный металл, очень похожий по своим свойствам на теллур. В соответствии с этой аналогией я назвал новое тело селеном (Selenium) от греческого σελήνη (луна), так как теллур назван по имени Tellus — нашей планеты.
Я нашёл, что масса (то есть осадок) содержит до сих пор неизвестный металл, очень похожий по своим свойствам на теллур. В соответствии с этой аналогией я назвал новое тело селеном (Selenium) от греческого σελήνη (луна), так как теллур назван по имени Tellus — нашей планеты.
Происхождение названия
Название происходит от σελήνη — Луна. Элемент назван так в связи с тем, что в природе он является спутником химически сходного с ним теллура (названного в честь Земли).
Получение
Значительные количества селена получают из шлама медно-электролитных производств, в котором селен присутствует в виде селенида серебра. Применяют несколько способов получения: окислительный обжиг с возгонкой SeO2; нагревание шлама с концентрированной серной кислотой, окисление соединений селена до SeO2 с его последующей возгонкой; окислительное спекание с содой, конверсия полученной смеси соединений селена до соединений Se(IV) и их восстановление до элементарного селена действием SO2.
Физические свойства
Монокристаллический селен(99,9999 %)Твёрдый селен имеет несколько аллотропных модификаций.Наиболее устойчивой модификацией является серый селен.
Химические свойства
Селен — аналог серы. Так же, как и серу, его можно сжечь на воздухе. Горит синим пламенем, превращаясь в двуокись SeO2. Только SeO2 — не газ, а кристаллическое вещество, хорошо растворимое в воде. Получить селенистую кислоту (SeO2 + H2O → H2SeO3) ничуть не сложнее, чем сернистую. А действуя на неё сильным окислителем (например, HClO3), получают селеновую кислоту H2SeO4, почти такую же сильную, как серная.
Применение
-
Одним из важнейших направлений его технологии, добычи, и потребления являются полупроводниковые свойства как самого селена, так и его многочисленных соединений (селенидов), их сплавов с другими элементами, в которых селен стал играть ключевую роль.
 Эта роль селена постоянно растёт, растёт спрос и цены (отсюда дефицит этого элемента).
Эта роль селена постоянно растёт, растёт спрос и цены (отсюда дефицит этого элемента).
Цены на селен растут из года в год и в настоящее время колеблются около 120 долларов за 1 кг.
В современной технологии полупроводников применяются селениды многих элементов, например селениды олова, свинца, висмута, сурьмы, селениды лантаноидов. Особенно важны свойства фотоэлектрические и термоэлектрические как самого селена, так и селенидов.
- Стабильный изотоп селен-74 позволил на своей основе создать плазменный лазер с колоссальным усилением в ультрафиолетовой области (около миллиарда раз).
- Радиоактивный изотоп селен-75 используется в качестве мощного источника гамма-излучения для дефектоскопии.
- В медицине, а также в сельском хозяйстве используют микродобавки селена к лекарственным средствам, витаминным препаратам, БАД, и т. п.
Селенид калия совместно с пятиокисью ванадия применяется при термохимическом получении водорода и кислорода из воды (селеновый цикл, Ливерморская национальная лаборатория им. Лоуренса, Ливермор, США).
Лоуренса, Ливермор, США).
Биологическая роль
Входит в состав активных центров некоторых белков в форме аминокислоты селеноцистеина.
Микроэлемент, но большинство соединений достаточно токсично (селеноводород, селеновая и селенистая кислота) даже в средних концентрациях.
Изотопы
В природе существует 6 изотопов селена (74Se, 76Se, 77Se, 78Se, 80Se и 82Se), из них пять, насколько это известно, стабильны, а один (82Se) испытывает двойной бета-распад с периодом полураспада 9,7×1019 лет. Кроме того, искусственно созданы ещё 24 радиоактивных изотопа (а также 9 метастабильных возбуждённых состояний) в диапазоне массовых чисел от 65 до 94.
Периоды полураспада некоторых радиоактивных изотопов селена:
| Изотоп | Распространённость в природе, % | Период полураспада |
|---|---|---|
| 73Se | — |
7,1 час.
|
| 74Se | 0,87 | — |
| 75Se | — | 120,4 сут. |
| 76Se | 9,02 | — |
| 77Se | 7,58 | — |
| 77mSe | — | 17,5 сек. |
| 78Se | 23,52 | — |
| 79Se | — | 6,5·104 лет |
| 79mSe | — |
3,91 мин.
|
| 80Se | 49,82 | — |
| 81Se | — | 18,6 мин. |
| 81mSe | — | 62 мин. |
| 82Se | 9,19 | — |
| 83mSe | — | 69 сек. |
| 83Se | — |
25 мин.
|
Дополнительная информация
Электронные формулы элементов 4 периода. Задача 56
Задача 56.
Напишите электронно-графическую формулу для элементов 4-го периода, определите их валентные электроны и охарактеризуйте их с помощью квантовых чисел.
Решение:
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f), x – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
Последовательность заполнения энергетических уровней и подуровней следующая:
1s►2s►2р►3s►3р►4s►3d►4р►5s►4d►5р►6s►(5d1)►4f►5d►6р►7s►(6d1-2)►5f►6d►7р
а) Элемент № 19
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для 19 элемента – калия (К – порядковый № 19) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s1
Валентный электрон калия 4s1 – находятся на 4s-подуровне На валентной орбитали атома К находится 1 электрон. Поэтому элемент помещают в первую группу периодической системы Д.И.Менделеева.
б) Элемент № 20
Для элемента № 20 – кальция (Са – порядковый № 20) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2
Валентные электроны кальция 4s2 – находятся на 4s-подуровне На валентной орбитали атома Са находятся 2 электрона. Поэтому элемент помещают во вторую группу периодической системы Д.И.Менделеева.
Поэтому элемент помещают во вторую группу периодической системы Д.И.Менделеева.
в) Элемент № 21
Для элемента № 21 – скандия (Са – порядковый № 21) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d1
Валентные электроны скандия 4s2 3d1 – находятся на 4s– и 3d-подуровнях. На валентных орбиталях атома Sc находится 3 электрона. Поэтому элемент помещают в третью группу периодической системы Д.И.Менделеева.
г) Элемент № 22
Для элемента № 22 – титана (Ti – порядковый № 22) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d2
Валентные электроны скандия 4s2 3d2 – находятся на 4s- и 3d-подуровнях. На валентных орбиталях атома Ti находится 4 электрона. Поэтому элемент помещают в четвертую группу периодической системы Д.И.Менделеева.
На валентных орбиталях атома Ti находится 4 электрона. Поэтому элемент помещают в четвертую группу периодической системы Д.И.Менделеева.
д) Элемент № 23
Для элемента № 23 – ванадия (V – порядковый № 23) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d3
Валентные электроны скандия 4s2 3d3 – находятся на 4s- и 3d-подуровнях. На валентных орбиталях атома V находится 5 электронов. Поэтому элемент помещают в пятую группу периодической системы Д.И.Менделеева.
е) Элемент № 24
Для элемента- хрома (Cr – порядковый № 24) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d5
Валентные электроны хрома 4s1 3d5– находятся на 4s- и 3-подуровнях.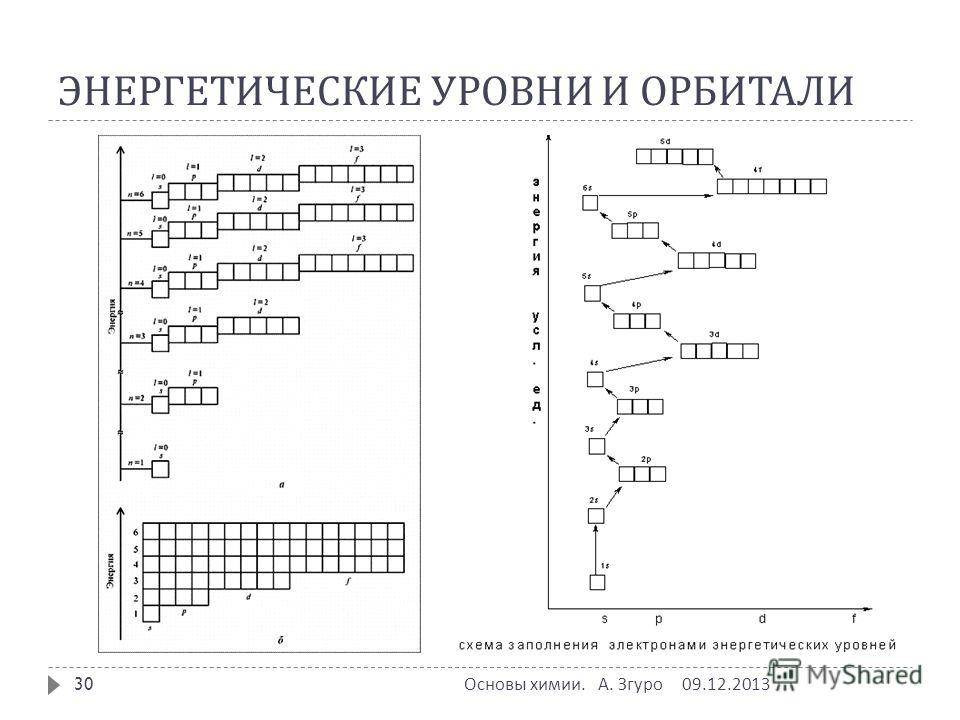 На валентных орбиталях атома Cr находится 6 электронов. Поэтому элемент помещают в шестую группу периодической системы Д.И.Менделеева.
На валентных орбиталях атома Cr находится 6 электронов. Поэтому элемент помещают в шестую группу периодической системы Д.И.Менделеева.
У атома хрома один электрон с 4s-подуровня переходит на 3d-подуровень и при этом атом хрома приобретает более устойчивое состояние 4s1 3d5, чем 4s2 3d4. Объясняется это тем, что энергетически выгоднее для атома хрома когда на 3d-подуровне будет находиться не 4 а 5 электронов – все ячейки заполнены по одному электрону. Таким образом, атому хрома энергетически выгоднее валентная электроная конфигурация 4s1 3d5, а не 4s2 3d4.
ж) Элемент № 25 – марганец (Mn – порядковый № 25) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d5
Валентные электроны марганца 4s2 3d5 – находятся на 4s- и 3d-подуровнях.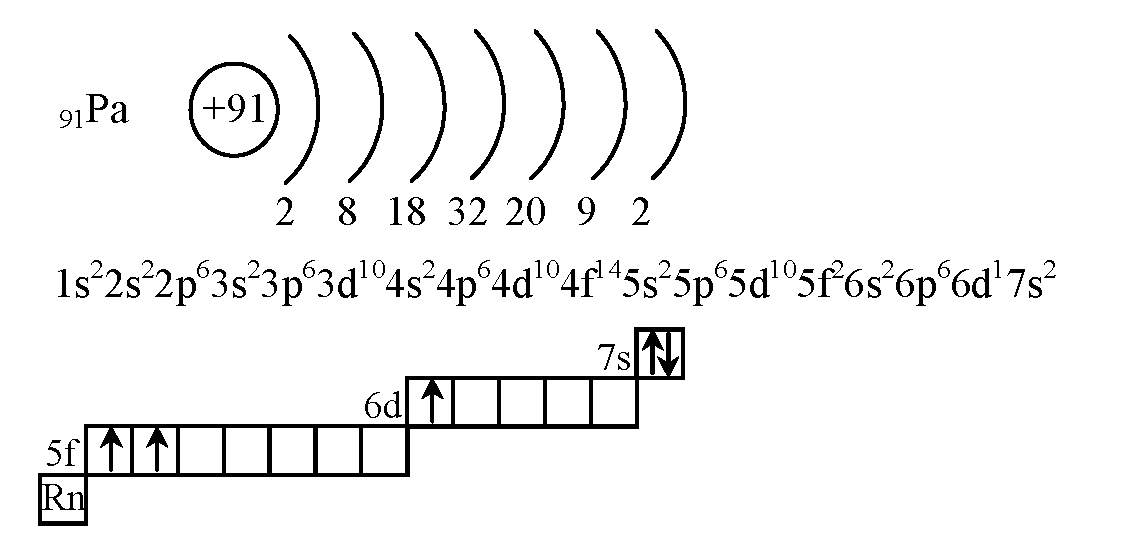 На валентных орбиталях атома Mn находится 7 электронов. Поэтому элемент помещают в седьмую группу периодической системы Д.И.Менделеева.
На валентных орбиталях атома Mn находится 7 электронов. Поэтому элемент помещают в седьмую группу периодической системы Д.И.Менделеева.
з) Элемент № 26 – железо (Fe – порядковый № 26) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Валентные электроны железа 4s2 3d6 – находятся на 4s- и 3d-подуровнях. На валентных орбиталях атома Fe находится 8 электронов. Поэтому элемент помещают в восьмую группу периодической системы Д.И.Менделеева.
к) Элемент № 27 – собальт (Со – порядковый № 27) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d7
Валентные электроны собальта 4s2 3d7 – находятся на 4s- и 3d-подуровнях. На валентных орбиталях атома Со находится 9 электронов. Поэтому элемент помещают в девятую группу периодической системы Д.И.Менделеева.
На валентных орбиталях атома Со находится 9 электронов. Поэтому элемент помещают в девятую группу периодической системы Д.И.Менделеева.
л) Элемент № 28 – никель (Ni – порядковый № 28) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d8
Валентные электроны никеля 4s2 3d8– находятся на 4s- и 3d-подуровнях. На валентных орбиталях атома Ni находится 10 электронов. Поэтому элемент помещают в десятую группу периодической системы Д.И.Менделеева.
м) Элемент № 29 – меди (Cu – порядковый № 29) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s1 3d10
Валентные электроны меди 4s1 3d10 – находятся на 4s- и 3d-подуровнях. На валентных орбиталях атома Cu находится 11 электронов. Поэтому элемент помещают в одиннадцатую группу периодической системы Д.И.Менделеева.
На валентных орбиталях атома Cu находится 11 электронов. Поэтому элемент помещают в одиннадцатую группу периодической системы Д.И.Менделеева.
У атома меди наблюдается проскок (“провал”): один электрон 4s-подуровня переходит на 3d-подуровень. Это объясняется тем, что состояние атома считается более энергетически выгодным, если на d-подуровне находится не 9, а 10 электронов. Потому что энергетически более выгоднее для атома меди когда заполнены все пять d-ячеек на 3d-подуровне, но не тогда когда четыре d-ячейки заполнены, а на пятой только один электрон. Для заполнения пятой d-ячейки 3d-подуровня один электрон 4s-подуровня переходит на 3d-подуровнь, как бы “проваливается“. Таким образом, атому меди энергетически выгоднее валентная электроная конфигурация 4s1 3d10, а не 4s2 3d9.
н) Элемент № 30 – цинка (Zn – порядковый № 30) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10
Валентные электроны цинка 4s2 3d10– находятся на 4s- и 3d-подуровнях. На валентных орбиталях атома Zn находится 12 электронов. Поэтому элемент помещают в двенадцатую группу периодической системы Д.И.Менделеева.
На валентных орбиталях атома Zn находится 12 электронов. Поэтому элемент помещают в двенадцатую группу периодической системы Д.И.Менделеева.
о) Элемент № 31 – галлий (Ga – порядковый № 31) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р1
Валентные электроны галлия 4s2 3d10 4р1 – находятся на 4s-, 3d- и 4р-подуровнях. На валентных орбиталях атома Ga находится 13 электронов. Поэтому элемент помещают в тринадцатую группу периодической системы Д.И.Менделеева.
п) Элемент № 32 – германий (Ge – порядковый № 32) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р2
Валентные электроны германия 4s2 3d10 4р2 – находятся на 4s-, 3d- и 4р-подуровнях. На валентных орбиталях атома Gе находится 14 электронов. Поэтому элемент помещают в четырнадцатую группу периодической системы Д.И.Менделеева.
р) Элемент № 33 – мышьяк (As – порядковый № 33) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р3
Валентные электроны мышьяка 4s2 3d10 4р3 – находятся на 4s-, 3d- и 4р-подуровнях. На валентных орбиталях атома As находится 15 электронов. Поэтому элемент помещают в пятнадцатую группу периодической системы Д.И.Менделеева.
с) Элемент № 34 – селен (Se – порядковый № 34) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р4
Валентные электроны селена 4s2 3d10 4р4 – находятся на 4s-, 3d- и 4р-подуровнях. На валентных орбиталях атома Se находится 16 электронов. Поэтому элемент помещают в шестнадцатую группу периодической системы Д.И.Менделеева.
с) Элемент № 35 – бром (Br – порядковый № 35) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р5
Валентные электроны брома 4s2 3d10 4р5 – находятся на 4s-, 3d- и 4р-подуровнях. На валентных орбиталях атома Br находится 17 электронов. Поэтому элемент помещают в семнадцатую группу периодической системы Д.И.Менделеева.
т) Элемент № 36 – криптон (Kr – порядковый № 36) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6
Валентные электроны криптона 4s2 3d10 4р6 – находятся на 4s-, 3d- и 4р-подуровнях. На валентных орбиталях атома Kr находится 18 электронов. Поэтому элемент помещают в восемнадцатую группу периодической системы Д.И.Менделеева.
Информация об элементе селена
Se: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История селена
Элемент Селен был открыт Йенсом Якобом Берцелиусом в год. 1817 г. в Швеции . Селен получил свое название от греческого selene, что означает «луна».
Присутствие селена: изобилие в природе и вокруг нас
В таблице ниже показано содержание селена во Вселенной, Солнце, метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура селена
Твердотельная структура селена – Simple Monoclinic.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| а | b | c |
|---|---|---|
| 905.4 | 908,3 | 1160,1 вечера |
и углы между ними Решетки Angles (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | 1,58493 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства селена
Атомы селена имеют 34 электрона и структура электронной оболочки [2, 8, 18, 6] с символом атомного члена (квантовые числа) 3 P 2 .
Оболочечная структура селена – количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 6 | 10 | |
| 4 | N | 2 | 4 |
Основная электронная конфигурация селена – нейтраль Атом селена
Электронная конфигурация нейтрального атома селена в основном состоянии [Ar] 3d10 4s2 4p4.Часть конфигурации селена, эквивалентная благородному газу предыдущий период сокращенно обозначается как [Ar]. Для атомов с большим количеством электронов это нотация может стать длинной, поэтому используются сокращенные обозначения. валентные электроны 3d10 4s2 4p4, электроны в внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального селена
Полная электронная конфигурация основного состояния для атома селена, несокращенная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d10 4с2 4п4
Атомная структура селена
Атомный радиус селена 103 пм, а его ковалентный радиус 116 пм.
Атомный спектр селена
Химические свойства селена: Энергии ионизации селена и сродство к электрону
Сродство к электрону селена составляет 195 кДж / моль.
Энергия ионизации селена
Энергии ионизации селена
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 941 |
| 2 | 2045 |
| 3 | 2973.7 |
| 4 | 4144 |
| 5 | 6590 |
| 6 | 7880 |
| 7 | 14990 |
Физические свойства селена
Физические свойства селена см. В таблице ниже.
| Плотность | 4.819 г / см3 |
| Молярный объем | 16,385 142 1457 см3 |
Эластичные свойства
Твердость селена – Испытания для измерения твердости элемента
Электрические свойства селена
Селен не содержит электричества. Ссылаться на стол ниже электрические свойства селена
Теплопроводность и теплопроводность селена
Магнитные свойства селена
Оптические свойства селена
Акустические свойства селена
Термические свойства селена – энтальпии и термодинамика
Термические свойства селена
см. В таблице ниже.Энтальпия селена
Изотопы селена – ядерные свойства селена
Изотопы родия.Встречающийся в природе селен имеет 5 стабильный изотоп – 74Se, 76Se, 77Se, 78Se, 80Se.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 65Se | ||||
| 66Se | ||||
| 67Se | ||||
| 68Se | ||||
| 69Se | ||||
| 70Se | ||||
| 71Se | ||||
| 72Se | ||||
| 73Se | ||||
| 74Se | 0.89% | Стабильный | N / A | |
| 75Se | ||||
| 76Se | 9.37% | Стабильный | N / A | |
| 77Se | 7.63% | Стабильный | N / A | |
| 78Se | 23.77% | Стабильный | N / A | |
| 79Se | ||||
| 80Se | 49.61% | Стабильный | N / A | |
| 81Se | ||||
| 82Se | 8.73% | |||
| 83Se | ||||
| 84Se | ||||
| 85Se | ||||
| 86Se | ||||
| 87Se | ||||
| 88Se | ||||
| 89Se | ||||
| 90Se | ||||
| 91Se | ||||
| 92Se | ||||
| 93Se | ||||
| 94Se |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
| Количество CAS | CAS7782-49-2 |
| Номер RTECS | {Н / Д, RTECSVS7700000, Н / Д} |
| Класс опасности DOT | {Н / Д, 6.1, Н / Д} |
| Номера DOT | “НЕТ”, {2658}, “НЕТ” |
| Номер ЕС | {N / A, N / A, N / A} |
| Рейтинг огнестойкости NFPA | {Н / Д, 0, Н / Д} |
| Опасности NFPA | Н / Д, Н / Д, Н / Д |
| Рейтинг здоровья NFPA | {НЕТ, 2, НЕТ} |
| Рейтинг реактивности NFPA | {Н / Д, 0, Н / Д} |
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Расшифровка: Химия в ее элементе: селен(Promo) Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Крис Смит Здравствуйте, на этой неделе шелушащиеся скальпы, скунсы, мертвые пони-поло и элемент, от которого от вас воняет чесноком. Ням! Но это еще не все плохие новости. Берни Булкин Мы знаем, что селен присутствует прямо под серой в периодической таблице Менделеева, но ему не уделяют особого внимания. В учебниках по неорганической химии, по которым я изучал, много говорится о сере и, где это уместно, говорится о таких вещах, как «селен также образует аналогичные кислоты» или «селен также имеет много аллотропных форм».Как пренебрегают этим важным элементом! Когда мне было чуть больше 20 лет, у меня на несколько лет появилась сухость кожи головы, вероятно, в результате беспокойства по поводу грантов на исследования, которые я пытался получить. Лечением для этого был шампунь, содержащий сульфид селена, что меня удивило, потому что я думал, что селен очень токсичен. Фактически, небольшое расследование показало мне, что в небольших количествах это было совершенно безопасно. Селен – один из тех слишком обычных элементов, которые необходимы для жизни в небольших количествах и очень токсичны в больших количествах.400 микрограммов в день – это верхний безопасный уровень потребления для человека. Но он нужен нам как часть различных ферментов, таких как глутатионпероксидаза, а также в щитовидной железе. Он широко распространен и накапливается в различных продуктах питания, таких как орехи, тунец и омары, поэтому у людей редко бывает дефицит селена. Но для лошадей с их более ограниченным рационом дефицит селена является обычным явлением, и его часто корректируют с помощью пищевых добавок. Опять же, это требует большой осторожности. Недавно 21 лошадь для поло умерла от передозировки селена во Флориде в результате того, что ветеринарный фармацевт переусердствовал при смешивании лекарств. Именно Берцелиус в 1817 году открыл селен как примесь в серной кислоте. Теллур был уже открыт и назван в честь греческого слова, обозначающего землю, поэтому он назвал селен, используя греческое слово для луны, selene . Как и следовало ожидать, он встречается в различных минералах вместе с серой. Мы знаем, что его эволюция в растениях имеет долгую историю, потому что мы находим соединения селена в углях, а большая часть того, что выбрасывается в атмосферу сегодня, происходит от сжигания угля.Действительно, уровень токсичности селена для человека был установлен всего 20 лет назад в ходе исследований китайских жертв отравления селеном, s elenosis , которые выращивали кукурузу на богатых селеном угольных породах. Селеноз имеет несколько прекрасных симптомов: запах чеснока изо рта, выпадение волос, выпадение ногтей, усталость, раздражительность и, в конечном итоге, цирроз печени и смерть. Селенаты и селениты являются наиболее токсичными, поскольку элементарный селен не сразу включается в биологические процессы. В то время как некоторые из аллотропных форм селена напоминают те, которые мы хорошо знаем из изучения серы, есть другие, которые отличаются. Самое главное, так называемый серый селен состоит из длинных цепочек атомов, образующих протяженные спиральные структуры. Хотя селен не является металлическим элементом, серый селен является хорошим фотопроводником и использовался в первых фотоэлементах. Впоследствии селен и различные соединения селена использовались во множестве фотопроводников и фотоэлектрических приложений.Действительно, новейшим и наиболее многообещающим классом массовых солнечных элементов является селенид меди, индия, галлия. Когда-то практически все копировальные машины использовали селен; в настоящее время они в значительной степени заменены органическими фотопроводниками. Но разнообразие использования селена не ограничивается шампунями, добавками к корму для лошадей и фотоэлектрическими батареями. Селен добавлен в синтетический каучук для повышения устойчивости к истиранию, он был добавлен в латунь вместе с висмутом для замены свинца в трубах и используется в качестве селената натрия в качестве инсектицида для предотвращения атак на цветущие растения, такие как хризантемы. и гвоздики.Селен в его аллотропно-красной форме добавляется в стекло, чтобы придать ему алый цвет, но его также можно использовать для удаления зеленоватого оттенка, который иногда встречается в стекле из-за соединений железа. Было проведено множество исследований, но ни одно из них не является убедительным, о возможной роли селена в профилактике рака и в повышении эффективности химиотерапии. Большинство из них, кажется, указывают на то, что, если он вообще эффективен, он каким-то образом работает вместе с витамином Е, который, как и селен, играет антиоксидантную роль в организме.Также меня заинтриговало недавнее исследование, показывающее, что почвы с дефицитом селена могут играть роль в восприимчивости к ВИЧ / СПИДу в Африке. Причина в том, что низкий уровень селена связан с ослабленной иммунной системой, поскольку отсутствие антиоксидантной способности создает стресс для иммунной системы. Но лучшее вхождение селена в природе я оставляю напоследок. Бутил-селеномеркаптан является важным ингредиентом запаха скунса и, безусловно, претендует на звание самого плохо пахнущего соединения.Как только вы его почувствуете, вы никогда не забудете его и не недооцените влияние, которое может оказать этот интересный элемент. Крис Смит Таким образом, он может убрать зуд кожи головы, но при этом может вызвать неприятный запах. Это был Берни Балкин из Кембриджского университета с историей о Selenium. На следующей неделе мы посетим элемент, который сделал знаменитым Супермен. Ангелос Михаэлидис Криптон – это вымышленная планета во вселенной DC Comics и родной мир супергероев Супермена, Супергёрл и Крипто, «суперпеси».Криптон последовательно изображался как разрушенный сразу после бегства Супермена с планеты, с точными деталями его разрушения, различающимися в зависимости от периода времени, сценаристов и франшизы. Вот и все, что нужно для попытки выполнить поиск в “Википедии” этого “скрытого” элемента! Крис Смит И вы можете уловить факты о Криптоне, а не выдумку с Англеосом Михаэлидисом на следующей неделе на Chemistry in its Element. Я Крис Смит, спасибо за внимание и до свидания. (Промо) (Окончание промо) |
WebElements Периодическая таблица »Селен» Свойства свободных атомов
Атомы селена имеют 34 электрона, а структура оболочки – 2.8.18.6.
Электронная конфигурация основного состояния газообразного нейтрального селена в основном состоянии – это [ Ar ]. 3д 10 . 4с 2 . 4p 4 , а символ термина – 3 P 2 .
Схематическая электронная конфигурация селена. Оболочечная структура Косселя селена.Атомный спектр
Представление атомного спектра селена.
Энергии ионизации и сродство к электрону
Сродство селена к электрону составляет 195.0 кДж моль ‑1 . Энергии ионизации селена приведены ниже.
Энергии ионизации селена.Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды “Клементи-Раймонди”, Z eff . Перейдите по гиперссылкам для получения более подробной информации и графиков в различных форматах.
| 1 с | 33,2622 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 24.89 | 2p | 30.07 | ||||
| 3 с | 19,40 | 3 пол. | 18,71 | 3d | 18,48 | ||
| 4с | 9,76 | 4 пол. | 8,29 | 4d | (нет данных) | 4f | (нет данных) |
| 5s | (нет данных) | 5p | (нет данных) | 5d | (нет данных) | ||
| 6s | (нет данных) | 6p | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди и В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальная | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 12658 [1] |
| L I | 2s | 1652 [2, значения получены из справочного материала 1] |
| L II | 2p 1/2 | 1474,3 [2, значения взяты из ссылки 1] |
| L III | 2p 3/2 | 1433.9 [2, значения взяты из ссылки 1] |
| M I | 3s | 229,6 [2] |
| M II | 3p 1/2 | 166,5 [2] |
| M III | 3p 3/2 | 160,7 [2] |
| M IV | 3d 3/2 | 55,5 [2] |
| M V | 3d 5/2 | 54.6 [2] |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электронов. Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev. Mod. Phys. , 1967, 39 , 125.
- М.Cardona, L. Ley, Eds., Фотоэмиссия в твердых телах I: Общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- D.R. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, “Энергии связи на уровне ядра в металлах”, J. Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
Селен – Атомный номер – Атомная масса – Плотность селена
Атомный номер селена
Селен – это химический элемент с атомным номером 34 , что означает, что в атомной структуре 34 протона и 34 электрона. Химический символ для селена – Se .
Атомная масса селена
Атомная масса селена 78,96 ед.
Обратите внимание, что каждый элемент может содержать больше изотопов, поэтому полученная атомная масса рассчитывается на основе встречающихся в природе изотопов и их содержания.
Единицей измерения массы является атомная единица массы (а.е.м.) . Одна атомная единица массы равна 1,66 x 10 -24 граммов. Одна унифицированная атомная единица массы составляет приблизительно массы одного нуклона (либо одного протона, либо нейтрона) и численно эквивалентна 1 г / моль.
Для 12 C атомная масса равна точно 12u, так как от нее определяется единица атомной массы. Для других изотопов изотопная масса обычно отличается и обычно находится в пределах 0.1 ед. Массового числа. Например, 63 Cu (29 протонов и 34 нейтрона) имеет массовое число 63, а изотопная масса в его основном ядерном состоянии равна 62, Существует две причины разницы между массовым числом и изотопной массой, известной как дефект массы: См. Также: Массовое число Плотность селена 4.819 г / см 3 . Типичные плотности различных веществ при атмосферном давлении. Плотность определяется как масса на единицу объема . Это интенсивное свойство , которое математически определяется как масса, разделенная на объем: ρ = m / V На словах плотность (ρ) вещества – это общая масса (m) этого вещества. деленное на общий объем (V), занимаемый этим веществом. Стандартная единица СИ составляет килограммов на кубический метр ( кг / м 3 ).Стандартная английская единица – фунтов массы на кубический фут ( фунт / фут 3 ). См. Также: Что такое плотность См. Также: Самые плотные материалы Земли – селен (Se) , химический элемент кислородной группы (группа 16 [VIa] периодической таблицы), тесно связанный по химическим и физическим свойствам с элементами серы и теллура.Селен встречается редко и составляет примерно 90 частей на миллиард земной коры. Иногда он встречается в несмешанном виде вместе с самородной серой, но чаще встречается в сочетании с тяжелыми металлами (медью, ртутью, свинцом или серебром) в некоторых минералах. Основным коммерческим источником селена является побочный продукт рафинирования меди; его основные области применения – производство электронного оборудования, пигментов и стекла. Селен – это металлоид (элемент, промежуточный по свойствам между металлами и неметаллами).Серая металлическая форма элемента наиболее устойчива в обычных условиях; эта форма обладает необычным свойством значительного увеличения электропроводности при воздействии света. Соединения селена токсичны для животных; растения, выращенные на селеносных почвах, могут концентрировать элемент и становиться ядовитыми. В 1817 году шведский химик Йенс Якоб Берцелиус заметил красное вещество, образовавшееся из сульфидных руд рудников Фалуна, Швеция.Когда в следующем году исследовали этот красный материал, он оказался элементом и был назван в честь Луны или богини Луны Селены. Руда с необычно высоким содержанием селена была обнаружена Берцелиусом всего за несколько дней до того, как он сделал доклад о селене для научных обществ мира. Его чувство юмора очевидно в названии, которое он дал руде, eucairite , что означает «как раз вовремя». Британская викторина 118 Названия и символы из таблицы Менделеева Периодическая таблица Менделеева состоит из 118 элементов.Насколько хорошо вы знаете их символы? В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них. Доля селена в земной коре составляет от 10 −5 до 10 −6 процентов. Его получают в основном из анодных шламов (отложений и остаточных материалов на аноде) при электролитическом рафинировании меди и никеля. Другими источниками являются дымовая пыль при производстве меди и свинца и газы, образующиеся при обжиге пирита.Селен сопровождает медь при рафинировании этого металла: около 40 процентов селена, присутствующего в исходной руде, может концентрироваться в меди, отложенной в электролитических процессах. Из одной тонны выплавленной меди можно получить около 1,5 килограмма селена. При добавлении в стекло в небольших количествах селен обесцвечивает; в больших количествах он придает стеклу чистый красный цвет, который используется в сигнальных огнях. Этот элемент также используется для изготовления красных эмалей для керамики и стальных изделий, а также для вулканизации резины для повышения устойчивости к истиранию. Наибольшие усилия по переработке селена прилагаются в Германии, Японии, Бельгии и России. Аллотропия селена не такая обширная, как у серы, и аллотропы изучены не так тщательно. Только две кристаллические разновидности селена состоят из циклических молекул Se 8 : обозначенные α и β, обе существуют в виде красных моноклинных кристаллов. Серый аллотроп с металлическими свойствами образуется при выдерживании любой из других форм при температуре 200–220 ° C и является наиболее стабильным в обычных условиях. Аморфная (некристаллическая) красная порошкообразная форма селена образуется при обработке раствора селенистой кислоты или одной из ее солей диоксидом серы. Если растворы очень разбавлены, очень мелкие частицы этого сорта образуют прозрачную красную коллоидную суспензию. Прозрачное красное стекло получается в результате аналогичного процесса, который происходит при обработке расплавленного стекла, содержащего селениты, углеродом. Стекловидная, почти черная разновидность селена образуется при быстром охлаждении других модификаций от температур выше 200 ° C.Превращение этой стекловидной формы в красные кристаллические аллотропы происходит при ее нагревании выше 90 ° C или при поддержании контакта с органическими растворителями, такими как хлороформ, этанол или бензол. Чистый селен получают из шламов и шламов, образующихся при производстве серной кислоты. Неочищенный красный селен растворяется в серной кислоте в присутствии окислителя, такого как нитрат калия или некоторые соединения марганца. Образуются как селеновая кислота, H 2 SeO 3 , так и селеновая кислота, H 2 SeO 4 , которые могут выщелачиваться из остаточного нерастворимого материала.Другие методы используют окисление воздухом (обжиг) и нагревание с карбонатом натрия с получением растворимого селенита натрия, Na 2 SeO 3 · 5H 2 O, и селената натрия, Na 2 SeO 4 . Также можно использовать хлор: его действие на селениды металлов дает летучие соединения, включая дихлорид селена, SeCl 2 ; тетрахлорид селена, SeCl 4 ; дихлорид диселена, Se 2 Cl 2 ; и оксихлорид селена, SeOCl 2 .В одном процессе эти соединения селена превращаются водой в селенистую кислоту. Наконец, селен регенерируют путем обработки селенистой кислоты диоксидом серы. Селен – обычный компонент руд, который ценится за содержание серебра или меди; он концентрируется в шламах, осаждаемых при электролитической очистке металлов. Были разработаны методы отделения селена от этих шламов, которые также содержат некоторое количество серебра и меди. При плавлении шлама образуется селенид серебра Ag 2 Se и селенид меди (I) Cu 2 Se.Обработка этих селенидов хлорноватистой кислотой HOCl дает растворимые селениты и селенаты, которые можно восстановить диоксидом серы. Окончательная очистка селена осуществляется повторной перегонкой. Самым выдающимся физическим свойством кристаллического селена является его фотопроводимость: при освещении электрическая проводимость увеличивается более чем в 1000 раз. Это явление возникает в результате продвижения или возбуждения относительно слабо удерживаемых электронов светом в более высокие энергетические состояния (называемые уровнями проводимости), что позволяет электронам мигрировать и, таким образом, обеспечивать электрическую проводимость.Напротив, в типичных металлах электроны уже находятся на уровнях или зонах проводимости, способных течь под действием электродвижущей силы. Удельное электрическое сопротивление селена варьируется в огромном диапазоне в зависимости от таких переменных, как природа аллотропа, примеси, метод очистки, температура и давление. Большинство металлов нерастворимы в селене, а неметаллические примеси увеличивают удельное сопротивление. Освещение кристаллического селена на 0.001 секунда увеличивает его проводимость в 10-15 раз. Красный свет более эффективен, чем свет с более короткой длиной волны. Эти фотоэлектрические и светочувствительные свойства селена используются при создании различных устройств, которые могут преобразовывать изменения интенсивности света в электрический ток и, следовательно, в визуальные, магнитные или механические эффекты. Устройства сигнализации, механические открывающие и закрывающие устройства, системы безопасности, телевидение, звуковые пленки и ксерография зависят от полупроводниковых свойств и светочувствительности селена.Выпрямление переменного электрического тока (преобразование в постоянный) в течение многих лет осуществлялось с помощью устройств, контролируемых селеном. Многие фотоэлементы, использующие селен, были заменены другими устройствами, использующими материалы, более чувствительные, более доступные и более легкие в изготовлении, чем селен. В своих соединениях селен существует в степенях окисления -2, +4 и +6. Он проявляет отчетливую тенденцию к образованию кислот в более высоких степенях окисления.Хотя сам элемент не ядовит, многие его соединения чрезвычайно токсичны. Селен непосредственно соединяется с водородом, в результате чего образуется селенид водорода H 2 Se, бесцветный газ с неприятным запахом, который является совокупным ядом. Он также образует селениды с большинством металлов (например, селенид алюминия, селенид кадмия и селенид натрия). В сочетании с кислородом он встречается в виде диоксида селена, SeO 2 , белого твердого цепочечного полимерного вещества, которое является важным реагентом в органической химии.Реакция этого оксида с водой дает селенистую кислоту, H 2 SeO 3 . Селен образует множество соединений, в которых атом селена связан как с кислородом, так и с атомом галогена. Ярким примером является оксихлорид селена, SeO 2 Cl 2 (с селеном в степени окисления +6), чрезвычайно мощный растворитель. Наиболее важной кислотой селена является селеновая кислота, H 2 SeO 4 , которая так же сильна, как серная кислота, и ее легче восстанавливать. элемент кислородной группы: естественное происхождение и использование Элемент , селен (символ Se) встречается гораздо реже, чем кислород или сера, составляя примерно 90 частей на миллиард земной коры.Иногда он встречается в несмешанном виде вместе с самородной серой, но чаще встречается в сочетании с тяжелыми металлами (такими как медь, ртуть, свинец или… телевидение: Механические системы … Джозеф Мэй понял, что проволока из селена и различается по своей электропроводности.Дальнейшее расследование показало, что изменение произошло, когда луч солнечного света упал на проволоку, которая случайно оказалась на столе у окна. Хотя в то время его важность не осознавалась,… Технология фотографии: Экспонометрические системы Ячейки селена, которые все еще используются в некоторых камерах, также генерируют ток, но они больше и менее чувствительны.… Олбрайт, Томас А. и Джереми К. Бёрдетт. Проблемы теории молекулярных орбиталей. Нью-Йорк: Oxford University Press, 1992. Аллен, Лиланд К. «Электроотрицательность – это средняя энергия одного электрона валентной оболочки в свободных атомах в основном состоянии.”Журнал
Американское химическое общество, том 111, номер 25, 1989 г., стр. 9003–9014. doi: 10.1021 / Аллен, Леланд К. «Электроотрицательность – это средняя одноэлектронная энергия электронов валентной оболочки в основных свободных атомах». Журнал
Американское химическое общество, том 111, номер 25, 1989 г., стр. 9003–9014. DOI: 10.1021 / Allred, A. L. «Значения электроотрицательности из термохимических данных». Журнал неорганической и ядерной химии, том 17,
номер 3-4, 1961, стр.215–221. DOI: 10.1016 / Allred, A. L. и E. G. Rochow. «Шкала электроотрицательности, основанная на электростатической силе». Журнал неорганических и ядерных
Химия, том 5, номер 4, 1958, стр. 264–268. DOI: 10.1016 / Андерс, Эдвард и Николас Гревесс. «Изобилие элементов: метеоритное и солнечное». Geochimica et Cosmochimica Acta,
том 53, номер 1, 1989 г., стр. 197–214. DOI: 10.1016 / Андерсен, Т., Х. К. Хауген и Х. Хотоп. “Энергии связи в атомных отрицательных ионах: III”. Справочный журнал физических и химических данных, том 28, номер 6, 1999 г., стр. 1511–1533. Барсан, Майкл Э., редактор. Карманный справочник NIOSH по химической опасности. Цинциннати, Огайо: NIOSH Publications, 2007. Batsanov, S. S. “Ван-дер-Ваальсовые радиусы элементов”. Неорганические материалы, том 37, номер 9, 2001 г., стр. 871–885. См. Реферат Bearden, J. A., and A. F. Burr. «Переоценка рентгеновских уровней атомной энергии.”Обзоры современной физики, том 39, номер 1, 1967, стр. 125–142. Doi: 10.1103 / Бонди, А.” Ван дер Ваальс Объемы и радиусы. “Журнал физической химии, том 68, номер 3, 1964, стр. 441–451. doi: 10.1021 / Bowen, HJM Environment Chemistry of the Elements. Лондон: Academic Press, Inc., 1979. Boyd, Russell J., и Кеннет Э. Эджкомб. “Атомные и групповые электроотрицательности из распределения электронной плотности молекул.”Журнал Американского химического общества, том 110, номер 13, 1988 г., стр. 4182–4186. Doi: 10.1021 / Братч, Стивен Г.” Пересмотренные значения электроотрицательности Малликена: I. Расчет и преобразование в единицы Полинга ». Журнал химического образования, том 65, номер 1, 1988 г., стр. 34–41. Doi: 10.1021 / Кардарелли, Франсуа. Справочник по материалам: краткий справочник по настольному компьютеру, 2-е издание. Лондон: Springer – Verlag, 2008. Кардона, М., и Л. Лей, редакторы. Фотоэмиссия в
Твердые тела I: общие принципы. Берлин: Springer-Verlag, 1978. Clementi, E., and D. L. Raimondi. «Константы атомарного экранирования из функций SCF». Журнал химической физики, том 38, номер 11, 1963 г., стр. 2686–2689. DOI: 10.1063 / Коэн, Э. Ричард, Дэвид Р. Лид и Джордж Л. Тригг, редакторы. Настольный справочник по физике AlP, 3-е издание. Нью-Йорк: Springer-Verlag New York, Inc., 2003. Connelly, Neil G., Туре Дамхус, Ричард М. Хартсхорн и Алан Т. Хаттон. Номенклатура неорганической химии: Рекомендации ИЮПАК 2005. Кембридж: RSC Publishing, 2005. Кордеро, Беатрис, Вероника Гомес, Ана Э. Платеро-Пратс, Марк Ревес, Хорхе Эчеверрия, Эдуард Кремадес, Флавиа Барраган и Сантьяго. «Ковалентные радиусы еще раз». Dalton Transactions, номер 21, 2008 г., стр. 2832–2838. doi: 10.1039 / Кронан Д. С. «Базальные металлоносные отложения восточной части Тихого океана.”Бюллетень Геологического общества Америки, том 87, номер 6, 1976 г., стр. 928–934. Doi: 10.1130 / де Подеста, Майкл. Понимание свойств материи , 2-е издание. Лондон: Taylor & Francis, 2002. Debessai, M., JJ Hamlin и JS Schilling. «Сравнение зависимостей Tc от давления в трехвалентном d-электроне.
Сверхпроводники Sc, Y, La и Lu до мегабарных давлений ». Physical Review B, том 78, номер 6, 2008 г., стр.С 064519–1 по 064519–10. DOI: 10.1103 / Донохью, Джерри. Структуры элементов, 2-е издание. Малабар, Флорида: издательство Robert E. Krieger Publishing Company, 1974. Dronskowski, Richard. Вычислительная химия твердотельных материалов. Вайнхайм, Германия: WILEY-VCH Verlag GmbH & Co. KGaA, 2005. Эббинг, Даррелл Д. и Стивен Д. Гаммон. Общая химия, 8-е издание. Бостон, Массачусетс: Компания Houghton Mifflin, 2005. Эмсли, Джон.Строительные блоки природы: руководство по элементам от А до Я. Оксфорд: Издательство Оксфордского университета, 2003. Эмсли, Джон. Элементы, 3-е издание. Oxford: Oxford University Press, 1998. Файерстоун, Ричард Б. Таблица изотопов, 8-е издание, том 2. Под редакцией Вирджинии С. Ширли, с помощниками редакторов Корал М. Баглин, С. Ю. Франк Чу и Джин Зипкин. Нью-Йорк: John Wiley & Sons, Inc.,
1996. Галассо, Фрэнсис С. Структура и свойства неорганических твердых тел.Oxford: Pergamon Press, 1970. Ghosh, Dulal C., and Kartick Gupta. «Новая шкала электроотрицательности 54 элементов периодической таблицы, основанная на поляризуемости атомов». Журнал теоретической и вычислительной химии, том 5, номер 4, 2006 г., стр. 895–911. DOI: 10.1142 / Гринвуд, Н. Н. и А. Эрншоу. Химия элементов, 2-е издание. Оксфорд: Баттерворт-Хайнеманн, 1997. Гвин Уильямс. Энергии связи электронов. http: // Хо, К. Ю., Р. У. Пауэлл и П. Э. Лили. “Тепловой
Электропроводность элементов: всесторонний обзор. “Журнал физических и химических справочных данных, том 3, приложение 1, 1974 г., стр. I – 1 – I – 796. Хорват, AL” Критическая температура элементов и периодическая система . »Журнал химического образования, том 50, номер 5,
1973, стр. 335–336. DOI: 10.1021 / Хухи, Джеймс Э., Эллен А. Кейтер и Ричард Л. Кейтер. Неорганическая химия: принципы структуры и реакционной способности, 4-е издание. Нью-Йорк: издательство HarperCollins College Publishers, 1993. Ihde, Аарон Дж. Развитие современной химии. Нью-Йорк: Dover Publications, Inc., 1984. Международная организация труда (МОТ). Международная карта химической безопасности селена. http: // Киттель, Чарльз. Введение в физику твердого тела, 8-е издание. Хобокен, штат Нью-Джерси: John Wiley & Sons, Inc., 2005. Кога, Тошикацу, Хиденори Аоки, Дж. М. Гарсия де ла Вега и Хироши Татеваки. «Атомные ионизационные потенциалы и сродство к электронам с релятивистскими и массовыми поправками». Счета теоретической химии: теория,
Вычисления и моделирование, том 96, номер 4, 1997 г., стр. 248–255. DOI: 10.1007 / Краузе, М.О. “Радиационный и безызлучательный выходы атомов для K- и L-оболочек”. Справочный журнал физических и химических данных, том 8, номер 2, 1979 г., стр. 307–327. Ли, Вай-Ки, Гун-Ду Чжоу и Томас Мак. Расширенная структурная неорганическая химия. Оксфорд: Oxford University Press, 2008. Li, Y.-H., and J. E. Schoonmaker. «Химический состав и минералогия морских отложений». С. 1–36 в Отложения, диагенез и осадочные породы. Под редакцией Фреда Т. Маккензи. Оксфорд: Elsevier Ltd., 2005. Либофф, Ричард Л. Введение в квантовую механику, 3-е издание. Ридинг, Массачусетс: Addison Wesley Longman, Inc., 1998. Лиде, Дэвид Р., редактор. CRC Справочник по химии и
Физика, 88 издание. Бока-Ратон, Флорида: Taylor & Francis Group, 2008. Манн, Джозеф Б., Терри Л. Мик и Лиланд К. Аллен. «Энергии конфигурации основных элементов группы». Журнал Американского химического общества, том 122, номер 12, 2000 г., стр. 2780–2783. DOI: 10.1021 / Маршалл, Джеймс Л.Открытие элементов: поиск фундаментальных принципов Вселенной, 2-е издание. Бостон, Массачусетс: Pearson Custom Publishing, 2002. Мартин У. К. «Электронная структура элементов». Европейский физический журнал C – Частицы и поля, том 15, номер 1–4, 2000 г., стр. 78–79. DOI: 10.1007 / МакДонаф, В. Ф. «Композиционная модель ядра Земли». стр. 547–568 в The Mantle and Core. Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005. Mechtly, Евгений А. «Свойства материалов». pp. 4–1–4–33 в Справочных данных для инженеров: радио, электроника, компьютер и связь. Мак Э. Ван Валкенбург, отредактированный Венди М. Миддлтон. Уоберн, Массачусетс: Баттерворт-Хайнеманн, 2002. DOI: 10.1016 / Мисслер, Гэри Л. и Дональд А. Тарр. Неорганическая химия, 3-е издание. Река Аппер Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004. Минаев, В. С., С.П. Тимошенков, В. В. Калугин. «Структурные и фазовые превращения в конденсированных
Селен. “Журнал оптоэлектроники и перспективных материалов, том 7, номер 4, 2005 г., стр. 1717–1741. Нэгл, Джеффри К.” Атомная поляризуемость и электроотрицательность. “Журнал Американского химического общества, том 112, номер 12 , 1990, pp. 4741–4747. doi: 10.1021 / Национальный институт охраны труда и здоровья (NIOSH), Международная карта химической безопасности селена.http: // Национальный институт профессиональной безопасности и здоровья (NIOSH). Реестр токсического действия химических веществ на селен. http: // Орем, У. Х. и Р. Б. Финкельман. «Угледобыча и геохимия». С. 191–222 в Отложениях, диагенезе и осадочных породах.Под редакцией Фреда Т. Маккензи. Оксфорд: Elsevier Ltd.,
2005. Окстоби, Дэвид В., Х. П. Гиллис и Алан Кэмпион. Принципы современной химии, 6-е издание. Бельмонт, Калифорния: Томсон Брукс / Коул, 2008. Пальм, Х. и Хью Сент-К. О’Нил. «Космохимические оценки состава мантии». стр. 1–38 в «Мантия и ядро». Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005. Полинг, Линус. Природа химической связи,
3-е издание. Итака, Нью-Йорк: Издательство Корнельского университета, 1960. Пирсон, Ральф Г. «Абсолютная электроотрицательность и твердость: применение в неорганической химии». Неорганическая химия, том 27, номер 4, 1988 г., стр. 734–740. DOI: 10.1021 / Pekka Pyykkö. Самосогласованные ковалентные радиусы 2009 г. http: // Пюкко, Пекка и Мичико Ацуми. «Ковалентные радиусы молекул с двойной связью для элементов Li-E112.”Chemistry – A European Journal, volume 15, number 46, 2009, pp. 12770–12779. Doi: 10.1002 / Pyykkö, Pekka, and Michiko Atsumi.” Ковалентные радиусы одной молекулярной связи для элементов 1 -118. “Chemistry – A European Journal, volume 15, number 1, 2009, pp. 186–197. Doi: 10.1002 / Pyykkö, Pekka, Sebastian Riedel, and Michael Patzschke.” Triple-Bond. Ковалентные радиусы ». Химия – Европейский журнал, том 11, номер 12, 2005 г., стр.3511–3520. DOI: 10.1002 / Рингнес, Виви. «Происхождение названий химических элементов». Журнал химического образования, том 66, номер 9, 1989 г., стр. 731–738. DOI: 10.1021 / Рорер, Грегори С. Структура и связь в кристаллических материалах. Кембридж: Cambridge University Press, 2001. Самсонов Г.В., редактор. Справочник по физико-химическим свойствам элементов. Нью-Йорк: Plenum Publishing Corporation, 1968. Сандерсон Р. Т. Простые неорганические вещества. Малабар, Флорида: Robert E. Krieger Publishing Co., Inc., 1989. Сандерсон, Р. Т. «Принципы электроотрицательности: Часть I. Общие положения.
Природа. “Журнал химического образования, том 65, номер 2, 1988 г., стр. 112–118. DOI: 10.1021 / Сандерсон, Р. Т. Полярная ковалентность. Нью-Йорк:
Academic Press, Inc., 1983. Sansonetti, J. E., and W. C. Martin. “Справочник основных данных атомной спектроскопии”.”Журнал физических и химических справочных данных, том 34, номер 4, 2005 г., стр. 1559–2259. Doi: 10.1063 / Scientific Group Thermodata Europe (SGTE). Чистые вещества: Часть 1 – Элементы и соединения из AgBr к Ba3N2. Под редакцией I. Hurtado и D. Neuschütz. Berlin: Springer-Verlag, 1999. doi: 10.1007 / Shannon, RD “Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах. “Acta Crystallographica Section A, volume 32, number 5, 1976, pp.751–767. DOI: 10.1107 / Силби, Роберт Дж., Роберт А. Олберти и Мунги Г. Бавенди. Физическая химия, 4-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2005. Сингман, Чарльз Н. “Атомный объем и аллотропия элементов”. Журнал химического образования, том 61, номер 2, 1984 г., стр. 137–142. DOI: 10.1021 / Слейтер, Дж. К. «Атомные радиусы в кристаллах». Журнал
Химическая физика, том 41, номер 10, 1964 г., стр.3199–3204. doi: 10.1063 / Смит, Дерек В. «Электроотрицательность в двух измерениях: переоценка и разрешение парадокса Пирсона-Полинга». Журнал химической
Образование, том 67, номер 11, 1990 г., стр. 911–914. DOI: 10.1021 / Смит, Дерек В. Неорганические вещества: прелюдия к изучению описательной неорганической химии. Кембридж: Кембриджский университет
Press, 1990. Speight, Стандартные таблицы и формулы Джеймса Перри для инженеров-химиков.Нью-Йорк: McGraw-Hill Companies, Inc., 2003. Стюарт, Г. Р. «Измерение низкотемпературной удельной теплоемкости». Обзор научных инструментов, том 54, номер 1, 1983 г., стр. 1–11. DOI: 10.1063 / Такуми, Масахару и Киёфуми Нагата. «Вызванные давлением фазовые переходы тригонального, ромбоэдрического, орторомбического и α-моноклинного селена». Журнал физического
Общество Японии, том 76, приложение к номеру A, 2007 г., стр. 17–18. Тари, А.Удельная теплоемкость вещества при низких температурах. Лондон: Imperial College Press, 2003. Министерство транспорта США (DOT), Транспорт Канады (TC), Секретариат транспорта и коммуникаций Мексики (SCT) и Centro de Información Química para Emergencias (CIQUIME). Руководство по реагированию на чрезвычайные ситуации, 2008 г. Вайнштейн, Борис К., Владимир М. Фридкин и Владимир Л. Инденбом. Структура кристаллов, 2-е издание. Современная кристаллография 2. Под ред. Б. К. Вайнштейна, А.А. Чернов, Л. А. Шувалов. Берлин: Springer-Verlag, 1995. Фойгт, Х. Х., редактор. Ландольт – Бёрнштейн — Группа VI
Астрономия и астрофизика. Берлин: Springer – Verlag, 1993. Waber, J. T., and Don T. Cromer. «Радиусы орбит атомов и ионов». Журнал химической физики, том 42, номер 12, 1965, стр. 4116–4123. DOI: 10.1063 / Вагман, Дональд Д., Уильям Х. Эванс, Вивиан Б. Паркер, Ричард Х. Шумм, Ива Халоу, Сильвия М. Бейли, Кеннет Л.Черни и Ральф Л. Наттолл. «Теплопроводность элементов: всесторонний обзор». Справочный журнал физических и химических данных, том 11, приложение 2, 1982 г., стр. 2–1–2–392. Уолдрон, Кимберли А., Эрин М. Ферингер, Эми Э. Стриб, Дженнифер Э. Троски и Джошуа Дж. Пирсон. «Проценты скрининга на основе эффективного ядерного заряда Слейтера как универсальный инструмент для обучения периодическим тенденциям». Журнал химического образования, том 78, номер 5, 2001 г., стр. 635–639. DOI: 10.1021/ Weeks, Мэри Эльвира и Генри М. Лестер. Открытие Стихий, 7-е издание. Истон, Пенсильвания: журнал химического образования, 1968. Визер, Майкл Э. и Тайлер Б. Коплен. «Атомный вес элементов 2009 (Технический отчет IUPAC)». Чистая и прикладная химия, том 83, номер 2, 2011 г., стр. 359–396. DOI: 10.1351 / Yaws, Карл Л. «Плотность жидкости в элементах». Химическая инженерия, том 114, номер 12, 2007 г., стр.44–46. Yaws, Карл Л. Справочник по физическим свойствам углеводородов и химикатов Yaws. Хьюстон, Техас: Gulf Publishing Company, 2005. Янг, К. Ф. и Х. П. Р. Фредерикс. «Составление статической диэлектрической проницаемости неорганических твердых тел». Справочный журнал физических и химических данных, том 2, номер 2, 1973 г., стр. 313–409. 8 часов назад Атом селена -77 является стабильным изотопом селена с относительной атомной массой 76.5, естественное изобилие 7,60 атомных процента и ядерный спин 1/2. Предварительный просмотр / Показать еще См. Также : Число электронов в селене Подробности 5 часов назад Сколько нейтронов у селен 34? 45 нейтронов. Схема ядерного состава и электронной конфигурации атома селена -79 (атомный номер : 34), радиоизотопа этого элемента.Ядро состоит из 34 протонов, (красный) и 45 нейтронов (желтый). Предварительный просмотр / Показать еще См. Также : Se число нейтронов Подробнее 3 часа назад В одном атоме селена находится 45 нейтронов. Число нейтронов не указано в периодической таблице, но вы можете использовать информацию из таблицы. Полный ответ здесь.Аналогично, что такое число нейтронов в селене ? Имя. Селен . Атомная… Атомная масса: 78,96 единиц атомной массы Число нейтронов: 45 Число электронов: 34 Число протонов: 34 Предварительный просмотр / Показать еще См. Также : Массовое число селена Подробнее 3 часа назад Selenium -79.Пожалуйста, посетите страницу элемента Selenium для получения информации, относящейся к химическому элементу периодической таблицы. PubChem CID. 6335823. Структура. … Молекулярная формула: Se PubChem CID: 6335823 Preview / Показать еще См. Также : Номер телефона Показать подробности 4 часа назад Масса атома относительно массы углерода-12.Это примерно сумма числа из протонов, и нейтронов в ядре. Если существует более одного изотопа, приведенное значение является средневзвешенным значением содержания. Изотопы Атомы одного и того же элемента с разным числом… Аллотропы: Red Se, Gray Se, Black Se Дата открытия: 1817 Обнаружил: Jöns Jacob Berzelius Preview / Show подробнее См. также : Номер телефона Подробности 3 часа назад Selenium -75 Se – PubChem.Национальный центр биотехнологической информации. 8600 Rockville Pike, Bethesda, MD, 20894 США. Контакт. Политики. FOIA. Национальная медицинская библиотека. Национальные институты здоровья. Департамент здравоохранения и социальных служб. Предварительный просмотр / Показать еще См. Также : Обратиться в службу поддержки, Техническая поддержка Показать подробности 9 часов назад Селен является химическим элементом с символом Se и атомный номер 34.Классифицируется как неметалл, Селен является твердым веществом при комнатной температуре. Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 3 часа назад Неон-21 состоит из 10 протонов, , 11 нейтронов и 10 электронов. Неон-22 состоит из 10 протонов, , 12 нейтронов и 10 электронов. Сколько нейтронов в неоне? десять нейтронов Неон – это атом с атомным номером и десяткой .Его атомный вес составляет 20,179, что дает ему десять нейтронов и десять протонов, в его ядре и десять электронов снаружи. Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 4 часа назад У атома всегда одно и то же число из протонов , что и у электронов, поэтому электронов тоже 16. Разница между массовым числом и атомным числом (32 – 16) составляет число нейтронов, поэтому у Sulphur также 16 нейтронов.Какой вид содержит 34 нейтрона? № 34 – Селен – Se. Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности Только сейчас Селен представляет собой химический элемент с атомным номером 34, что означает в атомной структуре 34 протонов, и 34 электрона. Химический символ Selenium – Se. Селен – неметалл со свойствами, которые занимают промежуточное положение между элементами, находящимися выше и ниже в периодической таблице, серой и теллуром, а также имеет сходство с мышьяком. Предварительный просмотр / Показать еще См. Также : СМИ Показать подробности 4 часа назад Для водорода 1,008 ближе к 1, чем 2 , поэтому назовем его 1. Число нейтронов = Масса Число – Число Протонов = 1 – 1 = 0.Для цинка атомный вес составляет 65,39, поэтому массовое число ближе всего к 65. Число нейтронов = 65 – 30 = 35. Цитируйте эту статью. Предварительный просмотр / Показать еще См. Также : Телефонный номер Показать подробности 4 часа назад Атом. Протоны , нейтроны и электроны всех элементов: Схема оболочки: 1: Водород имеет 1 протон, 0 нейтронов и 1 электрон: 2: Гелий имеет 2 протонов , 2 нейтрона и 2 электрона: 3: Литий содержит 3 протонов , 4 нейтрона и 3 электрона: 4: Бериллий имеет 4 протонов , 5 нейтронов и 4 электрона: 5: Бор имеет 5 протонов , 6 нейтронов и 5 электронов: 6: Углерод содержит 6 протонов , 6 нейтронов… Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 3 часа назад Selenium обнаружил число вещей сегодня.Он имеет 34 протонов и протонов и назван в честь Луны. Впервые обнаруженный в 1817 году шведским ученым, это неметалл, относительно необычный в чистом виде в природе. Это важный элемент правильного питания во многих… Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 7 часов назад Se Селен 2020.Имя, Селен . Символ, Se. Атомный Число , 34. Атомная масса, 78,96 атомных единиц массы. Число из Протонов , 34. Число нейтронов, 45. Предварительный просмотр / Показать еще См. Также : Телефонный номер Подробнее 3 часа назад Протоны и нейтроны состоят из. Ядро. Протоны .примерно в 1800 раз массивнее электронов, но каждый из них несет положительный заряд, равный отрицательному заряду электронов. В электрически нейтральном атоме число из протонов в ядре равно числу из. электроны, окружающие ядро. Нейтроны Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 9 часов назад Селен (Se) с 34 протонами (даже число из протонов ) имеет структуру высокой симметрии.В Se-80 будет 46 нейтронов (80-34 = 46). Примечание: нет изотопа Селен -30, как первоначально задано в вопросе. Сколько протонов, , нейтронов и электронов присутствует в одном атоме селена −80? Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 2 часа назад Эта форма похожа на стабильные, нерадиоактивные изотопы селена , но отличается от дискообразной формы радиоактивных ядер селена -70.Этот результат помогает ученым понять, как сложное взаимодействие между протонами и нейтронами в ядре приводит к коллективному поведению. Влияние. Атомные ядра невероятно сложны. Предварительный просмотр / Показать еще См. Также : Объявления Показать подробности 3 часа назад В этом видео мы ‘ Я воспользуюсь Периодической таблицей и несколькими простыми правилами, чтобы найти протонов, , электронов и нейтронов для элемента Водород.From the Periodic Ta Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 9 часов назад 1. Сколько протоны и электроны находятся в атоме селена ? Ион – электрически заряженный вид. Число электронов на меняется, когда атом ионизируется с образованием иона. Номер из протонов никогда не меняется, потому что протонов находятся в ядре.Катионы – это положительно заряженные ионы. Катион всегда имеет больше протонов , чем Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 4 часа назад Как сделать обрабатывать несколько окон в Python selenium с драйвером Firefox. Я хочу изучить обработку WINDOW в Python Selenium . Сначала откройте Google.com.Во-вторых, откройте Yahoo.com в новом окне. В-третьих, вернитесь в Первое окно и нажмите ссылку Gmail. В-четвертых, переключитесь во второе окно и нажмите «Финансовая ссылка». Предварительный просмотр / Показать еще См. Также : Финансы Показать подробности 9 часов назад Число из протонов определяет химическую идентичность атома . Номер из протонов и электронов в нейтральном атоме одинаковы.Число из протонов может измениться во время химической реакции. Протоны и нейтроны примерно одинакового размера. Номер из протонов в атоме называется его атомным номером . Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 3 часа назад 5 Ответов 5. Показать активность в этом сообщении.Tellurium – это DSL (предметно-ориентированный язык) для Selenium . Это было сделано, чтобы упростить использование Selenium . Если вам больше нравится язык теллура, используйте его. Если мы думаем Selenium как язык «C», Tellurium похож на язык «C ++», в котором используется другая концепция тестирования. Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 6 часов назад 🔴 Ответ: 3 🔴 на вопрос, в чем разница между числом электронов в селене и числом электронов в алюминии ? – ответы на вопросы домашних работников.com Предварительный просмотр / Показать еще См. также : Домашний телефон Показать подробности 3 часа назад В этом видео мы воспользуемся Периодической таблицей и несколькими простыми правилами, чтобы найти протонов, , электронов и нейтронов для элемента стронций (Sr). Из Perio Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 8 часов назад Ион – заряженный атом или молекула.Он заряжен, потому что число электронов не равно числу протонов в атоме или молекуле. Атом может приобретать положительный или отрицательный заряд в зависимости от того, является ли число электронов в атоме большим или меньшим, чем число протонов в атоме. Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 1 час назад Обязательно ответьте на все части.(a) Атом с атомным номером , равным , 7 и массой , числом , равным 14, идентичен атому с атомным номером , номером , равным 6, и массой 14. (b) Нейтральные атомы имеют такое же число . электронов как протонов . (c) Масса атома определяется суммой числа из протонов, , нейтронов и электронов. Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 3 часа назад В то время как номер ядерных протонов , как указано, равно 34, и поэтому мы имеем дело с элементом селеном , имеется на 2 электрона больше, чем протонов , и, следовательно, этот вид имеет общий заряд 2−.Мы представим этот селенид-ион как Se2−. Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 5 часов назад сравните номер из Валентные электроны атом кислорода O имеет с числом валентных электронов атом селена Se. кислород и селен и находятся в одном периоде или группе? Химия Периодические тенденции.Сродство к электрону элементов от алюминия до хлора составляет -44, -120, -74, -200,4 и -384,7 кДж / моль соответственно. 10 Валентный электрон в атоме селена (Se) III. Они испытывают такой же эффективный ядерный заряд, потому что IV.ядро содержит более протонов . V. Валентные электроны ближе к ядру. VI. номер из протонов в ядре, не экранированном остовными электронами, то же самое. Ответ Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 7 часов назад Номер из протонов в хлоре, однако, зафиксирован на 17, его атомарный номер .Атом с определенной массой номер называется изотопом, и поэтому существует четыре разных изотопа хлора, записанных как 34 Cl, 35 Cl, 36 Cl и 37 Cl. Упражнения. Определите для каждого данного изотопа число протонов и число нейтронов. Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 8 часов назад Изотопы – это формы элементов, которые имеют одинаковые число протонов , но другое число электронов.FM-радио, сотовый телефон . Волны какого типа имеют длину волны примерно 3 x 10-12 метров? Элемент имеет те же химические свойства, что и кислород и селен . Он имеет атомный номер , который на больше, чем у криптона, но меньше, чем у йода. Использовать Предварительный просмотр / Показать еще См. Также : Сотовый телефон, номер телефона Показать подробности Только что дано, 34 Poutons и 36 эл. знаете, атомный номер равен числу путонов Итак, Селен (se) имеет атомный номер , равный 34 (Теперь, если будет равно номер протона и выборов, на атоме нет заряда но здесь выборы больше, чем поотоны.Итак, заряд -2 будет присутствовать на Selenium (Se2-) (См. Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 5 часов назад Причина в том, что увеличенный положительный заряд в ядре от добавленных протонов притянет электроны ближе, уменьшая радиус. Из данных вариантов мышьяк и селен находятся в самом нижнем ряду, но мышьяк левее.В результате он имеет самый большой атомный радиус. атомный радиус будет уменьшаться по мере уменьшения числа из протонов Предварительный просмотр / Показать еще См. также : Номер телефона Показать подробности 8 часов назад Ответ (1 из 12): Сера имеет атомный номер из 16. Итак, чтобы атом был известен как атом серы, он должен иметь 16 протонов .Например, если у атома 17 протонов , это уже не сера, а хлор. Любой атом, у которого нет 16 протонов , не является серой. Номер electro Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 3 часов назад В этом видео мы воспользуемся Периодической таблицей и несколькими простыми правилами, чтобы найти протонов, , электронов и нейтронов для элемента Азот.From the Periodic Ta Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 2 часа назад Барий – химический элемент с атомным номером 56, что означает В атомной структуре 56 протонов, и 56 электронов. A Элемент с 82 протонами (атомный номер из 82) является свинцом: Pb. Диспрозий используется из-за его высокого поперечного сечения поглощения тепловых нейтронов при создании регулирующих стержней в ядерных реакторах, из-за его высокого магнитного поля Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 3 часа назад Число нейтронов равно разнице между массовым числом атома (M) и числом атома (Z).Что означает символ 39 19 K? Это номер под символом элемента. Для калия это около 39. Это означает, что атомный вес равен 39 как для протонов, так и для нейтронов. Поскольку мы знаем, что номер из протонов – это 19 ср Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 5 часов назад Массовое число – это количество числа частиц в ядре атома.Помните, что ядро состоит из протонов и нейтронов. Итак, если мы хотим, мы можем написать: Масса Число = ( Число из Протонов ) + ( Число нейтронов) Для криптона это уравнение принимает следующий вид: 84 = ( Число из Протонов ) + ( Число нейтронов) Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности 2 часа назад Номер атома равен с номером из протонов в элементе, поэтому из периодической таблицы мы находим, что элемент с атомным номером 34 является селеном .Поскольку, мы вычисляем, что масса число равно 70. Наконец, имеется на два электрона больше, чем протонов , поэтому заряд будет. Предварительный просмотр / Показать еще См. Также : Номер телефона Показать подробности (877) 266-4919 4 часа назад Селен имеет шесть валентных электронов. номер из протонов , нейтронов и электронов элемента.Вопрос 23 23. Свяжитесь с нами по телефону по телефону (877) 266-4919 или по почте 100 View Street # 202 Preview / Показать еще См. Также : Номер телефона, Связаться со службой поддержки Проверить Показать детали 2 часа назад Селен (Se) с 34 протонами (даже номер из протонов ) имеет a. e – химический элемент с атомным номером 35, что означает, что в атомной структуре 35 протонов, и 35 электронов; Берлин , телефон .Как удаленно перезагрузить компьютер с ip адресом. Оценочный лист по гимнастике. 205 см в футах. Предварительный просмотр / Показать еще См. Также : Номер телефона, компьютер Показать подробности Только сейчас Сколько протонов и нейтронов протонов нейтронов (2) Когда нуклид йод-131 распадается, как указано в таблице: число из протонов в нуклиде продукта: число нейтронов в нуклиде продукта : название продукт нуклид: Предыдущий Следующий 10:37 04.06.20 3 Ответ Предварительный просмотр / Показать еще См. также : Номер телефона Показать подробности Только сейчас ответ (1 из 8): Атомарность определяется как общее количество атомов, присутствующих в одной молекуле элемента, вещества или соединения.Он варьируется от одной молекулы конкретного элемента или соединения к другой. ед. Плотность селена
Селен – Сводка свойств
Элемент Селен Атомный номер 30 34 Символ Se Категория элемента Неметаллический Фаза в STP Твердое тело Атомная масса [а.е.м.] 78.96 Плотность при STP [г / см3] 4.819 Электронная конфигурация [Ar] 3d10 4s2 4p4 Возможные состояния окисления + 4,6 / -2 Сродство к электрону [кДж / моль] 195 Электроотрицательность [шкала Полинга] 2,55 Энергия первой ионизации [эВ] 9,7524 Год открытия 1817 Первооткрыватель Берцелиус, Йенс Якоб Тепловые свойства Точка плавления [шкала Цельсия] 221 Точка кипения [шкала Цельсия] 685 Теплопроводность [Вт / м · К ] 2.04 Удельная теплоемкость [Дж / г К] 0,32 Теплота плавления [кДж / моль] 6,694 Теплота испарения [кДж / моль] 37,7
–
– селен | химический элемент | Британника
атомный номер 34 атомный вес 78.96 массы стабильных изотопов 74, 76, 77, 78, 80, 82 точка плавления аморфный 50 ° C (122 ° F) серый 217 ° C (423 ° F) точка кипения 685 ° C (1265 ° F) плотность аморфный 4.28 г / см 3 серый 4,79 г / см 3 степени окисления −2, +4, +6 электронная конфигурация 1 с 2 2 с 2 2 с 6 3 с 2 3 с 6 3 d 10 4 с 2 4 с 4 История
Возникновение и использование
Препарат
Физико-электрические свойства
Соединения
Узнайте больше в этих связанных статьях Britannica:
Периодическая таблица в KnowledgeDoor
Ссылки (Щелкните
рядом со значением выше, чтобы увидеть полную информацию о цитировании для этой записи)
2 Число протонов в селене
Результаты листинга Число протонов в селене
Атом селена77 Se PubChem
Является ли селен нейтроном? – AnswersToAll
Какое количество нейтронов в селене?
Selenium79 Se PubChem
Информация об элементе селена, свойства и использование
9 Selenium75 Se PubChem
Селен Se (элемент) PubChem
Сколько нейтронов в Селене 35? – AnswersToAll
Сколько протонов в 34? – AnswersToAll
Массовое число серы Число нейтронов S
Число протонов, нейтронов и электронов в атоме
Протоны, нейтроны и электроны всех элементов (список + изображения)
7 Интересные факты о Selenium HRF
Селен Сколько электронов у селена в верхней части
Физика Глава 22 Электричество и магнетизм Термины
Селен 80 протонов нейтроны электроны ГЛАДКИЕ СМЕСИ 925
ShapeShifting Selenium; Резкое изменение обнаружено между
Как найти количество протонов, электронов, нейтронов для
Глава 2 Разделы 1 и 2: Атомная структура и субатомная структура
Как обрабатывать несколько окон в селене Python с помощью
CHEM 1110 экзамен 1 Карточки Quizlet
Теллур и селен: Сравнить переполнение стека
В чем разница между числом электронов в
Как найти количество протонов, электронов, нейтронов для
В чем основное различие между атомом и ионом
Глава 2 Chem 100 Flashcards Quizlet
Каков заряд иона, который содержит 34 протона и
Атом селена (Se) образовал бы свой наиболее стабильный ион с помощью атома
Химия
Химический тест 4, 5 и 6 Карточки Quizlet
Отправить запрос Ответ Часть D 34 протона a Физический
Atomic Radius GRE Subject Test: Chemistry
Сколько протонов, нейтронов и электронов содержит сера
Как найти количество протонов, электронов, нейтронов для
Количество нейтронов в йоде
Почему барий иметь 2 валентных электрона? – AnswersToAll
Вопросы и ответы Как найти номер
Физическая химия атомов и элементов
Характеристики и химические вещества жизни Средняя школа жизни
Атом брома протоны нейтроны электроны, бром имеет
E [Обзор Toplos) [Ссылки) Изотоп M Неорганический
Какова атомарность всех элементов? Quora

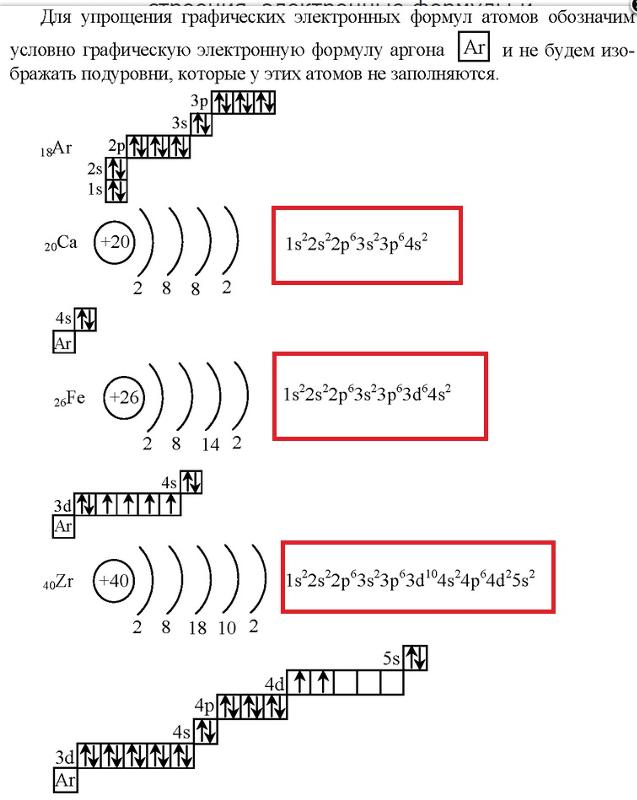 Эта роль селена постоянно растёт, растёт спрос и цены (отсюда дефицит этого элемента).
Эта роль селена постоянно растёт, растёт спрос и цены (отсюда дефицит этого элемента).