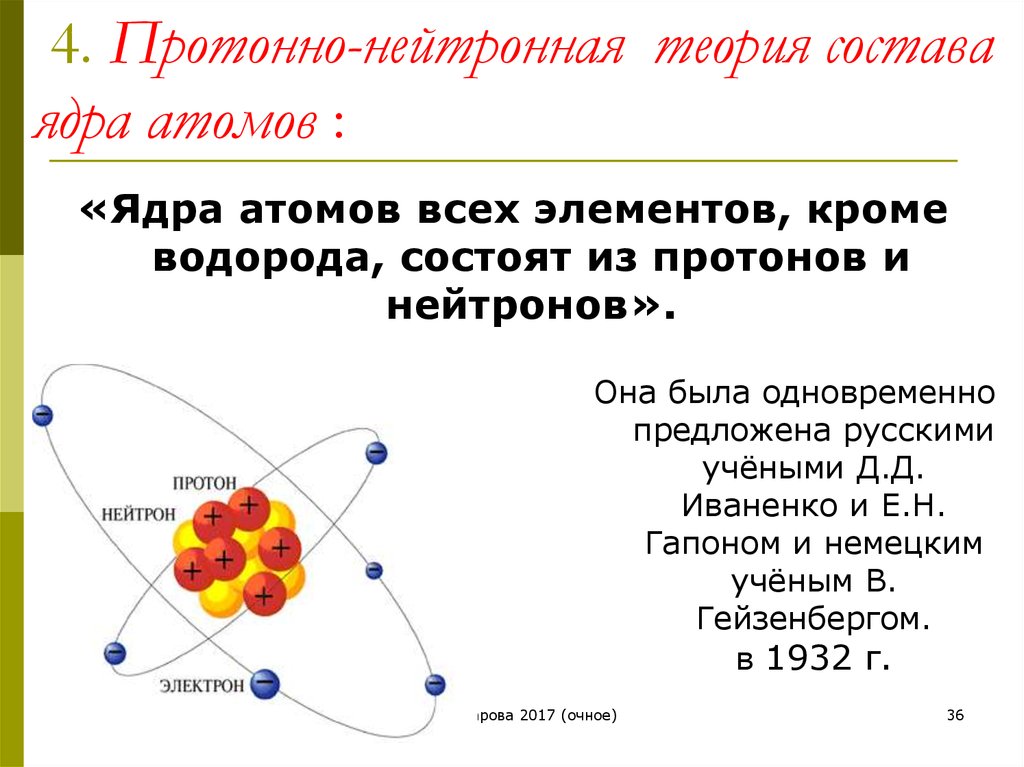
Вопрос 22. Современные представления о строении атома
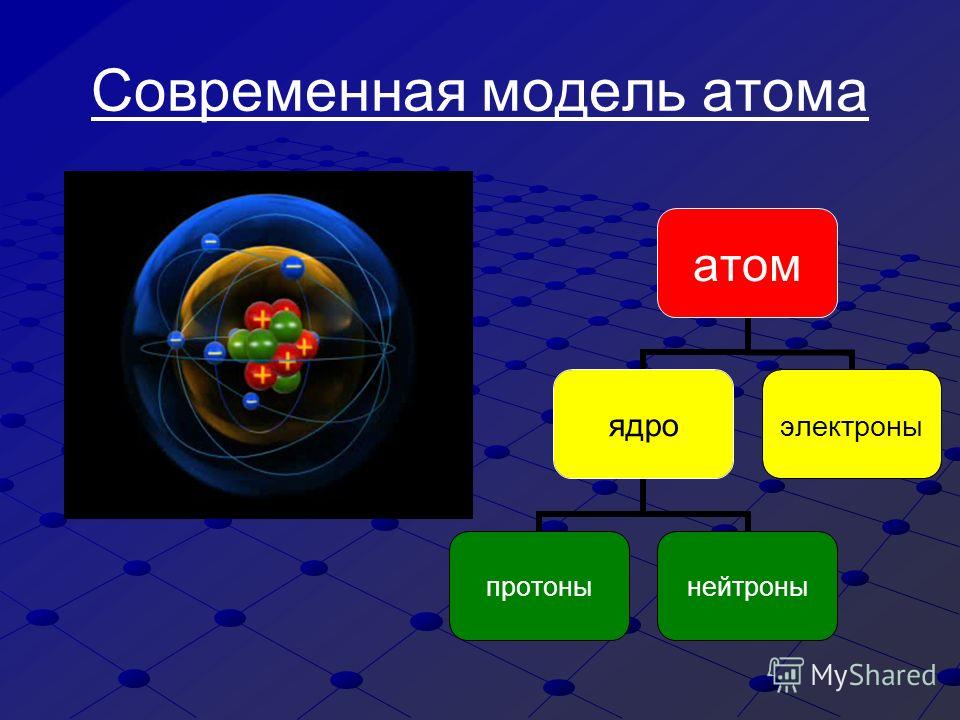
Атом – это мельчайшая, химически неделимая частица. В настоящее время известно более 110 химических элементов (видов атомов). Согласно современным представлениям атомы имеют сложное строение. Они состоят из ядра и электронов. Ядро почти в 2000 раз тяжелее атома. Но при этом оно примерно в 50000 раз меньше атома. Если мысленно увеличить масштаб и представить, что ядро атома имеет диаметр 2 см, тогда радиус атома составил бы приблизительно 500 м. Как выяснили ученые, ядро тоже имеет сложное строение. Оно состоит, главным образом, из двух видов частиц протонов и нейтронов.
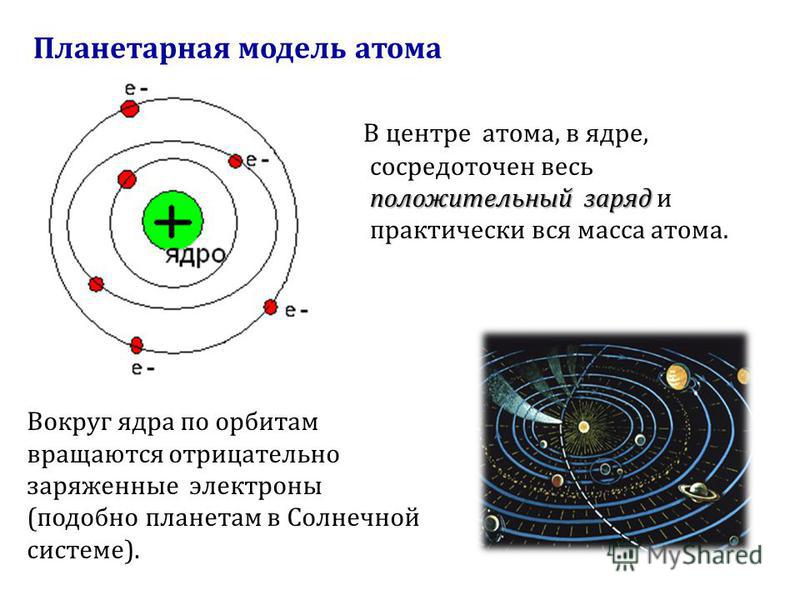
Планетарная
модель атома Бора-Резерфорда. В 1911 году
Эрнест Резерфорд, проделав ряд
экспериментов, пришёл к выводу, что атом
представляет собой подобие планетной
системы, в которой электроны движутся
по орбитам вокруг расположенного в
центре атома тяжёлого положительно
заряженного ядра («модель атома
Резерфорда»). Однако такое описание
атома вошло в противоречие с классической
электродинамикой.

Химические
свойства атомов определяются конфигурацией
электронной оболочки и описываются
квантовой механикой. Положение атома
в таблице Менделеева определяется
электрическим зарядом его ядра (то есть
количеством протонов), в то время как
количество нейтронов принципиально не
влияет на химические свойства; при этом
нейтронов в ядре, как правило, больше,
чем протонов (см.: атомное ядро). Если
атом находится в нейтральном состоянии,
то количество электронов в нём равно
количеству протонов. Основная масса
атома сосредоточена в ядре, а массовая
доля электронов в общей массе атома
незначительна (несколько сотых процента
массы ядра). Хотя слово атом в первоначальном
значении обозначало частицу, которая
не делится на меньшие части, согласно
научным представлениям он состоит из
более мелких частиц, называемых
субатомными частицами. Атом состоит из
электронов, протонов, все атомы, кроме
водорода-1, содержат также нейтроны.
Электрон является самой лёгкой из
составляющих атом частиц с массой
9,11×10−31 кг, отрицательным зарядом и
размером, слишком малым для измерения
современными методами.
Электронам,
как и другим частицам, свойственен
корпускулярно-волновой дуализм. Иногда
говорят, что электрон движется по
орбитали, что неверно. Состояние
электронов описывается волновой
функцией, квадрат модуля которой
характеризует плотность вероятности
нахождения частиц в данной точке
пространства в данный момент времени,
или, в общем случае, оператором плотности.
Существует дискретный набор атомных
орбиталей, которым соответствуют
стационарные чистые состояния электронов
в атоме.
Современная теория – строение – атом
Cтраница 1
Современная теория строения атомов и молекул основана на законах, описывающих движение электронов и других частиц, обладающих весьма малой массой – микрообъектов. Эти законы были окончательно сформулированы в 1925 – 1926 гг. Они резко отличаются от законов, определяющих движение больших тел – макрообъектов, к которым принадлежат предметы, видимые в оптический микроскоп или невооруженным глазом. [1]
Современная теория строения атома
 Доказано, что электроны сочетают в себе свойства частицы ( корпускулы) и волны, так как подвергаются дифракции. Под электронной орбитой в волновой механике понимают лишь ту сферу вокруг ядра, в которой нахождение электрона наиболее вероятно.
[2]
Доказано, что электроны сочетают в себе свойства частицы ( корпускулы) и волны, так как подвергаются дифракции. Под электронной орбитой в волновой механике понимают лишь ту сферу вокруг ядра, в которой нахождение электрона наиболее вероятно.
[2]Современная теория строения атома, основанная на квантовой ( волновой) механике, представляет поведение электрона в атоме очень сложным. Электрон – частица определенной массы, движущаяся с большой скоростью. [3]
Современная теория строения атомов и молекул основана на законах, описывающих движение электронов и других частиц, обладающих весьма малой массой, – микрообъектов.
Современная теория строения атома уже не рассматривает электрон как материал. Доказано, что электроны сочетают в себе свойства частицы корпускулы) и волны, так как подвергаются дифракции. Схема распределения в которой нахождение электрона плотности электронного облака, наиболее вероятно. [6]
| Энергетические уровни. [7] |
Современная теория строения атома
 [8]
[8]Современная теория строения атомов и молекул неопровержимо свидетельствует о том, что основой периодического закона является строение электронных оболочек атомов химических элементов. Важнейшая химическая характеристика элементов главных подгрупп – валентность атомов – определяется структурой внешнего электронного слоя, конкретнее – числом неспаренных электронов. [9]
Современная теория строения атомов и молекул основана на законах, описывающих движение электронов и других частиц, обладающих весьма малой массой, – микрообъектов. Эти законы были окончательно сформулированы-в 1925 – 1926 гг. Они резко отличаются от законов, определяющих движение больших тел-макрообъектов, к которым принадлежат предметы, видимые в оптический микроскоп или невооруженным глазом. [10]
Современная теория строения атомов и молекул основана на законах, описывающих движение электронов и других частиц, обладающих весьма малой массой, – микрообъектов. Эти законы были окончательно сформулированы в 1925 – 1926 гг.; они резко отличаются от законов, определяющих движение больших тел-макрообъектов, к числу которых принадлежат все предметы, видимые в оптический микроскоп или невооруженным глазом.
[11]
Эти законы были окончательно сформулированы в 1925 – 1926 гг.; они резко отличаются от законов, определяющих движение больших тел-макрообъектов, к числу которых принадлежат все предметы, видимые в оптический микроскоп или невооруженным глазом.
[11]
Современная теория строения атомов и молекул основана на новых законах, описывающих движение электронов и других малых частиц – так называемых микрочастиц. Эти законы были сформулированы в 1925 – 1927 гг.; они резко отличаются от законов определяющих движение больших тел – макротел. [12]
Современная теория строения атома, принимающая, что атом состоит из ядерной массы и электронов, стремится свести силы химического сродства к электрическим силам. Эта теория предполагает, что электроны располагаются в определенном порядке вокруг ядра, образуя ряд сфер, с определенным количеством электронов в каждой. Электроны, находящиеся в наружной сфере, наиболее легко подвергаются внешним воздействям, в результате чего может происходить отделение электрона от данного атома и присоединение его на внешнюю сферу другого атома. Вследствие того, что наиболее устойчивым состоянием считается такое, когда на внешней сфере будет 8 электронов, количество присоединяющихся электронов к данному атому будет равно количеству, недостающему до 8 электронов. То же относится к числу отделяющихся электронов: могут отделиться только электроны, находящиеся на внешней сфере, так как за ней внутри находится сфера, обычно, с полным набором электронов.
[13]
Вследствие того, что наиболее устойчивым состоянием считается такое, когда на внешней сфере будет 8 электронов, количество присоединяющихся электронов к данному атому будет равно количеству, недостающему до 8 электронов. То же относится к числу отделяющихся электронов: могут отделиться только электроны, находящиеся на внешней сфере, так как за ней внутри находится сфера, обычно, с полным набором электронов.
[13]
Современные теории строения атома объясняют эту особенность лантаноидов тем, что у них по мере увеличения атомных весов добавочные электроны располагаются не на внешней, а на одной из более глубоких внутренних электронных оболочек. Постоянство внешней сферы электронов определяет, таким образом, сравнительную неизменность и идентичность химических свойств. В этом отношении с лантаноидами сходна группа транс-урановых ( нептуний, плутоний и др.), связанная генетически с ураном аналогичным типом связи. [14]
Современная теория строения атома прежде всего исходит из представлений о корпускулярно-волновом дуализме электрона и описывает его состояние четырьмя параметрами – квантовыми числами. Предельное число электронов, которое может заселять одну орбиталь, равно двум, что соответствует принципу Паули. Электроны располагаются на одинаковых орбиталях так, чтобы суммарный спин был максимален.
[15]
Предельное число электронов, которое может заселять одну орбиталь, равно двум, что соответствует принципу Паули. Электроны располагаются на одинаковых орбиталях так, чтобы суммарный спин был максимален.
[15]
Страницы: 1 2 3
Для скачивания – Кафедра химии
- Главная
- Университет
- Для скачивания
- Кафедра химии
Лекция. Растворы неэлектролитов
Размер файла:
638.79 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Растворы неэлектролитов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
Учебно-методическое пособие включает лекцию по теме «Растворы неэлектролитов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Окислительно-восстановительные реакции
Размер файла:
609.98 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Окислительно – восстановительные реакции. Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекцию по теме «Окислительно – восстановительные реакции» и предназначено для контролируемой самостоятельной работы студентов инженерно–технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Комплексные соединения
Размер файла:
531.46 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Лекция «Комплексные соединения» по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 26 с.
– Гродно : ГГАУ, 2016. – 26 с.
Учебно-методическое пособие включает лекцию по теме «Комплексные соединения» курса «Общая химия». Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т.д. Координационные свойства проявляются всеми элементами периодической системы.
Скачать
Лекция. Кинетика химических реакций. Химическое равновесие
Размер файла:
768.32 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Кинетика химических реакций. Химическое равновесие. Лекции по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Предэкзаменационные тесты по органической и биологической ХИМИИ
Размер файла:
1.30 MB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
26.12.2016 12:02
Предэкзаменационные тесты по органической и биоло-гической химии для студентов биотехнологического факультета / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 205 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на биотехнологическом факультете, по предмету «Химия (органическая и биологическая)»
Скачать
Лекция. Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Размер файла:
758.87 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Электролиз. Коррозия металлов и методы защиты металлов от коррозии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Энергетика химических процессов.
Размер файла:
604.00 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Энергетика химических процессов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
Учебно-методическое пособие включает лекцию по теме «Энергетика химических процессов» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Строение атомов элементов
Размер файла:
789.90 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Строение атомов элементов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 23 с.
Учебно-методическое пособие включает лекцию по теме «Строение атомов элементов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Основные понятия и законы химии
Размер файла:
675.23 kB
Автор:
Апанович, З.В.
Дата:
26. 12.2016 12:03
12.2016 12:03
Основные понятия и законы химии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 30 с.
Учебно-методическое пособие включает лекцию по теме «Основные понятия и законы химии» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Скачать
Предэкзаменационные тесты по химии
Размер файла:
813.02 kB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
14.11.2016 11:47
Предэкзаменационные тесты по химии для студентов, обучающихся на агробиологических специальностях / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 201 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на агробиологических специальностях, по предмету «Химия».
Скачать
Методическое пособие для лабораторных работ по аналитической химии
Размер файла:
544.41 kB
Автор:
Апанович З.В., Тараненко Т.В., Томашева Е.В., Кулеш И.В., Цветницкая Э.В.
Дата:
28.12.2015 12:22
В пособие излагается материал по аналитической химии в объеме соответствующих программ по специальностям: «Ветеринарная медицина», «Аграномия», «Биотехналогия». Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Скачать
Комментарии для работы с рабочими тетрадями по химии элементов
Размер файла:
655.75 kB
Дата:
28.12.2015 12:22
Комментарии для работы с рабочими тетрадями по химии элементов / З.В. Апанович, Ю.А. Лукашенко.
Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.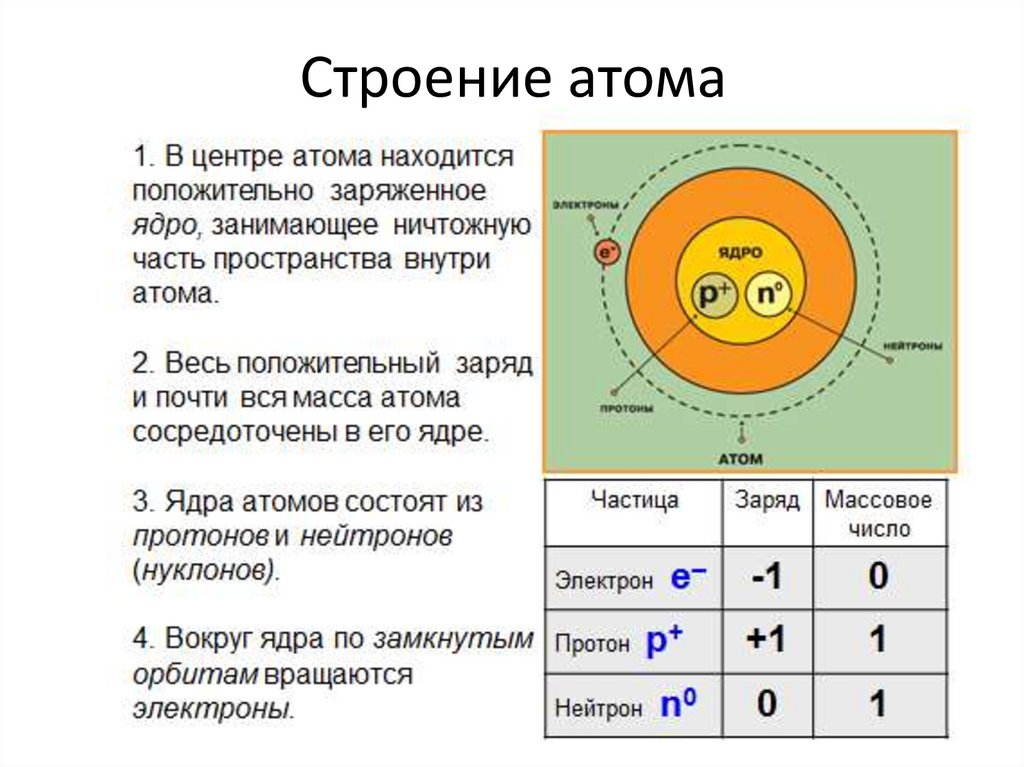
Скачать
Практикум по физической химии
Размер файла:
1.03 MB
Дата:
01.04.2013 04:24
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
Практикум по физической химии: учеб.-мет. пособие / О. И. Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Коллоидная химия
Размер файла:
834.37 kB
Дата:
01.04.2013 04:09
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
К-60 Практикум по физической химии: учеб.-мет. пособие / И. В. Кулеш, О. И. Валентюкевич.- Гродно: ГГАУ, 2013 – 94с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета.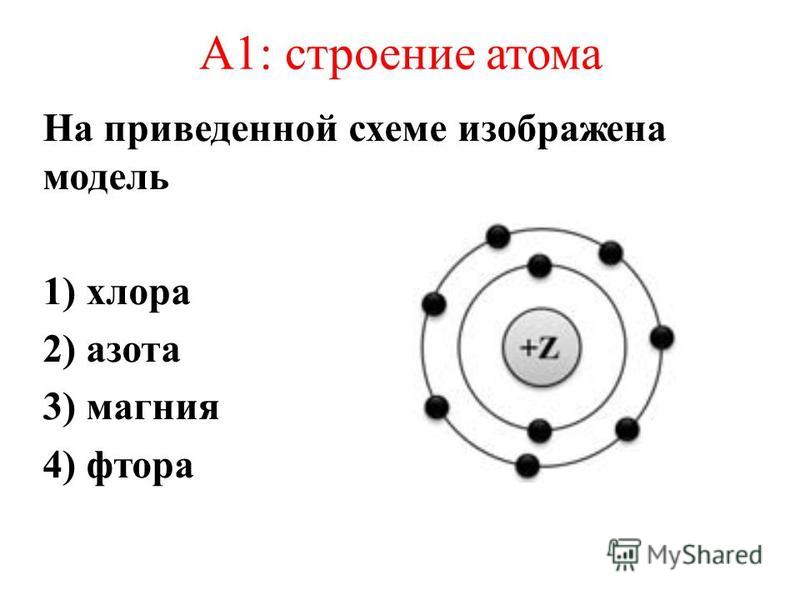 Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Курс лекций по дисциплине «Неорганическая химия»
Размер файла:
1.33 MB
Дата:
28.12.2015 12:22
Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З.В. Апанович.
Скачать
Рабочая тетрадь и методические указания по неорганической химии
Размер файла:
701.32 kB
Дата:
28.12.2015 12:23
Рабочая тетрадь и методические указания по неорганической химии. Для студентов технологических специальностей / З.В. Апанович.
Скачать
Ионные равновесия и обменные реакции в растворах электролитов
Скачать
Лабораторные работы по химии элементов для студентов технологических специальностей
Скачать
Университет
Атомная теория строения вещества • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Слово «атом» — греческого происхождения, и переводится оно «неделимый».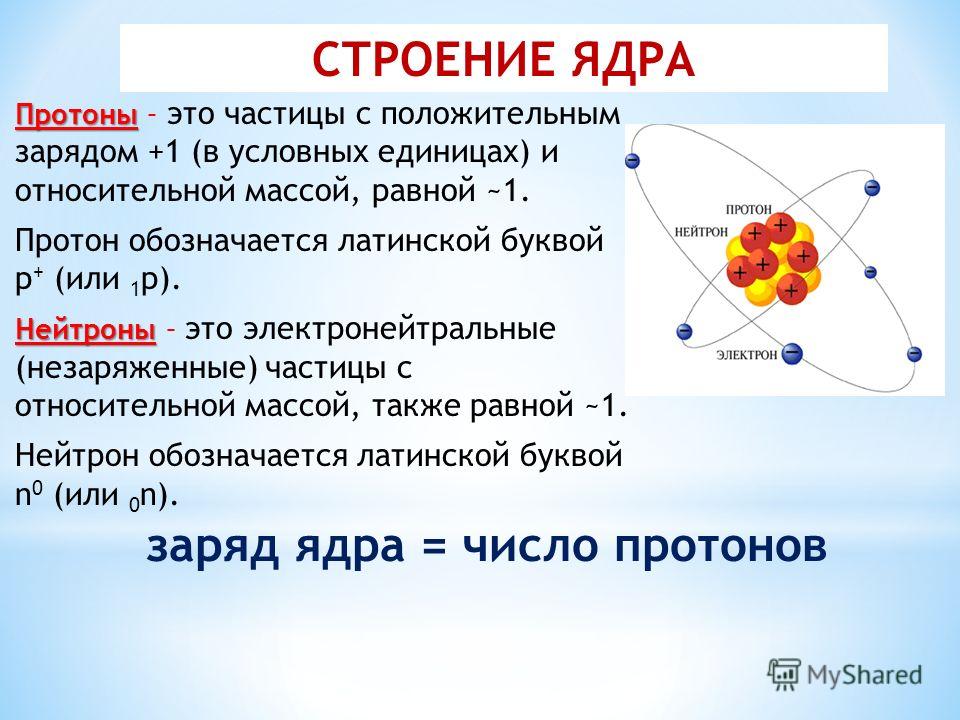 Принято считать, что первым идею о том, что кажущаяся гладкой и непрерывной материя на самом деле состоит из великого множества мельчайших и потому невидимых частиц, выдвинул древнегреческий философ Демокрит (чей «расцвет», согласно восхитительному по образности выражению классиков, пришелся на V век до н. э.). О жизни Демокрита нам, однако, практически ничего неизвестно, и оригинальные труды этого мыслителя до наших дней не дошли. Поэтому об идеях Демокрита остается судить в основном по цитатам из его работ, которые мы находим у других авторов, прежде всего у Аристотеля.
Принято считать, что первым идею о том, что кажущаяся гладкой и непрерывной материя на самом деле состоит из великого множества мельчайших и потому невидимых частиц, выдвинул древнегреческий философ Демокрит (чей «расцвет», согласно восхитительному по образности выражению классиков, пришелся на V век до н. э.). О жизни Демокрита нам, однако, практически ничего неизвестно, и оригинальные труды этого мыслителя до наших дней не дошли. Поэтому об идеях Демокрита остается судить в основном по цитатам из его работ, которые мы находим у других авторов, прежде всего у Аристотеля.
Логика рассуждений Демокрита, если перевести ее на современный язык, была крайне проста. Представим, говорил он, что у нас есть самый острый в мире нож. Берем первый попавшийся под руку материальный объект и разрезаем его пополам, затем одну из получившихся половинок также разрезаем пополам, затем разрезаем пополам одну из получившихся четвертинок и так далее. Рано или поздно, утверждал он (основываясь, как и все древнегреческие мыслители, прежде всего на философских соображениях), мы получим частицу столь мелкую, что дальнейшему делению на две она не поддается.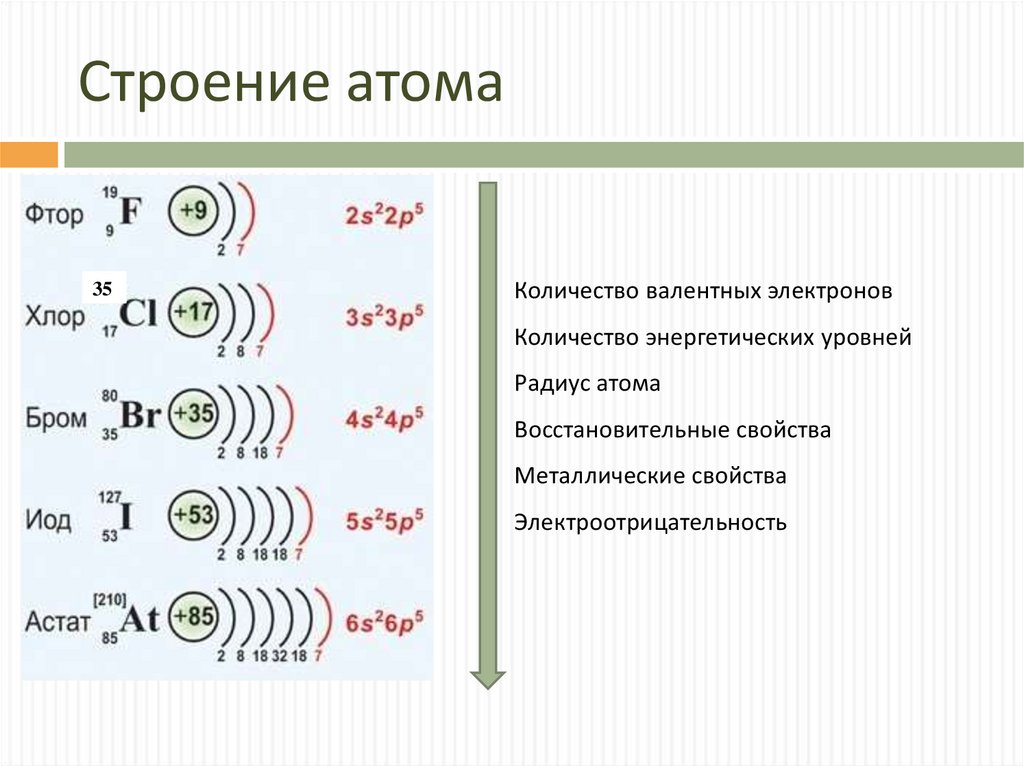 Это и будет неделимый атом материи.
Это и будет неделимый атом материи.
По представлениям Демокрита атомы были вечными, неизменными и неделимыми. Изменения во Вселенной происходили исключительно из-за изменений в связях между атомами, но не в них самих. Тем самым он тонко обошел давнишний спор древнегреческих философов о том, подвержена ли переменам сама суть видимого мира или все перемены в нем носят чисто внешний характер.
От древнегреческих представлений об атоме на сегодняшний день сохранилось разве что само слово «атом». Теперь мы знаем, что атом состоит из более фундаментальных частиц (см. Элементарные частицы). Ясно, что между древнегреческой теорией и современными научными исследованиями мало общего: идеи Демокрита не основывались ни на каких наблюдениях или практических опытах. Демокрит, подобно всем натурфилософам античности, просто рассуждал и делал умозрительные заключения относительно природы мира.
Тем не менее труды Демокрита не остались без признания и в современном мире. На последней греческой монете достоинством 10 драхм (теперь она выведена из обращения и заменена евро) на лицевой стороне изображен портрет Демокрита, а на оборотной — схематическая модель атома. Я весьма признателен своему другу Гансу фон Байеру, обратившему мое внимание на то, что на монете изображен атом с тремя электронами — стало быть, это атом лития. Демокрита называли «смеющимся философом» (похоже, он обладал несвойственным другим античным философам чувством юмора). Не потому ли на монете, увековечивающей его память, изображен именно атом лития — химического элемента, который теперь широко используется для лечения депрессии?
Я весьма признателен своему другу Гансу фон Байеру, обратившему мое внимание на то, что на монете изображен атом с тремя электронами — стало быть, это атом лития. Демокрита называли «смеющимся философом» (похоже, он обладал несвойственным другим античным философам чувством юмора). Не потому ли на монете, увековечивающей его память, изображен именно атом лития — химического элемента, который теперь широко используется для лечения депрессии?
Идея об атомном строении материи так и оставалась чисто философским умопостроением вплоть до начала XIX века, когда сформировались основы химии как науки. Химики первыми и обнаружили, что многие вещества в процессе реакций распадаются на более простые компоненты. Например, вода распадается на водород и кислород. Однако некоторые вещества — те же водород и кислород — разложению на составляющие при помощи химических реакций не поддаются. Такие вещества назвали химическими элементами. К началу XIX века было известно около 30 химических элементов (на момент написания этой статьи их открыто более 110, включая искусственно полученные в лабораторных условиях; см.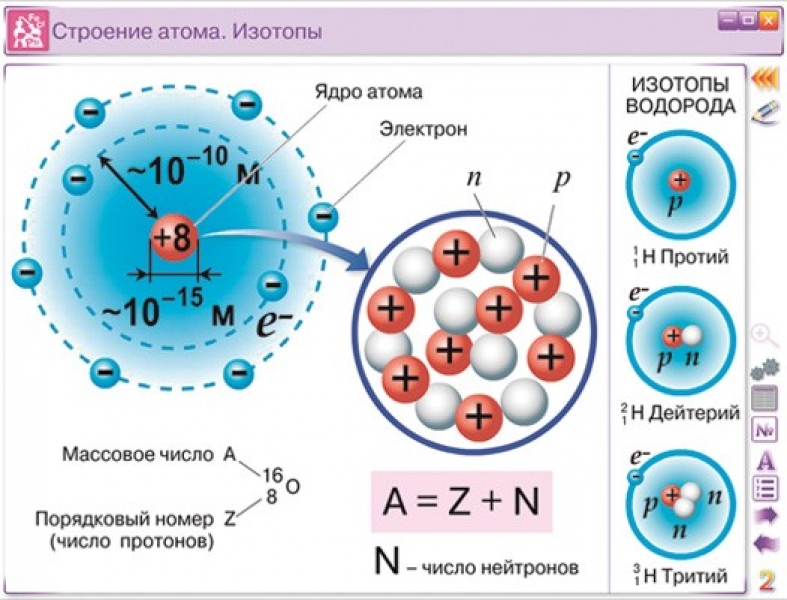 Периодическая система). Кроме того, было установлено, что в процессе химических реакций количественное соотношение веществ, участвующих в данной реакции, не изменяется. Так, для получения воды неизменно берутся восемь массовых долей кислорода и одна доля водорода (см. Закон Авогадро).
Периодическая система). Кроме того, было установлено, что в процессе химических реакций количественное соотношение веществ, участвующих в данной реакции, не изменяется. Так, для получения воды неизменно берутся восемь массовых долей кислорода и одна доля водорода (см. Закон Авогадро).
Первым осмысленную интерпретацию этих фактов предложил Джон Дальтон, чьё имя увековечено в открытом им законе Дальтона. В своих химических опытах он исследовал поведение газов (см. Закон Бойля—Мариотта, Закон Шарля и Основной закон термодинамики), но этим круг его интересов не ограничивался. В 1808 году он приступил к публикации своего фундаментального двухтомного труда «Новая система химической философии», радикально повлиявшего на дальнейшее развитие химии. В этой работе Дальтон предположил, что осмыслить и интерпретировать последние достижения экспериментальной химии можно только приняв, что каждому химическому элементу в этих опытах соответствует уникальный для него атом, и что именно смешение и объединение в различных пропорциях этих атомов приводит к образованию наблюдаемых в природе химических веществ. Например, вода, по Дальтону, состоит из сочетания двух атомов водорода и одного атома кислорода (общеизвестная формула H2O). Тот факт, что все атомы одного вида неразличимы между собой, удачно объяснял, почему при химических реакциях они всегда обнаруживаются в неизменных пропорциях. Так, в случае с водой, два атома водорода всегда одни и те же, где бы мы ни взяли эту воду, и всегда находятся в одной и той же связи с единственным атомом кислорода.
Например, вода, по Дальтону, состоит из сочетания двух атомов водорода и одного атома кислорода (общеизвестная формула H2O). Тот факт, что все атомы одного вида неразличимы между собой, удачно объяснял, почему при химических реакциях они всегда обнаруживаются в неизменных пропорциях. Так, в случае с водой, два атома водорода всегда одни и те же, где бы мы ни взяли эту воду, и всегда находятся в одной и той же связи с единственным атомом кислорода.
Для Дальтона, как и для Демокрита, атомы оставались неделимыми. В черновиках и книгах Дальтона мы находим рисунки, где атомы представлены в виде шариков. Однако основное положение его работы — что каждому химическому элементу соответствует особый тип атома — легло в основу всей современной химии. Этот факт остается непреложным и теперь, когда мы знаем, что каждый атом сам по себе является сложной структурой (см. Опыт Резерфорда) и состоит из тяжелого, положительно заряженного ядра и легких, отрицательно заряженных электронов, вращающихся по орбитам вокруг ядра. Достаточно обратиться к сложностям квантовой механики (см. также Атом Бора и Уравнение Шрёдингера), чтобы понять, что концепция атома не исчерпала себя и в XXI веке.
Достаточно обратиться к сложностям квантовой механики (см. также Атом Бора и Уравнение Шрёдингера), чтобы понять, что концепция атома не исчерпала себя и в XXI веке.
Неплохо, однако, для идеи, зародившейся в философских спорах 2500 лет назад!
Современные представления о структуре атомов
Primordia quaerere rerum
девиз Резерфорда
(доискивайся первоосновы вещей)
На протяжении многих тысячелетий мыслители всего мира искали первооснову, из которой построены различные материальные тела, существующие в природе. Такой монистический подход был довольно привлекательным благодаря своей простоте.
История сохранила имя древнего атомиста Мосха Сидонского из Сидона в Финикии (ныне г. Сайда в Ливане), который жил в ХII столетии до н. э. К тому же времени относятся взгляды китайского учёного Вен Ванга, полагавшего, что все вещества построены из наименьших частиц «ци».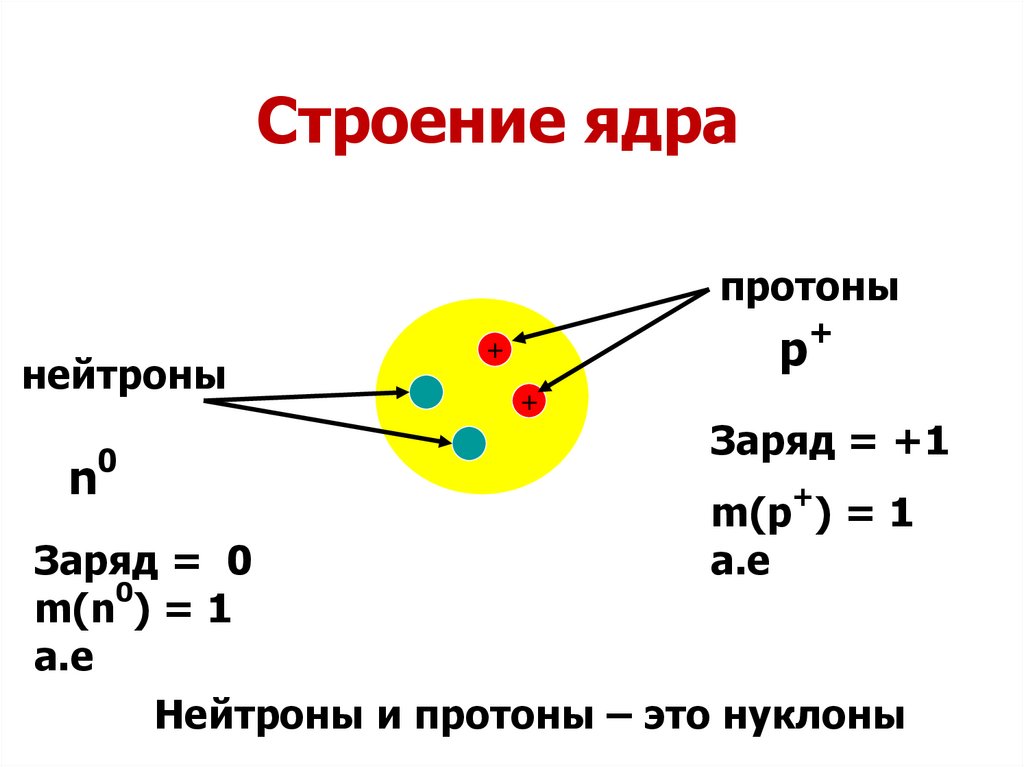
древнегреческий философ-материалист.
Основатель античного
атомистического учения.
В индийской философии атомные представления развивал Кáнада (VI–V ст. до н. э.), который думал, что все материальные тела создаются из атомов земли, воды, воздуха и эфира.
Первые греческие философы-ионийцы Фалес, Анаксимандр, Анаксимен (VII–VI ст. до н.э.) создавали космологические модели, в которых делали попытки объяснить все явления, происходящие в мире, на основе определенной первоосновы.
Идеи атомизма прослеживаются также во взглядах Гераклита из Эфеса, Парменида Элейского, Эмпедокла из Акраганта на Сицилии, Анаксагора из Клазомен и других древнегреческих мыслителей.
Переход от этих философских размышлений к понятию атома сделали Левкипп из Милета и его ученик Демокрит из Абдеры.
Именно Левкипп считается основателем античной атомистики, которую потом развил Демокрит. Среди последователей атомистического учения следует также отметить Эпикура, который полагал, что за сложностью и бесконечным разнообразием мира, окружающего нас, прячется внутренняя простота, характерная для тех уровней энергии, которые недоступны нашему непосредственному восприятию.
После смерти Демокрита выдающийся греческий мыслитель Аристотель, ученик Платона, полагал, что процесс деления вещества может быть бесконечным. Такой подход на много столетий стал доминирующим, а учение Демокрита забыли почти на 2000 лет.
На протяжении последующих многих столетий не было высказано никаких новых идей о структуре материи. Научная мысль в этом направлении начала возрождаться только в ХVII столетии.
Платон и Аристотель. Фрагмент фрески Рафаэля. Афинская школаПосле долгого забытья атомистических идей французский философ и математик Пьер Гассенди (1592–1655) возвратился к идее атомизма. Он выступал против аристотелево-схоластической картины мира, которая доминировала в те времена, против Декарта и картезианства.
Он выступал против аристотелево-схоластической картины мира, которая доминировала в те времена, против Декарта и картезианства.
Физику он рассматривал на основе атомистики Демокрита, полагал, что все тела создаются как определенные комбинации атомов, наряду с которыми существует пустое пространство, в котором происходит движение тел.
Руджер Йосип Бошкович (1711–1787)изображен на купюре в 25 динаров,
Хорватия.
Бошкович сделал вклад в теорию
орбитальной механики и был одним
из первых, кто размышлял
о силах между атомами
Различные физические и химические явления на основе атомистического подхода объяснял хорватский ученый Руджер Йосип Бошкович (1711–1787). Его идеи существенно повлияли на дальнейшее развитие естественных наук и оказались полезными для формирования физических и химических теорий XX столетия.
Однако не следует думать, что древнегреческие мыслители и их последователи благодаря гениальной интуиции действительно установили атомную структуру материи. На протяжении многих столетий атомы были только умозрительными понятиями, так как не было никакой возможности проверить их существование.
На протяжении многих столетий атомы были только умозрительными понятиями, так как не было никакой возможности проверить их существование.
Только создание устройств, позволивших экспериментально изучать свойства и структуру атомов, знаменовало новый научный этап в истории физики микромира.
Это была уже эпоха атомной физики, точнее, физики микрообъектов, в которой явления микромира описывались на основе разработанной физиками квантовой механики.
Дальнейшие исследования многих учёных XVIII–XIX столетий привели к тому, что во второй половине XIX века была подготовлена почва для развития экспериментальных исследований структуры атомов и молекул.
В 1910–1911 годах немецкий физик Ганс Гейгер и новозеландец Эрнест Марсден, работавшие в Кембридже под руководством англичанина Эрнеста Резерфорда (1871–1937), выполнили важные эксперименты по рассеянию альфа-частиц в тонких пленках.
Эрнест Резерфорд (1871-1937)изображен на Новозеландской
стодолларовой банкноте
Основываясь на результатах этих исследований, Резерфорд открыл атомное ядро (1911) и разработал планетарную модель атома (модель атома Резерфорда).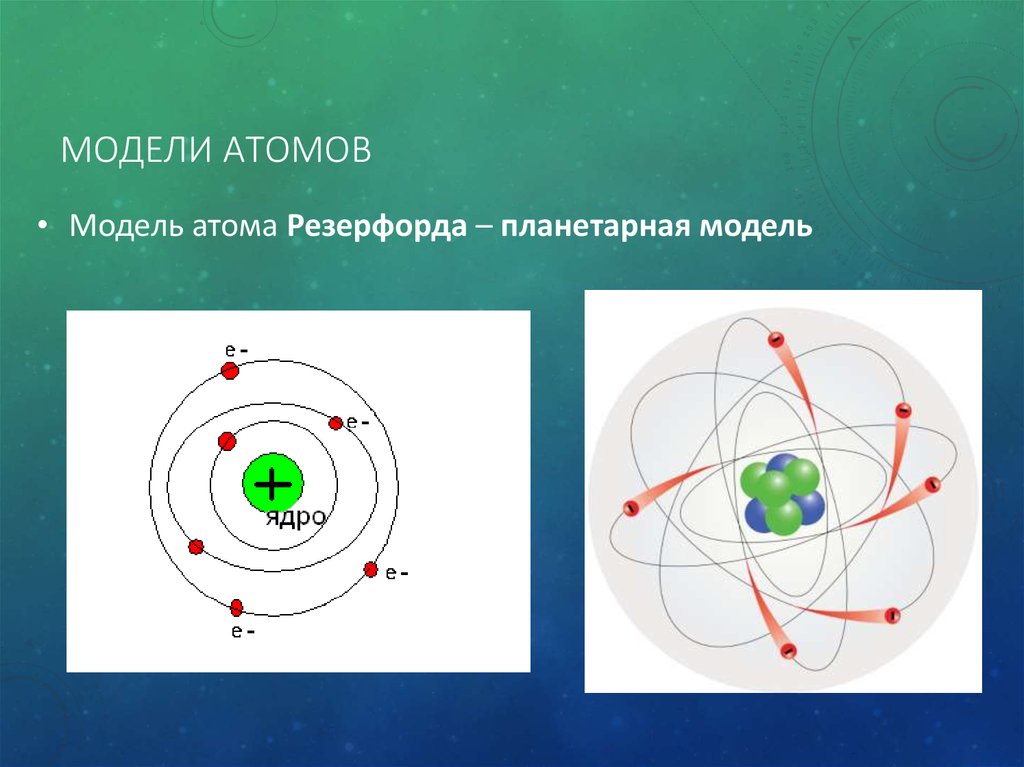 Термин «ядро» он предложил в 1912 г.
Термин «ядро» он предложил в 1912 г.
В результате этих исследований также было установлено, что линейный размер ядра (радиус ядра) очень мал Rяд ~ 10-14 м, но в ядре содержится почти вся масса атома. Ядро обладает положительным электрическим зарядом, а его объём составляет приблизительно 10-12 объёма атома.
Однако революционное открытие атомного ядра и создание планетарной модели атома столкнулись с большими трудностями, так как электрон, движущийся по криволинейной траектории в электрическом поле ядра, в соответствии с классической электродинамикой должен излучать электромагнитные волны.
Вследствие этого его энергия будет уменьшаться, также будет быстро уменьшаться и радиус его траектории (орбиты), т.е. электрон очутится в центре атома, где расположено атомное ядро, что вызовет коллапс атома, и атом перестанет существовать. Между тем было известно, что стабильные атомы «живут» бесконечно долго.
Таким образом, стало понятно, что классическая физика оказалась неспособной объяснить структуру атома.
Важный шаг для объяснения структуры атома на основе полуклассических соображений сделал датский физик Нильс Бор (1885–1962), сформулировавший постулаты, позволившие понять структуру атома водорода.
Бор получил формулу для энергетических состояний атома водорода, воспользовавшись равенством центробежной и электрической сил, действующих на заряженную частицу (электрон), движущийся по круговой орбите в электрическом поле ядра (протона).
Кроме того, он предположил, что момент импульса электрона в атоме водорода может принимать только дискретные значения. Из этих предположений вытекало, что электрон в атоме водорода может находиться как угодно долго только в определенных стационарных состояниях, характеризующихся такими значениями его полной энергии:
|
(1) |
где m – масса электрона; e – абсолютная величина заряда электрона; ħ – постоянная Планка; n – главное квантовое число, которое может принимать значения n = 0; 1; 2; …; знак минус в формуле (1) означает, что между электроном и ядром атома (протоном) действует электрическая сила притяжения.
На рис. 1 приведен энергетический спектр атома водорода, рассчитанный с помощью формулы (1).
Из формулы (1) следует, что атом, находящийся в возбужденном состоянии с энергией En, может перейти в состояние с энергией Es, вследствие чего будет излучаться фотон с энергией
|
(2) |
где ωns – частота фотона.
Формула (2) представляет собой правило частот Бора. После подстановки в формулу (2) выражения для энергии (1) получаем:
|
(3) |
В формуле (3) число s определяет серию частот (при s = 1 имеем серию Лаймана, при s = 2 – серию Бальмера, при s = 3 – серию Пашена), а число n определяет линию в серии. Для каждой серии выполняется условие n > s.
Благодаря своей гениальной научной интуиции Бор нашёл правильную формулу для энергий электрона в атоме водорода (энергетический спектр атома водорода), но способ её получения не выдерживает серьёзной критики с точки зрения современной квантовой механики, разработанной позже, которая позволила получить эту формулу совсем иным методом на основе решения уравнения Шредингера.
Отметим, что задача об атоме водорода является ключевой для понимания структуры всех атомов.
В квантовой механике частица или система частиц характеризуется орбитальным моментом импульса l и собственным моментом импульса (спином) s, измеряемых в единицах постоянной Планка ħ.
Орбитальный момент связан с движением микрообъекта в пространстве и может принимать значения l = 0; 1; 2; … В отличие от орбитальных моментов спины микрообъектов могут быть как целыми, так и полуцелыми числами.
Смысл главного квантового числа n в модели Бора и в квантовой механике разный. В модели Бора это орбитальный момент l, тогда как в квантовой механике имеем n = nr+ l + 1, где nr представляет собой так называемое радиальное квантовое число.
Принципиальная разница между моделью Бора и квантовой механикой заключается в том, что энергия основного состояния атома водорода, равная согласно формуле (1) E1=-me4/(2ħ2), в модели Бора соответствует орбитальному моменту l = 1, тогда как в квантовой механике в этом случае имеем l = 0.
Дальнейшие экспериментальные исследования показали, что формула (1) в основном правильно описывает энергетический спектр атома водорода. Однако оказалось, что этот спектр имеет более сложную структуру, которую можно понять только на основе квантовой электродинамики.
Иными словами, энергетический спектр атома водорода имеет тонкую и сверхтонкую структуры, для объяснения которых нужно воспользоваться релятивистской квантовой механикой и учесть наличие собственных моментов импульсов (спинов) электрона и протона (ядра атома водорода).
В квантовой механике состояния электрона в атоме водорода с определенными значениями орбитального момента l обозначаются латинскими буквами согласно схеме:
| l | 0 | 1 | 2 | 3 | 4 | 5 | 6 | … | (4) |
| s | p | d | f | g | h | i | … |
Для обозначения состояния электрона с определенными значениями n и l используется число для n и буква для l. Например, состояние с n = 1, l = 0 обозначается 1s; состояние с n = 2, l = 1 – 2p и т. д.
Например, состояние с n = 1, l = 0 обозначается 1s; состояние с n = 2, l = 1 – 2p и т. д.
Орбитальный момент и спин складываются в полный момент импульса j. Так как спин электрона равен s = ½, то полный момент импульса электрона составляет j = l ± ½ для l ≠ 0 и j = ½ для l = 0. Полный момент импульса может принимать значения в интервале |l – ½| ≤ j ≤ l + ½.
Состояние электрона в атоме водорода с определенными значениями n, l, j обзначается так: 1s½ для n = 1, l = 0, j = ½; 2p½ для n = 2, l = 1, j = ½; 2p3/2 для n = 2, l = 2, j = 3/2 и т. д. Подчеркнём, что моменты импульсов в квантовой механике измеряются в единицах постоянной Планка ħ.
Для определения тонкой структуры уровней энергии атома водорода нужно использовать релятивистское уравнение Дирака, приближённое решение которого с точностью до членов порядка (v/c)2 зависит от главного квантового числа n и полного момента импульса электрона j:
|
(5) |
где энергия En определяется формулой (1), величина α = e2/(ħc) ≈ 1/137 называется постоянной тонкой структуры.
Из формулы (5) следует, что расщепление уровней атома водорода (тонкая структура), обусловленная релятивистскими эффектами, пропорциональна квадрату постоянной тонкой структуры, являющейся малой величиной.
Однако в таком подходе состояния электрона с l = j ± ½ при заданных величинах n, j имеют одинаковые энергии. Например, пары уровней (2s1/2, 2p1/2), (3s1/2, 3p1/2), (3p3/2, 3d3/2) и т. д. имеют одинаковые энергии.
На рис. 2 приведена схема уровней атома водорода с учётом тонкой структуры.
Американские физики Уиллис Юджин Лэмб (1913–2008) и Роберт Ризерфорд (1912–1981) в 1947 г. провели экспериментальное исследование уровней 2s1/2 и 2p1/2 атома водорода с помощью радиоспектроскопического метода.
Они выяснили, что энергия уровня 2s1/2 превышает энергию уровня 2p1/2 на величину
|
ωэксп = (1057,90 ± 0,06) МГц, |
(6) |
где частота связана с энергией соотношением E = ħω.
Этот эффект получил название лэмбовского сдвига уровней энергии атома водорода. Таким образом, выяснилось, что энергетический спектр атома водорода имеет более сложную структуру, чем это вытекает из уравнения Дирака (рис. 3).
Рис. 3Первое объяснение лэмбовского сдвига на основе полуклассических соображений дал Ганс Бете (1906–2005) в 1947 г. Он установил, что соответствующая поправка к энергии по порядку величины составляет ΔE~α5ln(1/α). Позже этот эффект был объяснен на основе квантовой электродинамики.
Объяснение лэмбовского сдвига методами квантовой электродинамики основывается на учёте взаимодействия электрона с вакуумом электромагнитного поля, при котором происходит излучение и поглощение электроном виртуальных фотонов.
Фотоны представляют собой частицы (кванты) электромагнитного поля, т. е. считается, что электромагнитное поле одновременно имеет корпускулярную и волновую природу.
Иными словами, можно утверждать, что электромагнитному полю присущ корпускулярно-волновой дуализм. Сосуществование корпускулярных и волновых свойств в одном физическом объекте характерно для квантовой физики.
Сосуществование корпускулярных и волновых свойств в одном физическом объекте характерно для квантовой физики.
Поправки к энергии, обусловленные рассмотренными выше эффектами, называются радиационными поправками. При проведении таких расчётов выяснилось, что для достижения полного совпадения теоретических результатов с экспериментальными данными нужно было уточнить величину магнитного момента электрона μe.
Оказалось, что взаимодействие электрона с вакуумом электромагнитного поля приводит к увеличению магнитного момента электрона по сравнению с магнетоном Бора.
Такая поправка к μe называется аномальным магнитным моментом электрона. Она определяется формулой:
|
(7) |
Окончательно теоретическая оценка лэмбовского сдвига составляет:
|
ωтеор = 1057,911 МГц. |
(8) |
Последняя величина хорошо согласуется с экспериментально измеренной (6).
Исследование лэмбовского сдвига стало важным толчком для дальнейшего развития квантовой электродинамики. Подчеркнём, что учёт радиационных поправок и аномального магнитного момента электрона приводит к тому, что уровни с одинаковыми величинами моментов импульсов n и j, но с разными значениями l = j ± ½, имеют разные энергии, что согласуется с экспериментальными данными (рис. 2).
Рассмотрим теперь сверхтонкую структуру уровней энергии атома водорода, обусловленную взаимодействием магнитных моментов атомного электрона и ядра атома (протона).
Спин протона равен s = ½, а его магнитный момент составляет μp = 2,79 μN, где величина μN называется ядерным магнетоном, mp – масса протона. В релятивистской квантовой теории можно убедиться, что сверхтонкое расщепление испытывают только s-состояния. Частота излучения при переходе между компонентами основного 1s½ состояния атома водорода равна:
|
(9) |
Экспериментальное значение этой величины составляет:
|
Δωексп = (1420,405751768 ± 0,002) МГц. |
(10) |
Учёт релятивистских поправок, конечности массы ядра и аномального магнитного момента электрона приводит к согласию результата теоретического расчета с экспериментально измеренной величиной (10).
Частоте (10) соответствует длина волны
|
(11) |
Это означает, что водород во Вселенной можно определять по излучению с длиной волны 0,21 м.
Такое явление важно в астрофизике, так как наибольшее количество вещества во Вселенной составляет водород, являющийся хорошим «радиопередатчиком» на волне 0,21 м.
Рассмотренное излучение было открыто в 1951 г. и с тех пор изучается для определения распределения и движения межзвездного газа в нашей и других галактиках с помощью радиотелескопов, настроенных на «водородную волну».
Наблюдение излучения с длиной волны 0,21 м позволило выяснить распределение плотности водорода в Галактике, а также скорость вращения Галактики.
Тонкое и сверхтонкое расщепление энергетических уровней наблюдается также у многих сложных атомов, спины ядер которых отличны от нуля. Экспериментальное исследование сверхтонкого расщепления атомных уровней энергии является одним из методов измерения спинов и магнитных моментов атомных ядер.
Это явление используется также для определения эталона единицы времени. Так, секунда – это промежуток времени, равный 9 192 631 770 периодам излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия 133Cs.
Сейчас происходит стремительное развитие нано технологий. Эта область науки и техники требует от специалистов глубокого понимания структуры атомов и молекул.
Автор надеется заинтересовать молодёжь этими проблемами для дальнейшего изучения этого важного направления современной науки.
Ю.А. Бережной, доктор физ.-мат. наук, заслуженный рофессор Харьковского национального университета им. В. Н. Каразина, лауреат премий НАН Украины им. А. С. Давыдова и К. Д. Синельникова
Н. Каразина, лауреат премий НАН Украины им. А. С. Давыдова и К. Д. Синельникова
Разработка урока по химии в 11 классе “Современные представления о строении атома. Атом. Изотопы. Атомные орбитали. Электронная классификация элементов (s-, p- элементы). Особенности строения электронных оболочек атомов переходных элементов”
https://infourok.ru/videouroki ссылка на все видеоуроки
Тема 1. Строение вещества. 11 класс
Урок №1. Тема урока: ТБ. Современные представления о строении атома.
Атом. Изотопы. Атомные орбитали. Электронная классификация элементов (s-, p-
элементы). Особенности строения электронных оболочек атомов переходных элементов.
Цели и задачи урока:
Образовательные: повторить правила ТБ; обобщить знания из курсов физики и химии о явлениях, доказывающих сложность строения атома, познакомить учащихся с эволюцией научных взглядов на строение атома.
Воспитательные: Продолжить формирование познавательного интереса к предмету, показать значимость химических знаний для современного человека. Воспитание трудолюбия, аккуратности, коммуникативных качеств.
Развивающие: Развивать учебно-интеллектуальные умения выделять главное, устанавливать причинно-следственные связи (развивать логическое мышление), умений находить требуемую информацию в различных источниках и извлекать из предложенной информации нужные данные. Развивать память и внимание обучающихся.
Здоровьесберегающие технологии: следить за осанкой учащихся; проводить упражнения для снятия напряжения глаз; проветривание помещения.
Оборудование: ИКТ, презентация.
Ход урока:
Организационный момент. ТБ.
1. Тетради (рабочие, практические, контрольные)
Тетради (рабочие, практические, контрольные)
2. Учебники.
3. ТБ
Основная часть.
Беседа:
вы помните, что «атом» в переводе с греческого обозначает «неделимый», до конца ХIХ века это считалось верным. Но открытия конца ХIХ – начала ХХ вв. показали, что атом устроен сложно.
Лекция+ работа с учебником
С тех пор, как стало ясно, что атом состоит из более мелких частиц, ученые пытались
объяснить строение атома, предлагали модели:
Дж. Томсон (1904 г.) – атом состоит из положительного заряда, равномерно распространенному по всему объему атома, и электронов, колеблющихся внутри этого заряда. Эта модель не нашла экспериментального подтверждения.
Э.Резерфорд (1911 г.) – планетарная или ядерная модель атома:
– внутри атома находится положительно заряженное ядро, занимающее ничтожную часть объема атома;
– весь положительный заряд и почти вся масса атома сосредоточена в ядре;
– Электроны вращаются вокруг ядра, они нейтрализуют заряд ядра.
Модель Резерфорда подтверждалась опытами с тонкими металлическими пластинами, облучаемыми α-частицами.
Но классическая механика не могла объяснить, почему электроны не теряют энергию по мере вращения и не падают на ядро.
В 1913 г. Н.Бор дополнил планетарную модель постулатами:
– электроны в атоме вращаются по строго определенным замкнутым орбитам, не испуская и не поглощая энергии;
– при переходе электронов с одной орбиты на другую происходит поглощение или выделение энергии.
– электрон в атоме не движется по определенной траектории, а может находиться в любой части околоядерного пространства. Вероятность нахождения электрона в разных частях околоядерного пространства неодинакова.
Пространство вокруг ядра, где вероятность нахождения электрона наибольшая называется орбиталью.
– Ядро состоит из нуклонов – протонов и нейтронов. Число протонов в ядре равно порядковому номеру элеме6нта, а сумма чисел протонов и нейтронов равна массовому числу атома.
Число протонов в ядре равно порядковому номеру элеме6нта, а сумма чисел протонов и нейтронов равна массовому числу атома.
Это положение было сформулировано после открытия Э. Резерфордом в 1920 г. протона, Дж.Чедвиком в 1932 г.- нейтрона.
Различные виды атомов называются нуклидами. Нуклиды характеризуется массовым числом А и зарядом ядра Z.
Нуклиды с одинаковым Z, но разными А называют изотопами.( 35 17Cl и 37 17Cl).
Нуклиды с разными Z, но одинаковыми А называют изобарами.( 40 18Аr и 40 19К).
Электронная конфигурация атома –
показывает распределение ē по энерг. уровням и подуровням.
+1Н 1s1 ←число ē с данной формой облака
↑↖ форма электронного облака
Номер
энерг. уровня
уровня
Графические электронные формулы (изображения электронной структуры атома) –
показывает распределение ē по энерг. уровням, подуровням и орбиталям.
I период: +1Н
Где ↑ – ē, ↑↓ – ē с антипараллельными спинами, орбиталь.
При записи графической электронной формулы следует помнить правило Паули и правило Хундда « Если в пределах одного подуровня имеется несколько свободных орбиталей, то ē размещаются каждый на отдельной орбитали и лишь при отсутствии свободных орбиталей объединяются в пары».
(Работа с электронными и графическими электронными формулами).
Напр., H+11s1; He+21s2; Li+31s22s1 ; Na+11 1s2 2s2 2p63s1 ; Ar+181s2 2s2 2p6 3s23p6 ;
I период: водород и гелий – s-элементы, у них заполняется электронами s-орбиталь.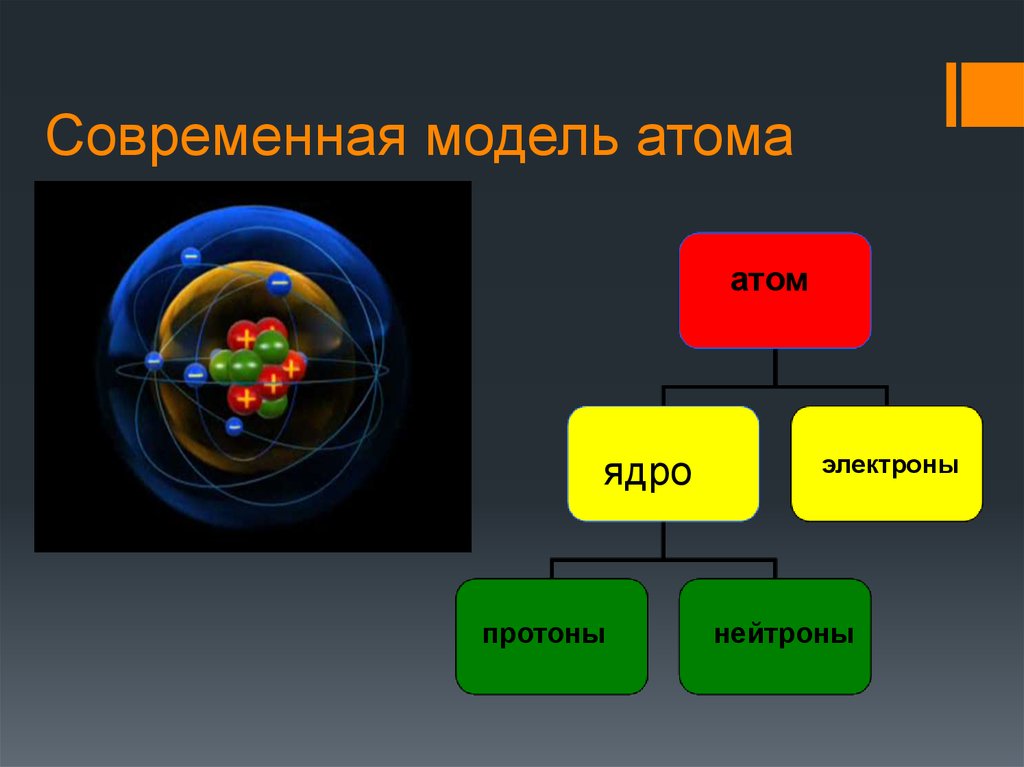
II период: Li и Be – s-элементы
B, С, N, O, F, Ne – р-элементы
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на 4 электронных семейства или блока:
1) s-элементы – у них заполняется ē-ми s-подуровень внешнего слоя атома; к ним относятся водород, гелий и эл-ты гл.п/гр. I и II групп.
2) р-элементы – у них заполняется электронами р-подуровень внешнего уровня атома; к ним относят элементы гл.п/гр. III – VIII групп.
3) d-элементы – у них заполняется электронами d-подуровень предвнешнего уровня атома; к ним относятся эл-ты побоч.п/гр. . I – VIII групп,т.е. эл-ты вставных декад больших периодов, распложенные между s- и р-элементами, их также называют переходными элементами.
4) f-элементы – у них заполняется электронами f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды ( 4f-элементы) и актиноиды (5f-элементы).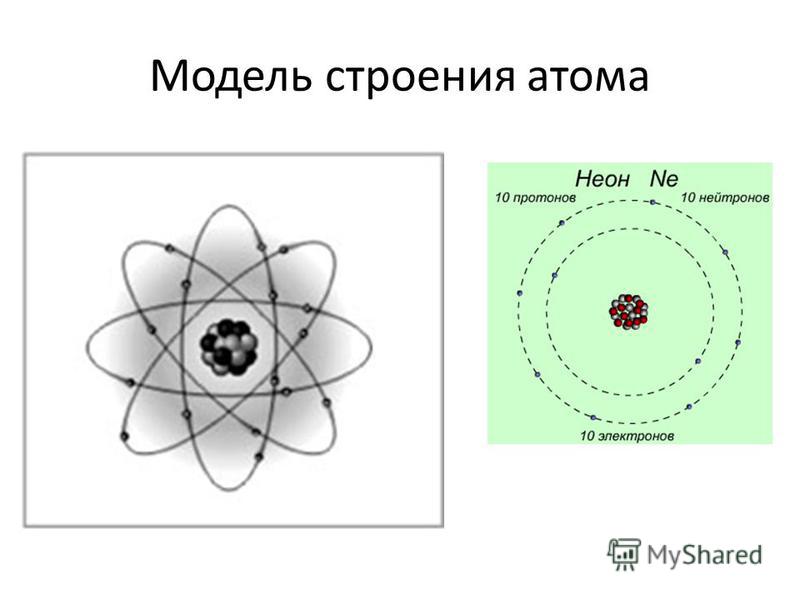
У атомов меди и хрома происходит «провал» ē с 4s- на 3d-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d5 и 3d10:
29Cu 1s22s22p63s23p64s13d10
24Cr 1s22s22p63s23p64s13d5
Задание1:
– расписать строение атома для элементов : железа, алюминия, бария, калия, кремния.
Задание 2
1.Определите химический элемент по составу его атома – 18 p+, 20 n0, 18 e–:
а) F б) Ca в) Ar г) Sr
2. Общее число электронов у иона хрома 24Cr3+:
Общее число электронов у иона хрома 24Cr3+:
а) 21 б) 24 в) 27 г) 52
3.Максимальное число электронов, занимающих 3s – орбиталь, равно:
а) 14 б) 2 в) 10 г) 6
4.Число орбиталей на f – подуровне:
а) 1 б) 3 в) 5 г) 7
5 .Наименьший радиус атома среди приведённых элементов имеет:
а) Mg б) Ca в) Si г) Cl
Д/з § 1, записи в тетради, упр. 1-8 стр.12, презентация
2.3: Современный взгляд на структуру атома
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21699
Цели обучения
- Знать значение изотопов и атомных масс.

Точная физическая природа атомов, наконец, была установлена в результате серии элегантных экспериментов, проведенных между 1895 и 1915 годами. Наиболее заметным из этих достижений был знаменитый эксперимент Эрнеста Резерфорда по рассеянию альфа-лучей 1911 года, который установил, что
- Почти вся масса атома содержится в крошечном (и, следовательно, чрезвычайно плотном) ядре , которое несет положительный электрический заряд, значение которого идентифицирует каждый элемент и известно как атомный номер элемента.
- Почти весь объем атома состоит из пустого пространства, в котором находятся электроны, основные носители отрицательного электрического заряда. Чрезвычайно малая масса электрона (1/1840 массы ядра водорода) заставляет его вести себя как квантовая частица, а это означает, что его местоположение в любой момент не может быть определено; лучшее, что мы можем сделать, — это описать его поведение в терминах вероятности его проявления в любой точке пространства.
 Принято (но несколько вводит в заблуждение) описывать объем пространства, в котором электроны атома имеют значительную вероятность быть обнаруженными, как электронное облако . Последний не имеет определенной внешней границы, как и атом. Радиус атома должен быть определен произвольно, например граница, в которой электрон может быть найден с вероятностью 95%. Атомные радиусы обычно составляют 30-300 пм.
Принято (но несколько вводит в заблуждение) описывать объем пространства, в котором электроны атома имеют значительную вероятность быть обнаруженными, как электронное облако . Последний не имеет определенной внешней границы, как и атом. Радиус атома должен быть определен произвольно, например граница, в которой электрон может быть найден с вероятностью 95%. Атомные радиусы обычно составляют 30-300 пм.
Само ядро состоит из двух видов частиц. Протоны являются носителями положительного электрического заряда в ядре; заряд протона точно такой же, как заряд электрона, но противоположного знака. Это означает, что в любом [электрически нейтральном] атоме количество протонов в ядре (часто называемое заряда ядра ) уравновешивается тем же числом электронов вне ядра. Другой ядерной частицей является нейтрон . Как следует из названия, эта частица не несет электрического заряда.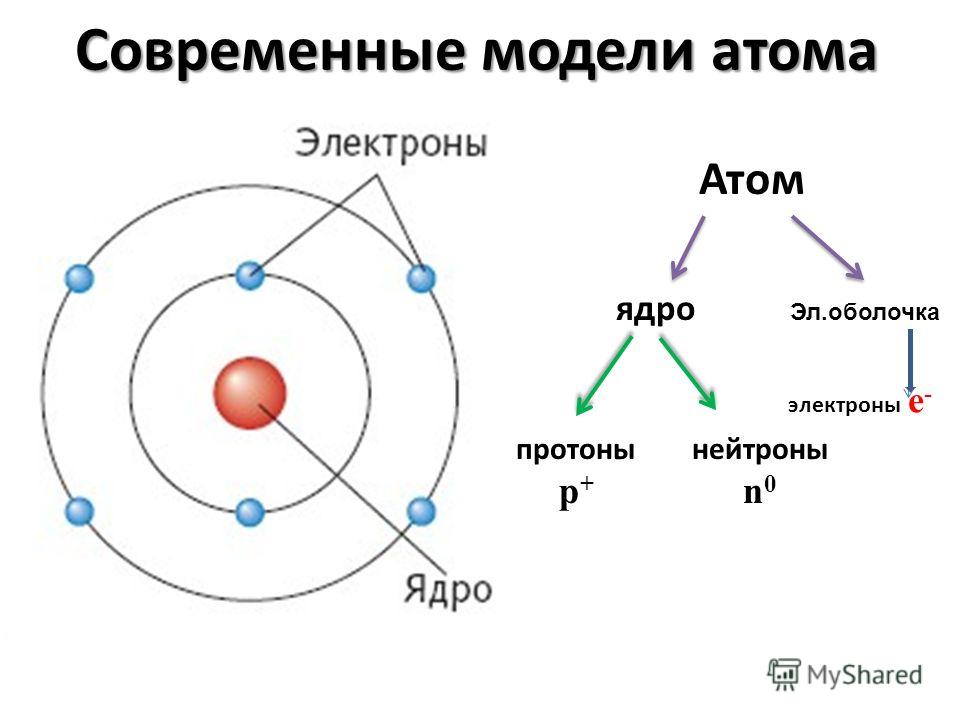 Его масса почти такая же, как у протона. Большинство ядер содержат примерно равное количество нейтронов и протонов, поэтому мы можем сказать, что эти две частицы вместе составляют почти всю массу атома.
Его масса почти такая же, как у протона. Большинство ядер содержат примерно равное количество нейтронов и протонов, поэтому мы можем сказать, что эти две частицы вместе составляют почти всю массу атома.
Поскольку электроны атома находятся в контакте с внешним миром, возможна потеря одного или нескольких электронов или добавление новых. Образовавшийся электрически заряженный атом называется ионом.
Элементы
На сегодняшний день открыто около 115 различных элементов; по определению каждый из них химически уникален. Чтобы понять, почему они уникальны, нужно понять строение атома (фундаментальной, отдельной частицы элемента) и характеристики его компонентов. Атомы состоят из электронов, протонов и нейтронов. Хотя это чрезмерное упрощение, игнорирующее другие открытые субатомные частицы, этого достаточно для обсуждения химических принципов. Некоторые свойства этих субатомных частиц приведены в таблице \(\PageIndex{1}\), которая иллюстрирует три важных момента:
- Электроны и протоны имеют электрические заряды, одинаковые по величине, но противоположные по знаку.
 Относительные заряды -1 и +1 приписаны электрону и протону соответственно.
Относительные заряды -1 и +1 приписаны электрону и протону соответственно. - Нейтроны имеют примерно ту же массу, что и протоны, но не имеют заряда. Они электрически нейтральны.
- Масса протона или нейтрона примерно в 1836 раз больше массы электрона. Протоны и нейтроны составляют основную массу атомов.
Открытие электрона и протона имело решающее значение для развития современной модели атома и представляет собой отличный пример применения научного метода. Фактически, выяснение структуры атома — одна из величайших детективных историй в истории науки.
| Частица | Масса (г) 9{-24}\) | 1.008665 | 0 | 0 |
|---|
В большинстве случаев символы элементов происходят непосредственно от названия каждого элемента, например, C для углерода, U для урана, Ca для кальция и Po для полония.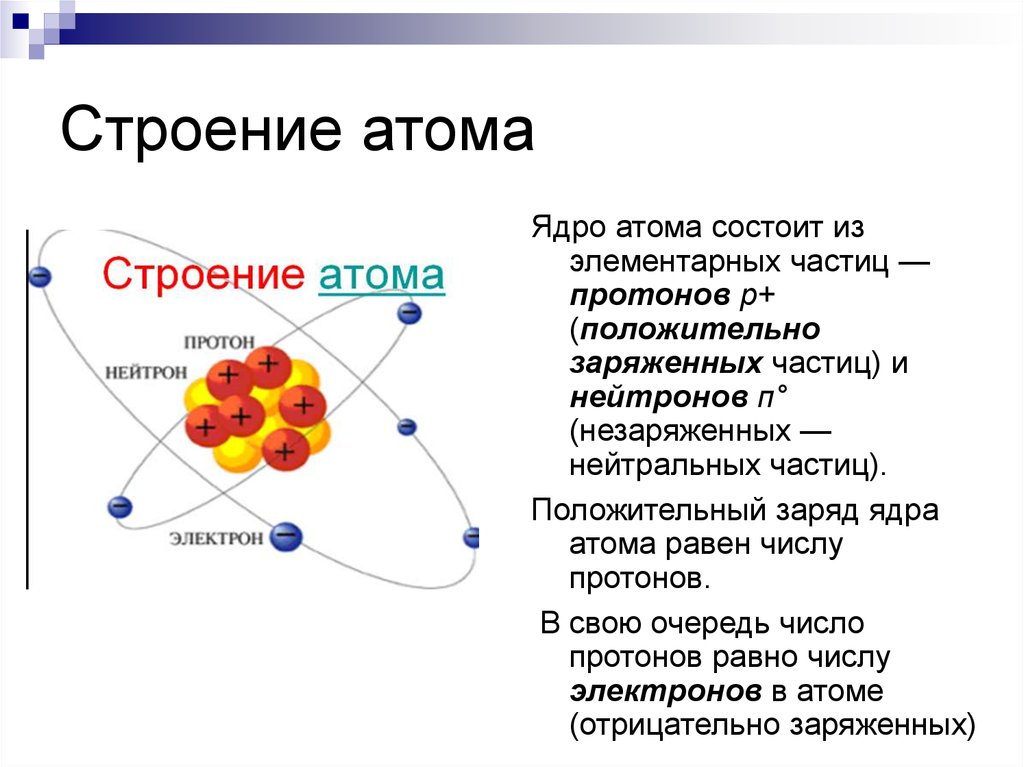 Элементы также были названы в честь их свойств [например, радий (Ra) из-за его радиоактивности], в честь страны ученого (ученых), открывшего их [полоний (Po) для Польши], в честь выдающихся ученых [курий (Cm) для Кюри], для богов и богинь [selenium (Se) для греческой богини луны Селены] и по другим поэтическим или историческим причинам. Некоторые из символов, используемых для элементов, которые были известны с древних времен, произошли от исторических названий, которые больше не используются; остаются только символы, указывающие на их происхождение. Примеры: Fe для железа, от латинского 9.0033 железо ; Na для натрия, от латинского natrium ; и W для вольфрама, от немецкого wolfram . Примеры приведены в таблице \(\PageIndex{2}\).
Элементы также были названы в честь их свойств [например, радий (Ra) из-за его радиоактивности], в честь страны ученого (ученых), открывшего их [полоний (Po) для Польши], в честь выдающихся ученых [курий (Cm) для Кюри], для богов и богинь [selenium (Se) для греческой богини луны Селены] и по другим поэтическим или историческим причинам. Некоторые из символов, используемых для элементов, которые были известны с древних времен, произошли от исторических названий, которые больше не используются; остаются только символы, указывающие на их происхождение. Примеры: Fe для железа, от латинского 9.0033 железо ; Na для натрия, от латинского natrium ; и W для вольфрама, от немецкого wolfram . Примеры приведены в таблице \(\PageIndex{2}\).
| Элемент | Символ | Производная | Значение |
|---|---|---|---|
| сурьма | Сб | сурьма | «знак» на латыни |
| медь | Медь | медь | от Cyprium, латинского названия острова Кипр, основного источника медной руды в Римской империи |
| золото | Золото | золотой | «золото» на латыни |
| железо | Fe | железо | «железо» на латыни |
| свинец | Пб | свинец | «тяжелый» на латыни |
| ртуть | рт.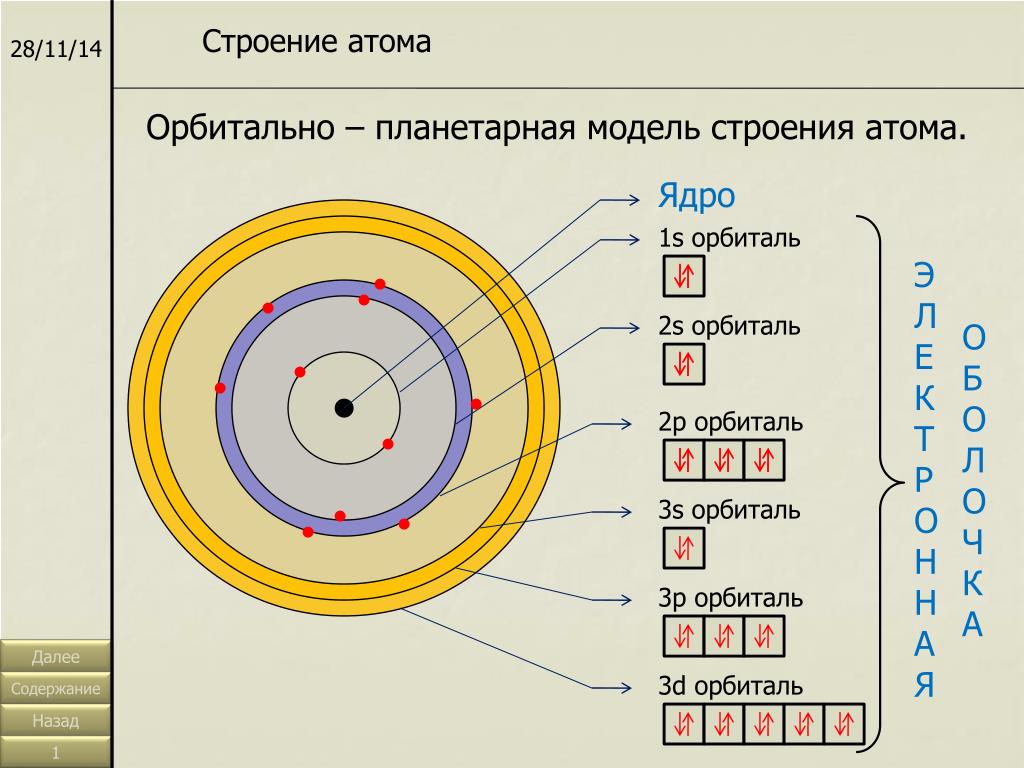 ст. ст. | гортань | «жидкое серебро» на латыни |
| калий | К | калий | от арабского al-qili, «щелочь» |
| серебро | Аг | серебро | «серебро» на латыни |
| натрий | На | натрий | «натрий» на латыни |
| банка | Сн | станнум | «жесть» на латыни |
| вольфрам | Вт | вольфрам | По-немецки «волчий камень», потому что он мешал плавке олова и, как считалось, пожирал олово |
Напомним, что ядра большинства атомов содержат нейтроны, а также протоны. В отличие от протонов, число нейтронов не является абсолютно фиксированным для большинства элементов. Атомы, имеющие одинаковое количество протонов и, следовательно, одинаковый атомный номер, но разное количество нейтронов, называются изотопами. Все изотопы элемента имеют одинаковое количество протонов и электронов, что означает, что они обладают одинаковым химическим составом. Изотопы элемента отличаются только своей атомной массой, которая определяется массовым числом (А), суммой числа протонов и нейтронов. 9{12} С\) чаще записывают как 12 С, что читается как «углерод-12». Тем не менее, значение Z обычно включается в обозначение ядерных реакций, потому что эти реакции связаны с изменением Z.
В отличие от протонов, число нейтронов не является абсолютно фиксированным для большинства элементов. Атомы, имеющие одинаковое количество протонов и, следовательно, одинаковый атомный номер, но разное количество нейтронов, называются изотопами. Все изотопы элемента имеют одинаковое количество протонов и электронов, что означает, что они обладают одинаковым химическим составом. Изотопы элемента отличаются только своей атомной массой, которая определяется массовым числом (А), суммой числа протонов и нейтронов. 9{12} С\) чаще записывают как 12 С, что читается как «углерод-12». Тем не менее, значение Z обычно включается в обозначение ядерных реакций, потому что эти реакции связаны с изменением Z.
Рисунок \(\PageIndex{2}\) : Формализм, используемый для идентификации конкретного нуклида (любого конкретного типа ядра)
Помимо \(^{12}C\), типичный образец углерода содержит 1,11% \(_6^{13}С\) ( 9{14} С\) ( 14 С), с 8 нейтронами и 6 протонами. Однако ядро 14 C не является стабильным, а подвергается медленному радиоактивному распаду, что является основой метода датирования по углероду-14, используемого в археологии. Многие элементы, кроме углерода, имеют более одного стабильного изотопа; олово, например, имеет 10 изотопов. Свойства некоторых распространенных изотопов приведены в таблице \(\PageIndex{3}\).
Однако ядро 14 C не является стабильным, а подвергается медленному радиоактивному распаду, что является основой метода датирования по углероду-14, используемого в археологии. Многие элементы, кроме углерода, имеют более одного стабильного изотопа; олово, например, имеет 10 изотопов. Свойства некоторых распространенных изотопов приведены в таблице \(\PageIndex{3}\).
| Элемент | Символ | Атомная масса (а.е.м.) | Массовый номер изотопа | Массы изотопов (а.е.м.) | Численность в процентах (%) |
|---|---|---|---|---|---|
| водород | Х | 1. 0079 0079 | 1 | 1.007825 | 99,9855 |
| 2 | 2.014102 | 0,0115 | |||
| бор | Б | 10,81 | 10 | 10.012937 | 19,91 |
| 11 | 11.009305 | 80,09 | |||
| уголь | С | 12. 011 011 | 12 | 12 (определено) | 99,89 |
| 13 | 13.003355 | 1.11 | |||
| кислород | О | 15,9994 | 16 | 15,994915 | 99,757 |
| 17 | 16.999132 | 0,0378 | |||
| 18 | 17,999161 | 0,205 | |||
| железо | Фе | 55,845 | 54 | 53. 939611 939611 | 5,82 |
| 56 | 55.934938 | 91,66 | |||
| 57 | 56.935394 | 2,19 | |||
| 58 | 57.933276 | 0,33 | |||
| уран | У | 238.03 | 234 | 234.040952 | 0,0054 |
| 235 | 235.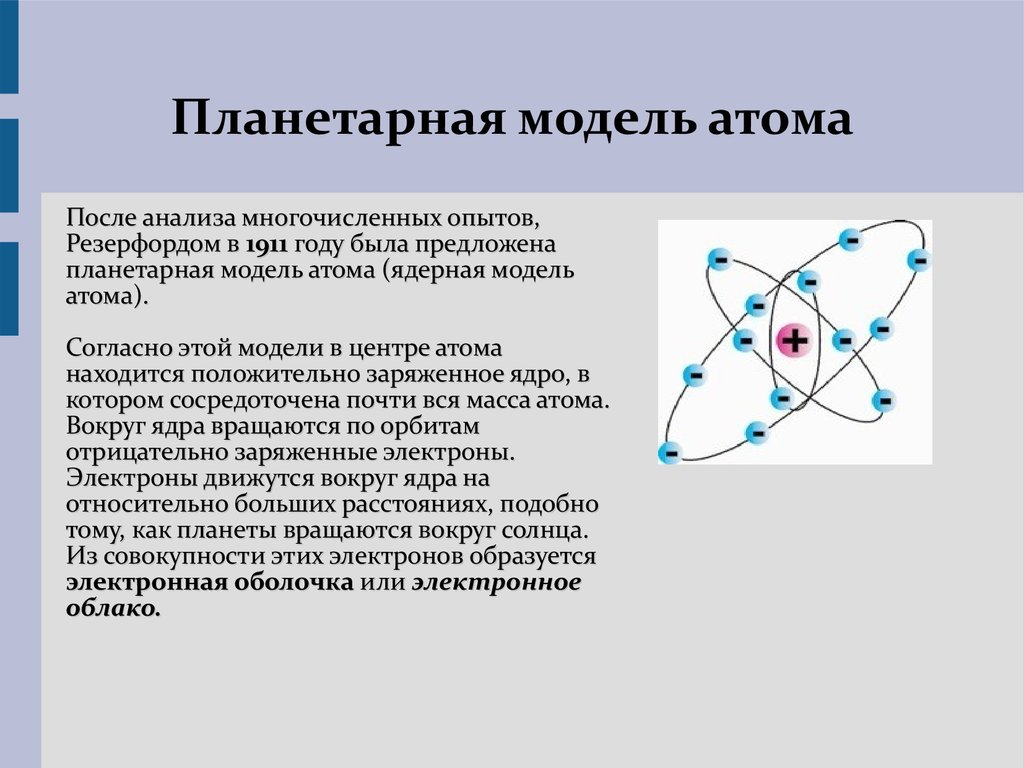 043930 043930 | 0,7204 | |||
| 238 | 238.050788 | 99,274 |
Источники изотопных данных: G. Audi et al., Nuclear Physics A 729 (2003): 337–676; Дж. К. Коц и К. Ф. Перселл, Химия и химическая реактивность, 2-е изд., 1991.
Как элементы представлены в периодической таблице: как элементы представлены в периодической таблице, YouTube (opens in new window) [youtu.be ]
Пример \(\PageIndex{1}\)
Элемент с тремя стабильными изотопами имеет 82 протона. Отдельные изотопы содержат 124, 125 и 126 нейтронов. Определите элемент и напишите символы для изотопов.
Дано : количество протонов и нейтронов
Запрошено : элемент и символ атома
Стратегия :
- Обратитесь к периодической таблице и используйте для определения количества протонов.
 {208}Pb\). 9{81}Бр}\).
{208}Pb\). 9{81}Бр}\).Резюме
Атом состоит из дискретных частиц, которые определяют его химическое и физическое поведение. Каждый атом элемента содержит одинаковое количество протонов, что соответствует атомному номеру ( Z ). Нейтральные атомы имеют одинаковое количество электронов и протонов. Атомы элемента, которые содержат разное количество нейтронов, называются изотопами . Каждый изотоп данного элемента имеет одинаковый атомный номер, но разные массовое число ( A ), которое представляет собой сумму чисел протонов и нейтронов. Относительные массы атомов сообщаются с использованием атомной единицы массы ( а.е.м. ), которая определяется как одна двенадцатая массы одного атома углерода-12 с 6 протонами, 6 нейтронами и 6 электронами.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СС BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- атомная единица массы
- атомный номер
- электрон
- изотоп
- масса
- массовый номер
- нейтрон
- ядро
- протон
Вопросы и ответы – Каково современное представление о строении атома? Чем протоны отличаются от нейтронов? В чем разница между протонами и электронами?
Предыдущий вопрос
(Атомы без нейтронов?)
Вопросы и ответы
Основной индексСледующий вопрос
(Заряд протона и нейтрона?)
Предыдущий вопрос
(Атомы без нейтронов?)
Вопросы и ответы Основной индекс
Следующий вопрос
(Заряд протона и нейтрона?)
Вопросы и ответы Основной индекс
Каково современное представление о строении атома? Чем протоны отличаются от нейтронов? В чем разница между протонами и электронами?
Есть несколько концепций, которые лежат в основе нашего современного взгляда на атом.
 Я перечислил пять, и все они являются «современными» в том смысле, что были разработаны в прошлом столетии.
Я перечислил пять, и все они являются «современными» в том смысле, что были разработаны в прошлом столетии.[Концепция 1] – Субатомные частицы
Протон: положительный заряд, масса примерно в 2000 раз больше массы электрона
Нейтрон: нейтральный или нулевой заряд, масса почти такая же, как у протона
Электрон: отрицательный заряд
Нейтрино: нейтральное, безмассовое (?)
Нейтрино — относительно неизвестная частица, но она играет важную роль в реакциях на Солнце.
[Концепция 2] – Силы, которые удерживают атомы вместе
Сильное взаимодействие: малое взаимодействие, притягивает протоны к нейтронам и притягивает протоны к другим протонам
Электромагнитное взаимодействие: длинное действие, притягивает электроны к протонам, отталкивает электроны от электронов и отталкивает протоны от протонов.
[Концепция 3] – Распад нейтронов
n → p + e + нейтрино
Или, наоборот, протон и электрон могут слиться, чтобы создать нейтрон:
p + e → n + нейтрино
[Концепция 4] – Дискретные электронные орбиты
Энергии атомов квантуются.

[Концепция 5] – Принцип запрета Паули
Никакие два электрона не могут занимать одно и то же пространство.
Давайте начнем с размышлений о том, как на самом деле формировались атомы в ранней Вселенной. Предположим, что на заре времён была смесь — суп или капля — протонов и электронов, плавающих в пространстве [Концепция 1]. Большая часть космоса пуста, потому что эти частицы очень малы. Единственная сила, ощущаемая частицами, — это электромагнитная сила, потому что она дальнодействующая. Сильное взаимодействие похоже на клей на поверхности протонов [Концепция 2]. Если протон столкнется с другим протоном, он немедленно прилипнет к нему. Но протоны отталкиваются друг от друга из-за одинаковых зарядов, так что никогда этого не происходит. Вместо этого протоны притягивают электроны, которые быстро начинают вращаться вокруг них, как планеты, образуя водород — атом с одним протоном и одним электроном. Это основной материал Вселенной и первичный элемент звезд.
Когда протоны и электроны образуют пару, их общий заряд равен нулю, поэтому они минимально взаимодействуют с соседними частицами.
 В звездах температура настолько высока (15 миллионов градусов и более), что протоны движутся достаточно быстро, чтобы преодолеть электромагнитную силу отталкивания и время от времени сталкиваться с другими протонами и прилипать к ним. Когда это происходит, один из протонов превращается в нейтрон [Концепция 3] и образует дейтерий (один электрон, вращающийся вокруг пары протон-нейтрон). Два атома дейтерия также могут столкнуться друг с другом и произвести атом гелия с двумя протонами и двумя нейтронами, слипшимися благодаря сильному взаимодействию. Эта четверка является ядром атома гелия с +2 единицами положительного заряда. Два электрона вращаются вокруг этого ядра, образуя нейтральный атом.
В звездах температура настолько высока (15 миллионов градусов и более), что протоны движутся достаточно быстро, чтобы преодолеть электромагнитную силу отталкивания и время от времени сталкиваться с другими протонами и прилипать к ним. Когда это происходит, один из протонов превращается в нейтрон [Концепция 3] и образует дейтерий (один электрон, вращающийся вокруг пары протон-нейтрон). Два атома дейтерия также могут столкнуться друг с другом и произвести атом гелия с двумя протонами и двумя нейтронами, слипшимися благодаря сильному взаимодействию. Эта четверка является ядром атома гелия с +2 единицами положительного заряда. Два электрона вращаются вокруг этого ядра, образуя нейтральный атом.Протон, электрон и нейтрон являются строительными блоками всех атомов. Легкие элементы формируются в центре звезд, как описано выше. Тяжелые элементы образуются во время взрывов сверхновых, когда ядра легких элементов сближаются и склеиваются клеем сильного взаимодействия. Атомы быстро располагают свои компоненты, чтобы они стали нейтральными.
 Следовательно, все атомы должны иметь одинаковое количество протонов и электронов. Нейтроны помогают удерживать протоны в ядре вместе, но по мере увеличения числа положительных протонов отталкивающий электромагнитный заряд в конечном итоге преодолевает сильное взаимодействие. Когда число протонов в ядре достигает сотни, ядра распадаются сами по себе, независимо от того, сколько нейтронов добавляется к смеси. Атомные орбиты аналогичны нашей Солнечной системе, где ядро играет роль солнца, а электроны выполняют роль планет. Солнце намного тяжелее планет, так же как протоны и нейтроны намного тяжелее электронов. Но есть несколько важных различий между Солнечной системой и атомами. Планеты могут находиться на любом расстоянии от Солнца, но электроны могут падать только на особые орбиты [Концепция 4], которые имеют заданные расстояния до ядра. Радиусы этих орбит находятся в соотношении 1:4:9.:16:25. Кроме того, в Солнечной системе на каждой орбите может находиться любое количество планет (или спутников).
Следовательно, все атомы должны иметь одинаковое количество протонов и электронов. Нейтроны помогают удерживать протоны в ядре вместе, но по мере увеличения числа положительных протонов отталкивающий электромагнитный заряд в конечном итоге преодолевает сильное взаимодействие. Когда число протонов в ядре достигает сотни, ядра распадаются сами по себе, независимо от того, сколько нейтронов добавляется к смеси. Атомные орбиты аналогичны нашей Солнечной системе, где ядро играет роль солнца, а электроны выполняют роль планет. Солнце намного тяжелее планет, так же как протоны и нейтроны намного тяжелее электронов. Но есть несколько важных различий между Солнечной системой и атомами. Планеты могут находиться на любом расстоянии от Солнца, но электроны могут падать только на особые орбиты [Концепция 4], которые имеют заданные расстояния до ядра. Радиусы этих орбит находятся в соотношении 1:4:9.:16:25. Кроме того, в Солнечной системе на каждой орбите может находиться любое количество планет (или спутников). Например, в поясе астероидов есть тысячи планет (или «астероидов»), вращающихся вокруг Солнца по практически одной и той же орбите. Но атомные орбиты подобны комнатам с несколькими кроватями, и как только они заполнены, дверь закрывается, и другие электроны должны найти место на других (незаполненных) орбитах [Концепция 5].
Например, в поясе астероидов есть тысячи планет (или «астероидов»), вращающихся вокруг Солнца по практически одной и той же орбите. Но атомные орбиты подобны комнатам с несколькими кроватями, и как только они заполнены, дверь закрывается, и другие электроны должны найти место на других (незаполненных) орбитах [Концепция 5].Поведение атома в основном зависит от числа электронов на последней орбите (наиболее удаленной от ядра). Другими словами, полные или «заполненные» орбиты не участвуют в химических реакциях. Например, атомы с одним электроном на последней орбите обладают одинаковыми основными свойствами (например, литий, натрий, калий и т. д.). Это приводит к закономерностям в периодической таблице.
Автор:
Элтон Смит, научный сотрудник
Информация о цитировании и ссылках
По вопросам, касающимся этой страницы, обращайтесь к Стиву Ганьону.
Современная атомная модель – Химия СЗМ
по
История развития модели атома
В таблице ниже показаны ученые, внесшие вклад в разработку модели атома.

Джон Далтон - Пять основных положений атомной теории Дальтона
- Вся материя состоит из очень маленьких частиц, называемых атомами.
- Все атомы данного элемента идентичны, имеют одинаковый размер, массу и химические свойства. Атомы определенного элемента отличаются от атомов любого другого элемента.
- Атомы не могут быть созданы, разделены на более мелкие частицы или уничтожены.
- Различные атомы соединяются в простых соотношениях целых чисел, образуя соединения.
- В химической реакции атомы разделяются, объединяются или перестраиваются.
- Атомы состоят из еще более мелких частиц, называемых электронами, протонами и нейтронами.
- Атомы могут быть созданы и уничтожены в ядерных реакциях, таких как ядерный синтез и ядерное деление.
 .
. - Атомы одного и того же элемента могут иметь разные физические свойства, например, изотопы водорода.
Дж.Дж. Томсон Электроны были расположены равномерно по всему атому. Эрнест Резерфорд - атом в основном пустое место,
- большая часть массы атома сосредоточена в крошечном центре, ядро и электроны удерживаются на орбите вокруг него за счет электростатического притяжения.
- Ядро было около 10-15 метров в диаметре, в центре атома диаметром 10-10 метров.
- Те альфа-частицы, которые подошли вплотную к ядру, были сильно отклонены, тогда как большинство прошло на относительно большом расстоянии от него.
Нильс Бор - Электроны в атоме элемента не распределены случайным образом вокруг атомного ядра.
- Электроны движутся вокруг ядра по фиксированным орбитам.

- Каждая орбита образует окружность и имеет фиксированное расстояние от ядра.
Джеймс Чедвик - Чедвик обнаружил присутствие нейтронов в ядре.
- Он пришел к выводу, что ядро содержит еще одну крошечную частицу, известную как нейтрон, которая не имеет заряда.
- Масса нейтрона почти аналогична массе протона.
- Все ядра содержат протоны и нейтроны, за исключением водорода, содержащего протоны. только
Современная атомная модель
Согласно современной атомной модели,
- Центральное ядро состоит из протонов и нейтронов. Он содержит почти всю массу атома.
- ядро атома очень маленькое по сравнению с размером атома
- электроны вращаются вне ядра в электронных оболочках
- электроны движутся в электронных оболочках с очень большой скоростью и мы не можем определить положение электронов в конкретный момент времени
Субатомные частицы атома
- Атомы состоят из крошечных частиц, называемых субатомными частицами.

- Атом содержит три типа субатомных частиц:
- протон,
- нейтрон и
- электрон,
- Протон и нейтрон образуют ядро в центре атома. Их еще называют нуклоном атома.
- Электрон движется вокруг ядра с очень большой скоростью.
- Ядро заряжено положительно из-за присутствия протонов, которые заряжены положительно. Нейтроны нейтральны.
- Символы, заряд и относительные массы протона, нейтрона и электрона приведены ниже.
Частица Символ Относительный заряд Относительная масса Протон р
+1
1
Нейтрон п
1
Электрон е
-1
1/1840
Заряд частиц
- Нейтральный атом содержит столько же электронов, сколько и протонов.

- Положительные и отрицательные заряды протонов и электронов соответственно нейтрализуют друг друга, например, (+4) + (-4) = 0
- Если число протонов больше числа электронов, частица имеет положительный заряд.
- Если число протонов больше числа электронов, частица имеет положительный заряд.
Пример :
Количество протонов Количество электронов Плата
3
3
5
2
+3
9
10
-1
11
10
+3
16
18
-2
17
18
-1
20
18
+3
Число протонов и число нуклонов
- Число протонов = число протонов
- Число нуклонов = Количество протонов + Количество нейтронов
Число протонов
- Число протонов (Z) представляет собой число протонов в ядре атома.

- число протонов = количество протонов
- Число протонов также известно как атомный номер.
- В атоме с нейтральным зарядом число электронов также равно атомному номеру.
- Следовательно, число протонов атома может также представлять число электронов.
Число нуклонов
- Число нуклонов (А), также называемое атомным массовым числом или массовым числом, представляет собой число протонов плюс число нейтронов в атомном ядре. (Число нуклонов = количество протонов + количество нейтронов)
- Нуклонное число атома примерно равно массе атома, потому что масса электрона очень мала и ею можно пренебречь.
Атом
Номер протона
Число нуклонов
Количество протонов
Количество электронов
Количество нейтронов
Гелий 2
4
2
2
2
Кислород 8
16
8
8
8
Натрий 11
23
11
11
12
Хлор 17
35
17
17
18
[Примечания: в ионах количество протонов НЕ равно количеству электронов]
Изотопы
Изотопы – это атомы определенных элементов, которые имеют одинаковое количество протонов, но разное количество нейтронов в ядре атомы.

Его также можно определить как атомы определенных элементов с одинаковыми числами протонов, но с разными числами нуклонов.
Свойства изотопа
Количество протонов равно Количество нейтронов разница Химические свойства то же Физические свойства разница Пример :
Элемент Имя Символ Номер протона Число нуклонов Количество протонов Число нейтронов Водород Водород 1 1 Н
1
1
1
Дейтерий 2 1 Н
1
12
1
1
Тритий 3 1 Н
1
23
1
2
Кислород Кислород-16 16 8 О
8
16
8
8
Кислород-17 17 8 О
8
17
8
9
Кислород-18 18 8 О
8
18
8
10
Углерод Углерод-12 12 6 С
6
12
6
6
Углерод-13 13 6 С
6
13
6
7
Углерод-14 14 6 С
6
14
6
8
Хлор Хлор-35 35 17 Класс
17
35
17
18
Хлор-37 37 17 Класс
17
37
17
20
Натрий Натрий-23 23 11 Нет
11
23
11
12
Натрий-24 24 11 Нет
11
24
11
13
Структура атома
В начале изучения структуры атома сэр Джозеф Томсон и Эрнест Резерфорд создали конкурирующие модели атома. Томсон предложил модель «сливовый пудинг». В этой модели отрицательные заряды — электронов, (сливы) — были окружены положительными зарядами (пудинг), заполняя объем атома.
Томсон предложил модель «сливовый пудинг». В этой модели отрицательные заряды — электронов, (сливы) — были окружены положительными зарядами (пудинг), заполняя объем атома.Чтобы продемонстрировать свою модель, Резерфорд бомбардировал тонкую металлическую фольгу пучком положительно заряженных частиц. Большинство частиц прошло без особого эффекта, но иногда одна из них отклонялась на большой угол. В качестве объяснения Резерфорд предложил планетарную модель атома с отрицательно заряженными электронами, вращающимися вокруг центральной концентрации положительного заряда — ядра .
В планетарной модели атома возникают две основные трудности. Во-первых, любой объект, движущийся по кругу, ускоряется. Согласно классической механике, ускоряющий заряд излучает энергию, производя электромагнитные волны; следовательно, вращающийся электрон должен излучать энергию и быстро падать на ядро. Поскольку материя существует, этого, очевидно, не происходит.
 Во-вторых, атом излучает только определенное электромагнитное излучение, не континуум всех частот.
Во-вторых, атом излучает только определенное электромагнитное излучение, не континуум всех частот.Атомные спектры
Когда газ возбуждается искрой, возникает свет определенного цвета. Например, неоновый газ дает красно-оранжевый цвет. Когда этот свет проходит через призму, наблюдается серия ярких линий с определенной длиной волны, называемая линейчатым спектром . Линейчатые спектры — это характеристики определенного газа, скорее, его атомные отпечатки пальцев. Например, видимый линейчатый спектр водорода состоит в основном из длин волн примерно 656 нм, 486 нм, 434 нм и 410 нм. Хотя в то время не было понятно, почему это работает, было найдено следующее уравнение, описывающее последовательность линий, называемую 9.0081 Серия Balmer :
, где n — целое число 3, 4, 5, … и R — постоянная, называемая теперь постоянной Ридберга:
В дополнение к излучению света определенных длин волн элемент также может поглощать свет определенных длин волн.
 Свет от лампочки или солнца образует непрерывный спектр — цветов радуги. Когда свет непрерывного спектра проходит через холодный газ, газ поглощает те же длины волн, которые он излучает при возбуждении, что проявляется в виде набора черных линий в непрерывном спектре. Черные линии называются спектр поглощения .
Свет от лампочки или солнца образует непрерывный спектр — цветов радуги. Когда свет непрерывного спектра проходит через холодный газ, газ поглощает те же длины волн, которые он излучает при возбуждении, что проявляется в виде набора черных линий в непрерывном спектре. Черные линии называются спектр поглощения .Атом Бора
Нильс Бор (1852–1962) объединил классическую механику и некоторые революционные постулаты, чтобы сформулировать модель атома водорода, которая надеялась обойти некоторые трудности классической физики и при этом объяснить атомные спектры. Ниже приведены его основные постулаты.
- Постулат 1: Электрон движется только по определенным разрешенным круговым орбитам — квантованным состояниям — вокруг положительного ядра под действием кулоновской силы.
- Постулат 2: Электрон не излучает энергию, когда он находится на одной из разрешенных орбит, называемых стационарным состоянием .

- Постулат 3: Когда электрон переходит из одного разрешенного состояния в другое, энергия выделяется в виде отдельного фотона с энергией, равной разнице энергий начального и конечного состояний:
Представления Планка о квантовании можно увидеть в постулатах Бора 1 и 3. Когда электрон находится в стационарном состоянии, Бор предполагал, что законы Ньютона, закон Кулона и закон сохранения энергии справедливы. Бор показал, что угловой момент электрона с массой м , движущийся со скоростью v по круговой орбите радиусом r , квантуется как
, где n — целое число, а h — постоянная Планка.
Также он вывел выражение для радиуса водорода из электростатической силы (закон Кулона), равной центростремительной силе:
Когда n = 1, радиус называется боровским радиусом , который является наименьшей орбитой водорода.
Чтобы найти выражение для полной энергии электрона, вращающегося вокруг атома, используйте классическую формулу для полной энергии, затем подставьте r n сверху и v из углового момента, чтобы получить следующее:
Когда n = 1, самое низкое энергетическое состояние атома называется основным состоянием .
 Значение основного состояния водорода составляет -13,6 электронвольт, что прекрасно согласуется с экспериментально наблюдаемым водородом 9.0081 энергия ионизации — энергия, необходимая для отрыва электрона в основном состоянии от атома.
Значение основного состояния водорода составляет -13,6 электронвольт, что прекрасно согласуется с экспериментально наблюдаемым водородом 9.0081 энергия ионизации — энергия, необходимая для отрыва электрона в основном состоянии от атома.Объединение этого результата с уравнением в постулате Бора 2 дает
Поскольку c = f λ, уравнение становится
Из предыдущего уравнения можно рассчитать постоянную Ридберга.
Все эти константы известны, и теоретическое значение постоянной Ридберга такое же, как и полученное Р . Это продемонстрированное согласие примечательно, и оно подтвердило постулаты Бора.
Уровни энергии
Бальмеровский ряд, обнаруженный экспериментально, можно объяснить с помощью боровской модели атома следующим образом. Рисунок 1 представляет собой схему энергетических переходов, возможных для водорода.
Рисунок 1 Энергетические переходы атома водорода со спектральными сериями.

Для серии Бальмера электрон водорода перескакивает из начального возбужденного состояния ( n = 3,4,5, …) в конечное состояние на уровне n = 2. При этом он испускает фотон с энергией, равной разности энергий начального и конечного состояний. Другие серии, указанные на рисунке, иллюстрируют другие серии линий, найденные Теодором Лайманом и Луи Пашеном. Этот тип диаграммы называется диаграмма уровней энергии , потому что она иллюстрирует дискретные разрешенные уровни энергии и допустимые переходы для электрона на орбите.
Волны де Бройля и атом водорода
Следующей задачей было выяснить, почему возможны только определенные дискретные уровни энергии. Де Бройль предположил, что орбита будет стабильной только в том случае, если она содержит целое или кратное целому числу электронных волн де Бройля. На рисунке показано представление стоячей круговой волны с тремя длинами волны.

Рисунок 2 Энергетические переходы атома водорода со спектральными сериями.
Изображенная орбита будет допустимой орбитой с квантовым числом 3, то есть n = 3. Этот визуальный способ понимания квантования показывает, что волновая природа материи лежит в основе модели атома. . Более сложные формулировки квантовой физики, которые были разработаны позже, основывались на этих концепциях.
Из каких частей состоит атом?
С незапамятных времен люди стремились понять, из чего состоит Вселенная и все, что в ней находится. И хотя древние маги и философы представляли себе мир, состоящий из четырех или пяти элементов — земли, воздуха, воды, огня (и металла, или сознания) — к классической древности философы начали теоретизировать, что вся материя на самом деле состоит из крошечных, невидимые и неделимые атомы.

С тех пор ученые постоянно занимаются изучением атома, надеясь обнаружить его истинную природу и строение. К 20 веку наше понимание усовершенствовалось до такой степени, что мы смогли построить его точную модель. И за последнее десятилетие наше понимание продвинулось еще дальше, до такой степени, что мы пришли к подтверждению существования почти всех его теоретических частей.
Сегодня атомные исследования сосредоточены на изучении структуры и функций материи на субатомном уровне. Это состоит не только в идентификации всех субатомных частиц, которые, как считается, составляют атом, но и в исследовании сил, которые ими управляют. К ним относятся сильные ядерные взаимодействия, слабые ядерные взаимодействия, электромагнетизм и гравитация. Вот разбивка всего, что мы узнали об атоме на данный момент…
Структура атома:
Наша текущая модель атома может быть разбита на три составляющие части — протоны, нейтроны и электроны. Каждая из этих частей имеет соответствующий заряд: протоны несут положительный заряд, электроны имеют отрицательный заряд, а нейтроны не имеют суммарного заряда.
Модель Нильса Бора для атома азота. Фото: britannica.com В соответствии со Стандартной моделью физики элементарных частиц протоны и нейтроны составляют ядро атома, а электроны вращаются вокруг него в «облаке».
В соответствии со Стандартной моделью физики элементарных частиц протоны и нейтроны составляют ядро атома, а электроны вращаются вокруг него в «облаке».Электроны в атоме притягиваются к протонам в ядре под действием электромагнитной силы. Электроны могут уйти со своей орбиты, но только в ответ на приложенный внешний источник энергии. Чем ближе орбита электрона к ядру, тем больше сила притяжения; следовательно, тем сильнее должна быть внешняя сила, чтобы заставить электрон убежать.
Электроны обращаются вокруг ядра по нескольким орбитам, каждая из которых соответствует определенному энергетическому уровню электрона. Электрон может изменить свое состояние на более высокий энергетический уровень, поглотив фотон с достаточной энергией, чтобы перевести его в новое квантовое состояние. Точно так же электрон в более высоком энергетическом состоянии может перейти в более низкое энергетическое состояние, излучая избыточную энергию в виде фотона.

Атомы электрически нейтральны, если они имеют одинаковое количество протонов и электронов. Атомы, имеющие либо дефицит, либо избыток электронов, называются ионами. Электроны, которые находятся дальше всего от ядра, могут быть переданы другим соседним атомам или разделены между атомами. Благодаря этому механизму атомы могут связываться в молекулы и другие типы химических соединений.
Все три из этих субатомных частиц являются фермионами, классом частиц, связанных с материей, которая является либо элементарной (электроны), либо составной (протоны и нейтроны) по своей природе. Это означает, что электроны не имеют известной внутренней структуры, тогда как протоны и нейтроны состоят из других субатомных частиц. называются кварками. В атомах есть два типа кварков, которые имеют дробный электрический заряд.
Стандартная модель элементарных частиц. Предоставлено: PBS NOVA/Fermilab/Particle Data Group Протоны состоят из двух «верхних» кварков (каждый с зарядом +2/3) и одного «нижнего» кварка (-1/3), а нейтроны состоят из одного верхнего кварк и два нижних кварка.
 Это различие объясняет разницу в заряде между двумя частицами, которая соответствует заряду +1 и 0 соответственно, в то время как электроны имеют заряд -1.
Это различие объясняет разницу в заряде между двумя частицами, которая соответствует заряду +1 и 0 соответственно, в то время как электроны имеют заряд -1.Другие субатомные частицы включают лептоны, которые в сочетании с фермионами образуют строительные блоки материи. В современной модели атома шесть лептонов: электрон, мюон и тау-частицы, а также связанные с ними нейтрино. Различные разновидности лептоновых частиц, обычно называемые «ароматами», различаются по своим размерам и зарядам, что влияет на уровень их электромагнитных взаимодействий.
Кроме того, существуют калибровочные бозоны, известные как «переносчики силы», поскольку они передают физические силы. Например, глюоны ответственны за сильное ядерное взаимодействие, удерживающее кварки вместе, в то время как бозоны W и Z (все еще гипотетические) считаются ответственными за слабое ядерное взаимодействие, лежащее в основе электромагнетизма. Фотоны — это элементарная частица, из которой состоит свет, а бозон Хиггса отвечает за массу бозонов W и Z.

Атомная масса:
Большая часть массы атома приходится на протоны и нейтроны, составляющие его ядро. Электроны являются наименее массивными частицами, составляющими атом, с массой 9,11 x 10 90 112 -31 90 113 кг и размером, слишком малым для измерения современными методами. Протоны имеют массу, которая в 1836 раз больше массы электрона и составляет 1,6726×10 -27 кг, а нейтроны являются самыми массивными из трех: 1,6929×10 -27 кг (в 1 839 раз больше массы электрона). ).
Массы всех 6 ароматов кварков, с протоном и электроном (красная точка), показанными внизу слева для масштаба. Кредит: Википедия/Incnis MrsiОбщее количество протонов и нейтронов в ядре атома (называемых «нуклонами») называется массовым числом. Например, элемент Углерод-12 назван так потому, что имеет массовое число 12, полученное из его 12 нуклонов (шесть протонов и шесть нейтронов). Однако элементы также располагаются на основе их атомных номеров, которые совпадают с количеством протонов в ядре.
 В этом случае углерод имеет атомный номер 6.
В этом случае углерод имеет атомный номер 6.Реальную массу покоящегося атома очень трудно измерить, так как даже самые массивные атомы слишком легки, чтобы выразить их в обычных единицах. Поэтому ученые часто используют единую атомную единицу массы (u), также называемую дальтоном (Da), которая определяется как двенадцатая часть массы свободного нейтрального атома углерода-12, что составляет примерно 1,66×10 -27 кг.
Химики также используют моли, единицу измерения, определяемую как один моль любого элемента, всегда имеющего одинаковое количество атомов (около 6,022×10 23 ). Это число было выбрано таким образом, что если элемент имеет атомную массу 1 u, моль атомов этого элемента имеет массу, близкую к одному грамму. Из-за определения единой атомной единицы массы каждый атом углерода-12 имеет атомную массу ровно 12 u, поэтому моль атомов углерода-12 весит ровно 0,012 кг.
Радиоактивный распад:
Любые два атома с одинаковым числом протонов принадлежат к одному и тому же химическому элементу.
Схема альфа- и бета-распада двух изотопов урана. Предоставлено: energy-without-carbon.org Но атомы с одинаковым количеством протонов могут иметь разное количество нейтронов, которые определяются как разные изотопы одного и того же элемента. Эти изотопы часто нестабильны, и известно, что все изотопы с атомным номером больше 82 радиоактивны.
Но атомы с одинаковым количеством протонов могут иметь разное количество нейтронов, которые определяются как разные изотопы одного и того же элемента. Эти изотопы часто нестабильны, и известно, что все изотопы с атомным номером больше 82 радиоактивны.Когда элемент подвергается распаду, его ядро теряет энергию, испуская излучение, которое может состоять из альфа-частиц (атомов гелия), бета-частиц (позитронов), гамма-лучей (высокочастотная электромагнитная энергия). ) и конверсионные электроны. Скорость, с которой распадается нестабильный элемент, известна как его «период полураспада», который представляет собой количество времени, необходимое для того, чтобы элемент упал до половины своего первоначального значения.
На стабильность изотопа влияет соотношение протонов и нейтронов. Из 339 различных типов элементов, встречающихся в природе на Земле, 254 (около 75%) были помечены как «стабильные изотопы», то есть не подверженные распаду.
 Еще 34 радиоактивных элемента имеют период полураспада более 80 миллионов лет и также существуют со времен ранней Солнечной системы (поэтому их называют «изначальными элементами»).
Еще 34 радиоактивных элемента имеют период полураспада более 80 миллионов лет и также существуют со времен ранней Солнечной системы (поэтому их называют «изначальными элементами»).Наконец, известно, что еще 51 короткоживущий элемент встречается в природе как «дочерние элементы» (то есть ядерные побочные продукты) распада других элементов (таких как радий из урана). Кроме того, короткоживущие радиоактивные элементы могут быть результатом естественных энергетических процессов на Земле, таких как бомбардировка космическими лучами (например, углерод-14, который встречается в нашей атмосфере).
История изучения:
Самые ранние известные примеры атомной теории происходят из Древней Греции и Индии, где такие философы, как Демокрит, постулировали, что вся материя состоит из крошечных, неделимых и неразрушимых частиц. Термин «атом» был придуман в Древней Греции и породил школу мысли, известную как «атомизм». Однако эта теория была скорее философской концепцией, чем научной.
Различные атомы и молекулы, изображенные в книге Джона Дальтона «Новая система химической философии» (1808 г.). Кредит: общественное достояние
Только в 19 веке теория атомов стала научно сформулированной, когда были проведены первые научно обоснованные эксперименты. Например, в начале 1800-х годов английский ученый Джон Дальтон использовал концепцию атома, чтобы объяснить, почему химические элементы реагируют определенными наблюдаемыми и предсказуемыми способами.
Дальтон начал с вопроса о том, почему элементы реагируют в соотношениях небольших целых чисел, и пришел к выводу, что эти реакции происходят в целых числах, кратных дискретным единицам — другими словами, атомам. Проведя серию экспериментов с газами, Дальтон разработал так называемую атомную теорию Дальтона, которая остается одним из краеугольных камней современной физики и химии.
Теория сводится к пяти предпосылкам: элементы в чистом виде состоят из частиц, называемых атомами; атомы определенного элемента все одинаковы, вплоть до самого последнего атома; атомы разных элементов можно отличить по их атомному весу; атомы элементов объединяются, образуя химические соединения; атомы не могут быть ни созданы, ни уничтожены в химической реакции, всегда меняется только их группировка.

К концу 19 века ученые начали теоретизировать, что атом состоит из более чем одной фундаментальной единицы. Однако большинство ученых предполагали, что эта единица будет размером с наименьший из известных атомов — водород. А потом в 1897, в ходе серии экспериментов с использованием катодных лучей физик Дж.Дж. Томпсон объявил, что открыл элемент, который в 1000 раз меньше и в 1800 раз легче атома водорода.
Модель атома сливового пудинга, предложенная Джоном Дальтоном. Фото: britannica.comЕго эксперименты также показали, что они идентичны частицам, испускаемым фотоэлектрическим эффектом и радиоактивными материалами. Последующие эксперименты показали, что эта частица переносит электрический ток через металлические провода и отрицательные электрические заряды внутри атомов. Вот почему частица, первоначально названная «корпускулой», позже была изменена на «электрон» в честь частицы, предсказанной Джорджем Джонстоном Стони в 1874 г.
Однако Томсон также постулировал, что электроны распределены по всему атому, который представляет собой однородное море положительного заряда.
 Это стало известно как «модель сливового пудинга», которая позже оказалась ошибочной. Это произошло в 1909 году, когда физики Ганс Гигер и Эрнест Марсден (под руководством Эрнеста Резерфода) провели свой эксперимент с использованием металлической фольги и альфа-частиц.
Это стало известно как «модель сливового пудинга», которая позже оказалась ошибочной. Это произошло в 1909 году, когда физики Ганс Гигер и Эрнест Марсден (под руководством Эрнеста Резерфода) провели свой эксперимент с использованием металлической фольги и альфа-частиц.В соответствии с атомной моделью Дальтона они полагали, что альфа-частицы будут проходить прямо через фольгу с небольшим отклонением. Однако многие частицы были отклонены на углы более 90°. Чтобы объяснить это, Резерфорд предположил, что положительный заряд атома сосредоточен в крошечном ядре в центре.
В 1913 году физик Нильс Бор предложил модель, в которой электроны вращаются вокруг ядра, но могут делать это только на конечном наборе орбит. Он также предположил, что электроны могут перескакивать между орбитами, но только при дискретных изменениях энергии, соответствующих поглощению или излучению фотона. Это не только усовершенствовало предложенную Резерфордом модель, но и породило концепцию квантованного атома, в котором материя ведет себя дискретными пакетами.
Эксперимент с золотой фольгой, проведенный Гейгером, Марсденом и Резерфордом. Предоставлено: glogster.com
Разработка масс-спектрометра, который использует магнит для изменения траектории пучка ионов, позволила измерить массу атомов с повышенной точностью. Химик Фрэнсис Уильям Астон использовал этот прибор, чтобы показать, что изотопы имеют разные массы. За этим, в свою очередь, последовал физик Джеймс Чедвик, который в 1932 году предложил нейтрон как способ объяснения существования изотопов.
В начале 20 века квантовая природа атомов получила дальнейшее развитие. В 1922 году немецкие физики Отто Штерн и Вальтер Герлах провели эксперимент, в котором пучок атомов серебра был направлен через магнитное поле, которое должно было разделить пучок между направлениями углового момента (или спина) атомов.
Известный как эксперимент Штерна-Герлаха, в результате луч расщеплялся на две части в зависимости от того, направлено ли вращение атомов вверх или вниз. В 1926 января физик Эрвин Шредингер использовал идею о том, что частицы ведут себя как волны, чтобы разработать математическую модель, описывающую электроны как трехмерные волны, а не как простые частицы.

Следствием использования сигналов для описания частиц является то, что математически невозможно получить точные значения положения и импульса частицы в любой момент времени. В том же году Вернер Гейзенберг сформулировал эту проблему и назвал ее «принципом неопределенности». Согласно Гейзенбергу, для данного точного измерения положения можно получить только диапазон вероятных значений импульса, и наоборот.
Деление ядер, при котором атом урана-92 расщепляется свободным нейтроном с образованием бария и криптона. Фото: physics.stackexchange.comВ 1930-х годах физики открыли ядерное деление благодаря экспериментам Отто Гана, Лизы Мейтнер и Отто Фриша. Эксперименты Гана включали направление нейтронов на атомы урана в надежде создать трансурановый элемент. Вместо этого процесс превратил его образец урана-92 (Ur 92 ) в два новых элемента — барий (B 56 ) и криптон (Kr 27 ).
Мейтнер и Фриш проверили эксперимент и приписали его расщеплению атомов урана с образованием двух элементов с одинаковым общим атомным весом, что также привело к высвобождению значительного количества энергии за счет разрыва атомных связей.
 В последующие годы начались исследования возможной вепонизации этого процесса (т. е. ядерного оружия), что привело к созданию первых атомных бомб в США к 1945 году.
В последующие годы начались исследования возможной вепонизации этого процесса (т. е. ядерного оружия), что привело к созданию первых атомных бомб в США к 1945 году.В 1950-х годах разработка усовершенствованных ускорителей и детекторов частиц позволила ученым изучить столкновения атомов, движущихся с высокой энергией. На основе этого была разработана Стандартная модель физики элементарных частиц, которая до сих пор успешно объясняла свойства ядра, существование теоретических субатомных частиц и силы, управляющие их взаимодействием.
Modern Experiments:
Со второй половины 20-го века было сделано много новых и захватывающих открытий в области атомной теории и квантовой механики. Например, в 2012 году долгие поиски бозона Хиггса привели к прорыву, когда исследователи, работающие в Европейской организации ядерных исследований (ЦЕРН) в Швейцарии, объявили о его открытии. 900:30 Большой адронный коллайдер (БАК) в Европейской организации ядерных исследований (ЦЕРН).
 Предоставлено: home.cern
Предоставлено: home.cernВ последние десятилетия физики посвятили много времени и энергии разработке единой теории поля (также известной как Теория Великого Объединения или Теория Всего). По сути, с тех пор, как была впервые предложена Стандартная модель, ученые стремились понять, как четыре фундаментальные силы Вселенной (гравитация, сильное и слабое ядерное взаимодействие и электромагнетизм) работают вместе.
В то время как гравитацию можно понять с помощью теорий относительности Эйнштейна, а ядерные силы и электромагнетизм можно понять с помощью квантовой теории, ни одна из теорий не может объяснить все четыре силы, действующие вместе. Попытки решить эту проблему на протяжении многих лет привели к ряду предложенных теорий, от теории струн до петлевой квантовой гравитации. На сегодняшний день ни одна из этих теорий не привела к прорыву.
Наше понимание атома прошло долгий путь от классических моделей, рассматривавших его как инертное твердое тело, механически взаимодействующее с другими атомами, до современных теорий, согласно которым атомы состоят из энергичных частиц, которые ведут себя непредсказуемо.
 Хотя на это ушло несколько тысяч лет, наши знания о фундаментальной структуре всей материи значительно продвинулись вперед.
Хотя на это ушло несколько тысяч лет, наши знания о фундаментальной структуре всей материи значительно продвинулись вперед.И все же остается много тайн, которые еще предстоит разгадать. Со временем и постоянными усилиями мы, наконец, сможем раскрыть последние оставшиеся секреты атома. С другой стороны, вполне может быть, что любые новые открытия, которые мы делаем, только вызовут новые вопросы, и они могут быть еще более запутанными, чем те, которые были раньше!
Мы написали много статей об атоме для Universe Today. Вот статьи об атомной модели Джона Дальтона, атомной модели Нильса Бора, Кем был Демокрит? и Сколько атомов во Вселенной?
Если вам нужна дополнительная информация об атоме, ознакомьтесь со статьей НАСА об анализе крошечных образцов, а вот ссылка на статью НАСА об атомах, элементах и изотопах.
Мы также записали целую серию Astronomy Cast all about the Atom. Послушайте, Эпизод 164: Внутри атома, Эпизод 263: Радиоактивный распад и Эпизод 394: Стандартная модель, Бозоны.

Нравится:
Нравится Загрузка…
Современная физика. Атом
Краткая история
Наше понимание того, что такое вещи и из чего они сделаны, по понятным причинам эволюционировало с годами. Это понятно, потому что чем ближе мы смотрим на мир, тем больше нам приходится приспосабливать наши представления к законам природы. Наше понимание атомов — превосходный пример эволюции нашего понимания.
Все наше понимание атомов началось, вероятно, темной и ненастной ночью около 2400 лет назад, когда жизнерадостный греческий философ по имени Демокрит задал себе этот вопрос: как материя может быть тем, чем она является?
Демокрит предположил, что если кто-то отрежет что-то, затем снова отрежет меньший кусок, а затем снова и снова отрежет новый маленький кусочек, в конце концов он достигнет точки, в которой кусок нельзя будет уменьшить. Он назвал этот бесконечно малый кусочек атомос . Так появилась теория атома, названная в честь слова атомос .
 Atomos означает «не резать». Для Демокрита атомы были твердыми частицами всех форм и размеров, состоящими из одного и того же материала, которые могли соединяться друг с другом, образуя материю.
Atomos означает «не резать». Для Демокрита атомы были твердыми частицами всех форм и размеров, состоящими из одного и того же материала, которые могли соединяться друг с другом, образуя материю.Теперь перенесемся на две тысячи лет вперед, в прошлое, за темные века, примерно в 1800 год. Джон Далтон, своего рода гений — он стал учителем английского языка в возрасте 12 лет, прикиньте — провел множество экспериментов и пришел к выводу, что атом подобен бильярдному шару. Он утверждал, что:
- Атомы составляют всю материю.
- Атомы нельзя разделить, создать или уничтожить.
- Атомы одного и того же элемента имеют одинаковую массу и одинаковые свойства.
- Атомы объединяются, образуя различные соединения.
- Атомы перестраиваются, когда происходит химическая реакция.
Вот схема того, что он узнал о различных видах существующих атомов.
(Источник)Модель Дальтона представляет собой примитивную Периодическую таблицу элементов.
 Хотя это кажется нам неполным, но не было бы намного легче изучать физику и химию, если бы модель Дальтона была достаточно хороша? Нам не нужно было бы думать о зарядах или субатомных частицах внутри атомов или каких-либо вариациях.
Хотя это кажется нам неполным, но не было бы намного легче изучать физику и химию, если бы модель Дальтона была достаточно хороша? Нам не нужно было бы думать о зарядах или субатомных частицах внутри атомов или каких-либо вариациях.Кто-то сказал обвинения? В 1897 году, экспериментируя с электронно-лучевой трубкой, Джозеф Джон Томсон обнаружил отрицательно заряженную частицу. Он назвал это корпускулой . В конце концов, он был переименован в электрон.
Томпон представил себе эти крошечные частицы, встроенные в атом, точно так же, как шоколадная стружка в шоколадном печенье или вздутие сливового пудинга. Поскольку атом нейтрален, он решил, что поверхность пудинга заряжена положительно, а эти маленькие отрицательные изюминки внутри делают весь пудинг нейтральным. Это известно как модель сливового пудинга Дж. Дж. Томсона.
(Источник)Что дальше? Примерно в 1910 году, через несколько лет после открытия отрицательных зарядов внутри атомов, мистер Эрнест Резерфорд решил проверить модель сливового пудинга.
 Резерфорд полагал, что если бы атом был подобен сливовому пудингу, то его масса была бы распределена равномерно. Чтобы проверить это, Резерфорд выстрелил альфа-частицами, или α -частицами (атомы гелия, лишенные своего электрона), через тонкий золотой алюминиевый лист. Резерфорд предположил, что если масса атома распределена равномерно, то положительно заряженные α -частицы пронеслись бы сквозь наполненный электронами сливовый пудинг, отклонившись или рассеяв максимум на несколько градусов.
Резерфорд полагал, что если бы атом был подобен сливовому пудингу, то его масса была бы распределена равномерно. Чтобы проверить это, Резерфорд выстрелил альфа-частицами, или α -частицами (атомы гелия, лишенные своего электрона), через тонкий золотой алюминиевый лист. Резерфорд предположил, что если масса атома распределена равномерно, то положительно заряженные α -частицы пронеслись бы сквозь наполненный электронами сливовый пудинг, отклонившись или рассеяв максимум на несколько градусов.К его большому удивлению, хотя многие α -частицы прошли прямо через золотую фольгу, некоторые разлетелись под углами больше 90 градусов. Не только это, но и некоторые α -частиц отскочили прямо назад под углом 180 o , прекрасный пример обратного рассеяния .
Цитируя Резерфорда: «Это было самое невероятное событие, которое когда-либо случалось со мной в моей жизни. Поразмыслив, я понял, что это рассеяние назад должно быть результатом единичного столкновения, и когда я произвел расчеты, то увидел, что невозможно получить что-либо такого порядка величины, если не взять систему, в которой большая часть Масса атома была сосредоточена в крошечном ядре Именно тогда у меня возникла идея атома с крошечным массивным центром, несущим заряд 1 ».

Перейдите сюда, чтобы узнать больше об эксперименте Резерфорда, но достаточно сказать, что обратное рассеяние привело Резерфорда к выводу, что большая часть массы атома сосредоточена в массивном центре, который мы теперь называем ядром. центр заряжен положительно. Он также понял, что большая часть атома представляет собой пустое пространство. заряженные «электронные кольца», как назвал их Резерфорд.0030
Введите сюда физика по имени Нильс Бор. Бор присоединился к лаборатории Резерфорда в 1912 году. Зная о квантовой механике, Бор решил, что атом следует рассматривать как мини-солнечную систему.
Вместо планет, вращающихся вокруг Солнца, удерживаемых гравитационной силой, отрицательные электроны вращаются вокруг ядра на разных расстояниях без потери энергии, удерживаемые электрической силой 2 , притягивающей их к положительному центру. Однако, в отличие от классической механики, каждый атомный уровень или орбиталь имеет фиксированную энергию, определяемую квантовой механикой 9.
 0112 3 . Те, что уютно живут рядом с ядром, более тесно связаны, чем те, кто далеко-далеко.
0112 3 . Те, что уютно живут рядом с ядром, более тесно связаны, чем те, кто далеко-далеко.В то время как ученые знали, что центральный заряд ядра варьируется в зависимости от элемента, именно Резерфорд назвал самое маленькое положительное ядро протоном в 1920 году, изучая водород, самый легкий элемент. «Протон» по-гречески означает «первый».
Структура атома снова изменилась с появлением на сцене Джеймса Чедвика в 1932 году.
Чедвик заметил, что атомы одного и того же элемента часто имеют разные свойства. Это означало что-то должно было отличаться между этими атомами, и это что-то не могло быть ни протоном, ни электроном, потому что изменение протонов полностью меняет элемент, а изменение электронов просто меняет суммарный заряд атома. Он пришел к выводу, что внутри ядра должен находиться другой тип электрически нейтральных частиц, который он назвал нейтроном. Затем данный элемент может варьироваться в зависимости от количества нейтронов или общего количества нуклонов.
 Нуклоны — это все частицы в ядре, как протоны, так и нейтроны.
Нуклоны — это все частицы в ядре, как протоны, так и нейтроны.В то время элементы одного и того же атома, но с разными свойствами, назывались изотопами , и это название прижилось. Каждый изотоп элемента имеет одинаковое количество протонов, количество которых определяет, какой это элемент, поэтому у них разное количество нейтронов, которые изменяют свойства элемента.
С другой стороны, изотонов — это атомы с одинаковым количеством нейтронов, но разным количеством протонов. Это делает изотоны набором различных элементов с одинаковым количеством общих нейтронов.
Атомная конфигурация
К этому моменту нашей жизни мы неизбежно сталкивались с периодической таблицей 4 . Нет, мы не собираемся изучать каждый элемент, свойство и число на этой диаграмме. Это для урока химии. В современной физике нам нужно знать всего несколько вещей: массовое число, атомный номер и символ элемента.
Стандартная форма записи элемента .
 Здесь X — элемент, A — массовое число, а Z — это атомный номер. Атомный номер Z — это ваше количество протонов, а массовое число A — это количество нуклонов.
Здесь X — элемент, A — массовое число, а Z — это атомный номер. Атомный номер Z — это ваше количество протонов, а массовое число A — это количество нуклонов.Почему мы называем A массовым числом ? Это потому, что он представляет массу ядра в атомных единицах массы (а.е.м.), где одна единица а.е.м., u, определяется как масса нейтрона ( m n ) или протона ( m p ). ). Массы протона и нейтрона почти одинаковы. Технически говоря, они имеют массы 1,007825 u и 1,008665 u соответственно. Математически 1 u = 1,66 × 10 -27 кг, значит м n ~ м р = 1 u = 1,66 × 10 -27 кг.
Электроны тоже имеют массу, но она намного меньше, чем масса электрона или протона. Мы говорим waaaaay немного. Масса электрона m e равна 5,49 × 10 -4 ед. Это тысячные доли массы протона, или 9,11 × 10 -31 кг.
 Да, электронов практически не существует.
Да, электронов практически не существует.Используя уравнение Эйнштейна 5 , E = m c 2 , мы также можем записать атомную единицу массы в эквивалентных единицах , где . Это означает, что масса протона равна , масса нейтрона равна , а масса электрона равна .
Модель Бора
Вернемся к квантованию энергии, отличительному признаку квантовой физики, введенному в модель атома Нильсом Бором.
Незадолго до появления модели Бора преобладающей моделью атома была модель Резерфорда, в которой облако отрицательно заряженных электронов вращается вокруг небольшого объема с положительным зарядом в центре (ядре). Однако с этой моделью возникла серьезная проблема. Согласно классической механике, когда заряженная частица ускоряется, она излучает энергию в виде электромагнитного излучения. Почему же тогда движущиеся по орбите электроны не теряют энергию и не ускоряются по направлению к ядру? Как возможно, что атомы остаются стабильными?
В качестве решения Бор предложил новую модель, в которой электронам необходимо вращаться на определенном дискретном наборе расстояний от центра атома. С каждым из этих расстояний или уровней связана определенная энергия, и энергия электрона может измениться только в том случае, если он «перепрыгнет» на другой уровень.
С каждым из этих расстояний или уровней связана определенная энергия, и энергия электрона может измениться только в том случае, если он «перепрыгнет» на другой уровень.Одним из следствий этого является то, что угловой момент электрона L может принимать только определенный набор дискретных значений, которые Бор определил как n × (где n — целое положительное число, а × — постоянная Планка).
Вопрос, над которым мы собираемся работать, таков: что именно представляют собой эти энергетические уровни? Можем ли мы написать выражение для энергии электрона на данном уровне? И какое это имеет отношение к цене сыра?Во-первых, радиусы орбит
Во-первых, давайте определим, что такое радиусы орбит.
Для простоты предположим, что орбиты электронов круговые и что они вращаются с постоянной скоростью вокруг ядра. Единственная сила, действующая на электрон, — это кулоновская сила, действующая на ядро (сейчас мы представим, что существует только один электрон). Следовательно, по второму закону Ньютона
Следовательно, по второму закону Ньютонагде:
m — масса электрона,
v — скорость электрона,
r — расстояние между электроном и центром атома,
Z — атомный номер (число протонов) атома,
e — элементарный заряд, а
ε 0 — константа диэлектрической проницаемости вакуума (приблизительно 8,854 × 10 -12 Ф/м).Запишем это через величину углового момента L вместо v . Мы хотим квантовать радиусы, и пока единственное, что мы знаем о квантовании — и как оно квантуется — это угловой момент благодаря Бору. Поскольку орбиты круговые и электроны движутся с постоянной скоростью, L = | r × р| = | r × m v | = п.м. , или v = л/ ( п.м. ). Приведенное выше уравнение тогда становится
Solving for r gives us
Recalling how angular momentum of the electron is quantized ( L = nħ ), this gives us that the radius of the n th orbital is
(Здесь мы добавили небольшой индекс « n » к r , чтобы подчеркнуть, что r — это последовательность, проиндексированная n , положительное целое число, нумерующее орбитали.
 ) Итак, теперь мы знаем радиус из n th орбиталь с точки зрения ничего, кроме набора констант: Z , х , ε 0 , e и м 9 .
) Итак, теперь мы знаем радиус из n th орбиталь с точки зрения ничего, кроме набора констант: Z , х , ε 0 , e и м 9 .Радиус нижней орбитали ( n = 1) атома водорода ( Z = 1) имеет специальное имя и символ: радиус Бора (вставьте сюда драматическую музыку):
Наконец, энергетические уровни
Полная энергия E электрона равна сумме кинетической энергии K и потенциальная энергия U .
Кинетическая энергия K равна
, где мы снова переписали наши выражения через величину углового момента L вместо скорости v .
И не забываем, что по закону Кулона потенциальная энергия U равна
Итак, полная энергия E = K + U равна
0029 Подключение нашего результата для R N , мы получаем энергию N TH Уровень E N ,, который упрощает
. as
as
Где называется энергия Ридберга, названная в честь шведского физика Йоханнеса Ридберга. Для атома водорода ( Z = 1) R E = 13,6 эВ [упражнение, которое нужно выполнить, когда скучно ждать автобуса: подтвердите это значение с помощью калькулятора и будьте осторожны с единицами измерения]. Это хорошо известное значение, так как это основное энергетическое состояние (самое низкое энергетическое состояние) водорода.
Еще нужно знать, что n = 1 имеет место только для 2 электронов, n = 2 и n = 3 имеют место для 8, n = 4 или 5 имеют место для 18 и т. д. , Видите образец? Взгляните на периодическую таблицу элементов, и картина станет ясной. Уровень n соответствует номеру строки.
Нам нравится думать об электронах как об учениках на школьных танцах. Студенты и электроны обычно двигаются по своим кругам, занимаясь своими делами, но если ди-джей играет песню с большим количеством энергии, то студенты и электроны подхватывают эту энергию и вырываются из своих обычных кругов, чтобы занять возбужденное состояние. Однако, как только песня заканчивается и энергии больше нет, ученики и электроны возвращаются к своим обычным кругам. Единственная разница между танцующими учениками и электронами заключается в том, что электроны возвращают эту энергию, когда они переходят из своего возбужденного состояния в свое «нормальное» состояние.
Однако, как только песня заканчивается и энергии больше нет, ученики и электроны возвращаются к своим обычным кругам. Единственная разница между танцующими учениками и электронами заключается в том, что электроны возвращают эту энергию, когда они переходят из своего возбужденного состояния в свое «нормальное» состояние.
Если электрон поглощает энергию, он переходит на более высокую орбиту; если он высвобождает энергию, он падает на более низкую орбиталь. Это факт, и поскольку энергия квантуется, мы можем точно сказать, сколько энергии.
Давайте рассмотрим n = 1 и n = 2. Теперь мы знаем, что электрон, вращающийся вокруг первого уровня атома водорода, имеет энергию E 1 = -13,6 эВ. Это. Мы могли вычислить, что E 2 = -3,4 эВ таким же образом, как мы рассчитали Е 1 . Разность энергий этих двух орбиталей Δ E определяется выражением Δ E = E 2 − E 1 = -3,4 – (-13,6) = 10,2 эВ. Именно столько энергии выделит электрон, вращающийся вокруг уровня n = 2, если он упадет до уровня n = 1.
Именно столько энергии выделит электрон, вращающийся вокруг уровня n = 2, если он упадет до уровня n = 1.
. Почему на первом уровне должно быть место для этого дополнительного электрона? Время историй.
Допустим, ион водорода, плывущий по Вселенной и занимающийся своими делами, имеет две полные орбиты, n = 1 и n = 2, когда в него врезается фотон. Этот фотон с энергией E = 15,6 эВ сталкивается непосредственно с электроном, счастливо вращающимся вокруг ядра с координатой n = 1. Мы думаем, что электрон с радостью поглотит всю эту энергию и оторвется от свободного агента, к сожалению, иону водорода это не нравится. Мы не можем забывать, что атомам нравится иметь полный первый энергетический уровень, но электрон должен что-то делать с этой дополнительной энергией, поэтому вместо того, чтобы ставить электрон на n = 1 свободен, он заставляет электрон, находящийся в n = 2, опуститься до n = 1, что, как мы подсчитали, высвобождает 10,2 эВ. Единственное, что освобождает атом водорода, — это новый фотон с энергией E = 10,2 эВ. Эта дополнительная энергия излучается в виде еще одного фотона в рентгеновском диапазоне частот.
Единственное, что освобождает атом водорода, — это новый фотон с энергией E = 10,2 эВ. Эта дополнительная энергия излучается в виде еще одного фотона в рентгеновском диапазоне частот.
То, что происходит с новым фотоном, очень круто, но не то, что происходит в атоме водорода, а то, что происходит в наших глазных яблоках. Наши глазные яблоки воспринимают фотоны, подобные тем, которые испускает атом водорода, и думают о цвете. Цвета, которые мы видим, связаны с электронами, заменяющими другие на энергетических уровнях внутри атомов. Цвет — понятие относительное, потому что частота может быть где угодно в электромагнитном спектре, но мы замечаем только те, что в видимом диапазоне.
Каждый цвет имеет свою собственную частоту, которую мы можем рассчитать с помощью , где h — постоянная Планка, f — частота фотона, а λ — его длина волны. Фотон с энергией E = 10,2 эВ, испущенный атомом водорода, вылетит с частотой = 2,47 × 10 15 Гц. Эта частота соответствует «цвету» света, излучаемого, когда электрон теряет энергетический уровень, и эта конкретная частота находится в дальнем ультрафиолетовом диапазоне частот, поэтому мы не сможем ее увидеть.
Эта частота соответствует «цвету» света, излучаемого, когда электрон теряет энергетический уровень, и эта конкретная частота находится в дальнем ультрафиолетовом диапазоне частот, поэтому мы не сможем ее увидеть.
Помните, что электрон-вольт — очень удобная единица измерения, но не стандартная, поэтому преобразование в джоули необязательно.
Взгляните на следующую картинку. Да, это как в начале раздела, но с добавлением фотона.
Фотон, выбивающий электрон из его оболочки, представляет собой явление, подобное фотоэффекту. Даже если рассматриваемый атом не является металлом, на который падает свет, фотон нужной энергии или частоты может освободить электрон с орбиты. Иногда этот процесс называют вынужденным излучением, иногда спонтанным излучением. Что бы это ни было, в том числе и в случае фотоэффекта, энергетический процесс один и тот же: атом становится ион , потеряв электрон, несущий суммарный положительный заряд вместо нейтрального заряда.
Если бы свет, падающий на атом кислорода, выбил один из его валентных электронов, то мы могли бы записать его с положительным зарядом. Как это: . Свободные электроны из-за своего отрицательного заряда недолго остаются в одиночестве. Они тоже (электрически) привлекательны. Они соединяются с другими атомами, обычно с положительными ионами, из-за того, что все противоположности притягиваются.
Ионы тоже могут иметь дополнительные электроны, просто для ясности, но эти отрицательные ионы не образуются, удаляя электроны с их орбиталей, а добавляя больше электронов на орбитали атома, чем требуется для электрической нейтральности. Энергия, необходимая для создания иона, называется — приготовьтесь — 9.0081 энергия ионизации .
В случае более крупных атомов с гораздо большим количеством электронов электроны, занимающие валентную оболочку (электронную оболочку, наиболее удаленную от ядра), являются более легкой мишенью, чем электроны, занимающие ближайшую к ядру оболочку. Энергия входящего фотона также важна: фотон с небольшой энергией или небольшим импульсом, поскольку E = пк , не сильно изменится для электрона, которому требуется больше энергии для движения.
Энергия входящего фотона также важна: фотон с небольшой энергией или небольшим импульсом, поскольку E = пк , не сильно изменится для электрона, которому требуется больше энергии для движения.
Однако чаще всего электрон меняет энергетические уровни, а не покидает атом полностью. Когда он меняет энергетические уровни, электрон остается в атоме, но в более возбужденном состоянии, чем раньше, и он может вернуться на самый низкий возможный энергетический уровень, испустив фотон, соответствующий разнице в энергии, которая существует между энергетическими уровнями.
Мы думаем, что электроны будут брать любую энергию, которую им дадут, пока они связаны с атомом, но это не так. Электроны разборчивы — для них либо все, либо ничего. Если появляется фотон с меньшей энергией, чем энергия связи электрона, электрон говорит: «Поговори с рукой».
Фотон должен предложить точное количество энергии, чтобы поднять электрон на новый разрешенный энергетический уровень — помните, они квантованы — или достаточно энергии, чтобы ионизировать атом. В противном случае они вообще не взаимодействуют. Да, они очень разборчивы. Чем выше энергия падающего фотона, тем больше у электрона шансов стать свободным агентом.
В противном случае они вообще не взаимодействуют. Да, они очень разборчивы. Чем выше энергия падающего фотона, тем больше у электрона шансов стать свободным агентом.
С какой энергией n = 1 электрон покинет атом водорода с помощью фотона E = 15,6 эВ? Ответ заключается в разнице между количеством энергии, связывающей электрон с атомом, — мы называем ее энергией связи 9 .0033 ϕ — и энергия падающего фотона E . Энергия связи в случае Водорода для электрона на уровне n = 1 равна . В этом случае E e = E − ϕ = 15,6 − 13,6 = 2 эВ. Эти 2 эВ — это вся кинетическая энергия, которая, как мы знаем, — это просто энергия скорости.
Уравнение E e = E − ϕ на самом деле может быть записано в виде неравенства, поскольку электрон никогда не убежит, если E ≥ ϕ так, что энергия вылетевшего электрона E e положительна. Обратите внимание, что в этом уравнении E e мы не ставим еще один отрицательный знак перед энергией связи. Если бы мы это сделали, то получили бы 29,2 эВ, что нарушает закон сохранения энергии. У нас этого не может быть.
Обратите внимание, что в этом уравнении E e мы не ставим еще один отрицательный знак перед энергией связи. Если бы мы это сделали, то получили бы 29,2 эВ, что нарушает закон сохранения энергии. У нас этого не может быть.
Энергия связи более крупных атомов относится к энергиям связи различных электронов валентной оболочки, поэтому мы должны указать, что n мы говорим о том, чтобы найти заданную энергию связи. Иногда у фотона есть удельная энергия, необходимая для удаления электрона со средней орбитали. В этом случае пустое место автоматически заполняется электроном более высокого уровня. Он прыгнет вниз, испустит фотон с энергией Δ E , что вызовет целую цепную реакцию других электронов более высокого уровня, перестраивающихся на более низкие уровни при испускании фотонов. Это известно как эффект Оже, и да, это очень круто.
Выше приведены несколько энергетических переходов, возможных для электрона атома водорода. Различные элементы имеют разные энергетические уровни и, следовательно, излучают разные цвета, соответствующие E = hf .
Различные элементы имеют разные энергетические уровни и, следовательно, излучают разные цвета, соответствующие E = hf .
Подходящим термином для состояния электрона с повышенными энергетическими уровнями является возбужденное состояние . Это относится к любому состоянию, которое не является его самым низким возможным энергетическим уровнем. Когда электроны занимают самые низкие энергетические орбитали, атом находится в основном состоянии. Напомним, что для атомов Z > 2, могут быть заполнены как n = 1 уровень, так и n = 2 и даже больше уровней.
А ионизированный атом? Атом довольно скоро захватывает еще один свободный электрон, такова мощность электрической силы. Для малых частиц, таких как электроны и атомы, электрическая сила преобладает над гравитацией, потому что их массы слишком малы, чтобы на них могла сильно влиять сила гравитации. Когда он захватывает электрон, этот электрон испускает фотон света, соответствующий изменению его энергетического уровня.
Атомные спектры
С электромагнитным спектром мы уже встречались в оптике 8 . Рад снова видеть вас, сэр.
Видимая часть электромагнитного спектра, как мы помним, соответствует радуге цветов, исходящих от света, распространяющегося на разных длинах волн 9 . С нашим новым пониманием орбитальных энергетических уровней мы теперь готовы встретиться с двумя другими типами электромагнитных спектров: спектрами поглощения и излучения. Эти два спектра относятся к цветам (длинам волн), поглощаемых или излучаемых атомами, что соответствует разнице энергий между их энергетическими уровнями.
Электроны в холодном разбавленном газе летаргичны в том смысле, что они стабильны с электронами на самых низких возможных энергетических уровнях, но если мы засыпаем их сгустком энергии, что произойдет?
Если к газу добавить энергию, его электроны возбудится в прямом и переносном смысле. Электроны будут поглощать фотоны, перескакивать на другие атомные уровни, скажем, с n = 2 на n = 3, и отражать все остальные фотоны.
Сколько энергии поглотят электроны? Разность энергий между двумя атомными уровнями или Δ E = E 3 − E 2 . Эта разница в энергии определяет цвет света как E = hf , или .
Поскольку часть фотонов будет поглощена, мы не увидим полной волшебной радуги в спектрах поглощения. Мы увидим большую часть радуги, но с темными (пустыми) линиями, соответствующими поглощенным фотонам. Поглощенные фотоны позже будут излучаться в случайных направлениях.
Как мы можем догадаться и как мы видим из изображения в верхней части страницы, этих фотонов относительно немного и они далеко друг от друга по сравнению со всем электромагнитным спектром. Спектр излучения конкретного атома прямо противоположен его спектру поглощения.
Каждый атом имеет уникальный спектр поглощения. Это означает, что мы можем сказать, из каких атомов или элементов состоит газ, посветив на него светом и посмотрев на отсутствующие темные линии.
Астрономы постоянно используют этот метод при изучении экзопланет, чтобы выяснить состав их атмосфер, а до этого этот метод использовался для изучения солнца. В 1814 году физик Йозеф фон Фраунгофер решил изучить солнечный спектр. Он заметил, что в солнечном свете появляется несколько темных линий, и измерил длину волны каждой из них. Сегодня они известны как линии Фраунгофера. Каждая серия линий соответствует элементу на Солнце.
Спектр излучения также создается из-за орбитальной энергии атома, только в обратном порядке. В случае спектров излучения свет проходит через горячий газ (как и раньше), а поглощение происходит, когда электроны переходят на более высокий уровень (точно так же, как и раньше). Однако за поглощением быстро следует испускание, когда электрон переходит из более высокого энергетического состояния в более низкое энергетическое состояние, например, из n = 3 в n = 2, когда это происходит, фотонов с определенной энергией, Δ E , излучаются эти испускаемые фотоны, что фиксирует спектр излучения.



 Принято (но несколько вводит в заблуждение) описывать объем пространства, в котором электроны атома имеют значительную вероятность быть обнаруженными, как электронное облако . Последний не имеет определенной внешней границы, как и атом. Радиус атома должен быть определен произвольно, например граница, в которой электрон может быть найден с вероятностью 95%. Атомные радиусы обычно составляют 30-300 пм.
Принято (но несколько вводит в заблуждение) описывать объем пространства, в котором электроны атома имеют значительную вероятность быть обнаруженными, как электронное облако . Последний не имеет определенной внешней границы, как и атом. Радиус атома должен быть определен произвольно, например граница, в которой электрон может быть найден с вероятностью 95%. Атомные радиусы обычно составляют 30-300 пм. Относительные заряды -1 и +1 приписаны электрону и протону соответственно.
Относительные заряды -1 и +1 приписаны электрону и протону соответственно. {208}Pb\). 9{81}Бр}\).
{208}Pb\). 9{81}Бр}\).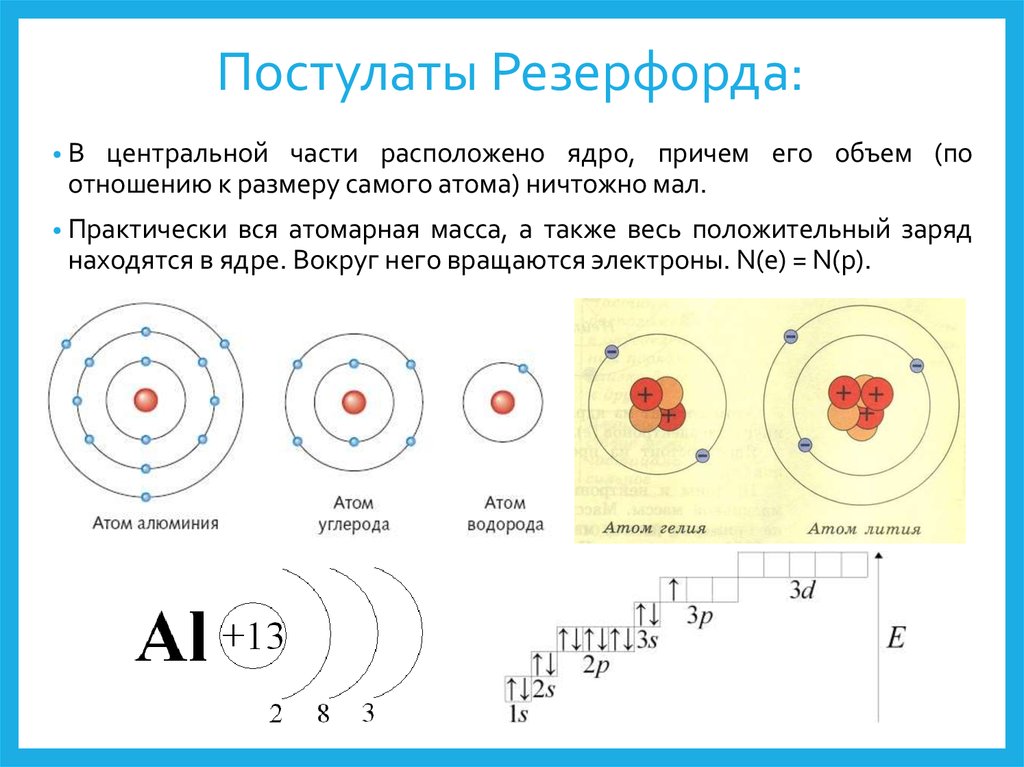
 Я перечислил пять, и все они являются «современными» в том смысле, что были разработаны в прошлом столетии.
Я перечислил пять, и все они являются «современными» в том смысле, что были разработаны в прошлом столетии.
 В звездах температура настолько высока (15 миллионов градусов и более), что протоны движутся достаточно быстро, чтобы преодолеть электромагнитную силу отталкивания и время от времени сталкиваться с другими протонами и прилипать к ним. Когда это происходит, один из протонов превращается в нейтрон [Концепция 3] и образует дейтерий (один электрон, вращающийся вокруг пары протон-нейтрон). Два атома дейтерия также могут столкнуться друг с другом и произвести атом гелия с двумя протонами и двумя нейтронами, слипшимися благодаря сильному взаимодействию. Эта четверка является ядром атома гелия с +2 единицами положительного заряда. Два электрона вращаются вокруг этого ядра, образуя нейтральный атом.
В звездах температура настолько высока (15 миллионов градусов и более), что протоны движутся достаточно быстро, чтобы преодолеть электромагнитную силу отталкивания и время от времени сталкиваться с другими протонами и прилипать к ним. Когда это происходит, один из протонов превращается в нейтрон [Концепция 3] и образует дейтерий (один электрон, вращающийся вокруг пары протон-нейтрон). Два атома дейтерия также могут столкнуться друг с другом и произвести атом гелия с двумя протонами и двумя нейтронами, слипшимися благодаря сильному взаимодействию. Эта четверка является ядром атома гелия с +2 единицами положительного заряда. Два электрона вращаются вокруг этого ядра, образуя нейтральный атом.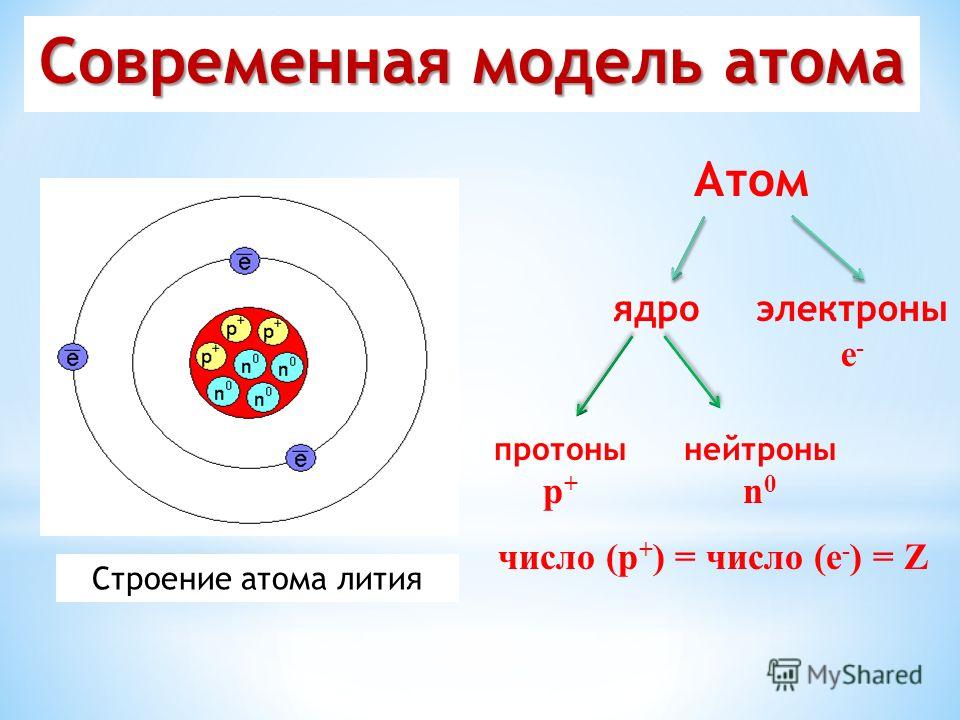 Следовательно, все атомы должны иметь одинаковое количество протонов и электронов. Нейтроны помогают удерживать протоны в ядре вместе, но по мере увеличения числа положительных протонов отталкивающий электромагнитный заряд в конечном итоге преодолевает сильное взаимодействие. Когда число протонов в ядре достигает сотни, ядра распадаются сами по себе, независимо от того, сколько нейтронов добавляется к смеси. Атомные орбиты аналогичны нашей Солнечной системе, где ядро играет роль солнца, а электроны выполняют роль планет. Солнце намного тяжелее планет, так же как протоны и нейтроны намного тяжелее электронов. Но есть несколько важных различий между Солнечной системой и атомами. Планеты могут находиться на любом расстоянии от Солнца, но электроны могут падать только на особые орбиты [Концепция 4], которые имеют заданные расстояния до ядра. Радиусы этих орбит находятся в соотношении 1:4:9.:16:25. Кроме того, в Солнечной системе на каждой орбите может находиться любое количество планет (или спутников).
Следовательно, все атомы должны иметь одинаковое количество протонов и электронов. Нейтроны помогают удерживать протоны в ядре вместе, но по мере увеличения числа положительных протонов отталкивающий электромагнитный заряд в конечном итоге преодолевает сильное взаимодействие. Когда число протонов в ядре достигает сотни, ядра распадаются сами по себе, независимо от того, сколько нейтронов добавляется к смеси. Атомные орбиты аналогичны нашей Солнечной системе, где ядро играет роль солнца, а электроны выполняют роль планет. Солнце намного тяжелее планет, так же как протоны и нейтроны намного тяжелее электронов. Но есть несколько важных различий между Солнечной системой и атомами. Планеты могут находиться на любом расстоянии от Солнца, но электроны могут падать только на особые орбиты [Концепция 4], которые имеют заданные расстояния до ядра. Радиусы этих орбит находятся в соотношении 1:4:9.:16:25. Кроме того, в Солнечной системе на каждой орбите может находиться любое количество планет (или спутников). Например, в поясе астероидов есть тысячи планет (или «астероидов»), вращающихся вокруг Солнца по практически одной и той же орбите. Но атомные орбиты подобны комнатам с несколькими кроватями, и как только они заполнены, дверь закрывается, и другие электроны должны найти место на других (незаполненных) орбитах [Концепция 5].
Например, в поясе астероидов есть тысячи планет (или «астероидов»), вращающихся вокруг Солнца по практически одной и той же орбите. Но атомные орбиты подобны комнатам с несколькими кроватями, и как только они заполнены, дверь закрывается, и другие электроны должны найти место на других (незаполненных) орбитах [Концепция 5].
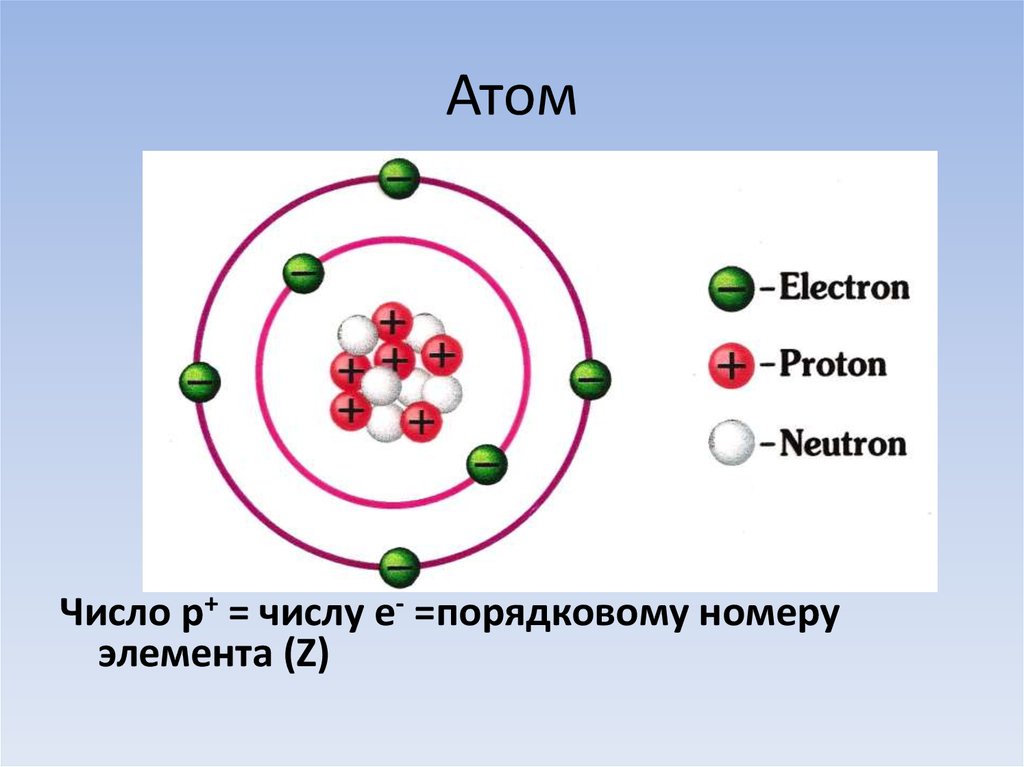 .
.
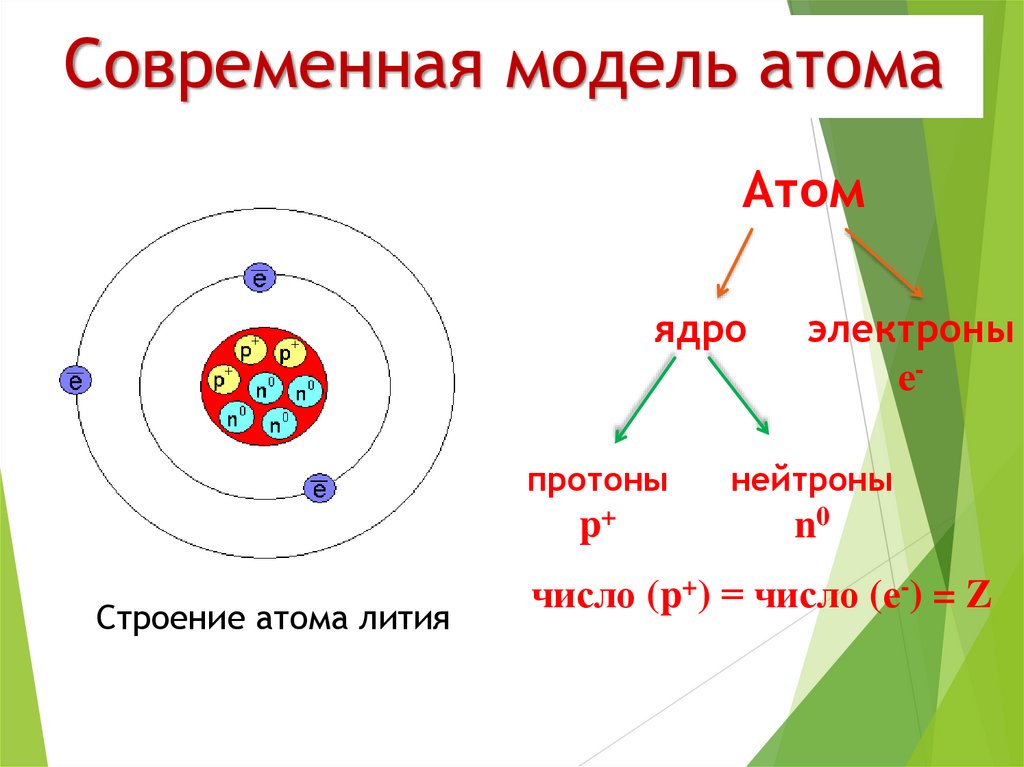



 Томсон предложил модель «сливовый пудинг». В этой модели отрицательные заряды — электронов, (сливы) — были окружены положительными зарядами (пудинг), заполняя объем атома.
Томсон предложил модель «сливовый пудинг». В этой модели отрицательные заряды — электронов, (сливы) — были окружены положительными зарядами (пудинг), заполняя объем атома.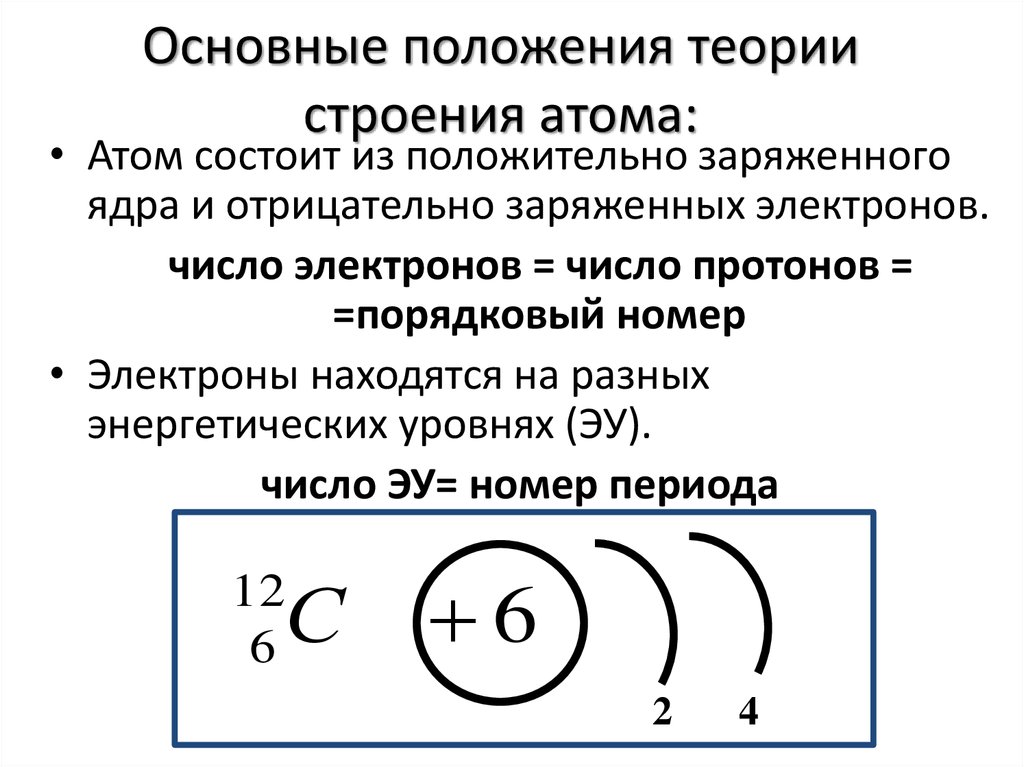 Во-вторых, атом излучает только определенное электромагнитное излучение, не континуум всех частот.
Во-вторых, атом излучает только определенное электромагнитное излучение, не континуум всех частот. Свет от лампочки или солнца образует непрерывный спектр — цветов радуги. Когда свет непрерывного спектра проходит через холодный газ, газ поглощает те же длины волн, которые он излучает при возбуждении, что проявляется в виде набора черных линий в непрерывном спектре. Черные линии называются спектр поглощения .
Свет от лампочки или солнца образует непрерывный спектр — цветов радуги. Когда свет непрерывного спектра проходит через холодный газ, газ поглощает те же длины волн, которые он излучает при возбуждении, что проявляется в виде набора черных линий в непрерывном спектре. Черные линии называются спектр поглощения .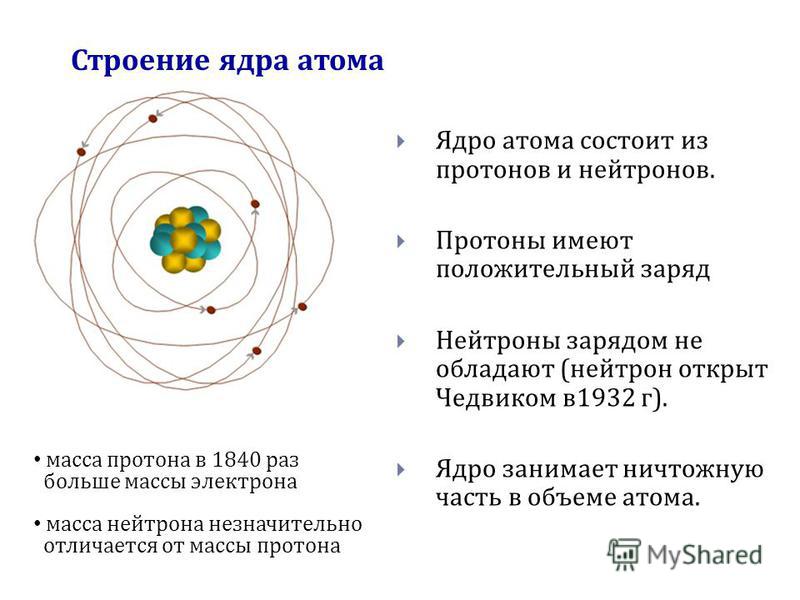
 Значение основного состояния водорода составляет -13,6 электронвольт, что прекрасно согласуется с экспериментально наблюдаемым водородом 9.0081 энергия ионизации — энергия, необходимая для отрыва электрона в основном состоянии от атома.
Значение основного состояния водорода составляет -13,6 электронвольт, что прекрасно согласуется с экспериментально наблюдаемым водородом 9.0081 энергия ионизации — энергия, необходимая для отрыва электрона в основном состоянии от атома.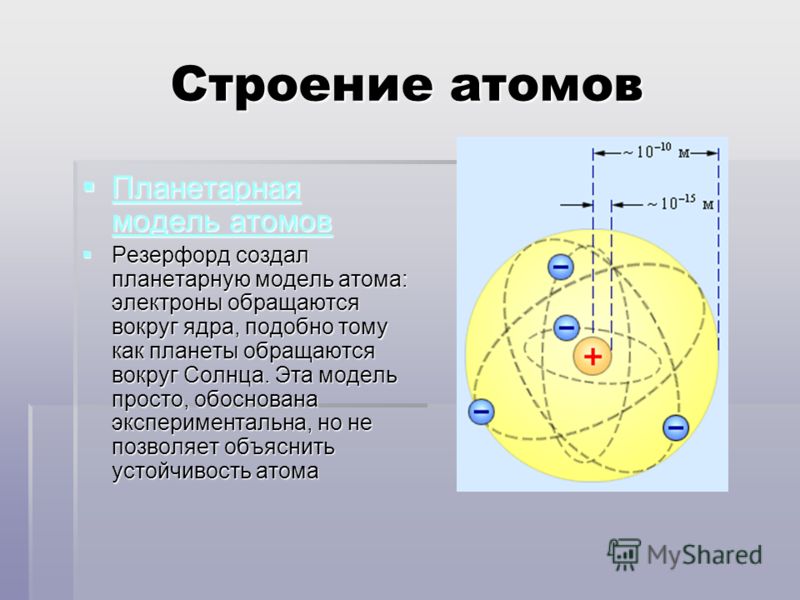
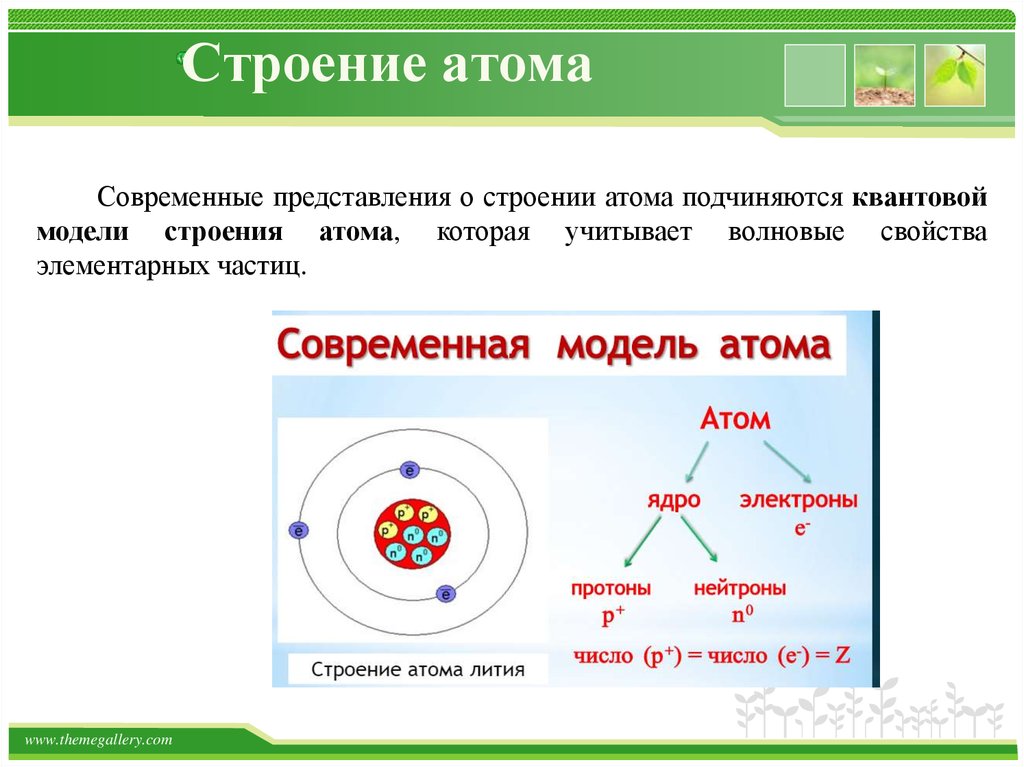

 В соответствии со Стандартной моделью физики элементарных частиц протоны и нейтроны составляют ядро атома, а электроны вращаются вокруг него в «облаке».
В соответствии со Стандартной моделью физики элементарных частиц протоны и нейтроны составляют ядро атома, а электроны вращаются вокруг него в «облаке».
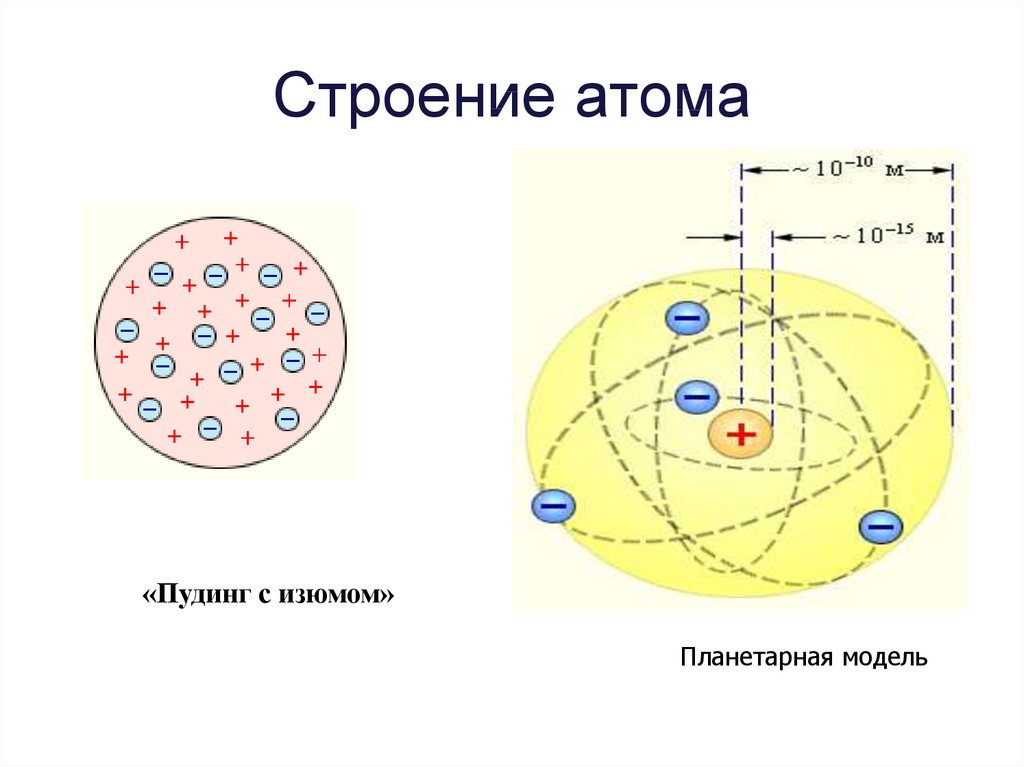 Это различие объясняет разницу в заряде между двумя частицами, которая соответствует заряду +1 и 0 соответственно, в то время как электроны имеют заряд -1.
Это различие объясняет разницу в заряде между двумя частицами, которая соответствует заряду +1 и 0 соответственно, в то время как электроны имеют заряд -1.
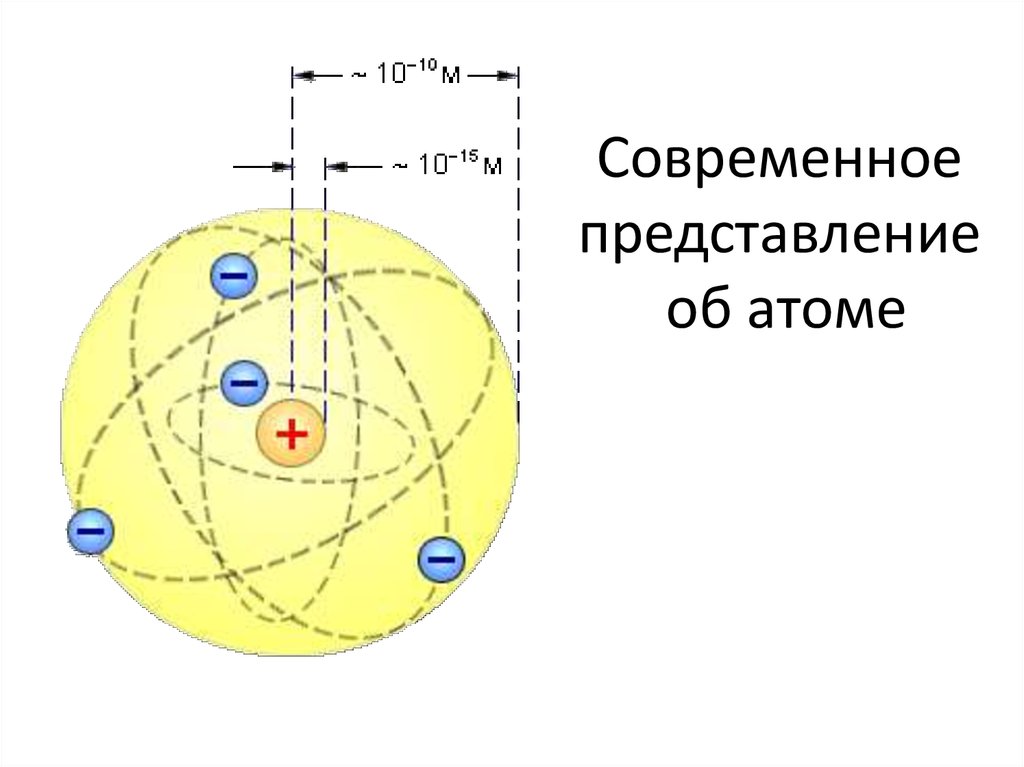 В этом случае углерод имеет атомный номер 6.
В этом случае углерод имеет атомный номер 6.