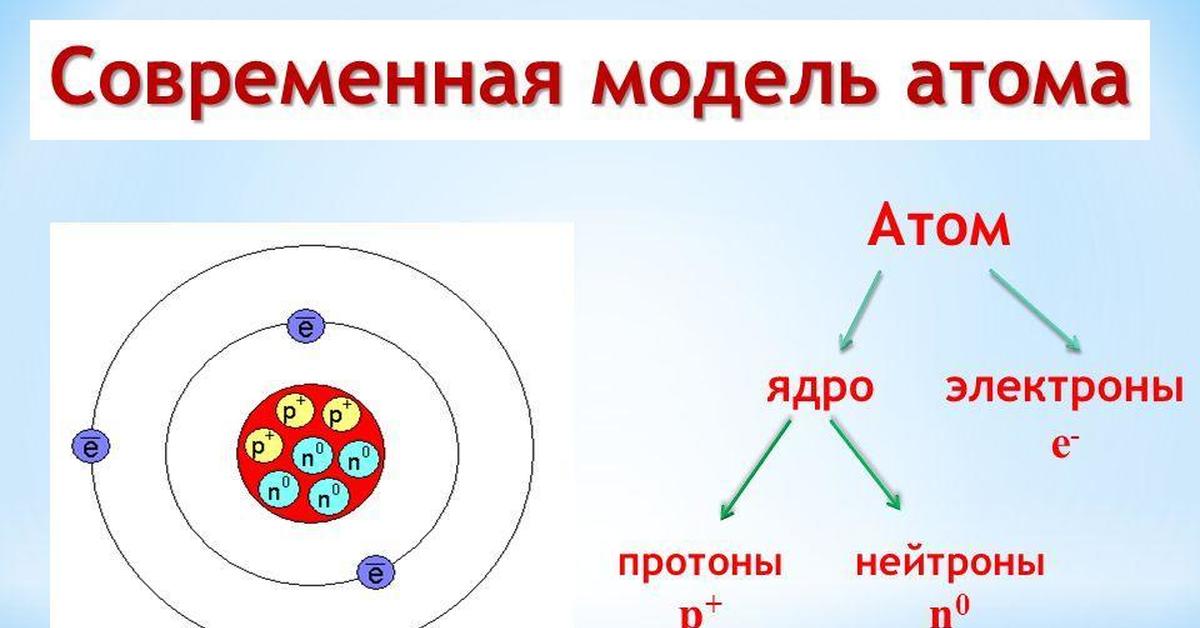
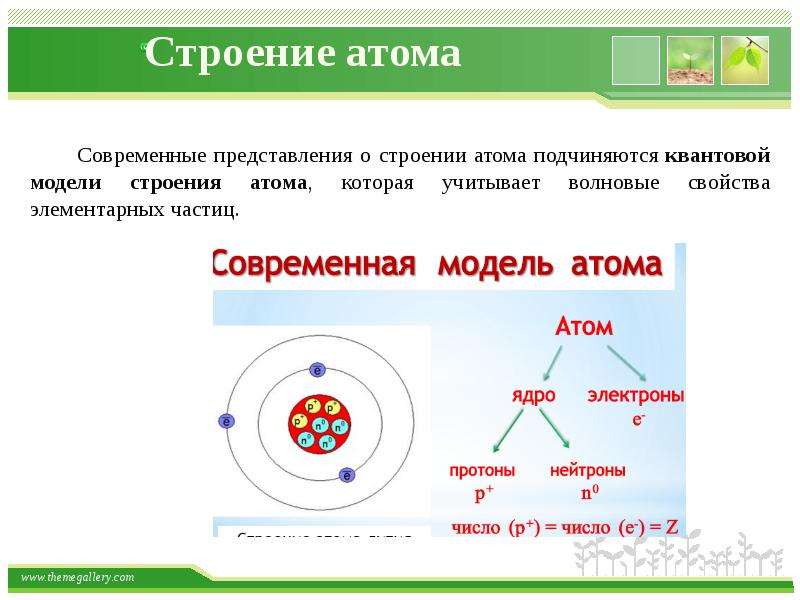
Современные представления о строении атома
из “Основы физической химии Издание 2”
Более 2000 лет тому назад выдающийся римский поэт Лукреций в поэме О природе вещей в своеобразной стихотворной форме описал учение древнегреческого философа Демокрита о мельчайших невидимых частичках, из которых построен весь мир. Демокрит считал, что тела только кажутся сплошными, в действительности они состоят из мельчайших частиц. У различных веществ эти частицы различны, но они настолько малы, что увидеть их невозможно. Демокрит назвал такие мельчайшие, неделимые частицы атомами, что по-гречески означает неделимые . Но эти утверждения были забыты и более 1000 лет господствовало учение Аристотеля, отрицавшее существование атомов. По мнению Аристотеля, все вещества могут взаимно превращаться друг в друга и любое тело может делиться до бесконечности. [c.11]В XVI в.

Велика заслуга М. В. Ломоносова в развитии учения об атомах. Он считал, что атом — не только мельчайшая частица, но и частица, обладающая определенными для данного элемента химическими свойствами. Великий русский ученый впервые указал на различие между атомами и молекулами. Значительный вклад в разработку атомистической теории внес английский физик Д. Дальтон (1803 г.). В 1860 г. Международный съезд химиков принял решение различать понятия атома и молекулы. [c.11]
 Рентгеном и явления радиоактивности (от латинского слоя радиус — луч) в 1896 г. французским физиком А. Беккерелем. Тщательное изучение радиоактивного излучения в магнитных и электрических полях показало, что это излучение сложное и состоит из а-, р- и у-лучей. [c.12]
Рентгеном и явления радиоактивности (от латинского слоя радиус — луч) в 1896 г. французским физиком А. Беккерелем. Тщательное изучение радиоактивного излучения в магнитных и электрических полях показало, что это излучение сложное и состоит из а-, р- и у-лучей. [c.12]
Первые попытки проникнуть в строение атома были сделаны английским ученым Д. Томсоном, который заинтересовался природой катодных лучей. Рядом с разрядной трубкой, представляющей собой стеклянный баллон с выкачанным воздухом и впаянными в оба конца электродами, Д. Томсон поместил металлическую пластинку. Когда пластинка была заряжена положительно, катодные лучи притягивались ею, когда отрицательно — отталкивались. [c.12]
 были сделаны два крупных открытия в области световых явлений. Немецкий физик М. Планк установил, что характер излучения дискретный (прерывистый), и ввел понятие квант действия . Русский ученый П. Н. Лебедев открыл и экспериментально измерил давление света. В дальнейшем было высказано предположение, что свет должен обладать массой. [c.13]
были сделаны два крупных открытия в области световых явлений. Немецкий физик М. Планк установил, что характер излучения дискретный (прерывистый), и ввел понятие квант действия . Русский ученый П. Н. Лебедев открыл и экспериментально измерил давление света. В дальнейшем было высказано предположение, что свет должен обладать массой. [c.13]
В 1905 г. А. Эйнштейн создал теорию относительности и вывел фундаментальный закон взаимосвязи массы и энергии. Им же было введено понятие фотон , или атом света . [c.13]
В 1911 г. английский физик Э. Резерфорд экспериментально доказал существование ядра. Он изучал рассеяние а-частиц при прохождении их через очень тонкие металлические пластинки. Было установлено, что некоторые а-частицы при прохождении пластинки резко изменяют свой путь, а некоторые даже отскакивают назад. Следовательно, а-частицы сталкиваются с какими-то положительно заряженными частицами. На основании этих экспериментов был сделан вывод, что весь положительный заряд атома сосредоточен в его центре.

Развивая исследования, Резерфорд разработал планетарную модель атома, согласно которой весь положительный заряд атома сосредоточен в его центре — ядре, а отрицательно заряженные электроны вращаются по определенным орбитам вокруг ядра. [c.13]
На основании теории Бора были определены стационарные орбиты электрона атома водорода, энергетический уровень атома, соответствующий этим орбитам электронов, а также переходы электрона с одной орбиты на другую и соответствующие этим переходам частоты квантов излучения.
 [c.15]
[c.15]
В последующие годы (1916 г.) теория атома Бора была несколько усовершенствована А. Зоммерфельдом, который, не меняя ее принципиально, обосновал, что наряду с круговыми могут существовать эллиптические орбиты вращения электронов. [c.15]
Особенность электрона, как и других элементарных частиц, заключается в его двойственной противоречивой природе. В свойствах электрона, в законах его движения проявляется неразрывность двух качественно различных форм существования материи — формы вещества и формы поля. Таким образом, представление о движении электронов вокруг ядра по определенным орбитам подобно движению планет вокруг солнца, нельзя считать верным. [c.15]
Согласно квантовой теории, электрон, вращаясь вокруг ядра, может в любой момент находиться в любом месте. Для атома водорода орбиты Бора характеризуют не единственно возможные положения электрона в атоме, а лишь его наиболее вероятные местонахождения. [c.15]
 О своих наблюдениях они сообщили на заседании Парижской академии наук в январе 1932 г. [c.16]
О своих наблюдениях они сообщили на заседании Парижской академии наук в январе 1932 г. [c.16]
Отсутствием заряда и объясняется высокая проникающая способность бериллиевого излучения. Так как электрические заряды ядра и электронные оболочки атомов на бериллиевое излучение не действуют, то оно свободно проходит через атом. [c.16]
Вернуться к основной статье
ПЗ и ПСХЭ Д. И. Менделеева в свете учения о строении атома
 Дмитрий Иванович Менделеев — великий
русский учёный, один из основоположников современной химии, создатель Периодической
системы элементов.
Дмитрий Иванович Менделеев — великий
русский учёный, один из основоположников современной химии, создатель Периодической
системы элементов.Он также является создателем учебника «Основы химии», в котором вся неорганическая химия изложена на основе Периодического закона. Менделеев является автором химической теории растворов.
В 1955 году группа американских учёных во главе с Гленом Сиборгом получила новый 101 элемент, которому присвоено название «менделевий» в честь выдающегося русского учёного.
Периодическая система является графическим выражением периодического закона. Д.И. Менделеев изначально расположил все химические элементы в ряд по увеличению их атомных масс и отметил там отрезки, в которых свойства элементов и их соединений изменялись сходным образом.
На основании этого,
им была предложена следующая формулировка закона: свойства
химических элементов и образованных ими веществ, находятся в периодической зависимости
от их относительных атомных масс.
Физический смысл периодического закона стал понятен только после создания теории строения атома. Но сама эта теория развивалась и развивается на основе периодического закона и периодической системы.
На развитие периодического закона оказала влияние не только теория строения атома, но и открытие явления существования изотопов, а также закон Мозли.
Согласно этому закону, заряд ядра атома каждого элемента в таблице Менделеева возрастает на единицу по сравнению с зарядом ядра атома предыдущего элемента. Поэтому заряд атомного ядра совпадает с порядковым номером элемента в таблице Менделеева. Закон Мозли вскрыл истинный принцип, по которому Менделеев интуитивно расположил химические элементы.
Согласно теории строения
атома, его главной характеристикой является положительный заряд ядра. Заряд ядра
определяет положение атома в Периодической системе, число электронов в атоме, его
электронное строение и все свойства атомов.
Таким образом, современная формулировка периодического закона звучит следующим образом: свойства атомов химических элементов, а также состав и свойства образуемых ими веществ находятся в периодической зависимости от зарядов атомных ядер.
Все химические элементы в Периодической системе расположены в порядке возрастания атомного, или порядкового номера. В каждой ячейке этой Периодической таблицы расположен химический элемент, где есть его название, порядковый номер и относительная атомная масса.
Численная величина атомного номера равна положительному заряду ядра атома соответствующего химического элемента. Кроме этого, порядковый номер указывает число протонов в нём и число электронов. Например, заряд ядра атома водорода равен плюс один, значит в атоме содержится один протон и один электрон.
Количество нейтронов в атоме можно найти по разности между массовым числом и количеством протонов.
Например, для изотопа
фосфора тридцать один число нейтронов равно шестнадцати (тридцать один минус пятнадцать).
В Периодической системе химических элементов Д.И. Менделеева семь горизонтальных рядов, которые называются периодами и восемь вертикальных столбов, которые называются группами. Поэтому каждый химический элемент имеет свой порядковый номер, находится в определенном периоде и в определённой группе.
Известно около семи сот форм графического изображения периодической системы. Но их объединяет то, что элементы в них располагаются в порядке возрастания их атомных ядер. Существует два основных варианта представления периодической системы: длиннопериодный, в котором выделяют 18 групп и короткопериодный, в котором групп 8, но вводится понятие главной и побочной подгрупп.
По мере увеличения атомного номера происходит постепенное заполнение электронами соответствующих орбиталей. Таким образом, структура Периодической системы связана с электронной структурой атомов элементов.
В зависимости от того,
какой энергетический подуровень заполняется последним, различают четыре семейства
элементов: это эс-элементы, у которых последним заполняется эс-подуровень
внешнего энергетического уровня, как например, у лития, поэтому литий – эс-элемент.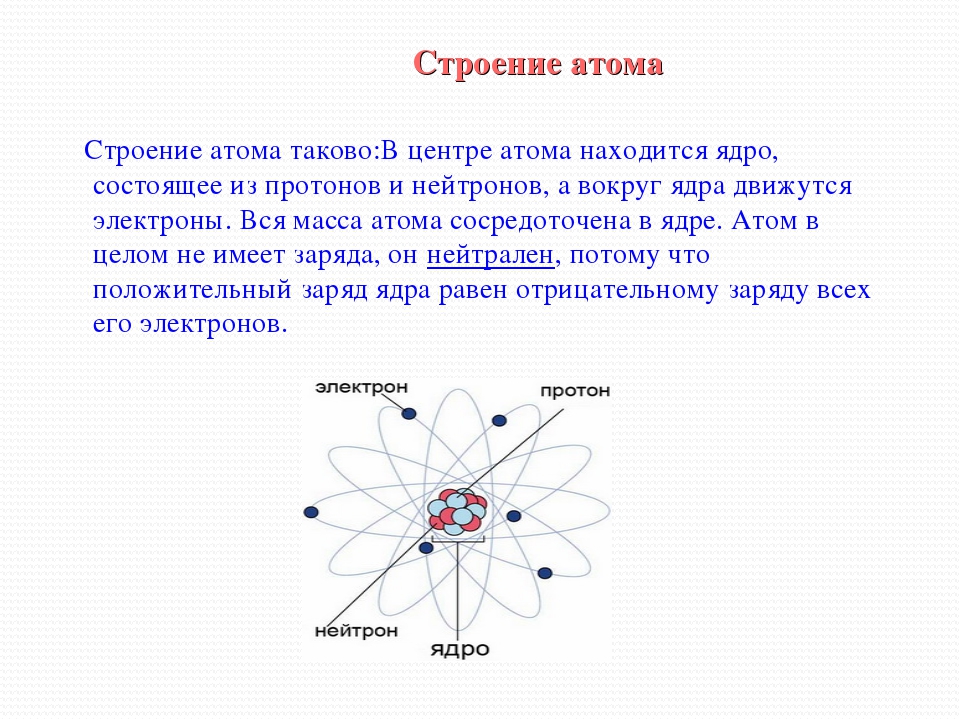
У элементов пэ-семейства последним заполняется пэ-подуровень, как, например, у фосфора, поэтому фосфор – пэ-элемент, у дэ-элементов последним заполняется дэ-подуровень, как у титана, поэтому титан – дэ-элемент, а у элементов эф-семейства последним заполняется эф-подуровень, как у эйнштэйния, поэтому эйнштэйний является эф-элементом.
Периодом называют последовательный ряд элементов, в атомах которых электронная конфигурация внешнего энергетического уровня изменяется от эн-эс-один до эн-эс-два эн-пэ-шесть (кроме первого периода).
Номер периода совпадает с номером внешнего энергетического уровня. Поэтому физический смысл номера периода заключается в том, что он указывает число энергетических уровней, на которых находятся электроны в атомах данного элемента.
Малыми считаются с первого по третий период, а большими – с четвёртого по восьмой.
В первом периоде два элемента, во втором и третьем – по
восемь элементов, в четвёртом и пятом – по восемнадцать элементов, в шестом и седьмом
– по тридцать два элемента.
Каждый период начинается щелочным металлом и заканчивается благородным газом. Первые три периода содержат только эс- и пэ-элементы. Четвёртый, пятый и последующие периоды включают элементы, у которых происходит заполнение дэ-подуровня внешнего энергетического уровня. У элементов шестого и седьмого периодов, кроме эс-, пэ-, дэ-подуровней, заполняются и эф-подуровни третьего снаружи электронного слоя. К эф-элементам относятся лантаниды и актиниды, которые вынесены за пределы таблицы.
В группах находятся элементы, атомы которых имеют схожее электронное строение. Группы делят на А и Б подгруппы: это главная и побочная. А группа содержит больше элементов, чем побочная.
Заполнение внешнего энергетического уровня
У элементов А-групп
последними заполняются эс- и пэ-подуровни внешних энергетических уровней, а у Б-групп
последними заполняются дэ-подуровни второго снаружи или эф-подуровни третьего снаружи
энергетического уровня.
Элементы первой А группы имеют один валентный электрон. Элементы второй А группы имеют два валентных электрона.
Некоторые главные подгруппы имеют свои названия: первая А группа – щелочные металлы, вторая А группа – щелочноземельные металлы, пятая А группа – пниктогены, шестая А группа – халькогены, седьмая А группа – галогены, восьмая А группа – благородные или инэртные газы.
Физический смысл номера группы заключается в том, что он показывает число электронов в атоме, которые могут участвовать в образовании химических связей.
Электроны, которые участвуют в образовании химической связи называются валентными. У элементов А-групп валентными являются электроны внешнего энергетического уровня, а у элементов Б-групп – ещё и электроны предпоследних уровней.
Следовательно, группа – вертикальный столбец элементов с одинаковым числом валентных электронов в атомах.
У каждой группы есть формула высшего оксида, то есть оксида с максимальной степенью окисления элементов. Эта информация написана внизу таблицы. Например, для элементов пятой А группы формула высшего оксида – эр-два-о-пять. В таблице отражен состав летучих водородных соединений. Такие соединения образуют элементы от четвёртой по седьмую группу.
Каждому элементу в Периодической системе отведено своё место. Однако для водорода в Периодической системе есть 2 места: в первой и седьмой группах. Водород, как и щелочные металлы, имеет один электрон на внешнем энергетическом уровне и относится к эс-семейству, поэтому он, как и щелочные металлы проявляет восстановительные свойства.
Но до завершения внешнего энергетического уровня водороду не хватает одного электрона, как и галогенам, поэтому он может проявлять и окислительные свойства.
Молекула водорода,
как и молекулы галогенов, состоит из двух атомов, связь между атомами ковалентная
неполярная.
Но в космосе существует металлический водород, который имеет металлическую кристаллическую решётку и обладает электропроводимостью. Как и у щелочных металлов, у водорода в соединениях степень окисления плюс один, но в гидридах у водорода степень окисления минус один.
Как известно, Берцэлиус определил атомные массы сорока пяти химических элементов и в 1818 году опубликовал их в виде таблицы. Для обозначения химических элементов Берцэлиус предложил использовать начальные буквы их латинских названий. Берцелиус открыл новые химические элементы: цэрий, селен и торий. Ему первому удалось получить в свободном состоянии кремний, титан, тантал, цирконий, а также ванадий.
Таким образом, периодический закон стал важным звеном в эволюции
атомно-молекулярного учения, оказав значительное влияние на разработку теории строения
атома. Он также способствовал формулировке современного понятия “химический
элемент” и уточнению представлений о простых и сложных веществах.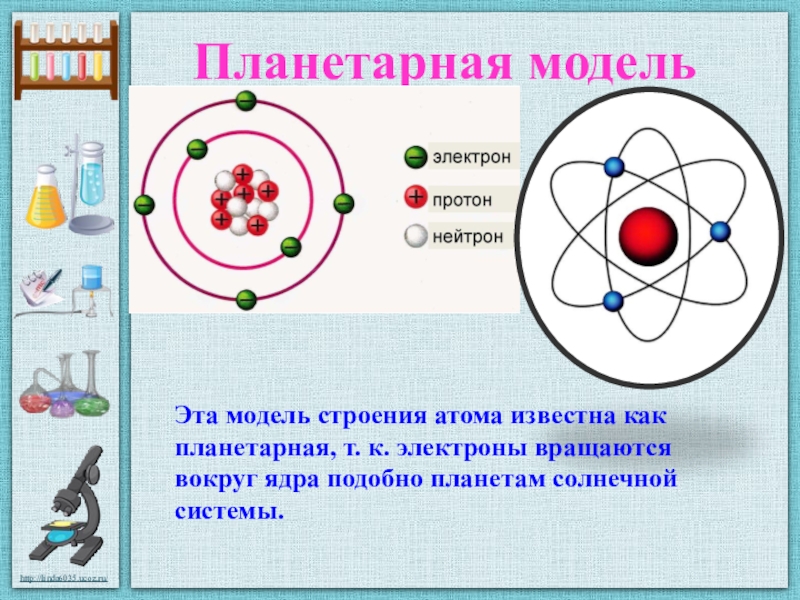
Периодический закон и Периодическая система позволили:
· установить взаимосвязь между элементами и объединить их по свойствам;
· обнаружить повторяемость свойств элементов и их соединений и объяснить их причину;
· исправить и уточнить значения относительных атомных масс некоторых элементов;
· исправить и уточнить степени окисления некоторых элементов;
· предсказать существование ещё неоткрытых элементов, описать их свойства, указать пути их открытия.
Следовательно, главной характеристикой атома является положительный заряд ядра, который численно равен атомному номеру элемента. Каждый химический элемент имеет свой атомный номер, находится в определённом периоде и определённой группе.
Российский ученый опроверг Эйнштейна – Образование
28 января 2009 09:45
Озвучены результаты исследования российских ученых, которые ставят под сомнение теорию относительности Эйнштейна. Более того, как утверждают исследователи, современное представление о строении атома неверно: никакой третьей частицы в его структуре быть не может. Таким образом, запуск Большого адронного коллайдера теряет всякий смысл – искать частицу Хиггса дорого и глупо. Хотя и не опасно.
Более того, как утверждают исследователи, современное представление о строении атома неверно: никакой третьей частицы в его структуре быть не может. Таким образом, запуск Большого адронного коллайдера теряет всякий смысл – искать частицу Хиггса дорого и глупо. Хотя и не опасно.
Российские ученые поведали журналистам о сенсационном открытии.
«Научные журналы не принимают к публикации его работы с формулировкой «не соответствует современным представлениям» Как рассказал член Медико-технологической академии при МГТУ им. Баумана Джабраил Базиев, в ходе проведенного им эксперимента из ртутной лапы высокого давления с помощью интерференционных фильтров были выделены синие, зеленые и красные пучки лучей.
Измерения показали, что скорости их распространения различны, а это, уверен Базиев, никак не стыкуется с современными данными науки: согласно учебнику физики, скорость распространения света является неизменной (2,99792458*108 м/с) и одинаковой для всех видов излучения. То есть «скорость света никогда не была фундаментальной константой», заявил ученый.
То есть «скорость света никогда не была фундаментальной константой», заявил ученый.
Развенчанием теории Эйнштейна Джабраил Базиев не ограничился: по его словам, теперь опровергнуты сами представления современной физики о строении и структуре элементарной частицы.
Напомним, теория планетарной модели атома утверждает, что он состоит из положительно заряженного ядра (в свою очередь делится на протоны и нейтроны), вокруг которого вращается электрон. Согласно же теории, предложенной Базиевым, атом состоит из неделимых электронов и электрино – положительно заряженной частицы, которая имеет постоянную массу и заряд. То есть, вопреки мнению остальных ученых, в элементарном атоме нет третьей частицы – он состоит только из электронов и электрино. И сколько бы ни дробили атомы, в конечном итоге все равно получатся только электрон и электрино.
«В V веке до н. э. древнегреческий философ Демокрит рассуждал, что если взять камень и начать его дробить на части, то рано или поздно мы дойдем до кусочков, которые уже ни на что не делятся, именно эти частицы он назвал атомом (др. -греч. Atomos – неделимый). Оказалось, что мы только сегодня подошли к такому понятию атома: электрон и электрино и есть те самые частицы, которые далее не делятся», – заявил ученый.
-греч. Atomos – неделимый). Оказалось, что мы только сегодня подошли к такому понятию атома: электрон и электрино и есть те самые частицы, которые далее не делятся», – заявил ученый.
По утверждению Базиева, «именно электрино является носителем электрического тока, магнитного поля, светового излучения и занимает в структуре атома 99,83% по массе».
Если предположить, что новое представление будет принято международным ученым сообществом, то перечеркнуты будут не только теоретические представления, существующие на текущий момент. Под сомнение ставятся и некоторые дорогостоящие научные проекты, реализуемые учеными. Например, всякий смысл потеряет нашумевший запуск Большого адронного коллайдера (БАК): поскольку в элементарном атоме кроме электронов и электрино нет никаких других частиц, в том числе и частицы Хиггса, то и искать ее, считает Базиев, бесполезно.
Впрочем, запуск БАКа не приведет к каким-либо катастрофам или разрушениям, успокоил Базиев.
Отметим, что отзывов на работу Базиева и со стороны коллег пока нет. Хотя, как говорит ученый, определенный интерес к данной области исследования есть на Западе, тем более что теория открывает немалые возможности для практического применения: по словам Базиева, его открытие позволяет использовать «магнитное поле Земли», которое – если расчеты верны, а в этом он не сомневается, – является «неиссякаемым источником энергии».
Хотя, как говорит ученый, определенный интерес к данной области исследования есть на Западе, тем более что теория открывает немалые возможности для практического применения: по словам Базиева, его открытие позволяет использовать «магнитное поле Земли», которое – если расчеты верны, а в этом он не сомневается, – является «неиссякаемым источником энергии».
При этом, как признался Базиев, научные журналы в России не принимают к публикации его работы с формулировкой «не соответствует современным представлениям».
Газете «Взгляд» пока не удалось получить каких-либо комментариев относительно этой теории от авторитетных научных организаций или экспертов. Зато открытие уже вызвало бурную реакцию в блогах, причем надо отметить, что отзывы в большинстве своем – скептические: например, по поводу того, что скорость распространения света не является фундаментальной константой, пользователь «Живого Журнала» под ником zaslany-kazak поясняет: «Современная физика говорит про независимость сугубо в вакууме. То что в среде скорость света зависит от длины волны называется дисперсией и ее легко можно наблюдать при помощи тривиальной стеклянной призмы. Это 10 класс школы».
То что в среде скорость света зависит от длины волны называется дисперсией и ее легко можно наблюдать при помощи тривиальной стеклянной призмы. Это 10 класс школы».
Как сообщает портал Elbrusoid.org, Джабраил Харунович Базиев – лидер исследовательской группы, член Медико-технологической академии при МГТУ им. Баумана. Открыл и описал до него неизвестное животное в фауне Кавказа – кавказского горностая. Также, утверждает Elbrusoid.org, Базиев решил физическую суть постоянной Планка, уравнение состояния реальных газов, включающее в себя 16 параметров в явном виде и девять – в неявном (уравнение Клайперона-Менделеева содержит только шесть параметров), и выстроил новую междисциплинарную теорию физики, опубликованную в книге «Основы единой теории физики» (М., Педагогика, 1994 г., 640 с.).
ВзглядВы не авторизованы, авторизуйтесь или зарегистрируйтесь.
Строение атома и элементарные частицы
СТРОЕНИЕ АТОМА И ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ [c. 182]
182]ГЛ. VI. СТРОЕНИЕ АТОМА И ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ [c.184]
Исследования строения атома и атомного ядра показали, что J3 состав атома входят электроны, протоны и нейтроны. Z протонов и (А — Z) нейтронов, вступая в сильные взаимодействия между собой, образуют атомное ядро Х , а Z электронов, обращающихся вокруг ядра, образуют электронную оболочку атома. В связи с этим вполне естественно было назвать эти частицы (е , р, п) элементарными частицами. Фотон (7), позитрон (е ) и нейтрино (v), имеющие самое непосредственное отношение к атому и ядру, также стали называть элементарными частицами. [c.337]
К разряду элементарных частиц следовало бы относить наиболее простые, неделимые частицы материи. Исследования строения атомов и атомных ядер показали, что эти микрообъекты являются составными. Электроны, находящиеся на периферии атома, протоны и нейтроны, образующие атомные ядра, стали называть элементарными частицами, подчеркивая тем самым, что они более простые частицы, чем атомы и ядра атомов.
 К элементарным частицам причислили фотоны — кванты электромагнитного поля, а также нейтрино, появляющиеся в процессах Р-распада ядер. Дальнейшие исследования показали, что в процессах взаимодействия элементарных частиц образуются и другие типы частиц, большинство из которых взаимодействуют с протонами и нейтронами и между собой с такой же интенсивностью, как протоны и нейтроны в ядрах атомов. Эту большую группу частиц также назвали элементарными. Однако оказалось, что большинство частиц, отнесенных к разряду элементарных, нестабильны и могут в результате распада превращаться в другие элементарные частицы. При этом нельзя считать, что продукты распада более элементарны, чем сами распадающиеся частицы, поскольку, как правило, наблюдается несколько различных каналов распада одной и той же частицы. Поэтому нельзя заключить, что нестабильные частицы состоят из частиц — продуктов распада. Обнаружены были также частицы, напоминающие по своим свойствам электроны, но являющиеся нестабильными и существенно более массивными, чем электрон.
К элементарным частицам причислили фотоны — кванты электромагнитного поля, а также нейтрино, появляющиеся в процессах Р-распада ядер. Дальнейшие исследования показали, что в процессах взаимодействия элементарных частиц образуются и другие типы частиц, большинство из которых взаимодействуют с протонами и нейтронами и между собой с такой же интенсивностью, как протоны и нейтроны в ядрах атомов. Эту большую группу частиц также назвали элементарными. Однако оказалось, что большинство частиц, отнесенных к разряду элементарных, нестабильны и могут в результате распада превращаться в другие элементарные частицы. При этом нельзя считать, что продукты распада более элементарны, чем сами распадающиеся частицы, поскольку, как правило, наблюдается несколько различных каналов распада одной и той же частицы. Поэтому нельзя заключить, что нестабильные частицы состоят из частиц — продуктов распада. Обнаружены были также частицы, напоминающие по своим свойствам электроны, но являющиеся нестабильными и существенно более массивными, чем электрон. Установлено существование трех разновидностей нейтрино.
[c.970]
Установлено существование трех разновидностей нейтрино.
[c.970]Если бы пятьдесят лет назад у химика или у физика спросили, можно ли рассматривать атом как элементарную частицу, то, вероятно, большинство ответило бы утвердительно, поскольку тогдашняя паука не знала строения атома и даже не предполагала, что атом имеет какое-либо строение. [c.7]
Механическая интерпретация этих концепций становится возможной и эмпиризм в значительной степени можно исключить, если основные концепции будут тесно связаны с теорией строения вещества. Таким путем проверяется правильность современных теорий строения вещества. В настоящее время считают, что вещество состоит из молекул, в свою очередь состоящих из атомов, построенных из таких элементарных частиц, как электроны, протоны и нейтроны. Элементарные частицы обусловливают свойства атомов, атомные свойства определяют свойства молекул, а молекулярные свойства определяют наблюдаемые свойства системы. Поэтому, зная свойства молекул, можно вычислить все наблюдаемые термодинамические свойства системы, состоящей из большого числа молекул. [c.69]
[c.69]
После появления в 1913 г. модели строения атома Резерфорда — Бора из элементарных частиц были известны электрон, фотон и около 95 различных ядер. (Элементарной можно практически считать всякую частицу, которую трудно себе представить как состоящую из других частиц). Открытие в 1932 г. нейтрона (нейтральной частицы с массой, слегка превышающей массу протона) привело к представлению о ядрах как [c.424]
Таким образом, несмотря на обилие разнообразных элементарных частиц, только некоторые из них играют очевидную роль в строении нормального вещества. Нейтроны и протоны вступают в связь между собой с образованием заряженных ядер. Вокруг ядра движется электронное облако, и все это вместе составляет атом. Атомы соединяются в молекулы. Большие совокупности молекул образуют макроскопические тела газы, жидкости, кристаллы… Ускоряемые электроны излучают или поглощают фотоны. Средством исследования переходов между стационарными атомными состояниями является спектроскопия,
[c.425]
Средством исследования переходов между стационарными атомными состояниями является спектроскопия,
[c.425]
Открытие первой элементарной частицы — электрона, в свою очередь, поставило перед исследователями множество проблем. В первую очередь следует упомянуть о проблеме строения атома, неделимость которого была опровергнута существованием значительно меньшей частицы (см. 7). Но сюрпризы, связанные с открытием электрона и исследованием его свойств, на этом не кончаются. Очень скоро удалось обнаружить, что масса электрона зависит от его скорости (рис. 17). Считавшееся до сих пор [c.105]
Пространственные решетки (ПР), или решетки Брава, — наиболее общий (абстрактный) образ внутреннего строения кристалла (рис. 5. I). ПР получаем, если исключим все особенности химической природы составляющих его частиц — форму, размер и состав молекул,, атомов или ионов и вместо частиц будем рассматривать точки (узлы решет и) — центры тяжести частиц. По взаимному расположению узлов ПР все многообразие кристаллов сводится к 14 типам. ПР, или решетка Бравэ, характеризуется прежде всего группой трансляций (три) или параллелепипедом повторяемости — элементарной ячейкой (ЭЯ) (см. рис. 5.1). Параллельным переносом (трансляцией) элементарной ячейки в трехмерном пространстве и строят ПР. Трансляция — одна из операций симметрии, поэтому решетки Бравэ можно называть также трансляционными группами . Симметрия относительного располо-
[c.95]
ПР, или решетка Бравэ, характеризуется прежде всего группой трансляций (три) или параллелепипедом повторяемости — элементарной ячейкой (ЭЯ) (см. рис. 5.1). Параллельным переносом (трансляцией) элементарной ячейки в трехмерном пространстве и строят ПР. Трансляция — одна из операций симметрии, поэтому решетки Бравэ можно называть также трансляционными группами . Симметрия относительного располо-
[c.95]
Физика XX в., проникая все глубже в строение материи, вышла сначала на уровень атома, затем — атомного ядра и, наконец, на уровень элементарных частиц. Однако понятие элементарный относительно. Как сказал Ферми, возможно, что оно отражает уровень нашего понимания . [c.78]
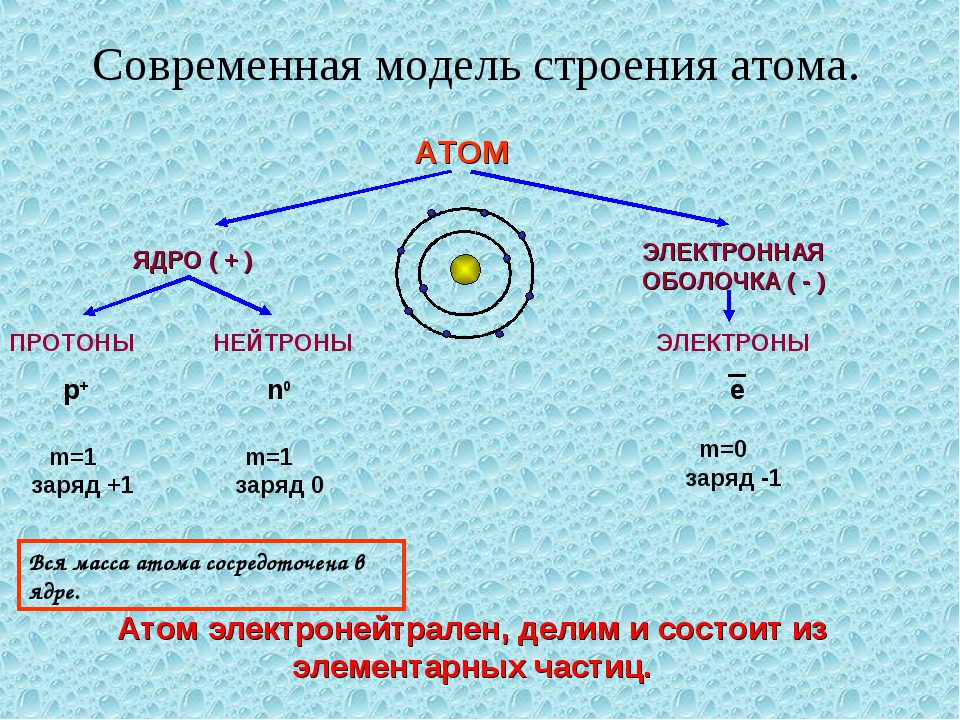
Атомы, электроны и ионы. По современным понятиям вещество имеет атомное строение, т. е. состоит из мелких частиц — атомов. Атом в свою очередь является совокупностью еще более мелких, электрически заряженных и нейтральных частиц. Наиболее простую систему представляет атом водорода.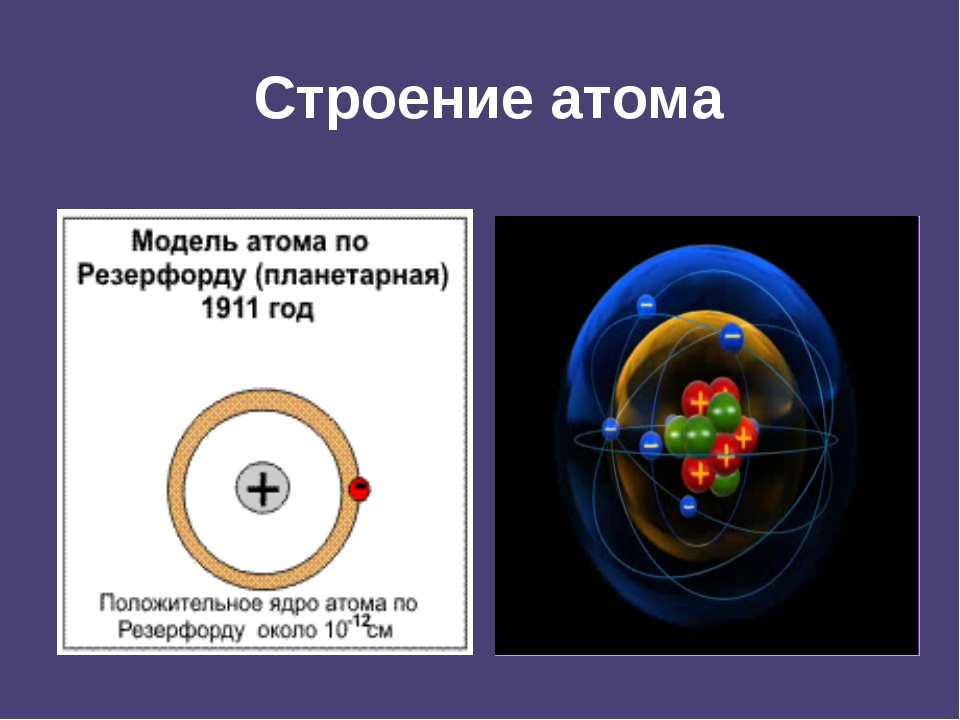 В его центре находится тяжелое ядро с элементарным положительным зарядом — протон, в котором практически сосредоточена вся масса атома. Вокруг ядра, под влиянием его притяжения, вращаются отрицательно заряженные частицы, называемые электронами. Ядро заряжено положительно, электроны имеют отрицательный заряд. Так как электроны обладают отрицательным зарядом, равным положительному заряду ядра, то атом электрически нейтрален.
[c.73]
В его центре находится тяжелое ядро с элементарным положительным зарядом — протон, в котором практически сосредоточена вся масса атома. Вокруг ядра, под влиянием его притяжения, вращаются отрицательно заряженные частицы, называемые электронами. Ядро заряжено положительно, электроны имеют отрицательный заряд. Так как электроны обладают отрицательным зарядом, равным положительному заряду ядра, то атом электрически нейтрален.
[c.73]
Все тела в природе могут быть разделены на две группы кристаллические и аморфные. Кристаллические тела отличаются от аморфных своим внутренним строением и свойствами. Кристаллические тела характеризуются тем, что атомы или молекулы (элементарные частицы, из которых состоят все вещества) в них расположены в определённом строгом порядке. Правильное расположение атомов создаёт пространственную решётку, являющуюся основным признаком кристаллического тела. Если образованию кристаллического тела не мешают другие тела, то и внешняя форма его также получается правильной, сообразно его кристаллической решётке. Однако правильная внешняя форма тела не является обязательным признаком его кристаллического строения.
[c.7]
Однако правильная внешняя форма тела не является обязательным признаком его кристаллического строения.
[c.7]
Соединение, полученное при сварке, характеризуется непрерывной структурной связью и монолитностью строения, достигаемыми за счет образования атомно-молекулярных связей между элементарными частицами сопрягаемых деталей. Для того чтобы произошла сварка, нужно сблизить соединяемые элементы на расстояние порядка величины атомного радиуса (10 см). При этом между поверхностными атомами твердых тел становится возможным межатомное взаимодействие и происходит сопровождаемое диффузией химическое взаимодействие. [c.11]
Механическая прочность твердых тел определяется силами взаимодействия элементарных частиц (молекул, атомов, ионов), зависящими от строения этих часг.и и от расстояний между ними. При соединении между собой двух или большего числа твердых тел для обеспечения прочности места контакта необходимо сблизить соединяемые (свариваемые) материалы настолько, чтобы расстояние между элементарными частицами их было соизмеримо с периодом кристаллической решетки свариваемых материалов.
 Это обеспечивается механическим сдавливанием свариваемых материалов или переводом их у места контакта в жидкое состояние. В результате происходящих при этом физико-химических процессов (образование жидких или твердых растворов, совместная кристаллизация, диффузия в твердом состоянии, образование химических соединений и т. п.) они вступают в тесное взаимодействие, и соединение приобретает достаточную механическую прочность.
[c.220]
Это обеспечивается механическим сдавливанием свариваемых материалов или переводом их у места контакта в жидкое состояние. В результате происходящих при этом физико-химических процессов (образование жидких или твердых растворов, совместная кристаллизация, диффузия в твердом состоянии, образование химических соединений и т. п.) они вступают в тесное взаимодействие, и соединение приобретает достаточную механическую прочность.
[c.220]Исследование процессов столкновения служит мощным средством изучения природы ядерных сил и сил взаимодействия между элементарными частицами, изучения структуры отдельных атомов и молекул и исследования строения вещества в различных агрегатных состояниях. [c.95]
Позднее, когда выяснилось, что строение атома сложно, понятие элементарности перенесли па ядра. Однако теперь мы знаем, что и ядра обладают сложным строением. Вообще можно сказать, что на каждом этапе развития пауки мы называем элементарными те частицы, строения которых не знаем и которые рассматриваем как точечные. [c.7]
[c.7]
Предмет и метод теоретической физики. Одним из исходных понятий в науке является понятие структуры. Структура есть множество объектов, которые имеют прочные устойчивые связи между собой. Физика изучает простейшие материальные структуры — элементарные частицы, атомы, молекулы, тела, поля, системы тел и полей, их строение, взаимодействие и движение. Это объект всей физической науки, в том числе и теоретической физики. [c.8]
Строение и дефекты твердых тел. Кристаллическая решетка — это присущее кристаллическому состоянию вещества регулярное расположение частиц (атомов, ионов, молекул), характеризующееся периодической повторяемостью, в трех измерениях. Полное описание кристаллической решетки дается пространственной группой, параметрами элементарной ячейки, координатами атомов в ячейке. В этом смысле понятие кристаллической решетки эквивалентно понятию атомарной структуры кристалла. Русский ученый Е. С. Федоров почти на 40 лет раньше, чем были найдены методы рентгеноструктурного анализа, рассчитал возможные расположения частиц в кристаллических решетках различных веществ.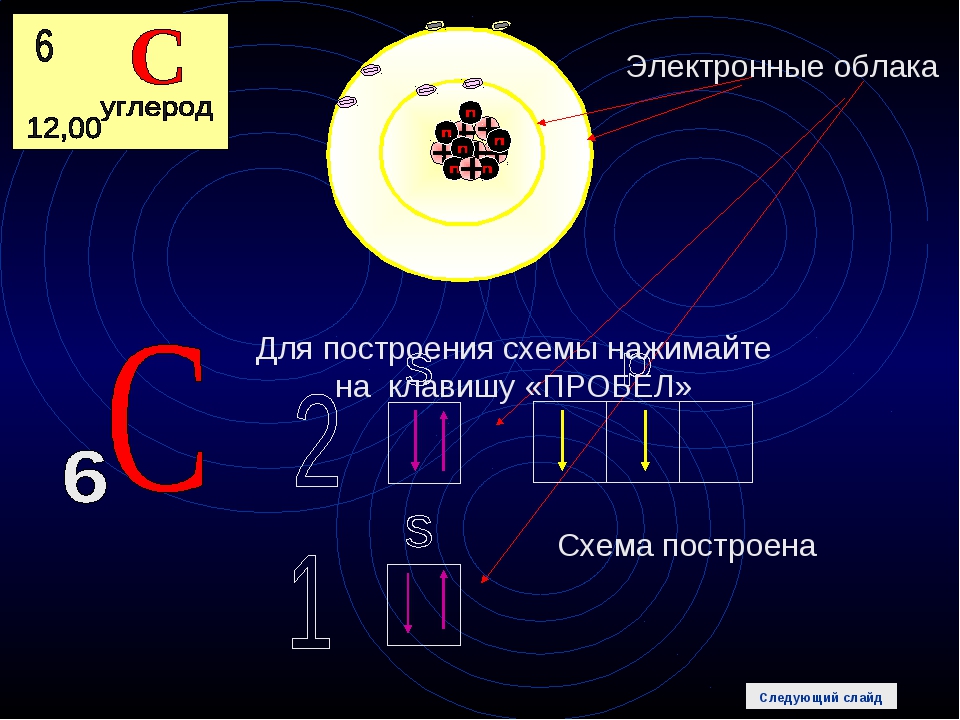 Он подразделил кристаллы на 32 класса симметрии, объединяющих 230 возможных пространственных групп. Кристаллы могут различаться по двойному лучепреломлению, по пьезо- и пироэлектрическим свойствам, образованию адсорбционных центров, работе выхода электронов и т. п.
[c.11]
Он подразделил кристаллы на 32 класса симметрии, объединяющих 230 возможных пространственных групп. Кристаллы могут различаться по двойному лучепреломлению, по пьезо- и пироэлектрическим свойствам, образованию адсорбционных центров, работе выхода электронов и т. п.
[c.11]
От редакции. Настояа1ая глава не исчерп . -вает всех данных из области современной химии, применяемых в машиностроении. Ряд дополнительных данных содержится в главах 2-го тома (физико-химические и механические свойства чистых металлов, Теория и расчеты процессов горения) б-го тома (Чугун, Сталь, Цветные металлы и сплавы),5-го тома (Электрические и химико-механические способы размерной обработки металлов. Технология термической и химико-термической обработки металлов, Технология покрытий деталей машин, Технология производства металлоке-рамнческих деталей). Подробные данные по ряду вопросов можно найти в приведенных ниже литературных источниках. Так, например, общие законы химии и свойства химических элементов и их соединений изложены в источнике [29] основные положения органической химии и общие свойства органических соединений — в (9], [38] строение атома, свойства элементарных частиц, теория
[c. 315]
315]
Френкель Яков Ильич (1894-1952) — советский физик-теоретик. Окончил Петроградский университет (1916 г.), работал в Физико-техническом институте и в Политехническом институте в Ленинграде. Научные работы относятся ко многим разделам физики (строение твердых и жидких тел, физика ядра и. элементарных частиц, физика твердого тела, магнетизм) и в ряде направлений были пионерскими. Независимо от Н. Бора разработал в 1936 г. капельную модель ядра, независимо от В. Гейзенберга — первую квантовомеханическую модель ферромагнетизма. В 1930 г. со.чдал теорию доменного строения ферромагнетиков, предложил теорию движения атомов и ионов в кристаллах. Развил теорию вырожденного релятивистского газа, сформулировал (1939 г.) основы теории спонтанного деления тяжелых ядер. Автор более 300 статей и двадцати книг. [c.369]
Теплоемкости определяются экспериментально (калориметрически), но они могут быть и вычислены теоретически, исходя из строения элементарных частиц и всего вещества в целом с достаточной степенью точности. При расчете теплоемкостей и энтальпий газов при высоких температурах, когда поглощение энергии газообразным веществом происходит вследствие возрастания энергии поступательного движения молекул, вращательного движения сложных молекул, колебательного движения атомов внутри молекул и расхода энергии на возбуждение электронных оболочек атомов, а в случае высокотемпературной плазмы (- 10 K) и на возбуждение ядерных структур (термоядерные реакции). Суммируя все расходы энергии, можно в общем виде представить уравнение теплоемкости газа следующим уравнением
[c.255]
При расчете теплоемкостей и энтальпий газов при высоких температурах, когда поглощение энергии газообразным веществом происходит вследствие возрастания энергии поступательного движения молекул, вращательного движения сложных молекул, колебательного движения атомов внутри молекул и расхода энергии на возбуждение электронных оболочек атомов, а в случае высокотемпературной плазмы (- 10 K) и на возбуждение ядерных структур (термоядерные реакции). Суммируя все расходы энергии, можно в общем виде представить уравнение теплоемкости газа следующим уравнением
[c.255]
Последовательность различных курсов как общей, так и теоретической физики определяется прежде всего постепенным переходом к изучению все более сложных форм движения соответствующих структурных видов материи (макротела, молекулы, атомы, элементарные частицы и поля). Механика изучает закономерности простейшей формы движения — относительного перемещения тел в пространстве во времени.
 Термодинамика и статистическая физика рассматривают явления, обусловленные совокупным действием огромного числа непрерывно движущихся молекул или других частиц, из которых состоят окружающие н с тела. Благодаря очень большому количеству частиц беспорядочное их движение приобретает новые качества макроскопические свойства систем из большого числа частиц в обычных условиях совершенно не зависят от начального положения этих частиц, в то время как механическое состояние системы существенно зависит от начальных условий. Это один из примеров диалектического закона перехода количестЕ енных изменений в качественные возрастание количества механически движущихся частиц в системе порождает качественно новый вид движения — тепловое движение. Тепловое движение представляет собой изменения системы, обусловленные ее атомистическим строением и наличием огромного числа частиц оно связано с молекулярным механическим движением, но этим не исчерпывается его сущность. Всякое движение, — писал Ф. Энгельс, — заключает в себе механическое движение, перемещение больших или мельчайших частей материи познать эти механические движения является первой задачей науки, однако лишь первой ее задачей.
Термодинамика и статистическая физика рассматривают явления, обусловленные совокупным действием огромного числа непрерывно движущихся молекул или других частиц, из которых состоят окружающие н с тела. Благодаря очень большому количеству частиц беспорядочное их движение приобретает новые качества макроскопические свойства систем из большого числа частиц в обычных условиях совершенно не зависят от начального положения этих частиц, в то время как механическое состояние системы существенно зависит от начальных условий. Это один из примеров диалектического закона перехода количестЕ енных изменений в качественные возрастание количества механически движущихся частиц в системе порождает качественно новый вид движения — тепловое движение. Тепловое движение представляет собой изменения системы, обусловленные ее атомистическим строением и наличием огромного числа частиц оно связано с молекулярным механическим движением, но этим не исчерпывается его сущность. Всякое движение, — писал Ф. Энгельс, — заключает в себе механическое движение, перемещение больших или мельчайших частей материи познать эти механические движения является первой задачей науки, однако лишь первой ее задачей. Но это механическое движение не исчерпывает движения вообще. Движение — это не только перемена места в надмеханических областях оно является также и изменением качества. Открытие, что теплота представляет собою некоторое молекулярное движение, составило эпоху в науке. Но если я не имею ничего другого сказать о теплоте кроме того, что она представляет собой известное перемещение молекул, то лучше мне замолчать . Определяющим для возникновения теплового движения является не механическое движение от-
[c.7]
Но это механическое движение не исчерпывает движения вообще. Движение — это не только перемена места в надмеханических областях оно является также и изменением качества. Открытие, что теплота представляет собою некоторое молекулярное движение, составило эпоху в науке. Но если я не имею ничего другого сказать о теплоте кроме того, что она представляет собой известное перемещение молекул, то лучше мне замолчать . Определяющим для возникновения теплового движения является не механическое движение от-
[c.7]МАГНЕТИЗМ МИКРОЧАСТИЦ — магн. свойства молекул, атомов, атомных ядер и субъядерных частиц (т. н. элементарных частиц). Магн. свойства элементарных частиц обусловлены наличием у них снина, а Оолее сложных снсто.м (ядер, атомов, молекул) — осо-бонностямн пх строения и вкладс1, т о суммарный магие-микросистемы отд. составляющих её частиц. [c.635]
Сведения о строении материи. Все тела представляют собой совокупность разного сорта моле1дгл и атомов.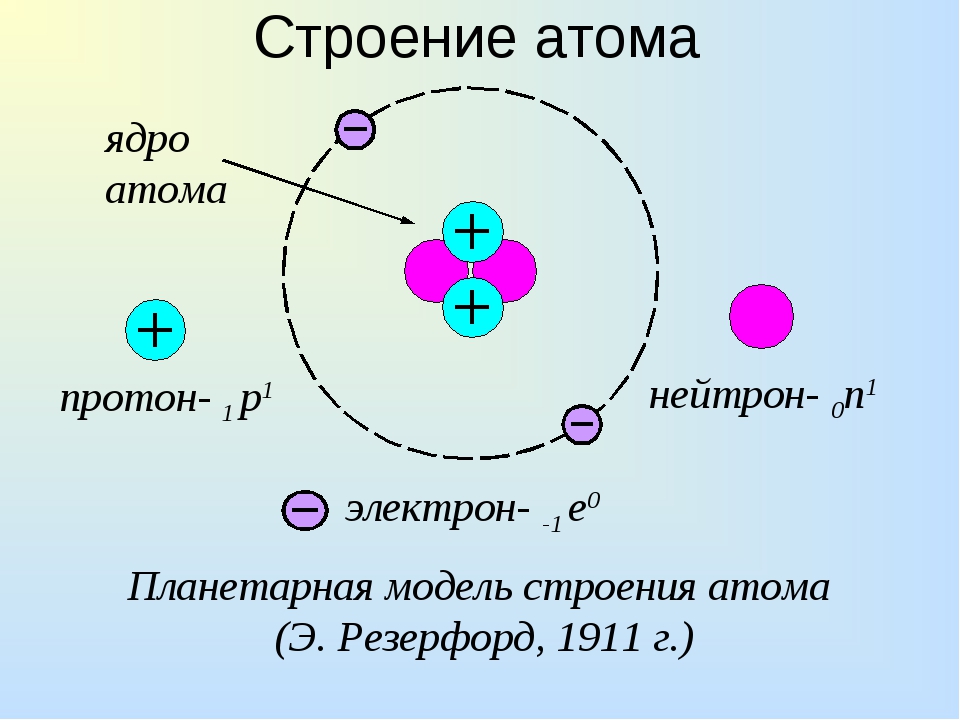 Данные о строении элементарных частиц
[c.113]
Данные о строении элементарных частиц
[c.113]
Расшифровка атомных и молекулярных спектров — установление связи между строением спектра и явлениями, происходяп ими в атомах и молекулах, давшее прочный фундамент оптическому спектральному анализу,— стала возможной лишь после того, как был отброшен предрассудок, что явления в микромире (в мире электронов и других элементарных частиц, атомов и молекул) подчиняются законам классической физики, частью которой является классическое учение о колебаниях и волнах. Законы классической физики были установлены в результате опытного изучения движения макротел (тел, содержап их громадное число атомов), электрических макротоков (токов, в которых участвует огромное число электронов) и т. д. Законы микромира оказались иными. [c.566]
Крупным шагом вперед по пути развития наших представлений о внешнем мире было открытие атомно-молекулярного строения веществ. Это открытие стало возможным только после длительного процесса накопления конкретных сведений о веществах, их составе и превращениях. Оказалось, что все основные свойства данного вещества несет в себе мельчайшая частичка этого вещества — молекула. Все молекулы данного вещества одинаковы, причем состав их не зависит от способа образования. Различных молекул имеется столько, сколько имеется различных веществ. Однако, и в этом была особенная ценность сделанного открытия, все огромное многообразие различных веществ можно представить в виде различнЬхх комбинаций из сравнительно небольшого (около 100) кодшчест-ва простейших элементов, носителями всех основных свойств которых являются частицы размерами около 10″ см, называемые атомами. Атом в переводе с греческого означает неделимый , т. е. в известном смысле — элементарный. Если вспомнить, что до конца XIX в. о строении атома ничего
[c.129]
Оказалось, что все основные свойства данного вещества несет в себе мельчайшая частичка этого вещества — молекула. Все молекулы данного вещества одинаковы, причем состав их не зависит от способа образования. Различных молекул имеется столько, сколько имеется различных веществ. Однако, и в этом была особенная ценность сделанного открытия, все огромное многообразие различных веществ можно представить в виде различнЬхх комбинаций из сравнительно небольшого (около 100) кодшчест-ва простейших элементов, носителями всех основных свойств которых являются частицы размерами около 10″ см, называемые атомами. Атом в переводе с греческого означает неделимый , т. е. в известном смысле — элементарный. Если вспомнить, что до конца XIX в. о строении атома ничего
[c.129]
Таким образом, к 1932 г. схема строения атома в значительной степени, определилась. Было установлено, что все атомы состоят из электронов и атомных ядер, которые в свою очередь состоят из протонов и нейтронов. Атомы и ядра различных веществ отличаются числом содержащихся в них электронов, протонов и нейтронов. При известных условиях можно изменить число содержащихся в атоме электронов (ионизация) или число содержащихся в ядре нуклонов (ядерная реакция). В результате таких, процессов из одних ядер и атомов получаются другие. Таким( образом, в некотором смысле атомы и ядра можно считать простым объединени1 м трех видов частиц — протонов, нейтронов и электронов. В связи с этим естественно было назвать эти частицы элементарными.
[c.132]
Атомы и ядра различных веществ отличаются числом содержащихся в них электронов, протонов и нейтронов. При известных условиях можно изменить число содержащихся в атоме электронов (ионизация) или число содержащихся в ядре нуклонов (ядерная реакция). В результате таких, процессов из одних ядер и атомов получаются другие. Таким( образом, в некотором смысле атомы и ядра можно считать простым объединени1 м трех видов частиц — протонов, нейтронов и электронов. В связи с этим естественно было назвать эти частицы элементарными.
[c.132]
ФАКТОР движущая сила какого-либо процесса, явления, определяющая его характер или отдельные его черты магнитного расщепления — множитель в формуле для расщепления уровней энергии, определяющий величину расщепления, выраженный в единицах магнетона Бора размагничивающий— коэффициент пропорциональности между напряженностью размагничивающего магнитного поля образца и его намагниченностью структурный—величина, характеризующая способность элементарной ячейки кристалла к когерентному рассеянию рентгеновского излучения, гамма-излучения и нейтронов в зависимости от внутреннего строения ячейки) ФЕРРИМАГНЕТИЗМ—состояние кристаллического вещества, при котором магнитные моменты ионов, входящих в его состав, образуют две или большее число подсистем (магнитных подрещеток) ФЕРРОМАГНЕТИЗМ—состояние кристаллического вещества, при котором магнитные моменты атомов или ионов самопроизвольно ориентированы параллельно друг другу ФИЛЬТРАЦИЯ—движение жидкости или газа через пористую среду ФЛУКТУАЦИЯ случайное отклонение значения физической величины от ее среднего значения, обусловленное прерывностью материи и тепловым движением частиц абсолютная — величина, равная корню квадратному из квадратичной флуктуации квадратичная 01ли дисперсия) равна среднему значению квадрата отклонения величины от ее среднего значения относительная равна отношению абсолютной флуктуации к среднему значению физической величины) ФЛУОРЕСЦЕНЦИЯ — люминесценция, быстро затухающая после прекращения действия возбудителя свечения ФОРМУЛА (барометрическая — соотношение, определяющее зависимость давления или плотности газа от высоты в ноле силы тяжести Больнмаиа показывает связь между энтропией системы и термодинамической вероятностью ее состояния Вина устанавливает зависимость испускательной способности абсолютно черного тела от его частоты в третьей степени и неизвестной функции отношения частоты к температуре)
[c. 292]
292]
Природа металла, строение его атомов (число неспаренных, валентных электронов), зарядность ионов, размер структурных частиц (ион-атомов), та или иная плотность упаковки, зависящая от вида элементарной кристаллической ячейки, оказывают в своей совокупности большое влияние на физические и механические свойства металлов плотность, твердость, пластичность, сжи- [c.34]
вопросов и ответов – Каково современное представление о строении атома? Чем протоны отличаются от нейтронов? В чем разница между протонами и электронами?
Каково современное представление о строении атома? Чем протоны отличаются от нейтронов? В чем разница между протонами и электронами?
Есть несколько концепций, которые лежат в основе нашего современного взгляда на атом. Я перечислил пять, и все они являются «современными» в том смысле, что были разработаны в прошлом столетии.
[Концепция 1] – Субатомные частицы
Протон: положительный заряд, масса примерно в 2000 раз больше массы электрона
Нейтрон: нейтральный или нулевой заряд, масса почти такая же, как у протона
Электрон: отрицательный заряд
Нейтрино: нейтральное, безмассовое (?)
Нейтрино — относительно неизвестная частица, но она играет важную роль в реакциях на Солнце.
[Концепция 2] – Силы, которые удерживают атомы вместе
Сильное взаимодействие: короткое взаимодействие, притягивает протоны к нейтронам и притягивает протоны к другим протонам
Электромагнитное взаимодействие: большое расстояние, притягивает электроны к протонам, отталкивает электроны от электронов и отталкивает протоны от протонов.
[Концепция 3] – Нейтроны распадаются
n → p + e + нейтрино
Или, наоборот, протон и электрон могут сливаться с образованием нейтрона:
p + e → n + нейтрино
[Концепция 4 ] – Дискретные электронные орбиты
Энергии атомов квантуются.
[Концепция 5] – Принцип запрета Паули
Никакие два электрона не могут занимать одно и то же пространство.
Давайте начнем с размышлений о том, как на самом деле образовались атомы в ранней Вселенной. Предположим, что на заре времён была смесь — суп или капля — протонов и электронов, плавающих в пространстве [Концепция 1].Большая часть космоса пуста, потому что эти частицы очень малы. Единственная сила, ощущаемая частицами, — это электромагнитная сила, потому что она дальнодействующая. Сильное взаимодействие похоже на клей на поверхности протонов [Концепция 2]. Если протон столкнется с другим протоном, он немедленно прилипнет к нему. Но протоны отталкиваются друг от друга из-за одинаковых зарядов, так что никогда этого не происходит. Вместо этого протоны притягивают электроны, которые быстро начинают вращаться вокруг них, как планеты, образуя водород — атом с одним протоном и одним электроном.Это основной материал Вселенной и первичный элемент звезд.
Единственная сила, ощущаемая частицами, — это электромагнитная сила, потому что она дальнодействующая. Сильное взаимодействие похоже на клей на поверхности протонов [Концепция 2]. Если протон столкнется с другим протоном, он немедленно прилипнет к нему. Но протоны отталкиваются друг от друга из-за одинаковых зарядов, так что никогда этого не происходит. Вместо этого протоны притягивают электроны, которые быстро начинают вращаться вокруг них, как планеты, образуя водород — атом с одним протоном и одним электроном.Это основной материал Вселенной и первичный элемент звезд.
Когда протоны и электроны спарены, их общий заряд равен нулю, поэтому они минимально взаимодействуют с соседними частицами. В звездах температура настолько высока (15 миллионов градусов и более), что протоны движутся достаточно быстро, чтобы преодолеть электромагнитную силу отталкивания и время от времени сталкиваться с другими протонами и прилипать к ним. Когда это происходит, один из протонов превращается в нейтрон [Концепция 3] и образует дейтерий (один электрон, вращающийся вокруг пары протон-нейтрон). Два атома дейтерия также могут столкнуться друг с другом и произвести атом гелия с двумя протонами и двумя нейтронами, слипшимися благодаря сильному взаимодействию. Эта четверка является ядром атома гелия с +2 единицами положительного заряда. Два электрона вращаются вокруг этого ядра, образуя нейтральный атом.
Два атома дейтерия также могут столкнуться друг с другом и произвести атом гелия с двумя протонами и двумя нейтронами, слипшимися благодаря сильному взаимодействию. Эта четверка является ядром атома гелия с +2 единицами положительного заряда. Два электрона вращаются вокруг этого ядра, образуя нейтральный атом.
Протон, электрон и нейтрон являются строительными блоками всех атомов. Легкие элементы формируются в центре звезд, как описано выше. Тяжелые элементы образуются во время взрывов сверхновых, когда ядра легких элементов сближаются и склеиваются клеем сильного взаимодействия.Атомы быстро располагают свои компоненты, чтобы они стали нейтральными. Следовательно, все атомы должны иметь одинаковое количество протонов и электронов. Нейтроны помогают удерживать протоны в ядре вместе, но по мере увеличения числа положительных протонов отталкивающий электромагнитный заряд в конечном итоге преодолевает сильное взаимодействие. Когда число протонов в ядре достигает сотни, ядра распадаются сами по себе, независимо от того, сколько нейтронов добавляется к смеси. Атомные орбиты аналогичны нашей Солнечной системе, где ядро играет роль солнца, а электроны выполняют роль планет.Солнце намного тяжелее планет, так же как протоны и нейтроны намного тяжелее электронов. Но есть несколько важных различий между Солнечной системой и атомами. Планеты могут находиться на любом расстоянии от Солнца, но электроны могут падать только на особые орбиты [Концепция 4], которые имеют заданные расстояния до ядра. Радиусы этих орбит находятся в соотношении 1:4:9:16:25. Кроме того, в Солнечной системе на каждой орбите может находиться любое количество планет (или спутников). Например, в поясе астероидов есть тысячи планет (или «астероидов»), вращающихся вокруг Солнца по практически одной и той же орбите.Но атомные орбиты подобны комнатам с несколькими кроватями, и как только они заполнены, дверь закрывается, и другие электроны должны найти место на других (незаполненных) орбитах [Концепция 5].
Атомные орбиты аналогичны нашей Солнечной системе, где ядро играет роль солнца, а электроны выполняют роль планет.Солнце намного тяжелее планет, так же как протоны и нейтроны намного тяжелее электронов. Но есть несколько важных различий между Солнечной системой и атомами. Планеты могут находиться на любом расстоянии от Солнца, но электроны могут падать только на особые орбиты [Концепция 4], которые имеют заданные расстояния до ядра. Радиусы этих орбит находятся в соотношении 1:4:9:16:25. Кроме того, в Солнечной системе на каждой орбите может находиться любое количество планет (или спутников). Например, в поясе астероидов есть тысячи планет (или «астероидов»), вращающихся вокруг Солнца по практически одной и той же орбите.Но атомные орбиты подобны комнатам с несколькими кроватями, и как только они заполнены, дверь закрывается, и другие электроны должны найти место на других (незаполненных) орбитах [Концепция 5].
Поведение атома в основном зависит от количества электронов на последней орбите (наиболее удаленной от ядра). Другими словами, полные или «заполненные» орбиты не участвуют в химических реакциях. Например, атомы с одним электроном на последней орбите обладают одинаковыми основными свойствами (например, литий, натрий, калий и т. д.).Это приводит к закономерностям в периодической таблице.
Другими словами, полные или «заполненные» орбиты не участвуют в химических реакциях. Например, атомы с одним электроном на последней орбите обладают одинаковыми основными свойствами (например, литий, натрий, калий и т. д.).Это приводит к закономерностям в периодической таблице.
Автор:
Элтон Смит, штатный научный сотрудник
Какие части атома?
С незапамятных времен люди стремились понять, из чего состоит Вселенная и все, что в ней находится. И хотя древние маги и философы представляли себе мир, состоящий из четырех или пяти элементов — земли, воздуха, воды, огня (и металла, или сознания) — к классической древности философы начали теоретизировать, что вся материя на самом деле состоит из крошечных, невидимые и неделимые атомы.
С тех пор ученые постоянно занимаются изучением атома, надеясь обнаружить его истинную природу и строение. К 20 веку наше понимание усовершенствовалось до такой степени, что мы смогли построить его точную модель. И за последнее десятилетие наше понимание продвинулось еще дальше, до такой степени, что мы пришли к подтверждению существования почти всех его теоретических частей.
И за последнее десятилетие наше понимание продвинулось еще дальше, до такой степени, что мы пришли к подтверждению существования почти всех его теоретических частей.
Сегодня атомные исследования сосредоточены на изучении структуры и функций материи на субатомном уровне.Это состоит не только в идентификации всех субатомных частиц, которые, как считается, составляют атом, но и в исследовании сил, которые ими управляют. К ним относятся сильные ядерные взаимодействия, слабые ядерные взаимодействия, электромагнетизм и гравитация. Вот разбивка всего, что мы узнали об атоме на данный момент…
Структура атома:
Наша текущая модель атома может быть разбита на три составные части – протоны, нейтроны и электроны. Каждая из этих частей имеет соответствующий заряд: протоны несут положительный заряд, электроны имеют отрицательный заряд, а нейтроны не имеют суммарного заряда.В соответствии со Стандартной моделью физики элементарных частиц протоны и нейтроны составляют ядро атома, а электроны вращаются вокруг него в «облаке».
Электроны в атоме притягиваются к протонам в ядре под действием электромагнитной силы. Электроны могут уйти со своей орбиты, но только в ответ на приложенный внешний источник энергии. Чем ближе орбита электрона к ядру, тем больше сила притяжения; следовательно, тем сильнее должна быть внешняя сила, чтобы заставить электрон убежать.
Электроны вращаются вокруг ядра по нескольким орбитам, каждая из которых соответствует определенному энергетическому уровню электрона. Электрон может изменить свое состояние на более высокий энергетический уровень, поглотив фотон с достаточной энергией, чтобы перевести его в новое квантовое состояние. Точно так же электрон в более высоком энергетическом состоянии может перейти в более низкое энергетическое состояние, излучая избыточную энергию в виде фотона.
Атомы электрически нейтральны, если они имеют одинаковое количество протонов и электронов.Атомы, имеющие либо дефицит, либо избыток электронов, называются ионами.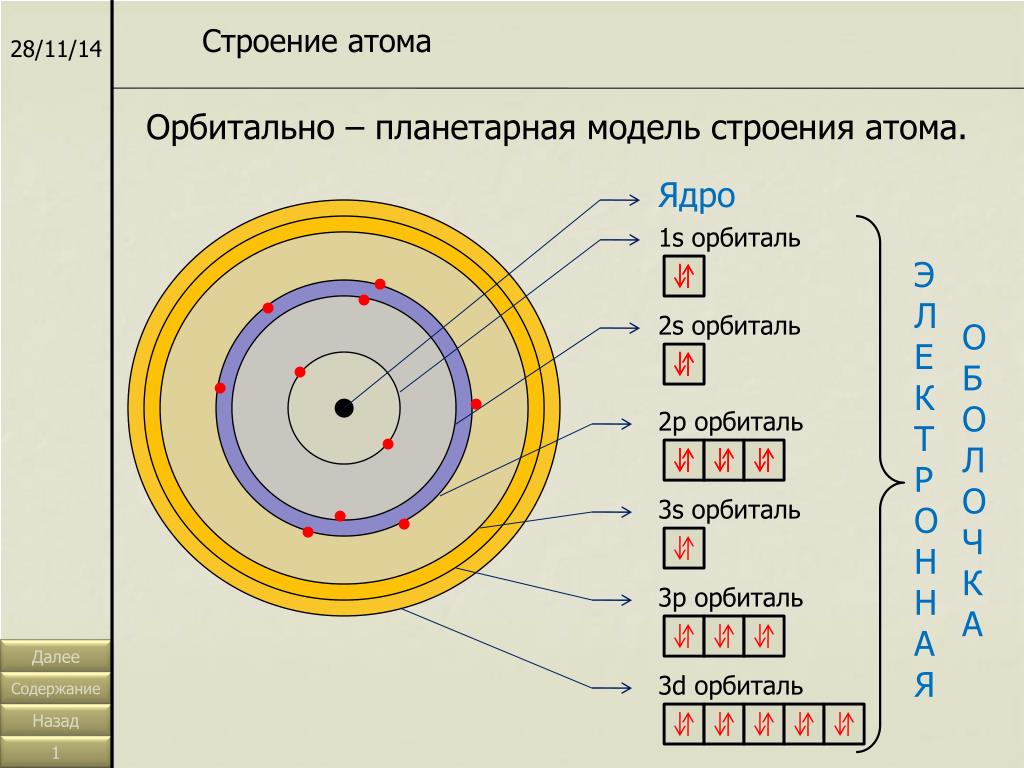 Электроны, которые находятся дальше всего от ядра, могут быть переданы другим соседним атомам или разделены между атомами. Благодаря этому механизму атомы могут связываться в молекулы и другие типы химических соединений.
Электроны, которые находятся дальше всего от ядра, могут быть переданы другим соседним атомам или разделены между атомами. Благодаря этому механизму атомы могут связываться в молекулы и другие типы химических соединений.
Все три из этих субатомных частиц являются фермионами, классом частиц, связанных с материей, которая является либо элементарной (электроны), либо составной (протоны и нейтроны) по своей природе. Это означает, что электроны не имеют известной внутренней структуры, тогда как протоны и нейтроны состоят из других субатомных частиц.называются кварками. В атомах есть два типа кварков, которые имеют дробный электрический заряд.
Стандартная модель элементарных частиц. Предоставлено: PBS NOVA/Fermilab/Particle Data Group Протоны состоят из двух «верхних» кварков (каждый с зарядом +2/3) и одного «нижнего» кварка (-1/3), а нейтроны состоят из одного верхнего кварк и два нижних кварка. Это различие объясняет разницу в заряде между двумя частицами, которая соответствует заряду +1 и 0 соответственно, в то время как электроны имеют заряд -1.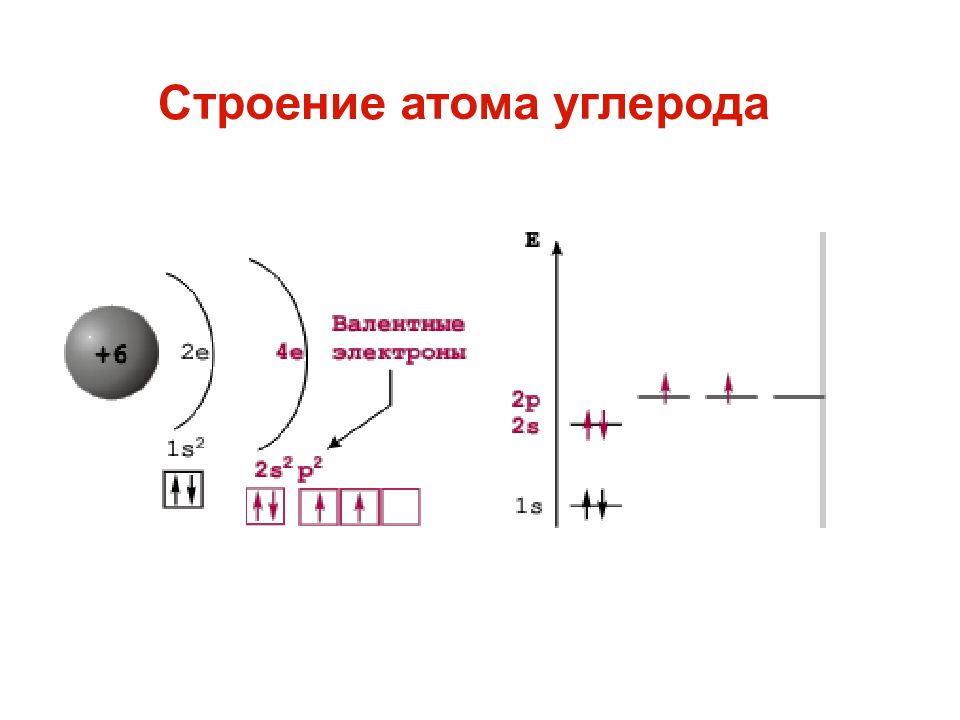
Другие субатомные частицы включают лептоны, которые в сочетании с фермионами образуют строительные блоки материи. В современной модели атома шесть лептонов: электрон, мюон и тау-частицы, а также связанные с ними нейтрино. Различные разновидности лептоновых частиц, обычно называемые «ароматами», различаются по своим размерам и зарядам, что влияет на уровень их электромагнитных взаимодействий.
Кроме того, существуют калибровочные бозоны, известные как «переносчики силы», поскольку они передают физические силы.Например, глюоны ответственны за сильное ядерное взаимодействие, удерживающее кварки вместе, в то время как бозоны W и Z (все еще гипотетические) считаются ответственными за слабое ядерное взаимодействие, лежащее в основе электромагнетизма. Фотоны — это элементарная частица, из которой состоит свет, а бозон Хиггса отвечает за массу бозонов W и Z.
Атомная масса:
Большая часть массы атома приходится на протоны и нейтроны, из которых состоит его ядро.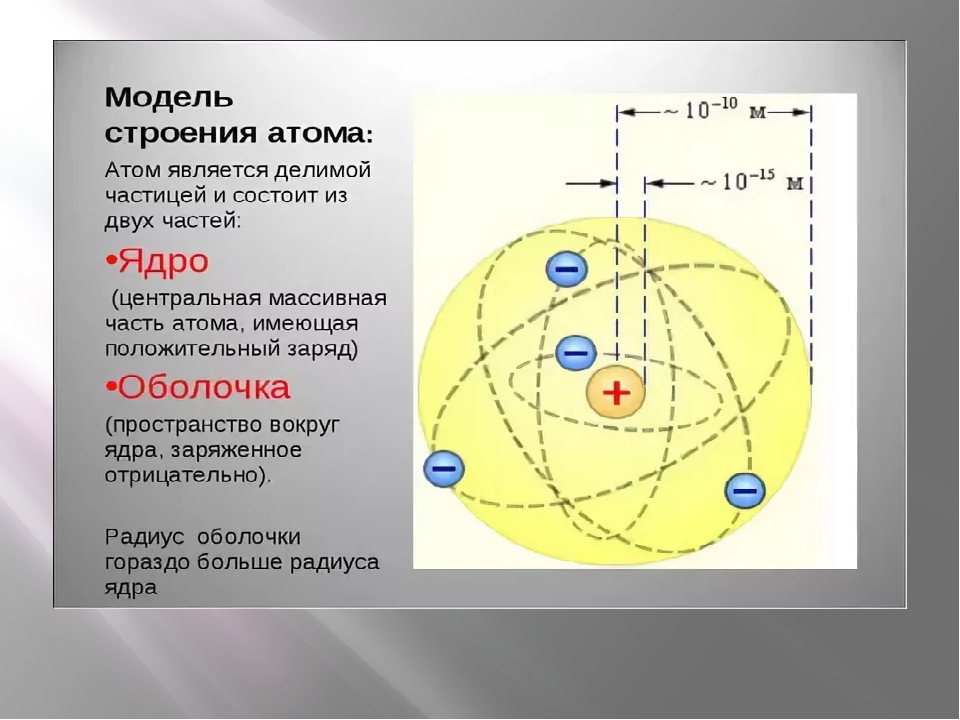 Электроны являются наименее массивными частицами, составляющими атом, с массой 9.11 x 10 -31 кг и размер слишком мал, чтобы его можно было измерить современными методами. Протоны имеют массу, которая в 1836 раз больше массы электрона (1,6726×10 -27 кг), а нейтроны являются самыми массивными из трех, 1,6929×10 -27 кг (в 1,839 раз больше массы электрона). ).
Электроны являются наименее массивными частицами, составляющими атом, с массой 9.11 x 10 -31 кг и размер слишком мал, чтобы его можно было измерить современными методами. Протоны имеют массу, которая в 1836 раз больше массы электрона (1,6726×10 -27 кг), а нейтроны являются самыми массивными из трех, 1,6929×10 -27 кг (в 1,839 раз больше массы электрона). ).
Общее количество протонов и нейтронов в ядре атома (называемых «нуклонами») называется массовым числом.Например, элемент Углерод-12 назван так потому, что имеет массовое число 12, полученное из его 12 нуклонов (шесть протонов и шесть нейтронов). Однако элементы также располагаются на основе их атомных номеров, которые совпадают с количеством протонов в ядре. В этом случае углерод имеет атомный номер 6.
. Фактическую массу покоящегося атома очень трудно измерить, так как даже самые массивные атомы слишком легки, чтобы выразить их в обычных единицах. Таким образом, ученые часто используют единую атомную единицу массы (u), также называемую дальтоном (Da), которая определяется как двенадцатая часть массы свободного нейтрального атома углерода-12, что приблизительно равно 1.66×10 -27 кг.
Таким образом, ученые часто используют единую атомную единицу массы (u), также называемую дальтоном (Da), которая определяется как двенадцатая часть массы свободного нейтрального атома углерода-12, что приблизительно равно 1.66×10 -27 кг.
Химики также используют моли, единицу измерения, определяемую как один моль любого элемента, всегда имеющего одинаковое количество атомов (около 6,022×10 23 ). Это число было выбрано таким образом, что если элемент имеет атомную массу 1 u, моль атомов этого элемента имеет массу, близкую к одному грамму. Из-за определения единой атомной единицы массы каждый атом углерода-12 имеет атомную массу ровно 12 u, поэтому моль атомов углерода-12 весит ровно 0,012 кг.
Радиоактивный распад:
Любые два атома, имеющие одинаковое количество протонов, принадлежат к одному и тому же химическому элементу.Но атомы с одинаковым количеством протонов могут иметь разное количество нейтронов, которые определяются как разные изотопы одного и того же элемента. Эти изотопы часто нестабильны, и известно, что все изотопы с атомным номером больше 82 радиоактивны.
Эти изотопы часто нестабильны, и известно, что все изотопы с атомным номером больше 82 радиоактивны.
Когда элемент подвергается распаду, его ядро теряет энергию, испуская излучение, которое может состоять из альфа-частиц (атомы гелия), бета-частиц (позитронов), гамма-лучей (высокочастотная электромагнитная энергия). ) и конверсионные электроны.Скорость, с которой распадается нестабильный элемент, известна как его «период полураспада», который представляет собой количество времени, необходимое для того, чтобы элемент упал до половины своего первоначального значения.
На стабильность изотопа влияет соотношение протонов и нейтронов. Из 339 различных типов элементов, встречающихся в природе на Земле, 254 (около 75%) были помечены как «стабильные изотопы», то есть не подверженные распаду. Еще 34 радиоактивных элемента имеют период полураспада более 80 миллионов лет и также существуют со времен ранней Солнечной системы (поэтому их называют «изначальными элементами»).
Наконец, известно, что еще 51 короткоживущий элемент встречается в природе как «дочерние элементы» (то есть ядерные побочные продукты) распада других элементов (таких как радий из урана). Кроме того, короткоживущие радиоактивные элементы могут быть результатом естественных энергетических процессов на Земле, таких как бомбардировка космическими лучами (например, углерод-14, который встречается в нашей атмосфере).
История обучения:
Самые ранние известные примеры атомной теории происходят из Древней Греции и Индии, где такие философы, как Демокрит, постулировали, что вся материя состоит из крошечных, неделимых и неразрушимых частиц.Термин «атом» был придуман в Древней Греции и породил школу мысли, известную как «атомизм». Однако эта теория была скорее философской концепцией, чем научной.
Различные атомы и молекулы, изображенные в «Новой системе химической философии» Джона Дальтона (1808 г.). Предоставлено: Public Domain Только в 19 веке теория атомов стала сформулирована как научный вопрос, когда были проведены первые эксперименты, основанные на фактических данных. Например, в начале 1800-х годов английский ученый Джон Дальтон использовал концепцию атома, чтобы объяснить, почему химические элементы реагируют определенными наблюдаемыми и предсказуемыми способами.
Например, в начале 1800-х годов английский ученый Джон Дальтон использовал концепцию атома, чтобы объяснить, почему химические элементы реагируют определенными наблюдаемыми и предсказуемыми способами.
Дальтон начал с вопроса о том, почему элементы реагируют в соотношении небольших целых чисел, и пришел к выводу, что эти реакции происходят в целых числах, кратных дискретным единицам, — другими словами, атомам. Проведя серию экспериментов с газами, Дальтон разработал так называемую атомную теорию Дальтона, которая остается одним из краеугольных камней современной физики и химии.
Теория сводится к пяти посылкам: элементы в чистом виде состоят из частиц, называемых атомами; атомы определенного элемента все одинаковы, вплоть до самого последнего атома; атомы разных элементов можно отличить по их атомному весу; атомы элементов объединяются, образуя химические соединения; атомы не могут быть ни созданы, ни уничтожены в химической реакции, всегда меняется только их группировка.
К концу 19 века ученые начали теоретизировать, что атом состоит из более чем одной фундаментальной единицы. Однако большинство ученых предполагали, что эта единица будет размером с наименьший из известных атомов — водород. А затем в 1897 г., проведя серию экспериментов с катодными лучами, физик Дж.Дж. Томпсон объявил, что открыл элемент, который в 1000 раз меньше и в 1800 раз легче атома водорода.
Модель атома сливового пудинга, предложенная Джоном Дальтоном.Фото: britannica.comЕго эксперименты также показали, что они идентичны частицам, испускаемым фотоэлектрическим эффектом и радиоактивными материалами. Последующие эксперименты показали, что эта частица переносит электрический ток через металлические провода и отрицательные электрические заряды внутри атомов. Вот почему частица, которая первоначально была названа «корпускула», позже была изменена на «электрон» в честь частицы, предсказанной Джорджем Джонстоном Стони в 1874 году.
Однако Томсон также постулировал, что электроны распределены по всему атому, который представляет собой однородное море положительного заряда. Это стало известно как «модель сливового пудинга», которая позже оказалась ошибочной. Это произошло в 1909 году, когда физики Ганс Гигер и Эрнест Марсден (под руководством Эрнеста Резерфода) провели свой эксперимент с использованием металлической фольги и альфа-частиц.
Это стало известно как «модель сливового пудинга», которая позже оказалась ошибочной. Это произошло в 1909 году, когда физики Ганс Гигер и Эрнест Марсден (под руководством Эрнеста Резерфода) провели свой эксперимент с использованием металлической фольги и альфа-частиц.
В соответствии с атомной моделью Дальтона они полагали, что альфа-частицы будут проходить прямо через фольгу с небольшим отклонением. Однако многие частицы были отклонены на углы более 90°. Чтобы объяснить это, Резерфорд предположил, что положительный заряд атома сосредоточен в крошечном ядре в центре.
В 1913 году физик Нильс Бор предложил модель, в которой электроны вращаются вокруг ядра, но могут делать это только на конечном наборе орбит. Он также предположил, что электроны могут перескакивать между орбитами, но только при дискретных изменениях энергии, соответствующих поглощению или излучению фотона. Это не только усовершенствовало предложенную Резерфордом модель, но и породило концепцию квантованного атома, в котором материя ведет себя дискретными пакетами.
Разработка масс-спектрометра, который использует магнит для изменения траектории пучка ионов, позволила измерить массу атомов с повышенной точностью. Химик Фрэнсис Уильям Астон использовал этот прибор, чтобы показать, что изотопы имеют разные массы. За этим, в свою очередь, последовал физик Джеймс Чедвик, который в 1932 году предложил нейтрон как способ объяснения существования изотопов.
В начале 20 века квантовая природа атомов получила дальнейшее развитие.В 1922 году немецкие физики Отто Штерн и Вальтер Герлах провели эксперимент, в котором пучок атомов серебра направлялся через магнитное поле, которое должно было разделить пучок между направлениями углового момента (или спина) атомов.
Известный как эксперимент Штерна-Герлаха, в результате луч расщеплялся на две части в зависимости от того, направлено ли вращение атомов вверх или вниз. В 1926 году физик Эрвин Шредингер использовал идею о том, что частицы ведут себя как волны, чтобы разработать математическую модель, описывающую электроны как трехмерные волны, а не просто частицы.
Последствием использования волновых форм для описания частиц является то, что математически невозможно получить точные значения как для положения, так и для импульса частицы в любой момент времени. В том же году Вернер Гейзенберг сформулировал эту проблему и назвал ее «принципом неопределенности». Согласно Гейзенбергу, для данного точного измерения положения можно получить только диапазон вероятных значений импульса, и наоборот.
Деление ядер, при котором атом урана-92 расщепляется свободным нейтроном с образованием бария и криптона.Фото: physics.stackexchange.comВ 1930-х годах физики открыли ядерное деление благодаря экспериментам Отто Гана, Лизы Мейтнер и Отто Фриша. Эксперименты Гана включали направление нейтронов на атомы урана в надежде создать трансурановый элемент. Вместо этого процесс превратил его образец урана-92 (Ur 92 ) в два новых элемента — барий (B 56 ) и криптон (Kr 27 ).
Мейтнер и Фриш проверили эксперимент и приписали его расщеплению атомов урана с образованием двух элементов с одинаковым общим атомным весом, что также привело к высвобождению значительного количества энергии за счет разрыва атомных связей. В последующие годы начались исследования возможной вепонизации этого процесса (т. е. ядерного оружия), что привело к созданию первых атомных бомб в США к 1945 году.
В последующие годы начались исследования возможной вепонизации этого процесса (т. е. ядерного оружия), что привело к созданию первых атомных бомб в США к 1945 году.
В 1950-х годах разработка усовершенствованных ускорителей и детекторов частиц позволила ученым изучить столкновения атомов, движущихся с высокой энергией. На основе этого была разработана Стандартная модель физики элементарных частиц, которая до сих пор успешно объясняла свойства ядра, существование теоретических субатомных частиц и силы, управляющие их взаимодействием.
Современные эксперименты:
Со второй половины 20 века было сделано много новых и захватывающих открытий в области атомной теории и квантовой механики. Например, в 2012 году долгие поиски бозона Хиггса привели к прорыву, когда исследователи, работающие в Европейской организации ядерных исследований (ЦЕРН) в Швейцарии, объявили о его открытии.
Большой адронный коллайдер (БАК) в Европейской организации ядерных исследований (ЦЕРН).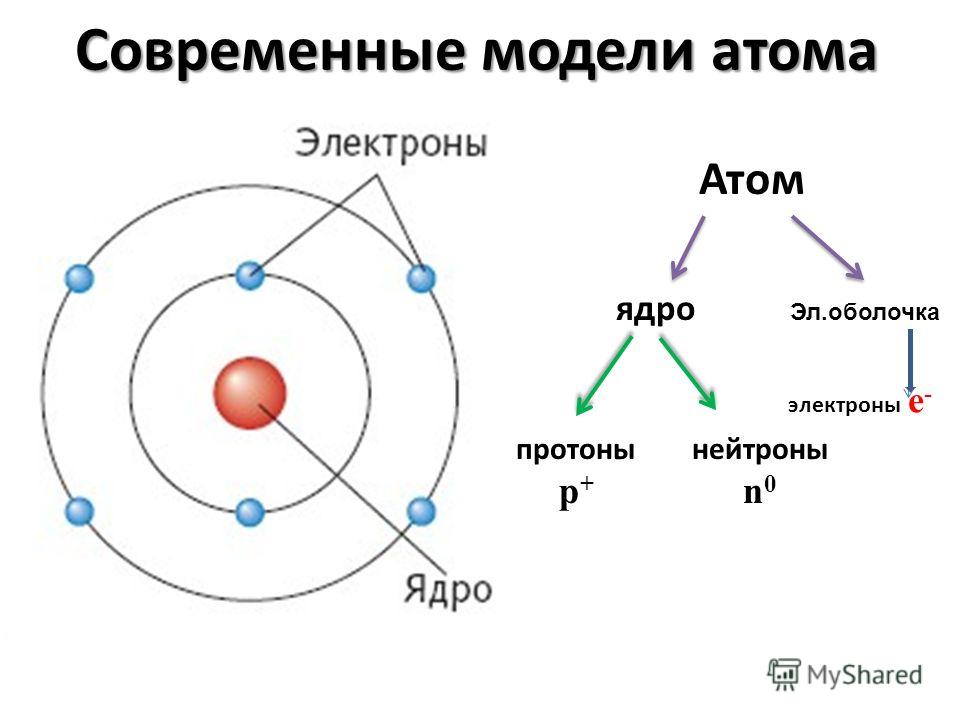 Кредит: дом.cern
Кредит: дом.cernВ последние десятилетия физики посвятили много времени и энергии разработке единой теории поля (также известной как Теория Великого Объединения или Теория Всего). По сути, с тех пор, как была впервые предложена Стандартная модель, ученые стремились понять, как четыре фундаментальные силы Вселенной (гравитация, сильное и слабое ядерное взаимодействие и электромагнетизм) работают вместе.
В то время как гравитацию можно понять с помощью теорий относительности Эйнштейна, а ядерные силы и электромагнетизм можно понять с помощью квантовой теории, ни одна из теорий не может объяснить все четыре силы, действующие вместе.Попытки решить эту проблему за эти годы привели к ряду предложенных теорий, от теории струн до петлевой квантовой гравитации. На сегодняшний день ни одна из этих теорий не привела к прорыву.
Наше понимание атома прошло долгий путь от классических моделей, рассматривавших его как инертное твердое тело, механически взаимодействующее с другими атомами, до современных теорий, согласно которым атомы состоят из энергичных частиц, которые ведут себя непредсказуемо. Хотя на это ушло несколько тысяч лет, наши знания о фундаментальной структуре всей материи значительно продвинулись вперед.
Хотя на это ушло несколько тысяч лет, наши знания о фундаментальной структуре всей материи значительно продвинулись вперед.
И все же остается много загадок, которые еще предстоит разгадать. Со временем и постоянными усилиями мы, наконец, сможем раскрыть последние оставшиеся секреты атома. С другой стороны, вполне может быть, что любые новые открытия, которые мы делаем, только вызовут новые вопросы — и они могут быть еще более запутанными, чем те, которые были раньше!
Мы написали много статей об атоме для Universe Today. Вот статьи об атомной модели Джона Дальтона, атомной модели Нильса Бора, Кем был Демокрит? и Сколько атомов во Вселенной?
Если вам нужна дополнительная информация об атоме, ознакомьтесь со статьей НАСА об анализе крошечных образцов, а вот ссылка на статью НАСА об атомах, элементах и изотопах.
Мы также записали целую серию Astronomy Cast, посвященную атому. Послушайте, Эпизод 164: Внутри атома, Эпизод 263: Радиоактивный распад и Эпизод 394: Стандартная модель, Бозоны.
Вот так:
Нравится Загрузка…
Квантовая теория атома
Простейшими атомами для рассмотрения являются водородные атомы, такие как H и He + , потому что нет взаимодействий между электронами, усложняющих задачу.
Молекула воды.Молекула воды состоит из атома кислорода и двух атомов водорода, которые соединены под углом 105°.
Атом, крошечный основной строительный блок материи. Весь материал на Земле состоит из различных комбинаций атомов. Атомы — это мельчайшие частицы химического элемента, которые по-прежнему обладают всеми химическими свойствами, уникальными для этого элемента. Ряд из 100 миллионов атомов будет иметь длину всего около сантиметра. См. химический элемент.
Понимание атомов является ключом к пониманию физического мира.В природе существует более 100 различных элементов, каждый из которых имеет свой уникальный атомный состав. Атомы этих элементов реагируют друг с другом и комбинируются по-разному, образуя практически неограниченное количество химических соединений. Когда два или более атома объединяются, они образуют молекулу. Например, два атома элемента водорода (сокращенно H) соединяются с одним атомом элемента кислорода (O) с образованием молекулы воды (h30).
Когда два или более атома объединяются, они образуют молекулу. Например, два атома элемента водорода (сокращенно H) соединяются с одним атомом элемента кислорода (O) с образованием молекулы воды (h30).
Поскольку вся материя — от ее образования в ранней Вселенной до современных биологических систем — состоит из атомов, понимание их структуры и свойств играет жизненно важную роль в физике, химии и медицине.Фактически, знание атомов необходимо для современного научного понимания сложных систем, управляющих физическим и биологическим мирами. Атомы и образуемые ими соединения участвуют почти во всех процессах, происходящих на Земле и в космосе. Все организмы полагаются на набор химических соединений и химических реакций для переваривания пищи, транспортировки энергии и размножения. Звезды, такие как Солнце, полагаются на реакции в атомных ядрах для производства энергии. Ученые дублируют эти реакции в лабораториях на Земле и изучают их, чтобы узнать о процессах, происходящих во Вселенной.
На протяжении всей истории люди пытались объяснить мир с точки зрения его основных частей. Древнегреческие философы придумали идею атома, которую они определили как наименьшую возможную часть вещества. Слово атом происходит от греческого слова, означающего «неделимый». Древние греки также верили, что эта фундаментальная частица неразрушима. С тех пор ученые узнали, что атомы не неделимы, а состоят из более мелких частиц, и атомы разных элементов содержат разное количество каждого типа этих более мелких частиц.
Атомы состоят из более мелких частиц, называемых электронами, протонами и нейтронами. Атом состоит из облака электронов, окружающего небольшое плотное ядро из протонов и нейтронов. Электроны и протоны обладают свойством, называемым электрическим зарядом, которое влияет на то, как они взаимодействуют друг с другом и с другими электрически заряженными частицами. Электроны несут отрицательный электрический заряд, а протоны имеют положительный электрический заряд. Отрицательный заряд противоположен положительному заряду, и, подобно противоположным полюсам магнита, эти противоположные электрические заряды притягиваются друг к другу.И наоборот, одинаковые заряды (отрицательный и отрицательный или положительный и положительный) отталкиваются друг от друга. Притяжение между электронами атома и его протонами удерживает атом вместе. Обычно атом электрически нейтрален, а это означает, что отрицательный заряд его электронов в точности равен положительному заряду его протонов.
Отрицательный заряд противоположен положительному заряду, и, подобно противоположным полюсам магнита, эти противоположные электрические заряды притягиваются друг к другу.И наоборот, одинаковые заряды (отрицательный и отрицательный или положительный и положительный) отталкиваются друг от друга. Притяжение между электронами атома и его протонами удерживает атом вместе. Обычно атом электрически нейтрален, а это означает, что отрицательный заряд его электронов в точности равен положительному заряду его протонов.
Ядро содержит почти всю массу атома, но занимает лишь крошечную часть пространства внутри атома. Диаметр типичного ядра составляет всего около 1 × 10-14 м (4 × 10-13 дюймов), или около 1/100 000 диаметра всего атома.Электронное облако составляет остальную часть общего размера атома. Если бы атом был увеличен до размера футбольного стадиона, ядро было бы размером с виноградину.
электронов[править | править источник]
Электроны — крошечные отрицательно заряженные частицы, образующие облако вокруг ядра атома.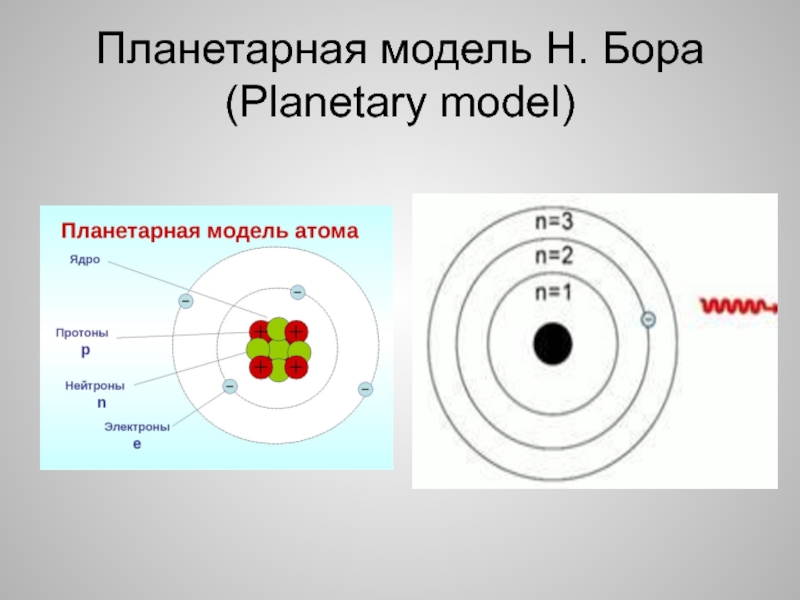 Каждый электрон несет одну фундаментальную единицу отрицательного электрического заряда, или –1.
Каждый электрон несет одну фундаментальную единицу отрицательного электрического заряда, или –1.
Электрон — одна из самых легких частиц с известной массой.Капля воды весит примерно в миллиард, миллиард, миллиард раз больше, чем электрон. Физики считают, что электроны — одна из фундаментальных частиц физики, а это значит, что их нельзя разделить на что-то меньшее. Физики также считают, что электроны не имеют реального размера, а представляют собой настоящие точки в пространстве, то есть электрон имеет нулевой радиус.
Электроны ведут себя не так, как обычные предметы, потому что электроны могут вести себя как частицы и волны. На самом деле все объекты обладают этим свойством, но волнообразное поведение более крупных объектов, таких как песок, мрамор или даже люди, слишком мало для измерения.В очень малых частицах волновое поведение измеримо и важно. Электроны движутся вокруг ядра атома, но поскольку они ведут себя как волны, они не следуют определенной траектории, как это делает планета, вращающаяся вокруг Солнца. Вместо этого они образуют области отрицательного электрического заряда вокруг ядра. Эти области называются орбиталями, и они соответствуют пространству, в котором наиболее вероятно нахождение электрона. Как мы обсудим позже, орбитали имеют разные размеры и формы в зависимости от энергии занимающих их электронов.
Вместо этого они образуют области отрицательного электрического заряда вокруг ядра. Эти области называются орбиталями, и они соответствуют пространству, в котором наиболее вероятно нахождение электрона. Как мы обсудим позже, орбитали имеют разные размеры и формы в зависимости от энергии занимающих их электронов.
Протоны и нейтроны[править | править источник]
Протоны несут изменение +1, а электроны несут противоположное изменение, -1. Количество протонов в ядре определяет общее количество положительного заряда в атоме.
Нейтроны примерно такого же размера, как протоны, но их масса немного больше. Без присутствия нейтронов отталкивание между протонами привело бы к разлету ядра. Рассмотрим элемент гелий, в ядре которого есть два протона. Если бы ядро не содержало также и нейтронов, оно было бы нестабильным из-за электрического отталкивания между протонами.(Процесс, с помощью которого нейтроны удерживают ядро вместе, объясняется ниже в разделе «Сильное взаимодействие» этой статьи. ) Ядру гелия для стабильности требуется один или два нейтрона. Большинство атомов стабильны и существуют в течение длительного периода времени, но некоторые атомы нестабильны и спонтанно распадаются и превращаются или распадаются на другие атомы.
) Ядру гелия для стабильности требуется один или два нейтрона. Большинство атомов стабильны и существуют в течение длительного периода времени, но некоторые атомы нестабильны и спонтанно распадаются и превращаются или распадаются на другие атомы.
В отличие от электронов, которые являются фундаментальными частицами, протоны и нейтроны не являются фундаментальными частицами, а состоят из кварков. Физики знают о шести различных кварках.Нейтроны и протоны состоят из верхних и нижних кварков — двух из шести различных видов кварков. Причудливые названия кварков не имеют ничего общего с их свойствами; имена — это просто ярлыки, позволяющие отличить один кварк от другого.
Атомы обладают несколькими свойствами, которые помогают отличить один тип атома от другого и определить, как атомы изменяются при определенных условиях.
Атомный номер[править | править источник]
Каждый элемент имеет уникальное количество протонов в атомах.Это число называется атомным номером (сокращенно Z). Поскольку атомы обычно электрически нейтральны, атомный номер также указывает, сколько электронов будет иметь атом. Количество электронов, в свою очередь, определяет многие химические и физические свойства атома. Самый легкий атом, водород, имеет атомный номер, равный единице, содержит один протон и (если он электрически нейтрален) один электрон. Самый массивный стабильный атом в природе — висмут (Z = 83). В природе существуют и более массивные нестабильные атомы, но со временем они распадаются и превращаются в другие атомы.Ученые изготовили в лабораториях еще более массивные нестабильные элементы.
Поскольку атомы обычно электрически нейтральны, атомный номер также указывает, сколько электронов будет иметь атом. Количество электронов, в свою очередь, определяет многие химические и физические свойства атома. Самый легкий атом, водород, имеет атомный номер, равный единице, содержит один протон и (если он электрически нейтрален) один электрон. Самый массивный стабильный атом в природе — висмут (Z = 83). В природе существуют и более массивные нестабильные атомы, но со временем они распадаются и превращаются в другие атомы.Ученые изготовили в лабораториях еще более массивные нестабильные элементы.
Массовый номер[править | править источник]
Суммарное число протонов и нейтронов в ядре атома является массовым числом атома (сокращенно А). Массовое число атома является аппроксимацией массы атома. Электроны вносят очень небольшой вклад в массу атома, поэтому они не включаются в массовое число. Стабильный атом гелия может иметь массовое число, равное трем (два протона плюс один нейтрон) или четырем (два протона плюс два нейтрона). Висмуту с 83 протонами для стабильности требуется 126 нейтронов, поэтому его массовое число равно 209 (83 протона плюс 126 нейтронов).
Висмуту с 83 протонами для стабильности требуется 126 нейтронов, поэтому его массовое число равно 209 (83 протона плюс 126 нейтронов).
Атомная масса и вес[править | править источник]
Ученые обычно измеряют массу атома в единицах, называемых атомной единицей массы (сокращенно а.е.м.). Они определяют а.е.м. как ровно 1/12 массы атома углерода с шестью протонами и шестью нейтронами. В этой шкале масса протона составляет 1,00728 а.е.м., а масса нейтрона — 1,00866 а.е.м. Масса атома, измеренная в а.е.м., почти равна его массовому числу.
Ученые могут использовать устройство, называемое масс-спектрометром, для измерения атомной массы. Масс-спектрометр удаляет один или несколько электронов из атома. Электроны настолько легки, что их удаление почти не меняет массу атома. Затем спектрометр посылает атом через магнитное поле, область пространства, которая воздействует на магнитные или электрически заряженные частицы. Из-за недостающих электронов атом имеет больше протонов, чем электронов, и, следовательно, чистый положительный заряд. Магнитное поле изгибает путь положительно заряженного атома, когда он движется через поле. Величина изгиба зависит от массы атома. Более легкие атомы будут затронуты сильнее, чем более тяжелые атомы. Измеряя, насколько изгибается траектория движения атома, ученый может определить массу атома.
Магнитное поле изгибает путь положительно заряженного атома, когда он движется через поле. Величина изгиба зависит от массы атома. Более легкие атомы будут затронуты сильнее, чем более тяжелые атомы. Измеряя, насколько изгибается траектория движения атома, ученый может определить массу атома.
Атомная масса атома, которая зависит от количества присутствующих протонов и нейтронов, также относится к атомной массе элемента. Вес обычно относится к силе тяжести, действующей на объект, но атомный вес на самом деле просто еще один способ выразить массу.Атомный вес элемента указан в граммах. Он представляет собой массу одного моля (6,02 × 1023 атомов) этого элемента. Численно атомный вес и атомная масса элемента совпадают, но первая выражается в граммах, а вторая — в единицах атомной массы. Итак, атомная масса водорода равна 1 грамму, а атомная масса водорода равна 1 а.е.м.
Изотопы[править | править источник]
Атомный номер атома представляет собой количество протонов в его ядре.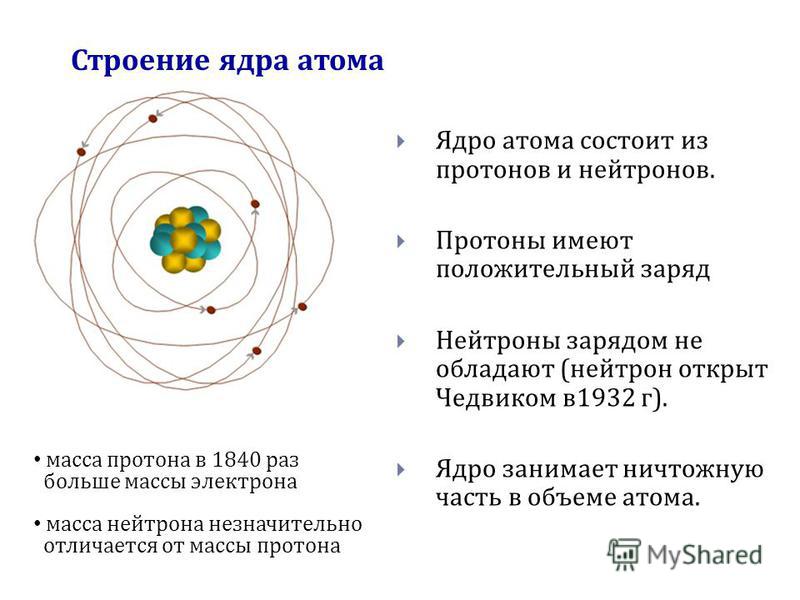 Это число остается постоянным для данного элемента.Однако количество нейтронов может варьироваться, создавая изотопы с одинаковым химическим поведением, но разной массой. Изотопы водорода: протий (без нейтронов), дейтерий (один нейтрон) и тритий (два нейтрона). Водород всегда имеет один протон в ядре. Эти иллюстрации выполнены не в масштабе — ядро примерно в 10 000 раз меньше среднего радиуса орбиты электрона, который определяет общий размер атома.
Это число остается постоянным для данного элемента.Однако количество нейтронов может варьироваться, создавая изотопы с одинаковым химическим поведением, но разной массой. Изотопы водорода: протий (без нейтронов), дейтерий (один нейтрон) и тритий (два нейтрона). Водород всегда имеет один протон в ядре. Эти иллюстрации выполнены не в масштабе — ядро примерно в 10 000 раз меньше среднего радиуса орбиты электрона, который определяет общий размер атома.
Атомы одного и того же элемента, отличающиеся массовым числом, называются изотопами.Поскольку все атомы данного элемента имеют одинаковое количество протонов в ядре, изотопы должны иметь разное количество нейтронов. Гелий, например, имеет атомный номер 2 из-за двух протонов в его ядре. Но у гелия есть два стабильных изотопа: один с одним нейтроном в ядре и массовым числом, равным трем, и другой с двумя нейтронами и массовым числом, равным четырем.
Ученые прикрепляют массовое число к названию элемента, чтобы различать изотопы. Согласно этому соглашению, гелий с массовым числом три называется гелием-3, а гелий с массовым числом четыре называется гелием-4.Гелий в своей естественной форме на Земле представляет собой смесь этих двух изотопов. Процент каждого изотопа, встречающегося в природе, называется изотопным содержанием изотопа. Изотопное содержание гелия-3 очень мало, всего 0,00014%, тогда как содержание гелия-4 составляет 99,99986%. Это означает, что только примерно один из каждого миллиона атомов гелия является гелием-3, а все остальные являются гелием-4. Висмут имеет только один встречающийся в природе стабильный изотоп, висмут-209. Таким образом, изотопное содержание висмута-209 составляет 100 процентов.Элемент с наибольшим количеством стабильных изотопов в природе — это олово, имеющее десять стабильных изотопов.
Согласно этому соглашению, гелий с массовым числом три называется гелием-3, а гелий с массовым числом четыре называется гелием-4.Гелий в своей естественной форме на Земле представляет собой смесь этих двух изотопов. Процент каждого изотопа, встречающегося в природе, называется изотопным содержанием изотопа. Изотопное содержание гелия-3 очень мало, всего 0,00014%, тогда как содержание гелия-4 составляет 99,99986%. Это означает, что только примерно один из каждого миллиона атомов гелия является гелием-3, а все остальные являются гелием-4. Висмут имеет только один встречающийся в природе стабильный изотоп, висмут-209. Таким образом, изотопное содержание висмута-209 составляет 100 процентов.Элемент с наибольшим количеством стабильных изотопов в природе — это олово, имеющее десять стабильных изотопов.
Все элементы также имеют нестабильные изотопы, которые более подвержены разрушению или распаду, чем другие изотопы элемента. При распаде атомов изменяется число протонов в их ядре. Поскольку количество протонов в ядре атома определяет, к какому элементу принадлежит этот атом, этот распад превращает один элемент в другой. Разные изотопы распадаются с разной скоростью.Один из способов измерить скорость распада изотопа — найти его период полураспада. Период полураспада изотопа — это время, которое проходит до тех пор, пока половина образца изотопа не распадётся.
Разные изотопы распадаются с разной скоростью.Один из способов измерить скорость распада изотопа — найти его период полураспада. Период полураспада изотопа — это время, которое проходит до тех пор, пока половина образца изотопа не распадётся.
Различные изотопы данного элемента имеют почти идентичные химические свойства и многие схожие физические свойства. Отличаются они, конечно, своей массой. Например, масса атома гелия-3 составляет 3,016 а.е.м., а масса атома гелия-4 — 4,003 а.е.м.
Обычно ученые не указывают атомный вес элемента в пересчете на тот или иной изотоп.Вместо этого они выражают атомный вес как среднее значение всех встречающихся в природе изотопов элемента с учетом содержания изотопов каждого из них. Например, элемент меди имеет два встречающихся в природе изотопа: медь-63 с массой 62,930 а.е.м. и изотопным содержанием 69,2% и медь-65 с массой 64,928 а.е.м. и содержанием 30,8%. Средняя масса встречающихся в природе атомов меди равна сумме атомной массы каждого изотопа, умноженной на содержание его изотопа.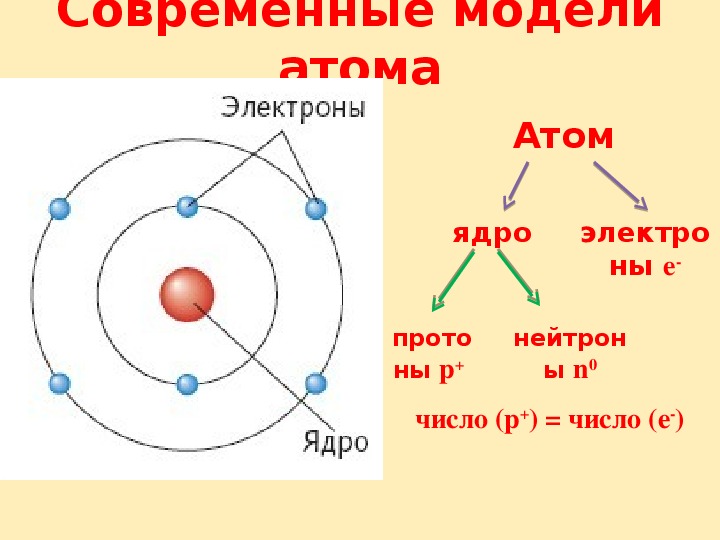 Для меди это будет (62,930 а.е.м. x 0,692) + (64,928 а.е.м. x 0,308) = 63,545 а.е.м. Таким образом, атомный вес меди равен 63,545 г.
Для меди это будет (62,930 а.е.м. x 0,692) + (64,928 а.е.м. x 0,308) = 63,545 а.е.м. Таким образом, атомный вес меди равен 63,545 г.
Радиоактивность[править | править источник]
Одним из способов распада нестабильного радиоактивного атома является испускание альфа-частицы. Альфа-частицы состоят из двух протонов и двух нейтронов и идентичны ядру атома гелия. Когда ядро атома испускает альфа-частицу, атом превращается в атом другого элемента.Около 300 комбинаций протонов и нейтронов в ядрах достаточно стабильны, чтобы существовать в природе. Ученые могут произвести еще 3000 ядер в лаборатории. Эти ядра, как правило, крайне нестабильны, потому что в них слишком много протонов или нейтронов, чтобы они могли долго оставаться единым целым. Нестабильные ядра, встречающиеся в природе или созданные в лаборатории, распадаются или превращаются в стабильные ядра в результате различных процессов, известных как радиоактивный распад (см. Радиоактивность).
Некоторые ядра с избытком протонов просто выбрасывают протон. Аналогичный процесс может происходить в ядрах с избытком нейтронов. Более распространенный процесс распада состоит в том, что ядро одновременно выбрасывает группу из 2 протонов и 2 нейтронов. Этот кластер на самом деле является ядром атома гелия-4, и этот процесс распада называется альфа-распадом. Прежде чем ученые идентифицировали выброшенную частицу как ядро гелия-4, они назвали ее альфа-частицей. Ядра гелия-4 до сих пор иногда называют альфа-частицами.
Аналогичный процесс может происходить в ядрах с избытком нейтронов. Более распространенный процесс распада состоит в том, что ядро одновременно выбрасывает группу из 2 протонов и 2 нейтронов. Этот кластер на самом деле является ядром атома гелия-4, и этот процесс распада называется альфа-распадом. Прежде чем ученые идентифицировали выброшенную частицу как ядро гелия-4, они назвали ее альфа-частицей. Ядра гелия-4 до сих пор иногда называют альфа-частицами.
Самый распространенный способ избавления ядра от избыточных протонов или нейтронов — это превращение протона в нейтрон или нейтрона в протон.Этот процесс известен как бета-распад. Суммарный электрический заряд до и после распада должен оставаться одним и тем же. Поскольку протоны электрически заряжены, а нейтроны — нет, в реакции должны участвовать другие заряженные частицы. Например, нейтрон может распасться на протон, электрон и другую частицу, называемую электронным антинейтрино. Нейтрон не имеет заряда, поэтому заряд в начале реакции равен нулю. Протон имеет электрический заряд +1, а электрон имеет электрический заряд -1.Антинейтрино — крошечная частица без электрического заряда. Электрические заряды протона и электрона компенсируют друг друга, оставляя суммарный заряд нулевым. Электрон является наиболее легко обнаруживаемым продуктом этого типа бета-распада, и ученые назвали эти продукты бета-частицами, прежде чем они идентифицировали их как электроны.
Протон имеет электрический заряд +1, а электрон имеет электрический заряд -1.Антинейтрино — крошечная частица без электрического заряда. Электрические заряды протона и электрона компенсируют друг друга, оставляя суммарный заряд нулевым. Электрон является наиболее легко обнаруживаемым продуктом этого типа бета-распада, и ученые назвали эти продукты бета-частицами, прежде чем они идентифицировали их как электроны.
Бета-распад может происходить двумя путями. Как показано слева, нейтрон превращается в протон, испуская антинейтрино и отрицательно заряженную бета-частицу. Как показано справа, протон превращается в нейтрон, испуская нейтрино и положительно заряженную бета-частицу.Положительные бета-частицы называются позитронами, а отрицательные бета-частицы называются электронами. После распада ядро атома содержит либо на один протон меньше, либо на один больше. Бета-распад превращает атом одного элемента в атом нового элемента.
Бета-распад также происходит, когда протон превращается в нейтрон. Конечный результат этого распада должен иметь заряд +1, чтобы уравновесить заряд исходного протона. Протон превращается в нейтрон, антиэлектрон (также называемый позитроном) и электронное нейтрино.Позитрон идентичен электрону, за исключением того, что позитрон имеет электрический заряд +1. Электронное нейтрино — это крошечная электрически нейтральная частица. Разница между антинейтрино в нейтрон-протонном бета-распаде и нейтрино в протон-нейтронном бета-распаде очень тонкая — настолько тонкая, что ученым еще предстоит доказать, что разница действительно существует.
Конечный результат этого распада должен иметь заряд +1, чтобы уравновесить заряд исходного протона. Протон превращается в нейтрон, антиэлектрон (также называемый позитроном) и электронное нейтрино.Позитрон идентичен электрону, за исключением того, что позитрон имеет электрический заряд +1. Электронное нейтрино — это крошечная электрически нейтральная частица. Разница между антинейтрино в нейтрон-протонном бета-распаде и нейтрино в протон-нейтронном бета-распаде очень тонкая — настолько тонкая, что ученым еще предстоит доказать, что разница действительно существует.
Хотя ученые часто создают нестабильные ядра в лаборатории, некоторые радиоактивные изотопы также встречаются в природе. Эти атомы распадаются медленнее, чем большинство радиоактивных изотопов, созданных в лабораториях.Если бы они разлагались слишком быстро, они не оставались бы достаточно долго, чтобы ученые могли их найти. Тяжелые радиоактивные изотопы, обнаруженные на Земле, образовались в недрах звезд более 5 миллиардов лет назад. Они были частью облака газа и пыли, сформировавшего нашу солнечную систему, и поэтому являются напоминанием о происхождении Земли и других планет. Кроме того, распад радиоактивного материала обеспечивает большую часть энергии, которая нагревает ядро Земли.
Они были частью облака газа и пыли, сформировавшего нашу солнечную систему, и поэтому являются напоминанием о происхождении Земли и других планет. Кроме того, распад радиоактивного материала обеспечивает большую часть энергии, которая нагревает ядро Земли.
Наиболее распространенными природными радиоактивными изотопами являются калий-40 (см. Калий), торий-232 (см. Торий) и уран-238 (см. Уран).Атомы этих изотопов существуют в среднем миллиарды лет, прежде чем подвергнуться альфа- или бета-распаду. Устойчивый распад этих изотопов и других, более стабильных атомов позволяет ученым определять возраст минералов, в которых встречаются эти изотопы. Ученые начинают с оценки количества изотопа, который присутствовал при образовании минерала, а затем измеряют, сколько изотопа распалось. Зная скорость распада изотопа, они могут определить, сколько времени прошло. Этот процесс, известный как радиоактивное датирование (см. Методы датирования), позволяет ученым определить возраст Земли.Принятое в настоящее время значение возраста Земли составляет около 4,5 миллиардов лет. Ученые также исследовали камни с Луны и других объектов Солнечной системы и обнаружили, что они имеют одинаковый возраст.
Ученые также исследовали камни с Луны и других объектов Солнечной системы и обнаружили, что они имеют одинаковый возраст.
Силы, действующие внутри атомов[править | править источник]
В физике сила — это толчок или притяжение объекта. Существует четыре фундаментальных взаимодействия, три из которых — электромагнитное взаимодействие, сильное взаимодействие и слабое взаимодействие — участвуют в поддержании целостности стабильных атомов и определении того, как будут распадаться нестабильные атомы.Электромагнитная сила удерживает электроны прикрепленными к их атому. Сильное взаимодействие удерживает протоны и нейтроны вместе в ядре. Слабое взаимодействие определяет, как распадаются атомы, когда у них есть избыток протонов или нейтронов. Четвертая фундаментальная сила, гравитация, становится очевидной только с объектами, намного большими, чем субатомные частицы.
Электромагнитная сила[править | править источник]
Самой известной из сил, действующих внутри атома, является электромагнитная сила.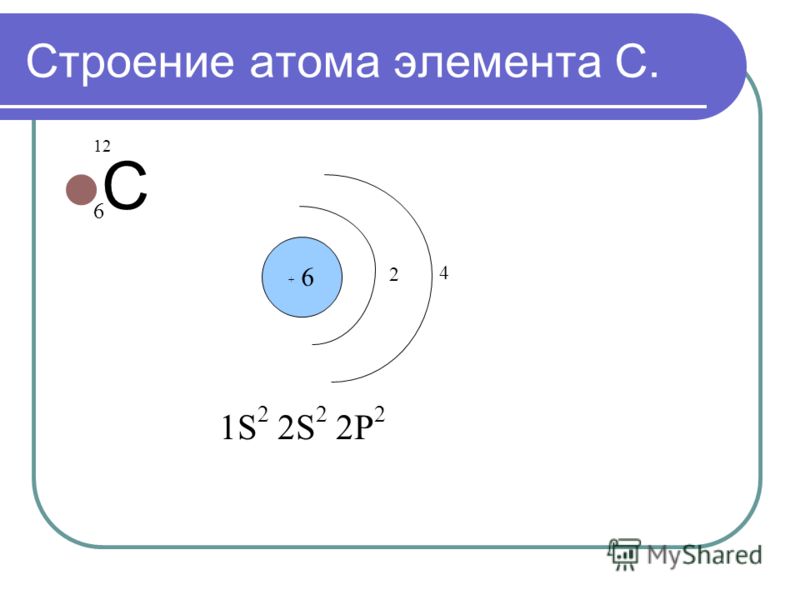 Это та же самая сила, которая заставляет волосы людей прилипать к расческе или расческе, когда на них накапливается статическое электричество.Электромагнитная сила заставляет противоположные электрические заряды притягиваться друг к другу. Из-за этой силы отрицательно заряженные электроны в атоме притягиваются к положительно заряженным протонам в ядре атома. Эта сила притяжения связывает электроны с атомом. Электромагнитная сила становится сильнее, когда расстояние между зарядами становится меньше. Это свойство обычно заставляет противоположно заряженные частицы максимально приближаться друг к другу. В течение многих лет ученые задавались вопросом, почему электроны просто не вкручиваются в ядро атома по спирали, приближаясь как можно ближе к протонам.Со временем физики узнали, что частицы размером с электрон могут вести себя как волны, и это свойство удерживает электроны на заданном расстоянии от ядра атома. Волновая природа электронов обсуждается ниже в разделе «Квантовый атом» этой статьи.
Это та же самая сила, которая заставляет волосы людей прилипать к расческе или расческе, когда на них накапливается статическое электричество.Электромагнитная сила заставляет противоположные электрические заряды притягиваться друг к другу. Из-за этой силы отрицательно заряженные электроны в атоме притягиваются к положительно заряженным протонам в ядре атома. Эта сила притяжения связывает электроны с атомом. Электромагнитная сила становится сильнее, когда расстояние между зарядами становится меньше. Это свойство обычно заставляет противоположно заряженные частицы максимально приближаться друг к другу. В течение многих лет ученые задавались вопросом, почему электроны просто не вкручиваются в ядро атома по спирали, приближаясь как можно ближе к протонам.Со временем физики узнали, что частицы размером с электрон могут вести себя как волны, и это свойство удерживает электроны на заданном расстоянии от ядра атома. Волновая природа электронов обсуждается ниже в разделе «Квантовый атом» этой статьи.
Электромагнитная сила также заставляет одноименные заряды отталкиваться друг от друга. Отрицательно заряженные электроны отталкиваются друг от друга и имеют тенденцию отдаляться друг от друга, но положительно заряженное ядро проявляет достаточную электромагнитную силу, чтобы удерживать электроны прикрепленными к атому.Протоны в ядре также отталкиваются друг от друга, но, как описано ниже, сильное взаимодействие преодолевает электромагнитное взаимодействие в ядре и удерживает протоны вместе.
Сильная сила[править | править источник]
Протоны и нейтроны в ядрах атомов удерживаются вместе сильным взаимодействием. Эта сила должна преодолеть электромагнитную силу отталкивания протонов в ядре друг к другу. Однако сильного взаимодействия между протонами недостаточно, чтобы удерживать их вместе.Другие частицы, которые добавляют к сильному взаимодействию, но не к электромагнитному взаимодействию, должны присутствовать, чтобы сделать ядро стабильным. Частицами, которые обеспечивают эту дополнительную силу, являются нейтроны. Нейтроны увеличивают силу притяжения, но не имеют электрического заряда и поэтому не увеличивают электромагнитное отталкивание.
Нейтроны увеличивают силу притяжения, но не имеют электрического заряда и поэтому не увеличивают электромагнитное отталкивание.
Диапазон сильной силы[править | править источник]
Сильное взаимодействие действует только на очень коротком расстоянии — около 2 фемтометров (сокращенно фм) или 2 × 10–15 м (8 × 10–14 дюймов).Физики также используют слово fermi (также сокращенно fm) для этой единицы в честь американского физика итальянского происхождения Энрико Ферми. Короткодействующее свойство сильного взаимодействия сильно отличает его от электромагнитных и гравитационных сил. Эти последние силы становятся слабее по мере увеличения расстояния, но они продолжают воздействовать на объекты, удаленные друг от друга на миллионы световых лет. И наоборот, сильное взаимодействие имеет такой ограниченный радиус действия, что даже не все протоны и нейтроны в одном и том же ядре ощущают сильное взаимодействие друг друга.Поскольку диаметр даже небольшого ядра составляет от 5 до 6 фм, протоны и нейтроны на противоположных сторонах ядра испытывают сильную силу только от своих ближайших соседей.
Сильное взаимодействие отличается от электромагнитных и гравитационных сил еще одним важным аспектом — тем, как оно меняется с расстоянием. Электромагнитные и гравитационные силы притяжения увеличиваются по мере того, как частицы приближаются друг к другу, независимо от того, насколько близко они подходят. Это увеличение заставляет частицы двигаться как можно ближе друг к другу.С другой стороны, сильное взаимодействие остается примерно постоянным, поскольку протоны и нейтроны движутся ближе друг к другу, чем примерно на 2 фм. Если частицы сближаются друг с другом, ядерная сила притяжения внезапно становится отталкивающей. Это свойство приводит к тому, что ядра образуются с одинаковым средним расстоянием — около 2 фм — между протонами и нейтронами, независимо от того, сколько протонов и нейтронов содержится в ядре.
Уникальная природа сильного взаимодействия определяет относительное количество протонов и нейтронов в ядре.Если в ядре слишком много протонов, сильное взаимодействие не может преодолеть электромагнитное отталкивание протонов.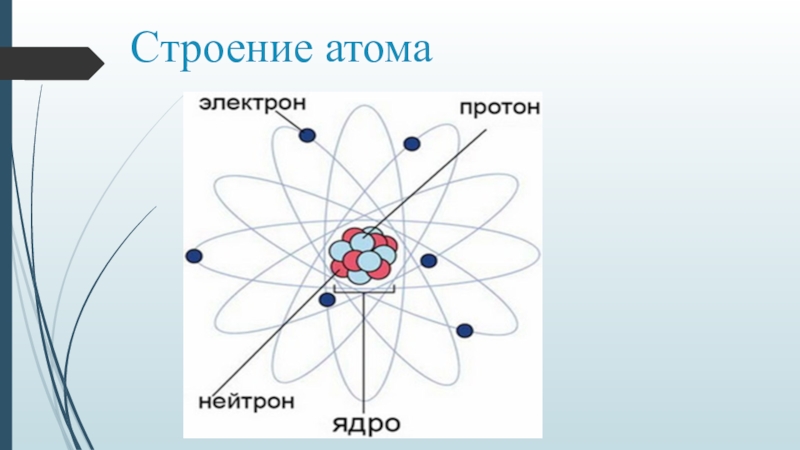 Если в ядре слишком много нейтронов, избыточное сильное взаимодействие пытается сжать протоны и нейтроны слишком близко друг к другу. Наиболее стабильные атомные ядра находятся между этими крайностями. Более легкие ядра, такие как углерод-12 и кислород-16, состоят на 50 процентов из протонов и на 50 процентов из нейтронов. Более массивные ядра, такие как висмут-209, содержат около 40 процентов протонов и 60 процентов нейтронов.
Если в ядре слишком много нейтронов, избыточное сильное взаимодействие пытается сжать протоны и нейтроны слишком близко друг к другу. Наиболее стабильные атомные ядра находятся между этими крайностями. Более легкие ядра, такие как углерод-12 и кислород-16, состоят на 50 процентов из протонов и на 50 процентов из нейтронов. Более массивные ядра, такие как висмут-209, содержат около 40 процентов протонов и 60 процентов нейтронов.
Пионы[править | править источник]
Физики элементарных частиц объясняют поведение сильного взаимодействия, вводя другой тип частиц, называемый пионами.Протоны и нейтроны взаимодействуют в ядре, обмениваясь пионами. Обмен пионами сближает протоны и нейтроны. Процесс аналогичен игре двух человек в мяч с тяжелым мячом, но каждый человек прикреплен к мячу пружиной. Когда один человек бросает мяч другому, пружина притягивает бросающего к мячу. Если игроки обмениваются мячами достаточно быстро, мяч и пружины становятся для наблюдателя размытым пятном, и создается впечатление, что два метателя просто притягиваются друг к другу. Это то, что происходит в ядрах атомов. Протоны и нейтроны в ядре — это люди, пионы действуют как мяч, а сильное взаимодействие действует как пружины, скрепляющие все вместе.
Это то, что происходит в ядрах атомов. Протоны и нейтроны в ядре — это люди, пионы действуют как мяч, а сильное взаимодействие действует как пружины, скрепляющие все вместе.
Пионы в ядре существуют лишь кратчайший момент времени, не более 1 × 10-23 секунд, но даже за время своего короткого существования они могут обеспечить притяжение, удерживающее ядро. Пионы также могут существовать как независимые частицы вне ядра атома. Ученые создали их, ударив по цели высокоскоростными протонами.Хотя свободные пионы тоже живут недолго (около 1 × 10–8 секунд), ученым удалось изучить их свойства.
Слабая сила[править | править источник]
Слабое взаимодействие оправдывает свое название — оно намного слабее электромагнитного и сильного взаимодействий. Как и сильное взаимодействие, оно действует только на коротком расстоянии, около 0,01 фм. Однако, в отличие от этих других сил, слабое взаимодействие действует на все частицы в атоме. Электромагнитное взаимодействие влияет только на электроны и протоны, а сильное взаимодействие влияет только на протоны и нейтроны. Когда в ядре слишком много протонов, чтобы удерживать их вместе, или так много нейтронов, что сильное взаимодействие сжимает их слишком сильно, слабое взаимодействие фактически превращает один тип частиц в другой. Например, когда атом подвергается одному типу распада, слабое взаимодействие заставляет нейтрон превращаться в протон, электрон и электронное антинейтрино. Полный электрический заряд и полная энергия частиц остаются неизменными до и после изменения.
Когда в ядре слишком много протонов, чтобы удерживать их вместе, или так много нейтронов, что сильное взаимодействие сжимает их слишком сильно, слабое взаимодействие фактически превращает один тип частиц в другой. Например, когда атом подвергается одному типу распада, слабое взаимодействие заставляет нейтрон превращаться в протон, электрон и электронное антинейтрино. Полный электрический заряд и полная энергия частиц остаются неизменными до и после изменения.
Ученые начала 20-го века обнаружили, что не могут объяснить поведение атомов, используя свои современные знания о материи.Им пришлось разработать новый взгляд на материю и энергию, чтобы точно описать поведение атомов. Они назвали эту теорию квантовой теорией или квантовой механикой. Квантовая теория описывает материю как действующую и как частицу, и как волну. В видимых объектах, встречающихся в повседневной жизни, волнообразная природа материи слишком мала, чтобы быть заметной. Однако волнообразная природа становится важной для микроскопических частиц, таких как электроны. Как мы уже говорили, электроны в атомах ведут себя как волны. Они существуют как нечеткое облако отрицательного заряда вокруг ядра, а не как частица, расположенная в одной точке.
Как мы уже говорили, электроны в атомах ведут себя как волны. Они существуют как нечеткое облако отрицательного заряда вокруг ядра, а не как частица, расположенная в одной точке.
Волновое поведение[править | править источник]
Чтобы понять квантовую модель атома, мы должны знать некоторые основные факты о волнах. Волны — это колебания, которые регулярно повторяются снова и снова. Знакомый пример волн возникает, когда один конец веревки привязан к неподвижному объекту, а другой конец кто-то двигает вверх и вниз. Это действие создает волны, которые распространяются по веревке. Самая высокая точка, до которой дотягивается веревка, называется гребнем волны. Самая нижняя точка называется впадиной волны.Впадины и гребни следуют друг за другом в правильной последовательности. Расстояние от одной впадины до следующей впадины или от одного гребня до следующего гребня называется длиной волны. Число длин волн, которые проходят через определенную точку за заданный промежуток времени, называется частотой волны.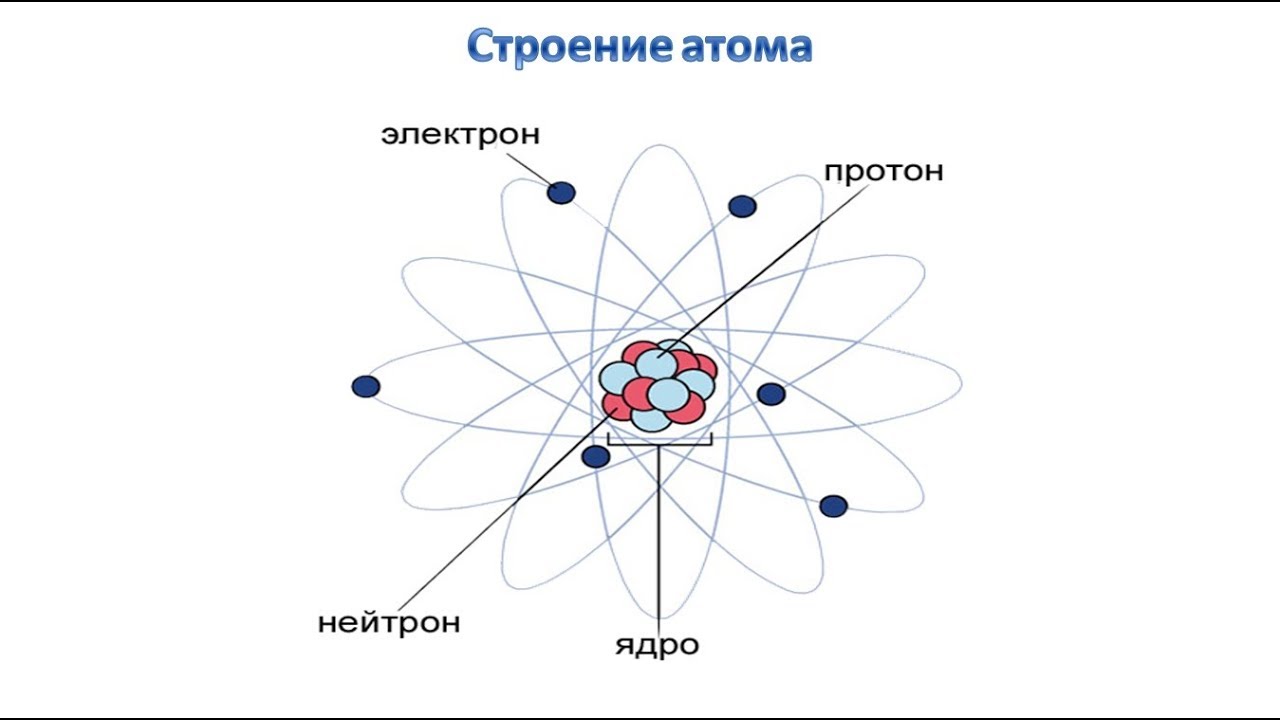
В физике слово волна обычно означает всю структуру, которая может состоять из множества отдельных впадин и гребней. Например, когда человек, держащий свободный конец веревки, очень быстро перемещает ее вверх и вниз, на веревке одновременно появляется множество впадин и гребней.Физик использовал бы слово «волна», чтобы описать весь набор впадин и гребней на веревке.
Когда две волны встречаются друг с другом, они сливаются в процессе, называемом интерференцией. Интерференция создает новую волновую картину. Если две волны с одинаковой длиной волны и частотой встречаются вместе, результирующая картина зависит от относительного положения гребней волн. Если гребни и впадины двух волн совпадают, говорят, что волны находятся в фазе. Волны в фазе друг с другом будут сливаться, образуя более высокие гребни и более низкие впадины.Физики называют этот тип интерференции конструктивной интерференцией.
Иногда волны с одинаковой длиной волны и частотой не совпадают по фазе, то есть они встречаются таким образом, что их гребни и впадины не совпадают. В этих случаях волны производят деструктивную интерференцию. Если две одинаковые волны сдвинуты по фазе ровно на половину длины волны, гребни одной волны совпадают с впадинами другой. Эти волны полностью компенсируют друг друга, и волна не появится.Если встречаются две волны, которые не совпадают по фазе и не совпадают по фазе ровно на половину длины волны, они будут конструктивно интерферировать в одних местах и деструктивно в других, создавая сложную новую волну. См. также Волновое движение.
В этих случаях волны производят деструктивную интерференцию. Если две одинаковые волны сдвинуты по фазе ровно на половину длины волны, гребни одной волны совпадают с впадинами другой. Эти волны полностью компенсируют друг друга, и волна не появится.Если встречаются две волны, которые не совпадают по фазе и не совпадают по фазе ровно на половину длины волны, они будут конструктивно интерферировать в одних местах и деструктивно в других, создавая сложную новую волну. См. также Волновое движение.
Электроны как волны[edit | править источник]
Эта картина получается, когда узкий пучок электронов проходит через образец титано-никелевого сплава. Картина показывает, что электроны движутся через образец больше как волны, чем частицы.Электроны дифрагируют (изгибаются) вокруг атомов, распадаясь на множество лучей и распространяясь наружу. Затем дифрагированные лучи интерферируют друг с другом, компенсируя друг друга в некоторых местах и усиливая друг друга в других местах. Яркие пятна — это места, где лучи конструктивно пересекались или усиливали друг друга. Темные пятна — это области, в которых лучи деструктивно интерферируют или компенсируют друг друга.
Яркие пятна — это места, где лучи конструктивно пересекались или усиливали друг друга. Темные пятна — это области, в которых лучи деструктивно интерферируют или компенсируют друг друга.
Электроны обладают свойствами как частиц, так и волн. Поскольку они обладают свойствами обоих, физики не могут определить точное положение электрона в атоме.Если бы электрон был просто частицей, определить его местоположение было бы относительно просто. Однако как только физики пытаются измерить его местоположение, становится очевидной волнообразная природа электрона, и они не могут определить точное местоположение. Вместо этого физики рассчитывают вероятность того, что электрон находится в определенном месте. Суммируя все эти вероятности, физики могут создать картину электрона, напоминающую расплывчатое облако вокруг ядра. Самая плотная часть этого облака представляет собой место, где, скорее всего, находится электрон.
Электронные орбитали и оболочки[edit | править источник]
Электроны окружают ядро атома в виде оболочек и подоболочек.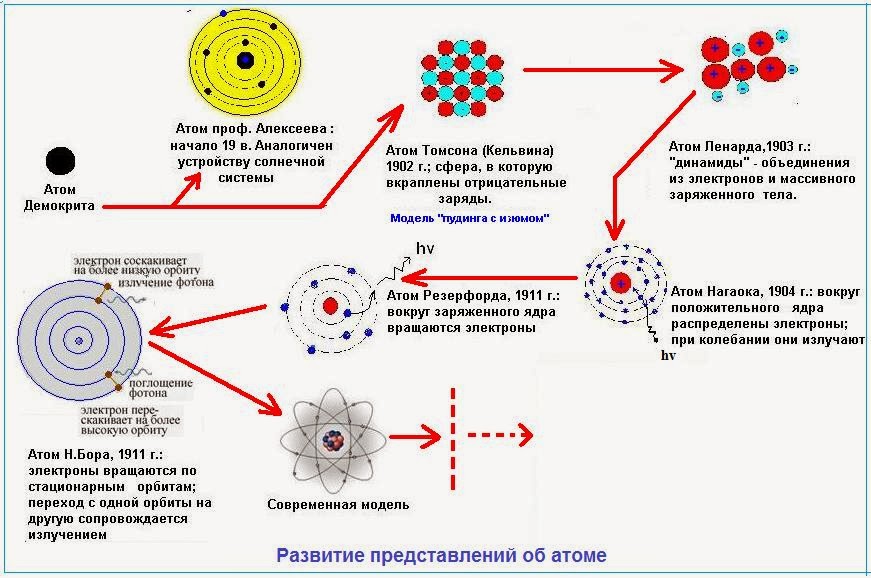 В этой таблице, показывающей электронную конфигурацию атома никеля, большие числа (1, 2, 3, 4) обозначают оболочки электронов (показаны маленькими сферами), буквы (s, p, d) обозначают подоболочки внутри этих оболочек. а показатели степени указывают количество электронов, присутствующих в каждой подоболочке. Подоболочки могут быть далее разделены на орбитали. Каждая орбиталь может содержать два электрона, а орбитали обозначены в таблице горизонтальными чертами, соединяющими пары электронов.Маленькие стрелки вверх и вниз указывают направление вращения каждого электрона. Электроны, занимающие одну и ту же орбиталь, всегда имеют противоположные спины. Если бы все электроны были оторваны от атома никеля (то есть атом был полностью ионизирован) и позволяли электронам возвращаться по одному, электроны заполняли бы слоты, указанные на диаграмме слева направо, вверху. на дно. Электроны не всегда заполняют все подоболочки оболочки, прежде чем начинают заполнять следующую оболочку. Подоболочка s оболочки 4, например, на самом деле заполняется перед подоболочкой d оболочки 3 (показана как самая нижняя строка на этой диаграмме).
В этой таблице, показывающей электронную конфигурацию атома никеля, большие числа (1, 2, 3, 4) обозначают оболочки электронов (показаны маленькими сферами), буквы (s, p, d) обозначают подоболочки внутри этих оболочек. а показатели степени указывают количество электронов, присутствующих в каждой подоболочке. Подоболочки могут быть далее разделены на орбитали. Каждая орбиталь может содержать два электрона, а орбитали обозначены в таблице горизонтальными чертами, соединяющими пары электронов.Маленькие стрелки вверх и вниз указывают направление вращения каждого электрона. Электроны, занимающие одну и ту же орбиталь, всегда имеют противоположные спины. Если бы все электроны были оторваны от атома никеля (то есть атом был полностью ионизирован) и позволяли электронам возвращаться по одному, электроны заполняли бы слоты, указанные на диаграмме слева направо, вверху. на дно. Электроны не всегда заполняют все подоболочки оболочки, прежде чем начинают заполнять следующую оболочку. Подоболочка s оболочки 4, например, на самом деле заполняется перед подоболочкой d оболочки 3 (показана как самая нижняя строка на этой диаграмме).
“Орбиталь” электрона относится к области пространства, в которой электрон может находиться внутри атома. Каждая орбиталь находится в группе орбиталей, имеющих одинаковый энергетический уровень, называемый «оболочкой». Эта энергия находится в форме как кинетической энергии, так и потенциальной энергии. Нижние оболочки расположены ближе к ядру, а высшие — дальше от ядра. Электроны, занимающие орбитали более высоких оболочек, обычно обладают большей энергией, чем электроны, занимающие орбитали более низких оболочек.
Различия между орбитами[edit | править источник]
Размер атомов элемента изменяется закономерным образом по периодической таблице, увеличиваясь вниз по группам (столбцам) и уменьшаясь по периодам (строкам) слева направо.Размер атома во многом определяется его электронами. Электроны расположены в оболочках, окружающих ядро каждого атома. Верхние элементы каждой группы имеют только одну или две электронные оболочки. Атомы элементов, расположенных дальше по таблице, имеют больше оболочек и, следовательно, больше по размеру. Двигаясь по периоду слева направо, самая внешняя электронная оболочка заполняется, но новые оболочки не добавляются. При этом количество протонов в ядре каждого атома увеличивается. Протоны притягивают электроны.Чем больше количество присутствующих протонов, тем сильнее притяжение, удерживающее электроны ближе к ядру, и тем меньше размер оболочек.
Двигаясь по периоду слева направо, самая внешняя электронная оболочка заполняется, но новые оболочки не добавляются. При этом количество протонов в ядре каждого атома увеличивается. Протоны притягивают электроны.Чем больше количество присутствующих протонов, тем сильнее притяжение, удерживающее электроны ближе к ядру, и тем меньше размер оболочек.
Волнообразная природа электронов устанавливает границы их возможного местоположения и определяет форму их орбитали или облака вероятности. Орбитали отличаются друг от друга по размеру, угловому моменту и магнитным свойствам. В общем, угловой момент – это энергия, содержащаяся в объекте, в зависимости от скорости вращения объекта, массы объекта и расстояния объекта от оси, вокруг которой он вращается.Угловой момент вращающегося шара, привязанного к веревке, например, был бы больше, если бы шар был тяжелее, нить была длиннее или вращение было быстрее. В атомах угловой момент электронной орбитали зависит от размера и формы орбитали. Орбиты одинакового размера и формы имеют одинаковый угловой момент. Однако некоторые орбитали могут отличаться по форме, но при этом иметь одинаковый угловой момент. Магнитные свойства орбитали описывают, как она будет вести себя в магнитном поле.Магнитные свойства также зависят от размера и формы орбитали, а также от ориентации орбитали в пространстве.
Однако некоторые орбитали могут отличаться по форме, но при этом иметь одинаковый угловой момент. Магнитные свойства орбитали описывают, как она будет вести себя в магнитном поле.Магнитные свойства также зависят от размера и формы орбитали, а также от ориентации орбитали в пространстве.
Орбитали в атоме должны располагаться на определенных расстояниях от ядра, чтобы создать стабильный атом. На этих расстояниях орбитали позволяют электронной волне пройти одну или несколько полуволн (y, 1, 1y, 2, 2y и т. д.) при движении вокруг ядра. Затем электронная волна может удвоить саму себя и конструктивно интерферировать сама с собой, усиливая волну.Любое другое расстояние заставит электрон непредсказуемым и нестабильным образом интерферировать с собственной волной, создав нестабильный атом.
Главные и вторичные квантовые числа[править | править источник]
Ученые описывают свойства электрона в атоме с помощью набора чисел, называемых квантовыми числами. Электроны — это разновидность частиц, известных как фермионы, и согласно закону физики не может быть двух абсолютно одинаковых фермионов. Таким образом, каждый электрон в атоме имеет разные свойства и свой набор квантовых чисел.Электроны, имеющие одно и то же главное квантовое число, образуют в атоме оболочку. На этой диаграмме показаны первые три оболочки. Два электрона, имеющие общее главное квантовое число 1, образуют первую оболочку. Один из этих электронов имеет квантовые числа 1, s, 0, 1/2, а другой электрон имеет квантовые числа 1, s, 0, -1/2.
Таким образом, каждый электрон в атоме имеет разные свойства и свой набор квантовых чисел.Электроны, имеющие одно и то же главное квантовое число, образуют в атоме оболочку. На этой диаграмме показаны первые три оболочки. Два электрона, имеющие общее главное квантовое число 1, образуют первую оболочку. Один из этих электронов имеет квантовые числа 1, s, 0, 1/2, а другой электрон имеет квантовые числа 1, s, 0, -1/2.
Физики называют число полуволн, которое допускает орбиталь, главным квантовым числом орбитали (сокращенно n). В общем случае это число определяет размер орбитали.Большие орбитали допускают большее количество полудлин волн и, следовательно, имеют более высокие главные квантовые числа. Орбиталь, допускающая одну половину длины волны, имеет главное квантовое число, равное единице. Только одна орбиталь допускает одну половину длины волны. Более чем одна орбиталь может допускать две или более полудлин волны. Эти орбитали могут иметь одно и то же главное квантовое число, но они отличаются друг от друга своим угловым моментом и своими магнитными свойствами.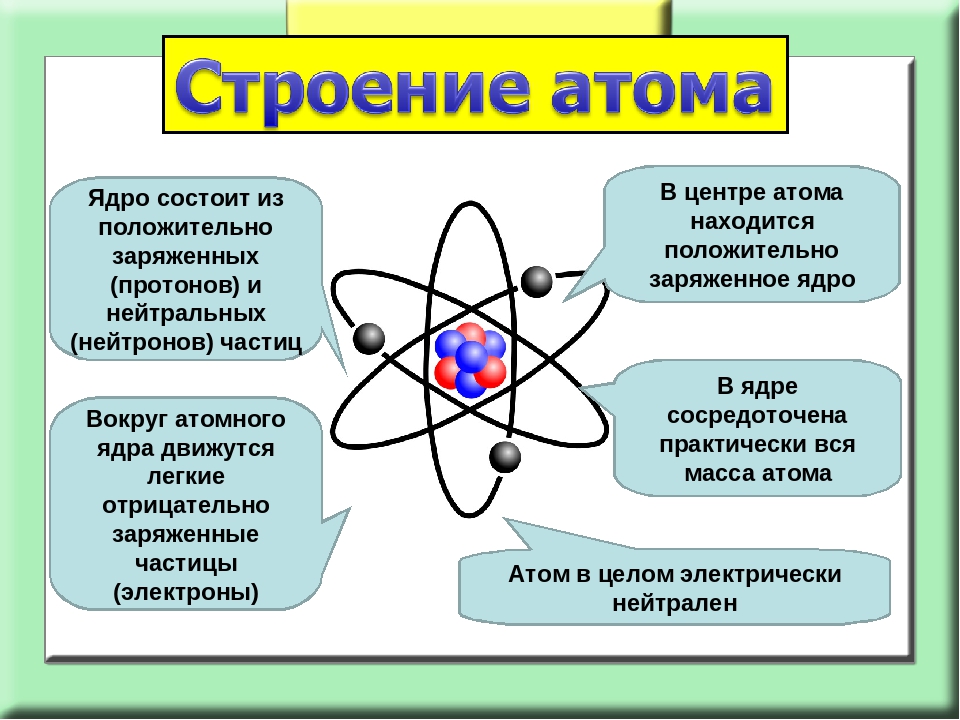 Орбитали, которые допускают одну длину волны, имеют главное квантовое число 2 (n = 2), орбитали, допускающие полторы длины волны, имеют главное квантовое число 3 (n = 3) и так далее.Набор орбиталей с одинаковым главным квантовым числом составляет оболочку.
Орбитали, которые допускают одну длину волны, имеют главное квантовое число 2 (n = 2), орбитали, допускающие полторы длины волны, имеют главное квантовое число 3 (n = 3) и так далее.Набор орбиталей с одинаковым главным квантовым числом составляет оболочку.
Атомные орбитали — это математическое описание того, где наиболее вероятно нахождение электронов в атоме (или молекуле). Эти описания получаются путем решения уравнения, известного как уравнение Шредингера, которое выражает наши знания об атомном мире. Когда угловой момент и энергия электрона увеличиваются, он имеет тенденцию находиться на орбиталях различной формы. Это описание было подтверждено многими экспериментами в химии и физике, в том числе реальным изображением p-орбитали, сделанным с помощью сканирующего туннельного микроскопа.© Корпорация Майкрософт. Все права защищены.
Физики используют второе число для описания углового момента орбитали. Это число называется вторичным квантовым числом орбитали или квантовым числом ее углового момента (сокращенно l). Количество возможных значений углового момента, которое может иметь орбиталь, на единицу меньше, чем количество полуволн, которое она допускает. Это означает, что орбиталь с главным квантовым числом n может иметь n-1 возможных значений для своего вторичного квантового числа.
Количество возможных значений углового момента, которое может иметь орбиталь, на единицу меньше, чем количество полуволн, которое она допускает. Это означает, что орбиталь с главным квантовым числом n может иметь n-1 возможных значений для своего вторичного квантового числа.
Физики обычно используют буквы для обозначения орбиталей с определенными вторичными квантовыми числами. В порядке увеличения углового момента орбитали с шестью низшими вторичными квантовыми числами обозначены буквами s, p, d, f, g и h. Буква s соответствует вторичному квантовому числу 0, буква p соответствует вторичному квантовому числу 1 и так далее. В общем, угловой момент орбитали зависит от ее формы. S-орбиталь со вторичным квантовым числом 0 является сферической.Р-орбиталь со вторичным квантовым числом 1 напоминает два полушария, обращенные друг к другу. Возможные комбинации главных и вторичных квантовых чисел для первых пяти оболочек перечислены ниже.
Подоболочки[править | править источник]
Более чем одна орбиталь может иметь одинаковое количество полуволн и иметь одинаковый угловой момент. Физики называют орбитали в оболочке с одинаковым угловым моментом подоболочкой. Они обозначают подоболочку с главным и вторичным квантовыми числами подоболочки.Например, подоболочка 1s — это группа орбиталей в первой оболочке с угловым моментом, описываемым буквой s. Подоболочка 2p — это группа орбиталей во второй оболочке с угловым моментом, описываемым буквой p.
Физики называют орбитали в оболочке с одинаковым угловым моментом подоболочкой. Они обозначают подоболочку с главным и вторичным квантовыми числами подоболочки.Например, подоболочка 1s — это группа орбиталей в первой оболочке с угловым моментом, описываемым буквой s. Подоболочка 2p — это группа орбиталей во второй оболочке с угловым моментом, описываемым буквой p.
Орбитали внутри подоболочки отличаются друг от друга своими магнитными свойствами. Магнитные свойства орбитали зависят от ее формы и ориентации в пространстве. Например, p-орбиталь может иметь три различные ориентации в пространстве: одна расположена сверху и снизу, одна сбоку и третья спереди назад.
Магнитное квантовое число и спин[править | править источник]
Физики описывают магнитные свойства орбитали с помощью третьего квантового числа, называемого магнитным квантовым числом орбитали (сокращенно m). Магнитное квантовое число определяет, как орбитали с одинаковым размером и угловым моментом ориентированы в пространстве. Магнитное квантовое число орбитали может иметь только целочисленные значения в диапазоне от значения вторичного квантового числа орбитали до отрицательного значения вторичного квантового числа.Например, p-орбиталь имеет вторичное квантовое число 1 (l = 1), поэтому магнитное квантовое число имеет три возможных значения: +1, 0 и -1. Это означает, что p-орбиталь имеет три возможных ориентации в пространстве. S-орбиталь имеет вторичное квантовое число 0 (l = 0), поэтому магнитное квантовое число имеет только одну возможность: 0. Эта орбиталь является сферой, а сфера может иметь только одну ориентацию в пространстве. Для d-орбитали вторичное квантовое число равно 2 (l = 2), поэтому магнитное квантовое число имеет пять возможных значений: -2, -1, 0, +1 и +2.D-орбиталь имеет четыре возможных ориентации в пространстве, а также пятую орбиталь, которая отличается по форме от остальных четырех. Вместе главное, вторичное и магнитное квантовые числа определяют конкретную орбиталь в атоме.
Магнитное квантовое число орбитали может иметь только целочисленные значения в диапазоне от значения вторичного квантового числа орбитали до отрицательного значения вторичного квантового числа.Например, p-орбиталь имеет вторичное квантовое число 1 (l = 1), поэтому магнитное квантовое число имеет три возможных значения: +1, 0 и -1. Это означает, что p-орбиталь имеет три возможных ориентации в пространстве. S-орбиталь имеет вторичное квантовое число 0 (l = 0), поэтому магнитное квантовое число имеет только одну возможность: 0. Эта орбиталь является сферой, а сфера может иметь только одну ориентацию в пространстве. Для d-орбитали вторичное квантовое число равно 2 (l = 2), поэтому магнитное квантовое число имеет пять возможных значений: -2, -1, 0, +1 и +2.D-орбиталь имеет четыре возможных ориентации в пространстве, а также пятую орбиталь, которая отличается по форме от остальных четырех. Вместе главное, вторичное и магнитное квантовые числа определяют конкретную орбиталь в атоме.
Электроны относятся к типу частиц, известных как фермионы. Австрийско-американский физик Вольфганг Паули обнаружил, что никакие два фермиона не могут иметь одинаковые квантовые числа. Этот принцип называется принципом запрета Паули, который гласит, что два или более одинаковых электрона не могут занимать одну и ту же орбиталь в атоме.Однако ученые знают, что на каждой орбитали может находиться два электрона. У электронов есть еще одно свойство, называемое спином, которое различает два электрона на каждой орбитали. Спин электрона имеет два возможных значения: +y (называемый спином вверх) или -y (называемый спином вниз). Эти два возможных значения означают, что два электрона могут занимать одну и ту же орбиталь, если их спины различны. Физики называют спин четвертым квантовым числом электронной орбитали (сокращенно ms). Спин, в дополнение к трем другим квантовым числам, однозначно описывает орбиталь конкретного электрона.
Австрийско-американский физик Вольфганг Паули обнаружил, что никакие два фермиона не могут иметь одинаковые квантовые числа. Этот принцип называется принципом запрета Паули, который гласит, что два или более одинаковых электрона не могут занимать одну и ту же орбиталь в атоме.Однако ученые знают, что на каждой орбитали может находиться два электрона. У электронов есть еще одно свойство, называемое спином, которое различает два электрона на каждой орбитали. Спин электрона имеет два возможных значения: +y (называемый спином вверх) или -y (называемый спином вниз). Эти два возможных значения означают, что два электрона могут занимать одну и ту же орбиталь, если их спины различны. Физики называют спин четвертым квантовым числом электронной орбитали (сокращенно ms). Спин, в дополнение к трем другим квантовым числам, однозначно описывает орбиталь конкретного электрона.
Заполнение орбиталей[edit | править источник]
Когда электроны собираются вокруг ядра атома, они заполняют орбитали по определенной схеме. Они ищут первую доступную орбиталь, для занятия которой требуется наименьшее количество энергии. Как правило, требуется больше энергии, чтобы занять орбитали с более высокими квантовыми числами. Чтобы занять все орбитали в подоболочке, требуется одна и та же энергия. Самая близкая к ядру орбиталь с наименьшей энергией. Он имеет главное квантовое число 1, вторичное квантовое число 0 и магнитное квантовое число 0.Первые два электрона — с противоположными спинами — занимают эту орбиталь.
Они ищут первую доступную орбиталь, для занятия которой требуется наименьшее количество энергии. Как правило, требуется больше энергии, чтобы занять орбитали с более высокими квантовыми числами. Чтобы занять все орбитали в подоболочке, требуется одна и та же энергия. Самая близкая к ядру орбиталь с наименьшей энергией. Он имеет главное квантовое число 1, вторичное квантовое число 0 и магнитное квантовое число 0.Первые два электрона — с противоположными спинами — занимают эту орбиталь.
Если атом имеет более двух электронов, электроны начинают заполнять орбитали в следующей подоболочке по одному электрону каждый, пока все орбитали в подоболочке не будут иметь по одному электрону. Оставшиеся электроны затем возвращаются и заполняют каждую орбиталь в подоболочке вторым электроном с противоположным спином. Они следуют этому порядку, потому что для добавления электрона на пустую орбиталь требуется меньше энергии, чем для завершения пары электронов на орбитали.Электроны заполняют все подоболочки в оболочке, а затем переходят на следующую оболочку. По мере увеличения подоболочек и оболочек порядок энергии для орбиталей усложняется. Например, для заполнения s-подоболочки четвертой оболочки требуется немного меньше энергии, чем для заполнения d-подоболочки третьей оболочки. Следовательно, электроны будут заполнять орбитали в подоболочке 4s до того, как они заполнят орбитали в подоболочке 3d, даже если подоболочка 3d находится в более низкой оболочке.
По мере увеличения подоболочек и оболочек порядок энергии для орбиталей усложняется. Например, для заполнения s-подоболочки четвертой оболочки требуется немного меньше энергии, чем для заполнения d-подоболочки третьей оболочки. Следовательно, электроны будут заполнять орбитали в подоболочке 4s до того, как они заполнят орбитали в подоболочке 3d, даже если подоболочка 3d находится в более низкой оболочке.
Атомные свойства[править | править источник]
Электронное облако атома, то есть расположение электронов вокруг атома, определяет большую часть физических и химических свойств атома.Поэтому ученые могут предсказать, как атомы будут взаимодействовать с другими атомами, изучая их электронные облака. Электроны на самой внешней оболочке во многом определяют химические свойства атома. Если эта оболочка заполнена, что означает наличие двух электронов на всех орбиталях оболочки, то атом стабилен и с трудом реагирует с другими атомами. Если оболочка не заполнена, атом будет реагировать, обмениваясь или делясь электронами с другими атомами, пытаясь заполнить свою внешнюю оболочку.
Оболочки Валентности[edit | править источник]
Физики называют внешнюю оболочку атома его валентной оболочкой.Валентная оболочка определяет химическое поведение атома или то, как он реагирует с другими элементами. Заполненность валентной оболочки атома влияет на то, как атом взаимодействует с другими атомами. Атомы с полностью заполненными валентными оболочками вряд ли будут взаимодействовать с другими атомами. Шесть газообразных элементов — гелий, неон, аргон, криптон, ксенон и радон — имеют оболочки полной валентности. Эти шесть элементов называются благородными газами из-за того, что они обычно избегают связывания с другими элементами; благородные газы химически инертны, потому что их атомы находятся в низкоэнергетическом состоянии.
Ковалентные связи[править | править источник]
В ковалентной связи два связанных атома имеют общие электроны. Когда атомы, участвующие в ковалентной связи, принадлежат к разным элементам, один из атомов будет стремиться сильнее притягивать общие электроны, и электроны будут проводить больше времени рядом с этим атомом; это полярная ковалентная связь. Когда атомы, связанные ковалентной связью, одинаковы, ни один атом не притягивает общие электроны сильнее, чем другой; это неполярная ковалентная связь.© Корпорация Майкрософт. Все права защищены.
Когда два атома имеют общую пару электронов, они образуют ковалентную связь. Когда атомы связываются ковалентно, они образуют молекулы. Молекула может состоять из двух или более атомов, соединенных ковалентными связями. Каждый атом может делиться своими электронами с одним или несколькими другими атомами. Некоторые молекулы содержат цепочки из тысяч ковалентно связанных атомов.
Когда атомы, связанные ковалентной связью, одинаковы, ни один атом не притягивает общие электроны сильнее, чем другой; это неполярная ковалентная связь.© Корпорация Майкрософт. Все права защищены.
Когда два атома имеют общую пару электронов, они образуют ковалентную связь. Когда атомы связываются ковалентно, они образуют молекулы. Молекула может состоять из двух или более атомов, соединенных ковалентными связями. Каждый атом может делиться своими электронами с одним или несколькими другими атомами. Некоторые молекулы содержат цепочки из тысяч ковалентно связанных атомов.
Углерод является важным примером элемента, который легко образует ковалентные связи. Всего у углерода шесть электронов.Два электрона заполняют первую орбиталь, орбиталь 1s, которая является единственной орбиталью в первой оболочке. Остальные электроны частично заполняют валентную оболочку углерода. Два заполняют следующую орбиталь, 2s-орбиталь, которая образует подоболочку 2s. Валентная оболочка углерода по-прежнему имеет подоболочку 2p, содержащую три p-орбитали. Каждый из двух оставшихся электронов заполняет половину двух орбиталей в подоболочке 2p. Таким образом, атом углерода имеет две полузаполненные орбитали и одну пустую орбиталь в своей валентной оболочке.Атом углерода заполняет свою валентную оболочку, делясь электронами с другими атомами, создавая ковалентные связи. Атом углерода может связываться с другими атомами через любую из трех незаполненных орбиталей в своей валентной оболочке. Три доступные орбитали в валентной оболочке углерода позволяют углероду связываться с другими атомами разными способами. Эта гибкость позволяет углероду образовывать большое разнообразие молекул, которые могут иметь столь же большое разнообразие геометрических форм. Это разнообразие молекул на основе углерода отвечает за важность углерода в молекулах, которые составляют основу живых существ (см. Органическая химия).
Каждый из двух оставшихся электронов заполняет половину двух орбиталей в подоболочке 2p. Таким образом, атом углерода имеет две полузаполненные орбитали и одну пустую орбиталь в своей валентной оболочке.Атом углерода заполняет свою валентную оболочку, делясь электронами с другими атомами, создавая ковалентные связи. Атом углерода может связываться с другими атомами через любую из трех незаполненных орбиталей в своей валентной оболочке. Три доступные орбитали в валентной оболочке углерода позволяют углероду связываться с другими атомами разными способами. Эта гибкость позволяет углероду образовывать большое разнообразие молекул, которые могут иметь столь же большое разнообразие геометрических форм. Это разнообразие молекул на основе углерода отвечает за важность углерода в молекулах, которые составляют основу живых существ (см. Органическая химия).
Ионные связи[править | править источник]
Связь (слева) между атомами в обычной поваренной соли (хлорид натрия) является типичной ионной связью.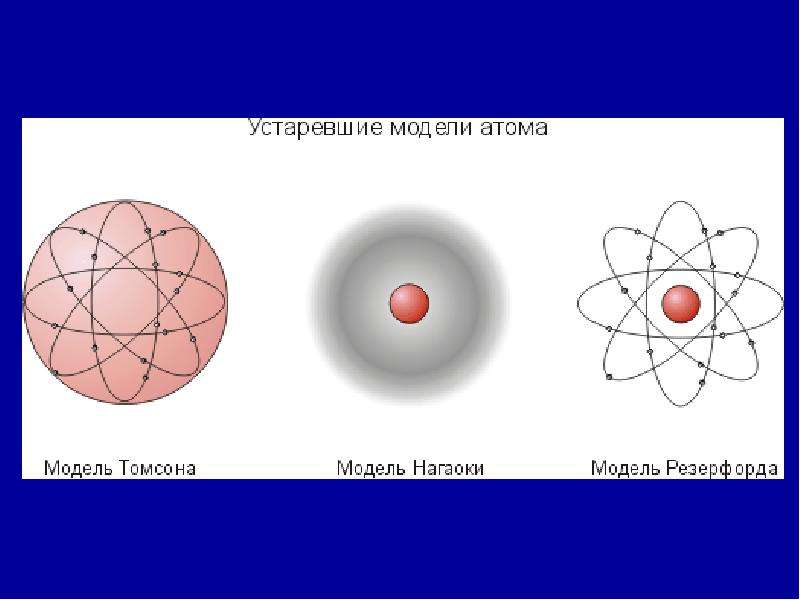 При образовании связи натрий становится катионом (положительно заряженным ионом), «отдавая» свой валентный электрон хлору, который затем становится анионом (отрицательно заряженным ионом). Этот электронный обмен отражается в разнице в размерах между атомами до и после связывания. Притягиваемые электростатическими силами (справа), ионы образуют кристаллическую структуру, в которой каждый сильно притягивается к набору противоположно заряженных «ближайших соседей» и, в меньшей степени, ко всем другим противоположно заряженным ионам во всем кристалле.
При образовании связи натрий становится катионом (положительно заряженным ионом), «отдавая» свой валентный электрон хлору, который затем становится анионом (отрицательно заряженным ионом). Этот электронный обмен отражается в разнице в размерах между атомами до и после связывания. Притягиваемые электростатическими силами (справа), ионы образуют кристаллическую структуру, в которой каждый сильно притягивается к набору противоположно заряженных «ближайших соседей» и, в меньшей степени, ко всем другим противоположно заряженным ионам во всем кристалле.
Атомы также могут терять или приобретать электроны, чтобы завершить свою валентную оболочку. Атом будет терять электроны, если в его валентной оболочке всего несколько электронов. После потери электронов следующая нижняя оболочка, которая заполнена, становится его валентной оболочкой. Атом будет стремиться украсть электроны у других атомов, если ему нужно всего несколько электронов для завершения оболочки. Потеря или приобретение электронов дает атому чистый электрический заряд, потому что количество электронов в атоме больше не совпадает с количеством протонов.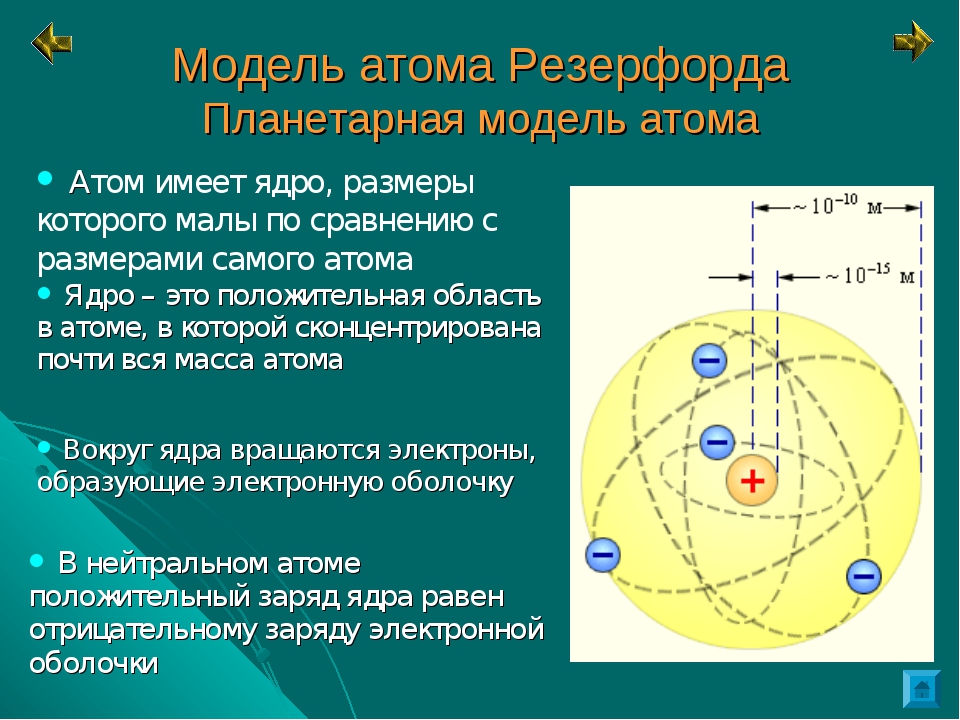 Атомы с суммарным электрическим зарядом называются ионами. Ученые называют атомы с чистым положительным электрическим зарядом катионами (произносится как CAT-eye-uhns), а атомы с чистым отрицательным электрическим зарядом — анионами (произносится как AN-eye-uhns).
Атомы с суммарным электрическим зарядом называются ионами. Ученые называют атомы с чистым положительным электрическим зарядом катионами (произносится как CAT-eye-uhns), а атомы с чистым отрицательным электрическим зарядом — анионами (произносится как AN-eye-uhns).
Разноименные катионы и анионы притягиваются друг к другу электромагнитной силой и образуют ионные связи. Когда эти ионы объединяются, они образуют кристаллы. Кристалл — это твердый материал, состоящий из повторяющихся структур атомов. Чередующиеся положительные и отрицательные ионы образуют твердую решетку или каркас.Кристаллы также называют ионными соединениями или солями.
Элемент натрия является примером атома с одним электроном на валентной оболочке. Он легко потеряет этот электрон и станет катионом. Атомы хлора находятся всего в одном электроне от завершения своей валентной оболочки. Они стремятся украсть электрон у другого атома, образуя анион. Когда атомы натрия и хлора соединяются, атомы натрия легко отдают свой внешний электрон атомам хлора. Противоположные ионы связываются друг с другом, образуя кристалл, известный как хлорид натрия или поваренная соль.См. также Химическая реакция.
Противоположные ионы связываются друг с другом, образуя кристалл, известный как хлорид натрия или поваренная соль.См. также Химическая реакция.
Металлические облигации[править | править источник]
Атомы могут достраивать свои валентные оболочки третьим способом: связываясь друг с другом таким образом, что все атомы в веществе делят внешние электроны друг друга. Так металлические элементы связываются и заполняют свои валентные оболочки. Металлы образуют структуры кристаллической решетки, подобные солям, но внешние электроны в их атомах не принадлежат какому-либо конкретному атому. Вместо этого внешние электроны принадлежат всем атомам в кристалле и могут свободно перемещаться по всему кристаллу.Это свойство делает металлы хорошими проводниками электричества.
Периодическая таблица[править | править источник]
Периодическая таблица элементов группирует элементы в столбцы и строки по общим химическим свойствам. Элементы появляются в последовательности в соответствии с их атомным номером. Щелчок по элементу в таблице предоставляет основную информацию об элементе, включая его имя, историю, электронную конфигурацию и атомный вес. Атомный вес в скобках указывает на атомный вес наиболее стабильного изотопа.
Щелчок по элементу в таблице предоставляет основную информацию об элементе, включая его имя, историю, электронную конфигурацию и атомный вес. Атомный вес в скобках указывает на атомный вес наиболее стабильного изотопа.
Организация периодической таблицы отражает то, как элементы заполняют свои орбитали электронами. Ученые впервые разработали эту диаграмму, сгруппировав элементы, которые ведут себя одинаково, в порядке возрастания атомного номера. В конце концов ученые поняли, что химическое и физическое поведение элементов зависит от электронных облаков атомов каждого элемента. Периодическая таблица не имеет простой прямоугольной формы.
Энергетические уровни электронов[edit | править источник]
Каждый электрон в атоме имеет определенную энергию.Эта энергия зависит от скорости электрона, присутствия других электронов, расстояния электрона от ядра и положительного заряда ядра. Для атомов с более чем одним электроном вычисление энергии каждого электрона становится слишком сложным для практического применения. Однако порядок и относительные энергии электронов соответствуют порядку электронных орбиталей, как обсуждалось в разделе «Электронная орбиталь и оболочка» этой статьи. Физики называют энергию, которую электрон имеет на определенной орбите, энергетическим состоянием электрона.Например, орбиталь 1s удерживает два электрона с минимально возможными энергиями в атоме. Эти электроны находятся в самом низком энергетическом состоянии среди всех электронов в атоме.
Однако порядок и относительные энергии электронов соответствуют порядку электронных орбиталей, как обсуждалось в разделе «Электронная орбиталь и оболочка» этой статьи. Физики называют энергию, которую электрон имеет на определенной орбите, энергетическим состоянием электрона.Например, орбиталь 1s удерживает два электрона с минимально возможными энергиями в атоме. Эти электроны находятся в самом низком энергетическом состоянии среди всех электронов в атоме.
Когда атом получает или теряет энергию, он делает это, добавляя энергию своим электронам или забирая энергию у них. Это изменение энергии заставляет электроны перемещаться с одной орбитали или разрешенного энергетического состояния на другое. В обычных условиях все электроны в атоме находятся в самых низких возможных энергетических состояниях, учитывая, что только два электрона могут занимать каждую орбиталь.Атомы получают энергию, поглощая ее из света или при столкновении с другой частицей, или они получают ее, входя в электрическое или магнитное поле. Когда атом поглощает энергию, один или несколько его электронов перемещаются на более высокую или более энергичную орбиталь. Обычно атомы могут удерживать энергию только в течение очень короткого промежутка времени — обычно 1 × 10–12 секунд или меньше. Когда электроны возвращаются в исходное энергетическое состояние, они высвобождают дополнительную энергию в виде фотона (пакета излучения). Иногда это излучение имеет форму видимого света.Примером этого процесса является свет, излучаемый люминесцентной лампой.
Когда атом поглощает энергию, один или несколько его электронов перемещаются на более высокую или более энергичную орбиталь. Обычно атомы могут удерживать энергию только в течение очень короткого промежутка времени — обычно 1 × 10–12 секунд или меньше. Когда электроны возвращаются в исходное энергетическое состояние, они высвобождают дополнительную энергию в виде фотона (пакета излучения). Иногда это излучение имеет форму видимого света.Примером этого процесса является свет, излучаемый люминесцентной лампой.
Внешние электроны в атоме легче переместить на более высокие орбитали, чем электроны на более низких орбиталях. Внутренним электронам требуется больше энергии для движения, потому что они ближе к ядру и, следовательно, испытывают более сильное электромагнитное притяжение к ядру, чем внешние электроны. Когда внутренний электрон поглощает энергию, а затем падает обратно, излучаемый им фотон имеет больше энергии, чем фотон, испускаемый внешним электроном.Излучаемая энергия напрямую связана с длиной волны фотона. Фотоны с большей энергией состоят из излучения с более короткой длиной волны. Когда внутренние электроны падают вниз, они излучают высокоэнергетическое излучение в диапазоне рентгеновских лучей. Рентгеновские лучи имеют гораздо более короткие длины волн, чем видимый свет. Когда внешние электроны падают вниз, они излучают свет с большей длиной волны в диапазоне видимого света.
Фотоны с большей энергией состоят из излучения с более короткой длиной волны. Когда внутренние электроны падают вниз, они излучают высокоэнергетическое излучение в диапазоне рентгеновских лучей. Рентгеновские лучи имеют гораздо более короткие длины волн, чем видимый свет. Когда внешние электроны падают вниз, они излучают свет с большей длиной волны в диапазоне видимого света.
Физики и химики впервые узнали о свойствах атомов косвенно, изучая, как атомы соединяются в молекулы или как атомы и молекулы образуют твердые тела, жидкости и газы.Современные устройства, такие как электронные микроскопы, ловушки частиц, спектроскопы и ускорители частиц, позволяют ученым проводить эксперименты с небольшими группами атомов и даже с отдельными атомами. Ученые используют эти эксперименты для более непосредственного изучения свойств атомов.
Электронные микроскопы[править | править источник]
Отдельные атомы элемента кремния можно увидеть на этом изображении, полученном с помощью сканирующего просвечивающего электронного микроскопа. Атомы в каждой паре находятся на расстоянии менее одной десятимиллионной миллиметра (менее одной стомиллионной дюйма) друг от друга.
Атомы в каждой паре находятся на расстоянии менее одной десятимиллионной миллиметра (менее одной стомиллионной дюйма) друг от друга.
Один из самых непосредственных способов изучения объекта — его фотография. Ученые фотографируют атомы с помощью электронного микроскопа. Электронный микроскоп имитирует обычную камеру, но для формирования изображения использует электроны вместо видимого света. В фотографии свет отражается от объекта и записывается на пленку или другой детектор. Сфотографировать атом со светом сложно, потому что атомы очень маленькие. Свет, как и все волны, имеет тенденцию преломляться или огибать объекты на своем пути (см. Дифракция).Чтобы сделать четкую фотографию любого объекта, длина волны света, отражающегося от объекта, должна быть намного меньше размера объекта. Если размер объекта примерно равен или меньше длины волны света, свет будет огибать объект и создавать нечеткое изображение.
Атомы настолько малы, что даже самые короткие волны видимого света будут преломляться вокруг них. Поэтому для получения фотографических изображений атомов необходимо использовать волны короче, чем волны видимого света.Рентгеновские лучи — это разновидность электромагнитного излучения, подобного видимому свету, но они имеют очень короткие длины волн — слишком короткие, чтобы их можно было увидеть человеческим глазом. Длины волн рентгеновского излучения достаточно малы, чтобы предотвратить дифрагию волн вокруг атомов. Рентгеновские лучи, однако, обладают такой большой энергией, что когда они отражаются от атома, они выбивают электроны из атома. Поэтому ученые не могут использовать рентгеновские лучи, чтобы сфотографировать атом, не изменяя сам атом. Они должны использовать другой метод, чтобы получить точную картину.
Поэтому для получения фотографических изображений атомов необходимо использовать волны короче, чем волны видимого света.Рентгеновские лучи — это разновидность электромагнитного излучения, подобного видимому свету, но они имеют очень короткие длины волн — слишком короткие, чтобы их можно было увидеть человеческим глазом. Длины волн рентгеновского излучения достаточно малы, чтобы предотвратить дифрагию волн вокруг атомов. Рентгеновские лучи, однако, обладают такой большой энергией, что когда они отражаются от атома, они выбивают электроны из атома. Поэтому ученые не могут использовать рентгеновские лучи, чтобы сфотографировать атом, не изменяя сам атом. Они должны использовать другой метод, чтобы получить точную картину.
Электронные микроскопы предоставляют ученым альтернативный метод. Ученые светят электронами вместо света на атом. Как обсуждалось в разделе «Электроны как волны» этой статьи, электроны обладают волновыми свойствами, поэтому они могут вести себя как световые волны. Электронный микроскоп простейшего типа фокусирует электроны, отраженные от объекта, и переводит рисунок, образованный отраженными электронами, в видимое изображение. Ученые использовали эту технику для создания изображений крошечных насекомых и даже отдельных живых клеток, но им не удалось использовать ее для получения четкого изображения объектов размером менее примерно 10 нанометров (сокращенно нм) или 1 × 10-8 м. (4 × 10-7 дюймов).
Электронный микроскоп простейшего типа фокусирует электроны, отраженные от объекта, и переводит рисунок, образованный отраженными электронами, в видимое изображение. Ученые использовали эту технику для создания изображений крошечных насекомых и даже отдельных живых клеток, но им не удалось использовать ее для получения четкого изображения объектов размером менее примерно 10 нанометров (сокращенно нм) или 1 × 10-8 м. (4 × 10-7 дюймов).
Чтобы добраться до уровня отдельных атомов, ученые должны использовать более мощный тип электронного микроскопа, называемый сканирующим туннельным микроскопом (СТМ). СТМ использует крошечный зонд, кончик которого может быть размером с один атом, для сканирования объекта. СТМ использует еще одно волновое свойство электронов, называемое туннелированием. Туннелирование позволяет электронам, испускаемым зондом микроскопа, проникать или туннелировать в поверхность исследуемого объекта. Скорость, с которой электроны туннелируют от зонда к поверхности, связана с расстоянием между зондом и поверхностью. Эти движущиеся электроны генерируют крошечный электрический ток, который измеряет СТМ. СТМ постоянно регулирует высоту зонда, чтобы поддерживать постоянный ток. Отслеживая, как изменяется высота зонда по мере его перемещения по поверхности, ученые могут получить подробную карту поверхности. Карта может быть настолько подробной, что видны отдельные атомы на поверхности.
Эти движущиеся электроны генерируют крошечный электрический ток, который измеряет СТМ. СТМ постоянно регулирует высоту зонда, чтобы поддерживать постоянный ток. Отслеживая, как изменяется высота зонда по мере его перемещения по поверхности, ученые могут получить подробную карту поверхности. Карта может быть настолько подробной, что видны отдельные атомы на поверхности.
Ловушки для частиц[edit | править источник]
Изучение отдельных атомов или небольших образцов атомов может помочь ученым понять структуру атома.Однако все атомы, даже атомы, входящие в состав твердого вещества, постоянно находятся в движении. Это постоянное движение затрудняет их изучение. Чтобы изучить отдельные атомы, ученые должны замедлить атомы и ограничить их движение в одном месте. Ученые могут замедлять и улавливать атомы с помощью устройств, называемых ловушками для частиц.
Замедление атомов на самом деле то же самое, что их охлаждение. Это связано с тем, что скорость движения атома напрямую связана с его температурой. Атомы, которые движутся очень быстро, заставляют вещество иметь высокую температуру.Атомы, движущиеся медленнее, создают более низкую температуру. Поэтому ученые строят ловушки, которые охлаждают атомы до очень низкой температуры.
Атомы, которые движутся очень быстро, заставляют вещество иметь высокую температуру.Атомы, движущиеся медленнее, создают более низкую температуру. Поэтому ученые строят ловушки, которые охлаждают атомы до очень низкой температуры.
Существует несколько различных типов ловушек для частиц. Некоторые ловушки предназначены для замедления ионов, а другие предназначены для замедления электрически нейтральных атомов. Ловушки для ионов часто используют электрические и магнитные поля, чтобы воздействовать на движение частицы, удерживая ее в небольшом пространстве или замедляя ее. В ловушках для нейтральных атомов часто используются лазеры, лучи света в которых световые волны однородны и последовательны.У света нет массы, но он движется так быстро, что у него есть импульс. Это свойство позволяет свету воздействовать на другие частицы или «натыкаться» на них. Когда лазерный луч сталкивается с атомами, импульс света заставляет атомы изменять скорость и направление.
Ученые используют захваченные и охлажденные атомы для различных экспериментов, включая те, которые точно измеряют свойства отдельных атомов, и те, в которых ученые создают чрезвычайно точные атомные часы. Атомные часы отслеживают время, считая волны излучения, испускаемые атомами в ловушках внутри часов.Поскольку ловушки удерживают атомы при низких температурах, механизмы внутри часов могут осуществлять больший контроль над атомом, уменьшая вероятность ошибки. Ученые также могут использовать изолированные атомы для измерения силы гравитации в определенной области с предельной точностью. Эти измерения полезны, среди прочего, при разведке нефти. Месторождение нефти или другого вещества под поверхностью Земли имеет плотность, отличную от окружающего его материала. Сила гравитационного притяжения в области зависит от плотности материала в этой области, поэтому эти изменения плотности вызывают изменения локальной силы гравитации.Достижения в манипулировании атомами также повысили возможность использования атомов для травления электронных схем. Это помогло бы сделать схемы меньше и, таким образом, позволило бы разместить больше схем на меньшем участке.
Атомные часы отслеживают время, считая волны излучения, испускаемые атомами в ловушках внутри часов.Поскольку ловушки удерживают атомы при низких температурах, механизмы внутри часов могут осуществлять больший контроль над атомом, уменьшая вероятность ошибки. Ученые также могут использовать изолированные атомы для измерения силы гравитации в определенной области с предельной точностью. Эти измерения полезны, среди прочего, при разведке нефти. Месторождение нефти или другого вещества под поверхностью Земли имеет плотность, отличную от окружающего его материала. Сила гравитационного притяжения в области зависит от плотности материала в этой области, поэтому эти изменения плотности вызывают изменения локальной силы гравитации.Достижения в манипулировании атомами также повысили возможность использования атомов для травления электронных схем. Это помогло бы сделать схемы меньше и, таким образом, позволило бы разместить больше схем на меньшем участке.
В 1995 году американские физики использовали ловушки для частиц, чтобы охладить образец атомов рубидия до температуры, близкой к абсолютному нулю (-273°C, или -459°F). Абсолютный ноль – это температура, при которой прекращается всякое движение. Когда ученые охладили атомы рубидия до такой низкой температуры, атомы замедлились почти до полной остановки.Ученые знали, что импульс атомов, связанный с их скоростью, близок к нулю. В этот момент особое правило квантовой физики, называемое принципом неопределенности, сильно повлияло на положение атомов. Это правило гласит, что импульс и положение частицы не могут иметь точных значений одновременно. У ученых было довольно точное значение импульса атома (почти ноль), поэтому положение атомов стало очень неточным. Положение каждого атома можно описать как большое расплывчатое облако вероятности.Атомы в ловушке находились очень близко друг к другу, поэтому облака вероятности многих атомов перекрывали друг друга. Ученые не могли сказать, где заканчивается один атом и начинается другой. По сути, атомы образовали одну огромную частицу. Это новое состояние вещества называется конденсатом Бозе-Эйнштейна.
Абсолютный ноль – это температура, при которой прекращается всякое движение. Когда ученые охладили атомы рубидия до такой низкой температуры, атомы замедлились почти до полной остановки.Ученые знали, что импульс атомов, связанный с их скоростью, близок к нулю. В этот момент особое правило квантовой физики, называемое принципом неопределенности, сильно повлияло на положение атомов. Это правило гласит, что импульс и положение частицы не могут иметь точных значений одновременно. У ученых было довольно точное значение импульса атома (почти ноль), поэтому положение атомов стало очень неточным. Положение каждого атома можно описать как большое расплывчатое облако вероятности.Атомы в ловушке находились очень близко друг к другу, поэтому облака вероятности многих атомов перекрывали друг друга. Ученые не могли сказать, где заканчивается один атом и начинается другой. По сути, атомы образовали одну огромную частицу. Это новое состояние вещества называется конденсатом Бозе-Эйнштейна.
Спектроскопы[править | править источник]
В этой газоразрядной трубке, заполненной азотом, электрический ток возбуждает атомы азота. Почти мгновенно эти возбужденные атомы теряют свою избыточную энергию, излучая свет с определенной длиной волны.Это явление дискретного излучения возбужденных атомов оставалось необъяснимым до появления квантовой механики в начале 20 века.
Почти мгновенно эти возбужденные атомы теряют свою избыточную энергию, излучая свет с определенной длиной волны.Это явление дискретного излучения возбужденных атомов оставалось необъяснимым до появления квантовой механики в начале 20 века.
Спектроскопия — это исследование излучения или энергии, которую испускают атомы, ионы, молекулы и атомные ядра. Эта излучаемая энергия обычно имеет форму электромагнитного излучения — вибрирующих электрических и магнитных волн. Электромагнитные волны могут иметь различные длины волн, в том числе видимого света. Рентгеновские лучи, ультрафиолетовое излучение и инфракрасное излучение также являются формами электромагнитного излучения.Ученые используют спектроскопы для измерения этого испускаемого излучения.
Характеристическое излучение атомов[править | править источник]
Каждый химический элемент имеет характерный спектр или определенное распределение электромагнитного излучения. Из-за этих «характерных» длин волн можно идентифицировать составляющие неизвестного вещества, анализируя его спектр; этот метод называется спектроскопией. Спектры излучения, такие как показанные здесь репрезентативные примеры, выглядят как несколько линий определенной длины волны, разделенных абсолютной темнотой.Линии указывают на молекулярную структуру, возникающую там, где атомы совершают переходы между состояниями с определенной энергией.
Спектры излучения, такие как показанные здесь репрезентативные примеры, выглядят как несколько линий определенной длины волны, разделенных абсолютной темнотой.Линии указывают на молекулярную структуру, возникающую там, где атомы совершают переходы между состояниями с определенной энергией.
Атомы испускают излучение, когда их электроны теряют энергию и падают на более низкие орбитали или энергетические состояния, как описано выше в разделе «Энергетические уровни электронов». Разница в энергии между орбиталями определяет длину волны испускаемого излучения. Это излучение может быть в форме видимого света для внешних электронов или это может быть излучение с более короткими длинами волн, такое как рентгеновское излучение, для внутренних электронов.Поскольку энергии орбиталей строго определены и различаются от элемента к элементу, атомы конкретного элемента могут излучать только определенные длины волн излучения. Изучая длины волн излучения, испускаемого веществом, ученые могут идентифицировать элемент или элементы, входящие в состав вещества. Например, внешние электроны в атоме натрия излучают характерный желтый свет, когда возвращаются на более низкие орбитали. Вот почему уличные фонари, в которых используются пары натрия, имеют желтоватый оттенок свечения (см. также Натриевая лампа).
Например, внешние электроны в атоме натрия излучают характерный желтый свет, когда возвращаются на более низкие орбитали. Вот почему уличные фонари, в которых используются пары натрия, имеют желтоватый оттенок свечения (см. также Натриевая лампа).
Химики часто используют процедуру, называемую испытанием пламенем, для идентификации элементов. При испытании пламенем химик сжигает образец элемента. Тепло возбуждает внешние электроны в атомах элемента, заставляя электроны переходить на более высокие энергетические орбитали. Когда электроны возвращаются на свои первоначальные орбитали, они излучают свет, характерный для этого элемента. Этот свет окрашивает пламя и позволяет химику идентифицировать элемент.
Испытание пламенем представляет собой простую лабораторную процедуру, позволяющую определить наличие определенных элементов в химическом образце.Небольшое количество испытуемого вещества помещают на кончик чистой палочки и помещают палочку в пламя горелки Бунзена. Различные элементы окрашивают пламя в разные цвета. © Корпорация Microsoft. Все права защищены.
Внутренние электроны атомов также излучают излучение, которое может помочь ученым идентифицировать элементы. Энергия, необходимая для перевода внутреннего электрона на более высокую орбиталь, напрямую связана с положительным зарядом ядра и притяжением, которое этот заряд оказывает на электрон.Когда электрон возвращается на свой первоначальный уровень, он испускает то же количество энергии, что и поглотил, поэтому испускаемая энергия также связана с зарядом ядра. Заряд ядра равен атомному номеру атома.
© Корпорация Microsoft. Все права защищены.
Внутренние электроны атомов также излучают излучение, которое может помочь ученым идентифицировать элементы. Энергия, необходимая для перевода внутреннего электрона на более высокую орбиталь, напрямую связана с положительным зарядом ядра и притяжением, которое этот заряд оказывает на электрон.Когда электрон возвращается на свой первоначальный уровень, он испускает то же количество энергии, что и поглотил, поэтому испускаемая энергия также связана с зарядом ядра. Заряд ядра равен атомному номеру атома.
Ученые измеряют энергию испускаемого излучения, измеряя длину волны излучения. Энергия излучения напрямую связана с его длиной волны, которая обычно напоминает рентгеновское излучение для внутренних электронов. Измеряя длину волны излучения, испускаемого внутренним электроном атома, ученые могут идентифицировать атом по его атомному номеру.Ученые использовали этот метод в 1910-х годах для определения атомного номера элементов и размещения элементов в правильном порядке в периодической таблице. Этот метод до сих пор используется для идентификации особенно тяжелых элементов (с атомными номерами больше 100), которые производятся по несколько атомов за раз в больших ускорителях (см. Трансурановые элементы).
Этот метод до сих пор используется для идентификации особенно тяжелых элементов (с атомными номерами больше 100), которые производятся по несколько атомов за раз в больших ускорителях (см. Трансурановые элементы).
Радиация, выпущенная радиоактивностью[edit | править источник]
Атомные ядра испускают излучение, когда подвергаются радиоактивному распаду, как обсуждалось в разделе «Радиоактивность» выше.Ядра обычно испускают излучение с очень короткими длинами волн (и, следовательно, с высокой энергией) при распаде. Часто это излучение имеет форму гамма-лучей, формы электромагнитного излучения с длинами волн, даже более короткими, чем рентгеновские лучи. Опять же, ядра различных элементов излучают излучение с характерными длинами волн. Ученые могут идентифицировать ядра, измеряя это излучение. Этот метод особенно полезен при нейтронно-активационном анализе, методе, который ученые используют для определения присутствия крошечных количеств элементов.Ученые бомбардируют образцы, которые они хотят идентифицировать, нейтронами. Некоторые из нейтронов присоединяются к ядрам, делая их радиоактивными. Когда ядра распадаются, они испускают излучение, которое позволяет ученым идентифицировать вещество. Ученые-экологи используют нейтронно-активационный анализ при изучении загрязнения воздуха и воды. Криминалисты, изучающие улики, связанные с преступлениями, используют этот метод для выявления остатков пороха и следов ядов.
Некоторые из нейтронов присоединяются к ядрам, делая их радиоактивными. Когда ядра распадаются, они испускают излучение, которое позволяет ученым идентифицировать вещество. Ученые-экологи используют нейтронно-активационный анализ при изучении загрязнения воздуха и воды. Криминалисты, изучающие улики, связанные с преступлениями, используют этот метод для выявления остатков пороха и следов ядов.
Ускорители частиц[править | править источник]
Эти треки были сформированы элементарными частицами в пузырьковой камере на объекте CERN, расположенном за пределами Женевы, Швейцария.Изучая эти следы, физики могут определить определенные свойства частиц, прошедших через пузырьковую камеру. Например, заряд частицы можно определить, отметив тип пути, по которому прошла частица. Пузырьковая камера помещается в магнитное поле, которое заставляет траекторию положительно заряженной частицы изгибаться в одном направлении, а траекторию отрицательно заряженной частицы изгибаться в противоположном направлении; нейтральные частицы, на которые не действует магнитное поле, движутся прямолинейно.
Ускорители частиц — это устройства, которые увеличивают скорость пучка элементарных частиц, таких как протоны и электроны. Ученые используют ускоренный луч для изучения столкновений между частицами. Луч может столкнуться с мишенью из неподвижных частиц или с другим ускоренным пучком частиц, движущихся в противоположном направлении. Если физики используют ядро атома в качестве мишени, частицы и излучение, возникающие при столкновении, могут помочь им узнать о ядре.Чем быстрее движутся частицы, тем большую энергию они содержат. Если столкновения происходят при очень высокой энергии, возможно создание частиц, которые раньше не обнаруживались. При определенных обстоятельствах энергия может быть преобразована в материю, в результате чего после столкновения образуются более тяжелые частицы.
Циклотроны и линейные ускорители — два наиболее важных типа ускорителей частиц. В циклотроне магнитное поле удерживает пучок заряженных частиц на круговом пути. Электрическое поле взаимодействует с электрическим зарядом частиц, увеличивая их энергию и скорость каждый раз, когда луч проходит по кругу. В линейных ускорителях заряженные частицы движутся прямолинейно. Они получают много небольших импульсов энергии от электрических полей, когда проходят через ускоритель.
В линейных ускорителях заряженные частицы движутся прямолинейно. Они получают много небольших импульсов энергии от электрических полей, когда проходят через ускоритель.
Бомбардировка ядер пучками нейтронов заставляет ядра поглощать часть нейтронов и становиться нестабильными. Затем нестабильные ядра радиоактивно распадаются. То, как распадаются атомы, говорит ученым об изначальной структуре атома. Ученые также могут определить размер и форму ядер по тому, как частицы разлетаются от ядер при столкновении.Еще одним применением ускорителей частиц является создание новых и экзотических изотопов, в том числе атомов элементов с очень высокими атомными номерами, не встречающихся в природе.
На более высоких уровнях энергии, используя частицы, движущиеся с гораздо более высокими скоростями, ученые могут использовать ускорители, чтобы заглянуть внутрь протонов и нейтронов, чтобы изучить их внутреннюю структуру. На этих уровнях энергии ускорители могут производить новые типы частиц. Некоторые из этих частиц похожи на протоны или нейтроны, но имеют большую массу и очень нестабильны.Другие имеют структуру, подобную пиону, частице, которая обменивается между протоном и нейтроном как часть сильного взаимодействия, которое связывает ядро вместе. Создавая новые частицы и изучая их свойства, физики смогли вывести их общую внутреннюю структуру и классифицировать их, используя теорию кварков. В результате высокоэнергетических столкновений одной частицы с другой часто образуются сотни частиц. Перед экспериментаторами стоит непростая задача идентифицировать и измерить все эти частицы, некоторые из которых существуют лишь мельчайшие доли секунды.
Некоторые из этих частиц похожи на протоны или нейтроны, но имеют большую массу и очень нестабильны.Другие имеют структуру, подобную пиону, частице, которая обменивается между протоном и нейтроном как часть сильного взаимодействия, которое связывает ядро вместе. Создавая новые частицы и изучая их свойства, физики смогли вывести их общую внутреннюю структуру и классифицировать их, используя теорию кварков. В результате высокоэнергетических столкновений одной частицы с другой часто образуются сотни частиц. Перед экспериментаторами стоит непростая задача идентифицировать и измерить все эти частицы, некоторые из которых существуют лишь мельчайшие доли секунды.
Начиная с Демокрита, жившего в конце 5-го и начале 4-го веков до нашей эры, греческие философы разработали теорию материи, которая была основана не на экспериментальных данных, а на их попытках понять вселенную в философских терминах. Согласно этой теории, вся материя состоит из мельчайших неделимых частиц, называемых атомами (от греческого слова atomos, означающего «неделимый»). Если образец чистого элемента разделить на все меньшие и меньшие части, в конце концов будет достигнута точка, в которой дальнейшая резка будет невозможна — это будет атом этого элемента, наименьшая возможная частица этого элемента.
Если образец чистого элемента разделить на все меньшие и меньшие части, в конце концов будет достигнута точка, в которой дальнейшая резка будет невозможна — это будет атом этого элемента, наименьшая возможная частица этого элемента.
Древние греки считали, что все атомы состоят из одного и того же основного материала, но атомы разных элементов имеют разные размеры и формы. Размеры, формы и расположение атомов материала определяют свойства материала. Например, атомы жидкости были гладкими, чтобы они могли легко скользить друг по другу, а атомы твердого тела были шероховатыми и зубчатыми, чтобы они могли прикрепляться друг к другу. В отличие от атомов, материя была пустым пространством. Атомы и пустое пространство считались конечной реальностью.
Хотя представление об атомах как о крошечных частицах элементарной материи согласуется с современной атомной теорией, исследователи предшествующих эпох не понимали природу атомов или их взаимодействия в материалах. На протяжении веков у ученых не было методов или технологий для проверки своих теорий об основной структуре материи, поэтому люди приняли точку зрения древних греков.
Рождение современной атомной теории[править | править источник]
Работа британского химика Джона Дальтона в начале 19 века дала некоторые из первых сведений об истинной природе атомов.Дальтон изучал, как количества различных элементов, таких как водород и кислород, могут соединяться для образования других веществ, таких как вода. В своей книге «Новая система химической философии» (1808 г.) Дальтон сделал два утверждения об атомах: (1) атомы каждого элемента идентичны друг другу, но отличаются от атомов всех других элементов, и (2) атомы разных элементы могут соединяться, образуя более сложные вещества.
Представление Дальтона о том, что разные элементы имеют разные атомы, отличалось от греческого представления об атомах.Характеристики атомов Дальтона определяли химические и физические свойства вещества, независимо от формы вещества. Например, атомы углерода могут образовывать как твердые алмазы, так и мягкий графит. В греческой теории атомов атомы алмаза сильно отличались бы от атомов графита. В теории Дальтона атомы алмаза очень похожи на атомы графита, потому что оба вещества состоят из одного и того же химического элемента.
В теории Дальтона атомы алмаза очень похожи на атомы графита, потому что оба вещества состоят из одного и того же химического элемента.
Разрабатывая свою теорию атомов, Дальтон заметил, что два элемента могут соединяться более чем одним способом.Например, современным ученым известно, что окись углерода (СО) и двуокись углерода (СО2) являются соединениями углерода и кислорода. Согласно опытам Дальтона, количества элемента, необходимые для образования различных соединений, всегда кратны друг другу в целых числах. Например, для образования литра СО2 требуется в два раза больше кислорода, чем для образования литра СО. Дальтон правильно пришел к выводу, что соединения были созданы, когда атомы чистых элементов соединялись вместе в фиксированных пропорциях, образуя единицы, которые сегодня ученые называют молекулы.
состояния материи[править | править источник]
Ученые в начале 19 века боролись в другой области атомной теории. Они пытались понять, как атомы одного элемента могут существовать в твердом, жидком и газообразном состояниях.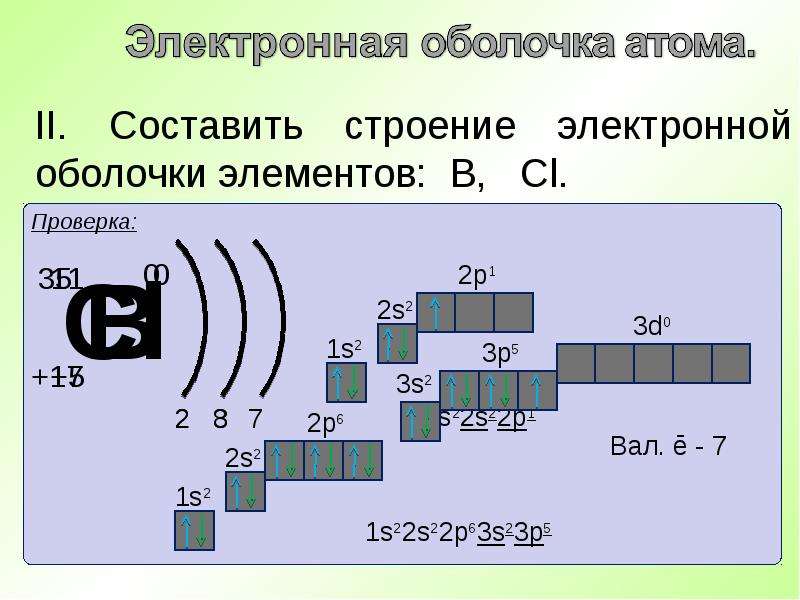 Ученые правильно предположили, что атомы в твердом теле притягиваются друг к другу с достаточной силой, чтобы удерживать твердое тело вместе, но они не понимали, почему атомы жидкостей и газов не притягиваются друг к другу так сильно. Некоторые ученые предположили, что силы между атомами были притягивающими на коротких расстояниях (например, когда атомы были упакованы очень близко друг к другу, образуя твердое тело) и отталкивающими на больших расстояниях (например, в газе, где атомы в среднем находятся относительно далеко друг от друга). отдельно).
Ученые правильно предположили, что атомы в твердом теле притягиваются друг к другу с достаточной силой, чтобы удерживать твердое тело вместе, но они не понимали, почему атомы жидкостей и газов не притягиваются друг к другу так сильно. Некоторые ученые предположили, что силы между атомами были притягивающими на коротких расстояниях (например, когда атомы были упакованы очень близко друг к другу, образуя твердое тело) и отталкивающими на больших расстояниях (например, в газе, где атомы в среднем находятся относительно далеко друг от друга). отдельно).
Ученым было трудно решить проблему состояний материи, потому что они не понимали должным образом природу тепла. Сегодня ученые признают, что тепло — это форма энергии, и что разное количество этой энергии в веществе приводит к разным состояниям материи. Однако в 19 веке считалось, что теплота представляет собой материальную субстанцию, называемую теплотворной, которая может передаваться от одного объекта к другому. Это объяснение теплоты было названо калорической теорией. Дальтон использовал теорию калорий, чтобы предположить, что каждая молекула газа окружена калорией, которая оказывает отталкивающую силу на другие молекулы. Согласно теории Дальтона, при нагревании газа к газу добавляется больше калорий, что увеличивает силу отталкивания между молекулами. Согласно экспериментам ученых, более калорийный газ будет оказывать большее давление на стенки его контейнера.
Дальтон использовал теорию калорий, чтобы предположить, что каждая молекула газа окружена калорией, которая оказывает отталкивающую силу на другие молекулы. Согласно теории Дальтона, при нагревании газа к газу добавляется больше калорий, что увеличивает силу отталкивания между молекулами. Согласно экспериментам ученых, более калорийный газ будет оказывать большее давление на стенки его контейнера.
Это раннее объяснение теплоты и состояний материи рухнуло, когда эксперименты в середине 19-го века показали, что тепло может превращаться в энергию движения.Законы физики гласят, что количество энергии в системе не может увеличиваться, поэтому ученым пришлось признать, что тепло должно быть энергией, а не веществом. Это открытие потребовало новой теории поведения атомов в различных состояниях материи.
Поведение газов[править | править источник]
В начале 19 века итальянский химик Амедео Авогадро сделал важный шаг вперед в понимании того, как ведут себя атомы и молекулы в газе.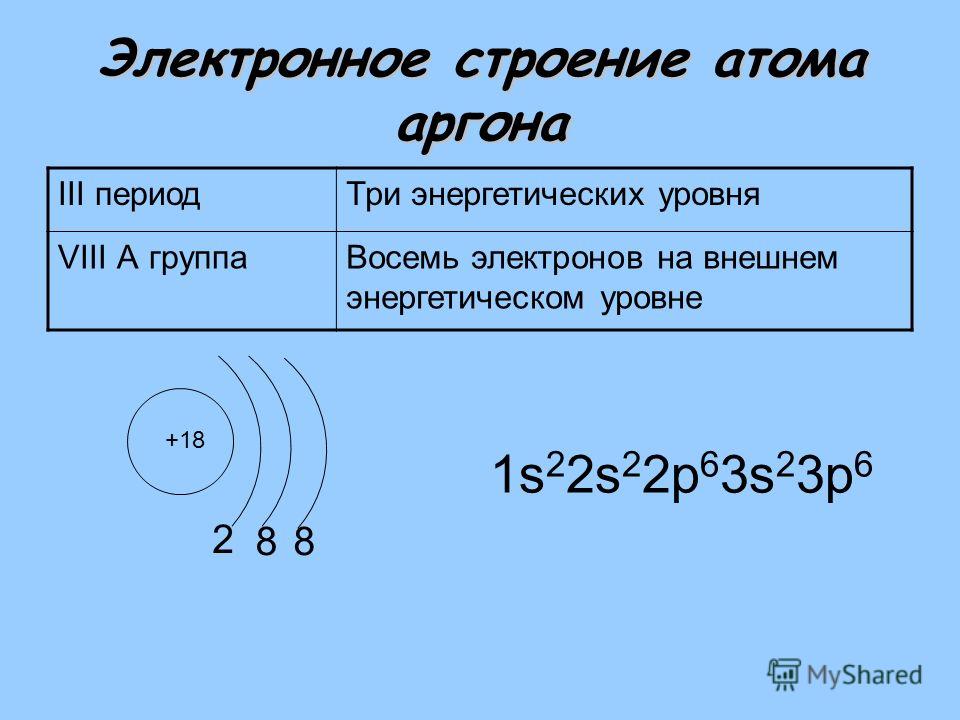 Авогадро начал свою работу с теории, разработанной Дальтоном.Теория Дальтона предполагала, что газообразное соединение, образованное соединением равного числа атомов двух элементов, должно иметь такое же количество молекул, как атомы в одном из исходных элементов. Например, десять атомов элемента водорода (H) соединяются с десятью атомами хлора (Cl) с образованием десяти молекул газообразного хлористого водорода (HCl).
Авогадро начал свою работу с теории, разработанной Дальтоном.Теория Дальтона предполагала, что газообразное соединение, образованное соединением равного числа атомов двух элементов, должно иметь такое же количество молекул, как атомы в одном из исходных элементов. Например, десять атомов элемента водорода (H) соединяются с десятью атомами хлора (Cl) с образованием десяти молекул газообразного хлористого водорода (HCl).
В 1811 году Авогадро разработал закон физики, который, казалось, противоречил теории Дальтона. Закон Авогадро гласит, что равные объемы различных газов содержат одинаковое количество частиц (атомов или молекул), если оба газа имеют одинаковые температуру и давление.В эксперименте Дальтона объем первоначальных сосудов, содержащих газообразный водород или хлор, был таким же, как и объем сосуда, содержащего газообразный хлористый водород. Давления исходных газов водорода и хлора были одинаковыми, но давление соляного газа было в два раза выше, чем у любого из исходных газов. Согласно закону Авогадро, это удвоенное давление означало бы, что частиц газообразного хлористого водорода было в два раза больше, чем частиц хлора до их соединения.
Согласно закону Авогадро, это удвоенное давление означало бы, что частиц газообразного хлористого водорода было в два раза больше, чем частиц хлора до их соединения.
Чтобы согласовать результаты эксперимента Дальтона с его новым правилом, Авогадро был вынужден заключить, что первоначальные сосуды с водородом или хлором содержали вдвое меньше частиц, чем предполагал Дальтон. Однако Дальтон знал общий вес каждого газа в сосудах, а также вес отдельного атома каждого газа, поэтому он знал общее число атомов каждого газа, находившегося в сосудах. Авогадро примирился с фактом, что в сосудах было вдвое больше атомов, чем частиц, предположив, что такие газы, как водород и хлор, на самом деле состоят из молекул водорода и хлора, по два атома в каждой молекуле.Сегодня ученые пишут химические символы водорода и хлора как h3 и Cl2 соответственно, указывая на то, что в каждой молекуле есть два атома. Одна молекула водорода и одна молекула хлора объединяются, образуя две молекулы хлороводорода (h3 + Cl2 → 2HCl). Образец хлористого водорода содержит в два раза больше частиц, чем водород или хлор, потому что при соединении молекулы водорода с молекулой хлора образуются две молекулы хлористого водорода.
Образец хлористого водорода содержит в два раза больше частиц, чем водород или хлор, потому что при соединении молекулы водорода с молекулой хлора образуются две молекулы хлористого водорода.
Электрические силы в атомах[править | править источник]
Когда ученые узнали о структуре атома в ходе экспериментов, они модифицировали свои модели атома, чтобы они соответствовали их данным.Британский физик Джозеф Джон Томсон понял, что атомы содержат положительные и отрицательные заряды, а британский физик Эрнест Резерфорд обнаружил, что положительный заряд атома сосредоточен в ядре. Датский физик Нильс Бор предположил, что электроны вращаются только на заданном расстоянии от ядра, а австрийский физик Эрвин Шредингер обнаружил, что электроны в атоме на самом деле ведут себя скорее как волны, чем как частицы.
Работа Дальтона и Авогадро привела к последовательному представлению о количествах различных газов, которые могут соединяться с образованием соединений, но ученые так и не поняли природу сил, притягивающих атомы друг к другу в соединениях и молекулах. Ученые подозревали, что электрические силы могут иметь какое-то отношение к этому притяжению, но им было трудно понять, как электрические силы могут позволить двум идентичным нейтральным атомам водорода притягиваться друг к другу, образуя молекулу водорода.
Ученые подозревали, что электрические силы могут иметь какое-то отношение к этому притяжению, но им было трудно понять, как электрические силы могут позволить двум идентичным нейтральным атомам водорода притягиваться друг к другу, образуя молекулу водорода.
В 1830-х годах британский физик Майкл Фарадей сделал первый значительный шаг к пониманию важности электрических сил в соединениях. Фарадей поместил два электрода, подключенных к противоположным полюсам батареи, в раствор воды, содержащий растворенное соединение.Пока электрический ток протекал через раствор, Фарадей заметил, что один из элементов, входящих в состав растворенного соединения, осаждался на одном электроде, а другой элемент осаждался на другом электроде. Электрический ток, создаваемый электродами, разрушал связь атомов в соединении. Фарадей также заметил, что количество каждого элемента, осажденного на электроде, прямо пропорционально общему количеству тока, протекающего через раствор: чем сильнее ток, тем больше материала осаждается на электроде. Это открытие прояснило, что электрические силы должны быть каким-то образом ответственны за соединение атомов в соединениях.
Это открытие прояснило, что электрические силы должны быть каким-то образом ответственны за соединение атомов в соединениях.
Несмотря на эти важные открытия, большинство ученых не сразу признали, что атомы, описанные Дальтоном, Фарадеем и Авогадро, ответственны за химическое и физическое поведение веществ. До конца 19 века многие ученые считали, что все химические и физические свойства могут быть определены правилами теплоты, понимание атомов ближе к пониманию греческих философов.Развитие науки термодинамики (научное изучение тепла) и признание того, что теплота является формой энергии, устранили роль теплорода в атомной теории и сделали атомную теорию более приемлемой. Новая теория тепла, называемая кинетической теорией, говорит, что атомы или молекулы вещества движутся быстрее или приобретают кинетическую энергию по мере того, как к веществу добавляется тепловая энергия. Тем не менее небольшая, но мощная группа ученых по-прежнему не признавала существования атомов — они рассматривали атомы как удобные математические устройства, объясняющие химию соединений, а не как реальные объекты.
В 1905 году французский химик Жан-Батист Перрен провел последние эксперименты, которые помогли доказать атомную теорию материи. Перрин наблюдал неравномерное покачивание пыльцевых зерен, взвешенных в жидкости (явление, называемое броуновским движением), и правильно объяснил, что это покачивание было результатом столкновения атомов жидкости с пыльцевыми зернами. Этот эксперимент показал, что идея о том, что материалы состоят из реальных атомов, находящихся в тепловом движении, на самом деле верна.
Когда ученые начали принимать атомную теорию, исследователи сосредоточили свои усилия на понимании электрических свойств атома.Несколько ученых, в первую очередь британский ученый сэр Уильям Крукс, изучали эффекты прохождения электрического тока через газ. Ученые поместили очень небольшое количество газа в герметичную стеклянную трубку. Трубка имела электроды на обоих концах. Когда к газу подавался электрический ток, с одного из электродов вытекал поток электрически заряженных частиц. Этот электрод назвали катодом, а частицы – катодными лучами.
Этот электрод назвали катодом, а частицы – катодными лучами.
Сначала ученые полагали, что лучи состоят из заряженных атомов или молекул, но эксперименты показали, что катодные лучи могут проникать через тонкие листы материала, что было бы невозможно для такой большой частицы, как атом или молекула.Британский физик сэр Джозеф Джон Томсон измерил скорость катодных лучей и показал, что они слишком быстры, чтобы быть атомами или молекулами. Никакая известная сила не могла бы разогнать такую тяжелую частицу, как атом или молекулу, до такой высокой скорости. Томсон также измерил отношение заряда катодного луча к массе катодного луча. Измеренное им значение было примерно в 1000 раз больше, чем любое предыдущее измерение, связанное с заряженными атомами или молекулами, что указывает на то, что в катодных лучах особенно маленькие массы несут относительно большое количество заряда.Томсон изучал разные газы и всегда находил одно и то же значение отношения заряда к массе. Он пришел к выводу, что наблюдает новый тип частиц, несущих отрицательный электрический заряд, но примерно в тысячу раз менее массивных, чем самый легкий из известных атомов. Он также пришел к выводу, что эти частицы были составными частями всех атомов. Сегодня ученые знают эти частицы как электроны, и Томсону приписывают их открытие.
Он также пришел к выводу, что эти частицы были составными частями всех атомов. Сегодня ученые знают эти частицы как электроны, и Томсону приписывают их открытие.
Ядерный атом Резерфорда[править | править источник]
Резерфорд изучал структуру атома, обстреливая атомы золота пучком альфа-частиц.Несколько альфа-частиц отскочили прямо назад, указывая на то, что они столкнулись с чем-то массивным. Резерфорд предположил, что большая часть массы атомов сосредоточена в их центрах. Эта концентрация массы теперь известна как ядро.
Ученые поняли, что если все атомы содержат электроны, но электрически нейтральны, атомы также должны содержать равное количество положительного заряда, чтобы уравновесить отрицательный заряд электронов. Кроме того, если электроны действительно намного менее массивны, чем даже самый легкий атом, то этот положительный заряд должен составлять большую часть массы атома.Томсон предложил модель, согласно которой могло происходить это явление: он предположил, что атом представляет собой сферу с положительным зарядом, в которую встроены отрицательные электроны, как изюм в буханке хлеба с изюмом. В 1911 году британский ученый Эрнест Резерфорд решил проверить предложение Томсона, обстреляв атомы пучком заряженных частиц.
В 1911 году британский ученый Эрнест Резерфорд решил проверить предложение Томсона, обстреляв атомы пучком заряженных частиц.
Резерфорд выбрал для своего луча альфа-частицы. Альфа-частицы — это тяжелые частицы с удвоенным положительным зарядом протона. Сейчас известно, что альфа-частицы представляют собой ядра атомов гелия, которые содержат два протона и два нейтрона.Если модель атома Томсона была верна, Резерфорд предположил, что электрический заряд и масса атомов будут слишком разбросаны, чтобы значительно отклонить альфа-частицы. Резерфорд был очень удивлен, увидев совсем другое. Большинство альфа-частиц действительно изменили свои траектории на небольшой угол, а иногда альфа-частица отскакивала назад в противоположном направлении. Отскочившие альфа-частицы, должно быть, столкнулись с чем-то не менее тяжелым, чем они сами.Это побудило Резерфорда предложить совершенно другую модель атома. Вместо того чтобы предположить, что положительный заряд и масса распределены по всему объему атома, он предположил, что они сосредоточены в центре атома.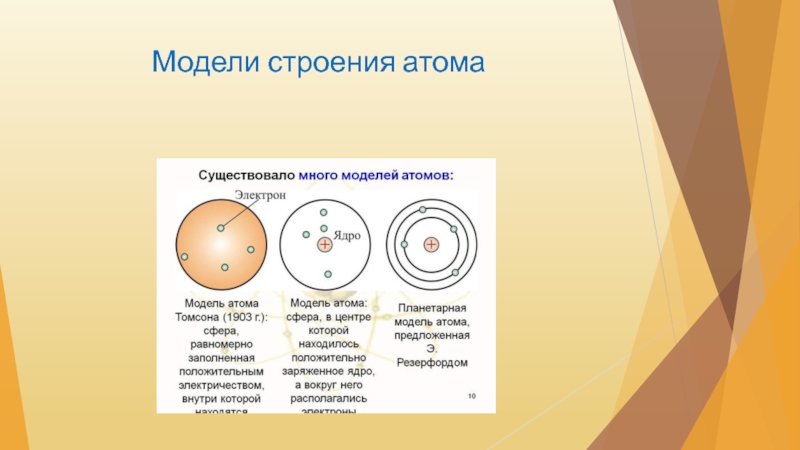 Резерфорд назвал эту концентрированную область электрического заряда ядром атома.
Резерфорд назвал эту концентрированную область электрического заряда ядром атома.
В течение 100 лет, от Дальтона до Резерфорда, основные представления об атомной структуре эволюционировали от очень примитивных представлений о том, как атомы соединяются друг с другом, к пониманию составляющих атомов — положительно заряженного ядра, окруженного отрицательно заряженными электронами. .Взаимодействия между ядром и электронами еще требовали изучения. Для физиков было естественным смоделировать атом, в котором крошечные электроны вращаются вокруг гораздо более массивного ядра, по образцу знакомой структуры, такой как Солнечная система, в которой планеты вращаются вокруг гораздо более массивного Солнца. Модель атома Резерфорда действительно напоминала крошечную солнечную систему. Единственная разница между ранними моделями ядерного атома и Солнечной системы заключалась в том, что атомы удерживались вместе электромагнитной силой, тогда как гравитационная сила удерживает вместе Солнечную систему.
Модель Бора[править | править источник]
Датский физик Нильс Бор использовал новые знания об излучении, испускаемом атомами, для разработки модели атома, существенно отличающейся от модели Резерфорда. Ученые 19 века обнаружили, что когда электрический разряд проходит через небольшое количество газа в стеклянной трубке, атомы газа излучают свет. Это излучение происходит только на определенных дискретных длинах волн, а разные элементы и соединения излучают разные длины волн.Бор, работая в лаборатории Резерфорда, намеревался понять испускание излучения на этих длинах волн на основе ядерной модели атома.
Используя модель атома Резерфорда как миниатюрной солнечной системы, Бор разработал теорию, с помощью которой он мог предсказать, что те же длины волн, которые ученые измерили, излучаются атомами с одним электроном. Однако, придумывая эту теорию, Бор был вынужден сделать несколько поразительных выводов. Он пришел к выводу, что, поскольку атомы излучают свет только с дискретными длинами волн, электроны могут вращаться только на определенных обозначенных радиусах, а свет может излучаться только тогда, когда электрон перескакивает с одной из этих обозначенных орбит на другую. Оба этих вывода противоречили классической физике, которая не устанавливала строгих правил относительно размера орбит. Чтобы заставить свою теорию работать, Бору пришлось предложить специальные правила, нарушающие правила классической физики. Он пришел к выводу, что в атомном масштабе некоторые предпочтительные состояния движения были особенно устойчивыми. В этих состояниях движения вращающийся по орбите электрон (вопреки законам электромагнетизма) не будет излучать энергию.
Оба этих вывода противоречили классической физике, которая не устанавливала строгих правил относительно размера орбит. Чтобы заставить свою теорию работать, Бору пришлось предложить специальные правила, нарушающие правила классической физики. Он пришел к выводу, что в атомном масштабе некоторые предпочтительные состояния движения были особенно устойчивыми. В этих состояниях движения вращающийся по орбите электрон (вопреки законам электромагнетизма) не будет излучать энергию.
В то же время, когда Бор и Резерфорд разрабатывали ядерную модель атома, другие эксперименты указывали на подобные неудачи классической физики.Эти эксперименты включали излучение горячих светящихся объектов (называемое тепловым излучением) и высвобождение электронов с металлических поверхностей, освещенных ультрафиолетовым светом (фотоэлектрический эффект). Классическая физика не могла объяснить эти наблюдения, и ученые начали понимать, что им нужен новый подход. Они назвали этот новый подход квантовой механикой (см. Квантовая теория) и разработали для него математическую основу в 1920-х годах. Законы классической физики прекрасно работают в масштабах повседневных объектов, но в масштабах крошечных атомов применимы законы квантовой механики.
Квантовая теория) и разработали для него математическую основу в 1920-х годах. Законы классической физики прекрасно работают в масштабах повседневных объектов, но в масштабах крошечных атомов применимы законы квантовой механики.
Квантовая теория атомов[править | править источник]
Квантовомеханический взгляд на структуру атома поддерживает некоторые идеи Резерфорда и Бора. Ядро все еще находится в центре атома и обеспечивает электрическое притяжение, которое связывает электроны с атомом. Однако, вопреки теории Бора, электроны не обращаются по определенным планетоподобным орбитам. Квантово-механический подход признает волнообразный характер электронов и обеспечивает основу для рассмотрения электронов как нечетких облаков отрицательного заряда.Электроны по-прежнему имеют заданные состояния движения, но эти состояния движения не соответствуют фиксированным орбитам. Вместо этого они сообщают нам кое-что о геометрии электронного облака — его размере и форме, а также о том, является ли оно сферическим или сгруппировано в лепестки, как восьмерка.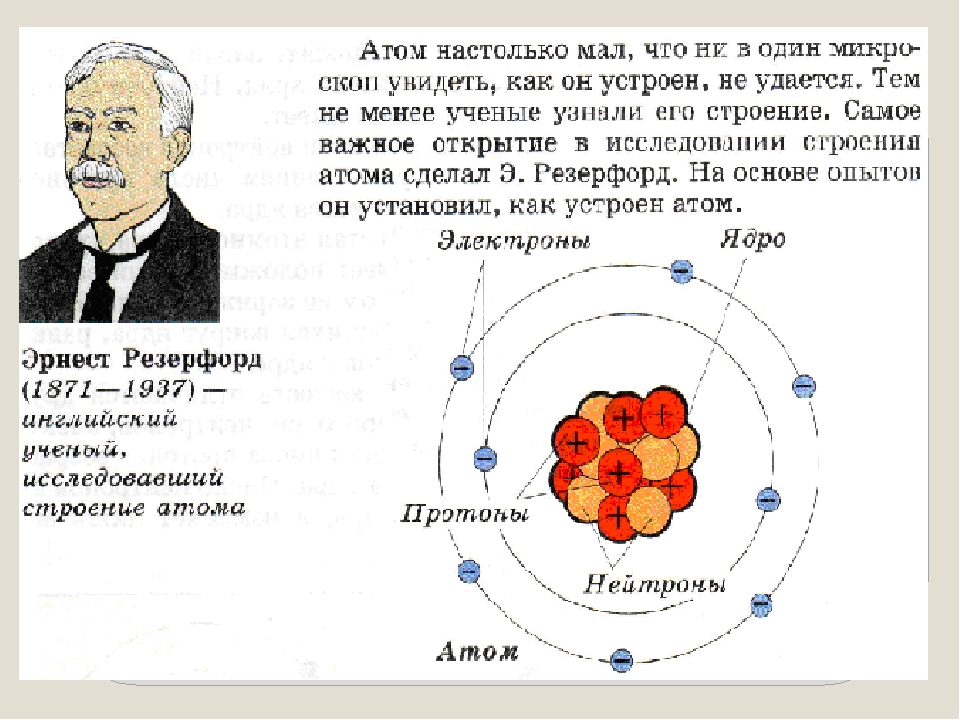 Физики назвали эти состояния движения орбиталями. Квантовая механика также обеспечивает математическую основу для понимания того, как атомы, соединяющиеся в молекулы, разделяют электроны. Спустя почти 100 лет после новаторских экспериментов Фарадея квантовая теория подтвердила, что именно электрические силы ответственны за структуру молекул.
Физики назвали эти состояния движения орбиталями. Квантовая механика также обеспечивает математическую основу для понимания того, как атомы, соединяющиеся в молекулы, разделяют электроны. Спустя почти 100 лет после новаторских экспериментов Фарадея квантовая теория подтвердила, что именно электрические силы ответственны за структуру молекул.
Два правила квантовой теории, наиболее важные для объяснения атома, — это идея корпускулярно-волнового дуализма и принцип исключения. Французский физик Луи де Бройль впервые предположил, что частицы можно описать как волны в 1924 году. В то же десятилетие австрийский физик Эрвин Шредингер и немецкий физик Вернер Гейзенберг расширили идеи де Бройля до формальных математических описаний квантовой механики. Принцип исключения был разработан американским физиком австрийского происхождения Вольфгангом Паули в 1925 году.Принцип запрета Паули гласит, что никакие два электрона в атоме не могут иметь абсолютно одинаковые характеристики.
Комбинация корпускулярно-волнового дуализма и принципа запрета Паули устанавливает правила заполнения электронных орбиталей в атомах.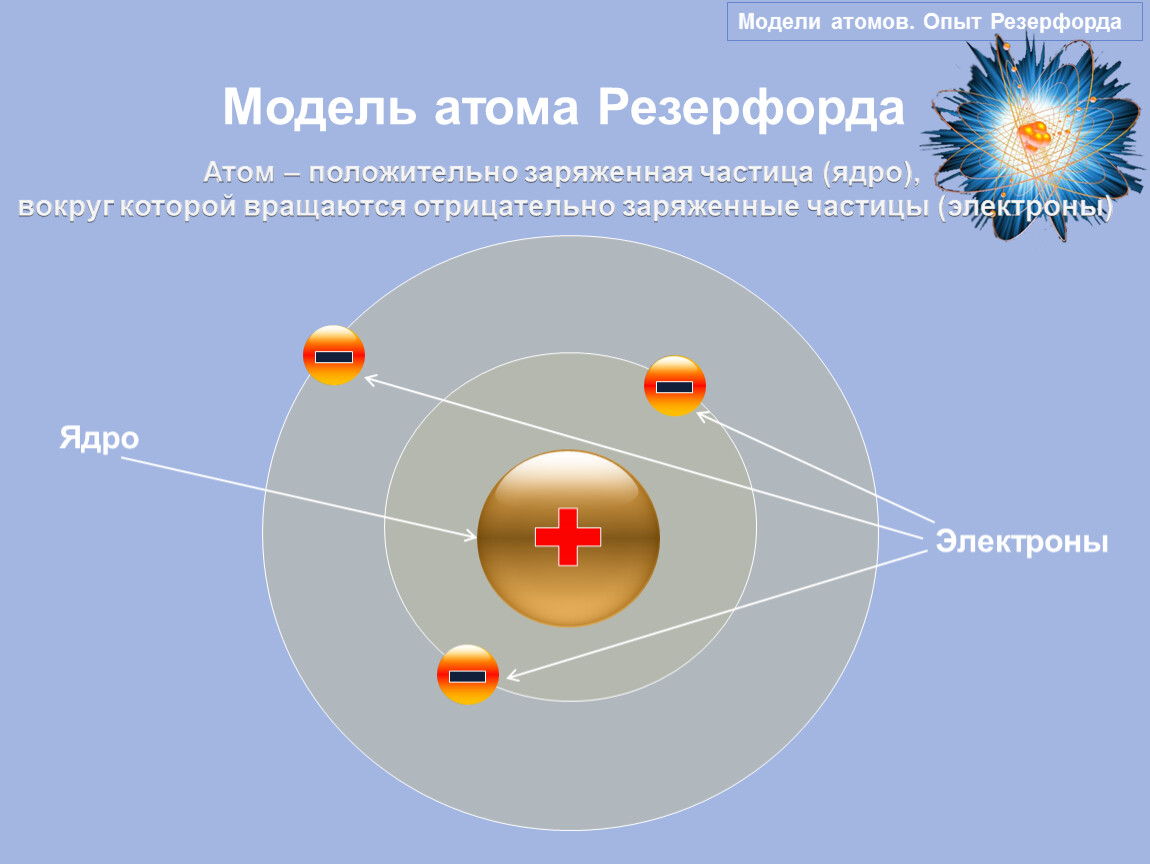 То, как электроны заполняют орбитали, определяет количество электронов, которые оказываются в валентной оболочке атома. Это, в свою очередь, определяет химические и физические свойства атома, например, как он реагирует с другими атомами и насколько хорошо он проводит электричество.Эти правила объясняют, почему атомы с одинаковым числом электронов могут иметь очень разные свойства и почему химические свойства снова и снова проявляются среди элементов в регулярном порядке.
То, как электроны заполняют орбитали, определяет количество электронов, которые оказываются в валентной оболочке атома. Это, в свою очередь, определяет химические и физические свойства атома, например, как он реагирует с другими атомами и насколько хорошо он проводит электричество.Эти правила объясняют, почему атомы с одинаковым числом электронов могут иметь очень разные свойства и почему химические свойства снова и снова проявляются среди элементов в регулярном порядке.
Реконструкция структуры атома и ее значение для учебников по общей физике: взгляд на историю и философию науки
AAPT (1999). Что такое наука? Американский журнал физики 67: 659.
Google Scholar
Абд-Эль-Халик, Ф.и Ледерман, Н. Г. (2000). Улучшение представлений учителей естественных наук о природе науки: критический обзор литературы. Международный журнал научного образования 22: 665-701.
Google Scholar
Ахинштайн, П. (1991). Частицы и волны: исторические очерки философии науки , Oxford University Press, Нью-Йорк.
(1991). Частицы и волны: исторические очерки философии науки , Oxford University Press, Нью-Йорк.
Google Scholar
Алонсо, М.и Финн, Э. Дж. (1972). Физика , Аддисон-Уэсли, Рединг, Массачусетс.
Google Scholar
Алонсо М. и Финн Э. Дж. (1995). Physics (испанское издание), Addison-Wesley, Reading, MA.
Google Scholar
Арфкен, Г.Б., Гриффинг, Д.Ф., +Келли, Д.К., и Прист, Дж. (1984). Университетская физика , Academic Press, Нью-Йорк.
Google Scholar
Арья А.П. (1974). Элементарная современная физика , Аддисон-Уэсли, Рединг, Массачусетс.
Google Scholar
Ауэрбах, Д. (2000). «Что такое наука? Разве это не что-то большее? American Journal of Physics 68: 305.
Google Scholar
Бейсер, А. (1972). Основные понятия физики , 2-е изд., Аддисон-Уэсли, Рединг, Массачусетс.
Google Scholar
Блатт, Ф.Дж. (1991). Основы физики , 3-е изд. (испанский), Prentice-Hall, Englewood Cliffs, NJ.
Google Scholar
Бор, Н. (1913). О строении атомов и молекул. Философский журнал 26: 1-25.
Google Scholar
Брем, Дж. Дж., и Маллин, В. Дж. (1989). Введение в строение материи. Курс современной физики , Уайли, Нью-Йорк.
Google Scholar
Кисть, С. Г. (2000). Томас Кун как историк науки. Наука и образование 9: 39-58.
Google Scholar
Bueche, FJ, and Jerde, D. A. (1995). Принципы физики , 6-е изд., McGraw-Hill, Нью-Йорк.
A. (1995). Принципы физики , 6-е изд., McGraw-Hill, Нью-Йорк.
Google Scholar
Коэн, Р.С. (1976). Физические науки , Холт, Райнхарт и Уинстон, Нью-Йорк.
Google Scholar
Купер, Л. Н. (1970). Введение в значение и структуру физики (краткое издание), Harper & Row, Нью-Йорк.
Google Scholar
Крукс, В. (1879 г.). О лучезарной материи. Природа 20: 419.
Google Scholar
Кроутер, Дж.Г. (1910). О рассеянии однородных γ-лучей и числе электронов в атоме, Proceedings of the Royal Society , Vol. lxxxiv, Королевское общество, Лондон, стр. 226–247.
Google Scholar
Катнелл, Дж. Д., и Джонсон, К. В. (1999). Physics (испанское издание), Wiley, Нью-Йорк.
Google Scholar
Дарвин, К.Г. (1962). Выступление на юбилейной конференции Резерфорда , Манчестер, Великобритания.
Эйсберг, Р. М. (1973). Основы современной физики , Уайли, Нью-Йорк.
Google Scholar
Айсберг, Р. М., и Лернер, Л. (1984). Физика: основы и приложения , Vol. II (исп. изд.), McGraw-Hill, Нью-Йорк.
Google Scholar
Элби, А. (2001). Помочь студентам-физикам научиться учиться. Американский журнал физики (приложение ) 69: S54-S64.
Google Scholar
Фальконер, И. (1987). Корпускулы, электроны и катодные лучи: Дж. Дж. Томсон и «открытие электрона». Британский журнал истории науки 20: 241-276.
Google Scholar
Фишбейн П. М., Гасиорович С. и Торнтон С.Т. (1994). Физика для ученых и инженеров , Vol. II (исп. изд.), Prentice-Hall, Englewood Cliffs, NJ.
М., Гасиорович С. и Торнтон С.Т. (1994). Физика для ученых и инженеров , Vol. II (исп. изд.), Prentice-Hall, Englewood Cliffs, NJ.
Google Scholar
Фитцджеральд Г. (1897 г.). Электрик 39: 103.
Google Scholar
Форинаш, К. (2000). Что такое наука? Американский журнал физики 68: 787-788.
Google Scholar
Галили И.и Хазан, А. (2000). Влияние исторически ориентированного курса на содержание знаний студентов по оптике оценивается с помощью анализа фасетных схем. Американский журнал физики 68 (Приложение): S3-S15.
Google Scholar
Гамов Г. и Кливленд Дж. (1975). Physics-Foundations and Frontiers , 2-е испанское изд., Prentice-Hall, Englewood Cliffs, NJ.
Google Scholar
Гейгер, Х. и Марсден, Э. (1909). О диффузном отражении альфа-частиц. Труды Королевского общества , Vol.lxxxii, Королевское общество, Лондон.
и Марсден, Э. (1909). О диффузном отражении альфа-частиц. Труды Королевского общества , Vol.lxxxii, Королевское общество, Лондон.
Google Scholar
Джанколи, округ Колумбия (1997). Physics, Principles With Applications , 4-е испанское изд., Prentice-Hall, Englewood Cliffs, NJ.
Google Scholar
Хакен Х. и Вольф Х.К. (1994). Физика атомов и квантов. Введение в эксперименты и теорию , 4-е изд., Springer-Verlag, Нью-Йорк.
Google Scholar
Холлидей Д. и Резник Р. (1971). Физика. Для студентов естественных и технических специальностей , часть. II, 2-е испанское изд., Wiley, Нью-Йорк.
Google Scholar
Холлидей Д., Резник Р. и Крейн К. С.(1994). Physics , Vol.2, 4-е испанское изд., Wiley, Нью-Йорк.
Google Scholar
Хаммер, Д. (1994). Эпистемологические убеждения во вводной физике. Познание и обучение 12: 151-183.
(1994). Эпистемологические убеждения во вводной физике. Познание и обучение 12: 151-183.
Google Scholar
Heilbron, JL (1981a). Атом Резерфорда-Бора. Американский журнал физики 49: 223-231.
Google Scholar
Хейлброн, Дж.Л. (1981б). Исторические исследования теории строения атома , Arno Press, Нью-Йорк.
Google Scholar
Хейлброн, Дж. Л., и Кун, Т. (1969). Генезис атома Бора. Исторические исследования в области физических наук 1: 211-290.
Google Scholar
Херрон, Дж. Д. (1977). Резерфорд и ядерный атом. Журнал химического образования 54: 499.
Google Scholar
Герц, Х. (1892 г.). Uber kathodenstrahlen durch dunn met-alschichten. Annalen der Physik und Chemie 45: 28.
Google Scholar
Холтон Г. (1981). Предисловие к симпозиуму: История атома. Американский журнал физики 49: 205.
Google Scholar
Холтон Г.(1986). Развитие науки и ее бремя , издательство Кембриджского университета, Кембридж, Великобритания.
Google Scholar
Холтон Г. (1993). Наука и антинаука , издательство Гарвардского университета, Кембридж, Массачусетс.
Google Scholar
Холтон Г. (1996). Научное образование и чувство собственного достоинства. В Gross, P.R., Levitt, N., and Lewis, M.W.(редакторы), Бегство от науки и разума , Академия наук, Нью-Йорк, стр. 551-560.
Google Scholar
Ховис, Р. К., и Краг, Х. (1991). Информационное письмо ГЭЭС-1: История физики элементарных частиц. Американский журнал физики 59: 779-807.
Google Scholar
Халсизер, Р. И., и Лазарус, Д. (1977). Мир физики , Аддисон-Уэсли, Менло-Парк, Калифорния.
Google Scholar
Джонс, Э. Р., и Чайлдерс, Р. Л. (1990). Современный колледж физики , Аддисон-Уэсли, Менло-Парк, Калифорния.
Google Scholar
Юсти Р. и Гилберт Дж. (2000). История и философия науки через модели: некоторые проблемы в случае «атома». Международный журнал научного образования 22: 993-1009.
Google Scholar
Кауфманн, В. (1897 г.). Умрите магнитные способности der katho-denstrahlen und ihre abh¨ angigkeit vom entladungspotential. Annalen der Physik und Chemie 61: 544.
Google Scholar
Kragh, HA (1992). Чувство истории: История науки и преподавание вводной квантовой теории. Наука и образование 1: 349-363.
Google Scholar
Кран К.С. (1996). Современная физика , 2-е изд., Wiley, Нью-Йорк.
Google Scholar
Кун, Т. (1970). Структура научных революций , 2-е изд., University of Chicago Press, Чикаго.
Google Scholar
Лакатос, И. (1970). Фальсификация и методология научно-исследовательских программ.В Лакатос, И., и Масгрейв, А. (ред.), Критика и рост знаний , Издательство Кембриджского университета, Кембридж, Великобритания, стр. 91-195.
Google Scholar
Лейте, Л. (2002). История науки в естественнонаучном образовании: разработка и утверждение контрольного списка для анализа исторического содержания учебников по естественным наукам. Наука и образование 11: 333-359.
Google Scholar
Маргенау, Х.(1950). Природа физической реальности , Макгроу-Хилл, Нью-Йорк.
Google Scholar
Марион, Дж. Б. (1981). Физика в современном мире , 2-е изд., Academic Press, Нью-Йорк.
Google Scholar
Маркит, Э. (1978). Философия физики в курсах общей физики. Американский журнал физики 46: 784-789.
Google Scholar
МакКомас, В., Almazroa, H., and Clough, M.P. (1998). Природа науки в естественнонаучном образовании: введение. Наука и образование 7: 511-532.
Google Scholar
МакГерви, Дж. Д. (1975). Введение в современную физику , 2-е изд. на испанском языке, Academic Press, Нью-Йорк.
Google Scholar
Милликен, Р. А. (1947). Электроны (+ и -), протоны, фотоны, нейтроны, мезотроны и космические лучи , 2-е изд., Чикагский университет Press, Чикаго.
Google Scholar
Ниаз, М. (1994). Улучшение мыслительных навыков: специфические для предметной области/общие стратегии предметной области – дилемма научного образования. Педагогическая наука 22: 413-422.
Google Scholar
Ниаз, М. (1998). От катодных лучей до альфа-частиц и кванта действия: рациональная реконструкция структуры атома и ее значение для учебников по химии. Научное образование 82: 527-552.
Google Scholar
Ниаз М. (2000a). Эксперимент с каплей масла: рациональная реконструкция противоречия Милликена-Эренхафта и его значение для учебников по химии. Журнал исследований в области преподавания естественных наук 37: 480-508.
Google Scholar
Ниаз М. (2000b). Рациональная реконструкция кинетической молекулярной теории газов, основанная на истории и философии науки, и ее значение для учебников по химии. Педагогическая наука 28: 23-50.
Google Scholar
Ниаз М. (2001a). Рациональная реконструкция происхождения ковалентной связи и ее значение для учебников по общей химии. Международный журнал научного образования 23: 623-641.
Google Scholar
Ниаз М. (2001b). Насколько важны законы определенных и кратных пропорций в химии и преподавании химии? – История и философия науки. Наука и образование 10: 243-266.
Google Scholar
Ниаз М. (2001c). Понимание природы науки как прогрессивных переходов в эвристических принципах. Научное образование 85: 684-690.
Google Scholar
Ниаз М., Агилера Д., Маза А. и Лиендо Г. (2002). Аргументы, противоречия, сопротивления и концептуальные изменения в понимании учащимися структуры атома. Научное образование 86: 505-525.
Google Scholar
Оганян, ХК (1987). Современная физика , Прентис-Холл, Энглвуд Клиффс, Нью-Джерси.
Google Scholar
Оленик Р.П., Апостол Т.М. и Гудштейн Д.Л. (1986). За пределами механической Вселенной. От электричества к современной физике , издательство Кембриджского университета, Кембридж, Великобритания.
Google Scholar
Поланьи, М. (1964). Личные знания , University of Chicago Press, Чикаго.
Google Scholar
Поппер, К. Р. (1959). Логика научных открытий , Бейсик Букс, Нью-Йорк.
Google Scholar
Редиш, Э. Ф., Сол, Дж. М., и Стейнберг, Р.Н. (1998). Ожидания учащихся по вводной физике. Американский журнал физики 66: 212-224.
Google Scholar
Родригес М.А. и Ниаз М. (1999). Conceptualizaci ´ on de la estructura at omica en estudiantes de cursos b´ asicos y de la licenciatura en química. Парадигма 20: 133-144.
Google Scholar
Родригес, М.А. и Ниаз М. (2002). Как, несмотря на риторику, история химии была проигнорирована при представлении строения атома в учебниках. Наука и образование 11: 423-441.
Google Scholar
Рольф, Дж. В. (1994). Современная физика от альфы до Z 0, Уайли, Нью-Йорк.
Google Scholar
Розенфельд, Л. (1963). Введение в книгу Бора: О строении атомов и молекул , Копенгаген, Дания.
Резерфорд, Э. (1911). Рассеяние альфа- и бета-частиц веществом и строением атома. Философский журнал 21: 669-688.
Google Scholar
Сандин, Т. Р. (1989). Современная физика , Аддисон-Уэсли, Рединг, Массачусетс.
Google Scholar
Шваб, Дж. Дж. (1962). Преподавание естественных наук как исследование , издательство Гарвардского университета, Кембридж, Массачусетс.
Google Scholar
Sears, F.W., and Zemansky, M.W. (1977). Университетская физика , 2-е испанское изд., Аддисон-Уэсли, Рединг, Массачусетс.
Google Scholar
Sears, F.W., Zemansky, M.W., и Young, H.D. (1988). Университетская физика , 6-е испанское изд., Аддисон-Уэсли, Рединг, Массачусетс.
Google Scholar
Сирс, Ф.В., Земанский М.В., Янг Х.Д. и Фридман Р.А. (1996). Университетская физика , 9-е испанское изд., Аддисон-Уэсли, Рединг, Массачусетс.
Google Scholar
Сероглу Ф. и Кумарас П. (2001). Вклад истории физики в физическое образование: обзор. Наука и образование 10: 153-172.
Google Scholar
Сервэй, Р.А. (1997). Физика для ученых и инженеров с современной физикой , 4-е испанское изд., McGraw-Hill, Нью-Йорк.
Google Scholar
Serway, R.A., and Faughn, J.S. (2001). College Physics , 5-е испанское издание, Prentice-Hall, Upper Saddle River, NJ.
Google Scholar
Сигель, Х. (1978). Кун и Шваб о научных текстах и целях естественнонаучного образования. Теория образования 28: 302-309.
Google Scholar
Солбес, Дж., и Трэвер, М. (2001). Resultados obtenidos introduciendo historia de la ciencia en las clases de física y química: Mejora de la imagen de la ciencia y desarrollo de actitudes positivas. Enseñanza de las Ciencias 19: 151-162.
Google Scholar
Стиннер, А. (1989).Преподавание физики и контексты исследования: от Аристотеля до Эйнштейна. Научное образование 73: 591-605.
Google Scholar
Томсон, Дж. Дж. (1897 г.). Катодные лучи. Философский журнал 44: 293-316.
Google Scholar
Томсон, Дж. Дж. (1907). Корпускулярная теория материи , Констебль, Лондон.
Тумм, В.и Тилли Д.Э. (1970). Физика: современный подход , издательство Каммингс, Менло-Парк, Калифорния.
Google Scholar
Тилли, Д. Э., и Тумм, В. (1976). Физика для студентов колледжей (испанское издание), Cummings Publishing, Menlo Park, CA.
Google Scholar
Типлер, Пенсильвания (1978). Physics (испанское издание), Worth Publishers, Нью-Йорк.
Google Scholar
Типлер, Пенсильвания (1999). Физика , Worth Publishers, Нью-Йорк.
Google Scholar
Тобиас, С. (2000). От инноваций к изменениям: разработка программы реформ физического образования в 21 веке. Американский журнал физики 68: 103-104.
Google Scholar
Уроне, П.П. (2001). College Physics , 2-е изд., Brooks/Cole, Pacific Grove, CA.
Google Scholar
Вихерт, Э. (1897 г.). Ergebniss einer messung der geschwindigkeit der kathodenstrahlen. Schriften der Physikalisch ¨ okonomisch Gesellschaft zu K¨ onigsberg 38: 3.
Google Scholar
Уильямс Д. и Спэнглер Дж. (1981). Физика для науки и техники , Ван Ностранд, Нью-Йорк.
Google Scholar
Уилсон, Д. (1983). Резерфорд: Simple Genius , MIT Press, Cambridge, MA
Google Scholar
Уилсон, Дж. Д. (1996). College Physics , 2-е испанское издание, Prentice-Hall, Englewood Cliffs, NJ.
Google Scholar
Зафиратос, К. (1976). Физика , Уайли, Нью-Йорк.
Google Scholar
%PDF-1.5 % 3252 0 объект > эндообъект внешняя ссылка 3252 3388 0000000016 00000 н 0000073972 00000 н 0000074109 00000 н 0000069430 00000 н 0000074382 00000 н 0000074514 00000 н 0000075778 00000 н 0000075869 00000 н 0000076113 00000 н 0000076771 00000 н 0000076898 00000 н 0000077122 00000 н 0000077388 00000 н 0000077650 00000 н 0000088433 00000 н 0000089250 00000 н 0000089486 00000 н 0000089757 00000 н 00000
00000 н 0000116824 00000 н 0000117641 00000 н 0000117792 00000 н 0000117942 00000 н 0000118092 00000 н 0000118242 00000 н 0000118445 00000 н 0000118654 00000 н 0000118857 00000 н 0000125887 00000 н 0000126074 00000 н 0000126292 00000 н 0000127479 00000 н 0000128661 00000 н 0000129848 00000 н 0000131034 00000 н 0000146591 00000 н 0000146636 00000 н 0000146852 00000 н 0000148037 00000 н 0000162090 00000 н 0000162144 00000 н 0000179033 00000 н 0000195030 00000 н 0000195078 00000 н 0000209326 00000 н 0000223673 00000 н 0000223734 00000 н 0000223777 00000 н 0000223835 00000 н 0000223884 00000 н 0000224070 00000 н 0000224163 00000 н 0000224256 00000 н 0000224349 00000 н 0000224443 00000 н 0000224489 00000 н 0000224685 00000 н 0000224837 00000 н 0000225039 00000 н 0000225149 00000 н 0000225362 00000 н 0000225528 00000 н 0000226710 00000 н 0000227888 00000 н 0000229065 00000 н 0000230234 00000 н 0000230289 00000 н 0000230494 00000 н 0000230556 00000 н 0000244668 00000 н 0000245538 00000 н 0000245838 00000 н 0000258351 00000 н 0000258430 00000 н 0000258505 00000 н 0000258657 00000 н 0000258728 00000 н 0000258805 00000 н 0000258910 00000 н 0000259007 00000 н 0000259092 00000 н 0000259173 00000 н 0000259236 00000 н 0000259301 00000 н 0000259453 00000 н 0000259658 00000 н 0000270044 00000 н 0000270109 00000 н 0000270209 00000 н 0000270790 00000 н 0000270930 00000 н 0000281151 00000 н 0000293763 00000 н 0000304533 00000 н 0000316868 00000 н 0000326950 00000 н 0000340425 00000 н 0000394065 00000 н 0000394165 00000 н 0000394741 00000 н 0000394837 00000 н 0000395216 00000 н 0000395280 00000 н 0000395576 00000 н 0000419897 00000 н 0000420067 00000 н 0000530794 00000 н 0001302368 00000 н 0001307701 00000 н 0001318102 00000 н 0001319077 00000 н 0001320245 00000 н 0001321784 00000 н 0001324188 00000 н 0001324965 00000 н 0001325786 00000 н 0001331454 00000 н 0001338973 00000 н 0001339920 00000 н 0001341109 00000 н 0001342272 00000 н 0001344126 00000 н 0001344985 00000 н 0001345751 00000 н 0001345957 00000 н 0001346840 00000 н 0001347736 00000 н 0001347942 00000 н 0001348590 00000 н 0001348929 00000 н 0001348986 00000 н 0001349046 00000 н 0001349521 00000 н 0001349631 00000 н 0001350121 00000 н 0001350244 00000 н 0001366040 00000 н 0001366080 00000 н 0001366142 00000 н 0001366292 00000 н 0001366405 00000 н 0001366479 00000 н 0001366541 00000 н 0001366696 00000 н 0001366810 00000 н 0001366887 00000 н 0001366943 00000 н 0001366993 00000 н 0001367046 00000 н 0001367097 00000 н 0001367147 00000 н 0001367188 00000 н 0001367254 00000 н 0001367348 00000 н 0001367452 00000 н 0001367479 00000 н 0001367507 00000 н 0001367593 00000 н 0001367655 00000 н 0001367687 00000 н 0001367714 00000 н 0001367747 00000 н 0001368351 00000 н 0001368427 00000 н 0001368878 00000 н 0001368982 00000 н 0001369039 00000 н 0001369802 00000 н 0001369826 00000 н 0001369846 00000 н 0001369870 00000 н 0001369909 00000 н 0001369933 00000 н 0001369957 00000 н 0001369980 00000 н 0001370004 00000 н 0001370083 00000 н 0001370162 00000 н 0001370241 00000 н 0001370320 00000 н 0001370401 00000 н 0001370428 00000 н 0001370455 00000 н 0001370479 00000 н 0001370506 00000 н 0001370530 00000 н 0001370557 00000 н 0001370581 00000 н 0001370608 00000 н 0001370632 00000 н 0001370707 00000 н 0001370866 00000 н 0001370941 00000 н 0001371040 00000 н 0001371077 00000 н 0001371168 00000 н 0001371218 00000 н 0001371270 00000 н 0001371372 00000 н 0001371419 00000 н 0001371517 00000 н 0001371559 00000 н 0001371648 00000 н 0001371704 00000 н 0001371835 00000 н 0001371885 00000 н 0001371934 00000 н 0001372071 00000 н 0001372202 00000 н 0001372297 00000 н 0001372397 00000 н 0001372552 00000 н 0001372602 00000 н 0001372656 00000 н 0001372741 00000 н 0001372852 00000 н 0001373015 00000 н 0001373065 00000 н 0001373122 00000 н 0001373267 00000 н 0001373416 00000 н 0001373558 00000 н 0001373608 00000 н 0001373664 00000 н 0001373755 00000 н 0001373890 00000 н 0001374030 00000 н 0001374080 00000 н 0001374135 00000 н 0001374242 00000 н 0001374373 00000 н 0001374527 00000 н 0001374577 00000 н 0001374631 00000 н 0001374712 00000 н 0001374793 00000 н 0001374940 00000 н 0001374990 00000 н 0001375046 00000 н 0001375131 00000 н 0001375262 00000 н 0001375417 00000 н 0001375467 00000 н 0001375524 00000 н 0001375609 00000 н 0001375741 00000 н 0001375897 00000 н 0001375947 00000 н 0001376003 00000 н 0001376124 00000 н 0001376272 00000 н 0001376415 00000 н 0001376465 00000 н 0001376520 00000 н 0001376648 00000 н 0001376751 00000 н 0001376903 00000 н 0001376953 00000 н 0001377007 00000 н 0001377092 00000 н 0001377203 00000 н 0001377253 00000 н 0001377315 00000 н 0001377411 00000 н 0001377462 00000 н 0001377523 00000 н 0001377679 00000 н 0001377730 00000 н 0001377791 00000 н 0001377892 00000 н 0001377980 00000 н 0001378080 00000 н 0001378131 00000 н 0001378194 00000 н 0001378302 00000 н 0001378353 00000 н 0001378415 00000 н 0001378535 00000 н 0001378586 00000 н 0001378648 00000 н 0001378758 00000 н 0001378808 00000 н 0001378869 00000 н 0001378919 00000 н 0001378980 00000 н 0001379099 00000 н 0001379150 00000 н 0001379213 00000 н 0001379318 00000 н 0001379369 00000 н 0001379431 00000 н 0001379530 00000 н 0001379581 00000 н 0001379643 00000 н 0001379751 00000 н 0001379802 00000 н 0001379865 00000 н 0001379959 00000 н 0001380010 00000 н 0001380071 00000 н 0001380171 00000 н 0001380222 00000 н 0001380285 00000 н 0001380398 00000 н 0001380449 00000 н 0001380510 00000 н 0001380636 00000 н 0001380687 00000 н 0001380749 00000 н 0001380848 00000 н 0001380899 00000 н 0001380960 00000 н 0001381011 00000 н 0001381072 00000 н 0001381123 00000 н 0001381184 00000 н 0001381234 00000 н 0001381295 00000 н 0001381426 00000 н 0001381477 00000 н 0001381531 00000 н 0001381650 00000 н 0001381701 00000 н 0001381756 00000 н 0001381889 00000 н 0001381940 00000 н 0001381995 00000 н 0001382120 00000 н 0001382171 00000 н 0001382225 00000 н 0001382365 00000 н 0001382416 00000 н 0001382471 00000 н 0001382609 00000 н 0001382660 00000 н 0001382714 00000 н 0001382835 00000 н 0001382886 00000 н 0001382940 00000 н 0001383087 00000 н 0001383138 00000 н 0001383193 00000 н 0001383317 00000 н 0001383368 00000 н 0001383422 00000 н 0001383548 00000 н 0001383599 00000 н 0001383653 00000 н 0001383774 00000 н 0001383825 00000 н 0001383880 00000 н 0001384004 00000 н 0001384055 00000 н 0001384110 00000 н 0001384249 00000 н 0001384300 00000 н 0001384354 00000 н 0001384491 00000 н 0001384542 00000 н 0001384596 00000 н 0001384723 00000 н 0001384774 00000 н 0001384829 00000 н 0001384955 00000 н 0001385006 00000 н 0001385062 00000 н 0001385186 00000 н 0001385237 00000 н 0001385291 00000 н 0001385429 00000 н 0001385480 00000 н 0001385534 00000 н 0001385655 00000 н 0001385706 00000 н 0001385760 00000 н 0001385875 00000 н 0001385925 00000 н 0001385979 00000 н 0001386090 00000 н 0001386140 00000 н 0001386194 00000 н 0001386314 00000 н 0001386364 00000 н 0001386418 00000 н 0001386547 00000 н 0001386597 00000 н 0001386651 00000 н 0001386788 00000 н 0001386838 00000 н 0001386892 00000 н 0001386942 00000 н 0001386996 00000 н 0001387046 00000 н 0001387103 00000 н 0001387206 00000 н 0001387315 00000 н 0001387477 00000 н 0001387528 00000 н 0001387583 00000 н 0001387711 00000 н 0001387839 00000 н 0001387999 00000 н 0001388050 00000 н 0001388105 00000 н 0001388206 00000 н 0001388324 00000 н 0001388424 00000 н 0001388475 00000 н 0001388530 00000 н 0001388639 00000 н 0001388690 00000 н 0001388745 00000 н 0001388845 00000 н 0001388896 00000 н 0001388952 00000 н 0001389074 00000 н 0001389125 00000 н 0001389181 00000 н 0001389295 00000 н 0001389346 00000 н 0001389401 00000 н 0001389543 00000 н 0001389593 00000 н 0001389649 00000 н 0001389699 00000 н 0001389754 00000 н 0001389870 00000 н 0001389921 00000 н 0001389976 00000 н 00013 00000 н 0001300000 н 00013
00000 н 0001300000 н 00013
00000 н 0001300000 н 00013
00000 н 0001300000 н 00013
00000 н 00013
00000 н 00013
00000 н 00013
00000 н 0001300000 н 00013
00000 н 00013
00000 н 0001391574 00000 н 0001391675 00000 н 0001391725 00000 н 0001391782 00000 н 0001391891 00000 н 0001391941 00000 н 0001391999 00000 н 0001392117 00000 н 0001392167 00000 н 0001392224 00000 н 0001392274 00000 н 0001392330 00000 н 0001392447 00000 н 0001392498 00000 н 0001392555 00000 н 0001392678 00000 н 0001392729 00000 н 0001392785 00000 н 0001392910 00000 н 0001392961 00000 н 0001393017 00000 н 0001393141 00000 н 0001393192 00000 н 0001393248 00000 н 0001393363 00000 н 0001393414 00000 н 0001393471 00000 н 0001393591 00000 н 0001393642 00000 н 0001393698 00000 н 0001393841 00000 н 0001393892 00000 н 0001393949 00000 н 0001394066 00000 н 0001394117 00000 н 0001394173 00000 н 0001394301 00000 н 0001394352 00000 н 0001394408 00000 н 0001394539 00000 н 0001394590 00000 н 0001394646 00000 н 0001394761 00000 н 0001394812 00000 н 0001394868 00000 н 0001394991 00000 н 0001395042 00000 н 0001395099 00000 н 0001395217 00000 н 0001395268 00000 н 0001395324 00000 н 0001395441 00000 н 0001395492 00000 н 0001395549 00000 н 0001395674 00000 н 0001395725 00000 н 0001395781 00000 н 0001395915 00000 н 0001395966 00000 н 0001396022 00000 н 0001396137 00000 н 0001396188 00000 н 0001396244 00000 н 0001396369 00000 н 0001396420 00000 н 0001396476 00000 н 0001396527 00000 н 0001396583 00000 н 0001396633 00000 н 0001396689 00000 н 0001396739 00000 н 0001396795 00000 н 0001396915 00000 н 0001397024 00000 н 0001397123 00000 н 0001397173 00000 н 0001397229 00000 н 0001397338 00000 н 0001397388 00000 н 0001397444 00000 н 0001397542 00000 н 0001397592 00000 н 0001397648 00000 н 0001397769 00000 н 0001397819 00000 н 0001397875 00000 н 0001397987 00000 н 0001398037 00000 н 0001398093 00000 н 0001398143 00000 н 0001398200 00000 н 0001398336 00000 н 0001398387 00000 н 0001398443 00000 н 0001398545 00000 н 0001398596 00000 н 0001398652 00000 н 0001398755 00000 н 0001398806 00000 н 0001398862 00000 н 0001399010 00000 н 0001399061 00000 н 0001399118 00000 н 0001399226 00000 н 0001399277 00000 н 0001399334 00000 н 0001399437 00000 н 0001399488 00000 н 0001399544 00000 н 0001399663 00000 н 0001399714 00000 н 0001399771 00000 н 0001399875 00000 н 0001399926 00000 н 0001399982 00000 н 0001400033 00000 н 0001400089 00000 н 0001400139 00000 н 0001400195 00000 н 0001400245 00000 н 0001400301 00000 н 0001400396 00000 н 0001400448 00000 н 0001400504 00000 н 0001400599 00000 н 0001400651 00000 н 0001400708 00000 н 0001400803 00000 н 0001400855 00000 н 0001400912 00000 н 0001401007 00000 н 0001401058 00000 н 0001401115 00000 н 0001401210 00000 н 0001401261 00000 н 0001401317 00000 н 0001401412 00000 н 0001401463 00000 н 0001401519 00000 н 0001401614 00000 н 0001401665 00000 н 0001401722 00000 н 0001401817 00000 н 0001401868 00000 н 0001401924 00000 н 0001402019 00000 н 0001402070 00000 н 0001402127 00000 н 0001402222 00000 н 0001402273 00000 н 0001402329 00000 н 0001402424 00000 н 0001402475 00000 н 0001402531 00000 н 0001402626 00000 н 0001402677 00000 н 0001402733 00000 н 0001402828 00000 н 0001402879 00000 н 0001402936 00000 н 0001403031 00000 н 0001403082 00000 н 0001403139 00000 н 0001403234 00000 н 0001403285 00000 н 0001403341 00000 н 0001403436 00000 н 0001403487 00000 н 0001403543 00000 н 0001403637 00000 н 0001403688 00000 н 0001403744 00000 н 0001403838 00000 н 0001403889 00000 н 0001403946 00000 н 0001404040 00000 н 0001404091 00000 н 0001404147 00000 н 0001404241 00000 н 0001404292 00000 н 0001404348 00000 н 0001404442 00000 н 0001404493 00000 н 0001404549 00000 н 0001404643 00000 н 0001404694 00000 н 0001404752 00000 н 0001404846 00000 н 0001404897 00000 н 0001404953 00000 н 0001405047 00000 н 0001405098 00000 н 0001405154 00000 н 0001405205 00000 н 0001405261 00000 н 0001405312 00000 н 0001405368 00000 н 0001405514 00000 н 0001405664 00000 н 0001405763 00000 н 0001405814 00000 н 0001405868 00000 н 0001405978 00000 н 0001406029 00000 н 0001406084 00000 н 0001406189 00000 н 0001406240 00000 н 0001406294 00000 н 0001406406 00000 н 0001406456 00000 н 0001406510 00000 н 0001406560 00000 н 0001406614 00000 н 0001406720 00000 н 0001406854 00000 н 0001407007 00000 н 0001407059 00000 н 0001407114 00000 н 0001407210 00000 н 0001407304 00000 н 0001407461 00000 н 0001407513 00000 н 0001407567 00000 н 0001407656 00000 н 0001407763 00000 н 0001407942 00000 н 0001407994 00000 н 0001408048 00000 н 0001408163 00000 н 0001408265 00000 н 0001408413 00000 н 0001408465 00000 н 0001408519 00000 н 0001408605 00000 н 0001408716 00000 н 0001408869 00000 н 0001408921 00000 н 0001408976 00000 н 0001409074 00000 н 0001409166 00000 н 0001409316 00000 н 0001409368 00000 н 0001409423 00000 н 0001409536 00000 н 0001409642 00000 н 0001409792 00000 н 0001409844 00000 н 0001409899 00000 н 0001410010 00000 н 0001410138 00000 н 0001410293 00000 н 0001410345 00000 н 0001410400 00000 н 0001410497 00000 н 0001410585 00000 н 0001410734 00000 н 0001410786 00000 н 0001410842 00000 н 0001410941 00000 н 0001411049 00000 н 0001411210 00000 н 0001411262 00000 н 0001411316 00000 н 0001411424 00000 н 0001411535 00000 н 0001411680 00000 н 0001411732 00000 н 0001411787 00000 н 0001411889 00000 н 0001411991 00000 н 0001412131 00000 н 0001412183 00000 н 0001412237 00000 н 0001412327 00000 н 0001412415 00000 н 0001412566 00000 н 0001412618 00000 н 0001412674 00000 н 0001412769 00000 н 0001412861 00000 н 0001413009 00000 н 0001413061 00000 н 0001413116 00000 н 0001413224 00000 н 0001413328 00000 н 0001413471 00000 н 0001413523 00000 н 0001413577 00000 н 0001413683 00000 н 0001413772 00000 н 0001413925 00000 н 0001413976 00000 н 0001414030 00000 н 0001414138 00000 н 0001414244 00000 н 0001414394 00000 н 0001414445 00000 н 0001414499 00000 н 0001414604 00000 н 0001414700 00000 н 0001414850 00000 н 0001414901 00000 н 0001414955 00000 н 0001415060 00000 н 0001415155 00000 н 0001415301 00000 н 0001415352 00000 н 0001415406 00000 н 0001415512 00000 н 0001415607 00000 н 0001415776 00000 н 0001415827 00000 н 0001415881 00000 н 0001415989 00000 н 0001416103 00000 н 0001416256 00000 н 0001416307 00000 н 0001416361 00000 н 0001416462 00000 н 0001416567 00000 н 0001416726 00000 н 0001416777 00000 н 0001416831 00000 н 0001416955 00000 н 0001417055 00000 н 0001417218 00000 н 0001417269 00000 н 0001417324 00000 н 0001417420 00000 н 0001417516 00000 н 0001417666 00000 н 0001417717 00000 н 0001417771 00000 н 0001417854 00000 н 0001417945 00000 н 0001417996 00000 н 0001418050 00000 н 0001418101 00000 н 0001418155 00000 н 0001418206 00000 н 0001418260 00000 н 0001418311 00000 н 0001418365 00000 н 0001418416 00000 н 0001418470 00000 н 0001418521 00000 н 0001418575 00000 н 0001418626 00000 н 0001418681 00000 н 0001418732 00000 н 0001418786 00000 н 0001418837 00000 н 0001418891 00000 н 0001418942 00000 н 0001418997 00000 н 0001419048 00000 н 0001419102 00000 н 0001419153 00000 н 0001419207 00000 н 0001419258 00000 н 0001419312 00000 н 0001419363 00000 н 0001419417 00000 н 0001419468 00000 н 0001419522 00000 н 0001419573 00000 н 0001419627 00000 н 0001419678 00000 н 0001419732 00000 н 0001419783 00000 н 0001419837 00000 н 0001419888 00000 н 0001419942 00000 н 0001419993 00000 н 0001420048 00000 н 0001420099 00000 н 0001420153 00000 н 0001420205 00000 н 0001420259 00000 н 0001420311 00000 н 0001420365 00000 н 0001420417 00000 н 0001420472 00000 н 0001420524 00000 н 0001420578 00000 н 0001420630 00000 н 0001420684 00000 н 0001420736 00000 н 0001420790 00000 н 0001420842 00000 н 0001420897 00000 н 0001420949 00000 н 0001421003 00000 н 0001421055 00000 н 0001421109 00000 н 0001421161 00000 н 0001421215 00000 н 0001421267 00000 н 0001421322 00000 н 0001421374 00000 н 0001421428 00000 н 0001421480 00000 н 0001421536 00000 н 0001421588 00000 н 0001421642 00000 н 0001421694 00000 н 0001421748 00000 н 0001421800 00000 н 0001421856 00000 н 0001421908 00000 н 0001421962 00000 н 0001422014 00000 н 0001422068 00000 н 0001422120 00000 н 0001422174 00000 н 0001422226 00000 н 0001422280 00000 н 0001422332 00000 н 0001422386 00000 н 0001422438 00000 н 0001422492 00000 н 0001422544 00000 н 0001422598 00000 н 0001422650 00000 н 0001422704 00000 н 0001422756 00000 н 0001422811 00000 н 0001422863 00000 н 0001422917 00000 н 0001422969 00000 н 0001423023 00000 н 0001423075 00000 н 0001423129 00000 н 0001423181 00000 н 0001423236 00000 н 0001423288 00000 н 0001423342 00000 н 0001423455 00000 н 0001423564 00000 н 0001423615 00000 н 0001423670 00000 н 0001423721 00000 н 0001423776 00000 н 0001423827 00000 н 0001423881 00000 н 0001423931 00000 н 0001423985 00000 н 0001424093 00000 н 0001424204 00000 н 0001424254 00000 н 0001424309 00000 н 0001424423 00000 н 0001424474 00000 н 0001424528 00000 н 0001424646 00000 н 0001424697 00000 н 0001424753 00000 н 0001424896 00000 н 0001424947 00000 н 0001425001 00000 н 0001425110 00000 н 0001425161 00000 н 0001425217 00000 н 0001425330 00000 н 0001425381 00000 н 0001425437 00000 н 0001425550 00000 н 0001425601 00000 н 0001425656 00000 н 0001425768 00000 н 0001425819 00000 н 0001425874 00000 н 0001425992 00000 н 0001426043 00000 н 0001426097 00000 н 0001426210 00000 н 0001426261 00000 н 0001426315 00000 н 0001426438 00000 н 0001426489 00000 н 0001426543 00000 н 0001426650 00000 н 0001426701 00000 н 0001426755 00000 н 0001426857 00000 н 0001426908 00000 н 0001426963 00000 н 0001427076 00000 н 0001427127 00000 н 0001427181 00000 н 0001427292 00000 н 0001427343 00000 н 0001427397 00000 н 0001427502 00000 н 0001427553 00000 н 0001427607 00000 н 0001427722 00000 н 0001427773 00000 н 0001427827 00000 н 0001427939 00000 н 0001427990 00000 н 0001428044 00000 н 0001428155 00000 н 0001428206 00000 н 0001428260 00000 н 0001428369 00000 н 0001428420 00000 н 0001428475 00000 н 0001428607 00000 н 0001428658 00000 н 0001428712 00000 н 0001428826 00000 н 0001428877 00000 н 0001428931 00000 н 0001429054 00000 н 0001429105 00000 н 0001429160 00000 н 0001429285 00000 н 0001429336 00000 н 0001429391 00000 н 0001429500 00000 н 0001429550 00000 н 0001429604 00000 н 0001429654 00000 н 0001429708 00000 н 0001429758 00000 н 0001429812 00000 н 0001429862 00000 н 0001429916 00000 н 0001430013 00000 н 0001430115 00000 н 0001430267 00000 н 0001430319 00000 н 0001430375 00000 н 0001430470 00000 н 0001430593 00000 н 0001430751 00000 н 0001430803 00000 н 0001430860 00000 н 0001430945 00000 н 0001431033 00000 н 0001431214 00000 н 0001431266 00000 н 0001431322 00000 н 0001431417 00000 н 0001431502 00000 н 0001431649 00000 н 0001431701 00000 н 0001431757 00000 н 0001431841 00000 н 0001431953 00000 н 0001432104 00000 н 0001432156 00000 н 0001432212 00000 н 0001432302 00000 н 0001432392 00000 н 0001432543 00000 н 0001432595 00000 н 0001432651 00000 н 0001432751 00000 н 0001432842 00000 н 0001432993 00000 н 0001433045 00000 н 0001433101 00000 н 0001433210 00000 н 0001433301 00000 н 0001433457 00000 н 0001433509 00000 н 0001433565 00000 н 0001433682 00000 н 0001433786 00000 н 0001433935 00000 н 0001433987 00000 н 0001434043 00000 н 0001434146 00000 н 0001434276 00000 н 0001434437 00000 н 0001434489 00000 н 0001434546 00000 н 0001434629 00000 н 0001434727 00000 н 0001434871 00000 н 0001434923 00000 н 0001434980 00000 н 0001435077 00000 н 0001435176 00000 н 0001435316 00000 н 0001435368 00000 н 0001435424 00000 н 0001435513 00000 н 0001435608 00000 н 0001435760 00000 н 0001435812 00000 н 0001435868 00000 н 0001435950 00000 н 0001436040 00000 н 0001436188 00000 н 0001436240 00000 н 0001436296 00000 н 0001436395 00000 н 0001436485 00000 н 0001436629 00000 н 0001436681 00000 н 0001436737 00000 н 0001436830 00000 н 0001436932 00000 н 0001437085 00000 н 0001437137 00000 н 0001437193 00000 н 0001437293 00000 н 0001437401 00000 н 0001437552 00000 н 0001437603 00000 н 0001437660 00000 н 0001437754 00000 н 0001437860 00000 н 0001438009 00000 н 0001438060 00000 н 0001438117 00000 н 0001438216 00000 н 0001438331 00000 н 0001438478 00000 н 0001438529 00000 н 0001438585 00000 н 0001438694 00000 н 0001438813 00000 н 0001438983 00000 н 0001439034 00000 н 0001439090 00000 н 0001439207 00000 н 0001439298 00000 н 0001439451 00000 н 0001439502 00000 н 0001439559 00000 н 0001439661 00000 н 0001439761 00000 н 0001439920 00000 н 0001439971 00000 н 0001440028 00000 н 0001440128 00000 н 0001440241 00000 н 0001440405 00000 н 0001440456 00000 н 0001440512 00000 н 0001440610 00000 н 0001440708 00000 н 0001440856 00000 н 0001440907 00000 н 0001440964 00000 н 0001441060 00000 н 0001441153 00000 н 0001441204 00000 н 0001441261 00000 н 0001441381 00000 н 0001441432 00000 н 0001441488 00000 н 0001441622 00000 н 0001441673 00000 н 0001441729 00000 н 0001441780 00000 н 0001441836 00000 н 0001441887 00000 н 0001441943 00000 н 0001442051 00000 н 0001442102 00000 н 0001442158 00000 н 0001442265 00000 н 0001442316 00000 н 0001442372 00000 н 0001442423 00000 н 0001442479 00000 н 0001442530 00000 н 0001442586 00000 н 0001442692 00000 н 0001442743 00000 н 0001442801 00000 н 0001442931 00000 н 0001442982 00000 н 0001443038 00000 н 0001443089 00000 н 0001443145 00000 н 0001443196 00000 н 0001443253 00000 н 0001443371 00000 н 0001443422 00000 н 0001443478 00000 н 0001443529 00000 н 0001443586 00000 н 0001443637 00000 н 0001443693 00000 н 0001443813 00000 н 0001443864 00000 н 0001443920 00000 н 0001443971 00000 н 0001444027 00000 н 0001444078 00000 н 0001444134 00000 н 0001444255 00000 н 0001444306 00000 н 0001444362 00000 н 0001444413 00000 н 0001444470 00000 н 0001444521 00000 н 0001444577 00000 н 0001444708 00000 н 0001444759 00000 н 0001444815 00000 н 0001444946 00000 н 0001444997 00000 н 0001445053 00000 н 0001445104 00000 н 0001445160 00000 н 0001445211 00000 н 0001445267 00000 н 0001445372 00000 н 0001445423 00000 н 0001445479 00000 н 0001445589 00000 н 0001445640 00000 н 0001445696 00000 н 0001445802 00000 н 0001445853 00000 н 0001445909 00000 н 0001445960 00000 н 0001446016 00000 н 0001446067 00000 н 0001446123 00000 н 0001446245 00000 н 0001446297 00000 н 0001446354 00000 н 0001446405 00000 н 0001446461 00000 н 0001446512 00000 н 0001446570 00000 н 0001446695 00000 н 0001446747 00000 н 0001446804 00000 н 0001446913 00000 н 0001446965 00000 н 0001447021 00000 н 0001447129 00000 н 0001447181 00000 н 0001447237 00000 н 0001447289 00000 н 0001447345 00000 н 0001447397 00000 н 0001447453 00000 н 0001447562 00000 н 0001447614 00000 н 0001447670 00000 н 0001447788 00000 н 0001447840 00000 н 0001447896 00000 н 0001447948 00000 н 0001448004 00000 н 0001448056 00000 н 0001448113 00000 н 0001448222 00000 н 0001448274 00000 н 0001448330 00000 н 0001448441 00000 н 0001448493 00000 н 0001448550 00000 н 0001448602 00000 н 0001448658 00000 н 0001448710 00000 н 0001448767 00000 н 0001448875 00000 н 0001448927 00000 н 0001448983 00000 н 0001449119 00000 н 0001449171 00000 н 0001449227 00000 н 0001449279 00000 н 0001449335 00000 н 0001449387 00000 н 0001449443 00000 н 0001449570 00000 н 0001449622 00000 н 0001449678 00000 н 0001449792 00000 н 0001449844 00000 н 0001449900 00000 н 0001449952 00000 н 0001450008 00000 н 0001450060 00000 н 0001450116 00000 н 0001450234 00000 н 0001450286 00000 н 0001450343 00000 н 0001450459 00000 н 0001450511 00000 н 0001450567 00000 н 0001450698 00000 н 0001450750 00000 н 0001450807 00000 н 0001450859 00000 н 0001450915 00000 н 0001450967 00000 н 0001451023 00000 н 0001451132 00000 н 0001451184 00000 н 0001451241 00000 н 0001451364 00000 н 0001451416 00000 н 0001451472 00000 н 0001451524 00000 н 0001451580 00000 н 0001451632 00000 н 0001451688 00000 н 0001451819 00000 н 0001451871 00000 н 0001451927 00000 н 0001451979 00000 н 0001452036 00000 н 0001452088 00000 н 0001452145 00000 н 0001452247 00000 н 0001452299 00000 н 0001452355 00000 н 0001452474 00000 н 0001452526 00000 н 0001452582 00000 н 0001452634 00000 н 0001452690 00000 н 0001452742 00000 н 0001452798 00000 н 0001452914 00000 н 0001452966 00000 н 0001453023 00000 н 0001453075 00000 н 0001453131 00000 н 0001453183 00000 н 0001453240 00000 н 0001453349 00000 н 0001453401 00000 н 0001453457 00000 н 0001453509 00000 н 0001453565 00000 н 0001453617 00000 н 0001453674 00000 н 0001453773 00000 н 0001453825 00000 н 0001453882 00000 н 0001453992 00000 н 0001454044 00000 н 0001454100 00000 н 0001454228 00000 н 0001454280 00000 н 0001454338 00000 н 0001454390 00000 н 0001454447 00000 н 0001454499 00000 н 0001454555 00000 н 0001454683 00000 н 0001454735 00000 н 0001454791 00000 н 0001454900 00000 н 0001454952 00000 н 0001455009 00000 н 0001455130 00000 н 0001455182 00000 н 0001455238 00000 н 0001455290 00000 н 0001455347 00000 н 0001455399 00000 н 0001455455 00000 н 0001455559 00000 н 0001455611 00000 н 0001455669 00000 н 0001455766 00000 н 0001455818 00000 н 0001455874 00000 н 0001455978 00000 н 0001456030 00000 н 0001456087 00000 н 0001456139 00000 н 0001456196 00000 н 0001456248 00000 н 0001456305 00000 н 0001456434 00000 н 0001456486 00000 н 0001456543 00000 н 0001456648 00000 н 0001456700 00000 н 0001456756 00000 н 0001456866 00000 н 0001456918 00000 н 0001456976 00000 н 0001457028 00000 н 0001457085 00000 н 0001457137 00000 н 0001457193 00000 н 0001457298 00000 н 0001457350 00000 н 0001457406 00000 н 0001457510 00000 н 0001457562 00000 н 0001457618 00000 н 0001457670 00000 н 0001457726 00000 н 0001457778 00000 н 0001457834 00000 н 0001457938 00000 н 0001458034 00000 н 0001458084 00000 н 0001458140 00000 н 0001458248 00000 н 0001458299 00000 н 0001458355 00000 н 0001458468 00000 н 0001458518 00000 н 0001458574 00000 н 0001458624 00000 н 0001458681 00000 н 0001458731 00000 н 0001458787 00000 н 0001458901 00000 н 0001458953 00000 н 0001459010 00000 н 0001459128 00000 н 0001459180 00000 н 0001459237 00000 н 0001459378 00000 н 0001459430 00000 н 0001459486 00000 н 0001459595 00000 н 0001459647 00000 н 0001459703 00000 н 0001459816 00000 н 0001459868 00000 н 0001459924 00000 н 0001460036 00000 н 0001460088 00000 н 0001460144 00000 н 0001460257 00000 н 0001460309 00000 н 0001460365 00000 н 0001460482 00000 н 0001460534 00000 н 0001460590 00000 н 0001460705 00000 н 0001460757 00000 н 0001460813 00000 н 0001460937 00000 н 0001460989 00000 н 0001461045 00000 н 0001461151 00000 н 0001461203 00000 н 0001461259 00000 н 0001461362 00000 н 0001461413 00000 н 0001461470 00000 н 0001461583 00000 н 0001461634 00000 н 0001461690 00000 н 0001461800 00000 н 0001461851 00000 н 0001461907 00000 н 0001462012 00000 н 0001462063 00000 н 0001462119 00000 н 0001462236 00000 н 0001462287 00000 н 0001462343 00000 н 0001462456 00000 н 0001462507 00000 н 0001462564 00000 н 0001462675 00000 н 0001462726 00000 н 0001462783 00000 н 0001462892 00000 н 0001462943 00000 н 0001462999 00000 н 0001463130 00000 н 0001463181 00000 н 0001463237 00000 н 0001463351 00000 н 0001463402 00000 н 0001463459 00000 н 0001463581 00000 н 0001463632 00000 н 0001463689 00000 н 0001463814 00000 н 0001463865 00000 н 0001463922 00000 н 0001464032 00000 н 0001464083 00000 н 0001464140 00000 н 0001464262 00000 н 0001464313 00000 н 0001464369 00000 н 0001464466 00000 н 0001464517 00000 н 0001464573 00000 н 0001464623 00000 н 0001464680 00000 н 0001464730 00000 н 0001464786 00000 н 0001464905 00000 н 0001464956 00000 н 0001465010 00000 н 0001465119 00000 н 0001465170 00000 н 0001465224 00000 н 0001465337 00000 н 0001465388 00000 н 0001465442 00000 н 0001465557 00000 н 0001465608 00000 н 0001465662 00000 н 0001465774 00000 н 0001465825 00000 н 0001465879 00000 н 0001465996 00000 н 0001466047 00000 н 0001466102 00000 н 0001466214 00000 н 0001466265 00000 н 0001466319 00000 н 0001466442 00000 н 0001466493 00000 н 0001466547 00000 н 0001466653 00000 н 0001466704 00000 н 0001466758 00000 н 0001466860 00000 н 0001466911 00000 н 0001466967 00000 н 0001467080 00000 н 0001467131 00000 н 0001467185 00000 н 0001467296 00000 н 0001467347 00000 н 0001467401 00000 н 0001467506 00000 н 0001467557 00000 н 0001467611 00000 н 0001467726 00000 н 0001467777 00000 н 0001467831 00000 н 0001467962 00000 н 0001468013 00000 н 0001468067 00000 н 0001468182 00000 н 0001468233 00000 н 0001468288 00000 н 0001468409 00000 н 0001468460 00000 н 0001468514 00000 н 0001468640 00000 н 0001468690 00000 н 0001468745 00000 н 0001468795 00000 н 0001468849 00000 н 0001468899 00000 н 0001468953 00000 н 0001469051 00000 н 0001469200 00000 н 0001469250 00000 н 0001469309 00000 н 0001469395 00000 н 0001469473 00000 н 0001469626 00000 н 0001469678 00000 н 0001469737 00000 н 0001469823 00000 н 0001469902 00000 н 0001470059 00000 н 0001470111 00000 н 0001470170 00000 н 0001470256 00000 н 0001470334 00000 н 0001470514 00000 н 0001470566 00000 н 0001470625 00000 н 0001470711 00000 н 0001470789 00000 н 0001470936 00000 н 0001470988 00000 н 0001471047 00000 н 0001471134 00000 н 0001471212 00000 н 0001471363 00000 н 0001471415 00000 н 0001471474 00000 н 0001471560 00000 н 0001471638 00000 н 0001471789 00000 н 0001471841 00000 н 0001471901 00000 н 0001471987 00000 н 0001472065 00000 н 0001472215 00000 н 0001472267 00000 н 0001472326 00000 н 0001472412 00000 н 0001472490 00000 н 0001472646 00000 н 0001472698 00000 н 0001472757 00000 н 0001472843 00000 н 0001472921 00000 н 0001473071 00000 н 0001473123 00000 н 0001473182 00000 н 0001473268 00000 н 0001473346 00000 н 0001473508 00000 н 0001473560 00000 н 0001473621 00000 н 0001473708 00000 н 0001473786 00000 н 0001473930 00000 н 0001473982 00000 н 0001474042 00000 н 0001474129 00000 н 0001474207 00000 н 0001474348 00000 н 0001474400 00000 н 0001474459 00000 н 0001474545 00000 н 0001474623 00000 н 0001474774 00000 н 0001474826 00000 н 0001474887 00000 н 0001474973 00000 н 0001475051 00000 н 0001475199 00000 н 0001475251 00000 н 0001475312 00000 н 0001475398 00000 н 0001475477 00000 н 0001475620 00000 н 0001475672 00000 н 0001475732 00000 н 0001475818 00000 н 0001475896 00000 н 0001476049 00000 н 0001476101 00000 н 0001476161 00000 н 0001476247 00000 н 0001476325 00000 н 0001476476 00000 н 0001476528 00000 н 0001476587 00000 н 0001476673 00000 н 0001476752 00000 н 0001476901 00000 н 0001476953 00000 н 0001477012 00000 н 0001477098 00000 н 0001477176 00000 н 0001477322 00000 н 0001477374 00000 н 0001477433 00000 н 0001477520 00000 н 0001477598 00000 н 0001477767 00000 н 0001477818 00000 н 0001477878 00000 н 0001477964 00000 н 0001478042 00000 н 0001478194 00000 н 0001478245 00000 н 0001478305 00000 н 0001478391 00000 н 0001478469 00000 н 0001478628 00000 н 0001478679 00000 н 0001478738 00000 н 0001478824 00000 н 0001478902 00000 н 0001479067 00000 н 0001479118 00000 н 0001479177 00000 н 0001479263 00000 н 0001479341 00000 н 0001479488 00000 н 0001479539 00000 н 0001479599 00000 н 0001479685 00000 н 0001479763 00000 н 0001479923 00000 н 0001479974 00000 н 0001480034 00000 н 0001480120 00000 н 0001480198 00000 н 0001480300 00000 н 0001480350 00000 н 0001480409 00000 н 0001480459 00000 н 0001480518 00000 н 0001480635 00000 н 0001480686 00000 н 0001480745 00000 н 0001480861 00000 н 0001480912 00000 н 0001480971 00000 н 0001481089 00000 н 0001481140 00000 н 0001481199 00000 н 0001481328 00000 н 0001481379 00000 н 0001481439 00000 н 0001481489 00000 н 0001481548 00000 н 0001481598 00000 н 0001481657 00000 н 0001481772 00000 н 0001481823 00000 н 0001481887 00000 н 0001482015 00000 н 0001482066 00000 н 0001482125 00000 н 0001482267 00000 н 0001482318 00000 н 0001482377 00000 н 0001482495 00000 н 0001482546 00000 н 0001482605 00000 н 0001482656 00000 н 0001482715 00000 н 0001482766 00000 н 0001482826 00000 н 0001482947 00000 н 0001482998 00000 н 0001483057 00000 н 0001483173 00000 н 0001483224 00000 н 0001483283 00000 н 0001483398 00000 н 0001483449 00000 н 0001483508 00000 н 0001483626 00000 н 0001483677 00000 н 0001483736 00000 н 0001483787 00000 н 0001483847 00000 н 0001483898 00000 н 0001483957 00000 н 0001484093 00000 н 0001484144 00000 н 0001484204 00000 н 0001484319 00000 н 0001484370 00000 н 0001484429 00000 н 0001484568 00000 н 0001484619 00000 н 0001484678 00000 н 0001484801 00000 н 0001484852 00000 н 0001484912 00000 н 0001484963 00000 н 0001485022 00000 н 0001485073 00000 н 0001485133 00000 н 0001485254 00000 н 0001485305 00000 н 0001485364 00000 н 0001485490 00000 н 0001485541 00000 н 0001485600 00000 н 0001485725 00000 н 0001485776 00000 н 0001485835 00000 н 0001485886 00000 н 0001485946 00000 н 0001485997 00000 н 0001486056 00000 н 0001486169 00000 н 0001486220 00000 н 0001486279 00000 н 0001486408 00000 н 0001486459 00000 н 0001486518 00000 н 0001486657 00000 н 0001486708 00000 н 0001486767 00000 н 0001486818 00000 н 0001486877 00000 н 0001486928 00000 н 0001486987 00000 н 0001487128 00000 н 0001487179 00000 н 0001487239 00000 н 0001487371 00000 н 0001487422 00000 н 0001487481 00000 н 0001487610 00000 н 0001487661 00000 н 0001487723 00000 н 0001487774 00000 н 0001487833 00000 н 0001487884 00000 н 0001487944 00000 н 0001488082 00000 н 0001488134 00000 н 0001488193 00000 н 0001488332 00000 н 0001488384 00000 н 0001488443 00000 н 0001488581 00000 н 0001488633 00000 н 0001488692 00000 н 0001488812 00000 н 0001488864 00000 н 0001488924 00000 н 0001488976 00000 н 0001489036 00000 н 0001489088 00000 н 0001489147 00000 н 0001489275 00000 н 0001489327 00000 н 0001489387 00000 н 0001489501 00000 н 0001489553 00000 н 0001489612 00000 н 0001489730 00000 н 0001489782 00000 н 0001489841 00000 н 0001489956 00000 н 0001400000 н 00014
00000 н 00014
00000 н 00014
00000 н 00014
00000 н 00014 00000 н 0001400000 н 00014
00000 н 00014
00000 н 0001400000 н 00014
00000 н 0001400000 н 00015
00000 н 00015
00000 н 00015
00000 н 00015
00000 н 0001500000 н 00015
00000 н 00015
00000 н 0001500000 н 00015
00000 н 00015 00000 н 00015
00000 н 00015vf\?j*9)5љjaf4 bpz(duBr4A89J!AXy 9ѷE)Ѹ#׳*{+&BxX%VnA\r `B)p>R?ATa $ѝ*8{bqy3(.
Что такое ATOM — структура атома, модели атомов и приложения
Фундаментальная концепция атома и его структура помогают Органическая молекулярная структура. В этом посте будет подробно обсуждаться, что такое атом, структура атома (атомная структура), различные типы атомных моделей и их применение. единица любого вещества.Проще говоря, Атомы можно назвать Лего вселенной. Точно так же, как сотни различных блоков Lego соединены в единую структуру, атомы также являются основными строительными блоками всего, что мы можем видеть вокруг себя.
Рис. 1 – Введение в атом
Демокрит, древнегреческий философ, был одним из первых теоретиков-атомщиков, заявивших, что вся материя состоит из атомов, и они полностью тверды.
Он также заявил, что это наименьшая единица материи, которая не может быть разбита (разделена) дальше.Свою теорию он назвал «атомной теорией Вселенной». Затем этот принцип был принят Джоном Дальтоном, и сегодня мир признает его «отцом современной атомной теории».
Однако теория атомов была открыта почти 2500 лет назад индийским мудрецом и философом по имени Ачарья Канад. Он назвал неделимую материю Ану (санскритское слово), что означает атом. Он был пионером атомной теории и основал школу под названием «Философская школа вайшешики», где преподавал свои афоризмы по «атомной теории».
Рис. 2 – Индийский мудрец Ачарья Канад
Структура атомаВсе в этой вселенной состоит из атомов. При современном понимании науки мы установили некоторые факты о природе атомов. Мы знаем, что каждый атом представляет собой ядро, состоящее из трех основных частей. Это:
- Протоны
- Нейтроны
- Электроны (не входят в состав ядра)
Рис.4 – Атомная структура
ПротоныПротон – это положительно заряженная часть ядра и важная часть химических свойств любого элемента. Количество протонов в атоме определяет природу каждого элемента. Идентичность атомов определяется их атомным номером.
Атомные номера определяются как количество протонов в ядре атома. Для например. Кислород (наиболее важный газ для выживания человека) имеет атомное число 8, а в его ядре 8 протонов.
Протоны были открыты Эрнестом Резерфордом в 1919 году. Он сделал это с помощью эксперимента по бомбардировке α-частицами. В этом эксперименте вакуумная трубка с помощью генератора высокого напряжения подвергается бомбардировке положительно заряженными ( α ) частицами.
Рис. 3 – Эксперимент Резерфорда с использованием α-частиц
При этом сцинтилляционные детекторы внутри трубки зафиксировали присутствие ядер водорода.После дальнейших экспериментов он обнаружил, что одни и те же ядра водорода присутствуют внутри атомов азота. Это продемонстрировало присутствие ядер водорода внутри атома азота. Следовательно, показано, что ядра водорода, которые затем были переименованы в «протон», присутствуют внутри каждого атома.
НейтроныНейтрон — это незаряженная субатомная частица, составляющая атом. Нейтрон тоже нуклон. Внутри ядра и нейтроны, и протоны работают одинаково, поэтому они оба имеют равные массы.
Свойства атома также определяются количеством нейтронов в его ядре. Нейтроны играют большую роль в излучении ядерной энергии. В течение десятилетий после его открытия ученые использовали нейтроны для питания множества ядерных экспериментов.
ЭлектроныЭлектрон — это отрицательно заряженная субатомная частица атома. Электроны вращаются вокруг ядра по орбитам. Эти Орбиты делятся на подорбиты и далее на Орбитали. Самые внутренние Орбиты имеют наименьший энергетический уровень и наименьшее количество Электронов.
При движении наружу уровень энергии Орбиталей увеличивается, а также увеличивается количество Электронов. На этих более высоких энергетических уровнях Орбиты делятся на более суборбитальные; следовательно, позволяет добавить больше электронов на эту орбиту.
Отрицательный заряд электрона равен отрицательной величине положительного заряда протона. А мы знаем, что стабильный Атом всегда нейтрален по заряду. Чтобы это беззарядное состояние было возможным, количество протонов должно быть равно количеству электронов.За счет этого общий заряд на Атоме будет равен нулю.
Типы атомных моделейВ истории атомной физики появилось несколько атомных моделей. Несколько моделей перечислены следующим образом:
- JJ ThoMson’s Atomic Model (модель Plum Pudding)
- Rutherford Atomic Model
- Bohr атомная модель
- квантовой механической атомной модели
Первую модель атома представил Дж.J Thomson представил модель сливового пудинга . В этой модели Атома положительно заряженная часть была распределена по всему объему Атома, а электроны как бы встроены внутрь этой чаши положительно заряженного пудинга и электроны сравнивались со сливами . Понятно, почему его интерпретацию атомной структуры сравнивают с тарелкой сливового пудинга.
Рис. 5 – Схематическое изображение модели сливового пудинга эксперименты, показавшие, как положительно заряженное ядро концентрируется в центре атома, а не распределяется по объему атома.
Узнайте больше о модели атома Дж. Дж. Томсона (модель сливового пудинга) в деталях
Модель атома Резерфорда
Резерфорд предложил «ядерную модель» атомной структуры. В соответствии с этой структурой Ядро располагалось в центре, а Электроны располагались вокруг Ядра. Проблема с этой моделью заключалась в том, что размещение электронов было неясным.
Протоны и нейтроны были главным образом в центре внимания этой модели, так как они составляли большую часть массы атома.Принимая во внимание, что электроны занимают наибольший объем. Рис. 6. Модель атома Резерфорда Эта проблема будет исправлена в новой модели атома в ближайшие годы Нильсом Бором в его модели атома.
Атомная модель БораАтомная модель Нила Бора была известна как «Модель оболочки» в 1913 году. Он предложил круговые орбиты электронов и дал теорию энергетических уровней.Эта теория объясняла, как орбиты более низких энергетических уровней содержат меньше электронов по сравнению с орбитами более высоких энергетических уровней.
Эта атомная модель объясняет положение электронов, а также расположение ядра. Она состояла из плотного ядра с вращающимися вокруг него электронами, как и наша Солнечная система.
Рис. 7 – Модель атома Бора
Единственная разница между структурой Солнечной системы и структурой атома Нила Бора заключалась в силе, удерживающей их вместе.Солнечная система удерживается вместе гравитационными силами, а атом удерживается электростатическими силами притяжения.
На рис. 7 выше показано представление модели атома Бора, где энергетические уровни представлены целыми числами (n=1,2,3,4…), а оболочки K, L, M, N относятся к разным орбитам. Электроны переходят с более низкого энергетического уровня на более высокий уровень, приобретая энергию, и наоборот.
Квантово-механическая модель атомаНовая «квантово-механическая модель атома» была представлена в 1926 году Эрвином Шредингером.Эта модель атомов очень сложна и считает электроны волнообразными, а не субатомными частицами. Он использовал математические уравнения для расчета вероятности присутствия Электрона в одной конкретной точке его орбиты.
Рис. 8 – Квантово-механическая модель атома
Поскольку положение электронов неясно, орбиты отображаются в виде облаков, а не идеальных траекторий, поскольку необходимо определить положение электрона.
Применение атомовПриложения включают:
- На основе атомной теории проводились и контролировались эксперименты по ядерному делению и синтезу на атомных станциях.
- Атомные бомбы были разработаны как для войны, так и для мира.
