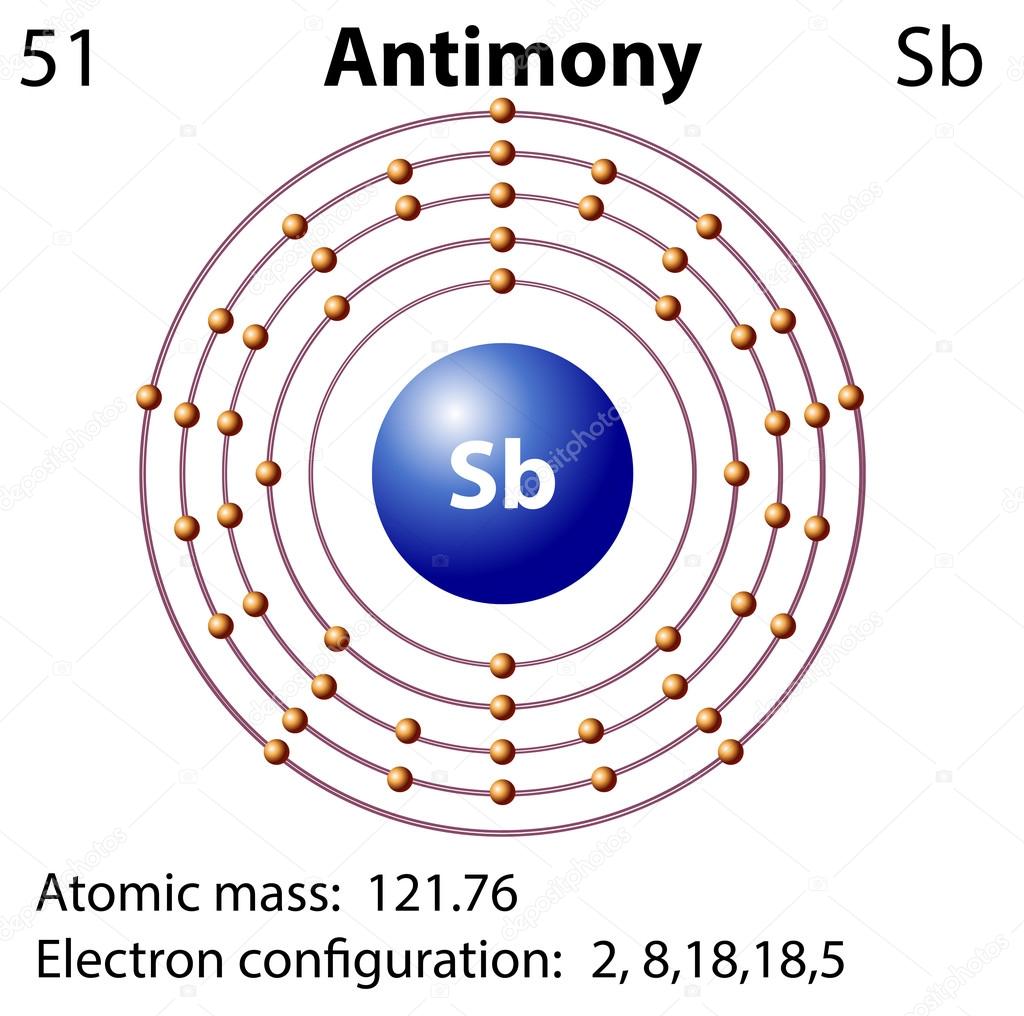
Строение атома сурьмы (Sb), схема и примеры
Общие сведения о строении атома сурьмы
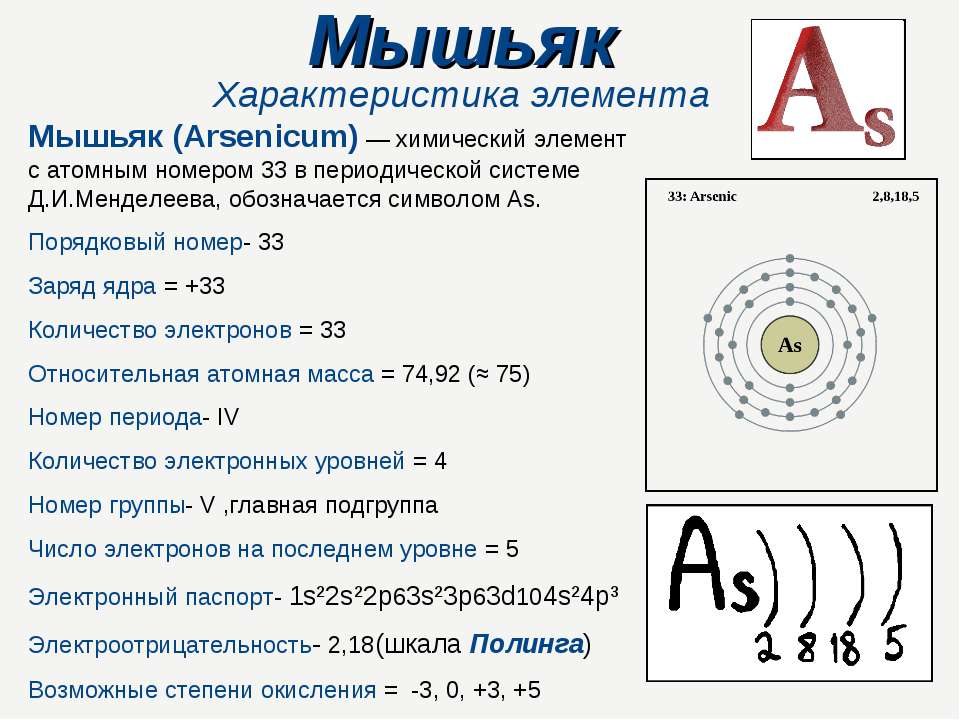
Относится к элементам p-семейства. Полуметалл. Обозначение – Sb. Порядковый номер – 51. Относительная атомная масса – 121,75 а.е.м.
Электронное строение атома сурьмы
Атом сурьмы состоит из положительно заряженного ядра (+51), внутри которого есть 51 протон и 71 нейтрон, а вокруг, по пяти орбитам движется 51 электрон.
Рис.1. Схематическое строение атома сурьмы.
Распределение электронов по орбиталям выглядит следующим образом:
+51Sb)2)8)18)18)5;
1s22s22p63s23p63d104s24p64d105s25p3.
Внешний энергетический уровень атома сурьмы содержит 5 электронов, которые являются валентными.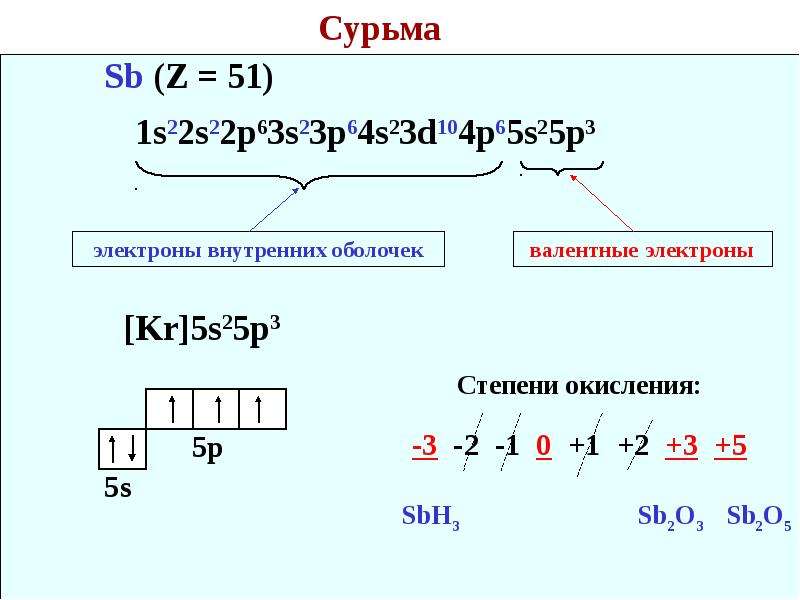
Наличие трех неспаренных электронов свидетельствует о том, что для сурьмы характерна степень окисления +3. За счет наличия вакантных орбиталей 5d-подуровня для атома сурьмы возможно возбужденное состояние (степень окисления +5):
Валентные электроны атома сурьмы можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
|
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
|
s |
5 |
0 |
0 |
-1/2 |
|
p |
5 |
1 |
-1 |
+1/2 |
|
p |
5 |
1 |
0 |
+1/2 |
|
p |
|
1 |
+1 |
+1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Строение атома рутения (Ru), схема и примеры
Общие сведения о строении атома рутения
Относится к элементам  Металл. Обозначение – Ru. Порядковый номер – 44. Относительная атомная масса – 101,07 а.е.м.
Металл. Обозначение – Ru. Порядковый номер – 44. Относительная атомная масса – 101,07 а.е.м.
Электронное строение атома рутения
Атом рутения состоит из положительно заряженного ядра (+44), внутри которого есть 44 протона и 57 нейтронов, а вокруг, по пяти орбитам движутся 44 электрона.
Рис.1. Схематическое строение атома рутения.
Распределение электронов по орбиталям выглядит следующим образом:
+44Ru)2)8)18)15)1;
1s22s22p63s2
Валентными электронами атома рутения считаются электроны, расположенные на 4d— и 5s-орбиталях. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома рутения можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
|
d |
4 |
2 |
-2 |
+1/2 |
|
d |
4 |
2 |
-1 |
+1/2 |
|
d |
4 |
2 |
0 |
+1/2 |
|
d |
4 |
|
+1 |
+1/2 |
|
d |
4 |
2 |
+2 |
+1/2 |
|
d |
4 |
2 |
-2 |
-1/2 |
|
|
4 |
2 |
-1 |
-1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Тест по химии Строение атома.
 Периодическая система.
Периодическая система.9 класс. Повторение. Тест 1. Периодическая система элементов и строение атомов.
1. Число нейтронов в ядре атома 23Na равно:
1) 12 2) 11 3) 23 4) 34
2. Элемент, у которого распределение электронов в атоме по энергетическим уровням 2,5 – это:
1) азот 2) фтор 3) фосфор 4) бор
3. Металлические свойства наиболее выражены у элемента:
1) Cl 2) Al 3) P 4) Mg
4. Одинаковое число электронов во внешнем слое имеют атомы:
1) Na и Mg 2) Mg и Al 3) Mg и Ca 4)Ca и K
5. Высшая степень окисления в ряду химических элементов в ряду:
фосфор → сера → хлор:
1) увеличивается 3) не изменяется
2) уменьшается 4) изменяется периодически
6. У
атома кальция число электронов на внешнем энергетическом уровне и число
протонов равны соответственно
У
атома кальция число электронов на внешнем энергетическом уровне и число
протонов равны соответственно
1) 4 и 20 2) 2 и 20 3) 4 и 40 4) 2 и 40
7. Окислительная способность атомов возрастает в ряду
1) C → N → O 3) S → P → Si
2) F → Cl → Br 4) Si → Al → Mg
8. В атоме калия число электронных слоев равно
1) 1 2) 4 3) 19 4) 39
9. Элементы Al → Ca → K характеризует следующее
1) имеют степень окисления, равную номеру группы
2) усиливаются металлические свойства
3) увеличивается высшая степень окисления
4) уменьшается основный характер высших гидроксидов
5) уменьшается радиус атома
10. В ряду химических элементов Al → Mg → Na:
1) Уменьшается радиус атомов
2) Усиливаются металлические свойства
3) Уменьшаются заряды ядер атомов
4) Увеличивается число электронов во внешнем электронном слое
5) Изменяется число электронных слоёв в атомах
Задание | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Ответ |
|
|
|
|
|
|
|
|
|
|
9 класс. Повторение. Тест 1. Периодическая система
элементов и строение атомов. ______________________________________________
ВАРИАНТ 2.
Повторение. Тест 1. Периодическая система
элементов и строение атомов. ______________________________________________
ВАРИАНТ 2.
1. Заряд ядра атома 15N равен:
1) +14 2) +7 3) +8 4) +5
2. Элемент, у которого распределение электронов в атоме по энергетическим уровням 2,8,4 – это:
1) Na 2) Si 3) C 4) Ca
3. Неметаллические свойства наиболее выражены у элемента:
1) Se 2) S 3) Po 4) O
4. Атом какого химического элемента имеет приведённую ниже схему строения?
+18 ) ) )
2 8 8
1) Ar 2) O 3) S 4) Ca
5. В ряду веществ Al(OH)3 → H2SiO3 → HClO4 свойства гидроксидов изменяются:
1) от основных к кислотным 3) от кислотных к амфотерным
2) от амфотерных к кислотным 4) от амфотерных к основным
6. Число
электронов в ионе Са2+ равно
Число
электронов в ионе Са2+ равно
1) 20 2) 22 3) 18 4) 40
7. В каком ряду химические элементы расположены в порядке ослабления неметаллических свойств?
1) Si → Al → Mg 3) Al → C → N
2) K → Mg → Al 4) Na → Li → H
8. Атом наиболее активного неметалла имеет электронную конфигурацию
1) …3s23p1 2) …3s2 3) …3s1 4) …3s23p2
9. В порядке ослабления металлических свойств расположены химические элементы следующих рядов
1) Be → Mg → Ca 4) Mg → Al → Si
2) Sn → Pb → Bi 5) Li → Be → B
3) Al → Mg → Na
10. В ряду химических элементов P → Si → Al:
1) увеличивается число протонов в ядре
2) увеличивается электроотрицательность
3) уменьшается число электронов во внешнем электронном слое
4) уменьшается радиус атомов
5) ослабевают неметаллические свойства
Задание | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Ответ |
|
|
|
|
|
|
|
|
|
|
9
класс. Повторение. Тест 1. Периодическая система элементов и строение атомов. ____________________________________________
ВАРИАНТ 3.
Повторение. Тест 1. Периодическая система элементов и строение атомов. ____________________________________________
ВАРИАНТ 3.
1. Распределение электронов по энергетическим уровням атома фосфора:
1) 2,5 2) 2,8,3 3) 2,8,5 4) 2,13
2. Высшему оксиду азота соответствует формула:
1) NO 2) N2O3 3) NO2 4) N2O5
3. Максимальной электроотрицательностью обладает элемент:
1) I 2) F 3) Br 4) Cl
4. Общее число электронов в атоме фтора равно:
1) 2 2) 7 3) 9 4) 19
5. В главных подгруппах периодической системы окислительная способность атомов химических элементов возрастает при:
1) Увеличении числа энергетических уровней электронов
2) Увеличении числа протонов в ядре
3) Уменьшении числа валентных электронов
4) Уменьшении радиуса атома
6. Атомы
углерода и кремния имеют одинаковое
Атомы
углерода и кремния имеют одинаковое
1) число нейтронов в ядре атома
2) значение относительной атомной массы
3) число протонов в ядре атома
4) число валентных электронов
7. Неметаллические свойства фосфора выражены сильнее, чем неметаллические свойства
1) кислорода 2) азота 3) алюминия 4) хлора
8. Общее число электронов в атоме калия равно
1) 2 2) 7 3) 9 4) 19
9. В ряду химических элементов Si → Al → Mg
1) увеличивается число протонов в ядрах атомов
2) увеличивается электроотрицательность
3) уменьшается число электронов во внешнем электронном слое
4) уменьшается радиус атомов
5) ослабевают неметаллические свойства
10. Укажите свойства, для которых характерно периодическое изменение с увеличением зарядов ядер атомов:
1) Атомная масса
2) Высшая степень окисления
3) Число электронных слоёв в атомах
4) Число нейтронов в ядрах атомов
5) Кислотно-основные
свойства оксидов и гидроксидов.
Задание | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Ответ |
|
|
|
|
|
|
|
|
|
|
9 класс. Повторение. Тест 1. Периодическая система
элементов и строение атомов. __________________________________________
ВАРИАНТ 4.
Повторение. Тест 1. Периодическая система
элементов и строение атомов. __________________________________________
ВАРИАНТ 4.
1. Распределение электронов по энергетическим уровням в атоме алюминия:
1) 2,8,1 2) 2,8,3 3) 1,9,3 4) 2,3
2. Фосфор образует летучее водородное соединение, формула которого:
1) НЭ 2) Н2Э 3) Н3Э 4) Н4Э
3. Наибольший радиус имеет атом элемента:
1) алюминия 2) хлора 3) кремния 4) фосфора
4. В атоме калия число электронных слоев равно:
1) 1 2) 4 3) 19 4) 39
5. Атом наиболее активного металла имеет электронную конфигурацию:
1)…3s23p1 2) …3s2 3) …3s1 4) …3s23p3
6. Сколько электронов находится на внешнем
энергетическом уровне атома, в ядре которого 6 протонов?
Сколько электронов находится на внешнем
энергетическом уровне атома, в ядре которого 6 протонов?
1) 1 2) 2 3) 6 4) 4
7. От кислотных к основным меняются свойства оксидов в ряду
1) CaO → SiO2 → SO3 3) SO3 → P2O5 → Al2O3
2) CO2 → Al2O3 → MgO 4) Na2O → MgO → Al2O3
8. В главных подгруппах периодической системы окислительная способность атомов химических элементов возрастает при
1) увеличении числа энергетических уровней
2) увеличении числа протонов в ядре
3) увеличении числа валентных электронов
4) уменьшении радиуса атома
9. В ряду химических элементов Al → Mg → Na
1) уменьшается радиус атомов
2) усиливаются металлические свойства
3) увеличиваются заряды ядер атомов
4) увеличивается число электронов во внешнем электронном слое
5) не изменяется число электронных слоёв
10. Элементы
Al – Ca – K
характеризует:
Элементы
Al – Ca – K
характеризует:
1) Высшая степень окисления равна номеру группы
2) Усиливаются металлические свойства
3) Увеличивается высшая степень окисления
4) Ослабляется основный характер их высших гидроксидов
5) Возрастает ‘электроотрицательность.
Задание | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Ответ |
|
|
|
|
|
|
|
|
|
|
9 класс. Повторение. Тест 1. Периодическая система
элементов и строение атомов. ______________________________________________
ВАРИАНТ 5.
Повторение. Тест 1. Периодическая система
элементов и строение атомов. ______________________________________________
ВАРИАНТ 5.
1. Элемент, у которого распределение электронов по электронным уровням описывается формулой 2,8,7 – это:
1) азот 2) фосфор 3) хлор 4) фтор
2. Формула высшего оксида серы:
1) SO6 2) SO3 3) SO2 4) SO
3. Окислительные свойства наиболее выражены у элемента:
1) Si 2) N 3) O 4) C
4. У атома кальция число электронов на внешнем энергетическом уровне и число протонов равны соответственно:
1) 4, 20 2) 2, 20 3) 4, 40 4) 2, 40
5. Окислительная способность атомов возрастает в ряду:
1) С → N → O 3) S → P → Si
2) F→ Cl → Br 4) Si → Al → Mg
6. У
атомов 23Na 24Mg
одинаковое число:
У
атомов 23Na 24Mg
одинаковое число:
1) нейтронов в ядре 3) протонов в ядре
2) валентных электронов 4) электронов в атоме
7. В каком ряду химические элементы расположены в порядке увеличения числа валентных электронов?
1) Be, B, C 2) S, P, C 3) K, Na, Li 4) C, Si, Ge
8. Атом какого элемента имеет распределение электронов по слоям 2е;8е;8е?
1) аргона 3) серы
2) кислорода 4) кальция
9. В ряду химических элементов I → Br → Cl:
1) уменьшаются заряды ядер атомов
2) увеличивается число электронов во внешнем электронном слое
3) уменьшается электроотрицательность
4) уменьшается радиус атомов
5) усиливаются металлические свойства.
10. Элементы S → Se → Te характеризует следующее:
1) Увеличиваются заряды ядер и радиусы атомов
2) Находятся в побочной подгруппе VI группы
3) Усиливаются кислотные свойства водородных соединений
4) Окислительные свойства усиливаются
5) Ослабевают металлические
свойства.
Задание | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Ответ |
|
|
|
|
|
|
|
|
|
|
9 класс. Повторение. Тест 1. Периодическая система
элементов и строение атомов. ____________________________________________
ВАРИАНТ 6.
Повторение. Тест 1. Периодическая система
элементов и строение атомов. ____________________________________________
ВАРИАНТ 6.
1. Распределение электронов по энергетическим уровням атома бора:
1) 2,1 2) 2,8,3 3) 2,3 4) 2,8,1
2. Формула высшего оксида хлора:
1) Cl2O3 2) Cl2O7 3) Cl2O 4) Cl2O5
3. Металлические свойства наименее ярко выражены у элемента:
1) калия 2) алюминия 3) натрия 4) магния
4. Число электронов в ионе Са2+ равно:
1) 20 2) 22 3) 18 4) 40
5. В каком ряду химические элементы расположены в порядке ослабления неметаллических свойств?
1) Al → Si → Mg 3) Al → C → N
2) F → Cl → Br 4) Na → Li → H
6. В
атоме калия распределение электронов по электронным слоям соответствует ряду
чисел:
В
атоме калия распределение электронов по электронным слоям соответствует ряду
чисел:
1) 2; 8; 6; 4 2) 2; 6; 8; 2; 1 3) 1; 8; 8; 2 4) 2; 8; 8; 1
7. В ряду веществ Al(OH)3 → Mg(OH)2 → NaOH свойства гидроксидов изменяются от:
1) основных к кислотным 3) амфотерных к кислотным
2) кислотных к амфотерным 4) амфотерных к основным
8. Одинаковое число электронов во внешнем электронном слое имеют атомы
1) Na и Mg 2) Mg и Al 3) Mg и Ca 4) Ca и K
9. В ряду химических элементов C → Si → Pb :
1) уменьшается электроотрицательность
2) уменьшаются радиусы атомов
3) ослабевают неметаллические свойства
4) увеличивается валентность в высших оксидах
5)
уменьшается число электронных слоёв в атомах.
10. Элементы Al → Ca → K характеризует:
1) все элементы имеют высшую степень окисления, равную номеру группы
2) усиливаются металлические свойства
3) увеличивается высшая степень окисления
4) уменьшаются основные свойства высших гидроксидов
5) уменьшается радиус атомов.
Задание | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Ответ |
|
|
|
|
|
|
|
|
|
|
9 класс. Повторение. Тест 1. Периодическая система
элементов и строение атомов. ______________________________________________
ВАРИАНТ 7.
Повторение. Тест 1. Периодическая система
элементов и строение атомов. ______________________________________________
ВАРИАНТ 7.
1. Элемент, у которого распределение электронов по энергетическим уровням соответствует формуле 2,8,8,2 – это:
1) Ba 2) S 3) Mg 4) Ca
2. Высшему оксиду кремния соответствует формула:
1) ЭО 2) ЭО3 3) ЭО2 4) Э2О3
3. Неметаллические свойства наименее ярко выражены у элемента:
1) S 2) Al 3) Cl 4) P
4. Атомы углерода и кремния имеют одинаковое:
1) число нейтронов в ядре 3) число протонов в ядре
2) значение атомной массы 4) число валентных электронов
5. Неметаллические свойства фосфора выражены сильнее, чем неметаллические свойства:
1) кислорода 2) азота 3) алюминия 4) хлора
6. Иону S2- соответствует схема заполнения электронных слоёв:
Иону S2- соответствует схема заполнения электронных слоёв:
1) 2; 8; 4 2) 2; 8; 8 3) 8; 8; 2 4) 4; 6; 8
7. В главных подгруппах периодической системы восстановительная способность атомов химических элементов усиливается с:
1) увеличением радиуса атомов
2) уменьшением радиуса атомов
3) увеличением числа электронов во внешнем слое
4) увеличением числа нейтронов в ядре.
8. В ряду веществ Al(OH)3 → H2SiO3 → HClO4 свойства гидроксидов изменяются от
1) основных к кислотным 3) кислотных к амфотерным
2) амфотерных к кислотным 4) амфотерных к основным
9. В ряду химических элементов I → Br → Cl:
1) уменьшаются заряды ядер атомов
2) увеличивается число электронов во внешнем слое
3) уменьшается электроотрицательность
4) уменьшается радиус атомов
5)
ослабевают неметаллические свойства.
10. В порядке усиления металлических свойств расположены химические элементы следующих рядов:
1) Be → Mg → Ca 3) Si → Mg → Na 5) Li → Be → B
2) Sn → Ge → Si 4) Mg → Al → S
Задание | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Ответ |
|
|
|
|
|
|
|
|
|
|
9 класс. Повторение. Тест 1. Периодическая система
элементов и строение атомов. ______________________________________________
ВАРИАНТ 8.
Повторение. Тест 1. Периодическая система
элементов и строение атомов. ______________________________________________
ВАРИАНТ 8.
1. Распределение электронов по энергетическим уровням в атоме натрия соответствует формуле:
1) 2,8,1 2) 2,8,3 3) 1,9,3 4) 2,3
2. Формула высшего оксида алюминия:
1) Э2О 2) ЭО 3) Э2О3 4) ЭО3
3. Наименьший радиус имеет атом химического элемента:
1) мышьяка 2) азота 3) сурьмы 4) фосфора
4. Сколько электронов находится на внешнем энергетическом уровне атома, в ядре которого 6 протонов?
1) 1 2) 2 3) 6 4) 4
5. От кислотных к основным меняются свойства оксидов в ряду:
1) CaO → SiO2 → SO3 3) SO3 → P2O5 → Al2O3
2) CO2 → Al2O3 → MgO 4) Na2O → MgO → Al2O3
6. У атома фосфора число
электронов во внешнем слое и заряд ядра равны соответственно:
У атома фосфора число
электронов во внешнем слое и заряд ядра равны соответственно:
1) 5, 31 2) 5, 15 3) 3, 31 4) 3, 15
7. Высшая степень окисления в ряду Cl → Br → I:
1) увеличивается 3) уменьшается
2) не изменяется 4) изменяется периодически
8. Высшая степень окисления в ряду химических элементов фосфор → сера → хлор
1) увеличивается 3) уменьшается
2) не изменяется 4) изменяется периодически
9. В порядке ослабления металлических свойств расположены химические элементы следующих рядов:
1) Be → Mg → Ca 4) Mg → Al → Si
2) Sn → Ge → Si 5) Li → Na → K
3) Al → Mg → Na
10. В ряду химических элементов C – Si – Pb:
1) Уменьшается электроотрицательность
2) Уменьшаются радиусы атомов
3) Ослабевают неметаллические свойства
4) Увеличивается валентность в высших оксидах
5) Уменьшается число заполненных электронных слоев
Задание | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Ответ |
|
|
|
|
|
|
|
|
|
|
9
класс. Повторение. Тест 1. Периодическая система элементов и строение атомов. __________________________________________
ВАРИАНТ 9.
Повторение. Тест 1. Периодическая система элементов и строение атомов. __________________________________________
ВАРИАНТ 9.
1. Частицы, имеющие распределение электронов по энергетическим уровням 2.8,8 – это: 1) Ne и O2- 2) Ar и S2- 3) Ne и O2+ 4) Ar и S2+
2. Кислоту, соответствующую формуле H2ЭО3, образует:
1) фосфор 2) хлор 3) углерод 4) бор
3. Окислительные свойства наиболее выражены у элемента:
1) бериллия 2) алюминия 3) бора 4) азота
4. Изотопы одного элемента имеют:
1) одинаковое число нейтронов
2) одинаковое число протонов
3) равную сумму числа протонов и нейтронов
4) одинаковую разность числа протонов и нейтронов
5. Наименьший радиус имеет атом с электронной конфигурацией:
Наименьший радиус имеет атом с электронной конфигурацией:
1) 1s22s22p63s23p1 3) 1s22s22p63s23p6
2) 1s22s22p63s23p64s1 4) 1s22s22p63s23p4
6. У атома бора число электронных слоёв равно:
1) 3 2) 2 3) 9 4) 5
7. Свойства оксидов в ряду Na2O → Al2O3 → Cl2O7 изменяются от:
1) амфотерных к кислотным 3) амфотерных к основным
2) основных к кислотным 4) кислотных к основным
8. В каком ряду химические элементы расположены в порядке увеличения числа валентных электронов?
1) Be, B, C 2) S, P, C 3) K, Na, Li 4) C, Si, Ge
9. Элементы S
→ Se → Te
характеризует следующее:
Элементы S
→ Se → Te
характеризует следующее:
1) увеличивается заряд ядер и радиус атомов
2) находятся в побочной подгруппе VI группы
3) усиливаются кислотные свойства водородных соединений
4) окислительные свойства усиливаются
5) ослабевают восстановительные свойства.
10. В ряду химических элементов Al → Mg → Na:
1) уменьшается радиус атомов
2) усиливаются металлические свойства
3) уменьшаются заряды ядер атомов
4) увеличивается число электронов на последнем слое
5) увеличивается число электронных слоёв
Задание | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Ответ |
|
|
|
|
|
|
|
|
|
|
9 класс. Повторение. Тест 1. Периодическая система
элементов и строение атомов. ____________________________________________
ВАРИАНТ 10.
Повторение. Тест 1. Периодическая система
элементов и строение атомов. ____________________________________________
ВАРИАНТ 10.
1. Распределение электронов по энергетическим уровня в атоме магния:
1) 2,3 2) 2,8,2 3) 2,8,8,2 4) 2,8,3
2. Формула летучего водородного соединения углерода:
1) ЭН 2) ЭН2 3) ЭН3 4) ЭН4
3. Минимальной электроотрицательностью обладает элемент:
1) C 2) Si 3) Ge 4) Sn
4. Атомы химических элементов, находящиеся в одной главной подгруппе, имеют:
1) одинаковое число нейтронов в ядре
2) одинаковые заряды ядер атомов
3) одинаковое число электронов во внешнем слое
4) одинаковые радиусы атомов
5. У какого элемента наиболее выражены металлические свойства?
1) Li 2) Fe 3) Na 4) Mg
6. Укажите общее число электронов в атоме кремния:
Укажите общее число электронов в атоме кремния:
1) 28 2) 4 3) 3 4) 14
7. В каком ряду химические элементы расположены в порядке ослабления неметаллических свойств?
1) Rb → K → Na 3) Mg → Al → Si
2) Al → Si → P 4) Cl → S → P
8. Неметаллические свойства фосфора выражены сильнее, чем неметаллические свойства
1) кислорода 2) азота 3) алюминия 4) хлора
9. Периодические изменения характерны для следующих свойств элементов:
1) атомная масса 4) радиус атомов
2) высшая степень окисления 5) заряд ядер атомов
3) число нейтронов в ядрах атомов
10. В ряду химических элементов P → Si → Al:
1) увеличивается число протонов в ядре
2) увеличивается электроотрицательность
3) уменьшается число электронов на последнем слое
4) уменьшается радиус атомов
5) ослабевают неметаллические свойства
Задание | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Ответ |
|
|
|
|
|
|
|
|
|
|
9 класс. Повторение. Тест 1. Периодическая система
элементов и строение атомов. _____________________________________________
ВАРИАНТ 11.
Повторение. Тест 1. Периодическая система
элементов и строение атомов. _____________________________________________
ВАРИАНТ 11.
1. Число нейтронов в ядре атома 23Na равно:
1) 12 2) 11 3) 23 4) 34
2. Элемент, у которого распределение электронов в атоме по энергетическим уровням 2,5 – это:
1) азот 2) фтор 3) фосфор 4) бор
3. Неметаллические свойства наиболее выражены у элемента:
1) Se 2) S 3) Po 4) O
4. Атом какого химического элемента имеет приведённую ниже схему строения?
+18 ) ) )
2 8 8 1) Ar 2) O 3) S 4) Ca
5. В главных подгруппах периодической системы окислительная способность атомов химических элементов возрастает при:
1) Увеличении числа энергетических уровней электронов
2) Увеличении числа протонов в ядре
3) Уменьшении числа валентных электронов
4) Уменьшении радиуса атома
6. Атомы углерода и
кремния имеют одинаковое
Атомы углерода и
кремния имеют одинаковое
1) число нейтронов в ядре атома 3) число протонов в ядре атома
2) значение относительной атомной 4) массы число валентных электронов
7. От кислотных к основным меняются свойства оксидов в ряду
1) CaO → SiO2 → SO3 3) SO3 → P2O5 → Al2O3
2) CO2 → Al2O3 → MgO 4) Na2O → MgO → Al2O3
8. В главных подгруппах периодической системы окислительная способность атомов химических элементов возрастает при
1) увеличении числа энергетических уровней
2) увеличении числа протонов в ядре
3) увеличении числа валентных электронов
4) уменьшении радиуса атома
9. В ряду химических элементов I → Br → Cl:
1) уменьшаются заряды ядер атомов
2) увеличивается число электронов во внешнем электронном слое
3) уменьшается электроотрицательность
4) уменьшается радиус атомов
5) усиливаются
металлические свойства.
10. Элементы S → Se → Te характеризует следующее:
1) Увеличиваются заряды ядер и радиусы атомов
2) Находятся в побочной подгруппе VI группы
3) Усиливаются кислотные свойства водородных соединений
4) Окислительные свойства усиливаются
5) Ослабевают металлические свойства.
Задание | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Ответ |
|
|
|
|
|
|
|
|
|
|
9 класс. Повторение. Тест 1. Периодическая система
элементов и строение атомов. ______________________________________________
ВАРИАНТ 12.
Повторение. Тест 1. Периодическая система
элементов и строение атомов. ______________________________________________
ВАРИАНТ 12.
1. Заряд ядра атома 15N равен:
1) +14 2) +7 3) +8 4) +5
2. Элемент, у которого распределение электронов в атоме по энергетическим уровням 2,8,4 – это:
1) Na 2) Si 3) C 4) Ca
3. Максимальной электроотрицательностью обладает элемент:
1) I 2) F 3) Br 4) Cl
4. Общее число электронов в атоме фтора равно:
1) 2 2) 7 3) 9 4) 19
5. Атом наиболее активного металла имеет электронную конфигурацию:
1)…3s23p1 2) …3s2 3) …3s1 4) …3s23p3
6. Сколько электронов находится на внешнем энергетическом уровне атома, в ядре
которого 6 протонов?
Сколько электронов находится на внешнем энергетическом уровне атома, в ядре
которого 6 протонов?
1) 1 2) 2 3) 6 4) 4
7. В каком ряду химические элементы расположены в порядке увеличения числа валентных электронов?
1) Be, B, C 2) S, P, C 3) K, Na, Li 4) C, Si, Ge
8. Атом какого элемента имеет распределение электронов по слоям 2е;8е;8е?
1) аргона 3) серы
2) кислорода 4) кальция
9. В ряду химических элементов C → Si → Pb :
1) уменьшается электроотрицательность
2) уменьшаются радиусы атомов
3) ослабевают неметаллические свойства
4) увеличивается валентность в высших оксидах
5) уменьшается число электронных слоёв в атомах.
10. Элементы Al → Ca
→ K характеризует:
Элементы Al → Ca
→ K характеризует:
1) все элементы имеют высшую степень окисления, равную номеру группы
2) усиливаются металлические свойства
3) увеличивается высшая степень окисления
4) уменьшаются основные свойства высших гидроксидов
5) уменьшается радиус атомов.
Задание | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Ответ |
|
|
|
|
|
|
|
|
|
|
Ответы на тестовые задания
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
В-1 | 1 | 1 | 4 | 3 | 1 | 2 | 1 | 2 | 12 | 23 |
В-2 | 2 | 2 | 4 | 1 | 2 | 3 | 1 | 4 | 45 | 35 |
В-3 | 3 | 4 | 2 | 3 | 4 | 4 | 3 | 4 | 35 | 25 |
В-4 | 2 | 3 | 1 | 2 | 3 | 4 | 2 | 4 | 25 | 12 |
В-5 | 3 | 2 | 3 | 2 | 1 | 1 | 1 | 1 | 14 | 13 |
В-6 | 3 | 2 | 2 | 3 | 2 | 4 | 4 | 3 | 13 | 12 |
В-7 | 4 | 3 | 2 | 4 | 3 | 2 | 1 | 2 | 14 | 13 |
В-8 | 1 | 3 | 2 | 4 | 2 | 2 | 2 | 1 | 24 | 13 |
В-9 | 2 | 3 | 4 | 2 | 3 | 2 | 2 | 1 | 13 | 23 |
В-10 | 2 | 4 | 4 | 3 | 3 | 4 | 4 | 3 | 24 | 35 |
В-11 | 1 | 1 | 4 | 1 | 4 | 4 | 2 | 4 | 14 | 13 |
В-12 | 2 | 2 | 2 | 3 | 3 | 4 | 1 | 1 | 13 | 12 |
Итоговая контрольная работа по теме “Подгруппа азота” (9 класс)
Вариант 1.
А1. Химический элемент, имеющий схему строения атома 2е5е – это:
1. азот 2. фосфор 3. мышьяк 4. сурьма
А2. Элемент с наиболее выраженными неметаллическими свойствами:
1. азот 2. фосфор 3. мышьяк 4. сурьма
А3. В молекуле N2 химическая связь:
1. ионная 2. ковалентная полярная 3. ковалентная неполярная 4. металлическая
А4. Элементом «Э» в схеме превращений Э → ЭО →ЭО2→ НЭО3 является:
1. бор 2. углерод 3. азот 4. сера
А5. Одинаковым у атомов азота и мышьяка является:
1. заряд ядра атома
число энергетических уровней;
относительная атомная масса;
число электронов на внешнем уровне.
А6. Степень окисления азота в соединениях N2O5, NH3 соответственно равна
1) +2 и -3; 3) +5 и -3;
2) +5 и +3; 4) -5 и +3.
А7. Качественной реакцией на ион аммония ( NH4+) является:
взаимодействие его с ионами хлора Cl–
взаимодействие его с гидроксид –ионами OH–
взаимодействие его с нитрат- ионами NO3–
взаимодействие его с сульфат- ионами SO42-
А8. Схема превращения 2N-3→ N20 соответствует химическому уравнению:
1. NH3 + HCl = NH4Cl
2. N2 + 3H2 = 2NH3
3. 4NH3 + 3O2 = 2N2 + 6H2O
4. 4NH3 + 5O2 = 4NO + 6H2O
А9. Укажите ядовитое аллотропное видоизменение фосфора
1) красный фосфор 2) белый фосфор
3) черный фосфор 4) все ответы верны
А10. Физические свойства азота при комнатной температуре:
Физические свойства азота при комнатной температуре:
1 – бесцветный газ;
2 – бесцветный газ, без запаха;
3 – бесцветный газ, без запаха, малорастворим в воде;
4 – бесцветный газ, без запаха, малорастворим в воде, тяжелее воздуха.
А11. Концентрированная азотная кислота реагирует с медью с образованием
1) Воды и нитрата меди(II) 2) Нитрата меди(II) и водорода
3) Нитрата меди (II), воды, оксида азота(II) 4) Нитрата меди(II), воды, оксида азота(IV)
В1. Установите соответствие:
Молекулярное уравнение реакции: Сокращенное ионное уравнение:
А. (NH4)2SO4 + BaCl2 = BaSO4↓ + 2NH4Cl; 1. Ba2+ + SO42- = BaSO4↓
Б. NH4Cl + KOH = KCl + NH3↑ + H2O; 2. CO32- + 2H+ = CO2↑ + H2O
NH4Cl + KOH = KCl + NH3↑ + H2O; 2. CO32- + 2H+ = CO2↑ + H2O
В. (NH4)2CO3 + H2SO4 = (NH4)2SO4+ CO2↑ + H2O; 3. NH4+ + OH– = NH3↑ + H2O;
Г. NH4NO3 + KOH = KNO3 + NH3↑ + H2O
В2. Верны ли следующие суждения о свойствах азота?
А. В соединениях с водородом и металлами азот проявляет степень окисления -3
Б . В соединениях с кислородом является восстановителем.
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
С1. Осуществите превращения:
P → P2O5 → H3PO4 → K3PO4 → Ag3PO4
↓
Ca3P2
С2. Вычислите объем бурого газа, который образуется при взаимодействии цинка массой 6,5г с концен-
Вычислите объем бурого газа, который образуется при взаимодействии цинка массой 6,5г с концен-
трированной азотной кислоты при нормальных условиях.
Вариант 2.
А1. Химический элемент, имеющий схему строения атома 2е8е5е – это:
1. азот 2. фосфор 3. мышьяк 4. сурьма
А2. Элемент с наиболее выраженными металлическими свойствами:
1. азот 2. фосфор 3. мышьяк 4. сурьма
А3. В молекуле P2O5химическая связь:
1. ионная 2. ковалентная полярная 3. ковалентная неполярная 4. металлическая
А4. Элементом «Э» в схеме превращений Э → ЭH3 →ЭО является:
1. бор 2. углерод 3. азот 4. сера
А5. Одинаковым у атомов азота и фосфора является:
1. заряд ядра атома
число энергетических уровней;
относительная атомная масса;
число электронов на внешнем уровне.

А6. Степень окисления азота в соединениях NO, NH3 соответственно равна
1) +2 и -3; 3) +5 и -3;
2) +5 и +3; 4) -5 и +3
А7. Качественной реакцией на фосфат- ион PO43- является:
взаимодействие его с ионами водорода H+
взаимодействие его с ионами бария Ba2+
взаимодействие его с ионами серебра Ag+
взаимодействие его с ионами свинца Pb2+
А8. Схема превращения N-3→ N+2 соответствует химическому уравнению:
1. NH3 + HCl = NH4Cl
2. N2 + 3H2 = 2NH3
3. 4NH3 + 3O2 = 2N2 + 6H2O
4. 4NH3 + 5O2 = 4NO + 6H2O
4NH3 + 5O2 = 4NO + 6H2O
А9. Укажите аллотропное видоизменение фосфора
1) красный фосфор 2) белый фосфор
3) черный фосфор 4) все ответы верны
А10. Физические свойства аммиака (при н. у.):
1 – бесцветный газ;
2 – бесцветный газ с резким запахом;
3 – бесцветный газ с резким запахом, ядовит, легче воздуха
4 – бесцветный газ с резким запахом, ядовит, тяжелее воздуха
А11. Разбавленная азотная кислота реагирует с медью с образованием
1) Воды и нитрата меди(II) 2) Нитрата меди(II) и водорода
3) Нитрата меди (II), воды, оксида азота(II) 4) Нитрата меди(II), воды, оксида азота(IV)
В1. Установите соответствие:
Молекулярное уравнение реакции: Сокращенное ионное уравнение:
А. (NH4)2SO4 + BaCl2 = BaSO4↓ + 2NH4Cl; 1. NH4+ + OH– = NH3↑ + H2O;
(NH4)2SO4 + BaCl2 = BaSO4↓ + 2NH4Cl; 1. NH4+ + OH– = NH3↑ + H2O;
Б. NH4Cl + NaOH = NaCl + NH3↑ + H2O; 2. CO32- + 2H+ = CO2↑ + H2O
В. (NH4)2CO3 + 2HCl = 2NH4Cl + CO2↑ + H2O; 3. Ba2+ + SO42- = BaSO4↓
Г. NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O
В2. Верны ли следующие суждения о свойствах азота?
А. Азот бесцветный газ, без вкуса и запаха.
Б. Азот легче воздуха
1) верно только А ; 3) верны оба суждения;
2) верно только Б ; 4) оба суждения неверны.
С1. Осуществите превращения:
N2→ NH3→ NO →NO2→HNO3→Ba(NO3)2
С2. Вычислите объем бурого газа, который образуется при взаимодействии меди массой 3,2 г с концен-
трированной азотной кислоты при нормальных условиях.
Состояние электронов в атоме – презентация онлайн
«Состояниеэлектронов в
атоме»
Модель строения атома Резерфорда
3. Строение атома водорода
s1
H
1
1
Электронная формула 1s1
4. Строение атома гелия
s4
Hе
2
2
Электронная формула 1s2
5. Строение атома лития
s s7
Li
3
21
Электронная формула 1s2 2s1
6. Строение атома бериллия
9s s
Be
4
2 2
Электронная формула 1s2 2s2
7. Графическая формула атома бора
s sp11
B
5
2 3
Электронная формула 1s2 2s2 2p1
8.
 Строение атома углерода s sp
Строение атома углерода s sp12
С
6
2 4
Электронная формула 1s2 2s2 2p2
9. Строение атома азота
s sp14
7
N
2 5
Электронная формула 1s2 2s2 2p3
10. Строение атома кислорода
s sp16
O
8
2 6
Электронная формула 1s2 2s2 2p4
11. Строение атома фтора
s sp19
F
9
2 7
Электронная формула 1s2 2s2 2p5
12. Строение атома неона
s sp20
Ne
10
2 8
Электронная формула 1s2 2s2 2p6
13. Строение атома натрия
s sp s23
Na
11
2 8 1
Электронная формула 1s2 2s2 2p6 3s1
14. Строение атома магния
24s sp s
Mg
12
2 8 2
Электронная формула 1s2 2s2 2p6 3s2
15. Строение атома алюминия
s sp sp27
Al
13
2 8 3
Электронная формула 1s2 2s2 2p6 3s2 3p1
16. Строение атома кремния
s sp sp28
Si
14
2 8 4
Электронная формула 1s2 2s2 2p6 3s2 3p2
17.
 Строение атома фосфора s sp sp
Строение атома фосфора s sp sp31
P
15
2 8 5
Электронная формула 1s2 2s2 2p6 3s2 3p3
18. Строение атома серы
s sp sp32
S
16
2 8 6
Электронная формула 1s2 2s2 2p6 3s2 3p4
19. Строение атома хлора
s sp sp35
Cl
17
2 8 7
Электронная формула 1s2 2s2 2p6 3s2 3p5
20. Строение атома аргона
s sp sp40
Ar
18
2 8 8
Электронная формула 1s2 2s2 2p6 3s2 3p6
21. Строение атома калия
s sp sp s39
K
19
2881
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s1
22. Строение атома кальция
s sp sp s40
Ca
20
2882
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2
23. Строение атома скандия
s sp spd s45
Sc
21
289 2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d1
24. Строение атома титана
s sp spd s48
Ti
22
2 8 10 2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d2
25.
 Строение атома ванадия s sp spd s
Строение атома ванадия s sp spd s51
V
23
2 8 11 2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d3
26. Строение атома хрома
– проскок электронаs sp spd s
52
Cr
24
2 8 13
12 1
2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s1 3d5
27. Строение атома марганца
s sp spd s55
Mn
25
2 8 13 2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d5
28. Строение атома железа
s sp spd s56
Fe
26
2 8 14 2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d6
29. Строение атома кобальта
s sp spd s59
Co
27
2 8 15 2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d7
30. Строение атома никеля
s sp spd s59
Ni
28
2 8 16 2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d8
31. Строение атома меди
– проскок электронаs sp spd s
64
Cu
29
2 8 18
17 1
2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s1 3d10
32.
 Строение атома цинка s sp spd s
Строение атома цинка s sp spd s65
Zn
30
2 8 18 2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10
33. Строение атома галлия
s sp spd sp70
Ga
31
2 8 18 3
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1
34. Строение атома германия
s sp spd sp73
Ge
32
2 8 18 4
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2
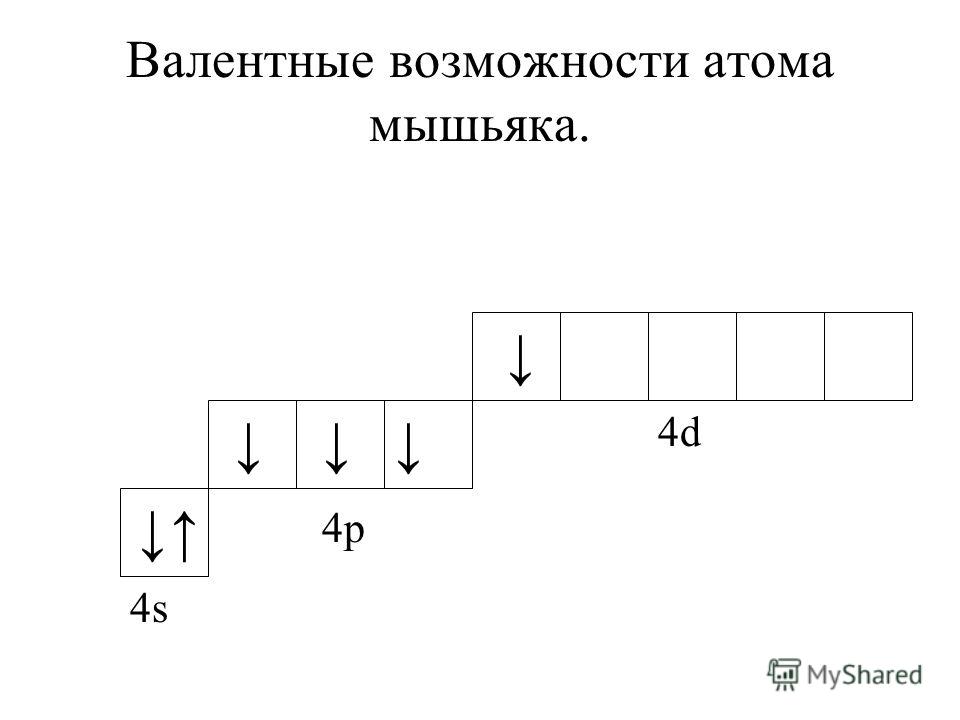
35. Строение атома мышьяка
s sp spd sp75
As
33
2 8 18 5
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
36. Строение атома селена
s sp spd sp79
Se
34
2 8 18 6
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4
37. Строение атома брома
s sp spd sp80
Br
35
2 8 18 7
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
38. Строение атома криптона
s sp spd sp84
Kr
36
2 8 18 8
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
39.
 Строение атома рубидия s sp spd sp s
Строение атома рубидия s sp spd sp s85
Rb
37
2 8 18 8 1
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
40. Строение атома стронция
s sp spd sp s88
Sr
38
2 8 18 8 2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
41. Строение атома иттрия
s sp spdspds89
Y
39
2 8 18 9 2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d1
42. Строение атома циркония
s sp spdspds91
Zr
40
2 8 18 10 2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2
43. Строение атома ниобия
– проскок электрона93
s sp spdspds
Nb
41
2 8 18 12
11 1
2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d4
44. Строение атома молибдена
– проскок электрона96
s sp spdspds
Mo
42
2 8 18 13
12 1
2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d5
45.
 Строение атома технеция s sp spdspds
Строение атома технеция s sp spdspds98
Tc
43
2 8 18 13 2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d5
46. Строение атома рутения
– проскок электрона101
s sp spdspds
Ru
44
2 8 18 15
14 1
2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d7
47. Строение атома родия
– проскок электрона103
s sp spdspds
Rh
45
2 8 18 16
15 1
2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d8
48. Строение атома палладия
– проскок электрона106
s sp spdspds
Pd
46
2 8 18 18
16 0
2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s0 4d10
49. Графическая формула атома серебра
– проскок электрона108
s sp spdspds
Ag
47
2 8 18 18
17 1
2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
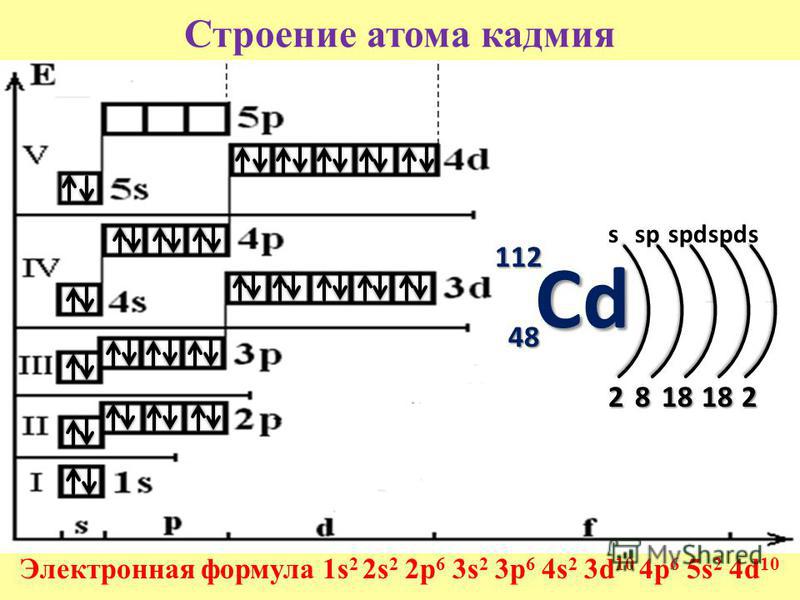
50. Строение атома кадмия
112s sp spdspds
Cd
48
2 8 18 18 2
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10
51.
 Строение атома индия 115
Строение атома индия 115s sp spdspdsp
In
49
2 8 18 18 3
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1
52. Строение атома олова
119s sp spdspdsp
Sn
50
2 8 18 18 4
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p2
53. Строение атома сурьмы
122s sp spdspdsp
Sb
51
2 8 18 18 5
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p3
54. Строение атома теллура
128s sp spdspdsp
Te
52
2 8 18 18 6
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p4
55. Строение атома иода
s sp spdspdsp127
I
53
2 8 18 18 7
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5
56. Строение атома ксенона
s sp spdspdsp131
Xe
54
2 8 18 18 8
Электронная формула 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
Строение атома цезия
s sp spdspdsp s
133
Cs
55
2 8 18 18 8 1
Электронная формула …4s2 3d10 4p6 5s2 4d10 5p6 6s1
Строение атома бария
s sp spdspdsp s
137
Ba
56
2 8 18 18 8 2
Электронная формула …4s2 3d10 4p6 5s2 4d10 5p6 6s2
Строение атома лантана
s sp spd spdfspd s
139
La
57
2 8 18 18
19 9
8 2
Электронная формула …4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f0 5d1
Схема электронных орбиталей атомов
химических элементов от водорода до .
 ..
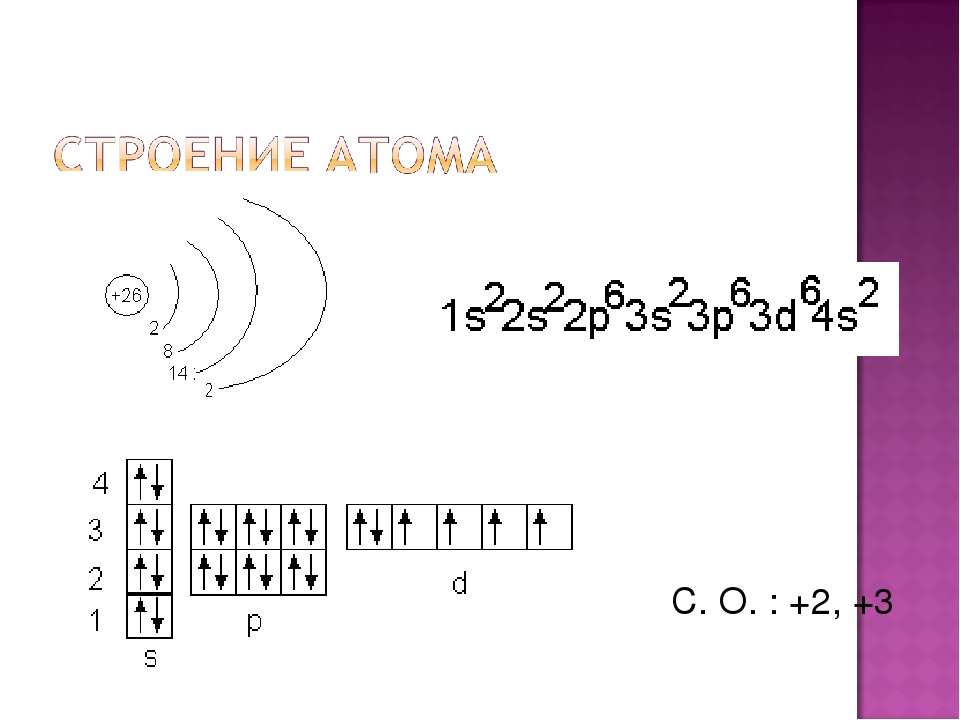
..Сурьма электронное строение – Справочник химика 21
Электронное строение атомов фосфора, мышьяка, сурьмы и висмута [c.275]Сурьма принадлежит к пятой группе периодической системы химических элементов Д. И. Менделеева и входит в подгруппу мышьяка. Атомная масса сурьмы равна 121,75 [213, 992], атомный номер 51. Строение электронной оболочки 1 , 2 , 2/) , З , Зр 45 , 4р , 4 1 , 5s 5р [c.7]
Фосфор, мышьяк или сурьма (имеющие электронное строение внешнего энергетического уровня s pЗ и проявляющие валентность 5), будучи введенными в кристаллические решетки германия или олова (электронное строение внешнего уровня 5 р валентность 4) ведут себя как донорные примеси, т. е. отдают электроны и создают проводимость п-типа. Если же в германий или кремний ввести бор, алюминий, галлий или индий (электронное строение внешнего уровня 5 р, валентность 3), то атомы примеси захватывают четвертый электрон и полупроводник обнаруживает проводимость р-типа.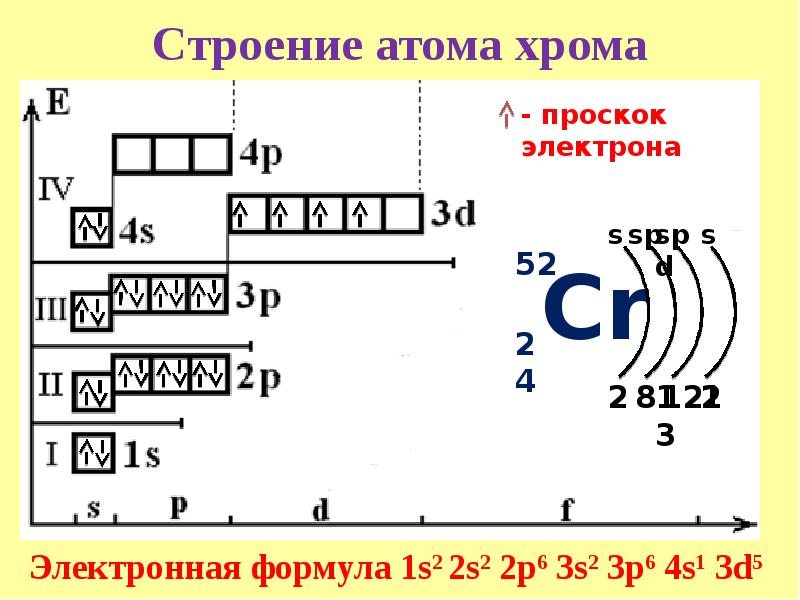 [c.186]
[c.186]
Строение внешней электронной оболочки атома Азот Фосфор Мышьяк Сурьма Висмут [c.427]
Многочисленные известные людям металлы химики делят на четыре типа в соответствии с электронным строением металлы (щелочные, щелочноземельные, магний и бериллий), р-металлы (алюминий, галлий, индий, таллий, олово, свинец, сурьма, висмут, полоний), ё- и / металлы (которые иногда объединяют термином переходные металлы ). А какие металлы относятся к черным, цветным и малым [c.210]
Размещению известных Менделееву европия, гадолиния, тербия, гольмия, эрбия, тулия в девятом ряду препятствовало полное несходство их с серебром, кадмием, индием, оловом, сурьмой, теллуром и йодом, под которыми были оставлены места (см. табл. 2). Не зная электронного строения элементов, нельзя было определить, что лантаноиды не являются аналогами элементов главных подгрупп и d-переходных металлов, а образуют самостоятельные третьи подгруппы /-переходных металлов. Открытие лютеция и гафния привело к перемещению иттербия во Пс подгруппу, а церия из подгруппы титана в IV подгруппу. Совершенно так же открытие советским ученым Н. И. Флеровым с сотрудниками в 1964 г. элемента № 104, являющегося аналогом гафния, исключает возможность размещения тория, протактиния и урана в подгруппах d-переходных металлов под гафнием, танталом и вольфрамом, поскольку нельзя в клетку, где поме- [c.24]
Открытие лютеция и гафния привело к перемещению иттербия во Пс подгруппу, а церия из подгруппы титана в IV подгруппу. Совершенно так же открытие советским ученым Н. И. Флеровым с сотрудниками в 1964 г. элемента № 104, являющегося аналогом гафния, исключает возможность размещения тория, протактиния и урана в подгруппах d-переходных металлов под гафнием, танталом и вольфрамом, поскольку нельзя в клетку, где поме- [c.24]
На основании электронного строения атомов р-элементов IV и V групп, изменения их атомных радиусов, их металлических и неметаллических свойств решите вопрос об изменении наиболее устойчивой степени окисления этих элементов по группам. Ответ мотивируйте составлением уравнений реакций растворения в азотной кислоте а) углерода, кремния, олова, свинца б) мышьяка, сурьмы, висмута. [c.67]
Подгруппа мышьяка. Мышьяк. Элементы подгруппы мышьяка — мышьяк, сурьма и висмут — имеют во внешнем квантовом слое атомов такое же число электронов, как азот и фосфор. Однако они отличаются строением предпоследнего квантового слоя, который содержит 18 электронов . Этим объясняется зна- [c.274]
Однако они отличаются строением предпоследнего квантового слоя, который содержит 18 электронов . Этим объясняется зна- [c.274]
Электролиз расплавленных солей подчиняется тем же основным законам, которые выведены для электрохимии водных растворов. Ток через расплавленные соли проходит так же, как и в водных растворах электролитов, с помощью ионов, поэтому электролиз солевых расплавов подчиняется законам Фарадея. Электропроводность солевых расплавов при высоких температурах несколько выше, чем электропроводность водных электролитов при комнатной температуре. Положение металлов в ряде напряжений для расплавленных солей [364] и в водных электролитах принципиально мало различается между собой. Как и в водных растворах, наиболее отрицательные значения электродных потенциалов имеют щелочные и щелочноземельные металлы более положительные потенциалы имеют сурьма, висмут, медь, ртуть и серебро. Электродные потенциалы одних и тех же металлов в расплавленных хлоридах, бромидах и йодидах сравнительно мало отличаются. Это объяснимо, если считать, что электродные потенциалы металлов в основном определяются, электронным строением атомов, т. е. положением их в периодической системе элементов Д. И. Менделеева. Как и в водных электролитах, электроосаждение металлов из солевых расплавов протекает с поляризацией, однако степень ее значительно меньше, чем в водных растворах. Электролиз расплавленных солей проводится при высоких температурах в электролизерах, обычно имеющих огнеупорную футеровку, диафрагму, отделяющую анодное пространство от катодного. В ряде случаев необходима герметизация электролизера или защитная атмосфера. [c.102]
Это объяснимо, если считать, что электродные потенциалы металлов в основном определяются, электронным строением атомов, т. е. положением их в периодической системе элементов Д. И. Менделеева. Как и в водных электролитах, электроосаждение металлов из солевых расплавов протекает с поляризацией, однако степень ее значительно меньше, чем в водных растворах. Электролиз расплавленных солей проводится при высоких температурах в электролизерах, обычно имеющих огнеупорную футеровку, диафрагму, отделяющую анодное пространство от катодного. В ряде случаев необходима герметизация электролизера или защитная атмосфера. [c.102]
Внутреннее строение атома В1 роднит его не только с мышьяком и сурьмой, что естественно, но и со многими другими металлами. В атоме висмута есть предпоследний 18-электронный слой (слой типа купро ), который характерен для свинца, а также меди и ее аналогов (Ап, Ag). Интересно, что с этими же элементами висмут нередко бывает связан в рудных месторождениях. [c.240]
[c.240]
Мышьяк Аз (5-10 %), сурьма 8Ь (110″ %) и висмут В1 (2-10″ %). Строение электронных оболочек атомов этих элементов отличается от такового для азота и фосфора. Второй снаружи энергетический уровень в атомах мышьяка, сурьмы и висмута содержит 18 электронов (п—1)5 (тг—1)р (/г—1) 1 . В связи со значительным ростом радиусов атомов и уменьшением энергии ионизации атомы этих элементов могут превращаться в положительно заряженные ионы Однако восстановительные свойства их [c.364]
Радиусы атомов рутения (1,30), родия (1,34) и палладия (1,37) больше, чем металлов подгруппы железа, что создает геометрические предпосылки для образования более сложных силицидов. Строение электронных оболочек этих металлов характеризуется заканчивающимся заполнением Л 4с -слоя и началом заполнения (кроме палладия) ОдЗ-слоя. Следующие за ними пять элементов (серебро, кадмий, индий, олово, сурьма) не образуют силицидов, а теллур и йод дают лишь малостойкие соединения с кремнием. Можно предполагать, что теплоты образования и температуры плавления силицидов рассматриваемых металлов должны понижаться от рутения к палладию. Отсутствие соответствующих термодинамических данных о силицидах металлов группы палладия и диаграмм состояния систем Ки—51 и КЬ—51 лишают возможности более подробно выявить имеющиеся здесь закономерности. Судя по диаграмме состояния системы Рс1—51, температуры плавления силицидов рутения и родия должны быть относительно невысокими (едва ли выше 1400—1500°). Все изученные силициды рутения, родия и палладия образуются с уменьшением объема (см. табл. 2). [c.205]
Можно предполагать, что теплоты образования и температуры плавления силицидов рассматриваемых металлов должны понижаться от рутения к палладию. Отсутствие соответствующих термодинамических данных о силицидах металлов группы палладия и диаграмм состояния систем Ки—51 и КЬ—51 лишают возможности более подробно выявить имеющиеся здесь закономерности. Судя по диаграмме состояния системы Рс1—51, температуры плавления силицидов рутения и родия должны быть относительно невысокими (едва ли выше 1400—1500°). Все изученные силициды рутения, родия и палладия образуются с уменьшением объема (см. табл. 2). [c.205]
Больщинство известных химических элементов, находясь в виде простых веществ, представляют собой металлы. Некоторые элементы (германий, мышьяк, сурьма, алюминий) в одних условиях ведут себя как металлы, в других условиях — как неметаллы. Все металлы имеют на внешнем энергетическом уровне небольшое число валентных электронов — электронные конфигурации металлов представлены в табл. I. Повторение химических свойств металлов обусловлено периодическим повторением строения электронных конфигураций внешних электронных уровней. [c.317]
I. Повторение химических свойств металлов обусловлено периодическим повторением строения электронных конфигураций внешних электронных уровней. [c.317]
Ядерный гамма-резонанс (эффект Мессбауэра) позволяет получать ценную информацию о строении электронных оболочек атомов, содержащих мессбауэровские ядра. Существенным недостатком метода является ограниченность числа элементов, практически доступных для исследования. В настоящей работе сделана попытка преодолеть это ограничение, используя результаты мессбауэровских измерений на ядрах 5п 9 и 5Ь 21 атомов олова и сурьмы, входящих в состав соединений, а также на ядрах Ре примесных ато.мов железа в качестве критерия применимости различных подходов при теоретическом расчете эффективных зарядов атомов в соединениях рассматриваемого типа. [c.148]
Валентная электронная конфигурация всех элементов VA-группы— ns np , т. е. на внешнем энергетическом (валентном) уровне они содержат 2 спаренных s-электрона и 3 неспаренных (в соответствии с правилом Гунда) электрона на трехкратно вырожденном р-уровне. Однако между элементами этой группы существуют и различия в электронном строении. Так, у фосфора в отличие от азота впервые появляется вакантный внешний М-уровепь, что обусловливает возможность промотирования одного 35-электрона с образованием пятиковалентного состояния, которое, как известно, отсутствует у азота. У мышьяка, сурьмы и висмута к вакантному -уровню добавляется еще в отличие от фосфора полностью завершенный внутренний (п—1) -уровень, а у висмута, следующего за лентаноидами, кроме того, и 4/ -уровень. [c.282]
Однако между элементами этой группы существуют и различия в электронном строении. Так, у фосфора в отличие от азота впервые появляется вакантный внешний М-уровепь, что обусловливает возможность промотирования одного 35-электрона с образованием пятиковалентного состояния, которое, как известно, отсутствует у азота. У мышьяка, сурьмы и висмута к вакантному -уровню добавляется еще в отличие от фосфора полностью завершенный внутренний (п—1) -уровень, а у висмута, следующего за лентаноидами, кроме того, и 4/ -уровень. [c.282]
Наличие заполненных предвнешних (п—l)d- и (п—2)/-уровней сверх оболочки предыдущего благородного газа накладывает отпечаток на свойства элементов подгруппы мышьяка. Отметим, что между собой мышьяк, сурьма и висмут являются полными электронными аналогами и отличаются с точки зрения электронного строения от типических элементов VA-группы — азота и фосфора, т. е. по отношению к ним являются неполными электронными аналогами. [c.282]
Строение атома хлора обусловливает его сильно выраженные окислительные свойства. Он легко отнимает электроны от атомов других элементов и превращается в отрицательно заряженный ион. Обладая большим сродством к электрону, хлор непосредственно реагирует почти со всеми металлами, причем многие реакции идут очень энергично, с выделением тепла и света. Например, если внести мелко измельченную сурьму в цилиндр, наполненный хлором, она воспламенится [c.196]
Он легко отнимает электроны от атомов других элементов и превращается в отрицательно заряженный ион. Обладая большим сродством к электрону, хлор непосредственно реагирует почти со всеми металлами, причем многие реакции идут очень энергично, с выделением тепла и света. Например, если внести мелко измельченную сурьму в цилиндр, наполненный хлором, она воспламенится [c.196]
Свойства атомов. Сопоставление внутренних электронных остовов, валентных и вакантных подуровней показывает, что различия в физических и химических свойствах элементов обусловлены в основном особенностями строения электронных оболочек атомов (табл. 19.2). Атомы элементов этой подгруппы имеют совпадающие по строению валентные подуровни (пз пр ), различные электронные остовы и вакантные подуровни. Два электрона валентных з-подуровней спарены, три электрона р-подуровней заселяют орбитали этих подуровней по одному. Электронная структура азота выделяется отсутствием вакантных подуровней, энергетически близких к наполовину заполненному 2р-подуровню. У фосфора есть один вакантный с -подуровень, а мышьяк, сурьма и висмут имеют несколько вакантных подуровней, близко расположенных к валентным подуровням. [c.383]
У фосфора есть один вакантный с -подуровень, а мышьяк, сурьма и висмут имеют несколько вакантных подуровней, близко расположенных к валентным подуровням. [c.383]
Исследования элементов при высоких давлениях, кардинальным образом изменяющих строение и степень перекрытия внешних электронных оболочек, привели к обнаружению неизвестных ранее модификаций рубидия, цезия, бария, галлия, индия, таллия, кремния, германия, олова, свинца, сурьмы, висмута, титана, циркония и других элементов. Круг полиморфных металлов расширился настолько, что можно полагать, что в природе вообще не существует элементов, сохраняющих одну и ту же структуру в достаточно широком диапазоне давлений и температур. [c.196]
Подгруппа иьппьяка. Характеристика элементов УА-группы. Валентная электронная конфигурация всех элементов УА-Г1зуппы — пз пр , т.е. на внешнем энергетическом (валентном) уровне они содержат два спаренных -электрона и три неспаренных электрона на трехкратно вырожденном пр-уровне. Однако между элементами этой группы существуют и р личия в электронном строении. У мышьяка, сурьмы и висмута к вакантному пс(-уровню добавляется еще в отличие от фосфора полностью завершенный внутренний (п — 1) -уровень, а у висмута, следующего за лантаноидами, кроме того, и 4/ -уровень. В силу наличия внутренних и /оболочек, экранирующих внешние электроны, в ряду Аз — 8Ь — В1 проявляется вторичная периодичность. В результате этого для среднего элемента ряда — сурьмы — степень окисления +5 оказывается более стабильной, чем для мышьяка и висмута. [c.417]
Однако между элементами этой группы существуют и р личия в электронном строении. У мышьяка, сурьмы и висмута к вакантному пс(-уровню добавляется еще в отличие от фосфора полностью завершенный внутренний (п — 1) -уровень, а у висмута, следующего за лантаноидами, кроме того, и 4/ -уровень. В силу наличия внутренних и /оболочек, экранирующих внешние электроны, в ряду Аз — 8Ь — В1 проявляется вторичная периодичность. В результате этого для среднего элемента ряда — сурьмы — степень окисления +5 оказывается более стабильной, чем для мышьяка и висмута. [c.417]
В результате оба атома образуют ковалентные а-связи с тремя заместителями, например КзАз или Кз5Ь, причем орбитали центрального атома оказываются средними между Зр-орби-талями, требующими угла 90° между связями, и хр -гибридизо-ванными орбиталями, требующими углов около 109,5° [1]. Как и следовало ожидать из электронного строения и по аналогии с такими же соединениями фосфора, соединения трехвалентного мышьяка и сурьмы являются основаниями Льюиса и образуют четвертичные соли. [c.302]
[c.302]
Свойства элементов и простых веществ закономерно изменяются в подгруппе с ростом радиуса атомов и уменьшением энергии ионизации, как это можно видеть из табл. 27. Азот и фосфор — типичные неметаллы, т. е. кислотообразователи. Различия в строении предвнеш-него электронного уровня у атомов фосфора и мышьяка меньше сказываются на изменении свойств элементов, чем при переходе от кремния к германию в IVA-подгруппе. У мышьяка сильнее выражены неметаллические свойства. У сурьмы неметаллические и металлические свойства проявляются приблизительно в одинаковой степени. Для висмута характерно преобладание металлических (основных) свойств. [c.339]
Ион [5Ь(С204) з] образует устойчивые соли. Он, как было установлено, имеет строение неполной пентагональной пирамиды (рис. 17.3), в которой одно из аксиальных положений занимает неподеленная электронная пара. Комплексы трехвалентной сурьмы с винной кислотой подробно изучены и более 300 лет используются в медицине как рвотный камень .
 Структура аниона этой, соли К2[5Ь2( /-С4Н20б)2]-ЗНгО показана на рис. 17.4. [c.350]
Структура аниона этой, соли К2[5Ь2( /-С4Н20б)2]-ЗНгО показана на рис. 17.4. [c.350]Пятикоординационная сурьма обычно имеет тригонально-бипирамидальную координацию. Как уже отмечено выше (см. стр. 96), основные особенности геометрии тригонально-бипира-мидальных молекул хорошо объясняются теорией отталкивания электронных пар. Наиболее характерной чертой является расположение более электроотрицательных заместителей в аксиальных положениях. Такое строение имеют молекулы КзМХ2 и К4МХ, основные геометрические параметры которых приведены в табл. 31. [c.147]
Установлено, что октаэдрическое строение имеет анион [ТеС1б] . Подобно комплексному аниону сурьмы (П1) (см. с. 178) рассматриваемый анион, кроме шести связывающих пар электронов, имеет одну неподеленную пару. Если бы эта пара влияла на геометрию аниона, следовало бы ожидать возникновения искаженной октаэдрической структуры. Тот факт, что эти ионы имеют достаточно правильную форму, является одним из многих, предупреждающих нас не следует рассчитывать, будто теория применима во всех случаях. Следовательно, как и в случае сурьмы, неподеленная пара не влияет на стереохимию, т. е. она должна находиться на s-орби али. Тогда у читателя может возникнуть вопрос, почему для объяснения стереохимии ионов [ТеХз]- учет неподеленной пары был необходим. Простейший ответ состоит в том, что центральный атом стремится иметь возможно более высокую симметрию по отношению к своему электронному окружению на этом основании октаэдрическая конфигурация оказывается предпочтительнее. Однако в следующем разделе (на примере ХеРб) мы увидим, что это утверждение верно не во всех случаях. [c.191]
Следовательно, как и в случае сурьмы, неподеленная пара не влияет на стереохимию, т. е. она должна находиться на s-орби али. Тогда у читателя может возникнуть вопрос, почему для объяснения стереохимии ионов [ТеХз]- учет неподеленной пары был необходим. Простейший ответ состоит в том, что центральный атом стремится иметь возможно более высокую симметрию по отношению к своему электронному окружению на этом основании октаэдрическая конфигурация оказывается предпочтительнее. Однако в следующем разделе (на примере ХеРб) мы увидим, что это утверждение верно не во всех случаях. [c.191]
Фосфор и мышьяк в своих кислородных кислотах и их анионах имеют координационное число четыре, поскольку атомы кислорода расположены вокруг центрального атома тетраэдрически. Иначе ведет себя сурьма, которая проявляет по отношению к кислороду координационное число, равное шести, и атомы кислорода располагаются октаэдрически. Очевидно, строение этих кислородных кислот и их анионов определяется прежде всего координационным числом по отношению к кислороду и соответствующим атомам, а затем электронной конфигурацией (или их валентностью). [c.458]
[c.458]
Sb Информация об элементе сурьмы: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История сурьмы
Элемент Сурьма был обнаружен неизвестными в году. 3000 г. до н.э. в неизвестном месте . Сурьма получил свое название от греческих «anti», «против», и monos, «одинокий» (stibium на латыни).
Присутствие сурьмы: изобилие в природе и вокруг нас
В таблице ниже показано содержание сурьмы во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
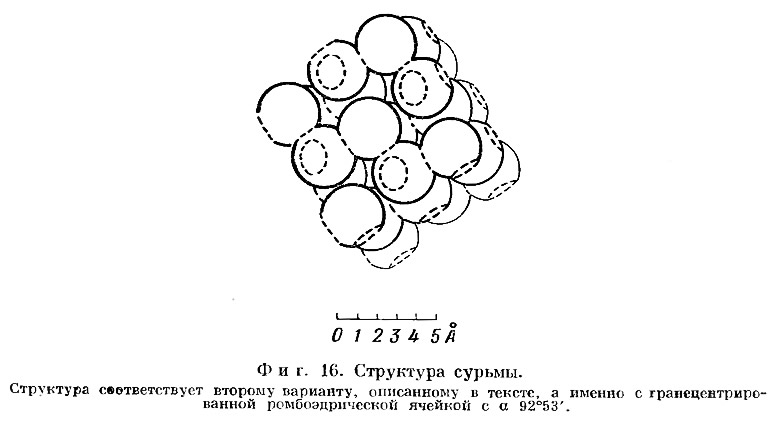
Кристаллическая структура сурьмы
Сурьма имеет твердую структуру Simple Trigonal.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в
три
пространственное пространство для формирования конструкции.
Элементарные ячейки повторяются в
три
пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| а | b | c |
|---|---|---|
| 430.7 | 430,7 | 1127,3 вечера |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | 2 π / 3 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений (
x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства сурьмы
Атомы сурьмы имеют 51 электрон и структура электронной оболочки [2, 8, 18, 18, 5] с символом атомного члена (квантовые числа) 4 S 3/2 .
Оболочечная структура сурьмы – количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 6 | 10 | |
| 4 | N | 2 | 6 | 10 | |
| 5 | O | 2 | 3 |
Основное состояние электронной конфигурации сурьмы – нейтральный Атом сурьмы
Электронная конфигурация нейтрального атома сурьмы в основном состоянии
[Кр] 4д10 5с2 5п3. Часть конфигурации сурьмы, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается [Kr]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 4d10 5s2 5p3, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации сурьмы, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается [Kr]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 4d10 5s2 5p3, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтральной Сурьмы
Полная электронная конфигурация основного состояния для атома сурьмы, несокращенная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d10 4с2 4п6 4д10 5с2 5п3
Атомная структура сурьмы
Атомный радиус сурьмы 133 пм, а его ковалентный радиус 138 пм.
Атомный спектр сурьмы
Химические свойства сурьмы: Энергии ионизации сурьмы и сродство к электрону
Сродство к электрону сурьмы составляет 103,2 кДж / моль.
Энергия ионизации сурьмы
Энергия ионизации сурьмы
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 834 |
| 2 | 1594.9 |
| 3 | 2440 |
| 4 | 4260 |
| 5 | 5,4 × 103 |
| 6 | 1,04 × 104 |
Физические свойства сурьмы
Физические свойства сурьмы см. В таблице ниже.
| Плотность | 6. 697 г / см3 697 г / см3 |
| Молярный объем | 18.1812751978 см3 |
Эластичные свойства
Твердость сурьмы – Испытания для измерения твердости элемента
Электрические свойства сурьмы
Сурьма – проводник электричества. Ссылаться на Таблица ниже электрические свойства сурьмы
Теплопроводность и теплопроводность сурьмы
Магнитные свойства сурьмы
Оптические свойства сурьмы
Акустические свойства сурьмы
Термические свойства сурьмы – энтальпии и термодинамика
Термические свойства сурьмы
см. В таблице ниже.Энтальпия сурьмы
Изотопы сурьмы – ядерные свойства сурьмы
Изотопы родия. Встречающаяся в природе сурьма имеет
2 стабильных изотопа –
121Сб, 123Сб.
Встречающаяся в природе сурьма имеет
2 стабильных изотопа –
121Сб, 123Сб.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 103Сб | ||||
| 104Сб | ||||
| 105Сб | ||||
| 106Сб | ||||
| 107Сб | ||||
| 108Сб | ||||
| 109Сб | ||||
| 110Сб | ||||
| 111Сб | ||||
| 112Сб | ||||
| 113Сб | ||||
| 114Сб | ||||
| 115Сб | ||||
| 116Сб | ||||
| 117Сб | ||||
| 118Сб | ||||
| 119Сб | ||||
| 120Сб | ||||
| 121Сб | 57. 21% 21% | Стабильный | Нет данных | |
| 122Сб | ||||
| 123Сб | 42. 79% 79% | Стабильный | Нет данных | |
| 124Сб | ||||
| 125Сб | ||||
| 126Сб | ||||
| 127Сб | ||||
| 128Сб | ||||
| 129Сб | ||||
| 130Сб | ||||
| 131Сб | ||||
| 132Сб | ||||
| 133Сб | ||||
| 134Сб | ||||
| 135Сб | ||||
| 136Сб | ||||
| 137Сб | ||||
| 138Сб | ||||
| 139Сб |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Sb Информация об элементе сурьмы: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История сурьмы
Элемент Сурьма был обнаружен неизвестными в году. 3000 г. до н.э. в неизвестном месте
.Сурьма
получил свое название от греческих «anti», «против», и monos, «одинокий» (stibium на латыни).
3000 г. до н.э. в неизвестном месте
.Сурьма
получил свое название от греческих «anti», «против», и monos, «одинокий» (stibium на латыни).
Присутствие сурьмы: изобилие в природе и вокруг нас
В таблице ниже показано содержание сурьмы во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура сурьмы
Сурьма имеет твердую структуру Simple Trigonal.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| а | b | c |
|---|---|---|
430. 7 7 | 430,7 | 1127,3 вечера |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | 2 π / 3 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства сурьмы
Атомы сурьмы имеют 51 электрон и структура электронной оболочки [2, 8, 18, 18, 5] с символом атомного члена (квантовые числа) 4 S 3/2 .
Оболочечная структура сурьмы – количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 6 | 10 | |
| 4 | N | 2 | 6 | 10 | |
| 5 | O | 2 | 3 |
Основное состояние электронной конфигурации сурьмы – нейтральный Атом сурьмы
Электронная конфигурация нейтрального атома сурьмы в основном состоянии
[Кр] 4д10 5с2 5п3. Часть конфигурации сурьмы, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается [Kr]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 4d10 5s2 5p3, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации сурьмы, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается [Kr]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 4d10 5s2 5p3, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтральной Сурьмы
Полная электронная конфигурация основного состояния для атома сурьмы, несокращенная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d10 4с2 4п6 4д10 5с2 5п3
Атомная структура сурьмы
Атомный радиус сурьмы 133 пм, а его ковалентный радиус 138 пм.
Атомный спектр сурьмы
Химические свойства сурьмы: Энергии ионизации сурьмы и сродство к электрону
Сродство к электрону сурьмы составляет 103,2 кДж / моль.
Энергия ионизации сурьмы
Энергия ионизации сурьмы
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 834 |
| 2 | 1594.9 |
| 3 | 2440 |
| 4 | 4260 |
| 5 | 5,4 × 103 |
| 6 | 1,04 × 104 |
Физические свойства сурьмы
Физические свойства сурьмы см. В таблице ниже.
| Плотность | 6. 697 г / см3 697 г / см3 |
| Молярный объем | 18.1812751978 см3 |
Эластичные свойства
Твердость сурьмы – Испытания для измерения твердости элемента
Электрические свойства сурьмы
Сурьма – проводник электричества. Ссылаться на Таблица ниже электрические свойства сурьмы
Теплопроводность и теплопроводность сурьмы
Магнитные свойства сурьмы
Оптические свойства сурьмы
Акустические свойства сурьмы
Термические свойства сурьмы – энтальпии и термодинамика
Термические свойства сурьмы
см. В таблице ниже.Энтальпия сурьмы
Изотопы сурьмы – ядерные свойства сурьмы
Изотопы родия. Встречающаяся в природе сурьма имеет
2 стабильных изотопа –
121Сб, 123Сб.
Встречающаяся в природе сурьма имеет
2 стабильных изотопа –
121Сб, 123Сб.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 103Сб | ||||
| 104Сб | ||||
| 105Сб | ||||
| 106Сб | ||||
| 107Сб | ||||
| 108Сб | ||||
| 109Сб | ||||
| 110Сб | ||||
| 111Сб | ||||
| 112Сб | ||||
| 113Сб | ||||
| 114Сб | ||||
| 115Сб | ||||
| 116Сб | ||||
| 117Сб | ||||
| 118Сб | ||||
| 119Сб | ||||
| 120Сб | ||||
| 121Сб | 57. 21% 21% | Стабильный | Нет данных | |
| 122Сб | ||||
| 123Сб | 42. 79% 79% | Стабильный | Нет данных | |
| 124Сб | ||||
| 125Сб | ||||
| 126Сб | ||||
| 127Сб | ||||
| 128Сб | ||||
| 129Сб | ||||
| 130Сб | ||||
| 131Сб | ||||
| 132Сб | ||||
| 133Сб | ||||
| 134Сб | ||||
| 135Сб | ||||
| 136Сб | ||||
| 137Сб | ||||
| 138Сб | ||||
| 139Сб |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Sb Информация об элементе сурьмы: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История сурьмы
Элемент Сурьма был обнаружен неизвестными в году.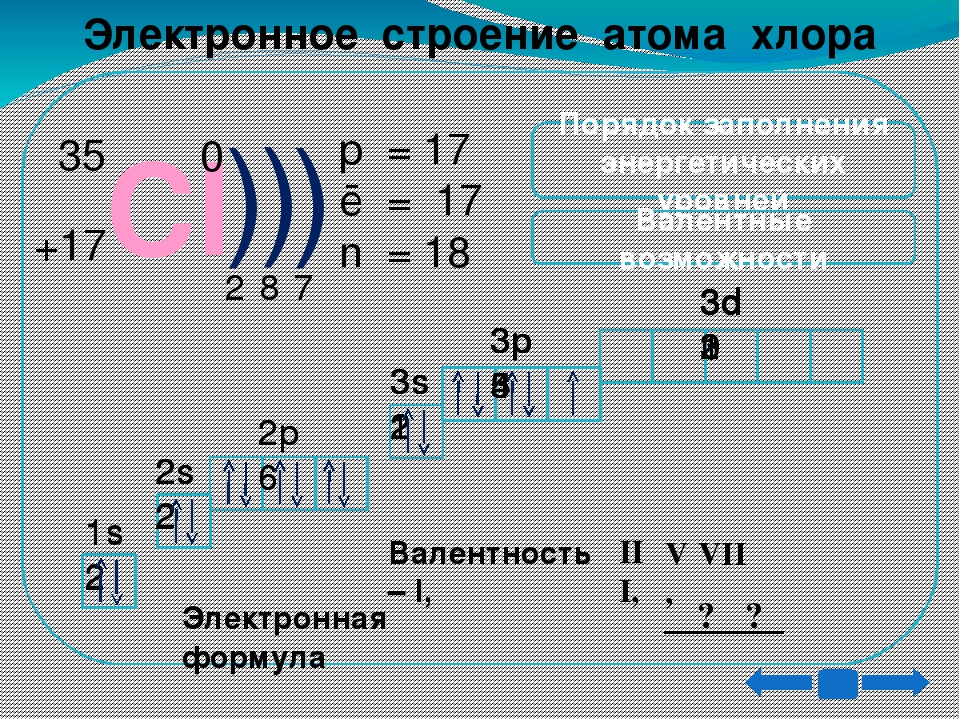 3000 г. до н.э. в неизвестном месте
.Сурьма
получил свое название от греческих «anti», «против», и monos, «одинокий» (stibium на латыни).
3000 г. до н.э. в неизвестном месте
.Сурьма
получил свое название от греческих «anti», «против», и monos, «одинокий» (stibium на латыни).
Присутствие сурьмы: изобилие в природе и вокруг нас
В таблице ниже показано содержание сурьмы во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура сурьмы
Сурьма имеет твердую структуру Simple Trigonal.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| а | b | c |
|---|---|---|
430. 7 7 | 430,7 | 1127,3 вечера |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | 2 π / 3 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства сурьмы
Атомы сурьмы имеют 51 электрон и структура электронной оболочки [2, 8, 18, 18, 5] с символом атомного члена (квантовые числа) 4 S 3/2 .
Оболочечная структура сурьмы – количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 6 | 10 | |
| 4 | N | 2 | 6 | 10 | |
| 5 | O | 2 | 3 |
Основное состояние электронной конфигурации сурьмы – нейтральный Атом сурьмы
Электронная конфигурация нейтрального атома сурьмы в основном состоянии
[Кр] 4д10 5с2 5п3. Часть конфигурации сурьмы, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается [Kr]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 4d10 5s2 5p3, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации сурьмы, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается [Kr]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 4d10 5s2 5p3, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтральной Сурьмы
Полная электронная конфигурация основного состояния для атома сурьмы, несокращенная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d10 4с2 4п6 4д10 5с2 5п3
Атомная структура сурьмы
Атомный радиус сурьмы 133 пм, а его ковалентный радиус 138 пм.
Атомный спектр сурьмы
Химические свойства сурьмы: Энергии ионизации сурьмы и сродство к электрону
Сродство к электрону сурьмы составляет 103,2 кДж / моль.
Энергия ионизации сурьмы
Энергия ионизации сурьмы
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 834 |
| 2 | 1594.9 |
| 3 | 2440 |
| 4 | 4260 |
| 5 | 5,4 × 103 |
| 6 | 1,04 × 104 |
Физические свойства сурьмы
Физические свойства сурьмы см. В таблице ниже.
| Плотность | 6.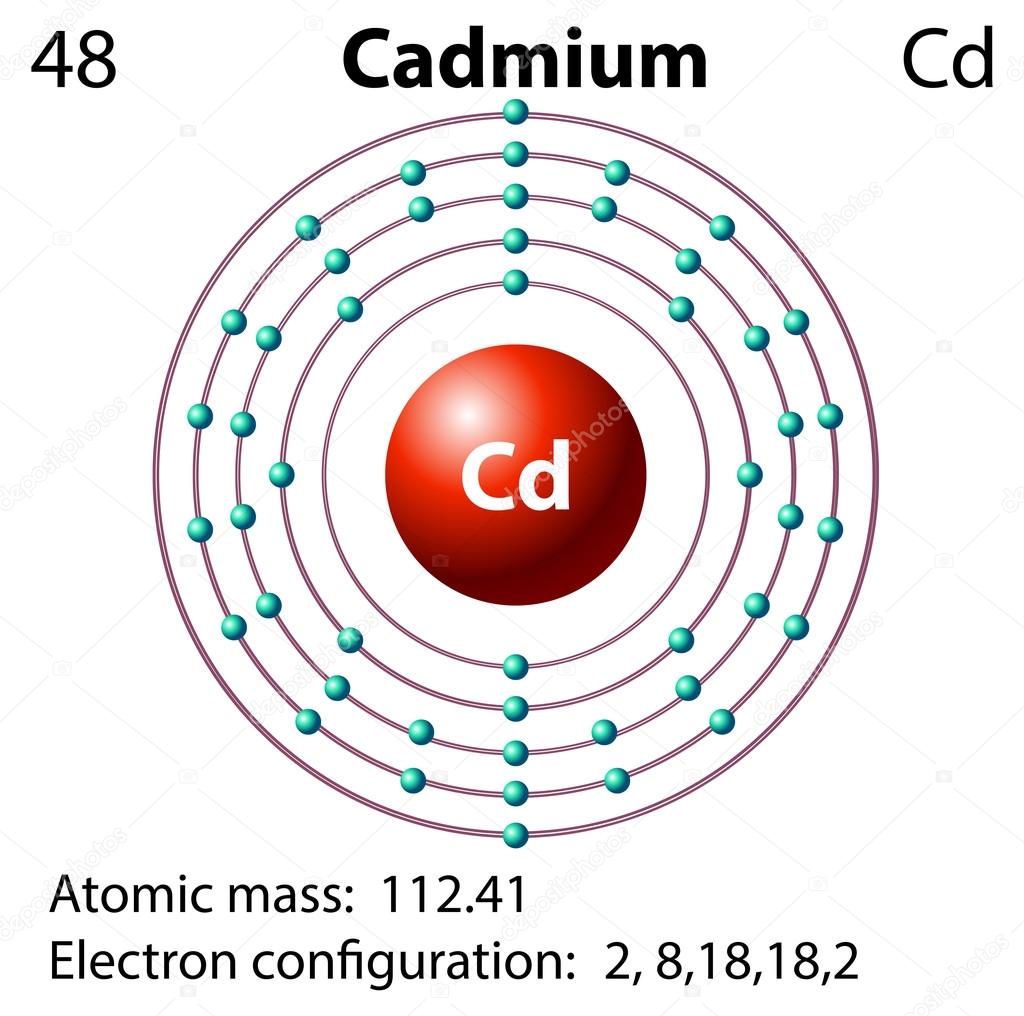 697 г / см3 697 г / см3 |
| Молярный объем | 18.1812751978 см3 |
Эластичные свойства
Твердость сурьмы – Испытания для измерения твердости элемента
Электрические свойства сурьмы
Сурьма – проводник электричества. Ссылаться на Таблица ниже электрические свойства сурьмы
Теплопроводность и теплопроводность сурьмы
Магнитные свойства сурьмы
Оптические свойства сурьмы
Акустические свойства сурьмы
Термические свойства сурьмы – энтальпии и термодинамика
Термические свойства сурьмы
см. В таблице ниже.Энтальпия сурьмы
Изотопы сурьмы – ядерные свойства сурьмы
Изотопы родия. Встречающаяся в природе сурьма имеет
2 стабильных изотопа –
121Сб, 123Сб.
Встречающаяся в природе сурьма имеет
2 стабильных изотопа –
121Сб, 123Сб.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 103Сб | ||||
| 104Сб | ||||
| 105Сб | ||||
| 106Сб | ||||
| 107Сб | ||||
| 108Сб | ||||
| 109Сб | ||||
| 110Сб | ||||
| 111Сб | ||||
| 112Сб | ||||
| 113Сб | ||||
| 114Сб | ||||
| 115Сб | ||||
| 116Сб | ||||
| 117Сб | ||||
| 118Сб | ||||
| 119Сб | ||||
| 120Сб | ||||
| 121Сб | 57. 21% 21% | Стабильный | Нет данных | |
| 122Сб | ||||
| 123Сб | 42.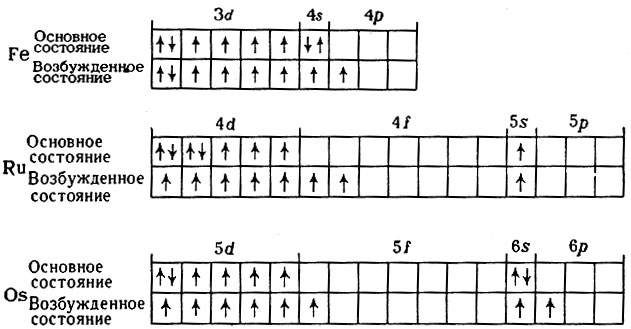 79% 79% | Стабильный | Нет данных | |
| 124Сб | ||||
| 125Сб | ||||
| 126Сб | ||||
| 127Сб | ||||
| 128Сб | ||||
| 129Сб | ||||
| 130Сб | ||||
| 131Сб | ||||
| 132Сб | ||||
| 133Сб | ||||
| 134Сб | ||||
| 135Сб | ||||
| 136Сб | ||||
| 137Сб | ||||
| 138Сб | ||||
| 139Сб |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Сурьма – информация об элементе, свойства и использование
Вы слушаете химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.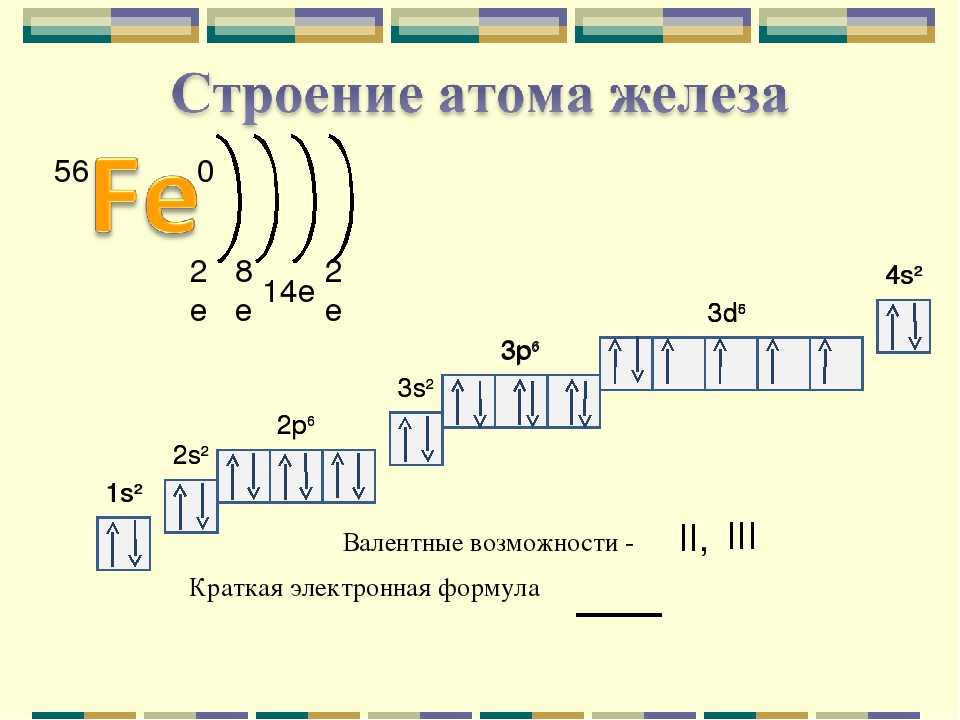
Здравствуйте, на этой неделе мы знакомимся с химическим веществом, которое искалечили и убили, но часто из лучших побуждений. Чтобы рассказать историю элемента, который не может решить, металл это или нет, вот Фил Болл.
Фил Болл
Многие войны велись из-за территории, некоторые из-за гордости, любви или денег. Но в 1600-х годах из-за сурьмы велась долгая и жестокая война.
Что, спросите вы, есть за что бороться в этом внешне ничем не примечательном элементе, мягком сероватом металле, который даже не проводит электричество достаточно хорошо, чтобы считаться настоящим металлом? У него есть свои применения, но они повседневные: в качестве компонента сплава аккумуляторных электродов и олова, а также в качестве антипирена.
Но в основе войны с сурьмой, которая бушевала во Франции и Германии на протяжении большей части семнадцатого века, было более маловероятное использование сурьмы. Некоторые врачи того возраста считали, что это жизненно важный ингредиент в медицине. Сторонники и противники этой точки зрения на самом деле не брались за оружие: они дрались пером в руке, иногда осуждая друг друга в выражениях, гораздо более яростных, чем мы находим в современной академической литературе.
Сторонники и противники этой точки зрения на самом деле не брались за оружие: они дрались пером в руке, иногда осуждая друг друга в выражениях, гораздо более яростных, чем мы находим в современной академической литературе.
Очень любопытно, что предметом спора должна быть сурьма, ведь этот элемент на самом деле довольно токсичен, вызывая поражение печени в достаточно больших дозах.Но фармацевтическое использование сурьмы имеет долгую историю. В древнем мире он был известен прежде всего как черная сульфидная руда, называемая стибнитом, которую греческий врач Диоскорид рекомендовал при кожных заболеваниях в первом веке нашей эры. Между тем египтяне использовали стибнит в качестве косметического средства, применяя его в качестве туши для ресниц. Они назвали его kuhl , что означает «краска для глаз», и для более поздних исламских врачей-алхимиков это стало al-kohl . Исходя из своего первоначального значения порошкового стибнита, этот термин стал обозначать любой порошок, а затем мощный экстракт любого вещества. В начале шестнадцатого века швейцарский врач-алхимик Парацельс назвал дистиллированный винный экстракт alcool vini , откуда мы и получили современное слово алкоголь: долгий и странный путь от макияжа глаз до опьяняющего напитка.
В начале шестнадцатого века швейцарский врач-алхимик Парацельс назвал дистиллированный винный экстракт alcool vini , откуда мы и получили современное слово алкоголь: долгий и странный путь от макияжа глаз до опьяняющего напитка.
Парацельс особенно любил соединения сурьмы в качестве лекарств. После его смерти многие врачи в Европе, особенно во Франции, отстаивали химическую медицину Парацельса, и некоторые из них сделали сурьму своим самым ценным средством. Один из них, немецкий соледователь, писавший под вымышленным лицом монаха пятнадцатого века по имени Василий Валентин, опубликовал целую книгу, рекламирующую сурьмяные средства в 1604 году, под названием Триумфальная колесница сурьмы .Валентин признал, что сурьма ядовита – на самом деле он дал апокрифическое объяснение названию, сказав, что оно происходит от anti-monachos , что означает «антимонах» на латыни, потому что однажды он случайно отравил нескольких своих собратьев-монахов, добавив это тайно к их пище в попытке улучшить свое здоровье. Но он утверждал, что алхимию можно использовать, чтобы освободить металл от его токсических эффектов и сделать его «самым полезным лекарством».
Но он утверждал, что алхимию можно использовать, чтобы освободить металл от его токсических эффектов и сделать его «самым полезным лекарством».
Парацельсовским врачам-химикам противостояли традиционалисты, которые предпочитали медицинские теории древних врачей, таких как Гиппократ, основанные на идее, что наше здоровье контролируется балансом четырех юморов.Отчасти это была битва за академическую власть, но соперничающие лагеря также разделились по религиозным и политическим мотивам. Таким образом, борьба была очень важна, и какое-то время она кристаллизовалась вокруг медицинской ценности сурьмы.
Токсичность сурьмы может вызвать рвоту, но ее сторонники считали это хорошо. Они вводили солевой раствор тартрата сурьмы как так называемое рвотное средство, вызывающее рвоту, которое, как полагали, очищало организм от других вредных веществ.
Некоторые врачи продолжали беспрепятственно прописывать сурьму после безрезультатной войны с сурьмой, и было высказано предположение, что именно любовь к сурьмянистым препаратам на самом деле убила Моцарта в 1791 году.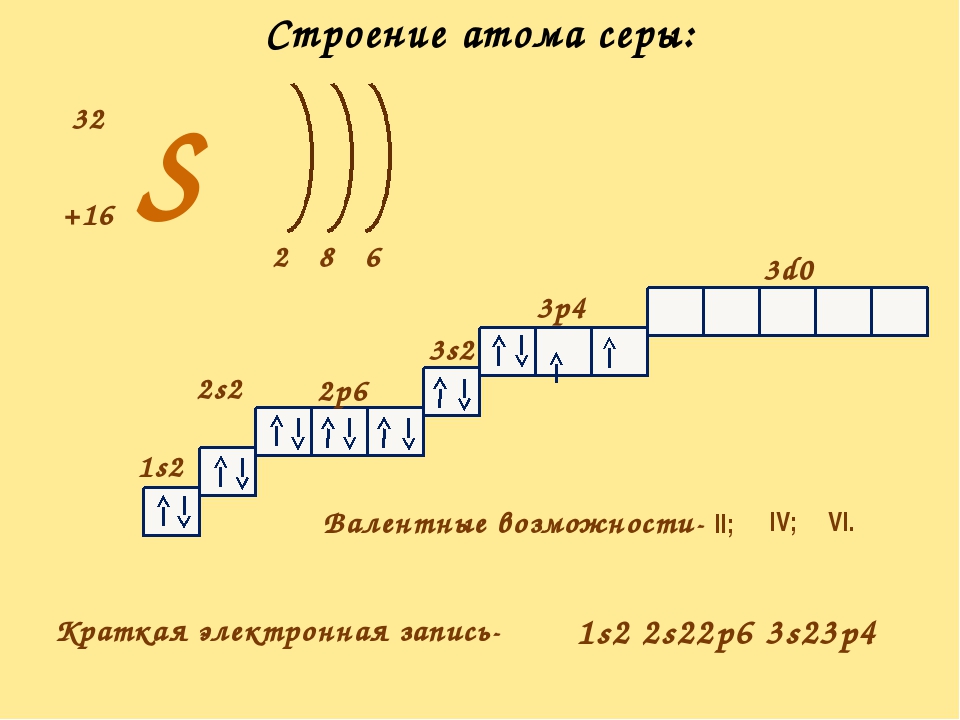 К девятнадцатому веку он стал излюбленным медленным ядом убийц, стремящихся скрыть свои преступления – химический злодей, почти столь же известный, как свинец.
К девятнадцатому веку он стал излюбленным медленным ядом убийц, стремящихся скрыть свои преступления – химический злодей, почти столь же известный, как свинец.
Крис Смит
Но был бы Моцарт таким маэстро, каким он был, без помощи сурьмы? Думаю, мы никогда не узнаем. Большое спасибо писателю и писателю Филу Боллу. На следующей неделе мы расскажем об элементе, который когда-то буквально поддерживал мир, но не совсем так, как вы могли бы подумать.
Джон Эмсли
Летом 1618 года Англию охватила засуха, но когда Генри Уикер шел по Эпсом-Коммон, он наткнулся на лужу с водой, из которой жаждущий скот отказывался пить. Он обнаружил, что вода горькая на вкус и при испарении выделяется соль, оказывающая замечательное действие: она действует как слабительное. Это стало знаменитой английской солью (сульфат магния, MgSO 4 ) и использовалось для лечения запора на следующие 350 лет.
Крис Смит
350 лет, безусловно, звучит как тяжелый случай запора.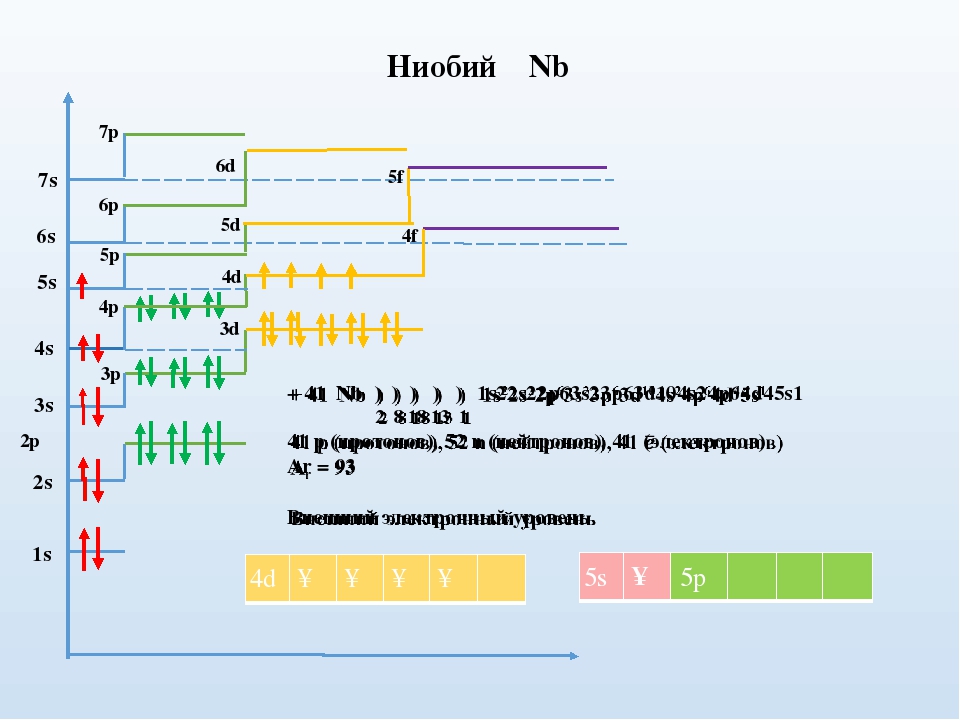 К счастью, Джон Эмсли будет гладко проходить через элемент с атомным номером 12, и это магний в химии на следующей неделе в его элементе, я надеюсь, вы сможете присоединиться к нам. Я Крис Смит, спасибо за внимание, увидимся в следующий раз.
К счастью, Джон Эмсли будет гладко проходить через элемент с атомным номером 12, и это магний в химии на следующей неделе в его элементе, я надеюсь, вы сможете присоединиться к нам. Я Крис Смит, спасибо за внимание, увидимся в следующий раз.
(Промо)
(Конец промо)
WebElements Periodic Table »Сурьма» свойства свободных атомов
Атомы сурьмы имеют 51 электрон, а структура оболочки – 2.8.18.18.5.
Электронная конфигурация основного состояния газообразной нейтральной сурьмы в основном состоянии – это [ Kr ]. 4д 10 . 5с 2 . 5p 3 , а символ термина – 4 S 3/2 .
Схема электронной конфигурации сурьмы. Оболочечная структура Косселя сурьмы.Атомный спектр
Представление атомного спектра сурьмы.
Энергии ионизации и сродство к электрону
Электронное сродство сурьмы составляет 103,2 кДж / моль ‑1 . Энергии ионизации сурьмы приведены ниже.
Энергии ионизации сурьмы.Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды “Клементи-Раймонди”, Z eff . Для получения более подробной информации и графиков в различных форматах перейдите по гиперссылкам.
| 1с | 49.97 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 37,60 | 2-пол. | 46,87 | ||||
| 3с | 33,21 | 3 пол. | 33,18 | 3d | 36,80 | ||
| 4с | 23,54 | 4 пол | 22,18 | 4д | 18,97 | 4f | (нет данных) |
| 5с | 11,61 | 5p | 9.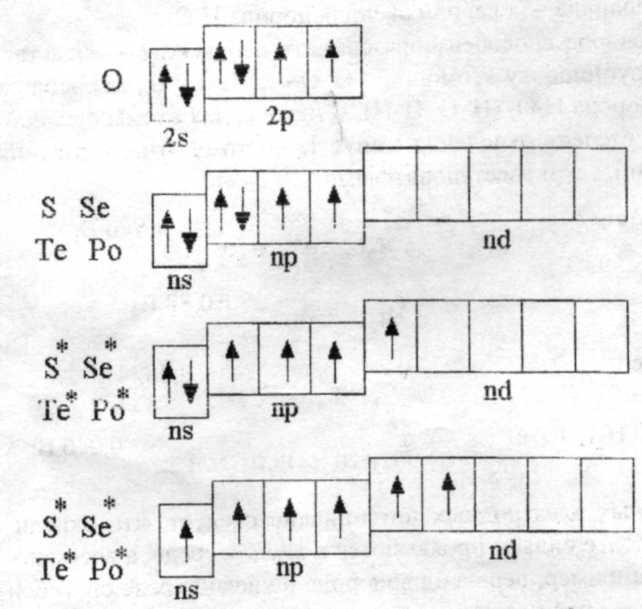 99 99 | 5d | (нет данных) | ||
| 6s | (нет данных) | 6p | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- ,
- E. Clementi и D.L.Raimondi, J. Chem. Phys. 1963, 38, , 2686.
- Э. Клементи, Д.Л. Раймонди и В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальная | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 30491 [1] |
| L I | 2s | 4698 [1] |
| L II | 2p 1/2 | 4380 [1] |
| L III | 2p 3/2 | 4132 [1] |
| M I | 3s | 940 [3] |
| M II | 3 пол. 1/2 | 812.7 [3] |
| M III | 3p 3/2 | 766,4 [3] |
| M IV | 3d 3/2 | 537,5 [3] |
| M V | 3d 5/2 | 528,2 [3] |
| N I | 4s | 153,2 [3] |
| N II | 4p 1 / 2 | 95,6 [3, одночастичное приближение недопустимо из-за короткого срока службы сердечника] |
| N III | 4p 3/2 | 95.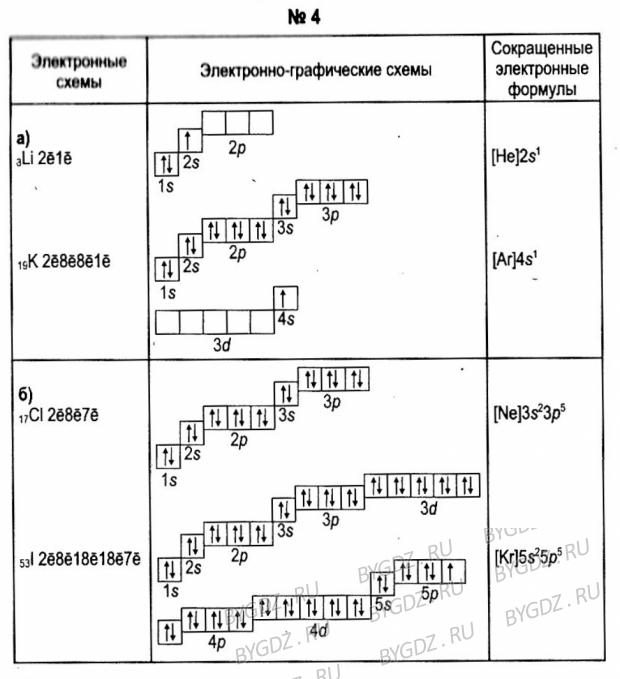 6 [3, одночастичное приближение недействительно из-за короткого срока службы сердечника] 6 [3, одночастичное приближение недействительно из-за короткого срока службы сердечника] |
| N IV | 4d 3/2 | 33,3 [3] |
| N V | 4d 5/2 | 32,1 [3] |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электронов. Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev. Mod. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: Общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- Д. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.

- J. C. Fuggle и N. Mårtensson, “Энергии связи на уровне ядра в металлах”, J. Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
валентных электронов сурьмы | Точечная диаграмма
валентности сурьмы (Sb)Изучите валентные электроны сурьмы здесь и расширите свои знания по химии. Вы также можете проверить другую информацию об элементе. Сурьма – химический элемент на языке химии. Он использует атомный номер 51 и символ Sb.Сурьма принадлежит к семейству металлоидов периодической таблицы. следовательно, он обладает как металлическими, так и неметаллическими свойствами. Он выглядит как сплошной блестящий металл сероватого цвета с метаглоидными характеристиками.
Сколько валентных электронов у сурьмы?
Сурьма практически не имеет свободной формы, поскольку она содержится в сульфидных минералах. Следовательно, вы можете рассматривать его как побочный продукт процесса извлечения сульфида.
Итак, являясь металлоидным элементом, сурьма доступна как в порошковой, так и в металлической форме. Порошковая форма в основном используется при производстве нескольких лекарственных средств в фармацевтической сфере. В настоящее время Китай является крупнейшим производителем сурьмы в мире. Страна производит и экспортирует большую часть сурьмы в мир.
Порошковая форма в основном используется при производстве нескольких лекарственных средств в фармацевтической сфере. В настоящее время Китай является крупнейшим производителем сурьмы в мире. Страна производит и экспортирует большую часть сурьмы в мир.
Сурьма обладает высокими огнезащитными свойствами, поэтому ее можно использовать с такими приборами. Около 60% сурьмы используется в производстве огнестойких приборов. Кроме того, остальную сурьму можно использовать в сплавах как чистый металлический элемент.Этот элемент увеличивает силу твердости сплавов, чтобы сделать их прочнее.
Точечная диаграмма электронов валентности сурьмыВзгляните на валентные электроны сурьмы с нашей точечной диаграммой Льюиса. Схема объясняет взаимодействие валентных электронов атомов.
Это также полезно для изображения химической связи валентных электронов. Вы можете легко понять количество и связь валентных электронов сурьмы на диаграмме.
Валентность сурьмы Точная валентность сурьмы равна 5, поскольку она содержит 5 валентных электронов на своей внешней оболочке. Сурьма является элементом семейства азота, поэтому она находится ниже фосфора.
Сурьма является элементом семейства азота, поэтому она находится ниже фосфора.
Периодическая таблица в KnowledgeDoor
Ссылки (Щелкните рядом со значением выше, чтобы просмотреть полную информацию о цитировании этой записи)
Олбрайт, Томас А. и Джереми К. Бёрдетт. Проблемы теории молекулярных орбиталей. Нью-Йорк: Oxford University Press, 1992.
Аллен, Лиланд К. «Электроотрицательность – это средняя энергия одного электрона валентной оболочки в свободных атомах в основном состоянии.”Журнал Американского химического общества, том 111, номер 25, 1989 г., стр. 9003–9014. Doi: 10.1021 /
Allred, AL” Значения электроотрицательности по термохимическим данным. “Журнал неорганической и ядерной химии, том 17, номер 3-4, 1961, стр. 215–221. doi: 10.1016 /
Оллред, А.Л. и Э.Г. Рохов. «Шкала электроотрицательности, основанная на электростатической силе. “Журнал неорганической и ядерной химии”, том 5, номер 4, 1958 г. , стр.264–268. DOI: 10.1016 /
, стр.264–268. DOI: 10.1016 /
Андерс, Эдвард и Николас Гревесс. «Изобилие элементов: метеоритное и солнечное». Geochimica et Cosmochimica Acta, том 53, номер 1, 1989 г., стр. 197–214. DOI: 10.1016 / -X
Андерсен Т., Х. К. Хауген и Х. Хотоп. “Энергии связи в атомной Отрицательные ионы: III. “Journal of Physical and Chemical Reference Data, том 28, номер 6, 1999 г., стр. 1511–1533.
Ball, David W.”Элементная этимология: что в имени?” Журнал химического образования, том 62, номер 9, 1985 г., стр. 787–788. DOI: 10.1021 /
Барсан, Майкл Э., редактор. Карманный справочник NIOSH по химической опасности. Цинциннати, Огайо: NIOSH Publications, 2007.
Batsanov, S. S. “Ван-дер-Ваальсовые радиусы элементов”. Неорганические материалы, том 37, номер 9, 2001 г., стр. 871–885. См. Реферат
Бедфорд, Р. Э., Дж. Боннье, Х. Маас и Ф. Павезе. «Рекомендуемые значения температуры по международной температурной шкале 1990 г. для выбранного набора вторичных контрольных точек.”Metrologia, volume 33, number 2, 1996, pp. 133–154. DOI: 10.1088 /
для выбранного набора вторичных контрольных точек.”Metrologia, volume 33, number 2, 1996, pp. 133–154. DOI: 10.1088 /
Bowen, HJM Environment Chemistry of the Elements. Лондон. : Academic Press, Inc., 1979.
Братч, Стивен Г. «Пересмотренные электроотрицательности Малликена: I. Расчет и преобразование в единицы Полинга». Журнал химического образования, том 65, номер 1, 1988, стр. 34–41. doi: 10.1021 /
Кэмпбелл, Дж. Л. «Выходы флуоресценции и вероятности Костера – Кронига для атомных L-подоболочек.”Атомные данные и таблицы ядерных данных, том 85, номер 2, 2003 г., стр. 291–315. Doi: 10.1016 /
Кардарелли, Франсуа. Справочник по материалам: краткий справочник на рабочем столе” , 2-е издание. Лондон: Springer – Verlag, 2008.
Clementi, E., DL Raimondi и WP Reinhardt. “Atomic Screening”
Константы из функций SCF. II. Атомы с 37 до 86 электронов ».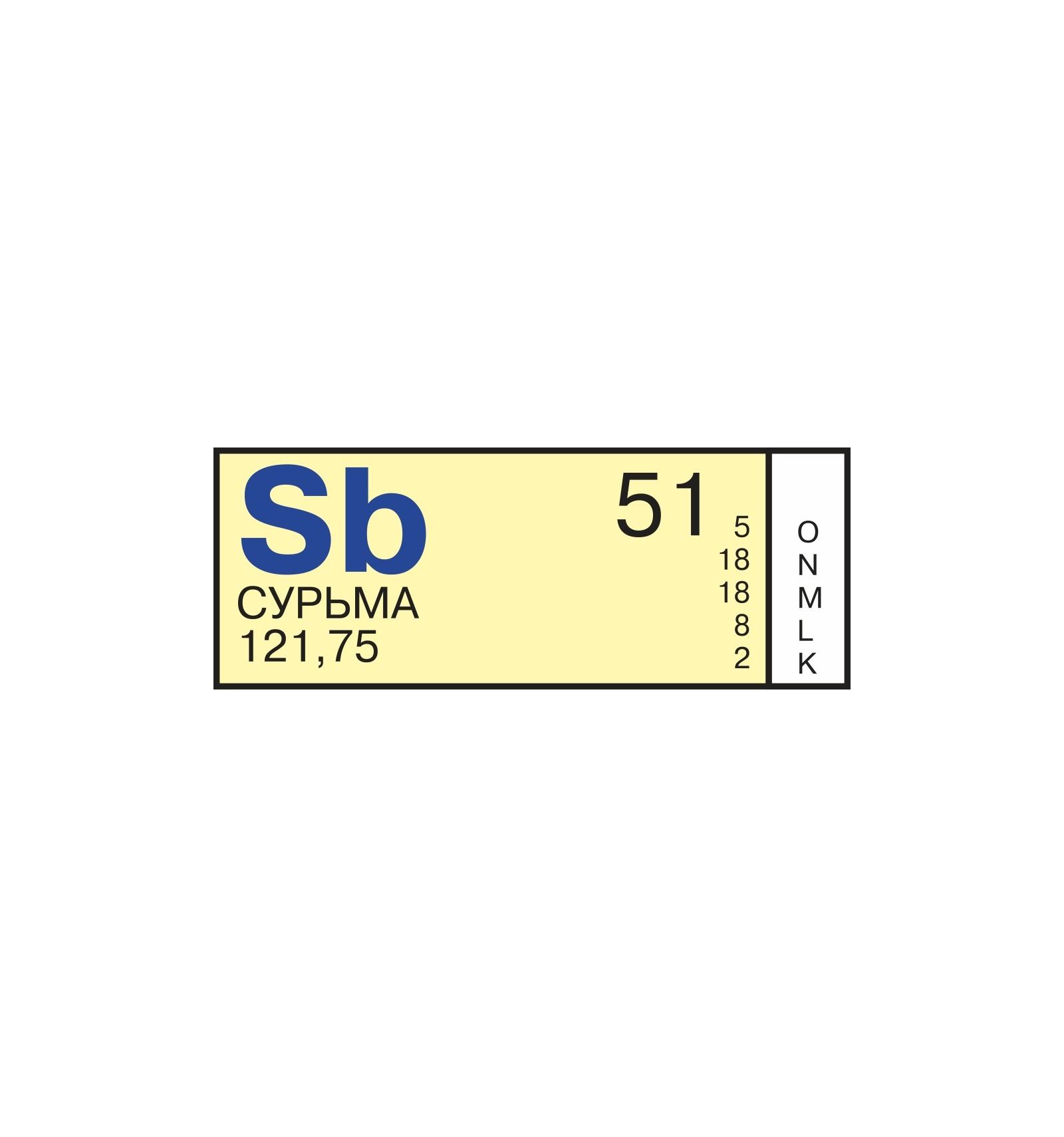 Журнал химической физики, том 47, номер 4, 1967, стр. 1300–1307. Doi: 10.1063 /
Журнал химической физики, том 47, номер 4, 1967, стр. 1300–1307. Doi: 10.1063 /
Коэн, Э. Ричард, Дэвид Р. Лид и Джордж Л. Тригг, редакторы. Настольный справочник по физике AlP, 3-е издание. Нью-Йорк: Springer-Verlag New York, Inc., 2003.
Коннелли, Нил Г., Туре Дамхус, Ричард М. Хартсхорн и Алан Т. Хаттон. Номенклатура неорганической химии: Рекомендации IUPAC 2005. Кембридж: RSC Publishing, 2005.
Кордеро, Беатрис, Вероника Гомес, Ана Э. Платеро-Пратс, Марк Ревес, Хорхе Эчеверрия, Эдуард Кремадес, Флавия Барраган и Сантьяго Альварес.«Ковалентные радиусы еще раз». Dalton Transactions, номер 21, 2008 г., стр. 2832–2838. DOI: 10.1039 /
де Подеста, Майкл. Понимание свойств материи, 2-е издание. Лондон: Тейлор и Фрэнсис, 2002.
Дебессай, М., Дж. Дж. Хэмлин и Дж. С. Шиллинг. «Сравнение зависимостей Tc от давления в трехвалентных d-электронных сверхпроводниках Sc, Y, La и Lu до мегабарных давлений». Physical Review B, том 78, номер 6, 2008 г.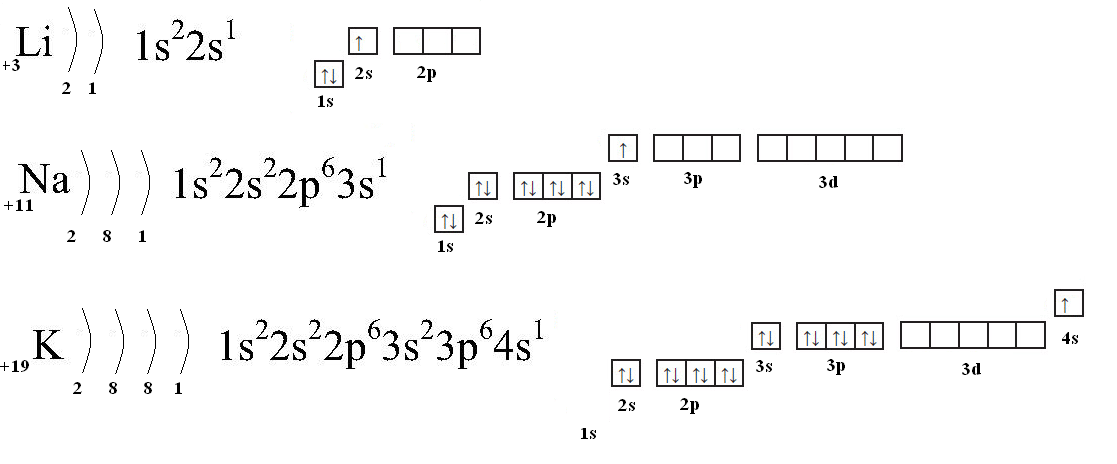 , стр. С 064519–1 по 064519–10.DOI: 10.1103 /
, стр. С 064519–1 по 064519–10.DOI: 10.1103 /
Донохью, Джерри. Структуры элементов, 2-е издание. Малабар, Флорида: издательство Robert E. Krieger Publishing Company, 1974.
Дронсковски, Ричард. Вычислительная химия твердотельных материалов. Вайнхайм, Германия: WILEY-VCH Verlag GmbH & Co. KGaA, 2005.
Эббинг, Даррелл Д. и Стивен Д. Гаммон. Общая химия, 8-е издание. Бостон, Массачусетс: Компания Houghton Mifflin, 2005.
Эмсли, Джон. Строительные блоки природы: руководство по элементам от А до Я.Оксфорд: Издательство Оксфордского университета, 2003.
Эмсли, Джон. Элементы, 3-е издание. Oxford: Oxford University Press, 1998.
Файерстоун, Ричард Б. Таблица изотопов, 8-е издание, том 2. Под редакцией Вирджинии С. Ширли, с помощниками редакторов Корал М. Баглин, С. Ю. Фрэнк Чу и Джин Зипкин. Нью-Йорк: John Wiley & Sons, Inc., 1996.
Галассо, Фрэнсис С. Структура и свойства неорганических твердых тел. Oxford: Pergamon Press, 1970.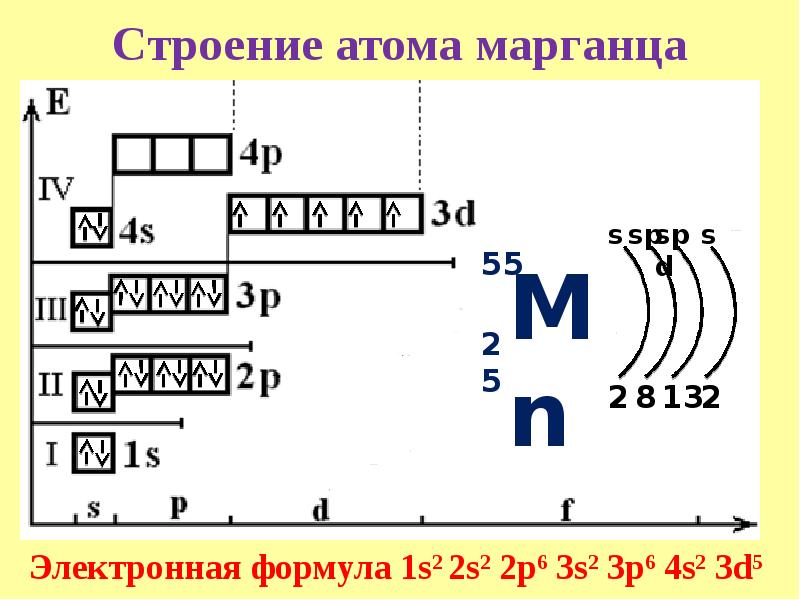
Ghosh, Dulal C., и Картик Гупта. “Новая шкала электроотрицательности
54 элемента периодической таблицы на основе поляризуемости атомов ». Журнал теоретической и вычислительной химии, том 5, номер 4, 2006 г., стр. 895–911. Doi: 10.1142 /
Гринвуд, Н. Н. и А. Эрншоу. Химия элементов, 2-е издание. Оксфорд: Баттерворт-Хайнеманн, 1997.
Гвин Уильямс. Энергии связи электронов. http: //
Хо, К. Ю., Р. У. Пауэлл и П. Э. Лили. «Теплопроводность элементов: всесторонний обзор». Справочный журнал физических и химических данных, том 3, приложение 1, 1974 г., стр. С I – 1 по I – 796.
Хорват, А. Л. «Критическая температура элементов и периодическая система». Журнал химического образования, том 50, номер 5, 1973 г., стр. 335–336. DOI: 10.1021 /
Хухи, Джеймс Э., Эллен А. Кейтер и Ричард Л. Кейтер. Неорганическая химия: принципы структуры и реакционной способности, 4-е издание. Нью-Йорк: издательство HarperCollins College, 1993.
Неорганическая химия: принципы структуры и реакционной способности, 4-е издание. Нью-Йорк: издательство HarperCollins College, 1993.
Международная организация труда (МОТ). Международная карта химической безопасности сурьмы. http: //
Международная организация труда (МОТ). Международный
Карта химической безопасности сурьмы. http: //
Кинг, Х. У. “Зависящие от давления аллотропные структуры элементов”. Бюллетень фазовых диаграмм сплавов, том 4, номер 4, 1983 г., стр. 449–450. DOI: 10.1007 /
449–450. DOI: 10.1007 /
Киттель, Чарльз. Введение в физику твердого тела, 8-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2005.
Краузе, М. О. «Атомные радиационные и безызлучательные выходы для K- и L-оболочек». Справочный журнал физических и химических данных, том 8, номер 2, 1979 г., стр. 307–327.
Li, Y.-H., and J. E. Schoonmaker. «Химический состав и минералогия морских отложений». С. 1–36 в Отложения, диагенез и осадочные породы.Под редакцией Фреда Т. Маккензи. Oxford: Elsevier Ltd., 2005.
Liboff, Ричард Л. Введение в квантовую механику, 3-е издание. Ридинг, Массачусетс: Addison Wesley Longman, Inc., 1998.
Лиде, Дэвид Р., редактор. Справочник по химии и физике CRC, 88-е издание. Бока-Ратон, Флорида: Taylor & Francis Group, 2008.
Маделунг, О., У. Рёсслер и М. Шульц, редакторы. Элементы с нететраэдрической связью и бинарные соединения I. Берлин: Springer-Verlag, 1998. doi: 10.1007 /
Mann, Joseph B. , Терри Л. Мик и Леланд С. Аллен. «Энергии конфигурации основных элементов группы». Журнал Американского химического общества, том 122, номер 12, 2000 г., стр. 2780–2783. DOI: 10.1021 /
, Терри Л. Мик и Леланд С. Аллен. «Энергии конфигурации основных элементов группы». Журнал Американского химического общества, том 122, номер 12, 2000 г., стр. 2780–2783. DOI: 10.1021 /
Мануэль, О., редактор. Происхождение элементов в Солнечной системе: последствия наблюдений после 1957 года. Нью-Йорк: Kluwer Academic Publishers, 2000.
Мартин, В. К. «Электронная структура элементов». Европейский физический журнал C – Частицы и поля, том 15, номер 1–4, 2000 г., стр.78–79. DOI: 10.1007 /
Макдонаф, В. Ф. «Композиционная модель ядра Земли». стр. 547–568 в The Mantle and Core. Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005.
. Mechtly, Евгений А. «Свойства материалов». С. 4–1–4–33 в Справочных данных для инженеров: радио, электроника, компьютер и связь. Мак Э. Ван Валкенбург, отредактированный Венди М. Миддлтон. Уоберн, Массачусетс: Баттерворт-Хайнеманн, 2002. DOI: 10.1016 /
Мисслер, Гэри Л. и Дональд А. Тарр. Неорганическая химия, 3-е издание. Аппер-Сэдл-Ривер, Нью-Джерси: Pearson Prentice Hall, 2004.
и Дональд А. Тарр. Неорганическая химия, 3-е издание. Аппер-Сэдл-Ривер, Нью-Джерси: Pearson Prentice Hall, 2004.
Мур, Шарлотта Э. Ионизационные потенциалы и пределы ионизации, полученные из анализа оптических спектров. Вашингтон, округ Колумбия: Национальное бюро стандартов, 1970.
Нэгл, Джеффри К. «Атомная поляризуемость и электроотрицательность». Журнал Американского химического общества, том 112, номер 12, 1990 г., стр. 4741–4747. DOI: 10.1021 /
Национальный институт профессиональной безопасности и здоровья (NIOSH).Международная карта химической безопасности сурьмы. http: //
Национальный институт безопасности и гигиены труда (NIOSH). Международная карта химической безопасности сурьмы. http: // 
Национальный институт безопасности и гигиены труда (NIOSH).Регистр токсического действия химических веществ на сурьму. http: //
Николас, Дж. В. и Д. Р. Уайт. «Температура». С. 8–41 в Измерение термодинамических свойств одиночных фаз. Под редакцией А. Р. Х. Гудвина, В. А. Уэйкхема и К. Н. Марша. Амстердам: Elsevier Science, 2003.
Орем, У. Х. и Р. Б. Финкельман. «Угледобыча и геохимия». С. 191–222 в Отложениях, диагенезе и осадочных породах.Под редакцией Фреда Т. Маккензи. Oxford: Elsevier Ltd., 2005.
Oxtoby, Дэвид У., Х. П. Гиллис и Алан Кэмпион. Принципы современной химии, 6-е издание. Бельмонт, Калифорния: Thomson Brooks / Cole, 2008.
Palme, H., and H. Beer. «Метеориты и состав солнечной фотосферы». стр. 204–206 в книге Ландольта – Бернштейна – Группа VI: Астрономия и астрофизика. Под редакцией Х. Х. Фойгта. Нью-Йорк: Springer – Verlag, 1993. doi: 10.1007 /
doi: 10.1007 /
Palme, H., and Hugh St.К. О’Нил. «Космохимические оценки состава мантии». стр. 1–38 в «Мантия и ядро». Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005.
Полинг, Линус. Природа химической связи, 3-е издание. Итака, Нью-Йорк: Издательство Корнельского университета, 1960.
Пирсон, Ральф Г. «Абсолютная электроотрицательность и твердость: приложение к неорганической химии». Неорганическая химия, том 27, номер 4, 1988 г., стр. 734–740. DOI: 10.1021 /
Pekka Pyykkö.Самосогласованные ковалентные радиусы 2009 г. http: //
Полак, Марк Л., Густав Гербер, Джо Хо и У. К. Линебергер.
«Фотоэлектронная спектроскопия малых кластерных анионов сурьмы: Sb-, Sb-2, Sb-3, Sb-4». Журнал химической физики, том 97, номер 12, 1992 г., стр. 8990–9000. DOI: 10.1063 /
Pyykkö, Pekka и Michiko Atsumi. «Ковалентные радиусы молекул с двойной связью для элементов Li-E112.”Chemistry – A European Journal, volume 15, number 46, 2009, pp. 12770–12779. Doi: 10.1002 /
«Ковалентные радиусы молекул с двойной связью для элементов Li-E112.”Chemistry – A European Journal, volume 15, number 46, 2009, pp. 12770–12779. Doi: 10.1002 / 2
Pyykkö, Pekka, and Michiko Atsumi.” Молекулярные ковалентные радиусы одинарных связей для элементов 1 -118. “Chemistry – A European Journal, volume 15, number 1, 2009, pp. 186–197. Doi: 10.1002 /
Pyykkö, Pekka, Sebastian Riedel, and Michael Patzschke.” Triple-Bond. Ковалентные радиусы ». Химия – Европейский журнал, том 11, номер 12, 2005 г., стр.3511–3520. DOI: 10.1002 /
Рорер, Грегори С. Структура и связь в кристаллических материалах. Кембридж: Cambridge University Press, 2001.
Самсонов Г.В., редактор. Справочник по физико-химическим свойствам элементов. Нью-Йорк: Plenum Publishing Corporation, 1968.
Сандерсон, Р. Т. «Принципы электроотрицательности: Часть I. Общие положения.
Природа. “Журнал химического образования, том 65, номер 2, 1988 г. , стр. 112–118. DOI: 10.1021 /
, стр. 112–118. DOI: 10.1021 /
Sanderson, R.Т. Полярная ковалентность. Нью-Йорк: Academic Press, Inc., 1983.
Sansonetti, J. E., and W. C. Martin. «Справочник по основным данным атомной спектроскопии». Справочный журнал физических и химических данных, том 34, номер 4, 2005 г., стр. 1559–2259. DOI: 10.1063 /
Научная группа Thermodata Europe (SGTE). Чистые вещества: Часть 1 – Элементы и соединения от AgBr до Ba3N2. Под редакцией И. Уртадо и Д. Нойшютца. Берлин: Springer-Verlag, 1999. doi: 10.1007 /
Shannon, R.D. «Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах». Acta Crystallographica Раздел A, том 32, номер 5, 1976 г., стр. 751–767. DOI: 10.1107 /
Силби, Роберт Дж., Роберт А. Олберти и Мунги Г. Бавенди. Физическая химия, 4-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc. , 2005.
, 2005.
Сингман, Чарльз Н. “Атомный объем и аллотропия элементов”. Журнал химического образования, том 61, номер 2, 1984 г., стр.137–142. DOI: 10.1021 /
Слейтер, Дж. К. «Атомные радиусы в кристаллах». Журнал
Химическая физика, том 41, номер 10, 1964, стр. 3199–3204. doi: 10.1063 /
Смит, Дерек В. «Электроотрицательность в двух измерениях: переоценка и разрешение парадокса Пирсона-Полинга». Журнал химии
Образование, том 67, номер 11, 1990 г., стр. 911–914. DOI: 10.1021 /
Смит, Дерек В. Неорганические вещества: прелюдия к изучению описательной неорганической химии.Кембридж: Кембриджский университет Press, 1990.
Стюарт, Г. Р. “Измерение низкотемпературной удельной теплоемкости”. Обзор научных инструментов, том 54, номер 1, 1983 г., стр. 1–11. DOI: 10.1063 /
Стюарт, Г. Р. “Измерение низкотемпературной удельной теплоемкости”. Обзор научных инструментов, том 54, номер 1, 1983 г.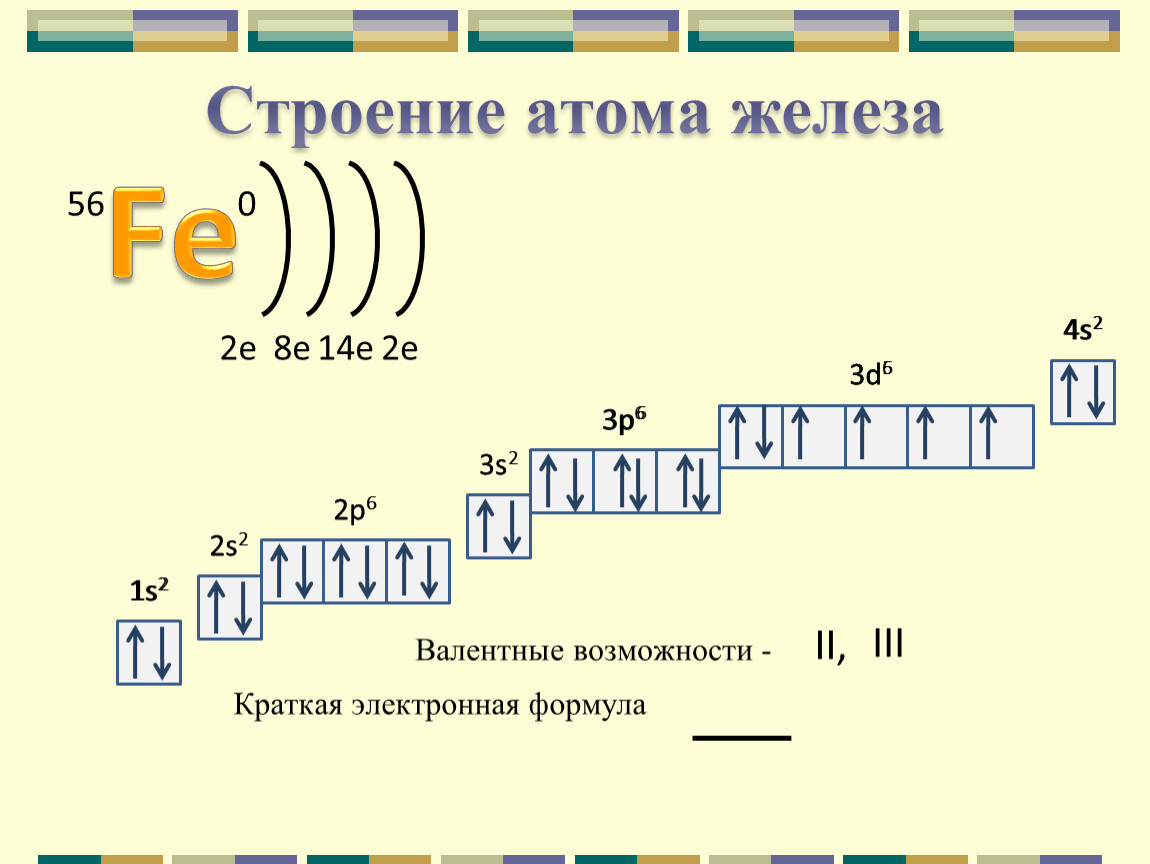 , стр. 1–11. DOI: 10.1063 /
, стр. 1–11. DOI: 10.1063 /
Тари, А. Низкая удельная теплоемкость вещества Температуры. Лондон: Imperial College Press, 2003.
Министерство транспорта США (DOT), Транспорт Канады (TC), Секретариат транспорта и коммуникаций Мексики (SCT) и Centro de Información Química para Emergencias (CIQUIME). Руководство по реагированию на чрезвычайные ситуации 2008 г.
Вайнштейн, Борис К., Владимир М. Фридкин, Владимир Л. Инденбом. Структура кристаллов, 2-е издание. Современная кристаллография 2. Под ред. Б. К. Вайнштейна, А. А. Чернова, Л. А. Шувалова. Берлин: Springer-Verlag, 1995.
Voigt, H.Х., редактор. Ландольт – Бёрнштейн — Астрономия и астрофизика VI группы. Берлин: Springer – Verlag, 1993.
Waber, J. T., and Don T. Cromer. «Радиусы орбиты атомов и ионов». Журнал химической физики, том 42, номер 12, 1965, стр. 4116–4123. DOI: 10.1063 /
Вагман, Дональд Д., Уильям Х. Эванс, Вивиан Б. Паркер, Ричард Х. Шумм, Ива Халоу, Сильвия М. Бейли, Кеннет Л. Черни и Ральф Л. Наттолл. «Теплопроводность элементов: всесторонний обзор.”Журнал физических и химических справочных данных, том 11, приложение 2, 1982 г., стр. 2–1–2–392.
Шумм, Ива Халоу, Сильвия М. Бейли, Кеннет Л. Черни и Ральф Л. Наттолл. «Теплопроводность элементов: всесторонний обзор.”Журнал физических и химических справочных данных, том 11, приложение 2, 1982 г., стр. 2–1–2–392.
Уолдрон, Кимберли А., Эрин М. Ферингер, Эми Э. Стриб, Дженнифер Э.
Троски и Джошуа Дж. Пирсон. «Проценты скрининга на основе эффективного ядерного заряда Слейтера как универсальный инструмент для обучения периодическим тенденциям». Журнал химического образования, том 78, номер 5, 2001 г., стр. 635–639. DOI: 10.1021 /
Визер, Майкл Э. и Тайлер Б. Коплен. «Атомный вес элементов 2009 г. (Технический отчет IUPAC).«Чистая и прикладная химия, том 83, номер 2, 2011 г., стр. 359–396. Doi: 10.1351 /
Yaws, Карл Л.« Плотность жидкости в элементах ». Химическая инженерия, том 114, номер 12, 2007 г., стр. 44–46.
Yaws, Карл Л. Справочник по физическим свойствам углеводородов и химикатов Yaws. Хьюстон, Техас: издательство Gulf Publishing Company, 2005.



