Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
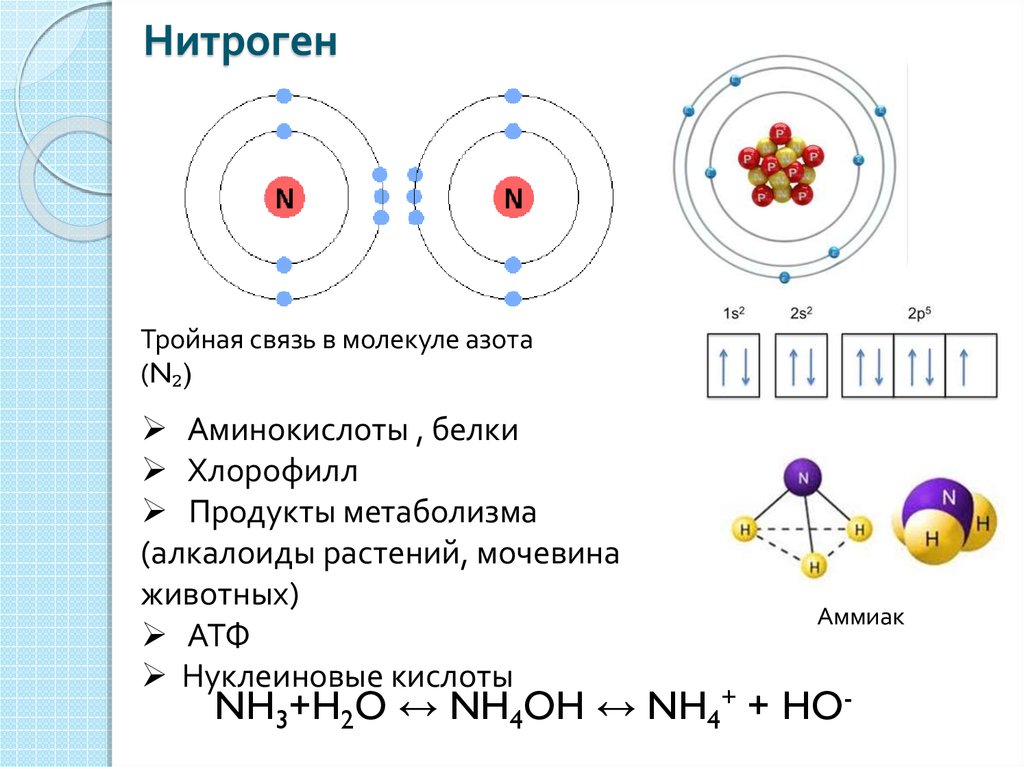
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Теллур, свойства атома, химические и физические свойства
Теллур, свойства атома, химические и физические свойства.
Поделиться в:
Te 52 Теллур
127,60(3) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p4
Теллур — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 52. Расположен в 16-й группе (по старой классификации — главной подгруппе шестой группы), пятом периоде периодической системы.
И. Менделеева с атомным номером 52. Расположен в 16-й группе (по старой классификации — главной подгруппе шестой группы), пятом периоде периодической системы.
Атом и молекула теллура. Формула теллура. Строение атома теллура
Изотопы и модификации теллура
Свойства теллура (таблица): температура, плотность, давление и пр.
Физические свойства теллура
Химические свойства теллура. Взаимодействие теллура. Химические реакции с теллуром
Получение теллура
Применение теллура
Таблица химических элементов Д.И. Менделеева
Атом и молекула теллура. Формула теллура. Строение атома теллура:
Теллур (лат. Tellurium, от лат. tellus, родительный падеж telluris, – «Земля») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Te и атомным номером 52. Расположен в 16-й группе (по старой классификации – главной подгруппе шестой группы), пятом периоде периодической системы.
Теллур – неметалл. Относится к группе халькогенов, а также к полуметаллам. Редкий, рассеянный элемент.
Теллур обозначается символом Te.
Как простое вещество теллур при нормальных условиях представляет собой хрупкое, серебристо-белое вещество с металлическим блеском.
Молекула теллура одноатомна.
Химическая формула теллура Te.
Электронная конфигурация атома теллура 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p4. Потенциал ионизации (первый электрон) атома теллура равен 869,3 кДж/моль (9,009808(6) эВ).
Строение атома теллура. Атом теллура состоит из положительно заряженного ядра (+52), вокруг которого по пяти оболочкам движутся 52 электрона. При этом 46 электронов находятся на внутреннем уровне, а 6 электронов – на внешнем. Поскольку теллур расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома теллура на 5s-орбитали находятся два спаренных электрона, на 5p-орбитали – два спаренных и два неспаренных электрона. В свою очередь ядро атома теллура состоит из 52 протонов и 76 нейтронов. Теллур относится к элементам p-семейства.
Радиус атома теллура (вычисленный) составляет 123 пм.
Атомная масса атома теллура составляет 127,60(3) а. е. м.
м.
Теллур, свойства атома, химические и физические свойства
Изотопы и модификации теллура:
Свойства теллура (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения* | |
| 101 | Название | Теллур |
| 102 | Прежнее название | |
| 103 | Латинское название | Tellurium |
| 104 | Английское название | Tellurium |
| 105 | Символ | Te |
| 106 | Атомный номер (номер в таблице) | 52 |
| 107 | Тип | Неметалл |
| 108 | Группа | Полуметалл, халькоген |
| 109 | Открыт | Франц Йозеф Мюллер, Австрия, 1782 г. |
| 110 | Год открытия | 1782 г. |
| Внешний вид и пр. | Хрупкое, серебристо-белое вещество с металлическим блеском | |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации: – α-теллур (кристаллический, металлический теллур) с гексагональной кристаллической решёткой, – аморфный теллур в виде чёрно-коричневого порошка |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 9,9·10-8 % |
| 120 | Содержание в морях и океанах (по массе) | |
| 121 | Содержание во Вселенной и космосе (по массе) | 9,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | |
| 123 | Содержание в метеоритах (по массе) | 0,00021 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 127,60(3) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p4 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O6 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 123 пм |
| 205 | Эмпирический радиус атома* | 140 пм |
| 206 | Ковалентный радиус* | 138 пм |
| 207 | Радиус иона (кристаллический) | Te2- 207 (6) пм, Te4+ 111 (6) пм, Te6+ 70 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 206 пм |
| 209 | Электроны, Протоны, Нейтроны | 52 электрона, 52 протона, 76 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 16-ая группа (по старой классификации – главная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 2, -1, +1, +2, +3, +4, +5, +6 |
| 302 | Валентность | II, IV, VI |
| 303 | Электроотрицательность | 2,1 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 869,3 кДж/моль (9,009808(6) эВ) |
| 305 | Электродный потенциал | Te + 2e– → Te |
| 306 | Энергия сродства атома к электрону | 190,161(1) кДж/моль (1,970875(7) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 6,24 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело), 5,70 г/см3 (при температуре плавления 449,51 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 449,51 °C (722,66 K, 841,12 °F) |
| 403 | Температура кипения* | 988 °C (1261 K, 1810 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 17,49 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 114,1 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,202 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 25,73 Дж/(K·моль) |
| 411 | Молярный объём | 20,4487 см³/моль |
| 412 | Теплопроводность | 1,97-3,38 Вт/(м·К) (при стандартных условиях) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-теллур (кристаллический, металлический теллур) |
| 512 | Структура решётки | Гексагональная
|
| 513 | Параметры решётки | a = 4,457 Å, c = 5,929 Å |
| 514 | Отношение c/a | 1,330 |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | P3121 |
| 517 | Номер пространственной группы симметрии | 152 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 13494-80-9 |
Примечание:
100* Данные в таблице приводятся применительно к кристаллическому, металлическому теллуру.
205* Эмпирический радиус атома теллура согласно [1] и [3] составляет 140 пм и 160 пм соответственно.
206* Ковалентный радиус теллура согласно [1] и [3] составляет 138±4 пм и 136 пм соответственно.
401* Плотность теллура согласно [3] составляет 6,25 г/см3 (при 25 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления теллура согласно [3] и [4] составляет 449,55 °С (722,7 K, 841,19 °F) и 449,8 °С (722,95 K, 841,64 °F) соответственно.
403* Температура кипения теллура согласно [3] и [4] составляет 989,85 °C (1263 K, 1813,73 °F) и 990 °С (1263,15 K, 1814 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) теллура согласно [3] и [4] составляет 17,91 кДж/моль и 17,5 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) теллура согласно [3] и [4] составляет 49,8 кДж/моль и 51 кДж/моль соответственно.
410* Молярная теплоемкость теллура согласно [3] составляет 25,8 Дж/(K·моль).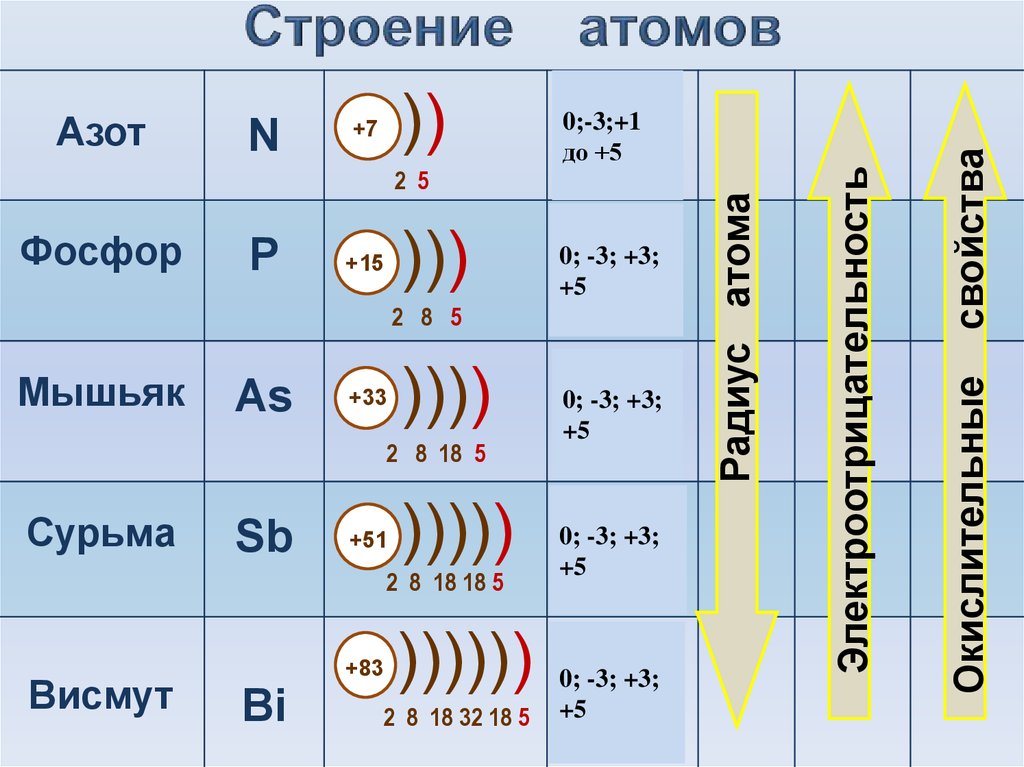
Физические свойства теллура:
Химические свойства теллура. Взаимодействие теллура. Химические реакции с теллуром:
Получение теллура:
Применение теллура:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25.
 Марганец
Марганец - 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59.
 Празеодим
Празеодим - 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92.
 Уран
Уран - 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Tellurium
- https://de.
 wikipedia.org/wiki/Tellur
wikipedia.org/wiki/Tellur - https://ru.wikipedia.org/wiki/Теллур
- http://chemister.ru/Database/properties.php?dbid=1&id=262
- https://chemicalstudy.ru/tellur-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
теллур атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле теллура теллур
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 2 196
Теллур, атомарная структура – Стоковая фотография – C018/3733
Похоже, вы используете старый веб-браузер, который не поддерживается. Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Это изображение недоступно для покупки в вашей стране.
C018/3733
Управление правами
74,5 МБ (74,0 МБ со сжатием)
5197 x 5008 пикселей
43,9 x 42,4 см ⏐ 17,3 х 16,7 дюйма (300 точек на дюйм)
Это изображение недоступно для покупки в вашей стране.
Пожалуйста, свяжитесь с вашим менеджером по работе с клиентами, если у вас есть какие-либо вопросы.
Запрос
Цена Добавить в корзину Удалять ДОБАВИТЬ НА ДОСКУ ДелитьсяКупить Распечатать
Кредит
КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА
Заголовок
Теллур (Te). Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома теллура-128 (атомный номер: 52), изотопа этого элемента.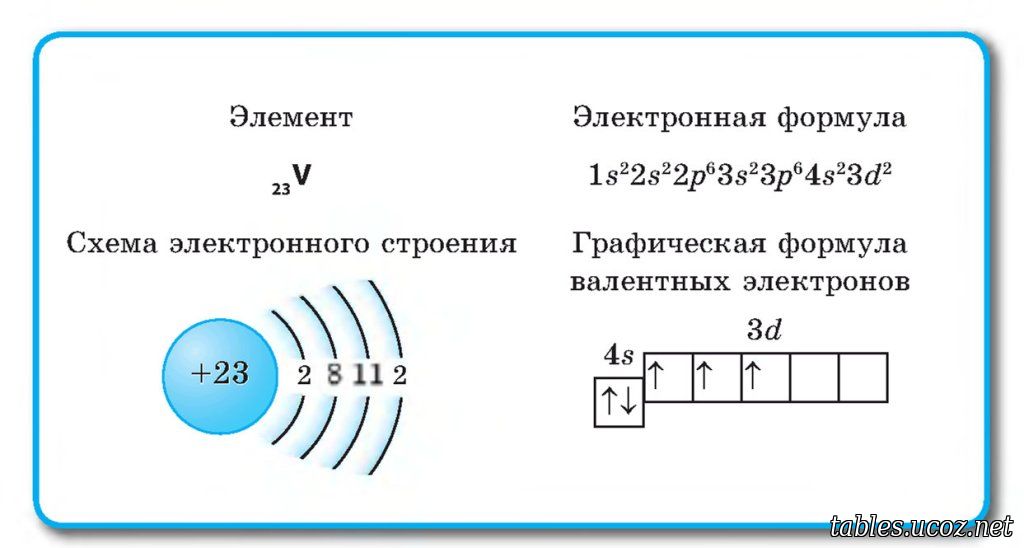 Ядро состоит из 52 протонов (красный) и 76 нейтронов (оранжевый). 52 электрона (белые) последовательно занимают доступные электронные оболочки (кольца). Стабильность внешних (валентных) электронов элемента определяет его химические и физические свойства. Теллур – это металлоид в группе 16, периоде 5 и р-блоке периодической таблицы. Он имеет температуру плавления 450 градусов по Цельсию. Редкий элемент, он используется в основном в сплавах, солнечных панелях и полупроводниках.
Ядро состоит из 52 протонов (красный) и 76 нейтронов (оранжевый). 52 электрона (белые) последовательно занимают доступные электронные оболочки (кольца). Стабильность внешних (валентных) электронов элемента определяет его химические и физические свойства. Теллур – это металлоид в группе 16, периоде 5 и р-блоке периодической таблицы. Он имеет температуру плавления 450 градусов по Цельсию. Редкий элемент, он используется в основном в сплавах, солнечных панелях и полупроводниках.
Сведения о выпуске
Разрешение модели не требуется. Разрешение собственности не требуется.
Ключевые слова
- 5p
- 5п4
- 5с
- 5с2
- а.е.м.
- атом
- атомный
- атомный номер
- атомных орбиталей
- атомный радиус
- атомный вес
- черный фон
- химические данные
- химические свойства
- химическое свойство
- химия
- схема
- электронная конфигурация
- номер электрона
- электронная оболочка
- электронный
- электронов
- элемент
- элементаль
- элементов
- уровней энергии
- группа 16
- иллюстрация
- изотоп
- уровень
- уровней
- металлоид
- металлоиды
- нейтрон
- нейтрон номер
- нейтронов
- ядерный
- ядерные данные
- нуклон
- нуклонов
- ядро
- орбитальный
- орбитальные типы
- орбиталей
- р блок
- р-блок
- период 5
- физическая химия
- физические свойства
- физическое имущество
- вечера
- протон номер
- квантовая химия
- оболочка
- каркасная конструкция
- снаряды
- простая электронная конфигурация
- твердый
- твердые вещества
- структурный
- структура
- субатомный
- субатомный
- подоболочка
- подоболочек
- символ
- тэ
- теллур
- теллур-128
- валентная орбиталь
- волновая функция
Димер теллура и его анион
- DOI:10.
 1080/002689797170202
1080/002689797170202 - Идентификатор корпуса: 97440381
@article{Heinemann1997TheTD,
title={Димер теллура и его анион},
автор={Кристоф Хайнеманн и Вольфрам Кох},
журнал={Молекулярная физика},
год = {1997},
объем = {92},
страницы = {463-470}
}. был построен для теллура. Используя этот набор в сочетании с релятивистски скорректированным взаимодействием множественных эталонных конфигураций и связанными кластерными волновыми функциями, были определены потенциальные кривые основного и спектроскопически наиболее важных возбужденных состояний нейтрального и анионного димера теллура. Прогнозы спектроскопических констант и энергетических деталей, таких как… Просмотр через Publisher
Электронный спектр сульфида селена — теоретическое исследование
- S. Sinnecker, W. Koch
Химия
- 2000
- H. Abdallah
Химия
- 2020
- A. Polo, A. Pardo, J.J. Camacho, J. Poyato
Физика, химия
- С.
 Аарт, В. Верховен, П. Веркерк, В. Лугт
Аарт, В. Верховен, П. Веркерк, В. Лугт Материаловедение
- 20400
1
Нейтронографические эксперименты были проведены для двух жидких сплавов составов CsBi и Cs3Bi2. Результаты показывают, что, вероятно, полианионы со средним числом атомов Bi около двух…
Кварцевые волокна, легированные теллуром: спектроскопические свойства и природа активных центров
- А. Зленко, В. Машинский, В. Плотниченко
Химия
- 2016
Изготовлены заготовка и дырчатые волокна с составом сердцевины Te:SiO2. Исследованы спектроскопические свойства волокон, вытянутых в различных окислительно-восстановительных условиях. Интенсивные полосы поглощения вблизи 430,…
Природа халькогеновых центров окраски в твердых телах ультрамаринового типа
- D. Reinen, G. Lindner
Химия
- 1999
Голубые минералы и драгоценные камни всегда привлекали внимание человека. В частности, лазурит высоко ценился и использовался как драгоценный камень и как пигмент.
 Соединение-хозяин…
Соединение-хозяин…Оптические свойства экстремальных нанопроволок теллура, сформированных в каналах субнанометрового диаметра
- В. Поборчий, Александр Фокин, А. Шкляев
Физика
Nanoscale Advances
- 2022
Отдельные теллуровые (Te) спинтронные свойства привлекают большое внимание уникальными электронными и нанопроволочными свойствами. Здесь мы инкапсулируем Te из расплава в каналы цеолитов AFI (∼0,73…
Ab initio изучение малых кластеров теллуридов металлов чеканки AunTem (n, m = 1, 2)
- Q. Rong, F. Liu, Xinying Ли, Ю. Ф. Чжао, С. Цзин
Химия
- 2007
Методом МП2 определены геометрии наиболее стабильных изомеров теллуридных систем золота AuTe, Au2Te и AuTe2. Аспект взаимодействия золота и теллурида, электронная корреляция и…
ПОКАЗАНЫ 1-10 ИЗ 18 ССЫЛОК
СОРТИРОВАТЬ ПОРелевантности Наиболее влиятельные статьиНедавность
Свойства основного и возбужденного состояний нейтральных и анионных димеров и тримеров селена.

- Хайнеманн, Кох, Линднер, Райнен, Видмарк
Химия
Физический обзор. A, Атомная, молекулярная и оптическая физика
- 1996
Помимо точных предсказаний спектроскопических констант, сродства к электрону и матричных элементов переходов, особое внимание уделяется использованию вычисленных кривых потенциальной энергии димеров для интерпретации недавно исследовали специфические оптические свойства двухатомных разновидностей селена, встроенных в твердые матрицы-хозяева.
MCSCF/6-31 G(d,p) Расчет констант одноэлектронного спин-орбитального взаимодействия в двухатомных молекулах
- С. Косеки, Майкл В. Шмидт, М. Гордон
Химия, физика
- 1992
Эффективные заряды ядер, которые являются эмпирическими параметрами в приближенном спин-орбитальном гамильтониане, определяются для первого - и элементы второго ряда периодической таблицы с использованием…
Теоретическое исследование спектроскопических свойств Te2
- К.
 Баласубраманян
Баласубраманян Химия, физика
- 1987
Метод взаимодействия состояния CASSCF
- P. Malmqvist, B. Roos
, Физика
- 1989
Френкинг, Г. Штеффен, Д. Рейнен, М. Янсен, В. Ассенмахер
Химия
- 1993
- P. Knowles, C. Hampel, H. Werner
Химия, физика
- 1993
- Дж. Альмлёф, П. Тейлор
Химия
- 1987
10
10
10
10
электронные состояния молекулы SeS были исследованы с использованием высокоуровневых неэмпирических квантово-химических методов. методы взаимодействия многоэталонных конфигураций и типа связанного кластера.…
методы взаимодействия многоэталонных конфигураций и типа связанного кластера.…
Пересмотр кластеров теллура (Ten; n = 2–8) с использованием методов ab initio
Оптимизированные геометрии и частоты колебаний кластеров Te n = 2–8 рассчитаны с использованием ab initio молекулярно-орбитальной теории в B3LYP, BHP, BLYH, MP2 уровни приближения. Мы нашли...
Чем отличаются кластеры Te — исследование из первых принципов
Расчеты электронной структуры на основе теории функционала плотности проведены для получения геометрий, соответствующих трем низшим значениям энергии для Tey (y = 2 − 20 ) кластеры. Сравнение…
Измерения времени жизни и сечения полной релаксации некоторых колебательно-колебательных уровней B0u+-состояния Te2 с помощью лазерной спектроскопии
Структура жидких сплавов цезий-висмут, изученная методом нейтронографии
2A2) при оптимизированной геометрии основного состояния X 2B1 теоретически предсказываются на уровне MRCI-SD…
Теория связанных кластеров для высокоспиновых эталонных волновых функций с открытой оболочкой
Метод связанных кластеров возбуждений (CCSD) рассматривается для случая эталонного детерминанта открытой оболочки Хартри–Фока, ограниченного по спину. Спин-орбитальный базис…
Общее сокращение гауссовых базисных множеств. I. Атомные естественные орбитали для атомов первого и второго ряда
Представлена общая схема сжатия для гауссовых базисных наборов.

 Марганец
Марганец Празеодим
Празеодим Уран
Уран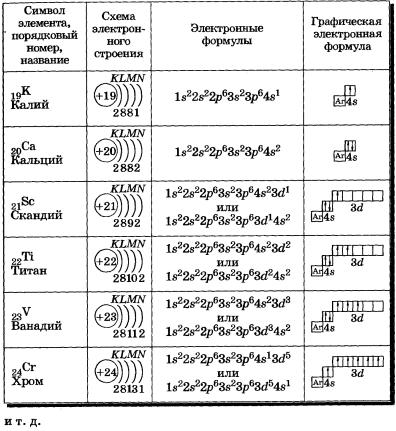 wikipedia.org/wiki/Tellur
wikipedia.org/wiki/Tellur 1080/002689797170202
1080/002689797170202 Аарт, В. Верховен, П. Веркерк, В. Лугт
Аарт, В. Верховен, П. Веркерк, В. Лугт Соединение-хозяин…
Соединение-хозяин…
 Баласубраманян
Баласубраманян