Каким символом обозначается ядро атома водорода. Строение атома водорода. Электронное строение атома водорода
Атом – это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из ядра, имеющего положительный электрический заряд, и отрицательно заряженных электронов. Заряд ядра любого химического элемента равен произведению Z на e, где Z – порядковый номер данного элемента в периодической системе химических элементов, е – величина элементарного электрического заряда.
Электрон – это мельчайшая частица вещества с отрицательным электрическим зарядом е=1,6·10 -19 кулона, принятым за элементарный электрический заряд. Электроны, вращаясь вокруг ядра, располагаются на электронных оболочках К, L, М и т. д. К – оболочка, ближайшая к ядру. Размер атома определяется размером его электронной оболочки. Атом может терять электроны и становиться положительным ионом или присоединять электроны и становиться отрицательным ионом. Заряд иона определяет число потерянных или присоединенных электронов. Процесс превращения нейтрального атома в заряженный ион называется ионизацией.
Процесс превращения нейтрального атома в заряженный ион называется ионизацией.
Атомное ядро (центральная часть атома) состоит из элементарных ядерных частиц – протонов и нейтронов. Радиус ядра примерно в сто тысяч раз меньше радиуса атома. Плотность атомного ядра чрезвычайно велика. Протоны – это стабильные элементарные частицы, имеющие единичный положительный электрический заряд и массу, в 1836 раз большую, чем масса электрона. Протон представляет собой ядро атома самого легкого элемента – водорода. Число протонов в ядре равно Z. Нейтрон – это нейтральная (не имеющая электрического заряда) элементарная частица с массой, очень близкой к массе протона. Поскольку масса ядра складывается из массы протонов и нейтронов, то число нейтронов в ядре атома равно А – Z, где А – массовое число данного изотопа (см. ). Протон и нейтрон, входящие в состав ядра, называются нуклонами. В ядре нуклоны связаны особыми ядерными силами.
В атомном ядре имеется огромный запас энергии, которая высвобождается при ядерных реакциях. Ядерные реакции возникают при взаимодействии атомных ядер с элементарными частицами или с ядрами других элементов. В результате ядерных реакций образуются новые ядра. Например, нейтрон может переходить в протон. В этом случае из ядра выбрасывается бета-частица, т. е. электрон.
Ядерные реакции возникают при взаимодействии атомных ядер с элементарными частицами или с ядрами других элементов. В результате ядерных реакций образуются новые ядра. Например, нейтрон может переходить в протон. В этом случае из ядра выбрасывается бета-частица, т. е. электрон.
Иногда образовавшееся ядро обладает избытком энергии (находится в возбужденном состоянии) и, переходя в нормальное состояние, выделяет лишнюю энергию в виде электромагнитного излучения с очень малой длиной волны – . Энергия, выделяющаяся при ядерных реакциях, практически используется в различных отраслях промышленности.
Атом (греч. atomos – неделимый) наименьшая частица химического элемента, обладающая его химическими свойствами.

Размеры атома определяются размерами электронных оболочек и составляют для всех Z величину порядка 10 -8 см. Поскольку масса всех электронов атома в несколько тысяч раз меньше массы ядра, масса атома пропорциональна массовому числу. Относительная масса атома данного изотопа определяется по отношению к массе атома изотопа углерода С 12 , принятой за 12 единиц, и называется изотопной массой. Она оказывается близкой к массовому числу соответствующего изотопа. Относительный вес атома химического элемента представляет собой среднее (с учетом относительной распространенности изотопов данного элемента) значение изотопного веса и называется атомным весом (массой).
Атом является микроскопической системой, и его строение и свойства могут быть объяснены лишь при помощи квантовой теории, созданной в основном в 20-е годы 20 века и предназначенной для описания явлений атомного масштаба. Опыты показали, что микрочастицы – электроны, протоны, атомы и т. д.,- кроме корпускулярных, обладают волновыми свойствами, проявляющимися в дифракции и интерференции. В квантовой теории для описания состояния микрообъектов используется некоторое волновое поле, характеризуемое волновой функцией (Ψ-функция). Эта функция определяет вероятности возможных состояний микрообъекта, т. е. характеризует потенциальные возможности проявления тех или иных его свойств. Закон изменения функции Ψ в пространстве и времени (уравнение Шредингера), позволяющий найти эту функцию, играет в квантовой теории ту же роль, что в классической механике законы движения Ньютона. Решение уравнения Шредингера во многих случаях приводит к дискретным возможным состояниям системы. Так, например, в случае атома получается ряд волновых функций для электронов, соответствующих различным (квантованным) значениям энергии.
Кроме атомных спектров, квантовая теория позволила объяснить и другие свойства атомов. В частности, были объяснены валентность, природа химической связи и строение молекул, создана теория периодической системы элементов.
ОПРЕДЕЛЕНИЕ
Водород – первый элемент Периодической таблицы. Обозначение – H. Расположен в первом периоде, I группе, А подгруппе.
Относится к неметаллам. Заряд ядра равен 1.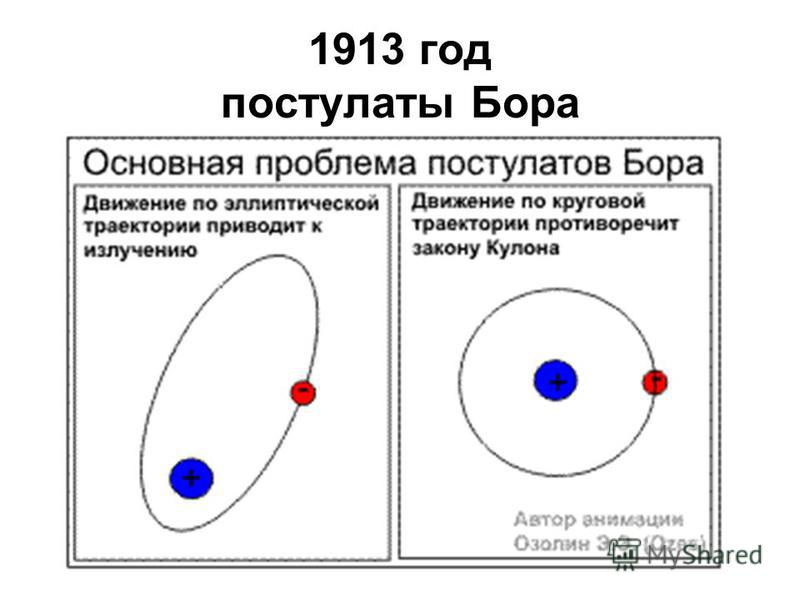 Атомный вес может варьироваться: 1, 2, 3, что связано с наличием изотопов дейтерия и трития.
Атомный вес может варьироваться: 1, 2, 3, что связано с наличием изотопов дейтерия и трития.
Электронное строение атома водорода
В атоме водорода имеется положительно заряженное ядро (+1), 1 протон и один электрон. Поскольку водород имеет самое простейшее строение атома из всех элементов Периодической системы, он хорошо изучен. В 1913 году Нильс Бор предложил схему строения атома водорода, согласно которой положительно заряженное ядро находится в центре, а вокруг него по единственной орбитали движется электрон (рис. 1). В соответствии с этой схемой он вывел спектр излучения этого химического элемента. Который был позже доказан с помощью квантово-механических расчетов уравнения Шредингера (1925-1930 годы).
Рис. 1. Схема строения атома водорода.
Электронная конфигурация атома водорода будет выглядеть следующим образом:
Водород относится к семейству s-элементов. Энергетическая диаграмма атома водорода имеет вид:
Единственный электрон, который имеется у водорода является валентным, т.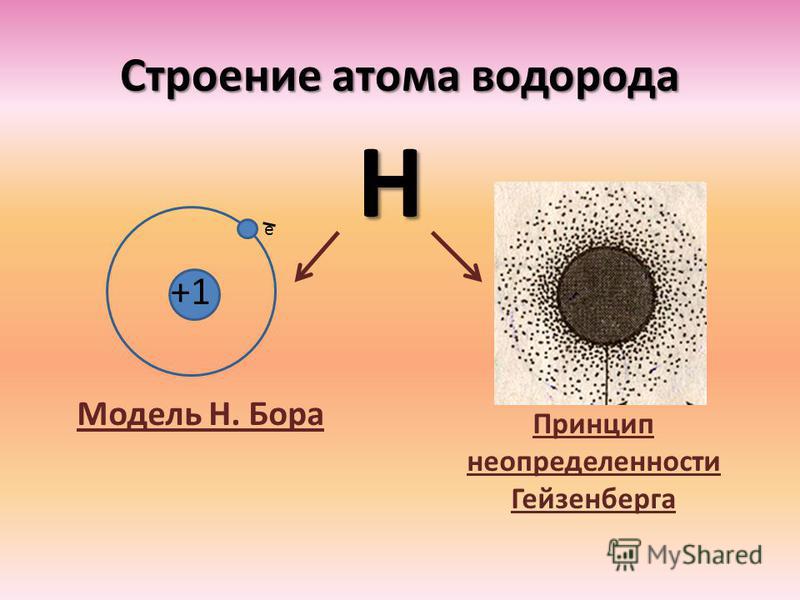 к. участвует в образовании химических связей. В результате взаимодействия водород может как терять электрон, т.е. являться его донором, так и принимать, т.е. быть акцептором. В этих случаях атом превращается либо в положительно, либо отрицательно заряженный ион (H + /Н —):
к. участвует в образовании химических связей. В результате взаимодействия водород может как терять электрон, т.е. являться его донором, так и принимать, т.е. быть акцептором. В этих случаях атом превращается либо в положительно, либо отрицательно заряженный ион (H + /Н —):
H 0 +e →H — .
Примеры решения задач
ПРИМЕР 1
ПРИМЕР 2
| Задание | Укажите количество протонов и нейтронов, которые содержатся в ядрах азота (атомный номер 14), кремния (атомный номер 28) и бария (атомный номер 137). |
| Решение | Количество протонов в ядре атома химического элемента определяется по его порядковому номеру в Периодической таблице, а количество нейтронов – это разница между массовым числом (М) и зарядом ядра (Z). Азот: n(N)= M -Z = 14-7 = 7. Кремний: n(Si)= M -Z = 28-14 = 14. Барий: n (Ba)= M -Z = 137-56 = 81. |
| Ответ | Количество протонов в ядре азота равно 7, нейтронов – 7; в ядре атоме кремня протонов 14, нейтронов – 14; в ядре атоме бария протонов 56, нейтронов – 81. |
«Атом и атомное ядро» – Изотопы. Биография атома. Решение задач. Открытие нейтрона. Вклады неравны. Модель атома в виде положительно заряженного шара. Викторина. Обозначение ядра атома. Атом имеет ядро. Ядерные силы. В космических глубинах. Представления о строении атома. Теория ядра. Ядро атома состоит из нуклонов. Протонно-нейтронная модель ядра атома.
«Энергия связи ядра» – Уменьшение удельной энергии связи у легких элементов объясняется поверхностными эффектами. – Дефект массы. Кулоновские силы стремятся разорвать ядро. Удельная энергия связи. Максимальную энергию связи (8,6 МэВ/нуклон) имеют элементы с массовыми числами от 50 до 60. Энергия связи атомных ядер. Энергия связи нуклонов на поверхности меньше, чем у нуклонов внутри ядра.
«Ядро атома» – Эрнест Резерфорд. Тест (продолжение). Изотопы одного элемента различаются числом … в ядре. Ядро атома состоит из протонов и нейтронов. Информация о составе атомного ядра указывается следующим образом: Молекулы Ионы Протоны. А суммарный заряд электронов –Ze. Тест: Например, в ядро атома кислорода. Протоны являются носителями элементарного положительного заряда, нейтроны – электрически нейтральны.
А суммарный заряд электронов –Ze. Тест: Например, в ядро атома кислорода. Протоны являются носителями элементарного положительного заряда, нейтроны – электрически нейтральны.
«Атомное ядро» – 1932 г Иваненко и Гейзенберг предложили протонно-нейтронную модель атомного ядра. Кванты ядерных взвимодействий. Открытие строения ядра. Модель ядра. Однако внутри стабильного ядра нейтроны связаны с протонами и самопроизвольно не распадаются. Дж.Чедвик повторил эксперимент. Открытие нейтрона явилось важным шагом вперед.
«Фундаментальные взаимодействия» – Ньютоновская теория всемирного тяготения. Суперобъединение. Модели объединения. Типы взаимодействия элементарных частиц. Создание единой теории фундаментальных взаимодействий. Теоретические достижения. Элементарная частица. Условное обозначение слабого взаимодействия. Взаимодействия. Рычажные весы. Электромагнитное взаимодействие.
«Физика атомного ядра» – Активность препарата – число ядер, распадающихся за единичный промежуток времени: Типы ядерных реакций. Виртуальные частицы. I. Нуклон. 3. Странность. Законы сохранения. Элементарные частицы – частицы, ведущие себя как безструктрурные. Синтез трансурановых химических элементов. Спектр?-излучения – дискретный.
Виртуальные частицы. I. Нуклон. 3. Странность. Законы сохранения. Элементарные частицы – частицы, ведущие себя как безструктрурные. Синтез трансурановых химических элементов. Спектр?-излучения – дискретный.
Всего в теме 9 презентаций
Атомное ядро — это центральная часть атома, состоящая из протонов и нейтронов (которые вместе называются нуклонами ).
Ядро было открыто Э. Резерфордом в 1911 г. при исследовании прохождения α -частиц через вещество. Оказалось, что почти вся масса атома (99,95%) сосредоточена в ядре. Размер атомного ядра имеет порядок величины 10 -1 3 -10 – 12 см, что в 10 000 раз меньше размера электронной оболочки.
Предложенная Э. Резерфордом планетарная модель атома и экспериментальное наблюдение им ядер водорода , выбитых α -частицами из ядер других элементов (1919-1920 гг.), привели уче-ного к представлению о протоне . Термин протон был введен в начале 20-х гг XX ст.
Протон (от греч. protons — первый, символ p ) — стабильная элементарная частица, ядро ато-ма водорода.
Протон — положительно заряженная частица, заряд которой по абсолютной величине равен заряду электрона e = 1,6 · 10 -1 9 Кл. Масса протона в 1836 раз больше массы электрона. Масса покоя протона m р = 1,6726231 · 10 -27 кг = 1,007276470 а.е.м.
Второй частицей, входящей в состав ядра, является нейтрон .
Нейтрон (от лат. neuter — ни тот, ви другой, символ n ) — это эле-ментарная частица, не имеющая заряда, т. е. нейтральная.
Масса нейтрона в 1839 раз превышает массу электрона. Масса нейтрона почти равна (незначительно больше) массе протона: масса покоя свободного нейтрона m n = 1,6749286 · 10 -27 кг = 1,0008664902 а.е.м. и превосходит массу протона па 2,5 массы электрона. Нейтрон, наря-ду с протоном под общим названием нуклон входит в состав атомных ядер.
Нейтрон был открыт в 1932 г. учеником Э. Резерфорда Д. Чедвигом при бомбардировке бериллия α -частицами. Возникающее при этом излучение с большой проникающей способностью (преодолевало пре-граду из свинцовой пластины толщиной 10-20 см) усиливало свое действие при прохождении через парафиновую пластину (см. рисунок). Оценка энергии этих частиц по трекам в камере Вильсона, сделанная супругами Жолио-Кюри, и дополнительные наблюдения позволили исключить первоначальное предположение о том, что это γ -кванты. Большая проникающая способность новых частиц, названных ней-тронами, объяснялась их электронейтральностью. Ведь заряженные частицы активно взаимодействуют с веществом и быстро теряют свою энергию. Существование нейтронов было предсказано Э. Резерфордом за 10 лет до опытов Д. Чедвига. При попадании α -частиц в ядра бериллия происходит следующая реакция:
рисунок). Оценка энергии этих частиц по трекам в камере Вильсона, сделанная супругами Жолио-Кюри, и дополнительные наблюдения позволили исключить первоначальное предположение о том, что это γ -кванты. Большая проникающая способность новых частиц, названных ней-тронами, объяснялась их электронейтральностью. Ведь заряженные частицы активно взаимодействуют с веществом и быстро теряют свою энергию. Существование нейтронов было предсказано Э. Резерфордом за 10 лет до опытов Д. Чедвига. При попадании α -частиц в ядра бериллия происходит следующая реакция:
Здесь — символ нейтрона; заряд его равен нулю, а относительная атомная масса прибли-зительно равна единице. Нейтрон — нестабильная частица: свободный нейтрон за время ~ 15 мин. распадается на протон, электрон и нейтрино — частицу, лишенную массы покоя.
После открытия Дж. Чедвиком нейтрона в 1932 г. Д. Иваненко и В. Гейзенберг независимо друг от друга предложили протонно-нейтронную (нуклонную) модель ядра . Согласно этой моде-ли, ядро состоит из протонов и нейтронов. Число протонов Z совпадает с порядковым номером элемента в таблице Д. И. Менделеева .
Число протонов Z совпадает с порядковым номером элемента в таблице Д. И. Менделеева .
Заряд ядра Q определяется числом протонов Z , входящих в состав ядра, и кратен абсолютной величине заряда электрона e :
Q = +Ze.
Число Z называется зарядовым числом ядра или атомным номером .
Массовым числом ядра А называется общее число нуклонов, т. е. протонов и нейтронов, содер-жащихся в нем. Число нейтронов в ядре обозначается буквой N . Таким образом, массовое число равно:
А = Z + N.
Нуклонам (протону и нейтрону) приписывается массовое число, равное единице, электрону — нулевое значение.
Представлению о составе ядра содействовало также открытие изотопов .
Изотопы (от греч. isos — равный, одинаковый и topoa — место) — это разновидности атомов одного и того же химического элемента, атомные ядра которых имеют одинаковое число прото-нов (Z ) и различное число нейтронов (N ).
Изотопами называются также ядра таких атомов. Изотопы являются нуклидами одного эле-мента. Нуклид (от лат. nucleus — ядро) — любое атомное ядро (соответственно атом) с заданными числами Z и N . Общее обозначение нуклидов имеет вид ……. где X — символ химического эле-мента, A = Z + N — массовое число.
Изотопы занимают одно и то же место в Периодической системе элементов, откуда и про-изошло их название. По своим ядерным свойствам (например, по способности вступать в ядерные реакции) изотопы, как правило, существенно отличаются. Химические (b почти в той же мере физические) свойства изотопов одинаковы. Это объясняется тем, что химические свойства элемен-та определяются зарядом ядра, поскольку именно он влияет на структуру электронной оболочки атома.
Исключением являются изотопы легких элементов. Изотопы водорода 1 Н — протий , 2 Н — дейтерий , 3 Н — тритий столь сильно отличаются по массе, что и их физические и хими-ческие свойства различны. Дейтерий стабилен (т.е. не радиоактивен) и входит в качестве неболь-шой примеси (1: 4500) в обычный водород. При соединении дейтерия с кислородом образуется тяжелая вода . Она при нормальном атмосферном давлении кипит при 101,2 °С и замерзает при +3,8 ºС. Тритий β -радиоактивен с периодом полураспада около 12 лет.
Дейтерий стабилен (т.е. не радиоактивен) и входит в качестве неболь-шой примеси (1: 4500) в обычный водород. При соединении дейтерия с кислородом образуется тяжелая вода . Она при нормальном атмосферном давлении кипит при 101,2 °С и замерзает при +3,8 ºС. Тритий β -радиоактивен с периодом полураспада около 12 лет.
У всех химических элементов имеются изотопы. У некоторых элементов имеются только нестабильные (радиоактивные) изотопы. Для всех элементов искусственно получены радиоактив-ные изотопы.
Изотопы урана. У элемента урана есть два изотопа — с массовыми числами 235 и 238. Изотоп составляет всего 1/140 часть от более распространенного .
Когда выяснилось, что ядра атомов имеют сложное строение, встал вопрос о том, из каких именно частиц они состоят.
В 1913 г. Резерфорд выдвинул гипотезу о том, что одной из частиц, входящих в состав атомных ядер всех химических элементов, является ядро атома водорода.
Основанием для такого предположения послужил ряд появившихся к тому времени фактов, полученных опытным путём.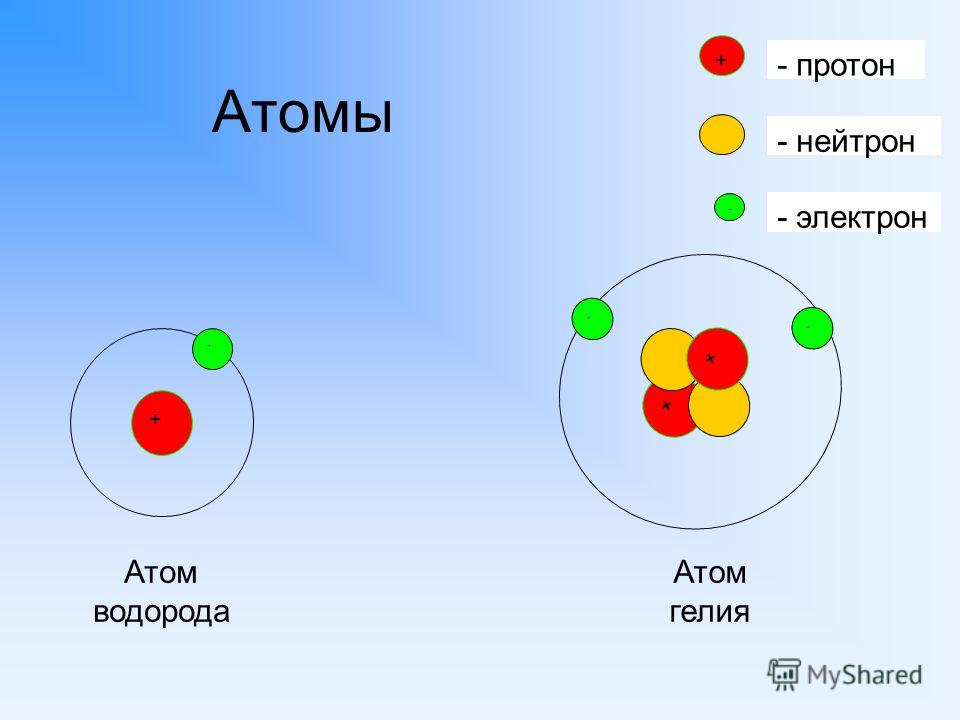 В частности, было известно, что массы атомов химических элементов превышают массу атома водорода в целое число раз (т. е. кратны ей).
В 1919 г. Резерфорд поставил опыт по исследованию взаимодействия α-частиц с ядрами атомов азота.
В частности, было известно, что массы атомов химических элементов превышают массу атома водорода в целое число раз (т. е. кратны ей).
В 1919 г. Резерфорд поставил опыт по исследованию взаимодействия α-частиц с ядрами атомов азота.
В этом опыте α-частица, летящая с огромной скоростью, при попадании в ядро атома азота выбивала из него какую-то частицу. По предположению Резерфорда, этой частицей было ядро атома водорода, которое Резерфорд назвал протоном (от греч. protos – первый). Но поскольку наблюдение этих частиц велось методом сцинтилляций, то нельзя было точно определить, какая именно частица вылетала из ядра атома азота.
Удостовериться в том, что из ядра атома действительно вылетал протон, удалось только несколько лет спустя, когда реакция взаимодействия α-частицы с ядром атома азота была проведена в камере Вильсона.
Через прозрачное круглое окошко камеры Вильсона даже невооружённым глазом можно увидеть треки (т. е. траектории) частиц, быстро движущихся в ней (рис.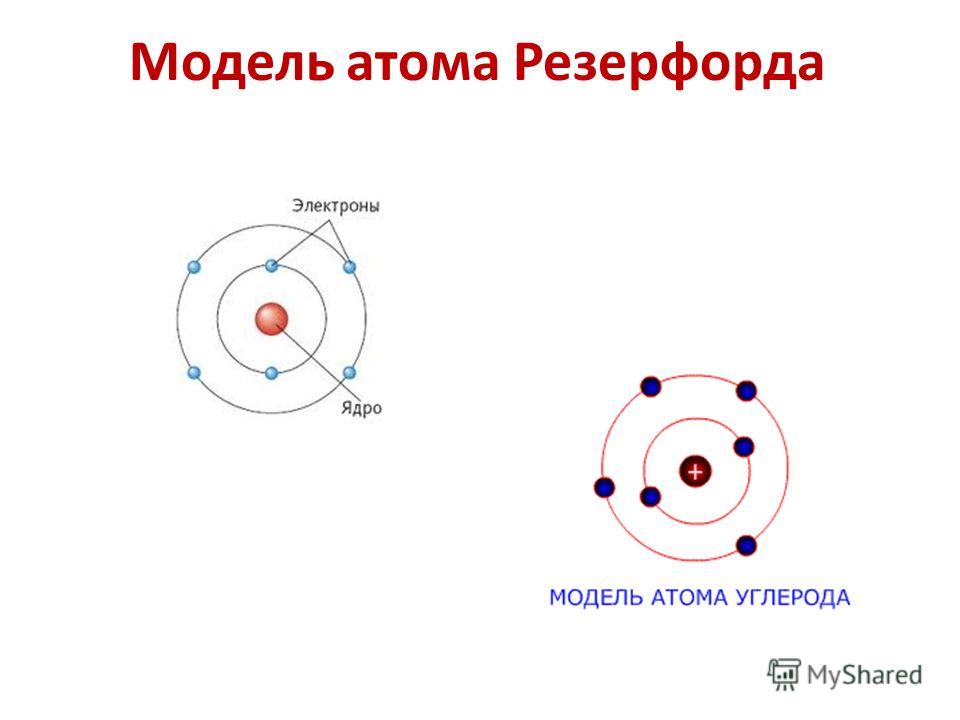 161).
161).
Рис. 161. Фотографии треков заряженных частиц, полученных в камере Вильсона
На рисунке видны расходящиеся веером прямые. Это следы α-частиц, которые пролетели сквозь пространство камеры, не испытав соударений с ядрами атомов азота. Но след одной α-частицы раздваивается, образуя так называемую «вилку». Это означает, что в точке раздвоения трека произошло взаимодействие α-частицы с ядром атома азота, в результате чего образовались ядра атомов кислорода и водорода. То, что образуются именно эти ядра, было выяснено по характеру искривления треков при помещении камеры Вильсона в магнитное поле.
Реакцию взаимодействия ядра азота с α-частицами с образованием ядер кислорода и водорода записывают так:
где символом H обозначен протон, т. е. ядро атома водорода, с массой, приблизительно равной 1 а. е. м. (точнее, 1,0072765 а. е. м.), и положительным зарядом, равным элементарному (т. е. модулю заряда электрона). Для обозначения протона используют также символ).
В дальнейшем было исследовано взаимодействие а-частиц с ядрами атомов других элементов: бора (В), натрия (Na), алюминия (Аl), магния (Mg) и многих других. В результате выяснилось, что из всех этих ядер α-частицы выбивали протоны. Это давало основания полагать, что протоны входят в состав ядер атомов всех химических элементов.
Открытие протона не давало полного ответа на вопрос о том, из каких частиц состоят ядра атомов. Если считать, что атомные ядра состоят только из протонов, то возникает противоречие.
Покажем на примере ядра атома бериллия (), в чём заключается это противоречие.
Допустим, что ядро состоит только из протонов. Поскольку заряд каждого протона равен одному элементарному заряду, то число протонов в ядре должно быть равно зарядовому числу, в данном случае четырём.
Но если бы ядро бериллия действительно состояло только из четырёх протонов, то его масса была бы приблизительно равна 4 а. е. м. (так как масса каждого протона приблизительно равна 1 а. е. м.).
е. м.).
Однако это противоречит опытным данным, согласно которым масса ядра атома бериллия приблизительно равна 9 а. е. м.
Таким образом, становится ясно, что в ядра атомов помимо протонов входят ещё какие-то частицы.
В связи с этим в 1920 г. Резерфордом было высказано предположение о существовании электрически нейтральной частицы с массой, приблизительно равной массе протона.
В начале 30-х гг. XX в. были обнаружены неизвестные ранее лучи, которые назвали бериллиевым излучением, так как они возникали при бомбардировке α-частицами бериллия.
Джеймс Чедвик (1891-1974)
Английский физик-экспериментатор. Работы в области радиоактивности и ядерной физики. Открыл нейтрон
В 1932 г. английский учёный Джеймс Чедвик (ученик Резерфорда) с помощью опытов, проведённых в камере Вильсона, доказал, что бериллиевое излучение представляет собой поток электрически нейтральных частиц, масса которых приблизительно равна массе протона. Отсутствие у исследуемых частиц электрического заряда следовало, в частности, из того, что они не отклонялись ни в электрическом, ни в магнитном поле. А массу частиц удалось оценить по их взаимодействию с другими частицами.
А массу частиц удалось оценить по их взаимодействию с другими частицами.
Эти частицы были названы нейтронами. Точные измерения показали, что масса нейтрона равна 1,0086649 а. е. м., т.е. чуть больше массы протона. Во многих случаях массу нейтрона (как и массу протона) считают равной 1 а. е. м. Поэтому вверху перед символом нейтрона ставят единицу. Нуль внизу означает отсутствие электрического заряда.
Вопросы
- Какой вывод был сделан на основании фотографии треков частиц в камере Вильсона (см. рис. 161)?
- Как иначе называется и каким символом обозначается ядро атома водорода? Каковы его масса и заряд?
- Какое предположение (относительно состава ядер) позволяли сделать результаты опытов по взаимодействию α-частиц с ядрами атомов различных элементов?
- К какому противоречию приводит предположение о том, что ядра атомов состоят только из протонов? Поясните это на примере.
- Как было доказано отсутствие у нейтронов электрического заряда? Как была оценена их масса?
- Как обозначается нейтрон, какова его масса по сравнению с массой протона?
Упражнение 47
Рассмотрите запись ядерной реакции взаимодействия ядер азота и гелия, в результате чего образуются ядра кислорода и водорода. Сравните суммарный заряд взаимодействующих ядер с суммарным зарядом ядер, образованных в результате этого взаимодействия. Сделайте вывод о том, выполняется ли закон сохранения электрического заряда в данной реакции.
Сравните суммарный заряд взаимодействующих ядер с суммарным зарядом ядер, образованных в результате этого взаимодействия. Сделайте вывод о том, выполняется ли закон сохранения электрического заряда в данной реакции.
Сметанный крем с желатином для торта – рецепт
Окунь морской красный рецепты приготовления
1. Кто такие и где встречаются
Атомы — элементарные кирпичики вещества — устроены, на первый взгляд, очень просто. Внутри атома тяжелое и очень компактное ядро, вокруг которого движутся несколько электронов. Законы квантовой механики говорят, что электроны не могут двигаться как угодно, а должны образовывать определенную устойчивую конфигурацию, которая имеет наименьшую энергию и сама по себе уже не развалится. Эта конфигурация называется основным состоянием атома; практически все атомы вокруг нас — именно такие. Вся химия, всё многообразие веществ и материалов возникает из того, как взаимодействуют друг с другом атомы в основном состоянии.
Однако электронную конфигурацию можно «взбаламутить», посветив на атом светом или как-то иначе передав ему дополнительную энергию. Форма электронной оболочки изменится, полная энергия атома повысится, и атом перейдет в новое состояние, которое называется возбужденным. Опять же, по законам квантовой механики возбужденные состояния не могут быть какие угодно, они должны быть строго определенными, с некоторой дополнительной энергией, зависящей от типа возбуждения. Поэтому возбужденные состояния занимают определенные энергетические уровни, причем эта лесенка уровней энергии — своя для каждого сорта атомов.
Форма электронной оболочки изменится, полная энергия атома повысится, и атом перейдет в новое состояние, которое называется возбужденным. Опять же, по законам квантовой механики возбужденные состояния не могут быть какие угодно, они должны быть строго определенными, с некоторой дополнительной энергией, зависящей от типа возбуждения. Поэтому возбужденные состояния занимают определенные энергетические уровни, причем эта лесенка уровней энергии — своя для каждого сорта атомов.
Передав атому очень много лишней энергии, его можно возбудить настолько сильно, что электрон попросту от него оторвется и улетит прочь. Такой процесс называется ионизацией, а получившийся положительно заряженный «недоатом» — ионом. Оставшиеся у иона электроны можно возбуждать дальше, но только лесенка, — или, на научном языке, спектр — возбужденных уровней энергии у него уже будет отличаться от исходного атома. Экстремальный случай возбуждения — это когда у атома отбирают вообще все электроны, и от него остается лишь голое ядро. Так бывает либо при очень высокой температуре, либо в экстремальных условиях, например, при поглощении сверхмощной световой вспышки.
Так бывает либо при очень высокой температуре, либо в экстремальных условиях, например, при поглощении сверхмощной световой вспышки.
То, что у каждого сорта атомов и даже у каждого типа ионов одного элемента есть свой собственный спектр возбужденных состояний, — очень помогает физикам. Это дает им исключительно удобный метод диагностики на расстоянии, без непосредственного контакта, и самого вещества, и физических условий, в которых оно находится.
Например, в глубоком космосе встречаются огромные облака частично ионизированного газа. От него идет свет, в спектре которого встречаются многочисленные линии излучения или поглощения. Расшифровав эти спектры, можно найти в них «личную подпись» каждого типа ионов, находящихся в том далеком облаке. Сравнив интенсивность линий друг с другом, можно узнать, каких ионов там больше, а отсюда оценить температуру и плотность газа. Ну а если вдруг в спектре светящихся космических облаков встретится какая-то «анонимка» — линия излучения, не соответствующая ни одному известному иону, — это производит в физике настоящий фурор. Один пример такой ситуации, которая развивается прямо на наших глазах, см. в новостях В спектрах скоплений галактик обнаружена неизвестная линия излучения и Новые результаты не подтверждают загадочную рентгеновскую линию излучения
Один пример такой ситуации, которая развивается прямо на наших глазах, см. в новостях В спектрах скоплений галактик обнаружена неизвестная линия излучения и Новые результаты не подтверждают загадочную рентгеновскую линию излучения
8: Атом водорода – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 4519
- Дэвид М. Хэнсон, Эрика Харви, Роберт Суини, Тереза Джулия Зелински
- Цифровая библиотека химического образования (ChemEd DL)
Атом водорода представляет особый интерес, поскольку волновые функции атома водорода, полученные путем решения уравнения Шредингера для атома водорода, представляют собой набор функций, называемых атомными орбиталями, которые можно использовать для описания более сложных атомов и даже молекул. Это свойство особенно полезно, поскольку, как мы увидим в главах 9 и 10, уравнение Шредингера для более сложных химических систем не может быть решено аналитически. Используя атомные орбитали, полученные из решения уравнения Шредингера для атома водорода, мы можем описать структуру и реакционную способность молекул и характер химических связей. Расстояния и интенсивности спектроскопических переходов между электронными состояниями атома водорода также количественно предсказываются квантовой обработкой этой системы.
Это свойство особенно полезно, поскольку, как мы увидим в главах 9 и 10, уравнение Шредингера для более сложных химических систем не может быть решено аналитически. Используя атомные орбитали, полученные из решения уравнения Шредингера для атома водорода, мы можем описать структуру и реакционную способность молекул и характер химических связей. Расстояния и интенсивности спектроскопических переходов между электронными состояниями атома водорода также количественно предсказываются квантовой обработкой этой системы.
- 8.1: Уравнение Шредингера
- Атом водорода, состоящий из электрона и протона, представляет собой систему из двух частиц, и внутреннее движение двух частиц вокруг их центра масс эквивалентно движению одной частица с уменьшенной массой.
- 8.2: Волновые функции
- Решениями уравнения Шредингера для атома водорода являются функции, которые являются произведениями сферической гармонической функции и радиальной функции.

- 8.3: Уровни орбитальной энергии, правила выбора и спектроскопия
- Собственные значения орбитальной энергии, полученные путем решения уравнения Шрёдингера для атома водорода, отрицательны и стремятся к нулю, когда квантовое число n приближается к бесконечности. Поскольку атом водорода используется в качестве основы для многоэлектронных систем, полезно помнить полную энергию (энергию связи) атома водорода в основном состоянии.
- 8.4: Магнитные свойства и эффект Зеемана
- Электроны в атомах также являются движущимися зарядами с угловым моментом, поэтому они также создают магнитный диполь, поэтому некоторые материалы являются магнитными. Магнитный диполь взаимодействует с приложенным магнитным полем, и энергия этого взаимодействия определяется скалярным произведением магнитного дипольного момента и магнитного поля.
- 8.
 5: Открытие спина электрона
5: Открытие спина электрона - Затем у нас есть заряд, движущийся по кругу, угловой момент и магнитный момент, который взаимодействует с магнитным полем и дает нам эффект Зеемана, который мы наблюдали. Чтобы описать спин электрона с точки зрения квантовой механики, мы должны иметь спиновые волновые функции и спиновые операторы. Свойства спиновых состояний выводятся из экспериментальных наблюдений и по аналогии с нашей трактовкой состояний, возникающих из-за орбитального углового момента электрона. 9{2+}\) и т. д. Гамильтониан меняется в двух местах. Что наиболее важно, член потенциальной энергии изменен для учета заряда ядра, который представляет собой атомный номер атома или иона, \(Z\), умноженный на фундаментальную единицу заряда, \(e\).
- 8.
- 8.7: Спин-орбитали и электронные конфигурации
- Волновые функции, полученные путем решения уравнения Шрёдингера для атома водорода, связаны с орбитальным угловым движением и часто называются пространственными волновыми функциями, чтобы отличить их от спиновых волновых функций.
 Полная волновая функция электрона в атоме водорода должна содержать как пространственную, так и спиновую составляющие.
Полная волновая функция электрона в атоме водорода должна содержать как пространственную, так и спиновую составляющие.
- 8.8: Связь углового момента и спектроскопических символов
- Наблюдение тонкой структуры в эмиссии атомарного водорода показало, что диаграмма орбитальных энергетических уровней не полностью описывает энергетические уровни атомов. Эта тонкая структура также предоставила в то время ключевое свидетельство существования спина электрона, которое использовалось не только для качественного объяснения мультиплетов, но и для высокоточных расчетов расщеплений мультиплетов.
- 8.E: Атом водорода (упражнения)
- Упражнения для «Квантовые состояния атомов и молекул» TextMap Zielinksi et al.
- 8.S: The Hydrogen Atom (Summary)
/или под кураторством Дэвида М. Хэнсона, Эрики Харви, Роберта Суини, Терезы Джулии Зелински через исходный контент, отредактированный в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Глава
- Автор
- Тереза Юлия Зелински
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.
- Теги
- источник@https://web.archive.org/web/20200619182410/http://www.
 chemeddl.org
chemeddl.org
- источник@https://web.archive.org/web/20200619182410/http://www.
атомов водорода | Уточнение кристаллической структуры: руководство кристаллографа по SHELXL
Фильтр поиска панели навигации Oxford Academic Уточнение структуры кристаллов: руководство кристаллографа по SHELXLCrystallographyBooksJournals Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford Academic Уточнение структуры кристаллов: руководство кристаллографа по SHELXLCrystallographyBooksJournals Термин поиска на микросайте
Расширенный поиск
Иконка Цитировать Цитировать
Разрешения
- Делиться
- Твиттер
- Подробнее
Cite
Müller, Peter,
‘Hydrogen atoms’
,
Crystal Structure Refinement: A Crystallographer’s Guide to SHELXL
, International Union of Crystallography Texts on Crystallography
(
Oxford,
2006;
онлайн-издание,
Oxford Academic
, 1 сентября 2010 г.
), https://doi.org/10.1093/acprof:oso/9780198570769.003.0003,
, по состоянию на 5 декабря 2022 г.
Выберите формат Выберите format.ris (Mendeley, Papers, Zotero).enw (EndNote).bibtex (BibTex).txt (Medlars, RefWorks)
Закрыть
Фильтр поиска панели навигации Oxford Academic Уточнение структуры кристаллов: руководство кристаллографа по SHELXLCrystallographyBooksJournals Термин поиска мобильного микросайта
Закрыть
Фильтр поиска панели навигации Oxford Academic Уточнение структуры кристаллов: руководство кристаллографа по SHELXLCrystallographyBooksJournals Термин поиска на микросайте
Advanced Search
Abstract
Атомы водорода играют важную роль в химии, однако их трудно локализовать в рентгеновских структурах. Электронная плотность измеряется с помощью рентгеновской дифракции, а водород имеет только один электрон, который не находится в ядре. Поэтому атомы водорода, как известно, трудно обнаружить методами рентгеновской дифракции. Особенно для атомов водорода, связанных с углеродом, обычно можно рассчитать положения водорода, в то время как кислые атомы водорода, такие как в NH или OH, должны быть обнаружены в экспериментальной электронной плотности. Особенно трудно обнаружить атомы водорода в гидридах тяжелых металлов. В этой главе объясняется теория, приводятся три подробных примера уточнения атома водорода и описывается, как рассчитать водородные связи.
Электронная плотность измеряется с помощью рентгеновской дифракции, а водород имеет только один электрон, который не находится в ядре. Поэтому атомы водорода, как известно, трудно обнаружить методами рентгеновской дифракции. Особенно для атомов водорода, связанных с углеродом, обычно можно рассчитать положения водорода, в то время как кислые атомы водорода, такие как в NH или OH, должны быть обнаружены в экспериментальной электронной плотности. Особенно трудно обнаружить атомы водорода в гидридах тяжелых металлов. В этой главе объясняется теория, приводятся три подробных примера уточнения атома водорода и описывается, как рассчитать водородные связи.
Ключевые слова: атомы водорода, длины связей X-H, расчет положений водорода, кислотные атомы водорода, гидриды металлов, водородные связи
Тема
Кристаллография
В настоящее время у вас нет доступа к этой главе.
Войти
Получить помощь с доступом
Получить помощь с доступом
Доступ для учреждений
Доступ к контенту в Oxford Academic часто предоставляется посредством институциональных подписок и покупок. Если вы являетесь членом учреждения с активной учетной записью, вы можете получить доступ к контенту одним из следующих способов:
Доступ на основе IP
Как правило, доступ предоставляется через институциональную сеть к диапазону IP-адресов. Эта аутентификация происходит автоматически, и невозможно выйти из учетной записи с IP-аутентификацией.
Войдите через свое учреждение
Выберите этот вариант, чтобы получить удаленный доступ за пределами вашего учреждения. Технология Shibboleth/Open Athens используется для обеспечения единого входа между веб-сайтом вашего учебного заведения и Oxford Academic.
- Щелкните Войти через свое учреждение.
- Выберите свое учреждение из предоставленного списка, после чего вы перейдете на веб-сайт вашего учреждения для входа.
- Находясь на сайте учреждения, используйте учетные данные, предоставленные вашим учреждением. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если вашего учреждения нет в списке или вы не можете войти на веб-сайт своего учреждения, обратитесь к своему библиотекарю или администратору.
Войти с помощью читательского билета
Введите номер своего читательского билета, чтобы войти в систему. Если вы не можете войти в систему, обратитесь к своему библиотекарю.
Члены общества
Доступ члена общества к журналу достигается одним из следующих способов:
Войти через сайт сообщества
Многие общества предлагают единый вход между веб-сайтом общества и Oxford Academic. Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
Если вы видите «Войти через сайт сообщества» на панели входа в журнале:
- Щелкните Войти через сайт сообщества.
- При посещении сайта общества используйте учетные данные, предоставленные этим обществом. Не используйте личную учетную запись Oxford Academic.
- После успешного входа вы вернетесь в Oxford Academic.
Если у вас нет учетной записи сообщества или вы забыли свое имя пользователя или пароль, обратитесь в свое общество.
Вход через личный кабинет
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам. Смотри ниже.
Личный кабинет
Личную учетную запись можно использовать для получения оповещений по электронной почте, сохранения результатов поиска, покупки контента и активации подписок.
Некоторые общества используют личные аккаунты Oxford Academic для предоставления доступа своим членам.
Просмотр учетных записей, вошедших в систему
Щелкните значок учетной записи в правом верхнем углу, чтобы:
- Просмотр вашей личной учетной записи и доступ к функциям управления учетной записью.
- Просмотр институциональных учетных записей, предоставляющих доступ.
Выполнен вход, но нет доступа к содержимому
Oxford Academic предлагает широкий ассортимент продукции. Подписка учреждения может не распространяться на контент, к которому вы пытаетесь получить доступ. Если вы считаете, что у вас должен быть доступ к этому контенту, обратитесь к своему библиотекарю.
Ведение счетов организаций
Для библиотекарей и администраторов ваша личная учетная запись также предоставляет доступ к управлению институциональной учетной записью. Здесь вы найдете параметры для просмотра и активации подписок, управления институциональными настройками и параметрами доступа, доступа к статистике использования и т.


 5: Открытие спина электрона
5: Открытие спина электрона Полная волновая функция электрона в атоме водорода должна содержать как пространственную, так и спиновую составляющие.
Полная волновая функция электрона в атоме водорода должна содержать как пространственную, так и спиновую составляющие. chemeddl.org
chemeddl.org