Подвижный элемент: геологи установили необычное поведение золота на крупнейшем российском месторождении
Учёные СФУ изучили процессы аккумуляции и миграции золота в окисленных рудах Олимпиадинского месторождения — одного из крупнейших месторождений золота в России и в мире.
Олимпиадинское месторождение находится на полтысячи километров севернее города Красноярска. Начиная с 80-х годов 20 века на месторождении добыли более пятисот тонн золота и, по расчётам специалистов, еще около тысячи тонн осталось в недрах.
Первичные руды Олимпиады — это плотные породы с вкраплением сульфидных минералов (соединений металлов и серы) и очень мелкого самородного золота (рис. 1). Содержание золота в таких рудах составляет 3-5 граммов на тонну.
Месторождение образовалось около 800 миллионов лет назад. За это время на его руды воздействовали природные процессы, главными компонентами которых являются вода и кислород. Под их действием сульфиды и многие другие минералы разрушались и окислялись, превращаясь в бурую рыхлую массу — так образовались окисленные руды.
Максимальное содержание золота в окисленных рудах Олимпиадинского месторождения достигало 450 граммов на тонну. Ранее считалось, что в таких условиях золото ведет себя как инертный металл — не подвергается коррозии и окислению, и, в отличие от большинства «неблагородных» металлов, не реагирует с щелочами и кислотами (кроме «царской водки»). Однако исследователи СФУ получили доказательства его подвижности и активности золота в гипергенных условиях, при воздействии на него особых геологических и климатических факторов.
Для этого научный коллектив, состоящий из университетских исследователей и специалистов предприятия «Норильскгеология» (Красноярский край), исследовал четырёхсотметровую толщу окисленных руд Олимпиадинского месторождения. Оказалось, что при окислении первичных руд, золото, содержащееся в сульфидных минералах в виде отдельных атомов, высвобождается, образует комплексные соединения с другими элементами и легко мигрирует.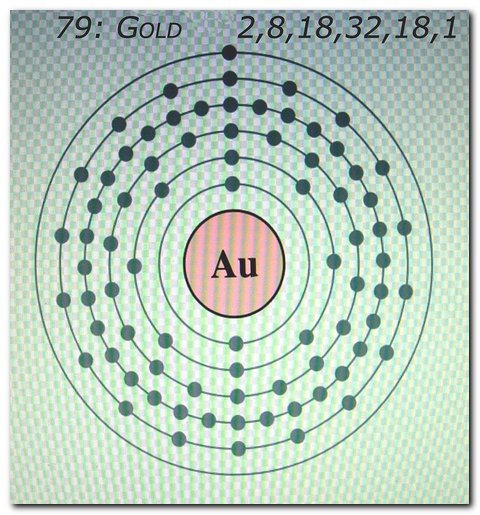
Рис. 1. Самородное золото (желтое) в трещинах кристалла арсенопирита (белое)
Рис. 2. Губчатое золото (светлое) окисленных руд
Рис. 3. Глобули золота окисленных руд
Агрессивные воды растворяют и самородное золото, и распространённое на месторождении его соединение с сурьмой — минерал ауростибит (AuSb2). В процессе образуются частицы так называемого губчатого золота (рис. 2), похожего на морскую губку с многочисленными порами, увеличивающими свободную поверхность частиц. Такое строение позволяет агрессивным растворам интенсивней растворять благородный металл.
Стабильность комплексных соединений золота различна, и при изменении условий они могут разрушаться, а освободившееся атомарное золото группируется в нано- и микрообособления, которые зачастую обретают форму шара (глобули) или даже кристалла, что и было обнаружено на месторождении (рис. 3). Сейчас известно, что подобные процессы могут происходить даже с участием бактерий, которые способны восстанавливать наночастицы металлического золота из его соединений с другими элементами.
Рис. 3. Микрокристаллы золота окисленных руд
Рис. 3. Микрокристаллы золота окисленных руд
Рис. 3. Микрокристаллы золота окисленных руд
Рис. 3. Микрокристаллы золота окисленных руд
Исследователи отмечают, что процесс формирования окисленных руд, а также миграция и новообразование золота Олимпиадинского месторождения хорошо иллюстрируются в разрезе толщи окисленных руд. В нижней части содержится много реликтового золота первичных руд, а также большое количество губчатого золота. Выше по разрезу доля губчатого и реликтового золота снижается, но увеличивается количество новообразованных глобуль и микрокристаллов. А вот наибольшее количество глобуль и микрокристаллов, как и максимальное суммарное содержание золота (до 60 грамм на тонну в изученных пробах), наблюдается в верхнем слое изученного разреза. Эта зона примечательна еще тем, что здесь найден минерал церианит (оксид церия, CeO2), выступающий индикатором резкого изменения условий окружающей среды.
«Хотя окисленные руды Олимпиадинского месторождения были отработаны еще в 2007 году, изучение форм нахождения, поведения и распределения золота в них важно по ряду причин. В первую очередь, окисленные руды ценны, поскольку не требуют сложных процессов обогащения и рентабельны даже при низких содержаниях золота в них. С другой стороны, зоны окисления золоторудных месторождений представляют и фундаментальный интерес, связанный с экзогенной геохимией и металлогенией золота», — отметил ведущий инженер кафедры геологии, минералогии и петрографии СФУ Сергей Сильянов.
Соавтор исследования, инженер аналитической лаборатории Научно-технологического R&D центра ГМК «Норильский никель»
«Нами было изучено немало техногенных объектов — там процессы переноса вещества и образования новых минералов происходят особенно быстро.Удивительно было увидеть, насколько похожи микрокристаллы золота и многих других минералов из окисленных руд Олимпиадинского месторождения на новообразованные минералы других объектов. Такое внешнее сходство не всегда списывается на конвергенцию — механизмы формирования новых минералов в столь разных обстановках схожи, а изучение одних процессов в данном случае помогает понять все остальные»
, — сказал учёный.
Выполненное сибирскими учёными исследование показало, что формирование окисленных руд Олимпиадинского месторождения происходило при сложных геохимических условиях, в которых золото вело себя как подвижный элемент, способный и к перераспределению, и к переотложению на геохимических барьерах (участках изменения условий окружающей среды).
Работа выполнена при финансовой поддержке РФФИ в рамках научного проекта № 19-35-90017\19.
Электронно-графические формулы s-, p- и d-элементов 6 периода. Задача 58
Задача 58.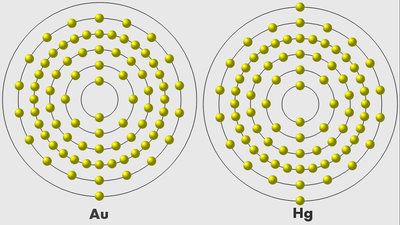
Напишите электронно-графическую формулу для s-, p- и d-элементов 6-го периода, определите их валентные электроны и охарактеризуйте их с помощью квантовых чисел.
Решение:
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение –
1s►2s►2р►3s►3р►4s►3d►4р►5s►4d►5р►6s►(5d1)►4f►5d►6р►7s►(6d1-2)►5f►6d►7р
а) Элемент № 55
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.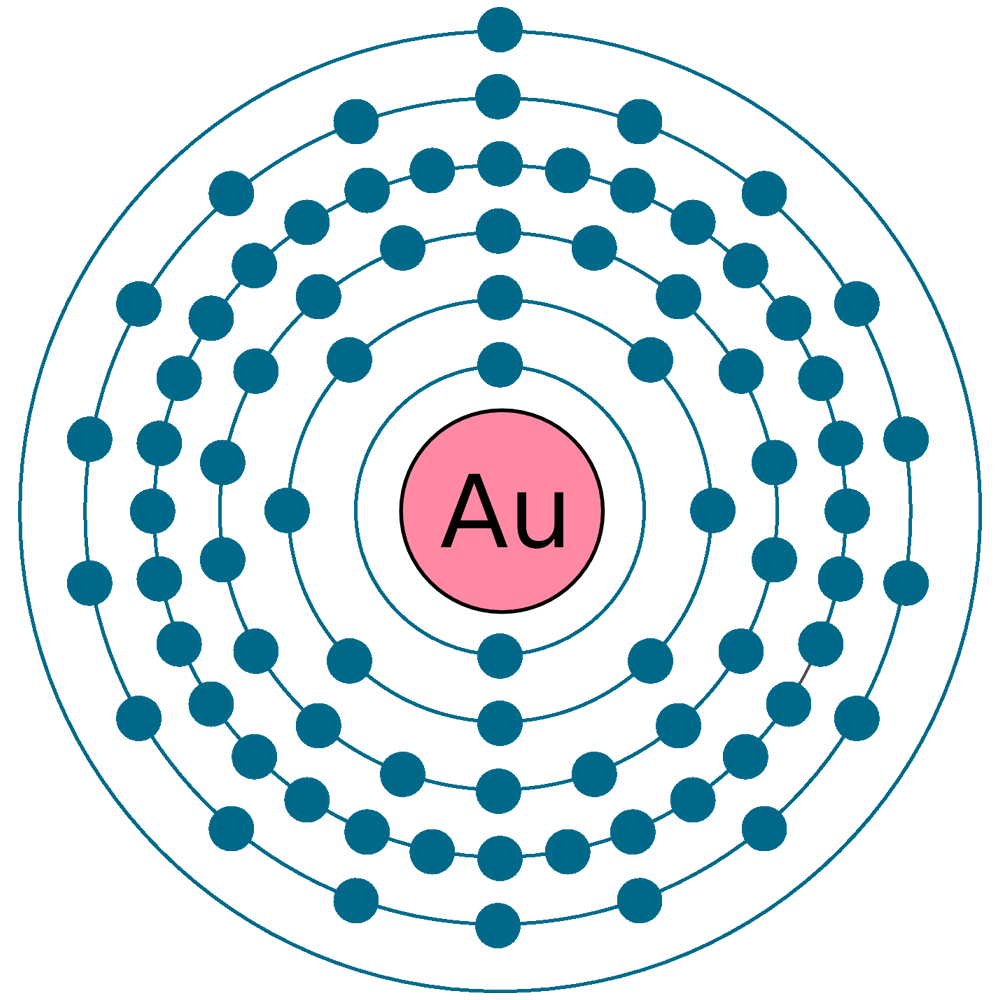
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s1
Валентный электрон цезия 6s1 – находятся на 6s-подуровне На валентной орбитали атома Cs находится 1 электрон. Поэтому элемент помещают в первую группу периодической системы Д.И.Менделеева. Цезий является s-элементом.
б) Элемент № 56
Для элемента № 56 – бария (Ва – порядковый № 56) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2
Валентные электроны бария 6s2 – находятся на 6s-подуровне На валентной орбитали атома Ва находятся 2 электрона. Поэтому элемент помещают во вторую группу периодической системы Д.И.Менделеева. Барий является s-элементом.
Поэтому элемент помещают во вторую группу периодической системы Д.И.Менделеева. Барий является s-элементом.
в) Элемент № 57
Для элемента № 57- лантан (La – порядковый № 57) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 5d1
Валентные электроны лантана 6s2 5d1 – находятся на 6s- и 5d-подуровнях. На валентных орбиталях атома La находится 3 электрона. Поэтому элемент помещают в третью группу периодической системы Д.И.Менделеева. Лантан относится к d-элементам.
г) Элемент № 72
Для элемента № 72 – гафний (Hf – порядковый № 72) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d2
Валентные электроны циркония 6s2 5d2 – находятся на 6s- и 5d-подуровнях.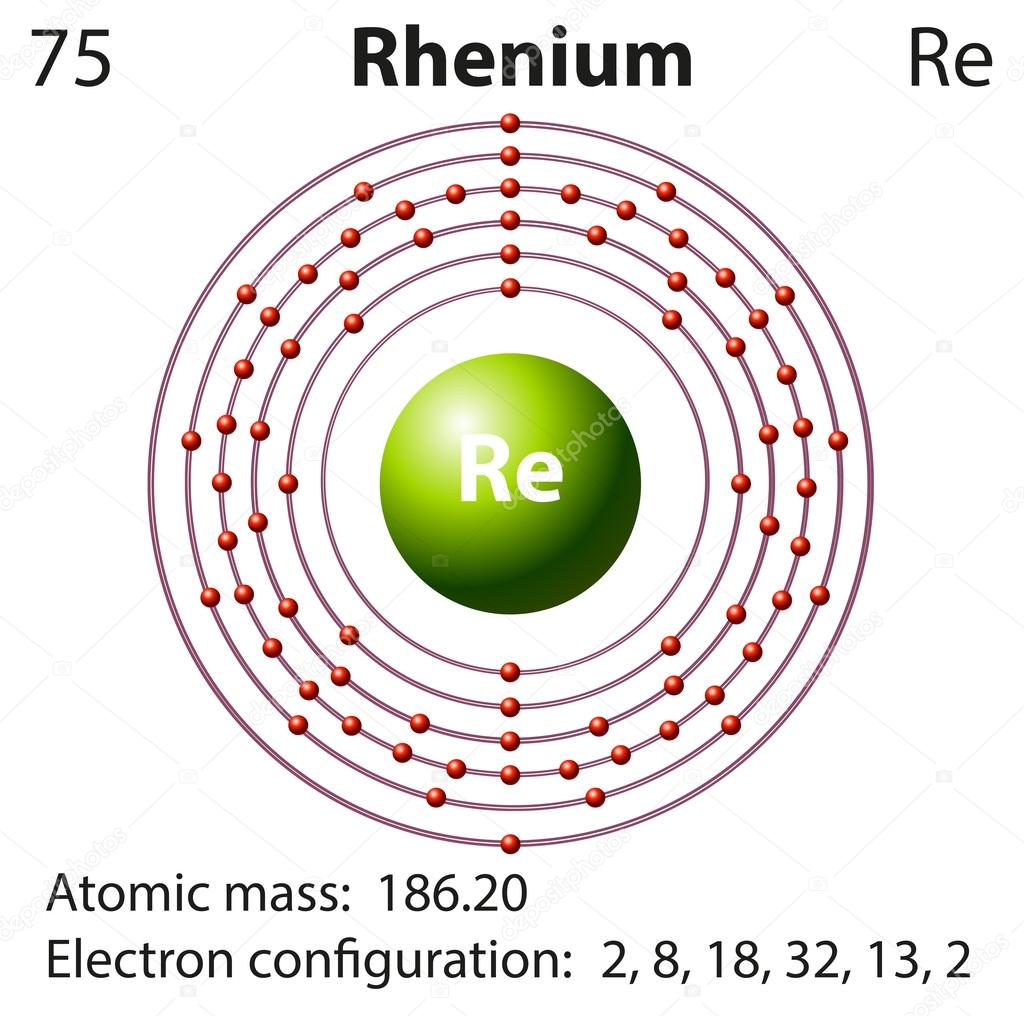 На валентных орбиталях атома Hf находится 4 электрона. Поэтому элемент помещают в четвертую группу периодической системы Д.И.Менделеева. Гафний относится к d-элементам.
На валентных орбиталях атома Hf находится 4 электрона. Поэтому элемент помещают в четвертую группу периодической системы Д.И.Менделеева. Гафний относится к d-элементам.
д) Элемент № 73
Для элемента № 73 – тантала (Та – порядковый № 73) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d3
Валентные электроны тантала 6s2 5d3 – находятся на 6s- и 5d-подуровнях. На валентных орбиталях атома Та находится 5 электронов. Поэтому элемент помещают в пятую группу периодической системы Д.И.Менделеева. Тантал относится к d-элементам.
е) Элемент № 74 – вольфрам (W – порядковый №74) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d4
Валентные электроны вольфрама 6s2 5d4 – находятся на 6s- и 5d-подуровнях. На валентных орбиталях атома W находится 6 электронов. Поэтому элемент помещают в шестую группу периодической системы Д.И.Менделеева. Вольфрам относится к d-элементам.
На валентных орбиталях атома W находится 6 электронов. Поэтому элемент помещают в шестую группу периодической системы Д.И.Менделеева. Вольфрам относится к d-элементам.
ж) Элемент № 75 – рений (Re – порядковый № 75) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d5
Валентные электроны рениия 6s2 5d5 – находятся на 6s- и 5d-подуровнях. На валентных орбиталях атома Re находится 7 электронов. Поэтому элемент помещают в седьмую группу периодической системы Д.И.Менделеева. Рений относится к d-элементам.
з) Элемент № 76- осмий (Os – порядковый № 76) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d6
Валентные электроны осмия 6s2 5d6 – находятся на 6s- и 5d-подуровнях. На валентных орбиталях атома Os находится 8 электронов. Поэтому элемент помещают в восьмую группу периодической системы Д.И.Менделеева. Осмий относится к d-элементам.
На валентных орбиталях атома Os находится 8 электронов. Поэтому элемент помещают в восьмую группу периодической системы Д.И.Менделеева. Осмий относится к d-элементам.
к) Элемент № 77 – иридий (Ir – порядковый № 77) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d7
Валентные электроны иридия 6s2 5d7 – находятся на 6s- и 5d-подуровнях. На валентных орбиталях атома Ir находится 9 электронов. Поэтому элемент помещают в девятую группу периодической системы Д.И.Менделеева. Иридий относится к d-элементам.
л) Элемент № 78 – платина (Pt – порядковый № 78) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s1 4f14 5d9
Валентные электроны платина 6s1 и 5d9 – находятся на 6s- и 5d-подуровне.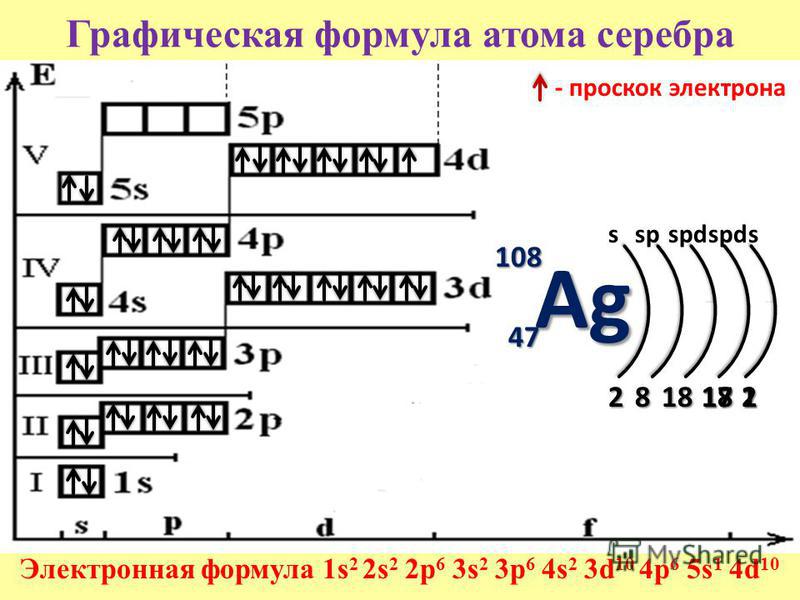 На валентной орбитали атома Pt находится 10 электронов. Поэтому элемент помещают в десятую группу периодической системы Д.И.Менделеева. В электронной оболочке элемента платины наблюдается провал одного электрона с подуровня 6s на уровень 5d. Электронная конфигурация валентных электронов атома платины 6s1 5d9 энергетически более выгодна, чем конфигурации 6s2 5d8. Платина относится к d-элементам.
На валентной орбитали атома Pt находится 10 электронов. Поэтому элемент помещают в десятую группу периодической системы Д.И.Менделеева. В электронной оболочке элемента платины наблюдается провал одного электрона с подуровня 6s на уровень 5d. Электронная конфигурация валентных электронов атома платины 6s1 5d9 энергетически более выгодна, чем конфигурации 6s2 5d8. Платина относится к d-элементам.
м) Элемент № 79 – золото (Au – порядковый № 79) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s1 4f14 5d10
Валентные электроны золота 6s1 5d10 – находятся на 6s- и 5d-подуровнях. На валентных орбиталях атома Au находится 11 электронов. Поэтому элемент помещают в одиннадцатую группу периодической системы Д. И.Менделеева.
И.Менделеева.
У атома золотта наблюдается проскок (“провал”): один электрон с 6s-подуровня переходит на 5d-подуровень. Это объясняется тем, что состояние атома считается более энергетически выгодным, если на d-подуровне находится не 9, а 10 электронов. Потому что энергетически более выгоднее для атома золота, когда заполнены все пять d-ячеек на 5d-подуровне, но не тогда когда четыре d-ячейки заполнены, а на пятой только один электрон. Для заполнения пятой d-ячейки 5d-подуровня один электрон 6s-подуровня переходит на 5d-подуровнь, как бы “проваливается”. Таким образом, целиком заполненный 5d-подуровень является энергетически выгодным для атома золота. Золото относится к d-элементам.
н) Элемент № 80 – ртуть (Hg – порядковый № 80) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d10
Валентные электроны ртути 6s2 5d10 – находятся на 6s- и 5d-подуровнях. На валентных орбиталях атома Hg находится 12 электронов. Поэтому элемент помещают в двенадцатую группу периодической системы Д.И.Менделеева. Ртуть относится к d-элементам.
На валентных орбиталях атома Hg находится 12 электронов. Поэтому элемент помещают в двенадцатую группу периодической системы Д.И.Менделеева. Ртуть относится к d-элементам.
о) Элемент № 81 – таллий (Tl – порядковый № 81) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d10 6р1
Валентные электроны таллия 6s2 4d10 6р1 – находятся на 6s-, 5d- и 6р-подуровнях. На валентных орбиталях атома Tl находится 13 электронов. Поэтому элемент помещают в тринадцатую группу периодической системы Д.И.Менделеева. Таллий относится к р-элементам.
п) Элемент № 82 – свинец (Pb – порядковый № 82) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d10 6р2
Валентные электроны свинца 6s2 4d10 6р2 – находятся на 6s-, 5d- и 6р-подуровнях. На валентных орбиталях атома Pb находится 14 электронов. Поэтому элемент помещают в четырнадцатую группу периодической системы Д.И.Менделеева. Свинец относится к р-элементам.
На валентных орбиталях атома Pb находится 14 электронов. Поэтому элемент помещают в четырнадцатую группу периодической системы Д.И.Менделеева. Свинец относится к р-элементам.
р) Элемент № 83 – висмут (Bi – порядковый № 83) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d10 6р3
Валентные электроны висмута 6s2 5d10 6р3 – находятся на 6s-, 5d- и 6р-подуровнях. На валентных орбиталях атома Bi находится 15 электронов. Поэтому элемент помещают в пятнадцатую группу периодической системы Д.И.Менделеева. Висмут относится к р-элементам.
с) Элемент № 84 – полоний (Ро – порядковый № 84) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d10 6р4
Валентные электроны полония 6s2 5d10 6р4 – находятся на 5s-, 4d- и 5р-подуровнях. На валентных орбиталях атома Ро находится 16 электронов. Поэтому элемент помещают в шестнадцатую группу периодической системы Д.И.Менделеева. Полоний относится к р-элементам.
На валентных орбиталях атома Ро находится 16 электронов. Поэтому элемент помещают в шестнадцатую группу периодической системы Д.И.Менделеева. Полоний относится к р-элементам.
с) Элемент № 85 – астат (At – порядковый № 85) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d10 6р5
Валентные электроны астата 6s2 5d10 6р5 – находятся на 5s-, 4d- и 5р-подуровнях. На валентных орбиталях атома At находится 17 электронов. Поэтому элемент помещают в семнадцатую группу периодической системы Д.И.Менделеева. Астат относится к р-элементам.
т) Элемент № 86 – радон (Rn – порядковый № 86) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d10 6р6
Валентные электроны радона 6s2 4d10 5р6 – находятся на 6s-, 5d- и 6р-подуровнях.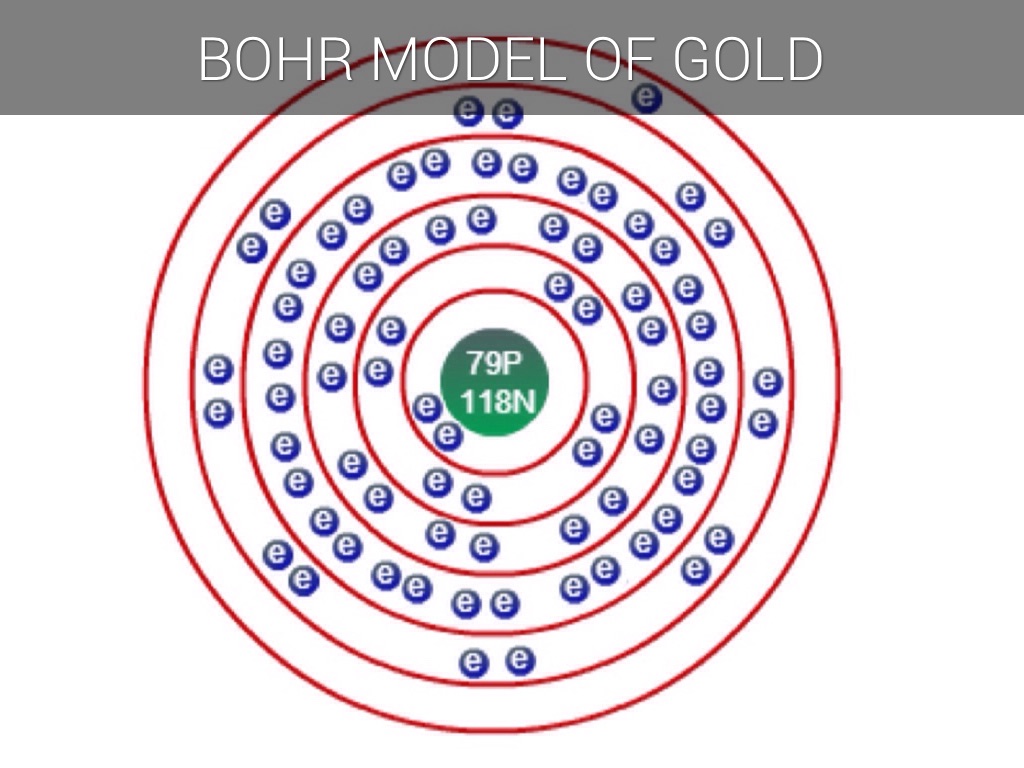 На валентных орбиталях атома Rn находится 18 электронов. Поэтому элемент помещают в восемнадцатую группу периодической системы Д.И.Менделеева. Радон относится к р-элементам.
На валентных орбиталях атома Rn находится 18 электронов. Поэтому элемент помещают в восемнадцатую группу периодической системы Д.И.Менделеева. Радон относится к р-элементам.
Опыты Резерфорда по рассеянию альфа-частиц — урок. Физика, 9 класс.
Эксперимент по рассеиванию альфа-частиц
Открытие электрона, рентгеновского излучения и явления радиоактивности свидетельствовало о том, что представление об атоме как неделимой частице являлось неверным. К концу \(XIX\) века стало понятно, что атом должен иметь сложное строение. Большой вклад в изучение строения атома внёс физик-экспериментатор Эрнест Резерфорд.
Эрнест Резерфорд
В \(1904\) году Резерфорд начал свои эксперименты по бомбардировке альфа-частицами тонких металлических пластин (золотых и платиновых) для изучения структуры атомов, из которых состоят пластины.
Альфа-частица — ионизированный атом гелия.
Альфа-частица — это массивная (масса альфа-частицы в несколько тысяч раз больше, чем масса электрона) положительно заряженная частица. Заряд альфа-частицы в два раза больше элементарного заряда.
Заряд альфа-частицы в два раза больше элементарного заряда.
Схематично установка Резерфорда изображена на рисунке ниже.
В толстостенном свинцовом футляре (\(1\)) находится радиоактивное вещество (\(2\)), излучающее поток альфа-частиц. Через небольшое отверстие (\(3\)) поток альфа-частиц направляется на тонкую золотую фольгу (\(4\)) (толщиной порядка \(0,1\) мк). За фольгой располагается экран, покрытый сернистым цинком (\(5\)). При столкновении альфа-частицы на экране наблюдается вспышка.
Согласно модели строения атома по Томсону, альфа-частицы должны столкнуться с большими плотными атомами и разлететься под разными углами. Однако опыт показал, что большинство альфа-частиц пролетают беспрепятственно через пластинку металла (\(6\)). И только небольшая часть всех альфа-частиц изменяет направление движения, отклоняясь на небольшие углы (\(7\)). А некоторые частицы и вовсе отлетают от фольги в обратном направлении (\(8\)).
Результаты опыта были удивительными. Только в \(1911\) году Резерфорд смог объяснить результаты опытов, предложив новую модель строения атома.
Только в \(1911\) году Резерфорд смог объяснить результаты опытов, предложив новую модель строения атома.
Ядерная модель строения атома
Так как большинство альфа-частиц свободно проходило через фольгу, это означало, что практически всё пространство, через которое проходит поток альфа-частиц, — это пустота. Где же тогда «спрятана» вся масса атома? Резерфорд предположил, что практически вся масса атома сосредоточена в очень маленьком объёме — ядре атома. Было очевидно, что ядро должно быть положительно заряжено. Когда альфа-частица пролетает достаточно близко от такого ядра, то из-за Кулоновских сил отталкивания происходит отклонение от первоначального направления движения частицы. А при столкновении с ядром частица отскакивает в обратном направлении. По расчётам Резерфорда, ядро атома должно было иметь размер примерно в \(3000\) раз меньший, чем атом. Остальное пространство атома должны занимать электроны.
Планетарная модель строения атома
Итак, стало понятно, что «пудинговая модель строения атома» неверна. На основе экспериментальных данных была предложена новая модель строения атома, которая получила название «планетарная модель строения атома».
На основе экспериментальных данных была предложена новая модель строения атома, которая получила название «планетарная модель строения атома».
Обрати внимание!
Согласно модели Резерфорда, атом состоит из очень маленького положительно заряженного ядра, размер которого в тысячи раз меньше самого атома, и электронов, которые вращаются вокруг ядра по круговым орбитам.
Метафорическое название данной модели обусловлено сравнением вращения электронов относительно ядра с обращением планет вокруг Солнца. Однако классическая электродинамика постулирует, что движущийся с ускорением заряд является источником «уносящих» энергию электромагнитных волн. Поэтому электроны должны были бы «растерять» энергию, что привело бы к нарушению наблюдаемому на опыте свойству устойчивости атомных систем без излучения электромагнитных волн. Данный факт отражает ограниченность применения законов классической физики к описанию микромира.
Опыт Резерфорда. Методические материалы
Цифровой ресурс может использоваться для обучения в рамках программы средней школы (профильного и углубленного уровней).
Компьютерная программа моделирует классический опыт Резерфорда по зондированию атома с помощью α-частиц, на основе результатов которого была предложена планетарная модель строения атома.
Краткая теория
Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909–1911 годах.
Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но все же значительно меньше скорости света).
α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда представлена на рис. 1.
Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда представлена на рис. 1.
|
Рис. 1. Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп |
От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Опыты Резерфорда и его сотрудников привели к выводу о том, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10–14–10–15 м. Это ядро занимает только 10–12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома.
Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны. Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны. Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
Планетарная модель атома, предложенная Резерфордом, явилась крупным шагом вперед в развитии знаний о строении атома. Она была совершенно необходимой для объяснения опытов по рассеянию α-частиц, однако оказалась неспособной объяснить сам факт длительного существования атома, т. е. его устойчивость. По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 10–8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.
Работа с моделью
Пользователь имеет возможность:
- наблюдать рассеяние частиц на неподвижном ядре золота;
- изменять прицельное расстояние и начальную скорость частицы;
- измерять угол рассеяния частицы;
- исследовать кривую рассеяния при бомбардировке ядра золота потоком частиц с заданной энергией в автоматическом режиме.
Рекомендации по применению модели
Данная модель может быть применена в качестве иллюстрации на уроках изучения нового материала в 9 и 11 классах по теме «Строение атома». На примере этой модели можно рассмотреть с учащимися опыт Резерфорда по определению строения атома.
Пример планирования урока с использованием модели
Тема «Строение атома»
Цель урока: рассмотреть модель атома Томпсона, на опыте Резерфорда обосновать не состоятельность модели атома Томпсона, дать планетарную модель атома, рассмотреть модели атомов различных химических элементов, ввести понятие иона.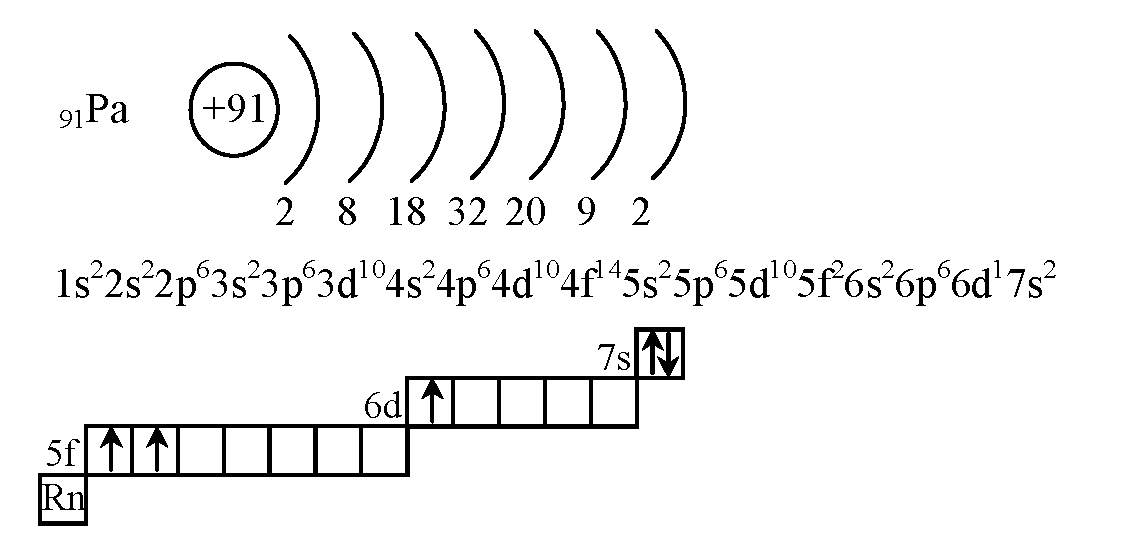
|
|||||||||||||||||||||||||
|
Таблица 1. |
Примеры вопросов и заданий
- Почему в опыте Резерфорда большая часть α-частиц свободно проходит сквозь фольгу, испытывая малые отклонения от прямолинейных траекторий?
-
В опытах Резерфорда поток α-частиц, несущих заряд 2e (e – элементарный заряд), направлялся на золотую фольгу. Ядро атома золота содержит 79 протонов. Найдите минимальное значение первоначальной кинетической энергии α-частиц, при котором они могут приблизиться к центру неподвижного ядра золота на расстояние r = 4,0∙10–14 м. Предполагается, что радиус ядра меньше этого расстояния.
- Какой вывод сделал Резерфорд на основании исследования явления рассеяния альфа-частиц при прохождении через тонкие слои вещества?
САМОЕ ГЛАВНОЕ – ПОНЯТЬ САМОЕ ГЛАВНОЕ
Наука и жизнь // Иллюстрации
Рис. 1. Рисунок из рабочих тетрадей Никиты.
1. Рисунок из рабочих тетрадей Никиты.
Рис. 2. Было время, когда атом (в переводе с греческого – неделимый) считался цельным микроскопическим шариком, но уже примерно сто лет нет никаких сомнений: атом – сложная система, собранная из протонов, нейтронов и электронов.
Рис. 3. Доктор Чикоруди (справа) и его студенты (слева направо): первый ряд (сидят) – Жорик (Георгий), Никита, Федя Ли; второй ряд – Светлана, Перец, Паша (Павел), Маша, Катя; третий ряд – Саша, Сергей, Зурик (Зураб), Андрей.
Рис. 4. Рисунок из рабочих тетрадей Маши.
Рис. 5. Три модели молекул. Основные детали, с которыми работает великая наука химия, – это молекулы.
Рис. 6. В древнем мире, еще не сформировав, возможно, самого понятия “модель” и не придумав отдельного слова для него, люди широко пользовались моделями.
Рис. 7. Самая, пожалуй, важная модель в мире электрической или электронной техники – это принципиальная схема.
Рис. 8. В марте 1953 года английские ученые Джеймс Уотсон и Френсис Крик раскрыли нераскрываемый, казалось, генетический код.
8. В марте 1953 года английские ученые Джеймс Уотсон и Френсис Крик раскрыли нераскрываемый, казалось, генетический код.
Рис. 9. Рисунок из рабочих тетрадей Саши.
Рис. 10. Рисунок из рабочих тетрадей Зурика.
Рис. 11. Рисунок из рабочих тетрадей Феди.
Рис. 12. Опубликованные в 1873 году знаменитые уравнения Максвелла (А) – математическая модель взаимосвязи и взаимодействия электричества и магнетизма, которые совместно создают одну из Главных сил природы – электромагнетизм.
‹
›
ЛЕКЦИИ ДОКТОРА ВСЕХ НАУК ЧИКОРУДИ ДЛЯ ПОДЗАБЫВШИХ КОЕ-ЧТО НЕ СОВСЕМ ОТЛИЧНИКОВ, НО ВПОЛНЕ ТОЛКОВЫХ МАЛЬЧИКОВ И ДЕВОЧЕК СРЕДНЕГО И СТАРШЕГО ШКОЛЬНОГО ВОЗРАСТА, А ТАКЖЕ ДЛЯ ИХ РОДИТЕЛЕЙ, УЧИТЕЛЕЙ, СОСЕДЕЙ И, НАКОНЕЦ, ДЛЯ ТЕХ ПОСЕТИТЕЛЕЙ ШКОЛЫ, КТО ЕЩЕ НЕ СТАЛ ВПОЛНЕ ТОЛКОВЫМ, А ОЧЕНЬ ДАЖЕ МОЖЕТ СТАТЬ. И ХОЧЕТ.
Представляем читателям фрагменты книги “Самое главное – понять самое главное”, подготовленные автором специально для публикации в журнале. Книга написана в экспериментальном жанре диалогов учителя с учениками. Основа книги – более ста рассказов-лекций о нашем мире, которые доктор наук, профессор Чикоруди (сокращенно ДЧР) во время летних каникул прочитал небольшой группе учеников средней школы приморского поселка Дельфиновка (пригород известного портового Черноморска, то бишь Одессы), к этой группе примкнули приехавшие погостить в теплых пляжных краях ребята из других городов и даже из других стран. Читателю представлены не только сами лекции, но и активное их обсуждение – дети внимательно слушают и свободно задают самые разные вопросы, что им не всегда удается на школьных уроках.
Автор книги Рудольф Анатольевич Сворень наверняка знаком многим нашим читателям. Радиоинженер по образованию, педагог по призванию, журналист и редактор по профессии, кандидат педагогических наук, более 40 лет он работал в журнале “Наука и жизнь”. Был специальным корреспондентом, редактором отдела, заместителем главного редактора. Опубликовал в журнале десятки статей об успехах наук и технологий.
Книга написана в экспериментальном жанре диалогов учителя с учениками. Основа книги – более ста рассказов-лекций о нашем мире, которые доктор наук, профессор Чикоруди (сокращенно ДЧР) во время летних каникул прочитал небольшой группе учеников средней школы приморского поселка Дельфиновка (пригород известного портового Черноморска, то бишь Одессы), к этой группе примкнули приехавшие погостить в теплых пляжных краях ребята из других городов и даже из других стран. Читателю представлены не только сами лекции, но и активное их обсуждение – дети внимательно слушают и свободно задают самые разные вопросы, что им не всегда удается на школьных уроках.
Автор книги Рудольф Анатольевич Сворень наверняка знаком многим нашим читателям. Радиоинженер по образованию, педагог по призванию, журналист и редактор по профессии, кандидат педагогических наук, более 40 лет он работал в журнале “Наука и жизнь”. Был специальным корреспондентом, редактором отдела, заместителем главного редактора. Опубликовал в журнале десятки статей об успехах наук и технологий. Лауреат многих профессиональных премий, в том числе Премии Союза журналистов СССР (“Золотое перо”). Издано 12 его книг, общий тираж которых превысил 8 миллионов. Среди них – энциклопедия юного радиолюбителя “Электроника шаг за шагом”, учебник информатики для средней школы (в соавторстве), рассказы о науке для школьников “В просторы космоса, в глубины атома”, книжка для всех об электронике “Ваш радиоприемник”. Сейчас Рудольф Анатольевич работает над новыми книгами.
Лауреат многих профессиональных премий, в том числе Премии Союза журналистов СССР (“Золотое перо”). Издано 12 его книг, общий тираж которых превысил 8 миллионов. Среди них – энциклопедия юного радиолюбителя “Электроника шаг за шагом”, учебник информатики для средней школы (в соавторстве), рассказы о науке для школьников “В просторы космоса, в глубины атома”, книжка для всех об электронике “Ваш радиоприемник”. Сейчас Рудольф Анатольевич работает над новыми книгами.
ИЗ ЧЕГО ВСЕ В НАШЕМ МИРЕ СДЕЛАНО (из лекции 3)
ДЧР (доктор Чикоруди) . Вся невообразимо большая Вселенная, все ее звезды и планеты, в том числе наша Земля и все, что на ней, все собрано из невидимо мелких деталей – они в тысячи миллиардов раз меньше пляжной песчинки. Детали эти называют микрочастицами (от греческого микрос – малый), а мыcленно выделенные пространства, где они живут и работают, – это микромир.
Три детали, из которых собрано все на свете. Трудно поверить, но все, что есть в нашем мире, собрано всего из трех разных деталей, из трех микрочастиц – это сравнительно небольшая и очень легкая частица электрон и две сравнительно большие и тяжелые частицы – протон и нейтрон.
Маша. Вы сначала сказали, что все собрано из трех невидимо мелких деталей, а теперь оказывается, что маленький только электрон, а две другие частицы – большие и тяжелые.
ДЧР. Говорить о размерах, о массе или о весе лучше не словами, а цифрами. Размер протона примерно одна триллионная часть миллиметра, то есть 0,000 000 000 001 мм (10-12 мм), масса протона – триллионная часть триллионной части грамма, то есть 0,000 000 000 000 000 000 000 001 г (10-24 г). Почти такие же размеры и масса у нейтрона. Чтобы получился 1 грамм вещества, нужно собрать вместе 1024 протонов или нейтронов, из такого количества песчинок получилась бы гора высотой 200 километров. О размере электрона говорить трудно, настолько он мал, а его масса в 2000 раз меньше, чем у протона, то есть 0,5.10-27г. Думаю, приведенных цифр достаточно, чтобы протон, нейтрон и электрон называть микрочастицами и чтобы считать электрон сравнительно легкой частицей, а протон и нейтрон – сравнительно (в сравнении с электроном) тяжелыми.
Никита. А что будет, если из какого-нибудь вещества случайно выпадет протон, а на его место прилетит более крупный протон, например, из другой галактики? Эта чужая частица может разрушить вещество и привести к серьезной аварии.
ДЧР. Можешь не волноваться – аварии не будет.
Протоны во всей Вселенной одинаковые. Микромир отличается, если можно так сказать, высочайшим уровнем стандартизации – во всей Вселенной протоны совершенно одинаковые. И точно так же одинаковы все электроны, все нейтроны и другие микрочастицы.
Андрей. Выходит, все электроны были изготовлены по одному чертежу? Почему во всей огромной Вселенной электроны одинаковые?
ДЧР. На этот вопрос пока возможен лишь один ответ: так устроен наш мир. Физики, правда, иногда пытаются ответить по-другому, но человеку со стороны трудно понять эти ответы. Один известный теоретик, например, одинаковость всех электронов объяснял так: это на самом деле всего один электрон, который каким-то образом проецируется одновременно во все окружающее нас пространство.
Саша. Понять невозможно, но идея красивая.
Жорик. У меня вопрос попроще: неужели всего из трех деталей получается абсолютно все? В мире, наверно, тысяча разных веществ – металлы, пластмассы, бензин, дерево, бумага, стекло… И все это получается всего из трех разных деталей – из протонов, нейтронов и электронов? Не верю!
ДЧР. Для начала поправлю названную тобой “тысячу” – сегодня химикам известно более 20 миллионов различных веществ, созданных природой или синтетических (от греческого синтезис – соединение ), то есть искусственных. Как все это многообразие получается всего из трех частиц, наверняка может объяснить каждый, кто с интересом относится к школьной химии. Есть добровольцы, готовые помочь товарищу?
Сергей. Давайте я попробую.
Механизмы многообразия – взгляд с высоты. Три частицы, из которых все на свете собрано, то есть протон, нейтрон и электрон, не идут в дело россыпью, поодиночке. Они проходят два “сборочных цеха” и превращаются в два вида строительных блоков – в атомы и молекулы.
Они проходят два “сборочных цеха” и превращаются в два вида строительных блоков – в атомы и молекулы.
Атом. В учебниках его в упрощенном виде рисуют так: в центре – ядро из соединившихся протонов и нейтронов, вокруг ядра по круговым орбитам вращаются электроны, и все это чем-то напоминает нашу Солнечную систему (рис. 1). Важное примечание: на орбитах атома вращается столько электронов, сколько протонов в его ядре. А в атомном ядре может быть разное число протонов, и именно число протонов определяет основные свойства атома. Так, в атоме ртути 80 протонов (и соответственно 80 электронов на орбитах), но если один протон убрать из ядра и оставить в нем 79 протонов, то получится атом золота.
Катя. Это просто идея или её где-то проверили?
ДЧР. Проверили, проверили. И уже довольно давно.
Катя. Так почему же не строят заводы, где из ртути буду делать золото тоннами?
Никита. Потому, что одно дело в научном институте один атом ртути превратить в атом золота, и совсем другое дело завод.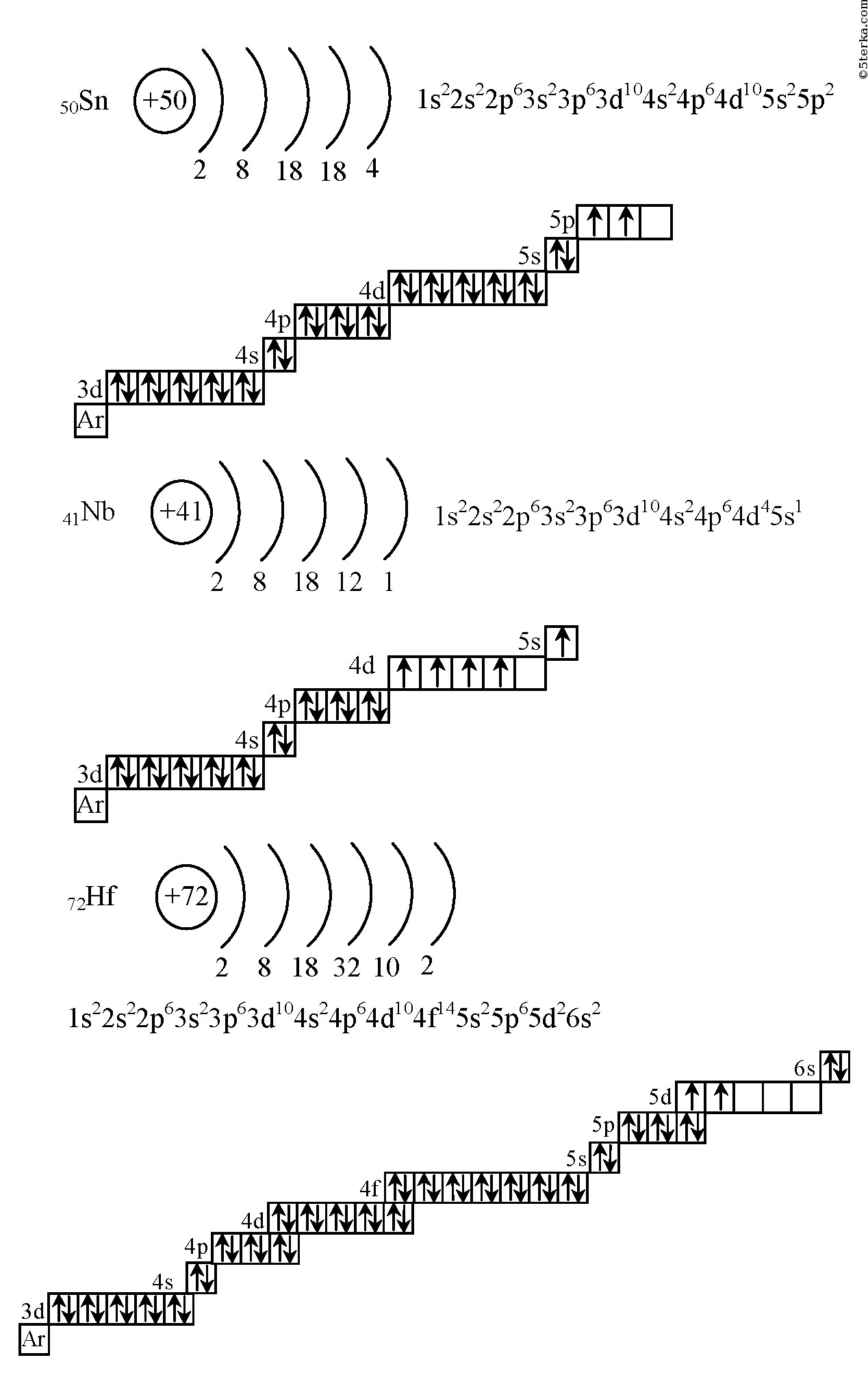
Зурик. Кроме того, твоему проекту нужна арифметическая проверка – очень может быть, что искусственное золото окажется намного дороже настоящего.
Саша. Есть еще одна проблема, возможно, самая главная – золотой запас какой-нибудь страны поддерживает цену её бумажных денег. Если золото станет дешевым, деньги ста нут просто бумагой и могут начаться серьезные финансовые катастрофы.
Голоса. Но почему?… Дешевого золота любая страна сможет иметь огромный запас… И трубы водопроводные можно делать вечные – золото не ржавеет… Люди богаче жить будут… Непонятно почему дешевое золото плохо для финансов…
ДЧР. О непонятностях экономики, финансовых систем, о богатстве и бедности отдельных людей и целых стран мы с вами еще поговорим – всё это есть в наших планах. А сейчас давайте вернемся к непонятностям микромира и попробуем в упрощенном виде понять главное, что должен знать о нём образованный человек.
Сергей. Атомы с разным числом протонов в ядре называются химическими элементами, они в определенном порядке собраны в таблице Менделеева – каждый последующий элемент в таблице имеет на один протон больше, чем предыдущий, и, значит, вокруг ядра вращается больше на один электрон. Сегодня известно больше ста разных химических элементов, и все эти разные атомы – первый шаг от трех строительных деталей к многообразию нашего мира. Второй шаг – создание из атомов более крупных строительных блоков, многоатомных молекул.
Атомы с разным числом протонов в ядре называются химическими элементами, они в определенном порядке собраны в таблице Менделеева – каждый последующий элемент в таблице имеет на один протон больше, чем предыдущий, и, значит, вокруг ядра вращается больше на один электрон. Сегодня известно больше ста разных химических элементов, и все эти разные атомы – первый шаг от трех строительных деталей к многообразию нашего мира. Второй шаг – создание из атомов более крупных строительных блоков, многоатомных молекул.
Молекула (уменьшительное от латинского молес – масса, то есть маленькая масса, массочка). Эти многоатомные строительные блоки могут быть разными из-за разного числа атомов – от двух до многих миллионов. Но главное то, что в молекулах могут быть разные сочетания химических элементов: два атома водорода и один атом кислорода – это трехатомная молекула воды (короткая запись Н2О), а два атома кислорода и один атом углерода – это трехатомная молекула углекислого газа (СО2). Но и молекулы с одинаковым набором атомов тоже могут быть разными – из-за того, что эти атомы по-разному соединяются друг с другом или по-разному расположены в пространстве. Наконец, разные вещества могут получаться, если в них объединяются разные виды молекул. И вот вам результат: из-за разного числа трех микрочастиц в атоме (протонов, нейтронов и электронов) получается много разных атомов, из-за разного набора разных атомов в молекуле получаются очень-очень много разных молекул, из этих разных молекул или из их разных сочетаний в одном веществе получается очень-очень-очень много разных веществ.
Но и молекулы с одинаковым набором атомов тоже могут быть разными – из-за того, что эти атомы по-разному соединяются друг с другом или по-разному расположены в пространстве. Наконец, разные вещества могут получаться, если в них объединяются разные виды молекул. И вот вам результат: из-за разного числа трех микрочастиц в атоме (протонов, нейтронов и электронов) получается много разных атомов, из-за разного набора разных атомов в молекуле получаются очень-очень много разных молекул, из этих разных молекул или из их разных сочетаний в одном веществе получается очень-очень-очень много разных веществ.
ДЧР. Браво, молодец! Рассказал коротко, понятно и, главное, про самое главное.
Перец. Одно у нас пока остается неясным – каким клеем склеены микрочастицы в атомном ядре и чем склеены атомы в молекулах.
ИНСТРУМЕНТ “М” – НАШ ВЕРНЫЙ И МОГУЧИЙ ПОМОЩНИК В НАУКЕ И В ЖИЗНИ (из лекции 6).
ДЧР. Прежде чем начать эту лекцию, хочу сказать несколько слов о ваших занятиях
в школе. Вы посещаете школу 11 лет, проводите на уроках примерно 1000 часов в
год и еще полстолько наверняка тратите на домашние задания. За это время (в сумме
более 16 тысяч часов) вы получаете огромный объем знаний. Наши с вами лекции,
так же как и книга (“Самое главное – понять самое главное”), которая будет подготовлена
на их основе, никак не могут конкурировать с возможностями школы и призваны лишь
помочь вам в понимании школьных предметов и отдельных тем. Поэтому автор будущей
книги, составляя ее подробный план, просмотрел школьные учебники и особо выделил
темы, которым, как ему показалось, в школе надо бы уделить больше внимания. Автор
книги попросил меня посвятить этим темам специальные лекции, и одна из таких особо
важных лекций будет вам сейчас представлена.
Вы посещаете школу 11 лет, проводите на уроках примерно 1000 часов в
год и еще полстолько наверняка тратите на домашние задания. За это время (в сумме
более 16 тысяч часов) вы получаете огромный объем знаний. Наши с вами лекции,
так же как и книга (“Самое главное – понять самое главное”), которая будет подготовлена
на их основе, никак не могут конкурировать с возможностями школы и призваны лишь
помочь вам в понимании школьных предметов и отдельных тем. Поэтому автор будущей
книги, составляя ее подробный план, просмотрел школьные учебники и особо выделил
темы, которым, как ему показалось, в школе надо бы уделить больше внимания. Автор
книги попросил меня посвятить этим темам специальные лекции, и одна из таких особо
важных лекций будет вам сейчас представлена.
Сразу же поясню, что стоит за этим придуманным мною таинственным названием “Инструмент “М”…
Голоса. Я и сам знаю – это молоток…- Зачем науке молоток? Инструмент “М” – это монтажный паяльник для сборки и ремонта электронных схем…- Скучно мыслите, дорогие студенты. Инструмент “М” – это сверхсекретный “Магический кристалл”, который лазерным лучом режет и соединяет железо, дерево, пластмассу, стекло, одним словом, любые материалы …
Инструмент “М” – это сверхсекретный “Магический кристалл”, который лазерным лучом режет и соединяет железо, дерево, пластмассу, стекло, одним словом, любые материалы …
ДЧР. Все намного проще, инструмент “М” – это модели.
Голоса. Инструмент “М” – это модели? Такого не может быть… Это какая-то ошибка… У меня дома маленькие модели автомобилей, целая коллекция – 180 штук. И почему они инструмент?.. Каждый ребенок про модели знает – никакой это не научный помощник… И в жизни модели ничем не помогают. Просто игрушки… А я всегда думала, что модель – это красивая женщина, которая проходит перед публикой и модную одежду показывает…Можно считать, что мои куклы – это модели девочек. Они тоже “могучий помощник науки”?
ДЧР: Слово “модель” (от латинского модулус – мерило, образец) сначала употреблялось в смысле “образец для подражания”, а также “упрощенная копия чего-то реально существующего”, например, небольшая модель парусника, кареты или дворца.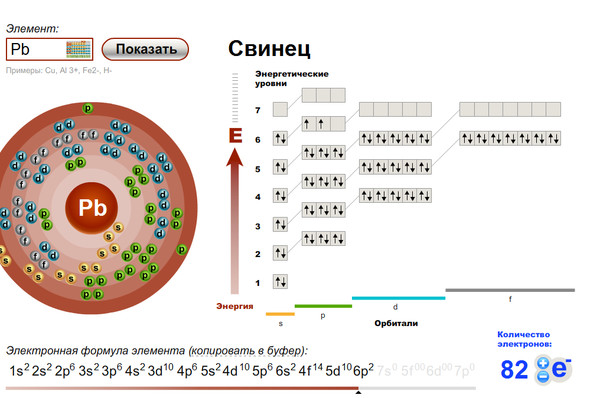
Значение слов со временем может меняться. Шли годы, люди открывали и меняли окружающий мир. При этом им приходилось не только вводить в свой язык (точнее, в языки – их и в древности было немало, а сейчас насчитывают около 2500) новые слова, но и расширять значение старых. Возьмем, к примеру, слово “электричество” (от греческого электрон – янтарь), которым еще 400 лет назад называли загадочную силу, притягивавшую мелкие клочки шелка.
Светлана. А почему вы считаете, что это было 400 лет назад? Я читала, что про электрические силы еще 2500 лет назад знали древние греки.
ДЧР. Действительно, книги тех времен подтверждают, что в опытах с натертым янтарем появляются неизвестные ранее силы. Но нигде не сказано, что уже греки назвали эти силы электричеством. И точно известно, что более 400 лет назад это слово ввел в свои научные отчеты известный английский врач и исследователь электричества Вильям Гильберт. То было удивительное время – мир возрождался после долгого средневекового сна, мы с вами позже посвятим этой эпохе Возрождения специальную лекцию.
Но вернемся, однако, к слову “электричество” – сейчас оно обозначает совсем не то, что во времена Гильберта. Сегодня электричество – это мощнейшие электростанции, это свет в домах и на улицах, миллионы электромоторов, помогающих нашим мускулам, электропоезда, красочный телеэкран и рентгеновский аппарат, позволяющий врачу заглянуть внутрь нашего тела.
Значение некоторых слов меняется, когда люди начинают глубже понимать то, что с этими словами связано. Возьмите, к примеру, такое слово, как “теплота”, оно всегда называло знакомые всем, но необъяснимые свойства нагретых предметов, а сейчас обозначает еще и тщательно изученные процессы в мире атомов и молекул: температура воды в чайнике растет потому, что при нагреве усиливается беспорядочное движение молекул, они чаще и сильней соударяются и больше выделяют энергии.
Сергей. Еще очень изменился смысл слова “знание”. Его, конечно, ценили и раньше – в каменном веке наверняка уважали охотника, который лучше других знал, как выследить мамонта. Но еще больше, я думаю, в те времена ценили силу и ловкость. А сейчас все понимают, что самое главное – это знания, от них все богатство человечества.
Но еще больше, я думаю, в те времена ценили силу и ловкость. А сейчас все понимают, что самое главное – это знания, от них все богатство человечества.
Жорик. И зарплата за знания намного больше, чем за физическую работу.
Перец. Мы начали этот интересный разговор о словах для того, чтобы как-то пояснить два важных для нас слова – “инструмент” и “модель”. Так давайте поговорим именно про них.
ДЧР. Очень своевременное предложение. Начнем, пожалуй, со слова “инструмент”.
Инструмент – это не только молоток, пила или отвертка. Представьте себе, что мы с вами сочиняем словарь для младших школьников и нам нужно очень коротко объяснить, что такое инструмент. Какие будут предложения?
Никита. Инструмент – это как бы железное продолжение человеческой руки, инструмент позволяет нам делать то, что руками сделать трудно или невозможно – разрезать доски, отвинчивать гайки, забивать или выдергивать гвозди.
Зурик. Инструмент – это все, что помогает человеку работать. У плотника – это пила, у зубного врача – бормашина, у милиционера – свисток.
Инструмент – это все, что помогает человеку работать. У плотника – это пила, у зубного врача – бормашина, у милиционера – свисток.
Саша. Инструмент – это предметы, процессы и правила, которые увеличивают возможности работающего человека. Люди широко используют такие инструменты, как молоток, микроскоп и телескоп, как таблица умножения, грамматические правила, помогающие нам писать без ошибок, микрокалькулятор, кардиограф, на экране которого врач видит, как работает наше сердце, математические формулы, позволяющие быстро и легко вычислять площадь круга или объем шара, часы – инструмент для определения времени.
ДЧР. Это последнее объяснение получает первую премию. Автор подчеркнул главное – в наше время слово “инструмент” имеет очень широкий смысл. Теперь мы можем смело отметить, что к числу наших помощников-инструментов относятся многочисленные и разнообразные модели.
В выпущенной чуть более ста лет назад Энциклопедии издателей Ф. А. Брокгауза и И. А. Ефрона сказано, что модель – это “подобие какого-либо предмета, сделанное из дерева, пробки, картона, воска, глины, металла или другого вещества, воспроизводящее этот предмет с точностью, но в уменьшенном виде”. Лет через 30 первое издание БСЭ (Большая советская энциклопедия) сообщает, что модель – это ценный инструмент авиаконструктора : уменьшенные модели самолетов можно исследовать в воздушном потоке, а затем учитывать результаты этих исследований при конструировании настоящих, больших машин.
А. Брокгауза и И. А. Ефрона сказано, что модель – это “подобие какого-либо предмета, сделанное из дерева, пробки, картона, воска, глины, металла или другого вещества, воспроизводящее этот предмет с точностью, но в уменьшенном виде”. Лет через 30 первое издание БСЭ (Большая советская энциклопедия) сообщает, что модель – это ценный инструмент авиаконструктора : уменьшенные модели самолетов можно исследовать в воздушном потоке, а затем учитывать результаты этих исследований при конструировании настоящих, больших машин.
Проходит еще лет тридцать-сорок, и очередное издание БСЭ представляет слово “модель”
в его нынешнем, широком значении – это, в частности, условный или мысленный образ
какого-либо объекта, например рисунок, чертеж, описание, карта, таблица, схема,
план и так далее. При определенных условиях этот образ используется в качестве
“заменителя” или “представителя” самого объекта. И далее сообщается, что моделирование,
то есть создание моделей и работу с ними, широко используют для исследований в
биологии, физике, астрономии, геологии, одним словом, практически во всех науках. От себя добавлю, что и мы с вами, даже не замечая этого, пользуемся мысленным
моделированием при решении своих житейских задач.
От себя добавлю, что и мы с вами, даже не замечая этого, пользуемся мысленным
моделированием при решении своих житейских задач.
Перец. А можно привести несколько примеров, показывающих, как модели помогают науке?
ДЧР. Конечно и вы эти примеры прекрасно знаете, но только не думали о них как о работе с моделями – были в плену старых представлений об этом слове.
Итак – несколько примеров.
Пример первый: чертежи, незаменимая модель для конструктора, создающего новую машину, и для механика, ремонтирующего старую. Без этой модели, без чертежа, конструктору пришлось бы заказывать детали для новой машины (например, стальные шестеренки) и, получив их, пробовать – подойдут они или не подойдут. Вместо этого безумия конструктор сначала отрабатывает машину на модели – в чертежах, свободно меняя или уточняя форму, размеры и расположение деталей. Разумеется, потом создаются опытные образцы машины и подправляется то, что было неточно отработано в чертежах. Но такие неизбежные, как правило, поправки даже сравнивать нельзя с огромным объемом переделок в машине, сконструированной без чертежа, “на глазок”.
Но такие неизбежные, как правило, поправки даже сравнивать нельзя с огромным объемом переделок в машине, сконструированной без чертежа, “на глазок”.
Андрей. Я все понял: работа с моделью позволяет без особого труда отработать и проверить на ней все, что нужно отработать и проверить. После этого любое дело можно делать уверенно, быстро и правильно.
ДЧР. Об этом можно сказать еще и так: работа с моделью избавляет от утомительного и дорогого метода проб и ошибок.
Но вернемся, однако, к нашему списку моделей.
Пример второй: анализ крови, список важнейших ее составляющих с указанием их количества. Эта модель (анализ крови) многое говорит врачу о состоянии пациента, о том, какие биохимические процессы протекают в его организме нормально, а какие с отклонениями от нормы. Через некоторое время врач вновь делает анализ крови и по изменениям в этой модели видит, как подействовали на пациента лекарства и как вообще протекает болезнь.
Пример третий: географическая карта, модель местности, в пояснениях и оценках не нуждается.
Пример четвертый: математическое описание теоремы Пифагора: а2 + b2 = с2, где а и b – катеты прямоугольного треугольника, а с – его гипотенуза. С помощью этой модели можно без труда узнать длину какой-либо стороны треугольника, если известна длина двух других сторон. Подобные математические модели создаются для самых разных Предметов и Процессов , и на этих моделях предварительно отрабатывают, а затем безошибочно выполняют очень сложные операции – от компьютерного проектирования микропроцессоров и поисков месторождений нефти до запуска космических аппаратов на Марс.
Пример пятый: электрическая схема телевизора – модель всех его электрических цепей и соединения всех его деталей.
Пример шестой: кузов легкового автомобиля в натуральную величину, изготовленный из цветного пластилина. На такой модели дизайнер отрабатывает внешние формы будущей машины. Продолжать?
На такой модели дизайнер отрабатывает внешние формы будущей машины. Продолжать?
Никита. Не нужно – все понятно. Сдаемся…
ДЧР. А вместе с тем огромное число людей имеют о моделях совершенно неверное представление. Недавно в нашей поселковой библиотеке я просматривал переведенную с английского великолепную детскую энциклопедию, в ней написано вот что: “Модель – маленькая копия чего-нибудь большого”. Это так, но это лишь одно из многих значений исключительно важного слова “модель”.
Паша. У меня есть просьба. Модели, о которых мы узнали, в основном относятся к науке. А название лекции говорит, что модели – это наш помощник еще и в жизни. Можно попросить вас привести хотя бы один пример того, как это делается – как модели помогают нам жить?
ДЧР. Сначала скажу о жизни как о биологическом процессе.
В биологических процессах модели используются на каждом шагу, а одна из моделей сделала возможным само существование жизни.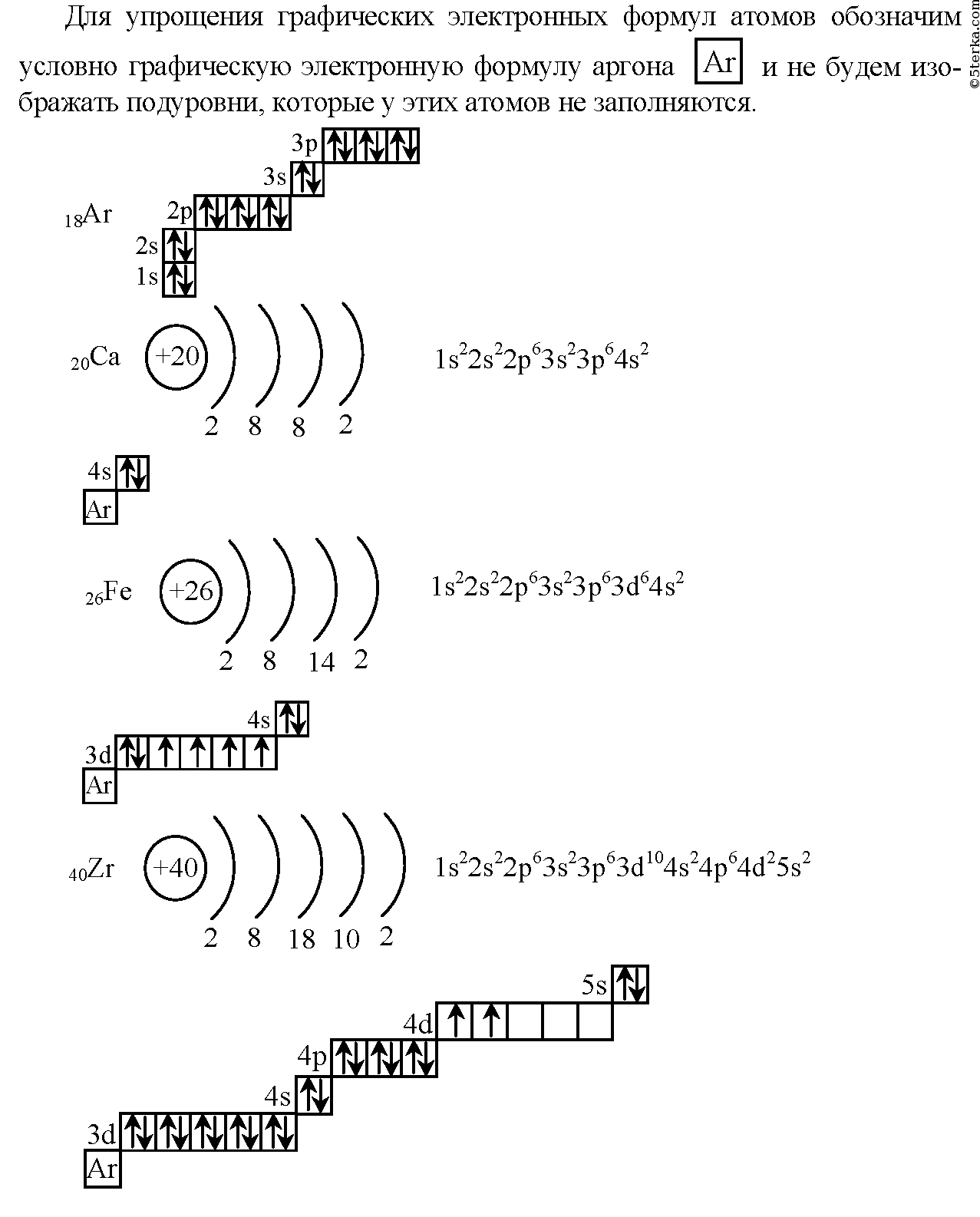 До сих пор мы в основном говорили про модель, которую можно назвать упрощенной копией какой-то реальности. Так, например, географическая карта – упрощенная копия местности, на небольшой карте мы видим огромную территорию, находим место, где встречаются две нужные нам дороги, легко определяем расстояние до этого места. Но модель – это не только упрощенная копия реальности, моделью также называют образец, по которому создается какое-либо изделие. В современном производстве обязательно есть утвержденный образец (эталон) автомобиля, телевизора или вертолета, и все машины, которые сходят с заводского конвейера, – это копии эталонного образца, копии тщательно испытанной и утвержденной модели.
До сих пор мы в основном говорили про модель, которую можно назвать упрощенной копией какой-то реальности. Так, например, географическая карта – упрощенная копия местности, на небольшой карте мы видим огромную территорию, находим место, где встречаются две нужные нам дороги, легко определяем расстояние до этого места. Но модель – это не только упрощенная копия реальности, моделью также называют образец, по которому создается какое-либо изделие. В современном производстве обязательно есть утвержденный образец (эталон) автомобиля, телевизора или вертолета, и все машины, которые сходят с заводского конвейера, – это копии эталонного образца, копии тщательно испытанной и утвержденной модели.
Все вы, конечно, слышали, что в клетках каждого растения, каждого животного, насекомого,
каждой одноклеточной бактерии есть большая молекула по имени ДНК. Большая в том
смысле, что это цепочка из молекулярных блоков, в которой в сумме может быть несколько
миллионов атомов. Молекула ДНК – это особый химический чертеж, в котором определенным
расположением атомов записано все устройство организма. Но, кроме того, молекула
ДНК – это еще и эталонный образец, с которого копируются новые молекулы ДНК, они
по наследству передаются следующим поколениям растений или животных и именно поэтому
пра-пра-правнучка вашей кошки устроена так же, как ее пра-пра-прабабушка. Эстафета
жизни на нашей планете началась тогда, когда природа научилась копировать молекулярные
чертежи с первого удачно сложившегося образца – с первой молекулярной модели.
Молекула ДНК – это особый химический чертеж, в котором определенным
расположением атомов записано все устройство организма. Но, кроме того, молекула
ДНК – это еще и эталонный образец, с которого копируются новые молекулы ДНК, они
по наследству передаются следующим поколениям растений или животных и именно поэтому
пра-пра-правнучка вашей кошки устроена так же, как ее пра-пра-прабабушка. Эстафета
жизни на нашей планете началась тогда, когда природа научилась копировать молекулярные
чертежи с первого удачно сложившегося образца – с первой молекулярной модели.
Теперь о роли моделей и моделирования в повседневной жизни. Начну с забавной, но с серьезным смыслом истории, которую очень советую запомнить.
Много лет назад в книжке с картинками я прочитал о мальчике, у которого была хорошая табуретка, но с маленьким недостатком – она неровно стояла на полу. Мальчик решил поправить дело и немного подпилил одну ножку – табуретку еще больше перекосило. Слегка подпилил вторую ножку – табуретку перекосило в другую сторону. Снова что-то подпилил и опять перекос. Так этот мастер, пробуя и ошибаясь, постепенно спилил у табуретки все ножки, своими руками уничтожил любимую мебель. Ничего этого не случилось бы, если бы мальчик сначала все проделал на модели, в данном случае – на чертеже. Измерил бы длину всех ножек, набросал бы простенький чертеж и на нем отметил бы, какую ножку и на сколько миллиметров нужно укоротить.
Слегка подпилил вторую ножку – табуретку перекосило в другую сторону. Снова что-то подпилил и опять перекос. Так этот мастер, пробуя и ошибаясь, постепенно спилил у табуретки все ножки, своими руками уничтожил любимую мебель. Ничего этого не случилось бы, если бы мальчик сначала все проделал на модели, в данном случае – на чертеже. Измерил бы длину всех ножек, набросал бы простенький чертеж и на нем отметил бы, какую ножку и на сколько миллиметров нужно укоротить.
А теперь вопрос: мог ли мальчик все сделать хорошо и правильно без чертежа?
Зурик. Никогда в жизни!
Маша. Конечно, мог бы. Надо было померить длину ножек, а затем подумать и в уме сообразить, какую ножку на сколько укоротить. И никакой чертеж для такого пустякового дела не нужен.
Андрей. Если бы он подумал, то одной ножкой все обошлось бы – у меня уже был такой случай. А этот дурачок взялся пилить не думаючи.
ДЧР. То, что я хочу сказать вам в заключение лекции, начинается с этих очень правильных ответов – прежде чем брать в руки пилу, мальчику надо было подумать.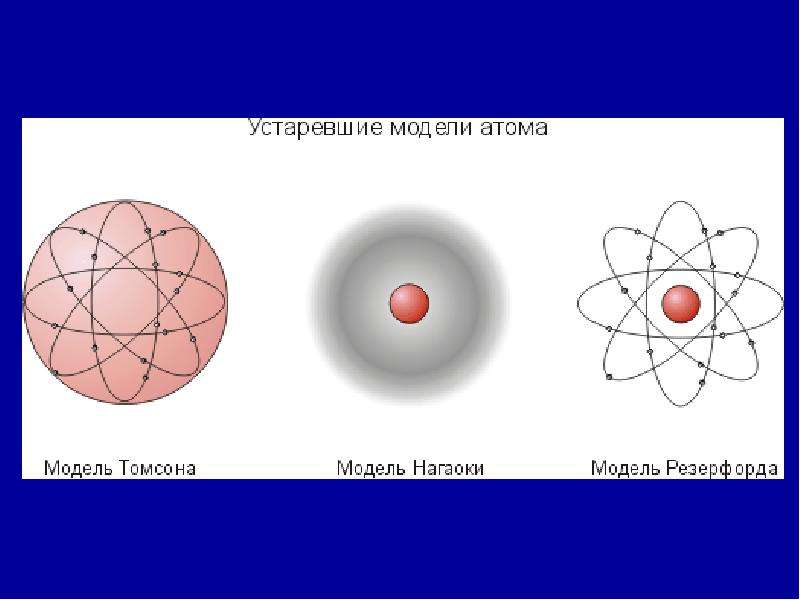 Но что это конкретно значит “надо было подумать”? Известно, что мы думаем головой, мозгами, что же конкретно происходит в нашей голове, в мозгах, когда мы о чем-нибудь думаем?
Но что это конкретно значит “надо было подумать”? Известно, что мы думаем головой, мозгами, что же конкретно происходит в нашей голове, в мозгах, когда мы о чем-нибудь думаем?
В большинстве случаев мышление – это создание моделей в нейронных сетях головного мозга и работа с этими мысленными моделями. Главные работающие детали мозга – нервные клетки, нейроны, в головном мозге человека их больше 10 миллиардов. Несколькими своими отростками, напоминающими тончайшие волоски проводов, каждый нейрон как-то связан с несколькими другими нейронами (напомню – их более 10 миллиардов!), часто и очень быстро обменивается с ними электрохимическими сигналами (нервными импульсами), и все это вместе образует сложнейшую систему связи и обработки сигналов. Называется эта система “нейронная сеть”. Именно в нейронной сети каким-то способом создаются модели того, о чем вы думаете, именно в нейронных сетях идут какие-то процессы, из которых складывается то, что мы называем высоким словом “мышление”.
Светлана. Что это значит “каким-то образом создаются модели”? Каким именно способом они создаются? Как, например, выглядит в нейронной сети модель тарелки, которую я хочу помыть?
Федя Ли. И как понять такие ваши слова – “в нейронных сетях идут какие-то процессы, из которых складывается наше мышление”? Что происходит в нейронной сети, если я решил помочь Светлане и подумал: “Наведу-ка я сначала порядок на столе”?
Сергей. Я тоже решил включиться в эту уборку квартиры и для начала пропылесосить ковер. Как выглядит в нейронной сети это мое решение? Как в нужный момент будут посланы нужные команды мускулам рук, которые должны взять пылесос, включить его и перемещать по ковру?
ДЧР. Должен вас огорчить – сегодня вряд ли кто-нибудь возьмется на эти вопросы ответить.
Наука очень многое сделала для понимания великой загадки человеческого мышления и энергично продвигается к этому пониманию по двум главным направлениям. Одно из них традиционное – глубокие исследования физиологов, молекулярных биологов, психологов. На другом направлении в основном работают математики, инженеры, лингвисты, они пытаются создать искусственный интеллект, пытаются научить электронные вычислительные машины делать то, что умеет наш мозг. Но, мне кажется, еще далеко до того момента, когда об исследовании человеческого мышления можно будет сказать: “Дело сделано – теперь все ясно”.
Одно из них традиционное – глубокие исследования физиологов, молекулярных биологов, психологов. На другом направлении в основном работают математики, инженеры, лингвисты, они пытаются создать искусственный интеллект, пытаются научить электронные вычислительные машины делать то, что умеет наш мозг. Но, мне кажется, еще далеко до того момента, когда об исследовании человеческого мышления можно будет сказать: “Дело сделано – теперь все ясно”.
ГЛАВНЫЕ РАБОТНИКИ ВСЕЛЕННОЙ (из лекции 4).
ДЧР. Так сложилось, что, размышляя об устройстве нашего мира, мы в основном обращаем внимание на Предметы – мы с вами уже коротко говорили о таких природных шедеврах, как звезды, галактики, атомы, микрочастицы, молекулы. Предметы, однако, не находятся в состоянии абсолютного покоя, с ними всегда что-то происходит: в закипающем чайнике вода превращается в пар, планеты вращаются вокруг Солнца, в солнечном веществе соединяются ядра атомов водорода, выбрасывая порции тепла и света. Короче говоря, наш мир – это не только невообразимое разнообразие Предметов, но еще и невообразимое разнообразие Процессов. Некоторые из них обязательно нужно подкармливать энергией, другие же, наоборот, сами выделяют энергию, расходуя какие-то свои запасы.
Короче говоря, наш мир – это не только невообразимое разнообразие Предметов, но еще и невообразимое разнообразие Процессов. Некоторые из них обязательно нужно подкармливать энергией, другие же, наоборот, сами выделяют энергию, расходуя какие-то свои запасы.
Все разнообразие Процессов нашего мира кормится всего лишь пятеркой Главных сил. Сегодня известны пять главных работников Вселенной, пять главных сил, с которыми связаны все Процессы, идущие в нашем мире. Для начала перечислим эти силы, пока без комментариев: 1. Гравитация (от латинского гравис – тяжелый). 2. Электрические силы. 3. Магнитные силы. И, наконец, действующие только в микромире две силы со странными названиями. 4. Сильные (ядерные) силы и 5. Слабые силы. Попробую коротко представить вам эту великолепную пятерку.
Гравитационные силы каким-то образом тянут друг к другу два любых предмета – две молекулы, две звезды, два яблока на тарелке. Человек, видимо, обнаружил гравитацию миллионы лет назад, когда он еще не был Человеком разумным – наши далекие предки начали присматриваться к окружающему миру и поняли, что все почему-то притягивается к земле.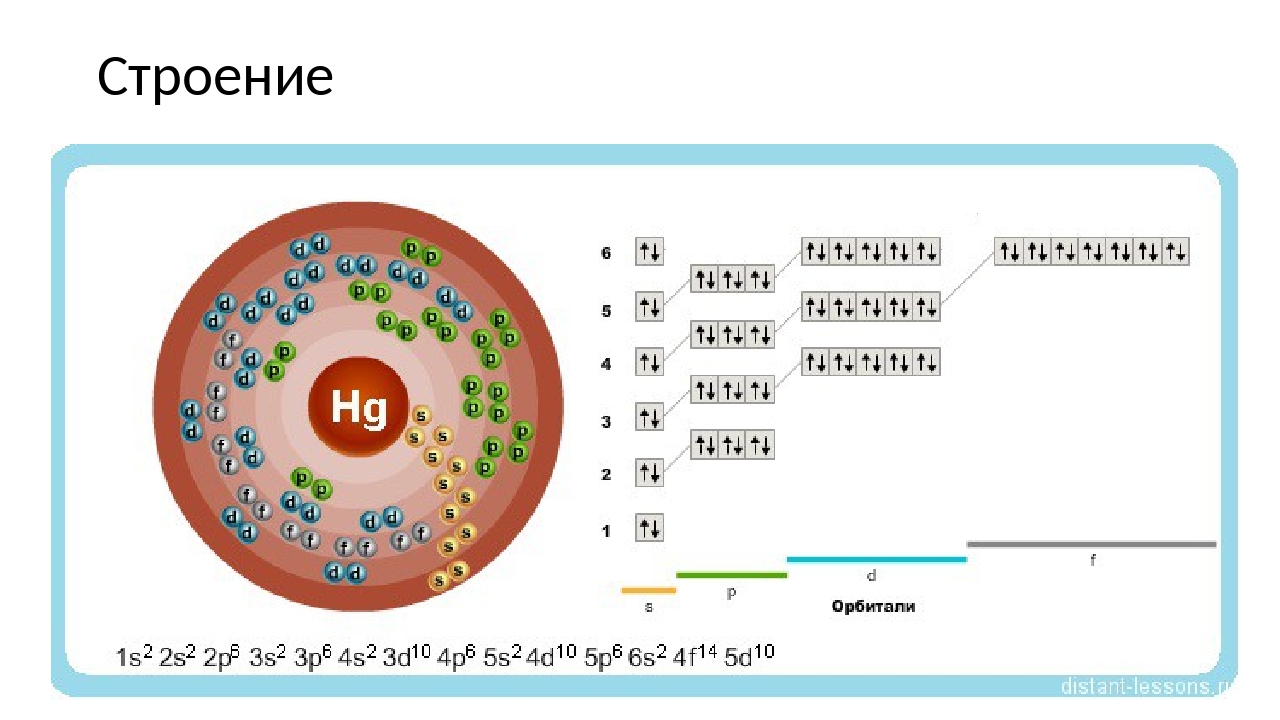
Зурик. Это, я думаю, была самая первая в мире научная мысль.
Андрей. Гениальный был мужик, который первым подумал о земном притяжении.
Светлана. Самый настоящий гений. Все другие с трудом поднимали тяжелые камни, спотыкались и падали носом в песок, собирали упавшие на землю спелые бананы, но никто не подумал, почему все всегда двигается сверху вниз. А этот пещерный Архимед понял, что у земли есть какая-то притягивающая сила, которую мы теперь называем гравитацией или тяготением.
ДЧР. Две с половиной тысячи лет назад древнегреческие мыслители подумали,
что гравитационным силам должны быть подвластны все небесные тела, что под действием
этих сил Луна камнем упала бы на Землю, если бы ее не удерживала какая-то иная
сила. А около 320 лет назад, в 1687 году, великий физик и математик Исаак Ньютон
коротко и четко, в виде простой формулы (рис. 9), показал, от чего зависят гравитационные
силы, и назвал их Всемирным тяготением (согласно толковому словарю, тяготение
– свойство тел притягивать друг друга, стремление к чему-нибудь или к кому-нибудь). Важное примечание: r – это расстояние между центрами тяжести двух тел, и если
тело шарообразное, то его центр тяжести совпадает с центром шара (рис. 9).
Важное примечание: r – это расстояние между центрами тяжести двух тел, и если
тело шарообразное, то его центр тяжести совпадает с центром шара (рис. 9).
Арбуз, который у нас на Земле весит 10 килограмм, на Солнце весил бы значительно больше, а на Луне значительно меньше. Вы, конечно, догадались, почему на Солнце вес арбуза увеличивается, а на Луне уменьшается…
Голоса. Догадались… Догадались, догадались… Еще как догадались…
Катя. А я не догадалась. Может, кто-то все это и понимает, а мне совершенно непонятно, почему после путешествия на Луну арбуз похудел, а после путешествия на Солнце – поправился…
Маша. Тебе все непонятно потому, что ты математику ненавидишь и даже слушать не хочешь то, что она тебе так понятно и дружелюбно объясняет.
Саша. Сам арбуз нисколько не изменился, изменилась сила его притяжения к небесному телу: на Солнце эта сила больше, чем на Земле, на Луне – меньше.
Андрей.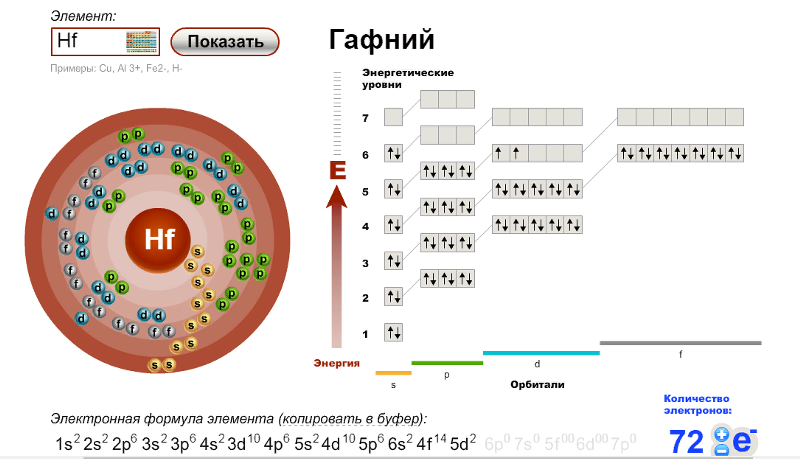 Посмотри на формулу Всемирного тяготения. Когда дело происходит на Земле, то в спектакле участвуют масса Земли m1 и масса арбуза m2, а буквой F обозначена сила притяжения арбуза к Земле.
Посмотри на формулу Всемирного тяготения. Когда дело происходит на Земле, то в спектакле участвуют масса Земли m1 и масса арбуза m2, а буквой F обозначена сила притяжения арбуза к Земле.
Катя. Здесь мне все понятно: сила F – это вес арбуза…
Зурик. Вот видишь – самое главное ты уже понимаешь. А теперь еще раз посмотри на формулу. Обе массы m1 и m2 находятся наверху, в числителе дроби, и поэтому, чем больше m1 или m2, тем больше сила F. У Земли масса (m1) довольно большая, и весит арбуз на Земле немало – 10 килограмм.
Светлана. Давай посмотрим, что будет на Солнце. Теперь m1 – это масса Солнца, она намного больше земной, и поэтому сила F тоже больше, то есть арбуз на Солнце тяжелее.
Сергей. А масса Луны (теперь m1 обозначает именно ее) намного меньше земной и арбуз на Луне весит меньше.
Катя. Неужели все так просто?
ДЧР. Ты сделала очень важный шаг к пониманию, и пока, пожалуй, этого достаточно. Но если ты пойдешь в астрофизики, придется вникать в дело поглубже. В дополнение к тому, что вы поняли, для будущих астрофизиков приведу несколько цифр. Масса Земли 6.1024 килограмма, масса Луны в 81 раз меньше, Солнца – в 330 000 раз больше; земной радиус 6400 километров, лунный – в 3,7 раза меньше, солнечный – в 110 раз больше. Арбуз, который на Земле весит 10 килограмм (или примерно 100 ньютонов), на Луне весил бы 1,7 килограмма (17 ньютонов) и на Солнце 214 килограмм (2140 ньютонов). Всмотритесь в эти цифры, в них скрыто что-то интересное. Попробуйте догадаться что. А я перехожу к следующей главной силе – к электричеству.
Известный сыщик Шерлок Холмс расследует загадку электрических сил в пенопластовых шариках. Электрические силы играют в нашем мире исключительно важную роль. Достаточно сказать, что атомы объединяются в молекулы в основном с помощью электричества – у атомов в молекуле появляются общие электронные орбиты, они как бы стягивают, склеивают атомы, создают из них единую систему. Электрические процессы и сигналы участвуют также в движении живых организмов, в их питании, в обмене веществ, размножении, управлении органами, в мышлении. Несмотря на все это, у живых организмов, за исключением некоторых рыб, нет “электрического чувства”, такого, например, как ощущение веса.
Электрические процессы и сигналы участвуют также в движении живых организмов, в их питании, в обмене веществ, размножении, управлении органами, в мышлении. Несмотря на все это, у живых организмов, за исключением некоторых рыб, нет “электрического чувства”, такого, например, как ощущение веса.
Жорик. И правда, берешь, например, чашку с молоком и, не глядя, по весу чувствуешь – полная она или в ней половина. А батарейку сколько ни трогай, никак не почувствуешь, есть еще в ней заряд или весь вышел.
ДЧР. Возможно, именно из-за такой скрытности электричество, работая рядом с нами и в нас самих, так долго оставалось неизвестным. По той же причине знакомство с электрическими силами полезно начинать с опыта, который покажет, что электричество – это не выдумка, что оно реально существует. Опыт простой: потрите тряпкой расческу или пластмассовую палочку, в них проснется дремавшее электричество, и они начнут притягивать мелкие клочки бумаги. Под действием силы тяжести клочки должны падать вниз, а они поднимаются вверх, к натертой палочке. О чем это говорит?
О чем это говорит?
Светлана. О том, что против силы тяжести действует какая-то другая сила. Действует и побеждает.
Зурик. Это и есть электричество. Ура!
ДЧР. Такой же опыт можно проделать и со стеклянной палочкой, в ней при натирании тоже просыпаются электрические силы. А теперь сделаем следующее: подвесим на нитках несколько пенопластовых шариков и будем в разных сочетаниях передавать им электрические силы, прикасаясь к шарикам натертыми палочками. Обнаружится следующая загадочная закономерность: если к двум соседним шарикам прикоснуться разными палочками (пластмассовой и стеклянной) – шарики притягиваются друг к другу, а если к ним прикоснуться одной и той же палочкой – шарики расталкиваются (рис. 11).
Расследуя эту загадку, великий сыщик Шерлок Холмс первым делом спросил бы: “Одинаковые ли у вас шарики?”
Маша. Одинаковые, одинаковые!
ДЧР. Тогда мистер Холмс поинтересуется: “Не меняется ли результат, если провести этот опыт в других помещениях?”
Андрей. Не меняется. Я когда-то делал эти опыты в кухне, на балконе и даже в ванной. Результат одинаковый.
Не меняется. Я когда-то делал эти опыты в кухне, на балконе и даже в ванной. Результат одинаковый.
ДЧР. После этого последует уверенный вывод: “В пластмассовой и стеклянной палочках возникают электрические силы двух разных видов”. Вывод великого сыщика (это, конечно, шутка, на самом деле две разновидности электричества в 1733 году обнаружил французский физик Шарль Дюфе) теперь можно найти в любом школьном учебнике физики. При этом электрические свойства натертых палочек называют электрическим зарядом, заряд пластмассовой палочки – отрицательным (его обозначают знаком минус (-), а заряд стеклянной палочки – положительным (знак +). Все варианты взаимодействия двух разных сортов электричества описываются одной фразой: “Разноименные электрические заряды (+ и -) взаимно притягиваются, одноименные (+ и + или – и -) взаимно отталкиваются”.
Магнитные силы. Проделав несколько похожих опытов с магнитами и стальными гвоздиками, можно убедиться, что в нашем мире есть также два сорта магнитных сил (их назвали северный магнетизм и южный) и что своим взаимодействием они чем-то похожи на электричество.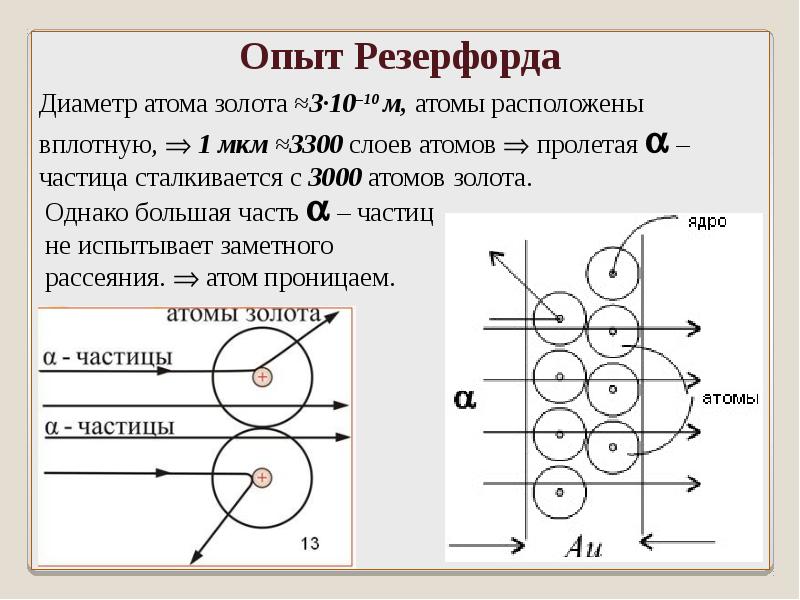
Еще одна, четвертая по счету, Главная сила природы, без нее наш мир просто не мог бы существовать. Оба вида электричества (+ и -), порознь или совместно прекрасно работают в электрических машинах и электронных аппаратах, но в одном случае скопление одинаковых зарядов становится угрозой существования всей нашей Вселенной.
Жорик. Ух, как страшно – натертая тряпкой стеклянная палочка угрожает человечеству!…
Катя. Чтобы стать остроумным, нужно сначала стать умным. Так что ты, дорогой Георгий, не спеши свои шутки шутить, послушай сначала, что тебе рассказывают и постарайся понять. Если сумеешь.
ДЧР. Начнем с того, что некоторые микрочастицы имеют свой электрический заряд: у электронов, например, как у натертой пластмассовой палочки он отрицательный (-), у протонов, как у натертой стеклянной палочки, – положительный (+). Именно этот электрический “плюс” протонов мог бы стать причиной разрушения нашей Вселенной. Как вы думаете – почему?
Саша. Тут особо и думать нечего – одноименные заряды взаимно отталкиваются. Поэтому если собрать в атомном ядре несколько протонов, то они сразу начнут расталкивать друг друга и разлетятся в разные стороны – ядро развалится, а вместе с ним и атом. А поскольку это произойдет одновременно во всех атомах Вселенной, то она мгновенно рассыплется – превратится в хаос микрочастиц.
Тут особо и думать нечего – одноименные заряды взаимно отталкиваются. Поэтому если собрать в атомном ядре несколько протонов, то они сразу начнут расталкивать друг друга и разлетятся в разные стороны – ядро развалится, а вместе с ним и атом. А поскольку это произойдет одновременно во всех атомах Вселенной, то она мгновенно рассыплется – превратится в хаос микрочастиц.
Катя. Какой ужас!
Жорик. Почему же этого не происходит?
ДЧР. Действительно – почему этого не происходит? Наша Вселенная, несмотря на расталкивание протонов в атомных ядрах, вот уже 13 миллиардов лет остается целой и невредимой. Почему?
Федя Ли. У нас уже была похожая история в электрических опытах – сила тяжести, то есть гравитация, тянула клочки бумаги вниз, а они двигались вверх. Потому, что против гравитации действовала другая, более сильная сила – электричество.
Андрей. А в атомном ядре против электричества действует еще какая-то сила, более сильная – она сжимает протоны, стягивает их вместе, не дает им разлететься.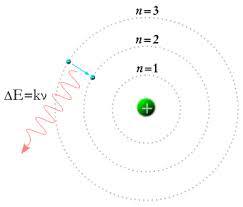
ДЧР. Эта “еще какая-то сила” называется ядерной или, иначе, сильной силой, она действует в 100 раз сильней электричества, которое в свою очередь в триллионы триллионов раз сильней гравитации. Именно ядерные силы, поборов электрическое расталкивание протонов, крепко соединяют их в атомном ядре и обеспечивают устойчивость нашего мира.
Паша. А нельзя нам проделать опыты, вроде натирания стеклянной палочки, и своими глазами увидеть, как действуют ядерные силы?
ДЧР. К сожалению, это невозможно – ядерные силы начинают действовать на очень малых, недоступных нашему зрению, расстояниях, когда между протонами остаются миллиардные доли миллиметра. Кстати, есть еще одна действующая только в микромире Главная сила. Она участвует в некоторых редких ядерных процессах и называется слабой силой, поскольку в тысячи триллионов раз слабее сильных сил.
Две ветки одного куста поначалу приняли за два отдельных кустика. Долгое время считали, что электричество и магнетизм – это две отдельные, самостоятельные силы. Но примерно 200 лет назад в довольно простых опытах с электричеством обнаружили, что оно само может создавать магнитные силы, а затем поняли, что с помощью магнитов можно получать электричество. Теоретики объяснили, а эксперименты подтвердили, что электрические и магнитные силы – это лишь разные проявления одной физической реальности, чтобы никого не обижать, ее назвали электромагнетизмом. Но еще лет через сто выяснилось, что этот “союз двух” – самостоятельно работающая часть “союза трех”: в микромире открыли электрослабую силу, природное объединение электромагнитных и слабых сил.
Но примерно 200 лет назад в довольно простых опытах с электричеством обнаружили, что оно само может создавать магнитные силы, а затем поняли, что с помощью магнитов можно получать электричество. Теоретики объяснили, а эксперименты подтвердили, что электрические и магнитные силы – это лишь разные проявления одной физической реальности, чтобы никого не обижать, ее назвали электромагнетизмом. Но еще лет через сто выяснилось, что этот “союз двух” – самостоятельно работающая часть “союза трех”: в микромире открыли электрослабую силу, природное объединение электромагнитных и слабых сил.
Понимание природы и свойств электромагнетизма произвело переворот в технике и технологиях, подарило людям миллиарды неутомимых помощников – электродвигатели и мощные электрогенераторы, каждый из которых может зажечь 10 – 20 миллионов лампочек. В числе подарков оказались и радиоволны, связавшие континенты и доставляющие в наши дома десятки телевизионных программ. Открытие электромагнетизма, особенно после того, как к нему добавились слабые силы и обнаружился “союз трех”, дало физикам повод думать о “Великом объединении” – о единой природе всех Главных сил нашего мира. В то же время в реальной жизни электромагнетизм иногда работает своей электрической составляющей (карманный фонарик), иногда магнитной (магнитофон), и это дает повод по старинке считать, что в нашем мире действует великолепная пятерка Главных сил.
В то же время в реальной жизни электромагнетизм иногда работает своей электрической составляющей (карманный фонарик), иногда магнитной (магнитофон), и это дает повод по старинке считать, что в нашем мире действует великолепная пятерка Главных сил.
На этом надо бы закончить нашу лекцию, но я понимаю, что у вас есть вопросы.
Голоса. Вопросов миллион… Первый мой: почему Луна не падает на Землю, если ее так сильно тянет гравитация?.. А у меня такой вопрос: как электрические силы, магнитные силы и гравитация двигают разные предметы? Может быть, они их тянут невидимыми атомными нитями?.. Почему гравитация и ядерные силы умеют только притягивать, а электричество и магнетизм могут еще и отталкивать?.. Это правда, что физики ищут гравитацию, которая не притягивает, а отталкивает предметы, и уже назвали ее – антигравитация? Вот будет здорово, если эту антигравитацию найдут, – за счет отталкивания от Земли каждый сможет бесплатно летать куда угодно… Как на атомных электростанциях ядерные силы превращаются в электрические?. . Из чего состоят радиоволны?.. Вы сказали, что гравитация в несколько триллионов раз слабее электричества. Почему же она с такой силой притягивает к земле чемодан, с которым бабушка приезжает к нам в гости?..
. Из чего состоят радиоволны?.. Вы сказали, что гравитация в несколько триллионов раз слабее электричества. Почему же она с такой силой притягивает к земле чемодан, с которым бабушка приезжает к нам в гости?..
ДЧР. Давайте на этом бабушкином чемодане пока остановимся – я понял, что вопросов у вас действительно миллион, и все очень интересные. Напишите, пожалуйста, свои вопросы на листках бумаги и завтра передайте их мне – постараюсь в следующих лекциях на них ответить. А сейчас вам пора отдохнуть после непростого учебного дня. Спокойной ночи и до встречи завтра – на том же месте в тот же час.
(Продолжение следуют)
Урок в 11-м классе по теме “Строение атома”
1. Представление обучающимся темы, цели и задач урока. Для этого используется заранее подготовленная презентация урока.
Цель – изучение фундаментального
эксперимента английского физика Эрнеста
Резерфорда, проведённого им для выяснения
строения атома.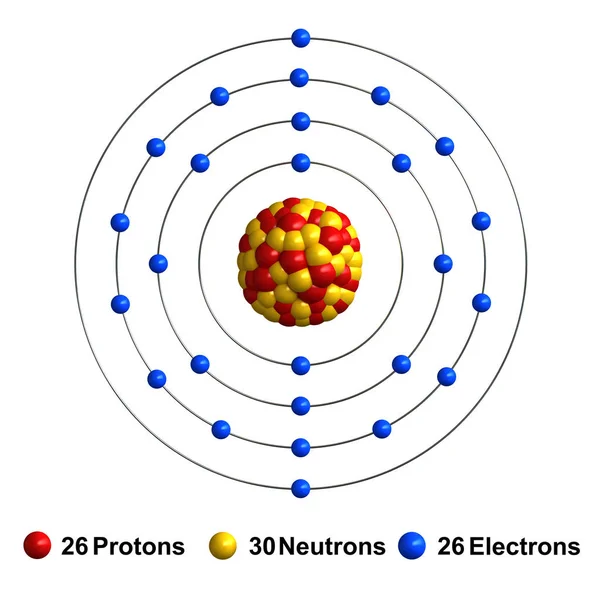
Задачи:
- способствовать формированию представлений о фундаментальности экспериментов на основе их значимости в изучении природы;
- использовать качественные представления о вариантах взаимодействия заряженных частиц для обучения решению задач на количественном уровне.
2. Мотивация познания. К мотиву познания сути эксперимента Резерфорда, его значимости для изучения строения вещества учитель подводит постепенно, используя, в том числе, их знания в изучаемой области из 7-9 классов:
- учитель предлагает школьникам вспомнить
известные им сведения о строении тел. Возможный
ответ – состоят из атомов и молекул. Далее в
беседе организуется выяснение того, что такое
атом, молекула; как переводится с греческого
языка слово “атом”, а с латинского “молекула”.
Обращается особое внимание на значение слова
“атом” – неделимый.

- учитель просит обучающихся вспомнить основателей атомизма. В случае положительного и отрицательного варианта ответов, в последующем на экран подаются изображения сведений о Левкиппе и Демокрите: годы жизни; портрет Демокрита; принципы Демокрита. Обсуждается вопрос о том, что думал Демокрит о внутреннем устройстве атома.
- представление учителем воззрений М.В. Ломоносова о строении вещества: на экран подаётся изображение портрета Ломоносова с текстом о его научном мировоззрении по поводу строения вещества. Обращается особое внимание на объяснение им теплоты и упругости газов движениями “нечувствительных частиц”. Демонстрируются современные модели молекул газов.
- обсуждается вопрос об открытиях конца 19 начала
20 века: проекция на экран портретов Анри
Беккереля, Джозефа Джона Томсона, Марии
Склодовской-Кюри, Пьера Кюри.
 Рассказ учителя об
открытиях лучей Беккереля, электрона,
радиоактивности.
Рассказ учителя об
открытиях лучей Беккереля, электрона,
радиоактивности. - постановка учителем проблем. На экран проецируются задания для школьников: “На какие свойства атома указывают открытия, исследования конца 19 начала 20 века? Может ли атом (неделимый) при таких обстоятельствах не иметь внутренней структуры?” Возможные ответы: частицы вылетают из атомов, из которых состоит исследуемое вещество. Атомы не могут не иметь внутренней структуры. Атомы состоят из каких-то частиц. Название “атом” не соответствует свойствам частицы, обозначенной этим словом.
- задание учителя школьникам, которое даётся с помощью текста, выведенного на экран: попробуйте смоделировать атом, учитывая те обстоятельства, что эта частица электрически нейтральна, но из неё вылетают электрические заряженные частицы.
Обучающимся предлагается решить поставленную
проблему. Для этого выделяется 2-3 минуты времени
урока. По истечении этого срока учитель
организует обсуждение достоинств и недостатков
моделей атомов, придуманных детьми. Модели для
наглядности изображаются на доске.
Для этого выделяется 2-3 минуты времени
урока. По истечении этого срока учитель
организует обсуждение достоинств и недостатков
моделей атомов, придуманных детьми. Модели для
наглядности изображаются на доске.
- чтение школьниками в учебнике абзаца “Модель Томсона” на странице 256. Сравнение своих моделей с моделью, построенной учёным. Демонстрация модели атома Томсона и пояснительного текста к ней на экран;
- демонстрация классу портрета японского физика Хантаро Нагаоки и его модели атома с пояснительным текстом к нему;
- проекция на экран исторической справки о пионерах планетарной модели атома Л. Пуанкаре, Вильгельме Вине, Жане Батисте Перрене: портреты учёных, пояснительный текст;
- вопросы на экране: “Какая модель из двух предложенных моделей атома в большей степени соответствует истине? Чем и как можно подтвердить или опровергнуть ту или иную модель?” Школьникам предлагается подумать и, на том или ином основании, выбрать верную модель атома;
- после обсуждения вариантов выбранных моделей
атома школьниками в качестве “верных”, на экран
проецируется “Историческая справка”,
рассказывающая о выборе модели атома учёными,
где разъясняются мотивы такого выбора.
 Обучающиеся
легко должны понять позицию учёных, так как они
уже знакомы с главой 7 “Электромагнитные волны”,
и знают условия их возникновения. Знают, что
электромагнитные волны переносят энергию.
Обучающиеся
легко должны понять позицию учёных, так как они
уже знакомы с главой 7 “Электромагнитные волны”,
и знают условия их возникновения. Знают, что
электромагнитные волны переносят энергию.
Проекция на экран вопроса: “Каковы, по вашему мнению, должны быть дальнейшие действия учёных в сложившейся ситуации?” Знания и опыт школьников должны помочь им самим назвать последующие действия учёных – экспериментальная проверка предложенных моделей атома.
На этом этапе урока заканчивается мотивация изучения эксперимента Резерфорда. Эта предварительная часть урока постепенно, логически и исторически обоснованно подводит обучающихся к главной части урока. Из опыта известно, что такой подход в уроках формирования новых знаний, вызывает интерес для продолжения учебного процесса.
3. Основная часть урока. Знакомство с
экспериментатором: подача на экран кадра
“Экспериментальная проверка”. Демонстрация
портрета Эрнеста Резерфорда с текстом о
некоторых аспектах его научной деятельности.
Демонстрация
портрета Эрнеста Резерфорда с текстом о
некоторых аспектах его научной деятельности.
Следующий кадр – задание школьникам прочитать абзац в учебнике “Идея опыта Резерфорда” на странице 257.
После прочтения (в другом варианте перед прочтением) обучающимися назначенного текста, учитель просит ответить их на вопросы: “Что решил использовать Резерфорд в качестве “щупа” для внедрения в атом с целью его изучения?”, “ Почему?”. Для облегчения формирования ответов на экране демонстрируются выше названные вопросы.
Представление учителем (с целью экономии
времени, и как одного из вариантов ведения урока)
экспериментальной установки Резерфорда. Рассказ
об этапах проведения эксперимента, наблюдаемых
фактов: на экране спроецированная схема
установки Резерфорда, модель
движения альфа-частиц вблизи ядра в период
эксперимента, наблюдаемые в микроскоп
изображения мест попаданий альфа-частиц в период
отсутствия и присутствия золотой фольги в
установке.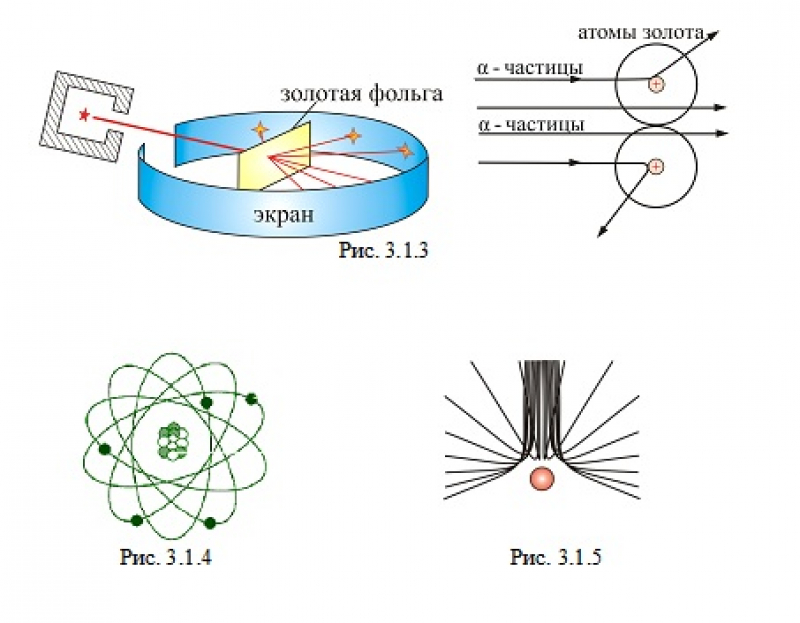
Фронтальная беседа, в которой выясняются возможные причины: отсутствия отклонений в движении альфа-частиц, когда на их пути нет золотой фольги; рассеяния альфа частиц в период их движения через золотую фольгу; рассеяния альфа-частиц на углы близкие к 180 градусам. Обсуждение вопроса о возможных причинах разного количества альфа-частиц, отклонившихся на большие и малые углы при их движении через фольгу.
Демонстрация кинофрагмента “Опыт Резерфорда”. Это необходимо для более глубокого понимания устройства экспериментальной установки Резерфорда, её экспериментальных возможностей, наблюдения эксперимента в динамике. Кинофильм позволяет достаточно быстро увидеть всё то, что обсуждалось в беседе с обучаемыми. Способствует восприятию всех этапов эксперимента в комплексе.
Проекция на экран текста: “Выводы учёного,
сделанные им после эксперимента”: положительный
заряд атома и его масса сконцентрированы в очень
малой области пространства; отрицательные
электроны в атоме располагаются от
положительного заряда на очень больших
расстояниях (по меркам микромира).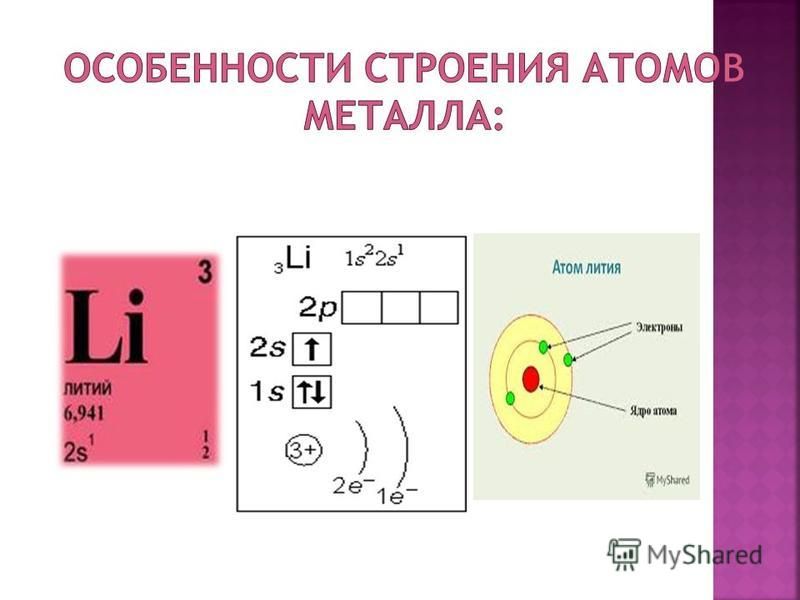 Электроны в
атоме движутся по круговым траекториям вокруг
положительного заряда; атом похож на планетную
систему (правыми оказались Л. Пуанкаре, Вин,
Перрен, Нагаока).
Электроны в
атоме движутся по круговым траекториям вокруг
положительного заряда; атом похож на планетную
систему (правыми оказались Л. Пуанкаре, Вин,
Перрен, Нагаока).
Обсуждение с обучающимися на качественном уровне выводов, сделанных Резерфордом в виде постановки учителем проблем типа: “Почему учёный сделал именно такие выводы?”. Здесь, после демонстрации вопроса, на экран возвращается предыдущий кадр.
Объективные реалии, позволившие Резерфорду
сделать представленные выводы. В этой части
урока учитель дополняет качественные выводы
учёного, сделанные им на основе анализа
наблюдаемых в эксперименте фактов,
количественными, полученными им после
проведения соответствующих расчётов. А именно:
максимальная сила отталкивания определяется по
закону Кулона. Чем меньше радиус ядра атома R, тем
больше сила, отталкивающая альфа частицу: . Чтобы
положительный заряд атома мог отбросить альфа
частицу назад, потенциальная энергия
кулоновского отталкивания у границы
положительного заряда атома должна равняться
кинетической энергии альфа частицы: .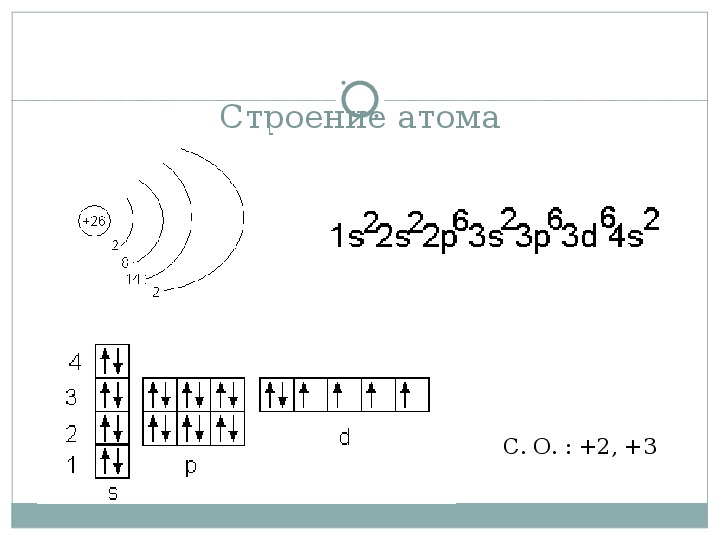 Расчёт
диаметра ядра атома (~ 10-13 см). Расчёт
диаметра атома (~10-8 см). Атом по размерам
(размер атома определяется размером его
электронной оболочки) в 100000 раз больше чем ядро.
Электроны движутся (иначе упали бы на ядро) почти
по круговым орбитам вокруг ядра. Суммарный заряд
атома равен 0 (заряд ядра +Ze, заряд всех электронов
на оболочках -Ze; где Z – порядковый номер
химического элемента в таблице Менделеева, e -
модуль заряда одного электрона).
Расчёт
диаметра ядра атома (~ 10-13 см). Расчёт
диаметра атома (~10-8 см). Атом по размерам
(размер атома определяется размером его
электронной оболочки) в 100000 раз больше чем ядро.
Электроны движутся (иначе упали бы на ядро) почти
по круговым орбитам вокруг ядра. Суммарный заряд
атома равен 0 (заряд ядра +Ze, заряд всех электронов
на оболочках -Ze; где Z – порядковый номер
химического элемента в таблице Менделеева, e -
модуль заряда одного электрона).
Демонстрация модели простейшего атома водорода, сконструированного после эксперимента Резерфорда учёными по представлениям классической физики о строении вещества. Демонстрация модели более сложного атома, построенного учёными по представлениям классической физики о строении вещества.
Представление обучающимся интересной
исторической справки: “О результатах своих
исследований Резерфорд сообщил в феврале 1911 г. Через три месяца его доклад был опубликован, и
мир узнал о новой, планетарной модели атома.
Осенью того же года состоялся первый
Сольвеевский конгресс в Брюсселе, на который
приехали выдающиеся физики Европы: М. Планк, А.
Пуанкаре, А. Эйнштейн, Х.А. Лоренц, В. Нернст и др.
Среди приглашённых участников был и Э. Резерфорд.
С волнением он ожидал оценки своей работы. И что
же он услышал? Ничего. О предложенной им модели
атома не было сказано ни слова. Вообще-то
председательствующий на конгрессе Лоренц
говорил о достоинствах атомной модели, только не
резерфордовской, а той, “которая была предложена
сэром Дж. Дж. Томсоном”. Таким образом, научный
мир не принял всерьёз модель атома Резерфорда”.
Через три месяца его доклад был опубликован, и
мир узнал о новой, планетарной модели атома.
Осенью того же года состоялся первый
Сольвеевский конгресс в Брюсселе, на который
приехали выдающиеся физики Европы: М. Планк, А.
Пуанкаре, А. Эйнштейн, Х.А. Лоренц, В. Нернст и др.
Среди приглашённых участников был и Э. Резерфорд.
С волнением он ожидал оценки своей работы. И что
же он услышал? Ничего. О предложенной им модели
атома не было сказано ни слова. Вообще-то
председательствующий на конгрессе Лоренц
говорил о достоинствах атомной модели, только не
резерфордовской, а той, “которая была предложена
сэром Дж. Дж. Томсоном”. Таким образом, научный
мир не принял всерьёз модель атома Резерфорда”.
Для выяснения причин такого отношения учёного
мира к результатам экспериментальной
деятельности Резерфорда обучающимся
предлагается прочитать самим в учебнике на
странице 259 соответствующий текст. Для этого на
экран проецируется задание: “Учебник физики. Страница 259. Найдите причину отрицательного
отношения учёных к экспериментально выявленной
Резерфордом модели атома”.
Страница 259. Найдите причину отрицательного
отношения учёных к экспериментально выявленной
Резерфордом модели атома”.
Коллективное обсуждение прочитанной информации. Проекция на экран модели “гибели” атома с разъяснительным текстом.
Предложение обучающимся решить несколько проблем для более глубокого понимания опыта Резерфорда. Для этого на экран проецируется изображение раздела “Постарайтесь ответить на вопросы самостоятельно”. В этом разделе три вопроса, на которые обучающиеся во фронтальной беседе дают соответствующие ответы.
“Атом в основном пуст. Какие экспериментальные факты в опыте Резерфорда указывают на это?”.
“Фундаментальный [лат.] – основательный, крепкий, солидный, прочный; основной. Почему опыт Резерфорда называют фундаментальным?”.
“Примерно одна из каждых 20000 альфа частиц отклонялась на углы в 90 и более градусов (т. е. назад). Почему так мало таких частиц было зафиксировано в опыте Резерфорда?”
4. Решаем задачу вместе. Это заключительная
часть урока. В ней предлагается решить задачу
непосредственно связанную с изучаемым на уроке
материалом. Решение такой задачи будет
способствовать закреплению знаний, полученных
при изучении опыта Резерфорда. После решения
задачи (при наличии времени) можно разрешить
несколько проблем, связанных с условием этой
задачи. Это касается моделирования более сложных
ситуаций взаимодействия заряженных
элементарных частиц. Построение таких моделей
существенно углубит понимание закона сохранения
энергии, необходимого для решения разнообразных
задач о взаимодействии заряженных частиц.
Решаем задачу вместе. Это заключительная
часть урока. В ней предлагается решить задачу
непосредственно связанную с изучаемым на уроке
материалом. Решение такой задачи будет
способствовать закреплению знаний, полученных
при изучении опыта Резерфорда. После решения
задачи (при наличии времени) можно разрешить
несколько проблем, связанных с условием этой
задачи. Это касается моделирования более сложных
ситуаций взаимодействия заряженных
элементарных частиц. Построение таких моделей
существенно углубит понимание закона сохранения
энергии, необходимого для решения разнообразных
задач о взаимодействии заряженных частиц.
На экран проецируется текст задачи: “Рассчитать,
на какое наименьшее расстояние альфа-частица,
имеющая скорость , может приблизиться к ядру атома
золота, двигаясь по прямой линии, проходящей
через центр ядра. Масса альфа-частицы , заряд
альфа-частицы ,
заряд ядра золота “. Обучающимся предлагается
записать её краткое условие.
Обучающимся предлагается
записать её краткое условие.
Проекция на экран изображения краткого условия задачи. Проверка школьниками своих записей. Исправление, дополнение (при необходимости) своих записей.
Предложение обучающимся с помощью выведения на экран соответствующего текста смоделировать ситуацию, описанную в задаче сначала на качественном уровне, а потом ещё дать разъяснение чертежом.
Обсуждение моделей, предложенных школьниками. Изображение обучающимися своих моделей на доске. Выбор правильной модели на основе обсуждения достоинств и недостатков, предложенных учениками моделей.
Если предыдущая часть урока окажется
“неудачной”, школьникам предлагается помощь в
виде текста, описывающего модель взаимодействия
частиц, о которых говорится в задаче: “В задаче
предполагается, что ядро атома золота неподвижно
и закреплено. Первоначально альфа-частица
располагается в бесконечности (взаимодействие с
ядром атома золота отсутствует) и имеет скорость
в направлении центра ядра атома золота. Система двух заряженных частиц обладает
полной энергией равной кинетической энергии
альфа-частицы. Во втором состоянии система
частиц обладает только потенциальной энергией
взаимодействия, так как альфа-частица
остановилась”. При удачном описании модели
сближения частиц кем-либо из школьников, текст
также проецируется на экран для тех, кто не всё
понял.
Система двух заряженных частиц обладает
полной энергией равной кинетической энергии
альфа-частицы. Во втором состоянии система
частиц обладает только потенциальной энергией
взаимодействия, так как альфа-частица
остановилась”. При удачном описании модели
сближения частиц кем-либо из школьников, текст
также проецируется на экран для тех, кто не всё
понял.
На экран проецируется чертёж (рис.1), моделирующий описанную в задаче ситуацию. На чертеже намеренно не сделаны обозначения. Эту информацию учитель попытается узнать у школьников. В беседе со школьниками происходит уточнение различных тонкостей взаимодействия частиц, исправление ошибок, допущенных в рассуждениях школьников при построении ими теории взаимодействия частиц.
Подготовка обучающихся к решению задачи на
количественном уровне. На экране изображение
раздела урока, который называется “Ответьте на
вопросы”. Школьники поочерёдно прочитывают
предложенные учителем вопросы и стараются
решить поставленные в них проблемы. Разрешение
этих проблем даёт полное понимание задачи и (при
знаниях физических формул и математики) упростит
решение задачи:
Разрешение
этих проблем даёт полное понимание задачи и (при
знаниях физических формул и математики) упростит
решение задачи:
Какую систему тел составляют альфа-частица и ядро атома золота?
Какой закон справедлив для таких тел?
Какие преобразования энергии происходят в процессе сближения частиц?
Для каких состояний двух частиц вы будете использовать названный вами закон?
Далее школьникам предлагается самим решить задачу. Обучающиеся решают, учитель наблюдает за процессом деятельности своих учеников и называет им сделанные ошибки в индивидуальном порядке.
При успешном решении задачи кем-либо из класса,
учитель предлагает ему продемонстрировать своё
решение на доске. При таком варианте хода урока
или при отсутствии решивших задачу (больше 3-5
минут на самостоятельные действия детей
отводить времени не следует), на экран подаётся
следующий кадр презентации с решением задачи. Обучающиеся прорабатывают предложенное решение
в тетрадях.
Обучающиеся прорабатывают предложенное решение
в тетрадях.
Учитель предлагает обучающимся сделать проверку наименований единиц по конечной формуле решённой задачи. По истечении некоторого времени для самоконтроля школьникам демонстрируется эта физико-математическая операция.
Далее на экран выводится кадр “Обсуждаем
вместе!”. С целью более качественного
разъяснения опыта Резерфорда и углубления
понимания его обучающимися полезно обсудить
вопрос о том, что произойдёт с – частицей после её
остановки. Разгоняясь, в сторону от ядра
золота, она достигнет бесконечности с такой же по
модулю скоростью, с которой была запущена в него.
Оставаясь в свободном состоянии, частица
продолжит движение с этой скоростью бесконечно
долго. Или: какие явления и почему происходили
бы с частицами, если бы ядро золота не
предполагалось быть закреплённым? При
сближении частиц, ядро золота приобретёт
некоторую скорость в сторону от альфа-частицы. После их сближения на минимальное расстояние,
альфа-частица остановится и начнёт разгоняться в
противоположную сторону. Ядро золота продолжит
разгоняться в том же направлении. При достижении
частицами взаимного расстояния, равного
бесконечности, они приобретут некоторые
скорости, которые при их последующем взаимном
удалении сохранятся неизменными. Почему же в
эксперименте Резерфорд и его ученики обнаружили
рассеяние -
частиц от первоначального направления движения
после взаимодействия с ядром золота на большие
углы, но не было таких, которые рассеялись бы на
угол ? При
внимательном рассмотрении схемы установки
Резерфорда, обнаруживается, что на такой угол не
могли повернуться экран с микроскопом для
фиксации этого явления: они бы заслонили путь – частицам до
фольги. Естественно, такой факт имеет место, но
очень редко из-за малой его вероятности.
После их сближения на минимальное расстояние,
альфа-частица остановится и начнёт разгоняться в
противоположную сторону. Ядро золота продолжит
разгоняться в том же направлении. При достижении
частицами взаимного расстояния, равного
бесконечности, они приобретут некоторые
скорости, которые при их последующем взаимном
удалении сохранятся неизменными. Почему же в
эксперименте Резерфорд и его ученики обнаружили
рассеяние -
частиц от первоначального направления движения
после взаимодействия с ядром золота на большие
углы, но не было таких, которые рассеялись бы на
угол ? При
внимательном рассмотрении схемы установки
Резерфорда, обнаруживается, что на такой угол не
могли повернуться экран с микроскопом для
фиксации этого явления: они бы заслонили путь – частицам до
фольги. Естественно, такой факт имеет место, но
очень редко из-за малой его вероятности.
Домашнее задание: 94, придумать и решить задачу
обратную задаче, решённой на уроке.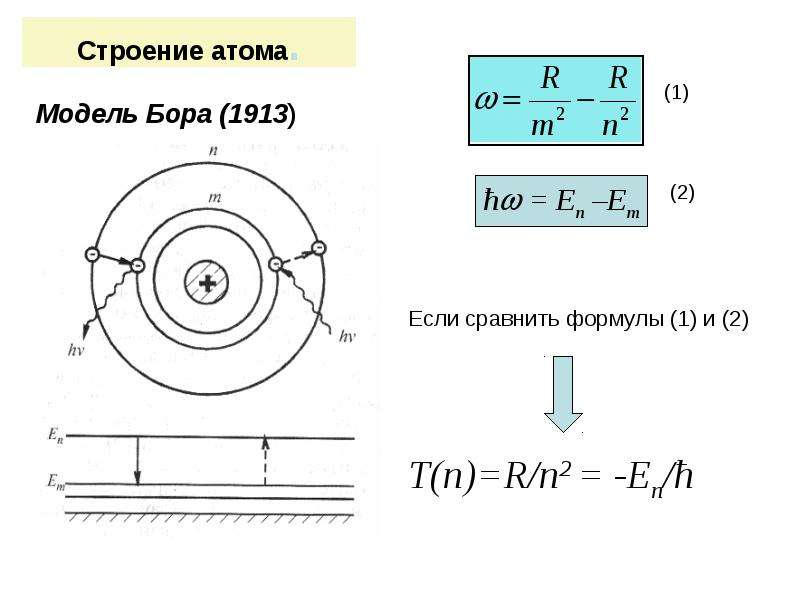
Литература, использованная для подготовки электронной разработки и плана-конспекта урока:
- Браверманн Э.М., Уроки физики: какими им быть сегодня, // Физика в школе, № 2, 2009;
- Громов С.В., Физика 11, М.: Просвещение. 2002;
- Генденштейн Л.Э., Дик Ю.И., Физика 11 класс, М.: Илекса. 2006;
- Евграфова Н.Н., Каган В.Л., Курс физики, М.: Высшая школа. 1984;
- Кудрявцев П.С., Курс истории физики, М.: Просвещение. 1974;
- Лёхин И.В., профессор Петрова Ф.Н. – редакторы, Краткий словарь иностранных слов, М.: ОГИЗ, 1947
- Мякишев Г.Я., Буховцев Б.Б., Физика 10, М.: Просвещение. 1976;
- Мякишев Г.Я., Буховцев Б.Б., Физика 11, М.: Просвещение.2004;
- Пинский А.А. – редактор, Физика 11, М.:
Просвещение.
 2000;
2000; - Рымкевич А.П., Рымкевич П.А. Сборник задач по физике для 8-10 классов средней школы. М.: Просвещение. 1984;
- Храмов Ю.А., Физики. Биографический справочник, М.: Наука. 1983.
Изотопы химического элемента Aurum – золота. Характеристики
Изотопы золота – это разновидности атомов химического элемента золота, имеющие разное содержание нейтронов в ядре. Все изотопы золота, за исключением одного стабильного, радиоактивны. Наиболее устойчивыми являются 195Au (период полураспада – 186,098 суток), 196Au (период полураспада – 6,1669 суток) и 199Au (период полураспада – 3,139 суток).
Изотопы золота характеризуются различной атомной массой. Это объясняется тем, что при постоянном числе протонов и электронов (по 79 элементарных частиц каждого типа) в них присутствует различное число не имеющих заряда нейтронов. Атомная масса изотопов золота может находиться в пределах от 169 до 205, если учитывать все известные разновидности атомов в настоящее время.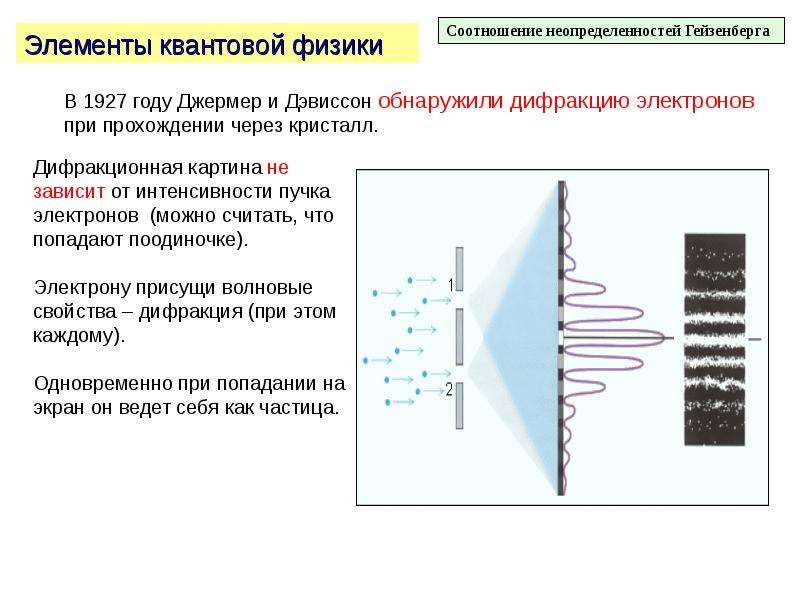
Природное золото состоит из единственного стабильного изотопа – 197Au. Его атомная масса выражается верхним индексом и составляет примерно 196,9666. Зарядовое число ядра, то есть количество протонов, составляет 79. Это порядковый номер золота в Периодической системе химических элементов. Следующий изотоп 198Au широко используется в радиотерапии и медицинской диагностике, в исследованиях с применением радиоактивных индикаторов.
Средневековые алхимики не одно десятилетие искали способ получения золото из других химических веществ: серебра, ртути, свинца, алюминия. В настоящее время учёные доказали теоретическую возможность такого процесса. Всем известно, что атомы состоят из протонов, нейтронов и электронов, причём число протонов в ядре совпадает с числом электронов (электрическая нейтральность). Количество протонов p+, а следовательно, и количество электронов e– соответствует порядковому номеру атома в таблице Менделеева. К примеру, нейтральный атом золота Au содержит 79 протонов и 79 электронов, а нейтральный атом ртути Hg – 80 протонов и 80 электронов.
К примеру, нейтральный атом золота Au содержит 79 протонов и 79 электронов, а нейтральный атом ртути Hg – 80 протонов и 80 электронов.
Если каким-то фантастическим образом убрать из атома ртути 1 протон и 1 электрон, он превратится в атом золота. Атом золота теоретически можно получить также из атома платины, стоящей слева в таблице Менделеева. Поскольку порядковый номер платины 78, в атом этого вещества нужно добавить 1 протон и 1 электрон, чтобы превратить его в атом золота. Если же такую операцию одновременно проделать с каждым атомом платинового слитка, то он превратится в золотой. Конечно, далеко не факт, что в данном случае сохранятся атомно-молекулярные связи, присущие любому веществу.
Превращение одного вещества в другое посредством изменения в каждом атоме числа элементарных частиц – ещё очень и очень далёкое будущее нашей цивилизации. Многие учёные опровергают возможность такого процесса, поскольку он должен занимать невозможно огромное количество энергии, что делает само превращение крайне невыгодным. К тому же, очень мало шансов, что после полной трансформации вещество сохранит целостность и получит необходимую структуру. Хотя вполне вероятно, что через 5-8 тысячелетий утюги будут спокойно трансформироваться в телевизоры и микроволновые печи, а автомобили превращаться в самолёты и космические корабли…
К тому же, очень мало шансов, что после полной трансформации вещество сохранит целостность и получит необходимую структуру. Хотя вполне вероятно, что через 5-8 тысячелетий утюги будут спокойно трансформироваться в телевизоры и микроволновые печи, а автомобили превращаться в самолёты и космические корабли…
Ценная информация продоставлена сайтом по покупке серебра и золота – Металл Дисконт
Золото – информация об элементе, свойства и использование
Стенограмма:
Химия в ее стихии: золото
(Промо)
Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет! пленка толщиной всего 230 атомов.На этой неделе нас ждет золото легендарного научного телеведущего и популяризатора Джонни Болла.
Джонни Болл
Элемент золота. Золото — это элемент 79, а его символ — Au. Хотя название англо-саксонское, золото произошло от латинского Aurum, или сияющий рассвет, а ранее от греческого. Его содержание в земной коре составляет 0,004 промилле.
100% золота, обнаруженного в природе, представляет собой изотоп Au-197. 28 других изотопов можно производить искусственно, и все они радиоактивны.
Золото вместе с серебром и медью образуют столбец в периодической таблице. Они встречаются в природе и были первыми тремя элементами, известными человеку. Все они использовались в качестве примитивных денег задолго до появления первых золотых монет в Египте около 3400 г. до н.э.
Большая часть золота является древним или происходит от центральноамериканских ацтеков и южноамериканских инков, привезенных в Европу испанцами и португальцами в 16 веке, и которое с тех пор многократно перерабатывалось. В 1830 году мировая добыча не превышала 12 тонн в год. Но примерно в то же время были сделаны новые открытия золота. Находки были обнаружены в Сибири, Калифорнии, Новом Южном Уэльсе и Виктории, Австралии, Трансваале, Южной Африке, Клондайке и Аляске, и все они вызвали золотую лихорадку. Мировое производство тогда составляло около 150 тонн в год. Сейчас это около 2300 тонн в год.
Но примерно в то же время были сделаны новые открытия золота. Находки были обнаружены в Сибири, Калифорнии, Новом Южном Уэльсе и Виктории, Австралии, Трансваале, Южной Африке, Клондайке и Аляске, и все они вызвали золотую лихорадку. Мировое производство тогда составляло около 150 тонн в год. Сейчас это около 2300 тонн в год.
Поскольку оно находится в естественном состоянии и не соединяется естественным образом ни с чем другим, и поскольку это самый тяжелый металл, при просеивании горной породы в воде золото всегда падает на дно, а все менее плотные примеси смываются.
Самым большим самородком был самородок «Добро пожаловать незнакомец», найденный в Виктории, Австралия, в 1869 году. Он весил более 71 кг. Этот тип самородков встречается в природе, но очень и очень редко. Чистое золото 24 карата. 18-каратное — это 75%, а 12-каратное — 50% чистого золота.
Золото — самый ковкий из всех металлов и достаточно мягкий, чтобы его можно было резать ножом. Народы каменного века чеканили золото в пластины для украшения. Были собраны действительно довольно большие суммы. Хотя царь Тутанхамон был несовершеннолетним фараоном и умер в возрасте 18 лет, только в его гробу было 112 кг золота.Египтяне также изготавливали тонкие листы золота, посуду, разнообразные украшения и даже золотую нить. Когда король Тутанхамон был похоронен, на его теле было более 150 золотых украшений.
Были собраны действительно довольно большие суммы. Хотя царь Тутанхамон был несовершеннолетним фараоном и умер в возрасте 18 лет, только в его гробу было 112 кг золота.Египтяне также изготавливали тонкие листы золота, посуду, разнообразные украшения и даже золотую нить. Когда король Тутанхамон был похоронен, на его теле было более 150 золотых украшений.
Сегодня 1 грамм можно превратить в лист квадратного метра толщиной всего 230 атомов. Из 1 кубического сантиметра получится лист площадью 18 квадратных метров. На лобовом стекле Concord был слой золота для защиты пилотов от ультрафиолетового света, и сегодня его часто используют в окнах небоскребов, чтобы уменьшить как тепло, так и ультрафиолет от солнечного света. Из 1 грамма можно получить 165 метров проволоки толщиной 20 мкм (микрон) (1/200 миллиметра)
Золотой цвет ограды Букингемского дворца на самом деле покрыт золотом, так как он держится 30 лет, в то время как золотая краска ( который вообще не содержит золота) сохраняется в отличном состоянии всего около года.
Морская вода содержит около 3 частей на миллиард золота, но до сих пор не найдено экономических способов его извлечения. Немцы очень старались во время Второй мировой войны, но потерпели неудачу.
Самый большой современный клад — это 30 000 тонн в Федеральном резервном банке США в Нью-Йорке, который принадлежит 18 различным странам. Подсчитано, что все золото мира, собранное вместе, составило бы куб со стороной около 18 метров — около 6000 кубических метров. И это золото.
Крис Смит
Итак, теперь вы знаете, почему пираты грызли золотые монеты, чтобы убедиться, что они настоящие. Дело было не только в камере, потому что она хорошо выглядела, а в том, что металл был достаточно мягким, чтобы оставлять следы от зубов. Это Джонни Болл рассказывал историю о золоте. В следующий раз в программе «Химия в ее стихии» Виктория Гилл представит химическое вещество, которое положило начало науке о фотографии, а также помогло начать карьеру победителям «Оскара».
Виктория Гилл
В 1840 году Генри Тэлбот открыл еще одну химическую особенность: так называемое латентное серебряное изображение, которое было кратковременно экспонировано на слое йодида серебра, может быть обнаружено с помощью галловой кислоты.Эффект воспринимался как волшебное, дьявольское искусство. Голливуд никогда не мог бы существовать без химической реакции, которая дала целлулоидной пленке способность захватывать звезд и выводить их на метко названный серебряный экран.
Крис Смит
И вы можете слышать, как Виктория Джилл скрещивает вашу когнитивную ладонь и набивает серебром ваш интеллектуальный карман на следующей неделе Химия в ее стихии. Я Крис Смит, спасибо, что выслушали, увидимся в следующий раз.
(Акция)
(Конец акции)
ученых только что обнаружили новую структуру в золоте, которая существует только в экстремальных состояниях
Ученые только что открыли кое-что новое о золоте. Когда экстремальное сокрушительное давление применяется быстро, всего за наносекунды, атомная структура элемента изменяется, становясь более похожей на металлы, которые тверже золота.
Когда экстремальное сокрушительное давление применяется быстро, всего за наносекунды, атомная структура элемента изменяется, становясь более похожей на металлы, которые тверже золота.
Впервые такое структурное состояние наблюдалось в золоте, что указывает на свойства, которые могут помочь ученым уточнить свое понимание того, как элементы ведут себя под давлением.
Золото — очаровательный элемент. Он является одним из наименее реакционноспособных, и его кристаллическая структура, по прогнозам, будет стабильной при невероятно высоких давлениях.
Расположение атомов в золоте соответствует так называемой «гранецентрированной кубической» (ГЦК) структуре. Проще говоря, атомы в золоте образуют кубы с атомом в каждом из углов и еще одним атомом в центре каждой из граней (вы можете увидеть, как это выглядит на изображении ниже). Золото, серебро, платина, серебро, алюминий и никель имеют такую структуру.
(Ливерморская национальная лаборатория Лоуренса)
Предыдущие эксперименты показали, что в золоте структура ГЦК остается стабильной даже при давлении, в три раза превышающем давление в центре Земли. Это одно из свойств, которое делает золото очень полезным для установления стандарта давления в экспериментах с алмазными наковальнями — устройствами, используемыми для создания чрезвычайно высокого давления в лаборатории.
Это одно из свойств, которое делает золото очень полезным для установления стандарта давления в экспериментах с алмазными наковальнями — устройствами, используемыми для создания чрезвычайно высокого давления в лаборатории.
Но обычно давление применяется постепенно. При ударном сжатии ученые из Ливерморской национальной лаборатории имени Лоуренса наблюдали нечто иное.
При 223 ГПа (гигапаскалях) — это в 2,2 миллиона раз больше земного атмосферного давления на уровне моря — золото перестраивается в менее плотно упакованную «объемно-центрированную кубическую» (ОЦК) структуру, две структуры сосуществуют по мере того, как металл переходит из одной в другую. другой.
Слева: структура bcc; справа: структура ГЦК. (Daniel Mayer/DrBob/Stannered/Wikimedia Commons)
Как следует из названия, bcc также является кубической структурой с атомом на каждом из углов; но вместо атомов на каждой из граней куба есть только один в его центре (см. Выше). Многие металлы, включая более мягкие, такие как литий и натрий, и более твердые, такие как вольфрам и хром, имеют ОЦК-структуру.
В то время как физики знакомы со сдвигом между ГЦК и ОЦК структурами в металлургии, такой как производство стали, этот фазовый переход ранее не был задокументирован в золоте.
«Мы обнаружили новую структуру в золоте, которая существует в экстремальных состояниях — две трети давления в центре Земли», — сказал физик Ричард Бриггс из Ливерморской национальной лаборатории Лоуренса.
“Новая структура на самом деле имеет менее эффективную упаковку при более высоких давлениях, чем исходная структура, что было удивительно, учитывая огромное количество теоретических предсказаний, указывающих на существование более плотно упакованных структур.”
Команда не остановилась и на 223 ГПа.После первоначального шока они отслеживали структурные изменения по мере увеличения давления. При 262 ГПа фазовый переход завершился, и золото начало плавиться. При 322 ГПа — почти давлении в центре Земли — золото было полностью жидким, такого состояния ученые ранее не наблюдали при таком уровне давления.
Это действительно увлекательно для заполнения диаграммы фазового перехода для золота, но результаты также имеют более широкое значение для производства, говорят исследователи.Например, железо имеет ГЦК- или ОЦК-структуру в зависимости от температуры, что важно для производства стали: высокотемпературное ГЦК-железо может поглощать больше углерода, чем более холодное ОЦК.
Но точные механизмы фазового перехода до сих пор плохо изучены. Это исследование показывает, что золото претерпело фазовый переход как из-за температуры, так и из-за давления, что может помочь в будущих экспериментах попытаться выяснить этот механизм.
И сосуществование структур ГЦК и ОЦК в золоте при 220 ГПа в ударных условиях предполагает, что тройная точка, где его твердая, жидкая и газообразная формы существуют в равновесии, связана с этими условиями.
«Многие теоретические модели золота, которые используются для понимания поведения при высоких давлениях и температурах, не предсказывают формирование объемно-центрированной структуры», — сказал Бриггс.
«Наши результаты могут помочь теоретикам улучшить свои модели элементов при экстремальном сжатии и использовать эти новые модели для изучения эффектов химической связи, чтобы помочь в разработке новых материалов, которые могут образовываться в экстремальных состояниях».
Исследование опубликовано в Physical Review Letters .
Примечание редактора (2 августа 2019 г.): в более ранней версии этой статьи неверно указывалось, что металлы с ОЦК-структурой тверже золота. Теперь эта ошибка исправлена.
Построить атом
Информация об учителе:
Описание деятельности:
Интерактивный модуль, знакомящий с атомной структурой
Цели обучения:
После этого задания учащийся сможет описать базовую структуру вещества, назвать части атома, получить опыт работы с периодической таблицей, объяснить элементы и иметь представление об изотопах.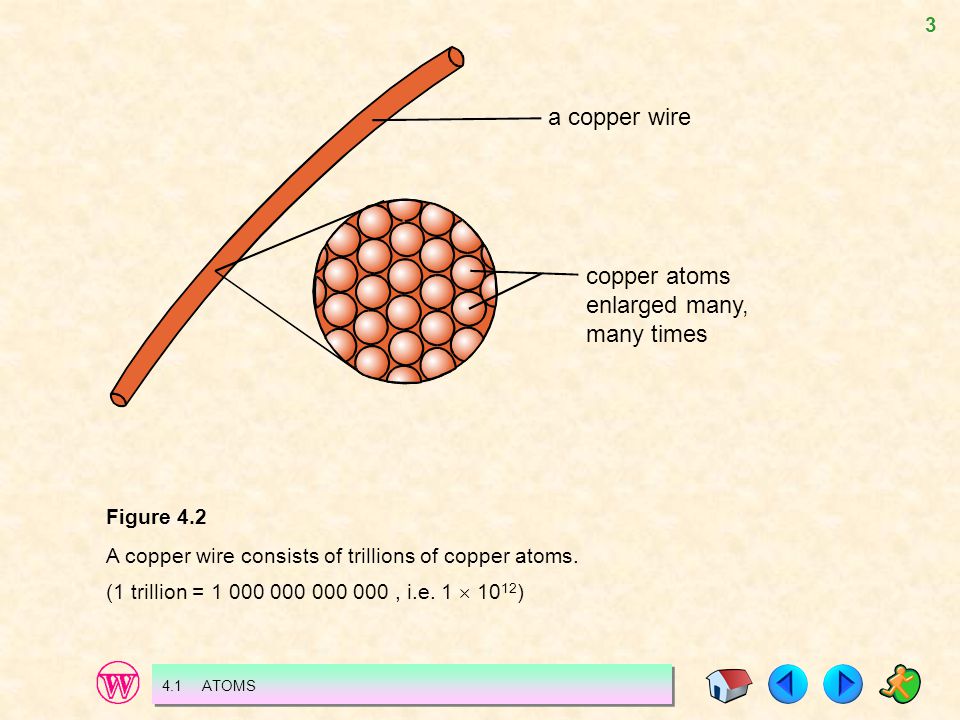
Концепты:
Химические элементы, периодическая таблица, химические символы, атом, атомный номер, атомный вес, протоны, электроны, нейтроны, атомная структура.
Большие идеи науки:
- Материя состоит из дискретных фундаментальных единиц, называемых атомами
- Химические и физические свойства материалов можно объяснить структурой и расположением атомов, ионов и молекул и силами между ними
- Любая связь или межмолекулярное притяжение, которые могут образоваться, могут быть разрушены
Национальные стандарты:
НС 5.8.2 – Развивать понимание свойств материи
Примечание:
Эта игра представляет собой простое введение в модель атома Резерфорда-Бора и то, как мы организуем элементы. Для этой игры используются самые распространенные изотопы химических элементов. Общие вопросы о свойствах элементов предполагают стандартные температуру и давление (гелий жидкий ниже -268°С, а золото жидкий выше 1064°С). Они предназначены для того, чтобы заставить игроков задуматься о том, что они уже знают об элементах.Студентов могут заинтересовать еще более мелкие частицы квантовой физики, такие как кварки, бозоны, нейтрино и антинейтрино.
Для этой игры используются самые распространенные изотопы химических элементов. Общие вопросы о свойствах элементов предполагают стандартные температуру и давление (гелий жидкий ниже -268°С, а золото жидкий выше 1064°С). Они предназначены для того, чтобы заставить игроков задуматься о том, что они уже знают об элементах.Студентов могут заинтересовать еще более мелкие частицы квантовой физики, такие как кварки, бозоны, нейтрино и антинейтрино.
Как найти электронную конфигурацию элементов для золота (Au)
Электронная конфигурация для золота : Золото имеет символ «Au» и один из встречающихся в природе элементов с более высоким атомным номером. В чистом виде ЗОЛОТОЙ элемент представляет собой легкий, яркий, красновато-желтый, мягкий, плотный, пластичный и ковкий металл. Золото является переходным элементом и находится в 11 й группе периодической таблицы.
Электронная конфигурация элемента определяется как количество электронов, присутствующих на орбитах атома или молекулы.
В случае золота в 6 оболочках атома золота присутствует 79 электронов. Количество электронов на каждой орбите равно 2, 8, 18, 32, 18 и 1. Электронная конфигурация золота:
.Химический элемент с атомным номером 79.
1S 2 2S 2 2 P 2 2P 6 3P 6 3P 6 3P 10 4s 2 4p 6 4 p 6 4D 10 4f 14 5с 2 5p 6 5d 10 6s 1 .
или
[Xe] 4f 14 5d 10 6s 1
Электронная конфигурация для иона золотаЭлектронная конфигурация иона золота может быть представлена как количество электронов, присутствующих на орбите оболочки атома золота, и она записывается как [Xe] 4f 14 5d 10 6s 1
Полная электронная конфигурация для золотаПолная электронная конфигурация золота может быть определена как:
1S 2 2S 2 2 P 2 2P 6 3P 6 3P 6 3P 10 4s 2 4p 6 4 p 6 4D 10 4f 14 5с 2 5p 6 5d 10 6с 1
Валентные электроны золота В самой внешней оболочке Золота присутствует только один электрон, поэтому количество валентных электронов у Золота равно ОДИН.
Электронная конфигурация – это распределение электронов атомов по орбитам. Для золотой конфигурации электронов 1S 2 2S 2 2P 6 3P 2 3P 2 3P 6 33 10 4s 2 4p 6 4P 10 4f 14 5с 2 5p 6 5д 10 6с 1
Сколько валентных электронов в золоте
Количество валентных электронов — это количество электронов, находящихся на самой внешней оболочке атома.Золото имеет 79 электронов и имеет только один электрон на самой внешней оболочке и образует одновалентные соединения. Итак, золото имеет только 1 (один) валентный электрон.
22.1 Строение атома – Физика
Раздел Цели обучения
К концу этого раздела вы сможете делать следующее:
- Описывать эксперимент Резерфорда и его модель атома
- Описать спектры излучения и поглощения атомов
- Опишите боровскую модель атома
- Рассчитайте энергию электронов, когда они меняют энергетические уровни
- Рассчитать частоту и длину волны испускаемых фотонов, когда электроны меняют энергетические уровни
- Опишите квантовую модель атома
Поддержка учителей
Поддержка учителей
Цели обучения в этом разделе помогут вашим ученикам освоить следующие стандарты:
- (8) Научные концепции.
 Учащийся знает простые примеры атомных, ядерных и квантовых явлений. Ожидается, что студент:
Учащийся знает простые примеры атомных, ядерных и квантовых явлений. Ожидается, что студент:- (Б) сравнивать и объяснять спектры излучения различных атомов.
Кроме того, в Руководстве по физике для средней школы рассматривается содержание этого раздела лабораторной работы под названием: Атом, а также следующие стандарты:
- (8) Научные концепции. Учащийся знает простые примеры атомных, ядерных и квантовых явлений.Ожидается, что студент:
- (Б) сравнивать и объяснять спектры излучения различных атомов.
Основные термины раздела
| диаграмма уровней энергии | возбужденное состояние | Линии Фраунгофера |
| основное состояние | Принцип неопределенности Гейзенберга | водородоподобные атомы |
| планетарная модель атома | Резерфордское рассеяние | постоянная Ридберга |
Откуда мы знаем, что атомы действительно существуют, если мы не можем видеть их своими глазами? Хотя наши знания о существовании и структуре атомов часто принимаются как должное, они являются результатом многовековых размышлений и экспериментов. Самые ранние из известных рассуждений об атоме относятся к пятому веку до нашей эры, когда греческие философы Левкипп и Демокрит размышляли о том, можно ли бесконечно делить вещество на все более мелкие части. С тех пор такие ученые, как Джон Дальтон (1766–1844), Амадео Авогадро (1776–1856) и Дмитрий Менделеев (1834–1907), помогли открыть свойства этой фундаментальной структуры материи. Хотя можно было бы много написать о любом числе важных ученых-философов, в этом разделе основное внимание будет уделено роли Эрнеста Резерфорда (1871–1937).Хотя его понимание нашей самой элементарной материи коренится в успехе бесчисленных предшествующих исследований, его удивительное открытие внутренней части атома является самым фундаментальным в объяснении многих хорошо известных явлений.
Самые ранние из известных рассуждений об атоме относятся к пятому веку до нашей эры, когда греческие философы Левкипп и Демокрит размышляли о том, можно ли бесконечно делить вещество на все более мелкие части. С тех пор такие ученые, как Джон Дальтон (1766–1844), Амадео Авогадро (1776–1856) и Дмитрий Менделеев (1834–1907), помогли открыть свойства этой фундаментальной структуры материи. Хотя можно было бы много написать о любом числе важных ученых-философов, в этом разделе основное внимание будет уделено роли Эрнеста Резерфорда (1871–1937).Хотя его понимание нашей самой элементарной материи коренится в успехе бесчисленных предшествующих исследований, его удивительное открытие внутренней части атома является самым фундаментальным в объяснении многих хорошо известных явлений.
Служба поддержки учителей
Служба поддержки учителей
[AL]Особо любознательным студентам предложите изучить труды Демокрита и определить, насколько его атомная теория верна сегодня.
Эксперимент Резерфорда
В начале 1900-х общепринятой моделью атома была модель сливового пудинга .Модель, предложенная в 1904 году Дж. Дж. Томсоном, предполагала, что атом представляет собой сферический шар с положительным зарядом, по которому равномерно рассеяны отрицательно заряженные электроны. В этой модели положительные заряды составляли пудинг, а электроны действовали как изолированные сливы. За время своей короткой жизни модель можно было использовать для объяснения того, почему большинство частиц были нейтральными, хотя при несбалансированном количестве слив могли существовать электрически заряженные атомы.
Поддержка учителей
Поддержка учителей
Модель сливовый пудинг — это устаревший термин, который многие учащиеся не поймут.Модель мороженого с шоколадной крошкой может лучше подойти для описания модели Томсона учащимся. Более продвинутые учащиеся могут самостоятельно описать другие модели.
Более продвинутые учащиеся могут самостоятельно описать другие модели.
Когда Эрнест Резерфорд начал свой эксперимент с золотой фольгой в 1909 году, вряд ли кто-то мог ожидать, что модель сливового пудинга будет оспорена. Однако с помощью радиоактивного источника, тонкого листа золотой фольги и фосфоресцирующего экрана Резерфорд обнаружил нечто настолько великое, что позднее назовет это «самым невероятным событием, которое когда-либо случалось со мной в жизни» [James, L. .К. (1993). Нобелевские лауреаты по химии, 1901–1992 гг. . Вашингтон, округ Колумбия: Американское химическое общество.]
Эксперимент, разработанный Резерфордом, показан на рис. 22.2. Как вы можете видеть, радиоактивный источник был помещен в свинцовый контейнер с отверстием на одной стороне, чтобы произвести пучок положительно заряженных частиц гелия, называемых альфа-частицами . Затем в пучок помещали тонкий лист золотой фольги. Когда высокоэнергетические альфа-частицы проходили через золотую фольгу, они рассеивались. Рассеяние наблюдалось по ярким пятнам, которые они образовывали при попадании на люминофорный экран.
Рассеяние наблюдалось по ярким пятнам, которые они образовывали при попадании на люминофорный экран.
Поддержка учителей
Поддержка учителей
Уделите время объяснению этой концепции. Студентам, возможно, потребуется напомнить о фосфоресценции. Кроме того, в этом курсе еще не рассматривалась радиоактивность. На данный момент, возможно, имеет смысл заявить, что источник в свинцовом контейнере «выстреливает мелкими частицами с высокой скоростью».
Рис. 22.2 Эксперимент Резерфорда дал прямые доказательства размера и массы ядра путем рассеяния альфа-частиц тонкой золотой фольгой.Рассеяние частиц предполагает, что ядра золота очень малы и содержат почти всю массу атома золота. Особенно важное значение для определения размера ядра имеют альфа-частицы, которые разлетаются под очень большими углами, как футбольный мяч, отскакивающий от головы вратаря.
Ожидание от модели сливового пудинга заключалось в том, что высокоэнергетические альфа-частицы будут лишь незначительно рассеиваться в присутствии золотого листа. Поскольку энергия альфа-частиц была намного выше энергии, обычно связанной с атомами, альфа-частицы должны были пройти сквозь тонкую фольгу подобно тому, как сверхзвуковой шар для боулинга пробивает несколько десятков рядов кеглей.Ожидалось, что любое отклонение будет незначительным и связано, главным образом, с электростатической кулоновской силой между альфа-частицами и внутренними электрическими зарядами фольги.
Поскольку энергия альфа-частиц была намного выше энергии, обычно связанной с атомами, альфа-частицы должны были пройти сквозь тонкую фольгу подобно тому, как сверхзвуковой шар для боулинга пробивает несколько десятков рядов кеглей.Ожидалось, что любое отклонение будет незначительным и связано, главным образом, с электростатической кулоновской силой между альфа-частицами и внутренними электрическими зарядами фольги.
Однако истинный результат оказался совсем другим. В то время как большинство альфа-частиц беспрепятственно проходили через фольгу, Резерфорд и его сотрудники Ганс Гейгер и Эрнест Марсден обнаружили, что альфа-частицы иногда рассеиваются под большими углами, а некоторые даже возвращаются в том же направлении, откуда пришли! Результат, названный рассеянием Резерфорда, означал, что ядра золота на самом деле были очень малы по сравнению с размером атома золота.Как показано на рис. 22.3, плотное ядро окружено в основном пустым пространством атома, и эта идея подтверждается тем фактом, что только 1 из 8000 частиц рассеивалась назад.
Служба поддержки учителей
Служба поддержки учителей
[BL][OL]Учащиеся должны распознать два различных результата эксперимента с золотой фольгой. (1) Ядро золота очень плотное. (2) Атом в основном представляет собой пустое пространство. Попросите учащихся определить, какие данные из эксперимента с золотой фольгой подтверждают эти два утверждения.
[AL] Предложите учащимся определить, произойдет ли обратное рассеяние в модели сливового пудинга.
Вы также можете предложить учащимся провести исследование, чтобы изучить тип расчета, необходимого для определения диаметра ядра по количеству столкновений; он доступен на этом веб-сайте.
Рис. 22.3. Увеличенное изображение атомов в золотой фольге в эксперименте Резерфорда. Кружками обозначены атомы диаметром около 10 −10 м, а точками — ядра диаметром около 10 −15 м.Чтобы быть видимыми, точки должны быть намного больше масштаба — если бы ядра действительно были размером с точки, каждый атом имел бы диаметр около пяти метров! Большинство альфа-частиц прорываются сквозь них, но практически не подвергаются воздействию из-за их высокой энергии и малой массы электрона. Некоторые, однако, поражают ядро и рассеиваются прямо назад. Детальный анализ их взаимодействия дает размер и массу ядра.
Некоторые, однако, поражают ядро и рассеиваются прямо назад. Детальный анализ их взаимодействия дает размер и массу ядра.
Хотя результаты эксперимента были опубликованы его коллегами в 1909 году, Резерфорду потребовалось два года, чтобы убедиться в их значении.Позже Резерфорд писал: «Это было почти так же невероятно, как если бы вы выстрелили 15-дюймовым снарядом в кусок папиросной бумаги, а он вернулся бы и попал в вас. Поразмыслив, я понял, что это рассеяние назад… [означало]… большая часть массы атома сосредоточена в крошечном ядре». В 1911 году Резерфорд опубликовал свой анализ вместе с предложенной моделью атома, которая частично была основана на работе Гейгера предыдущего года. В результате работы было определено, что размер ядра составляет около 10-1510-15 м, или в 100 000 раз меньше размера атома.Это подразумевает огромную плотность, порядка 10 15 10 15 г/см 90 181 3 90 182 , намного большую, чем любая макроскопическая материя.
Основываясь на обнаруженных им в эксперименте размерах и массе ядра, а также массе электронов, Резерфорд предложил планетарную модель атома. Планетарная модель атома изображает электроны с малой массой, вращающиеся вокруг ядра с большой массой. Размеры электронных орбит велики по сравнению с размером ядра, и большая часть атома представляет собой вакуум. Эта модель аналогична тому, как планеты с малой массой в нашей Солнечной системе вращаются вокруг Солнца с большой массой.В атоме кулоновская сила притяжения аналогична гравитации в планетарной системе (см. рис. 22.4).
Планетарная модель атома изображает электроны с малой массой, вращающиеся вокруг ядра с большой массой. Размеры электронных орбит велики по сравнению с размером ядра, и большая часть атома представляет собой вакуум. Эта модель аналогична тому, как планеты с малой массой в нашей Солнечной системе вращаются вокруг Солнца с большой массой.В атоме кулоновская сила притяжения аналогична гравитации в планетарной системе (см. рис. 22.4).
Рис. 22.4 Планетарная модель атома Резерфорда включает в себя характеристики ядра, электронов и размер атома. Модель была первой, которая распознала структуру атомов, в которой электроны с малой массой вращаются вокруг очень маленького массивного ядра по орбитам, намного большим, чем ядро. Атом в основном пуст и аналогичен нашей планетной системе.
Виртуальная физика
Резерфордовское рассеяние
Как Резерфорд выяснил строение атома, не имея возможности его увидеть? Исследуйте ответ с помощью этого моделирования знаменитого эксперимента, в котором он опроверг модель сливового пудинга, наблюдая за альфа-частицами, отскакивающими от атомов, и определяя, что они должны иметь маленькое ядро.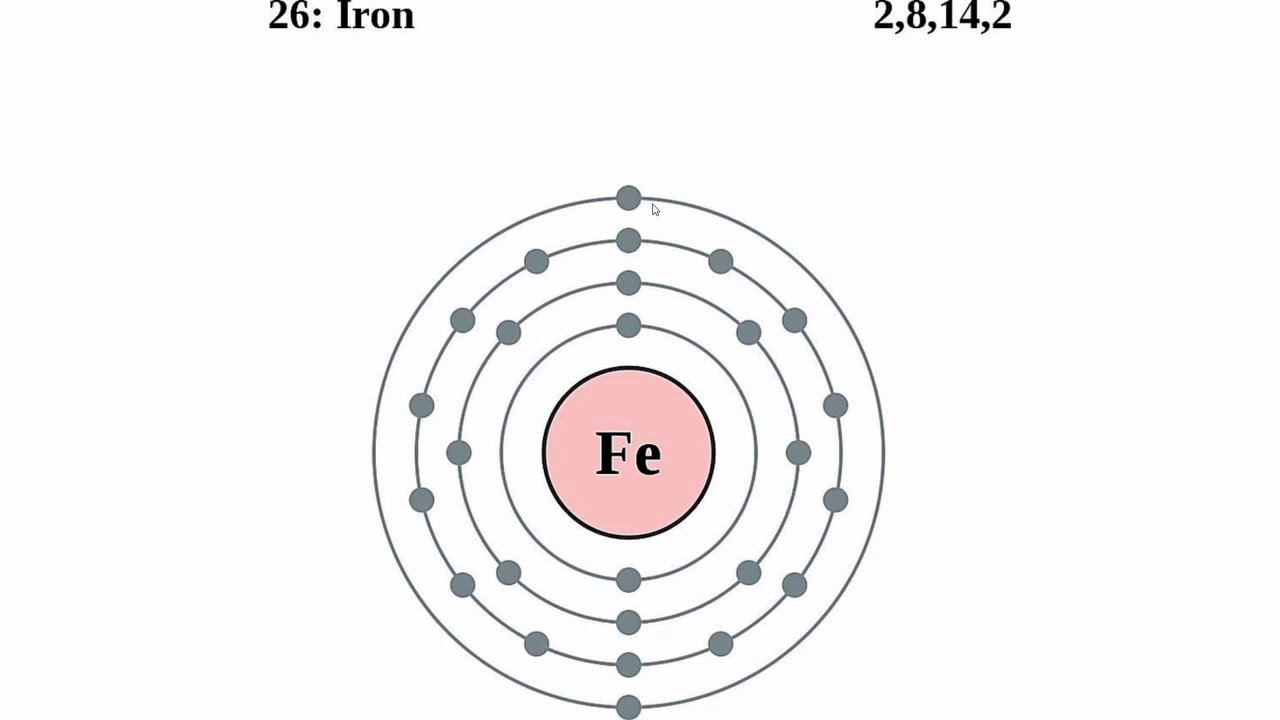
Советы для достижения успеха
По мере изучения модели атома учитывайте влияние экспериментов на научный процесс.Спросите себя: какой была бы наша модель атома без эксперимента Резерфорда с золотой фольгой? Какое дальнейшее понимание атома не было бы достигнуто? Как это повлияет на наши нынешние технологии? Хотя эксперименты, проводимые сегодня для дальнейшего понимания состава атома, часто сбивают с толку, возможно, они могут иметь аналогичный эффект.
Спектры поглощения и излучения
Служба поддержки учителей
Служба поддержки учителей
Прежде чем приступить к этому разделу, важно рассмотреть концепцию квантования.Что значит быть квантованным? Приведите примеры понятий, которые являются квантовыми, и понятий, которые таковыми не являются. Обзор значительно упростит понимание спектров излучения и орбитальных состояний.
[EL] Спектр относится к диапазону электромагнитного излучения, испускаемого формой материи или энергии. Множественное число спектров .
Множественное число спектров .
В 1900 году Макс Планк признал, что вся энергия, излучаемая источником, излучается атомами в квантовых состояниях. Как эта радикальная идея соотносится с внутренней частью атома? Ответ был впервые найден при исследовании спектра света или спектра излучения, возникающего при сильном возбуждении газа.
На рис. 22.5 показано, как выделить спектр излучения одного из таких газов. Газ помещается в газоразрядную трубку слева, где он заряжается до такой степени, что начинает излучать энергию или излучать свет. Излучаемый свет направляется тонкой щелью, а затем проходит через дифракционную решетку, которая разделяет свет на составляющие его длины волн. Затем отделенный свет попадет на фотопленку справа.
Поддержка учителя
Поддержка учителя
- Обязательно объясните, как газоразрядная трубка начинает излучать энергию.Когда газ помещается в электрическое поле, ему может быть сообщено достаточно энергии, чтобы он начал излучать.
 Сосредоточение внимания на увеличении энергии за счет электрического поля поможет учащимся отделить эту концепцию от непрерывного энергетического спектра, создаваемого увеличением температуры излучающего черного тела.
Сосредоточение внимания на увеличении энергии за счет электрического поля поможет учащимся отделить эту концепцию от непрерывного энергетического спектра, создаваемого увеличением температуры излучающего черного тела. - Если дифракционная решетка не под рукой, рис. 22.5 можно смоделировать, используя вместо нее призму.
Линейчатый спектр, показанный в части (b) рис. 22.5, представляет собой результат, показанный на пленке для возбужденного железа.Обратите внимание, что этот спектр не непрерывен, а дискретен. Другими словами, источник железа излучает только определенные длины волн. Почему это так?
Рис. 22.5 Часть (а) показывает слева направо газоразрядную трубку, щель и дифракционную решетку, создающую линейчатый спектр. В части (b) показан эмиссионный спектр железа. Дискретные линии означают квантованные энергетические состояния атомов, которые их производят. Линейчатый спектр каждого элемента уникален, обеспечивая мощный и часто используемый аналитический инструмент, и многие линейчатые спектры были хорошо известны за много лет до того, как их можно было объяснить с помощью физики. (кредит: (b) Yttrium91, Wikimedia Commons)
(кредит: (b) Yttrium91, Wikimedia Commons)
Спектр света, создаваемого возбужденным железом, показывает множество дискретных длин волн, излучаемых в пределах видимого спектра. Каждый элемент, возбужденный до соответствующей степени, создаст дискретный спектр излучения, как в части (b) рис. 22.5. Однако излучаемые длины волн будут варьироваться от элемента к элементу. Спектр излучения железа был выбран для рисунка 22.5 исключительно потому, что значительная часть спектра его излучения находится в пределах видимого спектра.На рис. 22.6 показан спектр излучения водорода. Обратите внимание, что, несмотря на дискретность, большая часть эмиссии водорода происходит в ультрафиолетовой и инфракрасной областях.
Поддержка учителей
Поддержка учителей
Покажите фотографии светящихся газов неона, аргона и гелия. Предложите учащимся порассуждать о спектрах видимых линий этих газов.
Рис. 22.6 Схема спектра водорода показывает несколько рядов, названных в честь тех, кто внес наибольший вклад в их определение. Часть серии Бальмера находится в видимом спектре, в то время как серия Лаймана полностью находится в ультрафиолетовом диапазоне, а серия Пашена и другие — в инфракрасном. Для некоторых линий показаны значения n f и n i . Их важность будет описана в ближайшее время.
Часть серии Бальмера находится в видимом спектре, в то время как серия Лаймана полностью находится в ультрафиолетовом диапазоне, а серия Пашена и другие — в инфракрасном. Для некоторых линий показаны значения n f и n i . Их важность будет описана в ближайшее время.
Так же, как спектр излучения показывает все дискретные длины волн, испускаемые газом, спектр поглощения показывает весь свет, поглощаемый газом. Черные линии существуют там, где длины волн поглощаются, а остальная часть спектра, освещенная светом, может свободно проходить.Как вы думаете, какая связь существует между черными линиями спектра поглощения газа и цветными линиями спектра его излучения? На рис. 22.7 показан спектр поглощения Солнца. Черные линии называются линиями Фраунгофера, и они соответствуют длинам волн, поглощаемым газами снаружи Солнца.
Служба поддержки учителей
Служба поддержки учителей
[AL] Предложите учащимся изучить, как астрономы используют линии Фраунгофера для определения состава звезд.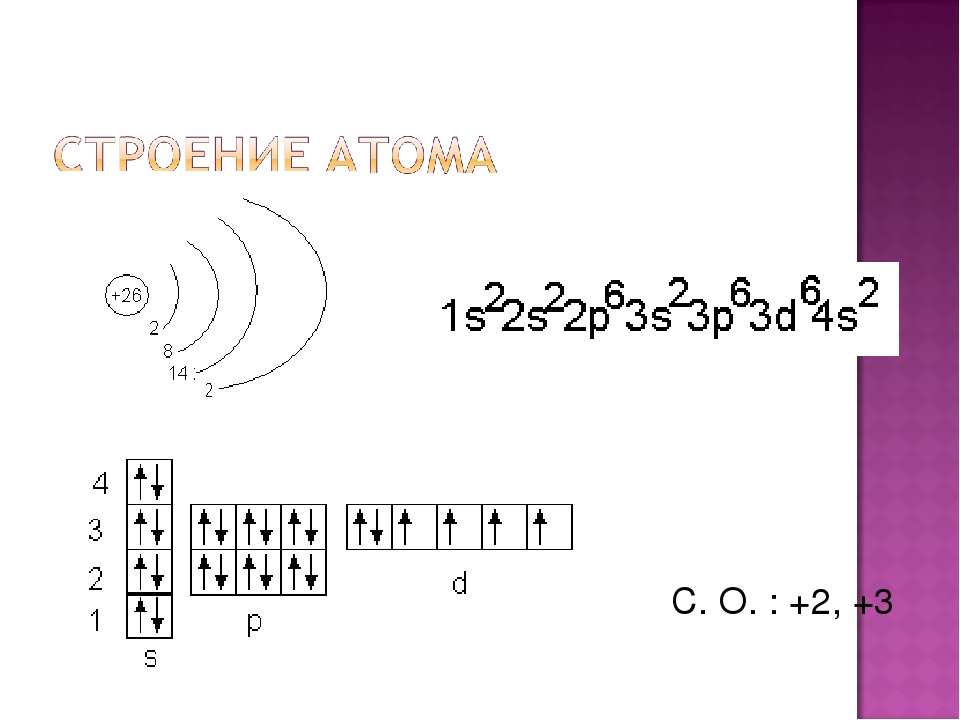
[BL][OL]Попросите учащихся предположить спектр поглощения, обеспечиваемый идеальным излучателем или идеальным поглотителем. Как бы выглядел спектр поглощения черной дыры?
Рис. 22.7 Спектр поглощения Солнца. Черные линии появляются на длинах волн, поглощаемых внешней газовой средой Солнца. Энергичные фотоны, испускаемые изнутри Солнца, поглощаются газом снаружи и переизлучаются в направлениях, удаленных от наблюдателя. Это приводит к темным линиям в спектре поглощения.Линии называются линиями Фраунгофера в честь немецкого физика, который их открыл. Линии, подобные тем, используются для определения химического состава звезд далеко за пределами нашей Солнечной системы.
Боровское объяснение спектра водорода
Чтобы связать уникальные признаки спектров излучения с составом самого атома, потребуется умное мышление. Нильс Бор (1885–1962), датский физик, сделал именно это, немедленно воспользовавшись планетарной моделью атома Резерфорда.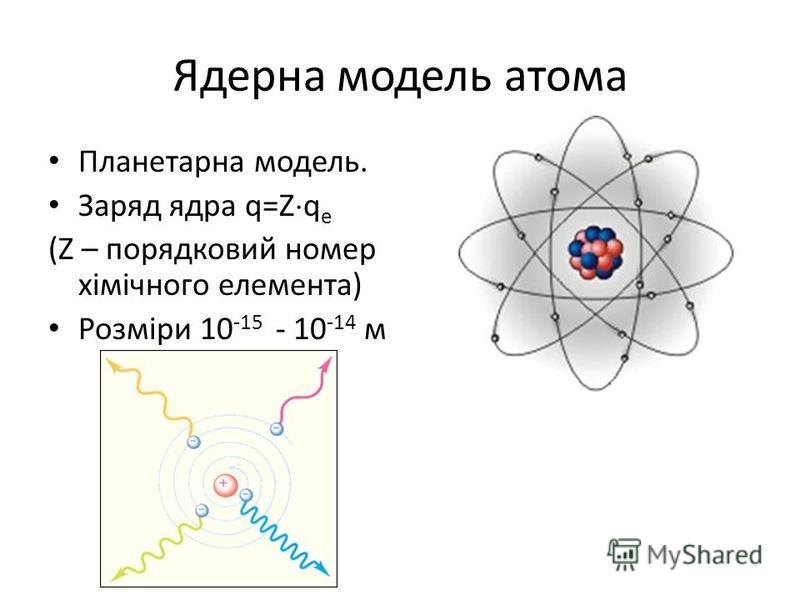 Бор, показанный на рис. 22.8, убедился в его достоверности и провел часть 1912 г. в лаборатории Резерфорда. В 1913 году, вернувшись в Копенгаген, он начал публиковать свою теорию простейшего атома водорода, основанную на планетарной модели Резерфорда.
Бор, показанный на рис. 22.8, убедился в его достоверности и провел часть 1912 г. в лаборатории Резерфорда. В 1913 году, вернувшись в Копенгаген, он начал публиковать свою теорию простейшего атома водорода, основанную на планетарной модели Резерфорда.
Рис. 22.8 Нильс Бор, датский физик, использовал планетарную модель атома для объяснения атомного спектра и размера атома водорода. Его большой вклад в развитие атомной физики и квантовой механики, его личное влияние на многих студентов и коллег и его личная честность, особенно перед лицом нацистского гнета, снискали ему видное место в истории.(кредит: Неизвестный автор, Wikimedia Commons)
Бор смог вывести формулу для спектра водорода, используя основы физики, планетарную модель атома и некоторые очень важные новые гипотезы. Его первая гипотеза заключалась в том, что разрешены только определенные орбиты: другими словами, в атоме орбиты электронов квантуются. Каждая квантованная орбита имеет различную энергию, и электроны могут двигаться на более высокую орбиту, поглощая энергию, или опускаться на более низкую орбиту, излучая энергию. Из-за квантованных орбит количество испускаемой или поглощаемой энергии также должно быть квантовано, создавая дискретные спектры, показанные на рис. 22.5 и рис. 22.7. В форме уравнения количество поглощенной или излучаемой энергии можно найти как
Из-за квантованных орбит количество испускаемой или поглощаемой энергии также должно быть квантовано, создавая дискретные спектры, показанные на рис. 22.5 и рис. 22.7. В форме уравнения количество поглощенной или излучаемой энергии можно найти как
22,1
, где EiEi относится к энергии начальной квантованной орбиты, а EfEf относится к энергии конечных орбит. Кроме того, испускаемая длина волны может быть найдена с помощью уравнения
hf=Ei-Ef,hf=Ei-Ef,22.2
и связь длины волны с частотой, найденная с помощью уравнения v=fλv=fλ, где v соответствует скорости света.
Логично, что энергия участвует в смене орбит. Например, для выхода спутника на более высокую орбиту требуется всплеск энергии. Чего не ожидается, так это того, что атомные орбиты должны быть квантованы. Квантование не наблюдается для спутников или планет, которые могут иметь любую орбиту при соответствующей энергии (см. рис. 22.9).
Рис. 22.9 Планетарная модель атома, модифицированная Бором, имеет квантованные орбиты электронов. Допускаются только определенные орбиты, что объясняет, почему атомные спектры дискретны или квантованы. Энергия, уносимая фотоном от атома, возникает в результате перехода электрона с одной разрешенной орбиты на другую и, таким образом, квантуется. То же верно и для атомного поглощения фотонов.
На рис. 22.10 показана диаграмма уровней энергии — удобный способ отображения энергетических состояний.Каждая из горизонтальных линий соответствует энергии электрона на разных орбиталях. Энергия изображена вертикально с самым низким или основным состоянием внизу и с возбужденными состояниями вверху. Вертикальная стрелка вниз показывает энергию, испускаемую атомом из-за перехода электрона из одного возбужденного состояния в другое. Это соответствовало бы линии, показанной на спектре излучения атома. Серия Лаймана, показанная на рис. 22.6, возникает в результате перехода электронов в основное состояние, тогда как серии Бальмера и Пашена приводят к переходу электронов в состояния n = 2 и n = 3 соответственно.
Служба поддержки учителей
Служба поддержки учителей
[BL][OL]Опросите учеников в это время. Покажите на доске большую диаграмму уровней энергии.Нарисуйте стрелку вверх и спросите, излучается или поглощается энергия. Предложите учащимся нарисовать стрелку, показывающую, что поглощается больше энергии. Нарисуйте стрелку вниз и спросите, излучается или поглощается энергия. Предложите учащимся сравнить количество энергии, излучаемой каплями разного уровня энергии.
[AL] Попросите учащегося нарисовать планетарную модель в соответствии с диаграммой энергетических уровней, показанной выше.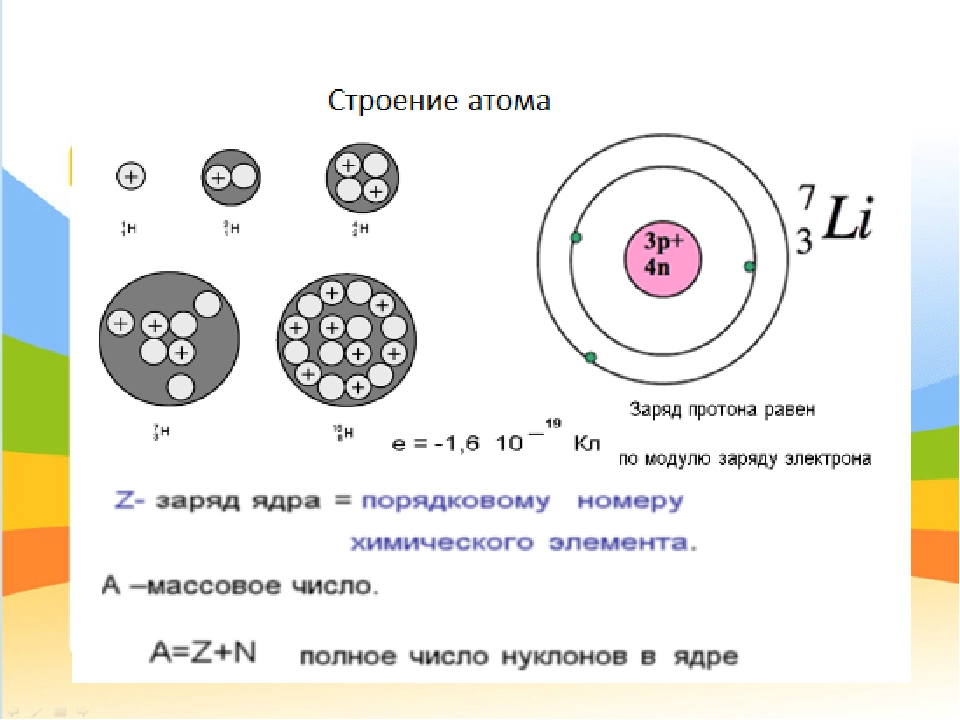 Предложите учащимся смоделировать изменения энергетических состояний на своей планетарной модели так, как они показаны на диаграмме энергетических уровней.Предложите учащимся использовать в своих объяснениях такие термины, как ряд Бальмера , ряд Лаймана и ряд Пашена .
Предложите учащимся смоделировать изменения энергетических состояний на своей планетарной модели так, как они показаны на диаграмме энергетических уровней.Предложите учащимся использовать в своих объяснениях такие термины, как ряд Бальмера , ряд Лаймана и ряд Пашена .
Энергия и длина волны спектра испускаемого водорода
Служба поддержки учителей
Служба поддержки учителей
Студентам может быть трудно понять отрицательное значение в следующем уравнении. Если вы уже обсуждали потенциальную энергию в крупномасштабных гравитационных системах, вы можете напомнить учащимся об этом приложении перед этим обсуждением.
Энергия, связанная с определенной орбиталью атома водорода, может быть найдена с помощью уравнения
En=−13,6eVn2(n=1,2,3,…),En=−13,6eVn2(n=1,2,3,…),22,3
, где n соответствует орбитальному значению ядра атома.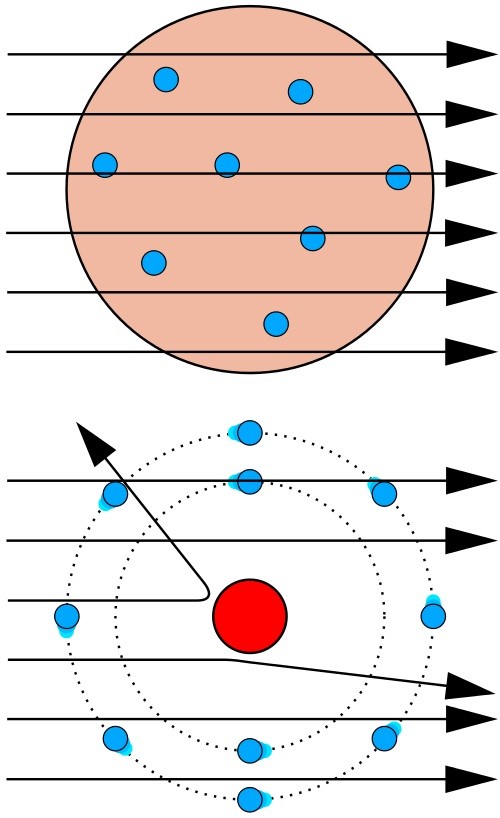 Отрицательное значение в уравнении основано на базовой энергии, равной нулю, когда электрон находится бесконечно далеко от атома. В результате отрицательное значение показывает, что энергия необходима для освобождения электрона из его орбитального состояния.Минимальная энергия для освобождения электрона также называется его энергией связи . Уравнение справедливо только для атомов с одним электроном на их орбитальных оболочках (например, водород). Для ионизированных атомов, подобных водороду, можно использовать следующую формулу.
Отрицательное значение в уравнении основано на базовой энергии, равной нулю, когда электрон находится бесконечно далеко от атома. В результате отрицательное значение показывает, что энергия необходима для освобождения электрона из его орбитального состояния.Минимальная энергия для освобождения электрона также называется его энергией связи . Уравнение справедливо только для атомов с одним электроном на их орбитальных оболочках (например, водород). Для ионизированных атомов, подобных водороду, можно использовать следующую формулу.
22,4
Обратите внимание, что EoEo соответствует –13,6 эВ, как упоминалось ранее. Кроме того, ZZ относится к атомному номеру изучаемого элемента. Атомный номер — это количество протонов в ядре — он различен для каждого элемента.Приведенное выше уравнение получено из некоторых основных физических принципов, а именно сохранения энергии, сохранения углового момента, закона Кулона и центростремительной силы. Есть три вывода, которые приводят к уравнениям орбитальной энергии, и они показаны ниже. Хотя вы можете использовать уравнения энергии, не понимая их вывода, они помогут напомнить вам, насколько ценны эти фундаментальные концепции.
Есть три вывода, которые приводят к уравнениям орбитальной энергии, и они показаны ниже. Хотя вы можете использовать уравнения энергии, не понимая их вывода, они помогут напомнить вам, насколько ценны эти фундаментальные концепции.
Поддержка учителей
Поддержка учителей
Следующие три варианта предназначены для продвинутых учащихся.Если у вас есть учащийся на уровне или ниже, вы можете пропустить его и сразу перейти к рисунку 22.11.
Вывод 1 (нахождение радиуса орбитали)
Одно из основных различий между планетарной моделью Солнечной системы и планетарной моделью атома заключается в причине кругового движения. В то время как гравитация вызывает движение планет вокруг внутренней звезды, кулоновская сила отвечает за круглую форму орбиты электрона. Величина центростремительной силы равна mev2rnmev2rn, а величина кулоновской силы равна k(Zqe)(qe)re2k(Zqe)(qe)re2.Здесь предполагается, что ядро более массивно, чем неподвижный электрон, и электрон вращается вокруг него.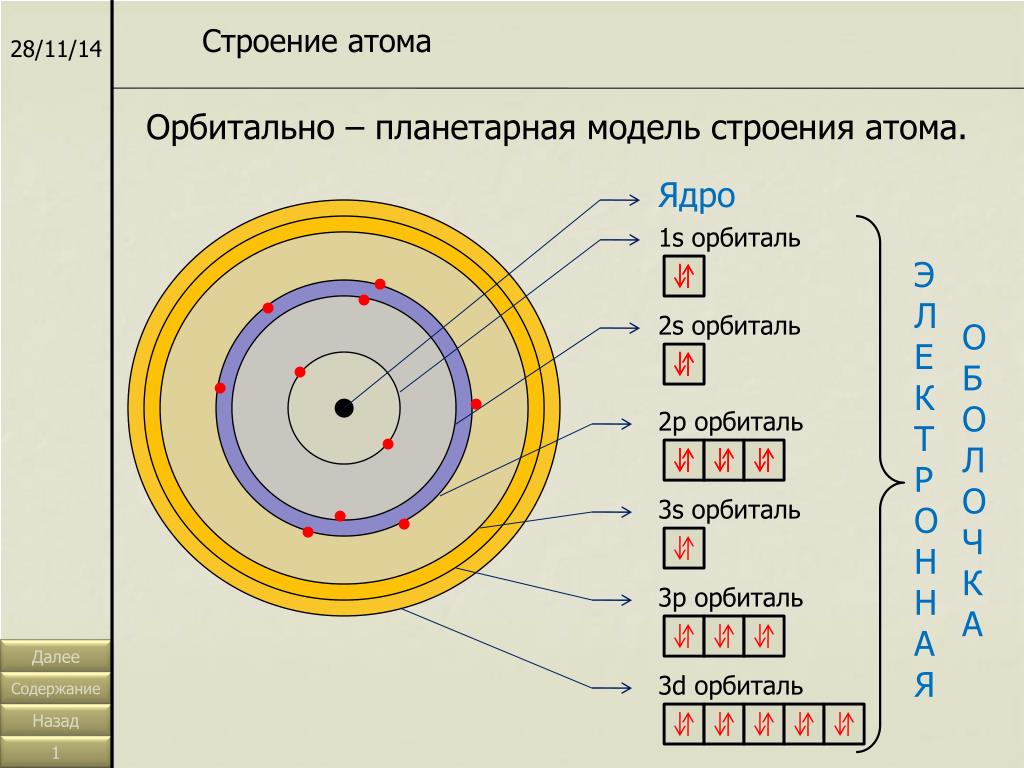 Это согласуется с планетарной моделью атома. Приравнивая силу Кулона к центростремительной силе,
Это согласуется с планетарной моделью атома. Приравнивая силу Кулона к центростремительной силе,
22,5
, что дает
rn=k(Zqe2)mv2.rn=k(Zqe2)mv2.22,6
Вывод 2 (нахождение скорости вращающегося электрона)
Бор был достаточно умен, чтобы найти способ вычислить орбитальную энергию электрона в водороде.Это был важный первый шаг, который был улучшен, но его стоит повторить здесь, потому что он правильно описывает многие характеристики водорода. Предполагая круговые орбиты, Бор предположил, что угловой момент L электрона на его орбите также квантуется, т. е. имеет только определенные, дискретные значения. Значение для L определяется по формуле
L=mevrn=nh3π(n=1,2,3,…),L=mevrn=nh3π(n=1,2,3,…),22,7
, где L — угловой момент, m e — масса электрона, r n — радиус n -й орбиты, h 90’009 — постоянная Планка.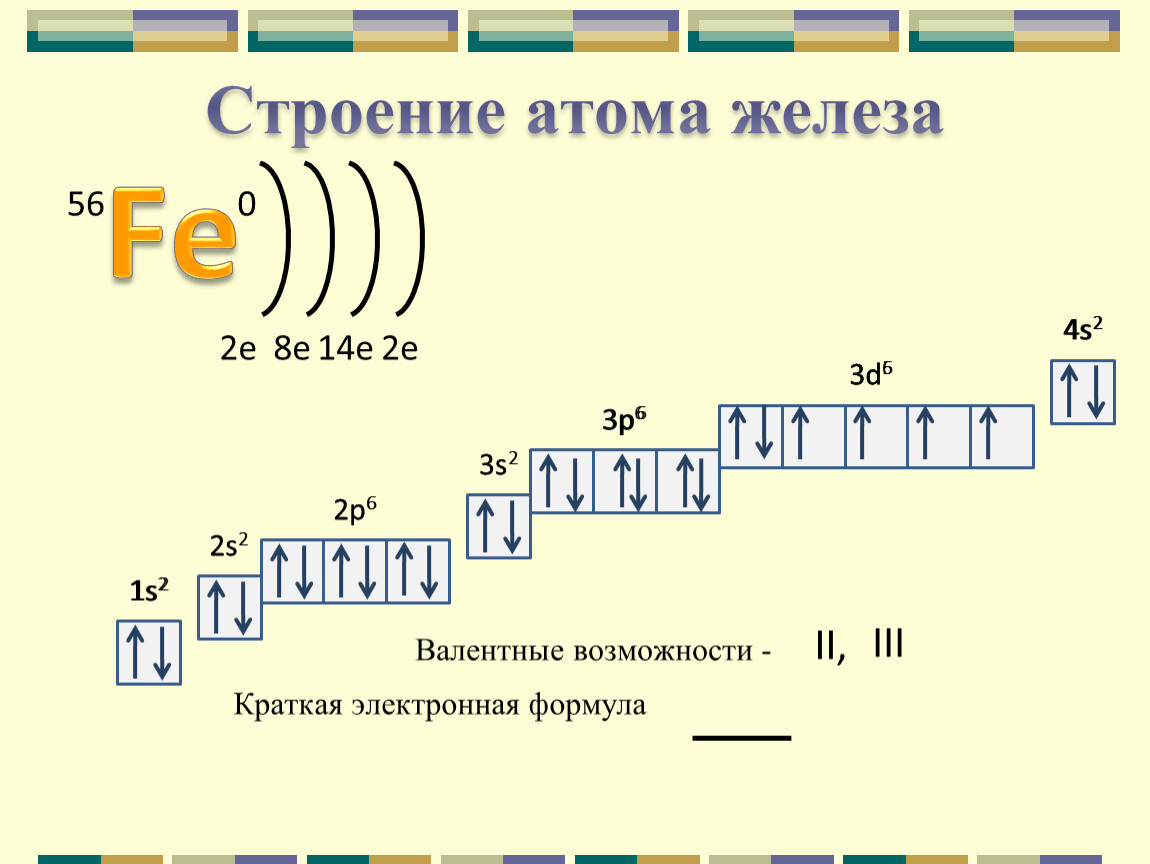 Обратите внимание, что угловой момент равен L=IωL=Iω . Для малого объекта радиусом r I=mr2I=mr2 и ω=vrω=vr, так что L=Iω=(mr2)(vr)=mvr. L=Iω=(mr2)(vr)=mvr. Квантование говорит, что значение mvr может быть равно только ч /2, 2 ч /2, 3 ч /2 и т. д. В то время сам Бор не знал, почему угловой момент должен быть квантован, но, используя это предположение, он смог рассчитать энергии в спектре водорода, чего в то время не делал никто другой.
Обратите внимание, что угловой момент равен L=IωL=Iω . Для малого объекта радиусом r I=mr2I=mr2 и ω=vrω=vr, так что L=Iω=(mr2)(vr)=mvr. L=Iω=(mr2)(vr)=mvr. Квантование говорит, что значение mvr может быть равно только ч /2, 2 ч /2, 3 ч /2 и т. д. В то время сам Бор не знал, почему угловой момент должен быть квантован, но, используя это предположение, он смог рассчитать энергии в спектре водорода, чего в то время не делал никто другой.
Вывод 3 (нахождение энергии вращающегося электрона)
Чтобы получить орбитальную энергию электрона, начнем с того, что заметим, что энергия электрона есть сумма его кинетической и потенциальной энергии.
Кинетическая энергия — это знакомая нам KE=12mv2KE=12mv2, если предположить, что электрон не движется с релятивистской скоростью. Потенциальная энергия электрона представляет собой электрическую энергию, или PE=qeVPE=qeV, где V — это потенциал, обусловленный ядром, которое выглядит как точечный заряд.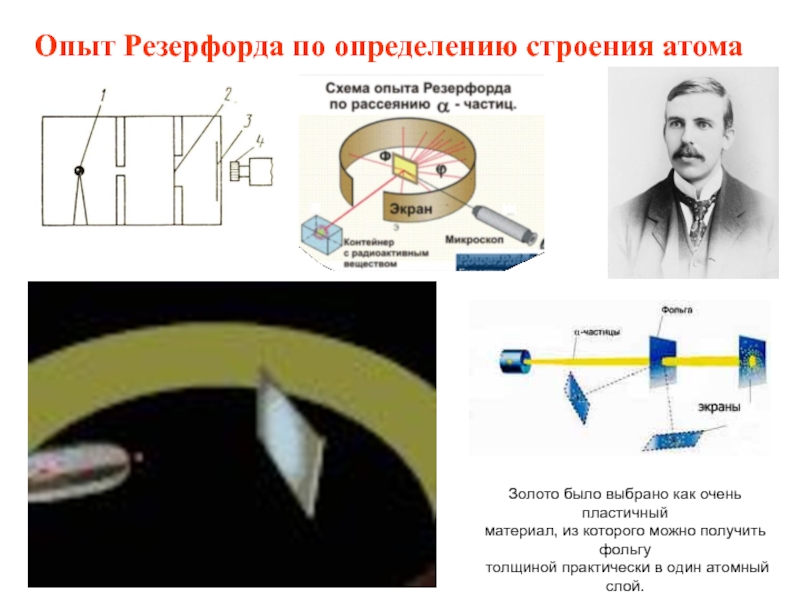 Ядро имеет положительный заряд ZqeZqe; таким образом, V = kZqernV = kZqern, напоминая более раннее уравнение для потенциала, связанного с точечным зарядом, из главы «Электричество и магнетизм». Поскольку заряд электрона отрицателен, мы видим, что PE=−kZqe2rn.PE=−kZqe2rn. Подставляя выражения для KE и PE,
Ядро имеет положительный заряд ZqeZqe; таким образом, V = kZqernV = kZqern, напоминая более раннее уравнение для потенциала, связанного с точечным зарядом, из главы «Электричество и магнетизм». Поскольку заряд электрона отрицателен, мы видим, что PE=−kZqe2rn.PE=−kZqe2rn. Подставляя выражения для KE и PE,
22,9
Теперь найдем r n и v , используя уравнение для углового момента L=mevrn=nh3π(n=1,2,3,…)L=mevrn=nh3π(n=1,2,3,…), что дает
v=nh3πmern(n=1,2,3,…)v=nh3πmern(n=1,2, 3,…)22.10
и
rn=nh3πmev(n=1,2,3,…).rn=nh3πmev(n=1,2,3,…).22.11
Подстановка выражения для r n и v в приведенные выше выражения для энергии (KE и PE) и выполнение алгебраических операций дает
En=-Z2n2Eo(n=1,2,3,…)En=-Z2n2Eo(n=1,2,3,…)22,12
для орбитальных энергий водородоподобных атомов.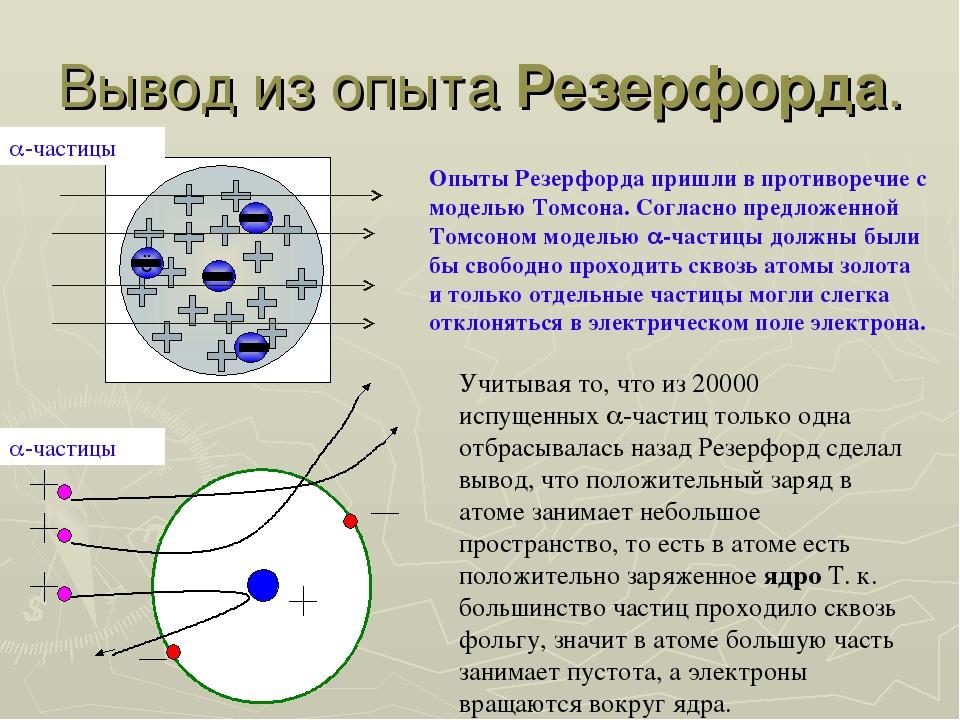 Здесь E o представляет собой энергию основного состояния ( n = 1) водорода ( Z = 1) и определяется как
Здесь E o представляет собой энергию основного состояния ( n = 1) водорода ( Z = 1) и определяется как
22.13
Таким образом, для водорода
En=-13,6eVn2(n=1,2,3,…).En=-13,6eVn2(n=1,2,3,…).22.14
Соотношение между орбитальной энергией и орбитальными состояниями атома водорода можно увидеть на рис. 22.11.
Рис. 22.11 Диаграмма уровней энергии для водорода, показывающая серию переходов Лаймана, Бальмера и Пашена.Орбитальные энергии рассчитываются с использованием приведенного выше уравнения, впервые полученного Бором.
Рабочий пример
В атом водорода попадает фотон. Какое количество энергии должно быть поглощено фотоном, чтобы перевести электрон атома водорода из основного состояния на вторую орбиталь?
Стратегия
Атом водорода имеет атомный номер Z = 1. Поднятие электрона из основного состояния на его вторую орбиталь повысит его орбитальный уровень с n = 1 до n = 2.Определенная энергия будет измеряться в электрон-вольтах.
Поднятие электрона из основного состояния на его вторую орбиталь повысит его орбитальный уровень с n = 1 до n = 2.Определенная энергия будет измеряться в электрон-вольтах.
Решение
Количество энергии, необходимое для изменения состояния электрона, равно разнице между конечной и начальной энергиями электрона. Конечное энергетическое состояние электрона можно найти с помощью
En=Z2n2Eo(n=1,2,3,…).En=Z2n2Eo(n=1,2,3,…).22.15
Зная значения n и Z для атома водорода и зная, что E o = –13.6 эВ, результат
Ef=1222(-13,6 эВ)=-3,4 эВ. Ef=1222(-13,6 эВ)=-3,4 эВ.22.16
Первоначальное количество энергии, связанной с электроном, эквивалентно орбитали основного состояния, или
EO = 1212 (-13,6 эВ) = -13,6 эВ. EO = 1212 (-13,6 эВ) = -13,6 эВ. 22. 17
17
Количество энергии, необходимое для изменения орбитального состояния электрона, можно определить, определив изменение энергии электрона.
ΔE=Ef-Eo=(-3,4 эВ)-(-13,6 эВ)=+10,2 эВ ΔE=Ef-Eo=(-3,4 эВ)-(-13,6 эВ)=+10.2 эВ22,18
Обсуждение
Энергия, необходимая для изменения орбитального состояния электрона, положительна. Это означает, что для того, чтобы электрон перешел в состояние с большей энергией, к атому должна быть добавлена энергия. Если электрон вернется в исходное энергетическое состояние, произойдет изменение на -10,2 эВ, и атом излучит 10,2 эВ энергии. Точно так же, как атом может поглощать только квантовые количества энергии, атом может излучать только квантовые количества энергии.Это помогает объяснить многие квантовые световые эффекты, о которых вы узнали ранее.
Рабочий пример
Характеристическая энергия рентгеновского излучения
Рассчитайте приблизительную энергию рентгеновского излучения, испускаемого при переходе от n = 2 до n = 1 в вольфрамовом аноде рентгеновской трубки.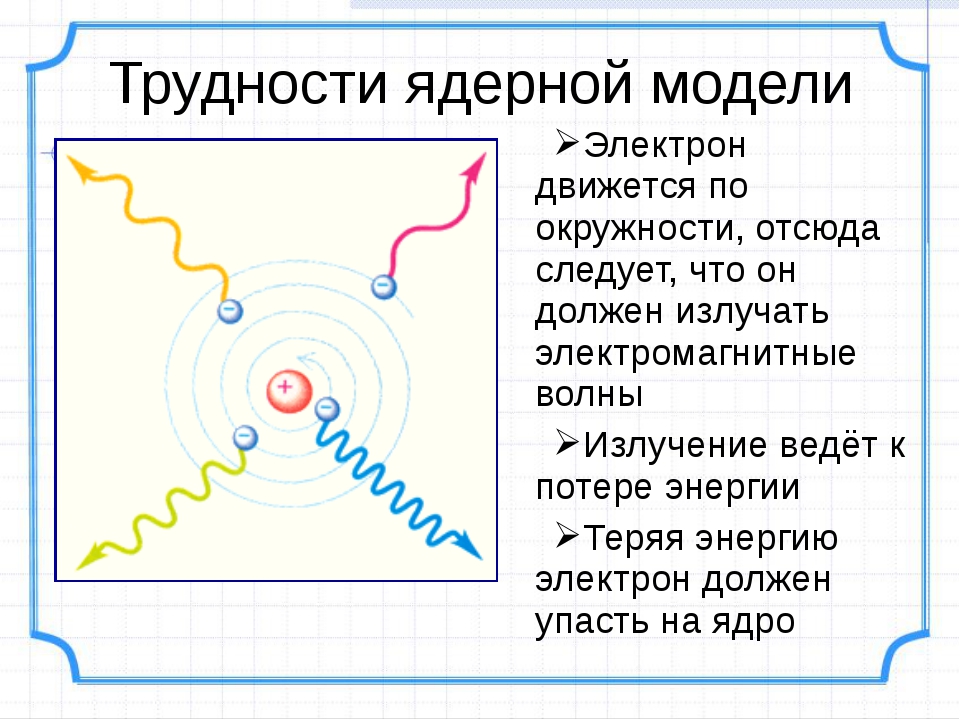
Стратегия
Как рассчитать энергию многоэлектронного атома? В случае характеристического рентгеновского излучения целесообразно следующее приближенное вычисление.Характеристическое рентгеновское излучение возникает при заполнении вакансии во внутренней оболочке. Электроны внутренней оболочки находятся ближе к ядру, чем другие электроны в атоме, и, таким образом, испытывают небольшое общее влияние со стороны других. Это похоже на то, что происходит внутри заряженного проводника, где его избыточный заряд распределяется по поверхности так, что он не создает внутри электрического поля. Разумно предположить, что электроны внутренних оболочек имеют энергию, подобную водороду, как
En=Z2n2Eo(n=1,2,3,…)En=Z2n2Eo(n=1,2,3,…)22.19
Для вольфрама Z = 74, так что эффективный заряд равен 73.
Решение
Количество энергии, испускаемой в виде рентгеновского излучения, определяется с помощью
.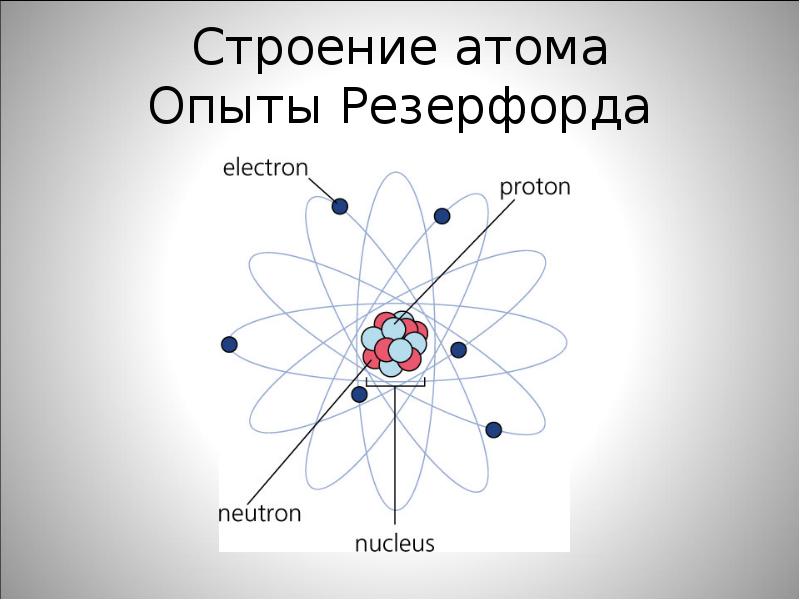 ΔE=hf=Ei−Ef, ΔE=hf=Ei−Ef,
ΔE=hf=Ei−Ef, ΔE=hf=Ei−Ef,22,20
где
Ef=-Z212Eo=-7321(13,6 эВ)=-72,5 кэVEf=-Z212Eo=-7321(13,6 эВ)=-72,5 кэВ22,21
и
Ei=-Z222Eo=-7324(13,6эВ)=-18,1кэВ.Ei=-Z222Eo=-7324(13,6эВ)=-18,1кэВ.22.22
Таким образом,
ΔE=Ei-Ef=(-18.1кэВ)-(-72,5кэВ)=54,4кэВ. ΔE=Ei-Ef=(-18,1кэВ)-(-72,5кэВ)=54,4кэВ.22.23
Обсуждение
Эта большая энергия фотона типична для характеристического рентгеновского излучения тяжелых элементов. Он велик по сравнению с другими атомными выбросами, потому что он возникает, когда вакансия внутренней оболочки заполнена, а электроны внутренней оболочки тесно связаны. Характеристические энергии рентгеновского излучения становятся все больше для более тяжелых элементов, потому что их энергия увеличивается примерно как Z 2 .Для создания таких вакансий во внутренней оболочке требуется значительное ускоряющее напряжение, потому что другие оболочки заполнены, и вы не можете просто перебросить один электрон на более заполненную оболочку.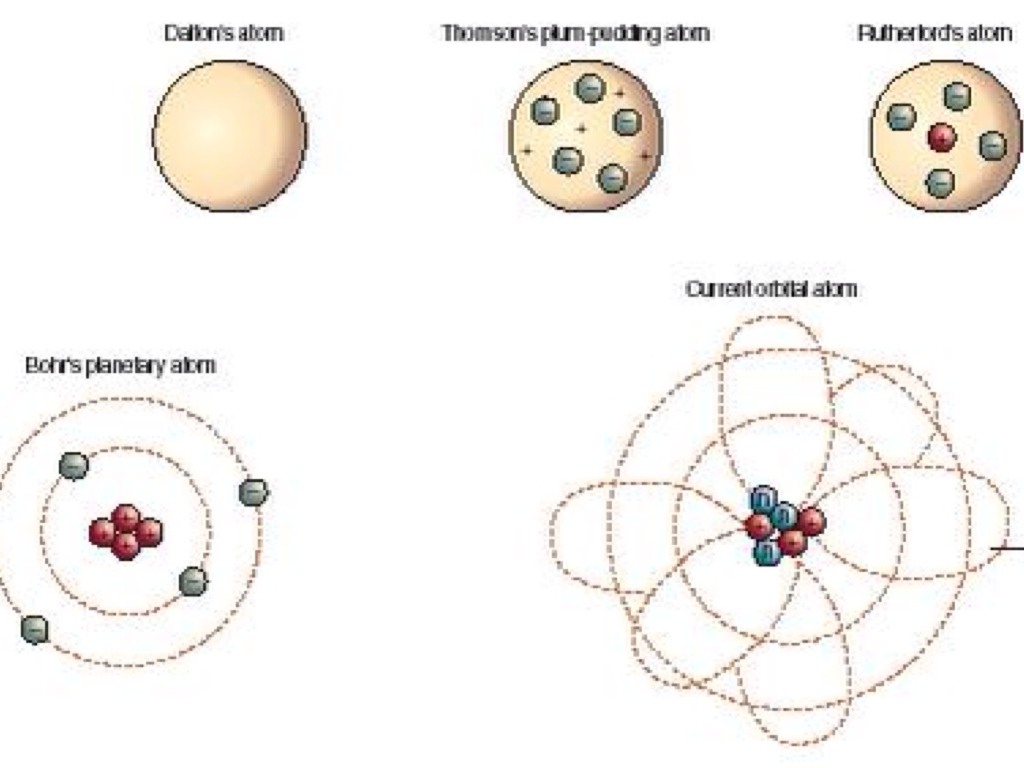 Вы должны полностью удалить его из атома. В случае с вольфрамом необходимо не менее 72,5 кВ. Вольфрам – обычный анодный материал в рентгеновских трубках; так много энергии сталкивающихся электронов поглощается, повышая его температуру, что требуется материал с высокой температурой плавления, такой как вольфрам.
Вы должны полностью удалить его из атома. В случае с вольфрамом необходимо не менее 72,5 кВ. Вольфрам – обычный анодный материал в рентгеновских трубках; так много энергии сталкивающихся электронов поглощается, повышая его температуру, что требуется материал с высокой температурой плавления, такой как вольфрам.
Поддержка учителей
Поддержка учителей
Как и в предыдущем разделе, следующий вывод может быть опущен для учащихся ниже уровня.Если оно опущено, учащиеся должны продолжить в уравнении 22.28.
Длина волны света, излучаемого атомом, также может быть определена с помощью основных производных. Рассмотрим энергию фотона, испускаемого атомом водорода при нисходящем переходе, определяемую уравнением
ΔE=hf=Ei-Ef ΔE=hf=Ei-Ef22,24
Подставляя En=(−13,6eVn2)En=(−13,6eVn2), получаем
hf=(13,6 эВ)(1nf2−1ni2).hf=(13,6 эВ)(1nf2−1ni2).22,25
Разделив обе части уравнения на hc , мы получим выражение для 1λ1λ,
hfhc=fc=1λ=13. 6eVhc(1nf2−1ni2).hfhc=fc=1λ=13,6eVhc(1nf2−1ni2).
6eVhc(1nf2−1ni2).hfhc=fc=1λ=13,6eVhc(1nf2−1ni2).22.26
Можно показать, что
(13,6 эВ·ч) = (13,6 эВ) (1,602 × 10–19 Дж/эВ) (6,602 × 10–34 Дж·с) (2,998 × 108 м/с) = 1,097 × 107 м–1 = R, (13,6 эВ·ч) = (13,6 эВ)(1,602×10-19Дж/эВ)(6,602×10-34Дж⋅с)(2,998×108м/с)=1,097×107м-1=R,22,27
, где R — постоянная Ридберга.
Упрощенная формула для определения длины волны излучения теперь может быть записана как
1λ=R(1nf2−1ni2).1λ=R(1nf2−1ni2).22,28
Рабочий пример
Какой длины волны света излучает электрон, переходящий с третьей орбитали в основное состояние атома водорода?
Стратегия
Основное состояние атома водорода считается первой орбиталью атома.В результате n f = 1 и n i = 3. Постоянная Ридберга уже определена и будет постоянной независимо от выбранного атома.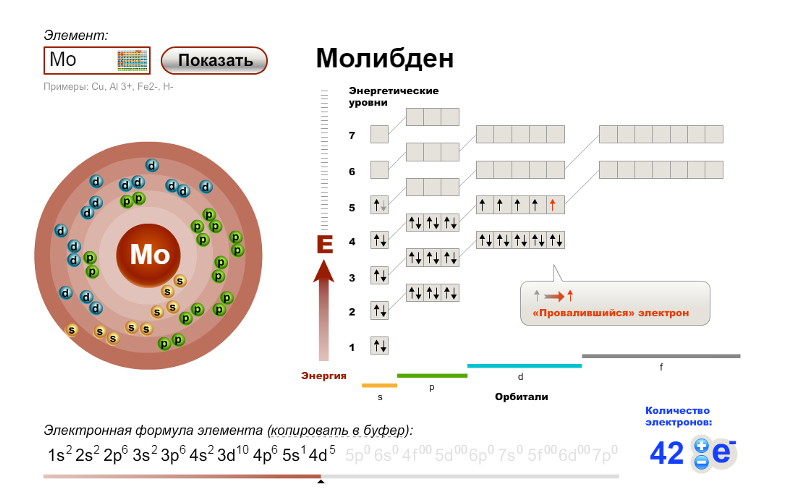
Решение
1λ=R(1nf2−1ni2)1λ=R(1nf2−1ni2)22,29
Для приведенного выше уравнения рассчитайте длину волны на основе известных энергетических состояний.
1λ=1,097×107(112−132)=9,751×106м−11λ=1,097×107(112−132)=9,751×106м−122,30
Преобразование уравнения для длины волны дает
λ=1.026×10-7м=102,6нм.λ=1,026×10-7м=102,6нм.22.31
Обсуждение
Эта длина волны соответствует свету в ультрафиолетовом спектре. В результате мы не смогли бы увидеть фотон света, испускаемый, когда электрон переходит из своего третьего в первое энергетическое состояние. Однако стоит отметить, что, подавая свет с длиной волны ровно 102,6 нм, мы можем заставить электрон в водороде перейти из его первого в третье орбитальное состояние.
Поддержка учителей
Поддержка учителей
Прежде чем двигаться дальше, повторите теорию Бора со студентами.
[BL][OL]Попросите учащихся описать, что квантуется и как квантовые орбитали соотносятся с длинами волн излучаемой энергии.
[AL] Предложите учащимся объяснить, как теория Бора подтверждается излучением абсолютно черного тела и фотоэлектрическим эффектом. Объясните, что фотоэлектрический эффект возникает, когда фотоны, ударяясь о поверхность солнечного элемента, создают электрический ток в элементе, и что фотоэлектрический эффект позволяет солнечному свету преобразовываться непосредственно в электричество. Посмотрите, смогут ли учащиеся глубже понять наблюдения, упомянутые в главе о квантовой природе света.
Ограничения теории Бора и квантовой модели атома
У теории Бора есть пределы. Он не учитывает взаимодействие связанных электронов, поэтому его нельзя полностью применить к многоэлектронным атомам, даже таким простым, как двухэлектронный атом гелия. Модель Бора — это то, что мы называем полуклассическим . Орбиты квантованы (неклассические), но предполагаются простыми круговыми траекториями (классические). По мере развития квантовой механики стало ясно, что четко определенных орбит не существует; скорее, есть облака вероятности.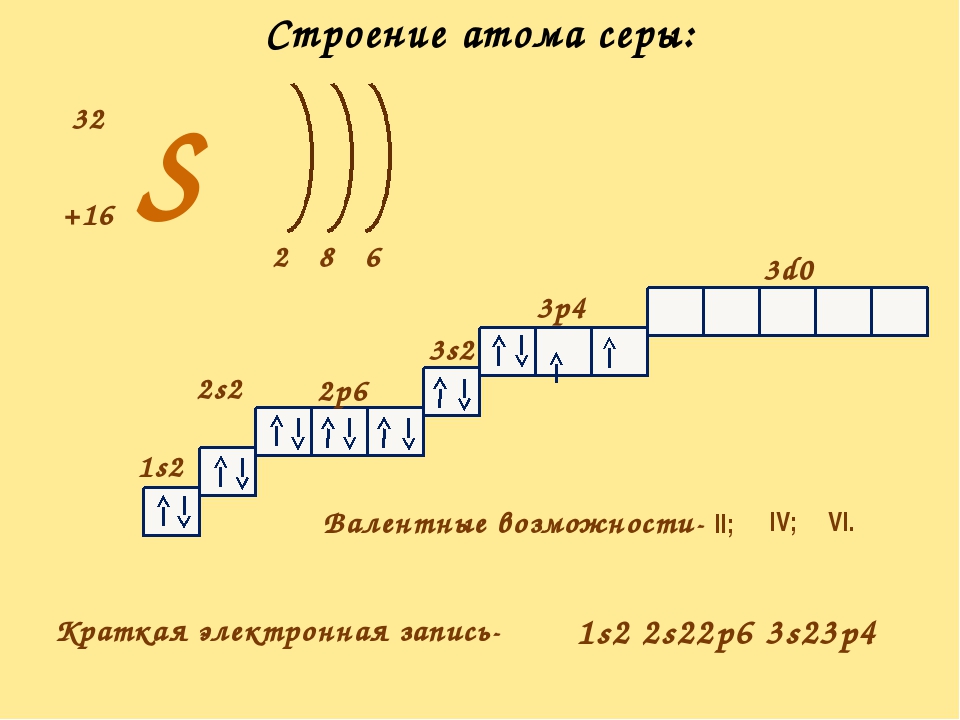 Кроме того, теория Бора не объясняла, что некоторые спектральные линии являются дублетами или расщепляются на две при внимательном рассмотрении. Хотя мы более подробно рассмотрим некоторые из этих аспектов квантовой механики, следует помнить, что Бор не ошибся. Скорее, он сделал очень важные шаги на пути к большему знанию и заложил основу всей атомной физики, которая с тех пор развивалась.
Кроме того, теория Бора не объясняла, что некоторые спектральные линии являются дублетами или расщепляются на две при внимательном рассмотрении. Хотя мы более подробно рассмотрим некоторые из этих аспектов квантовой механики, следует помнить, что Бор не ошибся. Скорее, он сделал очень важные шаги на пути к большему знанию и заложил основу всей атомной физики, которая с тех пор развивалась.
Волны ДеБройля
Служба поддержки учителей
Служба поддержки учителей
Если учащиеся давно не видели стоячую волну, покажите им стоячую волну с помощью обтягивающего или электрического осциллятора.Покажите, что стоячая волна может появиться только для определенных частот. Подобно гитарной струне, играющей только на определенной частоте при передергивании, электрон может вписаться в определенную орбиталь только при наличии соответствующего количества энергии.
После первоначальной работы Бора над атомом водорода прошло десятилетие, прежде чем Луи де Бройль предположил, что материя обладает волновыми свойствами. Волнообразные свойства вещества впоследствии были подтверждены наблюдениями интерференции электронов при рассеянии на кристаллах.Электроны могут существовать только в тех местах, где они конструктивно интерферируют. Как это влияет на электроны на атомных орбитах? Когда электрон связан с атомом, его длина волны должна умещаться в небольшом пространстве, что-то вроде стоячей волны на струне (см. рис. 22.12). Допускаются орбиты, на которых электрон может конструктивно интерферировать сам с собой. Все орбиты, на которых не может происходить конструктивная интерференция, не могут существовать. Таким образом, разрешены только определенные орбиты. Волновая природа электрона, согласно де Бройлю, является причиной квантования орбит!
Волнообразные свойства вещества впоследствии были подтверждены наблюдениями интерференции электронов при рассеянии на кристаллах.Электроны могут существовать только в тех местах, где они конструктивно интерферируют. Как это влияет на электроны на атомных орбитах? Когда электрон связан с атомом, его длина волны должна умещаться в небольшом пространстве, что-то вроде стоячей волны на струне (см. рис. 22.12). Допускаются орбиты, на которых электрон может конструктивно интерферировать сам с собой. Все орбиты, на которых не может происходить конструктивная интерференция, не могут существовать. Таким образом, разрешены только определенные орбиты. Волновая природа электрона, согласно де Бройлю, является причиной квантования орбит!
Рисунок 22.12 (a) Стоячие волны на струне имеют длину волны, связанную с длиной струны, что позволяет им конструктивно интерферировать. (б) Если мы представим струну, сформированную в виде замкнутого круга, мы получим приблизительное представление о том, как электроны на круговых орбитах могут конструктивно интерферировать. в) если длина волны не укладывается в длину окружности, электрон деструктивно интерферирует; он не может существовать на такой орбите.
в) если длина волны не укладывается в длину окружности, электрон деструктивно интерферирует; он не может существовать на такой орбите.
Для круговой орбиты конструктивная интерференция возникает, когда длина волны электрона точно совпадает с окружностью, так что гребни волн всегда совпадают с гребнями, а впадины волн — с впадинами, как показано на рисунке 22.12(б). Точнее, когда целое кратное длины волны электрона равно длине окружности орбиты, получается конструктивная интерференция. В форме уравнения условие конструктивной интерференции и разрешенной электронной орбиты равно
. nλn=2πrn(n=1,2,3,…),nλn=2πrn(n=1,2,3,…),22,32
, где λnλn — длина волны электрона, а r n — радиус этой круговой орбиты. На рис. 22.13 показаны третья и четвертая орбитали атома водорода.
Рис. 22.13 Третья и четвертая разрешенные круговые орбиты имеют по окружности три и четыре длины волны соответственно.
Неопределенность Гейзенберга
Как определение местоположения электрона меняет его траекторию? Ответ принципиально важен — измерение влияет на наблюдаемую систему. Невозможно точно измерить физическую величину, и большая точность измерения одной величины приводит к меньшей точности измерения связанной величины.Вернер Гейзенберг первым установил этот предел знания в 1929 г. в результате своей работы по квантовой механике и волновым характеристикам всех частиц (см. рис. 22.14).
Невозможно точно измерить физическую величину, и большая точность измерения одной величины приводит к меньшей точности измерения связанной величины.Вернер Гейзенберг первым установил этот предел знания в 1929 г. в результате своей работы по квантовой механике и волновым характеристикам всех частиц (см. рис. 22.14).
Рис. 22.14 Вернер Гейзенберг был физиком, разработавшим первую версию истинной квантовой механики. Его работа не только дала описание природы в очень мелком масштабе, но и изменила наш взгляд на доступность знания. Хотя он получил всеобщее признание за важность своей работы, получив, например, Нобелевскую премию в 1932 году, Гейзенберг оставался в Германии во время Второй мировой войны и возглавлял усилия Германии по созданию ядерной бомбы, навсегда отчуждая себя от большей части научного сообщества. .(кредит: Неизвестный автор, Wikimedia Commons)
Например, вы можете измерить положение движущегося электрона, рассеивая от него свет или другие электроны.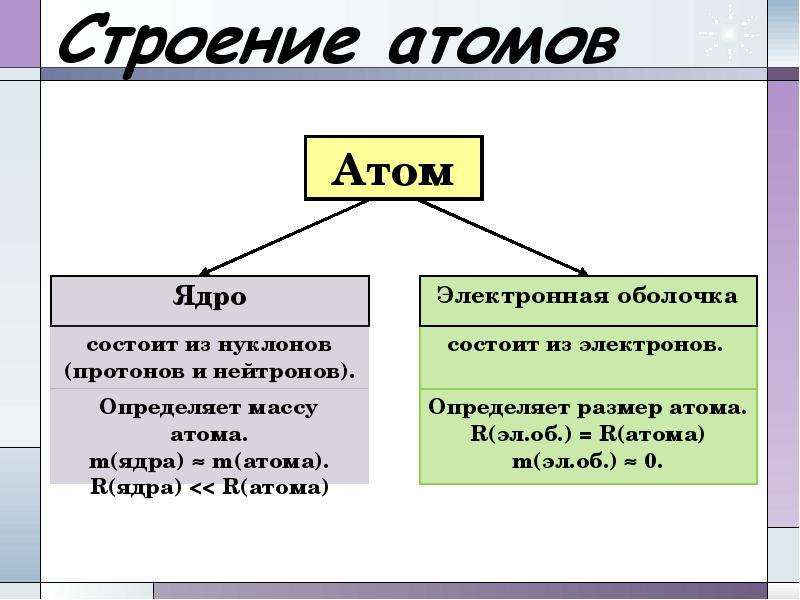 Однако, делая это, вы сообщаете электрону энергию и, следовательно, сообщаете ему импульс. В результате импульс электрона изменяется и не может быть точно определен. Это изменение импульса может быть где угодно от близкого к нулю вплоть до относительного импульса электрона (p≈h/λp≈h/λ). Обратите внимание, что в данном случае частицей является электрон, но принцип применим к любой частице.
Однако, делая это, вы сообщаете электрону энергию и, следовательно, сообщаете ему импульс. В результате импульс электрона изменяется и не может быть точно определен. Это изменение импульса может быть где угодно от близкого к нулю вплоть до относительного импульса электрона (p≈h/λp≈h/λ). Обратите внимание, что в данном случае частицей является электрон, но принцип применим к любой частице.
Рассматривая электрон через модель корпускулярно-волнового дуализма, Гейзенберг понял, что, поскольку волна не находится в одной фиксированной точке пространства, с положением любого электрона связана неопределенность. Эта неопределенность положения ΔxΔx , приблизительно равна длине волны частицы. То есть Δx≈λΔx≈λ. Существует интересный компромисс между позицией и импульсом. Неопределенность положения электрона можно уменьшить, используя более коротковолновый электрон, поскольку Δx≈λΔx≈λ.Но сокращение длины волны увеличивает неопределенность в импульсе, поскольку Δp≈h/λΔp≈h/λ. И наоборот, неопределенность импульса можно уменьшить, используя более длинноволновый электрон, но это увеличивает неопределенность положения. Математически вы можете выразить компромисс, умножив неопределенности. Длина волны отменяется, остается
И наоборот, неопределенность импульса можно уменьшить, используя более длинноволновый электрон, но это увеличивает неопределенность положения. Математически вы можете выразить компромисс, умножив неопределенности. Длина волны отменяется, остается
ΔxΔp≈h.ΔxΔp≈h.
Следовательно, если одна неопределенность уменьшается, другая должна увеличиваться, так что их произведение равно ≈h≈h . С помощью высшей математики Гейзенберг показал, что лучшее, что можно сделать при одновременном измерении положения и импульса, — это
. ΔxΔp≥h5π.ΔxΔp≥h5π.22,33
Это соотношение известно как принцип неопределенности Гейзенберга.
Служба поддержки учителей
Служба поддержки учителей
[BL][OL]Еще одна модель для объяснения принципа неопределенности для учащихся, которые борются с этой концепцией: представьте себе поиск плавающего воздушного шара в темной комнате. Когда ваша рука ударяет по шарику, вы создаете импульс и перемещаете его из исходного положения.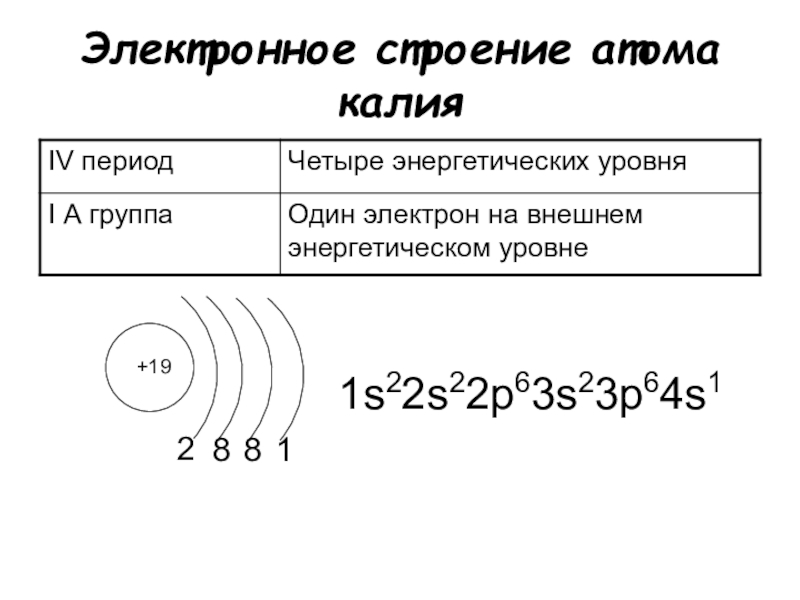 В то время как вы узнали положение объекта, вы потревожили его во время поиска.В результате у него появился новый импульс, который неизвестен!
В то время как вы узнали положение объекта, вы потревожили его во время поиска.В результате у него появился новый импульс, который неизвестен!
Квантовая модель атома
Из-за волновой характеристики материи идея четко определенных орбит уступает место модели, в которой существует облако вероятности, согласующееся с принципом неопределенности Гейзенберга. На рис. 22.15 показано, как этот принцип применяется к основному состоянию водорода. Если вы попытаетесь проследить за электроном по какой-то четко определенной орбите, используя зонд с достаточно малой длиной волны, чтобы точно измерить положение, вы вместо этого выбьете электрон с его орбиты.Каждое измерение положения электрона обнаружит, что он находится в определенном месте где-то рядом с ядром. Повторные измерения показывают облако вероятности, подобное показанному на рисунке, где местоположение каждой точки определяется одним измерением. Не существует четко определенного кругового орбитального типа распределения. Природа снова оказывается другой в малом масштабе, чем в макроскопическом.
Природа снова оказывается другой в малом масштабе, чем в макроскопическом.
Служба поддержки учителей
Служба поддержки учителей
[BL][OL]При просмотре Рис. 22.15, попросите учащихся объяснить, как изображение поддерживается принципом неопределенности Гейзенберга.
[AL] Попросите учащихся объяснить, как волны ДеБройля связаны с рис. 22.15. Как бы выглядело электронное облако, если бы на картинке был атом углерода?
Рис. 22.15. Основное состояние атома водорода имеет вероятностное облако, описывающее положение его электрона. Вероятность найти электрон пропорциональна темноте облака. Электрон может быть ближе или дальше боровского радиуса, но очень маловероятно, что он находится на большом расстоянии от ядра.
Виртуальная физика
Модели атома водорода
Как ученые выяснили структуру атомов, не глядя на них? Попробуйте разные модели, стреляя светом в атом. Используйте эту симуляцию, чтобы увидеть, как предсказание модели соответствует экспериментальным результатам.
Используйте эту симуляцию, чтобы увидеть, как предсказание модели соответствует экспериментальным результатам.
Проверьте свое понимание
1.Альфа-частицы заряжены положительно. Какое влияние оказал их заряд на эксперимент с золотой фольгой?
- Положительно заряженные альфа-частицы притягивались электростатической силой притяжения положительных ядер атомов золота.
- Положительно заряженные альфа-частицы рассеивались электростатической силой притяжения от положительных ядер атомов золота.
- Положительно заряженные альфа-частицы рассеивались электростатической силой отталкивания от положительных ядер атомов золота.
- Положительно заряженные альфа-частицы притягивались отталкивающей электростатической силой положительных ядер атомов золота.
Кластеры, состоящие из нескольких атомов, имеют тенденцию быть сферическими.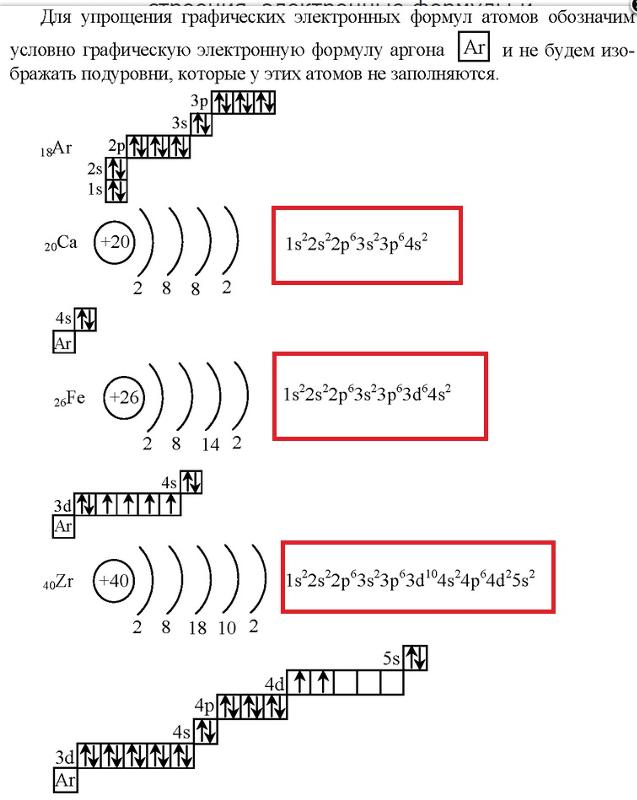 Обычно они организованы в виде атомных оболочек вокруг центрального атома. Это относится ко многим элементам, но не к золоту! Эксперименты и сложные расчеты показали, что отдельно стоящие кластеры из двадцати атомов золота принимают пирамидальную форму. У них есть треугольная основная плоскость, состоящая из десяти аккуратно расположенных атомов, с дополнительными треугольниками из шести и трех атомов, увенчанными одним атомом [см. рисунок, на котором модель из двадцати апельсинов сравнивается с теоретической и экспериментальной структурой].
Обычно они организованы в виде атомных оболочек вокруг центрального атома. Это относится ко многим элементам, но не к золоту! Эксперименты и сложные расчеты показали, что отдельно стоящие кластеры из двадцати атомов золота принимают пирамидальную форму. У них есть треугольная основная плоскость, состоящая из десяти аккуратно расположенных атомов, с дополнительными треугольниками из шести и трех атомов, увенчанными одним атомом [см. рисунок, на котором модель из двадцати апельсинов сравнивается с теоретической и экспериментальной структурой].
Замечательная тетраэдрическая структура впервые была получена с помощью сканирующего туннельного микроскопа. Этот высокотехнологичный микроскоп может визуализировать отдельные атомы. Он работает при экстремально низких температурах (269 градусов ниже нуля) и использует квантовое туннелирование электрического тока от острого сканирующего металлического наконечника через кластер в подложку. Квантовое туннелирование — это процесс, при котором электрический ток течет между двумя проводниками без какого-либо физического контакта между ними.
Модель из 20 апельсинов сравнивается с теоретической и экспериментальной структурой. Кредит: КУ Левен
Исследователи использовали интенсивную плазму в сложной установке вакуумной камеры для распыления атомов золота из макроскопического куска золота. «Часть распыленных атомов срастается в мелкие частицы от нескольких до нескольких десятков атомов благодаря процессу, сравнимому с конденсацией молекул воды в капли», — говорит Чжэ Ли, главный автор статьи, в настоящее время в Харбинский технологический институт, Шэньчжэнь.«Мы выбрали пучок кластеров, состоящий ровно из двадцати атомов золота. Мы посадили эти виды одной из треугольных граней на подложку, покрытую очень тонким слоем кухонной соли (NaCl) толщиной ровно в три атома».
Исследование также выявило своеобразную электронную структуру маленькой золотой пирамиды. Подобно атомам благородных газов или ароматическим молекулам, кластер имеет только полностью заполненные электронные орбитали, что делает их гораздо менее реакционноспособными, чем кластеры с одним или несколькими атомами больше или меньше.
Известно, что кластеры золота размером от нескольких до нескольких десятков атомов обладают замечательными свойствами.
Новое открытие помогает ученым оценить каталитические и оптические характеристики этих кластеров, что важно для разработки катализаторов на основе кластеров и оптических устройств. Недавние применения кластеров включают использование в топливных элементах и улавливание углерода.
Ссылка: «Раскрытие атомной структуры, поведения при созревании и электронной структуры поддерживаемых кластеров Au 20 », авторы Zhe Li1, Hsin-Yi Tiffany Chen, Koen Schouteden, Thomas Picot, Ting-Wei Liao, Александр Селиверстов, Крис Ван Хазендонк , Джанфранко Паччиони, Эвальд Янссенс и Питер Ливенс, 3 января 2020 г., Science Advance s.
DOI: 10.1126/sciadv.aay4289
Атомный Структура
A. Атомный номер равен электронам или протонам
Каждый элемент имеет атомный номер. Атомные номера указаны вместе с названиями и символами элементов на внутренней стороне обложки текста. Атомный номер равен заряду ядра. Следовательно, оно также равно числу протонов в ядре, а также численно равно числу электронов в нейтральном атоме.Атомный номер имеет символ Z.
Атомный номер равен заряду ядра. Следовательно, оно также равно числу протонов в ядре, а также численно равно числу электронов в нейтральном атоме.Атомный номер имеет символ Z.
Разные элементы имеют разные атомные номера; поэтому атомы разных элементов содержат разное количество протонов (и электронов). Кислород имеет атомный номер 8; его атомы содержат 8 протонов и 8 электронов. Уран имеет атомный номер 92; его атомы содержат 92 протона и 92 электрона.
Связь между атомным номером и количеством протонов или электронов можно сформулировать следующим образом:
| Атомный номер | = количество протонов на атом |
| = количество электронов на нейтральный атом |
Б.Массовое число равно протонам плюс нейтронам
Каждый атом также имеет массовое число, обозначаемое символом А. Массовое число атома равно количеству протонов плюс количество нейтронов, которые он содержит. Другими словами, количество нейтронов в любом атоме равно его массовому числу минус его атомный номер.
Массовое число атома равно количеству протонов плюс количество нейтронов, которые он содержит. Другими словами, количество нейтронов в любом атоме равно его массовому числу минус его атомный номер.
Количество нейтронов = массовое число – атомный номер
или
Массовое число = количество протонов + количество нейтронов
Атомный номер и массовое число атома элемента можно показать, написав перед символом элемента массовое число в виде верхнего индекса и атомный номер в виде нижнего индекса:
| массовый номер атомный номер | Символ элемента | или | А З | Х |
Например, атом золота (символ Au) с атомным номером 79 и массовым числом 196 обозначается как:
С.Изотопы
Хотя все атомы данного элемента должны иметь одинаковый атомный номер, не обязательно, чтобы все они имели одинаковое массовое число. Например, некоторые атомы углерода (атомный номер 6) имеют массовое число 12, другие имеют массовое число 13, а третьи имеют массовое число 14. Эти разные виды одного и того же элемента называются изотопами.
Изотопы — это атомы с одинаковым атомным номером (и, следовательно, из одного и того же элемента), но с разными массовыми числами.Состав атомов встречающихся в природе изотопов углерода показан в таблице 4.2.
Например, некоторые атомы углерода (атомный номер 6) имеют массовое число 12, другие имеют массовое число 13, а третьи имеют массовое число 14. Эти разные виды одного и того же элемента называются изотопами.
Изотопы — это атомы с одинаковым атомным номером (и, следовательно, из одного и того же элемента), но с разными массовыми числами.Состав атомов встречающихся в природе изотопов углерода показан в таблице 4.2.
| ТАБЛИЦА 4.2 Встречающиеся в природе изотопы углерода | |||
| Изотоп | Протоны | Электроны | Нейтроны |
|---|---|---|---|
| 6 | 6 | 6 | |
| 6 | 6 | 7 | |
| 6 | 6 | 8 | |
Различные изотопы элемента могут быть обозначены с помощью надстрочных и нижних индексов, чтобы показать массовое число и атомный номер. Их также можно идентифицировать по названию элемента с массовым числом конкретного изотопа. Например, в качестве альтернативы
Их также можно идентифицировать по названию элемента с массовым числом конкретного изотопа. Например, в качестве альтернативы
мы можем написать углерод-12, углерод-13 и углерод-14.
В природе на Земле встречается около 350 изотопов, еще 1500 были получены искусственно. Изотопы данного элемента отнюдь не одинаково распространены. Например, 98,89 % всего углерода, встречающегося в природе, — это углерод-12, 1,11 % — углерод-13, и лишь незначительное количество — углерод-14.Некоторые элементы имеют только один встречающийся в природе изотоп. В таблице 4.3 перечислены встречающиеся в природе изотопы нескольких распространенных элементов, а также их относительная распространенность.
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
D. Внутренняя структура атома
До сих пор мы обсуждали электроны, протоны и нейтроны и способы определения
сколько каждого конкретного атома содержит. Остается вопрос: эти
частицы, беспорядочно распределенные внутри атома, как черника в булочке,
или у атома есть какая-то организованная внутренняя структура? В начале
ХХ века ученые пытались ответить на этот вопрос. Различные теории
были предложены, но ни один из них не был проверен экспериментально. В нашем обсуждении
истории науки мы предположили, что на различных этапах ее развития
наука топталась на месте, пока кто-нибудь не провел ключевой эксперимент, который дал
новые идеи.В истории изучения атомов был поставлен ключевой эксперимент
в 1911 году Эрнестом Резерфордом и его коллегами.
Остается вопрос: эти
частицы, беспорядочно распределенные внутри атома, как черника в булочке,
или у атома есть какая-то организованная внутренняя структура? В начале
ХХ века ученые пытались ответить на этот вопрос. Различные теории
были предложены, но ни один из них не был проверен экспериментально. В нашем обсуждении
истории науки мы предположили, что на различных этапах ее развития
наука топталась на месте, пока кто-нибудь не провел ключевой эксперимент, который дал
новые идеи.В истории изучения атомов был поставлен ключевой эксперимент
в 1911 году Эрнестом Резерфордом и его коллегами.
1. Силы между телами
Наше понимание выводов, сделанных из эксперимента Резерфорда, зависит от знания сил, действующих между телами. Поэтому, прежде чем обсуждать его эксперимент, уместно сделать краткий обзор этих сил. Во-первых, это сила
сила тяжести, существующая между всеми телами. Его величина зависит от соответствующих масс и от расстояния между центрами тяжести двух взаимодействующих тел. Вы знакомы с гравитацией; он удерживает ваши ноги на земле, а луну на орбите.
Электрические силы также существуют между заряженными частицами. Величина электрической силы между двумя заряженными телами зависит от заряда каждого тела и от расстояния между их центрами. Если заряды одного знака (положительные или отрицательные), тела отталкиваются друг от друга; если заряды разного знака, то тела притягиваются друг к другу.
Магнитные силы, третий тип, аналогичны электрическим силам.Каждый магнит имеет два полюса – северный полюс и южный полюс. Когда два магнита соединяются вместе, между одноименными полюсами возникает сила отталкивания, а между разноименными полюсами — сила притяжения. В заряженном теле могут взаимодействовать магнитные и электрические силы. Эти три силы были известны в конце девятнадцатого века, когда интенсивно изучалась структура атома.
Вы знакомы с гравитацией; он удерживает ваши ноги на земле, а луну на орбите.
Электрические силы также существуют между заряженными частицами. Величина электрической силы между двумя заряженными телами зависит от заряда каждого тела и от расстояния между их центрами. Если заряды одного знака (положительные или отрицательные), тела отталкиваются друг от друга; если заряды разного знака, то тела притягиваются друг к другу.
Магнитные силы, третий тип, аналогичны электрическим силам.Каждый магнит имеет два полюса – северный полюс и южный полюс. Когда два магнита соединяются вместе, между одноименными полюсами возникает сила отталкивания, а между разноименными полюсами — сила притяжения. В заряженном теле могут взаимодействовать магнитные и электрические силы. Эти три силы были известны в конце девятнадцатого века, когда интенсивно изучалась структура атома.
2. Опыт Резерфорда
Опишем опыт Резерфорда.
В 1911 г. было общепризнано, что атом содержит электроны и протоны, но они, вероятно, не расположены по какому-либо определенному образцу. Резерфорд хотел установить, существует ли закономерность. Он надеялся получить эту информацию, изучая, как протоны в атоме отклоняют траекторию движения другой заряженной частицы, проходящей через атом. В качестве второй частицы он выбрал альфа
() частицы. Альфа-частица содержит два протона и два нейтрона, что придает ей относительную массу 4 а.е.м. и заряд +2. Альфа-частица настолько близка по массе и заряду к протону, что ее траектория изменилась бы, если бы она прошла рядом с протоном.В эксперименте пучок альфа-частиц направлялся на кусок золотой фольги, настолько тонкой, что становилась полупрозрачной, и, что более важно для Резерфорда, толщиной всего в несколько атомов. Фольга была окружена экраном из сульфида цинка, который вспыхивал каждый раз, когда в него попадала альфа-частица. Построив расположение вспышек, можно было бы определить, как путь альфа-частиц через атом был изменен протонами в атоме.
Три пути, показанные на рисунке 4.2 (пути A, B и C) являются репрезентативными для наблюдаемых.
Резерфорд хотел установить, существует ли закономерность. Он надеялся получить эту информацию, изучая, как протоны в атоме отклоняют траекторию движения другой заряженной частицы, проходящей через атом. В качестве второй частицы он выбрал альфа
() частицы. Альфа-частица содержит два протона и два нейтрона, что придает ей относительную массу 4 а.е.м. и заряд +2. Альфа-частица настолько близка по массе и заряду к протону, что ее траектория изменилась бы, если бы она прошла рядом с протоном.В эксперименте пучок альфа-частиц направлялся на кусок золотой фольги, настолько тонкой, что становилась полупрозрачной, и, что более важно для Резерфорда, толщиной всего в несколько атомов. Фольга была окружена экраном из сульфида цинка, который вспыхивал каждый раз, когда в него попадала альфа-частица. Построив расположение вспышек, можно было бы определить, как путь альфа-частиц через атом был изменен протонами в атоме.
Три пути, показанные на рисунке 4.2 (пути A, B и C) являются репрезентативными для наблюдаемых. Большинство альфа-частиц следовали по пути А; они прошли прямо сквозь фольгу, как будто ее и не было. Некоторые были слегка отклонены от своего первоначального пути, как на пути B; и еще меньшее число отскочило от фольги, как будто они ударились о твердую стену (путь C).
Большинство альфа-частиц следовали по пути А; они прошли прямо сквозь фольгу, как будто ее и не было. Некоторые были слегка отклонены от своего первоначального пути, как на пути B; и еще меньшее число отскочило от фольги, как будто они ударились о твердую стену (путь C).
| РИСУНОК 4.2 (a) Поперечное сечение аппарата Резерфорда. |
| РИСУНОК 4.2 (б) Увеличенное сечение золотой фольги в аппарате, показывающее отклонение альфа-частиц ядрами атомов золота. |
Хотя вы можете быть удивлены, что какие-либо альфа-частицы прошли через золотую фольгу, Резерфорд этого не сделал. Он ожидал, что многие пройдут прямо (путь А). Он также ожидал, что из-за наличия в атоме положительно заряженных протонов некоторые альфа-частицы будут следовать по слегка отклоненному пути (путь В).Тот факт, что некоторые альфа-частицы отскочили назад (путь С), поразил Резерфорда и его коллег.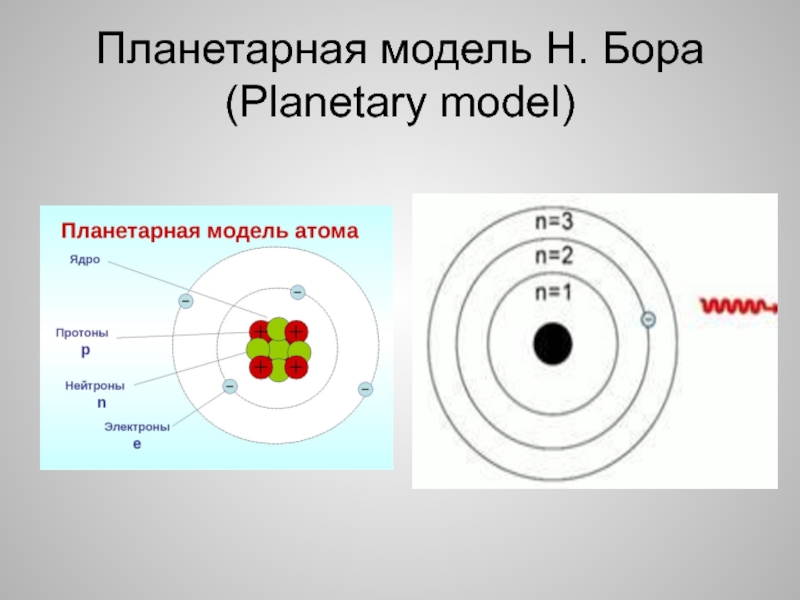 Путь C предполагал, что частицы врезались в область плотной массы и отскочили назад. Если использовать аналогию Резерфорда, возможность такого отскока была столь же маловероятной, как пушечное ядро, отскакивающее от куска папиросной бумаги.
Путь C предполагал, что частицы врезались в область плотной массы и отскочили назад. Если использовать аналогию Резерфорда, возможность такого отскока была столь же маловероятной, как пушечное ядро, отскакивающее от куска папиросной бумаги.
3. Результаты эксперимента
Тщательное рассмотрение результатов и особенно пути С убедило Резерфорда (и научное сообщество) в том, что атом содержит очень маленькое плотное ядро и большое количество внеядерного пространства.Согласно теории Резерфорда, ядро атома содержит всю массу атома и, следовательно, все протоны. Протоны придают ядру положительный заряд. Поскольку одноименные заряды отталкиваются друг от друга, положительно заряженные альфа-частицы, пролетая близко к ядру, отклоняются (путь В). Ядро, содержащее все протоны и нейтроны, массивнее альфа-частицы; следовательно, альфа-частица, ударившаяся в ядро атома золота, отскакивает от столкновения, как и те, что следовали по пути С.
Вне ядра, в относительно огромном внеядерном пространстве атома, находятся крошечные электроны. Поскольку электроны настолько малы по сравнению с занимаемым ими пространством, внеядерное пространство атома практически пусто. В эксперименте Резерфорда альфа-частицы, сталкиваясь с этой частью атомов в золотой фольге, проходили через фольгу неотклоняясь (путь А).
Поскольку электроны настолько малы по сравнению с занимаемым ими пространством, внеядерное пространство атома практически пусто. В эксперименте Резерфорда альфа-частицы, сталкиваясь с этой частью атомов в золотой фольге, проходили через фольгу неотклоняясь (путь А).
Если ядро содержит практически всю массу атома, оно должно быть чрезвычайно плотным.Его диаметр составляет около 10 -12 см, что составляет примерно 1/10 000 диаметра всего атома. Учитывая эту модель, если бы ядро было размером с мрамор, атом с его внеядерными электронами имел бы диаметр 300 мкм. Если бы шарик имел такую же плотность, как ядро атома, он весил бы 3,3 х 10 10 кг.
Эта модель ядра требует введения силы, отличной от тех, которые обсуждались ранее, силы, которая позволит протонам с их взаимно отталкивающими положительными зарядами плотно упаковываться в ядре, разделенные только незаряженными нейтронами.Эти ядерные силы, по-видимому, зависят от взаимодействия между протонами и нейтронами. Некоторые слабые, а некоторые очень сильные. Вместе они скрепляют ядро, но они еще не изучены.
Некоторые слабые, а некоторые очень сильные. Вместе они скрепляют ядро, но они еще не изучены.
Модель атома, основанная на работах Резерфорда, конечно, не более чем модель; мы не можем видеть эти субатомные частицы или их расположение внутри атома. Однако эта модель дает нам представление об атоме, которое совпадает с наблюдениями, сделанными в отношении его свойств.Теперь мы можем определить не только то, какие субатомные частицы содержит тот или иной атом, но и то, находятся ли они в его ядре. Например, атом углерода-12
содержит 6 протонов и 6 нейтронов в ядре и 6 электронов вне ядра.
У нас есть две отдельные части атома — ядро и внеядерное пространство. Ядро атома не играет никакой роли в химических реакциях, но участвует в радиоактивных реакциях.(Такие реакции обсуждаются далее в этой главе.) Химия атома зависит от его электронов — сколько их и как они расположены во внеядерном пространстве.
Назад Домой   Далее
.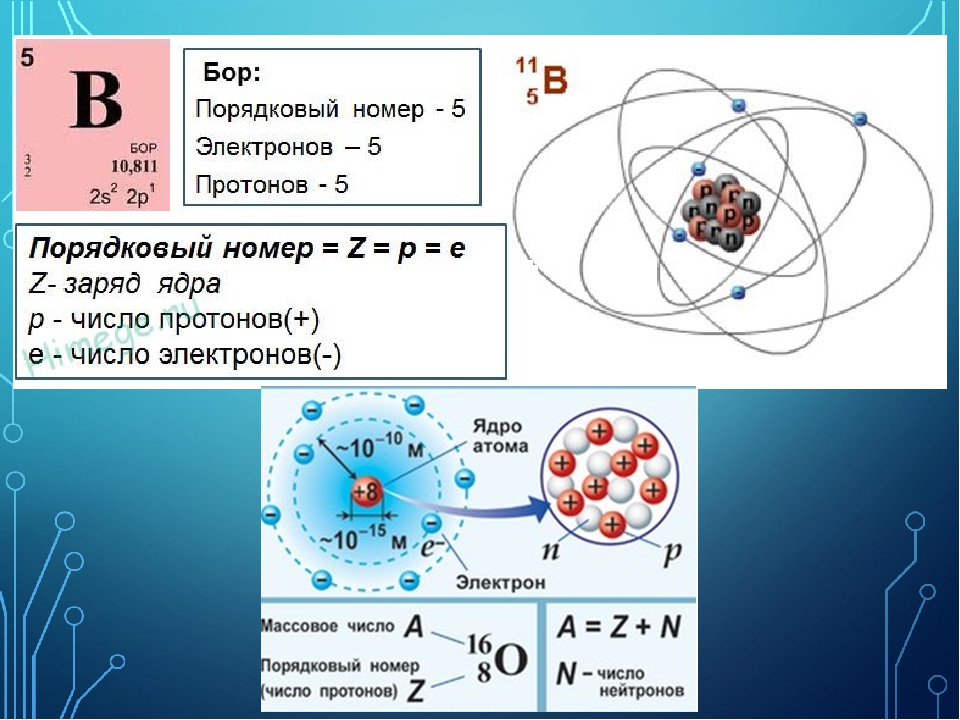

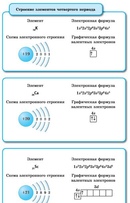 Удивительно было увидеть, насколько похожи микрокристаллы золота и многих других минералов из окисленных руд Олимпиадинского месторождения на новообразованные минералы других объектов. Такое внешнее сходство не всегда списывается на конвергенцию — механизмы формирования новых минералов в столь разных обстановках схожи, а изучение одних процессов в данном случае помогает понять все остальные»
Удивительно было увидеть, насколько похожи микрокристаллы золота и многих других минералов из окисленных руд Олимпиадинского месторождения на новообразованные минералы других объектов. Такое внешнее сходство не всегда списывается на конвергенцию — механизмы формирования новых минералов в столь разных обстановках схожи, а изучение одних процессов в данном случае помогает понять все остальные» Строение атома»
Строение атома»
 Рассказ учителя об
открытиях лучей Беккереля, электрона,
радиоактивности.
Рассказ учителя об
открытиях лучей Беккереля, электрона,
радиоактивности.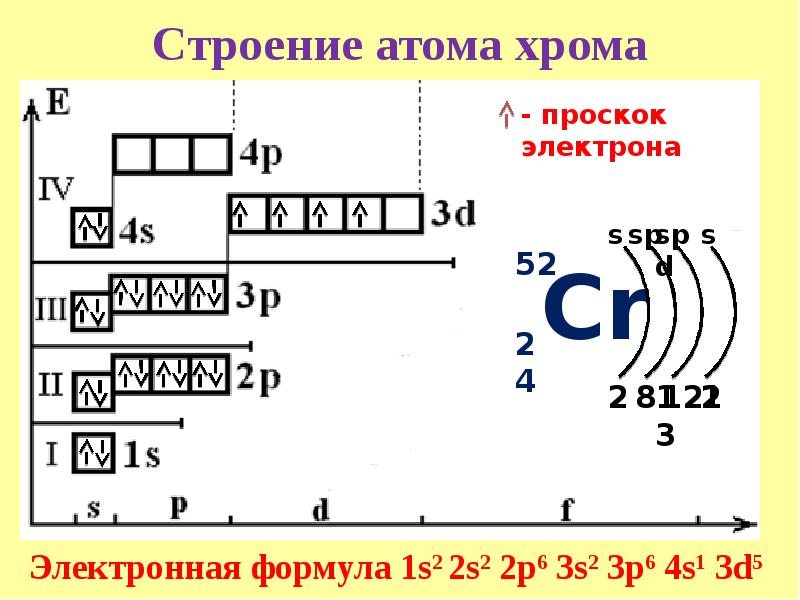 Обучающиеся
легко должны понять позицию учёных, так как они
уже знакомы с главой 7 “Электромагнитные волны”,
и знают условия их возникновения. Знают, что
электромагнитные волны переносят энергию.
Обучающиеся
легко должны понять позицию учёных, так как они
уже знакомы с главой 7 “Электромагнитные волны”,
и знают условия их возникновения. Знают, что
электромагнитные волны переносят энергию.  2000;
2000;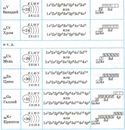 Учащийся знает простые примеры атомных, ядерных и квантовых явлений. Ожидается, что студент:
Учащийся знает простые примеры атомных, ядерных и квантовых явлений. Ожидается, что студент: Сосредоточение внимания на увеличении энергии за счет электрического поля поможет учащимся отделить эту концепцию от непрерывного энергетического спектра, создаваемого увеличением температуры излучающего черного тела.
Сосредоточение внимания на увеличении энергии за счет электрического поля поможет учащимся отделить эту концепцию от непрерывного энергетического спектра, создаваемого увеличением температуры излучающего черного тела.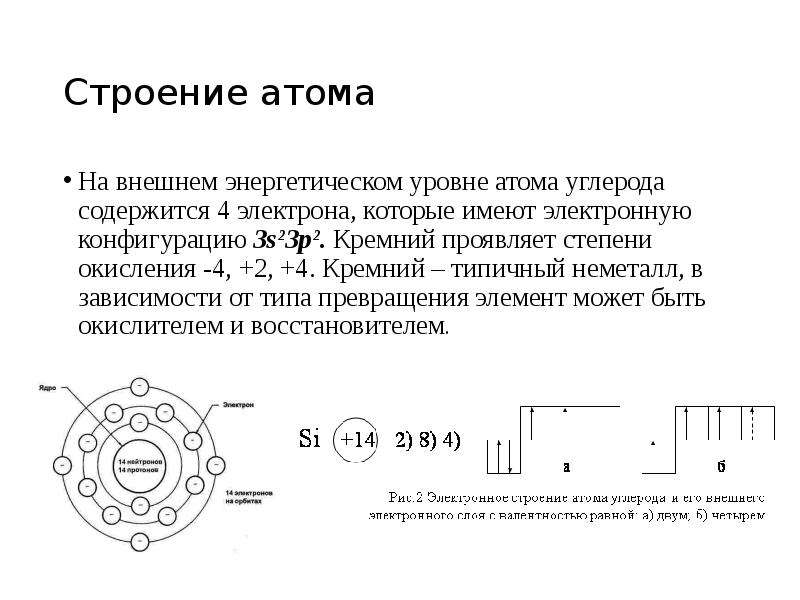 985
985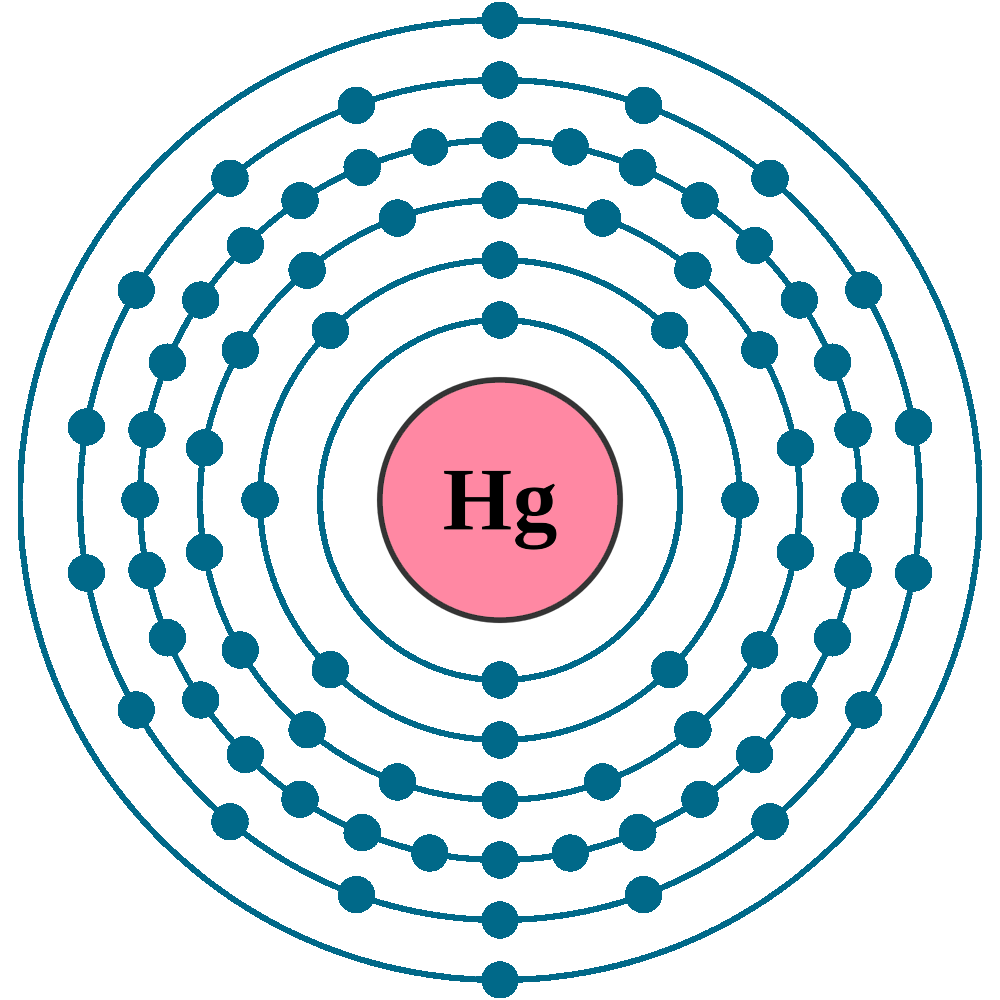 76
76 47
47