2. Электронное строение атомов элементов 1–3 периодов периодической системы
Атомы элементов первого периода устроены просто. У них один энергетический уровень, на котором находится только одна \(s\)-орбиталь.
В атоме водорода всего один неспаренный электрон.
В атоме гелия два \(s\)-электрона, они спарены, и больше нет места для электронов. Единственный энергетический уровень гелия завершён.
| H | 1s1 |
| He | 1s2 |
У элементов второго периода атомы устроены сложнее. В их электронных оболочках появляется второй энергетический уровень, на котором находятся четыре орбитали: одна \(s\)-орбиталь и три \(p\)-орбитали.
В атомах лития и бериллия электроны второго уровня расположены на \(s\)-орбитали, а \(p\)-орбитали свободны.
| Li | 1s22s1 |
| Be | 1s22s2 |
У бора, углерода и азота происходит заполнение свободных \(p\)-орбиталей. Электроны располагаются на этих орбиталях по одному.
Электроны располагаются на этих орбиталях по одному.
| B | 1s22s22p1 | ||||
| C | 1s22s22p2 | ||||
| N | 1s22s22p3 |
В атомах кислорода, фтора и неона продолжается заполнение \(p\)-орбиталей. В атоме неона второй энергетический уровень заполнен полностью, все электроны спарены.
| O | 1s22s22p4 |
| |||
F | 1s22s22p5 | ||||
| Ne | 1s22s22p6 |
У элементов третьего периода появляется третий уровень, на котором одна \(s\)-орбиталь, три \(p\)-орбитали и пять \(d\)-орбиталей. Заполнение этого уровня начинается у натрия.
Заполнение этого уровня начинается у натрия.
Na
| 1s22s22p63s1 |
Порядок размещения электронов на третьем уровне такой же, как и на втором.
Так, у фосфора строение внешнего уровня аналогично строению внешнего уровня азота: имеются два спаренных \(s\)-электрона и три неспаренных \(p\)-электрона.
P
| 1s22s22p63s23p3 |
Завершается заполнение \(p\)-орбиталей третьего уровня у аргона. \(d\)-орбитали остаются свободными. На них размещаются электроны у атомов элементов четвёртого периода.
Ar
| 1s22s22p63s23p6 |
Урока химии “Строение атома”
Урок №1 в теме “Атомы химических элементов”
Тема урока: “Строение атома”
Тип урока: урок ознакомления с новым
материалом.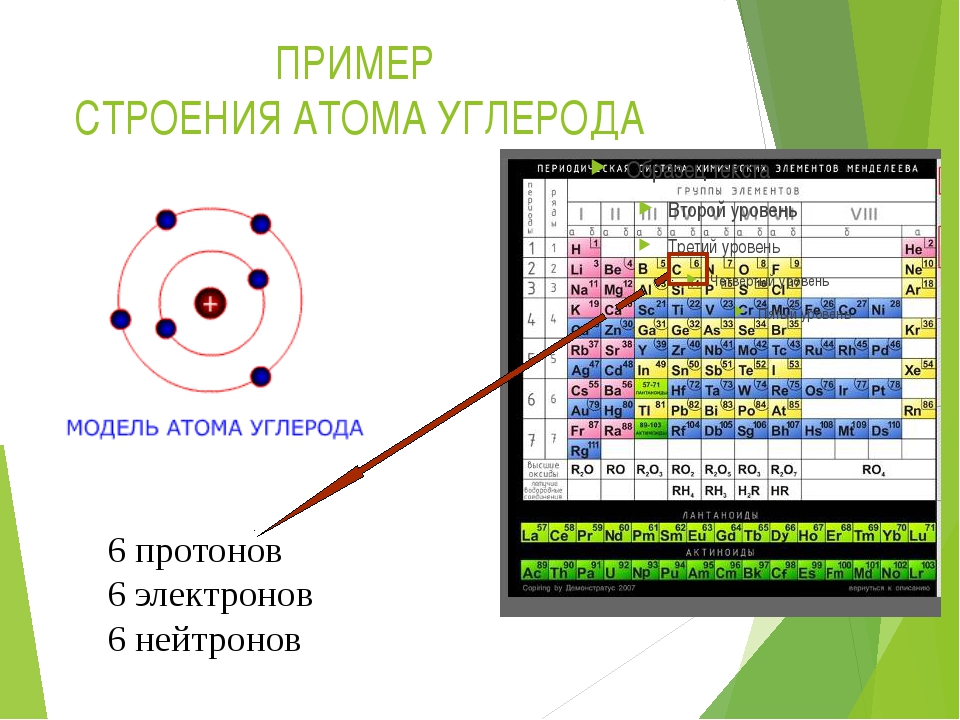
Цель: дать понятие о составе атома и составе атомного ядра; раскрыть взаимосвязь понятий: протон, нейтрон, массовое число, электрон.
Задачи:
- Обучающие: формирование целостности представления об атоме.
- Развивающие: способствовать развитию знаний об атоме, пробудить у учащихся интерес к изучению предпосылок открытия конкретных явлений; продолжить развитие мышления, умение анализировать, сравнивать, делать логические выводы.
- Воспитательные: развитие навыков коллективной работы; развитие навыков культуры общения, толерантного отношения друг к другу; умение излагать свою точку зрения и отстаивать свою правоту.
Планируемые результаты обучения:
- Новые знания: понятия – ядро, протон, нейтрон, электрон.
- Обобщение представлений об атоме.

- Умение определять количество р+ , no, е– .
- Развитие навыков: работы с инструментами, самостоятельное принятие решений, коммуникативные умения и навыки, умение самостоятельной мыслительной деятельности.
- Развитие навыка самоконтроля.
- Расширение кругозора.
Ход урока
Здравствуйте, ребята!
Сегодня мы начинаем изучать новую тему “Атомы химических элементов”. На изучение этой темы отводится 7 часов. Сегодня мы познакомимся со строением атома, а на следующих уроках вы будете знакомиться со строением электронных орбиталей, ионами, видами химической связи. Напишите 2 тематических учета знаний и 1 контрольную работу.
А сейчас мы отправимся в дальнейшее
путешествие по удивительной стране “Химия”.
План нашего урока перед вами.
Откройте тетради, запишите число, тему урока: “Строение атома”. И так, мы начинаем.
ВИДЕО
(После просмотра) Давайте хором назовем химические элементы.
СЛАЙД № 1
Вы знаете, что вещества состоят из молекул, а
молекулы из атомов. Ребята, атом тоже имеет
сложное строение. Об этом говорят многочисленные
опыты, с которыми вы будете знакомиться на уроках
физики и при дальнейшем изучении химии. Атом
имеет ядро и электроны, которые движутся вокруг
ядра. Если применить образное сравнение, то весь
объем атома можно уподобить стадиону в Лужниках,
а ядро – футбольному мячу, положенному в центр
поля.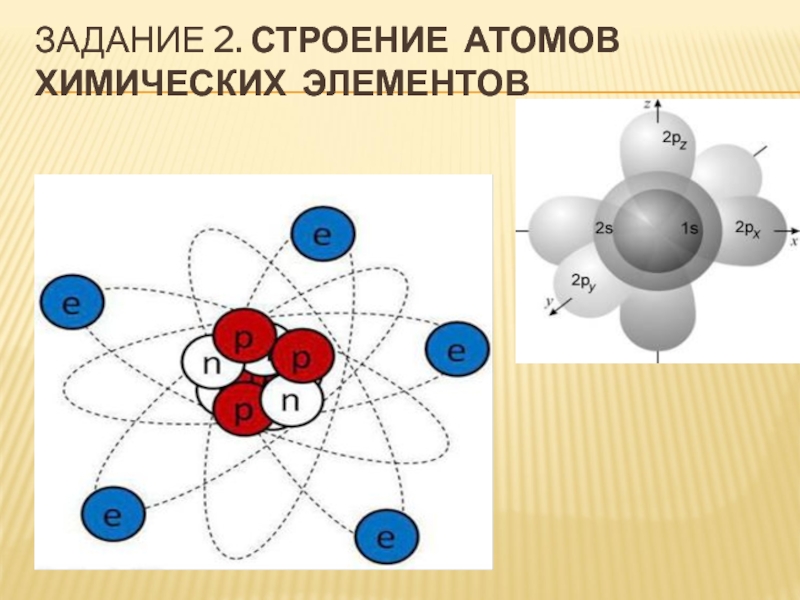
СХЕМА № 1 Возьми на своих столах схему № 1.
Рассмотрите ее внимательно: атом состоит из ядра и электронной оболочки, которая состоит из электронов. В центре атома находится ядро. Ядро состоит из протонов и нейтронов, которые называются нуклонами.
СЛАЙД № 2 Задание – заполнить пропуски в тексте, используя данные слова.
“В центре атома находится ядро, которое состоит из протонов и нейтронов. Вокруг ядра с большой скоростью движутся электроны”.
Повернитесь друг к другу в полоборота, сядьте ровно. Сейчас вы работаете в парах и друг другу проговорите еще раз шепотом
 1).
1).Познакомимся с основными характеристиками элементарных частиц. Заполним вместе таблицу.
| Масса | Заряд | |
| Протон р+ | 1 | +1 |
| 1 | 0 | |
| Электрон е– | 0 | -1 |
СЛАЙД № 3
- Посмотрим в схему 1. Какие частицы находятся в ядре?
- Какие из них имеют заряд?
- А ядро будет иметь заряд?
- За счет каких частиц?
- Атом имеет массу?
- За счет каких частиц?
- Электроны вносят вклад в массу атома?
- Значит в какой части атома сосредоточена его масса?
Мы знакомы с ПСХЭ.
СЛАЙД № 4 Химический элемент представляет собой совокупность атомов, имеющих одинаковый атомный номер.
Запишем в тетрадь: Число протонов в ядре атома соответствует его атомному номеру и обозначается символом Z.
Работа по закреплению у ПСХЭ.
Гимнастика для глаз
Познакомимся с атомным номером. Возьмите в руки ПСХЭ Д.И.Менделеева. Вам необходимо определить атомный номер элемента и число протонов для следующих элементов
Мы узнали, что число протонов определяется по порядковому номеру элемента.
СЛАЙД № 5 Сейчас наша задача научиться определять число нейтронов. Т.к. вся масса атома сосредоточена в ядре, то число нейтронов можно определить по следующей формуле:
Запишите в тетрадь атомный номер и массовое число следующих элементов:
Фосфора и кислорода.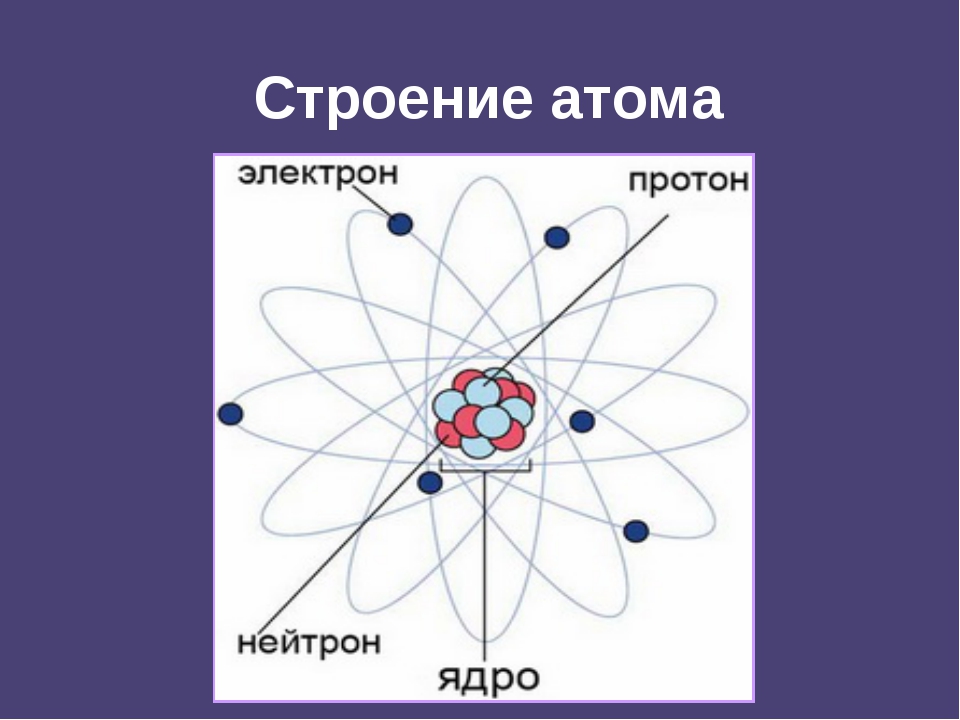
Обратная сторона доски: Проверьте.
СЛАЙД № 6 Кол-во нейтронов вычисляется по формуле: N=A-Z.
Например: ядро атома магния содержит 12 нейтронов. 24 – 12 = 12.
Гимнастика для глаз: Возьмите в руки ПСХЭ Д.И.Менделеева на расстоянии вытянутой руки. Молча определите кол-во протонов и нейтронов для атомов: С, Si.
Обратная сторона доски: Проверьте. Правильно? Запишите это в тетрадь.
Учимся определять число электронов. Число электронов определяется по порядковому номеру. Допишите в тетради число электронов у С и Si.
Ребята, кто был из вас внимателен в начале урока? Скажите мне, с какими новыми понятиями вы сегодня познакомились? ………….
У нас с вами творческая работа. Работать вы
будете в группах по 4 человека. Вам предстоит
создать модель атома гелия. Посмотрите
внимательно, как может выглядеть атом. Для работы
используйте наборы, которые лежат на столах. На
выполнение работы вам дается 4 минуты. И так,
время пошло. Кто первый завершит конструирование
своей модели атома гелия, тот вывешивает свою
работу на доску.
Для работы
используйте наборы, которые лежат на столах. На
выполнение работы вам дается 4 минуты. И так,
время пошло. Кто первый завершит конструирование
своей модели атома гелия, тот вывешивает свою
работу на доску.
Давайте посмотрим ваши работы. Выбрать правильную. Расскажите как вы выполняли. Молодцы.
Сейчас посмотрите в свои тетрадочки с самого начала урока. Вспомните то, что мы сегодня записали. Подошло время
СЛАЙД № 7 Время на выполнение работы – 3 минуты. Самопроверка по образцу.
Встаньте те, кто не допустил ни одной ошибки. Продолжайте стоять. Встаньте те, кто допустил 1 ошибку. Похлопаем. Молодцы. Садитесь.
Самой распространенной ошибкой в этой работе было нахождение числа нейтронов. Еще раз, скажите мне, как мы находим кол-во нейтронов?
Домашнее задание.
Ребята, что же мы с вами узнали на сегодняшнем уроке?
Чему научились? Обратитесь к схеме 1 (строение атома). Сделать вывод.
Оценка работы учащихся на уроке.
Презентация
Строение атома и периодическая система элементов Менделеева
Менделеев, показав химическую частицу (атом), обладающей валентностью, как единство противоположностей, более глубоко раскрыл сущность строения веществ, состоящих из этих частиц. Оказалось, что в зависимости от условий элемент не только обладает различной валентностью, но что последняя, как и многие другие химические свойства атомов, подчиняется периодическому закону, т. е. изменение валентности происходит не случайно, а связано с положением элемента в периодической системе. [c.256]Периодический закон был гениальным обобщением всего накопленного в химии материала.
 Химия превратилась из сборища разрозненных рецептурных данных в единую научную систему. Периодическая система побуждала к заключению о генетическом единстве элементов, ставила вопрос о едином принципе строения атомов и, следовательно, о делимости самого атома. Однако этой мысли Менделеев не разде тял. В его время еще безраздельно господствовало представление, что атом неделим, хотя уж давно раздавались отдельные голоса о сложности атомной структуры химических элементов. Эту идею защищал еще в 1811 году известный химик П р о у т. Твердое убеждение о делимости атома высказывал выдающийся русский химик А. М. Бутлеров (1886 г.). Однако в те времена не было никаких фактов, которые подтверждали бы эту мысль. И только к концу XIX века были получены данные о сложном строении атома. [c.37]
Химия превратилась из сборища разрозненных рецептурных данных в единую научную систему. Периодическая система побуждала к заключению о генетическом единстве элементов, ставила вопрос о едином принципе строения атомов и, следовательно, о делимости самого атома. Однако этой мысли Менделеев не разде тял. В его время еще безраздельно господствовало представление, что атом неделим, хотя уж давно раздавались отдельные голоса о сложности атомной структуры химических элементов. Эту идею защищал еще в 1811 году известный химик П р о у т. Твердое убеждение о делимости атома высказывал выдающийся русский химик А. М. Бутлеров (1886 г.). Однако в те времена не было никаких фактов, которые подтверждали бы эту мысль. И только к концу XIX века были получены данные о сложном строении атома. [c.37] ГАФНИЙ (Hafnium, от древнего названия Копенгагена) Hf — химический элемент IV группы 6-го периода периодической системы элементов Д. И. Менделеева, п. н. 72, ат. м. 178,49 природный Г. состоит из шести изотопов. Положение Г. в периодической системе предсказал Д. И. Менделеев задолго до его открытия. Основываясь на выводах Н, Бора о строении атома 72-го элемента, Д. Костер и Г. Хевеши обнаружили этот элемент в минералах циркония и назвали его. Г.— рассеянный элемент, не имеет собственных минералов, в природе сопутствует цирконию (I — 7%). Г.— серебристо-белый металл, т. нл. 2222 30 С чистый Г. очень пластичен и ковок, легко поддается холодной и горячей обработке. По своим химическим свойствам очень близок к цирконию, потому их трудно разделить. В соединениях Г. четырехвалентен. Металлический Г. легко поглощает газы. На воздухе Г. покрывается тонкой пленкой оксида HfOj. При нагревании реагирует с галогенами, а при высоких температурах — с азотом и углеродом, [c.65]
Положение Г. в периодической системе предсказал Д. И. Менделеев задолго до его открытия. Основываясь на выводах Н, Бора о строении атома 72-го элемента, Д. Костер и Г. Хевеши обнаружили этот элемент в минералах циркония и назвали его. Г.— рассеянный элемент, не имеет собственных минералов, в природе сопутствует цирконию (I — 7%). Г.— серебристо-белый металл, т. нл. 2222 30 С чистый Г. очень пластичен и ковок, легко поддается холодной и горячей обработке. По своим химическим свойствам очень близок к цирконию, потому их трудно разделить. В соединениях Г. четырехвалентен. Металлический Г. легко поглощает газы. На воздухе Г. покрывается тонкой пленкой оксида HfOj. При нагревании реагирует с галогенами, а при высоких температурах — с азотом и углеродом, [c.65]
Закон, на котором основана периодическая система элементов (Д.Я. Менделеев, 1869 г.) периодическое изменение строения атом ной оболочки элементов определяет периодичность изменения свойств элементов. [c. 41]
41]
Но уже в XIX в. многие крупнейшие ученые придерживались мнения о сложности структуры атомов. Созданная Менделеевым периодическая система давала хотя и косвенное, но убедительное указание на сложность строения атомов, на наличие внутри них таких структурных особенностей, которые периодически повторяются в рядах элементов. Менделеев прямо говорит о том, что атомы простых тел суть сложные вещества, образованные сложением некоторых, еще меньших частей, что называемое нами неделимым (атом) неделимо только обычными химическими силами . [c.36]
Строение атомов | Параграф 8. (8)
“Химия. 8 класс”. О.С. Габриелян
Вопрос 1 (1).
а) — схема строения атома алюминия; б) — схема строения атома фосфора; в) — схема строения атома кислорода.
Вопрос 2 (2).
а) сравним строение атомов азота и фосфора.
Строение электронной оболочки этих атомов схоже, оба на последнем энергетическом уровне содержат по 5 электронов. Однако у азота всего 2 энергетических уровня, а у фосфора – 3.
Однако у азота всего 2 энергетических уровня, а у фосфора – 3.
б) Сравним строение атомов фосфора и серы.
Атомы фосфора и серы имеют по 3 энергетических уровня, причем у каждого последний уровень незавершенный, но у фосфора на последнем энергетическом уровне 5 электронов, а у серы 6.
Вопрос 3 (3).
Атом кремния содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов равно порядковому номеру элемента. Число энергетических уровней определяется номером периода и равно 3. Число внешних электронов определяется номером группы и равно 4.
Вопрос 4 (4).
Количество содержащихся в периоде элементов равно максимально возможному числу электронов на внешнем энергетическом уровне и это число определяется по формуле 2n2, где n — номер периода. Поэтому в первом периоде содержится только 2 элемента (2 . 12 = 2), а во втором периоде 8 элементов (2 .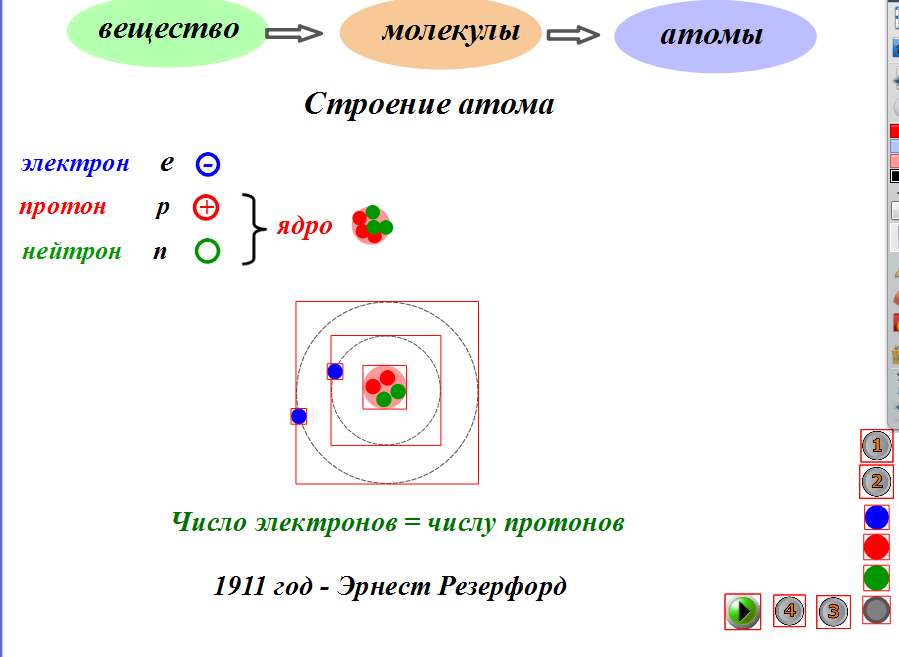 22 = 8).
22 = 8).
Вопрос 5 (5).
В астрономии — Период вращения Земли вокруг своей оси 24 часа.
В географии — Смена сезонов с периодом 1 год, а также морские приливы и отливы.
В физике — Периодические колебания маятника, движение поршня в двигателе внутреннего сгорания.
В биологии — Деление клеток микроорганизмов при оптимальных условиях через каждые 20 мин.
Вопрос 6 (6).
Электроны и строение атома были открыты в начале ХХ века, чуть позже было написано это стихотворение, которое отражает во многом нуклеарную, или планетарную, теорию строения атома, а также В. Брюсов допускает возможность, что и электроны тоже сложные частицы, строение которых учёные ещё не изучили.
Вопрос 7 (7).
Приведенные в учебнике выше поэтические строки говорят о большом поэтическом таланте В. Брюсова и гибком уме его, раз он мог так легко понять и принять все достижения современной ему науки. Эти два четверостишия показывают просвещенность и образованность поэта в данной области.
Эти два четверостишия показывают просвещенность и образованность поэта в данной области.
Урок 26. строение атома. состав атомных ядер. изотопы – Химия – 8 класс
Строение атома. Состав атомных ядер. Изотопы
К девяностым годам XIX века периодический закон Д. И. Менделеева приобрёл всеобщее научное признание. Созданная периодическая система устанавливала связи между элементами и позволяла предсказывать ещё неоткрытые химические элементы, но не могла объяснить, почему свойства элементов изменяются. Сам Менделеев писал: «Легко предположить, но ныне пока нет ещё возможности доказать, что атомы простых тел суть сложные существа, образованные сложением некоторых ещё меньших частей, что назы-ваемое нами неделимым – неделим только химическими силами, как частицы неделимы в обычных условиях физическими силами… Выставленная мною периодическая зависи-мость между свойствами и весом, по-видимому, подтверждает такое предчувствие».
Предчувствие Менделеева подтвердилось уже на рубеже XIX и XX веков.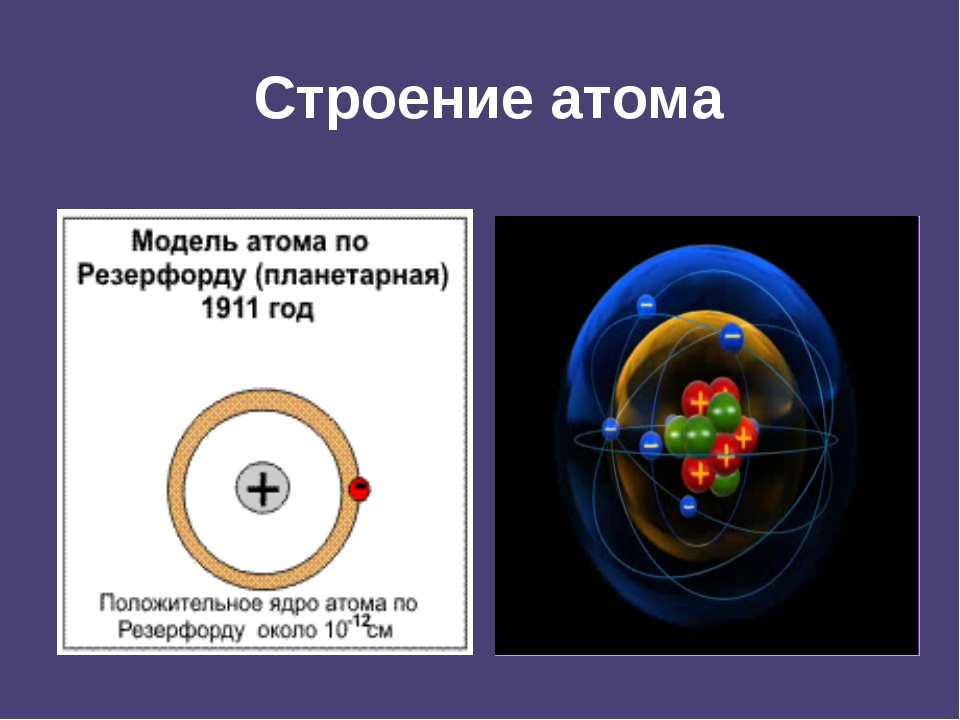 Открытие радиоактивности Анри Беккерелем и получение радиоактивных химических элемен-тов супругами Кюри показали способность атома к распаду. Джон Джозеф Томпсон открывает электрон – отрицательно заряженную частицу и предлагает модель атома. Эрнест Резерфорд доказывает существование положительного атомного ядра и предлагает планетарную модель атома. Позднее было установлено, что ядра атомов состоят из протонов и нейтронов. Работы Нильса Бора дополнили планетарную модель.
Открытие радиоактивности Анри Беккерелем и получение радиоактивных химических элемен-тов супругами Кюри показали способность атома к распаду. Джон Джозеф Томпсон открывает электрон – отрицательно заряженную частицу и предлагает модель атома. Эрнест Резерфорд доказывает существование положительного атомного ядра и предлагает планетарную модель атома. Позднее было установлено, что ядра атомов состоят из протонов и нейтронов. Работы Нильса Бора дополнили планетарную модель.
Сегодня мы можем сказать, что атом состоит из ядра и электронной оболочки. В ядре находятся нуклоны – протоны и электроны. Заряд ядра атома определяется числом протонов и совпадает с порядковым номером химического элемента в периодической системе. Заряд ядра атома определяет принадлежность атома к химическому элементу. Атом – электронейтральная частица. Нейтрон и протон имеют приблизительно одинаковую относительную массу, равную 1. Суммарная масса протонов и нейтронов в ядре – это массовое число (A). n0 = A – p+. Состав атома принято указывать с использованием специальной формы записи, где m – массовое число, p – заряд ядра атома, а Э – химический знак элемента
Состав атома принято указывать с использованием специальной формы записи, где m – массовое число, p – заряд ядра атома, а Э – химический знак элемента
Например, массовое число атома водорода равно единице, заряд ядра атома равен плюс одному
Но существуют другие атомы водорода: дейтерий – тяжелый водород с массовым числом 2 и зарядом ядра плюс один , и сверхтяжёлый – тритий . Все эти разновид-ности являются атомами одного химического элемента – водорода. Они называются изо-топы.
Изотопы – это разновидности атомов одного и того же химического элемента, имеющие одинаковое количество протонов, но разное число нейтронов в ядре.
Изотопы химических элементов применяются в разных областях человеческой деятельности.
СТРОЕНИЕ АтОмА реферат по химии
Министерство общего и профессионального образования
Российской Федерации
Управление Образования Администрации Аксайского района Вечерняя общеобразовательная школа РЕФЕРАГ н на тему «СТРОЕНИЕАТОМА» н сн
нс м: нс сн “7. 7 Выполнила: |Попова Ольга Сергеевна Проверила:
Аксай 2007 г. Содержание: Введение………………………………………………………….. стр. 3 Основные законы и понятия химии ……………………………. стр. 4 Ядерная модель строения атома………………………………… стр. 8 Атом Резерфорда…………………………………………………. стр. 8 Модель атома Бор-Резерфорд……………………………………. стр. 10 Модель кристалла………………………………………………. стр.11 Характеристика поведения электронов в атомах………………. стр. 14 Представление о содержащихся в веществах электрических частицах…………………………………………………………… стр. 15 Свойства электрона………………………………………………. стр. 16 Общие принципы заполнения электронных оболочек атомов элементов по периодам…………………………………………… стр. 16 Ядра атомов……………………………………………………… стр. 17 Протон и нейтрон………………………………………………… стр. 18 Строение атомных ядер…………………………………………. стр. 18 Атомная орбиталь………………………………………………… стр. 18 Заключение……………………………………………………….. стр. 18 Список использованной литературы……………………………. стр. 20 Основные законы и понятия химии. Закон сохранения массы.
7 Выполнила: |Попова Ольга Сергеевна Проверила:
Аксай 2007 г. Содержание: Введение………………………………………………………….. стр. 3 Основные законы и понятия химии ……………………………. стр. 4 Ядерная модель строения атома………………………………… стр. 8 Атом Резерфорда…………………………………………………. стр. 8 Модель атома Бор-Резерфорд……………………………………. стр. 10 Модель кристалла………………………………………………. стр.11 Характеристика поведения электронов в атомах………………. стр. 14 Представление о содержащихся в веществах электрических частицах…………………………………………………………… стр. 15 Свойства электрона………………………………………………. стр. 16 Общие принципы заполнения электронных оболочек атомов элементов по периодам…………………………………………… стр. 16 Ядра атомов……………………………………………………… стр. 17 Протон и нейтрон………………………………………………… стр. 18 Строение атомных ядер…………………………………………. стр. 18 Атомная орбиталь………………………………………………… стр. 18 Заключение……………………………………………………….. стр. 18 Список использованной литературы……………………………. стр. 20 Основные законы и понятия химии. Закон сохранения массы.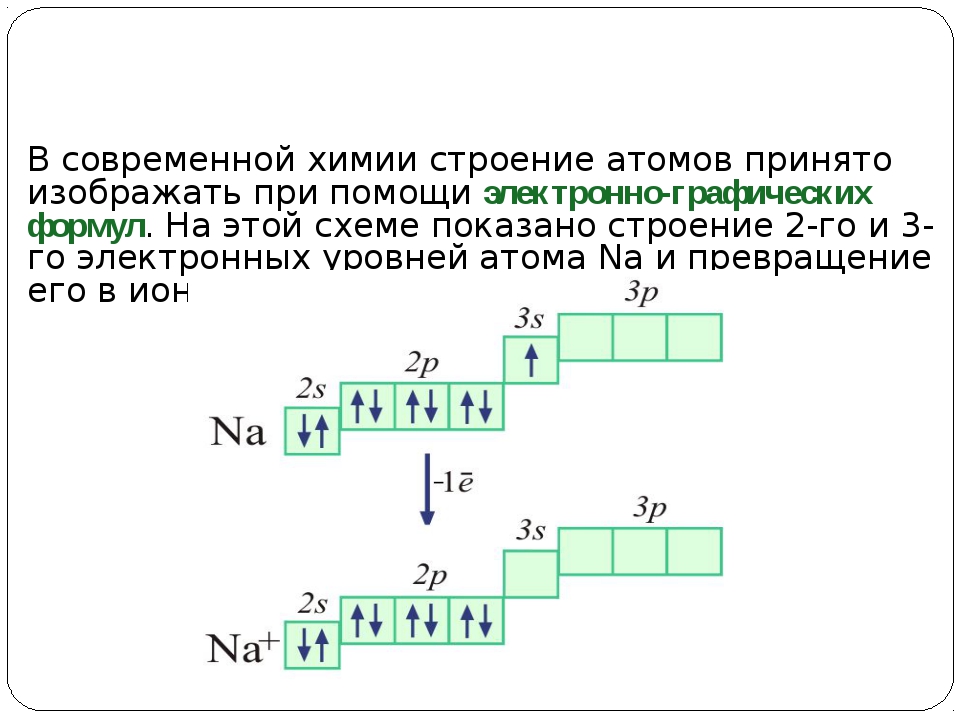 Исключительное значение для химии имело 0 0 1 Fустановление закона сохранения массы, являющегося след ствием 0 0 1 Fвсеобщего естественного закона сохранения материи и дви жения, сформулированного М.В.Ломоносовым (1711-1765 гг.) как всеобщий естественный закон в 1748 г. в письме к Д. Эйлеру: “Все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимется, столько присовокупится к другому, ежели, где убудет несколько материи, то умножится в другом месте… Сей всеобщий закон простирается и в самые пра 0 01 Fвила движения; ибо тело, движущее своей силой другое, столько же он у себя теряет, сколько сообщает другому, которое от него движе ние получает.” Это положение, высказанное в виде философской концепции. М. В. Ломоносов подтвердил экспериментально в 1756 г., повторив опыты Р. Боиля по прокаливанию металлов в запаянных стеклянных сосудах (ретортах). Русс кий ученый установил, что если сосуд, содержащий металл, взвесить до и после прокаливания, не вскрывая его, то масса остается без изменений.
Исключительное значение для химии имело 0 0 1 Fустановление закона сохранения массы, являющегося след ствием 0 0 1 Fвсеобщего естественного закона сохранения материи и дви жения, сформулированного М.В.Ломоносовым (1711-1765 гг.) как всеобщий естественный закон в 1748 г. в письме к Д. Эйлеру: “Все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимется, столько присовокупится к другому, ежели, где убудет несколько материи, то умножится в другом месте… Сей всеобщий закон простирается и в самые пра 0 01 Fвила движения; ибо тело, движущее своей силой другое, столько же он у себя теряет, сколько сообщает другому, которое от него движе ние получает.” Это положение, высказанное в виде философской концепции. М. В. Ломоносов подтвердил экспериментально в 1756 г., повторив опыты Р. Боиля по прокаливанию металлов в запаянных стеклянных сосудах (ретортах). Русс кий ученый установил, что если сосуд, содержащий металл, взвесить до и после прокаливания, не вскрывая его, то масса остается без изменений. При нагревании же металла во вскрытой реторте масса увеличивается за счет его с оединения с воздухом, проникающим в сосуд. Аналогичных выводы на основе экспериментом по прокаливанию м еталлов сделал в 1777 г. и А. Лавуазье (1743-1794 гг.), который (после открыт ия и 1774 г. Д. Пристли кислорода) уже знал качественный и количественный состав воздуха. Например, оксид углерода (IV) можно получить по любой и 0 01 Fз ука занных ниже реакций: С+О2=СО2; 2СО+02=2С02; СаСОз=С02+СаО В химически чистом образце этого оксида всегда содержится 27,29% С и 72,71% 0 01 F О. Отклонение от указанного состава свидетель ствует о присутствии примесей. Утверждение, обратное закону о постоянстве состава 0 0 1 Fвеществ: каждому определенному составу отве чает только одно химическое соединение, неверно. Действительно, диметиловый эфир и этиловый спирт имеют одинаковый химический состав – С2НбО, но отличаются друг от друга структурой молекул, т. е. порядком соединения в них атомов (изомеры). Закон эквивалентов. Химические элементы соединяются друг с другом в строго определенных количествах, соответствующих их эквивалентам (В.
При нагревании же металла во вскрытой реторте масса увеличивается за счет его с оединения с воздухом, проникающим в сосуд. Аналогичных выводы на основе экспериментом по прокаливанию м еталлов сделал в 1777 г. и А. Лавуазье (1743-1794 гг.), который (после открыт ия и 1774 г. Д. Пристли кислорода) уже знал качественный и количественный состав воздуха. Например, оксид углерода (IV) можно получить по любой и 0 01 Fз ука занных ниже реакций: С+О2=СО2; 2СО+02=2С02; СаСОз=С02+СаО В химически чистом образце этого оксида всегда содержится 27,29% С и 72,71% 0 01 F О. Отклонение от указанного состава свидетель ствует о присутствии примесей. Утверждение, обратное закону о постоянстве состава 0 0 1 Fвеществ: каждому определенному составу отве чает только одно химическое соединение, неверно. Действительно, диметиловый эфир и этиловый спирт имеют одинаковый химический состав – С2НбО, но отличаются друг от друга структурой молекул, т. е. порядком соединения в них атомов (изомеры). Закон эквивалентов. Химические элементы соединяются друг с другом в строго определенных количествах, соответствующих их эквивалентам (В. Рихтер, 1792-1794 гг.). Понятие эквивалента введено в химию для 0 0 1 Fсопоставления соединительной способности раз личных элементов. Эквивалентом химического элемента называют такую его массу, которая соединяется с 1,008 ч. м. 0 01 F (части массы) во дорода или 8 ч. м. кислорода или з 0 0 1 Fамещает эти массы в соедине ниях* Отметим, что один и тот же элемент может иметь не один, а 0 01 Fне сколько эквивалентов. Так, эквивалент углерода в оксиде углерода (IV) равен трем, а в оксиде углерода (II) – шести. 0 0 1 FПонятие эквивалента можно распространить и на сложные соеди нения типа кислот, солей и оснований. Эквивалентом сложного соединения называют массу этого 0 0 1 Fсоеди нения, содержащую эквивалент водорода (кислоты) или эквивалент металлической составной части (основания, соли). 0 0 1 FВ общем виде закон эквивалентов можно сформулировать следую щим образом: Во всех химических реакциях взаимодействие различных веществ друг 0 0 1 Fс другом происходит в соответствии с их эквивалентами, неза висимо от того, являются ли эти вещества простыми или сложными.
Рихтер, 1792-1794 гг.). Понятие эквивалента введено в химию для 0 0 1 Fсопоставления соединительной способности раз личных элементов. Эквивалентом химического элемента называют такую его массу, которая соединяется с 1,008 ч. м. 0 01 F (части массы) во дорода или 8 ч. м. кислорода или з 0 0 1 Fамещает эти массы в соедине ниях* Отметим, что один и тот же элемент может иметь не один, а 0 01 Fне сколько эквивалентов. Так, эквивалент углерода в оксиде углерода (IV) равен трем, а в оксиде углерода (II) – шести. 0 0 1 FПонятие эквивалента можно распространить и на сложные соеди нения типа кислот, солей и оснований. Эквивалентом сложного соединения называют массу этого 0 0 1 Fсоеди нения, содержащую эквивалент водорода (кислоты) или эквивалент металлической составной части (основания, соли). 0 0 1 FВ общем виде закон эквивалентов можно сформулировать следую щим образом: Во всех химических реакциях взаимодействие различных веществ друг 0 0 1 Fс другом происходит в соответствии с их эквивалентами, неза висимо от того, являются ли эти вещества простыми или сложными. Закон кратных отношений. Если два элемента образуют друг с Другом несколько химических соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как простые целые числа (Д. Дальтон, 1803 г.). Д. Дальтон (1776-1844 гг.) в дальнейшем, используя 0 4 3 E 0 4 4 2 0 4 3 A 0 4 4 0 0 4 4 B тый им закол кратных отношений, закон эквивалентов и закон 0 0 1 Fпосто янства состава, создал новую версию атомистической теории, основан ную на количественных соотношениях, возникающих при 0 0 1 Fвзаимодей ствии между химическими элементами. Нетрудно убедиться, что закон кратных отношений представляет собой дальнейшее развитие закона эквивалентов, 0 4 3 E 0 4 4 1 0 4 3 D 0 4 3 E 0 4 3 2 0 4 3 0 0 4 3 D 0 4 3 D 0 4 3 E 0 4 3 5 0 4 3 D 0 4 3 0 0 4 3 F 0 4 3 E 0 4 4 1 ледовательном анализе рядов химических соединений, образующихся при взаимодействии друг с другом двух 0 4 3 B 0 4 4 E 0 4 3 1 0 4 4 B 0 4 4 5 0 4 4 5 0 4 3 8 0 4 3 C 0 4 3 8 0 4 4 7 0 4 3 5 0 4 4 1 0 4 3 A 0 4 3 8 0 4 4 5 0 4 4 D 0 4 3 B 0 4 3 5 0 4 3 C 0 4 3 5 0 4 3 D тов.
Закон кратных отношений. Если два элемента образуют друг с Другом несколько химических соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как простые целые числа (Д. Дальтон, 1803 г.). Д. Дальтон (1776-1844 гг.) в дальнейшем, используя 0 4 3 E 0 4 4 2 0 4 3 A 0 4 4 0 0 4 4 B тый им закол кратных отношений, закон эквивалентов и закон 0 0 1 Fпосто янства состава, создал новую версию атомистической теории, основан ную на количественных соотношениях, возникающих при 0 0 1 Fвзаимодей ствии между химическими элементами. Нетрудно убедиться, что закон кратных отношений представляет собой дальнейшее развитие закона эквивалентов, 0 4 3 E 0 4 4 1 0 4 3 D 0 4 3 E 0 4 3 2 0 4 3 0 0 4 3 D 0 4 3 D 0 4 3 E 0 4 3 5 0 4 3 D 0 4 3 0 0 4 3 F 0 4 3 E 0 4 4 1 ледовательном анализе рядов химических соединений, образующихся при взаимодействии друг с другом двух 0 4 3 B 0 4 4 E 0 4 3 1 0 4 4 B 0 4 4 5 0 4 4 5 0 4 3 8 0 4 3 C 0 4 3 8 0 4 4 7 0 4 3 5 0 4 4 1 0 4 3 A 0 4 3 8 0 4 4 5 0 4 4 D 0 4 3 B 0 4 3 5 0 4 3 C 0 4 3 5 0 4 3 D тов. В простейшем случае указанный ряд может состоять из двух соединений. Например, при вз аимодействии углерода и кислорода: образуются два соединения: оксид углерода (II) и оксид углерода- (IV). Доказательство постоянства состава для самых разнообразных хими ческих соединении уже являлось само по себе свидетельством в пользу дискретного строения материи. Применение же закона постоянства состава для анализа любого из указанных рядов показывает, что существование дв 0 0 1 Fух (или нескольких) соединений, обра зующихся при взаимодействии любой пары химических элементов, возможно лишь в том случае, когда состав соединений буде 0 01 Fт отли чаться один от другого на целые атомы. Естественно, что эти разли 0 01 Fчия в составе химических соединений ряда, впрочем, как и сами основные законы химии, справедливы лишь при условии, что материя действительно состоит из мельчайших неделимых частиц. Выдвигая новую версию атомистической теории, опирающуюся на основные химические законы, и отдавая дань 0 01 F уважения древнегре ческим философам- атомистам, Д.
В простейшем случае указанный ряд может состоять из двух соединений. Например, при вз аимодействии углерода и кислорода: образуются два соединения: оксид углерода (II) и оксид углерода- (IV). Доказательство постоянства состава для самых разнообразных хими ческих соединении уже являлось само по себе свидетельством в пользу дискретного строения материи. Применение же закона постоянства состава для анализа любого из указанных рядов показывает, что существование дв 0 0 1 Fух (или нескольких) соединений, обра зующихся при взаимодействии любой пары химических элементов, возможно лишь в том случае, когда состав соединений буде 0 01 Fт отли чаться один от другого на целые атомы. Естественно, что эти разли 0 01 Fчия в составе химических соединений ряда, впрочем, как и сами основные законы химии, справедливы лишь при условии, что материя действительно состоит из мельчайших неделимых частиц. Выдвигая новую версию атомистической теории, опирающуюся на основные химические законы, и отдавая дань 0 01 F уважения древнегре ческим философам- атомистам, Д. 0 01 F Дальтон сохранил предложен ное ими название для мельчайших неделимых частиц материи – атом. И наконец, использование закона постоянства состава и закона кратных отношений позволило Д. Дальтону установить значения относительных атомных масс элементов, принимая за единичную – массу атома водорода. Так, том Дальтона, обладающий конкретным материальным 0 01 Fсвой ством – атомной массой, из отвлеченной модели превратился в 0 01 Fконк ретное химическое понятие. С введением в химию понятия “атомная масса” наука переходит на более высокую ступень своего развития. 0 0 1 FВместе с тем атомистика Дальтона еще не свободна от недос татков: в ней нет места молекулам, а существуют только “сложные атомы ”. Закон объемных отношений и закон Авогадро. 0 01 F Объемы вступаю щих в 0 0 1 Fреакцию газов относятся друг к другу, а также к объему полу чающихся газообразных продуктов как простые целые числа (Ж. Гей-Люссак, 1805 г.). 0 0 1 FЭтот закон находится в серьезном про тиворечии с выводами атомистики Дальтона.
0 01 F Дальтон сохранил предложен ное ими название для мельчайших неделимых частиц материи – атом. И наконец, использование закона постоянства состава и закона кратных отношений позволило Д. Дальтону установить значения относительных атомных масс элементов, принимая за единичную – массу атома водорода. Так, том Дальтона, обладающий конкретным материальным 0 01 Fсвой ством – атомной массой, из отвлеченной модели превратился в 0 01 Fконк ретное химическое понятие. С введением в химию понятия “атомная масса” наука переходит на более высокую ступень своего развития. 0 0 1 FВместе с тем атомистика Дальтона еще не свободна от недос татков: в ней нет места молекулам, а существуют только “сложные атомы ”. Закон объемных отношений и закон Авогадро. 0 01 F Объемы вступаю щих в 0 0 1 Fреакцию газов относятся друг к другу, а также к объему полу чающихся газообразных продуктов как простые целые числа (Ж. Гей-Люссак, 1805 г.). 0 0 1 FЭтот закон находится в серьезном про тиворечии с выводами атомистики Дальтона. Для объяснения наблюдавшихся Ж. Гей-Люссаком 0 01 F законо мерностей соединения газов оказалось необходимым предположить следующее: 1) любые газы (в том числе и простые) состоят не из атомов, а из молекул; 2) 0 01 F в равных объемах различных газов при одинаковых темпера туре и давлении содержится одинаковое число молекул. Последнее утверждение, высказанное итальянским ученым А. А во га дров 1811 г., вошло в химию под именем закона Авогадро. Однако в начале 19 в. 0 0 1 Fэти воззрения не получили должно го признания: даже крупные химики того времени Д. Дальтон и И. Берцелиус отрицали возможность существования молекул, состоящих из нескольких одинаковых атомов. Прошло еще полвека, прежде чем на 1 Международном съезде химиков, состоявшемся в Карлсруэ (Германия) в сентябре 1860 г., были окончате 0 01 Fльно приня ты основные 0 0 1 Fхимические представления (понятия об атомах и моле кулах), зародившиеся в виде философского учения в Древней Греции (Левкипп, Демокрит, Эпикур), 0 0 1 Fвпервые развитые в виде на учной концепции Д.
Для объяснения наблюдавшихся Ж. Гей-Люссаком 0 01 F законо мерностей соединения газов оказалось необходимым предположить следующее: 1) любые газы (в том числе и простые) состоят не из атомов, а из молекул; 2) 0 01 F в равных объемах различных газов при одинаковых темпера туре и давлении содержится одинаковое число молекул. Последнее утверждение, высказанное итальянским ученым А. А во га дров 1811 г., вошло в химию под именем закона Авогадро. Однако в начале 19 в. 0 0 1 Fэти воззрения не получили должно го признания: даже крупные химики того времени Д. Дальтон и И. Берцелиус отрицали возможность существования молекул, состоящих из нескольких одинаковых атомов. Прошло еще полвека, прежде чем на 1 Международном съезде химиков, состоявшемся в Карлсруэ (Германия) в сентябре 1860 г., были окончате 0 01 Fльно приня ты основные 0 0 1 Fхимические представления (понятия об атомах и моле кулах), зародившиеся в виде философского учения в Древней Греции (Левкипп, Демокрит, Эпикур), 0 0 1 Fвпервые развитые в виде на учной концепции Д.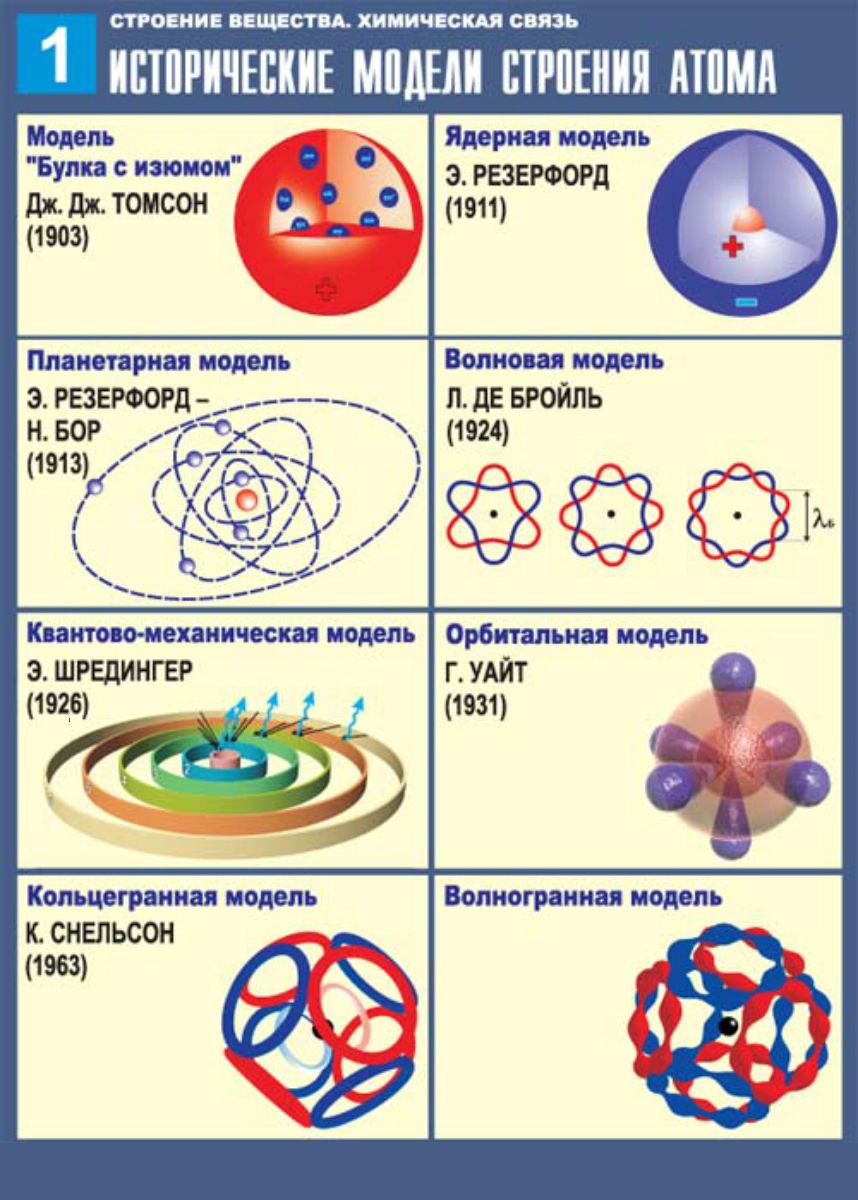 Дальтоном, подтвержденные опытами Ж. Пруста, Ж. Гей-Люссака и окончательно 0 0 1 Fсформулирован ные в трудах А. Авогадро и его ученика С.Канниццаро. Таким образом, основные положения атомно-молекулярного учения можно сформулировать следующим образом: Все вещества состоят из атомов. Атомы каждого вида одинаковы между собой, но отличаются от атомов любого другого вида. каждой частицы равнялась 0,00055 углеродной частицы. Заряд равняется 1,602 на 10 в минус 19 степени. Особенно замечательно, что масса частиц и величина их заряда не зависит ни от природы газа, остающегося в трубке, ни от вещества из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут существовать без своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет, самую сущность их природы. Эти частицы получили название электронов. В катодных трубках электроны отделяются от катода под влиянием электрического заряда.
Дальтоном, подтвержденные опытами Ж. Пруста, Ж. Гей-Люссака и окончательно 0 0 1 Fсформулирован ные в трудах А. Авогадро и его ученика С.Канниццаро. Таким образом, основные положения атомно-молекулярного учения можно сформулировать следующим образом: Все вещества состоят из атомов. Атомы каждого вида одинаковы между собой, но отличаются от атомов любого другого вида. каждой частицы равнялась 0,00055 углеродной частицы. Заряд равняется 1,602 на 10 в минус 19 степени. Особенно замечательно, что масса частиц и величина их заряда не зависит ни от природы газа, остающегося в трубке, ни от вещества из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут существовать без своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет, самую сущность их природы. Эти частицы получили название электронов. В катодных трубках электроны отделяются от катода под влиянием электрического заряда. Но они могут возникать и вне всякой связи с электрическим зарядом. Так, например при электронной эмиссии металлы испускают электроны; при фотоэффекте многие вещества также выбрасывают электроны. Выделение электронов самыми разнообразными веществами указывает на то, что эти частицы входят в состав всех атомов; следовательно атомы являются сложными образованиями, построенными из более мелких «составных частей». Изучение строения атома практически началось в 1897-1898 гг., после того как была окончательно установлена природа катодных лучей как потока электронов и были определены величина заряда и масса электрона. Факт выделения электронов самыми разнообразными веществами приводил к выводу, что электроны входят в состав всех атомов. Но атом, как известно, электрически нейтрален, из этого следовало, что в его состав должна была входить ещё одна составная часть, уравновешивавшая сумму отрицательных зарядов электронов. Эта положительно заряженная часть атома была открыта в 1911 г. Резерфордом при исследовании движения α – частиц в газах и других веществах.
Но они могут возникать и вне всякой связи с электрическим зарядом. Так, например при электронной эмиссии металлы испускают электроны; при фотоэффекте многие вещества также выбрасывают электроны. Выделение электронов самыми разнообразными веществами указывает на то, что эти частицы входят в состав всех атомов; следовательно атомы являются сложными образованиями, построенными из более мелких «составных частей». Изучение строения атома практически началось в 1897-1898 гг., после того как была окончательно установлена природа катодных лучей как потока электронов и были определены величина заряда и масса электрона. Факт выделения электронов самыми разнообразными веществами приводил к выводу, что электроны входят в состав всех атомов. Но атом, как известно, электрически нейтрален, из этого следовало, что в его состав должна была входить ещё одна составная часть, уравновешивавшая сумму отрицательных зарядов электронов. Эта положительно заряженная часть атома была открыта в 1911 г. Резерфордом при исследовании движения α – частиц в газах и других веществах. α – частицы, выбрасываемые веществами активных элементов представляют собой положительно заряженные ионы гелия, скорость движения которых достигает 20000 км/сек. Благодаря такой огромной скорости α -частицы, пролетая через воздух и сталкиваясь с молекулами газов, выбивают из них электроны. Молекулы, потерявшие электроны, становятся заряженными положительно, выбитые же электроны тотчас присоединяются к другим молекулам, заряжая их отрицательно. Таким образом, в воздухе на пути α – частиц образуются положительно и отрицательно заряженные ионы газа. Способность α -частиц ионизировать воздух была использована английским физиком Вильсоном для того, чтобы сделать видимыми пути движения отдельных частиц и сфотографировать их. Впоследствии аппарат для фотографирования частиц получил название камеры Вильсона. (Первый трековый детектор заряженных частиц. Изобретена Ч. Вильсоном в 1912. Действие Вильсона камеры основано на конденсации пересыщенного пара (образовании мелких капелек жидкости) на ионах, возникающих вдоль следа (трека) заряженной частицы.
α – частицы, выбрасываемые веществами активных элементов представляют собой положительно заряженные ионы гелия, скорость движения которых достигает 20000 км/сек. Благодаря такой огромной скорости α -частицы, пролетая через воздух и сталкиваясь с молекулами газов, выбивают из них электроны. Молекулы, потерявшие электроны, становятся заряженными положительно, выбитые же электроны тотчас присоединяются к другим молекулам, заряжая их отрицательно. Таким образом, в воздухе на пути α – частиц образуются положительно и отрицательно заряженные ионы газа. Способность α -частиц ионизировать воздух была использована английским физиком Вильсоном для того, чтобы сделать видимыми пути движения отдельных частиц и сфотографировать их. Впоследствии аппарат для фотографирования частиц получил название камеры Вильсона. (Первый трековый детектор заряженных частиц. Изобретена Ч. Вильсоном в 1912. Действие Вильсона камеры основано на конденсации пересыщенного пара (образовании мелких капелек жидкости) на ионах, возникающих вдоль следа (трека) заряженной частицы. В дальнейшем вытеснена другими трековыми детекторами.) Исследуя пути движения частиц с помощью камеры, Резерфорд заметил, что в камере они параллельны (пути), а при пропускании пучка параллельных лучей через слой газа или тонкую металлическую пластинку, они выходят не параллельно, а несколько расходятся, т.е. происходит отклонение частиц от их первоначального пути. Некоторые частицы отклонялись очень сильно, некоторые вообще не проходили через тонкую пластинку. Модель атома Бор-Резерфорд. Исходя из этих наблюдений, Резерфорд предложил свою схему строения атома: в центре атома находится положительное ядро, вокруг которого по разным орбиталям вращаются отрицательные электроны. Центростремительные силы, возникающие при их вращении удерживают их на своих орбиталях и не дают им улететь. Эта модель атома легко объясняет явление отклонения α – частиц. Размеры ядра и электронов очень малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов; поэтому большинство α -частиц пролетает через атомы без заметного отклонения.
В дальнейшем вытеснена другими трековыми детекторами.) Исследуя пути движения частиц с помощью камеры, Резерфорд заметил, что в камере они параллельны (пути), а при пропускании пучка параллельных лучей через слой газа или тонкую металлическую пластинку, они выходят не параллельно, а несколько расходятся, т.е. происходит отклонение частиц от их первоначального пути. Некоторые частицы отклонялись очень сильно, некоторые вообще не проходили через тонкую пластинку. Модель атома Бор-Резерфорд. Исходя из этих наблюдений, Резерфорд предложил свою схему строения атома: в центре атома находится положительное ядро, вокруг которого по разным орбиталям вращаются отрицательные электроны. Центростремительные силы, возникающие при их вращении удерживают их на своих орбиталях и не дают им улететь. Эта модель атома легко объясняет явление отклонения α – частиц. Размеры ядра и электронов очень малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов; поэтому большинство α -частиц пролетает через атомы без заметного отклонения.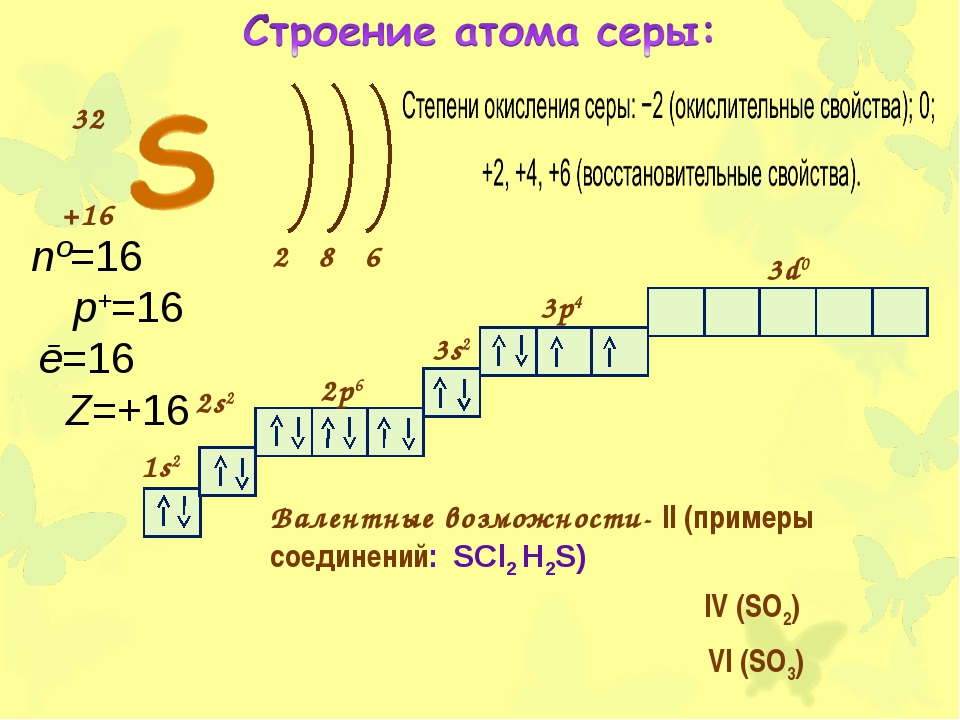 Только в тех случаях, когда α -частицы очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяние α -частиц положило начало ядерной теории атома. Одной из задач, стоявших перед теорией строения атома в начале ее развития, было определение величины заряда ядра различных атомов. Так как атом в целом электрически нейтрален, то, определив заряд ядра, можно было бы установить и число окружающих ядро электронов. В решении этой задачи этой большую помощь оказало изучение спектров рентгеновских лучей. Рентгеновские лучи возникают при ударе быстро летящих электронов о какое-либо твердое тело и отличаются от лучей видимого света только значительно меньшей длиной волны. В то время как короткие световые волны имеют длину около 4000 ангстремов (фиолетовые лучи), длины волн рентгеновских лучей лежат в пределах от 20 до 0,1 ангстрема. Чтобы получить спектр рентгеновских лучей, нельзя пользоваться обыкновенной призмой или дифракционной решеткой.
Только в тех случаях, когда α -частицы очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяние α -частиц положило начало ядерной теории атома. Одной из задач, стоявших перед теорией строения атома в начале ее развития, было определение величины заряда ядра различных атомов. Так как атом в целом электрически нейтрален, то, определив заряд ядра, можно было бы установить и число окружающих ядро электронов. В решении этой задачи этой большую помощь оказало изучение спектров рентгеновских лучей. Рентгеновские лучи возникают при ударе быстро летящих электронов о какое-либо твердое тело и отличаются от лучей видимого света только значительно меньшей длиной волны. В то время как короткие световые волны имеют длину около 4000 ангстремов (фиолетовые лучи), длины волн рентгеновских лучей лежат в пределах от 20 до 0,1 ангстрема. Чтобы получить спектр рентгеновских лучей, нельзя пользоваться обыкновенной призмой или дифракционной решеткой. (Дифракционная РЕШЕТКА, оптический прибор; совокупность большого количества параллельных щелей в непрозрачном экране или отражающих зеркальных полосок (штрихов), равноотстоящих друг от друга, на которых происходит дифракция света. Дифракционная решетка разлагает падающий на нее пучок света в спектр, что используется в спектральных приборах. ) Для рентгеновских лучей требовалась решётка с очень большим количеством делений на один миллиметр (примерно 1млн./1мм.). Такую решётку искусственно приготовить было невозможно. В 1912 г. у швейцарского физика Лауэ возникла мысль использовать кристаллы в качестве дифракционной решетки для рентгеновских лучей. Модель кристалла. Упорядоченное расположение атомов в кристалле и малое расстояние между ними давало повод предполагать что как раз кристаллы и подойдут на роль требуемой дифракционной решётки. Опыт блестяще подтвердил предположение Лауэ, вскоре удалось построить приборы, которые давали возможность получать спектр рентгеновских лучей почти всех элементов.
(Дифракционная РЕШЕТКА, оптический прибор; совокупность большого количества параллельных щелей в непрозрачном экране или отражающих зеркальных полосок (штрихов), равноотстоящих друг от друга, на которых происходит дифракция света. Дифракционная решетка разлагает падающий на нее пучок света в спектр, что используется в спектральных приборах. ) Для рентгеновских лучей требовалась решётка с очень большим количеством делений на один миллиметр (примерно 1млн./1мм.). Такую решётку искусственно приготовить было невозможно. В 1912 г. у швейцарского физика Лауэ возникла мысль использовать кристаллы в качестве дифракционной решетки для рентгеновских лучей. Модель кристалла. Упорядоченное расположение атомов в кристалле и малое расстояние между ними давало повод предполагать что как раз кристаллы и подойдут на роль требуемой дифракционной решётки. Опыт блестяще подтвердил предположение Лауэ, вскоре удалось построить приборы, которые давали возможность получать спектр рентгеновских лучей почти всех элементов. Для получения рентгеновских спектров антикатод в рентгеновских трубках делают из того металла, спектр которого хотят получить, или же наносят соединение исследуемого элемента. Экраном для спектра служит фотобумага; после проявления на ней видны все линии спектра. В 1913 г. английский ученый Мозли, изучая рентгеновские спектры нашел соотношение между длинами волн рентгеновских лучей и порядкового номерами соответствующих элементов – это носит название закона Мозли и может быть сформулировано следующим образом: Корни квадратные из обратных значений длин волн находятся в линейной зависимости от порядковых номеров элементов. Еще до работ Мозли некоторые учёные предполагали, что порядковый номер элемента указывает число зарядов ядра его атома. В тоже время Резерфорд, изучая рассеивание F 06 1-частиц при прохождении через тонкие металлические пластинки, выяснил, что если заряд электрона принять за единицу, то выражаемый в таких единицах заряд ядра приблизительно равен половине атомного веса элемента.
Для получения рентгеновских спектров антикатод в рентгеновских трубках делают из того металла, спектр которого хотят получить, или же наносят соединение исследуемого элемента. Экраном для спектра служит фотобумага; после проявления на ней видны все линии спектра. В 1913 г. английский ученый Мозли, изучая рентгеновские спектры нашел соотношение между длинами волн рентгеновских лучей и порядкового номерами соответствующих элементов – это носит название закона Мозли и может быть сформулировано следующим образом: Корни квадратные из обратных значений длин волн находятся в линейной зависимости от порядковых номеров элементов. Еще до работ Мозли некоторые учёные предполагали, что порядковый номер элемента указывает число зарядов ядра его атома. В тоже время Резерфорд, изучая рассеивание F 06 1-частиц при прохождении через тонкие металлические пластинки, выяснил, что если заряд электрона принять за единицу, то выражаемый в таких единицах заряд ядра приблизительно равен половине атомного веса элемента. Порядковый номер, по крайне мере более легких элементов, тоже равняется примерно половине атомного веса. Все вместе взятое привело к выводу, что Заряд ядра численно равен порядковому номеру элемента. Таким образом, закон Мозли позволил определить заряды атомных ядер. Тем самым, ввиду нейтральности атомов, было установлено и число электронов, вращающихся вокруг ядра в атоме каждого элемента. Модель Нильса Бора N=2n*n где n-номер слоя. Кроме того, установлено, что число электронов в наружном слое для всех элементов, кроме палладия, не превышает восьми, а в предпоследнем – восемнадцати. Электроны наружного слоя, как наиболее удаленные от ядра и, следовательно, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся заряженные положительно, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот атомы присоединившие электроны становятся заряженные отрицательно.
Порядковый номер, по крайне мере более легких элементов, тоже равняется примерно половине атомного веса. Все вместе взятое привело к выводу, что Заряд ядра численно равен порядковому номеру элемента. Таким образом, закон Мозли позволил определить заряды атомных ядер. Тем самым, ввиду нейтральности атомов, было установлено и число электронов, вращающихся вокруг ядра в атоме каждого элемента. Модель Нильса Бора N=2n*n где n-номер слоя. Кроме того, установлено, что число электронов в наружном слое для всех элементов, кроме палладия, не превышает восьми, а в предпоследнем – восемнадцати. Электроны наружного слоя, как наиболее удаленные от ядра и, следовательно, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся заряженные положительно, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот атомы присоединившие электроны становятся заряженные отрицательно.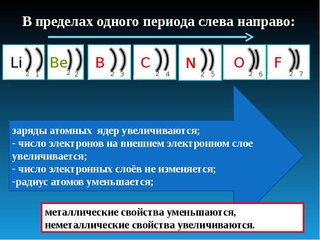 Образующиеся таким путем заряженные частицы, качественно отличные от соответствующих атомов. называются ионами. Многие ионы в свою очередь могут терять или присоединять электроны, превращаясь при этом или в электронейтральные атомы, или в новые ионы с другим зарядом. Теория Бора оказала огромные услуги физике и химии, подойдя, с одной стороны, к раскрытию законов спектроскопии и объяснению механизма лучеиспускания, а с другой – к выяснению структуры отдельных атомов и установлению связи между ними. Однако оставалось еще много явлений в этой области, объяснить которые теория Бора не могла. Движение электронов в атомах Бор представлял как простое механическое, однако оно является сложным и своеобразным. Это своеобразие было объяснено новой квантовой теорией. Отсюда и пошло: «Карпускулярно- вролновой дуализм». Характеристика поведения электронов в атомах. Теория Бора оказала огромные услуги физике и химии. Однако оставалось еще много явлений в этой области, объяснить которые теория Бора не могла.
Образующиеся таким путем заряженные частицы, качественно отличные от соответствующих атомов. называются ионами. Многие ионы в свою очередь могут терять или присоединять электроны, превращаясь при этом или в электронейтральные атомы, или в новые ионы с другим зарядом. Теория Бора оказала огромные услуги физике и химии, подойдя, с одной стороны, к раскрытию законов спектроскопии и объяснению механизма лучеиспускания, а с другой – к выяснению структуры отдельных атомов и установлению связи между ними. Однако оставалось еще много явлений в этой области, объяснить которые теория Бора не могла. Движение электронов в атомах Бор представлял как простое механическое, однако оно является сложным и своеобразным. Это своеобразие было объяснено новой квантовой теорией. Отсюда и пошло: «Карпускулярно- вролновой дуализм». Характеристика поведения электронов в атомах. Теория Бора оказала огромные услуги физике и химии. Однако оставалось еще много явлений в этой области, объяснить которые теория Бора не могла. Движение электронов в атомах рисовалось Бору до известной степени как простое механическое перемещение, между тем как оно является весьма сложным и своеобразным. Своеобразие движения электронов было раскрыто новой теорией – квантовой, или волновой, механикой. Квантовая механика показывает, что законы движения электронов имеют много общего с законами распространения волн. Атомы различных элементов характеризуются определенным значением заряда ядра и равным ему числом электронов, которые распределяются по энергетическим уровням. Поведение электронов в атоме характеризуется четырьмя квантовыми числами: 1) Главное квантовое число n определяет уровень энергии, которому отвечает данная орбита, и ее удаленность от ядра. Число может принимать значения ряда натуральных чисел (в реальных атомах от одного до семи). Эти числа соответствуют электронным слоям атома или его энергетическим уровням, которые обозначаются прописными буквами латинского алфавита: 1 2 3 4 5 6 7 К L M N O P Q Помимо главного квантового числа, состояние электрона в атоме характеризуется еще тремя другими квантовыми числами: l, m, s.
Движение электронов в атомах рисовалось Бору до известной степени как простое механическое перемещение, между тем как оно является весьма сложным и своеобразным. Своеобразие движения электронов было раскрыто новой теорией – квантовой, или волновой, механикой. Квантовая механика показывает, что законы движения электронов имеют много общего с законами распространения волн. Атомы различных элементов характеризуются определенным значением заряда ядра и равным ему числом электронов, которые распределяются по энергетическим уровням. Поведение электронов в атоме характеризуется четырьмя квантовыми числами: 1) Главное квантовое число n определяет уровень энергии, которому отвечает данная орбита, и ее удаленность от ядра. Число может принимать значения ряда натуральных чисел (в реальных атомах от одного до семи). Эти числа соответствуют электронным слоям атома или его энергетическим уровням, которые обозначаются прописными буквами латинского алфавита: 1 2 3 4 5 6 7 К L M N O P Q Помимо главного квантового числа, состояние электрона в атоме характеризуется еще тремя другими квантовыми числами: l, m, s. 2) Орбитальное, побочное или азимутальное квантовое число l характеризует момент количества движения электрона относительно центра орбиты. Оно определяет форму электронного облака (форму орбиты), его сплошность или разрывы и его вытянутость. Принимает целые значения от 0 до (n-1). Для данного значения n имеется n различных орбиталей, т.е. число значений l определяет количество атомных орбиталей. Энергетические подуровни обозначаются следующим образом: 0 1 2 3 s p d f 3) Магнитное квантовое число m определяет положение плоскости орбиты электрона в пространстве или, в соответствии с представлениями волновой механики, то направление, в котором вытянуто электронное облако. Может принимать целые значения от -l до l (включая 0), всего (2*l+1) значений. Число значений m определяет число орбиталей данного (s-, p-, d-, f- типа). 4) Спиновое квантовое число s определяет направление вращения электрона, может принимать только два значения: 1/2 и -1/2. Изучению распределения электронов в атомах уделяется большое внимание, так как поведение атомов в химических реакциях в значительной мере зависит от того, насколько прочно их электроны удерживаются на своих орбиталях.
2) Орбитальное, побочное или азимутальное квантовое число l характеризует момент количества движения электрона относительно центра орбиты. Оно определяет форму электронного облака (форму орбиты), его сплошность или разрывы и его вытянутость. Принимает целые значения от 0 до (n-1). Для данного значения n имеется n различных орбиталей, т.е. число значений l определяет количество атомных орбиталей. Энергетические подуровни обозначаются следующим образом: 0 1 2 3 s p d f 3) Магнитное квантовое число m определяет положение плоскости орбиты электрона в пространстве или, в соответствии с представлениями волновой механики, то направление, в котором вытянуто электронное облако. Может принимать целые значения от -l до l (включая 0), всего (2*l+1) значений. Число значений m определяет число орбиталей данного (s-, p-, d-, f- типа). 4) Спиновое квантовое число s определяет направление вращения электрона, может принимать только два значения: 1/2 и -1/2. Изучению распределения электронов в атомах уделяется большое внимание, так как поведение атомов в химических реакциях в значительной мере зависит от того, насколько прочно их электроны удерживаются на своих орбиталях. Представление о содержащихся в веществах электрических частицах. Представление о содержащихся в веществах электрических частицах было высказано в качестве гипотезы английским ученым Г. Джонстоном Стонеем. Стоней знал, что вещества можно разложить электрическим током, – например, воду можно разложить таким способом на водород и кислород. Ему было известно также о работах Майкла Фарадея, установившего, что для получения некоторого количества элемента из того или иного его соединения требуется определенное количество электричества. Обдумывая эти явления, Стоней в 1874г. пришел к выводу о том, что они указывают на существование электричества в виде дискретных единичных зарядов, причем эти единичные заряды связаны с атомами. В 1891г. Стоней предложил название электрон для постулированной им единицы электричества. Экспериментально электрон был открыт в 1897г Дж. Дж. Томсоном (1856-1940) в Кембриджском университете. Свойства электрона. Электрон представляет собой частицу с отрицательным зарядом величиной –0,1602 10-18 Кл.
Представление о содержащихся в веществах электрических частицах. Представление о содержащихся в веществах электрических частицах было высказано в качестве гипотезы английским ученым Г. Джонстоном Стонеем. Стоней знал, что вещества можно разложить электрическим током, – например, воду можно разложить таким способом на водород и кислород. Ему было известно также о работах Майкла Фарадея, установившего, что для получения некоторого количества элемента из того или иного его соединения требуется определенное количество электричества. Обдумывая эти явления, Стоней в 1874г. пришел к выводу о том, что они указывают на существование электричества в виде дискретных единичных зарядов, причем эти единичные заряды связаны с атомами. В 1891г. Стоней предложил название электрон для постулированной им единицы электричества. Экспериментально электрон был открыт в 1897г Дж. Дж. Томсоном (1856-1940) в Кембриджском университете. Свойства электрона. Электрон представляет собой частицу с отрицательным зарядом величиной –0,1602 10-18 Кл.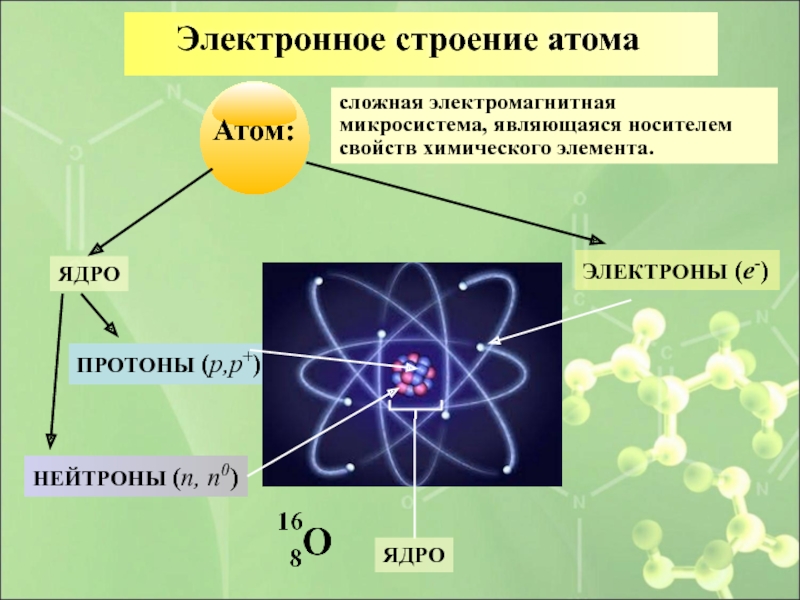 Масса электрона равна 0,9108 10-30кг, что составляет 1/1873 массы атома водорода. Электрон имеет очень небольшие размеры. Радиус электрона точно не определен, но известно, что он значительно меньше 1·10-15м. В 1925г. было установлено, что электрон вращается вокруг собственной оси и что он имеет магнитный момент. Общие принципы заполнения электронных оболочек атомов элементов по периодам. Число электронов в электронейтральном атоме закономерно повышается при переходе элемента от Z к Z + 1. Эта закономерность подчиняется квантовой теории строения атома. Максимальная устойчивость атома, как системы электрических частиц, отвечает минимуму его полной энергии. Потому электроны при заполнении энергетических уровней в электромагнитном поле ядра будут занимать (застраивать) в первую очередь наиболее низкий из них (К – уровень; n=1). В электронейтральном невозбужденном атоме электрон в этих условиях имеет наименьшую энергию (и, соответственно, наибольшую связь с ядром). Когда К – уровень будет заполнен (1s2 – состояние, характерное для атома гелия), электроны начнут застраивать уровень L (n = 2), затем M – уровень (n=3).
Масса электрона равна 0,9108 10-30кг, что составляет 1/1873 массы атома водорода. Электрон имеет очень небольшие размеры. Радиус электрона точно не определен, но известно, что он значительно меньше 1·10-15м. В 1925г. было установлено, что электрон вращается вокруг собственной оси и что он имеет магнитный момент. Общие принципы заполнения электронных оболочек атомов элементов по периодам. Число электронов в электронейтральном атоме закономерно повышается при переходе элемента от Z к Z + 1. Эта закономерность подчиняется квантовой теории строения атома. Максимальная устойчивость атома, как системы электрических частиц, отвечает минимуму его полной энергии. Потому электроны при заполнении энергетических уровней в электромагнитном поле ядра будут занимать (застраивать) в первую очередь наиболее низкий из них (К – уровень; n=1). В электронейтральном невозбужденном атоме электрон в этих условиях имеет наименьшую энергию (и, соответственно, наибольшую связь с ядром). Когда К – уровень будет заполнен (1s2 – состояние, характерное для атома гелия), электроны начнут застраивать уровень L (n = 2), затем M – уровень (n=3).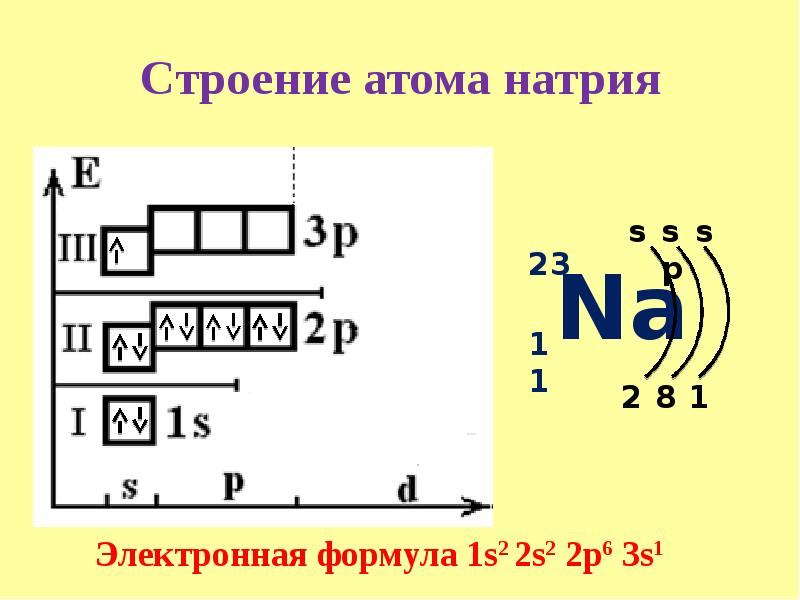 При данном n электроны должны застраивать сначала s-, затем p-, d- и т. д. подуровни. Вначале в качестве примера рассмотрим дейтрон. Это ядро атома тяжелого водорода, или атома дейтерия. Дейтрон имеет такой же электрический заряд, как и протон, но его масса приблизительно вдвое электрический заряд, как и протон, но его масса приблизительно вдвое превышает массу протона. Полагают, что дейтрон состоит из одного протона и одного нейтрона. Ядро атома гелия, которое также называют альфа – частицей или гелионом, имеет электрический заряд, в два раза превышающий заряд протона, и массу приблизительно в четыре раза больше массы протона. Считают, что альфа- частица состоит из двух протонов и двух нейтронов. Заключение. Открытия Резерфорда и Бора являются фундаментальными и имеют огромное значение для современной физики и для всего человечества. История науки учит, что всякий раз, когда человечество овладевает очередной ступенькой лестницы, ведущей в глубь вещества, это приводит к открытию нового, еще более мощного вида энергии.
При данном n электроны должны застраивать сначала s-, затем p-, d- и т. д. подуровни. Вначале в качестве примера рассмотрим дейтрон. Это ядро атома тяжелого водорода, или атома дейтерия. Дейтрон имеет такой же электрический заряд, как и протон, но его масса приблизительно вдвое электрический заряд, как и протон, но его масса приблизительно вдвое превышает массу протона. Полагают, что дейтрон состоит из одного протона и одного нейтрона. Ядро атома гелия, которое также называют альфа – частицей или гелионом, имеет электрический заряд, в два раза превышающий заряд протона, и массу приблизительно в четыре раза больше массы протона. Считают, что альфа- частица состоит из двух протонов и двух нейтронов. Заключение. Открытия Резерфорда и Бора являются фундаментальными и имеют огромное значение для современной физики и для всего человечества. История науки учит, что всякий раз, когда человечество овладевает очередной ступенькой лестницы, ведущей в глубь вещества, это приводит к открытию нового, еще более мощного вида энергии. Горение и взрыв связаны с перестройкой молекул. Внутриатомные процессы сопровождаются выделением в миллионы раз большей энергии. Еще большее выделение энергии происходит на уровне элементарных частиц. А что будет на следующих ступенях? Открытия Резерфорда и Бора доказали, что атом не есть неделимая частица, и дают возможность современной физике ответить на этот вопрос. Список использованной литературы: Кедров Ф. Эрнест Резерфорд. М.: Атомиздат, 1965. Кульман А. Г., Общая химия- М: Наука, 1982. Некрасов Б. В., Основы общей химии-М: Химия, 1973. Полинг Л., Полинг П. Химия –М: Мир, 1978. Резерфорд Эрнест. Избранные научные труды. М., 1971.
Горение и взрыв связаны с перестройкой молекул. Внутриатомные процессы сопровождаются выделением в миллионы раз большей энергии. Еще большее выделение энергии происходит на уровне элементарных частиц. А что будет на следующих ступенях? Открытия Резерфорда и Бора доказали, что атом не есть неделимая частица, и дают возможность современной физике ответить на этот вопрос. Список использованной литературы: Кедров Ф. Эрнест Резерфорд. М.: Атомиздат, 1965. Кульман А. Г., Общая химия- М: Наука, 1982. Некрасов Б. В., Основы общей химии-М: Химия, 1973. Полинг Л., Полинг П. Химия –М: Мир, 1978. Резерфорд Эрнест. Избранные научные труды. М., 1971.
2: Атомная структура — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
Так же, как язык имеет алфавит, из которого строятся слова, химия имеет алфавит, с помощью которого описывается материя. Однако химический алфавит больше, чем тот, который мы используем для правописания. Возможно, вы уже поняли, что химический алфавит состоит из химических элементов. Их роль занимает центральное место в химии, поскольку они объединяются, образуя миллионы и миллионы известных соединений.
Однако химический алфавит больше, чем тот, который мы используем для правописания. Возможно, вы уже поняли, что химический алфавит состоит из химических элементов. Их роль занимает центральное место в химии, поскольку они объединяются, образуя миллионы и миллионы известных соединений.
- 2.1: Элементы
- Вся материя состоит из элементов. Химические элементы обозначаются однобуквенным или двухбуквенным символом.
- 2.2: Атомная теория
- Атомы — это основные строительные блоки всей материи.Современная атомная теория устанавливает представления об атомах и о том, как они составляют материю.
- 2.3: Структура атомов
- Атомы состоят из трех основных субатомных частиц: протонов, нейтронов и электронов. Протоны и нейтроны группируются в ядре атома, а электроны вращаются вокруг ядра.
- 2.
 4: Ядра атомов
4: Ядра атомов - Элементы можно идентифицировать по их атомному номеру и массовому числу.Изотопы — это атомы одного и того же элемента, имеющие разную массу.
- 2.
- 2.5: Расположение электрона (модель оболочки)
- Электронная оболочка представляет собой внешнюю часть атома вокруг атомного ядра. Это группа атомных орбиталей с одинаковым значением главного квантового числа \(n\). Электронные оболочки имеют одну или несколько электронных подоболочек или подуровней. Название электронных оболочек происходит от модели Бора, в которой считалось, что группы электронов движутся вокруг ядра на определенных расстояниях, так что их орбиты образуют «оболочки».
- 2.6: Периодическая таблица
- Химические элементы расположены в таблице, называемой периодической таблицей. Некоторые характеристики элементов связаны с их положением в периодической таблице.
- 2.
 7: Резюме главы
7: Резюме главы - Это домашнее задание к главе 2 Ball et al. Текстовая карта «Основы химии GOB».
- 2.
Атомная теория — Американское химическое общество
Бесплатные статьи
«Следуй за углеродом.Следуйте за Что?
Февраль 2008 г. (стр. 16–19)
Автор: Лора Бличер
Химия Связи: Атомная теория, ядерная, органическая/биохимия
Описание: Описывает набор инструментов для анализа проб на Марсе (SAM) на борту Марсианской научной лаборатории (MSL) для посадки на Марсе в конце 2009 года и остается там, путешествуя по поверхности, собирая данные. Инструменты включают лазерный спектрометр, газовый хроматограф и квадрупольный масс-спектрометр.Далее следует обсуждение ценности изучения углерода как важнейшего ингредиента жизни и его роли в органических соединениях. Разговоры об изотопах углерода дают информацию о происхождении органических материалов, которые может обнаружить ЗРК.
, февраль 2006 г. (стр. 8–10)
Автор: Лоис Фруэн
Химия Связи: Атомная теория, равновесие, история/биография, ядерная, органическая/биохимия
Описание: Обсуждаются методы, используемые для аутентификации древностей, с упором на радиоуглеродное датирование.Описаны процесс и предпосылки науки. Другие описанные методы: определение твердости и плотности, микроскопический анализ минерального состава, масс-спектрометрия для измерения соотношения изотопов O-18 и O-16. Ученые сообщили, что артефакты были подделкой, но затем дальнейшие исследования, проведенные другими учеными, опровергли утверждения о подделке. Вопрос остается без ответа. Химия сосредоточена на изотопном составе и присутствии углекислого газа в подземных водах, растворяющих кальцит (приведены уравнения равновесия).
Super Fibers
Февраль 2006 г. (стр. 11–13)
Автор: Кристен Браунли
Химия Связи: Атомная теория, соединение
Описание: Разговоры об одежде пехоты в будущем, предоставление всего, от индивидуального кондиционирования воздуха до показаний здоровья до двусторонней связи, до изменения камуфляжа, соответствующего местности, для защиты от снарядов, все разработано в рамках ткани униформы на основе углеродных нанотрубок. Обсуждаются открытие и история разработки и производства нанотрубок, а также прогнозируемая роль волокон, изготовленных из них, включая печально известный космический лифт и всемирный распределитель электроэнергии.
Обсуждаются открытие и история разработки и производства нанотрубок, а также прогнозируемая роль волокон, изготовленных из них, включая печально известный космический лифт и всемирный распределитель электроэнергии.
Откуда берутся химические элементы?
Октябрь 2009 г. (стр. 6–8)
Автор: Кэролин Рут
Химия Связи: Атомная теория, ядерная теория, периодичность, реакции
Описание: Описывает различные процессы производства различных элементов в звездах различных типов.Подробно описаны реакции синтеза, деления и «r». Спектроскопия используется для идентификации элементов в звездах и газовых облаках.
ChemHistory: The New Alchemy
октябрь 2006 г. (стр. 15–17)
Автор: Майкл МакКлюр
Химия Связи: Атомная теория, история/биография, ядерная, периодичность
Описание: относится к истории открытия/объяснения различных ядерных реакций (синтез, радиоактивность, деление, трансмутация).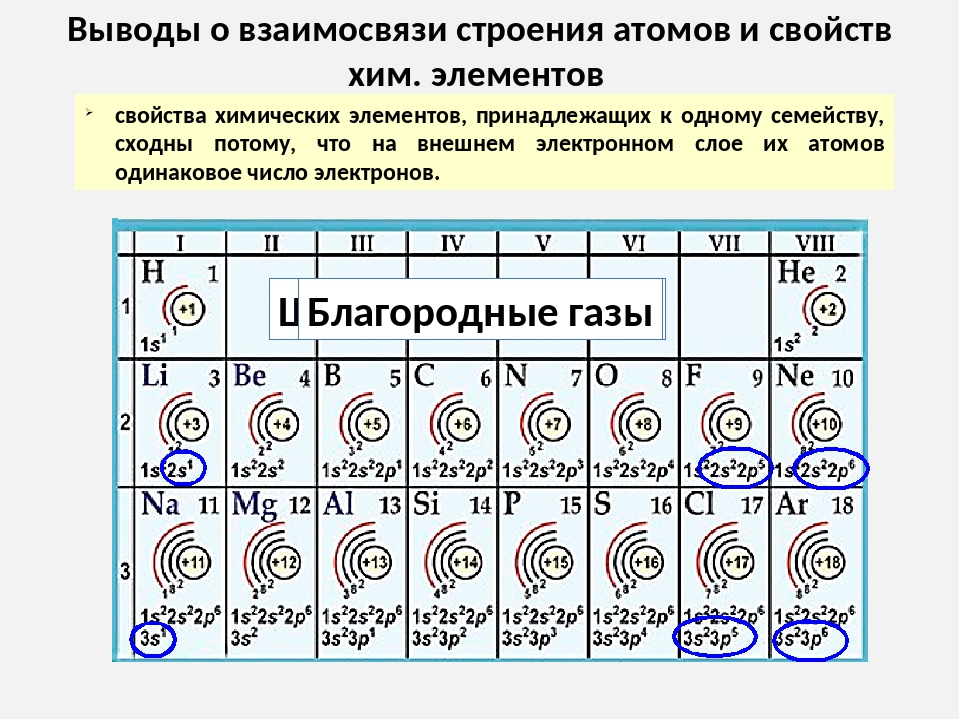 Работая с трансурановыми элементами, Сиборг предложил серию актинидов.
Работая с трансурановыми элементами, Сиборг предложил серию актинидов.
ChemSumer: Химия цифровой фотографии и печати
, февраль 2006 г. (стр. 4–7)
Автор: Брайан Рориг
Химия Связи: Атомная теория, связь, металлы/неметаллы, периодичность
Описание: Начинается с очень краткого описания пленочной фотографии и ее химии. Затем описывается роль полупроводников типа «n» и «p» для формирования диодов, фотоэлементов или пикселей в датчике цифровой камеры. Также обсуждаются различия между черно-белыми и цветными датчиками.Затем в нем обсуждаются процессы струйной и лазерной печати с акцентом на различия в расходах для переноса изображения или текста.
Чудесный год Эйнштейна
Декабрь 2005 г. (стр. 4–6)
Автор: Дорис Кимбро
Химия Связи: Атомная теория, история/биография, твердые вещества/жидкости/газы
Описание: Обсуждаются три основные проблемы, решенные Эйнштейном в 1905 году: фотоэлектрический эффект и природа атомной структуры. пространственно-временной континуум.Фотоэлектрический эффект: описывает свет как электромагнитные волны и утверждает, что частота, а не интенсивность определяет, выбрасываются ли электроны, когда свет падает на металл, а более высокая частота означает, что выбрасываются более быстрые электроны. Ответ Эйнштейна: думайте о свете здесь как о частице (фотоне), а не о волне. Атомная теория: Эйнштейн объяснил броуновское движение как движение атомов и молекул, сталкивающихся друг с другом, и рассчитал размер атомов на основе своих наблюдений, закрепив представление об атомах для сомневающихся ученых.Специальная теория относительности: Эйнштейн показал, что время и пространство относительны в зависимости от системы отсчета наблюдателя. Диаграмма иллюстрирует фотоэлектрический эффект.
пространственно-временной континуум.Фотоэлектрический эффект: описывает свет как электромагнитные волны и утверждает, что частота, а не интенсивность определяет, выбрасываются ли электроны, когда свет падает на металл, а более высокая частота означает, что выбрасываются более быстрые электроны. Ответ Эйнштейна: думайте о свете здесь как о частице (фотоне), а не о волне. Атомная теория: Эйнштейн объяснил броуновское движение как движение атомов и молекул, сталкивающихся друг с другом, и рассчитал размер атомов на основе своих наблюдений, закрепив представление об атомах для сомневающихся ученых.Специальная теория относительности: Эйнштейн показал, что время и пространство относительны в зависимости от системы отсчета наблюдателя. Диаграмма иллюстрирует фотоэлектрический эффект.
Антиматерия
Апрель 2005 г. (стр. 10–13)
Автор: Брайан Рориг
Химия Связи: Атомная теория, ядерная
Описание: Дает определение антиматерии и устанавливает существование частиц антиматерии для каждой известной частицы во Вселенной. Обсуждается история открытия частиц антиматерии, их существование во Вселенной, огромные инструменты, необходимые для создания этих частиц (Стэнфордский линейный ускоритель и ЦЕРН), и энергия, возникающая при столкновении этих частиц и античастиц.Говорит о том, как создается антиматерия для использования в позитронно-эмиссионной спектроскопии (ПЭТ) сканирования тела.
Обсуждается история открытия частиц антиматерии, их существование во Вселенной, огромные инструменты, необходимые для создания этих частиц (Стэнфордский линейный ускоритель и ЦЕРН), и энергия, возникающая при столкновении этих частиц и античастиц.Говорит о том, как создается антиматерия для использования в позитронно-эмиссионной спектроскопии (ПЭТ) сканирования тела.
MysteryMatters: сканирующая электронная микроскопия раскрывает тайну!
Декабрь 2003 г. (стр. 17–19)
Автор: Тим Грэм
Химические связи: Атомная теория, реакции
Описание: Использование электронной микроскопии рассеяния (РЭМ) для анализа химического состава дефектного лакокрасочного покрытия автомобиля. На схематической схеме показаны основы работы СЭМ, результаты анализа краски и ответы на вопрос о причине брака краски.
Структура атома – Атомная структура – AQA – GCSE Chemistry (Single Science) Revision – AQA
10rf1l3sw34.0.0.0.1:0.1.0.$0.$2.$0″> Субатомные частицыЯдра всех атомов содержат субатомные частицы, называемые протонами. Ядра большинства атомов также содержат нейтроны.
Структура атома углерода, не в масштабеМассы субатомных частиц очень малы. Вместо того, чтобы записывать их фактические массы в килограммах, мы часто используем их относительные массы. Относительная масса протона равна 1, а частица с относительной массой меньше 1 имеет меньшую массу.
| 0.1:0.1.0.$0.$2.$4.$1.$0.$0″> субатомных частиц | Относительная масса | Относительная заряд |
|---|---|---|
| Протон 1 | ||
| Нейтрон 1 | 10rf1l3sw34.0.0.0.1:0.1.0.$0.$2.$4.$2.$1.$2″> 0 | |
| Электронно Очень маленькие | -1 |
Масса электрона очень мала по сравнению с протоном или нейтроном. Поскольку ядро содержит протоны и нейтроны, большая часть массы атома сосредоточена в его ядре.
Протоны и электроны имеют электрические заряды, которые равны и противоположны друг другу.
Помните, что P ротонов являются 0.1:0.1.0.$0.$2.$7.1.$3″> P положительными, а N нейтронов N нейтральными.
Атомная структура — Викиверситет
Атом — небольшая часть элемента, участвующая в химических реакциях. Он состоит из трех субатомных структур, называемых протонов , нейтронов и электронов .
Субатомные структуры:
_________________________________________
Частица: Заряд: Масса:
Протон +1 1 *u
Нейтрон 0 1 *u
Электрон -1 1 / 1836*у
Позитрон +1. 1/1836*у
Ядро в центре атома состоит из протонов и нейтронов. Вокруг ядра вращаются электроны.
Модель атома лития
Ядро в центре атома состоит из протонов и нейтронов. Вокруг ядра вращаются электроны. Каждый уникальный элемент имеет атомный номер, равный количеству содержащихся в нем протонов. В природе встречается 94 элемента (от 1 до 94).
и другие искусственно созданные (95+..)
Каждый элемент имеет атомный вес для наиболее часто встречающегося изотопа. Атомный вес = количество протонов + количество нейтронов.
См.: Периодическая таблица.
В стабильном незаряженном атоме количество электронов будет равно количеству протонов.Если число электронов изменится, атом станет ионизированным.
и получить либо положительный (меньше электронов)
или отрицательный (большие электроны) заряд.
В природе встречается 94 элемента (от 1 до 94).
и другие искусственно созданные (95+..)
Каждый элемент имеет атомный вес для наиболее часто встречающегося изотопа. Атомный вес = количество протонов + количество нейтронов.
См.: Периодическая таблица.
В стабильном незаряженном атоме количество электронов будет равно количеству протонов.Если число электронов изменится, атом станет ионизированным.
и получить либо положительный (меньше электронов)
или отрицательный (большие электроны) заряд.
Один и тот же элемент может существовать в разных формах, причем каждая форма имеет одинаковую атомный номер, но разные массовые числа. Эти формы называются изотопами . Изотопы, которые не могут распадаться в течение определенного периода времени, называются стабильными изотопами . А изотопы, которые могут распадаться в течение определенного периода времени, называются нестабильными (или радиоактивными ) изотопами.Например :
1 2 3
1ч 1ч 1ч
Протиум. Дейтерий. Тритий.
Дейтерий. Тритий.
Тритий — нестабильный изотоп водорода.
Модель Бора Считается, что электроны движутся вокруг ядра по фиксированным оболочкам (орбитам) на различных энергетических уровнях . Эти уровни могут быть обозначены как оболочки K L M N …….. или 1 2 3 4 ……….. Орбиты . На первом уровне всего 2 электрона. Второй уровень может содержать 6 электронов. Максимальное количество электронов, которые могут занимать одну оболочку s, определяется по формуле 2nî или 2n в квадрате, где n — номер оболочки
Когда электроны возбуждены, они могут перемещаться между оболочками. По мере удаления от ядра энергетические уровни увеличиваются. Электроны имеют собственную энергию, и энергия увеличивается с увеличением значения n или орбиты.
Конфигурация электронов, занимающих наименьшее количество пространства (модель Бора), называется основным состоянием .Но когда электроны возбуждаются (получая электричество, тепло), они перескакивают на более высокий уровень.
Это состояние атома называется возбужденным состоянием . Когда электроны возвращаются в основное состояние, они выделяют энергию.
Все энергетические уровни содержат подуровней , известных как s p d f .
Подуровень S может содержать 2 электрона. (Одна пара.)
P может содержать 6 электронов. (Три пары.)
D может содержать 10 электронов.(Пять пар.)
F может содержать 14 электронов. (Семь пар.)
Первая оболочка имеет только подуровень s и поэтому имеет только 2 электрона Вторая оболочка имеет оба подуровня s и p и может содержать 8 электронов. Третья оболочка имеет подуровни s, p и d и может содержать 18 электронов. Четвертая и последняя оболочка имеет подуровни s, p, d и f и может содержать 32 электрона.
- Области вокруг ядра, в которых вероятность нахождения электрона определенного энергетического уровня наиболее высока, называются орбиталями.2 число электронов.
- Форма орбитали зависит от подуровня.

- Валентные электроны вращаются в валентных оболочках.
- Электроны, которые могут вступить в реакцию, находятся только на последнем уровне.
- Эти электроны называются валентными электронами. Максимальное число
валентных электронов равно 8. Валентность определяет, сколько электронов атом должен одолжить или одолжить. Все части атомов, кроме последней орбиты, называются ядром.
- Формула электронной точки представляет валентные электроны.
Примеры: . .
. Н . Пунктирная формула азота.
.
Энергия ионизации — это количество энергии, необходимое для удаления или добавления электрона из газообразного атома или иона. Энергия ионизации зависит от числа протонов в ядре и экранирования (экранирования) внутренних электронов.
- ↑ «Три изотопа водорода — видео и стенограмма урока | Study.com». Study.com .Проверено 18 сентября 2018 г. .

Атомная структура и свойства — AP Chemistry
Если вы считаете, что контент, доступный с помощью Веб-сайта (как это определено в наших Условиях обслуживания), нарушает одно или более ваших авторских прав, пожалуйста, сообщите нам, предоставив письменное уведомление («Уведомление о нарушении»), содержащее в информацию, описанную ниже, назначенному агенту, указанному ниже. Если университетские наставники примут меры в ответ на ан Уведомление о нарушении, он предпримет добросовестную попытку связаться со стороной, предоставившей такой контент средства самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении может быть направлено стороне, предоставившей контент, или третьим лицам, таким как в виде ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы существенно
искажать информацию о том, что продукт или деятельность нарушают ваши авторские права. Таким образом, если вы не уверены, что содержимое находится
на Веб-сайте или на который ссылается Веб-сайт, нарушает ваши авторские права, вам следует сначала обратиться к адвокату.
Таким образом, если вы не уверены, что содержимое находится
на Веб-сайте или на который ссылается Веб-сайт, нарушает ваши авторские права, вам следует сначала обратиться к адвокату.
Чтобы подать уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись владельца авторских прав или лица, уполномоченного действовать от его имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, как вы утверждаете, нарушает ваши авторские права, в \
достаточно подробно, чтобы преподаватели университета могли найти и точно идентифицировать этот контент; например, мы требуем
а
ссылку на конкретный вопрос (а не только название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
Отправьте жалобу нашему назначенному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
Сент-Луис, Миссури 63105
Или заполните форму ниже:
Атомная структура и периодическая таблица (3.1.1) | CIE IGCSE Chemistry Revision Notes 2020
Электронная структура
- Мы можем представить структуру атома двумя способами: используя диаграммы, называемые электрон оболочка диаграммы или записывая специальную запись конфигурация
- Электроны вращаются вокруг ядра в оболочках (или энергии уровней ), и каждая оболочка имеет различное количество энергии, связанное с ядром
- тогда больше энергии у снаряда.

- Электроны занимают ближайшую к ядру оболочку, которая может содержать только 2 электронов и которые входят отдельно
- Когда оболочка становится полной электронами, заполняют следующую оболочку
- Вторая оболочка может содержать 8 электронов, а третья оболочка также может содержать 8 электронов, и электроны организуются парами в этих оболочках
- Самая внешняя оболочка атома называется валентной оболочкой, и атом гораздо более стабилен, если ему удается полностью заполнить эту оболочку Электроны
- Расположение электронов в оболочках также можно объяснить с использованием номеров
- , есть четкий отношения между электронами внешней оболочки и как устроена Периодическая таблица
- Количество обозначений s в электронной конфигурации покажет количество электронных оболочек атома, показывая Период , в котором этот элемент находится в
- Последнее обозначение показывает количество внешних электронов, которые имеет атом, показывая Группу этого элемента В
- элементов в
- в же Группа У Time Количество внешних Shell
- 8
- Все атомы элементов группы 8/0 имеют 8 электронов на своих внешних оболочках, за исключением гелия, у которого их 2.
 Но так как у гелия всего 2 электрона и, таким образом, первая оболочка заполнена (единственная оболочка), таким образом, это внешняя оболочка, поэтому гелий также имеет полную валентную оболочку
Но так как у гелия всего 2 электрона и, таким образом, первая оболочка заполнена (единственная оболочка), таким образом, это внешняя оболочка, поэтому гелий также имеет полную валентную оболочку - Все благородные газы нереакционноспособны как они имеют полные внешние оболочки и, таким образом, очень стабильны
- Все элементы хотят заполнить свои внешние оболочки электронами, поскольку это гораздо более стабильная и желательная конфигурация
Гайнутдинов Р.В., Ширяев А.А., Бойкоц В.С., Федорчук Ю. Протяженные дефекты в природных алмазах: исследование с помощью атомно-силовой микроскопии. Диам. Относ. Матер. 40 , 17–23 (2013).
Сусло, С.Дж. Х. и Балмер, Р. С. Алмаз как электронный материал. Матер. Сегодня 11 , 22–28 (январь – февраль 2008 г.).
Дхомкар, С., Хеншоу, Дж., Джаякумар, Х. и Мерилес, К.А. Долгосрочное хранение данных в алмазе. науч. Доп. 2 , e1600911 (2016).
Артикул Google Scholar
Босак А., Чернышов Д., Криш М. и Дубровинский Л. Симметрия дефектов пластинок в алмазе: новое понимание синхротронного света. Акта Крист. B66 , 493–496 (2010).
Артикул Google Scholar
“>
8 Электронная конфигурация для хлора 8
8
Период: красные цифры внизу показывают количество обозначений, равное 3, показывая, что атом хлора имеет 3 оболочки электронов
Группа: Зеленое поле выделяет последнее обозначение, равное 7, показывая, что атом хлора имеет 7 внешних электронов
Положение хлора в периодической таблице
90 398 Благородные газы
Инертные газы находятся в периодической таблице в группе 8 /0
Электронная конфигурация первых двадцати элементов Примечание: хотя третья оболочка может содержать до 18 электронов, заполнение оболочек происходит по более сложной схеме после калия и кальция.Для этих двух элементов третья оболочка содержит 8, а оставшиеся электроны (из соображений стабильности) сначала занимают четвертую оболочку, прежде чем заполнить третью оболочку.
Визуализация атомной структуры и локального химического состава пластинок в природном алмазе типа Ia
Госс, Дж. П., Бриддон, П. Р. и Папагианнидис, С. Междоузельный азот и его комплексы в алмазе. Физ. Ред. B 70 , 235208 (2004 г.).
Артикул Google Scholar
Раман С. В. и Нилакантан П. Отражение рентгеновских лучей с изменением частоты.Часть II. Дело об алмазе. Проц. Инд. акад. науч. A11 , 389–397 (1940).
Evans, T. & Phaal, C. Дефекты в бриллиантах типа I и типа II. Проц. Р. Соц. А А270 , 535–552 (1962).
Google Scholar
Соболев Е. В., Лисоиван В. И., Ленская С. В. Связь между «пичковыми» дополнительными отражениями в лау-картинах природных алмазов и их оптическими свойствами. Сов. физ. Докл. 12 , 665–668 (1968).
Госс, Дж. и др. Протяженные дефекты в алмазе: интерстициальная пластинка.
 Физ. Ред. B 67 , 165208 (2003 г.).
Физ. Ред. B 67 , 165208 (2003 г.).Артикул Google Scholar
Барри Дж., Бурсилл Л. и Хатчисон Дж. О структуре дефектов пластин {100} в алмазе типа la. Фил. Маг. А 51 , 15–49 (1985).
КАС Статья Google Scholar
Ланг, А.Предлагаемая структура пластинок примеси N в алмазе. Проц. физ. соц. 84 , 871–876 (1964).
КАС Статья Google Scholar
Хамбл П., Маккензи Дж. и Олсен А. Дефекты тромбоцитов в природном алмазе. I. Измерение смещения. Фил. Маг. А 52 , 605–621 (1985).
КАС Статья Google Scholar
Миранда, К., Антонелли, А. и Нуньес, Р. Микроскопическая модель пластинок в алмазе, основанная на дефектах упаковки.
 Физ. Преподобный Летт. 93 , 265502 (2004).
Физ. Преподобный Летт. 93 , 265502 (2004).КАС Статья Google Scholar
Bursill, L. A. & Glaisher, R. W. Агрегация и растворение мелких и протяженных дефектных структур в алмазе типа Ia. утра. Мин. 70 , 608–618 (1985).
КАС Google Scholar
Бергер С.и Пенникук, С. Обнаружение N на {100} тромбоцитах в алмазе. Природа 298 , 635–637 (1982).
КАС Статья Google Scholar
Fallon, P., Brown, L., Barry, J. & Bruley, J. Определение и характеристика N в пластинах природного алмаза. Фил. Маг. А 72 , 21–37 (1995).
КАС Статья Google Scholar
Брюли, Дж.Обнаружение N на {100} тромбоцитах в алмазе типа IaA/B.
 Фил. Маг. лат. 66 , 47–56 (1992).
Фил. Маг. лат. 66 , 47–56 (1992).КАС Статья Google Scholar
Кифлави И., Брюли Дж., Луйтен В. и Ван Тенделу Г. «Природные» и «искусственные» пластины в алмазах типа Ia. Фил. Маг. B 78 , 299–314 (1998).
КАС Статья Google Scholar
Коули, Дж.М. и Муди А.Ф. Рассеяние электронов атомами и кристаллами. I. Новый теоретический подход. Акта Крист. 10 , 609–619 (1957).
КАС Статья Google Scholar
Stadelmann, P.A. Интегрированный комплекс компьютерных программ для обработки электронных микрофотографий биологических структур. Ультрамикроскопия 21 , 131 (1987).
КАС Статья Google Scholar
“>Эгертон, Р. Ф. Электронная спектроскопия потерь энергии в электронном микроскопе 2-е изд., 277-283 (Пленум, Нью-Йорк, штат Нью-Йорк, 1996).
Брайдсон Р., Браун, Л. М. и Брюли, Дж. Характеристика локальной азотной среды на пластинах в алмазе типа IaA/B. J. Microsc. 189 , 137–144 (1998).
КАС Статья Google Scholar
Фелтон, С. и др. Исследование методом электронного парамагнитного резонанса N дефектов внедрения в алмазе. J. Phys. конд. Материя 21 , 364212 (2009).

КАС Статья Google Scholar
Савада Х.и другие. Визуализация сверхвысокого разрешения с помощью микроскопа с атомарным разрешением JEM-ARM300F. Новости JEOL 49 , 51–58 (2014).
Google Scholar
Землин Ф., Вайс К., Шиске П., Кунат В. и Герман К. Х. Выравнивание электронных микроскопов высокого разрешения без комы с помощью оптических дифрактограмм. Ультрамикроскопия 3 , 49–60 (1978).
Артикул Google Scholar
Килаас, Р.Оптимальные и близкие к оптимальным фильтры в электронной микроскопии высокого разрешения. J. Microsc. 190 , 45–51 (1998).
Артикул Google Scholar
де ла Пенья, Ф. и др. hyperspy/hyperspyv1.

Косгрифф, Э.К., Оксли, М.П., Аллен, Л.Дж. и Пенникук, С.Дж. Пространственное разрешение изображений с использованием спектроскопии потерь в сердечнике в сканирующем просвечивающем электронном микроскопе. Ультрамикроскопия 102 , 317–326 (2005).
КАС Статья Google Scholar

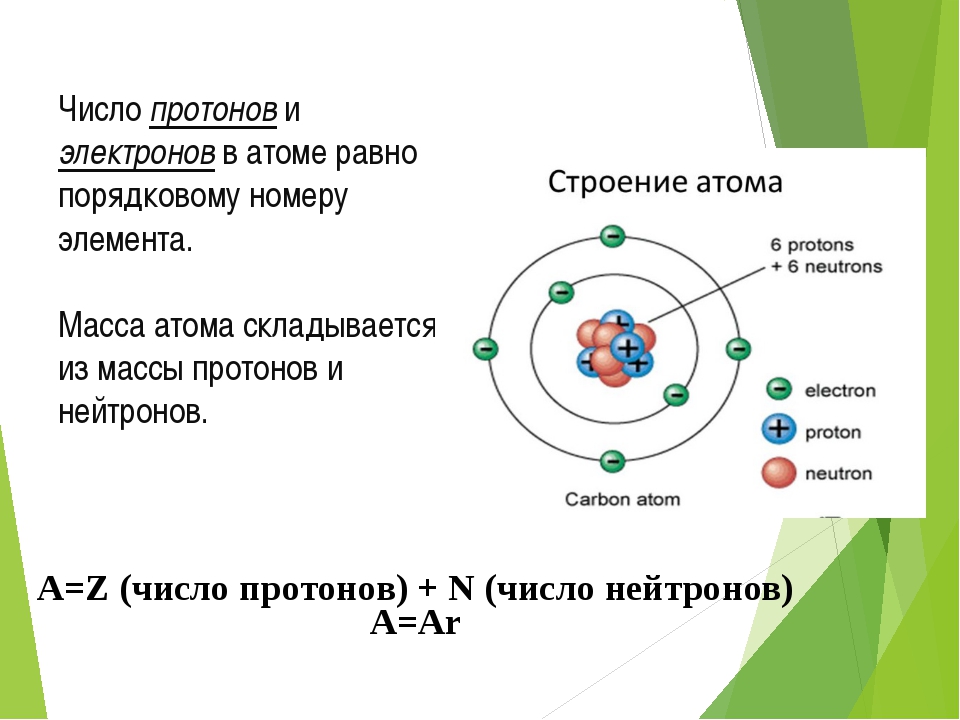
 4: Ядра атомов
4: Ядра атомов 7: Резюме главы
7: Резюме главы Дейтерий. Тритий.
Дейтерий. Тритий.



 Но так как у гелия всего 2 электрона и, таким образом, первая оболочка заполнена (единственная оболочка), таким образом, это внешняя оболочка, поэтому гелий также имеет полную валентную оболочку
Но так как у гелия всего 2 электрона и, таким образом, первая оболочка заполнена (единственная оболочка), таким образом, это внешняя оболочка, поэтому гелий также имеет полную валентную оболочку
 Физ. Ред. B 67 , 165208 (2003 г.).
Физ. Ред. B 67 , 165208 (2003 г.). Физ. Преподобный Летт. 93 , 265502 (2004).
Физ. Преподобный Летт. 93 , 265502 (2004).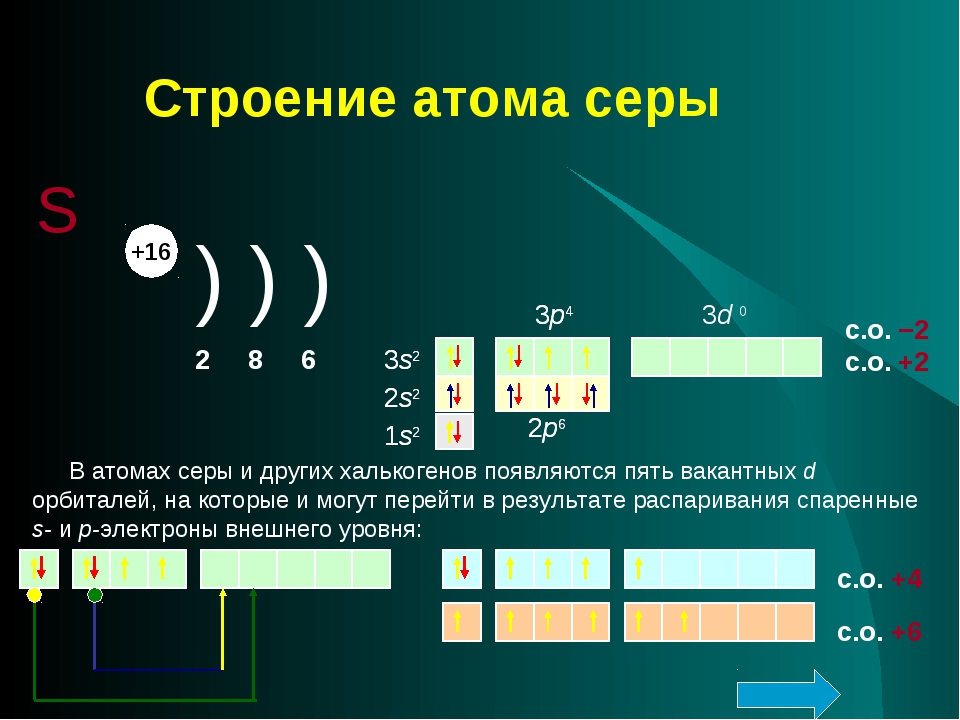 Фил. Маг. лат. 66 , 47–56 (1992).
Фил. Маг. лат. 66 , 47–56 (1992).
