Сравните строение и свойства атомов. Химия. 8 класс. Габриелян. ГДЗ. § 10. Глава 1. Вопрос 1. – Рамблер/класс
Сравните строение и свойства атомов. Химия. 8 класс. Габриелян. ГДЗ. § 10. Глава 1. Вопрос 1. – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания “Останкино”?
Помогите сравнить строение и свойства атомов:
а) углерода и кремния; б) кремния и фосфора.
ответы
Вот твое сравнение.
а) Сравним строение и свойства атомов углерода и кремния
По строению электронной оболочки эти элементы схожи: оба на последнем энергетическом уровне имеют по 4 электрона, но у углерода 2 энергетических уровня, а у кремния 3. Т.к. число электронов на внешнем уровне одинаково, то и свойства этих элементов будут похожи, но радиус атома кремния больше, поэтому по сравнению с углеродом он будет проявлять больше металлических свойств.
б) Сравним строение и свойства атомов кремния и фосфора:
Атомы кремния и фосфора имеют по 3 энергетических уровня, причем у каждого последний уровень незавершенный, но у кремния на последнем энергетическом уровне 4 электрона, а у фосфора 5, поэтому радиус атома фосфора меньше и он в большей степени проявляет неметаллические свойства, чем кремний.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Психология
ЕГЭ
10 класс
9 класс
похожие вопросы 5
Влияние воздуха на горение свечи. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 2. Опыт 3.
Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 2. Опыт 3.
Попробуйте провести следующий опыт. Влияние воздуха на горение свечи.
Вставьте стеклянную трубку с оттянутым концом в резиновую (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Приготовление раствора сахара и расчёт его массовой доли в растворе. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 5.
Попробуйте провести следующий опыт. Приготовление раствора
сахара и расчёт его массовой доли в растворе.
Отмерьте мерным (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Здравствуйте.
(Подробнее…)
Химия
Это правда, что будут сокращать иностранные языки в школах?
Хочется узнать, когда собираются сократить иностранные языки в школе? Какой в итоге оставят? (Подробнее…)
ШколаНовостиИностранные языки
11. Выпишите слово, в котором на месте пропуска пишется буква Е. Русский язык ЕГЭ-2017 Цыбулько И. П. ГДЗ. Вариант 12.
Выпишите слово, в котором на месте пропуска пишется буква Е. Русский язык ЕГЭ-2017 Цыбулько И. П. ГДЗ. Вариант 12.
11.
Выпишите слово, в котором на месте пропуска пишется буква Е.
произнос., шь (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Программа по химии
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ИСПЫТАНИЙ
ПО ХИМИИ
1. Общая химия
Основные химические понятия. Атомно-молекулярное учение. Атомы. Молекулы. Химический элемент. Простые и сложные вещества. Относительные атомные и молекулярные массы. Моль-единица количества вещества. Молярная масса. Массовая, объемная, молярная доли компонента (элемента, вещества) в системе.
Основные законы химии. Закон сохранения массы вещества. Закон постоянства состава. Закон Авогадро. Молярный объем газа. Относительная плотность газов (по водороду, кислороду, воздуху).
Основные классы неорганических соединений и типы химических реакций. Оксиды несолеобразующие и солеобразующие (основные, кислотные, амфотерные). Названия, химические свойства, получение. Основания. Названия, химические свойства, получение. Кислоты. Названия, химические свойства, получение. Понятие гидроксид. Основные, кислотные и амфотерные гидроксиды. Соли (средние, кислые, основные). Названия, химические свойства, получение солей. Основные типы химических реакций (соединения, замещения, разложения, обмена).
Оксиды несолеобразующие и солеобразующие (основные, кислотные, амфотерные). Названия, химические свойства, получение. Основания. Названия, химические свойства, получение. Кислоты. Названия, химические свойства, получение. Понятие гидроксид. Основные, кислотные и амфотерные гидроксиды. Соли (средние, кислые, основные). Названия, химические свойства, получение солей. Основные типы химических реакций (соединения, замещения, разложения, обмена).
Строение вещества. Строение атома. Понятие о составе атома и ядра атома. Энергетические уровни и подуровни, очередность их заполнения. Электронное строение атомов элементов 1,2,3 и 4 периодов периодической системы. s, p и d элементы. Распределение валентных электронов по атомным орбиталям, условное графическое изображение.
Периодический закон и периодическая система Д.И. Менделеева. Современная формулировка периодического закона. Порядковый номер элемента. Связь структуры периодической системы со сведениями о строении атомов. Большие и малые периоды, главные и побочные подгруппы (А и Б).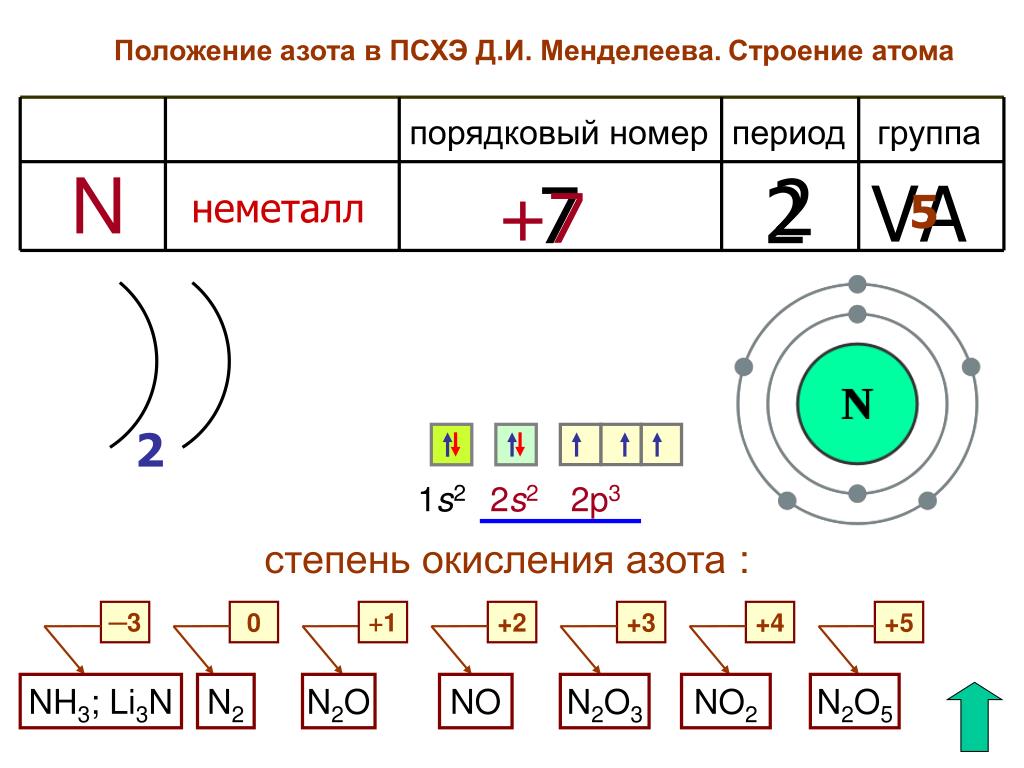 Зависимость свойств элементов от положения в периодической системе.
Зависимость свойств элементов от положения в периодической системе.
Химическая связь. Типы химических связей: ковалентная, ионная, металлическая, водородная, донорно-акцепторная. Примеры соединений с
различными типами химической связи. Понятия электроотрицательности и относительной электроотрицательности. Полярная и неполярная ковалентная связь. Способы перекрывания электронных облаков при образовании ковалентной связи (σ- и π- связь). Структурные формулы молекул.
Окислительно-восстановительные реакции (ОВР). Понятия: окислитель, восстановитель, окисление, восстановление. Определение степеней окисления атомов элементов в соединениях. Составление уравнений ОВР методом электронного баланса.
Общие закономерности химических реакций. Тепловые эффекты химических реакций. Эндо- и экзотермические реакции. Термохимические уравнения. Скорость химических реакций в гомогенных и гетерогенных системах. Зависимость скорости от природы реагирующих веществ, концентрации, температуры. Катализаторы. Примеры каталитических реакций. Необратимые и обратимые реакции. Химическое равновесие. Константа равновесия. Смещение химического равновесия, принцип Ле-Шателье.
Примеры каталитических реакций. Необратимые и обратимые реакции. Химическое равновесие. Константа равновесия. Смещение химического равновесия, принцип Ле-Шателье.
Растворы. Образование растворов. Растворимость веществ. Тепловые эффекты при растворении. Массовая доля растворенного вещества, процентная концентрация. Растворы электролитов. Электролитическая диссоциация. Степень электролитической диссоциации. Сильные и слабые электролиты. Реакции в растворах электролитов. Гидролиз солей.
2. Неорганическая химия
Водород. Получение, физические и химические свойства, применение.
Галогены. Общая характеристика элементов: электронное строение атомов, степени окисления атомов элементов в соединениях, нахождение в природе, физические и химические свойства. Хлор. Получение, физические и химические свойства. Соединения хлора. Хлороводород, хлороводородная (соляная) кислота и ее соли. Применение хлора и его соединений.
Элементы главной подгруппы VI группы. Общая характеристика: электронное строение атомов, степени окисления в соединениях с водородом, оксиды и гидроксиды серы, селена, теллура. Кислород. Нахождение в природе, получение, физические и химические свойства, применение. Соединения: сероводород, оксид серы (IV), сернистая кислота, оксид серы (VI), серная кислота, физические и химические свойства, применение. Химические основы производства серной кислоты контактным способом.
Общая характеристика: электронное строение атомов, степени окисления в соединениях с водородом, оксиды и гидроксиды серы, селена, теллура. Кислород. Нахождение в природе, получение, физические и химические свойства, применение. Соединения: сероводород, оксид серы (IV), сернистая кислота, оксид серы (VI), серная кислота, физические и химические свойства, применение. Химические основы производства серной кислоты контактным способом.
Вода. Нахождение в природе, получение, физические и химические свойства. Кристаллогидраты.
Элементы главной подгруппы V группы. Общая характеристика: электронное строение атомов, степени окисления в соединениях с водородом, оксиды. Азот. Нахождение в природе, получение, физические и химические свойства. Гидроксид аммония, соли аммония, химические свойства. Применение аммиака и солей аммония. Оксиды азота (I, II, III, IV, V). Краткие характеристики химических свойств. Азотная кислота. Получение. Физические и химические свойства. Соли азотной кислоты. Применение азотной кислоты и нитратов. Фосфор. Нахождение в природе. Физические и химические свойства. Оксид фосфора, ортофосфорная кислота, физические и химические свойства. Соли ортофосфорной кислоты. Применение соединений фосфора.
Фосфор. Нахождение в природе. Физические и химические свойства. Оксид фосфора, ортофосфорная кислота, физические и химические свойства. Соли ортофосфорной кислоты. Применение соединений фосфора.
Элементы главной подгруппы IV группы. Общая характеристика элементов. Степени окисления в соединениях. Соединения с водородом, оксиды. Углерод. Нахождение в природе, физические и химические свойства. Применение. Оксиды углерода ( II, IV). Угольная кислота, физические и химические свойства, применение. Кремний, оксид кремния (IV), кремниевая кислота, физические и химические свойства, применение; соли кремниевой кислоты, их гидролиз.
Общие химические свойства металлов. Положение металлов в периодической системе, физические и химические свойства. Ряд стандартных электродных потенциалов металлов. Взаимодействие металлов с водой, некоторыми кислотами (соляной, серной, азотной), растворимыми щелочами. Коррозия металлов. Способы борьбы с коррозией. Основные способы получения металлов. Электролиз водных растворов и расплавов солей.
Элементы главной подгруппы I группы. Общая характеристика элементов. Нахождение в природе, получение, химические свойства.
Элементы главной подгруппы II группы. Общая характеристика элементов. Нахождение в природе, получение, химические свойства. Применение соединений кальция. Жесткость воды и способы ее устранения.
Алюминий. Общая характеристика элемента на основе положения в периодической системе и строения атома. Нахождение в природе, получение, химические свойства. Амфотерность оксида и гидроксида алюминия. Применение алюминия в технике.
Железо и его соединения. Общая характеристика элемента, нахождение в природе, получение, химические свойства. Соединения Fe(II) и Fe(III). Химические реакции, на которых основано производства чугуна и стали.
Общая характеристика 3d-элементов (медь, цинк, титан, хром) на основе положения в периодической системе. Возможные степени окисления. Оксиды, гидроксиды, их характер. Отношение к воде, кислотам, щелочам.
3. Органическая химия
Органическая химия
Теория химического строения органических соединений. Основные положения теории химического строения органических соединений, сформулированной А. М. Бутлеровым. Изомерия. Электронная природа химических связей в молекулах. Механизм разрыва ковалентной связи в молекулах органических веществ: ионный или гетеролитический, радикальный или гомолитический.
Гомологический ряд предельных углеводородов (алканов). Номенклатура алканов. Электронное строение и пространственное строение (Sp-гибридизация). Физические и химические свойства. Метан. Применение в технике.
Гомологический ряд этиленовых углеводородов (алкенов). Номенклатура алкенов. Электронное строение и пространственное строение (Sp-гибридизация). Физические и химические свойства. Этилен. Применение этиленовых углеводородов.
Общие понятия химии высокомолекулярных соединений (BMC): мономер, полимер, элементарное звено, степень полимеризации. Реакции полимеризации, поликонденсации. Полиэтилен: химические свойства, получение, применение. Природный и синтетический каучуки.
Природный и синтетический каучуки.
Гомологический ряд ацетиленовых углеводородов (алкинов). Номенклатура алкинов. Электронное строение и пространственное строение (Sp-гибридизация, тройная связь). Получение ацетилена карбидным способом и из метана, физические и химические свойства. Применение.
Ароматические углеводороды. Номенклатура углеводородов ряда бензола. Бензол: электронное и пространственное строение (σ- и π-связи, бензольное ядро). Получение бензола Физические и химические свойства, применение. Толуол. Физические и химические свойства. Понятие о взаимном влиянии атомов.
Природные источники углеводородов. Природный и попутный нефтяной газ, уголь, нефть. Перегонка нефти. Крекинг нефтепродуктов: термический и каталитический.
Кислородосодержащие органические соединения.
Спирты. Гомологический ряд предельных одноатомных спиртов. Номенклатура. Физические и химические свойства. Этанол: получение, физические и химические свойства, применение. Многоатомный спирт глицерин: физические и химические свойства, применение.
Фенол. Физические свойства. Строение фенола, взаимное влияние атомов в молекуле. Химические свойства фенола в сопоставлении со свойствами спиртов и бензола. Применение.
Альдегиды. Гомологический ряд альдегидов. Номенклатура. Электронное строение. Физические и химические свойства. Получение и применение муравьиного и уксусного альдегидов.
Карбоновые кислоты. Гомологический ряд одноосновных карбоновых кислот. Название предельных одноосновных карбоновых кислот. Электронное строение карбоксильной группы. Физические и химические свойства кислот. Некоторые представители одноосновных карбоновых кислот: муравьиная, уксусная, стеариновая, олеиновая.
Сложные эфиры. Получение (реакция этерификации), номенклатура, физические и химические свойства. Жиры как представители сложных эфиров: нахождение в природе, строение, физические и химические свойства, химическая переработка.
Углеводы. Моносахариды, ди- и полисахариды. Глюкоза-представитель моносахаридов: строение, физические и химические свойства, применение. Сахароза – важнейший представитель дисахаридов: физические свойства и нахождение в природе, строение и химические свойства. Гидролиз сахарозы. Полисахариды: крахмал и целлюлоза. Физические свойства и нахождение в природе. Строение и химические свойства. Применение. Понятие об искусственных волокнах.
Сахароза – важнейший представитель дисахаридов: физические свойства и нахождение в природе, строение и химические свойства. Гидролиз сахарозы. Полисахариды: крахмал и целлюлоза. Физические свойства и нахождение в природе. Строение и химические свойства. Применение. Понятие об искусственных волокнах.
Азотсодержащие органические соединения.
Амины. Первичные, вторичные, третичные. Номенклатура. Физические и химические свойства: амины как органические основания, их реакции с водой и кислотами. Анилин – простейший представитель ароматических аминов. Физические и химические свойства. Получение из нитробензола по реакции Н.И. Зинина. Применение.
Аминокислоты. Номенклатура. Физические и химические свойства. Понятие о пептидной (амидной) связи. Синтетическое волокно капрон. Белки. Альфа-аминокислоты как структурные единицы белков. Строение белков: первичная, вторичная, третичная структуры. Биологическая роль белков.
Обзор атомной структуры и ее свойств.
Джон Дальтон в 1800 году был тем, кто объяснил закон о множественных пропорциях. Атом представляет собой фундаментальные единицы, которые можно разделить на субатомные частицы. Это приводит к развитию атомных моделей. В 1898 году Томсон предложил модель, утверждая, что масса атома равномерно распределена или распределена по нему, но эксперимент Резерфорда по рассеянию опровергает это утверждение в 1909 году. вращение электронов вокруг него. Кроме того, модель Бора не может объяснить структуру атома, состоящего из множества электронов, и не подчиняется принципу неопределенности Гейзенберга. Позже в 1926 Было предложено уравнение Шредингера. Согласно модели, основанной на квантовой теории, ясно, что количество электронов расположено в соответствующих оболочках. Размер атома измеряется в ангстремах, то есть 10 -10 метров.
Атом представляет собой фундаментальные единицы, которые можно разделить на субатомные частицы. Это приводит к развитию атомных моделей. В 1898 году Томсон предложил модель, утверждая, что масса атома равномерно распределена или распределена по нему, но эксперимент Резерфорда по рассеянию опровергает это утверждение в 1909 году. вращение электронов вокруг него. Кроме того, модель Бора не может объяснить структуру атома, состоящего из множества электронов, и не подчиняется принципу неопределенности Гейзенберга. Позже в 1926 Было предложено уравнение Шредингера. Согласно модели, основанной на квантовой теории, ясно, что количество электронов расположено в соответствующих оболочках. Размер атома измеряется в ангстремах, то есть 10 -10 метров.
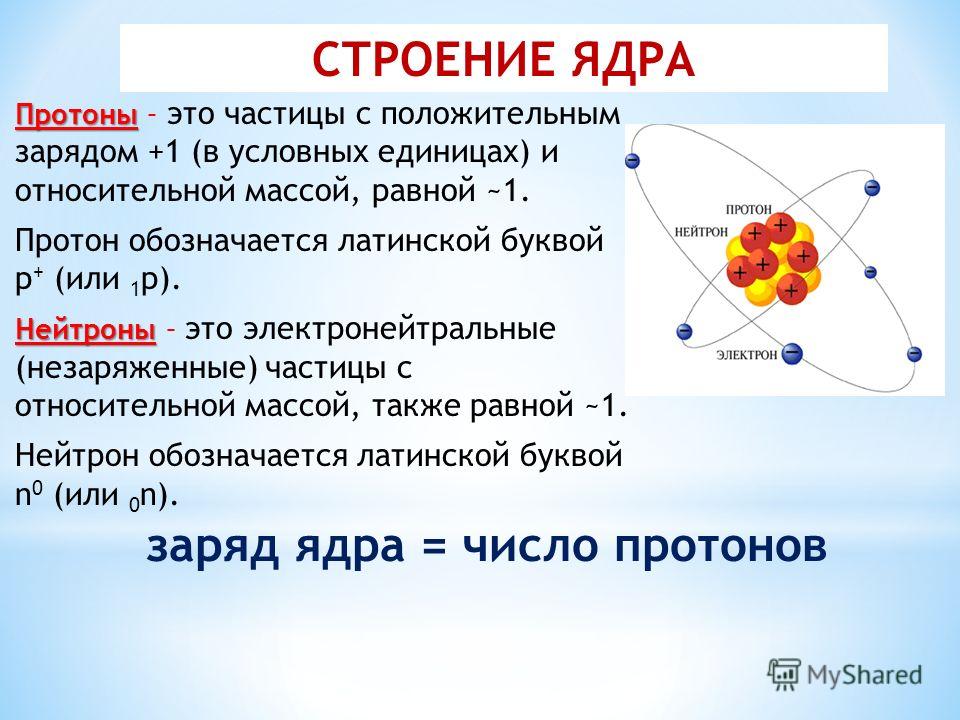
Каждый атом имеет ядер и электронов связанных с ним. протонов и нейтронов , находящихся внутри ядра, известны как нуклонов . В основном ядро отвечает за основную составляющую массы атома. Структура атома в основном окружает электрон, протон и нейтрон. Поведение атома связано с орбиталью, на которой вращаются электроны, а химические свойства определяются оболочками.
В основном ядро отвечает за основную составляющую массы атома. Структура атома в основном окружает электрон, протон и нейтрон. Поведение атома связано с орбиталью, на которой вращаются электроны, а химические свойства определяются оболочками.
Общая структура атома
Общая структура атомаЭлектрон заряжен отрицательно, протон имеет положительный заряд, тогда как нейтрон нейтрален. Если в атоме одинаково сбалансированы электроны и протоны, то атом становится нейтральным, иначе это приводит к образованию иона. По наибольшему содержанию электронов и протонов можно описать положительный или отрицательный заряд атома.
Электромагнитная сила связывает электроны и ядра. Протоны и нейтроны состоят из ядерной силы, притягивающей друг друга внутри ядра. Наличие ряда протонов указывает на атомный номер. Точно так же количество нейтронов описывает изотопы. Магнитные свойства элемента могут быть связаны с наличием в нем количества электронов. Взаимодействие и отвлечение атомов друг на друга приводит к физическим изменениям в окружающей среде. Это можно сделать путем химической связи между ними.
Взаимодействие и отвлечение атомов друг на друга приводит к физическим изменениям в окружающей среде. Это можно сделать путем химической связи между ними.
Существует квантовое состояние, в котором протон должен присутствовать в ядре, но оно должно быть разным для каждого протона, то есть следует принципу запрета Паули. Поэтому протоны, нейтроны и электроны относятся к категории фермионов. По классификации заряда нейтроны по сравнению с протонами тяжелее по массе. Электроны имеют массу 9,109382911*10 -28 грамм. Протон или нейтрон по сравнению с электроном в 1836 раз тяжелее.
Поскольку электрон стремится вращаться, чтобы обрести устойчивость, он перескакивает с одной орбитали на другую, что делает поведение атомных спектров столь непредсказуемым. Этот метод известен как квантовый скачок. Когда это происходит с более высокого уровня на следующий более низкий уровень, происходит испускание излучения в терминах фотонов.
Свойства атома:На основании количества протонов, электронов и нейтронов можно описать свойства атома:
(1) Атомный номер:
Наличие количества протонов в ядре определяет его атомный номер относится к химическим свойствам атома. Символ, используемый для представления атомного номера, — Z. Четко указано, что на атомный номер влияют положительно заряженные частицы. Если элементы состоят из равного количества протонов и электронов, получается нейтральный атом. Углерод является одним из нейтральных атомов.
Символ, используемый для представления атомного номера, — Z. Четко указано, что на атомный номер влияют положительно заряженные частицы. Если элементы состоят из равного количества протонов и электронов, получается нейтральный атом. Углерод является одним из нейтральных атомов.
Пример: Z = 6 представляет собой углерод.
(2) Атомная масса:
В основном вес или масса атома зависит от его ядра. Масса ядра зависит от суммы масс протона и нейтрона. Этот тип массы известен как атомная масса. Символ А обозначает атомную массу. Если нейтроны и протоны различаются по количеству, то это называется изотопами.
Пример:
Водород является наилучшим подходящим примером, который может относиться к этому условию. На основе нейтронов классифицируется как
(a) Протий: Состоит из 99,985% атома водорода с одним протоном.
Изотоп водорода-протий
(b) Дейтерий: Имеет один протон и один нейтрон.
Изотоп водорода-дейтерий
(c) Тритий: Он имеет два нейтрона и один протон. Естественно, это условие невозможно, его нужно сделать исходя из потребности.
Естественно, это условие невозможно, его нужно сделать исходя из потребности.
Изотоп водорода-тритий
(3) Радиоактивный:Изменение числа протонов и нейтронов приводит к изменению ядра. Тогда соответствующий атом известен как радиоактивный. Это состояние есть не что иное, как нестабильное ядро. На этом этапе атомы будут находиться в одном и том же состоянии, пока оно не станет стабильным. Элементы с атомным номером больше 82 называются радиоактивными.
Пример: свинец
(4) Спин электронов: Существует свойство, касающееся вращения электронов, так как оно происходит под действием фермионов, оно занимает только половину целочисленного спина. Например, гелий является химическим элементом, основанным на количестве протонов, его атомный номер равен двум. Для того, чтобы занимать одну и ту же орбиту, ее надо крутить в разные стороны. Это приводит к движению электрического заряда, так что они рассматриваются как магнит в крошечной форме. У электронов есть магнитный момент, и он составляет почти 9,28*10 -24 джоулей на тесла.
У электронов есть магнитный момент, и он составляет почти 9,28*10 -24 джоулей на тесла.
Атомы, участвующие в движении электрона и в образовании связей для достижения стабильности приводят к образованию иона. В этом процессе атом, дающий, становится положительным, а тот, кто его берет, становится отрицательным.
(6) Относительная атомная масса:Поскольку количество протонов эквивалентно количеству нейтронов в углероде, что делает его нейтральным атомом, относительное значение атомной массы сравнительно среднее по отношению к массе одного атома углерода.
Резюме: В этой статье объясняются основы атомов и то, как их структура была классифицирована на основе концепции орбиталей, на основе субатомных частиц можно объяснить химические свойства атомов. В основном его цель состоит в том, чтобы дать основные детали структуры и разобраться с основными свойствами. То, как электрон, протон, нейтрон лежат в атоме и как соотносятся его массы, и заряды фермионов обсуждалось. Существует сильное влияние заряженных частиц в атоме. На основе зарядов рассмотрена классификация ионов и результаты эффекта увеличения и уменьшения субатомных частиц. Были обсуждены энергии, связанные между ядром и электронами.
То, как электрон, протон, нейтрон лежат в атоме и как соотносятся его массы, и заряды фермионов обсуждалось. Существует сильное влияние заряженных частиц в атоме. На основе зарядов рассмотрена классификация ионов и результаты эффекта увеличения и уменьшения субатомных частиц. Были обсуждены энергии, связанные между ядром и электронами.
Следовательно, атомы являются фундаментальными единицами любой базовой структуры, их классификация по субатомным частицам помогла выяснить наличие различных химических элементов в периодической таблице. На основе классификации мы можем иметь дело со свойствами основных атомов. Обычно мы используем графитовые карандаши в нашей повседневной деятельности. Вы когда-нибудь задумывались о том, как грифели соединяются и превращаются в цельный карандаш?
Перейдите по этой ссылке, чтобы узнать больше об архитектуре FPGA.
2.1A: Обзор атомной структуры
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 7293
Атомы состоят из частиц, называемых протонами, нейтронами и электронами, которые отвечают за массу и заряд атомов.
Цели обучения
- Обсудить электронные и структурные свойства атома
Ключевые положения
- Атом состоит из двух областей: ядра, которое находится в центре атома и содержит протоны и нейтроны, и внешней области атома, которая удерживает электроны на орбите вокруг ядра.
- Протоны и нейтроны имеют приблизительно одинаковую массу, около 1,67 × 10 −24 граммов, которую ученые определяют как одну атомную единицу массы (а.е.м.) или один дальтон.
- Каждый электрон имеет отрицательный заряд (-1), равный положительному заряду протона (+1).
- Нейтроны — это незаряженные частицы, находящиеся внутри ядра.
Ключевые термины
- атом : Наименьшее возможное количество вещества, которое все еще сохраняет свою идентичность как химический элемент, состоящий из ядра, окруженного электронами.
- протон : Положительно заряженная субатомная частица, входящая в состав ядра атома и определяющая атомный номер элемента.
 Он весит 1 а.е.м.
Он весит 1 а.е.м. - нейтрон : Субатомная частица, входящая в состав ядра атома. У него нет заряда. По массе он равен протону или весит 1 а.е.м.
Атом — это наименьшая единица вещества, сохраняющая все химические свойства элемента. Атомы объединяются, образуя молекулы, которые затем взаимодействуют, образуя твердые тела, газы или жидкости. Например, вода состоит из атомов водорода и кислорода, которые, объединившись, образуют молекулы воды. Многие биологические процессы посвящены расщеплению молекул на составные атомы, чтобы их можно было собрать в более полезную молекулу.
Атомные частицы
Атомы состоят из трех основных частиц: протонов, электронов и нейтронов. Ядро (центр) атома содержит протоны (положительно заряженные) и нейтроны (без заряда). Самые внешние области атома называются электронными оболочками и содержат электроны (отрицательно заряженные). Атомы обладают различными свойствами в зависимости от расположения и количества их основных частиц.
Атом водорода (H) содержит только один протон, один электрон и не содержит нейтронов. Это можно определить, используя атомный номер и массовое число элемента (см. понятие об атомных числах и массовых числах).
Структура атома : Элементы, такие как гелий, изображенные здесь, состоят из атомов. Атомы состоят из протонов и нейтронов, расположенных внутри ядра, с электронами на орбиталях, окружающих ядро.
Атомная масса
Протоны и нейтроны имеют примерно одинаковую массу, около 1,67 × 10 −24 граммов. Ученые определяют это количество массы как одну атомную единицу массы (аму) или один дальтон. Несмотря на то, что протоны имеют одинаковую массу, они заряжены положительно, а нейтроны заряда не имеют. Следовательно, количество нейтронов в атоме вносит значительный вклад в его массу, но не в его заряд.
Электроны намного меньше по массе, чем протоны, и весят всего 9,11 × 10 −28 граммов, или около 1/1800 атомной единицы массы. Следовательно, они не вносят большого вклада в общую атомную массу элемента. При рассмотрении атомной массы принято игнорировать массу любых электронов и вычислять массу атома, основываясь только на числе протонов и нейтронов.
Следовательно, они не вносят большого вклада в общую атомную массу элемента. При рассмотрении атомной массы принято игнорировать массу любых электронов и вычислять массу атома, основываясь только на числе протонов и нейтронов.
Электроны вносят большой вклад в заряд атома, поскольку каждый электрон имеет отрицательный заряд, равный положительному заряду протона. Ученые определяют эти заряды как «+1» и «-1». В незаряженном нейтральном атоме число электронов, вращающихся вокруг ядра, равно числу протонов внутри ядра. В этих атомах положительные и отрицательные заряды компенсируют друг друга, что приводит к атому без суммарного заряда.
| Протоны, нейтроны и электроны | |||
|---|---|---|---|
| Зарядка | Масса (а.е.м.) | Местоположение | |
| Протон | +1 | 1 | ядро |
| Нейтрон | 0 | 1 | ядро |
| Электрон | −1 | 0 | орбиталей |
И протоны, и нейтроны имеют массу 1 а. е.м. и находятся в ядре. Однако протоны имеют заряд +1, а нейтроны не заряжены. Электроны имеют массу примерно 0 а.е.м., вращаются вокруг ядра и имеют заряд -1.
е.м. и находятся в ядре. Однако протоны имеют заряд +1, а нейтроны не заряжены. Электроны имеют массу примерно 0 а.е.м., вращаются вокруг ядра и имеют заряд -1.
Изучение свойств электронов : Сравните поведение электронов с поведением других заряженных частиц, чтобы узнать свойства электронов, такие как заряд и масса.
Объем атомов
Принимая во внимание размеры протонов, нейтронов и электронов, большая часть объема атома — более 99 процентов — фактически представляет собой пустое пространство. Несмотря на все это пустое пространство, твердые объекты не просто проходят друг через друга. Электроны, окружающие все атомы, заряжены отрицательно и заставляют атомы отталкиваться друг от друга, не позволяя атомам занимать одно и то же пространство. Эти межмолекулярные силы не позволяют вам провалиться сквозь такой предмет, как ваш стул.
Интерактив: построй атом : построй атом из протонов, нейтронов и электронов и посмотри, как изменяются элементы, заряд и масса.
