Планетарная модель атома Резерфорда – строение ядра
3.9
Средняя оценка: 3.9
Всего получено оценок: 107.
3.9
Средняя оценка: 3.9
Всего получено оценок: 107.
На пути познания сложной структуры атомов вещества наукой пройден непростой путь. Одним из шагов на этом пути явилась планетарная модель атома. Рассмотрим эту модель подробнее.
Электроны и состав атома
Мысль о том, что все вещества в Природе состоят из мельчайших неделимых частиц – атомов, высказывалась еще в античные времена. По мере развития научных представлений, стало ясно, что это не совсем так. Минимальная частица вещества, сохраняющая свойства вещества – это молекула. Молекула же чаще всего состоит из нескольких атомов одного или разных элементов (но иногда молекула состоит из одного атома).
Атомы же элементов долгое время считались неделимыми.Однако, в самом конце XIXв были открыты электроны – их испускал нагретый электрод в колбе с вакуумом. Стало ясно, что даже атомы простого вещества имеют структуру.
Опыты Э. Резерфорда
Для зондирования состава атома Э. Резерфорд использовал поток альфа-частиц, испускаемых радиоактивным препаратом на тонкую металлическую фольгу, а после прохождения фольги частицы попадали на экран, вызывая его свечение. По размеру зоны отклонения можно было судить о том, как воздействовал атом вещества фольги на альфа-частицу.
Рис. 2. Опыт Резерфорда по рассеянию альфа-частиц.Альфа-частица (фактически, представляющая собой ядро атома гелия) имеет гораздо больший вес, чем электрон, таким образом, электроны не могут сколь-нибудь заметно повлиять на ее движение. Отклонение альфа-частицы может происходить только из-за взаимодействия с положительно заряженным атомом. При этом, чем равномернее распределен заряд по атому, тем меньше он будет отклонять альфа-частицу, влияя только на ее скорость (в результате кулоновского взаимодействия).
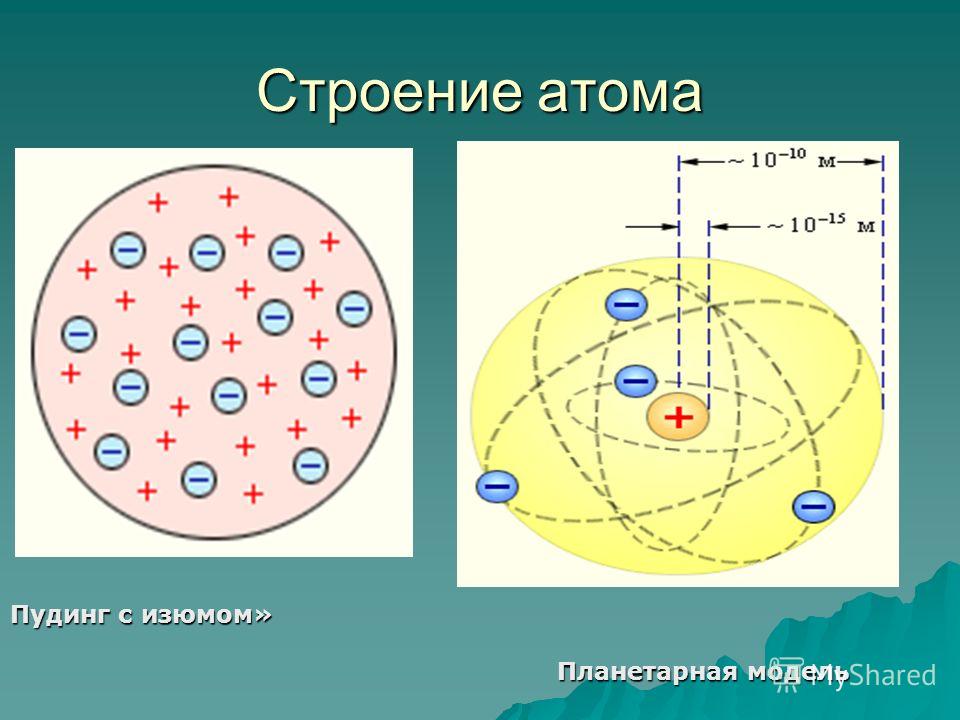
Поэтому была предложена планетарная модель строения атома, согласно которой внутри атома имеется маленькое положительно заряженное ядро, вокруг которого обращаются отрицательно заряженные электроны.
Рис. 3. Планетарная модель атома.На самом деле атом заметно более «пуст», чем Солнечная система. Если атом увеличить так, чтобы ядро увеличилось до размера Солнца, орбиты электронов будут в сто раз дальше от Солнца, чем Земля.
Проблемы планетарной модели
Планетарная модель атома Резерфорда объяснила опыт по рассеянию альфа-частиц, однако, она противоречила электродинамике Максвелла, согласно которой заряд, движущийся с ускорением, должен излучать электромагнитные волны. Электрон, двигаясь по круговой орбите, имеет постоянное центростремительное ускорение, а значит, должен излучать, теряя энергию, и в конце концов, должен упасть на ядро.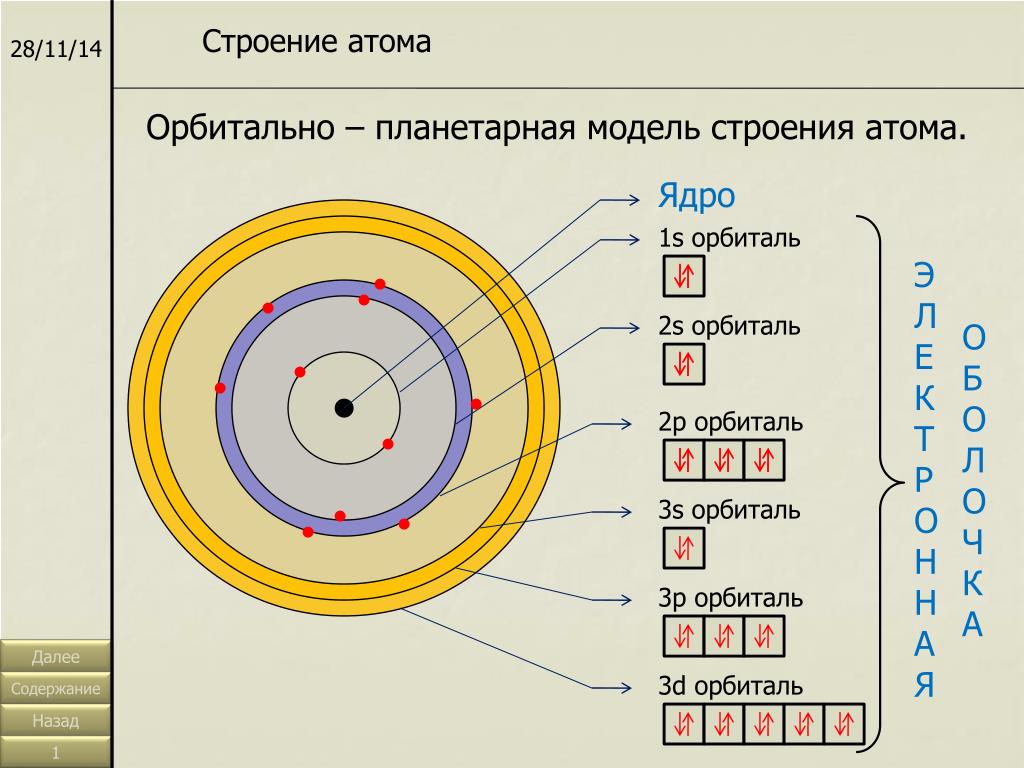
Что мы узнали?
Открытие электрона показало, что атом имеет сложную структуру. В результате опытов Э.Резерфорда была предложена планетарная модель строения атома, где весь положительный заряд и почти вся масса сосредоточена в ядре малых размеров, а электроны вращаются вокруг ядра на некотором расстоянии.
Тест по теме
Чтобы попасть сюда – пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
3.9
Средняя оценка: 3.9
Всего получено оценок: 107.
А какая ваша оценка?
Из чего состоит атом? Инфографика | Инфографика
Елена Слободян,
Елена Пацар
Примерное время чтения: 5 минут
43450
Категория: Инфографика
В 1913 году датский физик Нильс Бор предложил свою теорию строения атома.
Бор ввёл в теорию атома идею квантования. Согласно ей, электроны могут двигаться только по фиксированным орбитам, соответствующим определённым энергетическим уровням. Именно модель Бора стала основой для создания современной квантово-механической модели атома. В этой модели ядро атома, состоящее из положительно заряженных протонов и не имеющих заряда нейтронов, тоже окружено отрицательно заряженными электронами. Однако согласно квантовой механике, для электрона нельзя определить какую-то точную траекторию или орбиту движения — есть только область, в которой находятся электроны с близким энергетическим уровнем.
Что находится внутри атома?
Атомы состоят из электронов, протонов и нейтронов. Нейтроны были открыты после того, как физиками была разработана планетарная модель атома. Лишь в 1932 году, проводя серию опытов, Джеймс Чедвик обнаружил частицы, не имеющие никакого заряда. Отсутствие заряда подтверждалось тем, что эти частицы никак не реагировали на электромагнитное поле.
Нейтроны были открыты после того, как физиками была разработана планетарная модель атома. Лишь в 1932 году, проводя серию опытов, Джеймс Чедвик обнаружил частицы, не имеющие никакого заряда. Отсутствие заряда подтверждалось тем, что эти частицы никак не реагировали на электромагнитное поле.
Само ядро атома образуют тяжёлые частицы — протоны и нейтроны: каждая из этих частиц почти в две тысячи раз тяжелее электрона. Протоны и нейтроны также имеют схожие размеры, но протоны обладают положительным зарядом, а нейтроны не имеют заряда вообще.
В свою очередь, протоны и нейтроны состоят из элементарных частиц, называемых кварками. В современной физике кварки являются самой маленькой, основной частицей материи.
Размеры самого атома во много раз превышают размеры ядра. Если увеличить атом до размеров футбольного поля, то размеры его ядра могут быть сопоставимы с теннисным мячиком в центре такого поля.
В природе существует множество атомов, различающихся размерами, массой и другими характеристиками. Совокупность атомов одного вида называется химическим элементом. На сегодняшний день известно более ста химических элементов. Их атомы различаются размерами, массой, а также строением.
Совокупность атомов одного вида называется химическим элементом. На сегодняшний день известно более ста химических элементов. Их атомы различаются размерами, массой, а также строением.
Электроны внутри атома
Отрицательно заряженные электроны двигаются вокруг ядра атома, образуя своего рода облако. Массивное ядро притягивает электроны, но энергия самих электронов позволяет им «убегать» дальше от ядра. Таким образом, чем больше энергия электрона, тем дальше от ядра он находится.
Значение энергии электронов не может быть произвольным, оно соответствует чётко определенному набору энергетических уровней в атоме. То есть энергия электрона изменяется скачкообразно от одного уровня к другому. Соответственно, и двигаться электрон может только в рамках ограниченной электронной оболочки, соответствующей тому или иному энергетическому уровню — в этом смысл постулатов Бора.
Получив больше энергии, электрон «перескакивает» в более высокий от ядра слой, потеряв энергию — наоборот, в более низкий слой. Таким образом, облако электронов вокруг ядра упорядочено в виде нескольких «нарезанных» слоев.
Таким образом, облако электронов вокруг ядра упорядочено в виде нескольких «нарезанных» слоев.
История представлений об атоме
Само слово «атом» происходит от греческого «неделимый» и восходит к идеям древнегреческих философов о наименьшей неделимой части материи. В средние века химики убедились в том, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы. Такие наименьшие частицы вещества и получили название атомов. В 1860 году на международном съезде химиков в Германии это определение было официально закреплено в мировой науке.
В конце XIX — начале XX века физиками были открыты субатомные частицы и стало ясно, что атом в действительности не является неделимым. Сразу же были выдвинуты теории о внутреннем строении атома, одной из первых среди которых стала модель Томсона или модель «пудинга с изюмом». Согласно этой модели, маленькие электроны находились внутри массивного положительно заряженного тела — как изюм внутри пудинга. Однако, практические эксперименты химика Резерфорда опровергли эту модель и привели того к созданию планетарной модели атома.
Однако, практические эксперименты химика Резерфорда опровергли эту модель и привели того к созданию планетарной модели атома.
Развитие планетарной модели Бором наряду с открытием в 1932 году нейтронов сформировало основу для современной теории о строении атома. Следующие этапы в развитии знаний об атоме уже связаны с физикой элементарных частиц: кварков, лептонов, нейтринов, фотонов, бозонов и других.
Смотрите также:
- Что такое лампа накаливания и в чём её отличие от энергосберегающей лампы? →
- …Чем закончились эксперименты на БАКе? →
- Что такое «Кот Шрёдингера»? →
великие ученые
Следующий материал
Самое интересное в соцсетях
Новости СМИ2
Атом | Определение, структура, история, примеры, схема и факты
модель атомной оболочки
Посмотреть все медиа
- Ключевые люди:
- Эрнест Резерфорд
Нильс Бор
Лев Давидович Ландау
Стивен Чу
Уильям Д.
 Филлипс
Филлипс
- Похожие темы:
- субатомная частица радиоактивность изотоп атомизм периодическая таблица
Просмотреть весь связанный контент →
Популярные вопросы
Что такое атом?
Атом является основным строительным элементом химии. Это наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также наименьшая единица материи, обладающая характерными свойствами химического элемента.
Все ли атомы одного размера?
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем, определяемый как 10 −10 метра.
Из чего состоит масса атома?
Масса атома состоит из массы ядра плюс массы электронов.
Как определяется атомный номер атома?
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если атом имеет Z, равный 6, это углерод, а Z, равный 92, соответствует урану.
Сводка
Прочтите краткий обзор этой темы
атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также наименьшая единица материи, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Исследование различных конфигураций электронов в электронных оболочках вокруг ядра атома
Просмотреть все видео к этой статье Большая часть атома представляет собой пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств. В некотором отношении электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эта статья начинается с широкого обзора фундаментальных свойств атома и составляющих его частиц и взаимодействий. После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, которые были сформулированы на протяжении веков. Для получения дополнительной информации, касающейся структуры ядра и элементарных частиц, см. субатомные частицы.
Большая часть материи состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать. Каждый отдельный атом состоит из более мелких частиц, а именно электронов и ядер. Эти частицы электрически заряжены, и электрические силы на заряде ответственны за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом в основном состоит из пустого пространства.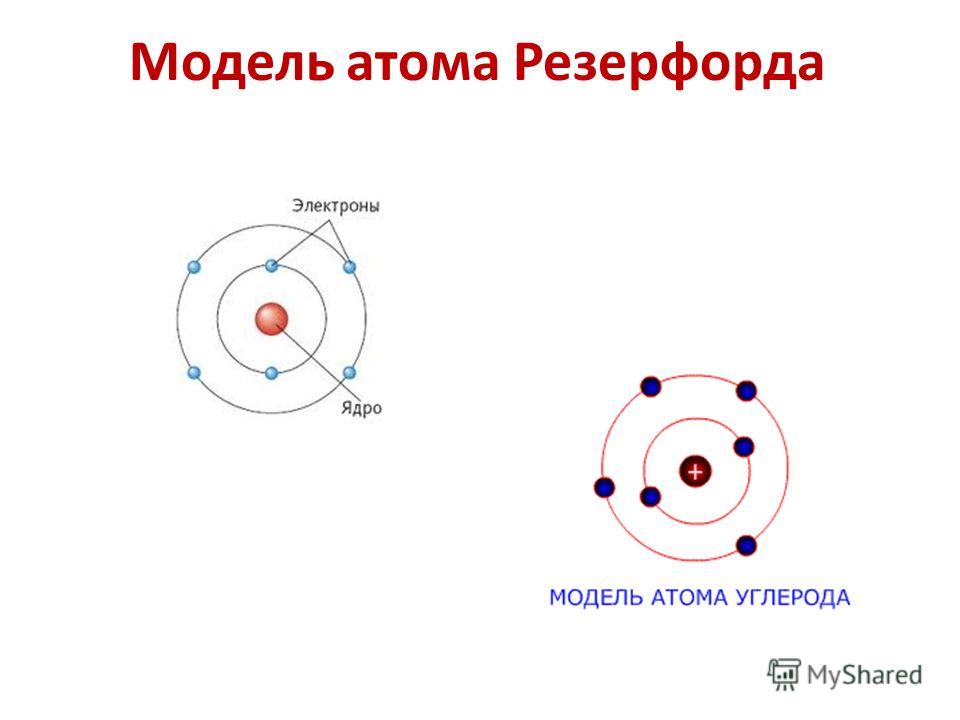 Ядро является положительно заряженным центром атома и содержит большую часть его массы. Он состоит из протонов, имеющих положительный заряд, и нейтронов, не имеющих заряда. Протоны, нейтроны и окружающие их электроны являются долгоживущими частицами, присутствующими во всех обычных атомах природного происхождения. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Ядро является положительно заряженным центром атома и содержит большую часть его массы. Он состоит из протонов, имеющих положительный заряд, и нейтронов, не имеющих заряда. Протоны, нейтроны и окружающие их электроны являются долгоживущими частицами, присутствующими во всех обычных атомах природного происхождения. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем (Å), определяемый как 10 −10 метра. Радиус атома составляет 1–2 Å. По сравнению с общим размером атома ядро еще меньше. Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метра пространства в атоме, т. е. 1 часть на 100 000. Удобная единица длины для измерения размеров ядер — фемтометр (фм), который равен 10 −15 метра. Диаметр ядра зависит от числа содержащихся в нем частиц и колеблется примерно от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — это массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их большие различия в массе. Самое легкое ядро, атом водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метра пространства в атоме, т. е. 1 часть на 100 000. Удобная единица длины для измерения размеров ядер — фемтометр (фм), который равен 10 −15 метра. Диаметр ядра зависит от числа содержащихся в нем частиц и колеблется примерно от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — это массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их большие различия в массе. Самое легкое ядро, атом водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Основные свойства
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z ), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если атом имеет Z из 6, это углерод, а Z из 92 соответствует урану. Нейтральный атом имеет равное количество протонов и электронов, поэтому положительные и отрицательные заряды точно уравновешиваются. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно количество протонов в ядре определяет химические свойства атома.
Например, если атом имеет Z из 6, это углерод, а Z из 92 соответствует урану. Нейтральный атом имеет равное количество протонов и электронов, поэтому положительные и отрицательные заряды точно уравновешиваются. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно количество протонов в ядре определяет химические свойства атома.
IRN-Современная модель атомов – Средняя школа округа Амелия
Современная модель строения атома
С древних времен люди изучали и задавали вопросы о мире материи вокруг себя. Более двух тысяч лет назад греческий философ по имени Демокрит выдвинул теорию о материи. Его теория предполагала, что все вещества состоят из очень маленьких частиц или атомов, которые слишком малы, чтобы их можно было увидеть человеческим глазом. Сегодня мы определяем материю как все, что имеет массу и объем. Давайте рассмотрим вклад некоторых выдающихся ученых и то, как их работа привела к современной модели строения атома.
Ученые продолжают изучать материю и крошечные частицы, называемые атомами, используя модели, помогающие объяснить структуру атома. В 1800-х годах английский химик и школьный учитель по имени Джон Дальтон опубликовал теорию атома. Его теория, основанная на экспериментальных данных, утверждала, что все вещества состоят из маленьких частиц, называемых атомами, которые не могут быть разделены или уничтожены. Он также предположил, что все атомы внутри элемента одинаковы, а атомы разных элементов различны. Кроме того, Дальтон считал, что атомы могут соединяться друг с другом для создания новых веществ. Модель атома Дальтона состояла из простой сплошной сферы.
К концу девятнадцатого века атомная теория Дальтона была пересмотрена, чтобы лучше понять и объяснить новые научные наблюдения и открытия. В конце 1800-х годов английский ученый по имени Джозеф Джон Томсон обнаружил ошибку в теории Дальтона. Его эксперименты показали, что атомы не являются сплошными неделимыми сферами, а на самом деле содержат более мелкие отрицательно заряженные частицы. Его модель стала известна как модель сливового пудинга, популярного английского десерта, потому что она выглядела как шарик пудинга с равномерно разбросанными по нему маленькими кусочками сливы. Пудинг представлял собой положительно заряженную часть атома, а кусочки сливы представляли собой отрицательно заряженные корпускулы, или электроны, как их сегодня называют.
Его модель стала известна как модель сливового пудинга, популярного английского десерта, потому что она выглядела как шарик пудинга с равномерно разбросанными по нему маленькими кусочками сливы. Пудинг представлял собой положительно заряженную часть атома, а кусочки сливы представляли собой отрицательно заряженные корпускулы, или электроны, как их сегодня называют.
В 1909 году другой английский ученый по имени Эрнест Резерфорд пересмотрел атомную теорию Томсона. Результаты его экспериментов привели его к мысли, что модель атомной структуры сливового пудинга неверна. Его атомная модель состояла из положительно заряженной чрезвычайно плотной области в центре атома, называемой ядром. Вокруг ядра была область пустого пространства, в которой находились электроны.
Четыре года спустя атомная модель была еще раз пересмотрена. Нильс Бор, датский ученый, считал, что электроны атома движутся по фиксированным орбитам или траекториям вокруг ядра. Он считал, что эти пути расположены на разном расстоянии от ядра, а позже предположил, что электроны могут перескакивать с одного пути на другой. Джеймс Чедвик, ученик Эрнеста Резерфорда, предположил, что ядро составляют положительные частицы, называемые протонами, и нейтральные частицы, называемые нейтронами. В конце концов эти открытия были объединены и привели к модели Бора, также известной как «планетарная модель». В этой модели присутствуют три субатомные частицы. К ним относятся протоны, нейтроны и электроны.
Джеймс Чедвик, ученик Эрнеста Резерфорда, предположил, что ядро составляют положительные частицы, называемые протонами, и нейтральные частицы, называемые нейтронами. В конце концов эти открытия были объединены и привели к модели Бора, также известной как «планетарная модель». В этой модели присутствуют три субатомные частицы. К ним относятся протоны, нейтроны и электроны.
Протоны — положительно заряженные частицы, находящиеся в ядре. Протоны имеют массу 1 атомная единица массы. Атомная единица массы или аму — это единица измерения, разработанная учеными для представления относительной массы крошечных частиц внутри атомов. Также в ядре находятся нейтроны. Нейтроны не имеют заряда. Они нейтральны. Хотя они немного больше, чем протоны, нейтроны также имеют массу 1 а.е.м. Протоны и нейтроны состоят из еще более мелких частиц, называемых кварками. За пределами ядра находятся отрицательно заряженные электроны. Электронам присваивается нулевая амулетовая единица из-за их крошечного размера. Для массы одного протона потребуется 1800 электронов! Размер на атомном уровне измеряется в наномасштабе.
Для массы одного протона потребуется 1800 электронов! Размер на атомном уровне измеряется в наномасштабе.
Современная модель строения атома называется моделью «электронного облака». Эдвин Шредингер, австрийский физик, предположил, что электроны не движутся по статическим или фиксированным траекториям. Вместо этого электроны путешествуют в областях, называемых электронными облаками. Электронное облако — это область вокруг ядра, в которой с наибольшей вероятностью могут находиться электроны.
По мере того, как ученые продолжают изучать атом, их понимание его структуры продолжает развиваться. Двумя наиболее часто используемыми атомными моделями являются модель Бора и модель электронного облака (квантовая механика). Хотя модель Бора не представляет трехмерные характеристики атома и имеет электроны, движущиеся по фиксированным орбитам, она используется, потому что позволяет легко показать атом в двух измерениях. Ученые считают, что модель электронного облака лучше поддерживает наше нынешнее понимание структуры атома и его роли в качестве основного строительного блока материи.