Периодическая таблица менделеева свойства элементов.
Как пользоваться таблицей Менделеева? Для непосвященного человека читать таблицу Менделеева – всё равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева может рассказать о мире очень многое.
Помимо того, что сослужит вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Современный вид таблицы Менделеева
Ниже приведем саму таблицу
Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды. В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.
- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются.
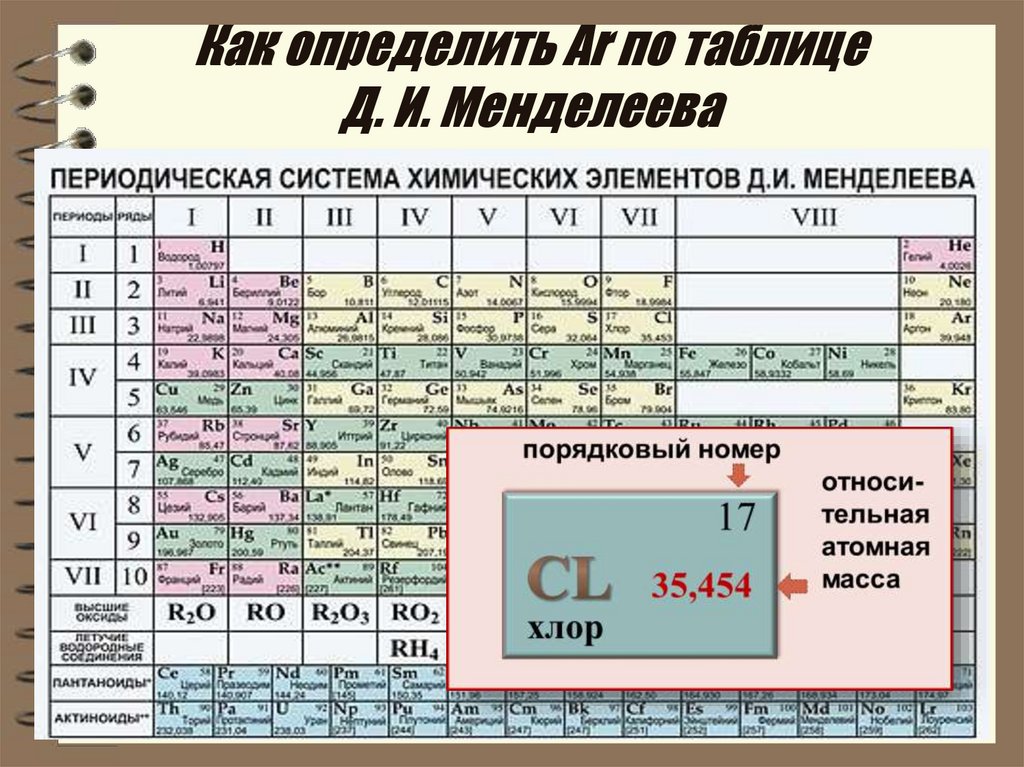
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.
Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс “Таблица Менделеева для чайников”. В завершение, предлагаем вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника.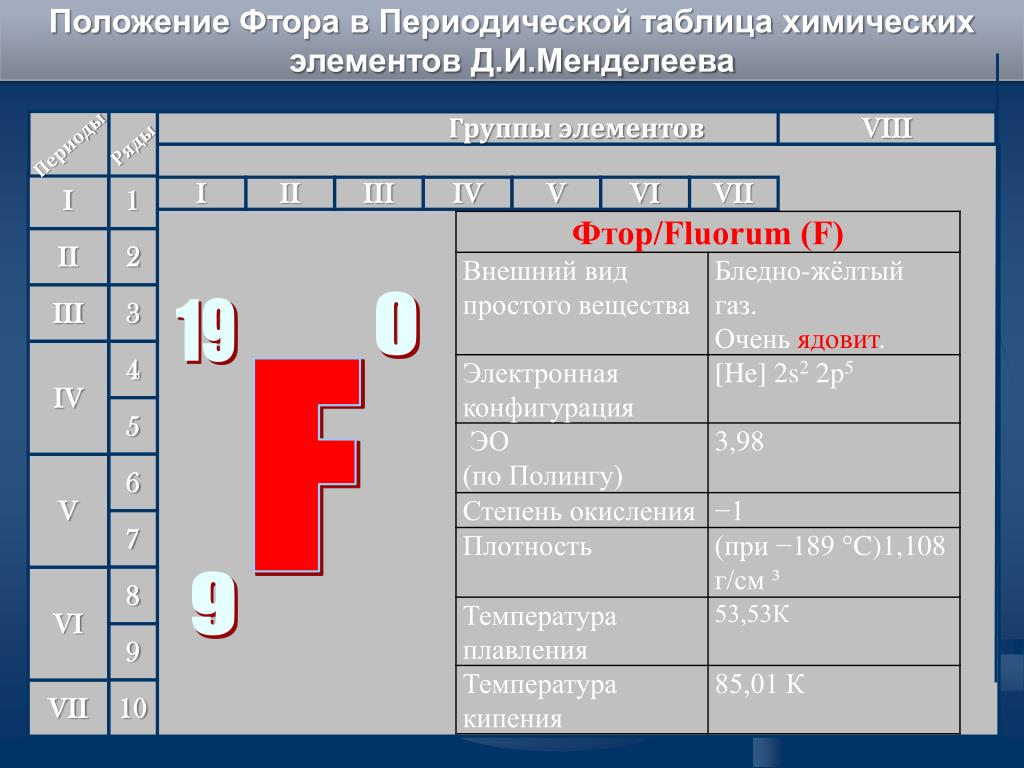
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Короткая форма таблицы Д.И. Менделеева.
Существует ещё и длинный вариант таблицы, он похож на полудлинный, но только лантаноиды и актиноиды не вынесены за пределы таблицы.
Оригинал таблицы Д. И. Менделеева
1. Период –химические элементы, расположенные в строчку (1 – 7)
Малые (1, 2, 3) – состоят из одного ряда элементов
Большие (4, 5, 6, 7) – состоят из двух рядов – чётного и нечётного
Периоды могут состоять из 2 (первый), 8 (второй и
третий), 18 (четвертый и пятый) или 32 (шестой) элементов. Последний, седьмой
период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом, а заканчиваются благородным газом.
Во всех периодах с увеличением относительных атомных масс элементов наблюдается усиление неметаллических и ослабление металлических свойств. В больших периодах переход свойств от активного металла к благородному газу происходит более медленно (через 18 и 32 элемента), чем в малых периодах (через 8 элементов). Кроме того, в малых периодах слева направо валентность в соединениях с кислородом возрастает от 1 до 7 (например, от Na до Cl ). В больших периодах вначале валентность возрастает от 1 до 8 (например, в пятом периоде от рубидия к рутению), затем происходит резкий скачок, и валентность уменьшается до 1 у серебра, потом снова возрастает.
2. Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные (А) и побочные подгруппы (Б).
Главные
подгруппы состоят из элементов малых и больших
периодов.
Побочные подгруппы состоят из элементов только больших периодов.
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме N, O , F ).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I – III групп (кроме бора) преобладают основные свойства, с IV по VIII – кислотные.
Группа | III | VII | VIII (кроме инертных газов) | |||||
Высший оксид | Э 2 О | ЭО | Э 2 О 3 | ЭО 2 | Э 2 О 5 | ЭО 3 | Э 2 О 7 | ЭО 4 |
Гидрат высшего оксида | ЭОН | Э(ОН) 2 | Э(ОН) 3 | Н 2 ЭО 3 | Н 3 ЭО 4 | Н 2 ЭО 4 | НЭО 4 | Н 4 ЭО 4 |
Для элементов главных подгрупп общими
являются формулы водородных соединений.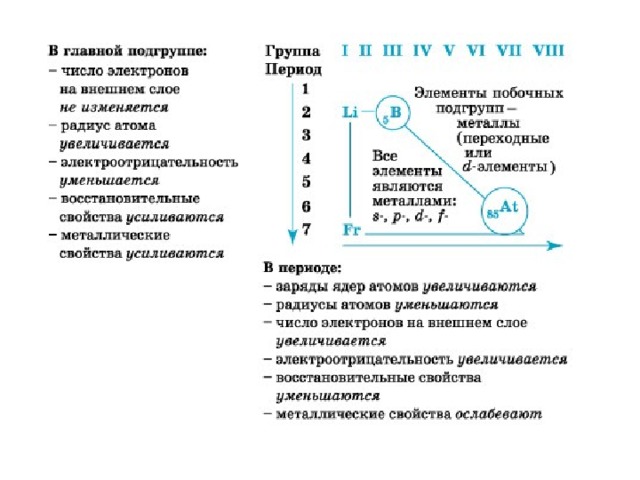 Элементы главных подгрупп
I
–
III
групп образуют твердые вещества –
гидриды (водород в степени окисления – 1), а
IV
–
VII
групп – газообразные. Водородные
соединения элементов главных подгрупп
IV
группы (ЭН 4) – нейтральны,
V
группы (ЭН 3) –
основания,
VI
и
VII
групп (Н 2 Э и НЭ) – кислоты.
Элементы главных подгрупп
I
–
III
групп образуют твердые вещества –
гидриды (водород в степени окисления – 1), а
IV
–
VII
групп – газообразные. Водородные
соединения элементов главных подгрупп
IV
группы (ЭН 4) – нейтральны,
V
группы (ЭН 3) –
основания,
VI
и
VII
групп (Н 2 Э и НЭ) – кислоты.
Таблица Менделеева является одним из величайших открытий человечества, позволившим упорядочить знания об окружающем мире и открыть новые химические элементы . Она является необходимой для школьников, а так же для всех, кто интересуется химией. Кроме того, данная схема является незаменимой и в других областях науки.
Данная схема содержит все известные человеку элементы, причем они группируются в зависимости от атомной массы и порядкового номера . Эти характеристики влияют на свойства элементов. Всего в коротком варианте таблицы имеется 8 групп, элементы, входящие в одну группу, обладают весьма сходными свойствами. Первая группа содержит водород, литий, калий, медь, латинское произношение на русском которой купрум. А так же аргентум — серебро, цезий, золото — аурум и франций. Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
А так же аргентум — серебро, цезий, золото — аурум и франций. Во второй группе расположены бериллий, магний, кальций, цинк, за ними идут стронций, кадмий, барий, заканчивается группа ртутью и радием.
В состав третьей группы вошли бор, алюминий, скандий, галлий, потом следуют иттрий, индий, лантан, завершается группа таллием и актинием. Четвертая группа начинается с углерода, кремния, титана, продолжается германием, цирконием, оловом и завершается гафнием, свинцом и резерфордием. В пятой группе имеются такие элементы, как азот, фосфор, ванадий, ниже расположены мышьяк, ниобий, сурьма, потом идут тантал висмут и завершает группу дубний. Шестая начинается с кислорода, за которым лежат сера, хром, селен, потом следуют молибден, теллур, далее вольфрам, полоний и сиборгий.
В седьмой группе первый элемент – фтор, потом следует хлор, марганец, бром, технеций, за ним находится йод, потом рений, астат и борий. Последняя группа является самой многочисленной . В нее входят такие газы, как гелий, неон, аргон, криптон, ксенон и радон.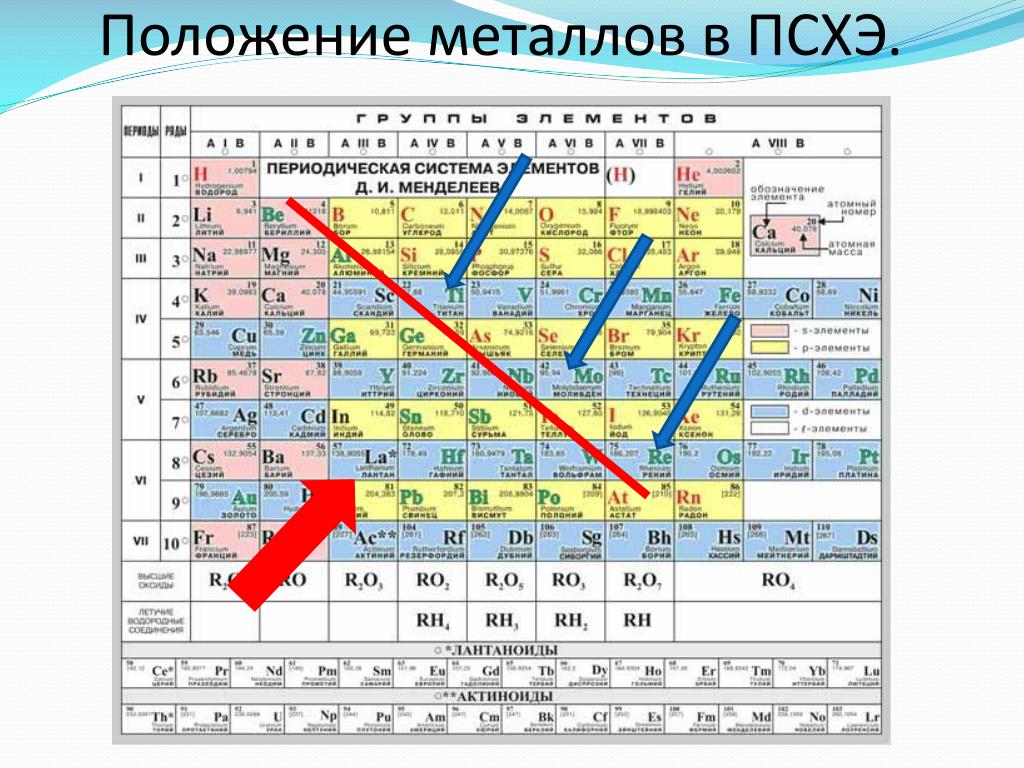 Так же к данной группе относятся металлы железо, кобальт, никель, родий, палладий, рутений, осмий, иридий, платина. Далее идут ханний и мейтнерий. Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов . Они обладают сходными свойствами с лантаном и актинием.
Так же к данной группе относятся металлы железо, кобальт, никель, родий, палладий, рутений, осмий, иридий, платина. Далее идут ханний и мейтнерий. Отдельно расположены элементы, которые образуют ряд актиноидов и ряд лантаноидов . Они обладают сходными свойствами с лантаном и актинием.
Данная схема включает в себя все виды элементов, которые делятся на 2 большие группы – металлы и неметаллы , обладающие разными свойствами. Как определить принадлежность элемента к той или иной группе, поможет условная линия, которую необходимо провести от бора к астату. Следует помнить, что такую линию можно провести только в полной версии таблицы. Все элементы, которые находятся выше этой линии, и располагаются в главных подгруппах считаются неметаллами. А которые ниже, в главных подгруппах – металлами. Так же металлами являются вещества, находящиеся в побочных подгруппах . Существуют специальные картинки и фото, на которых можно детально ознакомиться с положением этих элементов. Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.
Стоит отметить, что те элементы, которые находятся на этой линии, проявляют одинаково свойства и металлов и неметаллов.
Отдельный список составляют и амфотерные элементы, которые обладают двойственными свойствами и могут образовывать в результате реакций 2 вида соединений. При этом у них проявляются одинаково как основные, так и кислотные свойства . Преобладание тех или иных свойств зависит от условий реакции и веществ, с которыми амфотерный элемент реагирует.
Стоит отметить, что данная схема в традиционном исполнении хорошего качества является цветной. При этом разными цветами для удобства ориентирования обозначаются главные и побочные подгруппы . А так же элементы группируются в зависимости от схожести их свойств.
Однако в настоящее время наряду с цветной схемой очень распространенной является периодическая таблица Менделеева черно белая. Такой ее вид используется для черно-белой печати. Несмотря на кажущуюся сложность, работать с ней так же удобно, если учесть некоторые нюансы. Так, отличить главную подгруппу от побочной в таком случае можно по отличиям в оттенках, которые хорошо заметны. К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются разными цветами .
Так, отличить главную подгруппу от побочной в таком случае можно по отличиям в оттенках, которые хорошо заметны. К тому же в цветном варианте элементы с наличием электронов на разных слоях обозначаются разными цветами .
Стоит отметить, что в одноцветном исполнении ориентироваться по схеме не очень трудно. Для этого будет достаточно информации, указанной в каждой отдельной клеточке элемента.
Егэ сегодня является основным видом испытания по окончанию школы, а значит, подготовке к нему необходимо уделять особое внимание. Поэтому при выборе итогового экзамена по химии , необходимо обратить внимание на материалы, которые могут помочь в его сдаче. Как правило, школьникам на экзамене разрешено пользоваться некоторыми таблицами, в частности, таблицей Менделеева в хорошем качестве. Поэтому, чтобы она принесла на испытаниях только пользу, следует заблаговременно уделить внимание ее строению и изучению свойств элементов, а так же их последовательности. Необходимо научиться, так же пользоваться и черно-белой версией таблицы , чтобы на экзамене не столкнуться с некоторыми трудностями.
Помимо основной таблицы, характеризующей свойства элементов и их зависимость от атомной массы, существуют и другие схемы, которые могут оказать помощь при изучении химии. Например, существуют таблицы растворимости и электроотрицательности веществ . По первой можно определить, насколько растворимо то или иное соединение в воде при обычной температуре. При этом по горизонтали располагаются анионы – отрицательно заряженные ионы, а по вертикали – катионы, то есть положительно заряженные ионы. Чтобы узнать степень растворимости того, или иного соединения, необходимо по таблице найти его составляющие. И на месте их пересечения будет нужное обозначение.
Если это буква «р», то вещество полностью растворимо в воде в нормальных условиях. При наличии буквы «м» — вещество малорастворимое, а при наличии буквы «н» — оно почти не растворяется. Если стоит знак «+», — соединение не образует осадок и без остатка реагирует с растворителем. Если присутствует знак «-», это означает, что такого вещества не существует. Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Иногда так же в таблице можно увидеть знак «?», тогда это обозначает, что степень растворимости этого соединения доподлинно не известна. Электроотрицательность элементов может варьироваться от 1 до 8, для определения этого параметра так же существует специальная таблица.
Еще одна полезная таблица – ряд активности металлов. В нем располагаются все металлы по увеличении степени электрохимического потенциала. Начинается ряд напряжения металлов с лития, заканчивается золотом. Считается, что чем левее занимает место в данном ряду металл, тем он более активен в химических реакциях. Таким образом, самым активным металлом считается металл щелочного типа литий. В списке элементов ближе к концу так же присутствует водород. Считается, что металлы, которые расположены после него, являются практически неактивными. Среди них такие элементы, как медь, ртуть, серебро, платина и золото.
Таблица Менделеева картинки в хорошем качестве
Данная схема является одним из крупнейших достижений в области химии. При этом существует немало видов этой таблицы – короткий вариант, длинный, а так же сверхдлинный. Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.
При этом существует немало видов этой таблицы – короткий вариант, длинный, а так же сверхдлинный. Самой распространенной является короткая таблица, так же часто встречается и длинная версия схемы. Стоит отметить, что короткая версия схемы в настоящее время не рекомендуется ИЮПАК для использования.
Всего было разработано больше сотни видов таблицы , отличающихся представлением, формой и графическим представлением. Они используются в разных областях науки, либо совсем не применяются. В настоящее время новые конфигурации схемы продолжают разрабатываться исследователями. В качестве основного варианта используется либо короткая, либо длинная схема в отличном качестве.
Химия – увлекательный, но сложный предмет. А если в школе еще и не было принадлежностей для проведения экспериментов, то можно сказать, что она и вовсе прошла мимо. Но есть то, в чём должен хотя бы минимально ориентироваться каждый человек. Это таблица Менделеева.
Для школьников выучить ее – настоящая пытка.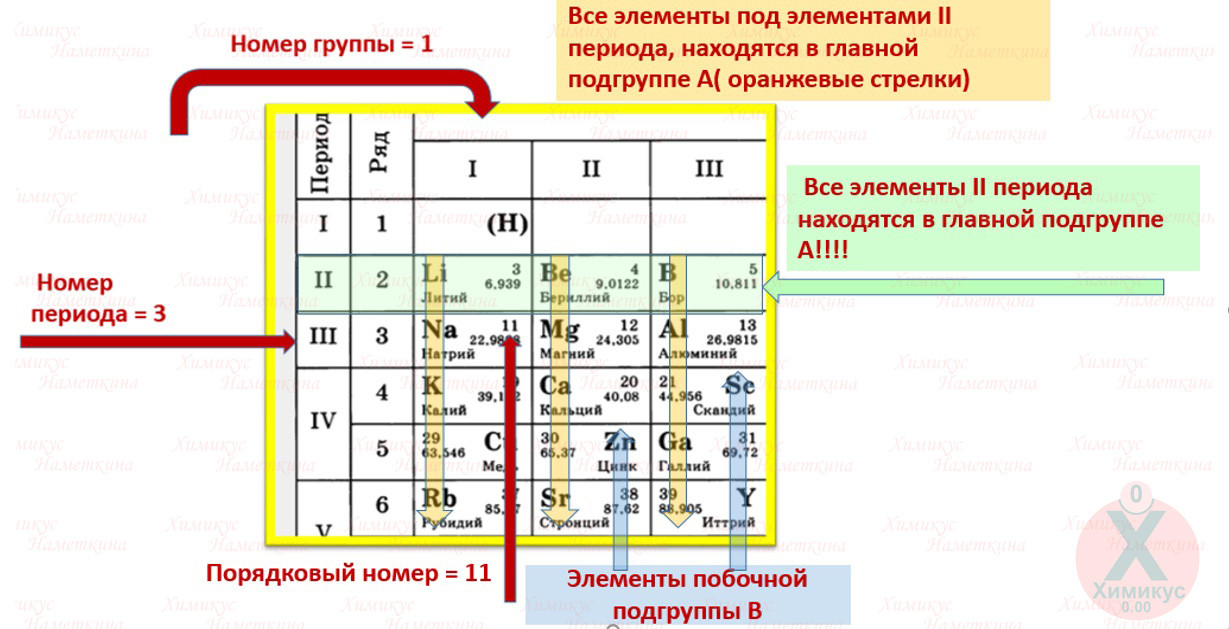 Если они видят ее в снах, то только кошмарных. Так много элементов, у каждого свой номер… Но одна многодетная мать придумала занимательный способ, как выучить таблицу Менделеева . Он подойдет как для детей, так и для взрослых, и о нём тебе с радостью расскажет реакция «Так Просто!» .
Если они видят ее в снах, то только кошмарных. Так много элементов, у каждого свой номер… Но одна многодетная мать придумала занимательный способ, как выучить таблицу Менделеева . Он подойдет как для детей, так и для взрослых, и о нём тебе с радостью расскажет реакция «Так Просто!» .
Периодическая таблица химических элементов
Как показывает опыт матери четверых детей Карин Трипп, при правильном подходе возможно выучить всё. Чтобы приобщить к изучению химии даже маленьких детей, она решила превратить периодическую таблицу элементов в поле для морского боя.
Игра содержит четыре страницы с таблицей Менделеева – по две для каждого игрока. Каждому игроку на одной таблице необходимо нарисовать свои корабли, а на другой – обозначать точками свои выстрелы и подбитые корабли соперника.
Правила морского боя такие же, как в классической игре. Только для того, чтобы подстрелить кораблик соперника, нужно назвать не букву c цифрой, а соответствующий химический элемент.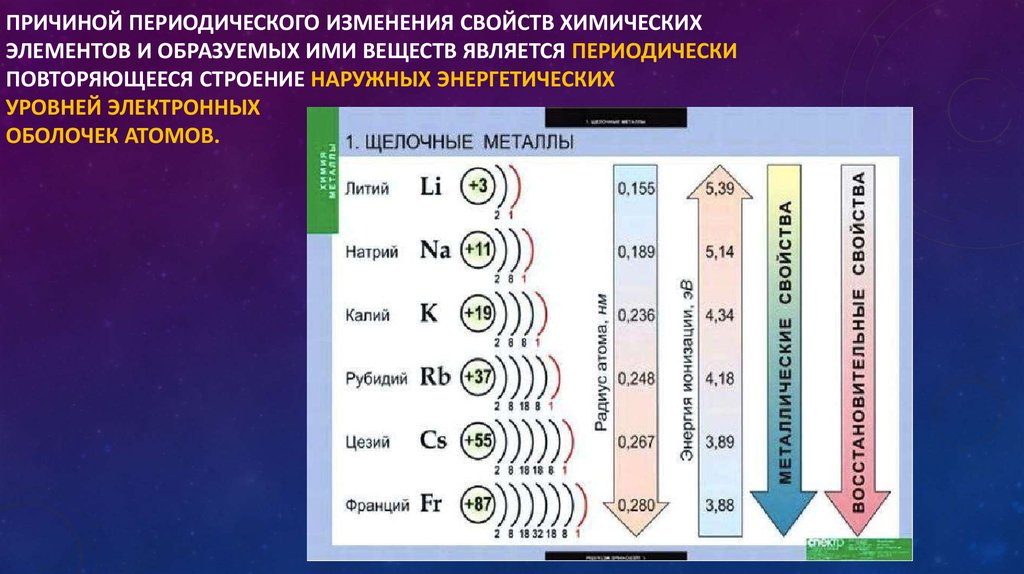
Такая методика позволит детям не только усвоить названия химических элементов. Она способствует развитию памяти и логического мышления. Ведь дети будут анализировать порядковые номера и цвета.
Для того чтобы детям на первых порах было проще найти нужный элемент, ряды и столбцы следует пронумеровать цифрами. Но, по словам Карин, ее дети уже через несколько дней игры в «химический морской бой» стали прекрасно ориентироваться в таблице Менделеева. Они знали даже атомные массы и порядковые номера элементов.
Со временем правила игры можно усложнить. Например, размещать корабль только в пределах одного семейства химических элементов.
В эту игру с удовольствием играет даже восьмилетняя дочь изобретательной матери, которая еще не изучала химию в школе. Да и для взрослых это отличный способ занимательно провести время.
Все страницы таблицы Менделеева для игры в морской бой можно распечатать на обычном или цветном принтере и использовать неограниченное количество раз.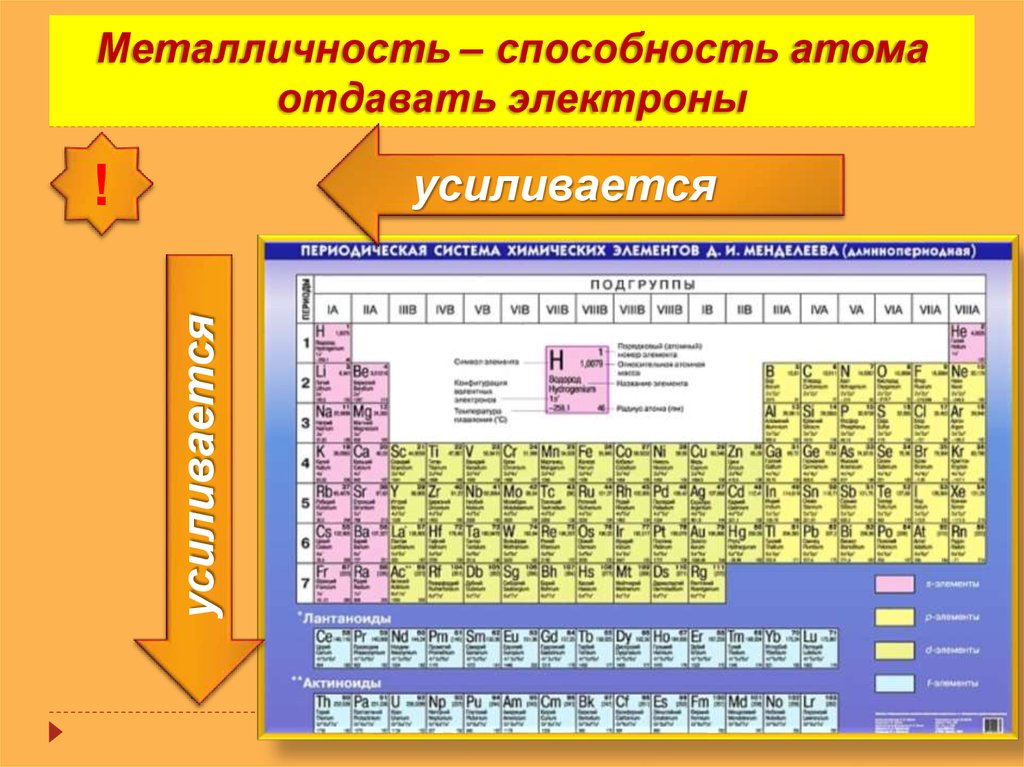
Учёный-химик рассказал о свойствах новых элементов таблицы Менделеева
14:46 Янв. 5, 2016 3067 3
Фото Станислав Красильников/ТАСС
Практического применения открытые элементы не имеют, так как живут они ничтожно короткий промежуток времени.
Об этом радиостанции «Говорит Москва» сообщил химик-материаловед, замдекана факультета наук о материалах МГУ Евгений Гудилин.
«Это важнейшее фундаментальное открытие, которое влезает в самую глубину материи. Но практического значения оно пока что никакого не имеет, так как эти элементы невозможно использовать: их не донесешь до потребителя ни по количеству, ни по времени жизни, ведь они живут тысячные доли секунды и получаются в количестве нескольких десятков атомов, если повезёт», – отметил Гудилин.
При этом он подчеркнул, что для науки данное открытие имеет большое значение. «Это победа науки фундаментальной, расчётной и инструментальной, если говорить об установках, на которых их получали. У этих короткоживущих изотопов пытаются изучать их химические и какие-то физические свойства, и это даже удаётся. Но это нужно для того, чтобы ещё раз доказать, что Дмитрий Иванович Менделеев был прав и получающиеся элементы очень похожи на предсказания, то есть периодичность свойств элементов выполняется», – добавил Гудилин.
Но это нужно для того, чтобы ещё раз доказать, что Дмитрий Иванович Менделеев был прав и получающиеся элементы очень похожи на предсказания, то есть периодичность свойств элементов выполняется», – добавил Гудилин.
Ранее стало известно, что таблицу Менделеева пополнили четыре новых элемента с 113-м, 115-м, 117-м и 118-м атомными номерами. Создателями 113-го элемента признаны ученые из японского института RIKEN. В связи с чем элементу предрекают имя «Японий».
Отметим, в природе не существует элементов тяжелее урана, то есть с атомными номерами больше 92. Элементы тяжелее 100-го в таблице Менделеева можно получать только в лабораторных условиях: на ускорителях, путем «бомбардировки» тяжелыми ионами.
Версия для печати
Все новости
20:30 Июль 23, 2021 2822
В Дубне появится самая большая в Евразии таблица Менделеева
19:43 Март 9, 2019 7977
ЮНЕСКО решит вопрос о присвоении периодической таблице имени Менделеева в конце года
16:50 Ноя.
 30, 2016 3157
30, 2016 3157Оганесон, московий, тенессий и нихоний пополнили таблицу Менделеева
12:46 Ноя. 30, 2016 3741
113-й химический элемент таблицы Менделеева получил название нихоний
18:22 Дек. 31, 2015 2488
Японцев официально признали первооткрывателями 113-го элемента таблицы Менделеева
07:05 Дек. 26, 2015 1915
Создателями 113 химического элемента признают японских учёных
16:36 Ноя. 18, 2015 3766
В результате пожара в общежитии РХТУ имени Менделеева есть пострадавшие
14:03 Сен. 18, 2015 2972
Учёный назвал открытие лауреата Шнобелевской премии по химии научным прорывом
10:43 Сен. 10, 2015 3352
Ректоры 2 московских вузов лишились должности из-за отсутствия повышения зарплат
07:45 Авг. 14, 2015 3322
14 августа 1943 года вице-президентом Академии наук СССР было подписано распоряжение о создании Лаборатории № 2
07:24 Май 12, 2015 4321
Российские учёные лишились подписки на тысячи научных журналов
10:39 Фев.
 8, 2015 1819
8, 2015 1819Дмитрий Медведев поздравил учёных с Днём российской науки
Связь с эфиром
Периодические тенденции в свойствах элементов
Периодическая таблица представляет собой табличное отображение различных химических элементов, расположенных в соответствии с их электронной конфигурацией, атомным номером и общими химическими свойствами. Существуют определенные тенденции, общие для всех групп и периодов.
Строки называются периодами, а периодическая таблица имеет 7 периодов. Металлы представлены в левых рядах, а ближе к правой стороне – неметаллы. Принимая во внимание, что столбцы называются группами. В группах элементы имеют различное химическое поведение. Существует 18 групп, галогены входят в группу 17, а инертные газы — в группу 18.
Периодические тренды
Особые закономерности свойств химических элементов, присутствующих в периодической таблице, известны как периодические тренды.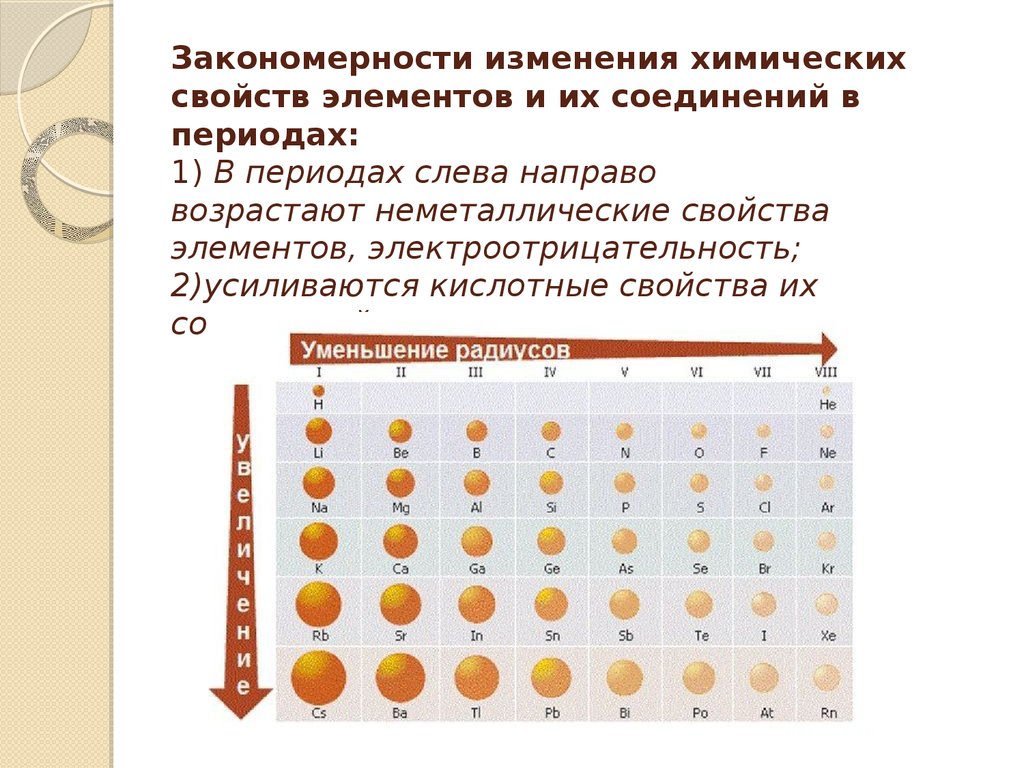 The important trends are,
The important trends are,
Ionization energy
Metallic character
Atomic Radii
Electronegativity
Ionic radius
Electron affinity
Chemical reactivity
Экранирующий эффект
Эти тенденции возникают вследствие изменения строения атомов элементов внутри их групп и периодов. Существует несколько исключений, например, энергия ионизации групп 3 и 6.
Периодический закон
Периодический закон формирует основу для периодических трендов. Согласно периодическому закону, «химические элементы расположены в порядке возрастания атомного номера, и основные свойства при этом претерпевают циклические изменения. Элементы, имеющие сходные химические свойства, повторяются через равные промежутки времени»
Этот принцип дал Дмитрий Менделеев. Он также заявил, что периодическая таблица основана не только на атомном весе, но и на различных физических и химических свойствах элементов.
Позже также было обнаружено, что повторение свойств обусловлено повторением сходных электронных конфигураций во внешних оболочках атомов.
1. Энергия ионизации
Потенциал ионизации можно определить как
«Минимальная энергия, необходимая изолированному атому для удаления одного электрона в его нейтральном или газообразном состоянии»
По мере прохождения периода энергия ионизации увеличивается. Причина этого заключается в том, что заряд ядра через период увеличивается, и, таким образом, электроны сильно удерживаются ядром.
Причина этого заключается в том, что заряд ядра через период увеличивается, и, таким образом, электроны сильно удерживаются ядром.
Но по мере продвижения вниз по группе энергия ионизации уменьшается по группе. Причина этого в том, что по группе валентные электроны удаляются дальше от ядра, поэтому заряд ядра уменьшается.
Факторы, влияющие на энергию ионизации
Различные факторы, влияющие на уровни энергии ионизации
Заряд ядра
Чем ниже заряд ядра, тем ниже сила притяжения между ядром и валентными электронами, поэтому энергия ионизации ниже.
Экранирующий эффект
Экранирующий эффект увеличивается по мере увеличения заряда ядра, таким образом, с увеличением экранирующего эффекта увеличивается и энергия ионизации.
Атомный радиус
По мере увеличения атомного радиуса сила притяжения между ядром и валентными электронами также уменьшается. Таким образом, с увеличением атомного радиуса ионизация уменьшается.
Таким образом, с увеличением атомного радиуса ионизация уменьшается.
Наполовину заполненные валентные оболочки
Псевдозаполненные или наполовину заполненные валентные оболочки имеют высокую энергию ионизации.
Простой принцип, который можно использовать, заключается в том, что если главное квантовое число низкое, то число ионизации для электрона, присутствующего в этой оболочке, будет высоким.
Исключения
Все элементы семейства кислорода и бора являются исключением из указанной выше периодической тенденции. Они требуют немного меньше энергии, чем обычный тренд.
2. Металлическое свойство
Металлическое свойство элемента можно определить как его способность проводить электричество. Металлические свойства увеличиваются вниз по группе по мере уменьшения заряда ядра вниз по группе. Поскольку валентный электрон слабо связан с ядрами, они способны хорошо проводить электричество.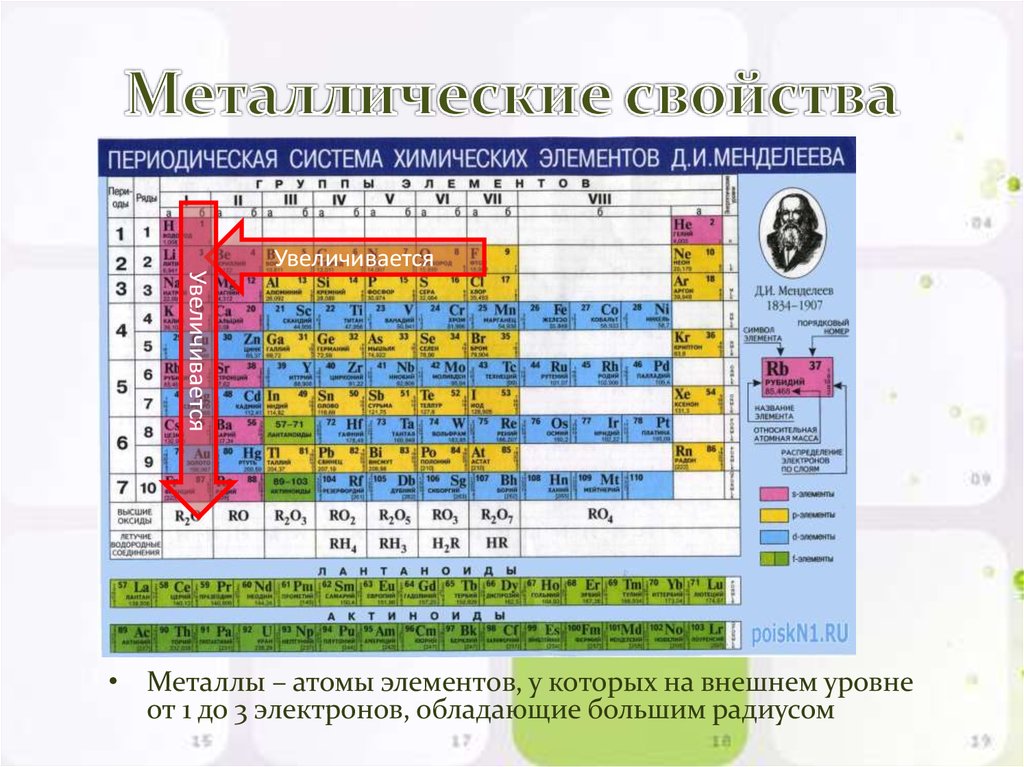
Но с течением времени металлический характер уменьшается по мере увеличения заряда ядра. Это вызывает увеличение силы притяжения между валентными электронами и ядрами, тем самым препятствуя их проведению электричества или тепла.
3. Атомные радиусы
Атомный радиус – это расстояние между атомным ядром и внешней стабильной электронной орбиталью атома, находящегося в равновесии. В течение периода радиус атома уменьшается по мере увеличения заряда ядра. Причина уменьшения заключается в том, что по мере увеличения заряда ядра сила притяжения между ядром и валентными электронами также увеличивается, и ядро крепко удерживает электрон, тем самым уменьшая атомные радиусы.
В группе атомный радиус увеличивается вниз по группе. Причина в том, что добавляются новые снаряды и таким образом уменьшается ядерный заряд. Но атомные радиусы также увеличиваются по диагонали, вызывая некоторые исключения.
Пример:
Вдоль периода – Li> Be > B > C > N > O > F
Вниз по Grp – Li < Na < K < Rb < Cs
4.
 Электроотрицательность
ЭлектроотрицательностьЭлектроотрицательность можно определить как способность атома или молекулы притягивать пару электронов. Образующаяся за счет этого связь в основном определяется разницей между электроотрицательностью атомов.
В течение периода электроотрицательность увеличивается по мере увеличения заряда ядра. Двигаясь вниз по группе, электроотрицательность уменьшается по мере уменьшения заряда ядра. Причина в том, что расстояние между ядром атома и валентными электронами велико, и поэтому электроны легко теряются.
Пример:
Вдоль периода – Li < Be < B < C < N < O < F
Вниз по Grp – Li > Na > K > Rb > Cs
Исключение
Элементы группы 13 являются исключением, поэтому электроотрицательность увеличивается от алюминия к таллию. Также в группе 14 электроотрицательность олова выше, чем у свинца.
5. Сродство к электрону
Сродство к электрону можно определить как тенденцию атома принимать электрон или электронную пару. Это характерная черта неметаллов, поскольку они приобретают электроны, превращаясь в анионы. В течение периода сродство к электрону увеличивается по мере увеличения заряда ядра.
Это характерная черта неметаллов, поскольку они приобретают электроны, превращаясь в анионы. В течение периода сродство к электрону увеличивается по мере увеличения заряда ядра.
Вниз по группе уменьшается, так как уменьшается заряд ядра. Фтор имеет самую высокую электроотрицательность, и благородные газы в него не входят. Причина в том, что они имеют полную валентную оболочку и поэтому не могут ни приобретать, ни терять электроны.
6. Экранирующий эффект
Его можно определить как отталкивание внешнего электрона внутренними электронами. Его также можно использовать для объяснения того, сколько ядер могут управлять внешними электронами. Эффективный заряд ядра уменьшается вниз по группе из-за увеличения экранирующего эффекта. В течение периода эффективный заряд ядра увеличивается по мере увеличения заряда ядра.
Подводя итог, можно сделать следующие выводы.
Characteristic | Period | Group |
Ionization energy | Increases | Decreases |
Metallic property | Уменьшается | Увеличивается |
Atomic radius | Decreases | Increases |
Electronegativity | Increases | Decreases |
Electron affinity | Increases | Уменьшается |
Защитный эффект | Увеличивается | Уменьшается |
7.
 Ионный радиус
Ионный радиусИон состоит из электронов в своих многочисленных оболочках и ядра. Расстояние между ядром и электроном в последней самой внешней оболочке иона известно как ионный радиус иона. Основываясь на ионном радиусе различных элементов, можно определить тенденцию в периодической таблице. По сути, эту тенденцию можно рассматривать как;
Если мы перейдем от вершины таблицы Менделеева к ее основанию, ионный радиус элементов увеличится. Это происходит потому, что по мере продвижения вниз по периодической таблице количество слоев или оболочек электронов увеличивается.
Если двигаться в периодической таблице слева направо, то ионный радиус имеет тенденцию к уменьшению. Хотя кажется странным, что размер иона будет уменьшаться по мере добавления большего количества протонов, электронов и нейтронов. Однако это происходит потому, что когда мы двигаемся боком по периодической таблице, металл сбрасывает свои внешние электронные слои, чтобы сформировать катионы.
 Для неметаллов ионный радиус увеличивается по мере того, как количество электронов, присутствующих в ионе, превышает количество протонов, вызывая значительное уменьшение заряда ядра.
Для неметаллов ионный радиус увеличивается по мере того, как количество электронов, присутствующих в ионе, превышает количество протонов, вызывая значительное уменьшение заряда ядра.
Эта тенденция относится не только к ионному радиусу, но и к атомному радиусу; однако они отличаются друг от друга.
8. Химическая реактивность
Реакционная способность элемента относится к способности атома вступать в реакцию с любым другим веществом. Химическая активность часто регулируется энергией ионизации (как просто электроны сбрасываются с самого внешнего слоя) и электроотрицательностью (насколько быстро атом принимает электроны другого атома). Этот процесс переноса и обмена электронами является принципом, по которому происходит тенденция химической активности в периодической таблице.
В металлах химическая активность уменьшается по мере того, как мы перемещаемся по периодической таблице слева направо.
 Принимая во внимание, что реактивность увеличивается по мере продвижения от верхних к нижним группам таблицы. Чем дальше вниз или влево мы движемся, тем легче и быстрее становится обмен электронами, увеличивая химическую активность элементов.
Принимая во внимание, что реактивность увеличивается по мере продвижения от верхних к нижним группам таблицы. Чем дальше вниз или влево мы движемся, тем легче и быстрее становится обмен электронами, увеличивая химическую активность элементов.В неметаллах все наоборот. Химическая активность увеличивается по мере продвижения слева направо по таблице. И реактивность уменьшается по мере продвижения к нижним группам от верхних групп. Чем дальше вверх или вправо, тем легче атомам сбрасывать свои электроны в обмен на другие электроны, увеличивая электроотрицательность, что, в свою очередь, делает химическую реактивность элементов более строгой.
Факты, основанные на тенденциях периода и периодических таблицах
Наиболее благородные газы — гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). )- имеют нулевую электроотрицательность, потому что они чрезвычайно стабильны.
 У них есть полностью валентные электронные слои, из-за которых они не теряют и не приобретают электроны легко.
У них есть полностью валентные электронные слои, из-за которых они не теряют и не приобретают электроны легко.Из 118 элементов таблицы Менделеева 90 можно найти в природе, а остальные 28 созданы человеком.
В то время как водород (H) является самым легким элементом в периодической таблице (его можно найти в верхнем левом углу), оганесон (Og) является самым тяжелым элементом (можно найти в правом нижнем углу)
Почти 75% элементов периодической таблицы — это металлы. В то время как есть только несколько неметаллов.
Единственными двумя элементами, которые являются жидкими при комнатной температуре, являются бром и ртуть.
Если периодическую таблицу сложить пополам вдоль ее группы 4 элементов, то группы, лежащие друг над другом, могут идеально слиться друг с другом, потому что они имеют гармонирующую электронную структуру.
 Следовательно, они сочетаются друг с другом в полной стабильности.
Следовательно, они сочетаются друг с другом в полной стабильности.
Подробнее о свойствах элементов
ЧТО ТАКОЕ ЭЛЕМЕНТЫ?
Элементы — это чистые вещества, состоящие только из атомов одного типа. Атом состоит из протонов, нейтронов и электронов. Например, атом углерода имеет 6 протонов, 6 нейтронов и 6 электронов. Это придает углероду уникальные свойства, которые можно использовать для его идентификации. В природе существует 118 элементов, каждый из которых имеет разное количество протонов.
Чтобы лучше понять свойства элементов…
ЧТО ТАКОЕ ЭЛЕМЕНТЫ?.
Элементы — это чистые вещества, состоящие только из атомов одного типа. Атом состоит из протонов, нейтронов и электронов. Например, атом углерода имеет 6 протонов, 6 нейтронов и 6 электронов. Это придает углероду уникальные свойства, которые можно использовать для его идентификации. В природе существует 118 элементов, каждый из которых имеет разное количество протонов. Чтобы лучше понять свойства элементов…
Чтобы лучше понять свойства элементов…
ДАВАЙТЕ РАЗЪЯСНИМ!
Элементы состоят из одинаковых типов атомов.
Элементы — это встречающиеся в природе вещества, которые существуют во всех трех состояниях — твердом, жидком и газообразном. Элементы состоят из одних и тех же типов атомов. Например, кислород существует в природе как двухатомный элемент, а это означает, что он имеет два атома кислорода. Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны расположены в центре атома, называемом ядром, а электроны находятся во внешних частях атома, называемых 9.0336 энергетических уровней или электронных орбиталей.
Элементы состоят из одних и тех же типов атомов. Элементы — это встречающиеся в природе вещества, которые существуют во всех трех состояниях — твердом, жидком и газообразном. Элементы состоят из одних и тех же типов атомов. Например, кислород существует в природе как двухатомный элемент, а это означает, что он имеет два атома кислорода. Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны расположены в центре атома, называемом ядром, а электроны находятся во внешних частях атома, называемых энергетическими уровнями или электронными орбиталями.
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны расположены в центре атома, называемом ядром, а электроны находятся во внешних частях атома, называемых энергетическими уровнями или электронными орбиталями.
Все элементы имеют свойства.
Все элементы имеют свойства. Эти свойства включают, помимо прочего, проводимость, магнетизм, температуру плавления, температуру кипения, цвет, состояние вещества и другие. Элементы со схожими свойствами сгруппированы вместе в разных областях периодической таблицы элементов. Наблюдение за свойствами элемента позволяет ученым классифицировать его, а также определять его реакционную способность с другими элементами. Расположение элемента в периодической таблице определяет, как он сочетается или не сочетается с другими элементами.
Все элементы имеют свойства. Все элементы имеют свойства. Эти свойства включают, помимо прочего, проводимость, магнетизм, температуру плавления, температуру кипения, цвет, состояние вещества и другие. Элементы со схожими свойствами сгруппированы вместе в разных областях периодической таблицы элементов. Наблюдение за свойствами элемента позволяет ученым классифицировать его, а также определять его реакционную способность с другими элементами. Расположение элемента в периодической таблице определяет, как он сочетается или не сочетается с другими элементами.
Элементы со схожими свойствами сгруппированы вместе в разных областях периодической таблицы элементов. Наблюдение за свойствами элемента позволяет ученым классифицировать его, а также определять его реакционную способность с другими элементами. Расположение элемента в периодической таблице определяет, как он сочетается или не сочетается с другими элементами.
Элементы в периодической таблице расположены по образцу.
Схема расположения элементов в периодической таблице помогает ученым классифицировать их на основе свойств и реакционной способности. Каждый период (строка) периодической таблицы связан с количеством энергетических уровней, которые вращаются вокруг ядра. Ряд 1 имеет один энергетический уровень; Ряд 2 имеет два уровня энергии; Строка 3 имеет три энергетических уровня и так далее до 7. Количество электронов, вращающихся вокруг ядра атома, будет определять, как этот элемент взаимодействует с другими элементами.
Элементы расположены по образцу в периодической таблице. Схема расположения элементов в периодической таблице помогает ученым классифицировать их на основе свойств и реакционной способности. Каждый период (строка) периодической таблицы связан с количеством энергетических уровней, которые вращаются вокруг ядра. Ряд 1 имеет один энергетический уровень; Ряд 2 имеет два уровня энергии; Строка 3 имеет три энергетических уровня и так далее до 7. Количество электронов, вращающихся вокруг ядра атома, будет определять, как этот элемент взаимодействует с другими элементами.
Схема расположения элементов в периодической таблице помогает ученым классифицировать их на основе свойств и реакционной способности. Каждый период (строка) периодической таблицы связан с количеством энергетических уровней, которые вращаются вокруг ядра. Ряд 1 имеет один энергетический уровень; Ряд 2 имеет два уровня энергии; Строка 3 имеет три энергетических уровня и так далее до 7. Количество электронов, вращающихся вокруг ядра атома, будет определять, как этот элемент взаимодействует с другими элементами.
Различные группы элементов имеют разные свойства.
Свойства элементов, включая, помимо прочего, плотность и реакционную способность, можно предсказать на основе их расположения в периодической таблице. Например, при перемещении по периоду плотность обычно увеличивается. Из-за этого куб одинакового размера из титана, железа и меди может иметь одинаковый объем, но иметь разную плотность. Другие свойства элементов также можно предсказать из периодической таблицы, включая состояние вещества, реакционную способность и проводимость.
Различные группы элементов имеют разные свойства. Свойства элементов, включая, помимо прочего, плотность и реакционную способность, можно предсказать на основе их расположения в периодической таблице. Например, при перемещении по периоду плотность обычно увеличивается. Из-за этого куб одинакового размера из титана, железа и меди может иметь одинаковый объем, но иметь разную плотность. Другие свойства элементов также можно предсказать из периодической таблицы, включая состояние вещества, реакционную способность и проводимость.
Элементы присутствуют в нашей повседневной жизни.
Элемент литий содержится в литиевых батареях, которые питают ваши телефоны, компьютеры и почти все перезаряжаемые устройства. Атомы фтора можно найти в питьевой воде и зубной пасте. Борется с кариесом и кариесом. Кальций необходим для формирования костей и панцирей живых существ. Висмут используется в медицине для лечения диареи и помогает людям чувствовать себя лучше при расстройстве желудка.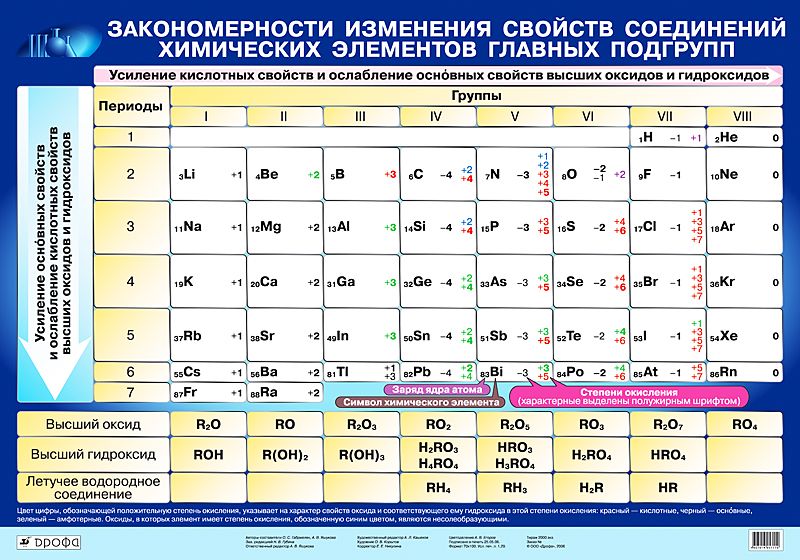 Йод используется в качестве дезинфицирующего средства для кожи, особенно при хирургическом вмешательстве. Хром используется для изготовления блестящих дисков на новых автомобилях. Медь используется внутри электрического провода для проведения электричества.
Йод используется в качестве дезинфицирующего средства для кожи, особенно при хирургическом вмешательстве. Хром используется для изготовления блестящих дисков на новых автомобилях. Медь используется внутри электрического провода для проведения электричества.
Элементы присутствуют в нашей повседневной жизни. Элемент литий содержится в литиевых батареях, которые питают ваши телефоны, компьютеры и почти все перезаряжаемые устройства. Атомы фтора можно найти в питьевой воде и зубной пасте. Борется с кариесом и кариесом. Кальций необходим для формирования костей и панцирей живых существ. Висмут используется в медицине для лечения диареи и помогает людям чувствовать себя лучше при расстройстве желудка. Йод используется в качестве дезинфицирующего средства для кожи, особенно при хирургическом вмешательстве. Хром используется для изготовления блестящих дисков на новых автомобилях. Медь используется внутри электрического провода для проведения электричества.
СВОЙСТВА ЭЛЕМЕНТОВ СЛОВАРЬ
Элемент
Чистые вещества, состоящие только из атомов одного типа.
Атом
Основная единица материи, состоящая из протонов, нейтронов и электронов.
Свойства
Характеристики элементов, которые помогают определить, что они из себя представляют.
Период
Повторяющиеся строки периодической таблицы, демонстрирующие закономерности расположения элементов.
Группа
Элементы, расположенные в вертикальных столбцах периодической таблицы, обладающие одинаковыми свойствами.
Атомный символ
Аббревиатура названия элемента периодической таблицы.
Атомный номер
Число протонов в ядре каждого элемента.
Атомная масса
Средняя масса ядра этого элемента.
Металлы
Элементы, хорошо проводящие электричество и тепловую энергию и часто твердые при комнатной температуре.
СВОЙСТВА ЭЛЕМЕНТОВ ВОПРОСЫ ДЛЯ ОБСУЖДЕНИЯ
Что такое элемент?
Элементы — это чистые вещества, состоящие только из атомов одного типа.
Приведите три примера свойств элементов.

магнетизм, проводимость, температура плавления
Что обозначают строки периодической таблицы?
В периодической таблице есть 7 строк, называемых периодами. Номер каждого периода указывает количество уровней энергии электрона, которые расположены вне ядра.
Приведите два примера того, где вы можете найти элементы в нашей повседневной жизни.
Фтор содержится в зубной пасте и питьевой воде. Аккумуляторы в телефонах и компьютерах сделаны из лития.
Как можно использовать периодическую таблицу для предсказания реактивности?
Элементы с аналогичными свойствами будут реагировать с другими элементами с другими свойствами. Положение элемента в периодической таблице может помочь предсказать, как элементы будут реагировать с другими.
Что такое благородные газы?
Благородные газы — это элементы в 18-м столбце периодической таблицы элементов, обладающие сходными свойствами. Они редко ни на что реагируют, но когда через них пропускаешь электричество, они светятся.

 30, 2016 3157
30, 2016 3157 8, 2015 1819
8, 2015 1819 Для неметаллов ионный радиус увеличивается по мере того, как количество электронов, присутствующих в ионе, превышает количество протонов, вызывая значительное уменьшение заряда ядра.
Для неметаллов ионный радиус увеличивается по мере того, как количество электронов, присутствующих в ионе, превышает количество протонов, вызывая значительное уменьшение заряда ядра. Принимая во внимание, что реактивность увеличивается по мере продвижения от верхних к нижним группам таблицы. Чем дальше вниз или влево мы движемся, тем легче и быстрее становится обмен электронами, увеличивая химическую активность элементов.
Принимая во внимание, что реактивность увеличивается по мере продвижения от верхних к нижним группам таблицы. Чем дальше вниз или влево мы движемся, тем легче и быстрее становится обмен электронами, увеличивая химическую активность элементов. У них есть полностью валентные электронные слои, из-за которых они не теряют и не приобретают электроны легко.
У них есть полностью валентные электронные слои, из-за которых они не теряют и не приобретают электроны легко. Следовательно, они сочетаются друг с другом в полной стабильности.
Следовательно, они сочетаются друг с другом в полной стабильности.