Периодическая система Менделеева • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Господин Менделеев не знал, а его последователи узнали, но начисто позабыли или антинаучно проигнорировали то, что атомы есть комплементарные пары из взаимно дополнительных вложенных друг в друга фундаментальных сущностей вещества: ядер атомов как внутренней сущности и электронных облаков как внешней сущности. Иначе говоря, атомы есть фракталы вложенностей – матрёшки.Отсюда следует, что на самом деле натуральный ряд элементов представляет собой не один ряд элементов, а два комплементарных ряда фундаментальных сущностей вещества – ядер атомов и электронных облаков!
Следующий грубейший научный промах Менделеева и его последователей: начало каждого периода щелочным металлом и окончание благородным газом. Ведь в первом периоде Периодической системы элементов в редакции Менделеева до 1902 года первым являлся не щелочной металл, а неметалл химически активный двух атомный газ водород, имеющий крайне низкую температуру кипения! В то время, как во всех последующих периодах первым был элемент группы щёлочноземельных металлов. Прокол в Периодической таблице элементов жутчайший! А в периодической таблице элементов в редакции Менделеева от 1902 и 1906 годов первым элементом в периодах являлся элемент группы благородных газов.
Прокол в Периодической таблице элементов жутчайший! А в периодической таблице элементов в редакции Менделеева от 1902 и 1906 годов первым элементом в периодах являлся элемент группы благородных газов.
Правильные, естественные окончания абсолютно каждого периода атомного мира материи является не благородный газ, а щёлочноземельный металл – по Мейеру Ю.Л. (приоритет от 1862 года на правильное окончание периодов на элементе группы щёлочноземельных металлов), Менделееву Д.И. (приоритет от 1869 и 1870 годов на правильное предсказание свойств нескольких не известных тогда элементов и исправление атомных масс нескольких известных элементов, а также на формулировку формулы периодического явления, ошибочно названного и до сих пор ошибочно считающегося периодическим законом, и приоритет от 1902 года на гипотезу о двух элементах материального эфира – ньютония и корония, предшествующих водороду), Веберу А. (приоритет от 1905 года на идею отображать каждый из всех периодов одним рядом), Жанету Ч. (приоритет от 1928 года на отображение каждого из всех правильных периодов одним рядом), Резерфорду Э. (приоритет от 1911 года на правильное объяснение устройства атомов из компактного электростатически положительно заряженного ядра и обширного электростатически отрицательного заряженного электронного облака), Мозли Г. (приоритет от 1913 года на экспериментальное, по рентгеновскому спектру, доказательство того, что номер элемента равен количеству протонов я ядре атома или количеству электронов в электронном облаке не ионизированного атома), Бору Н. (приоритет от 1913 года на идею о стационарных орбитах не возбуждённых электронов в оболочках слоёв электронного облака атома), и Макееву А.К. (приоритет от 2000, 2010, 2013 годы на пакет свыше 20 настоящих периодических законов и фундаментальных научных положений, описывающих строение и порядок формирования электронного облака атома по мере роста электростатического заряда ядер атомов; на расширение периодической системы элементов перед водородом на 10 элементов вакуумных уровней материи; создание модели строения материи вакуума и фотона, теоретического доказательства того, что кванты электростатического и магнитного полей в составе материи фотона в их векторах движения имеют скорость в корень квадратный из двух раз быстрее движения всей системы материи фотона в его векторе движения)!
(приоритет от 1928 года на отображение каждого из всех правильных периодов одним рядом), Резерфорду Э. (приоритет от 1911 года на правильное объяснение устройства атомов из компактного электростатически положительно заряженного ядра и обширного электростатически отрицательного заряженного электронного облака), Мозли Г. (приоритет от 1913 года на экспериментальное, по рентгеновскому спектру, доказательство того, что номер элемента равен количеству протонов я ядре атома или количеству электронов в электронном облаке не ионизированного атома), Бору Н. (приоритет от 1913 года на идею о стационарных орбитах не возбуждённых электронов в оболочках слоёв электронного облака атома), и Макееву А.К. (приоритет от 2000, 2010, 2013 годы на пакет свыше 20 настоящих периодических законов и фундаментальных научных положений, описывающих строение и порядок формирования электронного облака атома по мере роста электростатического заряда ядер атомов; на расширение периодической системы элементов перед водородом на 10 элементов вакуумных уровней материи; создание модели строения материи вакуума и фотона, теоретического доказательства того, что кванты электростатического и магнитного полей в составе материи фотона в их векторах движения имеют скорость в корень квадратный из двух раз быстрее движения всей системы материи фотона в его векторе движения)!
Тогда мировой науке официально следует принять то что первый правильный (естественный) период атомных уровней материи содержит 4 элемента, которые радикально отличаются друг от друга по физическим и химическим свойствам: водород (химический активный двух атомный газ), гелий (химически инертный одно атомный газ), литий (химически активный щелочной металл) и бериллий (химически активный щёлочноземельный металл-металлоид). Поэтому последние 4 элемента каждого последующего правильного (естественного) периода позиционно аналогичны неметаллу химически активному подобному галогенам двухатомному газу водороду, неметаллу химически инертному одноатомному газу гелию, химически активному щелочному металлу литию и химически активному щёлочноземельному металлу бериллию!
Поэтому последние 4 элемента каждого последующего правильного (естественного) периода позиционно аналогичны неметаллу химически активному подобному галогенам двухатомному газу водороду, неметаллу химически инертному одноатомному газу гелию, химически активному щелочному металлу литию и химически активному щёлочноземельному металлу бериллию!
В Матрице автоматизма материи – периодической таблице элементов вакуумных и атомных уровней материи Мейера, Жанета и Макеева проявляется очень важный запрет-закон Макеева, не замеченный Паули – запрет каждому слою электронного облака атома заполнять больше чем одну его оболочку в пределах каждого такого естественного периода, в котором этот слой заполняется электронами.
Смотрите подробности здесь:
1. Makeyev A.K. Julius Lothar Meyer was first which built the periodic table of elements // Eropean applied sciences, April, 2013, 4 (2) – pp. 49-61. ISSN 2195-2183
2. Макеев А.К. Система естественных циклов автоматизмов материи. Материалы 1-ой международной научно-практической конференции “Перспективы развития естествознания в 21 веке” // Апробация. Ежемесячный научно-практический журнал, № 2, 2012. 110 с., С. 88-100. ISSN 2305-4484
3. Макеев А.К. Частицы электростатического и магнитного полей в системе материи фотона движутся намного быстрее, чем движется сам фотон. // Научная дискуссия: материалы IV международной заочной научно-практической конференции. Часть I. (20 августа 2012) – Москва: Изд. “Международный центр науки и образования”, 2012. 142 с., С. 47-65. ISBN 978-5-905945-37-3 УДК 08. ББК 94. Н 34. http://www.internauka.org/node/479
4. Макеев А.К. Матрица автоматизмов материи и матрица элементарных артикуляций в каркасе голограммы всезнания // Научно-техническая библиотека. 27 марта 2013. 84 с. http://www.sciteclibrary.ru/rus/catalog/pages/12751.html
Кстати, авторитет и приоритет России, как родины фундаментальной азбучной истины физикохимии – Естественной системы элементов нисколько не пострадал! Ведь автором этой “периодической таблицы” элементов в правильных границах всех периодов и пакета из более чем двадцати настоящих периодических законов и фундаментальных научных положений является гражданин России, москвич Макеев Александр Константинович, врач и мультидисциплинарный исследователь и изобретатель, с приоритетом от 2000 года! В соавторстве с немецким врачом, физиком и химиком Мейером Юлиусом Лотаром, с приоритетом от 1862 года. И в соавторстве с французским инденером и учёным, предпринимателем Жанетом Чарльзом, с приоритетом от 1928 года.
И в соавторстве с французским инденером и учёным, предпринимателем Жанетом Чарльзом, с приоритетом от 1928 года.
Менделеева по справедливости не наградили Нобелевской Премией в 1906 году. Ведь его Периодическая таблица химических элементов грубо не верна в окончаниях всех периодов! Он даже не смог сформулировать ни одного настоящего периодического закона!
Теперь Комитет по присуждению Премии им. Альфреда Нобеля может с чистой душой, не опасаясь проявления со временем подвоха, присудить свою высокую Премию настоящему создателю Естественной системы элементов и открывателю целого пакета настоящих периодических законов россиянину Макееву Александру Константиновичу! Ау, нынешние Нобелевские Лауреаты, имеющие на то право, замолвите словечко в Нобелевский Комитет, пожалуйста!
Периодический закон Менделеева и периодическая система химических элементов
Периодический Закон Д.И. Менделеева
Периодический закон Д.И. Менделеева и периодическая система химических элементов имеет большое значение в развитии химии. Окунемся в 1871 год, когда профессор химии Д.И. Менделеев, методом многочисленных проб и ошибок, пришел к выводу, что
Окунемся в 1871 год, когда профессор химии Д.И. Менделеев, методом многочисленных проб и ошибок, пришел к выводу, что
«… свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Периодичность изменения свойств элементов возникает вследствие периодического повторения электронной конфигурации внешнего электронного слоя с увеличением заряда ядра.
Современная формулировка периодического закона
звучит следующим образом
«свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Преподавая химию, Менделеев понимал, что запоминание индивидуальных свойств каждого элемента, вызывает у студентов трудности. Он стал искать пути создания системного метода, чтобы облегчить запоминание свойств элементов. В результате появилась естественная таблица, позже она стала называться периодической.
В результате появилась естественная таблица, позже она стала называться периодической.
Наша современная таблица очень похожа на менделеевскую. Рассмотрим ее подробнее.
Таблица Менделеева
Периодическая таблица Менделеева состоит из 8 групп и 7 периодов. Рассмотрим подробнее что такое период и что такое группа в периодической таблице Менделеева.
Группы в таблице Менделеева
Вертикальные столбцы таблицы называют группами.
Элементы, внутри каждой группы, обладают сходными химическими и физическими свойствами. Это объясняется тем, что элементы одной группы имеют сходные электронные конфигурации внешнего слоя, число электронов на котором равно номеру группы. При этом группа разделяется на главные и побочные подгруппы.
В Главные подгруппы входят элементы, у которых валентные электроны располагаются на внешних ns- и np- подуровнях.
В Побочные подгруппы входят элементы, у которых валентные электроны располагаются на внешнем ns- подуровне и внутреннем (n — 1) d- подуровне (или (n — 2) f- подуровне).
Все элементы в периодической таблице, в зависимости от того, на каком подуровне (s-, p-, d- или f-) находятся валентные электроны классифицируются на:
- s- элементы (элементы главной подгруппы I и II групп),
- p- элементы (элементы главных подгрупп III — VII групп),
- d- элементы (элементы побочных подгрупп),
- f- элементы (лантаноиды, актиноиды).
Высшая и низшая степени окисления элементов
Высшая валентность элемента и высшая степень окисления (за исключением O, F, элементов подгруппы меди и восьмой группы) равна номеру группы, в которой он находится.
Низшая степень окисления элемента равна
Номер группы — 8
Для элементов главных и побочных подгрупп одинаковыми являются формулы высших оксидов (и их гидратов).
В главных подгруппах состав водородных соединений являются одинаковыми, для элементов, находящихся в этой группе.
Твердые гидриды образуют элементы главных подгрупп I — III групп, а IV — VII групп образуют а газообразные водородные соединения. Водородные соединения типа ЭН4 – нейтральнее соединения, ЭН3 – основания, Н2Э и НЭ — кислоты.
Периоды в таблице Менделеева
Горизонтальные ряды таблицы называют периодами. Элементы в периодах отличаются между собой. Общим является то, что последние электроны находятся на одном энергетическом уровне (главное квантовое число n — одинаково).
- Первый период отличается от других тем, что там находятся всего 2 элемента: водород H и гелий He.
- Во втором периоде находятся 8 элементов (Li — Ne). Литий Li – щелочной металл начинает период, а замыкает его благородный газ неон Ne.
- В третьем периоде, также как и во втором находятся 8 элементов (Na — Ar). Начинает период щелочной металл натрий Na, а замыкает его благородный газ аргон Ar.

- В четвёртом периоде находятся 18 элементов (K — Kr) – Менделеев его обозначил как первый большой период. Начинается он также с щелочного металла Калия, а заканчивается инертным газом криптон Kr. В состав больших периодов входят переходные элементы (Sc — Zn) — d-элементы.
- В пятом периоде, аналогично четвертому находятся 18 элементов (Rb — Xe) и структура его сходна с четвёртым. Начинается он также с щелочного металла рубидия Rb, а заканчивается инертным газом ксеноном Xe. В состав больших периодов входят переходные элементы (Y — Cd) — d-элементы.
- Шестой период состоит из 32 элементов (Cs — Rn). Кроме 10 d-элементов (La, Hf — Hg) в нем находится ряд из 14 f-элементов (лантаноиды) — Ce — Lu
- Седьмой период не закончен. Он начинается с Франция Fr, можно предположить, что он будет содержать, также как и шестой период, 32 элемента, которые уже найдены (до элемента с Z = 118).

Как определить металл или неметалл?
Если посмотреть на периодическую таблицу Менделеева и провести воображаемую черту, начинающуюся у бора и заканчивающуюся между полонием и астатом, то все металлы будут находиться слева от черты, а неметаллы главных подгрупп – справа.
Элементы, непосредственно прилегающие к этой линии будут обладать свойствами как металлов, так и неметаллов. Их называют металлоидами или полуметаллами. Это бор, кремний, германий, мышьяк, сурьма, теллур и полоний.
Как изменяются свойства элементов в Периодической таблице?
Правило октета
Правило октета утверждает, что все элементы стремятся приобрести или потерять электрон, чтобы иметь восьмиэлектронную конфигурацию ближайшего благородного газа. Т.к. внешние s- и p-орбитали благородных газов полностью заполнены, то они являются самыми стабильными элементами.
Согласно правилу октета, при движении по периодической таблице слева направо для отрыва электрона требуется больше энергии. Поэтому элементы с левой стороны таблицы стремятся потерять электрон, а с правой стороны – его приобрести.
Поэтому элементы с левой стороны таблицы стремятся потерять электрон, а с правой стороны – его приобрести.
Изменение энергии ионизации
Энергия ионизации – это количество энергии, необходимое для отрыва электрона от атома.
- Энергия ионизации уменьшается при движении вниз по группе, т.к. у электронов низких энергетических уровней есть способность отталкивать электроны с более высоких энергетических уровней. Это явление названо эффектом экранирования. Благодаря этому эффекту внешние электроны менее прочно связаны с ядром.
- Двигаясь по периоду энергия ионизации плавно увеличивается слева направо. Самая высокая энергия ионизации у инертных газов.
Изменение сродства к электрону
Сродство к электрону – изменение энергии при приобретении дополнительного электрона атомом вещества в газообразном состоянии.
- При движении по группе вниз сродство к электрону становится менее отрицательным вследствие эффекта экранирования.
Изменение электроотрицательности
Электроотрицательность — мера того, насколько сильно атом стремится притягивать к себе электроны связанного с ним другого атома.
Электроотрицательность увеличивается при движении в периодической таблице слева направо и снизу вверх. При этом надо помнить, что благородные газы не имеют электроотрицательности. Таким образом, самый электроотрицательный элемент – фтор.
Итак, в периодической зависимости находятся такие свойства атома, которые связанны с его электронной конфигурацией: атомный радиус, энергия ионизации, электроотрицательность.
Изменение металлических и неметаллических свойств атомов
Неметалличность атома увеличивается при движении в периодической таблице слева направо и снизу вверх.
Изменение основных и кислотных свойств оксидов и гидроксидов
Основные свойства оксидов уменьшаются, а кислотные свойства увеличиваются при движении слева направо и снизу вверх. При этом кислотные свойства оксидов тем сильнее, чем больше степень окисления образующего его элемента
По периоду слева направо основные свойства гидроксидов ослабевают.
По главным подгруппам сверху вниз сила оснований увеличивается. При этом, если металл может образовать несколько гидроксидов, то с увеличением степени окисления металла, основные свойства гидроксидов ослабевают.
По периоду слева направо увеличивается сила кислородосодержащих кислот. При движении сверху вниз в пределах одной группы сила кислородосодержащих кислот уменьшается. При этом сила кислоты увеличивается с увеличением степени окисления образующего кислоту элемента.
По периоду слева направо увеличивается сила бескислородных кислот. При движении сверху вниз в пределах одной группы сила бескислородных кислот увеличивается.
На рисунке ниже схематично показано изменение свойств атомов химических элементов в периодах и группах периодической таблицы Менделеева
Задания и примеры по строению таблицы Менделеева, положению атомов химического элемента в ней и закономерностям изменения свойств атомов элементов в периодах и группах периодической таблицы Менделеева представлены с разделе Задачи к разделу Периодический закон Д.И. Менделеева и периодическая система химических элементов
Периодическая таблица и физические свойства
Главная подгруппа V группы периодической системы химических элементов Д. И. Менделеева включает пять элементов азот N, фосфор Р, мышьяк Аа, сурьму 8Ь и висмут В1. Каждый из этих элементов на внешнем слое имеет 5 электронов (конфигурация С увеличением атомного номера свойства простых веществ, образованных атомами элементов этой подгруппы, закономерно изменяются увеличивается плотность, усиливается окраска, уменьшается электроотрицательность.
 Азот и фосфор — типичные неметаллы, висмут имеет больше металлических свойств. Мышьяк и сурьма занимают промежуточное положение. Многие их соединения обладают полупроводниковыми свойствами. Физические свойства элементов приведены в таблице 26, свойства простых веществ в таблице 27. [c.118]
Азот и фосфор — типичные неметаллы, висмут имеет больше металлических свойств. Мышьяк и сурьма занимают промежуточное положение. Многие их соединения обладают полупроводниковыми свойствами. Физические свойства элементов приведены в таблице 26, свойства простых веществ в таблице 27. [c.118] Между положением в периодической таблице легких элементов и их химическими свойствами не всегда обнаруживается закономерная взаимосвязь. Например, бериллий (II группа) во многих отношениях напоминает алюминий (группа ША) много общего также между бором и кремнием. Степени окисления этих элементов соответствуют номерам их групп, но, судя по свойствам образуемых ими соединений, по кислотно-основным характеристикам этих элементов и их физическим свойствам, между ними существует необычная для периодической системы диагональная связь. Причиной этого является сходство так называемых ионных потенциалов у диагонально расположенных в периодической таблице пар элементов. Ионным потенциалом (не пу- 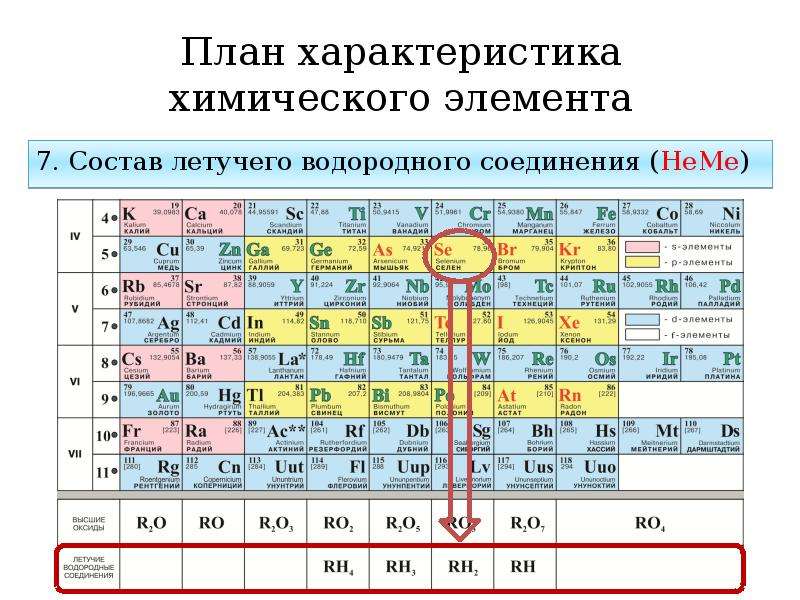
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА — естественная система химических элементов, созданная гениальным русским химиком Д. И. Менделеевым. Расположив элементы в последовательности возрастания атомных масс и сгруппировав элементы с аналогичными свойствами, Д. И. Менделеев составил таблицу элементов, закономерности которой теоретически вытекают из сформулированного им периодического закона Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, находятся в периодической зависимости от их атомного веса (1869—1871 гг.). Периодический закон и периодическая система элементов Д. И. Менделеева позволяют установить свя ь между всеми химическими элементами, предсказать существование ранее неизвестных элементов и описать их свойства. Как впоследствии стало известно, периодичность в изменении свойств элементов обусловлена числом электронов в атоме, электронной структурой атома, периодически изменяющейся по мере возрастания числа электронов.
Период полураспада (Т.
 д)- время, за которое количество нестабильных частиц уменьшается наполовину. П. п.— одна из основных характеристик радиоактивных изотопов, неустойчивых элементарных (фундаментальных) частиц. Периодическая система элементов Д. И. Менделеева — естественная система химических элементов. Расположив элементы в порядке возрастания атомных масс (весов) и сгруппировав элементы с аналогичными свойствами, Д. И. Менделеев составил таблицу элементов, выражающую открытый им периодический закон Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, стоят в периодической зависимости от их атомного веса (1869—1871 гг.). Периодический закон и периодическая таблица элементов Д. И. Менделеева позволяют установить взаимную связь между всеми известными химическими элементами, предсказать существование ранее неизвестных элементов и описать их свойства. На основе закона и периодической системы Д. И. Менделеева найдены закономерности в свойствах химических соединений различных элементов, открыты новые элементы, получено много новых веществ.
д)- время, за которое количество нестабильных частиц уменьшается наполовину. П. п.— одна из основных характеристик радиоактивных изотопов, неустойчивых элементарных (фундаментальных) частиц. Периодическая система элементов Д. И. Менделеева — естественная система химических элементов. Расположив элементы в порядке возрастания атомных масс (весов) и сгруппировав элементы с аналогичными свойствами, Д. И. Менделеев составил таблицу элементов, выражающую открытый им периодический закон Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, стоят в периодической зависимости от их атомного веса (1869—1871 гг.). Периодический закон и периодическая таблица элементов Д. И. Менделеева позволяют установить взаимную связь между всеми известными химическими элементами, предсказать существование ранее неизвестных элементов и описать их свойства. На основе закона и периодической системы Д. И. Менделеева найдены закономерности в свойствах химических соединений различных элементов, открыты новые элементы, получено много новых веществ.

Рассмотрение табл. 7-2 показывает, что Менделееву удалось очень точно предсказать физические и химические свойства недостававшего в его системе эле.мента. Этому элементу отводилось место в периодической таблице под кремнием, 81, и над оловом, 8п. Физические свойства германия представляют собой как раз нечто среднее между свойствами кремния и олова. Для предсказания химических свойств экасилиция Менделеев воспользовался также данными о закономерном изменении свойств в триаде фосфор-мышьяк-сурьма (8Ь), являющейся в периодической таблице правым соседом триады кремний-экасилиций-олово. [c.310]
Большую часть материала, изложенного в данной главе, намного легче понять и запомнить, если руководствоваться некоторыми закономерностями в физических и химических свойствах элементов, связанных с их положением в периодической таблице.
Далее мы видим, что внешние электронные оболочки сходны у атомов элементов (Ы, Ыа, К, 1 Ь, Сз) (Ве, Мд, Са, 8г) (Р, С1, Вг, Л) (Не, Ые, Аг, Кг, Хе) и т.,д. Именно поэтому каждая из вышеприведенных групп оказывается Б определенной группе периодической таблицы Ы, Ыа К, НЬ, Сб — в I группе, Р, С1, Вг, Л — в VII и т. д. Именно вследствие сходства строения электронных оболочек сходны их физические и химические свойства.
Развитие химии в период творческой деятельности Д. И. Менделеева привело ученого к выводу, что свойства химических элементов определяются их атомной массой, т. е. величиной, характеризующей относительную массу атома. Поэтому в основу систематики элементов он положил именно атомный вес, как фактор, от которого зависят физические и химические свойства элементов. Д. И. Менделеев сформулировал периодический закон так свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов . Вслед за открытием закона Д. И. Менделеев опубликовал периодическую систему элементов, в которой вертикальные ряды сходных элементов назвал группами, а горизонтальные ряды, в пределах которых закономерно изменяются свойства элементов от типичного металла до типичного неметалла,— периодами. Современная периодическая система химических элементов Д. И. Менделеева состоит из семи периодов и восьми групп и содержит 105 элементов. Порядковый номер элемента в периодической системе не только определяет его положение в таблице, но и отражает важнейшее свойство атомов — величину заряда их ядер. Поэтому периодический закон Д. И. Менделеева в настоящее время формулируется так свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядер атомов элементов.
В настоящей книге подробно описаны подготовка и выполнение демонстрационных опытов на лекциях но курсу неорганической химии (руководство содержит свыше 350 экспериментов). В ней перечислены экспонаты, образцы свободных элементов и химических соединений, которые рекомендуется демонстрировать в различных разделах этого курса, и приведены таблицы, характеризующие некоторые физические свойства элементов периодической системы Д. И. Менделеева. [c.3]
Недостатком разделения элементов по подгруппам на основании физических методов исследования является то, что для разных свойств получаются разные варианты таблицы. Так, например, по своим спектральным свойствам водород аналогичен щелочным металлам, а гелий — щелочноземельным. Поэтому оба эти элемента в таблице периодической системы в работах, посвященных спектроскопическим исследованиям химических элементов, помещаются в первой и во второй группах,где по этим свойствам им и надлежит быть. Однако нахождение гелия во второй группе при классификации, учитывающей не спектральные, а какие-либо другие физические свойства, оказывается совершенно неоправданньом. [c.274]
В данном приложении приведены таблицы, характеризующие некоторые физические свойства элементов периодической системы Д. И. Менделеева, а также схемы ряда химических производств, которые целесообразно рассмотреть в соответствующих разделах курса неорганической химии. [c.169]
Вертикальные колонки периодической таблицы называют группами химических элементов (переходы между короткими и длинными периодами в табл. 5.1 показаны стрелками). Элементы, входящие в одну группу, можно называть родственными эти элементы обладают весьма близкими физическими и химическими свойствами. [c.104]
Периодическая таблица представляет собой одно из выдаЮ щихся систематизирующих достижений в физике. Среди примерно ста элементов есть группы, имеющие очень близкие химические и физические свойства галогены Р, С1, Вг, I и щелочные металлы Ы, N8, К, КЬ, Сз служат типичными примерами таких групп. В середине XIX в. было предпринято много попыток выявить тот признак элементов, на основании которого можно было бы естественным образом распределить их по группам с одинаковыми свойствами. Эта задача была решена Д. И. Менделеевым, указавшим в 1869 г., что физические и химические свойства элементов и их соединений периодически зависят от их атомных весов. [c.50]
Следует заметить (см. рис. 11 [32]), что потенциалы ионизации, являющиеся мерой прочности связи с ядром внешних электронов (см. предпоследний столбец в табл. 14), показывают ту же периодичность, что и химические и физические свойства, использованные при построении периодической таблицы. [c.229]
Уже в первых вариантах периодической таблицы Менделеев оставил пустые места для трех новых элементов, которые он назвал экаалюминием, экасилицием и экабором (приставка эка на санскрите означает один ). Развернутое описание свойств этих элементов он дал в 1871 г. в первой подробной статье о периодическом законе Периодическая законность химических элементов . Однако эта статья, как и более ранние сообщения Менделеева, прошла почти незамеченной, и до 1875 г. об этом открытии в мировой химической литературе почти не упоминалось. В 1875 г. французский химик Лекок де Буабодран сообщил об открытии нового элемента, который он назвал галлием в честь Франции. Менделеев сразу же сообщил на заседании Русского химического и Русского физического обществ, что галлий – это предсказанный им четыре года тому назад экаалюминий и написал об этом в Парижскую академию наук, дополнив первое краткое описание де Буабодрана. Более того, он указал, что плотность металлического галлия должна быть не 4,7, как нашел де Буабодран, а 5,9-6,0 г/см . Буабодран тщательно очистил галлий и опреде- [c.231]
Физический смысл периодичности химических свойств состоит в периодическом изменении конфигурации электронов на внешнем энергетическом уровне (валентных электронов) с увеличением заряда ядра. Графическим изображением периодического закона является периодическая таблица. Она состоит из 7 периодов и 8 групп. [c.83]
Ранее мы уже отмечали (см. гл. 3), что электроотрицательность элементов обычно увеличивается при перемещении вправо вдоль периода, но уменьшается при перемещении вниз по группе. В результате этого наиболее реакционноспособные металлы сосредоточены в нижнем левом углу периодической таблицы, а наиболее реакционноспособные неметаллы — в верхнем правом углу. Эта закономерность достаточно подробно обсуждается в школьной учебной литературе и поэтому хорошо известна заинтересованному читателю. К сожалению, очень редко обращается внимание на другую, казалось бы частную, но также очень важную закономерность — существование так называемых диагональных соотношений в периодической таблице. Каждое диагональное соотношение связывает между собой пару элементов, находящихся в соседних группах, но обладающих сходными химическими и физическими свойствами. Классически- [c.223]
Вместе с тем многие физические свойства элементов соответствуют их положению в периодической системе. Температуры плавления и кипения типичных металлов (табл. 6.7), как правило, повышаются при переходе снизу вверх вдоль группы, а для неметаллов, наоборот, возрастают при переходе сверху вниз вдоль группы. Плотность металлов в общем связана с их положением в периодической системе. Наименее плотные металлы относятся к группам I и II иногда их так и называют легкими металлами . Наиболее плотные элементы, естественно, обнаруживаются среди тех, у которых самый большой атомный вес и самый маленький атомный объем, следовательно, в середине нижней части таблицы. Самым плотным элементом является осмий, его плотность равна 22,84 г/см . Окраска элементов почти не связана с их положением в периодической системе, если не считать того, что все элементы группы VIIА—галогены — обладают окраской. Большинство металлов имеют белый цвет, но все металлы с желтой окраской (Си, Ag и Аи) располагаются в группе 1Б. В дальнейшем (см. гл. 10) мы убедимся, что элементы одной группы кристаллизуются в сходных формах вследствие сходства их степени окисления, электроотрицательности и характера химической связи. [c.105]
В 1954 г. была издана книга Цейзе Термодинамика [4384], в которой приводятся таблицы термодинамических свойств, опубликованные в периодической литературе до 1953 г. В связи с тем, что все таблицы приведены без каких-либо уточнений по сравнению с оригинальными работами, в том числе опубликованными в начале тридцатых годов, в книге содержится много устаревших и неточных данных. Таблицы перечисленных авторов либо охватывают малый температурный интервал, либо вычислены слишком приближенно (часто с использованием устаревших исходных данных), либо не охватывают многих компонентов продуктов сгорания. К этому времени были уточнены или определены впервые физические и термические константы для многих атомов и молекул, что наряду с достигнутым развитием статистических методов расчета термодинамических величин позволило вычислить более полные и точные таблицы термодинамических свойств для большего числа многофазных компонентов продуктов сгорания топлив. [c.11]
В различных вариантах таблицы Периодической системы водород включается либо в первую, либо в седьмую группы элементов, либо одновременно в обе. Более обосновано помещение водорода в седьмую группу. Подобно галогенам, он способен присоединять. тишь один электрон до завершения устойчивой электронной конфигурации. При этом водород, как и галогены, образует солеподобные соединения с наиболее актигин ,1ии металлами (гидриды), например NaH, СаНг. Гидриды — ионные соединения, п которых отрицательным ионом является Н . Ближе к галогенам водород и по физическим свойствам. [c.206]
Селен и теллур в элементарном состоянии отличаются от серы своими физическими свойствами этого и следовало ожидать, учитывая относительное положение данных элементов в периодической таблице. Они обладают более высокими температурами плавления, температурами кипения и плотностями, как это видно из данных, приведенных в табл. 25. [c.300]
Однако прежде чем говорить о возникновении про блемы элемента № 61, мы хотим сделать несколько замечаний. Начать хотя бы с того, что биография этого элемента настолько своеобразна, что вряд ли сыщется что-либо подобное у других 102 элементов периодической таблицы. Решение вопроса об элементе № 61 было блистательным примером сотрудничества химии и физики там где одна наука оказывалась в тупике, ей на помощь приходила другая,— и это дает нам основания выделить в истории элемента № 61 химические и физические этапы. И, наконец, получение прометия в количествах, измеряемых граммами, и изучение его свойств отнюдь не означает решения проблемы наоборот, перед исследователями встали новые задачи. [c.152]
Первое сообщение в Русском Химическом Обществе Д. И. Менделеев сделал в марте 1869 г. в нем он дал распределение элементов в порядке возрастающих атомных весов, показанное в табл. 3-3. Можно видеть, что расположение элементов, предложенное Менделеевым, мало отличается от того, которое за пять лет до этого дал Одлинг. Однако Менделеев первый оценил значение этой периодичности. В первой статье он считает групповое сходство элементов настолько важным, что в случае необходимости изменяет порядок элементов, вопреки значениям атомных весов, чтобы сохранилось групповое сходство химических свойств. Он указывал, что это может служить доказательством неправильности известных в то время значений атомных весов, и, в частности, особенно отметил атомные веса теллура и иода. Интересно и важно, что Д. И. Менделеев оставил свободные места в своей таблице и для еще не открытых элементов и даже высказал мнение, что химические и физические свойства этих элементов можно правильно предсказать на основании их положения в таблице. Летом 1871 г. Д. И. Менделеев опубликовал более точную формулировку периодического закона и более известную сейчас форму таблицы (табл. 3-4). Хотя эта форма таблицы несколько отличается от короткой формы, используемой иногда и теперь, в основном она та же самая. [c.83]
Работа химика весьма часто заключается в определении физических и химических характеристик веществ. Группировать эпи данные можно различными способами. Самый лучший способ — это гакой, который позволяет выявить закономерности в экспериментальных величинах. Очень часто наличие таких закономерностей стимулирует работы по исследованию причин их существования. Разработка периодической таблицы является великолепным примером ценности такого подхода (гл. II, разд. Б.4). Вспомните, как вы предсказывали свойства элементов, исходя из знания свойств элементов, расположенных рядом. [c.184]
При взаимодействии с другими элементами периодической таблицы хлор образует многочисленные соединения-хлориды, которые в зависимости от свойств партнера (металла или неметалла) могут быть либо солями хлористоводородной кислоты, либо несолеобразными хлоридами. Примером монотонного изменения физических и химических свойств от основных к кислотным и от солей [c.26]
Jи ич Периодическая таблица приведена на форзаце. По- ябпща рядок расположения элементов характеризуется периодическим изменением их физических и химических свойств. Периодичность означает повторение свойств через правильные интервалы. Так, щелочные металлы, галогены и благородные газы располагаются в таблице через правильные интервалы в 8 или 18 элементов. Такой порядок изменения свойств является следствием способа заполнения электронных оболочек атомов (разд. 2.5.3). [c.358]
Предложенная Менделеевым периодическая таблица со временем подверглась изменениям, однако в основном ее построение осталось неизменным. Наиболее важному изменению в концепции о периодичности подвергся сам принцип расположения элементов в определенной последовательности. Оказалось, что положение каждого элемента в этой последовательности определяется не атомным весом, а порядковым (атомным) номером. Поэтому современная формулировка периодического закона гласит при расположении элементов в последовательности возрастани.ч порядковых (атомных) номеров их физические и химические свойства обнаруживают периодические изменения (см. рис. 6.4). [c.89]
К физическим свойствам элементов. Графики занисимости между атомными весами и температурами плавления, температурами кипения, коэффициентами расширения и магнитной восириимчивостп, мольными объемами, частотами колебаний и потенциалами ионизации показывают периодические возрастания и убывания. Некоторые из таких данных приведены в табл. 2. Температуры плавления взяты из таблиц Ландольта — Бернштейна. Атомные объемы, использованные в работе Лотара Мейера, установившего их периодичность, были в дальнейшем пересмотрены Бауром [2], по даппым которого построен приведенный на рис. 1 график. Периодичность изменения свойств сжимаемости элементов впервые была обнаружена Ричардсом [3], п некоторые из его данных прпведены в табл. 2. Использованные им величины, как правило, относились к температуре 293,1° К и были выра кены в обратных мегабарах. Более точные величины получены Бриджменом [4] для температуры 303,1° К, причем в качестве единиц измерения он использовал (кг1см ) . Данные Бриджмена относятся к бесконечно малым давлениям, и они получены экстраполяцией сжимаемостей, измеренных при различных давлениях. За исключением водорода, азота, кислорода, галогенов и редких газов, атомные объемы и сжимаемости приведены для элементов в твердом состоянии. [c.191]
Вещества, самопроизвольно испускающие радиацию, называются радиоактивными. Молекулы этих веществ содержат атомы элементов, для которых найдено, что они обладают указанным свойством. Переходы радиоактивных элементов и их отношение к стабильным элементам периодической таблицы установлены из рассмотрения излучений, которые они испускают, и по свойствам вновь образующихся атомов. Изучением излучения занимается физика рассмотрение остатков ядер является областью химии способ исследования, исиользованнып ири изучении скоростей радиоактивного распада атомов, отражает возможности и методы физической химии. [c.201]
Плутоний принадлежит к элементам VH периода таблицы Менделеева и следует в нем за ураном и нептунием. В отношении места этих элементов в периодической системе в настоящее время наиболее распространена теория Сиборга [3, гл. 17 170, 203, гл. 11 646, 648]. По этой теории у элементов, начиная формально с тория и кончая лауренсием, происходит последовательное заполнение четырнадцатью электронами внутреннего энергетического уров1НЯ 5/. Так как количество внешних валентных электронов (один электрон 6d и два —7s) при этом не меняется и остается рав ным количеству валентных электронов актиния, химические и физические свойства членов ряда должны быть сходны, а сам ряд получил название актинидов. Подобная закономерность четко выражена у лантанидов, имеющих электронную структуру сверх структуры ксенона if ndQs и главную валентность 3. [c.13]
Карбонилы металлов представляют особый интерес для химии металлов. Эта группа соединений не только обнаруживает некоторые поразительные физические свойства, но их строение является необычайным вызовом по адресу всех теорий химических связей. Образующие истинные карбонилы элементы располагаются в группах VI, VII и VIII периодической системы Менделеева. В таблице помещены карбонилы этих металлов. [c.222]
Окончательный и самый важный шаг в разработке периодической таблицы был сделан в 1869 г., когда русский химик Дмитрий Иванович Менделеев (1834—1907) выполнил работу но тщательному изучению соотношения между атомными весами элементов и их физическими и Х1[мическими свойствами, обратив при этом особое внимание, на валентность (гл. IX и X). Менделеев предложил периодическую таблицу, содержащую 17 столбцов, в общем похожую на периодическую таблицу, воспроизведенную в этой книге (табл. 4), но не вклкчаю]цую инертные газы (в то время инертные газы еще не были открыты, см. далее раздел 4). Затем Менделеев пересмотрел эту таблицу и передвинул, некоторые элементы на другие места, соответствующие уточненным значениям их атомных весов. В 1871 г. Менделеевым и независимо от него немецким химиком Лотаром [c.89]
Вертикальные колонки периодической таблицы с переходами между короткими и длинными периодами называются группами химических элементов. Элементы, входяище в одну и ту же группу, можно называть род-4 твеннымщ эти элементы обладают весьма близкими физическими и химическими свойствами. [c.93]
Исключительное положение водорода в периодической системе легко объясняется на основании теории Косселя, если принять во внимание, что он стоит в таблице до гелия. Так как Н в нейтральном состоянии обладает только одним электроном и поэтому может отдать только один электрон, он, следовательно, в определенном отношении подобен щелочным металлам, которые равным образом отдают только один электрон. Однако Н сильно отличается от щелочных металлов и вообще от всех металлов тем, что его электрон сравнительно прочно связан (ср. с табл. 22). Благодаря этому Н оказывается неметаллом, несмотря на то, что в своих соединениях он большей частью положительно заряжен. Его расположение перед гелием, инертным газом с двумя электронами приводит к тому, что оп может быть также электроотрицательным. Чтобы приобрести конфигурацию инертного газа, ему нужно присоединить только один электрон. Благодаря этому и в согласии с свойственным ему неметаллическим характером, проявляюпршся также в его физических свойствах, водород, несомненно, стоит ближе к галогенам, чем к щелочным металлам. [c.154]
Отсутствие справочного материала, связанного со свойствами изотопов, существенно снижает, по мнению редакторов, полезность первого издания книги, как источника информации. В связи с тем, что монография Изотопы свойства, получение, применение в значительной мере носит информационный, обзорный характер, было решено дополнить 2-е издание справочными данными, которые читатель найдёт в приложениях и на форзацах книги. В периодической таблице элементов приведены данные по распространённости стабильных изотопов, уточнённые профессором A.B. Тихомировым (Курчатовский институт). Группой сотрудников ОИЯИ под руководством профессора Ю.П. Гангрского были подготовлены таблицы свойств ядер вблизи линии стабильности. Из ряда справочников Физические величины под редакцией академика И. К. Кикоина и других систематизированы и собраны воедино данные по физическим свойствам элементов, важные для понимания изотопных явлений. [c.9]
Фосфористые водороды. Как простое вещество фосфор яе проявляет, как мы убедились, никаких, сходств с азотом ни в формах своих аллотропных модификаций, ни тем более в их физических и химических свойствах. Фосфор представляется нам при прямом сличении с азотом скорее его анггиподом, чем аналогом. Это впечатление лишь еще более укрепляетс я при сличении кислородных соединений обоих элементов одинаковыми в них оказываются лишь валентности, но не формы и не свойства йи их окислов, ни гидратов окислов. Химическую родственность фосфора с азотом заведомо нельзя было бы установить через непосред-твенное, прямое сличение обоих элементов, а лишь опосредствованно— -через периодический закон. Естествершо, что при первоначальных эмпи-рических группировках элементов никто никогда не помещал фосфор рядом с азотом. Если судить о химических элементах по свойствам как отвечающих им простых веществ, так и образуемых ими соединений с тем или иным третьим элементом, то на первый план выступит сходство фосфора не с азотом, а с соседним с фосфором элементом периодической таблицы — серой. [c.353]
Какая она, современная таблица Менделеева?
События и даты
17.03.2017 7609Какая она, современная таблица Менделеева?
17 марта 1950 года в университете Беркли (штат Калифорния, США) искусственным путем был получен новый радиоактивный химический элемент, которому присвоили атомный номер 98 в периодической системе и символ Cf (Californium). Как писали авторы, этим названием они хотели указать, что открыть данный элемент было так же трудно, как век назад колонистам-первопроходцам добраться до Калифорнии. Сравнительно большие количества этого элемента были получены путем длительного облучения плутония в атомных реакторах. В мире существует буквально несколько граммов этого вещества. Калифорний чрезвычайно летучий металл. Он существует в двух полиморфных модификациях.Кстати, сама периодическая таблица была представлена Дмитрием Ивановичем Менделеевым 18 марта 1868 года – через год и один день мы будем праздновать малый юбилей.
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
В начале XX века с открытием строения атома было установлено, что периодичность изменения свойств элементов определяется не атомным весом, а зарядом ядра, равным атомному номеру и числу электронов, распределение которых по электронным оболочкам атома элемента определяет его химические свойства.
Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, в которые помещались всё новые и новые элементы: благородные газы, природные и искусственно полученные радиоактивные элементы. В 2010 году, с синтезом 118 элемента, седьмой период периодической системы был завершён, проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии.
В период с 2003 по 2009 год, был утвержден ИЮПАК. 113-й химический элемент, открытый специалистами японского института естественных наук «Рикэн», получил название нихоний.
Элементы 115 и 117 получили названия московий (Mc) и теннессин (Ts) в соответствии с предложениям ОИЯИ, а также Национальной лаборатории Ок-Ридж, Университета Вандербильта и Ливерморской национальной лаборатории в США.
118-й элемент получил название Оганесон (Og) в честь профессора Юрия Оганесяна, внесшего вклад в исследования сверхтяжелых элементов. Наименование было предложено коллективами Объединенного института ядерных исследований и Ливерморской национальной лаборатории.
Уверены, что среди наших выпускников будут те, кто заполнит пока пустующие ячейки в 8 периоде!
Японские ученые разработали новую таблицу элементов — Российская газета
Сообщение о создании учеными Киотского университета новой периодической системы химических элементов сразу облетело мировые СМИ. Что и понятно. Ведь когда-то таблица Менделеева стала одним из величайших открытий в химии. Она внесла удивительный порядок в, казалось бы, хаотическое нагромождение разнообразных элементов. Наш великий соотечественник расположил элементы так, чтобы соседи по столбцу имели схожие химические свойства.
Что же нового придумали японцы? Здесь важно подчеркнуть, что, создавая свою таблицу, Менделеев ничего не знал ни о строении атома, ни о его ядре, ни о том, что электроны расположены на оболочках. А самое главное, что в одном столбце его таблицы находятся элементы с одним и тем же числом электронов на последней электронной оболочке. Все это было открыто через много лет. Можно сказать, что Менделеев совершил свое открытие не только во сне, но с завязанными глазами. И очередной раз можно только поразиться его предвидению.
У японцев ситуация принципиально иная. У них глаза широко раскрыты. Их таблица создана на основе уже имеющихся знаний о ядре атомов, состоящих из протонов и нейтронов. Еще в 1963 году была присуждена Нобелевская премия за модель, согласно которой протоны и нейтроны в ядре тоже расположены на оболочках. Ядро, у которого последняя протонная нейтронная оболочка полностью заполнена, особенно устойчиво, не вступает в ядерные реакции. Но практически не вступают в химические реакции и инертные газы, у которых полностью заполнена последняя электронная оболочка.
Аналогия очевидна. Именно на ней японские ученые и построили свою периодическую таблицу, взяв за основу не электронные, а протонные оболочки атомных ядер. И подход очевиден: надо “плясать от печки” – от ядер с полностью заполненными протонными оболочками. Это гелий, кислород, кальций, никель, олово, свинец и флеровий. Число протонов в их ядрах составляет 2, 8, 20, 28, 50, 82 и 114, соответственно. Эти числа называют магическими за ту особую устойчивость, которую они придают ядрам.
Именно эти элементы японские ученые расположили в одном столбце, аналогичном столбцу инертных газов в таблице Менделеева. На основе такого столбца они и создали свою таблицу, расположив в строках элементы слева направо по мере заполнения оболочек.
Великий Менделеев создал свою таблицу, когда наука вообще не имела никакого представления ни о строении атома, ни об электронах
Исследователи надеются, что предложенный ими альтернативный способ представления химических элементов даст возможность другим ученым по-новому взглянуть на уже известные химические и физические закономерности и приведет к новым открытиям.
Описание новой таблицы японские ученые опубликовали в журнале Foundations of Chemistry.
Комментарий
Алексей Хохлов, академик РАН:
Некоторые СМИ уже сравнивают эту таблицу с той, что была создана великим Менделеевым. Говорят,что она может привести к новым открытиям.
Алексей Хохлов: Подобные заявления могут делать только те, кто плохо в школе учил химию. Таблица Менделеева связана не с ядром атома, а с электронами. Они определяют практически все химические связи и химические закономерности. Японские ученые проиллюстрировали некоторые уже известные факты, связанные со строением атомного ядра. Но особенности строения ядра на химические свойства почти не влияют, это не та епархия. Разве что имеют отношение к радиоактивному распаду.
Если для химиков эта работа не имеет значения, может, для физиков она станет откровением, даже стимулирует на озарения?
Алексей Хохлов: Вряд ли. Ведь структура атомного ядра давно известна, известны различные ядерные модели, авторам которых присуждена Нобелевская премия. А тем, кто сравнивает эту работу японских ученых и Дмитрия Ивановича Менделеева, хочу напомнить, что он создал свою таблицу, когда наука вообще не имела никакого представления ни о строении атома, ни об электронах. Только через 50 с лишним лет появилась квантовая механика, которая все это объяснила, в том числе строение атома и электронных оболочек. Периодический закон следует из квантовой физики. Так что если бы в то время таблицы Менделеева не было, то она могла бы быть предложена просто как следствие фундаментальных квантовых законов.
Именно это сейчас произошло с таблицей японских ученых. Если есть желание и время, можно ее использовать в педагогических целях, но ничего нового вы не узнаете. Так что эту таблицу элементов можно назвать изящной игрушкой. Но, повторяю, для обучения студентов она может быть вполне полезна.
Дмитрием Ивановичем Менделеевым сдана в набор рукопись «Опыт системы элементов, основанной на их атомном весе и химическом сходстве»
17 февраля (1 марта) 1869 г. Дмитрием Ивановичем Менделеевым была сдана в набор рукопись «Опыт системы элементов, основанной на их атомном весе и химическом сходстве» — первый вариант Периодической таблицы элементов. Окончательная формулировка закона была дана учёным в июле 1871 г.
Периодический закон был открыт Д. И. Менделеевым в ходе работы над текстом учебника «Основы химии», когда он столкнулся с трудностями систематизации фактического материала. К середине февраля 1869 г., обдумывая структуру учебника, учёный постепенно пришёл к выводу, что свойства простых веществ и атомные массы элементов связывает некая закономерность.
Открытие периодической таблицы элементов было совершено не случайно, это был результат огромного труда, длительной и кропотливой работы, которая была затрачена и самим Дмитрием Ивановичем, и множеством химиков из числа его предшественников и современников. «Когда я стал окончательно оформлять мою классификацию элементов, я написал на отдельных карточках каждый элемент и его соединения, и затем, расположив их в порядке групп и рядов, получил первую наглядную таблицу периодического закона. Но это был лишь заключительный аккорд, итог всего предыдущего труда…» — говорил учёный. Менделеев подчёркивал, что его открытие было итогом, завершившим собой двадцатилетнее размышление о связях между элементами, обдумывание со всех сторон взаимоотношений элементов.
17 февраля (1 марта) рукопись статьи, содержащая таблицу под названием «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», была закончена и сдана в печать с пометками для наборщиков и с датой «17 февраля 1869 г.». Сообщение об открытии Менделеева было сделано редактором «Русского химического общества» профессором Н. А. Меншуткиным на заседании общества 22 февраля (6 марта) 1869 г. Сам Менделеев на заседании не присутствовал, так как в это время по заданию Вольного экономического общества обследовал сыроварни Тверской и Новгородской губерний.
В первом варианте системы элементы были расставлены учёным по девятнадцати горизонтальным рядам и по шести вертикальным столбцам. 17 февраля (1 марта) открытие периодического закона отнюдь не завершилось, а только началось. Его разработку и углубление Дмитрий Иванович продолжал еще в течение почти трёх лет. В 1870 г. Менделеев в «Основах химии» опубликовал второй вариант системы («Естественную систему элементов»): горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеев исправил атомные массы некоторых элементов, несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими, оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы.
В 1871 г. на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
Периодическая система элементов оказала большое влияние на последующее развитие химии. Она не только была первой естественной классификацией химических элементов, показавшей, что они образуют стройную систему и находятся в тесной связи друг с другом, но и явилась могучим орудием для дальнейших исследований. В то время, когда Менделеев на основе открытого им периодического закона составлял свою таблицу, многие элементы были еще неизвестны. Менделеев был не только убеждён, что должны существовать неизвестные еще элементы, которые заполнят эти места, но и заранее предсказал свойства таких элементов, основываясь на их положении среди других элементов периодической системы. В течение следующих 15 лет предсказания Менделеева блестяще подтвердились; все три ожидаемых элемента были открыты (Ga, Sc, Ge), что было величайшим триумфом периодического закона.
Большое значение имела периодическая система также при установлении валентности и атомных масс некоторых элементов. Точно так же периодическая система дала толчок к исправлению атомных масс некоторых элементов. Именно на её основе были искусственно созданы трансурановые элементы. Последующее развитие науки позволило, опираясь на периодический закон, гораздо глубже познать строение вещества, чем это было возможно при жизни Менделеева. Сам учёный о своём законе сказал так: «Будущее не грозит периодическому закону разрушением, а обещаются только надстройка и развитие».
Лит.: Агафошин Н. П. Периодический закон и периодическая система элементов Д. И. Менделеева. М., 1973; Евдокимов Ю. К истории периодического закона // Наука и жизнь. № 5 (2009). С. 12—15; Кедров Б. M. День одного великого открытия. M., 1958; Кедров Б. M., Трифонов Д. H. Закон периодичности и химические элементы. Открытия и хронология. M., 1969; Макареня А. А., Рысев Ю. В. Д. И. Менделеев. М., 1983; Макареня А. А., Трифонов Д. Н. Периодический закон Д. И. Менделеева. М., 1969; Макареня А. А., Трифонов Д. Н. Периодический закон Д. И. Менделеева. М., 1969; Менделеев Д. И. Периодический закон. Основные статьи. M., 1958.
См. также в Президентской библиотеке:
Кузнецов Б. Г. Ломоносов. Лобачевский. Менделеев : очерки жизни и мировоззрения. М.; Л., 1945;
Менделеев Д. И. Заветные мысли Д. Менделеева. СПб., 1903-1905;
Семенченко В. К. Менделеев и физика атома. Пенза, 1945;
Тобольск. Памятник Д. И. Менделееву [Изоматериал] / фото А. Мусина. М., 1969;
Учреждена Главная палата мер и весов // День в истории. 20 июня 1893 г.
Таблица Менделеева
Экспонат состоит из сенсорного экрана с диагональю 68 см, на котором представлена периодическая таблица химических элементов Д. И. Менделеева.
Посетитель имеет возможность самостоятельно конструировать химические соединения, перетаскивая представленные на экране элементы из таблицы в центральное окно, являющееся имитацией пробирки для химических экспериментов. Например, для конструирования поваренной соли нужно «уложить в пробирку» один атом натрия и один атом хлора. Если химическая формула составлена правильно, всплывает окно с фотоснимком и характеристиками синтезированного соединения. Если формула ошибочна, будут предложены варианты выбора элементов, до получения положительного результата. Удалив полученное вещество, можно конструировать новое.
Таблица является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан им в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). В настоящее время предложено несколько сотен вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). Международным союзом теоретической и прикладной химии (IUPAC), в качестве основного, предложен т.н. длинный вариант таблицы Менделеева, состоящий из 18 вертикальных столбцов (группы) и 7 горизонтальных строк (периоды), где группы определяют основные физико-химические свойства, а периоды, в определённой мере, подобны друг другу, так как каждый период (за исключением первого) начинается типичным металлом (Li, Nа, К, Rb, Cs, Fr) и заканчивается благородным газом (Не, Ne, Ar, Kr, Хе, Rn), которому предшествует галоген (F, Cl, Br, I, At,).
Именно этот вариант таблицы представлен на экспонате.
Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1871): «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Научная достоверность Периодического закона получили подтверждение очень скоро: в 1875—1886 годах были открыты галлий (экаалюминий), скандий (экабор) и германий (экасилиций), для которых Менделеев, пользуясь периодической системой, предсказал не только возможность их существования, но и, с поразительной точностью, целый ряд физических и химических свойств.
С развитием атомной физики и квантовой химии Периодический закон получил строгое теоретическое обоснование. Была создана квантово-механическая модель периодического изменения электронного строения атомов химических элементов по мере возрастания зарядов их ядер, что в большинстве случаев соответствует расположению по атомным весам.
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, в которые помещались всё новые и новые элементы: благородные газы, природные и искусственно полученные радиоактивные элементы. Седьмой период периодической системы до сих пор не завершён, проблема нижней границы таблицы Менделеева остаётся одной из важнейших в современной теоретической химии.
Периодические свойства элементов
В таблице Менделеева элементы упорядочены по периодическим свойствам, которые представляют собой повторяющиеся тенденции в физических и химических характеристиках. Эти тенденции можно предсказать, просто изучив периодическую таблицу, и их можно объяснить и понять, анализируя электронные конфигурации элементов. Элементы имеют тенденцию приобретать или терять валентные электроны для достижения стабильного формирования октетов. Стабильные октеты наблюдаются в инертных газах или благородных газах VIII Группы Периодической таблицы.Помимо этой деятельности, есть еще два важных направления. Во-первых, электроны добавляются по одному, перемещаясь слева направо через период. По мере того, как это происходит, электроны внешней оболочки испытывают все более сильное ядерное притяжение, поэтому электроны становятся ближе к ядру и более прочно связаны с ним. Во-вторых, двигаясь вниз по столбцу в периодической таблице, внешние электроны становятся менее тесно связанными с ядром. Это происходит потому, что количество заполненных основных энергетических уровней (которые защищают внешние электроны от притяжения к ядру) увеличивается вниз внутри каждой группы.Эти тенденции объясняют наблюдаемую периодичность элементных свойств атомного радиуса, энергии ионизации, сродства к электрону и электроотрицательности.
Атомный радиус
Атомный радиус элемента составляет половину расстояния между центрами двух атомов этого элемента, которые только касаются друг друга. Как правило, атомный радиус уменьшается через период слева направо и увеличивается вниз для данной группы. Атомы с наибольшим атомным радиусом расположены в группе I и в нижней части групп.
Двигаясь слева направо через период, электроны по одному добавляются к внешней энергетической оболочке. Электроны внутри оболочки не могут защитить друг друга от притяжения протонов. Поскольку количество протонов также увеличивается, эффективный заряд ядра увеличивается с течением времени. Это вызывает уменьшение атомного радиуса.
При движении вниз по группе в периодической таблице количество электронов и заполненных электронных оболочек увеличивается, но количество валентных электронов остается прежним.Внешние электроны в группе подвергаются действию одного и того же эффективного ядерного заряда, но электроны находятся дальше от ядра по мере увеличения числа заполненных энергетических оболочек. Следовательно, атомные радиусы увеличиваются.
Энергия ионизации
Энергия ионизации или потенциал ионизации – это энергия, необходимая для полного удаления электрона из газообразного атома или иона. Чем ближе и прочнее электрон к ядру, тем труднее его будет удалить и тем выше будет его энергия ионизации.Первая энергия ионизации – это энергия, необходимая для удаления одного электрона из родительского атома. Вторая энергия ионизации – это энергия, необходимая для удаления второго валентного электрона из одновалентного иона с образованием двухвалентного иона и так далее. Последовательные энергии ионизации увеличиваются. Вторая энергия ионизации всегда больше первой энергии ионизации. Энергия ионизации увеличивается при движении слева направо через период (уменьшение атомного радиуса). Энергия ионизации уменьшается при движении вниз по группе (увеличивая атомный радиус).Элементы группы I имеют низкую энергию ионизации, потому что потеря электрона формирует стабильный октет.
Сродство к электрону
Сродство к электрону отражает способность атома принимать электрон. Это изменение энергии, которое происходит, когда электрон присоединяется к газообразному атому. Атомы с более сильным эффективным зарядом ядра имеют большее сродство к электрону. Можно сделать некоторые обобщения относительно сродства к электрону определенных групп в периодической таблице. Элементы группы IIA, щелочноземельные элементы, имеют низкие значения сродства к электрону.Эти элементы относительно стабильны, поскольку они заполняют подоболочки и . Элементы группы VIIA, галогены, обладают высоким сродством к электрону, потому что добавление электрона к атому приводит к полностью заполненной оболочке. Элементы VIII группы, благородные газы, имеют сродство к электрону, близкое к нулю, поскольку каждый атом обладает стабильным октетом и с трудом принимает электрон. Элементы других групп имеют низкое сродство к электрону.
Через некоторое время галоген будет иметь самое высокое сродство к электрону, в то время как благородный газ будет иметь самое низкое сродство к электрону.Сродство к электрону уменьшается при движении вниз по группе, потому что новый электрон будет дальше от ядра большого атома.
Электроотрицательность
Электроотрицательность – это мера притяжения атома электронов в химической связи. Чем выше электроотрицательность атома, тем сильнее его притяжение для связывания электронов. Электроотрицательность связана с энергией ионизации. Электроны с низкими энергиями ионизации имеют низкую электроотрицательность, поскольку их ядра не оказывают сильного притяжения на электроны.Элементы с высокими энергиями ионизации обладают высокой электроотрицательностью из-за сильного притяжения, оказываемого ядром на электроны. В группе электроотрицательность уменьшается с увеличением атомного номера в результате увеличения расстояния между валентным электроном и ядром (больший атомный радиус). Примером электроположительного (т.е. с низкой электроотрицательностью) элемента является цезий; Примером сильно электроотрицательного элемента является фтор.
Сводка свойств элементов периодической таблицы
Движение влево → вправо
- Уменьшение радиуса атома
- Увеличение энергии ионизации
- Сродство к электрону обычно увеличивается (, кроме Сродство к электрону благородных газов, близкое к нулю)
- Увеличивается электроотрицательность
Перемещение сверху → снизу
- Увеличивает атомный радиус
- Уменьшение энергии ионизации
- Сродство к электрону обычно уменьшается при движении вниз по группе
- Уменьшение электроотрицательности
Периодическая таблица | Безграничная химия
Периодическая таблица
Таблица Менделеева показывает все элементы и их физические свойства; он устроен на основе атомных номеров и электронных конфигураций.
Задачи обучения
Определите общие периодические тенденции, которые можно вывести из периодической таблицы элементов
Основные выводы
Ключевые моменты
- В периодической таблице перечислены все элементы с информацией об их атомном весе, химических символах и атомных номерах.
- Расположение таблицы Менделеева позволяет нам визуализировать определенные тенденции среди атомов.
- Вертикальные столбцы (группы) таблицы Менделеева расположены так, что все ее элементы имеют одинаковое количество валентных электронов.Таким образом, все элементы в определенной группе обладают схожими свойствами.
Ключевые термины
- атомный номер : Число, равное количеству протонов в атоме, которое определяет его химические свойства. Символ: Z .
- группа : вертикальный столбец в периодической таблице, который обозначает количество электронов валентной оболочки в атоме элемента.
- период : горизонтальная строка в периодической таблице, которая обозначает общее количество электронных оболочек в атоме элемента.
Обозначения элементов
Периодическая таблица представляет собой сетку 18 X 7, расположенную над меньшим двойным рядом элементов. В периодической таблице перечислены только химические элементы, включая каждый изотоп каждого элемента в одной ячейке. В типичной периодической таблице каждый элемент указан по его символу элемента и атомному номеру. Например, «H» обозначает водород, «Li» обозначает литий и так далее. Большинство элементов представлены первой или двумя первыми буквами своего английского названия, но есть некоторые исключения.Два заметных исключения включают серебро и ртуть. Символ серебра – «Ag» от латинского « argentum», «», что означает «серый» или «сияющий». Символ ртути – «Hg» от латинизированного греческого слова hydrargyrum, , что означает «вода-серебро». Многие периодические таблицы включают также полное название элемента и цветовую кодировку элементов в зависимости от их фазы при комнатной температуре (твердое, жидкое или газообразное).
Периодическая таблица : Таблица Менделеева представляет собой табличное отображение всех химических элементов.Атомы сгруппированы в порядке возрастания атомного номера.
Строки и периоды
Символ элемента почти всегда сопровождается другой информацией, такой как атомный номер и атомный вес. Атомный номер описывает количество протонов в одном атоме этого элемента. Например, атом кислорода содержит 8 протонов. Элементы перечислены в порядке возрастания атомного номера слева направо. Каждая строка периодической таблицы называется периодом, а каждый столбец периодической таблицы называется группой (или семьей).У некоторых групп есть особые названия, такие как галогены или благородные газы. Элементы, относящиеся к одному периоду или группе, имеют схожие свойства.
Определение химических свойств с помощью таблицы Менделеева
Химические свойства каждого элемента определяются его электронной конфигурацией и, в частности, его внешними валентными электронами. Расположение элемента в периодической таблице в значительной степени зависит от его электронов; количество электронов валентной оболочки определяет его группу, а тип орбитали, на которой находятся валентные электроны, определяет блок элемента.Кроме того, общее количество электронных оболочек атома определяет, какому периоду он принадлежит. Из-за своей структуры периодическая таблица стала чрезвычайно полезным инструментом для оценки и предсказания тенденций изменения содержания элементов и химии.
Химия 3.1 Введение в Периодическую таблицу – YouTube : Введение в таблицу Менделеева, которая определяет металлы, неметаллы и металлоиды по местоположению, а также сравнивает и сравнивает физические свойства металлов и неметаллов.
Молекулы
Молекулы – это электрически нейтральные соединения, состоящие из нескольких атомов, связанных друг с другом химическими связями.
Задачи обучения
Распознавать общие свойства молекул
Основные выводы
Ключевые моменты
- Молекулы нейтральны и не несут заряда.
- Молекула может состоять из неметаллических атомов одного химического элемента, как в случае кислорода (O 2 ), или из различных элементов, как в случае воды (H 2 O).
- Геометрия и состав молекулы будут определять ее химические и физические свойства.
- Изомеры – это молекулы с одинаковыми атомами в разном геометрическом расположении.
Ключевые термины
- ковалентный : когда 2 или более неметаллических атома связаны вместе за счет общих электронов.
- изомер : молекулы с одинаковым числом атомов в разных геометрических формах.
- соединение : когда два или более разных атома удерживаются вместе ковалентной связью.Все соединения являются молекулами, но не все молекулы являются соединениями.
- молекула : два или более атома, которые удерживаются вместе химической ковалентной связью.
Атомы и молекулы
Атом определяется как основная единица материи, которая содержит централизованное плотное ядро, окруженное электронным облаком. Когда два или более атома удерживаются вместе химической ковалентной связью, этот новый объект известен как молекула. Слово «молекула» – это расплывчатый термин, который в разговорной речи имеет разные значения в разных областях исследований.Например, термин «молекулы» используется в кинетической теории газов и относится к любой газовой частице независимо от ее состава.
Чаще всего термин «молекулы» относится к нескольким атомам; молекула может состоять из одного химического элемента, например кислорода (O 2 ), или из нескольких элементов, таких как вода (H 2 O). Молекулы нейтральны и не несут заряда; это свойство отличает их от многоатомных ионов, например нитрата (NO 3 – ).
молекула кофеина : Кофеин – сложная молекула, состоящая из множества атомов, связанных друг с другом определенным образом.
Размер молекулы варьируется в зависимости от количества атомов, составляющих молекулу. Большинство молекул слишком малы, чтобы их можно было увидеть невооруженным глазом. Самая маленькая молекула – двухатомный водород (H 2 ) с длиной связи 0,74 ангстрем. Макромолекулы – это большие молекулы, состоящие из более мелких субъединиц; этот термин из биохимии относится к нуклеиновым кислотам, белкам, углеводам и липидам.Некоторые макромолекулы можно наблюдать в специализированные микроскопы.
Часто состав соединения также может быть обозначен эмпирической формулой, которая представляет собой простейшее целочисленное соотношение составляющих его химических элементов. Однако эта эмпирическая формула не всегда описывает конкретную рассматриваемую молекулу, поскольку она дает только соотношение ее элементов. Полный элементный состав молекулы может быть точно представлен ее молекулярной формулой, которая указывает точное количество атомов в молекуле.
Пример
- C 6 H 12 O 6 = молекулярная формула глюкозы
- CH 2 O = эмпирическая (упрощенное соотношение) формула для глюкозы
Изомеры
Изомеры – это молекулы с одними и теми же атомами в разном геометрическом расположении. Из-за такого разного расположения изомеры часто имеют очень разные химические и физические свойства. На рисунке ниже 1-пропанол в основном используется в синтезе других соединений и имеет менее неприятный запах, тогда как 2-пропанол является обычным бытовым спиртом.
структурные изомеры пропанола : Химическая формула пропанола (C 3 H 7 OH) описывает несколько различных молекул, которые различаются в зависимости от положения спирта (OH). Каждая молекула является структурным изомером другой.
Ионы
Ион – это атом или молекула, которые имеют чистый электрический заряд, потому что их общее количество электронов не равно количеству протонов.
Задачи обучения
Сравните разные классы ионов
Основные выводы
Ключевые моменты
- Ионы образуются, когда количество протонов в атоме не равно количеству электронов.Если присутствует больше протонов, ион положительный и известен как катион; если присутствует больше электронов, ион отрицательный и называется анионом.
- Ионы являются высокореактивными частицами. Обычно они находятся в газообразном состоянии и не встречаются на Земле в изобилии. Они отталкиваются одинаковыми электрическими зарядами и притягиваются к противоположным зарядам.
- Электронное облако атома определяет размер атома; добавленные электроны (анионы) увеличивают отталкивание электронов, увеличивая размер иона, в то время как катионы (с меньшим количеством электронов) меньше атома, потому что в облаке меньше электронов, отталкивающих друг друга.
Ключевые термины
- ion : атом или группа атомов, несущих электрический заряд, например атомы натрия и хлора в солевом растворе.
- анион : ионы, которые заряжены отрицательно, потому что у них больше электронов, чем протонов.
- катион : ионы, которые заряжены положительно, потому что у них больше протонов, чем электронов.
Атом – это основная единица материи, состоящая из плотного ядра, состоящего из положительно заряженных протонов и нейтральных нейтронов, окруженного облаком отрицательно заряженных электронов.Если в атоме одинаковое количество протонов и электронов, он электронно нейтрален. Однако, если общее количество электронов не равно количеству протонов, атом имеет чистый электрический заряд.
Любой атом или молекула с чистым зарядом, положительным или отрицательным, называется ионом. Ион, состоящий из одного атома, является одноатомным ионом; Ион, состоящий из двух или более атомов, называется многоатомным ионом. Положительный электрический заряд протона равен по величине отрицательному заряду электрона; следовательно, чистый электрический заряд иона равен количеству протонов минус количество электронов.
Ионы являются высокоактивными частицами. Обычно они находятся в газообразном состоянии и не встречаются на Земле в изобилии. Ионы в жидком или твердом состоянии образуются при взаимодействии солей со своими растворителями. Они отталкиваются одинаковыми электрическими зарядами и притягиваются к противоположным зарядам.
Типы ионов
Есть специализированные типы ионов. Анионы имеют больше электронов, чем протонов, и поэтому имеют отрицательный заряд. Катионы имеют больше протонов, чем электронов, и поэтому имеют чистый положительный заряд.Цвиттерионы нейтральны и имеют как положительные, так и отрицательные заряды в разных местах молекулы. Анионы обычно больше, чем исходная молекула или атом, потому что избыточные электроны отталкиваются друг от друга и увеличивают физический размер электронного облака. Катионы обычно меньше их родительского атома или молекулы из-за меньшего размера их электронных облаков.
Ионы водорода : показаны отношения между молекулой, ее катионом и анионом.
Ион обозначается путем написания его отрицательного заряда в верхнем индексе сразу после химической структуры атома / молекулы. Обычно размер нетто записывается с величиной перед знаком; величина однозарядных молекул / атомов обычно не указывается. Одноатомные ионы иногда также представлены римскими цифрами, которые обозначают формальную степень окисления элемента, тогда как цифры с надстрочным индексом обозначают чистый заряд. Например, Fe 2+ можно обозначать как Fe (II).Эти представления можно рассматривать как эквивалентные для одноатомных ионов, но римские цифры нельзя применять к многоатомным ионам.
Ионы образования
Ионы могут быть образованы в результате ионизации, которая представляет собой процесс потери или приобретения нейтральным атомом электронов. Обычно электроны либо добавляются, либо теряются на валентной оболочке атома; электроны внутренней оболочки более тесно связаны с положительно заряженным ядром и поэтому не участвуют в этом типе химического взаимодействия.
Ионизация обычно включает перенос электронов между атомами или молекулами. Этот процесс мотивирован достижением более стабильных электронных конфигураций, таких как правило октетов, которое гласит, что наиболее стабильные атомы и ионы имеют восемь электронов на своей внешней (валентной) оболочке. Многоатомные и молекулярные ионы также могут быть образованы, как правило, за счет приобретения или потери элементарных ионов, таких как H + , в нейтральных молекулах. Многоатомные ионы обычно очень нестабильны и реакционны.
Типичный пример иона – Na + . У натрия есть заряд +1, потому что у натрия одиннадцать электронов. Однако, согласно правилу октетов, натрий был бы более стабильным с 10 электронами (2 в самой внутренней оболочке, 8 в самой внешней оболочке). Следовательно, натрий имеет тенденцию терять электрон, чтобы стать более стабильным. С другой стороны, хлор имеет тенденцию приобретать электрон, чтобы стать Cl – . Хлор, естественно, имеет 17 электронов, но он был бы более стабильным с 18 электронами (2 в самой внутренней оболочке, 8 во второй оболочке и 8 в валентной оболочке).Следовательно, хлор заберет электрон у другого атома, чтобы стать отрицательно заряженным.
Periodic Properties: Part 3, Ionic Radius, Predicting Ionic Charges – YouTube : Продолжение обсуждения периодических свойств, включая ионный радиус и способы прогнозирования ионных зарядов.
Периодические свойства элементов с примерами
Периодические свойства элементов с примерами
1) Атомный радиус:
Атомный радиус элементов уменьшается по мере продвижения слева направо в периодической таблице.Причина в том; атомные числа элементов увеличиваются слева направо за один и тот же период, таким образом, увеличение числа протонов вызывает увеличение притяжения электронов протонами. Напротив, в той же группе, когда мы идем сверху вниз, атомный радиус элементов увеличивается. Поскольку количество оболочек в одной группе увеличивается сверху вниз, притяжение электронов протонами уменьшается, а радиус атома увеличивается.
Пример: Найдите соотношение между атомными радиусами элементов 3 X, 11 Y и 5 Z.
Сначала мы находим расположение элементов в периодической таблице.
3 X: 1 с 2 2 с 1 2. период I Группа A
11 Y: 1s 2 2s 2 2p 6 3s 1 3. период и группа I A
5 Z: 1s 2 2s 2 2p 1 2. период и группа III A.
I A III A
2. период X Z
3. период Y
Так как радиус атома увеличивается справа налево и сверху вниз;
Y> X> Z
2) Энергия ионизации:
Энергия, необходимая для удаления электрона из атомов или ионов, называется энергией ионизации .Энергия, необходимая для удаления первого валентного электрона, называется первой энергией ионизации, энергия, необходимая для удаления второго валентного электрона, называется второй энергией ионизации и т. Д. Следующие реакции показывают этот процесс;
X + IE 1 → X + + e –
X + + IE 2 → X +2 + e –
X +2 + IE 3 → X +3 + e –
Увеличение силы притяжения, прилагаемой ядром к электронам, затрудняет удаление электронов из оболочек.Вторая энергия ионизации больше, чем первая энергия ионизации, вторая энергия ионизации больше, чем третья энергия ионизации. Мы можем сказать это;
IE 1
Когда электроны удаляются из атома, сила притяжения на электрон увеличивается, таким образом, удаление электрона из атома становится более трудным. Атомы с электронной конфигурацией ns 2 np 6 обладают свойством сферической симметрии, и удаление электронов затруднено, а энергия ионизации высока.Более того, атомы с ns 2 np 6 ns 1 имеют более низкую энергию ионизации, поскольку удаление одного электрона у этих атомов делает их благородным газом и более стабильными. Таким образом, с них легко удалить электрон. Например;
10 Ne: 1s 2 2s 2 2p 6 и
11 Na: 1s 2 2s 2 2p 6 3s 1
IE Ne > IE Na
Зная последовательные энергии ионизации атома, помогает нам найти число валентных электронов атомов.Рассмотрим следующий пример;
IE 1 IE 2 IE 3 IE 4 IE 5
176 347 1850 2520 3260
Увеличение энергии ионизации от второй до третьей больше, чем у других, поэтому атом имеет 2 валентных электрона.
Пример:
Na (газ) + IE 1 → Na + + e –
Na (газ) + IE 2 → Na +2 + 2e –
Na (твердый) + IE 3 → Na + + e –
Na + (твердый) + IE 4 → Na +2 + e –
Какое из следующих утверждений, относящихся к приведенным выше химическим уравнениям, неверно.
I. E 1 – первая энергия ионизации Na
II. E 3 > E 1
III. E 2 – вторая энергия ионизации Na
IV. E 4 > E 1
V. E 2 = E 1 + E 4
Энергия первой ионизации – это энергия, необходимая для удаления одного электрона из нейтрального атома в газовом состоянии.Я правда.
E 3 – сумма энергий E 1 и энергии сублимации. Таким образом, E 3 > E 1 II верно
Вторая энергия ионизации – это энергия, необходимая для удаления одного электрона из +1 заряженного иона в газовом состоянии. Таким образом, III неверно.
E 4 – вторая энергия ионизации, а E 1 – первая энергия ионизации. Таким образом; E 4 > E 1 IV верно
Na (газ) + IE 1 → Na + + e –
Na + (твердый) + IE 4 → Na +2 + e –
——————————————
Na (газ) + (E 1 + E 4 ) → Na +2 (газ) + 2e –
Так; E 2 = E 1 + E 4 V верно
Изменения энергии ионизации в Периодической таблице;
I A
Поскольку II A и V A обладают свойством сферической симметрии, они обладают большей энергией ионизации, чем III A и VI A.График, приведенный ниже, показывает соотношение между энергией ионизации и атомным номером.
3) Сродство к электрону:
Если к нейтральному атому в газообразном состоянии добавить электрон, выделяется энергия. Мы называем эту энергию « сродством к электрону ». Следующее химическое уравнение показывает этот процесс.
X (газ) + e – → X – (газ) + E
В общем, сродство к электрону увеличивается при переходе слева направо по периоду. Напротив, сродство к электрону уменьшается в группе сверху вниз.
4) Электроотрицательность:
В химической связи способность атомов притягивать электроны называется электроотрицательностью. Слева направо в периоде электроотрицательность увеличивается, а сверху вниз в группе электроотрицательность уменьшается.Поскольку благородные газы не образуют химических связей, нельзя говорить об их электроотрицательности.
5) Металл-неметалл:
Способность отдавать электрон называется свойством металла, а способность отдавать электрон называется неметаллическим свойством элементов. Двигаясь по периоду слева направо, свойства металла увеличиваются, а свойства неметалла уменьшаются. В группе металлов сверху вниз свойства металла повышаются. В группах неметаллов сверху вниз неметаллические свойства атомов снижаются.
Пример: Какое из следующих утверждений относится к данным элементам в таблице Менделеева ниже.
I. Металлические свойства X больше, чем Y, Z и T.
II. Атомный радиус Z больше, чем X, Y и T.
III. Энергия ионизации T больше IE X.
IV. Самый электроотрицательный элемент – Y.
Свойства металла увеличиваются справа налево и сверху вниз. Таким образом, Y – самый металлический элемент. Я не прав.
Радиусы атомов увеличиваются справа налево и сверху вниз. Таким образом, Y имеет больший атомный радиус. II ложно.
Энергия ионизации увеличивается слева направо за тот же период. Таким образом, IE T > IE X. III верно.
Электроотрицательность увеличивается слева направо и снизу вверх.Z – наиболее электроотрицательный элемент.
Обзор периодических свойств представлен на рисунке ниже.
Экзамены по таблице Менделеева и решения проблем
| Поиск местоположения элементов в периодической таблице с примерами <Назад | Далее> Свойства групп с примерами |
|---|
Периодическая таблица элементов | Живая наука
Периодическая таблица элементов объединяет все известные химические элементы в информативный массив.Элементы расположены слева направо и сверху вниз в порядке увеличения атомного номера. Порядок обычно совпадает с увеличением атомной массы.
Строки называются периодами. По данным Лос-Аламосской национальной лаборатории, номер периода элемента означает наивысший уровень энергии, который занимает электрон в этом элементе (в невозбужденном состоянии). Число электронов в периоде увеличивается по мере движения вниз по таблице Менделеева; следовательно, по мере увеличения энергетического уровня атома количество энергетических подуровней на каждый энергетический уровень увеличивается.
Элементы, которые занимают один и тот же столбец в периодической таблице (называемые «группой»), имеют идентичные валентные электронные конфигурации и, следовательно, ведут себя аналогичным образом химически. Например, все элементы группы 18 – инертные газы. [По теме: Как сгруппированы элементы?]
«Отец» периодической таблицы
Дмитрий Менделеев, русский химик и изобретатель, считается «отцом» периодической таблицы, согласно Королевскому химическому обществу. В 1860-х годах Менделеев был популярным лектором в университете Санкт-Петербурга.Петербург, Россия. Поскольку в то время на русском языке не существовало современных учебников органической химии, Менделеев решил написать их и одновременно заняться проблемой неупорядоченных элементов.
Расставить элементы в каком-либо порядке было бы довольно сложно. В то время было известно менее половины элементов, и по некоторым из них были даны неверные данные. Это было похоже на работу над действительно сложным пазлом, состоящим только из половины частей, а некоторые из них деформированы.
Менделеев в конечном итоге написал окончательный учебник химии своего времени, названный «Основы химии» (два тома, 1868–1870 гг.), Согласно Ханской академии. Когда он работал над этим, он натолкнулся на важное открытие, которое внесло большой вклад в разработку действующей таблицы Менделеева. По данным Королевского химического общества, после записи свойств элементов на карточках он начал их упорядочивать, увеличивая атомный вес. Именно тогда он заметил, что регулярно появляются определенные типы элементов.После интенсивной работы над этой «головоломкой» в течение трех дней Менделеев сказал, что ему приснился сон, в котором все элементы встали на свои места, как и требовалось. Проснувшись, он сразу же записал их на листе бумаги – исправление показалось ему необходимым только в одном месте, как он позже сказал.
Менделеев расположил элементы по атомному весу и валентности. Он не только оставил место для элементов, которые еще не были обнаружены, но и предсказал свойства пяти из этих элементов и их соединений.В 1869 году он представил результаты Российскому химическому обществу. Его новая периодическая система была опубликована в немецком химическом журнале Zeitschrift fϋr Chemie (Журнал химии).
Чтение таблицы
Периодическая таблица содержит огромное количество важной информации:
Атомный номер: Число протонов в атоме называется атомным номером этого элемента. Количество протонов определяет, что это за элемент, а также определяет химическое поведение элемента.Например, атомы углерода имеют шесть протонов, атомы водорода – один, а атомы кислорода – восемь.
Атомарный символ : Атомарный символ (или символ элемента) – это сокращение, выбранное для обозначения элемента («C» для углерода, «H» для водорода и «O» для кислорода и т. Д.). Эти символы используются во всем мире и иногда бывают неожиданными. Например, символ вольфрама – «W», потому что другое название этого элемента – вольфрам. Кроме того, атомный символ золота – «Au», потому что слово «золото» на латыни – aurum .
Атомный вес : Стандартный атомный вес элемента – это средняя масса элемента в атомных единицах массы (а.е.м.). Отдельные атомы всегда имеют целое число атомных единиц массы; однако атомная масса в периодической таблице указана как десятичное число, потому что это среднее значение различных изотопов элемента. Среднее количество нейтронов для элемента можно найти, вычитая количество протонов (атомный номер) из атомной массы.
Атомный вес для элементов 93-118: Для природных элементов атомный вес рассчитывается путем усреднения весов естественного содержания изотопов этого элемента.Однако для созданных в лаборатории трансурановых элементов – элементов с атомными номерами выше 92 – нет «естественного» содержания. Условие состоит в том, чтобы указать атомный вес самого долгоживущего изотопа в периодической таблице. Эти атомные веса следует рассматривать как предварительные, поскольку в будущем может быть получен новый изотоп с более длительным периодом полураспада.
В эту категорию входят сверхтяжелые элементы или элементы с атомными номерами выше 104. Чем больше ядро атома, которое увеличивается с увеличением количества протонов внутри, тем более нестабильным является этот элемент в целом.Таким образом, по данным Международного союза чистой и прикладной химии (IUPAC), эти негабаритные элементы мимолетны, действуют всего несколько миллисекунд, прежде чем распасться на более легкие элементы. Например, сверхтяжелые элементы 113, 115, 117 и 118 были проверены IUPAC в декабре 2015 года, заполнив седьмую строку или точку в таблице. Несколько разных лабораторий производили сверхтяжелые элементы. Атомные номера, временные названия и официальные названия:
Классическая Периодическая таблица упорядочивает химические элементы в соответствии с количеством протонов, которые каждый имеет в своем атомном ядре.(Изображение предоставлено: Карл Тейт, участник Livescience.com)Дополнительный отчет Трейси Педерсен, участник Live Science
Физические свойства элементов
Корпускуляризм
Корпускуляризм – это теория, предложенная Декартом, согласно которой вся материя состоит из крошечных частиц.
Рене Декарт
Рене Декарт был известным математиком и философом 16 века, который выдвинул гипотезу корпускулярной теории об атоме
Блеск
Блеск – это термин, обозначающий отражающую поверхность, которая отражает свет, дающий блестящий вид.
Полупроводники
Полупроводники – это термин для описания металлоидов, которые могут проводить ток, когда электрическая энергия подается из-за движения электронов, но измерения проводимости не такие высокие, как у металлов, из-за меньшего количества электронов, переносящих заряд или менее упорядоченная структура.
Ионное соединение
Ионное соединение – это связь, которая образуется между металлами и неметаллами с образованием большой ионной решетки
Ядерный синтез
Ядерный синтез – это процесс, который происходит в.солнце. Атомы водорода под воздействием большого количества тепла и давления вынуждены вместе образовывать более крупный атом гелия
Принцип неопределенности
Принцип неопределенности Гейзенберга используется для описания взаимосвязи между импульсом и положением электрона. Где, если известно точное положение электрона, импульс будет неопределенным.
Гейзенберг
Вернер Гейзенберг был немецким физиком, пионером в области квантовой механики. Он разработал принцип неопределенности, связанный с импульсом и положением электрона.
Лепестки
Лепестки относятся к форме электронных волн и области наибольшей вероятности того, где этот электрон как частица будет обнаружен.
Принцип исключения Паули
Исключение Паули относится к теории, согласно которой каждый электрон может иметь только уникальный набор из 4 квантовых чисел, и никакие два электрона не могут иметь одинаковые квантовые числа
Квантовые числа
Квантовые числа – это используемый термин описать присвоение чисел электронам как математическую функцию для описания их импульса и энергии.
Модель Бора
Модель Бора рассматривает электроны как частицы, вращающиеся вокруг ядра.
Квантовая механика
Термин квантовая механика относится к уровням энергии и теоретической области физики и химии, где математика используется для объяснения поведения субатомных частиц.
Впадина
Впадина – это самая низкая точка на поперечной волне.
Пик
Пик – это самая высокая точка на поперечной волне.
Режимы вибрации
Режимы вибрации – это термин, используемый для описания постоянного движения в молекуле. Обычно это колебания, вращения и переводы.
Эрвин Шредингер
Эрвин Шредингер был австрийским физиком, который использовал математические модели для улучшения модели Бора электрона и создал уравнение для предсказания вероятности нахождения электрона в заданном положении.
Щелочной металл
Щелочные металлы, входящие в группу 1 периодической таблицы (формально известную как группа IA), настолько реактивны, что обычно встречаются в природе в сочетании с другими элементами.Щелочные металлы – это блестящие, мягкие, высокореактивные металлы при стандартной температуре и давлении.
Щелочноземельные металлы
Щелочноземельные металлы – вторая по активности группа элементов в периодической таблице. Они находятся в группе 2 периодической таблицы (формально известной как группа IIA).
Неизвестные элементы
Неизвестные элементы (или трансактиниды) – самые тяжелые элементы периодической таблицы Менделеева. Это мейтнерий (Mt, атомный номер 109), дармштадций (Ds, атомный номер 110), рентгений (Rg, атомный номер 111), нихоний (Nh, атомный номер 113), московий (Mc, атомный номер 115), ливерморий (Lv. , атомный номер 116) и теннессин (Ts, атомный номер 117).
Постпереходный металл
Постпереходные металлы – это металлы, находящиеся между переходными металлами (слева) и металлоидами (справа). Они включают алюминий (Al), галлий (Ga), индий (In), таллий (Tl), олово (Sn), свинец (Pb) и висмут (Bi).
Оганессон
Оганессон (Ог) – радиоактивный элемент, имеющий атомный номер 118 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 18.Имеет символ Ог.
Теннессин
Теннессин (Ts) – это радиоактивный элемент, имеющий атомный номер 117 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в 17-й группе. Обозначается символом Ts.
Livermorium
Livermorium (Lv) – это радиоактивный элемент, имеющий атомный номер 116 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 16.Имеет символ Ур.
Московий
Московий (Mc) – это радиоактивный металл, имеющий атомный номер 115 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 15. Имеет символ Mc.
Флеровий
Флеровий (Fl) – это радиоактивный металл, имеющий атомный номер 114 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 14. Обозначается символом Fl.
Nihonium
Nihonium (Nh) – это радиоактивный металл, имеющий атомный номер 112 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Он находится в группе 13. Обозначается символом Nh.
Copernicium
Copernicium (Cr) – это радиоактивный металл, имеющий атомный номер 112 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в группе 11. Он имеет обозначение Rg.
Roentgenium
Roentgenium (Rg) – это радиоактивный металл, имеющий атомный номер 111 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в группе 11. Он имеет обозначение Rg.
Дармштадций
Дармштадций (Ds) – это радиоактивный металл, имеющий атомный номер 110 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл группы 10.Он имеет обозначение Ds
Meitnerium
Meitnerium (Mt) – это радиоактивный металл, имеющий атомный номер 109 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в Группе 9. Он имеет символ Mt.
Калий
Калий (Hs) – это радиоактивный металл, имеющий атомный номер 108 в периодической таблице Менделеева, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в группе 8.Имеет символ Hs.
Bohrium
Bohrium (Bh) – это радиоактивный металл, имеющий атомный номер 107 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в Группе 7. Он имеет символ Bh.
Сиборгий
Сиборгий (Sg) – радиоактивный металл, имеющий атомный номер 106 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл группы 6.Он имеет символ Sg.
Дубний
Дубний (Db) – это радиоактивный металл, имеющий атомный номер 105 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в Группе 5. Он имеет обозначение Db.
Резерфордий
Резерфордий (Rf) – это радиоактивный металл, имеющий атомный номер 104 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это переходный металл в группе 4.Обозначается символом Rf.
Лоуренсий
Лоуренсий (Lr) – это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 103 в периодической таблице. Это актиноидный металл с символом Lr.
Nobelium
Нобелий (№) – это радиоактивный металл, имеющий атомный номер 102 в периодической таблице, его внешний вид полностью не известен из-за того, что он производится в незначительных количествах. Это актиноидный металл с символом №
Менделевий
Менделевий (Md) – это радиоактивный металл, имеющий атомный номер 101 в периодической таблице, его внешний вид полностью не известен из-за того, что он произведен в незначительных количествах.Это актиноидный металл с символом Md.
Фермий
Фермий (Fm) – это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 100 в периодической таблице. Это актиноидный металл с символом Fm.
Эйнштейний
Эйнштейний (Es) – это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 99 в периодической таблице. Это актиноидный металл с символом Es.
Калифорний
Калифорний (Cf) – это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 98 в периодической таблице.Это актиноидный металл с обозначением Cf.
Берклий
Берклий (Bk) – радиоактивный металл серебристого цвета, имеющий атомный номер 97 в периодической таблице. Это актиноидный металл с символом Bk.
Кюрий
Кюрий (Cm) – это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 96 в периодической таблице. Это актиноидный металл с символом Cm.
Америций
Америций (Am) – это радиоактивный металл серебристого цвета, имеющий атомный номер 95 в периодической таблице.Это актиноидный металл с символом Am.
Плутоний
Плутоний (Pu) – это радиоактивный металл серебристого цвета, имеющий атомный номер 94 в периодической таблице. Это актиноидный металл с обозначением Pu.
Нептуний
Нептуний (Np) – радиоактивный металл серебристого цвета, имеющий атомный номер 93 в периодической таблице. Это актиноидный металл с символом Np.
Протактиний
Протактиний (Па) – это блестящий радиоактивный металл серебристого цвета, имеющий атомный номер 91 в периодической таблице.Это актиноидный металл с символом Pa.
Торий
Торий (Th) – это радиоактивный металл серебристо-белого цвета, имеющий атомный номер 90 в периодической таблице. Это актиноидный металл с символом Th.
Актиний
Актиний (Ac) – это радиоактивный металл серебристого цвета, имеющий атомный номер 89 в периодической таблице. Это актиноидный металл с символом Ас.
Радий
Радий (Ra) – это металл серебристо-белого цвета, имеющий атомный номер 88 в периодической таблице.Это щелочноземельный металл с символом Ra, расположенный во 2-й группе периодической таблицы.
Франций
Франций (Fr) считается металлом серого цвета с атомным номером 87 в периодической таблице. Это щелочной металл с символом Fr, расположенный в группе 1 периодической таблицы.
Радон
Радон (Rn) – неметалл, не имеющий цвета и запаха, радиоактивный газ, имеющий атомный номер 86 в периодической таблице в Группе 18. Он имеет символ Rn.
Астатин
Астатин (At) – это радиоактивный неметалл, имеющий атомный номер 85 в периодической таблице в Группе 17. Он имеет символ At.
Полоний
Полоний (Po) – это серебристо-серый металл, имеющий атомный номер 84 в периодической таблице в группе 16. Он имеет символ Po.
Висмут
Висмут (Bi) – твердый металл серо-стального цвета, имеющий атомный номер 83 в периодической таблице в Группе 15. Он имеет символ Bi.
Свинец
Свинец (Pb) – это мягкий серый металл, имеющий атомный номер 82 в периодической таблице Группы 14.Обозначается символом Pb.
Таллий
Таллий (Tl) – это мягкий серый металл, имеющий атомный номер 81 в периодической таблице в группе 13. Он имеет символ Tl.
Меркурий
Ртуть (Hg) – жидкий металл серебристого цвета, имеющий атомный номер 80 в периодической таблице. Это переходный металл в группе 12. Он имеет обозначение Hg.
Золото
Золото (Au) – это металл мягкого золотого цвета, имеющий атомный номер 79 в периодической таблице. Это переходный металл группы 11.Имеет символ Au.
Платина
Платина (Pt) – тяжелый белый металл, имеющий атомный номер 78 в периодической таблице. Это переходный металл группы 10. Он имеет обозначение Pt.
Иридий
Иридий (Ir) – тяжелый белый металл, имеющий атомный номер 77 в периодической таблице. Это переходный металл в группе 9. Он имеет обозначение Ir.
Осмий
Осмий (Os) – это твердый мелкий черный порошок или сине-белый металл, имеющий атомный номер 76 в периодической таблице.Это переходный металл группы 8. Он обозначен символом Os.
Рений
Рений (Re) – металл серебристо-белого цвета, имеющий атомный номер 75 в периодической таблице. Это переходный металл группы 7. Он имеет символ Re.
Вольфрам
Вольфрам (W) – металл серого стального цвета, имеющий атомный номер 74 в периодической таблице. Это переходный металл в группе 6. Он имеет обозначение W.
Тантал
Тантал (Ta) – металл серого цвета, имеющий атомный номер 73 в периодической таблице.Это переходный металл в группе 5. Он имеет символ Ta.
Гафний
Гафний (Hf) – металл серебристого цвета, имеющий атомный номер 72 в периодической таблице. Это переходный металл в группе 4. Он имеет обозначение Hf.
Лютеций
Лютеций (Lu) – металл серебристо-белого цвета, имеющий атомный номер 71 в периодической таблице. Это металл лантаноид. Он имеет символ Лу.
Иттербий
Иттербий (Yb) – металл серебристого цвета, имеющий атомный номер 70 в периодической таблице.Это металл лантаноид. Имеет символ Yb.
Тулий
Тулий (Tm) – металл серебристого цвета, имеющий атомный номер 69 в периодической таблице. Это металл лантаноид. Обозначается символом Tm.
Эрбий
Эрбий (Er) – металл серебристого цвета, имеющий атомный номер 68 в периодической таблице. Это металл лантаноид. Имеет символ Er.
Гольмий
Гольмий (Ho) – металл серебристого цвета, имеющий атомный номер 67 в периодической таблице.Это металл лантаноид. Имеет символ Хо.
Диспрозий
Диспрозий (Dy) – металл серебристого цвета, имеющий атомный номер 66 в периодической таблице. Это металл лантаноид. Имеет символ Dy.
Тербий
Тербий (Tb) – металл серебристо-серого цвета, имеющий атомный номер 65 в периодической таблице. Это металл лантаноид. Обозначается символом Tb.
Гадолиний
Гадолиний (Gd) – металл серебристо-белого цвета, имеющий атомный номер 64 в периодической таблице.Это металл лантаноид. Он имеет символ Б-г.
Европий
Европий (Eu) – металл серебристо-белого цвета, имеющий атомный номер 63 в периодической таблице. Это металл лантаноид. Имеет символ Eu.
Самарий
Самарий (Sm) – металл серебристого цвета, имеющий атомный номер 62 в периодической таблице. Это металл лантаноид. Имеет символ Sm.
Прометий
Прометий (Pm) – редкий металл, имеющий атомный номер 61 в периодической таблице.Это металл лантаноид. Имеет символ Pm.
Неодим
Неодим (Nd) – металл серебристо-белого цвета, имеющий атомный номер 60 в периодической таблице. Это металл лантаноид. Обозначается символом Nd.
Празеодим
Празеодим (Pr) – металл серебристо-белого цвета, имеющий атомный номер 59 в периодической таблице. Это металл лантаноид. Имеет обозначение Pr.
Церий
Церий (Ce) – металл серого цвета, имеющий атомный номер 58 в периодической таблице.Это металл лантаноид. Имеет символ Ce.
Лантан
Лантан (La) – мягкий серебристо-белый металл, имеющий атомный номер 57 в периодической таблице. Это металл лантаноид. Он имеет символ La.
Барий
Барий (Ва) – это мягкий серебристо-белый металл, имеющий атомный номер 56 в периодической таблице. Это щелочноземельный металл, который находится во 2-й группе периодической таблицы. у него есть символ Ва.
Цезий
Цезий (Cs) – это металл мягкого серого цвета, имеющий атомный номер 55 в периодической таблице.Это щелочной металл, который находится в группе 1 периодической таблицы. он имеет символ Cs.
Ксенон
Ксенон (Хе) существует в виде бесцветного газа без запаха и химически инертен. Он имеет атомный номер 54 в периодической таблице Менделеева и относится к 18-й группе «Благородные газы». Это неметалл с символом Xe.
Йод
Йод (I) – неметаллическое твердое вещество пурпурно-серого цвета. Он имеет атомный номер 53 в периодической таблице. Он расположен в 17-й группе «Галогены». Имеет символ I.
Теллур
Теллур (Те) – это серебристо-белый полуметалл, имеющий атомный номер 52 в периодической таблице. Он находится в 16-й группе таблицы Менделеева. Имеет символ Те.
Сурьма
Сурьма (Sb) – твердый хрупкий серебристо-белый полуметалл, имеющий атомный номер 51 в периодической таблице. Он находится в 15-й группе таблицы Менделеева. Имеет символ Sb.
Олово
Олово (Sn) – это серебристо-белый металл, имеющий атомный номер 50 в периодической таблице.Он находится в 14-й группе периодической таблицы. Имеет символ Sn.
Индий
Индий (In) – это серебристо-белый металл, имеющий атомный номер 49 в периодической таблице. Он находится в 13-й группе периодической таблицы Менделеева. Имеет символ In.
Кадмий
Кадмий (Cd) – это бело-голубой металл, имеющий атомный номер 48 в периодической таблице. Это переходный металл, который находится в группе 12 периодической таблицы. Обозначается символом Cd.
Серебро
Серебро (Ag) – это металлическое серебро, имеющее атомный номер 47 в периодической таблице.Это переходный металл, расположенный в 11-й группе периодической таблицы. Имеет символ Ag.
Палладий
Палладий (Pd) – это серебристо-белый металл, имеющий атомный номер 46 в периодической таблице. Это переходный металл, расположенный в 10-й группе периодической таблицы. Обозначается символом Pd.
Родий
Родий (Rh) – хрупкий серебристо-белый металл, имеющий атомный номер 45 в периодической таблице. Это переходный металл, расположенный в 9-й группе периодической таблицы.Имеет символ Rh.
Рутений
Рутений (Ru) – хрупкий серебристо-серый металл, имеющий атомный номер 44 в периодической таблице. Это переходный металл, расположенный в 8-й группе периодической таблицы. Имеет символ Ru.
Технеций
Технеций (Tc) – это серебристо-серый металл, имеющий атомный номер 43 в периодической таблице. Это переходный металл, расположенный в 7-й группе периодической таблицы. Обозначается символом Tc.
Молибден
Молибден (Мо) – это серебристо-белый металл, имеющий атомный номер 42 в периодической таблице.Это переходный металл, расположенный в 6-й группе периодической таблицы. Обозначается символом Mb.
Ниобий
Ниобий (Nb) – это блестящий белый металл, имеющий атомный номер 41 в периодической таблице. Это переходный металл, расположенный в 5-й группе периодической таблицы. Обозначается символом Nb.
Цирконий
Цирконий (Zr) – это серый белый металл, имеющий атомный номер 40 в периодической таблице. Это переходный металл, который находится в группе 4 периодической таблицы Менделеева.Он имеет обозначение Zr.
Иттрий
Иттрий (Y) – это серебристый металл, имеющий атомный номер 39 в периодической таблице. Это переходный металл, который находится в группе 3 периодической таблицы. Он имеет символ Y.
Металлические и неметаллические свойства, Кислотные и основные свойства в периодической таблице
. В начале девятнадцатого века Берцелиус был первым ученым, который классифицировал элементы на две основные группы (металлы и неметаллы) в соответствии с их физическими свойствами. Действительно, это было еще до того, как было что-либо знать об атомной структуре. Это старая классификация, которая является все еще используются в настоящее время, хотя в периодической таблице между ними и их свойствами нет границ.
С развитием нашей концепции об электронной структуре атомов мы можем различать металлы и неметаллы. Кроме того, существует третья группа элементов, известных как металлоиды.
МеталлыИх валентная оболочка – как правило – имеет менее половины своей емкости электронов. Они имеют большой атомный радиус, что приводит к малым значениям энергии ионизации и сродства к электрону.
Это электроположительные элементы из-за их тенденции терять электроны валентной оболочки и превращаться в положительные ионы, чтобы достичь структуры ближайшего благородного газа.
Они являются хорошими электрическими проводниками из-за подвижности их небольшого количества валентных электронов, которые могут переходить из одного положения в другое в структуре металла.
Металлические и неметаллические свойства
НеметаллыИх валентная оболочка, как правило, имеет более половины емкости электронов. Они имеют малый атомный радиус, что приводит к высоким значениям энергии ионизации и сродства к электрону.
Они имеют малый атомный радиус, что приводит к высоким значениям энергии ионизации и сродства к электрону. Они являются электроотрицательными элементами из-за их тенденции приобретать электроны с образованием отрицательных ионов, которые имеют такую же электронную структуру, как ближайший благородный газ.
Они не проводят электричество (электрические изоляторы), потому что их валентные электроны прочно связаны с ядром. Таким образом, этим валентным электронам трудно переноситься.
МеталлоидыМеталлоиды характеризуются следующими свойствами:
Они имеют металлический внешний вид и большинство свойств неметаллов. Их электроотрицательность занимает промежуточное положение между металлами и неметаллами. Их электрическая проводимость меньше, чем у металлов, но больше, чем у неметаллов. Они используются в производстве деталей электронных инструментов, таких как как транзисторы – как полупроводники.
Металлоиды – это группа элементов, которые имеют металлический вид, и большинство свойств неметаллов, характеризующихся их электроотрицательностью, являются промежуточными между металлами и неметаллами, а их электропроводность меньше, чем у металлов, но больше, чем у неметаллов.
Градация металлических и неметаллических свойств в периодической таблице Менделеева: В той же группе: металлический характер увеличивается (неметаллический характер уменьшается) с увеличением атомного номера по мере того, как мы спускаемся по группе, из-за их большого атомного радиуса и низкого потенциала ионизации и сродства к электрону.
В тот же период: период начинается с самых прочных металлов в группе 1А, затем металлическое свойство постепенно уменьшается за счет увеличения атомного номера в течение периода, пока мы не достигнем металлоидов. Справа от металлоидов начинается неметаллическое свойство. Период заканчивается элементами высшего неметаллического свойства в группе 7А.
Следовательно: цезий считается наиболее активным металлом, потому что металлические свойства увеличиваются в той же группе за счет увеличения атомного номера, и он помещен в нижнюю часть левой части таблицы (металл с самым низким потенциалом ионизации).
Фтор считается наиболее активным неметаллом, потому что неметаллические свойства уменьшаются в той же группе из-за увеличения атомного номера, и он помещен в верхнюю часть правой части таблицы (наиболее электроотрицательный неметалл).
Градация металлических и неметаллических свойств в третьем периоде, Ясно, что при увеличении атомного номера металлический характер уменьшается, а неметаллический характер увеличивается.
Кислотные и основные свойстваКогда элемент соединяется с кислородом, образуя соединение, известное как оксид, существуют типы оксидов элементов: кислотные оксиды, основные оксиды и амфотерные оксиды.
Кислые оксидыНеметаллические оксиды названы кислотными оксидами, потому что:
Растворяются в воде с образованием кислородсодержащих кислот.
CO 2 (г) + H 2 O (л) → H 2 CO 3 (водн.)
SO 3 (г) + H 2 O (л) → H 2 SO 4 (водн.)
Они реагируют со щелочами, образуя соль и воду.
CO 2 (г) + 2NaOH (водн.) → Na 2 CO 3 (водн.) + H 2 O (л)
Из кислых оксидов, диоксид углерода CO 2 , триоксид серы SO 3 , диоксид азота NO 2 .
Основные оксидыОксиды металлов обычно известны как основные оксиды. Некоторые основные оксиды не растворимы в воде, а другие растворимы в воде, образующей щелочи. Водорастворимые основные оксиды также известны как оксиды щелочных металлов.
K 2 O (с) + H 2 O (л) → 2KOH (водн.)
H 2 O (л) + Na 2 O (с) → 2NaOH (водн.)
Из основных оксидов, оксид калия K 2 O, оксид натрия Na 2 O, оксид магния MgO.
Они реагируют с кислотами, образуя соль и воду:
2HCl (водн.) + Na 2 O (с) → 2NaCl (водн.) + H 2 O (л)
MgO (т) + H 2 SO 4 (водн.) → MgSO 4 (водн.) + H 2 O (л)
Амфотерные оксиды – это оксиды элементов, которые реагируют с кислотами как основные оксиды и реагируют с основаниями как кислотные оксиды, образуя в обоих случаях соль и воду.
ZnO (т) + H 2 SO 4 (водн.) → ZnSO 4 (водн.) + H 2 O (л)
ZnO (т.) + 2NaOH (водн.) → Na 2 ZnO 2 (водн.) + H 2 O (л)
Амфотерные оксиды, такие как оксид алюминия Al 2 O 3 , оксид цинка ZnO, оксид сурьмы Sb 2 O 3 , оксид олова SnO.
Градация кислотных и основных свойств в периодической таблице:В период: Основное свойство оксида уменьшается с увеличением атомного номера элемента, в то время как кислотное свойство увеличивается.
В группе: где в группе, которая начинается с металла, основное свойство оксида увеличивается с увеличением атомного номера, как в группе 1A.
В группе, которая начинается с неметалла, кислотные свойства оксида возрастают с увеличением атомного номера, как в группе 7A.
Градация кислотных и основных свойств в третьем периоде, По мере увеличения атомного номера основное свойство уменьшается, а кислотное свойство увеличивается.
Кислотное свойство соединений водорода группы 17 (галогенов) увеличивается с увеличением атомного номера, потому что увеличение атомного номера в группе приводит к увеличению атомного размера галогена, а затем его сила притяжения для атома водорода уменьшается. , облегчая ионизацию.
Радиус, потенциал ионизации, сродство к электрону и электроотрицательность
Современная таблица Менделеева и классификация элементов
Гидроксисоединения, Правила расчета степеней окисления
Периодическая таблица: свойства групп и периодов – видео и стенограмма урока
Дмитрий Менделеев
Поскольку элементов очень много, необходима система их организации.Здесь появляется русский химик по имени Дмитрий Менделеев. В конце 1800-х годов, когда было открыто всего около 60 элементов, Менделеев решил расположить элементы в порядке возрастания атомного веса. При этом он также организовал их так, чтобы элементы с похожими характеристиками были сгруппированы вместе.
При этом необходимо было оставить в его организации несколько пустых областей, которые позже стали пятнами для элементов, которые еще не были обнаружены. Это означает, что его система организации сработала настолько хорошо, что он мог предсказать как веса, так и свойства неоткрытых элементов! Мы все еще используем эту организацию сегодня в периодической таблице ; однако в настоящее время элементы организованы в порядке возрастания атомного номера.
Периоды и группы
Когда Менделеев располагал элементы в порядке возрастания атомного веса, он заметил, что закономерности периодически повторяются. Каждый раз, когда узор начинался заново, он начинал новый ряд. Период в периодической таблице – это просто горизонтальный ряд. Текущая таблица Менделеева состоит из семи периодов с островом из двух периодов внизу.Почему там внизу этот островок? Это действительно просто потому, что если бы эти две строки были помещены в периодическую таблицу, к которой они принадлежат, таблица заняла бы так много места и не могла бы легко поместиться на листе бумаги!
Вы знаете, как иногда Аляску помещают в другое место на карте Соединенных Штатов? Аляска ДЕЙСТВИТЕЛЬНО не находится ниже Калифорнии. Это просто для экономии места. Поэтому, когда вы используете таблицу Менделеева, просто помните, где она должна находиться. Верхний ряд этого острова находится в 6-м периоде, а нижний ряд – в 7-м периоде.Кроме того, вы можете обнаружить, что в некоторых периодических таблицах эти две строки отображаются в правильном месте.
Вертикальные столбцы периодической таблицы называются группами или семействами . Группы, вероятно, наиболее удобны при прогнозировании свойств элемента. Подобно тому, как все люди в семье могут иметь схожие черты, элементы в одной и той же группе в периодической таблице также будут иметь аналогичные свойства. Группы пронумерованы от 1 до 18 слева направо, а некоторые группы имеют специальные названия.Например, за исключением водорода, все элементы группы 1 в самой левой части таблицы Менделеева называются щелочными металлами . Щелочные металлы мягкие, серебристые и бурно реагируют с водой с образованием щелочного (или основного) раствора.
Щелочноземельные металлы относятся к группе 2 и имеют блестящий серебристо-белый цвет.Перейдя полностью к правой части таблицы, в Группе 17 вы найдете галогены . Все галогены очень реактивны и ядовиты, поэтому вы можете найти эти бактерии-убийцы в отбеливателях и дезинфицирующих средствах. Элементы последней группы периодической таблицы, группы 18, называются благородными газами , . Благородные газы не имеют цвета, запаха и крайне инертны. Их неспособность легко реагировать делает их главным кандидатом в газы в лампочках.
Так же, как на некоторых картах показаны границы между состояниями, в некоторых периодических таблицах справа есть «лестница». Эта «лестница» отделяет металлы от неметаллов. Металлы находятся слева от этой линии, и все они имеют очень похожие свойства: они блестящие, хорошо проводят тепло и электричество, податливы и пластичны. Под пластичностью и пластичностью понимается способность вещества деформироваться без растрескивания. Если на вашей машине есть вмятины, это потому, что она податливая.Если бы он треснул, то стал бы хрупким. Большинство элементов периодической таблицы – металлы.
Элементы справа от строки называются nonmetals . Неметаллы в своей твердой форме хрупкие, тусклые, плохо проводят тепло и электричество и имеют гораздо более низкие температуры плавления и кипения, чем металлы, поэтому многие из них являются газами при комнатной температуре. Некоторые элементы обладают свойствами металлов и неметаллов. Эти элементы называются металлоидами , и они находятся НА линии «лестницы».Элементами, которые чаще всего называют металлоидами, являются бор, кремний, германий, мышьяк, сурьма и теллур. Кремний – это элемент, который содержится в компьютерных микросхемах. Если вы когда-нибудь смотрели на компьютерный чип, вы могли заметить, что он блестит, как металл. Однако, если вы когда-нибудь ударите компьютерный чип молотком, вы обнаружите, что он очень хрупкий, свойство неметаллов.
Краткое содержание урока
Таблица Менделеева – один из наиболее часто используемых инструментов химика.Знание того, как он организован, является важной частью возможности его использовать. Элементы перечислены в порядке возрастания атомного номера и организованы в столбцы, называемые группами или семействами .

