Закономерности изменения свойств по таблице Д. И. Менделеева — что это, определение и ответ
Периодический закон – один из важнейших законов химии, был сформулирован Дмитрием Ивановичем Менделеевым в 1869 году. Современная формулировка закона выглядит так: свойства элементов, а также свойства и формы их соединений находятся в периодической зависимости от зарядов ядер атомов элементов.
Графическим отражением периодического закона является периодическая таблица, состоящая из периодов и групп.
Период – горизонтальный ряд элементов.
Различают два вида периодов:
Группа – вертикальный ряд элементов.
Выделяют два вида групп:
Закономерное изменение свойств элементов и их соединений обусловлено периодическим повторением строения электронных оболочек. Важнейшими свойствами элементов являются металличность и неметалличность.
Металличность – это способность атомов элементов отдавать электроны.
Количественной характеристикой металличности является энергия ионизации (количество энергии, которое необходимо для отрыва электрона от атома). Чем меньше энергия ионизации, тем легче атом отдает электрон, тем сильнее металлические свойства.
Неметалличность — это способность атомов элементов принимать электроны.
Количественной характеристикой неметалличности является сродство к электрону (энергия, которая выделяется при присоединении электрона к нейтральному атому). Чем больше сродство к электрону, тем легче атом присоединяет электрон, тем сильнее неметаллические свойства.
Универсальной характеристикой металличности и неметалличности стала электроотрицательность (ЭО).
Электроотрицательность – это способность атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле.
Рассмотрим, как меняются некоторые характеристики элементов в группах и периодах.
| Свойство | Изменение в группах | Изменение в периоде |
|---|---|---|
| радиус атома | ↓ увелич. | → уменьш. |
| металличность | ↓ увелич. | → уменьш. |
| энергия ионизации | ↓ уменьш. | → увелич. |
| неметалличность | ↓ уменьш. | → увелич. |
| энергия сродства к электрону | ↓ уменьш. | → увелич. |
электроотрица- тельность | ↓ уменьш. | → увелич. |
| кислотные свойства водородных соединений неметаллов | ↓ увелич. | → увелич. |
Закономерности изменения свойств по таблице Д.И. Менделеева — что это, определение и ответ
Периодическая система Дмитрия Ивановича Менделеева является одной из самых важных классификаций в химии, которая стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря таблице, которая является по сути графическим отражением периодического закона, возможно предсказать существование неизвестных науке химических элементов и предположить их химические свойства. Это открытие является настолько важным, что 2019 год был объявлен Международным годом Периодической таблицы химических элементов.
Благодаря таблице, которая является по сути графическим отражением периодического закона, возможно предсказать существование неизвестных науке химических элементов и предположить их химические свойства. Это открытие является настолько важным, что 2019 год был объявлен Международным годом Периодической таблицы химических элементов.
Дмитрий Иванович Менделеев, располагая элементы в порядке возрастания относительных атомных масс, наблюдал периодическое изменение их свойств. Эту закономерность в 1869 году он сформулировал в виде периодического закона.
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Таблица Менделеева состоит из периодов и групп.
Период – горизонтальный ряд элементов.
Различают два вида периодов:
Группа – вертикальный ряд элементов.
Выделяют два вида групп:
Закономерное изменение свойств элементов и их соединений обусловлено периодическим повторением строения электронных оболочек. Важнейшими свойствами элементов являются металличность и неметалличность.
Важнейшими свойствами элементов являются металличность и неметалличность.
Металличность – это способность атомов элементов отдавать электроны.
Неметалличность — это способность атомов элементов принимать электроны.
Универсальной характеристикой металличности и неметалличности стала электроотрицательность (ЭО).
Электроотрицательность – это способность атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле.
Рассмотрим, как меняются некоторые характеристики элементов в группах и периодах.
В группе растет | В периоде растет | |
|---|---|---|
| R | ↓ | ← |
| Me св-ва | ↓ | ← |
| неМе св-ва | ↑ | → |
| ЭО | ↑ | → |
кисл. св-ва св-ва | ↓ | → |
Существует закономерность для элементов, объединенных в одну группу, которую следует запомнить:
Высшая валентность элементов в соединениях с кислородом соответствует номеру группы (за исключением фтора). Элементы побочных групп могут проявлять и другую валентность.
Медь, являющаяся побочным элементом 1 группы, имеет два оксида – CuO и Cu2O, из которых наиболее устойчивым является CuO.
Главные элементы IV-VII групп образуют летучие водородные соединения, валентность в которых определяется разностью между числом восемь и номером группы.
Например, летучим водородным соединением является аммиак – NH3. Валентность азота в данном соединении определяется разностью между числом 8 и номером группы – (8-5) = 3.
Периодические тенденции в свойствах элементов
Периодическая таблица представляет собой табличное отображение различных химических элементов, расположенных в соответствии с их электронной конфигурацией, атомным номером и общими химическими свойствами.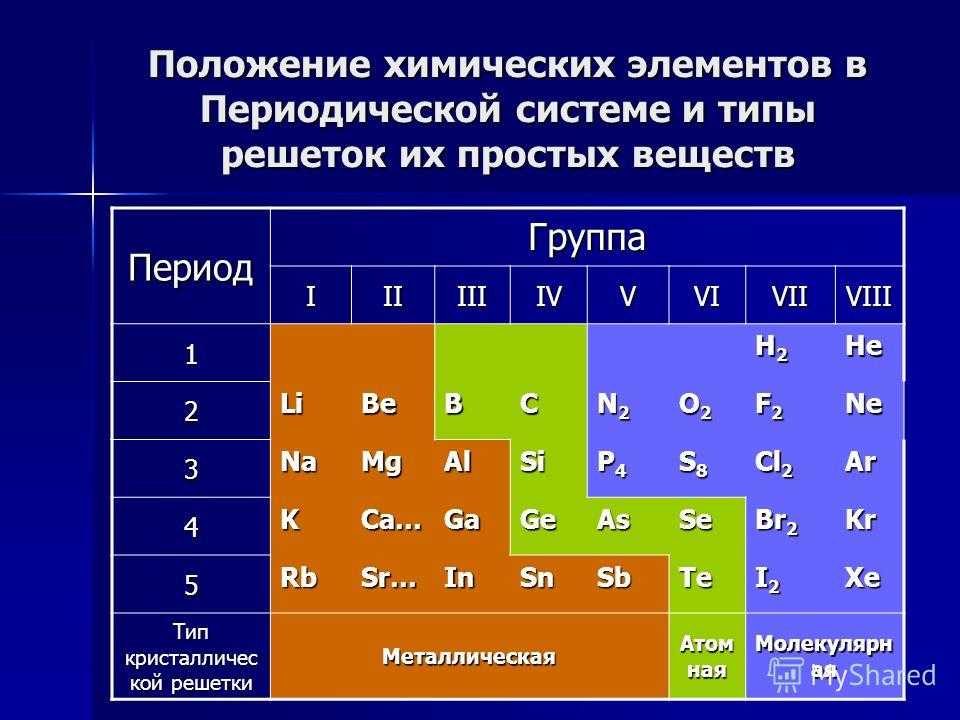 Существуют определенные тенденции, общие для всех групп и периодов.
Существуют определенные тенденции, общие для всех групп и периодов.
Строки называются периодами, а периодическая таблица имеет 7 периодов. Металлы представлены в левых рядах, а ближе к правой стороне – неметаллы. Принимая во внимание, что столбцы называются группами. В группах элементы имеют различное химическое поведение. Существует 18 групп, галогены входят в группу 17, а инертные газы — в группу 18.
Периодические тренды
Особые закономерности свойств химических элементов, присутствующих в периодической таблице, известны как периодические тренды. Важными направлениями являются:
Энергия ионизации
Металлический характер
Атомные радиусы
Электроотрицательность 90 121403 90 12 1403 90 12 403 звуковой радиус
Сродство к электрону
Химическая активность
Экранирующий эффект
Эти тенденции возникают вследствие изменения строения атомов элементов внутри их групп и периодов. Существует несколько исключений, например, энергия ионизации групп 3 и 6.
Существует несколько исключений, например, энергия ионизации групп 3 и 6.
Периодический закон
Периодический закон формирует основу для периодических трендов. Согласно периодическому закону, «химические элементы расположены в порядке возрастания атомного номера, и основные свойства при этом претерпевают циклические изменения. Элементы, имеющие сходные химические свойства, повторяются через равные промежутки времени»
Этот принцип дал Дмитрий Менделеев. Он также заявил, что периодическая таблица основана не только на атомном весе, но и на различных физических и химических свойствах элементов.
Позже также было обнаружено, что повторение свойств обусловлено повторением сходных электронных конфигураций во внешних оболочках атомов.
1. Энергия ионизации
Потенциал ионизации можно определить как
«Минимальная энергия, необходимая изолированному атому для удаления одного электрона в его нейтральном или газообразном состоянии»
По мере прохождения периода энергия ионизации увеличивается.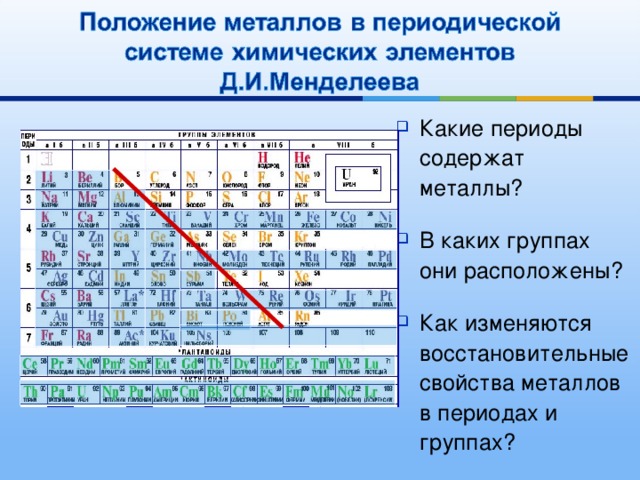 Причина этого заключается в том, что заряд ядра через период увеличивается, и, таким образом, электроны сильно удерживаются ядром.
Причина этого заключается в том, что заряд ядра через период увеличивается, и, таким образом, электроны сильно удерживаются ядром.
Но по мере продвижения вниз по группе энергия ионизации уменьшается по группе. Причина этого в том, что по группе валентные электроны удаляются дальше от ядра, поэтому заряд ядра уменьшается.
Факторы, влияющие на энергию ионизации
Различные факторы, влияющие на уровни энергии ионизации
Заряд ядра
Чем ниже заряд ядра, тем ниже сила притяжения между ядром и валентными электронами, поэтому энергия ионизации ниже.
Экранирующий эффект
Экранирующий эффект увеличивается по мере увеличения заряда ядра, таким образом, с увеличением экранирующего эффекта увеличивается и энергия ионизации.
Атомный радиус
По мере увеличения атомного радиуса сила притяжения между ядром и валентными электронами также уменьшается.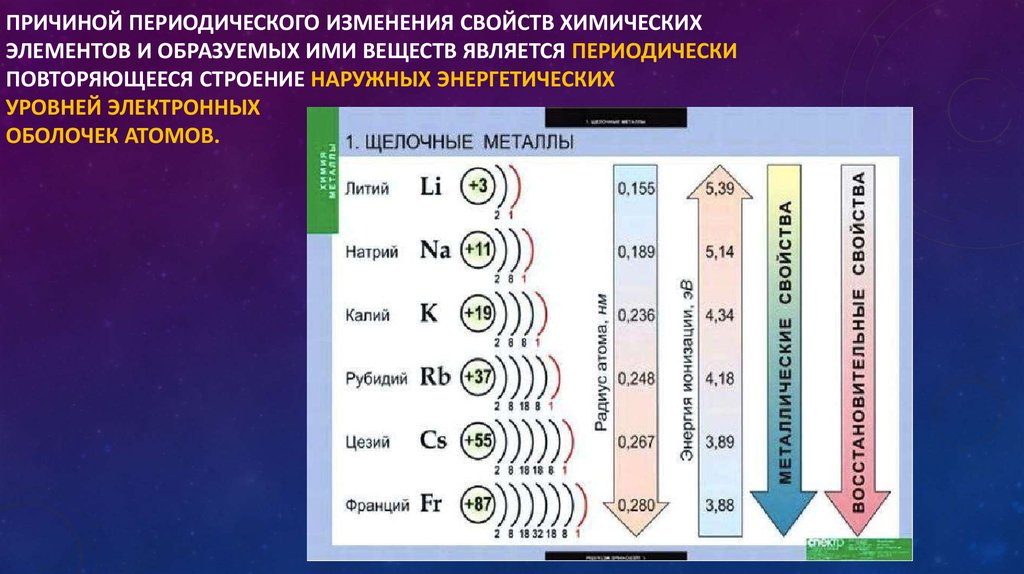 Таким образом, с увеличением атомного радиуса ионизация уменьшается.
Таким образом, с увеличением атомного радиуса ионизация уменьшается.
Наполовину заполненные валентные оболочки
Псевдозаполненные или наполовину заполненные валентные оболочки имеют высокую энергию ионизации.
Простой принцип, который можно использовать, заключается в том, что если главное квантовое число низкое, то число ионизации для электрона, присутствующего в этой оболочке, будет высоким.
Исключения
Все элементы семейства кислорода и бора являются исключением из указанной выше периодической тенденции. Они требуют немного меньше энергии, чем обычный тренд.
2. Металлическое свойство
Металлическое свойство элемента можно определить как его способность проводить электричество. Металлические свойства увеличиваются вниз по группе по мере уменьшения заряда ядра вниз по группе. Поскольку валентный электрон слабо связан с ядрами, они способны хорошо проводить электричество.
Но с течением времени металлический характер уменьшается по мере увеличения заряда ядра. Это вызывает увеличение силы притяжения между валентными электронами и ядрами, тем самым препятствуя их проведению электричества или тепла.
3. Атомные радиусы
Атомный радиус – это расстояние между атомным ядром и внешней стабильной электронной орбиталью атома, находящегося в равновесии. В течение периода радиус атома уменьшается по мере увеличения заряда ядра. Причина уменьшения заключается в том, что по мере увеличения заряда ядра сила притяжения между ядром и валентными электронами также увеличивается, и ядро крепко удерживает электрон, тем самым уменьшая атомные радиусы.
В группе атомный радиус увеличивается вниз по группе. Причина в том, что добавляются новые снаряды и таким образом уменьшается ядерный заряд. Но атомные радиусы также увеличиваются по диагонали, вызывая некоторые исключения.
Пример:
Вдоль периода – Li> Be > B > C > N > O > F
Вниз по Grp – Li < Na < K < Rb < Cs
4.
 Электроотрицательность
ЭлектроотрицательностьЭлектроотрицательность можно определить как способность атома или молекулы притягивать пару электронов. Образующаяся за счет этого связь в основном определяется разницей между электроотрицательностью атомов.
В течение периода электроотрицательность увеличивается по мере увеличения заряда ядра. Двигаясь вниз по группе, электроотрицательность уменьшается по мере уменьшения заряда ядра. Причина в том, что расстояние между ядром атома и валентными электронами велико, и поэтому электроны легко теряются.
Пример:
Вдоль периода – Li < Be < B < C < N < O < F
Вниз по Grp – Li > Na > K > Rb > Cs
Исключение
Элементы группы 13 являются исключением, поэтому электроотрицательность увеличивается от алюминия к таллию. Также в группе 14 электроотрицательность олова выше, чем у свинца.
5. Сродство к электрону
Сродство к электрону можно определить как тенденцию атома принимать электрон или электронную пару. Это характерная черта неметаллов, поскольку они приобретают электроны, превращаясь в анионы. В течение периода сродство к электрону увеличивается по мере увеличения заряда ядра.
Это характерная черта неметаллов, поскольку они приобретают электроны, превращаясь в анионы. В течение периода сродство к электрону увеличивается по мере увеличения заряда ядра.
Вниз по группе уменьшается, так как уменьшается заряд ядра. Фтор имеет самую высокую электроотрицательность, и благородные газы в него не входят. Причина в том, что они имеют полную валентную оболочку и поэтому не могут ни приобретать, ни терять электроны.
6. Экранирующий эффект
Его можно определить как отталкивание внешнего электрона внутренними электронами. Его также можно использовать для объяснения того, сколько ядер могут управлять внешними электронами. Эффективный заряд ядра уменьшается вниз по группе из-за увеличения экранирующего эффекта. В течение периода эффективный заряд ядра увеличивается по мере увеличения заряда ядра.
Подводя итог, можно сделать следующие выводы.
Характеристика | Период | Группа 30156 Энергия ионизации | Увеличивается | Уменьшается |
Металлические свойства | Уменьшается | Увеличивается | ||
Атомный радиус | Уменьшается | Увеличивается | ||
| 9000 Электроотрицательность 9 | Возрастает | Уменьшается | ||
Сродство к электрону | Возрастает | Уменьшается | ||
Защитный эффект | Увеличивается | Уменьшается |
7.
 Ионный радиус
Ионный радиусИон состоит из электронов в своих многочисленных оболочках и ядра. Расстояние между ядром и электроном в последней самой внешней оболочке иона известно как ионный радиус иона. Основываясь на ионном радиусе различных элементов, можно определить тенденцию в периодической таблице. По сути, эту тенденцию можно рассматривать как;
Если мы перейдем от вершины таблицы Менделеева к ее основанию, ионный радиус элементов увеличится. Это происходит потому, что по мере продвижения вниз по периодической таблице количество слоев или оболочек электронов увеличивается.
Если двигаться в периодической таблице слева направо, то ионный радиус имеет тенденцию к уменьшению. Хотя кажется странным, что размер иона будет уменьшаться по мере добавления большего количества протонов, электронов и нейтронов. Однако это происходит потому, что когда мы двигаемся боком по периодической таблице, металл сбрасывает свои внешние электронные слои, чтобы сформировать катионы.
 Для неметаллов ионный радиус увеличивается по мере того, как количество электронов, присутствующих в ионе, превышает количество протонов, вызывая значительное уменьшение заряда ядра.
Для неметаллов ионный радиус увеличивается по мере того, как количество электронов, присутствующих в ионе, превышает количество протонов, вызывая значительное уменьшение заряда ядра.
Эта тенденция относится не только к ионному радиусу, но и к атомному радиусу; однако они отличаются друг от друга.
8. Химическая реактивность
Реакционная способность элемента относится к способности атома вступать в реакцию с любым другим веществом. Химическая активность часто регулируется энергией ионизации (как просто электроны сбрасываются с самого внешнего слоя) и электроотрицательностью (насколько быстро атом принимает электроны другого атома). Этот процесс переноса и обмена электронами является принципом, по которому происходит тенденция химической активности в периодической таблице.
В металлах химическая активность уменьшается по мере того, как мы перемещаемся по периодической таблице слева направо.
 Принимая во внимание, что реактивность увеличивается по мере продвижения от верхних к нижним группам таблицы. Чем дальше вниз или влево мы движемся, тем легче и быстрее становится обмен электронами, увеличивая химическую активность элементов.
Принимая во внимание, что реактивность увеличивается по мере продвижения от верхних к нижним группам таблицы. Чем дальше вниз или влево мы движемся, тем легче и быстрее становится обмен электронами, увеличивая химическую активность элементов.В неметаллах все наоборот. Химическая активность увеличивается по мере продвижения слева направо по таблице. И реактивность уменьшается по мере продвижения к нижним группам от верхних групп. Чем дальше вверх или вправо, тем легче атомам сбрасывать свои электроны в обмен на другие электроны, увеличивая электроотрицательность, что, в свою очередь, делает химическую реактивность элементов более строгой.
Факты, основанные на тенденциях периода и периодических таблицах
Наиболее благородные газы — гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). )- имеют нулевую электроотрицательность, потому что они чрезвычайно стабильны.
 У них есть полностью валентные электронные слои, из-за которых они не теряют и не приобретают электроны легко.
У них есть полностью валентные электронные слои, из-за которых они не теряют и не приобретают электроны легко.Из 118 элементов таблицы Менделеева 90 можно найти в природе, а остальные 28 созданы человеком.
В то время как водород (H) является самым легким элементом в периодической таблице (его можно найти в верхнем левом углу), оганесон (Og) является самым тяжелым элементом (можно найти в правом нижнем углу)
Почти 75% элементов периодической таблицы — это металлы. В то время как есть только несколько неметаллов.
Единственными двумя элементами, которые являются жидкими при комнатной температуре, являются бром и ртуть.
Если периодическую таблицу сложить пополам вдоль ее группы 4 элементов, то группы, лежащие друг над другом, могут идеально слиться друг с другом, потому что они имеют гармонирующую электронную структуру.
 Следовательно, они сочетаются друг с другом в полной стабильности.
Следовательно, они сочетаются друг с другом в полной стабильности.
Химические свойства элементов и соединений
Атомный номер
Атомный номер указывает количество протонов в ядре атома. Атомный номер является важным понятием в химии и квантовой механике. Из этой концепции вытекают элемент и его место в периодической таблице.
Когда атом обычно электрически нейтрален, атомный номер будет равен количеству электронов в атоме, которое можно найти вокруг ядра. Эти электроны в основном определяют химическое поведение атома. Атомы, несущие электрический заряд, называются ионами. Ионы имеют число электронов больше (отрицательно заряженных) или меньше (положительно заряженных), чем атомный номер.
Атомная масса
Название указывает на массу атома, выраженную в атомных единицах массы (а.е.м.). Большая часть массы атома сосредоточена в протонах и нейтронах, содержащихся в ядре. Каждый протон или нейтрон весит около 1 а.
Электроотрицательность по Полингу
Электроотрицательность измеряет склонность атома тянуть электронное облако в своем направлении во время химической связи с другим атомом.
Шкала Полинга — широко используемый метод упорядочения химических элементов по их электроотрицательности. Лауреат Нобелевской премии Линус Полинг разработал эту шкалу в 1932 году.
Значения электроотрицательности не рассчитываются на основе математической формулы или измерения. Это больше похоже на прагматический диапазон.
Плотность
Плотность элемента указывает количество единиц массы элемента, присутствующих в определенном объеме среды. Традиционно плотность выражается греческой буквой ro (пишется как r). В системе единиц СИ плотность выражается в килограммах на кубический метр (кг/м 3 ). Плотность элемента обычно выражается графически с помощью температуры и давления воздуха, потому что эти два свойства влияют на плотность.
Температура плавления
Температура плавления элемента или соединения означает температуру, при которой твердая форма элемента или соединения находится в равновесии с жидкой формой. Обычно мы предполагаем, что атмосферное давление равно 1 атмосфере.
Например: температура плавления воды 0 o C, или 273 K.
Температура кипения
Температура кипения элемента или соединения означает температуру, при которой жидкая форма элемента или соединения находится в равновесии с газообразной формой. Обычно мы предполагаем, что атмосферное давление равно 1 атмосфере.
При температуре кипения давление паров элемента или соединения составляет 1 атмосферу.
Радиус Вандерваальса
Даже когда два атома, находящиеся рядом друг с другом, не связываются, они все равно будут притягиваться друг к другу. Это явление известно как взаимодействие Вандерваальса. 903:20 Силы Вандерваальса вызывают силу между двумя атомами. Эта сила становится сильнее по мере того, как атомы сближаются. Однако, когда два атома приближаются слишком близко друг к другу, начинает действовать отталкивающая сила вследствие чрезмерного отталкивания между отрицательно заряженными электронами обоих атомов. В результате между двумя атомами образуется определенное расстояние, известное как радиус Вандерваальса.
903:20 Силы Вандерваальса вызывают силу между двумя атомами. Эта сила становится сильнее по мере того, как атомы сближаются. Однако, когда два атома приближаются слишком близко друг к другу, начинает действовать отталкивающая сила вследствие чрезмерного отталкивания между отрицательно заряженными электронами обоих атомов. В результате между двумя атомами образуется определенное расстояние, известное как радиус Вандерваальса.
Ионный радиус
Ионный радиус — это радиус, который ион имеет в ионном кристалле, где ионы упакованы вместе до точки, где их самые внешние электронные орбитали соприкасаются друг с другом. Орбиталь — это область вокруг атома, где, согласно орбитальной теории, вероятность нахождения электрона наибольшая.
Изотопы
Атомный номер не определяет количество нейтронов в атомном ядре.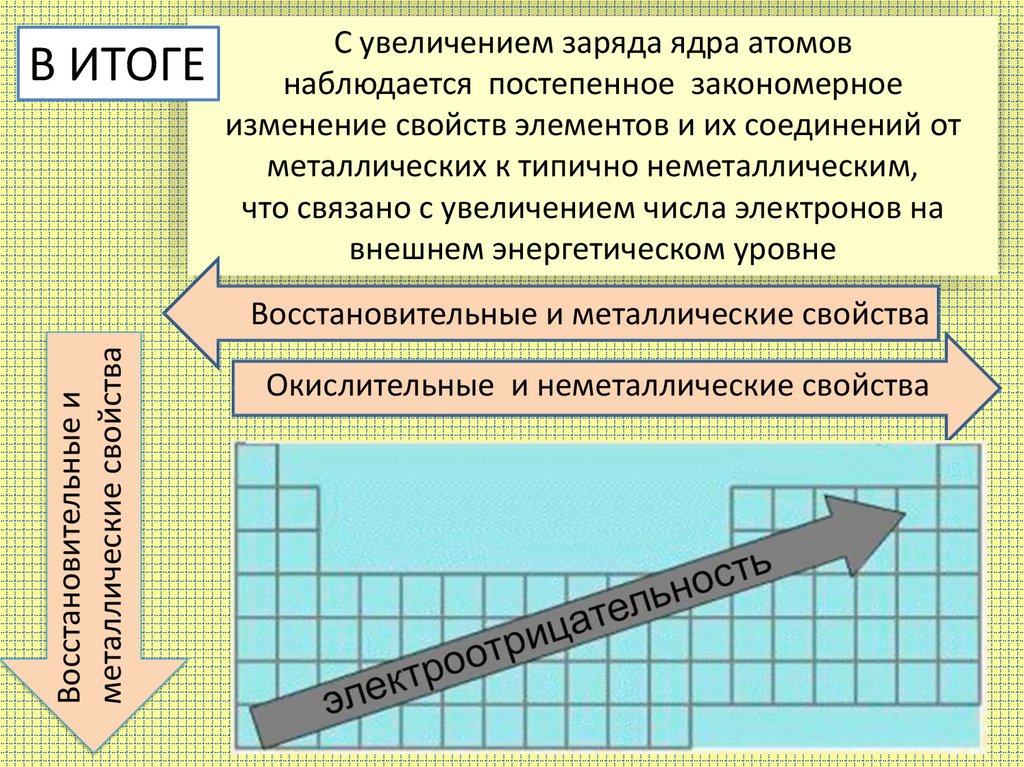 В результате количество нейтронов в атоме может варьироваться. Тогда атомы с одинаковым атомным номером могут отличаться по атомной массе. Атомы одного и того же элемента, отличающиеся атомной массой, называются изотопами.
В результате количество нейтронов в атоме может варьироваться. Тогда атомы с одинаковым атомным номером могут отличаться по атомной массе. Атомы одного и того же элемента, отличающиеся атомной массой, называются изотопами.
В основном у более тяжелых атомов с более высоким атомным номером количество нейтронов в ядре может превышать количество протонов.
Пример: хлор имеет атомный номер 17, что в основном означает, что все атомы хлора содержат 17 протонов в своем ядре. Есть два изотопа. Три четверти встречающихся в природе атомов хлора содержат 18 нейтронов, а одна четверть — 20 нейтронов. Массовые числа этих изотопов 17 + 18 = 35 и 17 + 20 = 37. Изотопы записываются следующим образом: 35Cl и 37Cl.
Когда изотопы обозначаются таким образом, количество протонов и нейтронов не нужно указывать отдельно, потому что символ хлора в периодической таблице (Cl) ставится на семнадцатом месте.
Большое количество изотопов нестабильны. Они развалятся в процессе радиоактивного распада. Изотопы, обладающие радиоактивностью, называются радиоизотопами.
Электронная оболочка
Электронная конфигурация атома — это описание расположения электронов по кругу вокруг ядра. Эти круги не совсем круглые; они содержат волнообразный рисунок. Для каждого круга вероятность присутствия электрона в определенном месте описывается математической формулой. Каждый из кругов имеет определенный уровень энергии по сравнению с ядром. Обычно энергетические уровни электронов выше, когда они находятся дальше от ядра, но из-за их зарядов электроны также могут влиять на энергетические уровни друг друга. Обычно первыми заполняются средние круги, но могут быть и исключения из-за отказов.

Энергия первой ионизации
Энергия ионизации означает энергию, необходимую для того, чтобы свободный атом или молекула потеряли электрон в вакууме. Другими словами; энергия ионизации является мерой прочности электронных связей с молекулами. Это касается только электронов во внешнем круге.
Энергия второй ионизации
Помимо энергии первой ионизации, которая показывает, насколько трудно удалить первый электрон из атома, существует также энергетическая мера второй ионизации. Эта энергия вторичной ионизации указывает на степень трудности удаления второго атома.
Таким образом, существует также энергия третьей ионизации, а иногда даже энергия четвертой или пятой ионизации.
Стандартный потенциал
Стандартный потенциал означает потенциал окислительно-восстановительной реакции, когда она находится в равновесии, относительно нуля. Когда стандартный потенциал превышает ноль, мы имеем дело с реакцией окисления.


 Для неметаллов ионный радиус увеличивается по мере того, как количество электронов, присутствующих в ионе, превышает количество протонов, вызывая значительное уменьшение заряда ядра.
Для неметаллов ионный радиус увеличивается по мере того, как количество электронов, присутствующих в ионе, превышает количество протонов, вызывая значительное уменьшение заряда ядра. Принимая во внимание, что реактивность увеличивается по мере продвижения от верхних к нижним группам таблицы. Чем дальше вниз или влево мы движемся, тем легче и быстрее становится обмен электронами, увеличивая химическую активность элементов.
Принимая во внимание, что реактивность увеличивается по мере продвижения от верхних к нижним группам таблицы. Чем дальше вниз или влево мы движемся, тем легче и быстрее становится обмен электронами, увеличивая химическую активность элементов. У них есть полностью валентные электронные слои, из-за которых они не теряют и не приобретают электроны легко.
У них есть полностью валентные электронные слои, из-за которых они не теряют и не приобретают электроны легко. Следовательно, они сочетаются друг с другом в полной стабильности.
Следовательно, они сочетаются друг с другом в полной стабильности.