Periodic Table – Ptable
Periodic Table – Ptable Menu Wide Top bar Side bar Dark SearchEnable JavaScript for a plethora of interactivity including property trend visualization, thousands of isotopes, compound mixing, and 3D orbital diagrams. Don’t like ads? No problem! Ptable will always be free for everyone. Find yourself here daily? Consider either unblocking the single ad banner, donating $1 a month (log in after donating), or buying a poster or wallet card, order numberTemperature
°C °F K
YearCE
- Search for:
- Atomic number
- Property values
- Linear
- Logarithmic
- s
- block
- p
- block
- d
- block
- f
- block
- α
- Alpha decay
- p
- Proton emission
- n
- Neutron emission
- SF
- Spontaneous fission
- β⁻
- Beta decay
- β⁺
- Positron emission
- ϵ
- Electron capture
- Stable
 008
008- 2 He Helium 4.0026
- 3 Li Lithium 6.94
- 4 Be Beryllium 9.0122
- 5 B Boron 10.81
- 6 C Carbon 12.011
- 7 N Nitrogen 14.007
- 8 O Oxygen 15.999
- 9 F Fluorine 18.998
- 10 Ne Neon 20.180
- 11 Na Sodium 22.990
- 12 Mg Magnesium 24.305
- 13 Al Aluminium 26.982
- 14 Si Silicon 28.085
- 15 P Phosphorus 30.974
- 16 S Sulfur 32.06
- 17 Cl Chlorine 35.
 45
45 - 18 Ar Argon 39.948
- 19 K Potassium 39.098
- 20 Ca Calcium 40.078
- 21
- 22 Ti Titanium 47.867
- 23 V Vanadium 50.942
- 24 Cr Chromium 51.996
- 25 Mn Manganese 54.938
- 26 Fe Iron 55.845
- 27 Co Cobalt 58.933
- 28 Ni Nickel 58.693
- 29 Cu Copper 63.546
- 30 Zn Zinc 65.38
- 31 Ga Gallium 69.723
- 32
- 33 As Arsenic 74.
 922
922 - 34 Se Selenium 78.971
- 35 Br Bromine 79.904
- 36 Kr Krypton 83.798
- 37 Rb Rubidium 85.468
- 38 Sr Strontium 87.62
- 39 Y Yttrium 88.906
- 40 Zr Zirconium 91.224
- 41 Nb Niobium 92.906
- 42 Mo Molybdenum 95.95
- 43 Tc Technetium (98)
- 44 Ru Ruthenium 101.07
- 45 Rh Rhodium 102.91
- 46 Pd Palladium 106.42
- 47 Ag Silver 107.87
- 48 Cd Cadmium 112.41
- 49 In Indium 114.
 82
82 - 50 Sn Tin 118.71
- 51 Sb Antimony
- 52 Te Tellurium 127.60
- 53 I Iodine 126.90
- 54 Xe Xenon 131.29
- 55 Cs Caesium 132.91
- 56 Ba Barium 137.33
- 57 La Lanthanum 138.91
- 58 Ce Cerium 140.12
- 59 Pr Praseodymium 140.91
- 60 Nd Neodymium 144.24
- 61 Pm Promethium (145)
- 62
- 63 Eu Europium 151.96
- 64 Gd Gadolinium 157.25
- 65 Tb Terbium 158.
 93
93 - 66 Dy Dysprosium 162.50
- 67 Ho Holmium 164.93
- 68 Er Erbium 167.26
- 69 Tm Thulium 168.93
- 70 Yb Ytterbium 173.05
- 71
- 72 Hf Hafnium 178.49
- 73 Ta Tantalum 180.95
- 74 W Tungsten 183.84
- 75 Re Rhenium 186.21
- 76 Os Osmium 190.23
- 77 Ir Iridium 192.22
- 78 Pt Platinum 195.08
- 79 Au Gold 196.97
- 80 Hg Mercury 200.59
- 81 Tl Thallium 204.

- 82 Pb Lead 207.2
- 83 Bi Bismuth 208.98
- 84 Po Polonium (209)
- 85 At Astatine (210)
- 86 Rn Radon (222)
- 87 Fr Francium (223)
- 88 Ra Radium (226)
- 89 Ac Actinium (227)
- 90 Th Thorium 232.04
- 91 Pa
- 92 U Uranium 238.03
- 93 Np Neptunium (237)
- 94 Pu Plutonium (244)
- 95 Am Americium (243)
- 96 Cm Curium (247)
- 97 Bk Berkelium (247)
- 98 Cf Californium (251)
- 99 Es Einsteinium (252)
- 100 Fm Fermium (257)
- 101 Md Mendelevium (258)
- 102 No Nobelium
- 103 Lr Lawrencium (266)
- 104 Rf Rutherfordium (267)
- 105 Db Dubnium (268)
- 106 Sg Seaborgium (269)
- 107 Bh Bohrium (270)
- 108 Hs Hassium (277)
- 109 Mt Meitnerium (278)
- 110 Ds Darmstadtium (281)
- 111 Rg Roentgenium (282)
- 112 Cn Copernicium (285)
- 113 Nh
- 114 Fl Flerovium (289)
- 115 Mc Moscovium (290)
- 116 Lv Livermorium (293)
- 117 Ts Tennessine (294)
- 118 Og Oganesson (294)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15Pnictogens
16Chalcogens
17Halogens
18
- Color
Minimum
Zero
Maximum
Unknown
- Scale
Atomic Symbol Name Weight
1
2
3
4
5
6
57–71
6
7
89–103
7
For elements with no stable isotopes, the mass number of the isotope with the longest half-life is in parentheses.
- View
- Wide
- Dark
- About
- Feature demo
- Questions
- PrivacyPrivacy
- Products
- Posters & cards
- ACSLesson plans
- Remove ads
- Editions
- Print PDF
- Image (Wide)
- LanguageAfrikaansالعربيةБългарскиবাংলাCatalàČeštinaCymraegDanskDeutschΕλληνικάEnglishEsperantoEspañolEestiفارسیSuomiFrançaisעבריתहिन्दीHrvatskiMagyarBahasaÍslenskaItaliano日本語한국어LatinaLietuviųLatviešuNederlandsNorskPolskiPortuguêsRomânăРусскийSlovenčinaSlovenščinaСрпскиSvenskaKiswahiliไทยTürkçeУкраїнськаTiếng Việt中文 (简)中文 (繁)
- Engage
- Discord Twitter Instagram
- Share
- Contact
D. I. Mendeleev sends his manuscript “The experiment of a system of elements based on their atomic weight and chemical similarity” to the printer’s
February 17 (March 1), 1869 Dmitri Ivanovich Mendeleev sent to the printer’s his manuscript, “The experiment of a system of elements based on their atomic weight and chemical similarity”, the first version of the periodic table of elements. The final wording of the law was given to scientists in July 1871.
The final wording of the law was given to scientists in July 1871.
The periodic law was discovered by Mendeleev in the course of composing “The Fundamentals of Chemistry” textbook when he had difficulty systemizing the facts. By mid-February 1869, considering the structure of the textbook, the scientist gradually came to the conclusion that the properties of simple substances and the atomic masses of elements are bound to a certain regularity.
The discovery of the periodic table of elements was not made by chance, it was the result of enormous effort, time-consuming and painstaking work done not only by Dmitri Ivanovich, but also by many chemists from among his predecessors and contemporaries. “When I was finishing drawing up my classification of the elements, I wrote down each element and its compounds on a slip, and then, placing them by groups and series, got the first visual table of the periodic law. But it was only the finale, the result of the previous work …,” said the scientist. Mendeleev stressed that his discovery was the result which had completed a twenty-year meditation on the relationship between the elements, thinking over the relationship of elements.
Mendeleev stressed that his discovery was the result which had completed a twenty-year meditation on the relationship between the elements, thinking over the relationship of elements.
February 17 (March 1), the manuscript of the article containing the table entitled “The experiment of a system of elements based on their atomic weight and chemical similarity,” was completed and sent to print with notes for typesetters dated “February 17, 1869.” Mendeleev’s discovery was reported by the editor of the “Russian Chemical Society,” Professor N. A. Menshutkin at the society’s meeting of 22 February (March 6) 1869. Mendeleev himself was not present at the meeting, as at that time, on the instructions of the Free Economic Society, was surveying cheese dairies in the Tver and Novgorod provinces.
In the first version of the system, the scholar organized the elements by nineteen horizontal rows and six vertical columns. February 17 (March 1) the discovery of the periodic law was not at all completed, but just began. Dmitri Ivanovich continued its development and deepening for almost three more years. In 1870 Mendeleev published the second version of the system (“The Natural System of Elements”) in “The Principles of Chemistry”: the horizontal columns of elements-analogs had been transformed into eight vertically arranged groups, while six vertical columns of the first version had become periods beginning with an alkali and ending with halogen. Each period was divided into two rows; the elements of different groups rows included in the group formed a series of subgroups.
Dmitri Ivanovich continued its development and deepening for almost three more years. In 1870 Mendeleev published the second version of the system (“The Natural System of Elements”) in “The Principles of Chemistry”: the horizontal columns of elements-analogs had been transformed into eight vertically arranged groups, while six vertical columns of the first version had become periods beginning with an alkali and ending with halogen. Each period was divided into two rows; the elements of different groups rows included in the group formed a series of subgroups.
The essence of the discovery of Mendeleev was the fact that as the atomic weight of chemical elements increased, their properties changed periodically, not monotonically. After a certain number of elements with different properties, arranged by growing atomic weight, the properties begin to repeat. The difference of Mendeleev’s work from those of his predecessors was the fact that Mendeleev used two basis for his classification of the elements instead of one: the atomic mass and the chemical similarity.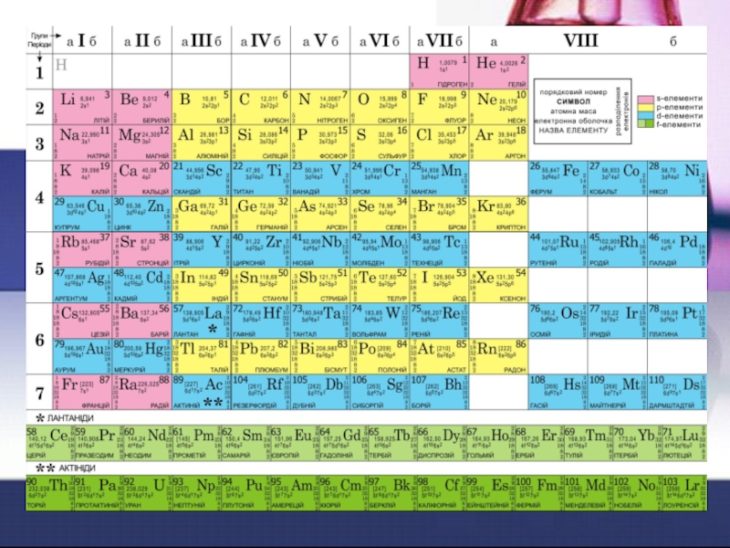 In order to fully maintain the periodicity, Mendeleev corrected the atomic weights of certain elements, matched some of them with other elements of his system despite the accepted notions of the time about their similarities, left empty squares in the table for the elements not yet discovered.
In order to fully maintain the periodicity, Mendeleev corrected the atomic weights of certain elements, matched some of them with other elements of his system despite the accepted notions of the time about their similarities, left empty squares in the table for the elements not yet discovered.
In 1871, on the basis of these studies; Mendeleev formulated the Periodic trends, whose form slightly improved over time.
The Periodic system of elements had a great impact on the further development of chemistry. Not only it was the first natural classification of the chemical elements, which demonstrated that they form a coherent system and are in close contact with each other, but also was a powerful instrument for further research. At the time when Mendeleev was drawing up his table in accordance with the periodic trends he had discovered, many elements were still unknown. Mendeleev was not only convinced that there must be yet unknown elements that would fill the gaps in his table, but had also predicted the properties of those elements considering their position among the other elements of the periodic system. Over the next 15 years, the predictions of Mendeleev brilliantly confirmed, all the three expected elements were discovered (Ga, Sc, Ge), which turned out to be the greatest triumph of the periodic trends.
Over the next 15 years, the predictions of Mendeleev brilliantly confirmed, all the three expected elements were discovered (Ga, Sc, Ge), which turned out to be the greatest triumph of the periodic trends.
The periodic system has also played an important role in determining the valence and the atomic weights of some elements. Similarly, the periodic system gave rise to the correction of the atomic masses of some elements. It was on its basis that transuranic elements have been artificially created. The further development of science, based on the periodic trends, allowed much deeper understanding of the structure of the substance, than it was possible during the life of Mendeleev. The scientist himself described his law as follows: “The future does not threaten the periodic trends the destruction, but will provide only improvement and development.”
Lit.: Агафошин Н. П. Периодический закон и периодическая система элементов Д. И. Менделеева. М., 1973; Евдокимов Ю. К истории периодического закона // Наука и жизнь. № 5 (2009). С. 12–15; Кедров Б. M. День одного великого открытия. M., 1958; Кедров Б. M., Трифонов Д. H. Закон периодичности и химические элементы. Открытия и хронология. M., 1969; Макареня А. А., Рысев Ю. В. Д. И. Менделеев. М., 1983; Макареня А. А., Трифонов Д. Н. Периодический закон Д. И. Менделеева. М., 1969; Макареня А. А., Трифонов Д. Н. Периодический закон Д. И. Менделеева. М., 1969; Менделеев Д. И. Периодический закон. Основные статьи. M., 1958.
К истории периодического закона // Наука и жизнь. № 5 (2009). С. 12–15; Кедров Б. M. День одного великого открытия. M., 1958; Кедров Б. M., Трифонов Д. H. Закон периодичности и химические элементы. Открытия и хронология. M., 1969; Макареня А. А., Рысев Ю. В. Д. И. Менделеев. М., 1983; Макареня А. А., Трифонов Д. Н. Периодический закон Д. И. Менделеева. М., 1969; Макареня А. А., Трифонов Д. Н. Периодический закон Д. И. Менделеева. М., 1969; Менделеев Д. И. Периодический закон. Основные статьи. M., 1958.
Based on the Presidential Library’s materials:
Boards of weights and measures established // On this day. 20 June;
Kuznetsov B. G. Lomonosov. Lobachevsky. Mendeleev: Essays on Life and Worldview. Moscow; Leningrad, 1945;
Mendeleev D. I. Treasured thoughts of D. Mendeleyev. SPb., 1903-1905;
Semenchenko V. K. Mendeleev and the physics of the atom. Penza, 1945;
Tobolsk. Monument to DI Mendeleyev [Izomaterial] / photo by A. Musin. M., 1969.
M., 1969.
Год Периодической таблицы: Менделеев и другие
Введение
Генеральная Ассамблея ООН провозгласила 2019 год Международным годом Периодической таблицы элементов (рис. 1). Точно так же 2011 год был годом химии, а 2014 год — годом кристаллографии. Нет никакой исключительности, и для данного года могут быть провозглашены несколько других обозначений. Тем не менее примечательно, что в течение одного десятилетия темы, относящиеся к сфере структурной химии, трижды объявлялись темами международных годов.
Рис. 1Периодическая таблица элементов Менделеева в качестве росписи на фасаде Менделеевского института метрологии в Санкт-Петербурге (фотография Магдолны Харгиттай; воспроизведена с разрешения)
Изображение в натуральную величину
годовщина рождения первой таблицы Менделеева Дмитрия Ивановича (1834–1907). Датой ее первого составления принято считать 17 февраля 1869 года. Однако это не могло быть внезапным моментом Эврики и дата должна относиться к составлению уже презентабельного варианта таблицы. В этот день Менделеев отправил в типографию свою таблицу и она была напечатана 1 марта 1869 г.. Как только Менделеев получил печатную версию, он тут же разослал копии российским и зарубежным коллегам. Однако должно было быть несколько черновых версий, ведущих к презентабельной, и такая ранняя версия воспроизведена на рис. 2 [1]. Мы показываем эту раннюю, едва понятную версию, чтобы показать, насколько кропотливым должен был быть процесс.
В этот день Менделеев отправил в типографию свою таблицу и она была напечатана 1 марта 1869 г.. Как только Менделеев получил печатную версию, он тут же разослал копии российским и зарубежным коллегам. Однако должно было быть несколько черновых версий, ведущих к презентабельной, и такая ранняя версия воспроизведена на рис. 2 [1]. Мы показываем эту раннюю, едва понятную версию, чтобы показать, насколько кропотливым должен был быть процесс.
Факсимиле ранней версии Периодической таблицы элементов Менделеева [1]
Изображение в натуральную величину
Менделеев готовился к лекциям по общей химии и своему тексту «Основы химии» ( Основы химии ), когда сделал наблюдение периодичности в свойствах элементов. В нем он привел пример par excellence того, как физический химик, ставший философом, Майкл Поланьи описал процесс научных открытий. Его идея была передана в краткой речи Юджина П. Вигнера 10 декабря 1963 года в Стокгольмской ратуше. Поводом стала Нобелевская премия Вигнера по физике. Четыре десятилетия назад Вигнер был докторантом Поланьи в Берлине. Вигнер, между прочим, сказал: «…наука начинается тогда, когда имеется совокупность явлений, обнаруживающих некоторую связность и закономерности, что наука состоит в усвоении этих закономерностей и в создании понятий, позволяющих выразить эти закономерности естественным образом» [2]. Менделеев отмечал закономерности и согласованность, несмотря на то, что его наблюдения основывались на атомных массах (а не на тогда еще неизвестных величинах атомных чисел) и даже несмотря на то, что некоторые из этих атомных масс в конечном счете нуждались в корректировке.
Поводом стала Нобелевская премия Вигнера по физике. Четыре десятилетия назад Вигнер был докторантом Поланьи в Берлине. Вигнер, между прочим, сказал: «…наука начинается тогда, когда имеется совокупность явлений, обнаруживающих некоторую связность и закономерности, что наука состоит в усвоении этих закономерностей и в создании понятий, позволяющих выразить эти закономерности естественным образом» [2]. Менделеев отмечал закономерности и согласованность, несмотря на то, что его наблюдения основывались на атомных массах (а не на тогда еще неизвестных величинах атомных чисел) и даже несмотря на то, что некоторые из этих атомных масс в конечном счете нуждались в корректировке.
С самого начала Менделеев осознавал важность того, чтобы его открытие стало всемирно известным. Еще одной важной чертой его достижений было то, что он предсказывал еще неизвестные элементы на основе своих наблюдений когерентности и закономерностей. В конце концов, его предсказания оказались верными. Он не только отправил свою таблицу коллегам в Западную Европу, в 1871 году он посетил химические центры, чтобы из первых рук сообщить своим коллегам о своей периодической таблице. В течение этих месяцев и лет он продолжал улучшать свой стол.
В течение этих месяцев и лет он продолжал улучшать свой стол.
Одновременность открытия
Как это часто бывает со значительными открытиями, для которых пришло время, несколько ученых примерно в одно и то же время пришли к выводу о периодичности в системе химических элементов. Наиболее известными из них были Лотар Дж. Мейер (1830–1895) в Германии и Джон А.Р. Ньюлендс (1837–1898) в Англии. Ньюлендс не преуспел на своей родине, и он не выставлял свое открытие на международном уровне. Когда он обнаружил свое наблюдение периодичности в свойствах элементов, некоторые коллеги высмеяли его — настолько им было чуждо воспринять его революционную идею. Кто-то даже спросил его, не пробовал ли он классифицировать элементы по начальным буквам их названий. Ньюлендс также предсказывал еще неизвестные элементы, но его идеи не встретили ни интереса, ни одобрения. Его отчеты отражают его оправданную горечь [3].
Профессиональная среда Ньюлендса в Англии не приняла его открытия, тогда как приветствовала открытия Мейера и Менделеева. Они были совместно награждены престижной медалью Дэви Королевского общества (Лондон) в 1882 году «за открытие периодических соотношений атомных весов». Несколько лет спустя, в 1887 году, Ньюлендс также получил эту награду «за открытие периодического закона химических элементов». Затем, в 1905 году, Менделеев получил высшую награду Королевского общества — медаль Копли «За вклад в химическую и физическую науку». Менделеев был избран иностранным членом Королевского общества, Национальной академии наук США и Шведской королевской академии наук.
Они были совместно награждены престижной медалью Дэви Королевского общества (Лондон) в 1882 году «за открытие периодических соотношений атомных весов». Несколько лет спустя, в 1887 году, Ньюлендс также получил эту награду «за открытие периодического закона химических элементов». Затем, в 1905 году, Менделеев получил высшую награду Королевского общества — медаль Копли «За вклад в химическую и физическую науку». Менделеев был избран иностранным членом Королевского общества, Национальной академии наук США и Шведской королевской академии наук.
№
пророк в своей стране Принимая во внимание важнейшее значение открытия Периодической таблицы элементов, о Ньюлендсе и Лотаре Мейере мало что известно. У Ньюлендса есть синяя табличка в Лондоне на фасаде здания на Западной площади, 19. Его текст «J.A.R. Ньюлендс, 1837–1898 гг., химик и первооткрыватель Периодического закона химических элементов, родился и вырос здесь». Он был построен Королевским химическим обществом. Место рождения Мейера, Варель, Германия, помнит его мемориальной доской и мемориалом, состоящим из трех колонн со скульптурными головами Мейера, Менделеева и Канниццаро. Итальянский химик Станислао Канниццаро (1826–1819 гг.).10) внес основополагающий вклад в открытие Периодической таблицы, обеспечив наиболее точные атомные веса того времени. Королевское общество наградило его медалью Копли в 1891 году «за вклад в химическую философию, особенно за применение им теории Авогадро». У него есть мемориальная доска в штаб-квартире Генуэзского университета (Палаццо Бальби, 5 Виа Бальби) и барельеф на старом месте Университета Палермо (172 Виа Македа).
Итальянский химик Станислао Канниццаро (1826–1819 гг.).10) внес основополагающий вклад в открытие Периодической таблицы, обеспечив наиболее точные атомные веса того времени. Королевское общество наградило его медалью Копли в 1891 году «за вклад в химическую философию, особенно за применение им теории Авогадро». У него есть мемориальная доска в штаб-квартире Генуэзского университета (Палаццо Бальби, 5 Виа Бальби) и барельеф на старом месте Университета Палермо (172 Виа Македа).
Менделеев при жизни не был избалован признанием в России. Он стал профессором Санкт-Петербургского технологического института в 1864 году и Санкт-Петербургского государственного университета в 1865 году. Однако впоследствии он лишился профессорских званий якобы из-за поддержки студенческих движений, направленных на улучшение их условий жизни и учебы. Последний период своей жизни он оставался контролером Весоизмерительной коллегии, которая затем превратилась в нынешний Менделеевский институт метрологии. Он был избран членом-корреспондентом Российской академии наук в 1877 году, но в 1880 году он был отклонен при решении вопроса о его полном членстве. Это произошло, несмотря на его международную известность и то, что он сделал Санкт-Петербург международным центром химии. Якобы споры о его втором браке, имевшие место незадолго до его развода с первой женой, способствовали негативному отношению к нему со стороны Академии. Это было явным унижением, ведь полноправное членство гораздо важнее члена-корреспондента в двухуровневой системе Российской академии наук.
Он был избран членом-корреспондентом Российской академии наук в 1877 году, но в 1880 году он был отклонен при решении вопроса о его полном членстве. Это произошло, несмотря на его международную известность и то, что он сделал Санкт-Петербург международным центром химии. Якобы споры о его втором браке, имевшие место незадолго до его развода с первой женой, способствовали негативному отношению к нему со стороны Академии. Это было явным унижением, ведь полноправное членство гораздо важнее члена-корреспондента в двухуровневой системе Российской академии наук.
Отсутствие Нобелевской премии
Менделеев был номинирован на Нобелевскую премию по химии в 1905, 1906 и 1907 годах. Ни один из номинантов не был из числа коллег Менделеева в России. Хотя предполагается, что Нобелевская премия присуждается за недавние открытия, успешно утверждалось, что Периодическая таблица элементов в последнее время приобрела дополнительное значение. Одним из наиболее показательных примеров сохраняющейся актуальности открытия Менделеева было то, как легко недавно открытые инертные (сегодня благородные) газы можно было разместить в Периодической таблице. В 1905, помимо Менделеева, главными номинантами были немецкий химик-органик Адольф фон Байер и французский химик-неорганик Анри Муассан, и премия была присуждена фон Байеру. В 1906 году Нобелевский комитет по химии рекомендовал Менделеева на премию общему собранию присуждающего премии органа, Шведской королевской академии наук. Голосование в комитете было большинством 4: 1. Единственный голос против был отдан Муассану. Несогласный член комитета Питер Класон решительно выступил за Муассона. При этом он не умалял достижений Менделеева, но подчеркивал, что без точных атомных весов Канниццаро открытие Периодической таблицы не могло бы произойти. Он предложил признание Канниццаро наряду с признанием Меделеева. Это было разумное условие, но включение Канниццаро было невозможно в 1906, потому что могли быть рассмотрены только те кандидатуры, кандидатуры которых были выдвинуты до 31 января. Канниццаро не было среди номинантов 1906 года. По решению Шведской королевской академии в 1906 году премия досталась Муассону.
В 1905, помимо Менделеева, главными номинантами были немецкий химик-органик Адольф фон Байер и французский химик-неорганик Анри Муассан, и премия была присуждена фон Байеру. В 1906 году Нобелевский комитет по химии рекомендовал Менделеева на премию общему собранию присуждающего премии органа, Шведской королевской академии наук. Голосование в комитете было большинством 4: 1. Единственный голос против был отдан Муассану. Несогласный член комитета Питер Класон решительно выступил за Муассона. При этом он не умалял достижений Менделеева, но подчеркивал, что без точных атомных весов Канниццаро открытие Периодической таблицы не могло бы произойти. Он предложил признание Канниццаро наряду с признанием Меделеева. Это было разумное условие, но включение Канниццаро было невозможно в 1906, потому что могли быть рассмотрены только те кандидатуры, кандидатуры которых были выдвинуты до 31 января. Канниццаро не было среди номинантов 1906 года. По решению Шведской королевской академии в 1906 году премия досталась Муассону. В 1907 году среди номинантов были и Менделеев, и Канниццаро, но Менделеев умер в начале года, а правила Нобелевской премии исключают посмертное присуждение.
В 1907 году среди номинантов были и Менделеев, и Канниццаро, но Менделеев умер в начале года, а правила Нобелевской премии исключают посмертное присуждение.
Отсутствие Нобелевской премии Менделеева — одно из самых заметных упущений в списке нобелевских лауреатов. Учитывая выдающийся вклад Менделеева в науку, его последующую известность и тот факт, что его Периодическая таблица элементов висит в классах по всему миру, где преподают химию, его имя выше всех мирских признаний. Именно учреждение Нобелевской премии страдает от его отсутствия среди лауреатов. Французская академия писала о Мольере (приписываемом Бернару-Жозефу Сорену), который так и не был избран в ее члены: «Rien ne manque à sa gloire, il manquait à la nôtre» («В его славе ничего не пропало; в нашей не хватало только его ).
Вспомнили Менделеева
На его родине в Тобольске стоит статуя Менделеева в полный рост. Недалеко от Тобольска находится Менделеево, один из нескольких населенных пунктов в России, носящих его имя.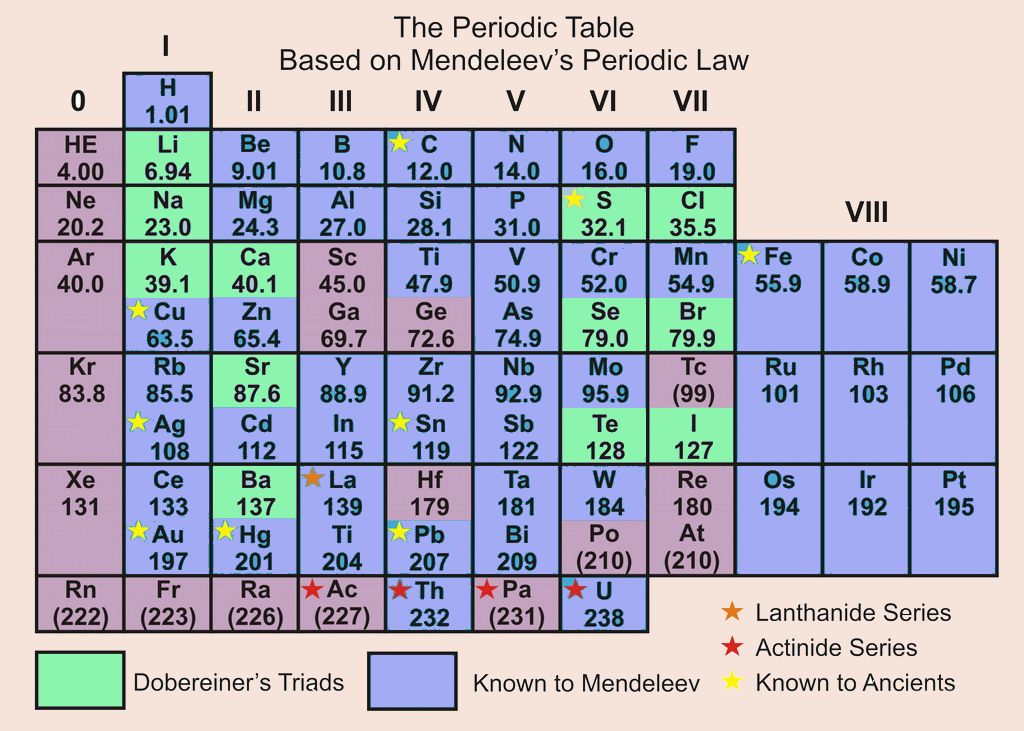 Имеются марки с портретом Менделеева и его периодической таблицей в России и за рубежом, а также статуи, бюсты и мемориальные доски (некоторые см. в [4, 5]). Здесь мы показываем два мемориала, которые менее известны, чем некоторые другие. Один находится в бывшей штаб-квартире Imperial Chemical Industries (ICI) в Лондоне. В центре пятого уровня главного фасада здания, обращенного к западному плацдарму Ламбетского моста через Темсу, находится гигантская ниша. Эта ниша посвящена Менделееву с его портретом, высеченным в замковом камне (рис. 3). С другой стороны здания увековечены память о других великих деятелях химии и химической промышленности. Другой памятник, который мы показываем здесь, — это статуя Менделеева в полный рост в Башне Московского государственного университета [6]. Поскольку вход в Башню возможен только по пропускам, эта статуя малоизвестна (рис. 4).
Имеются марки с портретом Менделеева и его периодической таблицей в России и за рубежом, а также статуи, бюсты и мемориальные доски (некоторые см. в [4, 5]). Здесь мы показываем два мемориала, которые менее известны, чем некоторые другие. Один находится в бывшей штаб-квартире Imperial Chemical Industries (ICI) в Лондоне. В центре пятого уровня главного фасада здания, обращенного к западному плацдарму Ламбетского моста через Темсу, находится гигантская ниша. Эта ниша посвящена Менделееву с его портретом, высеченным в замковом камне (рис. 3). С другой стороны здания увековечены память о других великих деятелях химии и химической промышленности. Другой памятник, который мы показываем здесь, — это статуя Менделеева в полный рост в Башне Московского государственного университета [6]. Поскольку вход в Башню возможен только по пропускам, эта статуя малоизвестна (рис. 4).
Дмитрий И. Менделеев на фасаде бывшей штаб-квартиры ICI, 9 Millbank, SW1, Лондон (фотографии Магдолны Харгиттай; воспроизведено с разрешения)
Изображение в натуральную величину
Рис.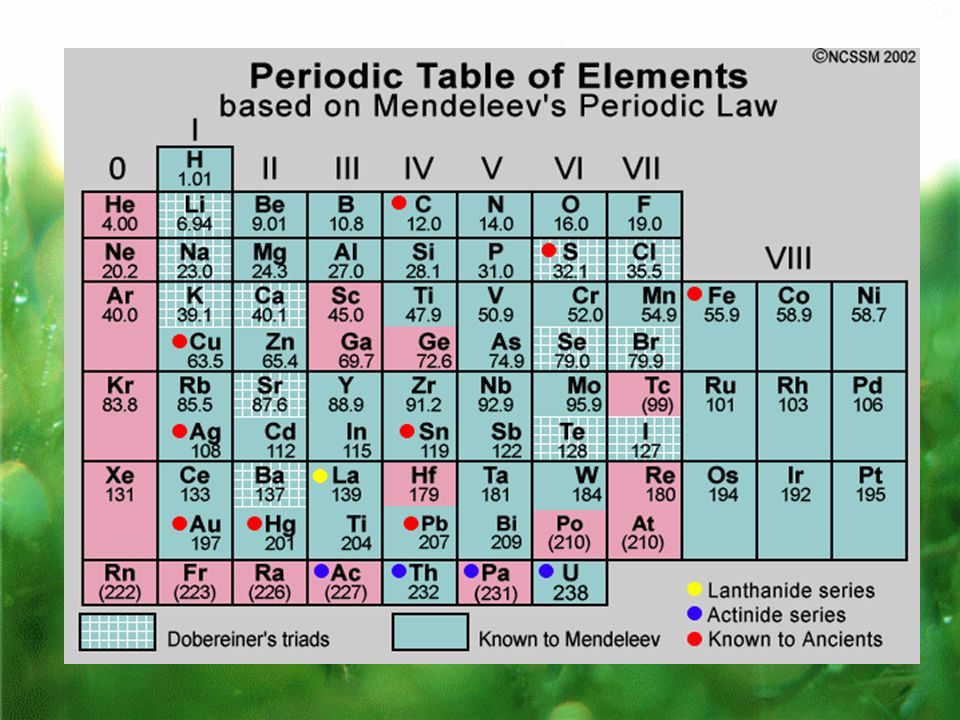 Матвей Г. Манизер и Елена Александровна Янсон-Манизер в одном из двух вестибюлей Парадного зала Башни МГУ имени М.В. Ломоносова (фотография Иштвана Харгиттая; воспроизводится с разрешения)
Матвей Г. Манизер и Елена Александровна Янсон-Манизер в одном из двух вестибюлей Парадного зала Башни МГУ имени М.В. Ломоносова (фотография Иштвана Харгиттая; воспроизводится с разрешения)Изображение в натуральную величину
Помимо его вездесущих периодических таблиц, имя Менделеева увековечено Element 101, Mendelevium, Md.
Литература
Кедров Б.М. закон). изд. акад. Наук СССР, Москва
Вигнер Э.П. (1963) Речь мэрии — Стокгольм, 1963. Воспроизведено в Вигнер Э.П. (1967) Симметрии и размышления: Научные очерки. Издательство Индианского университета, Блумингтон и Лондон, стр. 262–263 9.0005
Google ученый
Newlands JAR (1884 г.) Об открытии периодического закона и отношениях между атомными весами. E and FN Spon, Лондон (это сборник репринтов)
Google ученый
“>Hargittai I (2012) Ульф Лагерквист и его Нобелевские истории. Struct Chem 23:1663–1666
Статья КАС Google ученый
Hargittai I, Hargittai M (2019) Москва научная: памятники исследовательской империи. World Scientific, Сингапур (в производстве)
Google ученый
Харгитай Б., Харгитай И. (2007) Дмитрий И. Менделеев: Столетие. Struct Chem 18:253–255
Статья КАС Google ученый
Скачать ссылки
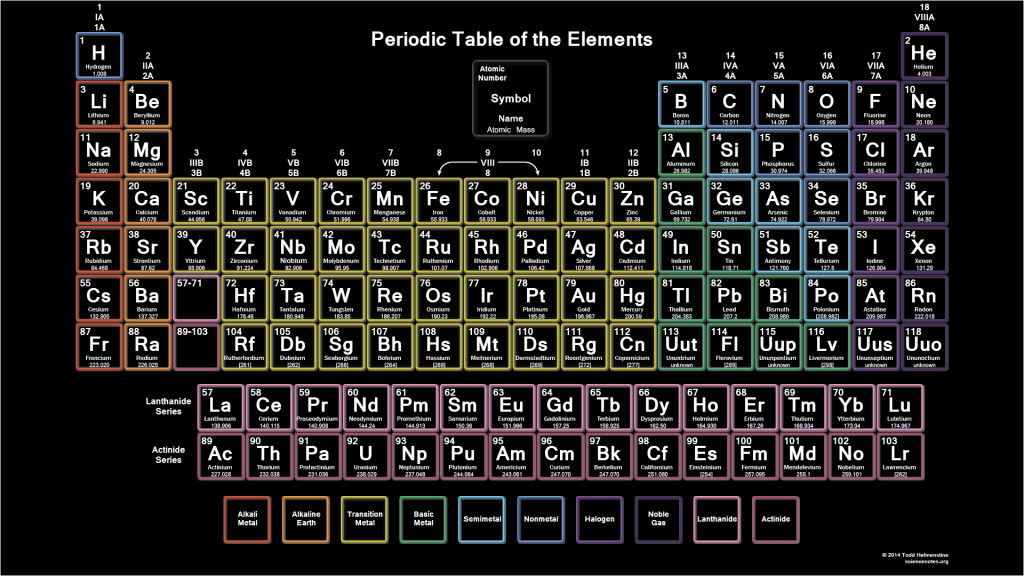
Таблица Менделеева – Etsy.de
Etsy больше не поддерживает старые версии вашего веб-браузера, чтобы обеспечить безопасность пользовательских данных. Пожалуйста, обновите до последней версии.
Воспользуйтесь всеми преимуществами нашего сайта, включив JavaScript.
Найдите что-нибудь памятное, присоединяйтесь к сообществу, делающему добро.

 008
008 45
45 922
922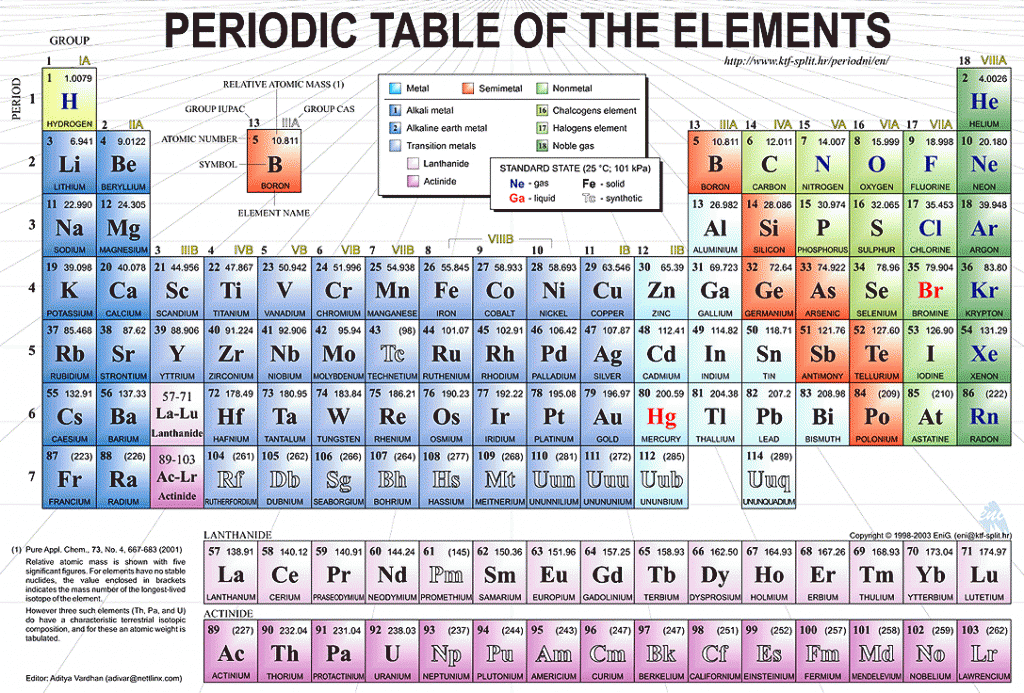 82
82 93
93