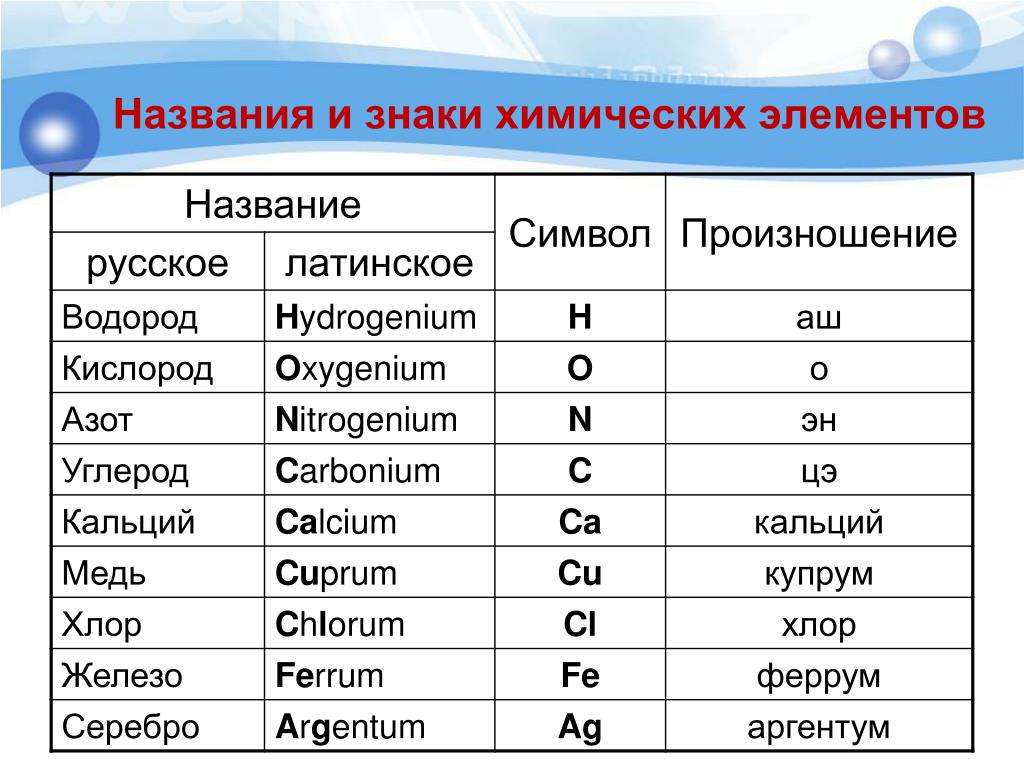
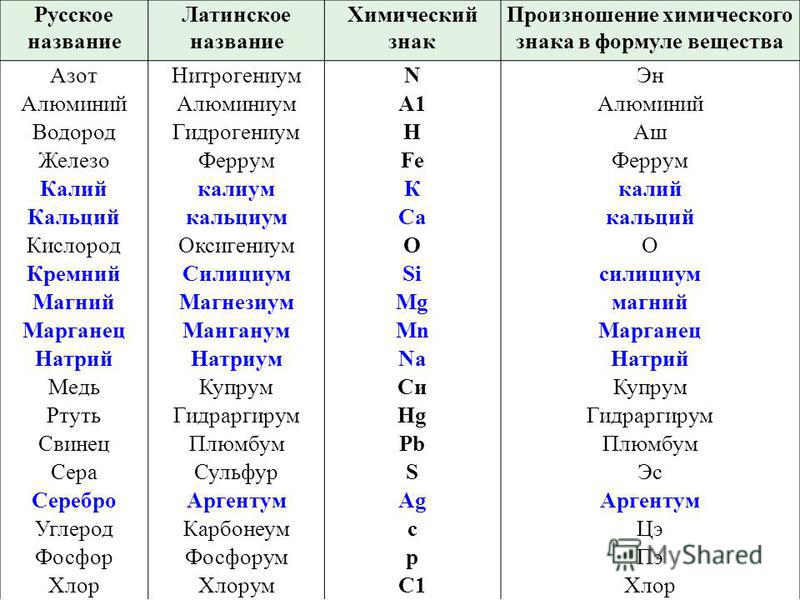
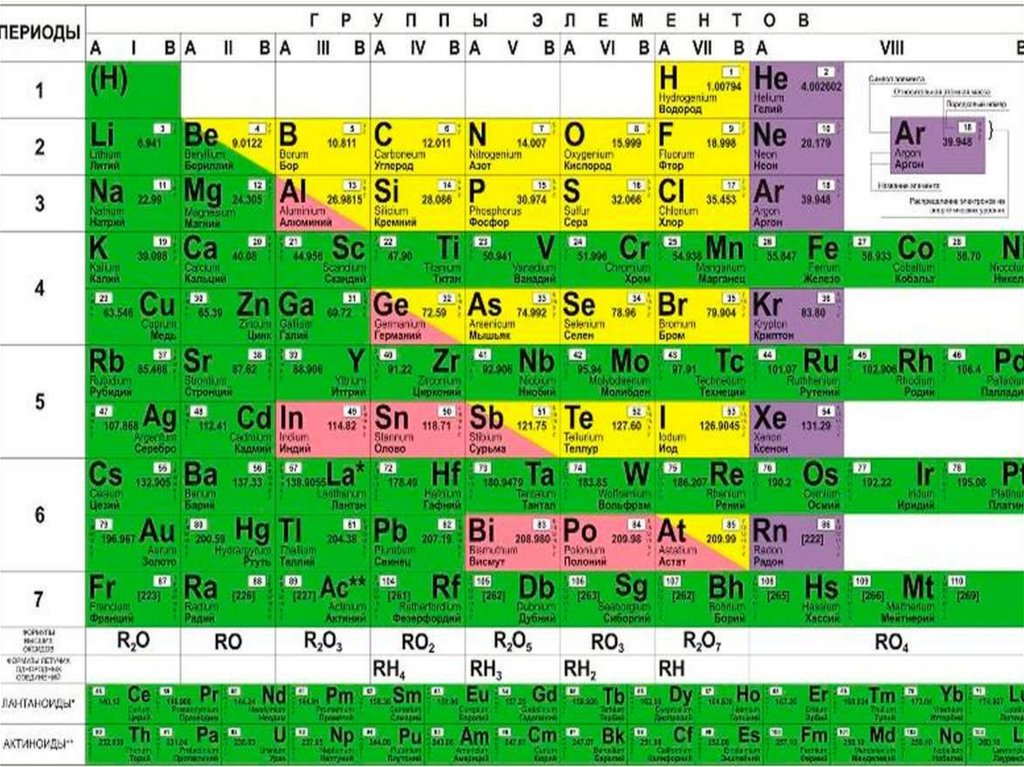
Тест по химии, 8 класс “Строение атома. Периодическая таблица химических элементов”
«СТРОЕНИЕ АТОМА» 8 КЛАСС. ВАРИАНТ 1
1. Определите элемент со схемой распределения электронов в атоме 2, 8, 4:
а) Mg; б) Si; в) Cl; г) S.
2. Максимальное число электронов на третьем энергетическом уровне:
а) 14; б) 18; в) 8; г) 24.
3. Сколько энергетических уровней в атоме серы?
а) 1; б) 2; в) 3; г) 4.
4. Атом какого химического элемента содержит три протона?
а) B; б) P; в) Al; г) Li.
5. Атом какого химического элемента имеет заряд ядра +22?
а) Na; б) P; в) О; г) Ti.
6. Число нейтронов в атоме марганца равно:
а) 25; б) 29; в) 30; г) 55.
7. Ряд химических элементов периодической системы Д. И. Менделеева, начинающийся металлом и заканчивающийся инертным газом, называется
1) группой 2) подгруппой 3) периодом 4) периодическим законом
8. В 4 периоде главной подгруппы V группы находится элемент с порядковым номером 1) 33 2) 23 3) 50 4) 75
В 4 периоде главной подгруппы V группы находится элемент с порядковым номером 1) 33 2) 23 3) 50 4) 75
9. Установите соответствие между химическим элементом и его положением в Периодической системе.
Элементы Положение в периодической системе
Fe В) 2 период, VII группа, главная подгруппа (А)
2)F Г) 4 период, VIII группа, побочная подгруппа (Б)
10. Установите соответствие между распределением электронов по энергетическим уровням и формулами химических частиц.
Распределение электронов по уровням Формулы частиц
1) 2, 8, 3 А) N
2) 2, 5 Б ) Al
«СТРОЕНИЕ АТОМА» 8 КЛАСС ВАРИАНТ 2
1. Определите элемент со схемой распределения электронов в атоме 2, 8, 8:
Определите элемент со схемой распределения электронов в атоме 2, 8, 8:
а) Na; б) P; в) Al; г) Ar.
2. Максимальное число электронов на четвертом энергетическом уровне:
а) 14; б) 32; в) 26; г) 18.
3. Сколько энергетических уровней в атоме углерода?
а) 1; б) 2; в) 3; г) 4.
4. Атом какого химического элемента содержит десять электронов?
а) S; б) H; в) Ne; г) Li.
5. Атом какого химического элемента имеет заряд ядра +35?
а) Ni; б) Pt; в) Br; г) Te.
6. Число нейтронов в атоме цинка равно:
а) 65; б) 22; в) 30; г) 35.
7. В 4 периоде побочной подгруппы VI группы находится элемент с порядковым номером 1) 34 2) 32 3) 24 4) 22
8. Общим в строении атомов элементов 3 периода является
1) число протонов 3) число электронов в атоме
2) число электронных слоев 4) величина зарядов ядер атомов
9. Установите соответствие между химическим элементом и его положением в Периодической системе.
Установите соответствие между химическим элементом и его положением в Периодической системе.
Химический элемент Положение элементов в периодической системе
1) Ca А) 2 период, V группа, главная подгруппа (А)
2) N Б) 4 период, II группа, главная подгруппа (А)
10. Установите соответствие между распределением электронов по энергетическим уровням и формулами химических частиц.
Распределение электронов по уровням Формулы частиц
1) 2, 8, 4 1) O
2, 6 2) Si
Демоверсия ВПР 2023 по химии для 8 класса
Официальная демоверсия проверочной работы по химии для 8 класса.
ВПР в 2023 году пройдут с 15 марта по 20 мая. Точные даты устанавливает образовательная организация самостоятельно.
Всего в работе 9 заданий. Время выполнения – 90 минут.
Время выполнения – 90 минут.
При выполнении работы разрешается использовать следующие дополнительные материалы:
– Периодическая система химических элементов Д.И. Менделеева;
– таблица растворимости кислот, солей и оснований в воде;
– ряд активности металлов / электрохимический ряд напряжений;
– непрограммируемый калькулятор.
При выполнении заданий Вы можете использовать черновик. Записи в черновике проверяться и оцениваться не будут.
→ Демоверсия: vpr_xi-8_demo_2023.pdf
→ Описание работы: vpr_xi-8_opisanie_2023.pdf
Цитата: Система оценивания
Правильный ответ на каждое из заданий 1.1, 6.2, 6.3 оценивается 1 баллом.
Ответ на каждое из заданий 1.2, 2, 3.2, 4, 5, 6.1, 6.4, 6.5, 7 оценивается в соответствии с критериями.
Полный правильный ответ на задание 3.1 оценивается 3 баллами. Если в ответе допущена одна ошибка (неправильно заполнена одна клетка таблицы), выставляется 2 балла; если допущено две ошибки (неправильно заполнены две клетки таблицы), выставляется 1 балл, если все клетки таблицы заполнены неправильно – 0 баллов.
Полный правильный ответ на каждое из заданий 8 и 9 оценивается 2 баллами. Если в ответе допущена одна ошибка (в том числе написана лишняя цифра, или не написана одна необходимая цифра), выставляется 1 балл; если допущено две или более ошибки – 0 баллов.
Максимальный первичный балл – 36.
«2»: 0–9
«3»: 10–18
«4»: 19–27
«5»: 28–36
Описание заданий
Задание 1 состоит из двух частей. Первая его часть ориентирована на проверку понимания различия между индивидуальными (чистыми) химическими веществами и их смесями. По форме первая часть задания 1 – это выбор одного правильного ответа из трех предложенных. Вторая часть этого задания проверяет умение выявлять индивидуальные химические вещества в составе смесей и записывать химические формулы известных химических соединений.
Задание 2 состоит из двух частей. Первая часть нацелена на проверку того, как обучающиеся усвоили различие между химическими реакциями и физическими явлениями. Форма первой части задания 2 – выбор одного правильного ответа из трех предложенных.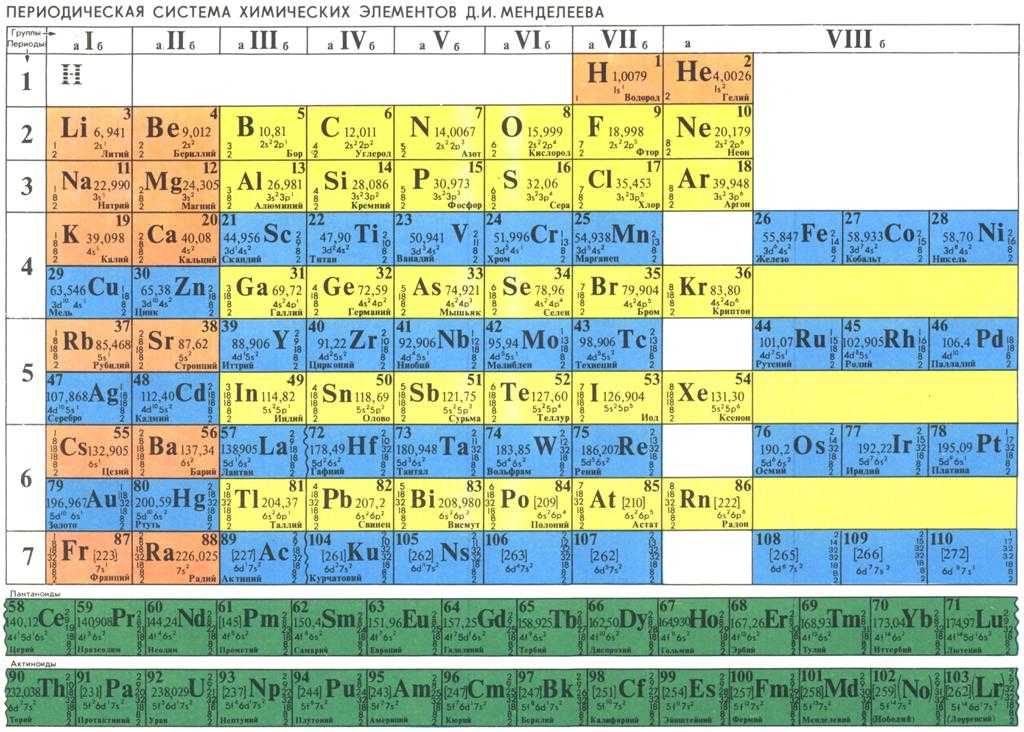 Вторая часть этого задания проверяет умение выявлять и называть признаки протекания химических реакций.
Вторая часть этого задания проверяет умение выявлять и называть признаки протекания химических реакций.
Задание 3 также состоит из двух частей. В первой части проверяется умение рассчитывать молярную массу газообразного вещества по его известной химической формуле. Вторая часть выясняет знание и понимание обучающимися закона Авогадро и следствий из него.
Задание 4 состоит из четырех частей. В первой части проверяется, как обучающиеся усвоили основные представления о составе и строении атома, а также физический смысл порядкового номера элемента. Вторая часть ориентирована на проверку умения обучающихся характеризовать положение заданных химических элементов в Периодической системе Д.И. Менделеева. Третья часть задания посвящена оценке сформированности у обучающихся умения определять металлические и неметаллические свойства простых веществ, образованных указанными химическими элементами. Четвертая часть этого задания нацелена на проверку умения составлять формулы высших оксидов для предложенных химических элементов.
В задании 5, состоящем из двух частей, проверяется умение производить расчеты с использованием понятия «массовая доля»: например, находить массовую долю вещества в растворе и/или определять массу растворенного вещества по известной массе раствора. При решении части этого задания используются сведения, приведенные в табличной форме.
Задания 6 и 7 объединены общим контекстом.
Задание 6 состоит из преамбулы и пяти составных частей. В преамбуле дается список химических названий нескольких простых и сложных веществ. В первой части задания проверяется умение составлять химические формулы указанных веществ по их названиям. Во второй части оценивается знание физических свойств веществ и умение идентифицировать эти вещества по их экспериментально наблюдаемым свойствам. Третья часть задания 6 посвящена проверке умения обучающихся классифицировать химические вещества. Четвертая часть ориентирована на проверку умения производить расчеты массовой доли элемента в сложном соединении.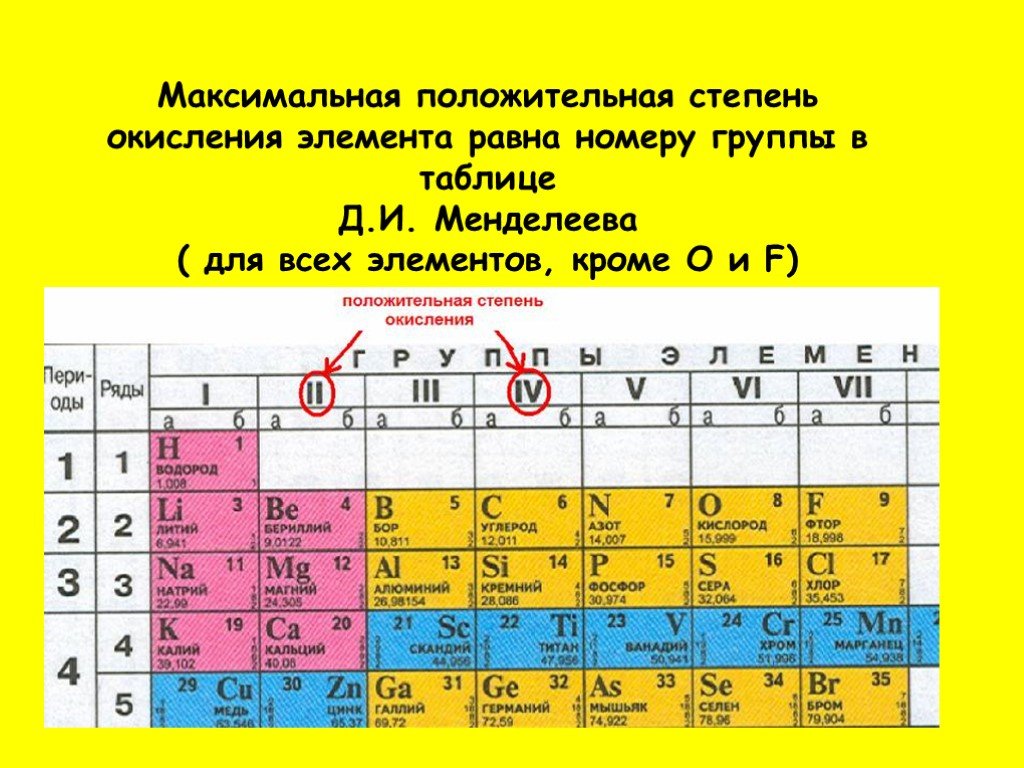
Задание 7 состоит из преамбулы и трех составных частей. В преамбуле приведены словесные описания двух химических превращений с участием веществ, перечень которых был дан ранее в преамбуле к заданию 6. Первая часть задания 7 проверяет умение обучающихся составлять уравнения химических реакций по словесным описаниям. Особенностью этой части является то, что необходимые формулы веществ обучающимися составлены заранее при решении первой части задания 6. В первой части задания 7 сознательно подобраны такие схемы взаимодействий, чтобы проверить, как обучающиеся умеют расставлять коэффициенты в уравнениях химических реакций.
Задание 8 проверяет знание областей применения химических веществ и предполагает установление попарного соответствия между элементами
двух множеств – «Вещество» и «Применение».
Задание 9 проверяет усвоение правил поведения в химической лаборатории и безопасного обращения с химическими веществами в повседневной жизни.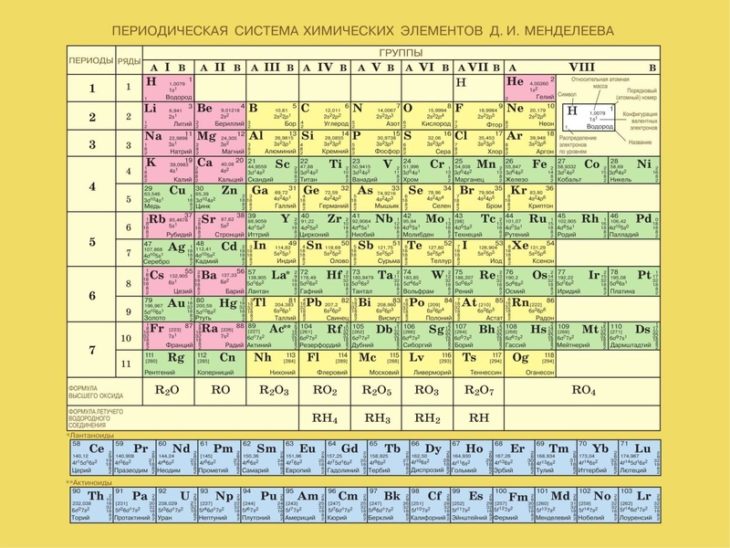 По форме задание 9 представляет собой выбор нескольких правильных суждений из четырех предложенных. Особенностью данного задания является отсутствие указания на количество правильных ответов.
По форме задание 9 представляет собой выбор нескольких правильных суждений из четырех предложенных. Особенностью данного задания является отсутствие указания на количество правильных ответов.
6, 7 и 8 классы | Наука | Средняя школа | Периодическая таблица
Эта научная викторина называется “Периодическая таблица – что это такое?” и она была написана учителями, чтобы помочь вам, если вы изучаете предмет в средней школе. Играть в образовательные викторины — отличный способ учиться, если вы учитесь в 6-м, 7-м или 8-м классе в возрасте от 11 до 14 лет. школьная работа. Вы можете подписаться на странице Присоединяйтесь к нам
Периодическая таблица — это средство, с помощью которого все химические элементы организованы на основе их атомного номера, электронных конфигураций и повторяющихся химических свойств.
Есть четыре общих элемента, которые включают землю, воздух, воду и огонь. Элемент — это любое вещество, которое нельзя разбить на два или более простых вещества. Помимо обычных элементов, у нас также есть химические элементы.
Помимо обычных элементов, у нас также есть химические элементы.
Химический элемент представляет собой вещество, состоящее из атомов одного типа. Химические элементы делятся на металлы, металлоиды и неметаллы.
Примеры включают углерод, азот, кислород, кремний, алюминий, железо, золото, свинец, ртуть, медь и мышьяк. К самым легким химическим элементам относятся гелий, водород, литий и бериллий. Любые два атома, имеющие одинаковое количество протонов в соответствующих ядрах, принадлежат к одному и тому же химическому элементу.
Элементы, перечисленные в периодической таблице, перечислены в порядке возрастания атомного номера. Периодическая таблица состоит из сетки элементов, расположенных в 18 столбцах и 7 строках. Под этой сеткой находится двойной ряд дополнительных элементов. Периодическая таблица содержит только химические элементы. Он не содержит смесей, соединений или субатомных частиц (частиц меньше атома).
Строки в периодической таблице обозначаются как « периодов », а столбцы — как « групп ».
Дмитрию Менделееву приписывают публикацию таблицы Менделеева в 1869 году. Таблица в то время была разработана с использованием известных тогда элементов. Он, однако, оставил пробелы для неизвестных элементов.
Количество протонов в ядре атома известно как атомный номер . Поскольку каждый элемент имеет разное количество протонов, каждый из них имеет свой собственный атомный номер.
Элементы, перечисленные в периодической таблице, варьируются от атомного номера 1 (водород) до 118 (неизвестный элемент). Эти элементы были открыты или синтезированы. Однако элементы 113, 115, 117 и 118 еще не подтверждены. По состоянию на 2013 год в периодической таблице было 114 подтвержденных элементов. Из них 98 встречаются в природе, а 16 элементов встречаются только при синтезе в лаборатории.
Электронная конфигурация — это распределение электронов в атоме или молекуле. Они описывают электроны как движущиеся независимо друг от друга по орбите. Чтобы понять структуру периодической таблицы, важно иметь некоторые знания об электронной конфигурации различных атомов.
Химические свойства – это любой материал, обнаруженный в результате химической реакции. Другими словами, вы не можете определить химические свойства вещества, просто взглянув на него или прикоснувшись к нему. Скорее катализатор , который сам по себе является химическим свойством, необходимо использовать для разрушения химического вещества, чтобы изучить его состав.
Allied Solutions — Упрощенная химия для средней школы — растворы для 8-го класса по главе 3 «Элементы, соединения и смеси»
Перейти к
- Иметь значение
- Физические и химические изменения
- Атомная структура
- Химические реакции
- Вода
- Углерод и его соединения
Главная > Решения Allied Solutions Химия класса 8 > Соединения и смеси элементов главы 3
Упражнения к соединениям и смесям элементов главы 8 8 класс
Упражнение
Вопросы целевого типа
Вопросы к упражнению
Q1) Представьте с помощью простой диаграммы, как материя классифицируется на чистые или нечистые вещества и далее на элементы, соединения и смеси, с дальнейшим сегментированием элементов.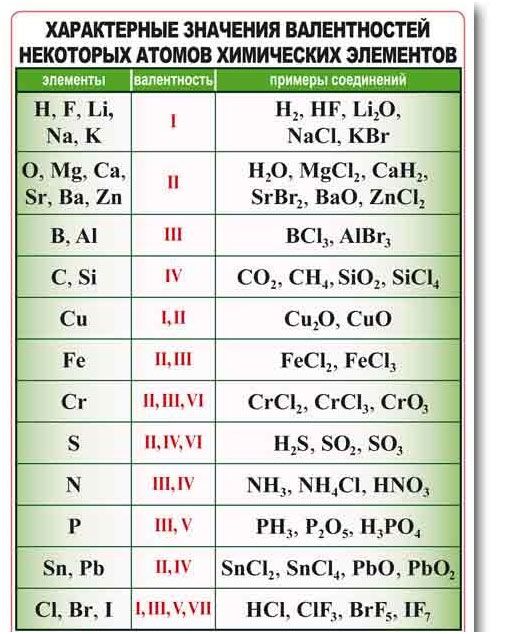
Q2) Дайте определение терминам элементы, соединения и смеси, чтобы показать их основное различие.
Q3) «Атом — это основная единица элемента». Нарисуйте схему атома — делимого, как мы видим сегодня.
Q4) «Современная таблица Менделеева состоит из элементов, расположенных в порядке возрастания их атомных номеров». Что касается элементов с атомными номерами от 1 до 20 в таблице Менделеева, разделите их на металлические элементы, металлоиды, неметаллы и инертные газы. .
Q5) Элементы в широком смысле подразделяются на металлы и неметаллы. Назовите шесть основных различий физических свойств металлов и неметаллов. Укажите два металла и два неметалла, которые противоречат общим физическим свойствам, с указанием причин. Укажите одно различие в свойствах металлоидов и инертных газов.
Назовите шесть основных различий физических свойств металлов и неметаллов. Укажите два металла и два неметалла, которые противоречат общим физическим свойствам, с указанием причин. Укажите одно различие в свойствах металлоидов и инертных газов.
Q6) Применительно к элементам – определить термин «молекула». Приведите по два примера одноатомных, двухатомных и многоатомных молекул.
Q7) Дайте определение термину «состав». В сложном диоксиде углерода элементы углерод и кислород соединены в фиксированном соотношении. Объяснять.
Q8) Назовите пять различных характеристик соединений. Приведите три различия между элементами и соединениями с соответствующими примерами.
Q9) Объясните термин «смесь». Различают гомогенные и гетерогенные смеси. Укажите, почему латунь считается гомогенной смесью, а смесь железа и серы – гетерогенной. Приведите пример двух жидкостей, которые образуют а) гомогенные б) гетерогенные смеси.
Q10) Сравните свойства сульфида железа (II) со смесью железа и серы, рассматривая сульфид железа (II) как соединение и частицы железа и серы, смешанные вместе, в качестве примера смеси.
Q11) Укажите любой метод – разделения следующих смесей –
- Две твердые смеси, одна из которых – непосредственно превращается в пар при нагревании.
- Две твердые смеси, одна из которых – растворяется в определенном растворителе, а другая – нет.

- Твердо-жидкая смесь, содержащая нерастворимое твердое вещество в жидком компоненте
- Твердо-жидкая смесь, содержащая растворимое твердое вещество в жидком компоненте
- Жидкостная смесь, содержащая – две несмешивающиеся жидкости, имеющие разную плотность.
- Жидкостная смесь, содержащая: – две смешивающиеся жидкости, имеющие разные температуры кипения.
- Газожидкостная смесь, содержащая – газ, растворенный в жидком компоненте
- Газогазовая смесь, содержащая – два газа с различной плотностью.
- Смесь различных твердых составляющих – в жидкой составляющей.
Q12) Объясните с помощью диаграмм процесс, используемый для выделения следующих веществ из данных смесей.
- Хлорид аммония из смеси хлорида аммония и хлорида калия
- Железо из смеси железа и меди
- Сера из смеси серы и меди
- Нитрат калия из смеси нитрата калия и хлората калия
- Карбонат свинца (нерастворимый) из смеси карбоната свинца и воды.

- Нитрат свинца (растворимый) из смеси нитрата свинца и воды, т.е. раствор нитрата свинца.
- Четыреххлористый углерод из смеси четыреххлористого углерода (более тяжелый компонент) и воды.
- Бензол из смеси бензола и толуола.
- Различные красители – в жидких составных чернилах.
Вопросы объективного типа Вопросы
Q1) Выберите правильный ответ из A, B, C, D и E для каждого приведенного ниже утверждения:
А: Порох
B: Йод
С: Бор
Д: Гелий
E: Бром
- Двухатомная молекула
- Металлоид
- Блестящий неметалл.
- Смесь элементов и соединений.
- Благородный газ
Q2) Сопоставьте разделение компонентов в списке I с наиболее подходящим процессом в списке II
| Список I | Список II |
|---|---|
1. Нафталин из нафталина и хлорида натрия Нафталин из нафталина и хлорида натрия | А: Делительная воронка |
| 2. Сливки из молока | Б: Сублимация |
| 3. Керосиновое масло из керосина и воды | С: кипячение |
| 4. Нитрат свинца из водного раствора нитрата свинца | D: Центрифугирование |
| 5. Аммиак из водного раствора аммиака | E: Перегонка |
Q3) На схеме представлена фракционная перегонка для разделения смесей. Ответить на следующие вопросы.
- Можно ли с помощью этого процесса разделить две несмешивающиеся жидкости?
- Разделение жидкостей в этом процессе основано на каком физическом свойстве?
- Если необходимо разделить метиловый спирт и воду, какая жидкость останется в колбе «X» после конденсации.

- Объясните приведенный выше ответ.
- Укажите назначение ректификационной колонны в аппарате.
Q4) Выберите правильный ответ из вариантов в скобках, чтобы закончить каждое предложение:
- Пыль в воздухе является примером _____ (гомогенной/гетерогенной) смеси.
- Растворимое твердое вещество отделяют от нерастворимого с помощью ______(фракционная кристаллизация/экстракция растворителем)
- Реактивным элементом из двух одноатомных элементов является ___ (неон/кремний)
- Соединения _____(гомогенные или гетерогенные/всегда гомогенные) по своей природе.
- Примером одноатомной молекулы является ____ (водород/гелий)
Q5) Обоснуйте следующие утверждения:
- Компоненты смеси можно разделить только физическими методами.
- Центрифугирование можно использовать для отделения более тяжелого нерастворимого твердого вещества, присутствующего в – нерастворимой твердо-жидкой смеси.