Химические свойства металлов — с чем реагируют? Свойства и таблица
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
4Li + O2 = 2Li2O
натрий образует пероксид
2Na + O2 = Na2O2
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину.
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется h3. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур.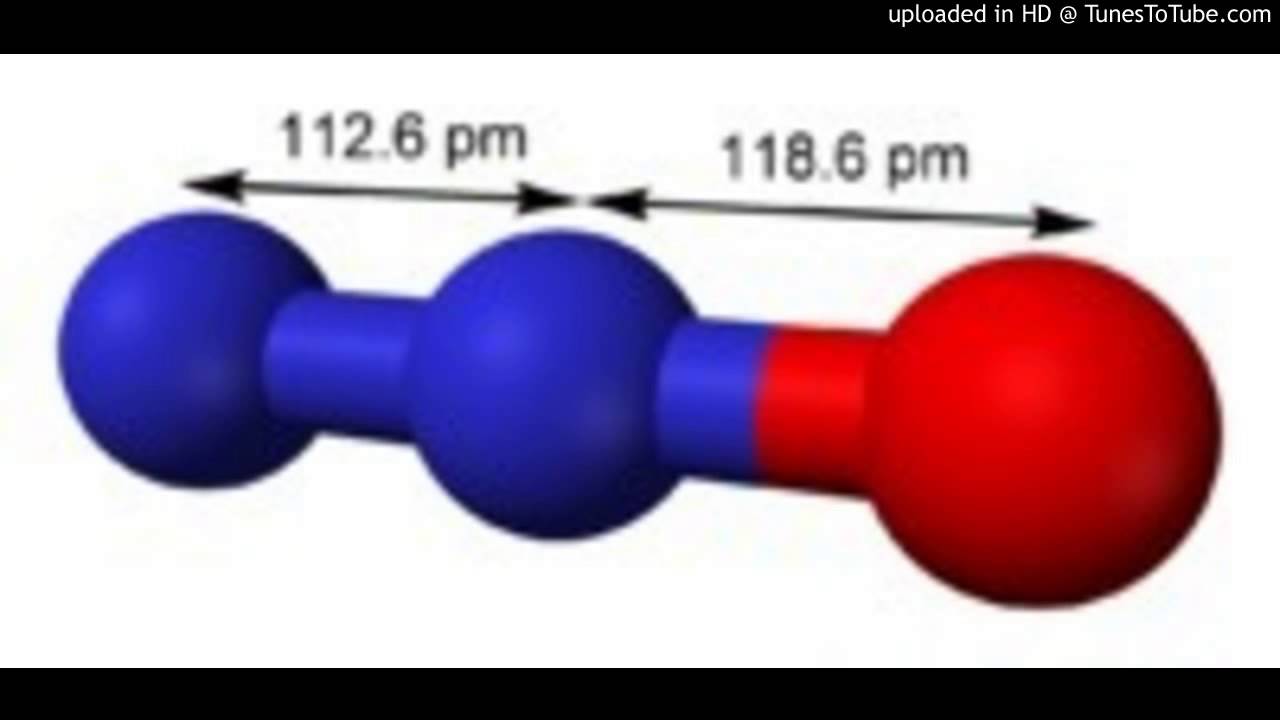 Результат данной реакции — образование оксида.
Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор)
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + Nh5NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Химические свойства металлов в таблице, общее применение (9 класс, химия)
4.4
Средняя оценка: 4.4
Всего получено оценок: 840.
4.4
Средняя оценка: 4.4
Всего получено оценок: 840.
Металлы – активные восстановители с положительной степенью окисления. Благодаря химическим свойствам металлы широко используются в промышленности, металлургии, медицине, строительстве.
Активность металлов
В реакциях атомы металлов отдают валентные электроны и окисляются. Чем больше энергетических уровней и меньше электронов имеет атом металла, тем легче ему отдавать электроны и вступать в реакции. Поэтому металлические свойства увеличиваются сверху вниз и справа налево в таблице Менделеева.
Чем больше энергетических уровней и меньше электронов имеет атом металла, тем легче ему отдавать электроны и вступать в реакции. Поэтому металлические свойства увеличиваются сверху вниз и справа налево в таблице Менделеева.
Активность простых веществ показана в электрохимическом ряду напряжений металлов. Слева от водорода находятся активные металлы (активность увеличивается к левому краю), справа – неактивные.
Наибольшую активность проявляют щелочные металлы, находящиеся в I группе периодической таблицы и стоящие левее водорода в электрохимическом ряду напряжений. Они вступают в реакцию со многими веществами уже при комнатной температуре. За ними идут щелочноземельные металлы, входящие во II группу. Они реагируют с большинством веществ при нагревании. Металлы, находящиеся в электрохимическом ряду от алюминия до водорода (средней активности) требуют дополнительных условий для вступления в реакции.
Рис. 2. Электрохимический ряд напряжений металлов.
Некоторые металлы проявляют амфотерные свойства или двойственность. Металлы, их оксиды и гидроксиды реагируют с кислотами и основаниями. Большинство металлов реагирует только с некоторыми кислотами, замещая водород и образуя соль. Наиболее ярко выраженные двойственные свойства проявляют:
- алюминий;
- свинец;
- цинк;
- железо;
- медь;
- бериллий;
- хром.
Каждый металл способен вытеснять стоящий правее него в электрохимическом ряду другой металл из солей. Металлы, находящиеся слева от водорода, вытесняют его из разбавленных кислот.
Свойства
Особенности взаимодействия металлов с разными веществами представлены в таблице химических свойств металлов.
Реакция | Особенности | Уравнение |
С кислородом | Большинство металлов образует оксидные плёнки. Щелочные металлы самовоспламеняются в присутствии кислорода. | – 4Li + O2 → 2Li2O; – 2Na + O2 → Na2O2; – K + O2 → KO2; – 4Al + 3O2 → 2Al2O3; – 2Cu + O2 → 2CuO |
С водородом | При комнатной температуре реагируют щелочные, при нагревании – щелочноземельные. Бериллий не вступает в реакцию. Магнию дополнительно необходимо высокое давление | – Sr + H2 → SrH2; – 2Na + H2 → 2NaH; – Mg + H2 → MgH2 |
С азотом | Только активные металлы. Литий вступает в реакцию при комнатной температуре. | – 6Li + N2 → 2Li3N; – 3Ca + N2 → Ca3N2 |
С углеродом | Литий и натрий, остальные – при нагревании | – 4Al + 3C → Al3C4; – 2Li+2C → Li2C2 |
С серой | Не взаимодействуют золото и платина | – 2K + S → K2S; – Fe + S → FeS; – Zn + S → ZnS |
С фосфором | При нагревании | 3Ca + 2P → Ca3P2 |
С галогенами | Не реагируют только малоактивные металлы, медь – при нагревании | Cu + Cl2 → CuCl2 |
С водой | Щелочные и некоторые щелочноземельные металлы. При нагревании, в условиях кислой или щелочной среды реагируют металлы средней активности | – 2Na + 2H2O → 2NaOH + H2↑; – Ca + 2H2O → Ca(OH)2 + H2; – Pb + H2O → PbO + H2↑ |
С кислотами | Металлы слева от водорода. | – Zn + 2HCl → ZnCl2 + 2H2↑; – Fe + H2SO4 → FeSO4 + H2↑; – Cu + 2H2SO4 → CuSO4 + SO2↑ +2H2O |
Со щелочами | Только амфотерные металлы | 2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3H2↑ |
С солями | Активные замещают менее активные металлы | 3Na + AlCl3 → 3NaCl + Al |
Металлы взаимодействуют между собой и образуют интерметаллические соединения – 3Cu + Au → Cu3Au, 2Na + Sb → Na2Sb.
Применение
Общие химические свойства металлов используются для создания сплавов, моющих средств, применяются в каталитических реакциях. Металлы присутствуют в аккумуляторах, электронике, в несущих конструкциях.
Основные отрасли применения указаны в таблице.
Отрасль | Производство | Металлы |
Химическая промышленность | Катализаторы, соли, щёлочи | Pt, Fe, Ni, K |
Пищевая промышленность | Поваренная соль (NaCl), сода (Na2CO3, NaHCO3) | Na, Ca, Ag |
Металлургия | Сплавы, покрытия, детали разной формы, проволока, облицовка, строительные материалы и инструменты | Fe, Cr, Ni, W, Mo |
Приборостроение | Микросхемы, фотоэлементы, датчики | Cs, Co, Ni, Cu |
Ювелирная промышленность | Украшения | Au, Pt, Ag |
Медицина | Протезы | Ti, Ni, Au |
 3. Висмут.
3. Висмут.Что мы узнали?
Из урока 9 класса химии узнали об основных химических свойствах металлов. Возможность взаимодействовать с простыми и сложными веществами определяет активность металлов. Чем активнее металл, тем легче он вступает в реакцию при обычных условиях. Активные металлы реагируют с галогенами, неметаллами, водой, кислотами, солями. Амфотерные металлы взаимодействуют со щелочами. Малоактивные металлы не реагируют с водой, галогенами, большинством неметаллов. Кратко рассмотрели отрасли применения. Металлы используются в медицине, промышленности, металлургии, электронике.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Валерия Олейник
10/10
Александр Котков
10/10
Лидия Маслова
10/10
Анна Богданова
10/10
Сергей Ефремов
7/10
Оценка доклада
4. 4
4
Средняя оценка: 4.4
Всего получено оценок: 840.
А какая ваша оценка?
Химические свойства элементов и соединений
Атомный номер
Атомный номер указывает количество протонов в ядре атома. Атомный номер является важным понятием в химии и квантовой механике. Из этой концепции вытекают элемент и его место в периодической таблице.
Когда атом обычно электрически нейтрален, атомный номер будет равен количеству электронов в атоме, которое можно найти вокруг ядра. Эти электроны в основном определяют химическое поведение атома. Атомы, несущие электрический заряд, называются ионами. Ионы имеют число электронов больше (отрицательно заряженных) или меньше (положительно заряженных), чем атомный номер.
Атомная масса
Название указывает на массу атома, выраженную в атомных единицах массы (а.е.м.). Большая часть массы атома сосредоточена в протонах и нейтронах, содержащихся в ядре. Каждый протон или нейтрон весит около 1 а. е.м., и, таким образом, атомная масса всегда очень близка к массе (или нуклону), числу , которое указывает число частиц в ядре атома; это означает протоны и нейтроны. Каждый изотоп химического элемента может различаться по массе. Атомная масса изотопа указывает на количество нейтронов, присутствующих в ядре атомов. Суммарная атомная масса элемента эквивалентна единицам массы его изотопов. Относительное распространение изотопов в природе является важным фактором в определении общей атомной массы элемента. Применительно к определенному химическому элементу атомная масса, показанная в периодической таблице, представляет собой среднюю атомную массу всех стабильных изотопов химического элемента. Среднее значение взвешивается относительным естественным содержанием изотопов элемента.
е.м., и, таким образом, атомная масса всегда очень близка к массе (или нуклону), числу , которое указывает число частиц в ядре атома; это означает протоны и нейтроны. Каждый изотоп химического элемента может различаться по массе. Атомная масса изотопа указывает на количество нейтронов, присутствующих в ядре атомов. Суммарная атомная масса элемента эквивалентна единицам массы его изотопов. Относительное распространение изотопов в природе является важным фактором в определении общей атомной массы элемента. Применительно к определенному химическому элементу атомная масса, показанная в периодической таблице, представляет собой среднюю атомную массу всех стабильных изотопов химического элемента. Среднее значение взвешивается относительным естественным содержанием изотопов элемента.
Электроотрицательность по Полингу
Электроотрицательность измеряет склонность атома тянуть электронное облако в своем направлении во время химической связи с другим атомом.
Шкала Полинга — широко используемый метод упорядочения химических элементов по их электроотрицательности. Лауреат Нобелевской премии Линус Полинг разработал эту шкалу в 1932 году.
Значения электроотрицательности не рассчитываются на основе математической формулы или измерения. Это больше похоже на прагматический диапазон.
Полинг дал элементу с максимально возможной электроотрицательностью, фтору, значение 4,0. Францию, элементу с минимально возможной электроотрицательностью, было присвоено значение 0,7. Всем остальным элементам присваивается значение где-то между этими двумя крайними значениями.
Плотность
Плотность элемента указывает количество единиц массы элемента, присутствующих в определенном объеме среды. Традиционно плотность выражается греческой буквой ro (пишется как r). В системе единиц СИ плотность выражается в килограммах на кубический метр (кг/м 3 ). Плотность элемента обычно выражается графически с помощью температуры и давления воздуха, потому что эти два свойства влияют на плотность.
Температура плавления
Температура плавления элемента или соединения означает температуру, при которой твердая форма элемента или соединения находится в равновесии с жидкой формой. Обычно мы предполагаем, что атмосферное давление равно 1 атмосфере.
Например: температура плавления воды 0 o C, или 273 K.
Температура кипения
Температура кипения элемента или соединения означает температуру, при которой жидкая форма элемента или соединения находится в равновесии с газообразной формой. Обычно мы предполагаем, что атмосферное давление равно 1 атмосфере.
Например: температура кипения воды составляет 100 o C или 373 K.
При температуре кипения давление паров элемента или соединения составляет 1 атмосферу.
Радиус Вандерваальса
Даже когда два атома, находящиеся рядом друг с другом, не связываются, они все равно будут притягиваться друг к другу. Это явление известно как взаимодействие Вандерваальса.
Силы Вандерваальса вызывают силу между двумя атомами. Эта сила становится сильнее по мере того, как атомы сближаются. Однако, когда два атома приближаются слишком близко друг к другу, начинает действовать отталкивающая сила вследствие чрезмерного отталкивания между отрицательно заряженными электронами обоих атомов. В результате между двумя атомами образуется определенное расстояние, известное как радиус Вандерваальса.
Путем сравнения радиусов Вандерваальса нескольких различных пар атомов мы разработали систему радиусов Вандерваальса, с помощью которой мы можем предсказать радиус Вандерваальса между двумя атомами путем сложения.
Ионный радиус
Ионный радиус — это радиус, который ион имеет в ионном кристалле, где ионы упакованы вместе до точки, где их самые внешние электронные орбитали соприкасаются друг с другом. Орбиталь — это область вокруг атома, где, согласно орбитальной теории, вероятность нахождения электрона наибольшая.
Изотопы
Атомный номер не определяет количество нейтронов в атомном ядре. В результате количество нейтронов в атоме может варьироваться. Тогда атомы с одинаковым атомным номером могут отличаться по атомной массе. Атомы одного и того же элемента, отличающиеся атомной массой, называются изотопами.
В результате количество нейтронов в атоме может варьироваться. Тогда атомы с одинаковым атомным номером могут отличаться по атомной массе. Атомы одного и того же элемента, отличающиеся атомной массой, называются изотопами.
В основном у более тяжелых атомов с более высоким атомным номером количество нейтронов в ядре может превышать количество протонов.
Изотопы одного и того же элемента часто встречаются в природе попеременно или в смесях.
Пример: хлор имеет атомный номер 17, что в основном означает, что все атомы хлора содержат 17 протонов в своем ядре. Есть два изотопа. Три четверти встречающихся в природе атомов хлора содержат 18 нейтронов, а одна четверть — 20 нейтронов. Массовые числа этих изотопов 17 + 18 = 35 и 17 + 20 = 37. Изотопы записываются следующим образом: 35Cl и 37Cl.
При таком обозначении изотопов количество протонов и нейтронов не нужно указывать отдельно, потому что символ хлора в периодической таблице (Cl) ставится на семнадцатом месте. Это уже указывает на количество протонов, так что всегда можно легко вычислить количество нейтронов с помощью массового числа.
Большое количество изотопов нестабильны. Они развалятся в процессе радиоактивного распада. Изотопы, обладающие радиоактивностью, называются радиоизотопами.
Электронная оболочка
Электронная конфигурация атома — это описание расположения электронов по кругу вокруг ядра. Эти круги не совсем круглые; они содержат волнообразный рисунок. Для каждого круга вероятность присутствия электрона в определенном месте описывается математической формулой. Каждый из кругов имеет определенный уровень энергии по сравнению с ядром. Обычно энергетические уровни электронов выше, когда они находятся дальше от ядра, но из-за их зарядов электроны также могут влиять на энергетические уровни друг друга. Обычно первыми заполняются средние круги, но могут быть и исключения из-за отказов.
Круги разделены на оболочки и подоболочки, которые можно пронумеровать с помощью количества.
Энергия первой ионизации
Энергия ионизации означает энергию, необходимую для того, чтобы свободный атом или молекула потеряли электрон в вакууме. Другими словами; энергия ионизации является мерой прочности электронных связей с молекулами. Это касается только электронов во внешнем круге.
Другими словами; энергия ионизации является мерой прочности электронных связей с молекулами. Это касается только электронов во внешнем круге.
Энергия вторичной ионизации
Помимо энергии первой ионизации, которая показывает, насколько трудно удалить первый электрон из атома, существует также энергетическая мера второй ионизации. Эта энергия вторичной ионизации указывает на степень трудности удаления второго атома.
Таким образом, существует также энергия третьей ионизации, а иногда даже энергия четвертой или пятой ионизации.
Стандартный потенциал
Стандартный потенциал означает потенциал окислительно-восстановительной реакции, когда она находится в равновесии, относительно нуля. Когда стандартный потенциал превышает ноль, мы имеем дело с реакцией окисления. Когда стандартный потенциал ниже нуля, мы имеем дело с реакцией восстановления. Стандартный потенциал электронов выражается в вольтах (В) символом V 0 .
Назад к Периодической таблице или к предметам Химия
1.3 Физические и химические свойства – Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Определение свойств и изменений в материи как физических или химических
- Определите свойства материи как экстенсивные или интенсивные
Характеристики, отличающие одно вещество от другого, называются свойствами. Физическое свойство – это характеристика вещества, не связанная с изменением его химического состава. Знакомые примеры физических свойств включают плотность, цвет, твердость, температуры плавления и кипения и электрическую проводимость. Некоторые физические свойства, такие как плотность и цвет, можно наблюдать, не изменяя физического состояния вещества. Другие физические свойства, такие как температура плавления железа или температура замерзания воды, можно наблюдать только по мере того, как материя претерпевает физические изменения. Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения химического состава веществ, содержащихся в этой материи. Физические изменения наблюдаются при плавлении воска, при растворении сахара в кофе и при конденсации пара в жидкую воду (рис. 1.18). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Физическое изменение — это изменение состояния или свойств материи без какого-либо сопутствующего изменения химического состава веществ, содержащихся в этой материи. Физические изменения наблюдаются при плавлении воска, при растворении сахара в кофе и при конденсации пара в жидкую воду (рис. 1.18). Другие примеры физических изменений включают намагничивание и размагничивание металлов (как это делается с обычными защитными бирками от кражи) и измельчение твердых частиц в порошок (что иногда может привести к заметным изменениям цвета). В каждом из этих примеров происходит изменение физического состояния, формы или свойств вещества, но не изменение его химического состава.
Рисунок 1,18 (а) Воск претерпевает физические изменения, когда твердый воск нагревается и образует жидкий воск. (b) Конденсация пара внутри кастрюли представляет собой физическое изменение, поскольку водяной пар превращается в жидкую воду. (кредит a: модификация работы «95jb14»/Wikimedia Commons; кредит b: модификация работы mjneuby/Flickr)
Превращение одного типа материи в другой тип (или неспособность измениться) является химическим имущество. Примеры химических свойств включают воспламеняемость, токсичность, кислотность и многие другие типы реактивности. Железо, например, соединяется с кислородом в присутствии воды, образуя ржавчину; хром не окисляется (рис. 1.19). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень неактивен.
Примеры химических свойств включают воспламеняемость, токсичность, кислотность и многие другие типы реактивности. Железо, например, соединяется с кислородом в присутствии воды, образуя ржавчину; хром не окисляется (рис. 1.19). Нитроглицерин очень опасен, потому что легко взрывается; неон почти не представляет опасности, потому что он очень неактивен.
Рисунок 1.19 а) Одним из химических свойств железа является то, что оно ржавеет; (б) одно из химических свойств хрома состоит в том, что он этого не делает. (кредит a: модификация работы Тони Хигетта; кредит b: модификация работы Atoma/Wikimedia Commons)
Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины. Взрыв нитроглицерина — это химическое изменение, поскольку образующиеся газы представляют собой вещества, сильно отличающиеся от исходного вещества. Другие примеры химических изменений включают реакции, проводимые в лаборатории (например, взаимодействие меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. 1.20).
Другие примеры химических изменений включают реакции, проводимые в лаборатории (например, взаимодействие меди с азотной кислотой), все формы возгорания (горения) и приготовление, переваривание или гниение пищи (рис. 1.20).
Рисунок 1,20 а) Медь и азотная кислота подвергаются химическому превращению с образованием нитрата меди и коричневого газообразного диоксида азота. (b) Во время горения спички целлюлоза спички и кислород воздуха претерпевают химические изменения с образованием углекислого газа и водяного пара. (c) Приготовление красного мяса вызывает ряд химических изменений, в том числе окисление железа в миоглобине, что приводит к знакомому изменению цвета с красного на коричневый. (d) Коричневый цвет банана — это химическое изменение, когда образуются новые, более темные (и менее вкусные) вещества. (кредит b: модификация работы Джеффа Тернера; кредит c: модификация работы Глории Кабада-Леман; кредит d: модификация работы Роберто Верцо)
Свойства материи относятся к одной из двух категорий. Если свойство зависит от количества присутствующей материи, это экстенсивное свойство. Масса и объем вещества являются примерами экстенсивных свойств; например, галлон молока имеет большую массу, чем чашка молока. Стоимость экстенсивного свойства прямо пропорциональна количеству рассматриваемой материи. Если свойство образца вещества не зависит от количества присутствующего вещества, оно является интенсивным свойством. Температура является примером интенсивного свойства. Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Если свойство зависит от количества присутствующей материи, это экстенсивное свойство. Масса и объем вещества являются примерами экстенсивных свойств; например, галлон молока имеет большую массу, чем чашка молока. Стоимость экстенсивного свойства прямо пропорциональна количеству рассматриваемой материи. Если свойство образца вещества не зависит от количества присутствующего вещества, оно является интенсивным свойством. Температура является примером интенсивного свойства. Если галлон и чашка молока имеют температуру 20 °C (комнатная температура), то при их объединении температура остается равной 20 °C. В качестве другого примера рассмотрим различные, но связанные свойства тепла и температуры. Капля горячего растительного масла, разбрызганная на руку, вызывает кратковременный незначительный дискомфорт, в то время как кастрюля с горячим маслом вызывает серьезные ожоги. И капля, и горшок с маслом имеют одинаковую температуру (интенсивное свойство), но горшок явно содержит гораздо больше тепла (экстенсивное свойство).
Химия в повседневной жизни
Опасный алмаз
Возможно, вы видели символ, показанный на рис. 1.21, на контейнерах с химическими веществами в лаборатории или на рабочем месте. Этот алмаз химической опасности, который иногда называют «огненным бриллиантом» или «алмазом опасности», предоставляет ценную информацию, которая кратко суммирует различные опасности, о которых следует помнить при работе с конкретным веществом.
Рисунок 1,21 Алмаз опасности Национального агентства противопожарной защиты (NFPA) обобщает основные опасности химического вещества.
Система идентификации опасностей 704 Национального агентства противопожарной защиты (NFPA) была разработана NFPA для предоставления информации о безопасности определенных веществ. Система подробно описывает воспламеняемость, реакционную способность, опасность для здоровья и другие опасности. В общем ромбовидном символе верхний (красный) ромб указывает уровень пожароопасности (температурный диапазон температуры вспышки). Синий (левый) ромб указывает на уровень опасности для здоровья. Желтый (справа) ромб описывает опасность реактивности, например, насколько легко вещество подвергается детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологически опасные, радиоактивные и так далее. Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Синий (левый) ромб указывает на уровень опасности для здоровья. Желтый (справа) ромб описывает опасность реактивности, например, насколько легко вещество подвергается детонации или сильному химическому изменению. Белый (нижний) ромб указывает на особую опасность, например, если он является окислителем (который позволяет веществу гореть в отсутствие воздуха/кислорода), вступает в необычную или опасную реакцию с водой, является коррозионным, кислотным, щелочным, биологически опасные, радиоактивные и так далее. Каждая опасность оценивается по шкале от 0 до 4, где 0 — отсутствие опасности, 4 — чрезвычайно опасная.
Хотя многие элементы резко различаются по своим химическим и физическим свойствам, некоторые элементы обладают сходными свойствами. Например, многие элементы хорошо проводят тепло и электричество, тогда как другие являются плохими проводниками. Эти свойства можно использовать для разделения элементов на три класса: металлы (элементы с хорошей проводимостью), неметаллы (элементы с плохой проводимостью) и металлоиды (элементы с промежуточной проводимостью).

 При этом натрий образует пероксид (Na2O2), остальные металлы I группы – надпероксиды (RO2). При нагревании щелочноземельные металлы самовоспламеняются, металлы средней активности – окисляются. Во взаимодействие с кислородом не вступают золото и платина
При этом натрий образует пероксид (Na2O2), остальные металлы I группы – надпероксиды (RO2). При нагревании щелочноземельные металлы самовоспламеняются, металлы средней активности – окисляются. Во взаимодействие с кислородом не вступают золото и платина Остальные металлы – при нагревании
Остальные металлы – при нагревании Медь растворяется в концентрированных кислотах
Медь растворяется в концентрированных кислотах