Электронная таблица Менделеева
НАЗНАЧЕНИЕ
Электронная таблица Д.И. Менделеева является наглядным справочно-информационным пособием и предназначена для использования на занятиях по химии, физике, материаловедению и другим предметам, изучение которых требует информации о физико-химических свойствах различных элементов. На многоразрядный цифровой индикатор СИТ выводятся значения 27-ми основных физико-химических параметров каждого из 110 элементов таблицы Менделеева.
Рекомендуем использовать электронную таблицу Менделеева вместе с таблицей растворимости.
РЕЖИМЫ РАБОТЫ
– ввод с пульта и отображение на индикаторе номера элемента
– ввод и отображение номера параметра элемента
– отображение параметров элементов на многоразрядном индикаторе
– отображение некоторых физико-химических констант
– отключение/включение звукового сигнала
– проверка всех индикаторов
ТЕХНИЧЕСКИЕ ДАННЫЕ
– Напряжение питания,В 220
– Потребляемая мощность, Вт 20,0
– Дальность действия пульта, м 6,0
– Общий вес, кг 11,2
Габаритные размеры:
– Информационно-управляющий блок 880х560х45 мм
– Демонстрационная таблица элементов 1160х880х35 мм
КОМПЛЕКТНОСТЬ
– Информационно-управляющий блок
– Демонстрационная таблица элементов
– Пульт дистанционного управления с батареей 9В
– Инструкция по эксплуатации
УПРАВЛЕНИЕ
Управление электронной таблицей Менделеева осуществляется с помощью пульта на инфракрасных лучах. Необходимо направить пульт в сторону цифровых индикаторов таблицы и набрать номер элемента и параметра.
Необходимо направить пульт в сторону цифровых индикаторов таблицы и набрать номер элемента и параметра.
Переход к режиму “Выбор номера элемента” осуществляется путем нажатия на пульте кнопки “N“. При этом на таблице засветиться точечный индикатор “Атомный номер элемента”. Непрерывное свечение этого индикатора указывает на готовность таблицы к приему номера элемента.
Набор номера осуществляется последовательным вводом необходимых цифр в порядке прочтения. Например, для элемента “N1”- нажать кнопку “1”, а “N10” – последовательным нажатием кнопок “1” и “0”, “N102” – “102” при мерцающем индикаторе “Атомный номер элемента”. На цифровом индикаторе “Атомный номер элемента” отображается выбранный номер. Мерцание индикатора (около 2 сек.) свидетельствует о возможности набора следующей цифры двух или трехразрядного номера.
Для набора номера параметра следует нажать на кнопку “Р“. Затем ввести требуемый параметр (N1 – кнопка “1”, N12 – “1” и “2”) при мерцающем индикаторе “Номер параметра”.
Следует учесть, что при наборе двух и трёхзначных номеров интервал времени между нажатием предыдущей и последующей кнопок не должен превышать двух секунд. Это время индицируется мерцанием точечного индикатора. В связи с этим набор следующего номера возможен не ранее, чем через две секунды после окончания набора предыдущего.
Кнопками “+/-” можно увеличить/уменьшить на одну единицу значение ранее введённого номера элемента или параметра.
Приём команд подтверждается звуковым сигналом.
В зависимости от номера параметра на индикатор выводится информация одного, двух или трех параметров химическог элемента. При двух параметрах индикатор делится на зоны “А” и “Б” в соответствии с маркировкой. При индикации параметра “N5” три значения энергий ионизации разделены несветящимися зонами индикатора.
Числовые значения параметров выводятся в виде натуральных чисел, чисел с фиксированной или плавающей запятой. Например, число “1,23*10‾4 ” на индикаторе воспроизводится как: “1. 23 E-4″.
23 E-4″.
Под номером параметра “00” на индикатор выводится распределение электронов по энергетическим подуровням, которые застраиваются (s, p, d, f). Причем символ “s” обозначается на индикаторе как “-“.
Для перехода в режим отображения физико-химических констант необходимо:
– нажать на пульте кнопку “N”
– затем номер “0”
– набрать “Р” (на индикаторах отображается “Con”)
– ввести номер константы (1 – 19)
– на многоразрядном индикаторе отображается числовое значение константы, а на индикаторе номера элемента ее символьное обозначение
– кнопками “+/-” можно увеличивать/уменьшать номер константы
Таблица констант приведена в Приложении 1.
Для отключения звукового сигнала необходимо перейти в режим набора номера элемента и набрать номер “123”. На индикаторе отображается надпись “Sound OFF”. Повторный набор номера “123” включает звуковой сигнал, а на индикаторе отображается надпись “Sound On”.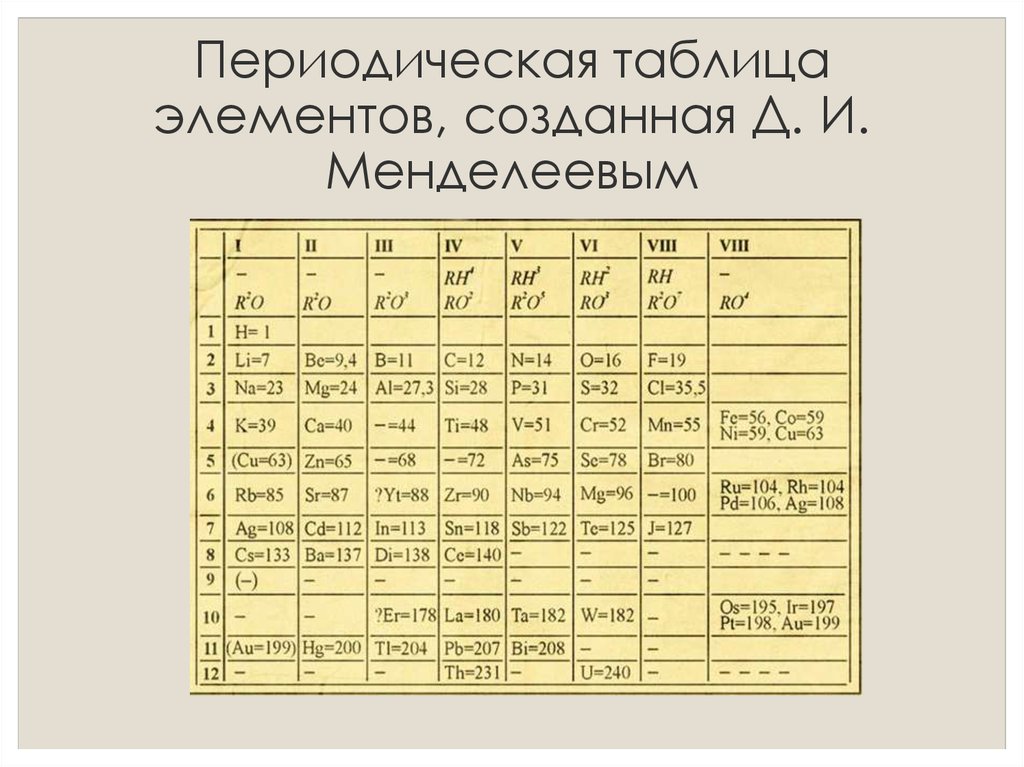
Проверка индикаторов производится в режиме набора номера элемента путём набора номера “111”. На всех цифровых индикаторах в течении двух секунд отображаются цифры “8”.
Приложение 1. Таблица физических констант.
Р | Наименование | Сим- вол | Числовое значение | СИ | СГС |
1 | Скорость света | С | 2.99792458 Е8 | м∙с‾¹ | Е10 см∙с‾¹ |
2 | Заряд электрона | е | 1.602189 Е-19 | Кл | Е-20 СГСМQ |
3 | Постоянная Планка | h | 6.626176 Е-34 | Дж∙с | Е-27 Эрг∙с |
4 | h/2¶ | ћ | 1. | Дж∙с | Е-27 Эрг∙с |
5 | Число Авогадро | L,Na | 6.022045 Е23 | моль‾¹ | Е23 моль‾¹ |
6 | Масса покоя электрона | me | 9.109534 Е-31 | Кг | Е-28 г |
7 | Масса покоя протона | mp | 1.672649 Е-27 | Кг | Е-24 г |
8 | Масса покоя нейтрона | mn | 1.674954 Е-27 | Кг | Е-24 г |
9 | Постоянная Фарадея | F | 9.648456 Е4 | Кл∙моль‾¹ | Е3 СГСМQ∙ моль‾¹ |
10 | Молярная газовая постоянная | R | 8.31441 | Дж∙моль‾¹∙ К‾¹ | Е7 эрг∙ моль‾¹∙К |
11 | Постоянная Больцмана | k | 1. | Дж∙К‾¹ | Е-16 эрг∙к‾¹ |
12 | Постоянная Стефана-Больцмана | σ | 5.67032 Е-8 | Вт∙м²∙к‾4 | Е-5 эрг∙с‾¹∙ к-4 |
13 | Гравитационная постоянная | G | 6.6720 Е-11 | Н∙м²∙кг‾² | Е-8 дин∙см²∙ г‾² |
14 | Нормальное ускорение свободного падения | g | 9.80665 | м∙с‾² | Е2 см∙с‾² |
15 | Объем моля идеального газа при нормальных условиях | Vm | 2.241383 Е-2 | м³∙моль‾¹ | Е4 см³∙ моль‾¹ |
16 | Электрическая постоянная | ε | 8.854188 Е-12 | Ф∙м‾¹ |
|
17 | Точка таяния льда | t0 | 273. | ºК | ºК |
18 | Нормальное атмосферное давление | Ратм | 101325 | Па | 10 дин∙см‾² |
19 | Механический эквивалент теплоты |
| 4.184 | дж∙кал‾¹ |
|
Водород – информация об элементе, свойства и использование
Стенограмма:
(Промо)
Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец акции)
Мира Сентилингам
На этой неделе мы узнаем, каково быть на вершине и номером один, когда встретимся с Королем стихий. Вот Брайан Клегг.
Вот Брайан Клегг.
Брайан Клегг
Забудьте о Даунинг-стрит, 10 или Пенсильвания-авеню, 1600, самом престижном адресе во вселенной . — номер один в периодической таблице, водород. В науке простота и красота часто приравниваются — и это делает водород таким прекрасным, как он есть, один протон и одинокий электрон составляют самый компактный из существующих элементов.
Водород существует с тех пор, как атомы впервые образовались в остатках Большого взрыва, и на сегодняшний день он является самым распространенным элементом. Несмотря на то, что миллиарды лет бесчисленные звезды превращают водород в гелий, он по-прежнему составляет 75 процентов обнаруживаемого содержимого Вселенной.
Этот легкий, бесцветный, легко воспламеняющийся газ сохраняет свою уникальность благодаря тому, что содержит только названные изотопы (и при этом одни из самых известных), дейтерий с добавленным нейтроном в ядре и тритий с двумя нейтронами.
Водород необходим для жизни, Вселенной и почти всего.
Только благодаря особой уловке водорода мы вообще можем использовать воду. Водород образует слабые связи между молекулами, зацепляясь за соседние атомы кислорода, азота или фтора. это эти водородные связи , которые придают воде многие ее свойства. Если бы их не было, температура кипения воды была бы ниже -70 градусов по Цельсию. Жидкой воды на Земле не было бы.
Водород был невольным открытием Парацельса, швейцарского алхимика шестнадцатого века, также известного как Теофраст Филиппус Ауреолус Бомбастус фон Гогенхайм. Он обнаружил, что что-то легковоспламеняющееся пузырится из металлов, которые были брошены в сильные кислоты, не подозревая о химической реакции, которая приводит к образованию солей металлов и выделению водорода, что-то, что многие другие, включая Роберта Бойля, независимо обнаружили на протяжении многих лет.
Однако первым, кто осознал, что водород является уникальным веществом, которое он назвал «горючим воздухом», был Генри Кавендиш, благородный предок Уильяма Кавендиша, который позже дал свое имя тому, что впоследствии стало самой известной в мире физической лабораторией в Кембридже. . Между 1760-ми и 1780-ми годами Генри не только выделил водород, но и обнаружил, что при его сжигании он соединяется с кислородом (или «дефлогистированным воздухом», как его называли) с образованием воды. Эти неуклюжие термины были отметены французским химиком Антуаном Лавуазье, который навсегда изменил химические названия, назвав горючий воздух «водородом», геном или создателем гидро, воды.
Поскольку водород очень легкий, этот чистый элемент редко встречается на Земле. Оно бы просто уплыло. Основные компоненты воздуха, азот и кислород, в четырнадцать и шестнадцать раз тяжелее, что придает водороду исключительную плавучесть. Эта легкость водорода сделала его естественным для одного из первых практических применений — наполнения воздушных шаров.
Первое такое воздушное судно было создано французским ученым Жаком Шарлем в 1783 году, который был вдохновлен успехом братьев Монгольфье с горячим воздухом за пару месяцев до того, как использовать водород в воздушном шаре из шелка, пропитанного каучуком. У водорода, казалось, было гарантированное будущее в летательных аппаратах, подкрепленное изобретением дирижаблей, построенных на жесткой раме, называемых дирижаблями в Великобритании, но более известных под своим немецким прозвищем Цеппелины, в честь их восторженного промоутера графа Фердинанда фон Цеппелина.
Эти дирижабли вскоре стали небесными лайнерами, безопасно и плавно перевозя пассажиров через Атлантику. Но, несмотря на исключительную легкость водорода, у него есть еще одно свойство, которое погубило дирижабли, — водород легко воспламеняется. Разрушение огромного цеппелина «Гинденбург», вероятно, в результате пожара, вызванного статическим электричеством, было заснято шокированной публикой по всему миру.
Тем не менее, водород остается важным игроком в сфере транспорта из-за высокой эффективности его сгорания. Многие ракеты НАСА, в том числе вторая и третья ступени программы «Аполлон» «Сатурн-5» и главные двигатели космического корабля «Шаттл», работают на сжигании жидкого водорода с чистым кислородом.
Совсем недавно водород был предложен в качестве замены ископаемого топлива в автомобилях. Здесь у него есть большое преимущество перед бензином в том, что он сжигает только воду. Выбросов парниковых газов не происходит. Наиболее вероятным способом использования водорода является не его взрывное сжигание, а использование его в топливном элементе, где электрохимическая реакция используется для производства электроэнергии для питания автомобиля.
Однако не все убеждены, что будущее за водородными автомобилями. Нам понадобится сеть водородных заправочных станций, а он остается опасным взрывоопасным веществом. В то же время он менее эффективен, чем бензин, так как в литре бензина примерно в три раза больше больше полезной энергии в нем, чем в литре жидкого водорода (если использовать сжатый газообразный водород, то может уйти до десяти раз больше).
Но даже если мы не получим автомобили на водородном топливе, у водорода все еще есть будущее в более драматическом источнике энергии – ядерном синтезе, источнике энергии солнца. Термоядерные электростанции через десятки лет не станут практичными, но они дают надежду на чистую, обильную энергию.
Как бы мы ни использовали водород, мы не можем отнять у него первое место. Это numero uno, высшее, царь стихий.
Мира Сентилингам
Итак, это самый распространенный элемент, он необходим для жизни на Земле, используется в качестве топлива для космических ракет и может решить нашу зависимость от ископаемого топлива. Вы можете понять, почему Брайан Клегг ставит водород на первое место. На следующей неделе мы встретимся с хранителем времени периодической таблицы.
Том Бонд
Одно из текущих применений — атомные часы, хотя рубидий считается менее точным, чем цезий. Рубидиевая версия атомных часов использует переход между двумя сверхтонкими энергетическими состояниями изотопа рубидия-87. В этих часах используется микроволновое излучение, которое настраивается до тех пор, пока оно не будет соответствовать сверхтонкому переходу, после чего интервал между гребнями волны излучения можно использовать для калибровки самого времени.
Мира Сентилингам
А чтобы узнать больше о роли Рубидия, присоединяйтесь к Тому Бонду на следующей неделе в программе «Химия в ее элементах». А пока я Мира Сентилингам, спасибо за внимание и до свидания.
(Promo)
Химия в ее стихии представлена вам Королевским химическим обществом и произведена thenakedscientists.com. Дополнительную информацию и другие выпуски «Химия в ее стихии» можно найти на нашем веб-сайте по адресу chemistryworld.
(Конец акции)
Понимание элементов периодической таблицы: набор 1
Понимание элементов периодической таблицы
* Отзывы *
Обзор серии: Понимание элементов периодической таблицы«Письмо интересное, разговорное и доступно для широкого круга читателей. Марганец — еще одно название в этой превосходной серии, которая представляет собой хорошее введение и отправную точку для исследования химических элементов. Рекомендуемая покупка для библиотек средней школы, а также удовлетворит потребности неохотных читателей и исследования начального уровня на уровне старшей школы».
Обзор серии: Понимание элементов Периодической таблицы
«Отлично. Тонкие тома содержат большой объем информации в удобной и понятной форме».
–М. Глисон, Средняя школа Люкс, Линкольн, Небраска
Обзор серии: Понимание элементов периодической таблицы
«Отличный ресурс для начинающих исследований химических элементов и периодической таблицы».


 054589 Е-34
054589 Е-34 380662 Е-23
380662 Е-23 15
15