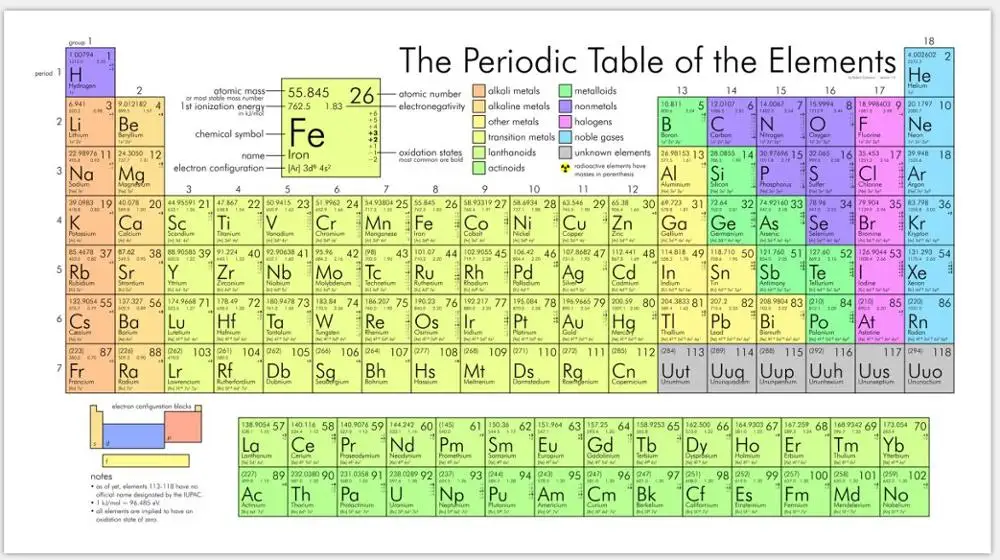
Формула кислорода. Периодическая таблица Менделеева – кислород
Формула кислорода. Периодическая таблица Менделеева — кислород
Химический элемент кислород находится во втором периоде VI основной группы устаревшей сокращенной версии таблицы Менделеева. По новым стандартам нумерации это 16-я группа. Соответствующее решение было принято ИЮПАК в 1988 году. Формула кислорода как простого вещества — O2. Рассмотрим его основные свойства, роль в природе и хозяйстве. Начнем с характеристики всей группы таблицы Менделеева, к которой относится кислород. Этот элемент отличается от связанных с ним халькогенов, а вода отличается от водородных соединений серы, селена и теллура. Объяснение всех отличительных черт можно найти, только узнав о структуре и свойствах атома.
Содержание
- 1 Халькогены — родственные кислороду элементы
- 2 Кислород — самый распространенный элемент
- 3 Строение атома кислорода
- 4 Свойства кислорода — химического элемента
- 5 Кислород — простое вещество
- 6 Физические свойства
- 7 Получение кислорода в лаборатории
- 8 Горение
- 9 Получение кислорода в промышленных масштабах
- 10 Химические расчеты по формуле и уравнениям реакций с участием молекул О2
- 11 Роль молекул О2 в природе и жизни человека
- 12 Кислород — идеальный окислитель
Халькогены — родственные кислороду элементы
Атомы с подобными свойствами образуют группу в периодической таблице. Кислород является прародителем семейства халькогенов, но отличается от них рядом свойств.
Атомная масса кислорода — предка группы — составляет 16 а.е.м. Халькогены при образовании соединений с водородом и металлами показывают обычную степень окисления: –2. Например, в составе воды (Н2О) окислительное число кислорода составляет –2.
Состав типичных водородных соединений халькогенов соответствует общей формуле: h3R. Когда эти вещества растворяются, образуются кислоты. Только водородное соединение кислорода — вода — обладает особыми свойствами. Согласно выводам ученых, это необычное вещество является одновременно очень слабой кислотой и очень слабым основанием.
Сера, селен и теллур имеют типичные положительные степени окисления (+4, +6) в сочетании с кислородом и другими неметаллами с высокой электроотрицательностью (EO). Состав оксидов халькогенов отражает общие формулы: RO2, RO3. Соответствующие кислоты имеют следующий состав: h3RO3, h3RO4.
Элементам соответствуют простые вещества: кислород, сера, селен, теллур и полоний. Первые три представителя проявляют неметаллические свойства. Кислородная формула — O2. Аллотропной модификацией того же элемента является озон (O3). Обе модификации газовые. Сера и селен — твердые неметаллы. Теллур — неметаллическое вещество, проводник электрического тока, полоний — металл.
Кислород — самый распространенный элемент
Общее содержание атомов элемента в земной коре составляет около 47% (по весу). Кислород содержится как в свободной форме, так и во многих соединениях. Простое вещество, формула которого — О2, входит в состав атмосферы, составляя 21% воздуха (по объему). Молекулярный кислород растворен в воде, он находится среди частиц почвы.
Мы уже знаем, что существует другой тип существования того же химического элемента в виде простого вещества. Это озон, газ, образующий слой на высоте около 30 км от поверхности земли, часто называемый озоновым экраном. Связанный кислород входит в молекулы воды, в состав многих горных пород и минералов, а также в органические соединения.
Строение атома кислорода
Таблица Менделеева содержит полную информацию о кислороде:
- Порядковый номер элемента — 8.
- Основной заряд — +8.
- Общее количество электронов 8.
- Электронная формула кислорода 1с22с22п4.
В природе есть три стабильных изотопа, которые имеют одинаковый порядковый номер в периодической таблице, одинаковый состав протонов и электронов, но разное количество нейтронов. Изотопы обозначены одним и тем же символом — О. Для сравнения приведем диаграмму, показывающую состав трех изотопов кислорода:
Изотопы обозначены одним и тем же символом — О. Для сравнения приведем диаграмму, показывающую состав трех изотопов кислорода:
Свойства кислорода — химического элемента
В подслое 2p атома находятся два неспаренных электрона, что объясняет появление степеней окисления -2 и +2. Два парных электрона не могут разделиться, так что степень окисления повышается до +4, как сера и другие халькогены. Причина в отсутствии бесплатного подуровня. Следовательно, в соединениях химический элемент кислород не имеет валентности и степени окисления, равной номеру группы в сокращенной версии периодической системы (6). Его нормальная степень окисления -2.
Только в соединениях с фтором кислород показывает необычную положительную степень окисления +2. Величина ЭО двух сильных неметаллов различна: ЭО (О) = 3,5; EO (F) = 4. Будучи более электроотрицательным химическим элементом, фтор сильнее удерживает свои электроны и притягивает валентные частицы к внешнему энергетическому уровню атома кислорода. Следовательно, в реакции с фтором кислород является восстановителем и отдает электроны.
Следовательно, в реакции с фтором кислород является восстановителем и отдает электроны.
Кислород — простое вещество
Английский исследователь Д. Пристли в 1774 году в ходе экспериментов выделил газ при разложении оксида ртути. Двумя годами ранее К. Шееле получил то же самое вещество в чистом виде. Всего через несколько лет французский химик А. Лавуазье установил, какой газ входит в состав воздуха, и изучил его свойства. Химическая формула кислорода — O2. Отражаем в регистре состава вещества электроны, участвующие в образовании неполярной ковалентной связи — O :: O. Каждую пару связывающих электронов заменяем признаком: O = O. Эта формула кислорода ясно показывает что атомы в молекуле связаны между двумя общими парами электронов.
Мы выполняем несложные вычисления и определяем, чему равен относительный молекулярный вес кислорода: Mr (O2) = Ar (O) x 2 = 16 x 2 = 32. Для сравнения: Mr (воздух) = 29. Химическая формула l кислорода отличается из формулы озона для атома кислорода.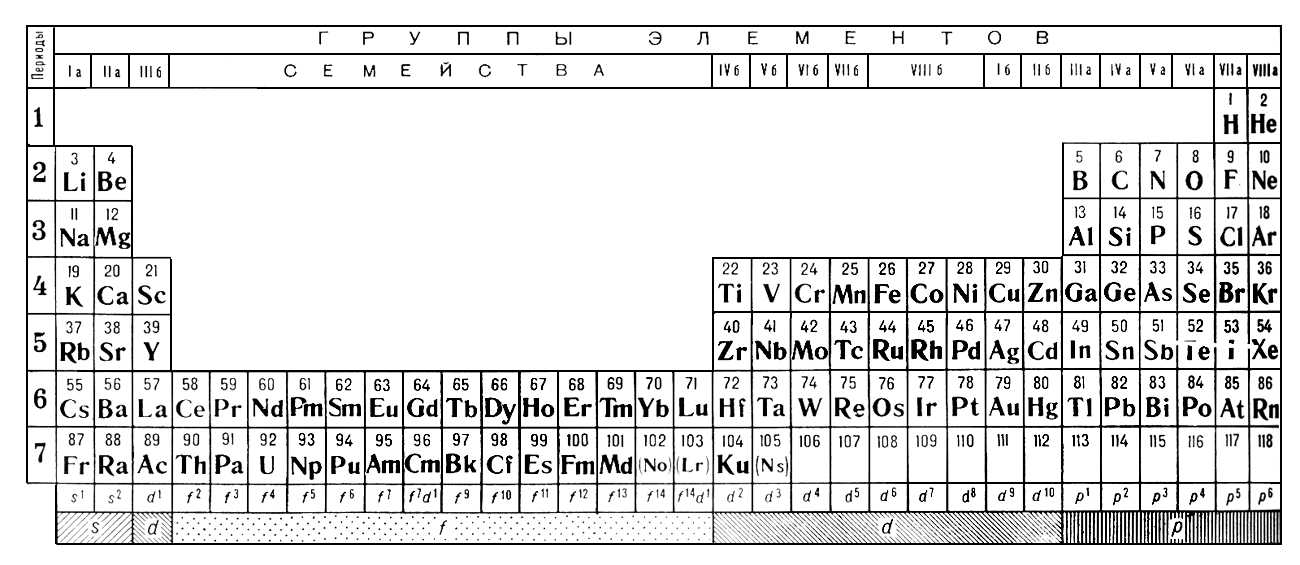 Следовательно, Mr (O3) = Ar (O) x 3 = 48. Озон в 1,5 раза тяжелее кислорода.
Следовательно, Mr (O3) = Ar (O) x 3 = 48. Озон в 1,5 раза тяжелее кислорода.
Физические свойства
Кислород — это газ без цвета, вкуса и запаха (при нормальной температуре и атмосферном давлении). Вещество немного тяжелее воздуха; растворим в воде, но в небольших количествах. Температура плавления кислорода отрицательная и составляет -218,3 ° С. Точка, в которой жидкий кислород снова превращается в газообразный, является его температурой кипения. Для молекул O2 эта физическая величина достигает -182,96 ° C. В жидком и твердом состоянии кислород приобретает синий цвет.
Получение кислорода в лаборатории
При нагревании оксигенатов, таких как перманганат калия, образуется бесцветный газ, который можно собрать в колбе или пробирке. Если к чистому кислороду добавить горящий факел, он горит сильнее, чем на воздухе. Два других лабораторных метода получения кислорода — это разложение перекиси водорода и хлората калия (бертолетовой соли). Рассмотрим схему устройства, которое используется для термического разложения.
Бертолетную соль насыпать в пробирку или круглодонную колбу, закрыть крышкой с газоотводной трубкой. Его противоположный конец следует направить (под воду) в перевернутую колбу. Горловину следует опустить в большой стакан или кристаллизатор, наполненный водой. Кислород выделяется при нагревании трубки с бертолетской солью. Пропустить колбу через газоотводную трубку, вытеснив из нее воду. Когда баллон наполняется газом, его закрывают под водой и переворачивают вверх дном. Кислород, полученный в этом лабораторном эксперименте, можно использовать для изучения химических свойств простого вещества.
Горение
Если сжигание веществ в кислороде проводится в лаборатории, необходимо знать и соблюдать правила пожарной безопасности. Водород мгновенно горит на воздухе и при смешивании с кислородом в соотношении 2: 1 является взрывоопасным. Горение веществ в чистом кислороде намного интенсивнее, чем на воздухе. Это явление объясняется составом воздуха. Кислород в атмосфере составляет чуть более 1/5 части (21%). Горение — это реакция веществ с кислородом, в результате которой образуются различные продукты, в основном оксиды металлов и неметаллов. Кроме того, горючие смеси O2 с горючими веществами могут быть токсичными.
Горение — это реакция веществ с кислородом, в результате которой образуются различные продукты, в основном оксиды металлов и неметаллов. Кроме того, горючие смеси O2 с горючими веществами могут быть токсичными.
Горение обычной свечи (или спички) сопровождается образованием углекислого газа. Следующий эксперимент можно провести дома. Если вы сожжете вещество под стеклянной банкой или большим стаканом, горение прекратится, как только будет израсходован весь кислород. Азот не поддерживает дыхание и горение. Двуокись углерода, продукт окисления, больше не вступает в реакцию с кислородом. Прозрачная известковая вода позволяет обнаружить присутствие углекислого газа после зажигания свечи. Если продукты сгорания проходят через гидроксид кальция, раствор становится мутным. Между известковой водой и диоксидом углерода происходит химическая реакция с образованием нерастворимого карбоната кальция.
Получение кислорода в промышленных масштабах
Более дешевый процесс, в результате которого образуются безвоздушные молекулы O2, не связан с химическими реакциями. В промышленности, например, на металлургических заводах, воздух сжижается при низких температурах и высоких давлениях. Наиболее важные компоненты атмосферы, такие как азот и кислород, кипят при разных температурах. Воздушную смесь разделяют постепенным нагревом до нормальной температуры. Сначала высвобождаются молекулы азота, затем кислород. Метод разделения основан на различных физических свойствах простых веществ. Формула простого кислородного вещества такая же, как и до охлаждения и разжижения воздуха — O2.
В промышленности, например, на металлургических заводах, воздух сжижается при низких температурах и высоких давлениях. Наиболее важные компоненты атмосферы, такие как азот и кислород, кипят при разных температурах. Воздушную смесь разделяют постепенным нагревом до нормальной температуры. Сначала высвобождаются молекулы азота, затем кислород. Метод разделения основан на различных физических свойствах простых веществ. Формула простого кислородного вещества такая же, как и до охлаждения и разжижения воздуха — O2.
В результате некоторых реакций электролиза также выделяется кислород, который собирается на соответствующем электроде. Промышленным и строительным компаниям нужен газ в больших объемах. Спрос на кислород постоянно растет, особенно в химической промышленности. Полученный газ хранится для промышленных и медицинских целей в стальных баллонах с маркировкой. Кислородные баллоны окрашены в синий или голубой цвет, чтобы отличать их от других сжиженных газов: азота, метана, аммиака.
Химические расчеты по формуле и уравнениям реакций с участием молекул О2
Числовое значение молярной массы кислорода совпадает с другим значением: относительной молекулярной массой. Только в первом случае присутствуют единицы измерения. Вкратце формулу для кислорода и его молярную массу нужно записать так: M (O2) = 32 г / моль. В нормальных условиях один моль любого газа соответствует объему 22,4 литра. Это означает, что 1 моль O2 — это 22,4 литра вещества, 2 моль O2 — это 44,8 литра. Согласно уравнению реакции между кислородом и водородом видно, что 2 моля водорода и 1 моль кислорода взаимодействуют:
Если в реакцию вовлечен 1 моль водорода, объем кислорода составит 0,5 моль x 22,4 л / моль = 11,2 л.
Роль молекул О2 в природе и жизни человека
Кислород потребляется живыми организмами на Земле и участвует в круговороте веществ более 3 миллиардов лет. Это главное вещество для дыхания и обмена веществ, с его помощью происходит разложение молекул питательных веществ, синтезируется необходимая для организмов энергия.
Роль кислорода в природе и народном хозяйстве велика:
- процессы гниения, брожения, ржавления протекают при участии кислорода, который действует как окислитель;
- всасывается при дыхании живыми организмами;
- используется для получения продуктов тонкого органического синтеза.
- участвует в реакциях фотосинтеза у растений;
- входит в состав органических молекул;
Сжиженный кислород в баллонах используется для резки и сварки металлов при высоких температурах. Эти процессы выполняются на машиностроительных заводах, транспортных и строительных компаниях. Для проведения работ под водой, под землей, на большой высоте в безвоздушном пространстве людям также необходимы молекулы O2. Кислородные подушки используются в медицине для обогащения состава вдыхаемого больным воздуха. Газ для медицинских целей отличается от технического газа практически полным отсутствием посторонних примесей и запахов.
Газ для медицинских целей отличается от технического газа практически полным отсутствием посторонних примесей и запахов.
Кислород — идеальный окислитель
Известны соединения кислорода со всеми химическими элементами таблицы Менделеева, за исключением первых представителей семейства благородных газов. Многие вещества реагируют напрямую с атомами O, за исключением галогенов, золота и платины. Большое значение имеют явления с участием кислорода, которые сопровождаются выделением света и тепла. Такие процессы широко используются в быту и в промышленности. В металлургии взаимодействие минералов с кислородом называется обжигом. Предварительно измельченный минерал смешивается с воздухом, обогащенным кислородом. При высоких температурах металлы восстанавливаются из сульфидов до простых веществ. Так получают железо и некоторые цветные металлы. Наличие чистого кислорода увеличивает скорость технологических процессов в различных отраслях химии, машиностроения и металлургии.
Появление недорогого метода получения кислорода из воздуха путем разделения на компоненты при низких температурах стимулировало развитие многих областей промышленного производства. Химики считают молекулы O2 и атомы O идеальными окислителями. Это натуральные материалы, они постоянно обновляются в природе, не загрязняют окружающую среду. Кроме того, химические реакции с участием кислорода часто приводят к синтезу другого природного и безопасного продукта: воды. O2 играет важную роль в обезвреживании токсичных промышленных отходов, в очистке воды от загрязнений. Помимо кислорода для дезинфекции используется его аллотропная модификация — озон. Это простое вещество обладает высокой окислительной активностью. Озонирование воды разрушает загрязняющие вещества. Озон губительно действует и на патогенную микрофлору.
Химики считают молекулы O2 и атомы O идеальными окислителями. Это натуральные материалы, они постоянно обновляются в природе, не загрязняют окружающую среду. Кроме того, химические реакции с участием кислорода часто приводят к синтезу другого природного и безопасного продукта: воды. O2 играет важную роль в обезвреживании токсичных промышленных отходов, в очистке воды от загрязнений. Помимо кислорода для дезинфекции используется его аллотропная модификация — озон. Это простое вещество обладает высокой окислительной активностью. Озонирование воды разрушает загрязняющие вещества. Озон губительно действует и на патогенную микрофлору.
Поделиться:
- Предыдущая записьОбразованный человек — это… Качества образованного человека
- Следующая записьЖивотные в почве. Обитатели почвы и их приспособленность к среде
×
Рекомендуем посмотреть
Adblock
detector
112 элемент таблицы Менделеева получил название КОПЕРНИКИЙ
Международный союз чистой и прикладной химии (ИЮПАК) официально присвоил название “коперникий” 112-му элементу таблицы Менделеева, который был синтезирован немецкими физиками еще в 1996 году, сообщил в пятницу профессор Хорст Штокер (Horst Stoecker), научный руководитель Гельмгольцевского центра исследования тяжелых ионов (GSI) в Дармштадте (Германия).
“Я только что получил электронное письмо из ИЮПАК о том, что название “коперникий” официально присвоено 112-му элементу”, – сказал Штокер РИА Новости в кулуарах ученого совета Объединенного института ядерных исследований в подмосковной Дубне.
В природе химические элементы тяжелее 92-го – урана – не существуют. Более тяжелые элементы получают в ядерных реакторах, а тяжелее 100-го элемента – фермия – в реакциях слияния ядер на ускорителях. Группа германских физиков под руководством Сигурда Хофманна (Sigurd Hofmann) еще в 90-е годы получили на ускорителе тяжелых ионов 112-й элемент, однако только осенью 2009 года их результат был подтвержден независимым экспериментом, после чего ИЮПАК официально признал его успех.
Еще до германского эксперимента 112-й элемент был получен и в российской Дубне, однако российские физики получили только одно ядро, и поэтому ИЮПАК “засчитал” только немецкий результат.
Германские ученые предложили для нового элемента название “коперникий”. “Сегодня ИЮПАК объявил, что новый элемент назван в честь Николая Коперника, поляка, открывшего, что Земля вращается вокруг Солнца. Сегодня день его рождения”, – сказал Штокер.
“Сегодня ИЮПАК объявил, что новый элемент назван в честь Николая Коперника, поляка, открывшего, что Земля вращается вокруг Солнца. Сегодня день его рождения”, – сказал Штокер.
Он отметил, что группа Хофманна и группа из Дубны под руководством академика Юрия Оганесяна за последние 20 лет синтезировали около 20 сверхтяжелых элементов – с 107 по 118-й.
Руководитель эксперимента по синтезу 112-го элемента в Гельмгольцевском центре исследования тяжелых ионов в Дармштадте (Германия) профессор Зигурд Хофман (Sigurd Hofmann)
Группа Хофманна для получения атомов нового элемента использовала ионы цинка с атомным номером 30, которые разгонялись до очень больших энергий в 120-метровом ускорителе, после чего ударялись о мишень из свинца, атомный номер которого равен 82. При слиянии ядер цинка и свинца и происходило формирование ядер нового элемента, порядковый номер которого равен сумме атомных номеров исходных компонентов.
Свой успех ученые повторили в 2002, после чего независимая группа экспертов из Исследовательского института “Рикэн” в Японии повторила их достижение.
В Центре по исследованию тяжелых ионов в Дармштадте ранее уже были получены не встречающиеся в природе элементы с атомными номерами со 107 по 111 – борий, хассий, мейтнерий, дармштадтий и рентгений соответственно. В свою очередь, российские физики получили все более тяжелые элементы до 118-го.
В настоящее время российские физики из Лаборатории имени Флерова Объединенного института ядерных исследований в Дубне готовятся к эксперименту по синтезу 117-го элемента, место которого в таблице Менделеева между ранее полученными 116-м и 118-м элементами пока пустует.
по информации rian.ru
Скандий (Sc) — атомный номер 21
Произносится
SKAN-di-em
Скандий (Sc) — серебристо-белый металл с атомным номером 21 в периодической таблице. Это переходный металл, расположенный в группе 3 периодической таблицы. Он имеет символ Sc.
Скандий представляет собой переходный металл, часть d-электронного блока периодической таблицы и классифицируется как редкоземельный металл, который встречается только в рудах и не встречается в природе в земной коре. Он обычно присутствует в месторождениях урана и его трудно извлечь. Впервые он был обнаружен в 1879 г.Ларсом Нильсоном, который провел спектры неизвестного соединения, но только в 1937 году Фишеру и его коллегам удалось выделить скандий из руд. Промышленное производство чистого скандия затруднено, поэтому его очень часто производят в виде оксида скандия. Известно, что только три шахты в мире содержат соединения скандия. Скандий используется для легирования металлов, обычно с алюминием из-за его прочности и легкости. Он находится в группе 3 и имеет температуру плавления 1541°C и температуру кипения 2836°C, являясь твердым металлом при комнатной температуре.
Он обычно присутствует в месторождениях урана и его трудно извлечь. Впервые он был обнаружен в 1879 г.Ларсом Нильсоном, который провел спектры неизвестного соединения, но только в 1937 году Фишеру и его коллегам удалось выделить скандий из руд. Промышленное производство чистого скандия затруднено, поэтому его очень часто производят в виде оксида скандия. Известно, что только три шахты в мире содержат соединения скандия. Скандий используется для легирования металлов, обычно с алюминием из-за его прочности и легкости. Он находится в группе 3 и имеет температуру плавления 1541°C и температуру кипения 2836°C, являясь твердым металлом при комнатной температуре.
Загрузите скандий в виде изображения для печати и с полным масштабированием
Получите бесплатную загрузку здесь (JPEG, PDF, SVG)
Часто задаваемые вопросы
Какова температура плавления скандия?
Скандий имеет температуру плавления 1541°C, что означает, что при 1541°C он превратится в жидкость.
Какова температура кипения скандия?
Скандий имеет температуру кипения 2836°C, что означает, что при 2836°C он превратится в газ.
Что такое электроотрицательность скандия?
Электроотрицательность скандия равна 1,36. Электроотрицательность — это мера того, насколько сильно атомы притягивают к себе связывающие электроны.
Открыт
Ларсом Нильсоном
Дата открытия
1879
Что такое Теплота испарения скандия?
Скандий имеет теплоту испарения 314,2 кДж/моль.
Использование
Металлический скандий используется в некоторых аэрокосмических приложениях. Оксид скандума (Sc2O3) используется в производстве мощных электрических ламп. Иодид скандия (ScI3) используется в лампах, излучающих свет, цвет которого близко соответствует естественному солнечному свету.
Источники
Встречается в основном в минералах тортвейтиле (~34% скандия) и виките. Также в некоторых оловянных и вольфрамовых рудах. Чистый скандий получают как побочный продукт переработки урана.
Чистый скандий получают как побочный продукт переработки урана.
Об авторе
Натан М.
Автор
Натан имеет степень бакалавра биомедицинской химии в Уорикском университете и степень бакалавра биомедицинских наук в Университете Вулверхэмптона, Великобритания. Предмет Натана варьируется от общей химии до органической химии. Натан также создал учебную программу «Разрушение атома» на странице курса.
Citation
“Scandium”, опубликованная 30 декабря 2019 года. SC
Атомный вес
44.956
Атомный номер
21
Состояние
Сплошное
Плата
Неизвестно
1541
° C
Точка кипячения
1541
° C
.0003
2836
Unknown
°C
Heat of Vaporization
314.2
Unknown
kJ/mol
Crystal Structure
Hexagonal
Thermoconductivity
0.158
Unknown
W/cmK
Shells
2,8,9,2
Группа
Переходный металл
Период
4
Блок
D Блок
Орбитали 3 d 9s 9s
1 4 9006/см ом
Первый потенциал ионизации
6. 5614 V
5614 V
Второй потенциал ионизации
12,80 В
Третий потенциал ионизации
24,76 В
Ионовый радиус
.75 (+3) Å
oxydation
. 3
Параметр решетки
3,3091 Å
Параметр решетки 2
–
Параметр решетки 3
–
Orbital Configuration
2,8,9,2
0002
Загрузить периодическую таблицу
Элементы периодической таблицы по атомному номеру (21-40) Карточки
Связанные карточки
Пожалуйста, войдите, чтобы добавить в папки.
Войти
Вы создали 2 папки. Пожалуйста, обновитесь до Cram Premium, чтобы создавать сотни папок!
Обновление
- Перемешать
Включить
Выключить
- В алфавитном порядке
Включить
Выключить
- Передний Первый
Включить
Выключить
- Обе стороны
Включить
Выключить
- Читать
Включить
Выключить
Чтение.