Периодическая таблица Менделеева / Растворимость солей (формат А4)
| Артикул | 9789851719491 |
| Серия | Плакат |
| Переплет | Лист |
| Автор |
Волков А.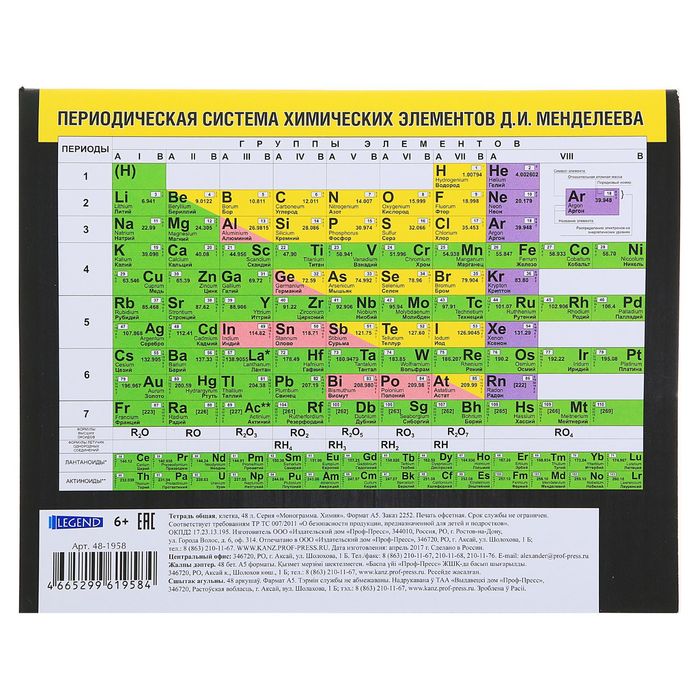 |
| Издательство | Литера Гранд (Минск) |
| Дата издания | 2020 |
| Кол-во страниц | 1 |
| Формат страниц | А4 |
Категории: Открытки
Таблица Менделеева. Растворимость солей (А4) | ISBN: 254245
Растворимость солей (А4) | ISBN: 254245
Аннотация
Двусторонняя таблица, формата А4
Дополнительная информация
| Регион (Город/Страна где издана): | Минск |
| Год публикации: | 2017 |
| Тираж: | |
| Страниц: | |
| Ширина издания: | 210 |
| Высота издания: | 295 |
Вес в гр. : : | 13 |
| Язык публикации: | Русский |
| Тип обложки: | Мягкий / Полужесткий переплет |
| Цвета обложки: | Белый |
| Полный список лиц указанных в издании: |
Таблица менделеева расшифровка элементов.
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе.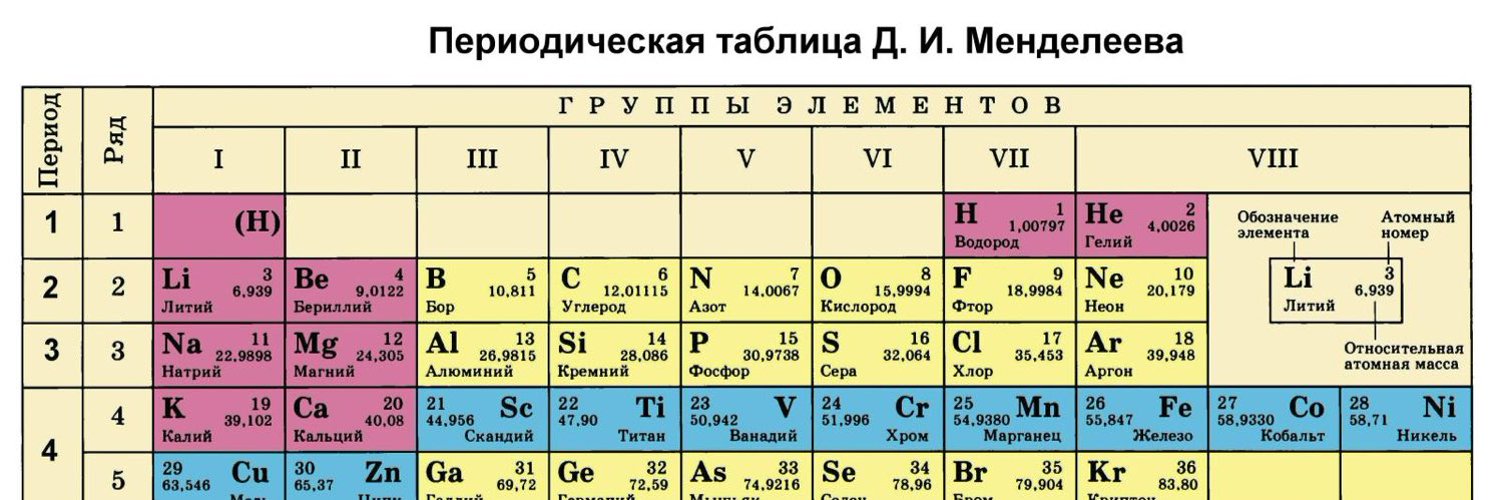 Затем можно приступить к изучению свойств каждого элемента. И наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
Затем можно приступить к изучению свойств каждого элемента. И наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
Шаги
Часть 1
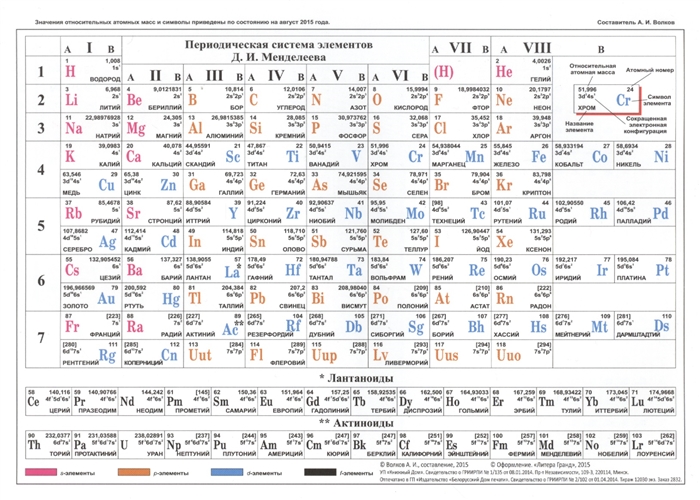
Структура таблицыКак видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент.

- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.

- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
Узнайте, почему в таблице присутствуют пустые ячейки. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 102 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.
Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах.
 Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.
Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода – 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними.
Часть 2
Обозначения элементовКаждый элемент обозначается одной или двумя латинскими буквами. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки.
 Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
Обратите внимание на полное название элемента, если оно приведено в таблице. Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.
- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.

- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента. Элементы имеют атомные номера от 1 до 118.
- Атомный номер всегда является целым числом.
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!
- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.
Обычно количество электронов равно числу протонов. Исключением является тот случай, когда атом ионизирован. Протоны имеют положительный, а электроны – отрицательный заряд. Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов.
 Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.
Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс». Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
- Знаки «плюс» и «минус» не ставятся, если атом не является ионом.
Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу). Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
Нестандартное домашнее задание по химии. Составляем Таблицу Менделеева из нарисованных карточек.
Тема домашнего задания: нарисовать карточку отдельного химического элемента, присутствующего в живых организмах (биоген) с иллюстрацией его действия на живые организмы.
Класс – 8– 10 класс; сложность – высокая, межпредметная; время выполнения – 30-40 минут.
Тип задания – индивидуальное, а затем – в группе; способ проверки – сбор иллюстраций отдельных химических элементов формата А4, и составление из них общей таблицы Менделеева.
Учебники:
1) учебник химии 10 класс — О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарев, углубленный уровень (ГЛАВА 7. Биологически активные соединения, стр.300).
2) учебник химии 8 класс – О.С. Габриелян, (§ 5. Периодическая система химических элементов Д. И. Менделеева. Знаки химических элементов, стр. 29).
3) учебник экологии 10 (11) класс – Е. А. Криксунов, В.В.Пасечник, (Глава 6. Окружающая среда и здоровье человека, 6.1. Химические загрязнения среды и здоровье человека, стр. 217).
4) учебник биологии 10-11 класс – Общая биология. Базовый уровень. Под ред. Беляева Д.К., Дымшица Г.М. (Глава 1. Химический состав клетки. § 1. Неорганические соединения, § 2. Биополимеры.).
Цели: освоениезнаний о биохимических процессах в живой клетке, геохимических процессах в природе, полученные школьниками самостоятельно и осмысленно, закреплённые рисунком, творческое рисование. Создание уникальных наглядных пособий для других учеников. Составление авторской уникальной «Таблицы Менделеева».
Пояснительная записка.
Суть домашнего задания в том, что ученики рисуют участие каждого химического элемента в геохимических процессах. А затем все рисунки объединяются в сводную “Таблицу Менделеева”, которую можно вывесить на стене в классе. Образуется некий наглядный продукт совместного творчества: “Экология в картинках”. В разных классах получаются разные “Таблицы Менделеева”, главное сохранить табличную форму и проследить, чтобы все рисунки были на листе формата А4. А также, чтобы в углу листа был проставлен химический знак того элемента, о котором нарисован сюжет. Вначале каждый ученик выбирает конкретный химический элемент для изучения. Затем самостоятельно, или с помощью учителя ищет информацию, выбирает нужную, придумывает сюжет рисунка, рисует и размещает свой рисунок на стене в ячейку умозрительной таблицы Менделеева для соответствующего химического элемента. Можно упростить/усложнить задачу, из всех химических элементов выбрав только наиболее распространенные на земле, или, наоборот – наименее распространенные. Можно выбрать только биогены (химические элементы, входящие в состав живых организмов) и рисовать
учебные карточки с сюжетами о них. Можно выбрать макроэлементы живых клеток, а можно – только микроэлементы и т.д. В экологических справочниках сейчас можно найти много различной информации на эту тему.
Можно выбрать только биогены (химические элементы, входящие в состав живых организмов) и рисовать
учебные карточки с сюжетами о них. Можно выбрать макроэлементы живых клеток, а можно – только микроэлементы и т.д. В экологических справочниках сейчас можно найти много различной информации на эту тему.
Справочный материал: Биогенными называют химические элементы, постоянно присутствующие в живых организмах и играющие какую-либо биологическую роль: O, C, H, Ca, N, K, P, Mg, S, Cl, Na, Fe, I , Cu .
Виртуальная «Таблица Менделеева». Вместо бумажной таблицы на стене в классе, можно организовать виртуальную таблицу и общую работу в ней учеников. Для этого учитель готовит макет таблицы в Google -документах и открывает доступ ученикам. Рисовать ученики могут с помощью компьютерных программ, а могут загружать рисунки, выполненные карандашами и красками. Вот первоначальный макет такой таблицы, частично заполненный учениками.
Отдельные учебные карточки , с ученическими скетчами на тему воздействия конкретных химических элементов на живые организмы (формат А4 каждой карточки).
ПРИЛОЖЕНИЕ. Таблица химических элементов-биогенов, как справочный материал для рисования сюжетов учебных карточек.
Пороговые концентрации химических элементов в почвах (мг/кг) и возможные реакции организмов (по Ковальскому) | |||
Химический элемент | Недостаток – нижняя пороговая концентрация | Норма | Избыток – верхняя пороговая концентрация |
Кобальт | Меньше 2-7. Анемия, гипо- и авитоминоз В, эндемический зоб. | 7-30 | Более 30. Угнетение синтеза витамина В. |
Медь | Меньше 6-13. Анемия, заболевания костной системы. Невызревание злаков, суховершинность плодовых деревьев. | 13-60 | Более 60. |
Марганец | До 400. Заболевание костей, увеличение зоба. | 400-3000 | Более 3000. Заболевания костной системы. |
Цинк | До 30. Карликовый рост растений и животных. | 30-70 | Более 70. Угнетение окислительных процессов, анемия |
Молибден | До 1,5. Заболевания растений. | 1,5-4 | Более 4. Подагра у человека, молибденовый токсикоз у животных. |
Бор | Меньше 3-6. Отмирание точек роста стеблей и корней растений. | 6-30 | Более 30. Боровые поносы (энтериты) у животных. |
Стронций | Более 600. Уровская болезнь, рахит, ломкость костей. | ||
Йод | Менее 2-5. Эндемический зоб у людей | 5-40 | Более 40. Ослабление синтеза йодистых соединений щитовидной железы. |
Как пользоваться таблицей Менделеева? Для непосвященного человека читать таблицу Менделеева – всё равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева может рассказать о мире очень многое.
Помимо того, что сослужит вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
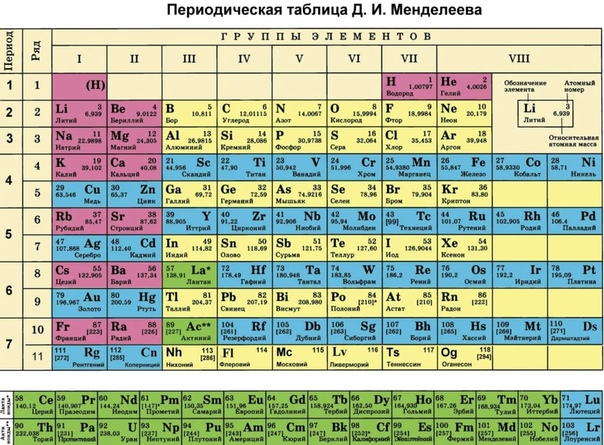
Современный вид таблицы Менделеева
Ниже приведем саму таблицу
Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды. В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.
- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.
Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс “Таблица Менделеева для чайников”. В завершение, предлагаем вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника. Именно поэтому, никогда не стоит забывать о студенческом сервисе , который с радостью поделится с вами своими знаниями и опытом.
Именно поэтому, никогда не стоит забывать о студенческом сервисе , который с радостью поделится с вами своими знаниями и опытом.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Короткая форма таблицы Д.И. Менделеева.
Полудлинный вариант таблицы Д.И. Менделеева.
Существует ещё и длинный вариант таблицы, он похож на полудлинный, но только лантаноиды и актиноиды не вынесены за пределы таблицы.
Оригинал таблицы Д. И. Менделеева
1. Период –химические элементы, расположенные в строчку (1 – 7)
Малые (1, 2, 3) – состоят из одного ряда элементов
Большие (4, 5, 6, 7) – состоят из двух рядов – чётного и нечётного
Периоды могут состоять из 2 (первый), 8 (второй и
третий), 18 (четвертый и пятый) или 32 (шестой) элементов.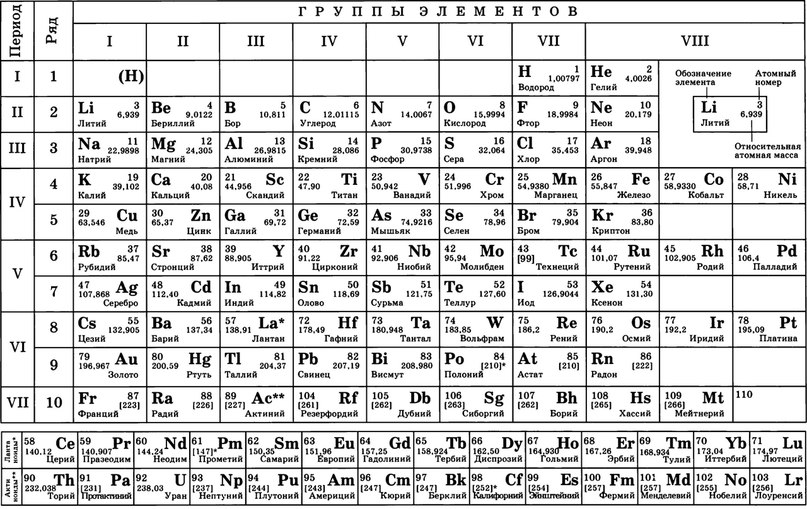 Последний, седьмой
период незавершен.
Последний, седьмой
период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом, а заканчиваются благородным газом.
Во всех периодах с увеличением относительных атомных масс элементов наблюдается усиление неметаллических и ослабление металлических свойств. В больших периодах переход свойств от активного металла к благородному газу происходит более медленно (через 18 и 32 элемента), чем в малых периодах (через 8 элементов). Кроме того, в малых периодах слева направо валентность в соединениях с кислородом возрастает от 1 до 7 (например, от Na до Cl ). В больших периодах вначале валентность возрастает от 1 до 8 (например, в пятом периоде от рубидия к рутению), затем происходит резкий скачок, и валентность уменьшается до 1 у серебра, потом снова возрастает.
2. Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные (А) и побочные подгруппы (Б).
Главные
подгруппы состоят из элементов малых и больших
периодов.
Побочные подгруппы состоят из элементов только больших периодов.
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме N, O , F ).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I – III групп (кроме бора) преобладают основные свойства, с IV по VIII – кислотные.
Группа | III | VII | VIII (кроме инертных газов) | |||||
Высший оксид | Э 2 О | ЭО | Э 2 О 3 | ЭО 2 | Э 2 О 5 | ЭО 3 | Э 2 О 7 | ЭО 4 |
Гидрат высшего оксида | ЭОН | Э(ОН) 2 | Э(ОН) 3 | Н 2 ЭО 3 | Н 3 ЭО 4 | Н 2 ЭО 4 | НЭО 4 | Н 4 ЭО 4 |
Для элементов главных подгрупп общими
являются формулы водородных соединений. Элементы главных подгрупп
I
–
III
групп образуют твердые вещества –
гидриды (водород в степени окисления – 1), а
IV
–
VII
групп – газообразные. Водородные
соединения элементов главных подгрупп
IV
группы (ЭН 4) – нейтральны,
V
группы (ЭН 3) –
основания,
VI и
VII групп (Н 2 Э и НЭ) – кислоты.
Элементы главных подгрупп
I
–
III
групп образуют твердые вещества –
гидриды (водород в степени окисления – 1), а
IV
–
VII
групп – газообразные. Водородные
соединения элементов главных подгрупп
IV
группы (ЭН 4) – нейтральны,
V
группы (ЭН 3) –
основания,
VI и
VII групп (Н 2 Э и НЭ) – кислоты.
На самом деле, немецкий физик Иоганн Вольфганг Доберейнер заметил особенности группирования элементов еще в 1817 году. В те дни химики еще не полностью поняли природу атомов, описанную Джона Дальтона в 1808 году. В своей «новой системе химической философии» Дальтон объяснил химические реакции, предполагая, что каждое элементарное вещество состоит из атома определенного типа.
Дальтон предположил, что химические реакции производили новые вещества, когда атомы разъединяются или соединяются. Он полагал, что любой элемент состоит исключительно из одного вида атома, который отличается от других по весу. Атомы кислорода весили в восемь раз больше, чем атомы водорода. Дальтон считал, что атомы углерода в шесть раз тяжелее водорода. Когда элементы объединяются для создания новых веществ, количество реагирующих веществ может быть рассчитано с учетом этих атомных весов.
Когда элементы объединяются для создания новых веществ, количество реагирующих веществ может быть рассчитано с учетом этих атомных весов.
Дальтон ошибался насчет некоторых масс – кислород в действительности в 16 раз тяжелее водорода, а углерод в 12 раз тяжелее водорода. Но его теория сделала идею об атомах полезной, вдохновив революцию в химии. Точное измерение атомной массы стало основной проблемой химиков на последующие десятилетия.
Размышляя об этих весах, Доберейнер отметил, что определенные наборы из трех элементов (он назвал их триадами) показывают интересную связь. Бром, например, имел атомную массу где-то между массами хлора и йода, и все эти три элемента демонстрировали сходное химическое поведение. Литий, натрий и калий также были триадой.
Другие химики заметили связи между атомными массами и , но лишь в 1860-х годах атомные массы стали достаточно хорошо поняты и измерены, чтобы выработалось более глубокое понимание. Английский химик Джон Ньюландс заметил, что расположение известных элементов в порядке увеличения атомной массы приводило к повторению химических свойств каждого восьмого элемента. Эту модель он назвал «законом октав» в статье 1865 года. Но модель Ньюландса не очень хорошо держалась после первых двух октав, что заставило критиков предложить ему расставить элементы в алфавитном порядке. И как вскоре понял Менделеев, отношение свойств элементов и атомных масс были чуть более сложными.
Эту модель он назвал «законом октав» в статье 1865 года. Но модель Ньюландса не очень хорошо держалась после первых двух октав, что заставило критиков предложить ему расставить элементы в алфавитном порядке. И как вскоре понял Менделеев, отношение свойств элементов и атомных масс были чуть более сложными.
Организация химических элементов
Менделеев родился в Тобольске, в Сибири, в 1834 году и был семнадцатым ребенком у своих родителей. Он жил яркой жизнью, преследуя разные интересы и путешествуя по дороге к выдающимся людям. Во время получения высшего образования в педагогическом институте в Санкт-Петербурге он чуть не умер от тяжелой болезни. После окончания он преподавал в средних школах (это нужно было, чтобы получать жалование в институте), попутно изучая математику и естественные науки для получения степени магистра.
Затем он работал преподавателем и лектором (и писал научные работы), пока не получил стипендию для расширенного тура исследований в лучших химических лабораториях Европы.
Вернувшись в Санкт-Петербург, он оказался без работы, поэтому написал превосходное руководство по в надежде выиграть крупный денежный приз. В 1862 году это принесло ему премию Демидова. Также он работал редактором, переводчиком и консультантом в различных химических сферах. В 1865 году он вернулся к исследованиям, получил доктора наук и стал профессором Петербургского университета.
Вскоре после этого Менделеев начал преподавать неорганическую химию. Готовясь освоить это новое (для него) поле, он остался неудовлетворен доступными учебниками. Поэтому решил написать собственный. Организация текста требовала организации элементов, поэтому вопрос их наилучшего расположения непрестанно был у него на уме.
К началу 1869 года Менделеев добился достаточного прогресса, чтобы понять, что некоторые группы подобных элементов демонстрировали регулярное увеличение атомных масс; другие элементы с примерно одинаковыми атомными массами имели схожие свойства. Оказалось, что упорядочение элементов по их атомному весу было ключом к их классификации.
Периодическая таблица Д. Менелеева.
По собственным словам Менделеева, он структурировал свое мышление, записав каждый из 63 известных тогда элементов на отдельной карточке. Затем, посредством своего рода игры в химический пасьянс, он нашел закономерность, которую искал. Располагая карточки в вертикальных столбцах с атомными массами от низкой к более высокой, он разместил элементы со схожими свойствами в каждом горизонтальном ряд. Периодическая таблица Менделеева родилась. Он набросал черновую версию 1 марта, отправил ее в печать и включил в свой учебник, который скоро должен был быть опубликован. Также он быстро подготовил работу для представления Российскому химическому обществу.
«Элементы, упорядоченные по размерам их атомных масс, показывают четкие периодические свойства», писал Менделеев в своей работе. «Все сравнения, которые я провел, привели меня к выводу, что размер атомной массы определяет природу элементов».
Тем временем, немецкий химик Лотар Мейер также работал над организацией элементов. Он подготовил таблицу, похожую на менделеевскую, возможно, даже раньше, чем Менделеев. Но Менделеев издал свою первым.
Он подготовил таблицу, похожую на менделеевскую, возможно, даже раньше, чем Менделеев. Но Менделеев издал свою первым.
Тем не менее, гораздо более важным, чем победа над Мейером, было то, как Менделеев использовал свою таблицу, чтобы сделать о неоткрытых элементах. В подготовке свой таблицы Менделеев заметил, что некоторых карточек недоставало. Он должен был оставить пустые места, чтобы известные элементы могли выровняться правильно. Еще при его жизни три пустых места были заполнены ранее неизвестными элементами: галлий, скандий и германий.
Менделеев не только предсказал существование этих элементов, но также правильно описал их свойства в подробностях. Галлий, например, открытый в 1875 году, имел атомную массу 69,9 и плотность в шесть раз превышающую воды. Менделеев предсказал этот элемент (он назвал его экаалюминий), только по этой плотности и атомной массе 68. Его прогнозы для экакремния близко соответствовали германию (открытому в 1886 году) по атомной массе (72 предсказано, 72,3 фактически) и плотности. Он также верно предсказал плотность германиевых соединений с кислородом и хлором.
Он также верно предсказал плотность германиевых соединений с кислородом и хлором.
Таблица Менделеева стала пророческой. Казалось, что в конце этой игры этот пасьян из элементов раскроет . При этом сам Менделеев был мастером в использовании своей же таблицы.
Успешные предсказания Менделеева принесли ему легендарный статус мастера химического волшебства. Но сегодня историки спорят о том, закрепило ли открытие предсказанных элементов принятие его периодического закона. Принятие закона могло быть в большей степени связано с его способностью объяснять установленные химические связи. В любом случае, прогностическая точность Менделеева, безусловно, привлекла внимание к достоинствам его таблицы.
К 1890-м годам химики широко признали его закон как веху в химическом познании. В 1900-м году будущий нобелевский лауреат по химии Уильям Рамсей назвал это «величайшим обобщением, которое когда-либо проводилось в химии». И Менделеев сделал это, сам не понимая как.
Математическая карта
Во многих случаях в истории науки великие предсказания, основанные на новых уравнениях, оказывались верными. Каким-то образом математика раскрывает некоторые природные секреты, прежде чем экспериментаторы их обнаружат. Один из примеров – антиматерия, другой – расширение Вселенной. В случае Менделеева, предсказания новых элементов возникли без какой-либо творческой математики. Но на самом деле Менделеев открыл глубокую математическую карту природы, поскольку его таблица отражала значение , математических правил, управляющих атомной архитектурой.
Каким-то образом математика раскрывает некоторые природные секреты, прежде чем экспериментаторы их обнаружат. Один из примеров – антиматерия, другой – расширение Вселенной. В случае Менделеева, предсказания новых элементов возникли без какой-либо творческой математики. Но на самом деле Менделеев открыл глубокую математическую карту природы, поскольку его таблица отражала значение , математических правил, управляющих атомной архитектурой.
В своей книге Менделеев отметил, что «внутренние различия материи, которую составляют атомы», могут быть ответственны за периодически повторяющиеся свойства элементов. Но он не придерживался этой линии мышления. По сути, многие годы он размышлял о том, насколько важна атомная теория для его таблицы.
Но другие смогли прочитать внутреннее послание таблицы. В 1888 году немецкий химик Йоханнес Вислицен объявил, что периодичность свойств элементов, упорядоченных по массе, указывает на то, что атомы состоят из регулярных групп более мелких частиц. Таким образом, в некотором смысле таблица Менделеева действительно предвидела (и предоставила доказательства) сложную внутреннюю структуру атомов, в то время как никто не имел ни малейшего представления о том, как на самом деле выглядел атом или имел ли он какую-нибудь внутреннюю структуру вовсе.
Таким образом, в некотором смысле таблица Менделеева действительно предвидела (и предоставила доказательства) сложную внутреннюю структуру атомов, в то время как никто не имел ни малейшего представления о том, как на самом деле выглядел атом или имел ли он какую-нибудь внутреннюю структуру вовсе.
К моменту смерти Менделеева в 1907 году ученые знали, что атомы делятся на части: , плюс некоторый положительно заряженный компонент, делающий атомы электрически нейтральными. Ключом к тому, как эти части выстраиваются, стало открытие 1911 года, когда физик Эрнест Резерфорд, работающий в Манчестерском университете в Англии, обнаружил атомное ядро. Вскоре после этого Генри Мозли, работавший с Резерфордом, продемонстрировал, что количество положительного заряда в ядре (число протонов, которое он содержит, или его «атомное число») определяет правильный порядок элементов в периодической таблице.
Генри Мозли.
Атомная масса была тесно связана с атомным числом Мозли – достаточно тесно, чтобы упорядочение элементов по массе только в нескольких местах отличалось от упорядочения по числу. Менделеев настаивал на том, что эти массы были неправильными и нуждались в повторном измерении, и в некоторых случаях оказался прав. Осталось несколько расхождений, но атомное число Мозли прекрасно легло в таблицу.
Менделеев настаивал на том, что эти массы были неправильными и нуждались в повторном измерении, и в некоторых случаях оказался прав. Осталось несколько расхождений, но атомное число Мозли прекрасно легло в таблицу.
Примерно в то же время датский физик Нильс Бор понял, что квантовая теория определяет расположение электронов, окружающих ядро, и что самые дальние электроны определяют химические свойства элемента.
Подобные расположения внешних электронов будут периодически повторяться, объясняя закономерности, которые первоначально выявила таблица Менделеева. Бор создал свою собственную версию таблицы в 1922 году, основываясь на экспериментальных измерениях энергий электронов (наряду с некоторыми подсказками из периодического закона).
Таблица Бора добавила элементы, открытые с 1869 года, но это был тот же периодической порядок, открытый Менделеевым. Не имея ни малейшего представления о , Менделеев создал таблицу, отражающую атомную архитектуру, которую диктовала квантовая физика.
Новая таблица Бора не стала ни первым, ни последним вариантом изначального дизайна Менделеева. Сотни версий периодической таблицы с тех пор были разработаны и опубликованы. Современная форма – в горизонтальном дизайне в отличие от первоначальной вертикальной версии Менделеева – стала широко популярной только после Второй мировой войны, во многом благодаря работе американского химика Гленна Сиборга.
Сиборг и его коллеги создали несколько новых элементов синтетически, с атомными числами после урана, последнего природного элемента в таблице. Сиборг увидел, что эти элементы, трансурановые (плюс три элемента, предшествовавшие урану), требовали новой строки в таблице, которую не предвидел Менделеев. Таблица Сиборга добавила строку для тех элементов под аналогичным рядом редкоземельных элементов, которым тоже не было места в таблице.
Вклад Сиборг в химию принес ему честь назвать собственный элемент – сиборгий с номером 106. Это один из нескольких элементов, названных в честь известных ученых. И в этом списке, конечно, есть элемент 101, открытый Сиборгом и его коллегами в 1955 году и названный менделевием – в честь химика, который прежде всех остальных заслужил место в периодической таблице.
И в этом списке, конечно, есть элемент 101, открытый Сиборгом и его коллегами в 1955 году и названный менделевием – в честь химика, который прежде всех остальных заслужил место в периодической таблице.
Заходите на наш канал с новостями , если хотите больше подобных историй.
Таблица Менделеева. Растворимость солей (А4) | ISBN: 254245
Аннотация
Двусторонняя таблица, формат А4
Дополнительная информация
| Регион (Город / Страна где издана): | Минск |
| Год публикации: | 2017 |
| Тираж: | |
| Страниц: | |
| Ширина издания: | 210 |
| Высота издания: | 295 |
Вес в гр. : : | 13 |
| Статья публикации: | Русский |
| Тип обложки: | Мягкий / Полужесткий переплет |
| Цвета обложки: | Белый |
| Полный список указанных в издании: |
Таблица Менделеева, таблица растворимости (двустор) А4 ламиниров
Выберите категорию:
Все
Аниме товары »К-POP »Тетради Аниме »Пеналы Аниме »Блокноты Аниме »Ручки Аниме »Наклейки Аниме А4 »Наклейки Аниме А5 »Аниме Кружки »Аниме Значки »Наклейки Аниме А3 »Наклейки Аниме мини »Пеналы Аниме 2 отд »Нашивки Аниме »Заколки Аниме »Магниты Аниме »Теплые наушники »Ободки Кошачьи ушки »Обложки на паспорт Аниме »Обложки на студенческий Аниме »Маски »Наборы закладок Аниме »Раскраски А4 Аниме »Попсокет »Наушники »Рюкзаки »Веера »Карты игральные »Плакаты Сувениры и собственное производство »Сублимация »» Маски с принтом »» Пазлы »Бейджи »Брелоки »Новогодние сувениры »Шкатулки »Копилки »Линейки Именные »Магниты »Обереги »Расчески »Салфетницы »Светильники Канцелярские принадлежности »Бумажная продукция »» Тетради »» Цветная бумага и картон »» Блоки для записи »» Блокноты и ежедневники »» Офисная бумага »» Ватманы и спец. бумага »» Расписания »» Дневники »» Бумага для рисования »Бэйджи »Глобусы »Дыроколы »Доски магнитные »Зажимы »Закладки »Калькуляторы »Клей и суперклей »Корректоры »Кнопки »Корзины для бумаг »Ножницы и ножи »Органайзеры и стаканы »Пишущие принадлежности »» Ручки »» Карандаши простые »» Стержни »» Маркеры »» »Текстовыделители »Папки и системы архиваций »» Лотки для бумаг »» Мультифоры (файлы) »» Короба архивные »» Папки и скоросшиватели картонные »» Папки пластиковые »» »Папки с мультифорами »» »Скоросшиватели »» »Папка-конверт »» »Папки с кольцами »» »Папки-планшеты »» »Папки на молнии »» »Папка-уголок »» »Портфели »» Папки регистраторы »Скрепки »Степлеры »» Скобы »Скотчи »Светоотражающие товары »Товары для школы »» Пеналы »» Сумки для обуви »» Обложки »» »Обложки на документы »» Портфолио »» Фартуки и клеенки для труда »» В помощь первокласснику »» Папки для труда и тетрадей »» Мел »» Подставки для книг »» Наглядные пособия »Товары для торговли »Товары для лепки »» Пластилин »» Инструменты для лепки »Чертежные пренадлежности »» Ластики »» Линейки »» Точилки »» Циркули и готовальни »» Тубусы »Резинки банковские »Штемпельная продукция Товары для детского творчества »Игрушки »» Пазлы »» Книжки »» Наклейки Разное Услуги печати документов Фототовары Товары для рисования »Карандаши цветные »Фломастеры »Краски акварельные и гуашь »Непроливайки »Кисти »Палитры »Краски акриловые
бумага »» Расписания »» Дневники »» Бумага для рисования »Бэйджи »Глобусы »Дыроколы »Доски магнитные »Зажимы »Закладки »Калькуляторы »Клей и суперклей »Корректоры »Кнопки »Корзины для бумаг »Ножницы и ножи »Органайзеры и стаканы »Пишущие принадлежности »» Ручки »» Карандаши простые »» Стержни »» Маркеры »» »Текстовыделители »Папки и системы архиваций »» Лотки для бумаг »» Мультифоры (файлы) »» Короба архивные »» Папки и скоросшиватели картонные »» Папки пластиковые »» »Папки с мультифорами »» »Скоросшиватели »» »Папка-конверт »» »Папки с кольцами »» »Папки-планшеты »» »Папки на молнии »» »Папка-уголок »» »Портфели »» Папки регистраторы »Скрепки »Степлеры »» Скобы »Скотчи »Светоотражающие товары »Товары для школы »» Пеналы »» Сумки для обуви »» Обложки »» »Обложки на документы »» Портфолио »» Фартуки и клеенки для труда »» В помощь первокласснику »» Папки для труда и тетрадей »» Мел »» Подставки для книг »» Наглядные пособия »Товары для торговли »Товары для лепки »» Пластилин »» Инструменты для лепки »Чертежные пренадлежности »» Ластики »» Линейки »» Точилки »» Циркули и готовальни »» Тубусы »Резинки банковские »Штемпельная продукция Товары для детского творчества »Игрушки »» Пазлы »» Книжки »» Наклейки Разное Услуги печати документов Фототовары Товары для рисования »Карандаши цветные »Фломастеры »Краски акварельные и гуашь »Непроливайки »Кисти »Палитры »Краски акриловые
Производитель:
ВсеБренд 1Бренд 10Бренд 100Бренд 101Бренд 102Бренд 103Бренд 104Бренд 105Бренд 106Бренд 107Бренд 108Бренд 109Бренд 11Бренд 110Бренд 111Бренд 112Бренд 113Бренд 114Бренд 115Бренд 116Бренд 12Бренд 13Бренд 14Бренд 15Бренд 16Бренд 17Бренд 18Бренд 19Бренд 2Бренд 20Бренд 21Бренд 22Бренд 23Бренд 24Бренд 25Бренд 26Бренд 27Бренд 28Бренд 29Бренд 3Бренд 30Бренд 31Бренд 32Бренд 33Бренд 34Бренд 35Бренд 36Бренд 37Бренд 38Бренд 39Бренд 4Бренд 40Бренд 41Бренд 42Бренд 43Бренд 44Бренд 45Бренд 46Бренд 47Бренд 48Бренд 49Бренд 5Бренд 50Бренд 51Бренд 52Бренд 53Бренд 54Бренд 55Бренд 56Бренд 57Бренд 58Бренд 59Бренд 6Бренд 60Бренд 61Бренд 62Бренд 63Бренд 64Бренд 65Бренд 66Бренд 67Бренд 68Бренд 69Бренд 7Бренд 70Бренд 71Бренд 72Бренд 73Бренд 74Бренд 75Бренд 76Бренд 77Бренд 78Бренд 79Бренд 8Бренд 80Бренд 81Бренд 82Бренд 83Бренд 84Бренд 85Бренд 86Бренд 87Бренд 88Бренд 89Бренд 9Бренд 90Бренд 91Бренд 92Бренд 93Бренд 94Бренд 95Бренд 96Бренд 97Бренд 98Бренд 99
Новинка:
Вседанет
Спецпредложение:
Вседанет
Результатов на странице:
5203550658095
Найти
ТАБЛИЦА МЕНДЕЛЕЕВА / РАСТВОРИМОСТЬ СОЛЕЙ А4 2019 Формат: А4.
ТАБЛИЦА МЕНДЕЛЕЕВА / РАСТВОРИМОСТЬ СОЛЕЙ А4 2019 Формат: А4. | Художественная литератураВы выключили JavaScript. Для правильной работы сайта необходимо включить его в настройках.
0,04 10100210 в
Смотрите также
Владивосток
84 р.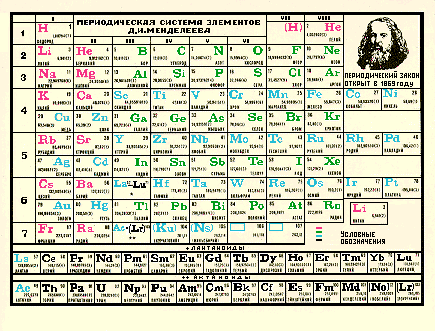
4 заказа
Подруга, как всегда, подбросила проблему – попросила на время приютить ее папу и маленькую собачку…
Менее 6шт.
Владивосток
76 р.
3 заказа
Даше Васильевой фатально не везет. Андрей Локтев, главный редактор «Желтухи» сообщил: в редакцию яв…
Менее 8шт.
Владивосток
60 р.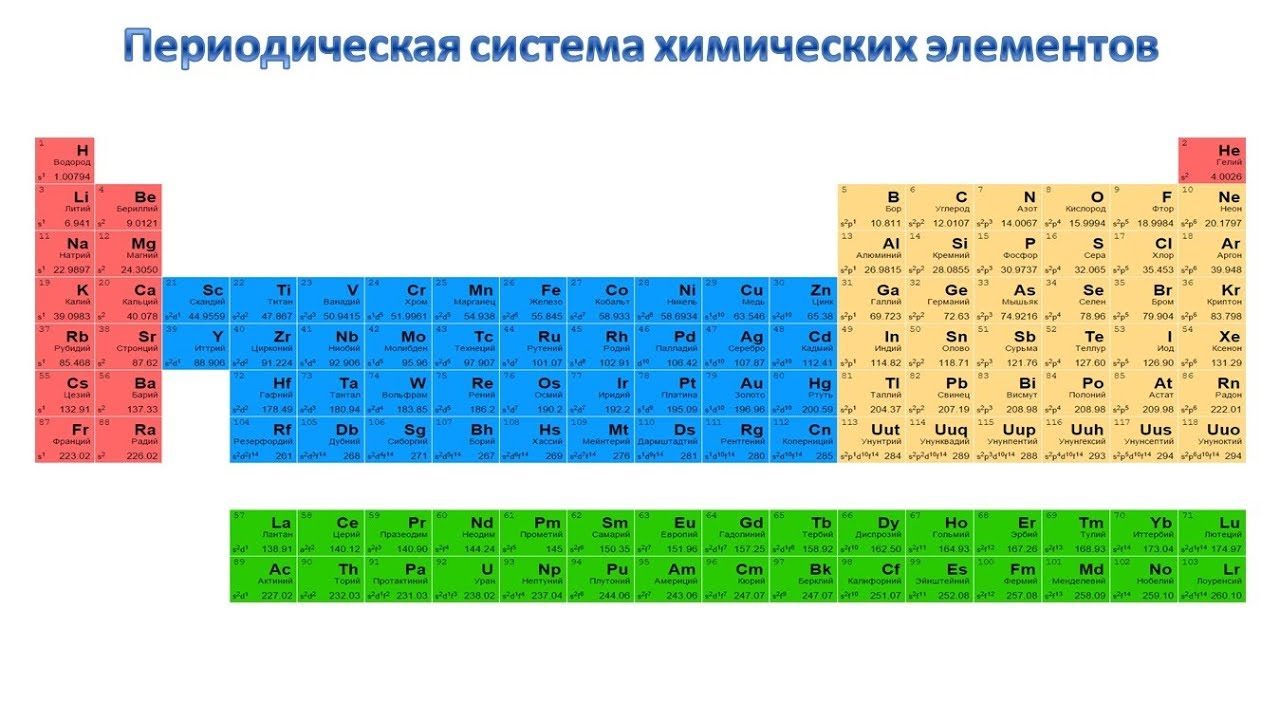
3 заказа
Когда она пришла к гадалке и та предсказала ей встречу с т…
Менее 47шт.
Владивосток
51 р.
2 заказа
1996 год. Журналист областной газеты приезжает в северный поселок, чтобы написать о загадочном месте…
Менее 6шт.
Владивосток
61 р.
4 заказа
Наша книга поможет вам спланировать семейный бюджет. Записывайте ваши доходы и расходы каждый день…
Менее 30шт.
Владивосток
45,36 р.
5 заказов
Мини-тренажёр – это новая оригинальная форма учебного пособия, способствующего эффективному овладен…
Менее 11шт.
Владивосток
67 р.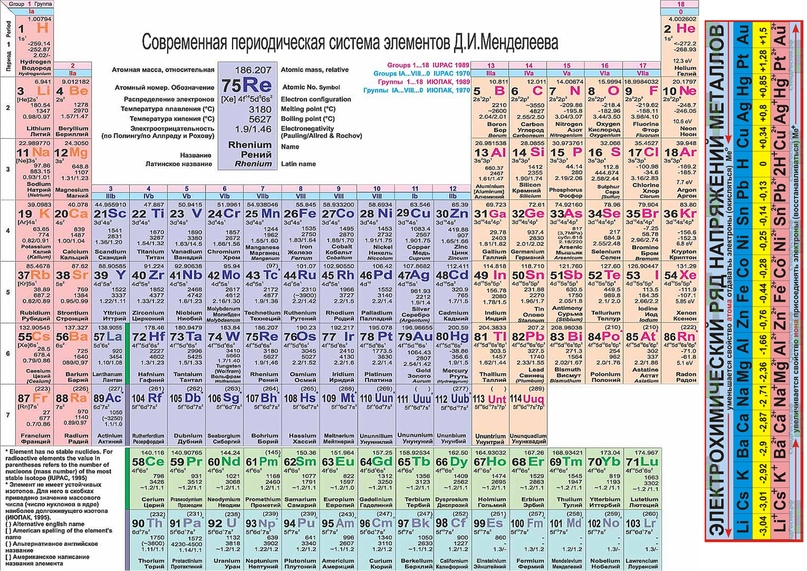
2 заказа
Триллер с уникальной женщиной в главной роли. Она – импульсивная и жестокая мстительница. Она – зол…
Менее 28шт.
Владивосток
49,14 р.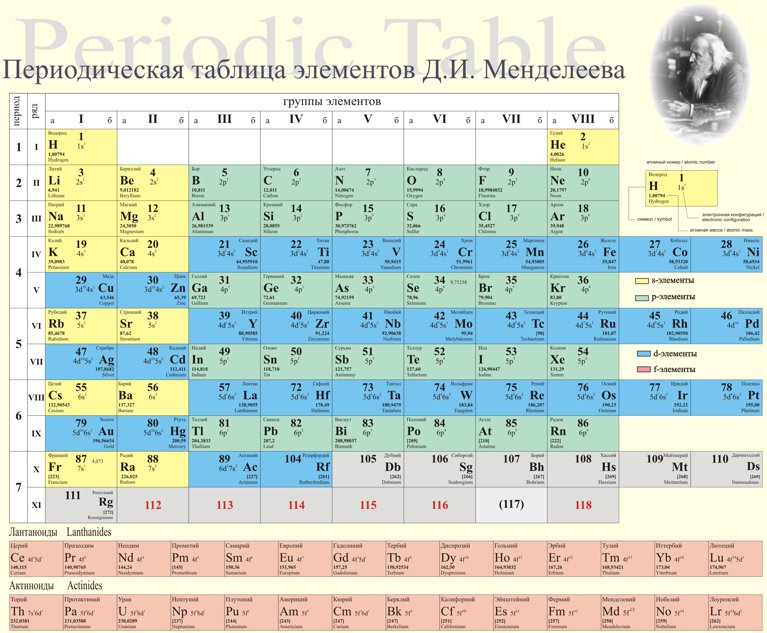
2 заказа
Это не просто тома с рецептами. Здесь масса информации о странах и их традициях – не только кулинар…
Достаточно
Владивосток
77 р.
3 заказа
Так и хочется воскликнуть: “Господи, избавь меня от родственников, а с врагами я как-нибудь сам раз…
”Менее 22шт.
Владивосток
23,94 р.
3 заказа
Снежная королева – прекрасная сказка великого датского сказочника Ганса Христиана Андерсена о насто…
Достаточно
Владивосток
25,20 р.
4 заказа
Сканворды, кроссворды, ребусы, шарады_x005F_x000D__x000D_ Самые классные головоломки для мальчишек…
Менее 10шт.
Владивосток
87 р.
3 заказа
Каждый выпуск этой серии приложение с зафиксированным в герметичной упаковке…
Достаточно
Владивосток
27,72 р.
2 заказа
Увлекательная школа вязания на спицах и крючком в одном журнале! Каждый выпуск _x005F_x000D__x000D_…
Менее 17шт.
Владивосток
66 р.
2 заказа
В новый сборник Виктора Мережко вошли две повести “Круглая дура Надя Круглова” и “Найти мужа Дарье…
Менее 31шт.
Владивосток
61 р.
2 заказа
Захватывающие истории на фактическом медицинском материале, написанные практикующим доктором._x000D…
Менее 15шт.
Владивосток
45,36 р.
2 заказа
Бизнесмен Никита Радецкий безумно любил свою жену, красавицу и умницу. Казалось, Габриэлла тоже душ…
Менее 6шт.
Владивосток
104 р.
1 заказ
Кражу иконы из захолустной церкви церкви можно было бы отнести к заурядным преступлениям. Если бы…
Менее 6шт.
Владивосток
87 р.
1 заказ
Искусство Японии представляет собой бесконечное воспевание природы, ее изменчивости и эфемерности…
Менее 81шт.
Владивосток
81 р.
2 заказа
Маргарита не думала, что из скучающей домохозяйки превратится в угрюмую униженную зечку. Ей предсто…
Менее 20шт.
Владивосток
52 р.
1 заказ
Наконец-то Римме, бессменному секретарю частного детектива Паши Синичкина, выпал шанс проявить себя…
Менее 30шт.
Владивосток
89 р.
2 заказа
“Сделай татуировку – и твоя жизнь изменится!” – обещал рекламный плакат. Саша, обычная девушка-студ…
Менее 19шт.
Владивосток
26,46 р.
2 заказа
Случилось давным-давно, когда у слонов и хобота-то никакого не было, а был только маленький-маленький…
Достаточно
Владивосток
36,54 р.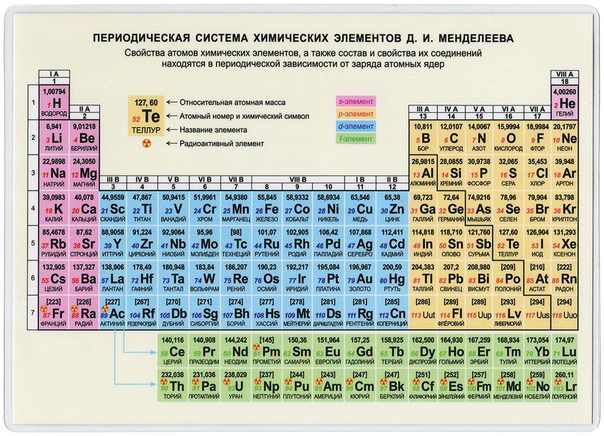
2 заказа
Журнал, который служит надежным источником полезной информации о продуктах питания и с…
Менее 84шт.
Владивосток
36,54 р.
2 заказа
Журнал, который служит надежным источником полезной информации о продуктах питания и с…
Менее 181шт.
Владивосток
53 р.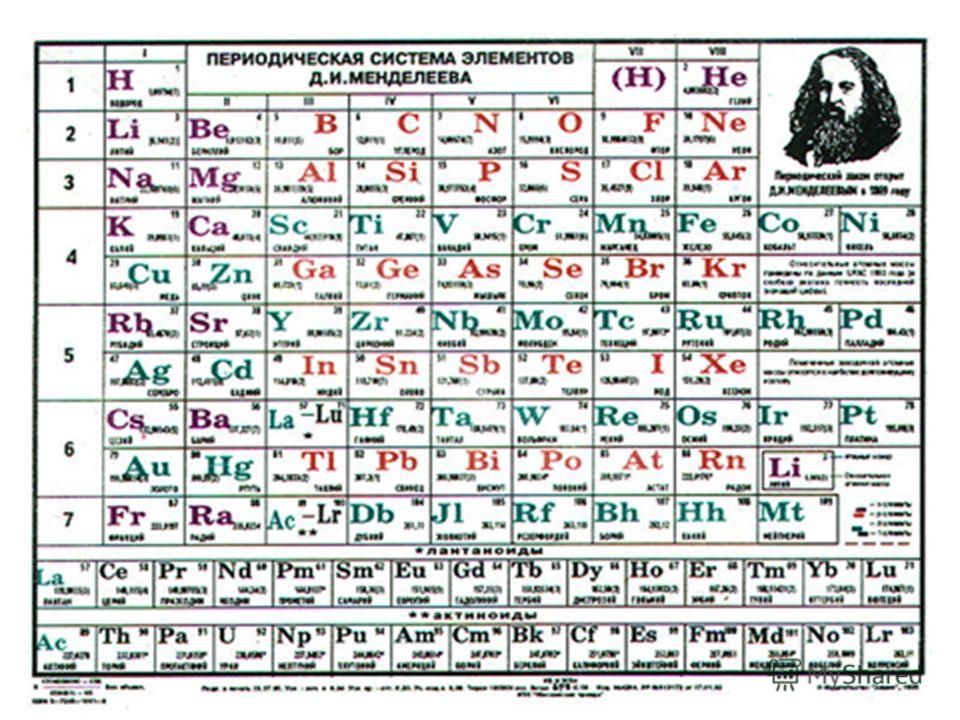
2 заказа
Сказка «Карлик Нос» – самое известное произведение замечательного немецкого сказочника Вильгельма Г…
Достаточно
Владивосток
53 р.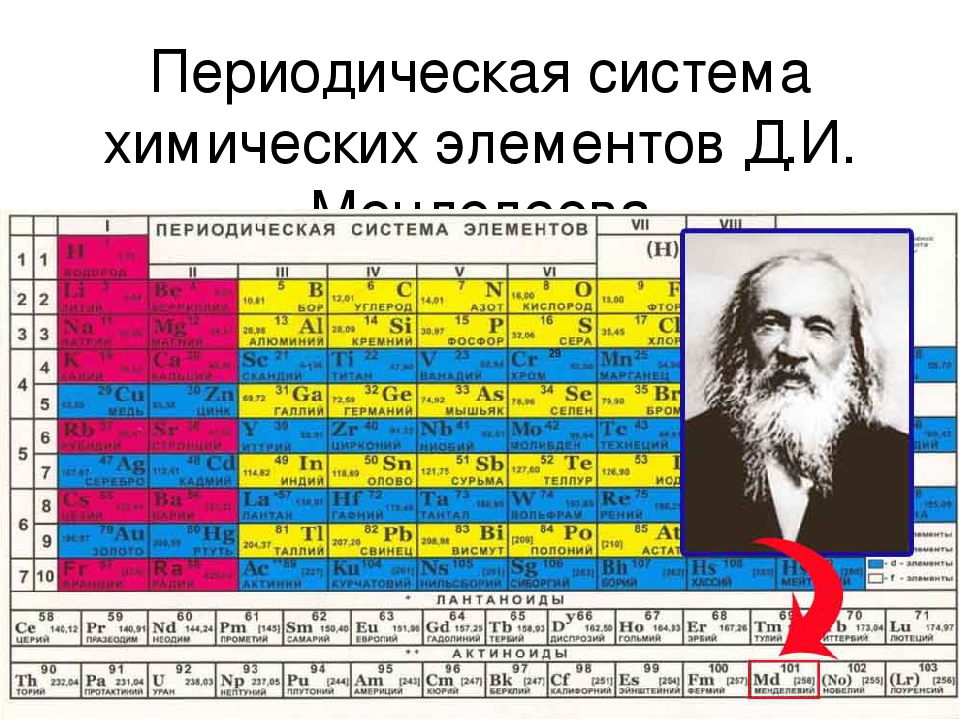
2 заказа
Однажды бедный дровосек нашел заверенного в расшитый звездами плащ ребёнка и принес его домой. Прош…
Достаточно
Владивосток
26,46 р.
2 заказа
Сюжет сказки “Аленький цветочек”: Попросила батюшку младшая, любимая дочь Настенька привезти ей из…
Достаточно
Владивосток
15,12 р.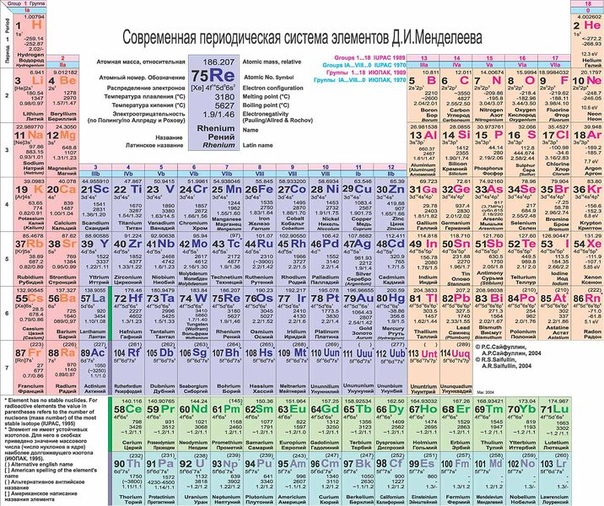
2 заказа
Дарья. Биография – захватывающие и неординарные истории о судьбах известных людей, чьи имена стали…
Менее 22шт.
Владивосток
55 р.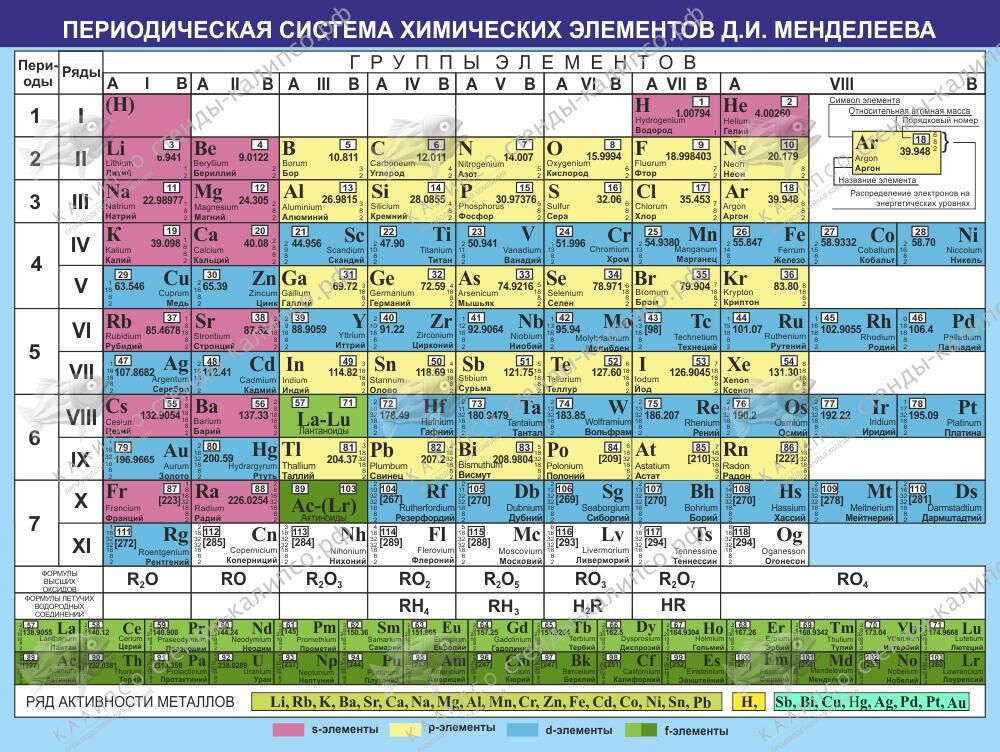
2 заказа
В контейнере товарного поезда найдет труп молодой женщины. На теле никаких признаков насилия – смерть…
Менее 54шт.
Владивосток
61 р.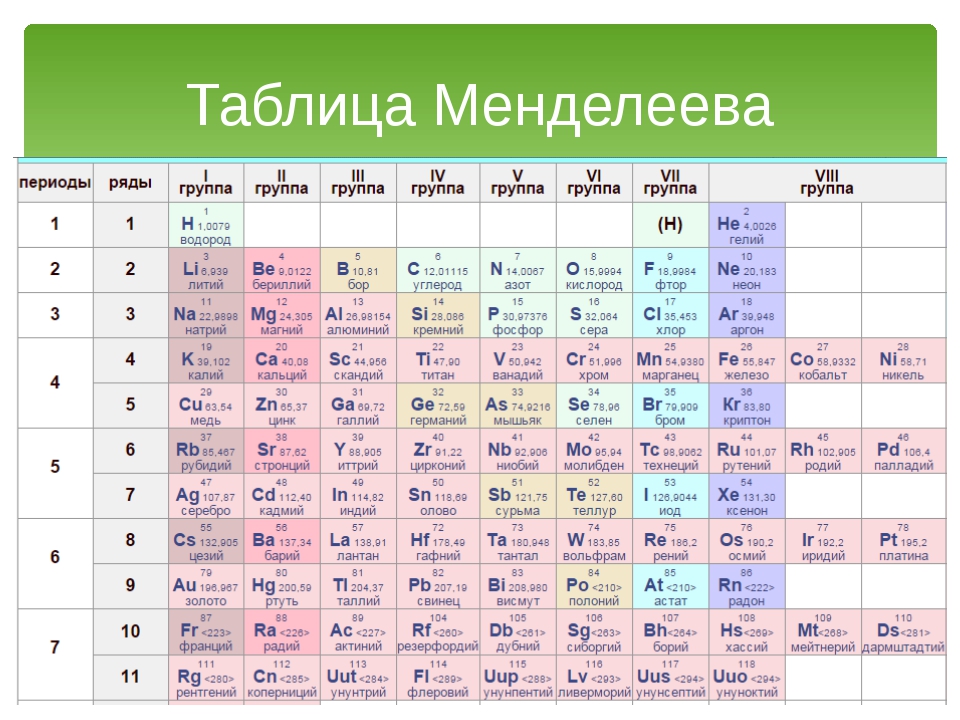
2 заказа
Наша книга поможет вам спланировать семейный бюджет. Записывайте ваши доходы и расходы каждый день…
Менее 23шт.
Владивосток
147 р.
2 заказа
На открытия великого ученого Дмитрия Менделеева построена вся современная химия. Но немногие знают…
Менее 41шт.
Владивосток
28,98 р.
2 заказа
Кулинарный журнал для всех любителей и ценический журнал домашней пищи. В журнале не менее 65 рецептов блюд…
Менее 164шт.
Владивосток
30,24 р.
2 заказа
Владивосток
46,62 р.
6 заказов
Мини-тренажёр – это новая оригинальная форма учебного пособия, способствующего эффективному овладен…
Менее 41шт.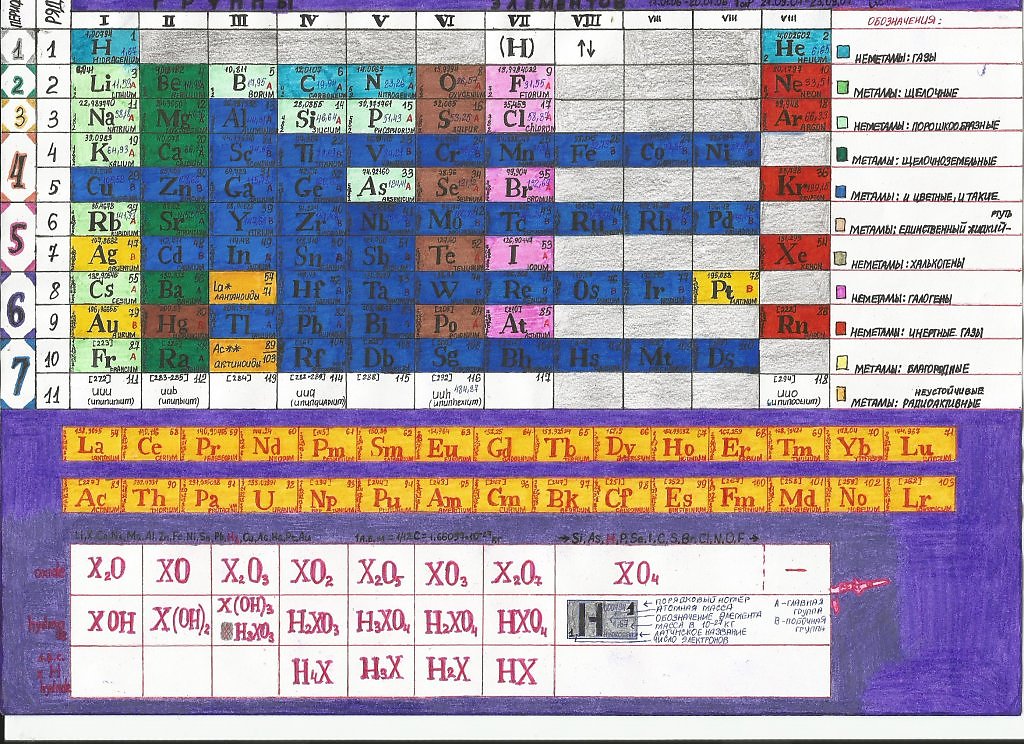
Владивосток
65 р.
3 заказа
В пособии приведены примеры написания букв, их элементы, прописи для упражнений по отработке навыка…
Менее 24шт.
Владивосток
274 р.
2 заказа
Продолжение приключений, где Солнышкин проходит школу настоящего моряка и открывает новые земли.
Менее 3шт.
Владивосток
11,34 р.
2 заказа
Вашему вниманию предлагается русская народная сказка “Царевна Несмеяна”. Для детей дошкольного возр…
Менее 177шт.
Владивосток
11,34 р.
2 заказа
Утопия, наконец ставшая реальность! Нанотехнологии и геномика на самом деле изменили мир. Нет ни а…
Достаточно
Владивосток
70 р.
2 заказа
Раскраска увеличенного формата с большим сюжетов для раскрашивания. В серии выходят под…
Менее 6шт.
Владивосток
75 р.
2 заказа
Татьяна Садовникова отправляется на воду, в шикарный санаторий в Карловых Варах. Всё ей там нравитс…
Менее 13шт.
Мы используем метаданные (файлы cookie, данные об IP-адресе и новое) для функционирования сайта. Продолжая пользоваться нашим сайтом, вы соглашаетесь с использованием метаданных Закрыть .
 Растворимость солей (А4) | ISBN: 254245
Растворимость солей (А4) | ISBN: 254245

 Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.
Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.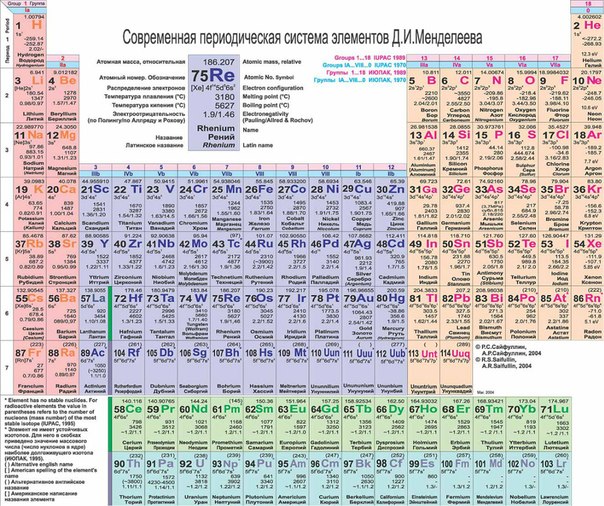 Поражение печени, анемия, желтуха.
Поражение печени, анемия, желтуха.