Валентность химических элементов (Таблица)
Валентность химических элементов – это способность у атомов хим. элементов образовывать некоторое число химических связей. Принимает значения от 1 до 8 и не может быть равна 0. Определяется числом электронов атома затраченых на образование хим. связей с другим атомом. Валентность это реальная величина. Обозначается римскими цифрами (I ,II, III, IV, V, VI, VII, VIII).
Как можно определить валентность в соединениях:
— Валентность водорода (H) постоянна всегда 1. Отсюда в соединении H2O валентность O равна 2.
— Валентность кислорода (O) постоянна всегда 2. Отсюда в соединении СО2 валентность С равно 4.
— Высшая валентность всегда равна № группы.
— Низшая валентность равна разности между числом 8 (количество групп в Таблице Менделеева) и номером группы, в которой находится элемент.
— У металлов в подгруппах А таблицы Менделеева, валентность = № группы.
— У неметаллов обычно две валентности: высшая и низшая.
Валентность химических элементов может быть постоянной и переменной. Постоянная в основном у металлов главных подгрупп, переменная у неметаллов и металлов побочных подгруп.
Таблица валентности химических элементов
|
Атомный № |
Химический элемент |
Символ |
Валентность химических элементов |
Примеры соединений |
|
1 |
Водород / Hydrogen |
H |
I |
HF |
|
2 |
Гелий / Helium |
He |
отсутствует |
— |
|
3 |
Литий / Lithium |
Li |
I |
Li2O |
|
|
Бериллий / Beryllium |
Be |
II |
BeH2 |
|
5 |
Бор / Boron |
B |
III |
BCl3 |
|
6 |
Углерод / Carbon |
C |
IV, II |
CO2, CH4 |
|
7 |
Азот / Nitrogen |
N |
I, II, III, IV |
NH3 |
|
8 |
Кислород / Oxygen |
O |
II |
H2O, BaO |
|
9 |
Фтор / Fluorine |
F |
I |
HF |
|
10 |
Неон / Neon |
Ne |
отсутствует |
— |
|
11 |
Натрий / Sodium |
Na |
I |
Na2O |
|
12 |
Магний / Magnesium |
Mg |
II |
MgCl2 |
|
13 |
Алюминий / Aluminum |
Al |
III |
Al2O3 |
|
14 |
Кремний / Silicon |
Si |
IV |
SiO2, SiCl4 |
|
15 |
Фосфор / Phosphorus |
P |
III, V |
PH3, P2O5 |
|
16 |
Сера / Sulfur |
S |
VI, IV, II |
H2S, SO3 |
|
17 |
Хлор / Chlorine |
Cl |
I, III, V, VII |
HCl, ClF3 |
|
18 |
Аргон / Argon |
Ar |
отсутствует |
— |
|
19 |
Калий / Potassium |
K |
I |
KBr |
|
20 |
Кальций / Calcium |
Ca |
II |
CaH2 |
|
21 |
Скандий / Scandium |
Sc |
III |
Sc2S3 |
|
22 |
Титан / Titanium |
Ti |
II, III, IV |
Ti2O3, TiH4 |
|
23 |
Ванадий / Vanadium |
V |
II, III, IV, V |
VF5, V2O3 |
|
24 |
Хром / Chromium |
Cr |
II, III, VI |
CrCl2, CrO3 |
|
25 |
Марганец / Manganese |
Mn |
II, III, IV, VI, VII |
Mn2O7, Mn2(SO4)3 |
|
26 |
Железо / Iron |
Fe |
II, III |
FeSO4, FeBr3 |
|
27 |
Кобальт / Cobalt |
Co |
II, III |
CoI2, Co2S3 |
|
28 |
Никель / Nickel |
Ni |
II, III, IV |
NiS, Ni(CO)4 |
29 |
Медь / Copper |
Сu |
I, II |
CuS, Cu2O |
|
30 |
Цинк / Zinc |
Zn |
II |
ZnCl2 |
|
31 |
Галлий / Gallium |
Ga |
III |
Ga(OH)3 |
|
32 |
Германий / Germanium |
Ge |
II, IV |
GeBr4, Ge(OH)2 |
|
33 |
Мышьяк / Arsenic |
As |
III, V |
As2S5, H3AsO4 |
|
34 |
Селен / Selenium |
Se |
II, IV, VI, |
H2SeO3 |
|
35 |
Бром / Bromine |
Br |
I, III, V, VII |
HBrO3 |
|
36 |
Криптон / Krypton |
Kr |
VI, IV, II |
KrF2, BaKrO4 |
|
37 |
Рубидий / Rubidium |
Rb |
I |
RbH |
|
38 |
Стронций / Strontium |
Sr |
II |
SrSO4 |
|
39 |
Иттрий / Yttrium |
Y |
III |
Y2O3 |
|
40 |
Цирконий / Zirconium |
Zr |
II, III, IV |
ZrI4, ZrCl2 |
|
41 |
Ниобий / Niobium |
Nb |
|
NbBr5 |
|
42 |
Молибден / Molybdenum |
Mo |
II, III, IV, V, VI |
Mo2O5, MoF6 |
|
43 |
Технеций / Technetium |
Tc |
I — VII |
Tc2S7 |
|
44 |
Рутений / Ruthenium |
Ru |
II — VIII |
RuO4, RuF5, RuBr3 |
|
45 |
Родий / Rhodium |
Rh |
I, II, III, IV, V |
RhS, RhF3 |
|
46 |
Палладий / Palladium |
Pd |
I, II, III, IV |
Pd2S, PdS2 |
|
47 |
Серебро / Silver |
Ag |
I, II, III |
AgO, AgF2, AgNO3 |
|
48 |
Кадмий / Cadmium |
Cd |
II |
CdCl2 |
|
49 |
Индий / Indium |
In |
III |
In2O3 |
|
50 |
Олово / Tin |
Sn |
II, IV |
SnBr4, SnF2 |
|
51 |
Сурьма / Antimony |
Sb |
III, V |
SbF5, SbH3 |
|
52 |
Теллур / Tellurium |
Te |
VI, IV, II |
TeH2, H6TeO6 |
|
53 |
Иод / Iodine |
I |
I, III, V, VII |
HIO3, HI |
|
54 |
Ксенон / Xenon |
Xe |
II, IV, VI, VIII |
XeF6, XeO4, XeF2 |
|
55 |
Цезий / Cesium |
Cs |
I |
CsCl |
|
56 |
Барий / Barium |
Ba |
II |
Ba(OH)2 |
|
57 |
Лантан / Lanthanum |
La |
III |
LaH3 |
|
58 |
Церий / Cerium |
Ce |
III, IV |
CeO2 , CeF3 |
|
59 |
Празеодим / Praseodymium |
Pr |
III, IV |
PrF4, PrO2 |
|
60 |
Неодим / Neodymium |
Nd |
III |
Nd2O3 |
|
61 |
Прометий / Promethium |
Pm |
III |
Pm2O3 |
|
62 |
Самарий / Samarium |
Sm |
II, III |
SmO |
|
63 |
Европий / Europium |
Eu |
II, III |
EuSO4 |
|
64 |
Гадолиний / Gadolinium |
Gd |
III |
GdCl3 |
|
65 |
Тербий / Terbium |
Tb |
III, IV |
TbF4, TbCl3 |
|
66 |
Диспрозий / Dysprosium |
Dy |
III |
Dy2O3 |
|
67 |
Гольмий / Holmium |
Ho |
III |
Ho2O3 |
|
68 |
Эрбий / Erbium |
Er |
III |
Er2O3 |
|
69 |
Тулий / Thulium |
Tm |
II, III |
Tm2O3 |
|
70 |
Иттербий / Ytterbium |
Yb |
II, III |
YO |
|
71 |
Лютеций / Lutetium |
Lu |
III |
LuF3 |
|
72 |
Гафний / Hafnium |
Hf |
II, III, IV |
HfBr3, HfCl4 |
|
73 |
Тантал / Tantalum |
Ta |
I — V |
TaCl5, TaBr2, TaCl4 |
|
74 |
Вольфрам / Tungsten |
W |
II — VI |
WBr6, Na2WO4 |
|
75 |
Рений / Rhenium |
Re |
I — VII |
Re2S7, Re2O5 |
|
76 |
Осмий / Osmium |
Os |
II — VI, VIII |
OsF8, OsI2, Os2O3 |
|
77 |
Иридий / Iridium |
Ir |
I — VI |
IrS3, IrF4 |
|
78 |
Платина / Platinum |
Pt |
I, II, III, IV, V |
Pt(SO4)3, PtBr4 |
|
79 |
Золото / Gold |
Au |
I, II, III |
AuH, Au2O3, Au2Cl6 |
|
80 |
Ртуть / Mercury |
Hg |
II |
HgF2, HgBr2 |
|
81 |
Талий / Thallium |
Tl |
I, III |
TlCl3, TlF |
|
82 |
Свинец / Lead |
Pb |
II, IV |
PbS, PbH4 |
|
83 |
Висмут / Bismuth |
Bi |
III, V |
BiF5, Bi2S3 |
|
84 |
Полоний / Polonium |
Po |
VI, IV, II |
PoCl4, PoO3 |
|
85 |
Астат / Astatine |
At |
нет данных |
— |
|
86 |
Радон / Radon |
Rn |
отсутствует |
— |
|
87 |
Франций / Francium |
Fr |
I |
— |
|
88 |
Радий / Radium |
Ra |
II |
RaBr2 |
|
89 |
Актиний / Actinium |
Ac |
III |
AcCl3 |
|
90 |
Торий / Thorium |
Th |
II, III, IV |
ThO2, ThF4 |
|
91 |
Проактиний / Protactinium |
Pa |
IV, V |
PaCl5, PaF4 |
|
92 |
Уран / Uranium |
U |
III, IV |
UF4, UO3 |
|
93 |
Нептуний |
Np |
III — VI |
NpF6, NpCl4 |
|
94 |
Плутоний |
Pu |
II, III, IV |
PuO2, PuF3, PuF4 |
|
95 |
Америций |
Am |
III — VI |
AmF3, AmO2 |
|
96 |
Кюрий |
Cm |
III, IV |
CmO2, Cm2O3 |
|
97 |
Берклий |
Bk |
III, IV |
BkF3, BkO2 |
|
98 |
Калифорний |
Cf |
II, III, IV |
Cf2O3 |
|
99 |
Эйнштейний |
Es |
II, III |
EsF3 |
|
100 |
Фермий |
Fm |
II, III |
— |
|
101 |
Менделевий |
Md |
II, III |
— |
|
102 |
Нобелий |
No |
II, III |
— |
|
103 |
Лоуренсий |
Lr |
III |
— |
|
Номер |
Элемент |
Символ |
Валентность химических элементов |
Пример |
Дмитрий Менделеев: изобрел водку, как создал периодическую таблицу и из чего она состоит
Аргументы Недели → Наука 13+
13 марта 2023, 14:21
13 марта ознаменован многими событиями, среди которых рождения и смерти, победы и поражения, но, возможно, среди научных открытий этого дня первое место занимает труд русского ученого Дмитрия Менделеева.
По легенде периодическая таблица ученому приснилась. Он якобы проснулся среди ночи и в один присест к письменному столу оформил гениальную работу. Психологи позже объяснили феномен типичной работой головного мозга, который, будучи озабочен какой-либо идеей, денно и нощно трудится над ее решением. Но гениальности Менделеева это не умалило.
Периодическая таблица Менделеева — это структура, в которой элементы расположены в порядке их атомных номеров и свойств. Она была разработана в 1869 году и использовалась для объяснения свойств элементов и того, как они взаимодействуют друг с другом. Таблица является одним из важнейших инструментов в химии, обеспечивая способ организации информации об элементах и их реакциях.
Периодическая таблица позволяет легко понять взаимосвязь между различными элементами в макроскопическом масштабе. Она помогает предсказать, как различные элементы будут реагировать друг с другом при соединении, а также дает представление о химических реакциях. Периодическая таблица позволяет химикам делать прогнозы относительно новых соединений, которые они могут создать, соединяя различные элементы вместе. Кроме того, она может использоваться для идентификации неизвестных веществ путем сравнения их свойств со свойствами известных элементов, перечисленных в таблице.
Периодическая таблица позволяет химикам делать прогнозы относительно новых соединений, которые они могут создать, соединяя различные элементы вместе. Кроме того, она может использоваться для идентификации неизвестных веществ путем сравнения их свойств со свойствами известных элементов, перечисленных в таблице.
До работы Менделеева многие ученые создавали варианты, по сути, периодической таблицы, однако ни один из них не смог точно предсказать свойства элементов или правильно расположить их в соответствии с атомным весом или номером до прорывного открытия Менделеева. Хотя в его первоначальной работе оставались некоторые пробелы, связанные с отсутствием информации о некоторых элементах на тот момент, он смог создать всеобъемлющую таблицу, в которой все известные химические вещества были точно упорядочены в соответствии с их атомным весом и свойствами.
Периодическая таблица Менделеева состоит в основном из групп (вертикальные столбцы) и семейств (горизонтальные строки).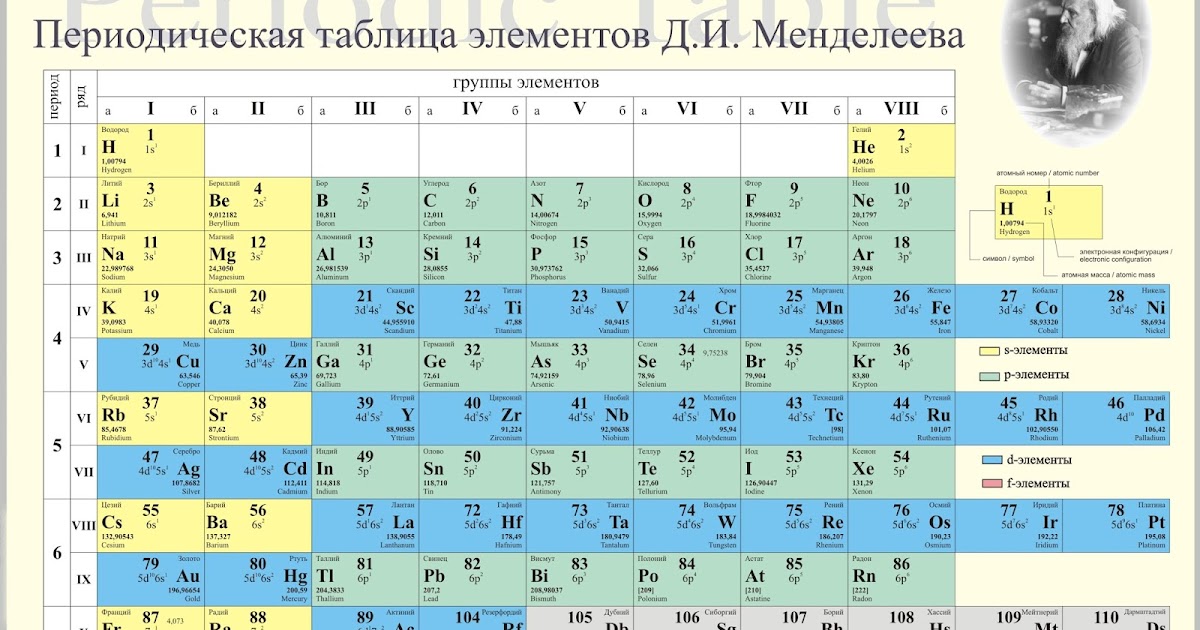 Элементы группируются вместе на основе сходных физических характеристик, таких как температура кипения, температура плавления, энергия ионизации и т. д., а семейства располагаются в соответствии с возрастающим атомным номером слева направо по всей таблице. Такая организация позволяет легко сравнивать различные группы элементов, что помогает химикам понять, как эти материалы взаимодействуют друг с другом во время химических реакций или процессов, таких как реакции растворения или осаждения. В современном виде (известном как «длинная форма») периодическая таблица насчитывает 118 известных элементов, объединенных в 18 основных семейств, включая щелочные металлы (группа 1), щелочноземельные металлы (группа 2), галогены (группа 7a), переходные металлы (группы 3–12), лантаноиды (группы 3b-6b) актиноиды (группы 4b-7b) постпереходные металлы (группы 8a-10a).
Элементы группируются вместе на основе сходных физических характеристик, таких как температура кипения, температура плавления, энергия ионизации и т. д., а семейства располагаются в соответствии с возрастающим атомным номером слева направо по всей таблице. Такая организация позволяет легко сравнивать различные группы элементов, что помогает химикам понять, как эти материалы взаимодействуют друг с другом во время химических реакций или процессов, таких как реакции растворения или осаждения. В современном виде (известном как «длинная форма») периодическая таблица насчитывает 118 известных элементов, объединенных в 18 основных семейств, включая щелочные металлы (группа 1), щелочноземельные металлы (группа 2), галогены (группа 7a), переходные металлы (группы 3–12), лантаноиды (группы 3b-6b) актиноиды (группы 4b-7b) постпереходные металлы (группы 8a-10a).
В завершении стоит отметить, что, любят Дмитрия Ивановича Менделеева (как в России, так и во всем мире) не только и не столько за систематизацию химических элементов, а за научную работу «О соединении спирта с водою» и день тот от 12 февраля 1865 года, с тех пор является Днем рождения водки.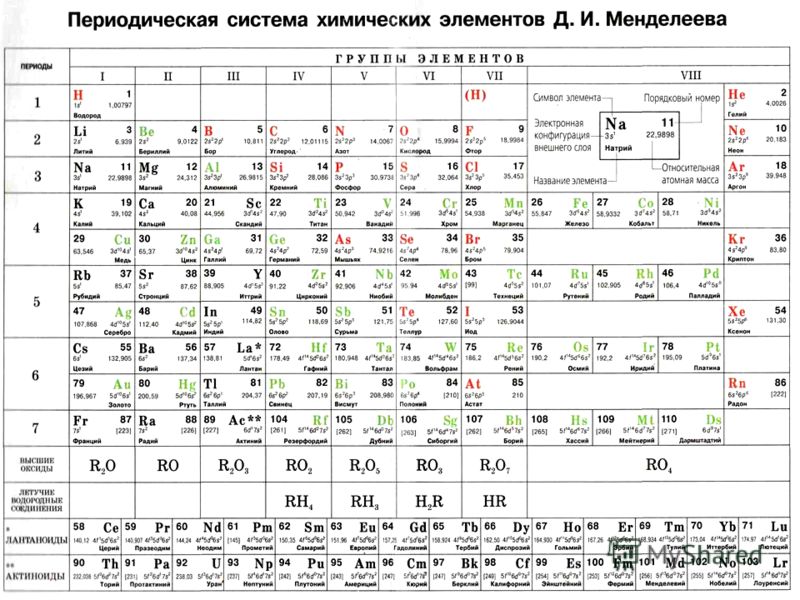
Подписывайтесь на Аргументы недели: Новости | Дзен | Telegram
- менделеев
- ученые
- химия
- РК
Новости МирТесен
Политика
Политика
Политика
Политика
Политика
Политика
Политика
Общество
Политика
В мире
Политика
Общество
Политика
Политика
Общество
Политика
Шоу-бизнес
Политика
Новости МирТесен
Общество
Общество
Потребитель
Политика
Периодическая таблица конечных элементов }} } \)
\( \smash{ \mathsf{dP}_{\mathsf{0}} } \)
\( \smash{ \mathsf{P}_{\mathsf{2}} } \ )
\( \smash{\mathsf{dP}_{\mathsf{1}} } \)
\( \smash{\mathsf{P}_{\mathsf{3}} } \)
\ ( \smash{\mathsf{dP}_{\mathsf{2}} } \)
n = 2
\( \smash{\mathsf{P}_{\mathsf{1}} } \)
\( \smash{\mathsf{RT}_{\mathsf{1}} } \)
\( \smash{\mathsf{dP}_{\mathsf{0}} } \)
\( \smash{\mathsf{P}_{\mathsf{2}} } \)
\( \smash{\mathsf{RT}_{\mathsf{2}} } \)
\( \smash{ \ mathsf{dP}_{\mathsf{1}} } \)
\( \smash{\mathsf{P}_{\mathsf{3}} } \)
\( \smash{ \mathsf{RT} _{\mathsf{3}} } \)
\( \smash{\mathsf{dP}_{\mathsf{2}} } \)
n = 3
\( \smash{ \mathsf{P }_{\mathsf{1}} } \) 9{\mathsf{f}}_{\mathsf{3}}} \)
\( \smash{\mathsf{dP}_{\mathsf{2}}} \)
k = 0
k = 1
k = 2
k = 3
n = 1
\( \smash{ \mathsf{P} _{\mathsf{1}} } \)
\( \smash{ \mathsf{dP }_{\mathsf{1}} } \)
\( \smash{\mathsf{P}_{\mathsf{2}} } \)
\( \smash{\mathsf{dP}_{\ mathsf{2}} } \)
\( \smash{\mathsf{P}_{\mathsf{3}} } \)
\( \smash{\mathsf{dP}_{\mathsf{3} } } \)
n = 2
\( \smash{\mathsf{P}_{\mathsf{1}} } \)
\( \smash{\mathsf{BDM}_{\mathsf{1}} } \ )
\( \smash{\mathsf{dP}_{\mathsf{1}} } \)
\( \smash{\mathsf{P}_{\mathsf{2}} } \)
\ ( \smash{\mathsf{BDM}_{\mathsf{2}} } \)
\( \smash{\mathsf{dP}_{\mathsf{2}} } \)
\( \smash{ \mathsf{P}_{\mathsf{3}} } \)
\( \smash{ \mathsf{BDM}_{\mathsf{3}} } \)
\( \smash{ \mathsf{dP }_{\mathsf{3}} } \) 9{\mathsf{f}}_{\mathsf{3}}} \)
\( \smash{\mathsf{dP}_{\mathsf{3}}} \)
k = 0
k = 1
k = 2
k = 3
n = 1
\( \smash{ \mathsf{Q} _{\mathsf{1}} } \)
\( \smash{ \mathsf{dQ }_{\mathsf{0}} } \)
\( \smash{\mathsf{Q}_{\mathsf{2}} } \)
\( \smash{\mathsf{dQ}_{\ mathsf{1}} } \)
\( \smash{\mathsf{Q}_{\mathsf{3}} } \)
\( \smash{\mathsf{dQ}_{\mathsf{2} } } \)
n = 2
\( \smash{ \mathsf{Q}_{\mathsf{1}} } \)
\( \smash{\mathsf{RTc}_{\mathsf{1}} } \ )
\( \smash{ \mathsf{dQ}_{\mathsf{0}} } \)
\( \smash{ \mathsf{Q}_{\mathsf{2}} } \)
\ ( \smash{\mathsf{RTc}_{\mathsf{2}} } \)
\( \smash{\mathsf{dQ}_{\mathsf{1}} } \)
\( \smash{ \mathsf{Q}_{\mathsf{3}} } \)
\( \smash{ \mathsf{RTc}_{\mathsf{3}} } \)
\( \smash{ \mathsf{dQ }_{\mathsf{2}} } \) 9{\mathsf{f}}_{\mathsf{3}}} \)
\( \smash{\mathsf{dQ}_{\mathsf{2}}} \)
k = 0
k = 1
k = 2
k = 3
n = 1
\( \smash{ \mathsf{S} _{\mathsf{1}} } \)
\( \smash{ \mathsf{dPc }_{\mathsf{1}} } \)
\( \smash{\mathsf{S}_{\mathsf{2}} } \)
\( \smash{\mathsf{dPc}_{\ mathsf{2}} } \)
\( \smash{\mathsf{S}_{\mathsf{3}} } \)
\( \smash{\mathsf{dPc}_{\mathsf{3} } } \)
n = 2
\( \smash{\mathsf{S}_{\mathsf{1}} } \)
\( \smash{\mathsf{BDMc}_{\mathsf{1}} } \ )
\( \smash{\mathsf{dPc}_{\mathsf{1}} } \)
\( \smash{\mathsf{S}_{\mathsf{2}} } \)
\ ( \smash{\mathsf{BDMc}_{\mathsf{2}} } \)
\( \smash{\mathsf{dPc}_{\mathsf{2}} } \)
\( \smash{ \mathsf{S}_{\mathsf{3}} } \)
\( \smash{ \mathsf{BDMc}_{\mathsf{3}} } \)
\( \smash{ \mathsf{dPc }_{\mathsf{3}} } \) 9{\mathsf{f}}_{\mathsf{3}} } \)
\( \smash{\mathsf{dPc}_{\mathsf{3}} } \)
Позиции тория и урана в Периодическая таблица
- Опубликовано:
- А. Э. ДУАЙТ 1
Природа том 187 , страницы 505–506 (1960)Цитировать эту статью
46 доступов
2 Цитаты
Сведения о показателях
Abstract
ЭЛЕМЕНТ 90 Периодической таблицы, торий, обычно появляется как первый элемент ряда актинидов, добавленный под церием в нижней части таблицы 1. Такое построение создает впечатление, что торий является вторым членом ряда, начинающегося с актиний в группе скандия, точно так же, как церий является вторым членом ряда, начинающегося с лантана в группе скандия. С точки зрения легирующих свойств торий нелогично рассматривать как относящийся к группе скандия. В ходе продолжающегося исследования поведения элементов группы скандия и титана при сплавлении с платиновыми металлами было отмечено, что торий ведет себя так, как если бы он был членом группы титана. Доказательства приведены в таблице 1, в которой кристаллическая структура интерметаллического соединения состава АБ 3 идентифицируется обычным образом по прототипу семейства соединений. Данные о кристаллической структуре, относящиеся к некоторым из этих соединений, были опубликованы 1 , остальные будут опубликованы в ближайшее время.
Такое построение создает впечатление, что торий является вторым членом ряда, начинающегося с актиний в группе скандия, точно так же, как церий является вторым членом ряда, начинающегося с лантана в группе скандия. С точки зрения легирующих свойств торий нелогично рассматривать как относящийся к группе скандия. В ходе продолжающегося исследования поведения элементов группы скандия и титана при сплавлении с платиновыми металлами было отмечено, что торий ведет себя так, как если бы он был членом группы титана. Доказательства приведены в таблице 1, в которой кристаллическая структура интерметаллического соединения состава АБ 3 идентифицируется обычным образом по прототипу семейства соединений. Данные о кристаллической структуре, относящиеся к некоторым из этих соединений, были опубликованы 1 , остальные будут опубликованы в ближайшее время.
Это предварительный просмотр содержимого подписки, доступ через ваше учреждение
Варианты доступа
Подписка на этот журнал
Получите 51 печатный выпуск и онлайн-доступ
199,00 € в год
только 3,90 € за выпуск
Подробнее
Арендуйте или купите эту статью
Получите только эту статью столько, сколько вам нужно
$39,95
Узнайте больше
Цены могут облагаться местными налогами, которые рассчитываются при оформлении заказа
Ссылки
Дуайт, А.
 Э., и Бек, П. А., Trans. амер. Инст. мех. англ. , 215 , 976 (1959).
Э., и Бек, П. А., Trans. амер. Инст. мех. англ. , 215 , 976 (1959).КАС Google Scholar
Деминг, Х. Г., «Общая химия», цитируется в двадцать третьем изд., «Справочник по химии и физике», (1939).
Google Scholar
Макаров Е.С., «Кристаллохимия простых соединений U, Th, Pu и Np» (1958).
Google Scholar
Рауб Э., З. Металлк. , 45 , 23 (1954).
КАС Google Scholar
Heal, T.J., and Williams, G.I., Acta Cryst. , 8 , 494 (1955).
Артикул КАС Google Scholar
Haworth, C.W., and Hume-Rothery, W., J. Inst. Металлы , 87 , 265 (1959).


 Э., и Бек, П. А., Trans. амер. Инст. мех. англ. , 215 , 976 (1959).
Э., и Бек, П. А., Trans. амер. Инст. мех. англ. , 215 , 976 (1959).