Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
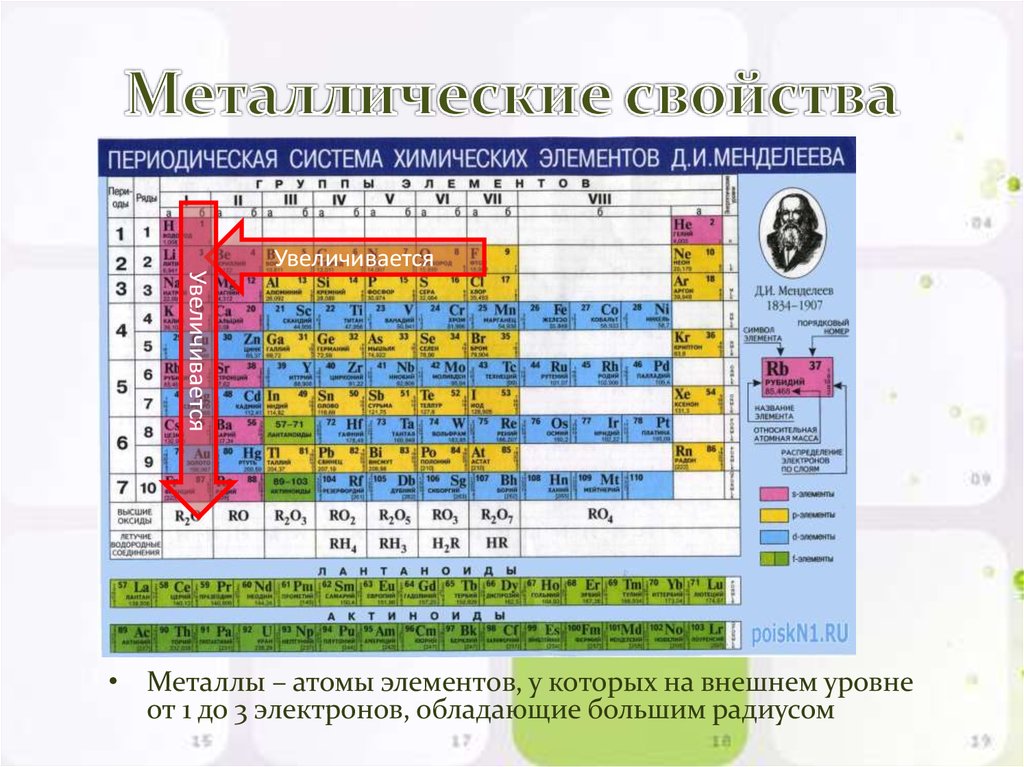
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.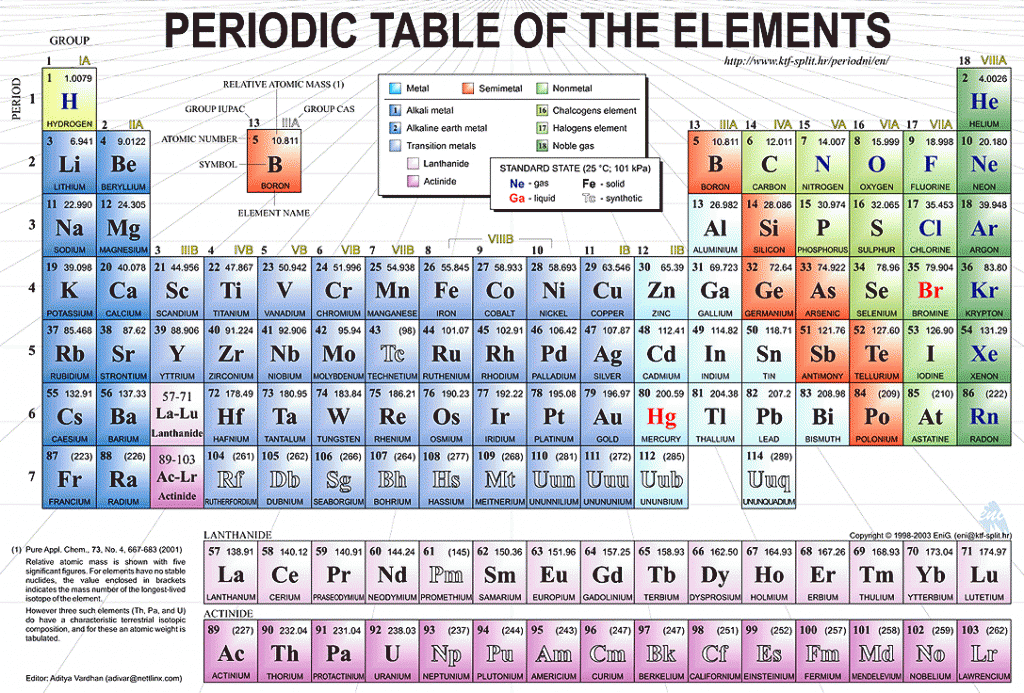
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Бром как химический элемент таблицы Менделеева
Б Бром является химическим элементом таблицы Менделеева с атомным номером 35 и условным обозначением Br. Бром при комнатной температуре предствляет собой дымящуюся красно-коричневую жидкость, которая легко испаряется.
Содержание
- Как был открыт Бром;
- Где и как добывают Бром;
- Распространенность Брома;
- Применение Брома;
- Интересные факты
Открытие такого химического элемента как бром было совершено почти одновременно и независимо друг от друга двумя учеными.
Первым является немецкий химик Карл Якоб Левиг. Ему удалось выделить новый элемент из источника минеральных вод в немецком городке Бад-Кройцнах в 1825 году. Для справки этот город является Родиной Левига. Используя раствор минеральной соли насыщенной хлором, Карл Левиг эстрагировал бром диэтиловым эфиром. После испарения эфира на дне оставалась коричневая жидкость. С этой жидкостью в качестве доказательства своего эксперимента, он просился на работу в лабораторию Леопольда Гмелина в Гейдельберге. В результате, публикация этого опыта была отложена и французский химик Антуан Балар опубликовал свою статью раньше.
Статья французского химика была опубликована только в 1826 году. Балар нашел новый химический элемент в золе морских водорослей из солончаков в Монпелье. Морские водоросли в то время использовались для получения йода и содержали в своем составе бром. Он выделил новый элемент из раствора золы водорслей, насыщенных хлором. Свойства этого элемента были похожи на свойства йода и хлора. Балар, проводя свои опыты пытался доказать, что найденое вещество является монохлоридом йода. Когда у него не получилось это доказать он решил зарегистрировать его как новый элемент и назвал его мюрид.
Балар, проводя свои опыты пытался доказать, что найденое вещество является монохлоридом йода. Когда у него не получилось это доказать он решил зарегистрировать его как новый элемент и назвал его мюрид.
После того, как французские химики, такие как Луи Николя Воклен, Луи Жак Тенар и Гей Люссак, одобрили открытие, новый элемент был представлен на одной из лекций в Академии наук и опубликованы в журнале «Annales de Chimie et Physique». До 1858 года бром не производился в больших количествах. В этом году было обнаружено месторождение в Штасфурте, которое открыло новое дыхание в производство этого элемента.
Где и как добывают БромНа сегодняшний день, мировое производство брома оценивается в 600 000 тонн в год. Лидерами по производству этого элемента являются США, Китай, Израиль и Иордания. В промышленных масштабах исходным материалом для добычи брома является либо раствор солей, либо вода из подземных источников большой глубины. Само получение элементарного брома в промышленных масштабах осуществляется путем окисления растворов бромида хлором. Химическая реакция этого процесса выглядит следующим образом.
Химическая реакция этого процесса выглядит следующим образом.
2KBr + Cl2 —> Br2 + 2KCl
При окислении бромида калия при повышенных температурах образуется чистый бром и хлорид калия. Еще одним возможным способом получения брома является его добыча как побочного продукта при переработке калия для изготовления удобрений. С 1970-х годов этот метод перестал быть коммерчески выгодным и от него отказались.
В лабораториях бром получают с помощью химической реакции бромида натрия с серной кислотой и диоксидом марганца. На выходе реакции из бромида натрия получается сульфат марганца, оксид брома, сульфат натрия и вода. После этого из раствора методом перегонки выделяют бром.
Распространенность БромаРаспространенность брома на нашей планете довольно относительная. Что касается земной коры, то этот элемент занимает почетное 46 место по массе. Его соотношение составляет 2.5 части на миллион. Это означает, что его обходят в несколько раз такие элементы как фтор и хлор. Гораздо большее содержание брома отмечается в морях и океанах, где соотношение брома составляет около 65 частей на миллион. Это означает, что в мировом океане на одну молекулу фтора или хлора приходится около 600 молекул брома. При этом в соляных озерах или скважинах концентрация брома может быть в разы выше. Таким примером выступает «Мертвое море». По оценкам ученых процентное содержание ионов брома в этом месте составляет около 0,4%. В таких источниках наиболее выгодна коммерческая добыча.
Гораздо большее содержание брома отмечается в морях и океанах, где соотношение брома составляет около 65 частей на миллион. Это означает, что в мировом океане на одну молекулу фтора или хлора приходится около 600 молекул брома. При этом в соляных озерах или скважинах концентрация брома может быть в разы выше. Таким примером выступает «Мертвое море». По оценкам ученых процентное содержание ионов брома в этом месте составляет около 0,4%. В таких источниках наиболее выгодна коммерческая добыча.
Соединения брома находят широкое применение в разных сферах промышленности. Некоторые соединения изготавливаются из самого брома, другие же изготавливаются из бромистого водорода. Бромистый водород в свою очередь представляет собой двухатомное соединение водорода и брома.
Большую часть коммерческого использования брома приходится на бромированные антипирены. Последние в свою очередь используются в противопожарных средствах защиты. Примером этого могут послужить некоторые огнетушители, а так же противопожарные средства обработки древесины. Так же бромированные антипирены используются в качстве примеси при изготовлении полимеров, различного рода пластмасс, полиэтилена и полипропилена. Еще одним известным применением бромированных антипиренов является изготовление термияески устойчивых эпоксидных смол для печатных плат в электротехнике.
Так же бромированные антипирены используются в качстве примеси при изготовлении полимеров, различного рода пластмасс, полиэтилена и полипропилена. Еще одним известным применением бромированных антипиренов является изготовление термияески устойчивых эпоксидных смол для печатных плат в электротехнике.
Еще одним значимым применением является использование бромида серебра в качестве светочувствительного компонента фотографических эмульсий. Другим важным применением являлся этиленбромид, который использовался в качестве пиисадки к бензину. Эта присадка помогала избавить бензиновые двигатели от эффекта детонации. В 80-х годах от этой присадки отказались из-за токсичности и разрушения озонового слоя.
До 2005 года бромметан, который явлляется токсичным везеством, широко использовался в качестве пестицидов для фумигации почвы. Он был запрещен по той же причине, что и присадка для бензиновых двигателей. Еще одним значимым применением являлась фармакология, где бромид калия довольно часто использовался в качестве седативного вещества. Другие сферы применения брома составляют буровые растворы высокой плотности, красители и фармацевтические препараты.
Другие сферы применения брома составляют буровые растворы высокой плотности, красители и фармацевтические препараты.
Интересных фактов связанных с бромом достаточно много. Стоит начать с того, что в 2014 году было проведено исследование, которое показало, что бром является необходимым кофактором в биосинтезе коллагена IV, что делает этот элемент необходимым для архитектуры базальной мембраны и развития тканей у животных. Другим интересным предположением является то, что ионы брома могут способствовать различного рода мутациям в ДНК живых организмов. Дибром и ртуть являются единственными веществами, которые при комнатной температуре находятся в жидком состоянии. Еще одним интересным моментом является то, что бром в простом состоянии способен вызывать химические ожоги. Вдыхание его паров способно вызывать одышку, пневмонию и отек легких.
Бром | Свойства, использование и факты
бром
Смотреть все СМИ
- Ключевые люди:
- Антуан-Жером Балар Виктор Мейер
- химический элемент галоген
См. все связанные материалы →
все связанные материалы →
бром (Br) , химический элемент, темно-красная ядовитая жидкость, член группы галогенов или группы 17 (группа VIIa) периодической таблицы.
| атомный номер | 35 |
|---|---|
| атомный вес | [79,901, 79,907] |
| температура плавления | −7,2 °C (19 °F) |
| температура кипения точка | 59 °C (138 °F) |
| удельный вес | 3,12 при 20 °C (68 °F) |
| степени окисления | −1, + 1, +3, +5, + 7 |
| электронная конфигурация | (Ar)3 d 10 4 s 2 4 p 5 |
История
Бром был открыт в 1826 году французским химиком Антуаном-Жеромом Баларом в остатки (горечь) от производства морской соли в Монпелье. Он освободил элемент, пропуская хлор через водный раствор остатков, который содержал бромид магния. Перегонка материала с диоксидом марганца и серной кислотой дала красные пары, которые конденсировались в темную жидкость. Сходство этой процедуры с процедурой получения хлора навело Балара на мысль, что он получил новый элемент, подобный хлору. (Немецкий химик Юстус фон Либих, по-видимому, получил этот элемент раньше Балара, но он ошибочно полагал, что это хлорид йода.) Из-за неприятного запаха этого элемента Французская академия наук предложила название бром, от греческого слова bromos , что означает «неприятный запах» или «вонь».
Он освободил элемент, пропуская хлор через водный раствор остатков, который содержал бромид магния. Перегонка материала с диоксидом марганца и серной кислотой дала красные пары, которые конденсировались в темную жидкость. Сходство этой процедуры с процедурой получения хлора навело Балара на мысль, что он получил новый элемент, подобный хлору. (Немецкий химик Юстус фон Либих, по-видимому, получил этот элемент раньше Балара, но он ошибочно полагал, что это хлорид йода.) Из-за неприятного запаха этого элемента Французская академия наук предложила название бром, от греческого слова bromos , что означает «неприятный запах» или «вонь».
Наличие и распространение
Бром, редкий элемент, встречается в природе в рассеянном виде по всей земной коре только в виде растворимых и нерастворимых бромидов. Некоторое обогащение происходит в океанской воде (65 частей на миллион по весу), в Мертвом море (приблизительно 5 граммов на литр [0,7 унции на галлон]), в некоторых термальных источниках и в редких нерастворимых минералах бромида серебра (таких как бромирит, встречается в Мексике и Чили).
Бром природный представляет собой смесь двух стабильных изотопов: брома-79 (50,54%) и брома-81 (49,46%). Из 17 известных радиоактивных изотопов элемента бром-77 имеет самый длительный период полураспада (57 часов).
Викторина «Британника»
Викторина «118 названий и символов периодической таблицы»
Физические и химические свойства
Свободный бром представляет собой красновато-коричневую жидкость с заметным давлением паров при комнатной температуре. Пары брома имеют янтарный цвет. Бром имеет резкий запах и раздражает кожу, глаза и дыхательную систему. Воздействие паров концентрированного брома даже на короткое время может привести к летальному исходу. Как и другие галогены, бром существует в виде двухатомных молекул во всех агрегатных состояниях.
Как и другие галогены, бром существует в виде двухатомных молекул во всех агрегатных состояниях.
Около 3,41 грамма (0,12 унции) брома растворяется в 100 мл (0,1 кварты) воды при комнатной температуре. Раствор известен как бромная вода. Подобно хлорной воде, это хороший окислитель, и он более полезен, потому что не так легко разлагается. Он высвобождает свободный йод из йодидсодержащих растворов и серу из сероводорода. Сернистая кислота окисляется бромной водой до серной кислоты. На солнечном свету бромная вода разлагается с выделением кислорода, как в следующем уравнении:
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться
Из бромной воды можно выделить гидрат (клатрат), который содержит 172 молекулы воды и 20 полостей, способных вместить молекулы брома. Бром растворяется в водных растворах гидроксидов щелочных металлов, давая бромиды, гипобромиты или броматы, в зависимости от температуры.
Сродство к электрону брома высокое и такое же, как у хлора. Однако он является менее сильным окислителем, главным образом из-за более слабой гидратации бромид-иона по сравнению с хлорид-ионом. Точно так же связь металл-бром слабее, чем соответствующая связь металл-хлор, и это различие отражается в химической активности брома, которая находится между реакционной способностью хлора и йода. Органическое соединение брома похоже на соответствующее производное хлора, но обычно более плотное, менее летучее, менее горючее и менее стабильное.
Бром бурно соединяется с щелочными металлами, а также с фосфором, мышьяком, алюминием и сурьмой, но менее бурно с некоторыми другими металлами. Бром вытесняет водород из насыщенных углеводородов и присоединяется к ненасыщенным углеводородам, хотя и не так быстро, как это делает хлор.
Наиболее стабильной степенью окисления элемента является -1, при которой бром встречается в природе. Но степени окисления 0 (элементарный бром, Br 2 ), +1 (гипобромит, BrO – ), +3 (бромит, BrO – 2 ), +5 (бромат, BrO – 3 ) и +7 (пербромат, BrO – 4 ) также известны. Первая энергия ионизации брома высока, и соединения, содержащие бром в положительных степенях окисления, стабилизируются соответствующими лигандами, главным образом кислородом и фтором. Соединения со степенью окисления +1, +3, +4, +5 и +7 содержат ковалентные связи.
Производство и использование
Основным коммерческим источником брома является морская вода, из которой элемент извлекают путем химического замещения (окисления) хлором в присутствии серной кислоты по реакции
Продукт реакции – разбавленный раствор брома, из которого элемент удаляют продуванием воздуха. Затем свободный бром смешивают с двуокисью серы, и смешанные газы пропускают вверх по башне, по которой стекает вода. В градирне происходит следующая реакция:
В градирне происходит следующая реакция:
, в результате чего получается смесь кислот, которая намного богаче ионами брома, чем морская вода. Вторая обработка хлором высвобождает бром, который освобождается от хлора и очищается путем пропускания через влажные железные опилки.
Товарный бром обычно содержит до 0,3 процента хлора. Обычно его хранят в стеклянных бутылках или в бочках, покрытых свинцовым или монель-металлическим покрытием.
В промышленном использовании брома преобладало соединение бромистого этилена (C 2 H 4 Br 2 ), которое когда-то добавляли к бензину с тетраэтилсвинцом для предотвращения отложения свинца в двигателе. После отказа от этилированного бензина соединения брома в основном использовались в антипиренах, но бромистый этилен по-прежнему остается важным соединением, поскольку он используется для уничтожения нематод и других вредителей в почве. Бром также используется в производстве катализаторов, таких как бромид алюминия.
Бром имеет и другие применения, например, в производстве различных красителей и соединений тетрабромэтана (C 2 H 2 Br 4 ) и бромоформа (CHBr 3 ), которые используются в качестве жидкостей в манометрах из-за их высокой удельный вес. До разработки барбитуратов в начале 20 века бромиды калия, натрия, кальция, стронция, лития и аммония широко использовались в медицине из-за их седативного действия. Бромид серебра (AgBr), важный компонент фотопленки, как и хлорид и йод серебра, чувствителен к свету. Следы бромата калия (KBrO 3 ) добавляют в пшеничную муку для улучшения выпечки. Другие важные соединения брома включают бромистый водород (HBr), бесцветный газ, используемый в качестве восстановителя и катализатора в органических реакциях. Раствор газа в воде называется бромистоводородной кислотой, сильной кислотой, которая напоминает соляную кислоту по своей активности по отношению к металлам, их оксидам и гидроксидам.
Бром (Br) – Атомный номер 35
Произносится
BRO-meen
Бром (Br) представляет собой красно-коричневый жидкий неметалл.
 Он имеет атомный номер 35 в периодической таблице. Он расположен в группе 17, галогены. Он имеет символ Br.
Он имеет атомный номер 35 в периодической таблице. Он расположен в группе 17, галогены. Он имеет символ Br. Бром получил свое название от древнегреческого слова Bromos, обозначающего зловоние. Подобно хлору и фтору, он имеет сильный запах. Бром является очень реакционноспособным элементом и не встречается в природе в свободном виде, а вместо этого существует в виде белых/бесцветных кристаллических твердых веществ в виде галоидных солей. Однако его легко найти в морской воде и обычно добывают в бассейнах с соляным раствором. Бром имеет ряд применений, но в основном он используется в качестве антипирена. Он также широко используется в фотографии в качестве пленки. Бром был открыт Карлом Якобом Лёвигом и Антуаном Баларом, которые независимо открыли эту жидкость в 1825 и 1826 годах. Обоим удалось выделить бром из различных соединений. Лёвиг выделил бром из проб воды в Германии, используя хлор и диэтиловый эфир, чтобы выделить коричневое твердое вещество. Но именно Балар из пепла морских водорослей произвел бром и первым опубликовал свое открытие. Он находится в группе 17 и имеет температуру плавления -7 ° C и точку кипения 58 ° C, будучи жидкостью при комнатной температуре.
Он находится в группе 17 и имеет температуру плавления -7 ° C и точку кипения 58 ° C, будучи жидкостью при комнатной температуре.
Загрузите бром в виде изображения для печати и с полным масштабированием
Получите бесплатную загрузку здесь (JPEG, PDF, SVG)
Часто задаваемые вопросы
Какова температура плавления брома?
Бром имеет температуру плавления -7,2°C, то есть при -7,2°C он превращается в жидкость.
Какова температура кипения брома?
Бром имеет температуру кипения 58,78°C, то есть при 58,78°C он превращается в газ.
Что такое электроотрицательность брома?
Электроотрицательность брома составляет 2,96. Электроотрицательность — это мера того, насколько сильно атомы притягивают к себе связывающие электроны.
Открыт
Антуаном Ж. Баларом
Дата открытия
1826
Что такое Теплота испарения брома?
Бром имеет теплоту испарения 15,438 кДж/моль.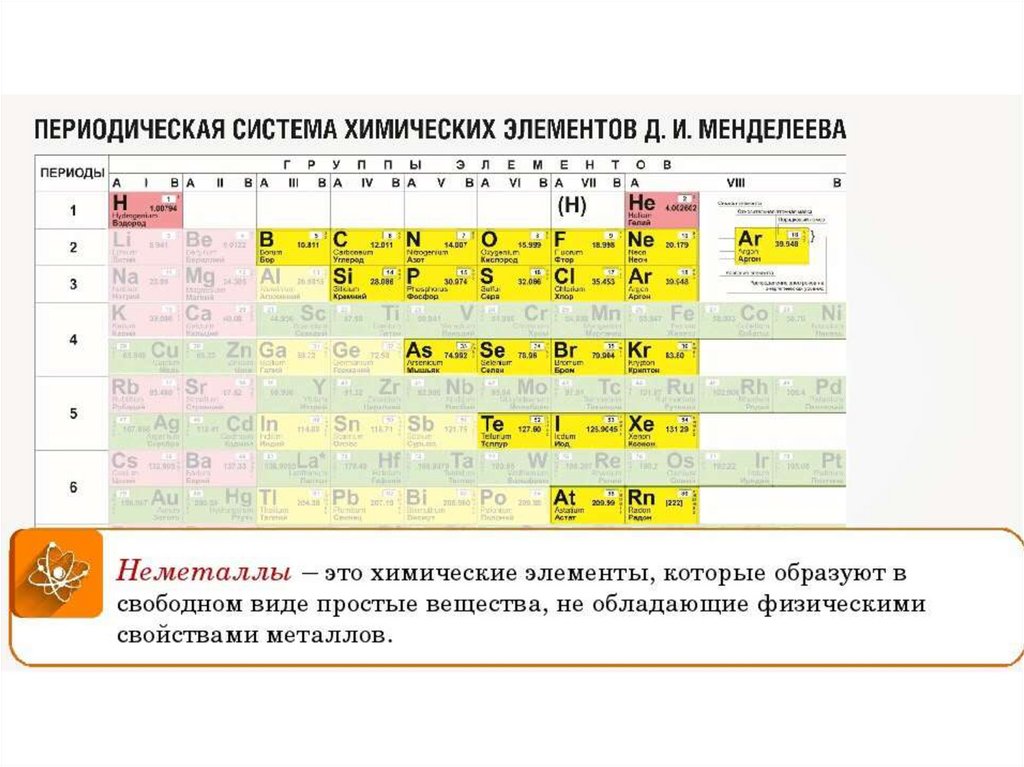
Применение
Когда-то он использовался в больших количествах для изготовления состава, удаляющего отложения соединений свинца в двигателях, работающих на этилированном бензине. Сейчас он в основном используется в красителях, дезинфицирующих средствах и фотохимикатах.
Источники
Встречается в соединениях в морской воде.
Об авторе
Nathan M
Автор
Nathan имеет степень бакалавра биомедицинской химии в Уорикском университете и степень бакалавра биологических наук в Университете Вулверхэмптона, Великобритания. Предмет Натана варьируется от общей химии до органической химии. Натан также создал учебную программу «Разрушение атома» на странице курса.
Цитирование
“Бром” Опубликовано 30 декабря 2019 г.. https://breakingatom.com/elements/bromine
35
Протоны
35
Электроны
45
Нейтроны
Символ элемента 900 03
Br
Атомный вес
79,904
Атомный номер
35
Состояние
Жидкость
Температура плавления
Неизвестно
-7,2
°C
Температура кипения
58,78 90 003
Неизвестно
°С
Теплота парообразования
15,438
Неизвестно
кДж/моль
Кристаллическая структура
Орторомбическая
Теплопроводность
0,0 0122
Неизвестно
Вт/смK
Оболочки
2,8,18,7
Группа
Галоген
Период
4
Блок
Блок P
Орбитали
[Ar] 3d10 4s2 4p5
900 02 Коэффициент теплового расширения—
Ковалентный радиус
1,14 Å
Плотность при 293K
3,119 г/см³
Электропроводность
—
9 0002 Первый потенциал ионизации11,8138 В
Второй потенциал ионизации
21,8 В
Третий потенциал ионизации
36,0 В
Ионный радиус
1,96 (-1) Å
Степени окисления
(±1),5
Параметр решетки
—
Параметр решетки 2
—
Параметр решетки 3
—
Орбитальная конфигурация
2,8,18,7
Загрузка периодической таблицы 9023 3
Узнать о других галогенах
126,904
53
I
Йод
35.
