Как понять таблицу Менделеева? | homeofknowledge.ru
Wed, 02/01/2019 – 11:00 By Anonymous (not verified) Химия 0 comments
Прежде чем обращать свой взор на таблицу Менделеева нужно усвоить несколько вещей:
– Знать, что такое атом, электрон, электронное облако, протон, нейтрон. Почитать можно тут.
– Знать, что такое изотоп. [ Изотоп – это тот же хим. элемент, только с меньшим или большим количеством нейтронов в ядре.]
– Немного анг. язык. Символы хим. элементов берут своё название от анг. слов. Например, O – oxygen (кислород), или He – helium (гелий) и т.д.
Без вышеперечисленных знаний, внять суть таблицы будет трудно. Как только всё это усвоится, можно смотреть на таблицу Менделеева. Смотрим на школьный вариант:
В правом верхнем углу показан пример с углеродом, как понимать числа в ячейке.
Все хим. элементы пронумерованы. Слева направо, и сверху вниз. Это не просто так. Номер элемента = заряду ядра атома = числу электронов в атоме = числу протонов в ядре атома. Неплохо для начала, правда… Далее смотрим на самый левый вертикальный столб [1-7] – это номера периодов.
Номер элемента = заряду ядра атома = числу электронов в атоме = числу протонов в ядре атома. Неплохо для начала, правда… Далее смотрим на самый левый вертикальный столб [1-7] – это номера периодов.
Номер периода.
Номер периода указывает на количество внешних энергетических уровней. Энергетический уровень – это орбиталь (трасса/маршрут) по которой летают электроны вокруг ядра. На макроуровне можно сказать, что Земля вращается на третьем энергетическом уровне Солнца. И да, сколько “энергетических уровней” у Солнца? =)
Так же, при чтении одного периода (слева направо) можно выявить несколько закономерностей:
– увеличивается заряд ядра.
– увеличивается число электронов на внешнем энергетическом уровне.
– уменьшается радиус атома.
– уменьшается способность атома отдавать электроны.
Группа.
Группа – это самый верхний горизонтальный столб [I-VIII]. Номер группы показывает кол-во электронов на внешнем энергетическом уровне.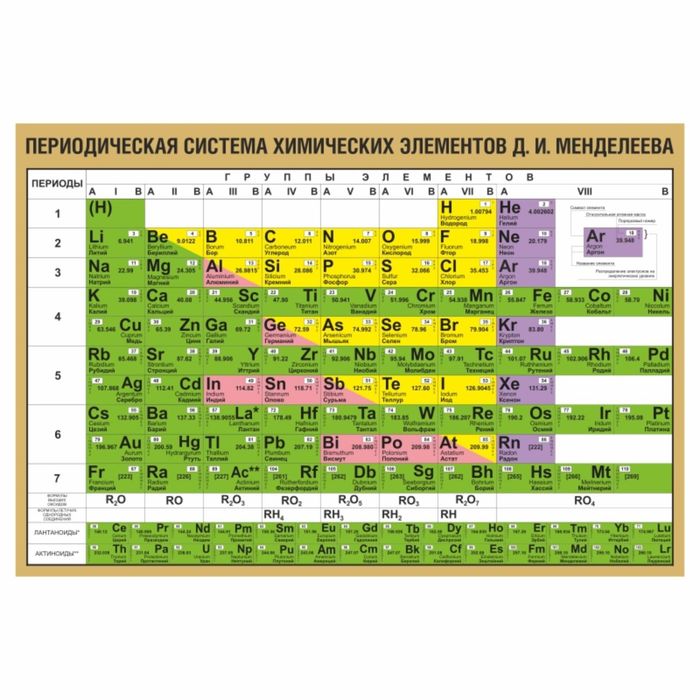 Если смотреть на группу элементов сверху вниз (в столбик), то выявятся следующие закономерности:
Если смотреть на группу элементов сверху вниз (в столбик), то выявятся следующие закономерности:
– увеличивается заряд ядра.
– увеличивается радиус ядра.
– увеличивается способность отдавать электроны.
Лантаноиди и Актиноиды.
Это последние 2 строки элементов в таблице белого цвета. Они как бы не входят в таблицу, но на самом деле входят. Видите, перед словами ЛАНТАНОИДЫ и АКТИНОИДЫ стоит * и **. Это говорит о том, что ранее на эти слова ссылались. Обратите внимание на хим. элементы #57 (Лантан) и #89 (Актиний). Видимо неудобно все эти элементы вписывать в таблицу (много слишком) вот и сделали сноску.
Цвет.
Все ячейки элементов покрашены в 4 цвета. Тоже не просто так. Посмотрите на правый край таблицы, и вы увидите запись: Красный – s элементы. Жёлтый – p элементы. Синий – d элементы. Белый – f элементы. Это указывает на формы электронных облаков. Электронное облако (орбитали) – это маршрут, по которому бегает электрон.
ВСЁ!
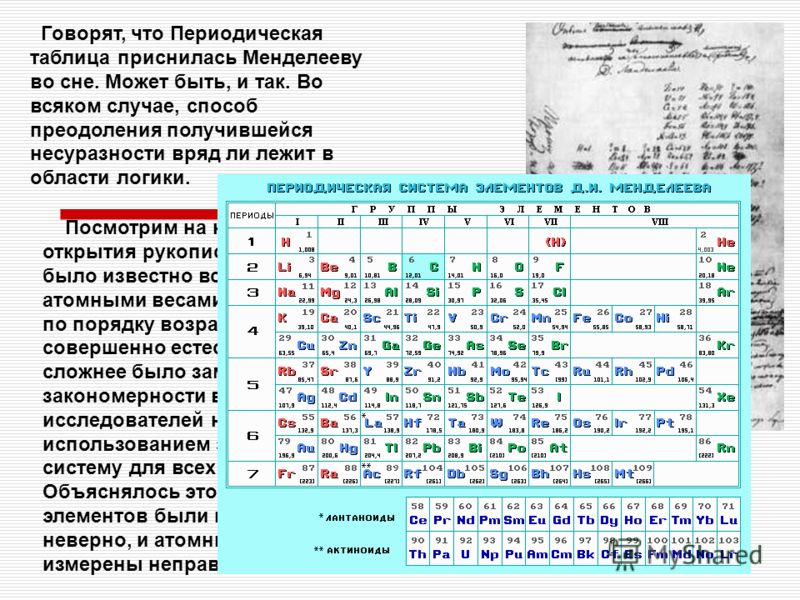
Освоив эти закономерности, таблица вам покажется простой и скучной. Но вспомните себя, когда вы смотрели на неё первый раз. К тому же есть другие виды этой таблицы, где есть доп. поля и графы, которые несут доп. информацию. Плюс есть всякие исключения из правил и т.д. И опять не всё так просто. А раз есть варианты таблиц, как же она выглядела в первоначальном виде? Для этого давайте обратимся к труду самого Дмитрия Ивановича “Попытка химического понимания мирового эфира” Издание 1905г.
И сразу же бросается в глаза 2 элемента нулевой группы x и y. X так вообще ещё и в нулевом ряду (и скорее всего и в нулевом периоде). А это значит, что у данного элемента вообще нет энергетический уровней? Давайте почитаем, что же сам Менделеев пишет об этом:
Но всё же этот y, т.
е. короний, или иной газ с плотностью около 0,2 по отношению к водороду, не может быть никоим образом мировым эфиром; его плотность (по водороду) для этого высока, он побродит, быть может, и долго, в мировых полях, вырвется из уз земли, опять в них случайно ворвется, но всё же из сферы притяжения солнца не вырвется, а, конечно, между звёздами найдутся и помассивнее нашей центральной звезды. Атомы же эфира, надо представить не иначе, как способными преодолевать даже солнечное притяжение, свободно наполняющими всё пространство и везде могущими проникать. Этот элемент, y, однако необходим для того, чтобы умственно подобраться к тому наилегчайшему, а потому и наиболее быстро движущемуся элементу x, который по моему разумению, можно считать эфиром.
Интересно Д.И. Менделеев написал. Современные учёные наверное признали бы его лже учёным, и его труды – лженаукой. Ведь они не признают эфира. Ну оставим это дело им. А нам, после нескольких минут (или часов) умственного труда, таблица стала чуточку ближе.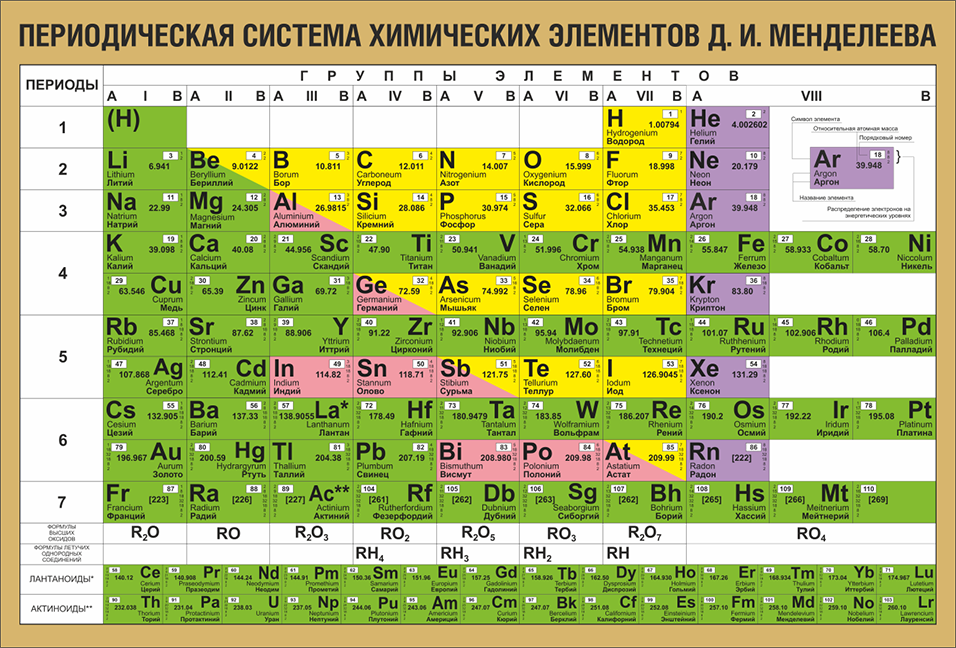
Полный труд Д.И. Менделеева “Попытка химического понимания мирового эфира” Издание 1905г. можно скачать тут.
Как определить валентность по таблице Менделеева и как она изменяется
Различные химические элементы отличаются по своей способности создавать химические связи, то есть соединяться с другими атомами. Поэтому в сложных веществах они могут находиться только в определенных соотношениях. Разберемся, как определить валентность по таблице Менделеева.
Содержание
Что такое валентность?
Существует такое определение валентности: это способность атома к образованию определенного числа химических связей. В отличие от степени окисления, эта величина всегда только положительная и обозначается римскими цифрами.
В качестве единицы используется эта характеристика для водорода, которая принята равной I. Это свойство показывает, с каким числом одновалентных атомов может соединиться данный элемент. Для кислорода эта величина всегда равна II.
Знать эту характеристику необходимо, чтобы верно записывать химические формулы веществ и уравнения реакций. Знание этой величины поможет установить соотношение между числом атомов различных типов в молекуле.
Данное понятие возникло в химии в XIX веке. Начало теории, объясняющей соединение атомов в различных соотношениях, положил Франкленд, но его идеи о «связывающей силе» не были очень распространены. Решающая роль в развитии теории принадлежала Кекуле. Он называл свойство образовывать некоторое количество связей основностью. Кекуле считал, что это фундаментальное и неизменное свойство каждого вида атомов. Важные дополнения к теории сделал Бутлеров. С развитием этой теории стало возможным наглядно изображать молекулы. Это очень помогло в изучении строения различных веществ.
Чем поможет периодическая таблица?
Находить валентность можно, посмотрев на номер группы в короткопериодном варианте. Для большинства элементов, у которых эта характеристика постоянная (принимает только одно значение), она совпадает с номером группы.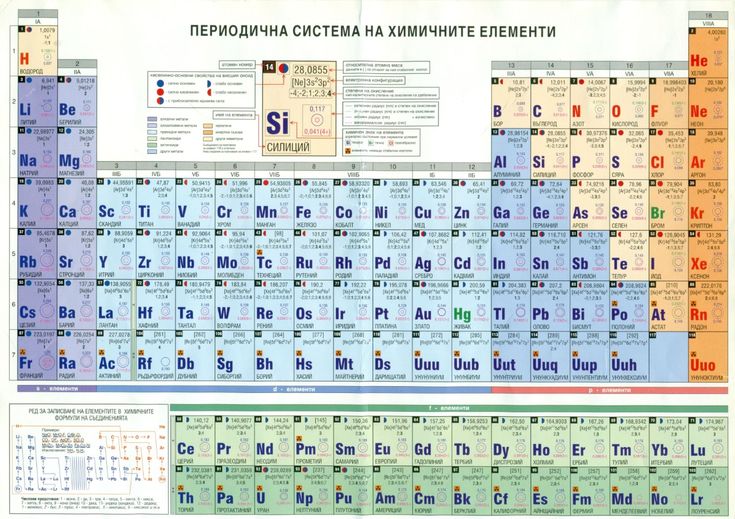
Такие свойства имеют металлы главных подгрупп. Почему? Номер группы соответствует числу электронов на внешней оболочке. Эти электроны называются валентными. Именно они отвечают за возможность соединяться с другими атомами.
Группу составляют элементы с похожим устройством электронной оболочки, а сверху вниз возрастает заряд ядра. В короткопериодной форме каждая группа делится на главную и побочную подгруппы. Представители главных подгрупп — это s и p-элементы, представители побочных подгрупп имеют электроны на d и f-орбиталях.
Как определить валентность химических элементов, если она меняется? Она может совпадать с номером группы или равняться номеру группы минус восемь, а также принимать другие значения.
Важно! Чем выше и правее элемент, тем его свойство образовывать взаимосвязи меньше.
Чем он более смещен вниз и влево, тем она больше.
То, как изменяется валентность в таблице Менделеева для конкретного вида атома, зависит от структуры его электронной оболочки. Сера, например, может быть двух-, четырех- и шестивалентной.
В основном (невозбужденном) состоянии у серы два неспаренных электрона находятся на подуровне 3р. В таком состоянии она может соединиться с двумя атомами водорода и образовать сероводород. Если сера перейдет в более возбужденное состояние, то один электрон перейдет на свободный 3d-подуровень, и неспаренных электронов станет 4.
Сера станет четырехвалентной. Если сообщить ей еще больше энергии, то еще один электрон перейдет с подуровня 3s на 3d. Сера перейдет в еще более возбужденное состояние и станет шестивалентной.
Постоянная и переменная
Иногда способность к образованию химических связей может меняться. Она зависит от того, в какое соединение входит элемент. Например, сера в составе h3S двухвалентна, в составе SO2 четырехвалентна, а в SO3 — шестивалентна. Наибольшее из этих значений называется высшим, а наименьшая — низшим. Высшую и низшую валентности по таблице Менделеева можно установить так: высшая совпадает с номером группы, а низшая равняется 8 минус номер группы.
Наибольшее из этих значений называется высшим, а наименьшая — низшим. Высшую и низшую валентности по таблице Менделеева можно установить так: высшая совпадает с номером группы, а низшая равняется 8 минус номер группы.
Как определить валентность химических элементов и то, изменяется ли она? Нужно установить, имеем мы дело с металлом или неметаллом. Если это металл, нужно установить, относится он к главной или побочной подгруппе.
- У металлов главных подгрупп способность к образованию химических взаимосвязей постоянная.
- У металлов побочных подгрупп — переменная.
- У неметаллов — также переменная. В большинстве случаев она принимает два значения — высшее и низшее, но иногда может быть и большее число вариантов. Примеры — сера, хлор, бром, йод, хром и другие.
Это интересно! Что такое алканы: строение и химические свойства
В соединениях низшую валентность проявляет тот элемент, который находится выше и правее в периодической таблице, соответственно, высшую — тот, который левее и ниже.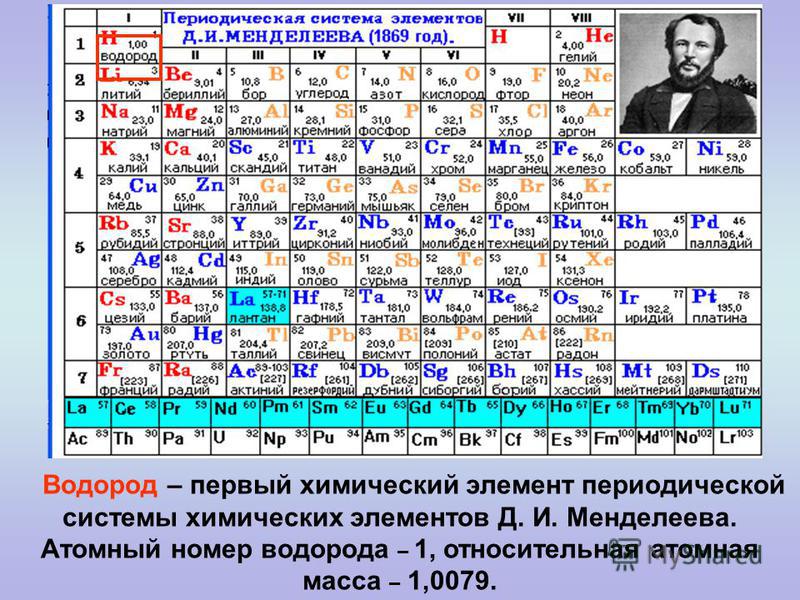
Часто способность образовывать химические связи принимает больше двух значений. Тогда по таблице узнать их не получится, а нужно будет выучить. Примеры таких веществ:
- углерод,
- сера,
- хлор,
- бром.
Как определить валентность элемента в формуле соединения? Если она известна для других составляющих вещества, это несложно. Например, требуется рассчитать это свойство для хлора в NaCl. Натрий — элемент главной подгруппы первой группы, поэтому он одновалентен. Следовательно, хлор в этом веществе тоже может создать только одну связь и тоже одновалентен.
Важно! Однако так не всегда можно узнать это свойство для всех атомов в сложном веществе. Для примера возьмем HClO4. Зная свойства водорода, можно только установить, что ClO4 — одновалентный остаток.
Как еще узнать эту величину?
Способность образовывать определенное количество связей не всегда совпадает с номером группы, и в некоторых случаях ее придется просто заучить. Здесь на помощь придет таблица валентности химических элементов, где приведены значения этой величины. В учебнике химии за 8 класс приведены значения способности соединяться с другими атомами наиболее распространенных видов атомов.
| Н, F, Li, Na, K | 1 |
| O, Mg, Ca, Ba, Sr, Zn | 2 |
| B, Al | 3 |
| C, Si | 4 |
| Cu | 1, 2 |
| Fe | 2, 3 |
| Cr | 2, 3, 6 |
| S | 2, 4, 6 |
| N | 3, 4 |
| P | 3, 5 |
| Sn, Pb | 2, 4 |
| Cl, Br, I | 1, 3, 5, 7 |
Применение
Стоит сказать, что ученые-химики в настоящее время понятие валентности по таблице Менделеева почти не используют. Вместо него для способности вещества образовывать определенное число взаимосвязей применяют понятие степени окисления, для веществ с ковалентной структурой — ковалентность, а для веществ ионного строения — заряд иона.
Вместо него для способности вещества образовывать определенное число взаимосвязей применяют понятие степени окисления, для веществ с ковалентной структурой — ковалентность, а для веществ ионного строения — заряд иона.
Однако рассматриваемое понятие применяют в методических целях. С его помощью легко объяснить, почему атомы разных видов соединяются в тех соотношениях, которые мы наблюдаем, и почему эти соотношения для разных соединений различны.
На данный момент подход, согласно которому соединение элементов в новые вещества всегда объяснялось с помощью валентности по таблице Менделеева независимо от типа связи в соединении, устарел. Сейчас мы знаем, что для ионной, ковалентной, металлической связей существуют разные механизмы объединения атомов в молекулы.
Полезное видео
Подведем итоги
По таблице Менделеева определить способность к образованию химических связей возможно не для всех элементов. Для тех, которые проявляют одну валентность по таблице Менделеева, она в большинстве случаев равна номеру группы. Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.
Для тех, которые проявляют одну валентность по таблице Менделеева, она в большинстве случаев равна номеру группы. Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.
Таблица Менделеева: что это такое и как ей пользоваться
Содержание:
- Что такое таблица Менделеева
- Порядок расположения элементов
- Почему в таблице есть пустые ячейки
- Как определить: металл или неметалл
- Группы элементов
- Что означают символы в ячейках таблицы
- Как определить валентность элементов по таблице
Таблица Менделеева – основное пособие для уроков химии. Из нее можно получить самую важную информацию обо всех известных химических элементах. Это супершпаргалка для решения задач.
Таблицу Менделеева официально разрешено использовать на ОГЭ и ЕГЭ. И если уметь правильно ею пользоваться, то информация из нее может очень помочь при выполнении экзаменационных заданий.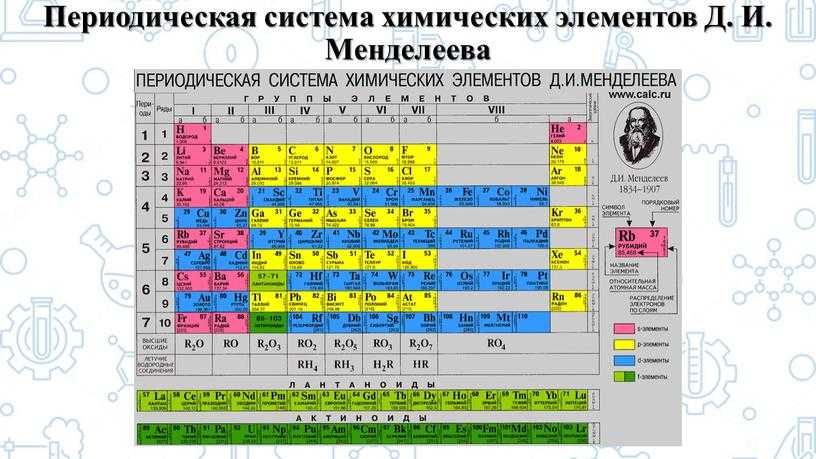
Что такое таблица Менделеева
Известный русский ученый – Дмитрий Иванович Менделеев – открыл в 1869 году периодический закон химических элементов. Суть его заключается в том, что свойства элементов и состоящих из них тел находятся в периодической зависимости от их атомного веса.
К тому времени многие ученые пытались найти способ классифицировать, упорядочить известные на тот момент химические вещества. Дмитрий Иванович собирал и анализировал информацию о различных элементах, фиксировал данные на карточках, а затем многократно раскладывал их на столе, перемещал, чтобы обнаружить логическую связь. И, в конце концов, ему это удалось.
Вот только открытие свое Менделеев совершил за 30 лет до того, как ученые окончательно разобрались со структурой атома. С учетом выявившихся обстоятельств закон был переформулирован: свойства веществ периодически зависят от величины зарядов их ядер.
Таблица, о которой здесь идет речь, является графической демонстрацией этого закона. В ней представлена классификация химических элементов, основанная на их взаимосвязи с величиной заряда атомного ядра.
В ней представлена классификация химических элементов, основанная на их взаимосвязи с величиной заряда атомного ядра.
За период существования таблицы представлялось 3 варианта ее формата: короткий, длинный и сверхдлинный. На настоящее время основным вариантом принято считать длинный. А вот от короткого решено было вовсе отказаться в 1989 году.
Порядок расположения элементов
В таблице вещества располагаются в особом порядке по мере увеличения атомных масс. Нарастание массы можно отметить при движении слева на право по строкам таблицы.
Также элементы объединены в периоды и группы. Всего в таблице 7 периодов и 8 групп.
Периоды можно проследить по горизонтальным рядам.
В каждом периоде у веществ, при увеличении порядкового номера, закономерно изменяются следующие свойства:
- электроотрицательность – она растет;
- неметаллические свойства усиливаются, а металлические, напротив, ослабевают;
- радиус атома уменьшается.
Периоды подразделяются на малые и большие.
Малые периоды – те, что содержат меньшее, чем прочие, количество элементов. К ним относятся первый (в нем всего 2 элемента), второй (8 элементов) и третий (8 элементов).
Оставшиеся 4 периода – большие. В четвертом и пятом периодах расположено по 18 наименований. В шестом сразу 32 элемента, а в седьмом – 24.
Всего рядов в таблице 10. Все малые периоды, а также седьмой состоят из одиночных рядов. А вот четвертый, пятый и шестой занимают по два ряда.
Под строками периодов располагаются элементы, называемые лантаноидами и атиноидами. Эти вещества изучены меньше прочих, так как ядра их из-за радиоактивности весьма неустойчивы.
Почему в таблице есть пустые ячейки
На момент создания таблицы в мире были известны только 63 химических элемента. Однако Менделеев, исходя из открытого им закона, спрогнозировал открытие новых и предусмотрительно оставил для них пустые клеточки.
Ожидания не оказались напрасными. Предположения подтвердились совсем скоро – спустя 6 лет был открыт галлий, еще через 4 года – скандий, после – германий.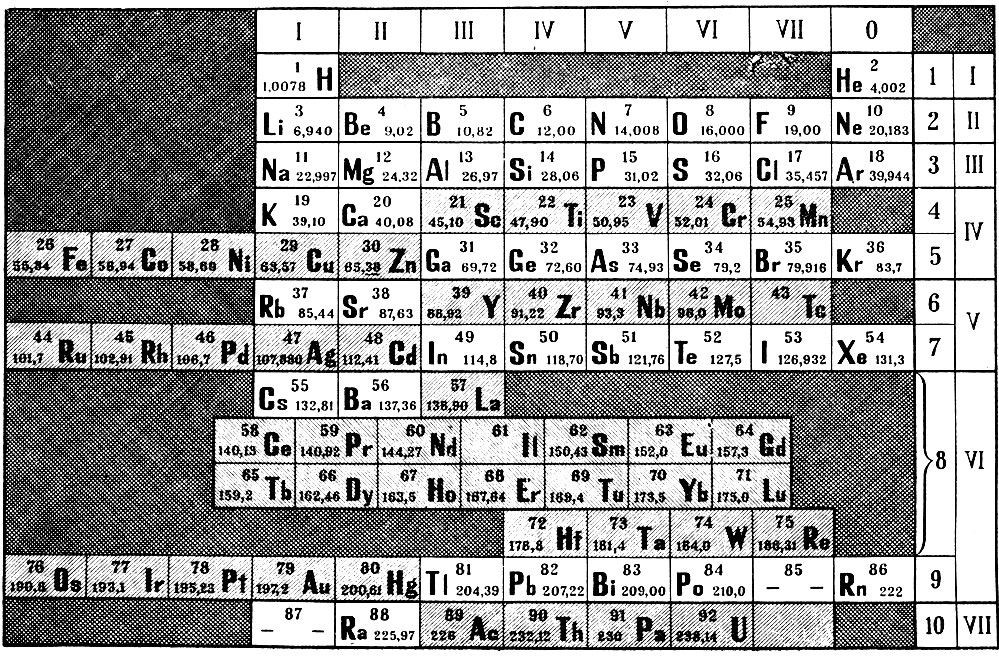
К 2021 году в таблице представлено практически в два раза больше элементов – 118. Последние 4 были открыты сравнительно недавно – в 2016 году. Это теннесин, нихоний, оганесон и московий.
Ученые уверены, что таблица не закончена. На данный момент ведется активный поиск следующего —119 элемента.
Как определить: металл или неметалл
Все большие периоды состоят из четного нечетного ряда. Четные ряды содержат металлические элементы, а нечетные – неметаллические.
Также выявить металлы и неметаллы можно, проведя мысленно линию от бора до полония и астата. Слева от этой черты располагаются металлы, а справа – неметаллы.
Интересно, что элементы, примыкающие к этой линии, обладают свойствами и металлов, и неметаллов одновременно. В связи с эти их называют полуметаллами или подобными металлам — металлоидами.
Группы элементов
Вертикальные ряды в таблице называются группами. В них объединяются вещества, имеющие схожие характеристики и проявляющие одинаковую закономерность изменения их в зависимости от величины атомного числа.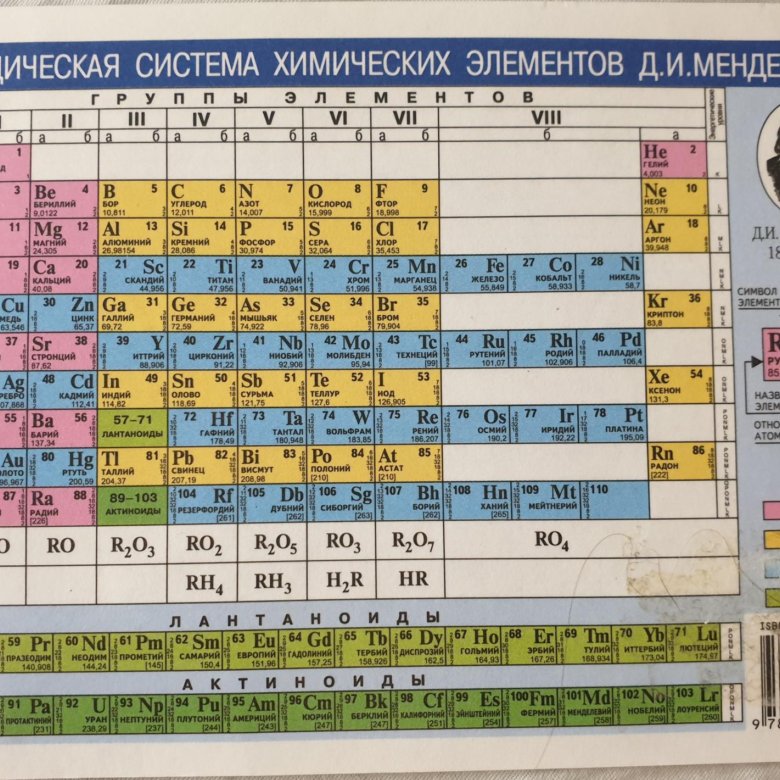
Группы пронумерованы от 1 о 18, начиная слева, где располагаются щелочные металлы, и перемещаясь вправо – к благородным газам.
Если просматривать элементы снизу вверх по группам, то можно обнаружить следующие закономерности:
- радиус атома увеличивается;
- металлические свойства проявляются сильнее, неметаллические выявляются меньше;
- электроотрицательность снижается.
В группах элементы подразделяются на основную и побочную подгруппы. Составляющие побочных подгрупп закрашиваются синим цветом. Причем это могут быть только вещества из больших периодов. Это переходные металлы.
Что означают символы в ячейках таблицы
В каждой клеточке таблицы имеются стандартные значения.
- Название элемента словом. Обычно его размещают под символом.
- Буквенное обозначение. Это общепринятое сокращение названия вещества. Символ обычно состоит из одной или двух букв латиницы. Обозначение указывается в центре ячейки.
- Атомный номер.
 Указывается в верхней части клеточки, в центре или в углу. Это стандартно целое число от 1 до 118.
Указывается в верхней части клеточки, в центре или в углу. Это стандартно целое число от 1 до 118. - Массовое число. Его определяют по атомной массе, округляя ее. Значение обычно располагается в нижней части ячейки.
Как определить валентность элементов по таблице
Валентностью называет свойство элементов формировать связи.
Валентность может быть постоянной или же меняться в зависимости от состава вещества, в которое включен элемент.
Чтобы узнать постоянную валентность из таблицы, нужно посмотреть, в какой группе располагается элемент. Валентность совпадает с ее номером.
Переменную же валентность следует высчитывать по формуле. Из 8 (число групп) нужно вычесть номер группы, в которой располагается элемент.
Так, постоянная валентность элементов из первой группы будет равна 1. А у мышьяка из пятой группы постоянная валентность равна 5, а переменная рассчитывается так: 8-5=3.
Это только некоторые особенности чтения таблицы. На самом же деле из этого пособия получится извлечь еще немало полезного.
Таким образом, освоив лишь несколько правил чтения таблицы Менделеева, можно значительно улучшить свои знания по химии.
Mendeleev 2.2 Таблица Менделеева
- формат exe
- размер 2.63 МБ
- добавлен 16 сентября 2008 г.
Очень красиво оформленная программа с подробной информацией об элементах таблицы Менделеева. По каждому элементу выводятся подробные данные: порядковый номер, группа, период, атомная масса, электроотрицательность, температура плавления, температура кипения, плотность, степени окисления. Что примечательно в данной программе – есть теория развития периодической системы, так что из нее можно узнать описания еще не открытых элементов, вплоть до 215-го.
Похожие разделы
- Абитуриентам и школьникам
- ВНО / ЗНО
- ЗНО по химии
- Абитуриентам и школьникам
- ЕГЭ
- Абитуриентам и школьникам
- ОГЭ / ГИА / ДПА
- ОГЭ / ГИА / ДПА по химии
- Абитуриентам и школьникам
- Химия
- Академическая и специальная литература
- Автоматизация
- Автоматизация химической промышленности
- Академическая и специальная литература
- Безопасность жизнедеятельности и охрана труда
- Охрана труда на предприятии
- Охрана труда в химической промышленности
- Академическая и специальная литература
- Безопасность жизнедеятельности и охрана труда
- Пожаровзрывобезопасность
- Пожаровзрывобезопасность на производствах
- Академическая и специальная литература
- Безопасность жизнедеятельности и охрана труда
- Радиационная, химическая и биологическая безопасность
- Академическая и специальная литература
- Биологические дисциплины
- Биохимия
- Академическая и специальная литература
- Геологические науки и горное дело
- Геохимия
- Академическая и специальная литература
- Медицинские дисциплины
- Фармацевтика
- Медицинская химия и разработка лекарств
- Академическая и специальная литература
- Медицинские дисциплины
- Фармацевтика
- Фармацевтическая и токсикологическая химия
- Академическая и специальная литература
- Наноматериалы и нанотехнологии
- Нанохимия
- Академическая и специальная литература
- Науки о Земле
- Гидрология
- Гидрохимия
- Академическая и специальная литература
- Науки о Земле
- Почвоведение
- Химия почв
- Академическая и специальная литература
- Педагогика
- Методики преподавания
- Методика преподавания химии
- Академическая и специальная литература
- Пищевая промышленность
- Пищевая химия
- Академическая и специальная литература
- Сельское хозяйство
- Агрохимия
- Академическая и специальная литература
- Транспорт
- Двигатели внутреннего сгорания (ДВС)
- Химмотология горюче-смазочных материалов
- Академическая и специальная литература
- Экологические дисциплины
- Обращение с отходами
- Сточные воды и их очистка
- Промышленные сточные воды и их очистка
- Очистка сточных вод предприятий химической промышленности
- Академическая и специальная литература
- Экологические дисциплины
- Экологическая химия
- Академическая и специальная литература
- Языки и языкознание
- Английский язык
- Для специалистов / English for Specific Purposes
- Для химических специальностей / English for Chemistry
- Стандарты
- Межгосударственные стандарты (МС)
- МС (ГОСТ) Химия и химическая промышленность
- Стандарты
- Стандарты России
- ГОСТ
- ГОСТ Химия и химическая промышленность
- Стандарты
- Стандарты России
- ГОСТ Р
- ГОСТ Р Химия и химическая промышленность
- Стандарты
- Стандарты России
- Технические условия (ТУ)
- ТУ Химия и химическая промышленность
- Учебные планы, программы и нормативная документация
- Для средней школы
- Химия
- Учебные планы, программы и нормативная документация
- Химия и химическая промышленность
Смотрите также
- формат jpg, htm, gif
- размер 1.
 88 МБ
88 МБ - добавлен 30 октября 2009 г.
Балтийский Военно-Морской институт, для индивидуальной работы по химии, все файлы скрытые кроме файла “Периодическая система Менделеева” с которого начинается работаrn
software
- формат exe
- размер 154.22 КБ
- добавлен 17 июня 2011 г.
Электронная периодическая система элементов Менделеева. 06.2000 Программа без инсталляции Показывает: Название Плотность Температура пл. Температура кип. Распр. в земной коре Атомная масса Электроотрицательность Степени окисления Открытиеrn
- формат jar
- размер 18.48 КБ
- добавлен
22 ноября 2008 г.

Простая и удобная в использовании периодическая система Менделеева для смартфонов с Symbian и мобильных телефонов. Установычный файл имеет расширение .jarrn
- формат exe
- размер 482.41 КБ
- добавлен 18 декабря 2008 г.
Таблица Менделеева. Показывает порядковый номер элемента, атомную массу, электроотрицательность и т. д.rn
- формат exe, gif, htm
- размер 1.23 МБ
- добавлен 06 февраля 2009 г.
Периодическая Таблица Менделеева (Периодическая система элементов) – классификация химических элементов, позволяющая выявить зависимость их различных свойств от числа протонов в атомном ядре. Первоначально система разработана русским химиком Д.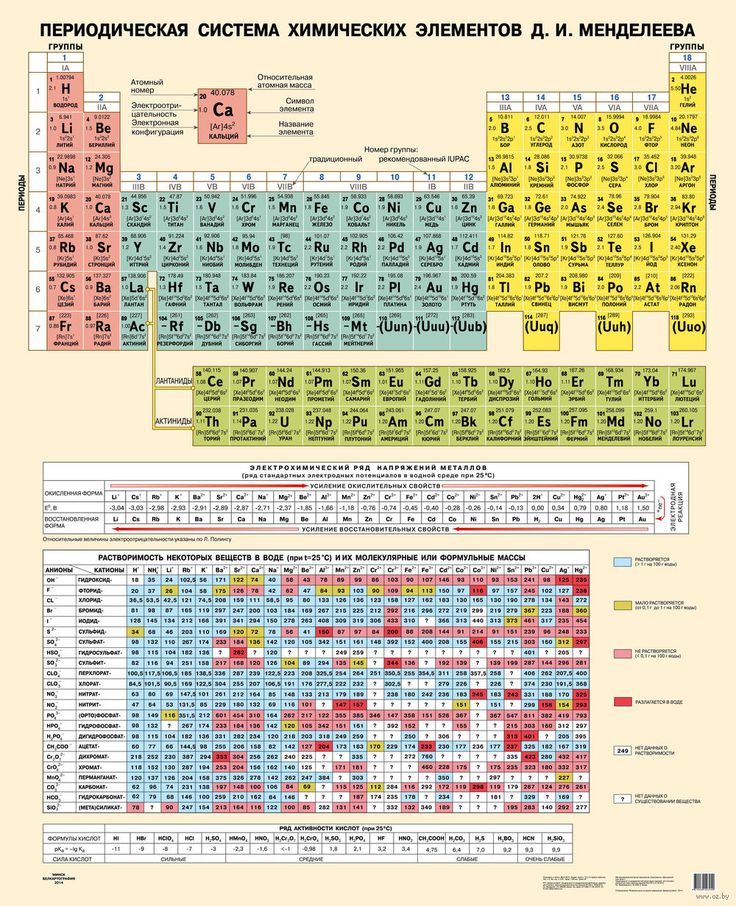 И. Менделеевым в 1869—1871 годы на основании открытого им в 1869 году периодического закона зависимости свойств элементов от атомной массы и является его графическим выражением. Всего предложено несколько…
И. Менделеевым в 1869—1871 годы на основании открытого им в 1869 году периодического закона зависимости свойств элементов от атомной массы и является его графическим выражением. Всего предложено несколько…
software
- формат exe
- размер 153.48 КБ
- добавлен 16 октября 2010 г.
Таблица Менделеева. Небольшая программа, установки не требует. Для каждого элемента даны основные сведения: обозначение, атомный номер, атомная масса, температура плавления, температура кипения, валентность, электронная формула. В справке приводятся краткие сведения о группах элементов.rn
- формат exe
- размер 486.35 КБ
- добавлен 10 июня 2009 г.
Программа-иллюстратор периодической таблицы химических элементов Д. Менделеева. “ГОУ ВПО «Уральский государственный технический университет – УПИ имени первого президента России Б. Н. Ельцина» Подготовлен мартериал кафедрой “РЭИС”rn
Менделеева. “ГОУ ВПО «Уральский государственный технический университет – УПИ имени первого президента России Б. Н. Ельцина» Подготовлен мартериал кафедрой “РЭИС”rn
- формат exe
- размер 1.68 МБ
- добавлен 06 апреля 2010 г.
Программа без инсталяции. Имеет подробное описание каждого элемента в отдельности, т. е. – год открытия, кем открыт, физические и химические св-ва, использование в промышленности и т. д. . .rn
software
- формат zip
- размер 1.06 МБ
- добавлен 29 июня 2011 г.
Изучайте таблицу Менделеева вместе с Сократикой. Более 30 фактов о каждом элементе. Аудиоклипы с названиями элементов. Проверьте свои знания, пройдя тест. Быстрый доступ к нужному элементу через таблицу, поиск или индекс. Русский интерфейс: Да Системные требования (Android OS all). Лицензия (freeware). Автор неизвестен.rn
Проверьте свои знания, пройдя тест. Быстрый доступ к нужному элементу через таблицу, поиск или индекс. Русский интерфейс: Да Системные требования (Android OS all). Лицензия (freeware). Автор неизвестен.rn
- формат exe
- размер 2 МБ
- добавлен 22 марта 2009 г.
Электронная периодическая таблица Менделеева Talbica. Talbica NC – это. 52 параметра для каждого элемента периодической системы. Простота в использовании, стильный дизайн, скорость и мощь. Скоростная система «всплывающих подсказок». Продвинутая система справки, позволяющая добавлять/редактировать данные. “Умная” таблица растворимости, показывающая формулу и массу вещества. Калькулятор, считающий массу введённого вещества. Универсальный переводчик…
Менделеевские числа: прорыв в химии?
Таблица Менделеева изучается уже 150 лет, и, казалось бы, про нее давно все известно. Но нет!
Но нет!
Ученые из «Сколтеха» изучили менделеевские числа и придумали метод, который позволяет распределять соединения по их физическим свойствам. А рассчитать, как поведет себя вещество, можно даже на бумажке!
Рассказывает кристаллограф-теоретик Артем Оганов, профессор «Сколтеха», профессор РАН, член Европейской академии и действительный член Королевского химического общества, Американского физического общества и Минералогического общества Америки.
Скрытые менделеевские числаМенделеевские числа к самому Менделееву отношения не имеют. Их предложил в 1984 году британский выдающийся физик Дэвид Петтифор. Предложил в одной коротенькой статье, которая наделала много шума, вошла во многие западные учебники и вызвала множество вопросов. Было понятно, что эта концепция работает, но было совершенно неясно, откуда она взялась и почему она работает. Мы разобрались с этими вопросами. В конце 2020 года вышла наша статья на эту тему.
Что такое менделеевские числа? Это попытка развернуть двухмерную таблицу Менделеева в виде ряда элементов — такого, чтобы соседние элементы были максимально похожи друг на друга. Попробуйте это сделать, и вы сразу же натолкнетесь на большие сложности. И сразу же понятно, что порядковый номер элементов в таблице Менделеева не дает вам такой последовательности. Потому что в конце периода и в начале периода — огромные скачки свойств.
Попробуйте это сделать, и вы сразу же натолкнетесь на большие сложности. И сразу же понятно, что порядковый номер элементов в таблице Менделеева не дает вам такой последовательности. Потому что в конце периода и в начале периода — огромные скачки свойств.
Например, водород и гелий идут подряд в таблице, но у них очень мало схожего. Или посмотрите на фтор, неон, натрий. Все три элемента обладают диаметрально противоположными характеристиками, а они ближайшие соседи. И, понятное дело, нужно каким-то другим образом эту таблицу развернуть в ряд, чтобы соседние элементы обладали похожими свойствами. Делать это совершенно без скачков невозможно: свойства атомов будут скакать. Математическая задача состоит в том, чтобы расположить атомы так, чтобы изменение их свойств было максимально плавным.
Вообще, такую формулировку, как «максимальная плавность», я произношу впервые. Петтифор таких слов не говорил, он просто показал «фокус-покус». Он сказал: «Вот есть такая последовательность, откуда я ее взял, вас не касается». Это единственная статья такого рода во всей научной литературе! И вот, мол, возьмите такую последовательность, и вы увидите, что в химическом пространстве на пересечении осей Y и Х, на которых вы откладываете элементы этой странной последовательности менделеевских чисел, будут разные химические системы. И соседние точки на химическом пространстве будут обладать похожими свойствами. Это означает, что, если у вас есть какой-то хороший материал, в этом химическом пространстве вокруг него будут кучковаться другие хорошие материалы. Так появляется какая-то очевидность и наглядность.
Это единственная статья такого рода во всей научной литературе! И вот, мол, возьмите такую последовательность, и вы увидите, что в химическом пространстве на пересечении осей Y и Х, на которых вы откладываете элементы этой странной последовательности менделеевских чисел, будут разные химические системы. И соседние точки на химическом пространстве будут обладать похожими свойствами. Это означает, что, если у вас есть какой-то хороший материал, в этом химическом пространстве вокруг него будут кучковаться другие хорошие материалы. Так появляется какая-то очевидность и наглядность.
Соединения с особо хорошими свойствами у вас занимают какую-то компактную часть химического пространства. Мало того что это дает вам наглядность и интуицию, куда смотреть в поисках хорошего материала, вы можете создать алгоритм! Допустим, вы ищите хорошие сверхпроводники, и, если они скучкованны, вы быстро понимаете, куда двигаться, и фокусируетесь на этой области. И так вы сможете найти самый твердый материал, самый магнитный материал, самый сверхпроводящий материал и т. д.
д.
Бинарные соединения легко визуализировать: их химическое пространство — это просто плоский лист бумаги. А тройные соединения — это уже куб. Четвертные соединения визуализировать никак не получится, разве что в проекции. Но вы можете создать алгоритм, который будет справляться с соединениями любой химической сложности, ведь для компьютера любое четырехмерное или даже двадцатимерное пространство совершенно не проблема.
Кстати, даже в бинарном пространстве эта проблема совершенно нетривиальная и очень-очень сложная. Там будет 2000 бинарных систем, и в каждой можно придумать огромное число соединений. Какие-то из них будут стабильными, какие-то нет, и заранее не всегда понятно какие. Для каждого соединения можно придумать астрономическое множество кристаллических структур, а это тоже будет определять свойства.
Если мы повышаем химическую сложность и идем к тройным-четверным системам, то там становится чудовищно сложно.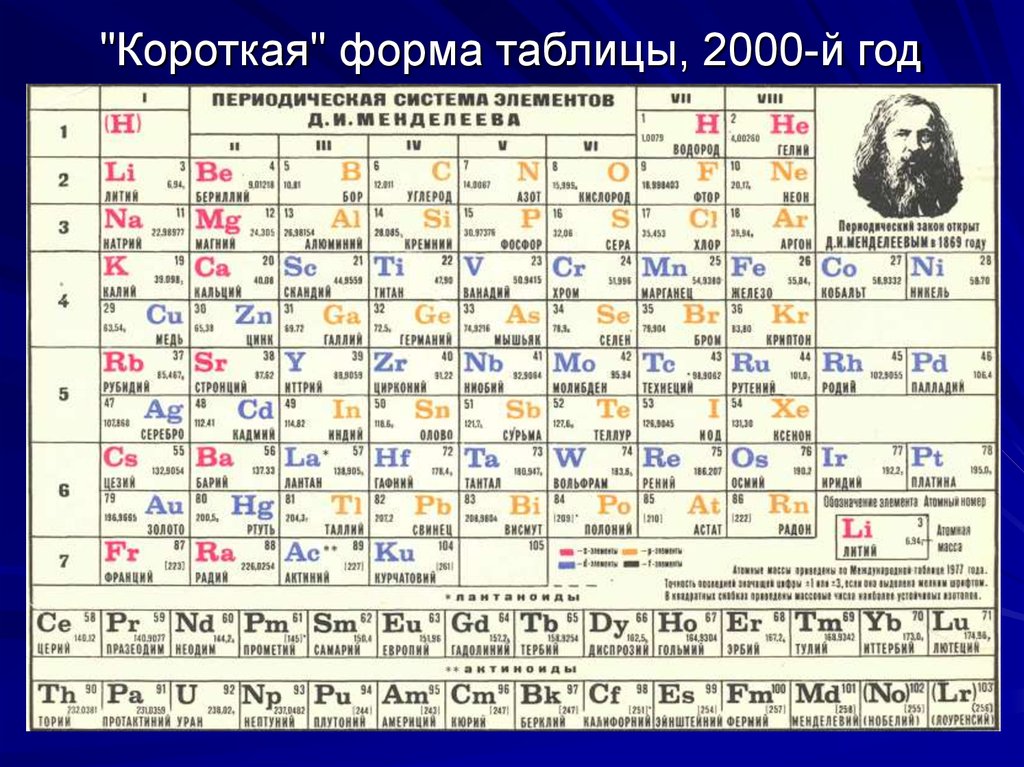 Сами посудите, сколько известно соединений четырех элементов. Углерод, водород, азот, кислород — вся органика, бессчетное множество! Мы используем менделеевские числа только для визуализации: когда нужно построить химическое пространство для бинарных или тройных соединений и мы хотим увидеть, где именно живут хорошие соединения. Но на самом деле компьютеру проще и лучше справляться с более сложным пространством.
Сами посудите, сколько известно соединений четырех элементов. Углерод, водород, азот, кислород — вся органика, бессчетное множество! Мы используем менделеевские числа только для визуализации: когда нужно построить химическое пространство для бинарных или тройных соединений и мы хотим увидеть, где именно живут хорошие соединения. Но на самом деле компьютеру проще и лучше справляться с более сложным пространством.
Дэвид Петтифор придумал эти менделеевские числа, но никому не сказал, откуда он их взял. И этот вопрос у меня висел где-то в подкорке лет 15. С 2004 года я знаю про менделеевские числа, и у кого я ни спрашивал, никто не знает, что это за ерунда. Почти случайно я смог понять, что это такое. В кристаллохимии есть основной закон — закон Гольдшмидта. Он говорит (а это самая важная характеристика вещества): кристаллическую структуру определяют соотношения атомов и свойства атомов. Три свойства являются основными: это радиус, электроотрицательность и поляризуемость (два последних коррелируют, это почти одно и то же). И если вы построите это пространство: по оси Y у вас будет электроотрицательность, а по оси X — радиус, вы увидите, что точки, каждая из которых соответствует какому-нибудь элементу, имеют свойство располагаться в форме очень сильно вытянутого облака. И это означает, что вы можете сделать примитивное координатное преобразование, где главная координата у вас будет вдоль оси удлинения этого облака, а второстепенная будет перпендикулярна ей. Менделеевское число будет не чем иным, как главной координатой. То есть это наилучший способ описать химию элемента одним числом.
И если вы построите это пространство: по оси Y у вас будет электроотрицательность, а по оси X — радиус, вы увидите, что точки, каждая из которых соответствует какому-нибудь элементу, имеют свойство располагаться в форме очень сильно вытянутого облака. И это означает, что вы можете сделать примитивное координатное преобразование, где главная координата у вас будет вдоль оси удлинения этого облака, а второстепенная будет перпендикулярна ей. Менделеевское число будет не чем иным, как главной координатой. То есть это наилучший способ описать химию элемента одним числом.
Такова природа. На самом деле еще Петтифор в 1984 году показал, что его менделеевское число, взятое непонятно откуда, с потолка, работает. Но, поняв принцип, как определять менделеевские числа, я смог переопределить их. Наша последовательность менделеевских чисел похожа на петтифоровскую, но есть серьезное отличие. И если вы посмотрите на то, как группируются соединения с похожими свойствами с нашим менделеевским числом, то качество группировки значительно выше, чем у Петтифора.
Мы поняли принцип, как построить химическое пространство, но в алгоритме фигурирует полное координатное описание. Второстепенная координата тоже должна учитываться там, где вы не ищете наглядность, а ищете точность. Подчеркну: наш подход не эмпирический. Эта идея понижения размерности пространства, в общем-то, тривиальна. Удивительно, что никто к этой идее не пришел раньше. И получается так: когда мы переопределяем последовательность менделеевских чисел, она работает лучше, чем петтифоровский вариант и чем те варианты, которые делались на искусственном интеллекте. Я получил огромное удовольствие от решения этой старинной загадочки.
«Что же из этого следует?»Можно ли с помощью этого открыть что-то классное? Конечно, можно! И Петтифор это делал не для развлечения. Если речь идет о двойных или тройных соединениях, вы можете на листочке бумаги без компьютера прикинуть, к какому классу соединений будет относиться ваше вещество, какого типа свойств от него ожидать. Кстати говоря, мы строили модели. Знаете, что мы делали? Мы взяли химическое пространство, вычеркнули из него большую часть данных, около половины, а потом попытались восстановить эти данные по оставшимся. И все работает!
Кстати говоря, мы строили модели. Знаете, что мы делали? Мы взяли химическое пространство, вычеркнули из него большую часть данных, около половины, а потом попытались восстановить эти данные по оставшимся. И все работает!
Есть приятные удивления, есть неприятные удивления. Начну с неприятных. Если вы смотрите на нашу последовательность или на петтифоровскую последовательность, там будут такие странные соседства (и это мы относим к толщине, которой мы пренебрегли): например, соседями оказываются железо и йод — не очень похожие элементы. В целом свойства у них не диаметрально противоположные. Но, конечно, сказать, что йод и железо — близнецы-братья, никому не придет в голову.
Что касается приятных сюрпризов: если вы посмотрите на этот ряд, то совершенно очевидно становится, куда класть водород. Среди химиков ведутся споры, похожие на борьбу с ветряными мельницами (и меня лично они забавляют), о том, как лучше рисовать таблицу Менделеева: короткой или длинной? Водород ставить над щелочными металлами или над галогенами? Так вот, правильный ответ: над галогенами. Он в последовательности менделеевских чисел — что в нашей, что в петтифоровской — ровно там, где фтор и хлор.
Он в последовательности менделеевских чисел — что в нашей, что в петтифоровской — ровно там, где фтор и хлор.
Напоследок хочу рассказать еще об одном исследовании. 14 октября 2020 года человечество впервые получило комнатную сверхпроводимость. Это экспериментальные результаты группы из США, которые были опубликованы в самом престижном научном журнале Nature. Я к этому исследованию не имею отношения, но очень впечатлен результатом и работой. Что это за соединение, непонятно, химический анализ сделать не удалось, как и определить кристаллическую структуру. Это удивительный пример: какая-то штука сверхпроводит при комнатной температуре, но что это за штука, пока никто не знает! Это было достигнуто при давлении свыше 2,5 млн атмосфер. Практического применения этот результат, к сожалению, не будет иметь. Я бы очень хотел создать комнатный сверхпроводник при нормальных условиях. 2,5 млн атмосфер, как в том американском исследовании, — это, конечно, чудовищное давление. Возможна ли комнатная сверхпроводимость при нормальном давлении — вот это вопрос.
На сайте могут быть использованы материалы интернет-ресурсов Facebook и Instagram, владельцем которых является компания Meta Platforms Inc., запрещённая на территории Российской Федерации
Хемофилия
Остальные теги
Расскажите друзьям
- Что было раньше
Раскрыт секрет изготовления знаменитых цветных стеклянных бусин викингов
- Социальное животное
Психофизиологи выяснили, почему люди во время долгого общения начинают говорить похоже
- Околонаука
Объявлены обладатели Нобелевской премии этого года по физике
- Хемофилия
- 42
Тайна зарождения жизни: химики раскрыли механизм образования пептидов в воде
- Хтоническое
Геофизики предсказывают обратное слияние континентов
Установка для создания атомного лазера
Scixel
Физики создали атомный лазер, который может работать вечно
Сахар: отказываться или нет?
Shutterstock
Ученые объяснили, почему рыба морской дракон выглядит так странно
Сергей Корсаков / @serg_korsakov / Роскосмос
Российский космонавт поделился фантастическими фотографиями с орбиты
Shutterstock
Роботы и искусство: совместимы ли эти понятия?
Хотите быть в курсе последних событий в науке?
Оставьте ваш email и подпишитесь на нашу рассылку
Ваш e-mail
Нажимая на кнопку «Подписаться», вы соглашаетесь на обработку персональных данных
Первая версия периодической таблицы год.
 История создания и развития. Переход от атомных весов к заряду ядра
История создания и развития. Переход от атомных весов к заряду ядраЕсли таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. И наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
Шаги
Часть 1
Структура таблицы
Как видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент. Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение.
 Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
Узнайте, почему в таблице присутствуют пустые ячейки. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.

- Элементы с атомными номерами с 57 по 102 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода – 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами.
 Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними.
Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними. Часть 2
Обозначения элементовКаждый элемент обозначается одной или двумя латинскими буквами. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
Обратите внимание на полное название элемента, если оно приведено в таблице.
 Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.
Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента. Элементы имеют атомные номера от 1 до 118.
- Атомный номер всегда является целым числом.
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!
- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.

- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.
Обычно количество электронов равно числу протонов. Исключением является тот случай, когда атом ионизирован. Протоны имеют положительный, а электроны – отрицательный заряд. Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.
- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс». Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
- Знаки «плюс» и «минус» не ставятся, если атом не является ионом.
Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу).
Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
См. также: Список химических элементов по атомным номерам и Алфавитный список химических элементов Содержание 1 Символы, используемые в данный момент … Википедия
См. также: Список химических элементов по символам и Алфавитный список химических элементов Это список химических элементов, упорядоченный в порядке возрастания атомных номеров. В таблице приводятся название элемента, символ, группа и период в… … Википедия
В таблице приводятся название элемента, символ, группа и период в… … Википедия
– (ИСО 4217) Коды для представления валют и фондов Codes for the representation of currencies and funds (англ.) Codes pour la représentation des monnaies et types de fonds (фр.) … Википедия
Простейшая форма материи, которая может быть идентифицирована химическими методами. Это составные части простых и сложных веществ, представляющие собой совокупность атомов с одинаковым зарядом ядра. Заряд ядра атома определяется числом протонов в … Энциклопедия Кольера
Содержание 1 Эпоха палеолита 2 10 е тысячелетие до н. э. 3 9 е тысячелетие до н. э … Википедия
Содержание 1 Эпоха палеолита 2 10 е тысячелетие до н. э. 3 9 е тысячелетие до н. э … Википедия
У этого термина существуют и другие значения, см. Русские (значения). Русские … Википедия
Терминология 1: : dw Номер дня недели. «1» соответствует понедельнику Определения термина из разных документов: dw DUT Разность между московским и всемирным координированным временем, выраженная целым количеством часов Определения термина из… … Словарь-справочник терминов нормативно-технической документации
Как всё начиналось?
Многие известные именитые химики на рубеже XIX-XX веков уже давно заметили, что физические и химические свойства многих химических элементов очень похожи друг на друга.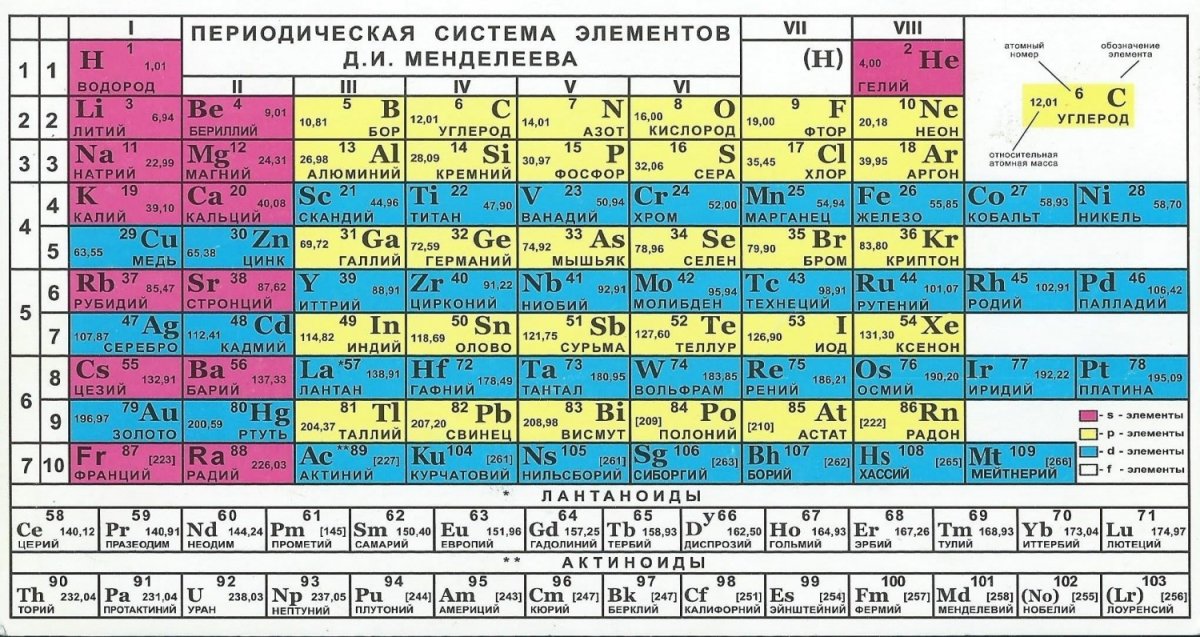 Так например Калий, Литий и Натрий – все являются активными металлами, которые при взаимодействии с водой образают активные гидроксиды этих металлов; Хлор, Фтор, Бром в своих соединениях с водородом проявляли одинаковую валентность равную I и все эти соединения являются сильными кислотами. Из этой похожести давно напрашивался вывод, что все известные химические элементы можно объединить в группы, причём так чтобы у элементов каждой группы был определённый набор физико-химических характеристик. Однако часто такие группы были неверно составлены из разных элементов различными учёными и долгое время многими игнорировалась одна из главных характеристик элементов – это их атомная масса. Игнорировалась она потому, что была и есть разная у различных элементов, а значит её не могли использовать в качестве параметра для объединения в группы. Исключение составил лишь франзуский химик Александр Эмиль Шанкуртуа, он попытался расположить все элементы в трёхмерной модели по винтовой линии, но его работа не была признана научным сообществом, а модель получилась громоздкая и неудобная.
Так например Калий, Литий и Натрий – все являются активными металлами, которые при взаимодействии с водой образают активные гидроксиды этих металлов; Хлор, Фтор, Бром в своих соединениях с водородом проявляли одинаковую валентность равную I и все эти соединения являются сильными кислотами. Из этой похожести давно напрашивался вывод, что все известные химические элементы можно объединить в группы, причём так чтобы у элементов каждой группы был определённый набор физико-химических характеристик. Однако часто такие группы были неверно составлены из разных элементов различными учёными и долгое время многими игнорировалась одна из главных характеристик элементов – это их атомная масса. Игнорировалась она потому, что была и есть разная у различных элементов, а значит её не могли использовать в качестве параметра для объединения в группы. Исключение составил лишь франзуский химик Александр Эмиль Шанкуртуа, он попытался расположить все элементы в трёхмерной модели по винтовой линии, но его работа не была признана научным сообществом, а модель получилась громоздкая и неудобная.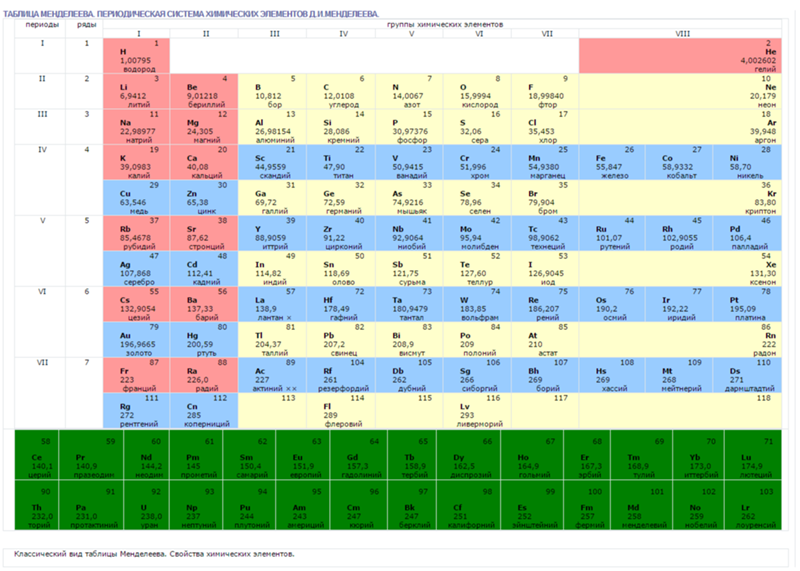
В отличие от многих учёных, Д.И. Менделеев взял атомную массу (в те времена ещё “Атомный вес”) как ключевой параметр при классификации элементов. В своём варианте Дмитрий Иванович расположил элементы по возрастанию их атомных весов и вот тут обозначилась закономерность, что через определённые промежутки элементов их свойства периодически повторяются. Правда пришлось сделать и исключения: некоторые элементы были поменяны местами и не соответствовали возрастанию атомных масс (например, теллур и йод), но зато соответствовали свойствам элементов. Дальнейшее развитие атомно-молекулярного учения оправдало такие подвижки и показало справедливость этой расстановки. Подробнее об этом вы можете прочесть в статье “В чём открытие Менделеева”
Как мы можем видеть, расположение элементов в этом варианте совсем не такое, какое мы видим в совремнном виде. Во первых, группы и периоды поменяны местами: группы по горизонтали, периоды по вертикали, а во-вторых, самих групп в нём как-то многовато – девятнадцать, вместо принятых на сегодня восемнадцати.
Однако, спустя всего год, в 1870-м Менделеев сформировал новый вариант таблицы, который уже более узнаваем нами: подобные элементы выстроены по вертикали, образуя группы, а 6 периодов расположены по горизонтали. Особенно примечательно то, что и в первом и во втором варианте таблицы виднеются существенные достижения, коих не было у его предшественников: в таблице заботливо оставлены места под элементы которые, по мнению Менделеева, ещё предстояло открыть. Соответствующие вакантные места обозначены им знаком вопроса и вы можете видеть их на рисунке выше. В дальнейшем были действительно открыты соответствующие элементы: Галий, Германий, Скандий. Таким образом Дмитрий Иванович не только систематезировал элементы в группы и периоды, но и предсказал открытие новых, ещё не известных, элементов.
В дальнейшем, после разрешения многих актуальных загадок химии того времени – открытие новых элементов, выделение группы благородных газов совместно с участием Уильяма Рамзая, установления того факта, что Дидимий вовсе не является самостоятельным элементом, а является смесью двух других, – были опубликованы всё новые и новые варианты таблицы, подчас имеющих даже вовсе и не табличный вид. Но не будем приводить здесь их все, а приведём лишь конечный вариант, сформировавшийся ещё при жизни великого учёного.
Но не будем приводить здесь их все, а приведём лишь конечный вариант, сформировавшийся ещё при жизни великого учёного.
Переход от атомных весов к заряду ядра.
К сожалению, Дмитрий Иванович не дожил до планетарной теории строения атома и не видел триумф опытов Резерфорда, хотя именно с его открытиями начинается новая эпоха в развитии периодического закона и всей периодической системы. Напомню что из опытов, проводимых Эрнестом Резерфордом, следовало, что атомы элементов состоят из положительно-заряженного атомного ядра и обращающихся вокруг ядра отрицательно-заряженных электронов. После определения зарядов атомных ядер всех, известных на тот момент, элементов, выяснилось, что в периодической системе они располагаются в соответствии с зарядом ядра. А периодический закон приобрёл новый смысл, теперь он стал звучать так:
“Свойства химических элементов, а также формы и свойства, образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов”
Теперь стало понятно, почему некоторые более лёгкие элементы были поставлены Менделеевым позади их более тяжёлых предшественников, – всё дело в том, что так они стоят по порядку зарядов их ядра. Например, теллур тяжелее йода, однако стоит в таблице раньше него, ибо заряд ядра его атома и количество электронов равняется 52, а у йода – 53. Можете посмотреть на таблицу и убедиться в этом сами.
Например, теллур тяжелее йода, однако стоит в таблице раньше него, ибо заряд ядра его атома и количество электронов равняется 52, а у йода – 53. Можете посмотреть на таблицу и убедиться в этом сами.
После открытия строения атома и атомного ядра, периодическая система претерпевала ещё несколько изменений, пока, наконец, не достигла вида, уже знакомого нам со школы, короткопериодного варианта таблицы Менделеева.
В этой таблице нам знакомо уже всё: 7 периодов, 10 рядов, побочные и главные подгруппы. Также со временем открытия новых элементов и наполнения ими таблицы, пришлось вынести в отдельные ряды элементы подобные Актинию и Лантану, все они соответственно были названы Актиноидами и Лантаноидами. Эта версия системы просуществовала очень долго – в мировом научном сообществе практически до конца 80х, начала 90х, а в нашей стране и того дольше – до 10х годов нынешнего столетия.
Современный вариант таблицы Менделеева.
Однако, тот вариант, которые многие из нас проходили в школе на деле оказывается весьма запутанным, а путаница выражается в разделении подгрупп на главные и побочные и запоминание логики отображения свойств элементов становится достаточно сложным. Конечно, несмотря на это, многие по нему учились, становились докторами химических наук, но всё же в современности ему на смену пришёл новый вариант – длиннопериодный. Отмечу, что именно этот вариант является одобренным IUPAC (международным союзом теоретической и прикладной химии). Давайте взглянем на него.
Конечно, несмотря на это, многие по нему учились, становились докторами химических наук, но всё же в современности ему на смену пришёл новый вариант – длиннопериодный. Отмечу, что именно этот вариант является одобренным IUPAC (международным союзом теоретической и прикладной химии). Давайте взглянем на него.
На смену восьми группам пришли восемнадцать, среди которых нет уже никакого разделения на главные и побочные, а все группы продиктованы расположением электронов в атомной оболочке. Заодно избавились и от двухрядных и однорядных периодов, теперь все периоды содержат только один ряд. Чем же удобен такой вариант? Теперь периодичность свойств элементов просматривается более наглядно. Номер группы, по сути, обозначает количество электронов во внешнем уровне, в связи с чем все главные подгруппы старого варианта расположились в первой, второй и с тринадцатой по восемнадцатую группу, а все “бывшие побочные” группы разместились в середине таблицы. Тем самым теперь из таблицы хорошо видно, что если это первая группа – то это щелочные металлы и никаких вам меди или серебра, и видно, что все транзитные металлы хорошо демонстрируют схожесть их свойств в связи с заполнением d-подуровня, в меньшей степени влияющим на внешние свойства, также как и лантаноиды и актиноиды проявляют подобные свойства по причине разного лишь f-подуровня. Таким образом, вся таблица разбита на следующие блоки: s-блок, на котором заполняются s-электроны, d-блок, p-блок и f-блок, с заполнением d, p, и f-электронов соответственно.
Таким образом, вся таблица разбита на следующие блоки: s-блок, на котором заполняются s-электроны, d-блок, p-блок и f-блок, с заполнением d, p, и f-электронов соответственно.
К сожалению, в нашей стране этот вариант включился в школьные учебники лишь в последние 2-3 года, да и то не во все. И очень напрасно. С чем это связано? Ну во-первых, с застойными временами в лихие 90-е, когда в стране не было вообще никакого развития, не говоря уж о сфере образования, а именно в 90е годы мировое химическое сообщество перешло на этот вариант. Во-вторых, с лёгкой инертностью и тяжестью восприятия всего нового, ведь нашим преподавателям привычен именно старый, короткопериодный вариант таблицы, несмотря на то, что при изучении химии он гораздо сложнее и менее удобен.
Расширенный вариант периодической системы.
Но время не стоит на месте, наука и технологии тоже. Уже открыт 118 элемент периодической системы, а значит скоро придётся открывать следующий, восьмой, период таблицы. Кроме того, появится новый энергетический подуровень: g-подуровень. Элементы его составляющие придётся вынести вниз таблицы, подобно лантаноидам или актиноидам, либо расширить эту таблицу ещё в два раза, так что она перестанет помещаться на лист формата A4. Здесь я приведу лишь ссылку на википедию (см. Расширенная периодическая система) и не буду лишний раз повторять описание этого варианта. Кому станет интересно – сможет пройти по ссылке и ознакомиться.
Элементы его составляющие придётся вынести вниз таблицы, подобно лантаноидам или актиноидам, либо расширить эту таблицу ещё в два раза, так что она перестанет помещаться на лист формата A4. Здесь я приведу лишь ссылку на википедию (см. Расширенная периодическая система) и не буду лишний раз повторять описание этого варианта. Кому станет интересно – сможет пройти по ссылке и ознакомиться.
В этом варианте ни f-элементы (лантаноиды и актиноиды) ни g-элементы (“элементы будущего” с №№ 121-128) не вынесены отдельно, а делают таблицу шире на 32 клетки. Также элемент Гелий помещён во вторую группу, так как он входит в s-блок.
В целом, же вряд ли будущие химики будут пользоваться этим вариантом, скорее всего на смену таблице Менделеева придёт одна из альтернатив, которые уже выдвигаются смелыми учёными: система Бенфея, “Химическая галактика” Стьюарта или иной вариант. Но это будет уже только после достижения второго острова стабильности химических элементов и, скорее всего, нужно будет больше для наглядности в ядерной физике, чем в химии, ну а нам пока хватит старой доброй периодической системы Дмитрия Ивановича.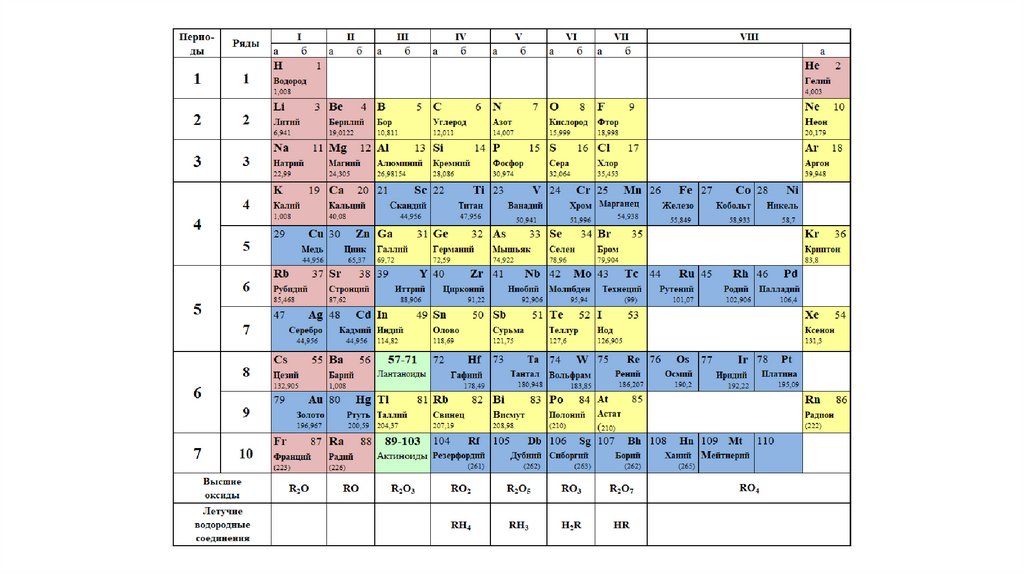
С некоторых пор в TheBat (непонятно по какой причине) перестает корректно работать встроенная база сертификатов для SSL.
При проверке посты выскакивает ошибка:
Неизвестный сертификат СА
Сервер не представил корневой сертификат в сессии и соответствующий корневой сертификат не найден в адресной книге.
Это соедининение не может быть секретным. Пожалуйста
свяжитесь с администратором вашего сервера.
И предлагается на выбор ответы – ДА / НЕТ. И так каждый раз когда снимаешь почту.
Решение
В этом случае случае нужно заменить стандарт реализации S/MIME и TLS на Microsoft CryptoAPI в настройках TheBat!
Так как мне надо было все файлы объединить в один, то я сначала преобразовал все doc файлы в единый pdf файл (с помощью программы Acrobat), а затем уже через онлайн-конвертер перевёл в fb2. Можно же конвертировать файлы и по отдельности. Форматы могут быть совершенно любые (исходные) и doc, и jpg, и даже zip архив!
Название сайта соответствующее сути:) Онлайн Фотошоп.
Апдейт май 2015
Я нашел еще один замечательный сайт! Еще удобнее и функциональнее для создания абсолютно произвольного коллажа! Это сайт http://www.fotor.com/ru/collage/ . Пользуйтесь на здоровье. И сам буду пользоваться.
Столкнулся в жизни с ремонтом электроплиты. Уже много что делал, много чему научился, но как-то с плитками дела имел мало. Нужна была замена контактов на регуляторах и конфорок. Возник вопрос – как определить диаметр конфорки у электроплиты?
Ответ оказался прост. Не надо ничего мерить, можно спокойной на глаз определить какой вам нужен размер.
Самая маленькая конфорка – это 145 миллиметров (14,5 сантиметров)
Средняя конфорка – это 180 миллиметров (18 сантиметров).
И, наконец, самая большая конфорка – это 225 миллиметров (22,5 сантиметров).
Достаточно на глаз определить размер и понять какого диаметра вам нужна конфорка. Я когда этого не знал – парился с этими размерами, не знал как измерять, по какому краю ориентироваться и т. д. Теперь я мудр:) Надеюсь и вам помог!
д. Теперь я мудр:) Надеюсь и вам помог!
В жизни столкнулся с такой задачей. Думаю, что не я один такой.
Эфир в таблице Менделеева
Мировой эфир есть субстанция ВСЯКОГО химического элемента и значит – ВСЯКОГО вещества, есть Абсолютная истинная материя как Всемирная элементообразующая Сущность. Мировой эфир – это исток и венец всей подлинной Таблицы Менделеева, её начало и конец, – альфа и омега Периодической системы элементов Дмитрия Ивановича Менделеева.
В античной философии эфир (aithér-греч) наряду с землей, водой, воздухом и огнем – один из пяти элементов бытия (по Аристотелю) – пятая сущность (quinta essentia -лат.), понимаемая как тончайшая всепроникающая материя. В конце XIX века в ученых кругах получила широкое хождение гипотеза о мировом эфире (МЭ), заполняющем все мировое пространство. Он понимался как невесомая и упругая жидкость, которая пронизывает все тела. Существованием эфира пытались объяснить многие физические явления и свойства.
Предисловие.
У Менделеева было два фундаментальных научных открытия:
1 – Открытие Периодического закона в субстанции химии,
2 – Открытие взаимосвязи субстанции химии и субстанции Эфира, а именно: частицы Эфира формирует молекулы, ядра, электроны и т.д., но в химических реакциях не участвуют.
Эфир – частицы вещества размером ~ 10-100 метра (фактически – «первокирпичики» материи).
Факты. В подлинной таблице Менделеева был Эфир. Ячейка для Эфира располагалась в нулевой группе с инертными газами и в нулевом ряду как главный системообразующий фактор для построения Системы химических элементов. После смерти Менделеева таблицу исказили, убрав из неё Эфир и отменив нулевую группу, тем самым, скрыв фундаментальное открытие концептуального значения.
В современных таблицах Эфира: 1 – не видно, 2 – и не угадывается (из-за отсутствия нулевой группы).
Такой целенаправленный подлог сдерживает развитие прогресса цивилизации.
Техногенные катастрофы (напр. Чернобыль и Фукусима) были бы исключены, если бы в развитие подлинной таблицы Менделеева своевременно были вложены адекватные ресурсы. Сокрытие концептуальных знаний идёт на глобальном уровне для «опускания» цивилизации.
Чернобыль и Фукусима) были бы исключены, если бы в развитие подлинной таблицы Менделеева своевременно были вложены адекватные ресурсы. Сокрытие концептуальных знаний идёт на глобальном уровне для «опускания» цивилизации.
Результат. В школах и ВУЗах преподают обрезанную таблицу Менделеева.
Оценка ситуации. Таблица Менделеева без Эфира – то же самое, что человечество без детей – прожить можно, но развития и будущего не будет.
Резюме. Если враги человечества знания скрывают, то наша задача – эти знания раскрывать.
Вывод. В старой таблице Менделеева элементов меньше, а форсайта больше, чем в современной.
Заключение. Новый уровень возможен только при изменении информационного состояния общества.
Итог. Возврат к истинной таблице Менделеева – это уже вопрос не научный, а вопрос политический.
В чем же был основной политический смысл эйнштейновского учения? Он состоял в том, чтобы любыми путями перекрыть человечеству доступ к неисчерпаемым естественным источникам энергии, которые открывало изучение свойств мирового эфира
. В случае успеха на этом пути, мировая финансовая олигархия теряла власть в этом мире, особенно в свете ретроспективы тех лет: Рокфеллеры сделали немыслимое состояние, превосходящее бюджет Соединенных Штатов, на нефтяных спекуляциях, и утрата той роли нефти, которую заняло «черное золото» в этом мире – роль крови мировой экономики – их не вдохновляла.
В случае успеха на этом пути, мировая финансовая олигархия теряла власть в этом мире, особенно в свете ретроспективы тех лет: Рокфеллеры сделали немыслимое состояние, превосходящее бюджет Соединенных Штатов, на нефтяных спекуляциях, и утрата той роли нефти, которую заняло «черное золото» в этом мире – роль крови мировой экономики – их не вдохновляла.
Не вдохновляло это и прочих олигархов – угольных и стальных королей. Так финансовый магнат Морган моментально прекратил финансирование экспериментов Николы Теслы, когда тот вплотную подошел к беспроводной передаче энергии и извлечению энергии «из ниоткуда» – из мирового эфира. После этого обладателю огромного количества воплощенных в практику технических решений не оказывал финансовой помощи никто – солидарность у финансовых воротил как у воров в законе и феноменальный нюх на то, откуда исходит опасность. Вот поэтому против человечества и была произведена диверсия под названием «Специальная Теория Относительности».
Один из первых ударов пришелся на таблицу Дмитрия Менделеева, в которой эфир стоял первым номером, именно размышления об эфире породили гениальное прозрение Менделеева – его периодическую таблицу элементов.
Глава из статьи: В.Г. Родионов. Место и роль мирового эфира в истинной таблице Д.И. Менделеева
6. Argumentum ad rem
То, что сейчас преподносят в школах и университетах под названием «Периодическая система химических элементов Д.И. Менделеева»,- откровенная ф а л ь ш и в к а.
Последний раз в неискажённом виде настоящая Таблица Менделеева увидела свет в 1906 году в Санкт-Петербурге (учебник «Основы химии», VIII издание). И только спустя 96 лет забвения подлинная Таблица Менделеева впервые восстаёт из пепла благодаря публикации диссертации в журнале ЖРФМ Русского Физического Общества.
После скоропостижной смерти Д. И. Менделеева и ухода из жизни его верных научных коллег по Русскому Физико-Химическому Обществу, впервые поднял руку на бессмертное творение Менделеева — сын друга и соратника Д. И. Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, Меншуткин действовал не в одиночку, — он лишь выполнял заказ. Ведь, новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д. И. Менделеева был фальсифицирован.
Ведь, новая парадигма релятивизма требовала отказа от идеи мирового эфира; и потому это требование было возведено в ранг догмы, а труд Д. И. Менделеева был фальсифицирован.
Главное искажение Таблицы — перенос «нулевой группы» Таблицы в её конец, вправо, и введение т.н. «периодов». Подчёркиваем, что такая (лишь на первый взгляд — безобидная) манипуляция логически объяснима только как сознательное устранение главного методологического звена в открытии Менделеева: периодическая система элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд, где располагается элемент «Х» (по Менделееву — «Ньютоний»),- т.е. мировой эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот элемент «Х» есть аргумент всей Таблицы Менделеева. Перенос же нулевой группы Таблицы в её конец уничтожает саму идею этой первоосновы всей системы элементов по Менделееву.
Для подтверждения вышесказанного, предоставим слово самому Д. И. Менделееву.
И. Менделееву.
«… Если же аналоги аргона вовсе не дают соединений, то очевидно, что нельзя включать ни одну из групп ранее известных элементов, и для них должно открыть особую группу нулевую … Это положение аргоновых аналогов в нулевой группе составляет строго логическое следствие понимания периодического закона, а потому (помещение в группе VIII явно не верно) принято не только мною, но и Браизнером, Пиччини и другими … Теперь же, когда стало не подлежать ни малейшему сомнению, что перед той I группой, в которой должно помещать водород, существует нулевая группа, представители которой имеют веса атомов меньше, чем у элементов I группы, мне кажется невозможным отрицать существование элементов более лёгких, чем водород.
Из них обратим внимание сперва на элемент первого ряда 1-й группы. Его означим через «y». Ему, очевидно, будут принадлежать коренные свойства аргоновых газов … «Короний», плотностью порядка 0,2 по отношению к водороду; и он не может быть ни коим образом мировым эфиром.
Этот элемент «у», однако, необходим для того, чтобы умственно подобраться к тому наиглавнейшему, а потому и наиболее быстро движущемуся элементу «х», который, по моему разумению, можно считать эфиром. Мне бы хотелось предварительно назвать его «Ньютонием» — в честь бессмертного Ньютона … Задачу тяготения и задачи всей энергетики (!!! — В.Родионов) нельзя представить реально решёнными без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Реального же понимания эфира нельзя достичь, игнорируя его химизм и не считая его элементарным веществом; элементарные же вещества ныне немыслимы без подчинения их периодической законности»
(«Попытка химического понимания мирового эфира». 1905 г., стр. 27).
«Эти элементы, по величине их атомных весов, заняли точное место между галлоидами и щелочными металлами, как показал Рамзай в 1900 году. Из этих элементов необходимо образовать особую нулевую группу, которую прежде всех в 1900 году признал Еррере в Бельгии. Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Считаю здесь полезным присовокупить, что прямо судя по неспособности к соединениям элементов нулевой группы, аналогов аргона должно поставить раньше элементов 1 группы и по духу периодической системы ждать для них меньшего атомного веса, чем для щелочных металлов.
Это так и оказалось. А если так, то это обстоятельство, с одной стороны, служит подтверждением правильности периодических начал, а с другой стороны, ясно показывает отношение аналогов аргона к другим, ранее известным, элементам. Вследствие этого можно разбираемые начала прилагать ещё шире, чем ранее, и ждать элементов нулевого ряда с атомными весами гораздо меньшими, чем у водорода.
Таким образом, можно показать, что в первом ряду первым перед водородом существует элемент нулевой группы с атомным весом 0,4 (быть может, это короний Ионга), а в ряду нулевом, в нулевой группе — предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий вследствие того чрезвычайно быстрым собственным частичным (газовым) движением.
Эти свойства, быть может, должно приписать атомам всепроникающего (!!! — В.Родионов) мирового эфира. Мысль об этом указана мною в предисловии к этому изданию и в русской журнальной статье 1902 года …» («Основы химии». VIII изд., 1906 г., стр. 613 и след.)
Настоящая таблица Менделеева. Рыбников Юрий Степанович.
Запретная Физика. Теория Эфира
Полное видео лекции тут: Фальсификация таблицы Менделеева
Из комментариев:
Для химии современной периодической таблицы элементов достаточно.
Роль эфира может быть полезна в ядерных реакциях, но и это слишком не значительно.
Учёт влияния эфира наиболее близко в явлениях распада изотопов. Однако учёт этот чрезвычайно сложен и наличие закономерностей принимаются не всеми учёными.
Самое простое доказательство наличия эфира: Явление аннигиляции позитрон-электронной пары и возникновение этой пары из вакуума, а также невозможность поймать электрон в состоянии покоя. Так же электромагнитное поле и полная аналогия между фотонами в вакууме и звуковыми волнами – фононами в кристаллах.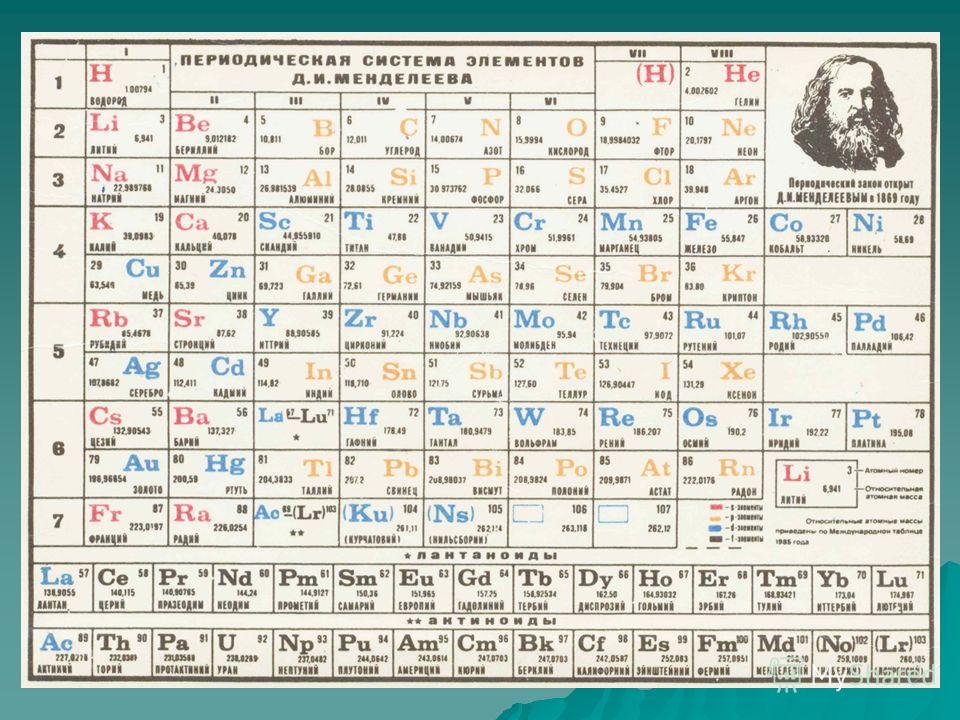
Эфир – это дифференцированная материя, так сказать, атомы в разобранном состоянии или правильней сказать, элементарные частицы, из которых формируются будущие атомы. Поэтому ему нет места в таблице Менделеева, так как логика построения данной системы не предполагает включать в её состав не целостные структуры,которыми являются сами атомы. В противном случае, так можно и для кварков найти место, где-нибудь в минус первом периоде.
Сам эфир имеет более сложную многоуровневую структуру проявления в мировом бытии, нежели об этом знает современная наука. Как только она раскроет первые тайны этого неуловимого эфира, тогда и будут изобретены новые двигатели для всевозможных машин на абсолютно новых принципах.
Действительно,Тесла едва ли не единственный, кто был близок к разгадке тайны, так называемого эфира,но ему сознательно мешали осуществить свои замыслы. Вот так до сегодняшнего дня ещё не родился тот гений, который продолжит дело великого изобретателя и расскажет всем нам, что же на самом деле представляет из себя таинственный эфир и на какой пьедестал его можно будет поставить.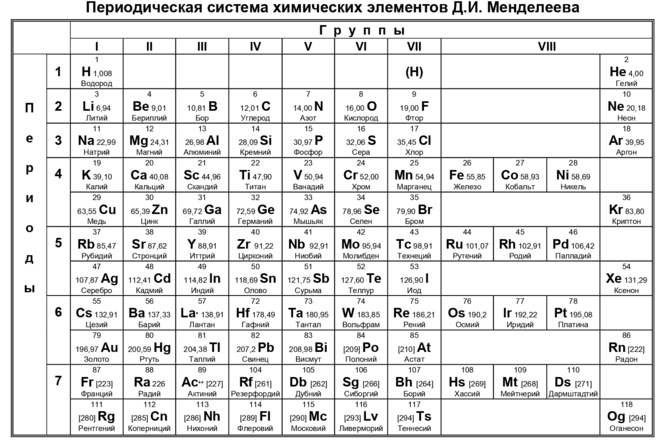
Что мы можем узнать об ЭЛЕМЕНТАХ из периодической таблицы?
Основной вопрос
| 1. Описать некоторые тенденции и закономерности в периодической таблице, особенно металлы и неметаллы 2. Описать свойства и использование металлов и неметаллов 3. Описать разработку Периодической таблицы Полезные ресурсы Просто нажмите на элемент, и появится много интересной и познавательной информации, а также видеоролики о крутых экспериментах, проведенных с этим элементом. Интерактивная периодическая таблица |
1. В небольших группах
В небольших группах
, а затем обсудите в качестве класса:
A) значение «группы» и «A» и «A», а затем обсудить как класс:
A). период” Периодической таблицы.
б) Опишите связь (или тенденции) между группами, периодами и электронами.
Science Focus 3 стр. 41–43 будет очень полезен.
2. Проведите практическое задание “Сравнение элементов” на стр. 46 в Science Focus 3, чтобы узнать, что элементы в группе имеют схожие свойства, а также определить свойства металлов и неметаллов. 3. Проведите один из практических занятий “Кристаллы металла” стр. 53 ИЛИ “Больше кристаллов” стр. 54 в Science Focus 3, чтобы выращивать кристаллы серебра для удовольствия! |
4. Создайте Видео или PowerPoint или другую презентацию, чтобы показать интересные способы использования металлов и неметаллов. Включите список их общего использования и предоставьте изображения как минимум одного распространенного металла и одного распространенного неметалла. Убедитесь, что информация, которую вы обнаружили, записана или распечатана и вставлена в вашу научную книгу для дальнейшего изучения. |
5. В своих лабораторных группах проведите исследование, чтобы идентифицировать и d описать свойства следующих основных групп Периодической таблицы – металлов, металлоидов, полуметаллов, неметаллов и благородных газов. Опишите все проблемы, обнаруженные при выполнении этой задачи. Мы закончим обсуждением в классе об этих свойствах, а также о том, что учащиеся предоставят веб-сайты, которые, по их мнению, были очень полезными. Полезные ресурсы – ????? |
6. Много раз заявлялось, что Периодическая таблица является высшим достижением научной мысли. Когда мы смотрим на него, он кажется довольно простым, однако есть блеск, который можно увидеть только при более внимательном рассмотрении его конструкции. Посмотрите это видео и ответьте на следующие вопросы: а) Сколько элементов было известно в 1860-х годах? |
7. Закрепите свое понимание, ответив на вопросы 1–16 0n p 59–60 в Science Focus 3 . |
Дополнительная задача: Выберите группу сплавов (используйте таблицу ниже) и изучите ее, задав следующие вопросы:
а) Опишите, что такое сплав.
b) Какие наиболее распространенные сплавы относятся к вашей группе сплавов?
c) Выберите два распространенных сплава в вашей группе сплавов и для каждого заполните следующее:
i) Каковы его особые свойства?
ii) Какие элементы используются для его изготовления? И почему?
iii) В каких целях используется этот сплав?
Представьте информацию классу с помощью PowerPoint на ЧЕТВЕРГ 6 марта . Максимум 10 слайдов и не более ОДНОГО предложения на каждом слайде. Основное внимание должно быть сосредоточено на вас как на выступающем, а PowerPoint – это больше, чтобы ВИЗУАЛЬНО улучшить вашу презентацию. Вы можете включить клип YouTube. Наконец, вы можете использовать карты Palm или iPad.
Максимум 10 слайдов и не более ОДНОГО предложения на каждом слайде. Основное внимание должно быть сосредоточено на вас как на выступающем, а PowerPoint – это больше, чтобы ВИЗУАЛЬНО улучшить вашу презентацию. Вы можете включить клип YouTube. Наконец, вы можете использовать карты Palm или iPad.
Дополнительное задание 2. Выберите объект, который вы используете или который хотели бы изобрести. Затем исследуйте лучшие материалы, чтобы сделать это. Вам нужно будет подготовить рекламные материалы, такие как телевизионная реклама, анимация или брошюра , в которой показаны различные используемые материалы, где они используются на объекте, а также причины, по которым вы их выбрали.
Новые материалы в науке | материалы, устойчивые к бактериям | Новые материалы, изменяющие форму |
1. Сыграйте в интерактивную игру Периодической таблицы, чтобы оценить свое понимание тенденций в Периодической таблице, используя ссылку ниже.
Сыграйте в интерактивную игру Периодической таблицы, чтобы оценить свое понимание тенденций в Периодической таблице, используя ссылку ниже.
Интерактивная игра с периодической таблицей
2. Заполните рабочий лист “2.5) Периодическая таблица, стр. 22 из Книги домашних заданий Science Focus 3
3. Заполните рабочий лист “2.6) Кроссворд”, стр. 24 из Книги домашних заданий Science Focus 3. Здесь есть пара вопросов, которые вы, возможно, не затронули, но которые отлично подходят для изучения — просто погуглите!
Уроки периодической таблицы
Уроки периодической таблицы
Скачать PDF
Скачать PDF
- Редакция
- Опубликовано:
Природные материалы том 18 , страница 91 (2019)Процитировать эту статью
5413 Доступы
7 Альтметрический
Сведения о показателях
Предметы
- Химия
- Материаловедение
- Физика
Поскольку Периодической таблице исполняется 150 лет, мы размышляем об историческом поиске новых элементов и рассматриваем тенденции использования элементов в некоторых ключевых областях исследований.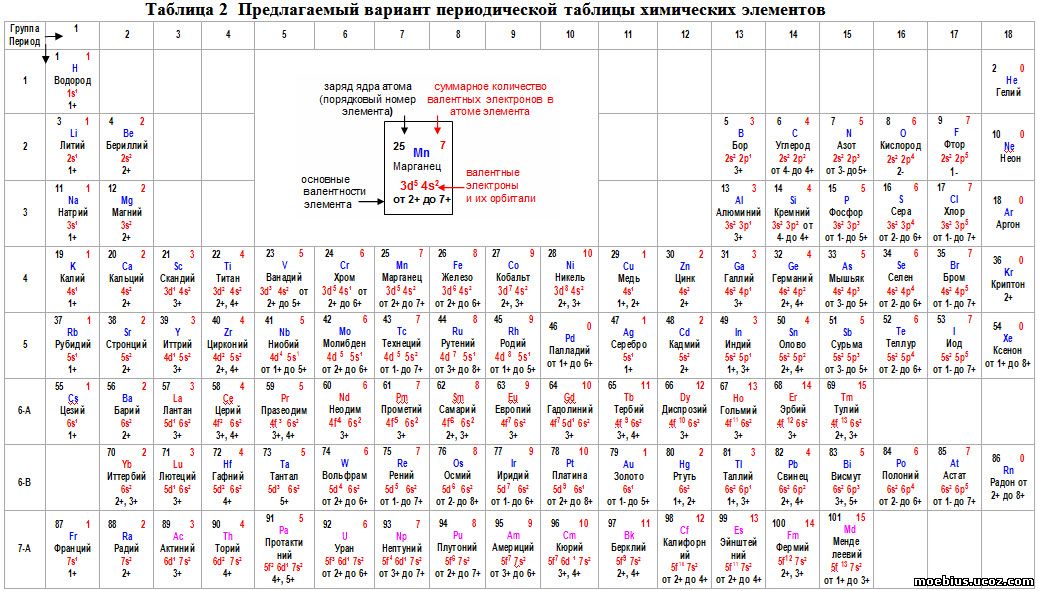
Мы прошли долгий путь от веры в то, что материя состоит из четырех элементов: земли, воздуха, огня и воды. До возникновения научного метода было получено только 13 чистых элементов. Но с момента первого зарегистрированного открытия элемента — фосфора Хеннигом Брандом в 1660-х годах (как изображено Джозефом Райтом; на фото) — наблюдение за многими элементами предполагало, что для их упорядочения можно использовать принцип. Лишь в 1869 г., с публикацией Менделеевым неполной периодической таблицы, основанной на сопоставлении физических свойств, которые таблица, которую мы теперь знаем, была впервые представлена, с более поздними уточнениями, необходимыми для формирования современной периодической таблицы. В ознаменование этого 150-летия Организация Объединенных Наций провозгласила 2019 год Международным годом Периодической таблицы элементов 1 .
Science History Images/Alamy Stock Photo
Алхимик в поисках философского камня (1771) Джозефа Райта.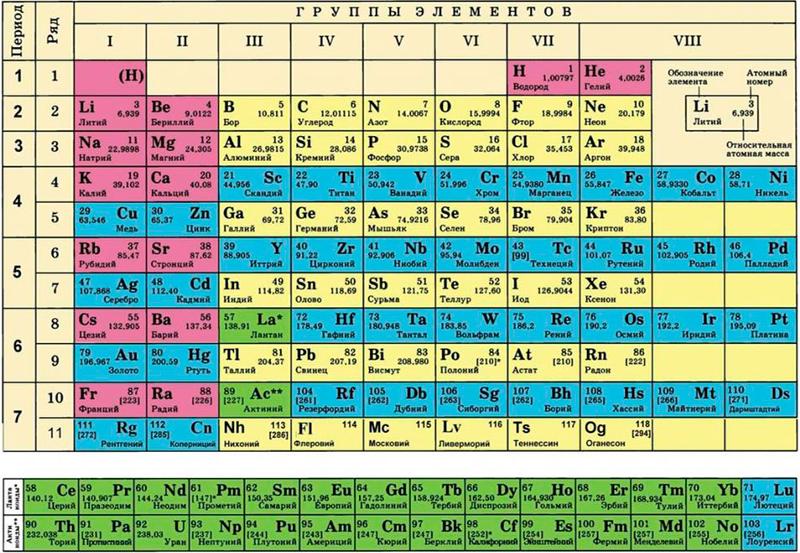
Исторически сложилось так, что поиск новых элементов зависел от развития характеристик и обработки. Например, электролиз был впервые использован для выделения элементов из их расплавленных солей в 1785 году Мартинусом ван Марумом, в результате чего были получены известные элементы сурьма, цинк и олово. Затем Хамфри Дэви использовал тот же подход для извлечения некоторых элементов группы 1 и группы 2 — калия, натрия и стронция 2 .
Открытие элементов до 1860 года основывалось на манипуляциях с химическими образцами, а подсказки о том, что минералы могут содержать новые элементы, исходили из цвета пламени, возникающего при горении. Однако в то время для окончательной идентификации требовался чистый элемент. Это часто требовало кропотливого химического восстановления и окисления образцов с последующими стадиями нагревания и конденсации. С кодификацией спектроскопии для элементного анализа Робертом Бунзеном и Густавом Кирхгофом в 1860 г. 3 , наступила эра, когда извлечение чистого элемента больше не требовалось. Это было особенно актуально для открытия гелия по данным солнечной спектроскопии Норманом Локьером в 1868 г. 4 , причем образцы были физически получены только 27 лет спустя в результате распада нестабильных изотопов в урановых рудах. Сегодня спектроскопия для идентификации элементов и видов является основной частью набора инструментов для современных материаловедов.
Это было особенно актуально для открытия гелия по данным солнечной спектроскопии Норманом Локьером в 1868 г. 4 , причем образцы были физически получены только 27 лет спустя в результате распада нестабильных изотопов в урановых рудах. Сегодня спектроскопия для идентификации элементов и видов является основной частью набора инструментов для современных материаловедов.
Элементы с атомным номером больше 92, как правило, не встречаются в природе на Земле, поскольку они быстро радиоактивно распадаются на более стабильные элементы. Чтобы синтезировать эти элементы, исследователи сталкиваются атомные ядра вместе 5 или бомбардируют тяжелые ядра нейтронами 6 . Нейтроны с их глубиной проникновения можно использовать для неразрушающего картирования распределения элементов, что позволяет анализировать бесценные артефакты.
После открытия многие элементы применялись для удовлетворения практических нужд, но на их использование влияло множество факторов. Например, алюминий изначально был драгоценным металлом из-за сложности его получения в чистом виде. Сегодня гораздо более дешевое и эффективное производство означает, что его можно использовать даже для упаковки.
Например, алюминий изначально был драгоценным металлом из-за сложности его получения в чистом виде. Сегодня гораздо более дешевое и эффективное производство означает, что его можно использовать даже для упаковки.
Применение и исследования конкретных элементов отражают научные, социальные и экологические тенденции. В настоящее время основное внимание уделяется более экологичному производству и хранению энергии. Батареи демонстрируют, как эта тенденция влияет на исследования, поскольку производительность чувствительна к химическому составу. Переходные и тяжелые металлы (такие как никель, цинк и свинец) широко использовались в двадцатом веке из-за простоты производства батарей и низкой стоимости по сравнению с такими альтернативами, как литий. Текущие тенденции к более высокой плотности энергии (и более дешевой обработке) сделали преобладающим литий, но другие элементы, близкие к литию в периодической таблице (такие как натрий, магний, алюминий или кальций), которые обещают аналогичные характеристики, но более распространены, также рассматривались 7 . Производство солнечной энергии с использованием органо-неорганических перовскитов представляет исследовательский интерес, но эти материалы содержат свинец с известными проблемами токсичности. При поиске более безопасных элементов-заменителей обычно рассматривают элементы из той же группы, например, олово, или смежные, например, висмут, но необходимо решить проблемы с производительностью и стабильностью.
Производство солнечной энергии с использованием органо-неорганических перовскитов представляет исследовательский интерес, но эти материалы содержат свинец с известными проблемами токсичности. При поиске более безопасных элементов-заменителей обычно рассматривают элементы из той же группы, например, олово, или смежные, например, висмут, но необходимо решить проблемы с производительностью и стабильностью.
Спустя 150 лет мы гораздо лучше понимаем, как на свойства влияет положение элементов в периодической таблице. Золото (преобладающий плазмонный металл) в группе 10 может выступать в качестве катализатора многих реакций; и другие металлы групп 10 и 11, такие как серебро или платина, также представляют исследовательский интерес, поскольку они могут обладать схожими химическими свойствами. При легировании для модификации электронного транспорта в полупроводниках часто используются элементы-заменители до или после основного элемента на столе, например, бор вместо кремния. В переходных металлах исследования магнетизма, как правило, сосредоточены на тех элементах, которые обладают локализованным d- электронов, таких как марганецсодержащие соединения, но свойства материалов, содержащих переходные металлы первого ряда, такие как медь и железо, также представляют интерес для исследования высокотемпературной сверхпроводимости.
Между нашим развивающимся пониманием периодической таблицы и нашим пониманием материалов существует синергия. Положение элемента в периодической таблице и соображения устойчивости играют роль в определении исследовательской деятельности и практических приложений. Пространство в периодической таблице для новых комбинаций материалов огромно. Все элементы будут по-прежнему достойны исследования.
Каталожные номера
ООН https://www.un.org/press/en/2017/ga11994.doc.htm (2017).
Дэви, Х. Филос. Транс. 98 , 1–44 (1808).
Google ученый
Кирхгоф, Г. и Бунзен, Р. Энн. физ. 180 , 161–189 (1860).
Артикул Google ученый
Lockyer, J.
 N. Proc. Рой. соц. 17 , 91–92 (1868).
N. Proc. Рой. соц. 17 , 91–92 (1868).Google ученый
Kennedy, J.W., Seaborg, G.T., Segrè, E. & Wahl, A.C. Phys. 70 , 555–556 (1946).
Артикул Google ученый
McMillan, E. & Abelson, P. H. Phys. 57 , 1185–1186 (1940).
КАС Статья Google ученый
Grey, C.P. & Tarascon, J.M. Nat. Матер. 16 , 45–56 (2017).
Артикул Google ученый
Ссылки на скачивание
Права и разрешения
Перепечатка и разрешения
Об этой статье
7 фактов о периодической таблице, которым вы должны научить своих студентов-химиков! • Онлайн-обучение LatinHire
- Эллиер Ленг
- STEM Tutoring
Периодическая таблица — самая важная таблица в истории науки. Он служит основой нашего понимания материального мира и представляет собой полезную дорожную карту для ученых и студентов-химиков по всему миру.
История и организация периодической таблицы завораживают. Если вы преподаете химию или любите изучать химию, вот семь фактов о периодической таблице, которые должны знать все студенты!
Факт № 1. Элементы организованы в соответствии с физическими и химическими свойствами.Вам нравится играть в карточные игры, такие как пасьянс? Организация периодической таблицы похожа на игру в сортировку карт. Вместо того, чтобы упорядочивать карты в соответствии с числами и мастями, периодическая таблица упорядочивает элементы по возрастающим атомным номерам и повторяющимся образцам с аналогичными свойствами.
Зная положение элемента в таблице Менделеева, вы можете предсказать его свойства, такие как структура, масса, электронная конфигурация, реакционная способность и многие другие.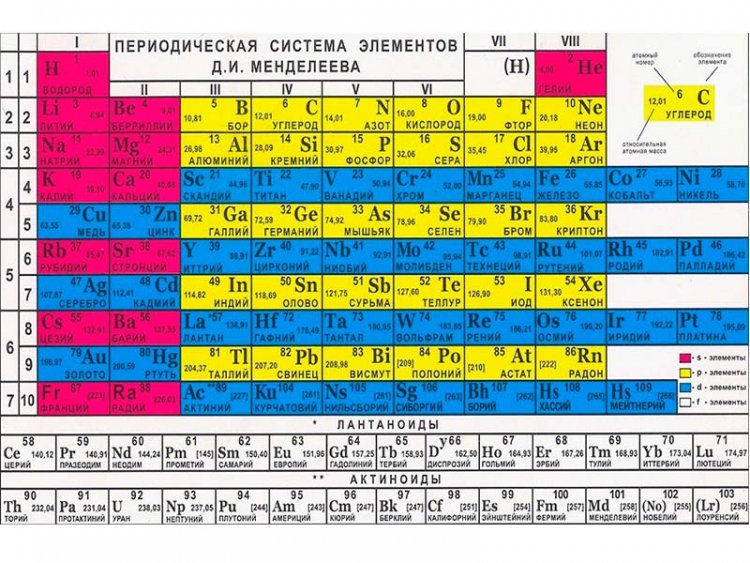 Элементы в одной группе (вертикальный столбец) имеют одинаковое количество валентных электронов, которые являются электронами на самом внешнем энергетическом уровне, в то время как элементы в одном периоде (горизонтальный столбец) имеют одинаковое количество энергетических уровней.
Элементы в одной группе (вертикальный столбец) имеют одинаковое количество валентных электронов, которые являются электронами на самом внешнем энергетическом уровне, в то время как элементы в одном периоде (горизонтальный столбец) имеют одинаковое количество энергетических уровней.
Хотя Дмитрий Менделеев не был первым ученым, создавшим версию таблицы Менделеева, ему приписывают организацию элементов в то, что больше всего напоминает современную таблицу Менделеева. Упорядочив элементы в соответствии с их атомной массой, он смог заметить закономерности повторяющихся свойств и сгруппировать эти элементы вместе.
Когда Менделеев закончил свою версию таблицы Менделеева, в ней было много пробелов для еще не открытых элементов. Анализируя закономерности, он смог правильно предсказать свойства этих отсутствующих элементов. Научное сообщество сбито с толку, когда годы спустя были открыты эти элементы с точными свойствами, описанными Менделеевым!
Факт #3: Лестница в правой части периодической таблицы разделяет металлы и неметаллы.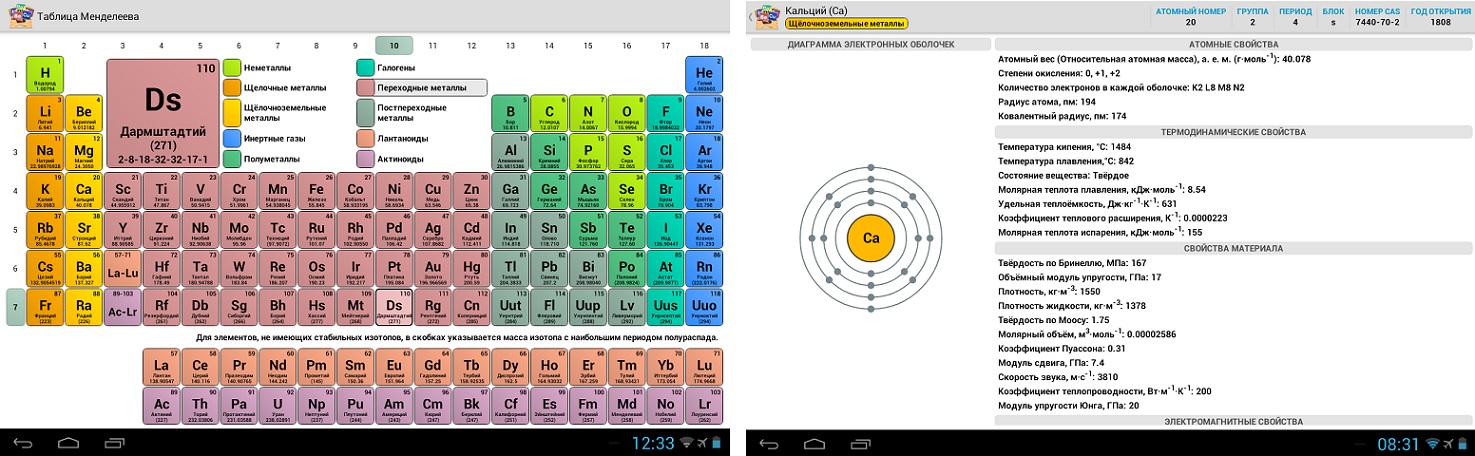
Чтобы быстро определить, является ли элемент металлом или неметаллом, все, что вам нужно знать, это расположение лестницы в правой части периодической таблицы. Слева от лестницы находятся металлы (кроме водорода), а справа от лестницы — неметаллы. Элементы лестницы — это металлоиды, обладающие свойствами как металлов, так и неметаллов!
Факт №4: Современная таблица Менделеева организована по возрастанию атомного номера, который представляет собой количество протонов.Основное различие между менделеевской версией периодической таблицы и современной периодической таблицей заключается в том, что Менделеев организовал элементы в соответствии с атомной массой, в то время как современная периодическая таблица упорядочивает элементы в соответствии с атомным номером. Атомный номер представляет собой количество протонов (положительно заряженных), которое также равно количеству электронов (отрицательно заряженных) в нейтральном атоме.
Например, первым элементом периодической таблицы является водород, который имеет один протон и один электрон. Второй элемент — гелий, который имеет два протона и два электрона. Каждый последующий элемент имеет на один дополнительный протон и один дополнительный электрон, чем предыдущий элемент.
Второй элемент — гелий, который имеет два протона и два электрона. Каждый последующий элемент имеет на один дополнительный протон и один дополнительный электрон, чем предыдущий элемент.
Масса атома получается из сложения его протонов и нейтронов (нейтральный заряд), которые обычно имеют одинаковую массу. Массу электрона можно не принимать во внимание, поскольку она составляет всего около 1/2000 массы протона или нейтрона. Следовательно, массовое число = # протонов + # нейтронов.
Чтобы получить массовое число, нужно просто округлить атомную массу, которая находится в таблице Менделеева. Затем, вычитая атомный номер (= # протонов) из массового числа, вы получите количество нейтронов. Например, углерод имеет атомный номер 6, что означает, что он имеет 6 протонов. Его атомная масса равна 12,01, поэтому округление дает 12 для его атомной массы.
Выполните вычисления:
12 (атомная масса) – 6 (атомный номер / количество протонов) = 6 (количество нейтронов)
Следовательно, в углероде 6 нейтронов!
Факт № 6: Атомная масса, указанная в периодической таблице, представляет собой средневзвешенное значение всех изотопов элемента.
Изотопы — это атомы с одинаковым числом протонов, но разным числом нейтронов. Поскольку масса атома определяется его протонами и нейтронами, если число нейтронов разное, то и атомная масса каждого изотопа будет разной. Таким образом, атомная масса, которую вы видите в периодической таблице, на самом деле является средневзвешенной массой всех изотопов. 9-12%, что незначительно.
Чтобы рассчитать среднюю атомную массу:
12 x 0,9889 + 13 x 0,0111 = 12,01
Факт № 7: Размер атома уменьшается в периодической таблице, даже если атомный номер увеличивается.Размер атома — это расстояние от ядра до самых удаленных электронов. Вы можете подумать, что размер атома будет увеличиваться по мере увеличения атомного номера, потому что добавляется больше протонов и нейтронов. Однако слева направо в таблице Менделеева размер атома на самом деле уменьшается!
Это связано с увеличением заряда ядра, в то время как экранирование электронов остается прежним.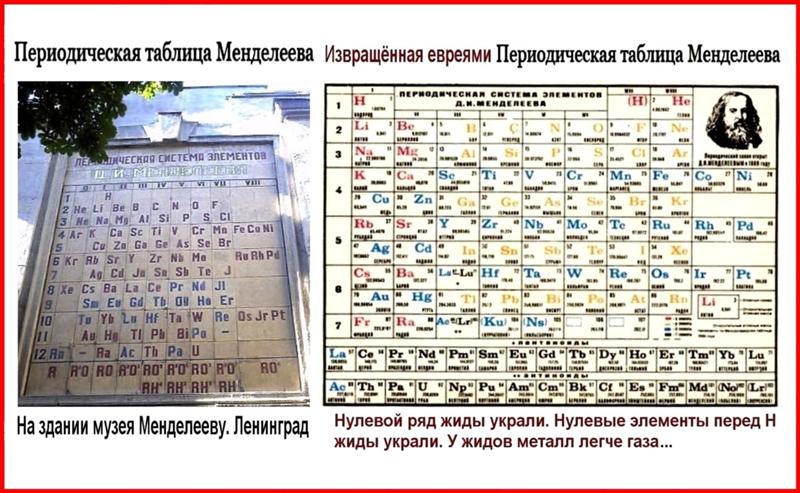 Заряд ядра – это суммарный положительный заряд ядра в результате действия протонов. Чем больше протонов добавляется слева направо, тем больше заряд ядра. Электронное экранирование относится к блокированию притяжения между валентными электронами и ядром из-за всех электронов внутренней оболочки. Экранирование электронов в течение периода остается неизменным, поскольку увеличивается число только валентных электронов.
Заряд ядра – это суммарный положительный заряд ядра в результате действия протонов. Чем больше протонов добавляется слева направо, тем больше заряд ядра. Электронное экранирование относится к блокированию притяжения между валентными электронами и ядром из-за всех электронов внутренней оболочки. Экранирование электронов в течение периода остается неизменным, поскольку увеличивается число только валентных электронов.
При большем заряде ядра и таком же электронном экранировании притяжение между ядром и валентными электронами становится сильнее, втягивая их внутрь и уменьшая размер атома. (Спускаясь по группам, размер атома увеличивается по мере добавления новых энергетических уровней.)
Мы надеемся, что эти факты из таблицы Менделеева оказались полезными для вашего урока химии! Каким еще фактам о периодической таблице вы обучаете своих студентов? Поделитесь ими в комментариях ниже!
Эллиер Ленг
Раскрась и узнай о периодической таблице
Это исследование предназначено для детей от 10 лет, как показывают цветные смайлики.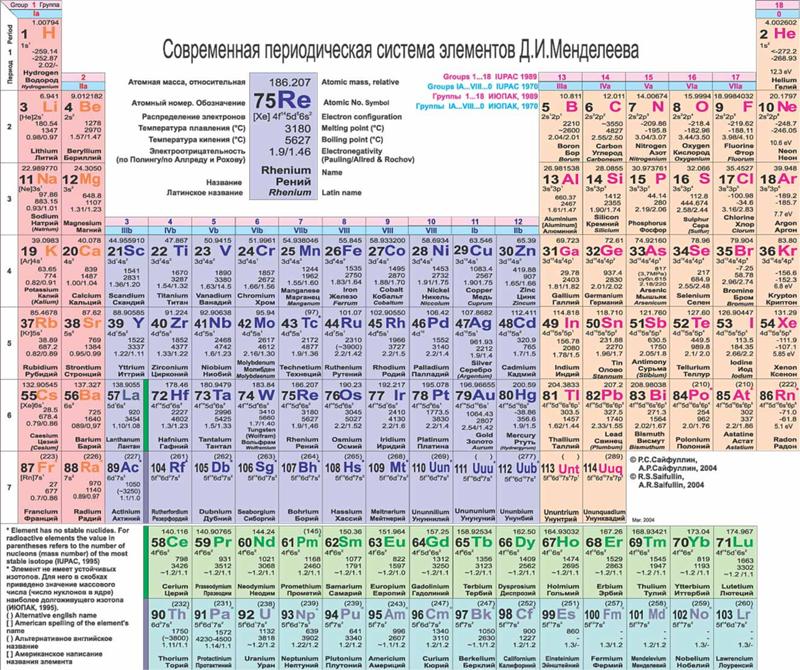 Вы можете изучать периодическую таблицу элементов с детьми от 5 до 12 классов!
Вы можете изучать периодическую таблицу элементов с детьми от 5 до 12 классов!
Периодическая таблица элементов — это наглядный способ, разработанный химиками для организации элементов вселенной. С помощью этого метода элементы группируются рядом с другими элементами, которые похожи. По мере разработки периодической таблицы было много неоткрытых элементов, присутствие которых было предсказано на основе пустого места в таблице. Периодическая таблица — одно из свидетельств того, что Вселенная упорядочена и предсказуема.
Шаг 1: Библиотечное исследование
Прежде чем приступить к исследованию, прочитайте одну или две книги о периодической таблице элементов. Вот несколько предложений, но если вы не можете их найти, поищите в своей библиотеке книги о движении, физике, гравитации и трении. Цветные смайлики над каждой книгой сообщают вам, для какого возраста они рекомендованы.
Цветные смайлики над каждой книгой сообщают вам, для какого возраста они рекомендованы.
Поскольку мы являемся аффилированными лицами Amazon, рекомендуемые ниже книги и продукты возвращают нам небольшой процент от вашей покупки. Это не влияет на ваши расходы и помогает нам в работе нашего веб-сайта. Мы благодарим Вас!
Периодическая таблица: элементы со стилем
от Adrian Dingle
Каждый элемент описан вместе с тем, в чем он лучше всего, в формате «домашних страниц» для каждого элемента.Периодическая таблица
от Шона Каллери
Познакомит вас с каждым элементом, объяснив, как элементы появляются в повседневной жизни, с большим количеством визуальных материалов.Шаг 2: Изучение периодической таблицы
Вам понадобится распечатка периодической таблицы и цветные карандаши, мелки, цветные ручки или краски.
Нажмите на это изображение, чтобы получить периодическую таблицу элементов для печати. Начните с окрашивания семейств элементов, как показано в примере ниже. Семейства – это элементы, обладающие схожими свойствами. Они ведут себя одинаково физически и химически.
Семейства – это элементы, обладающие схожими свойствами. Они ведут себя одинаково физически и химически.
Некоторые правила периодической таблицы
Далее изучите некоторые правила таблицы Менделеева.
Точки располагаются горизонтально по таблице строками, а атомный номер увеличивается на единицу при движении слева направо. Атомный номер – это количество протонов в атоме. Атомный номер — это большое число в верхней части поля для определенного элемента.
Группы расположены вертикально вниз по таблице, и все элементы в определенной группе имеют одинаковое количество электронов на внешней оболочке, поэтому они ведут себя одинаково. Первая группа, щелочные металлы, имеет один электрон на внешней оболочке. Вторая группа состоит из двух человек. Затем пропускаем выпадающий раздел и переходим к группе, которая начинается с Борона. Группа бора имеет три электрона, и так далее до инертных газов, у которых восемь электронов на внешней оболочке.
Буквы в каждой ячейке обозначают химическое вещество. Символом углерода является C, символом свинца является Pb, и он происходит от латинского слова свинец, который представляет собой свинец.
Число в нижней части ячейки элемента представляет собой атомный вес или общий вес протонов, нейтронов и электронов для этого элемента. Водород, который имеет один протон и один электрон, имеет вес 1. (Вес электронов по сравнению с протонами и нейтронами незначителен и на самом деле не учитывается.) Игра «Атом», чтобы попрактиковаться в построении атомов на основе элементов периодической таблицы.
Шаг 3: Покажите, что вы знаете
После того, как вы объясните основные правила таблицы Менделеева, спросите детей о наградах за хорошую работу.
- К какому семейству относится Xenon (Xe)?
- Какой химический символ у золота?
- Сколько электронов находится на внешней оболочке бора (B)?
- Назовите элемент из той же группы, что и углерод.

- Какой элемент имеет химический символ Na?
- Сколько электронов находится во внешней оболочке галогенов?
Вы поняли. Это упражнение предназначено не для того, чтобы помочь детям запомнить периодическую таблицу, а для того, чтобы узнать, что означают символы и как их интерпретировать, чтобы они могли обращаться к таблице, когда им понадобится информация позже.
Дополнительные слои
Дополнительные слои — это дополнительные действия, которые вы можете выполнять, или тангенсы, на которых вы можете остановиться. Вы найдете их на боковых панелях каждого блока Layers of Learning. Они необязательны, поэтому просто выберите то, что вас интересует.
Дополнительный слой
Было предложено множество альтернативных способов организации таблицы Менделеева. Вот одна идея.
Узнайте больше об альтернативных периодических таблицах, которые были предложены.
В Интернете
В каталоге Layers of Learning для каждого модуля есть список веб-сайтов для дальнейшего изучения тем.
Чтобы узнать больше о периодической таблице элементов, посетите https://www.ptable.com/, где вы можете щелкнуть элементы, чтобы узнать о них больше по одному.
Известные люди
Русский химик и изобретатель Дмитрий Менделеев составил первую периодическую таблицу в том виде, в каком мы ее знаем сегодня.
Он даже предсказал существование еще не открытых элементов.
Попробуйте домашнее обучение в семейном стиле прямо сейчас с бесплатными образцами четырех разделов Layers of Learning при подписке. Вы сможете вместе с детьми изучать историю, географию, естественные науки и искусство в семейном стиле.
Имя
Пожалуйста, введите ваше имя.
Адрес электронной почты
Пожалуйста, введите действительный адрес электронной почты.
Я согласен получать электронные письма от Layers of Learning. Я могу отписаться в любой момент.
Вы должны принять Условия использования.
Оценка бесплатных образцов
Мы очень рады, что вы присоединились к семье Layers of Learning.
Проверьте свою электронную почту, чтобы получить бесплатные образцы. Письмо должно прийти в течение 15 минут.
Что-то пошло не так. Пожалуйста, проверьте свои записи и повторите попытку.
Знакомство с периодической таблицей
Направления: Попросите учащихся ответить на следующие вопросы, основанные на статье Science News «Таблице Менделеева исполняется 150 лет».
1. До прочтения статьи и исходя из ваших предыдущих знаний, какими характеристиками обладает периодическая таблица? Какова цель периодической таблицы?
Периодическая таблица включает все известные элементы и организует элементы в строки и столбцы. Она упорядочена, кратка и ясна. Периодическая таблица обычно показывает химические символы элементов, атомные номера и атомные массы. Цель таблицы — показать, что представляют собой элементы, как они связаны друг с другом, и дать некоторые подсказки о том, как они ведут себя. Это полезное руководство для студентов-химиков и исследователей.
Это полезное руководство для студентов-химиков и исследователей.
2. Почему, согласно статье, годовщина таблицы Менделеева является поводом для празднования?
Таблица Менделеева знакома каждому. Он лаконично фиксирует элементы, из которых состоят все земные субстанции, и их взаимоотношения. Периодическая таблица раскрывает глубокие истины о химии и сыграла важную роль в нашем понимании атома и в квантовой теории. Рождение и эволюция периодической таблицы тоже интересная история.
3. Какие закономерности определяли в элементах ученые XIX века, в том числе Джон Дальтон, Иоганн Вольфганг Доберейнер, Джон Ньюлендс и Дмитрий Менделеев?
Джон Дальтон предположил, что элементы отличаются друг от друга по весу их атомов. Немецкий химик Иоганн Вольфганг Доберейнер заметил, что существуют определенные «триады», в которых три элемента с возрастающим весом (таким, что один является средним значением двух других) имеют сходное химическое поведение. Джон Ньюлендс увидел, что расположение элементов в порядке возрастания атомного веса приводит к повторению их химических свойств через каждые восемь элементов. Дмитрий Менделеев также заметил взаимосвязь между атомным весом и химическими свойствами, но обнаружил, что эта закономерность несколько сложнее, чем предполагал Ньюлендс.
Джон Ньюлендс увидел, что расположение элементов в порядке возрастания атомного веса приводит к повторению их химических свойств через каждые восемь элементов. Дмитрий Менделеев также заметил взаимосвязь между атомным весом и химическими свойствами, но обнаружил, что эта закономерность несколько сложнее, чем предполагал Ньюлендс.
4. Почему Дмитрий Менделеев начал организовывать элементы? Какие еще факты из жизни Менделеева вам интересны?
Менделеев начал систематизировать элементы, потому что он писал учебник для класса неорганической химии, и ему нужен был способ организовать текст. Среди других интересных фактов: Он был 17-м ребенком в семье. Он чуть не умер от тяжелой болезни во время учебы в колледже. Наряду с воспитателем и лектором он был научно-популярным писателем и редактором, переводчиком и консультантом химической промышленности. Он выиграл денежный приз, написав руководство по органической химии.
5. Почему автор статьи называет оригинальную таблицу Менделеева «оракулом»? Приведите пример, подтверждающий ваш ответ.
Организация таблицы Менделеева настолько хорошо объясняла установленные химические связи, что позволяла предсказывать неоткрытые элементы, три из которых были обнаружены при жизни Менделеева. Таблица Менделеева предсказала не только существование элементов, но и их свойства. Например, в 1875 году был открыт галлий с атомным весом 69..9 и плотностью в шесть раз больше, чем у воды. Менделеев предсказал элемент с такой же плотностью и атомным весом, очень близким к 68.
6. Основываясь на тексте и графике на странице 15, назовите не менее трех отличий между исходной таблицей Менделеева и таблицей, которую мы используем. Cегодня.
Таблица Менделеева была организована вертикально, а сегодняшняя — горизонтально. Таблица Менделеева зависела от упорядочения по атомному весу; сегодня мы упорядочиваем элементы по атомному номеру или количеству протонов. Таблица Менделеева не включала ни благородные газы, ни трансурановые соединения, ни другие синтетические элементы. (Многие элементы были открыты со времен Менделеева.) В таблице Менделеева не было элемента, названного в честь Менделеева; сегодняшняя таблица делает.
(Многие элементы были открыты со времен Менделеева.) В таблице Менделеева не было элемента, названного в честь Менделеева; сегодняшняя таблица делает.
7. Каковы были ограничения исходной периодической таблицы Менделеева? Как эти ограничения повлияли на понимание Менделеевым закономерностей в его таблице?
Таблица Менделеева была ограничена современными научными знаниями. В него вошли всего 63 известных элемента. Многие из атомных весов еще не были определены. Поскольку ученые не знали, что содержится в атоме, Менделеев организовал свою таблицу в целом по атомному весу. Но ему пришлось добавить некоторые исключения в этот порядок, чтобы сгруппировать элементы с похожими химическими свойствами. Менделеев также не знал, почему его таблица работает; основные правила или факты, которые привели к периодическому поведению, оставались загадкой.
8. Как открытия атома со времен Менделеева повлияли на наше понимание периодической таблицы?
Открытие электронов, ядра и протонов выявило субатомную структуру атома и внесло ясность в упорядочение элементов, а также объяснило повторяющийся характер химических свойств. Квантовая теория углубила понимание устройства электронов и подчеркнула важность самых удаленных электронов в управлении поведением элемента. Более полное понимание строения атома привело к созданию синтетических элементов. Хотя это и не обсуждалось напрямую в статье, открытие и объяснение радиоактивности привело к пониманию изотопов и превращений между элементами.
Квантовая теория углубила понимание устройства электронов и подчеркнула важность самых удаленных электронов в управлении поведением элемента. Более полное понимание строения атома привело к созданию синтетических элементов. Хотя это и не обсуждалось напрямую в статье, открытие и объяснение радиоактивности привело к пониманию изотопов и превращений между элементами.
9. Как вы думаете, почему эта статья помечена как «эссе», а не как «очерк» или «новостная» статья?
Хотя статья основана на исследованных и опубликованных фактах, как и все статьи в Science News , автор занимает особую позицию — создание периодической таблицы является поводом для празднования, а периодическая таблица имеет большое значение. огромную роль в развитии науки. Это тезис сочинения. «Эссе» помещает вывод в более глубокий контекст, включая личные данные, исторический анализ, интерпретацию и комментарии к существующим знаниям. Он также имеет менее формальную структуру, чем обычная новостная статья, и предлагает новые идеи, связывая их с другими областями науки.
10. Какие уроки история и изучение таблицы Менделеева преподносят другим областям науки и науке в целом?
Большая часть науки зависит от поиска закономерностей, порядка и структуры в кажущемся хаосе. Это упорядочение часто приводит к правилам, управляющим миром, и эти правила могут помочь ученым предсказать новые черты мира, новые факты, которые нужно будет упорядочить по-новому. Таким образом, наука развивается постепенно. Наука требует объективных рассуждений, подобных тем, которые применял Менделеев, разбирая свои карточки, и предполагает существование общих принципов, причин и следствий. Науки часто строятся на классификации — элементов, видов, субатомных частиц, клеток — создавая общий язык, который приводит к общему пониманию. Периодическая таблица также была построена с течением времени при участии многих ученых и продолжается до сих пор.
Новости науки
Как периодическая таблица превратилась из наброска в непреходящий шедеврЧитаемость: 11,2
Зарегистрируйтесь, если хотите получать бесплатные журналы Science News , а также ресурсы для преподавателей в следующем учебном году. Программа Общества науки по изучению научных новостей обслуживает почти 5000 государственных средних школ в Соединенных Штатах и во всем мире.
Программа Общества науки по изучению научных новостей обслуживает почти 5000 государственных средних школ в Соединенных Штатах и во всем мире.
Подробнее
Изучение периодической таблицы
1
Происхождение периодической таблицы
Истоки периодической таблицы начинаются с работ Джона Ньюлендса и Дмитрия Менделеева.
2
Структура атома в периодической таблице
Структура атома – это положительно заряженное ядро и вращающиеся вокруг него отрицательно заряженные электроны внутри атома.
3
Понимание названий элементов и символов
Названия элементов и символы используются для идентификации различных элементов периодической таблицы. В этом разделе вы узнаете, почему элементы названы так, как они есть, а также важность символов этих элементов и то, как они используются в периодической таблице.
4
Элементы в повседневной жизни и практике
Элементы окружают нас повсюду в повседневном мире. В этом разделе вы узнаете, как периодическая таблица связана с нашей повседневной жизнью и как мы используем эту информацию, чтобы связать элементы вокруг нас с нашей жизнью.
В этом разделе вы узнаете, как периодическая таблица связана с нашей повседневной жизнью и как мы используем эту информацию, чтобы связать элементы вокруг нас с нашей жизнью.
5
Группы и периоды в периодической таблице
Группы и периоды — это столбцы и строки периодической таблицы. В этом разделе вы исследуете, как была составлена таблица Менделеева, и два основных устройства таблицы Менделеева, сосредоточив внимание на группах и периодах, а также на металлах и неметаллах.
6
Металлы и неметаллы периодической таблицы
Металлы и неметаллы составляют все элементы периодической таблицы и расположены в определенном порядке.
7
Элементы, соединения и смеси
Соединения и смеси элементов представляют собой уникальные комбинации различных атомов по-разному.
8
Состояния материи
Состояния материи — это различные формы, которые мы находим в периодической таблице элементов, соединений и смесей в виде твердых тел, жидкостей и газов.
9
Изменения состояния элементов
Изменения состояния происходят, когда твердые, жидкие и газообразные вещества меняются друг с другом из-за добавления или уменьшения энергии.
10
Физические свойства
Физические свойства вещества – это способ измерения различных свойств этого элемента или соединения и их классификации.
11
Химические свойства
Химические свойства вещества — это способ измерения его реакционной способности и того, как оно взаимодействует с другими атомами с образованием соединений.
12
Атомный номер элемента
Атомный номер элемента дает информацию о количестве протонов в ядре.
13
Атомная масса элементов
Атомная масса относится к массе как протонов, так и нейтронов и всегда является большей из двух, представленных в периодической таблице.
14
Изотопы элементов
Изотопы — это элементы с разным количеством нейтронов в ядре, но с одинаковым количеством протонов.
15
Ионы элементов
Ионы – это атомы или группы атомов, которые либо потеряли, либо приобрели электроны, поэтому они имеют положительный или отрицательный заряд.
16
Почему периодическая таблица так важна?
17
Кто пользуется периодической таблицей?
18
Почему в периодической таблице есть пробелы?
Пробелы в таблице Менделеева были впервые использованы Дмитрием Менделеевым, когда он не смог найти элемент, соответствующий образцам групп и периодов, которые он использовал. Менделеев знал, что будут неоткрытые элементы, поэтому использовал эти пробелы, чтобы побудить других ученых начать их поиски.
19
Все ли элементы в изобилии?
Обилие элементов во Вселенной и на Земле является мерой того, сколько в пересчете на массу или процентное содержание этого элемента встречается в природе. Некоторые элементы во Вселенной, такие как водород и гелий, самые основные элементы составляют большое количество материи во Вселенной. В то время как редкие элементы, такие как франций и цезий, гораздо менее распространены и редки.
В то время как редкие элементы, такие как франций и цезий, гораздо менее распространены и редки.
20
Можно ли создавать элементы в лаборатории?
Некоторые элементы должны быть созданы в лаборатории, поскольку они не могут существовать в естественном мире, как большинство элементов. Эти элементы иногда требуют особых условий и оборудования, чтобы заставить их распасться или сблизить два разных ядра.
21
Электронная конфигурация и структура
Электроны существуют в оболочках вокруг ядра и имеют различные конфигурации и расположение в зависимости от элемента периодической таблицы. Электроны также очень важны для связи.
22
История химии: алхимия
Алхимия — это термин, используемый для описания исторического изучения элементов и материи с целью создания эликсира бессмертия или попытки превратить металлы в более драгоценные металлы.
23
Алхимия и современная химия
Алхимия, будучи изучением таких диких теорий, как трансмутация металлов и продление жизни, также имела много полезных истоков современной химии, от разработки лекарств до экспериментальных методов, которые мы до сих пор используем в лаборатории. .
.
24
История химии: символы алхимии
Символы алхимии — это иллюстрации, которые использовались алхимиками на протяжении сотен лет для общения между алхимиками о различных элементах и научных методах в поисках алхимии. Он также использовался как способ защиты своих открытий и находок, поскольку часто о них знали лишь несколько человек.
25
История химии: алхимия Символы древних греков
Первое зарегистрированное использование символов для обозначения элементов было древнегреческими философами, которые использовали свои исследования планет и дней, чтобы соответствовать их пониманию элементов .
26
История химии: Три простых числа
Три простых числа представляли собой серию из трех известных элементов, которые, по мнению алхимиков, определяли болезни, жизнь и душу в человеческой жизни, а контроль над этими элементами мог исцелять болезни и создавать жизнь. .
27
История химии: алхимические символы и соединения
Алхимические символы на протяжении веков использовались не только для обозначения элементов, но также для обозначения соединений и экспериментальных методов в химии.
28
Металлургия – изучение металлических элементов
Металлургия – это изучение металлов и связанных с ними физических и химических свойств. Подобно алхимии, она существует уже тысячи лет, но все еще актуальна в наше время из-за ее использования в производстве и технологиях.
29
Атомы Элементы Молекулы и соединения
Атомы составляют всю окружающую нас материю, они являются наименьшей частью всего сущего. Все атомы в периодической таблице имеют разное количество протонов и известны как элементы, и их можно комбинировать для создания соединений и молекул
30
Обзор связи
Связь описывает, как существуют металлические и неметаллические элементы периодической таблицы. как элементы или объединяясь вместе, образуя новые соединения с другими свойствами.
31
Металлическая связь
Металлическая связь — это связь, обнаруженная в металлах, положительные ионы металлов окружены морем делокализованных электронов.
32
Ковалентная связь
Ковалентная связь — это связь, обнаруженная в неметаллах, включающая совместное использование пары электронов или более между атомами.
33
Межмолекулярные силы в ковалентных молекулах
Межмолекулярные силы — это слабое притяжение между ковалентно связанными молекулами.
34
Простая ковалентная связь
Простая ковалентная связь включает общую пару электронов.
35
Гигантские ковалентные соединения
Гигантские ковалентные структуры существуют, когда многие атомы ковалентно связаны в большую структуру.
36
Ионная связь
Ионная связь – это связь, образованная, когда металлы и неметаллы передают электроны, создавая противоположно заряженные ионы.
37
Ионные свойства
Ионные соединения обладают рядом свойств благодаря их связыванию, они хрупкие, непроводящие в твердом состоянии и имеют высокие температуры плавления и кипения.
38
Структура и значение таблицы Менделеева: группы
Группы в таблице Менделеева — это столбцы, в которых элементы с похожими свойствами сгруппированы вместе.
39
Структура и значение периодической таблицы: периоды
Периоды периодической таблицы — это строки, расположенные слева направо в периодической таблице. Элементы расположены в них не из-за сходных свойств, а из-за увеличения их атомного номера слева направо.
40
Состояния материи: твердые тела, жидкости и газы
Состояния материи — это различные формы, в которых элементы, соединения и смеси могут существовать в твердом, жидком или газообразном состоянии в зависимости от того, насколько близко находятся их частицы.
41
Исключения из состояний периодической таблицы
В то время как общая тенденция, что металлы являются твердыми телами, а неметаллы являются газами, жидкости и твердые тела, остается верной, и по мере продвижения вниз по неметаллам становится больше твердых веществ. некоторые ключевые исключения.
некоторые ключевые исключения.
42
Физические свойства веществ
Все элементы обладают различными физическими свойствами. Некоторыми из этих физических свойств являются внешний вид, температура плавления, температура кипения, плотность, растворимость и текстура.
43
Плотность элементов
Плотность элементов в периодической таблице является мерой количества атомов и их массы, когда они занимают определенный объем пространства.
44
Химические свойства веществ
Все элементы периодической таблицы обладают химическими свойствами. Химические свойства — это то, как они реагируют с другими элементами с образованием соединений и новых веществ.
45
Реакционная способность элементов периодической таблицы
Реакционная способность является мерой того, насколько легко элемент будет соединяться с другими элементами с образованием соединений. Некоторые элементы нереактивны и нуждаются в энергии, другие будут реагировать спонтанно и легко.
46
Атомный радиус элементов
Атомный радиус — это мера расстояния от центра ядра до внешнего электрона.
47
Ядерный заряд атомов
Ядерный заряд атома является мерой эффекта притяжения между протонами в ядре и внешним электроном
48
Экранирование ядра внутренних оболочек электронов при ослаблении притяжения между протонами ядра и внешним электроном.
49
Энергия ионизации
Энергия ионизации — это мера количества энергии, необходимой для удаления внешнего электрона из атома с образованием положительно заряженного иона.
50
Степени окисления ионов и атомов
Степени окисления являются мерой разности числа протонов и электронов в ионе или атоме ряда элементов в периодической таблице, где их ядра разрушаются и высвобождают частицы, такие как альфа-, бета- и гамма-частицы.
52
Общие группы и периоды в периодической таблице
Все элементы в периодической таблице занимают место в зависимости от их атомного номера, и они распределяются по различным группам и периодам в зависимости от их реакционной способности и физических свойств.
53
Группа 1: Щелочные металлы
Группа 1 — это первая группа в периодической таблице, содержащая элементы, широко известные как щелочные металлы. Все они металлы и увеличивают реакционную способность вниз по группе и при взаимодействии с водой образуют растворы щелочей
54
Группа 2: Щелочноземельные металлы
Группа 2 Щелочноземельные металлы являются 2-й группой в периодической таблице и находятся непосредственно перед переходными металлами. Все они похожи по цвету на серебристо-белые металлы и реагируют с водой с образованием щелочных растворов. Однако они не так реакционноспособны, как металлы группы 1, поскольку имеют 2 валентных электрона вместо 1.
55
Переходные металлы
стол. Они известны как переходные элементы, поскольку они перекрывают промежуток между группами 2 и 3. Все они представляют собой металлы, образуют окрашенные соединения и могут действовать как катализаторы с различными степенями окисления.
56
Группа 17: Галогены
Галогены 17 группы представляют собой двухатомные неметаллические элементы с простой ковалентной связью. Они уменьшают реакционную способность вниз по группе, но повышают свои температуры плавления и кипения.
57
Группа 18: Благородные газы
Группа 18 Благородные газы — это название, данное совокупности газов, находящихся в Группе 18 в самом конце периодической таблицы. Все они неметаллы и существуют в виде одноатомных газов, относительно инертных и нереакционноспособных из-за того, что их внешняя оболочка заполнена электронами.
58
Металлоиды, полуметаллы в Периодической таблице
Металлоиды — это термин, данный элементам в периодической таблице, которые находятся между металлами и неметаллами в правой части. Это элементы, которые проявляют свойства как металлов, так и неметаллов.
59
Лантаниды из расширенной периодической таблицы
Лантаниды представляют собой ряд химических веществ в расширенной периодической таблице, которые имеют большее число орбиталей, чем у переходных металлов. Лантаниды в основном представляют собой мягкие металлы, твердость которых увеличивается с течением времени. Хотя они являются металлами и могут проводить электричество, лантаноиды имеют относительно высокое удельное сопротивление.
Лантаниды в основном представляют собой мягкие металлы, твердость которых увеличивается с течением времени. Хотя они являются металлами и могут проводить электричество, лантаноиды имеют относительно высокое удельное сопротивление.
60
Актиниды расширенной периодической таблицы
Актиниды, также известные как актиноиды, представляют собой набор элементов последнего периода периодической таблицы элементов с 89 по 103. Они представляют собой ряд радиоактивных элементов со схожими свойствами. .
61
Расширенная конфигурация электронов
Электроны являются важными компонентами элемента и определяют его реакционную способность и связывание. У них есть свои уникальные свойства, известные как квантовые числа, что делает их уникальными, существующими на ряде суборбиталей вокруг ядра.
62
Эволюция атома
Наше понимание атома, ядра и электронов, которые его окружают, прошло долгий путь со времен Древней Греции до нашего сегодняшнего понимания. С этим пониманием произошли большие скачки в технологиях и теориях, которые опровергли другие теории, ведущие к модели, которую мы имеем сегодня.
С этим пониманием произошли большие скачки в технологиях и теориях, которые опровергли другие теории, ведущие к модели, которую мы имеем сегодня.
63
История атомной модели: Лавуазье и Дальтон
Современная атомная модель была впервые разработана двумя ведущими учеными Лавуазье и Дальтоном с помощью других. Они сформулировали ключевые концепции закона сохранения массы и существования атомов как строительных блоков всей материи, используя свои знания о химических реакциях.
64
История атомной модели: Томсон и сливовый пудинг
Дж. Дж. Томсон внес огромный вклад в модель атома и современную теорию. Его работа включала использование электронно-лучевых трубок и идентификацию частицы, которая легче самого атома, — электрона.
65
История модели атома: Резерфорд и Бор
Работа ученика Дж. Дж. Томсона, Эрнеста Резерфорда, привела к открытию протона. Работая с альфа-частицами, обстрелянными куском золотой фольги, было замечено, что вместо того, чтобы проходить прямо через него, они рассеивались. Предполагая, что в центре атома находится что-то большое.
Предполагая, что в центре атома находится что-то большое.
66
История модели атома: Чедвик и нейтрон
К 1930-м годам атом состоял из протона как области с положительным зарядом и электронов, вращающихся вокруг него, но все еще не хватало части. Лишь в 1932 году Джеймс Чедвик открыл частицу с такой же массой, как у протона, но без общего заряда, — нейтрон.
67
История атомной модели: корпускулярно-волновой дуализм
Дуализм волновых частиц был революционным способом рассматривать электроны не только как частицы, но и как волны одновременно. Это открыло новые двери в объяснении атома и его поведения, влияя на область квантовой механики.
68
История атомной модели: принцип неопределенности Гейзенберга
Теперь, когда электрон можно рассматривать как волну и как частицу, работа Вернера Гейзенберга была важна для количественной оценки этого понятия как математической концепции и дальнейшего нашего понимания таинственного электрона.
69
История атомной модели: Шрёдингер и волновое уравнение электроны, используя квантовую механику, область науки, которая углубляется в математику и теорию субатомных частиц.
70
Физические свойства элементов
Физические свойства элементов описывают, как элементы взаимодействуют с окружающей средой, особенно с температурой и когда они помещаются в различные вещества.
71
Растворимость элементов и соединений
Растворимость – это физическое свойство, которое определяет, будет ли элемент или соединение растворяться в растворителе с образованием раствора
72
Кристаллические структуры твердых тел
Кристаллическая структура — это понятие, используемое для описания трехмерного расположения атомов в твердом теле.
73
Решетки твердых тел
Решетки представляют собой представления атомов в трехмерной структуре, которые очень часто повторяются снова и снова с одной и той же симметрией.
74
Расширение понятия «Химические свойства»
Химические свойства — это термин, используемый для описания поведения элементов, когда они реагируют друг с другом, и того, как они взаимодействуют, образуя соединения.
75
Атомный радиус
Атомный радиус — это мера расстояния от ядра до валентного электрона.
76
Заряд ядра
Заряд ядра — это мера влияния количества протонов в ядре и их способности притягивать отрицательно заряженные электроны на орбитах вокруг ядра.
77
Экранирование
Экранирование является мерой влияния внутренних подоболочек SPD и F на их интерференцию ядерного заряда протонов с валентным электроном.
78
Ионный радиус
Ионный радиус можно определить как размер радиуса иона от ядра до валентного электрона. Ионный радиус трудно измерить из-за перекрытия ионов в структуре решетки.
79
Сродство к электрону элементов
Сродство к электрону — это мера энергии, высвобождаемой при присоединении электрона к атому для создания отрицательно заряженного иона.
80
Электроотрицательность элементов
Электроотрицательность — это мера способности атома притягивать к себе электроны в ковалентной связи.
81
Прочность связи разорвать связь
82
Межмолекулярные силы в ковалентных соединениях
Межмолекулярные силы — это силы притяжения, существующие между ковалентными соединениями, удерживающими их вместе. Есть три разных типа разной силы.
83
Лондонские дисперсионные силы
Лондонские дисперсионные силы являются самым слабым типом межмолекулярных сил и требуют очень мало энергии для их преодоления. Они очень часто встречаются в неполярных молекулах, которые входят в состав простых ковалентных соединений или элементов.
84
Дипольное притяжение
Дипольные силы обычно возникают между молекулами, которые имеют разную электроотрицательность, поэтому электроны распределены неравномерно, что означает, что молекула полярна. Из-за его полярности это означает, что формируется слабый диполь, который создает слабое межмолекулярное притяжение к молекуле рядом с ним.

 е. короний, или иной газ с плотностью около 0,2 по отношению к водороду, не может быть никоим образом мировым эфиром; его плотность (по водороду) для этого высока, он побродит, быть может, и долго, в мировых полях, вырвется из уз земли, опять в них случайно ворвется, но всё же из сферы притяжения солнца не вырвется, а, конечно, между звёздами найдутся и помассивнее нашей центральной звезды. Атомы же эфира, надо представить не иначе, как способными преодолевать даже солнечное притяжение, свободно наполняющими всё пространство и везде могущими проникать. Этот элемент, y, однако необходим для того, чтобы умственно подобраться к тому наилегчайшему, а потому и наиболее быстро движущемуся элементу x, который по моему разумению, можно считать эфиром.
е. короний, или иной газ с плотностью около 0,2 по отношению к водороду, не может быть никоим образом мировым эфиром; его плотность (по водороду) для этого высока, он побродит, быть может, и долго, в мировых полях, вырвется из уз земли, опять в них случайно ворвется, но всё же из сферы притяжения солнца не вырвется, а, конечно, между звёздами найдутся и помассивнее нашей центральной звезды. Атомы же эфира, надо представить не иначе, как способными преодолевать даже солнечное притяжение, свободно наполняющими всё пространство и везде могущими проникать. Этот элемент, y, однако необходим для того, чтобы умственно подобраться к тому наилегчайшему, а потому и наиболее быстро движущемуся элементу x, который по моему разумению, можно считать эфиром. Чем он более смещен вниз и влево, тем она больше.
Чем он более смещен вниз и влево, тем она больше.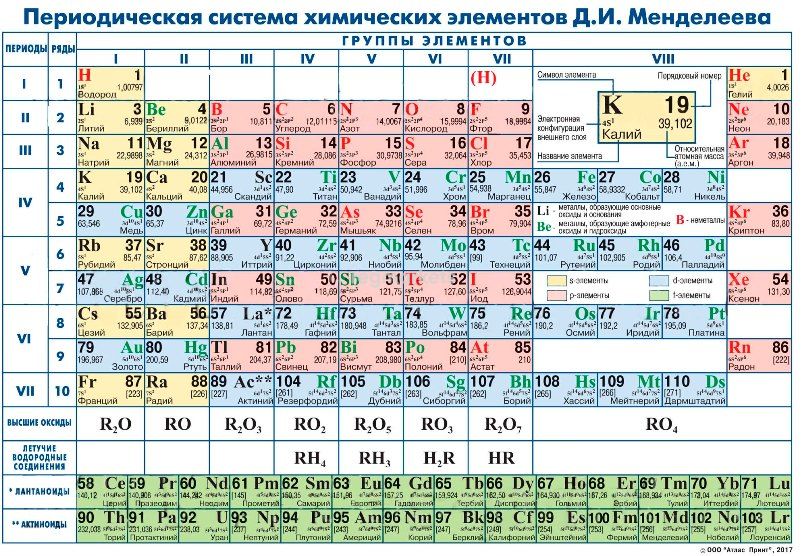
 Указывается в верхней части клеточки, в центре или в углу. Это стандартно целое число от 1 до 118.
Указывается в верхней части клеточки, в центре или в углу. Это стандартно целое число от 1 до 118.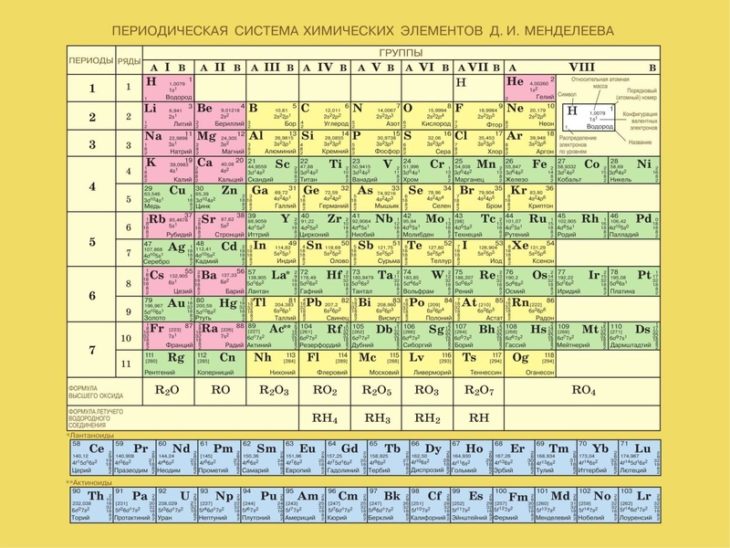 88 МБ
88 МБ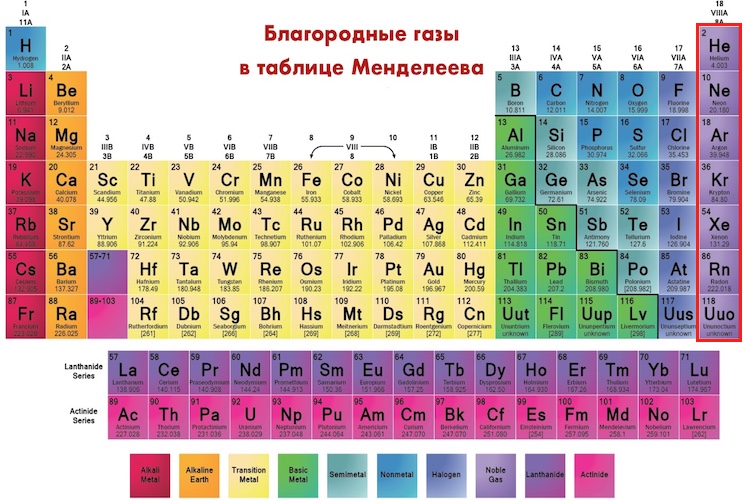
 Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
 Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними.
Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними.  Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.
Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.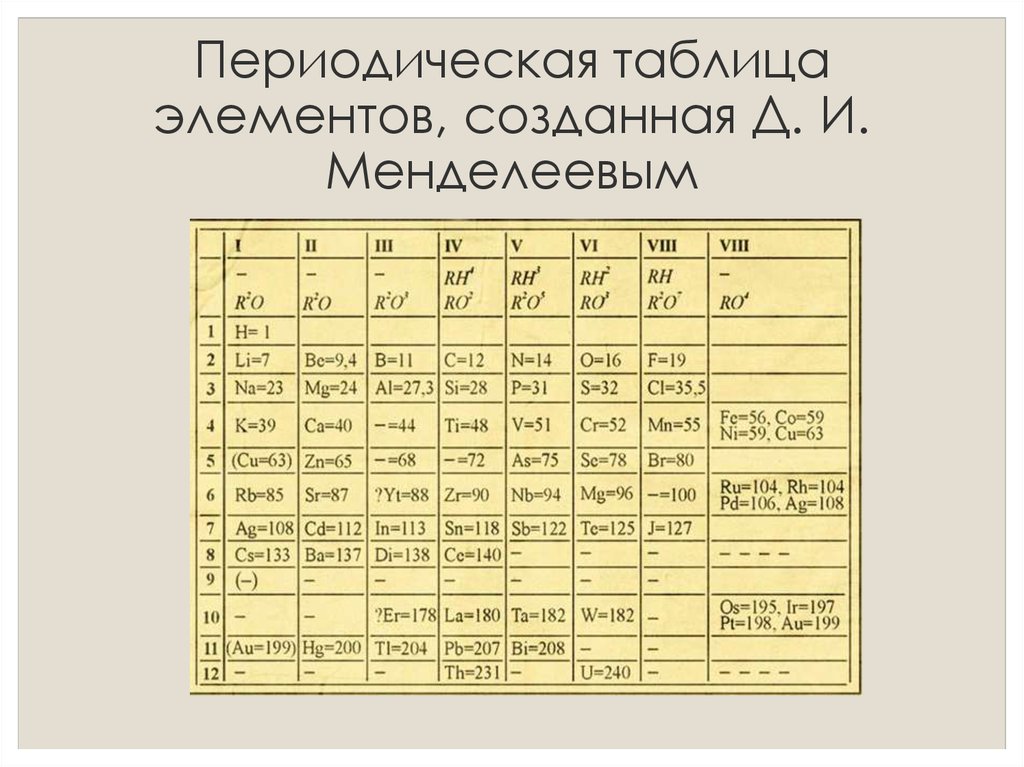


 Что это было?
Что это было?  N. Proc. Рой. соц. 17 , 91–92 (1868).
N. Proc. Рой. соц. 17 , 91–92 (1868).