Цезий
| Цезий | |
|---|---|
| Атомный номер | 55 |
| Внешний вид простого вещества |
очень мягкий вязкий серебристо-жёлтый похожий на золото металл |
| Свойства атома | |
|
Атомная масса (молярная масса) |
132,90543 а. е. м. (г/моль) |
| Радиус атома | 267 пм |
|
Энергия ионизации (первый электрон) |
375,5 (3,89) кДж/моль (эВ) |
| Электронная конфигурация | [Xe] 6s1 |
| Ковалентный радиус | 235 пм |
| Радиус иона | (+1e) 167 пм |
|
Электроотрицательность (по Полингу) |
0,79 |
| Электродный потенциал | 0 |
| Степени окисления | 1 |
| Термодинамические свойства простого вещества | |
| Плотность | 1,873 г/см³ |
| Молярная теплоёмкость | 32,21[1]Дж/(K·моль) |
| Теплопроводность | 35,9 Вт/(м·K) |
| Температура плавления | 301,6 K |
| Теплота плавления | 2,09 кДж/моль |
| Температура кипения | 951,6 K |
| Теплота испарения | 68,3 кДж/моль |
| Молярный объём | 70,0 см³/моль |
| Структура решётки |
кубическая объёмноцентрированная |
| Параметры решётки | 6,140 Å |
| Отношение c/a | n/a |
| Температура Дебая | 39,2 K |
| Cs | 55 |
|
132,90545 |
|
| [Xe]6s1 | |
| Цезий | |
Цезий — элемент главной подгруппы первой группы шестого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 55. Обозначается символом Cs (лат. Caesium). Простое вещество цезий (CAS-номер: 7440-46-2) — мягкий щелочной металл серебристо-жёлтого цвета. Своё название цезий получил за наличие двух ярких синих линий в эмиссионном спектре (от лат. caesius — небесно-голубой). Цезий был открыт в 1860 году немецкими учёными Р. В. Бунзеном и Г. Р. Кирхгофом в водах Дюрхгеймского минерального источника в Германии методом оптической спектроскопии, тем самым, став первым элементом, открытым при помощи спектрального анализа. В чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия (CsCN) и бария.
И. Менделеева, атомный номер 55. Обозначается символом Cs (лат. Caesium). Простое вещество цезий (CAS-номер: 7440-46-2) — мягкий щелочной металл серебристо-жёлтого цвета. Своё название цезий получил за наличие двух ярких синих линий в эмиссионном спектре (от лат. caesius — небесно-голубой). Цезий был открыт в 1860 году немецкими учёными Р. В. Бунзеном и Г. Р. Кирхгофом в водах Дюрхгеймского минерального источника в Германии методом оптической спектроскопии, тем самым, став первым элементом, открытым при помощи спектрального анализа. В чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия (CsCN) и бария.
Получение
Основными цезиевыми минералами являются поллуцит и очень редкий авогадрит (K,Cs)[BF4]. Кроме того, в виде примесей цезий входит в ряд алюмосиликатов: лепидолит, флогопит, биотит, амазонит, петалит, берилл, циннвальдит, лейцит, карналлит. В качестве промышленного сырья используются поллуцит и лепидолит.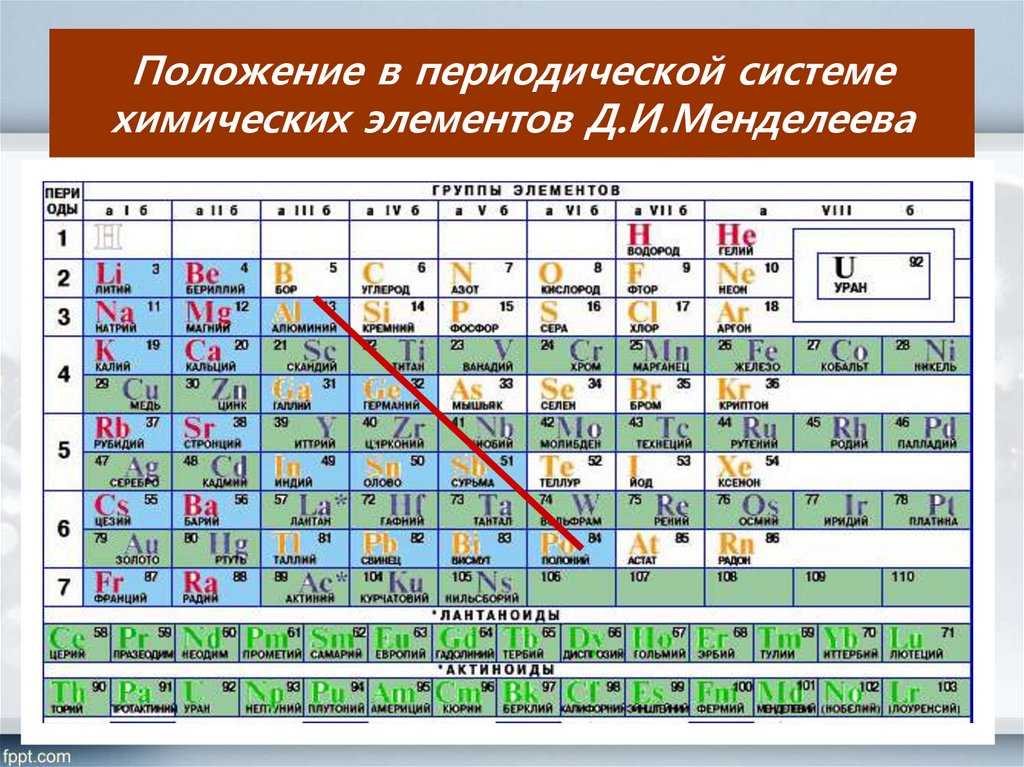
При промышленном получении цезий в виде соединений извлекается из минерала поллуцита. Это делается хлоридным или сульфатным вскрытием. Первое включает обработку исходного минерала подогретой соляной кислотой, добавление хлорида сурьмы SbCl3 для осаждения соединения Cs3[Sb2Cl9] и промывку горячей водой или раствором аммиака с образованием хлорида цезия CsCl. При втором — минерал обрабатывается подогретой серной кислотой с образованием алюмоцезиевых квасцов CsAl(SO4)2 · 12H2O.
В России после распада СССР промышленная добыча поллуцита не велась, хотя в Вороньей тундре под Мурманском ещё в советское время были обнаружены колоссальные запасы минерала. К тому времени, когда российская промышленность смогла встать на ноги, выяснилось, что лицензию на разработку этого месторождения купила Канадская компания
Существует несколько лабораторных методов получения цезия. Он может быть получен:
- нагревом в вакууме смеси хромата или дихромата цезия с цирконием;
- разложением азида цезия в вакууме;
- нагревом смеси хлорида цезия и специально подготовленного кальция.
Все методы являются трудоёмкими. Второй позволяет получить высокочистый металл, однако является взрывоопасным и требует на реализацию несколько суток.
Мировые ресурсы цезия
Цезий входит в группу химических элементов с ограниченными запасами вместе с гафнием, танталом, бериллием, рением, металлами платиновой группы, кадмием, теллуром. Общие выявленные мировые ресурсы руд составляют около 180 тыс. тонн (в пересчёте на окись цезия), но они крайне распылены, и, к сожалению, сверхвысокие цены — это неотъемлемая черта, сопровождающая цезий и рубидий в прошлом, настоящем и будущем. Мировой объём добычи цезия составляет около 9 тонн в год, а потребность свыше 85 тонн в год и она постоянно растёт.

Изотопы
Природный цезий — мононуклидный элемент, состоящий из единственного стабильного нуклида  Оба эти долгоживущих радионуклида являются продуктами ядерного распада.
Оба эти долгоживущих радионуклида являются продуктами ядерного распада.
Физические свойства
Цезий — мягкий металл, из-за низкой температуры плавления (Tпл=28,6 °C) при комнатной температуре находится в полужидком состоянии. Металлический цезий представляет собой вещество золотисто-белого цвета, по внешнему виду похожее на золото, но светлее. Расплав представляет подвижную жидкость, при этом его цвет становится более серебристым. Жидкий цезий хорошо отражает свет. Кристаллизуется цезий в объёмно-центрированную кубическую решётку (тип α-железа), при высоком давлении может переходить в другие полиморфные модификации[4]. Цезий — парамагнетик.
Химические свойства
Цезий является наиболее химически активным металлом. На воздухе цезий мгновенно окисляется с воспламенением, образуя надпероксид CsO2. При ограниченном доступе кислорода окисляется до оксида Cs2O. Взаимодействие с водой происходит со взрывом, продуктом взаимодействия являются гидроксид CsOH и водород H2. Цезий вступает в реакцию со льдом (даже при −120 °C), простыми спиртами, галогеноорганическими соединениями, галогенидами тяжёлых металлов, кислотами, сухим льдом (взаимодействие протекает с сильным взрывом). Активность цезия обусловлена не только высоким отрицательным электрохимическим потенциалом, но и невысокой температурой плавления и кипения (быстро развивается очень большая контактная поверхность, что увеличивает скорость реакции). Все образуемые цезием соли — нитраты, хлориды, бромиды, фториды, йодиды, хроматы, манганаты, перхлораты, хлораты, азиды, цианиды, карбонаты и т. д — чрезвычайно легко растворимы в воде и ряде органических растворителей, наименее растворимы перхлораты (что важно для технологии получения и очистки цезия). Несмотря на то, что цезий является весьма активным металлом, он, в отличие от лития, не вступает в реакцию с азотом при обычных условиях и, в отличие от бария, кальция, магния и ряда других металлов, не способен образовать с азотом соединений даже при сильнейшем нагревании.
Цезий вступает в реакцию со льдом (даже при −120 °C), простыми спиртами, галогеноорганическими соединениями, галогенидами тяжёлых металлов, кислотами, сухим льдом (взаимодействие протекает с сильным взрывом). Активность цезия обусловлена не только высоким отрицательным электрохимическим потенциалом, но и невысокой температурой плавления и кипения (быстро развивается очень большая контактная поверхность, что увеличивает скорость реакции). Все образуемые цезием соли — нитраты, хлориды, бромиды, фториды, йодиды, хроматы, манганаты, перхлораты, хлораты, азиды, цианиды, карбонаты и т. д — чрезвычайно легко растворимы в воде и ряде органических растворителей, наименее растворимы перхлораты (что важно для технологии получения и очистки цезия). Несмотря на то, что цезий является весьма активным металлом, он, в отличие от лития, не вступает в реакцию с азотом при обычных условиях и, в отличие от бария, кальция, магния и ряда других металлов, не способен образовать с азотом соединений даже при сильнейшем нагревании.
Гидроксид цезия — сильнейшее основание с высочайшей электропроводностью в водном растворе; так, например, при работе с ним необходимо учитывать, что концентрированный раствор CsOH разрушает стекло даже при обычной температуре, а расплав разрушает железо, кобальт, никель, а также платину, корунд и диоксид циркония, и даже постепенно разрушает серебро и золото (в присутствии кислорода — очень быстро). Единственным устойчивым в расплаве гидроксида цезия металлом является родий и его некоторые сплавы.
Применение
Цезий нашёл применение только в начале XX века, когда были обнаружены его минералы и разработана технология получения в чистом виде. В настоящее время цезий и его соединения используются в электронике, радио-, электро-, рентгенотехнике, химической промышленности, оптике, медицине, ядерной энергетике. В основном применяется стабильный природный цезий-133, и ограниченно — его радиоактивный изотоп цезий-137, выделяемый из суммы осколков деления урана, плутония, тория в реакторах атомных электростанций.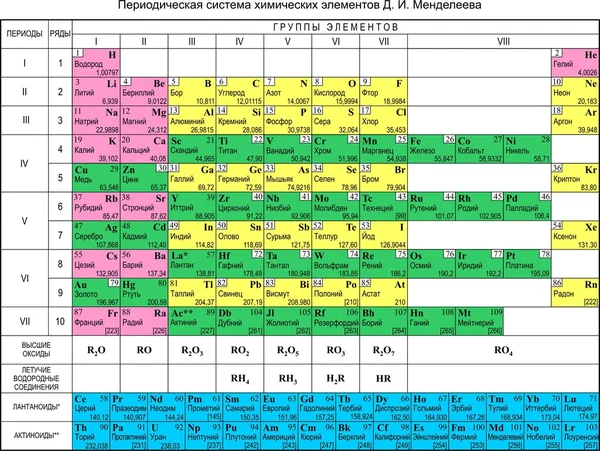
Фотоэлементы, фотоумножители
Благодаря крайне низкой работе выхода электрона, цезий используется при производстве высокочувствительных и малоинерционных фотоэлектрических приборов — фотоэлементов, фотоумножителей. В фотоэлементах цезий обычно применяется в виде сплавов с сурьмой, кальцием, барием, алюминием, или серебром, которые вводятся для повышения эффективности устройства, а также для экономии чрезвычайно дорогого цезия. Такие фотоэлементы способны работать в широком диапазоне длин волн: от дальней ультрафиолетовой, до коротковолновой инфракрасной области электромагнитного излучения, что делает цезиевые фотоэлементы эффективнее рубидиевых. Кроме того, недавно было обнаружено свойство цезия очень резко снижать работу выхода при диффузии в золото[источник не указан 155 дней], что может открыть новые перспективы его использования.
Счетчики заряженных частиц
Йодид цезия в виде монокристаллов, является чрезвычайно важным и чувствительным материалом в области регистрации излучений (для этого он активируется таллием). Детекторы частиц на его основе применяются в атомной технике, геологии, медицине, космических исследованиях. Так например измерения элементного состава поверхности Марса выполнялись с помощью гамма спектрометра на основе CsI (Tl), установленного на космическом орбитальном аппарате «Марс-5».
Детекторы частиц на его основе применяются в атомной технике, геологии, медицине, космических исследованиях. Так например измерения элементного состава поверхности Марса выполнялись с помощью гамма спектрометра на основе CsI (Tl), установленного на космическом орбитальном аппарате «Марс-5».
Оптика
Йодид и бромид цезия применяются в качестве оптических материалов в специальной оптике — инфракрасные приборы, очки и бинокли ночного видения, прицелы, обнаружение техники и живой силы противника (в том числе из космоса).
Источники света
В электротехнике цезий применяется в изготовлении светящихся трубок, где он применяется в виде соединений с цирконием или оловом (метацирконаты и ортостаннаты цезия). Наряду с другими металлами цезий используется для наполнения осветительных газоразрядных металлогалогеновых ламп.
Катализаторы
Цезий нашёл большое применение в производственной химии в качестве катализатора (органический и неорганический синтез). Каталитическая активность цезия используется в процессах получения аммиака, серной кислоты, бутилового спирта, в реакциях дегидрогенизации и при получении муравьиной кислоты. Особенно эффективным является применения цезия как промотора при каталитическом получении аммиака, синтезе бутадиена, и имеет очень большое экономическое значение так как резко увеличивает эффективность синтеза. Очень большое значение приобрел рутений-цезий-углеродный катализатор. В целом применение цезия в катализе имеет не только большую сферу его потребления но и большие перспективы дальнейшего развития. В ряде катализаторов оказалось чрезвычайно эффективным применение цезия совместно с рубидием (оба металла значительно увеличивают каталитическую активность друг друга). Цезий промотирует действие серебряного катализатора, и повышает его селективность при эпоксидировании этилена.
Каталитическая активность цезия используется в процессах получения аммиака, серной кислоты, бутилового спирта, в реакциях дегидрогенизации и при получении муравьиной кислоты. Особенно эффективным является применения цезия как промотора при каталитическом получении аммиака, синтезе бутадиена, и имеет очень большое экономическое значение так как резко увеличивает эффективность синтеза. Очень большое значение приобрел рутений-цезий-углеродный катализатор. В целом применение цезия в катализе имеет не только большую сферу его потребления но и большие перспективы дальнейшего развития. В ряде катализаторов оказалось чрезвычайно эффективным применение цезия совместно с рубидием (оба металла значительно увеличивают каталитическую активность друг друга). Цезий промотирует действие серебряного катализатора, и повышает его селективность при эпоксидировании этилена.
Химические источники тока
На основе цезия создан и применяется высокоэффективный твёрдый электролит для топливных элементов (в том числе автомобильных), и аккумуляторов чрезвычайно высокой энергоёмкости — цезий-бета-глинозём (алюминат цезия).
Изотопы
Радиоактивный нуклид цезий-137 претерпевает бета-распад (период полураспада 30,17 лет, продукты распада барий-137 и барий-137m) используется в гамма-дефектоскопии, измерительной технике и при стерилизации пищевых продуктов (консервы, туши птиц и животных, мяса), а также для стерилизации медицинских препаратов и лекарств, в радиотерапии для лечения злокачественных опухолей. Также цезий-137 используется в производстве радиоизотопных источников тока, где он применяется в виде хлорида цезия (плотность 3,9 г/см³, энерговыделение около 1,27 Вт/см³). Цезий-137 используется в датчиках предельных уровней сыпучих веществ в непрозрачных бункерах.
Нуклид цезий-133 используется в атомных часах.
Медицина
На основе соединений цезия созданы эффективные лекарственные препараты для лечения язвенных заболеваний, дифтерии, шоков, шизофрении.
Применение цезия в энергетике и космосе
Значительной сферой применения металлического цезия являются новейшие и стремительно развивающиеся работы и производство энергетических агрегатов. Цезиевая плазма является важнейшей и неотъемлемой компонентой МГД-генераторов с повышенным КПД до 65—70 %. Ионизированые пары цезия являются лучшим рабочим телом для ионных двигателей в космосе.
Цезиевая плазма является важнейшей и неотъемлемой компонентой МГД-генераторов с повышенным КПД до 65—70 %. Ионизированые пары цезия являются лучшим рабочим телом для ионных двигателей в космосе.
Сплав цезия с барием является лучшимиз известных материалов для выпрямления сверхмощных потоков электроэнергии (превосходя в этом отношении ртутные и полупроводниковые вентили) и в будущем займёт важнейшее положение в большой энергетике и космических электроракетных установках. Одним из его отличительных особенностей является возможность выпрямления и коммутирования чудовищных мощностей в импульсном режиме. В виду того что цезий имеет большую теплоёмкость, теплопроводность и ряд собственных сплавов с очень низкой температурой плавления (цезий 94,5 и натрий 5,5 %) −30 °C, то используется в качестве теплоносителя в атомных реакторах и высокотемпературных турбоэнергетических установках, а сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.
В течение последних 25 лет цезий исследуется в мире как Материя Ридберга (конденсат возбуждённых состояний цезия КВС), по предварительным оценкам сделанным экспериментально в Швеции и России, КВС цезия при температуре менее 700 K имеет весьма высокую электропроводность и работу выхода менее 1эВ и вплоть до 0,2 эВ, что позволяет применить металлический цезий для производства высокоэффективных источников тока, электростанций, утилизации тепла (например тепла продуктов сгорания автомобилей). Конденсат возбуждённых состояний цезия образуется при прокачке его паров сквозь перфорированный (губчатый) материал коллектора имеющий на своей поверхности тончайший слой углерода или окислов (например карбид гафния, ниобия или тантала). Для исследования КВС цезия применяется растровое лазерное сканирование, оптическая спектроскопия и съёмка видеокамерой, и уже в ходе первых исследований были обнаружены аномальные явления проявившие себя в образовании кластеров капельной плазменной фракции окрашенной в зеленые тона и резком уменьшении работы выхода коллектора.
Металлургия
Металлический цезий на заре поисков его ассимиляции в промышленности обнаружил свойство резко повышать жаропрочность магния и алюминия, так например добавка 0,3—0,4 % цезия к магнию в 3 раза повышает его прочность на разрыв и резко улучшает его коррозионную стойкость, но ввиду весьма высокой цены, и наличия других более дешёвых металлов для легирования он не применяется для этой цели.
Высокотемпературная сверхпроводимость
Недавно найдено что продукты внедрения цезия в графит (фуллериды) обладают свойством высокотемпературной сверхпроводимости и интенсивно изучаются.
Производство лазеров
В последние годы цезий так же весьма интенсивно изучается как рабочее тело и излучательная среда для создания лазеров имеющих рекордные значения пиковых мощностей как в непрерывном так и в импульсном режиме работы, и в значительной степени этот интерес и огромные капиталовложения направлены на разработку лазеров для вооружения и в области получения термоядерной энергии, но… в равной степени интересу и капиталовложениям противопоставлена закрытость и минимум информации для печати (обусловленных некоторой соревновательностью развитых в технологическом отношении стран, заинтересованных в этом направлении).
Производство электродов
Совершенно особое место и очень большую область применения и расхода металлического цезия в последние годы представляет его использование в качестве добавки к вольфраму для производства электродов мощных осветительных дуговых ламп и электродов применяемых для сварки алюминия, магния, титана, церия, нержавеющей стали и целого ряда активных сплавов в среде аргона, гелия и водорода. Применение этой добавки (около 0,1—0,35 %) в значительной степени облегчает зажигание и горение дуги при низком напряжении.
Термоэлектрические материалы
Совсем недавно цезий приобрёл новое направление своей ассимиляции (освоение практикой), и это направление является революционным прорывом для разработки новейшей компьютерной техники, генераторов энергии, холодильников глубокого холода (криогенных) и так далее. Оказалось что сплав сверхчистого висмута, сверхчистого теллура, и сверхчистого цезия обладает поистине фантастическими возможностями для создания охладителей основанных на эффекте Пельтье. Как показывает практический опыт эксплуатации этого нового полупроводникового материала, его использование наиболее эффективно именно в новейших суперпроцессорах на основе нитрида бора и монокристаллического алмаза в качестве теплоотвода и основы схемы. Применение этого материала открывает широкие возможности для повышения быстродействия — то есть «ускорения холодом». Так в опытах с этим новым полупроводниковым материалом удалось на сегодняшний день получить охлаждение вплоть до −237 °C, и это в свою очередь позволяет создавать микрохолодильники для охлаждения мощных процессоров (в том числе нанопроцессоров), холодильники для глубокой заморозки тканей и клеточного материала, сжижения газов, охлаждения боевых ультрафиолетовых и инфракрасных лазерных систем, тепловизоров, а в перспективе для охлаждения высокотемпературных сверхпроводников для высокоскоростного транспорта на «магнитной подушке». Очень важным направлением использования данного полупроводника ряд специалистов рассматривает создание лазеров на монокристаллах алмаза с очень высоким КПД, и возможностью работы в пикосекундном диапазоне, что очень важно для конструирования оптоэлектронных систем для обработки информации.
Как показывает практический опыт эксплуатации этого нового полупроводникового материала, его использование наиболее эффективно именно в новейших суперпроцессорах на основе нитрида бора и монокристаллического алмаза в качестве теплоотвода и основы схемы. Применение этого материала открывает широкие возможности для повышения быстродействия — то есть «ускорения холодом». Так в опытах с этим новым полупроводниковым материалом удалось на сегодняшний день получить охлаждение вплоть до −237 °C, и это в свою очередь позволяет создавать микрохолодильники для охлаждения мощных процессоров (в том числе нанопроцессоров), холодильники для глубокой заморозки тканей и клеточного материала, сжижения газов, охлаждения боевых ультрафиолетовых и инфракрасных лазерных систем, тепловизоров, а в перспективе для охлаждения высокотемпературных сверхпроводников для высокоскоростного транспорта на «магнитной подушке». Очень важным направлением использования данного полупроводника ряд специалистов рассматривает создание лазеров на монокристаллах алмаза с очень высоким КПД, и возможностью работы в пикосекундном диапазоне, что очень важно для конструирования оптоэлектронных систем для обработки информации. Ведущей страной в этой новой области использования является Япония.
Ведущей страной в этой новой области использования является Япония.
Оптические материалы микроэлектроники
Триборат цезия и триборат цезия-лития, а так же фосфат цезия-галлия используются как специальные оптические материалы в новейших областях радиоэлектроники.
Пьезоэлектрические материалы
Дигидрофосфат цезия в 7 раз более эффективный пьезоэлектрик, чем кварц, и, несмотря на то, что несколько уступает по эффективности сегнетовой соли, тем не менее более устойчив к влаге чем последняя.
Атомно-водородная энергетика
Совершенно исключительное значение металлический цезий играет в атомно-водородной энергетике при разложении воды термохимическим способом (цикл «Аэроджет Дженерал»).
Защита воздушных судов
Очень важной областью применения цезия является производство специальных ламп с электронным управлением, для создания тепловых помех для ракет противника. Такие цезиевые лампы устанавливаются на современных боевых самолётах и в значительной степени повышают живучесть самолетов в бою.
Прочие области ассимиляции цезия
Фторид цезия применяют для получения фторорганических соединений, пьезоэлектрической керамики, специальных стекол. Хлорид цезия — электролит в топливных элементах, флюс при сварке молибдена.
Биологическая роль
Цезий и рубидий относят к малоизученным микроэлементам. Эти элементы находятся в окружающей среде и поступают в организм различными путями, в основном с пищей. Установлено их постоянное наличие в организме. Однако до сих пор эти элементы не считаются биотическими.
Рубидий и цезий найдены во всех исследованных органах млекопитающих и человека. Поступая в организм с пищей, они быстро всасываются из желудочно-кишечного тракта в кровь. Средний уровень рубидия в крови составляет 2,3—2,7 мг/л, причём его концентрация в эритроцитах почти в три раза выше, чем в плазме. Рубидий и цезий весьма равномерно распределяется в органах и тканях, причём, рубидий, в основном, накапливается в мышцах, а цезий поступает в кишечник и вновь реабсорбируется в нисходящих его отделах.
Известна роль рубидия и цезия в некоторых физиологических процессах. В настоящее время установлено стимулирующее влияние этих элементов на функции кровообращения и эффективность применения их солей при гипотониях различного происхождения. Исходя из выраженного гипертензивного и сосудосуживающего действия, соли цезия ещё в 1888 г. впервые были применены С. С. Боткиным при нарушениях функции сердечно-сосудистой системы. В лаборатории И. П. Павлова С. С. Боткиным было установлено, что хлориды цезия и рубидия вызывают повышение артериального давления на длительное время и, что это действие связано, главным образом, с усилением сердечно-сосудистой деятельности и сужением периферических сосудов.
Установлено адреноблокирующее и симпатомиметическое действие солей цезия и рубидия на центральные и периферические адренореактивные структуры, которое особенно ярко выражено при подавлении тонуса симпатического отдела центральной нервной системы и дефиците катехоламинов. Солям этих металлов свойственен, главным образом, β-адреностимулирующий эффект.
Соли рубидия и цезия оказывают влияние на неспецифические показатели иммунобиологической резистентности — они вызывают значительное увеличение титра комплемента, активности лизоцима, фагоцитарной активности лейкоцитов. Есть указание на стимулирующее влияние солей рубидия и цезия на функции кроветворных органов. В микродозах они вызывают стимуляцию эритро- и лейкопоэза (на 20—25 %), заметно повышают резистентность эритроцитов, увеличивают содержание гемоглобина в них.
Хлорид рубидия и хлорид цезия участвуют в газовом обмене, активируя деятельность окислительных ферментов, соли этих элементов повышают устойчивость организма к гипоксии.
Цезий в живых организмах
Цезий в живых организмах — постоянный химический микроэлемент организма растений и животных. Морские водоросли например содержат от 0,01-0,1 мкг цезия в 1 г сухого вещества, наземные растения — 0,05—0,2. Животные получают цезий с водой и пищей. В организме членистоногих около 0,067—0,503 мкг/г цезия, пресмыкающихся — 0,04, млекопитающих — 0,05. Главное депо цезия в организме млекопитающих — мышцы, сердце, печень; в крови — до 2,8 мкг/л цезий относительно малотоксичен; его биологическая роль в организме растений и животных окончательно не раскрыта.
Главное депо цезия в организме млекопитающих — мышцы, сердце, печень; в крови — до 2,8 мкг/л цезий относительно малотоксичен; его биологическая роль в организме растений и животных окончательно не раскрыта.
Цезий-137 — радиоактивный изотоп цезия, испускающий бета излучение и гамма-кванты, и один из главных компонентов радиоактивного загрязнения биосферы. Содержится в радиоактивных выпадениях, радиоактивных отходах, сбросах заводов, перерабатывающих отходы атомных электростанций. Интенсивно сорбируется почвой и донными отложениями; в воде находится преимущественно в виде ионов. Содержится в растениях и организме животных и человека. Коэффициент накопления Cs-137 наиболее высок у пресноводных водорослей и арктических наземных растений, особенно лишайников. В организме животных Cs-137 накапливается главным образом в мышцах и печени. Наибольший коэффициент накопления его отмечен у северных оленей и североамериканских водоплавающих птиц. Накапливается в грибах, ряд которых (маслята, моховики, свинушка, горькушка, польский гриб) считается «аккумуляторами» радиоцезия.
Цезий – Периодическая Таблица
Группа
1
Период
6
Блок
s
Протоны
Электроны
Нейтроны
55
55
78
Главные Свойства
Атомный номер
55
Атомный вес
132,9054519
Массовое число
133
Категория
Щелочные металлы
Цвет
Серебряный
Радиоактивность
Да
От латинского слова цезиус — небесно-голубой
Кристаллическая структура
Телоцентрированный куб
История
Роберт Бунзен и Густав Кирхгоф были первыми, кто предложил найти цезий в 1860 году с помощью спектрального анализа.
Они обнаружили цезий по двум его синим эмиссионным линиям в образце минеральной воды Дюркгейм.
В конечном итоге чистый металл был выделен немецким химиком Карлом Сеттербергом во время работы над докторской степенью вместе с Кекуле и Бунзеном.
Цезий был первым элементом, обнаруженным с помощью спектроскопа
Физические Свойства
Фаза
Твердое тело
Плотность
1,873 грамм/см3
Температура плавления
301,59 K | 28,44 °C | 83,19 °F
Температура кипения
944,15 K | 671 °C | 1239,8 °F
Теплота плавления
2,09 кДж/моль
Теплота парообразования
65 кДж/моль
Удельная теплоемкость
0,242 Дж/грамм·K
Избыток на Земле
0,00019%
Избыток во Вселенной
8×10-8%
Изображение разработчиков: Wikimedia Commons (Dnn87)
Cesium metal sample from the Dennis s. k collection
k collection
Номер CAS
7440-46-2
Номер PubChem CID
5354618
Атомные Свойства
Атомный радиус
265 pm
Ковалентный радиус
244 pm
Электроотрицательность
0,79 (Шкала Полинга)
Ионизационный потенциал
3,8939 эВ
Атомный объем
71,07 см3/моль
Теплопроводность
0,359 W/см·K
Состояния окисления
-1, 1
Применения
Радиоактивный изотоп цезия-137 имеет период полураспада около 30 лет и используется в медицине, промышленных приборах и гидрологии.
Цезий также используется в фотоэлементах и в качестве катализатора гидрирования органических соединений.
Термоэмиссионные генераторы паров цезия представляют собой маломощные устройства, преобразующие тепловую энергию в электрическую.
Соединения цезия считаются умеренно токсичными
Изотопы
Стабильные изотопы
133Cs
Нестабильные изотопы
112Cs, 113Cs, 114Cs, 115Cs, 116Cs, 117Cs, 118Cs, 119Cs, 120Cs, 121Cs, 122Cs, 123Cs, 124Cs, 125Cs, 126Cs, 127Cs, 128Cs, 129Cs, 130Cs, 131Cs, 132Cs, 134Cs, 135Cs, 136Cs, 137Cs, 138Cs, 139Cs, 140Cs, 141Cs, 142Cs, 143Cs, 144Cs, 145Cs, 146Cs, 147Cs, 148Cs, 149Cs, 150Cs, 151Cs
Важные Ссылки
Википедия
Encyclopaedia BritannicaWolfram AlphaChemicoolRSC Visual ElementsWebElements
КсенонCsБарий
Цезий | Описание, символ, использование и факты
цезий
Смотреть все СМИ
- Ключевые люди:
- Роберт Бунзен Густав Кирхгоф
- Похожие темы:
- химический элемент щелочной металл цезий-137 цезий-133
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
цезий (Cs) , также пишется как цезий , химический элемент группы 1 (также называемой группой Ia) периодической таблицы, группы щелочных металлов и первого элемента, открытого спектроскопически (1860 г. ) немецким ученые Роберт Бунзен и Густав Кирхгоф, которые назвали его за уникальные синие линии его спектра (латинское caesius , «небесно-голубой»).
) немецким ученые Роберт Бунзен и Густав Кирхгоф, которые назвали его за уникальные синие линии его спектра (латинское caesius , «небесно-голубой»).
Этот серебристый металл с золотым отливом является самым реакционноспособным и одним из самых мягких металлов. Он плавится при 28,4 ° C (83,1 ° F), что чуть выше комнатной температуры. Его примерно вдвое меньше, чем свинца, и в 70 раз больше, чем серебра. Цезий встречается в незначительных количествах (7 частей на миллион) в земной коре в минералах поллуците, родизите и лепидолите. Поллюцит (Cs 4 Al 4 Si 9 O 26 ∙H 2 O) — богатый цезием минерал, напоминающий кварц. Он содержит 40,1 процента цезия в чистом виде, а нечистые образцы обычно разделяются методами ручной сортировки до содержания цезия более 25 процентов. Большие залежи поллуцита были обнаружены в Зимбабве и в литийсодержащих пегматитах на озере Берник, Манитоба, Канада. Родизит — редкий минерал, обнаруженный в низких концентрациях в лепидолите, а также в солевых рассолах и соляных отложениях.
Викторина «Британника»
Викторина «118 названий и символов периодической таблицы»
Основная трудность, связанная с получением чистого цезия, заключается в том, что цезий всегда встречается в природе вместе с рубидием, а также смешивается с другими щелочными металлами. Поскольку цезий и рубидий химически очень похожи, их разделение представляло множество проблем до появления ионообменных методов и ион-специфических комплексообразователей, таких как краун-эфиры. После того, как чистые соли были получены, преобразовать их в свободный металл несложно.
Цезий может быть выделен электролизом расплавленной смеси цианида цезия/цианида бария и другими методами, такими как восстановление его солей металлическим натрием с последующей фракционной перегонкой. Цезий взрывоопасно реагирует с холодной водой; он легко соединяется с кислородом, поэтому его используют в вакуумных трубках в качестве «поглотителя» для удаления следов кислорода и других газов, попавших в трубку при ее закрытии. Очень чистый безгазовый цезий, необходимый в качестве «поглотителя» кислорода в вакуумных трубках, может быть получен при необходимости путем нагревания азида цезия (CsN 3 ) в вакууме. Поскольку цезий сильно фотоэлектричен (легко теряет электроны при попадании света), он используется в фотоэлементах, фотоумножителях, сцинтилляционных счетчиках и спектрофотометрах. Он также используется в инфракрасных лампах. Поскольку атом цезия может быть ионизирован термически, а положительно заряженные ионы разогнаны до больших скоростей, цезиевые системы могут обеспечить чрезвычайно высокие скорости выхлопа для плазменных двигателей для исследования дальнего космоса.
Очень чистый безгазовый цезий, необходимый в качестве «поглотителя» кислорода в вакуумных трубках, может быть получен при необходимости путем нагревания азида цезия (CsN 3 ) в вакууме. Поскольку цезий сильно фотоэлектричен (легко теряет электроны при попадании света), он используется в фотоэлементах, фотоумножителях, сцинтилляционных счетчиках и спектрофотометрах. Он также используется в инфракрасных лампах. Поскольку атом цезия может быть ионизирован термически, а положительно заряженные ионы разогнаны до больших скоростей, цезиевые системы могут обеспечить чрезвычайно высокие скорости выхлопа для плазменных двигателей для исследования дальнего космоса.
Металлический цезий производится в довольно ограниченных количествах из-за его относительно высокой стоимости. Цезий применяется в термоэмиссионных преобразователях энергии, которые вырабатывают электричество непосредственно в ядерных реакторах или из тепла, выделяемого при радиоактивном распаде. Еще одним потенциальным применением металлического цезия является производство легкоплавкого эвтектического сплава NaKCs.
Атомарный цезий используется в мировом эталоне времени, цезиевых часах. Микроволновая спектральная линия, излучаемая изотопом цезия-133, имеет частоту 9,192 631 770 герц (циклов в секунду). Это обеспечивает фундаментальную единицу времени. Цезиевые часы настолько стабильны и точны, что их точность составляет 1 секунду за 1,4 миллиона лет. Первичные стандартные цезиевые часы, такие как NIST-F1 в Боулдере, штат Колорадо, размером примерно с железнодорожную платформу. Коммерческие вторичные стандарты размером с чемодан.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Встречающийся в природе цезий полностью состоит из нерадиоактивного изотопа цезия-133; получено большое количество радиоактивных изотопов от цезия-123 до цезия-144. Цезий-137 полезен в медицинской и промышленной радиологии из-за его длительного периода полураспада, составляющего 30,17 лет. Однако, будучи основным компонентом ядерных осадков и отходами производства плутония и другого обогащенного ядерного топлива, он представляет опасность для окружающей среды. Удаление радиоактивного цезия из загрязненной почвы на объектах по производству ядерного оружия, таких как Национальная лаборатория Ок-Ридж в Ок-Ридже, штат Теннесси, и объект Министерства энергетики США в Хэнфорде недалеко от Ричленда, штат Вашингтон, является серьезной задачей по очистке.
Удаление радиоактивного цезия из загрязненной почвы на объектах по производству ядерного оружия, таких как Национальная лаборатория Ок-Ридж в Ок-Ридже, штат Теннесси, и объект Министерства энергетики США в Хэнфорде недалеко от Ричленда, штат Вашингтон, является серьезной задачей по очистке.
С цезием трудно обращаться, поскольку он самопроизвольно реагирует на воздухе. Если образец металла имеет достаточно большую площадь поверхности, он может гореть с образованием супероксидов. Супероксид цезия имеет более красноватый оттенок. Cs 2 O 2 может образовываться при окислении металла необходимым количеством кислорода, но другие реакции цезия с кислородом гораздо сложнее.
Цезий является наиболее электроположительным и наиболее щелочным элементом, поэтому он легче, чем все другие элементы, теряет свой единственный валентный электрон и образует ионные связи почти со всеми неорганическими и органическими анионами. Анион Cs – также подготовлен. Гидроксид цезия (CsOH), содержащий анион гидроксида (OH –), является самым сильным известным основанием, атакующим даже стекло. Некоторые соли цезия используются в производстве минеральных вод. Цезий образует ряд амальгам ртути. Из-за повышенного удельного объема цезия по сравнению с более легкими щелочными металлами он менее склонен к образованию систем сплавов с другими металлами.
Гидроксид цезия (CsOH), содержащий анион гидроксида (OH –), является самым сильным известным основанием, атакующим даже стекло. Некоторые соли цезия используются в производстве минеральных вод. Цезий образует ряд амальгам ртути. Из-за повышенного удельного объема цезия по сравнению с более легкими щелочными металлами он менее склонен к образованию систем сплавов с другими металлами.
Рубидий и цезий смешиваются во всех соотношениях и обладают полной растворимостью в твердом состоянии; температура плавления минимум 9°C (48 °F).
| atomic number | 55 |
|---|---|
| atomic weight | 132. 196 |
| melting point | 28.44 °C (83.19 °F) |
| boiling point | 671 ° C (1240 °F) |
| удельный вес | 1,873 (при 20 °C или 68 °F) |
| степени окисления | +1, -1 (редко) |
| Электронная конфигурация | 2-8-18-18-8-1 или [xe] 6 S 1 |
James L. Dye
Dye
Cesium
1913 DATA LASE | ЗАМЕТА | Открытие | Факты | Внешний вид и характеристики | Использование | Изобилие и изотопы | Ссылки55
Cs
132,9
Химический элемент цезий относится к щелочным металлам. Он был открыт в 1860 году Робертом Бунзеном и Густавом Кирхгофом.
Зона данных
| Классификация: | Цезий — щелочной металл |
| Цвет: | желтый/серебристый |
| Атомный вес: | 132,9055 |
| Состояние: | твердый |
| Температура плавления: | 28,4 o С, 301,6 К |
| Точка кипения: | 670 или С, 943,2 К |
| Электронов: | 55 |
| Протоны: | 55 |
| Нейтроны в наиболее распространенном изотопе: | 78 |
| Электронные оболочки: | 2,8,18,18,8,1 |
| Электронная конфигурация: | [Хе] 6s 1 |
| Плотность @ 20 o C: | 1,873 г/см 3 |
Соединения, радиусы, проводимости”>Показать больше, в том числе: Теплота, Энергия, Окисление, Реакции,
Соединения, радиусы, проводимости
| Атомный объем: | 71,07 см 3 /моль |
| Структура: | bcc: объемно-центрированная кубическая |
| Твердость: | 0,2 месяца |
| Удельная теплоемкость | 0,24 Дж г -1 К -1 |
| Теплота плавления | 2,092 кДж моль -1 |
| Теплота распыления | 76 кДж моль -1 |
| Теплота парообразования | 67,740 кДж моль -1 |
| 1 ст энергия ионизации | 375,7 кДж моль -1 |
| 2 nd энергия ионизации | 2234,3 кДж моль -1 |
| 3 rd энергия ионизации | 3400 кДж моль -1 |
| Сродство к электрону | 45,506 кДж моль -1 |
| Минимальная степень окисления | 0 |
Мин. общее окисление нет. общее окисление нет. | 0 |
| Максимальная степень окисления | 3 |
| Макс. общее окисление нет. | 3 |
| Электроотрицательность (шкала Полинга) | 0,79 |
| Объем поляризуемости | 59,6 Å 3 |
| Реакция с воздухом | энергичный, ⇒ Cs 2 O |
| Реакция с 15 M HNO 3 | ядреный, ⇒ CsNO 3 |
| Реакция с 6 М HCl | энергичный, ⇒ H 2 , CsCl |
| Реакция с 6 М NaOH | энергичный, ⇒ H 2 , CsOH |
| Оксид(ы) | Cs 2 O, CsO 2 , Кс 2 О 2 |
| Гидрид(ы) | ЧШ |
| Хлорид(ы) | CsCl |
| Атомный радиус | 260 часов |
| Ионный радиус (1+ ион) | 181 вечера |
| Ионный радиус (2+ ион) | – |
| Ионный радиус (3+ ион) | – |
| Ионный радиус (1-ион) | – |
| Ионный радиус (2-ионный) | – |
| Ионный радиус (3-ионный) | – |
| Теплопроводность | 35,9 Вт·м -1 К -1 |
| Электропроводность | 5,3 x 10 6 S m -1 |
| Температура замерзания/плавления: | 28,4 o С, 301,6 К |
Кристаллы цезия высокой чистоты в атмосфере аргона. Фото Денниса С.К.
Фото Денниса С.К.
Основные спектры излучения пламени, подобные тем, которые наблюдали Бунзен и Кирхгоф. Верхний спектр — это калий с характерной фиолетовой линией. Для цезия двойные небесно-голубые линии показали присутствие нового элемента.
Открытие цезия
Доктор Дуг Стюарт
Цезий был первым элементом, открытым с помощью спектроскопа.
Он был открыт Робертом Бунзеном и Густавом Кирхгофом в 1860 году в Гейдельберге, Германия, когда они анализировали спектр минеральной воды.
Годом ранее Бунзен и Кирхгоф разработали спектроскоп. Устройство было основано на призме, которая разделяла свет пламени на радугу цветов.
В каждом спектре, на который они смотрели, Бунзен и Кирхгоф находили цветные линии. Они поняли, что эти линии были уникальными для сжигаемого вещества.
При изучении спектра остатков курортной минеральной воды они обнаружили серию окрашенных линий эмиссионного спектра, не соответствующих ни одному известному элементу.
Бунзен и Кирхгоф назвали элемент цезием, от латинского слова «caesius», означающего небесно-голубой, в честь синих линий, которые они видели в спектре.
Латинское написание до сих пор отражается в британском английском, где цезий пишется как «цезий».
В 1861 году Бунзен и Кирхгоф также открыли рубидий тем же методом.
Цезий (предшествующий рубидию), реагирующий с водой.
Цезиевые атомные часы. Точность до 1 секунды за 300 миллионов лет.
Внешний вид и характеристики
Вредное воздействие:
Цезий необходимо хранить в инертной жидкости/газе или в вакууме для защиты от воздуха и воды. Соединения цезия считаются слаботоксичными.
Характеристики:
Цезий – серебристо-золотистый, мягкий, пластичный щелочной металл. Он жидкий в теплом помещении, плавится при 28,4 o C (83,1 o F).
Цезий — один из немногих металлов, находящихся в жидком состоянии при температуре около комнатной. Остальные – галлий, франций и ртуть.
Цезий — чрезвычайно активный металл и самый щелочной из элементов. Он вступает в реакцию со взрывом при контакте с водой с образованием гидроксида цезия (CsOH), чрезвычайно сильного основания, которое может быстро разъедать стекло.
Использование цезия
Цезий используется в атомных часах, которые невероятно точны. NIST-F2, основной американский стандарт времени и частоты, представляет собой атомные часы с цезиевым фонтаном, разработанные в лабораториях NIST в Боулдере, штат Колорадо. NIST-F2 вносит свой вклад в международную группу атомных часов, которые определяют Всемирное координированное время (UTC), официальное мировое время. По мере того как ученые продолжают совершенствовать свою технологию, неопределенность в измерении времени NIST-F1 постоянно улучшается. В настоящее время она не выигрывает и не теряет ни секунды за более чем 300 миллионов лет. См. также стронций.
См. также стронций.
Цезий также используется в фотоэлектрических элементах и в качестве катализатора при гидрировании органических соединений. Металл используется в качестве «геттера» в электронных лампах.
Гидроксид цезия используется для травления кремния.
Изобилие и изотопы
Изобилие в земной коре: 3 части на миллион по массе, 0,5 части на миллион по молям
Изобилие в Солнечной системе: 8 частей на миллиард по массе, 70 частей на триллион по молям за 100 г
Стоимость, навалом: $ за 100 г
Источник: Цезий содержится в минералах поллуците и лепидолите. В коммерческих целях большая часть цезия производится как побочный продукт производства металлического лития. Более двух третей мировых запасов цезия — 110 000 тонн — находятся в озере Берник, Манитоба, Канада.
Изотопы: Цезий имеет 36 изотопов с известными периодами полураспада с массовыми числами от 112 до 148. Встречающийся в природе цезий состоит из одного стабильного изотопа, 133 Cs.
