Таблица Менделеева online – Fe
Fe
26
2
14
8
2
55.847±3
3d64s2
Железо
| Относительная электроотрицательность (по Полингу): | 1,64 |
| Температура плавления: | 1812 K (1538,85 °C) |
| Температура кипения: | 3134 K |
| Теплопроводность: | 0 |
| Плотность: | 7,874 г/см3 |
| Открыт: | А. Гиосо и др. |
| Цвет в твёрдом состоянии: | |
| Тип: | Переходный металл |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f145s25p65d105f146s26p66d27s2 |
| Электронная формула: |
Fe – 1s2 2s2 2p6 Fe – [Ar] 4s2 3d6 |
| Валентность: | +2, +3, (+4), (+6) |
| Степени окисления: | 0, +II, III, VI |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | |
Электропроводность в тв. фазе: фазе: |
|
| Ковалентный радиус: | |
| Атомный объем: | |
| Атомный радиус: | |
| Теплота распада: | |
| Теплота парообразования: | |
| Кристаллическая структура: |
Реклама
Изотопы
| Символ нуклида |
Z(p) | N(n) | Масса изотопа (а. е. м.) |
Период полураспада (T1/2) |
Спин и чётность ядра |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 45Fe | 26 | 19 | 45,01458 | 4,9 мс | 3/2+ |
| 46Fe | 26 | 20 | 46,00081 | 9 мс | 0+ |
| 47Fe | 26 | 21 | 46,99289 | 21,8 мс | 7/2- |
| 48Fe | 26 | 22 | 47,98050 | 44 мс | 0+ |
| 49Fe | 26 | 23 | 48,97361 | 70 мс | 7/2- |
| 50Fe | 26 | 49,96299 | 155 мс | 0+ | |
| 51Fe | 26 | 25 | 50,956820 | 305 мс | 5/2- |
| 52Fe | 26 | 26 | 51,948114 | 8,275 ч | 0+ |
| 52mFe | 6,81 МэВ | 45,9 с | 12+ | ||
| 53Fe | 26 | 27 | 52,9453079 | 8,51 мин | 7/2- |
| 53mFe | 3,040 МэВ | 2,526 мин | |||
| 54Fe | 26 | 28 | 53,9396105 | стабилен | 0+ |
| 54mFe | 6,5269 МэВ | 364 нс | 10+ | ||
| 55Fe | 26 | 29 | 54,9382934 | 2,737 лет | 3/2- |
| 56Fe | 26 | 30 | 55,9349375 | стабилен | 0+ |
| 57Fe | 26 | 31 | 56,9353940 | стабилен | 1/2- |
| 58Fe | 26 | 32 | 57,9332756 | стабилен | 0+ |
| 59Fe | 26 | 33 | 58,9348755 | 44,495 сут | 3/2- |
| 60Fe | 26 | 34 | 59,934072 | 2,6 млн лет | 0+ |
| 61Fe | 26 | 35 | 60,936745 | 5,98 мин | 3/2- |
| 61mFe | 861 кэВ | 250 нс | 9/2+ | ||
| 62Fe | 26 | 36 | 61,936767 | 68 с | |
| 63Fe | 26 | 37 | 62,94037 | 6,1 с | 5/2- |
| 64Fe | 26 | 38 | 63,9412 | 2,0 с | 0+ |
| 65Fe | 26 | 39 | 64,94538 | 1,3 с | 1/2- |
| 65mFe | 364 кэВ | 430 нс | 5/2- | ||
| 66Fe | 26 | 40 | 65,94678 | 440 мс | 0+ |
| 67Fe | 26 | 41 | 66,95095 | 394 мс | 1/2- |
| 67mFe | 367 кэВ | 64 мкс | 5/2- | ||
| 68Fe | 26 | 42 | 67,95370 | 187 мс | 0+ |
| 69Fe | 26 | 43 | 68,95878 | 109 мс | 1/2- |
| 70Fe | 26 | 44 | 69,96146 | 94 мс | 0+ |
| 71Fe | 26 | 45 | 70,96672 | 30 мс | 7/2+ |
| 72Fe | 26 | 46 | 71,96962 | 10 мс | 0+ |
Железо — общая характеристика элемента, химические свойства железа и его соединений » HimEge.
 ru
ruЖеле́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия). Металл средней активности, восстановитель.
Основные степени окисления — +2, +3
Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Химические свойства простого вещества — железа:
Ржавление и горение в кислороде
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O 2 + 6H 2 O → 4Fe(OH) 3
Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II, III):
3Fe + 2O 2 → Fe 3 O 4
3Fe+2O 2 →(Fe II Fe 2 III )O 4 (160 °С)
2) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H
3) Железо реагирует с неметаллами при нагревании:
2Fe+3Cl 2 →2FeCl 3 (200 °С)
2Fe + 3Br 2 – t° → 2FeBr 3
Fe + S – t° → FeS (600 °С)
Fe+2S → Fe +2 (S 2 -1 ) (700°С)
4) В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НСl и Н 2 SO 4 , при этом образуются соли железа(II) и выделяется водород:
Fe + 2HCl → FeCl 2 + H 2 (реакции проводятся без доступа воздуха, иначе Fe +2 постепенно переводится кислородом в Fe +3 )
Fe + H 2 SO 4 (разб.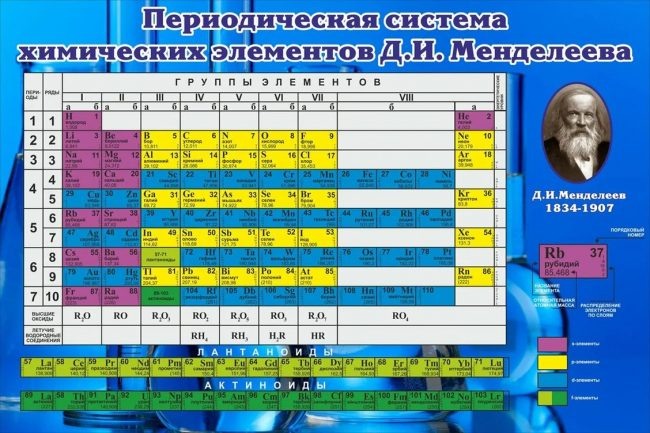 ) → FeSO 4 + H 2
) → FeSO 4 + H 2
В концентрированных кислотах–окислителях железо растворяется только при нагревании, оно сразу переходит в катион Фе 3+ :
2Fe + 6H 2 SO 4 (конц.) – t° → Fe 2 (SO 4 ) 3 + 3SO 2 + 6H 2 O
Fe + 6HNO 3 (конц.) – t° → Fe(NO 3 ) 3 + 3NO 2 + 3H 2 O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
Железный гвоздь, погруженный в голубоватый раствор медного купороса, постепенно покрывается налетом красной металлической меди
5) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO 4 → FeSO 4 + Cu
6)
Амфотерность железа проявляется только в концентрированных щелочах при кипячении:
Fе + 2NaОН (50 %) + 2Н 2 O= Nа 2 [Fе(ОН) 4 ]↓+ Н 2 ↑
и образуется осадок тетрагидроксоферрата(II) натрия.
Техническое железо — сплавы железа с углеродом: чугун содержит 2,06-6,67 % С, сталь 0,02-2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Мn, Ni, Сr), что придает сплавам железа технически полезные свойства — твердость, термическую и коррозионную стойкость, ковкость и др .
Доменный процесс производства чугунаДоменный процесс производства чугуна составляют следующие стадии:
а) подготовка (обжиг) сульфидных и карбонатных руд — перевод в оксидную руду:
FeS 2 →Fe 2 O 3 (O 2 ,800°С, -SO 2 ) FeCO 3 →Fe 2 O 3 (O 2 ,500-600°С, -CO 2 )
б) сжигание кокса при горячем дутье:
С (кокс) + O 2 (воздух) →СO 2 (600—700°С) СO 2 + С (кокс) ⇌ 2СО (700—1000 °С)
в) восстановление оксидной руды угарным газом СО последовательно:
Fe 2 O 3 →(CO) (Fe II Fe 2 III )O 4 →(CO) FeO →(CO) Fe
г) науглероживание железа (до 6,67 % С) и расплавление чугуна:
Fе (т ) →( C ( кокс) 900—1200°С) Fе (ж) (чугун, t пл 1145°С)
В чугуне всегда в виде зерен присутствуют цементит Fe 2 С и графит.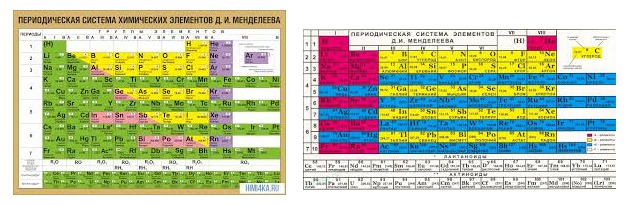
Передел чугуна в сталь проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева; температура процесса 1700-2000 °С. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (СО 2 , SО 2 ), либо связываются в легко отделяемый шлак — смесь Са 3 (РO 4 ) 2 и СаSiO 3 . Для получения специальных сталей в печь вводят легирующие добавки других металлов.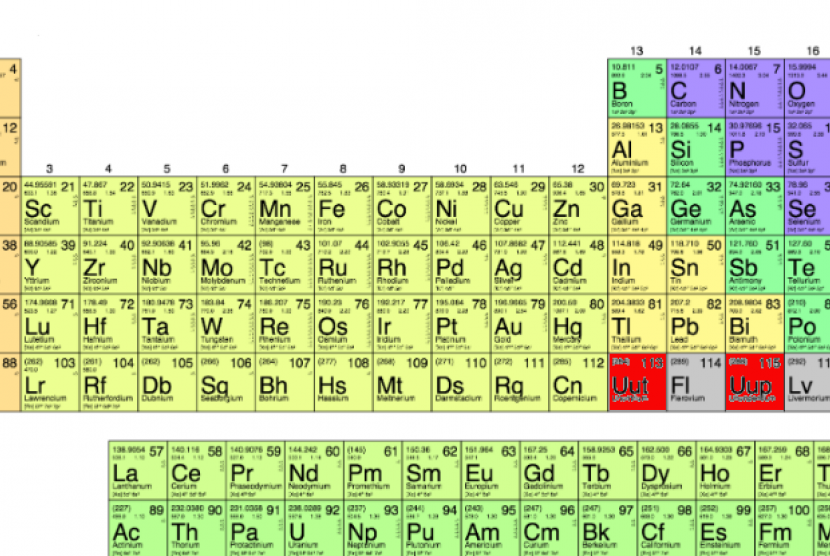
Получение чистого железа в промышленности — электролиз раствора солей железа, например:
FеСl 2 → Fе↓ + Сl 2 ↑ (90°С) (электролиз)
(существуют и другие специальные методы, в том числе восстановление оксидов железа водородом).
Чистое железо применяется в производстве специальных сплавов, при изготовлении сердечников электромагнитов и трансформаторов, чугун — в производстве литья и стали, сталь — как конструкционный и инструментальный материалы, в том числе износо-, жаро- и коррозионно-стойкие.
Оксид железа(II) F еО .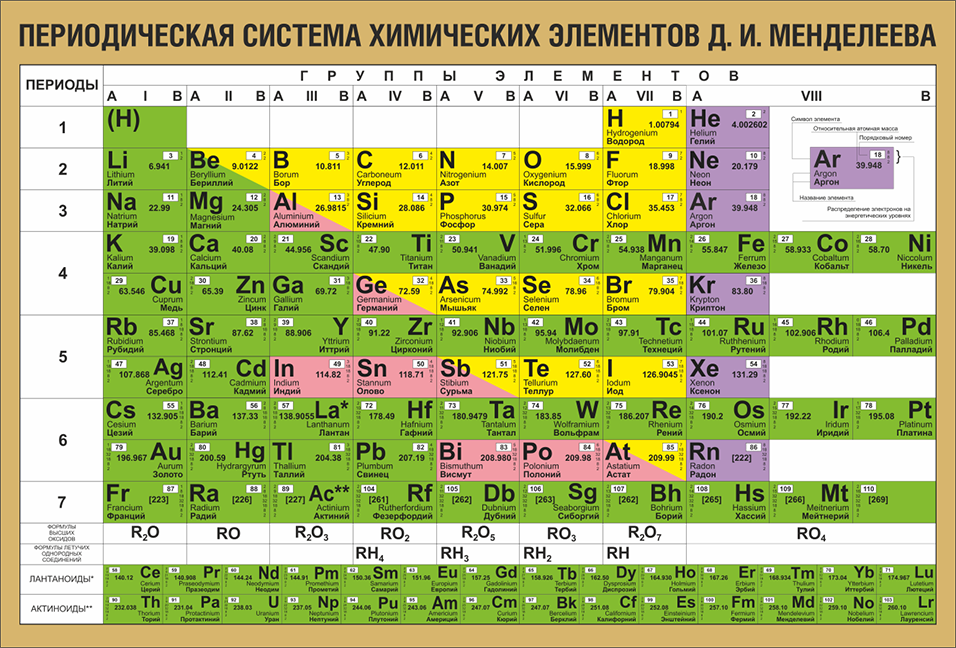 Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Фе 2+ O 2- . При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций:
Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Фе 2+ O 2- . При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций:
4FеО ⇌(Fe II Fe 2 III ) + Fе (560—700 °С , 900—1000°С)
FеО + 2НС1 (разб.) = FеС1 2 + Н 2 O
ФеО + 4ННО 3 ( конц . ) = Fе(NO 3 ) 3 +NO 2 ↑ + 2Н 2 O
) = Fе(NO 3 ) 3 +NO 2 ↑ + 2Н 2 O
FеО + 4NаОН =2Н 2 O + N а 4 F е O 3(красн .) триоксоферрат(II) (400—500 °С)
FеО + Н 2 =Н 2 O + Фе (особо чистое) (350°С)
FеО + С (кокс) = Фе + СО (выше 1000 °С)
ФеО + СО = Фе + СО 2 (900°С)
4FеО + 2Н 2 O (влага) + O 2 (воздух) →4FеО(ОН) (t)
6ФеО + O 2 = 2(Fe II Fe 2 III )O 4 (300—500°С)
Получение в лаборатории : термическое разложение соединений железа (II) без доступа воздуха:
Fе(ОН) 2 = FеО + Н 2 O (150-200 °С)
FеСОз = FеО + СO 2 (490-550 °С)
Оксид дижелеза (III) – железа( II ) ( Fe II Fe 2 III )O 4 . Двойной оксид. Черный, имеет ионное строение Fe 2+ (Fе 3+ ) 2 ( O 2- ) 4 . Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок ( железный сурик ), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий ( чернение, воронение ). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe 3 O 4 не рекомендуется.
Двойной оксид. Черный, имеет ионное строение Fe 2+ (Fе 3+ ) 2 ( O 2- ) 4 . Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок ( железный сурик ), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий ( чернение, воронение ). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe 3 O 4 не рекомендуется. Уравнения важнейших реакций:
Уравнения важнейших реакций:
2(Fe II Fe 2 III )O 4 = 6ФеО + O 2 (выше 1538 °С)
(Fe II Fe 2 III )O 4 + 8НС1 (разб.) = FеС1 2 + 2FеС1 3 + 4Н 2 O
(Fe II Fe 2 III )O 4 +10НNO 3 (конц.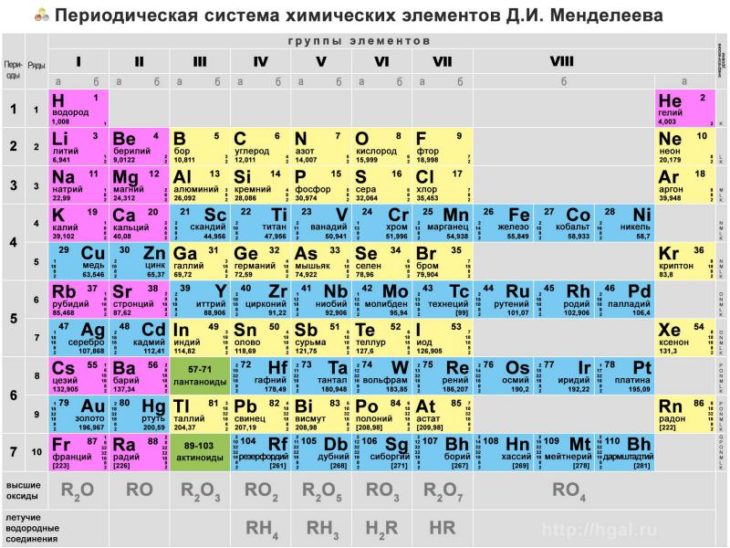 ) =3Fе(NO 3 ) 3 + NO 2 ↑+ 5Н 2 O
) =3Fе(NO 3 ) 3 + NO 2 ↑+ 5Н 2 O
(Fe II Fe 2 III )O 4 + O 2 (воздух) = 6Fе 2 O 3 (450-600°С)
(Fe II Fe 2 III )O 4 + 4Н 2 = 4Н 2 O + 3Фе (особо чистое, 1000 °С)
(Fe II Fe 2 III )O 4 + СО =ЗФеО + СО 2 (500—800°C)
(Fe II Fe 2 III )O4 + Fе ⇌4FеО (900—1000 °С , 560—700 °С)
Получение: сгорание железа (см. ) на воздухе.
) на воздухе.
В природе — оксидная руда железа магнетит.
Оксид железа(III) F е 2 О 3 . Амфотерный оксид с преобладанием основных свойств. Красно-коричневый, имеет ионное строение (Фе 3+ ) 2 (O 2- ) 3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Фе 2 O 3 nН 2 О. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
Уравнения важнейших реакций:
6Fе 2 O 3 = 4(Fe II Fe 2 III )O 4 +O 2 (1200—1300 °С)
Fе 2 O 3 + 6НС1 (разб. ) →2FеС1 3 + ЗН 2 O (t) (600°С,р)
) →2FеС1 3 + ЗН 2 O (t) (600°С,р)
Fе 2 O 3 + 2NaОН (конц.) →Н 2 O+ 2 N а F е O 2 (красн.) диоксоферрат(III)
Fе 2 О 3 + МО=(М II Fе 2 II I )O 4 (М=Сu, Мn, Fе, Ni, Zn)
Fе 2 O 3 + ЗН 2 =ЗН 2 O+ 2Фе (особо чистое, 1050—1100 °С)
Fе 2 O 3 + Fе = ЗFеО (900 °С)
3Fе 2 O 3 + СО = 2(Fe II Fе 2 III )O 4 + СO 2 (400—600 °С)
Получение в лаборатории — термическое разложение солей железа (III) на воздухе:
Fе 2 (SO 4 ) 3 = Fе 2 O 3 + 3SO 3 (500-700 °С)
4{Fе(NO 3 ) 3 9 Н 2 O} = 2Fе a O 3 + 12NO 2 + 3O 2 + 36Н 2 O (600-700 °С)
В природе — оксидные руды железа гематит Fе 2 O 3 и лимонит Fе 2 O 3 nН 2 O
Гидроксид железа (II) F е(ОН) 2 . Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Фе — ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Фе — ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Уравнения важнейших реакций:
Fе(OН) 2 = FеО + Н 2 O (150-200 °С, в атм.N 2 )
Fе(ОН) 2 + 2НС1 (разб.) =FеС1 2 + 2Н 2 O
Fе(ОН) 2 + 2NаОН (> 50%) = Nа 2 [Fе(ОН) 4 ] ↓ (сине-зеленый) (кипячение)
4Fе(ОН) 2 (суспензия) + O 2 (воздух) →4FеО(ОН)↓ + 2Н 2 O (t)
2Fе(ОН) 2 (суспензия) +Н 2 O 2 (разб. ) = 2FеО(ОН)↓ + 2Н 2 O
) = 2FеО(ОН)↓ + 2Н 2 O
Fе(ОН) 2 + КNO 3 (конц.) = FеО(ОН)↓ + NO↑+ КОН (60 °С)
Получение : осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере:
Fе 2+ + 2OH (разб.) = F е(ОН) 2 ↓
Fе 2+ + 2(NH 3 Н 2 O) = F е(ОН) 2 ↓ + 2NH 4
Метагидроксид железа F еО(ОН). Амфотерный гидроксид с преобладанием основных свойств. Светло-коричневый, связи Фе — О и Фе — ОН преимущественно ковалентные. При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Фе 2 O 3 nН 2 O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в ФеО(ОН). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Фе(ОН) 2 . Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Амфотерный гидроксид с преобладанием основных свойств. Светло-коричневый, связи Фе — О и Фе — ОН преимущественно ковалентные. При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Фе 2 O 3 nН 2 O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в ФеО(ОН). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Фе(ОН) 2 . Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Соединение состава Fе(ОН) 3 не известно (не получено).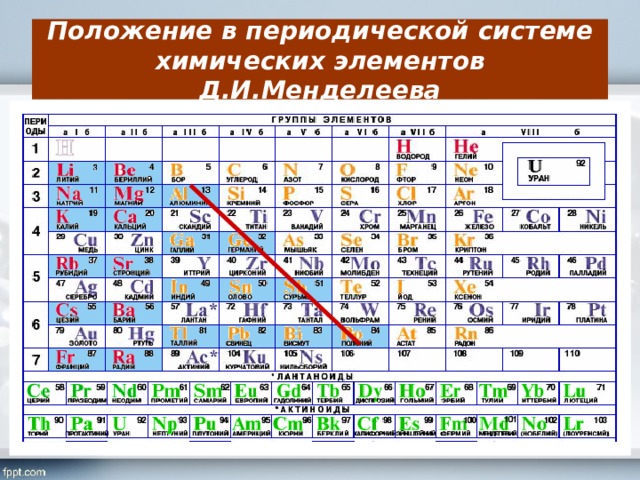
Уравнения важнейших реакций:
Fе 2 O 3 . nН 2 O→( 200-250 °С, — H 2 O ) FеО(ОН)→( 560-700° С на воздухе , -h3O) →Fе 2 О 3
FеО(ОН) + ЗНС1 (разб.) =FеС1 3 + 2Н 2 O
FeO(OH)→ Fe 2 O 3 . nH 2 O -коллоид (NаОН (конц.) )
nH 2 O -коллоид (NаОН (конц.) )
FеО(ОН)→ N а 3 [ F е(ОН) 6 ] белый , Nа 5 [Fе(OН) 8 желтоватый (75 °С, NаОН ( т) )
2FеО(ОН) + Fе(ОН) 2 =( Fe II Fe 2 III )O 4 + 2Н 2 O (600—1000 °С)
2FеО(ОН) + ЗН 2 = 4Н 2 O+ 2Фе (особо чистое, 500—600 °С)
2FеО(ОН) + ЗВr 2 + 10КОН = 2К 2 FеO 4 + 6Н 2 O + 6КВr
Получение: осаждение из раствора солей железа(Ш) гидрата Фе 2 О 3 nН 2 O и его частичное обезвоживание (см. выше).
выше).
В природе — оксидная руда железа лимонит Fе 2 O 3 nН 2 О и минерал гётит FеО(ОН).
Феррат калия К 2 F еО 4 . Оксосоль. Красно-фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель.
Сильный окислитель.
Качественная реакция — образование красного осадка феррата бария. Применяется в синтезе ферритов — промышленно важных двойных оксидов железа (III) и других металлов.
Уравнения важнейших реакций:
4К 2 FеO 4 = 4КФеО 2 + 3O 2 + 2К 2 O (700 °С)
4К 2 FеO 4 + 6Н 2 O (гор.) =4ФеО(ОН)↓ + 8КОН + 3O 2 ↑
FеО 4 2- + 2OН + (разб. ) =4Fе 3+ + 3O 2 ↑+10Н 2 O
) =4Fе 3+ + 3O 2 ↑+10Н 2 O
FеО 4 2- + 2(NH 3 . Н 2 O) →2FеО(ОН)↓ + N 2 ↑+ 2Н 2 O+ 4OН —
FеО 4 2- + Ва 2+ = ВаFеO 4 (красн.)↓ (в конц. КОН)
Получение : образуется при окислении соединений железа, например метагидроксида ФеО(ОН), бромной водой, а также при действии сильных окислителей (при спекании) на железо
Fе + 2КОН + 2КNO 3 = К 2 F е O 4 + 3КNO 2 + H 2 O (420 °С)
и электролизе в растворе:
электролиз
Fе + 2КОН (конц. ) + 2Н 2 O→ЗН 2 ↑ + К 2 F е O 4 ( электролиз)
) + 2Н 2 O→ЗН 2 ↑ + К 2 F е O 4 ( электролиз)
(феррат калия образуется на аноде).
Качественные реакции на ионы F е 2+ и F е 3+
Обнаружение ионов Фе 2+ и Fе 3+ в водном растворе проводят с помощью реактивов К 3 [Fе(СN) 6 ] и К 4 [Fе(СN) 6 ] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, КФе III [Fе II (СN) 6 ].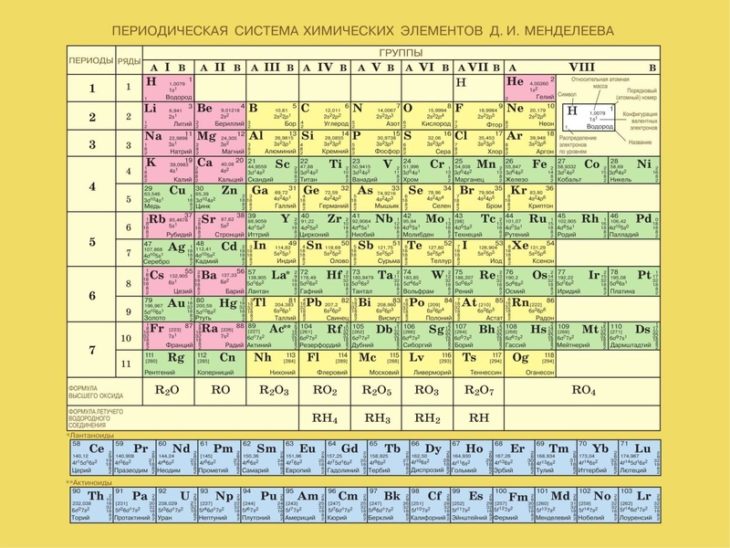 В лаборатории этот осадок называют берлинская лазурь , или турнбуллева синь :
В лаборатории этот осадок называют берлинская лазурь , или турнбуллева синь :
Fе 2+ + К + + [Fе(СN) 6 ] 3- = КFе III [Fе II (СN) 6 ]↓
Fе 3+ + К + + [Fе(СN) 6 ] 4- = КFе III [Fе II (СN) 6 ]↓
Химические названия исходных реактивов и продукта реакций:
К 3 Fе III [Fе(СN) 6 ]- гексацианоферрат (III) калия
К 4 Fе III [Fе (СN) 6 ]- гексацианоферрат (II) калия
КFе III [Fе II (СN) 6 ]- гексацианоферрат (II) железа (Ш) калия
Кроме того, хорошим реактивом на ионы Фе 3+ является тиоцианат-ион НСС — , железо (III) соединяется с ним, и появляется ярко-красная («кровавая») окраска:
Fе 3+ + 6NСS — = [Фе(НСС) 6 ] 3-
Этим реактивом (например, в виде соли КНСС) можно обнаружить даже следы железа (III) в водопроводной воде, если она проходит через железные трубы, покрытые изнутри ржавчиной.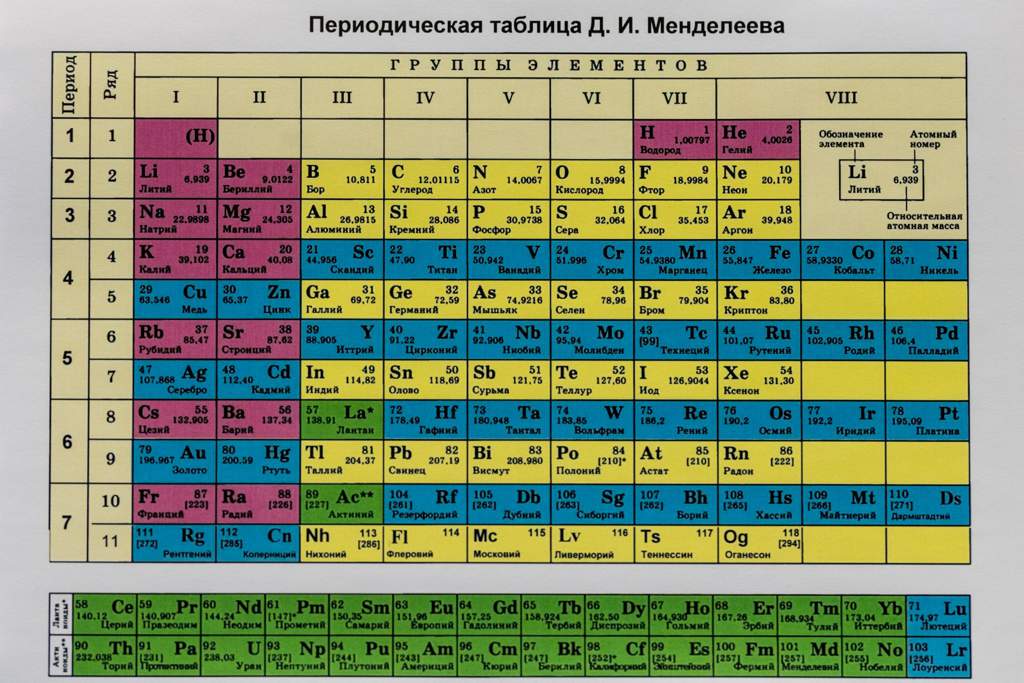
Железо
| Железо | |
|---|---|
| Атомный номер | 26 |
| Внешний вид простого вещества | ковкий, вязкий металл серебристо-белого цвета |
| Свойства атома | |
|
Атомная масса (молярная масса) |
55,847 а. е. м. (г/моль) |
| Радиус атома | 126 пм |
|
Энергия ионизации (первый электрон) |
759,1 (7,87) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d6 4s2 |
| Химические свойства | |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+3e) 64 (+2e) 74 пм |
|
Электроотрицательность (по Полингу) |
1,83 |
| Электродный потенциал |
Fe←Fe3+ −0,04 В Fe←Fe2+ −0,44 В |
| Степени окисления | 6, 3, 2, 0, −2 |
| Термодинамические свойства простого вещества | |
| Плотность | 7,874 г/см³ |
| Молярная теплоёмкость | 25,14[1]Дж/(K·моль) |
| Теплопроводность | 80,4 Вт/(м·K) |
| Температура плавления | 1812 K |
| Теплота плавления | 247,1 кДж/кг 13,8 кДж/моль |
| Температура кипения | 3134 K |
| Теплота испарения | ~6088 кДж/кг ~340 кДж/моль |
| Молярный объём | 7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 2,866 Å |
| Отношение c/a | — |
| Температура Дебая | 460 K |
| Fe | 26 |
| 55,847 | |
| [Ar]3d64s2 | |
| Железо | |
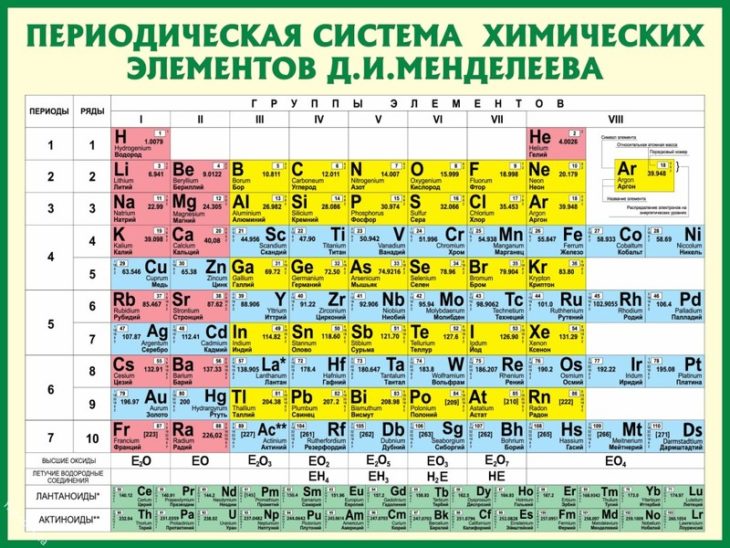
Железо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 26. Обозначается символом Fe (Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
И. Менделеева, атомный номер 26. Обозначается символом Fe (Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Простое вещество железо (CAS-номер: 7439-89-6) — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
На самом деле железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2 % углерода) и чугун (более 2 % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al). Считается также, что железо составляет бо́льшую часть земного ядра.
Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al). Считается также, что железо составляет бо́льшую часть земного ядра.
История
Железо как инструментальный материал известно с древнейших времён, самые древние изделия из железа, найденные при археологических раскопках, датируются 4-м тысячелетием до н. э. и относятся к древнешумерской и древнеегипетской цивилизациям. Это наконечники для стрел и украшения из метеоритного железа, то есть, сплава железа и никеля (содержание последнего колеблется от 5 до 30 %), из которого состоят метеориты. От их небесного происхождения идёт, видимо, одно из наименований железа в греческом языке: «сидер» (а на латыни это слово значит «звёздный»).
Изделия из железа, полученного искусственно, известны со времени расселения арийских племён из Европы в Азию и острова Средиземного моря (4—3-е тысячелетие до н. э.). Самый древний железный инструмент из известных — стальное долото, найденное в каменной кладке пирамиды Хеопса в Египте (построена около 2550 года до н. э.). Железо часто упоминается в древнейших (3-е тысячелетие до н. э.) текстах хеттов, основавших свою империю на территории современной Анатолии в Турции. Например, в тексте хеттского царя Анитты (около 1800 года до н. э.) говорится:
э.). Железо часто упоминается в древнейших (3-е тысячелетие до н. э.) текстах хеттов, основавших свою империю на территории современной Анатолии в Турции. Например, в тексте хеттского царя Анитты (около 1800 года до н. э.) говорится:
Когда на город Пурусханду в поход я пошел, человек из города Пурусханды ко мне поклониться пришел (…?) и он мне 1 железный трон и 1 железный скипетр (?) в знак покорности (?) преподнес.
В этом тексте железо обозначается словом «par-zi-lum» (сравните латинское «ferrum» и русское «железо»), что, скорее всего, значит «олово всадников» — от древнеарийских слов «PARSA» или «FERSY» (всадник — сравните этноним «персы», отсюда же шахматная фигура «ферзь», и латинские слова «persona» и «partia»), и корня «ZIL» (олово, и вообще белый металл).
В древности мастерами железных изделий слыли халибы, которых Геродот перечисляет в числе эллинских племён Малой Азии, подвластных Крезу. Халибы жили на севере державы Хеттов, у побережья Чёрного моря возле устья реки Галис (современный г. Самсун в Турции), и от их имени происходит греч. Χάλυβας — «сталь». Аристотель описал их способ получения стали: халибы несколько раз промывали речной песок их страны — видимо, таким способом (теперь это называют флотацией) выделяли тяжёлую железосодержащую фракцию породы, добавляли какое-то огнеупорное вещество, и плавили в печах особой конструкции; полученный таким образом металл имел серебристый цвет и был нержавеющим. Из этого процесса, видимо, возникло и название «руда», которое на латыни значит «мокрый» — то есть, «вымытый».
Самсун в Турции), и от их имени происходит греч. Χάλυβας — «сталь». Аристотель описал их способ получения стали: халибы несколько раз промывали речной песок их страны — видимо, таким способом (теперь это называют флотацией) выделяли тяжёлую железосодержащую фракцию породы, добавляли какое-то огнеупорное вещество, и плавили в печах особой конструкции; полученный таким образом металл имел серебристый цвет и был нержавеющим. Из этого процесса, видимо, возникло и название «руда», которое на латыни значит «мокрый» — то есть, «вымытый».
В качестве сырья для выплавки стали использовались магнетитовые пески, которые часто встречаются по всему побережью Чёрного моря: эти магнетитовые пески состоят из смеси мелких зёрен магнетита, титано-магнетита или ильменита, и обломков других пород, так что выплавляемая халибами сталь была легированной, и обладала отличными свойствами. Такой своеобразный способ получения железа не из руды говорит о том, что халибы, в основном, распространили железо как технологический материал, но их способ не мог быть методом повсеместного промышленного производства железных изделий. Однако их производство послужило толчком для дальнейшего развития металлургии железа.
Однако их производство послужило толчком для дальнейшего развития металлургии железа.
Судя по греческому названию инструментальных металлов χαλκός (это слово обозначает и бронзу, и железо), можно понять, что арийские племена нашли способ выделки железа во время перехода в Азию через Кавказ, а именно — в Колхиде (др.-греч. Κολχίς), так как другого удобного сухопутного пути из Европы в Азию не было. Пройдя степи Причерноморья, они оставили многочисленные памятники культуры бронзового века (так называемая «пахотно-скотоводческая культура»), и двинулись дальше — на юг. Конечно же, по пути они искали сырьё для изготовления бронзовых орудий, и так обнаружили свойства причерноморских песков, дающих новый твёрдый металл — железо. Видимо, сперва они приняли его за олово (первые металлурги плохо различали металлы), и это подтверждается также тем, что название «сталь» в языках северных арийцев (романских, германских, славянских) явно происходит от слова «STANN» через аберрацию N-L, а у римлян это слово обозначало олово. То есть, пытаясь найти олово для бронзы, они обнаружили металл, который оказался крепким и без сплавления с медью, и стали называть его по аналогии с оловом. Найденный тогда способ выплавки стальных изделий не позволял получать их в больших количествах, однако использовался более тысячи лет, пока не была разработана технология выплавки железа из руды, добываемой в копях.
То есть, пытаясь найти олово для бронзы, они обнаружили металл, который оказался крепким и без сплавления с медью, и стали называть его по аналогии с оловом. Найденный тогда способ выплавки стальных изделий не позволял получать их в больших количествах, однако использовался более тысячи лет, пока не была разработана технология выплавки железа из руды, добываемой в копях.
Климент Александрийский в своём энциклопедическом труде «Строматы» упоминает, что по греческим преданиям железо (видимо, выплавка его из руды) было открыто на горе Иде — так называлась горная цепь возле Трои (в Илиаде она упоминается как гора Ида, с которой Зевс наблюдал за битвой греков с троянцами). Произошло это через 73 года после Девкалионова потопа, а этот потоп, согласно Паросской хронике, был в 1528 году до нашей эры, то есть метод выплавки железа из руды был открыт примерно в 1455 году до н. э. Однако из описания Климента не ясно, говорит ли он именно об этой горе в Передней Азии (Ида Фригийская у Вергилия), или же о горе Ида на острове Крит, о которой римский поэт Вергилий в Энеиде пишет:
Остров Юпитера, Крета, лежит средь широкого моря,
Нашего племени там колыбель, где высится Ида …
А римляне, как известно, были потомками малоазиатских троянцев, переселившихся в Италию после разрушения Трои. Могила их предводителя Энея до сих пор существует в местечке Пратика-ди-Маре возле Рима, и в ней был обнаружен железный жезл — символ власти, и другие предметы из железа и бронзы.
Могила их предводителя Энея до сих пор существует в местечке Пратика-ди-Маре возле Рима, и в ней был обнаружен железный жезл — символ власти, и другие предметы из железа и бронзы.
Более вероятно, что Климент Александрийский говорит именно о фригийской Иде возле Трои, так как там были найдены древние железные копи и очаги железоделательного производства. Видимо, ознакомившись с методом халибов, древние троянцы развили свой способ выплавки стали из руды, оказавшийся более производительным.
В самой глубокой древности железо ценилось дороже золота, и по описанию Страбона, у африканских племён за 1 фунт железа давали 10 фунтов золота, а по исследованиям историка Г. Арешяна стоимости меди, серебра, золота и железа у древних хеттов были в соотношении 1 : 160 : 1280 : 6400. В те времена железо использовалось как ювелирный металл, из него делали троны и другие регалии царской власти: например, в библейской книге Второзаконие 3,11 описан «одр железный» рефаимского царя Ога. В гробнице Тутанхамона (около 1350 года до н. э.) был найден кинжал из железа в золотой оправе — возможно, подаренный хеттами в дипломатических целях. Но хетты не стремились к широкому распространению железа и его технологий, что видно и из дошедшей до нас переписки египетского фараона и его тестя — царя Хеттов. Фараон просит прислать побольше железа, а царь хеттов уклончиво отвечает, что запасы железа иссякли, а кузнецы заняты на сельскохозяйственных работах, поэтому он не может выполнить просьбу царственного зятя. Как видно, хетты старались использовать свои знания для достижения военных преимуществ, и не давали другим возможности сравняться с ними. Видимо, поэтому железные изделия получили широкое распространение только после Троянской войны и падения державы хеттов, когда благодаря торговой активности греков технология железа стала известной многим, и были открыты железные месторождения и рудники. Так на смену «Бронзовому» веку настал век «Железный».
В гробнице Тутанхамона (около 1350 года до н. э.) был найден кинжал из железа в золотой оправе — возможно, подаренный хеттами в дипломатических целях. Но хетты не стремились к широкому распространению железа и его технологий, что видно и из дошедшей до нас переписки египетского фараона и его тестя — царя Хеттов. Фараон просит прислать побольше железа, а царь хеттов уклончиво отвечает, что запасы железа иссякли, а кузнецы заняты на сельскохозяйственных работах, поэтому он не может выполнить просьбу царственного зятя. Как видно, хетты старались использовать свои знания для достижения военных преимуществ, и не давали другим возможности сравняться с ними. Видимо, поэтому железные изделия получили широкое распространение только после Троянской войны и падения державы хеттов, когда благодаря торговой активности греков технология железа стала известной многим, и были открыты железные месторождения и рудники. Так на смену «Бронзовому» веку настал век «Железный».
По описаниям Гомера, хотя во время Троянской войны (примерно 1250 год до н. э.) оружие было в основном из меди и бронзы, но железо уже было хорошо известно и пользовалось большим спросом, хотя больше как драгоценный металл. Например, в 23-й песне «Илиады» Гомер рассказывает, что Ахилл наградил диском из железной крицы победителя в соревновании по метанию диска. Это железо ахейцы добывали у троянцев и сопредельных народов (Илиада 7,473), в том числе у халибов, которые воевали на стороне троянцев:
э.) оружие было в основном из меди и бронзы, но железо уже было хорошо известно и пользовалось большим спросом, хотя больше как драгоценный металл. Например, в 23-й песне «Илиады» Гомер рассказывает, что Ахилл наградил диском из железной крицы победителя в соревновании по метанию диска. Это железо ахейцы добывали у троянцев и сопредельных народов (Илиада 7,473), в том числе у халибов, которые воевали на стороне троянцев:
Прочие мужи ахейские меной вино покупали,
Те за звенящую медь, за седое железо меняли,
Те за воловые кожи или волов круторогих,
Те за своих полоненых. И пир уготовлен веселый…
Возможно, железо было одной из причин, побудивших греков-ахейцев двинуться в Малую Азию, где они узнали секреты его производства. А раскопки в Афинах показали, что уже около 1100 года до н. э. и позднее уже широко были распространены железные мечи, копья, топоры, и даже железные гвозди. В библейской книге Иисуса Навина 17,16 (ср. Судей 14,4) описывается, что филистимляне (библейские «PILISTIM», а это были протогреческие племена, родственные позднейшим эллинам, в основном пеласги) имели множество железных колесниц, то есть, в это время железо уже стало широко применяться в больших количествах.
Судей 14,4) описывается, что филистимляне (библейские «PILISTIM», а это были протогреческие племена, родственные позднейшим эллинам, в основном пеласги) имели множество железных колесниц, то есть, в это время железо уже стало широко применяться в больших количествах.
Гомер в «Илиаде» и «Одиссее» называет железо «многотрудный металл», и описывает закалку орудий:
Расторопный ковач, изготовив топор иль секиру,
В воду металл, раскаливши его, чтоб двойную
Он крепость имел, погружает…
Гомер называет железо многотрудным, потому что в древности основным методом его получения был сыродутный процесс: перемежающиеся слои железной руды и древесного угля прокаливались в специальных печах (горнах — от древнего «Horn» — рог, труба, первоначально это была просто труба, вырытая в земле, обычно горизонтально в склоне оврага). В горне окислы железа восстанавливаются до металла раскалённым углём, который отбирает кислород, окисляясь до окиси углерода, и в результате такого прокаливания руды с углём получалось тестообразное кричное (губчатое) железо. Крицу очищали от шлаков ковкой, выдавливая примеси сильными ударами молота. Первые горны имели сравнительно низкую температуру — заметно меньше температуры плавления чугуна, поэтому железо получалось сравнительно малоуглеродистым. Чтобы получить крепкую сталь приходилось много раз прокаливать и проковывать железную крицу с углём, при этом поверхностный слой металла дополнительно насыщался углеродом и упрочнялся. И хотя это требовало больших трудов, изделия, полученные таким способом, были существенно более крепкими, чем бронзовые.
Крицу очищали от шлаков ковкой, выдавливая примеси сильными ударами молота. Первые горны имели сравнительно низкую температуру — заметно меньше температуры плавления чугуна, поэтому железо получалось сравнительно малоуглеродистым. Чтобы получить крепкую сталь приходилось много раз прокаливать и проковывать железную крицу с углём, при этом поверхностный слой металла дополнительно насыщался углеродом и упрочнялся. И хотя это требовало больших трудов, изделия, полученные таким способом, были существенно более крепкими, чем бронзовые.
В дальнейшем научились делать более эффективные печи (в русском языке — домна, домница) для производства стали, и применили меха для подачи воздуха в горн. Уже римляне умели доводить температуру в печи до плавления стали (около 1400 градусов, а чистое железо плавится при 1535 градусах). При этом образуется чугун с температурой плавления 1100—1200 градусов, очень хрупкий в твёрдом состоянии (даже не поддающийся ковке), и не обладающий упругостью стали. Первоначально его считали вредным побочным продуктом (англ. pig iron, по-русски, свинское железо, чушки, откуда, собственно, и происходит слово чугун), но потом обнаружилось, что при повторном прожигании в печи с усиленным продуванием воздуха чугун превращается в сталь хорошего качества, так как лишний углерод выгорает. Такой двухстадийный процесс производства стали из чугуна оказался более простым и выгодным, чем кричный, и этот принцип используется без особых изменений многие века, оставаясь и до наших дней основным способом производства железных материалов.
Первоначально его считали вредным побочным продуктом (англ. pig iron, по-русски, свинское железо, чушки, откуда, собственно, и происходит слово чугун), но потом обнаружилось, что при повторном прожигании в печи с усиленным продуванием воздуха чугун превращается в сталь хорошего качества, так как лишний углерод выгорает. Такой двухстадийный процесс производства стали из чугуна оказался более простым и выгодным, чем кричный, и этот принцип используется без особых изменений многие века, оставаясь и до наших дней основным способом производства железных материалов.
Происхождение названия
Схема атома железа (условно)
Версии происхождения славянского слова «железо» (белор. жалеза, болг. желязо, укр. залізо, польск. Żelazo, словен. Železo).
Наиболее вероятно, что это название происходит от древнеарийского корня «ZIL», которым обозначали олово и вообще белые металлы (в том числе серебро — «zilber», и название «цинк» получилось из этого же слова аберрацией L-N). От него же, видимо, происходит и санскритское «жальжа», что означает «металл, руда». Другая версия усматривает в слове славянский корень «лез», тот же, что и в слове «лезвие» (так как железо в основном употреблялось на изготовление оружия), третье связывает с греческим словом χαλκός, что означало железо и медь. Есть также связь между словом «желе» и студнеобразной консистенцией «болотной руды», из которой некоторое время добывался металл.
От него же, видимо, происходит и санскритское «жальжа», что означает «металл, руда». Другая версия усматривает в слове славянский корень «лез», тот же, что и в слове «лезвие» (так как железо в основном употреблялось на изготовление оружия), третье связывает с греческим словом χαλκός, что означало железо и медь. Есть также связь между словом «желе» и студнеобразной консистенцией «болотной руды», из которой некоторое время добывался металл.
Название природного карбоната железа (сидерита) происходит от sidereus — звёздный; действительно, первое железо, попавшее в руки людям, было метеоритного происхождения. Возможно, это совпадение не случайно. В частности древнегреческое слово сидерос (σίδηρος) для железа и латинское sidus, означающее «звезда», вероятно, имеют общее происхождение.
Изотопы железа
Изотоп железа 56Fe относится к наиболее стабильным ядрам: все следующие элементы могут уменьшить энергию связи на нуклон путём распада, а все предыдущие элементы, в принципе, могли бы уменьшить энергию связи на нуклон за счёт синтеза. Полагают, что железом оканчивается ряд синтеза элементов в ядрах нормальных звёзд, а все последующие элементы могут образоваться только в результате взрывов сверхновых.
Полагают, что железом оканчивается ряд синтеза элементов в ядрах нормальных звёзд, а все последующие элементы могут образоваться только в результате взрывов сверхновых.
Геохимия железа
Гидротермальный источник с железистой водой. Окислы железа окрашивают воду в бурый цвет
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %. Из металлов железо уступает по распространённости в коре только алюминию. При этом в ядре находится около 86 % всего железа, а в мантии 14 %.
Геохимические свойства железа
Важнейшая геохимическая особенность железа — наличие у него нескольких степеней окисления. Железо в нейтральной форме — металлическое — слагает ядро земли, возможно, присутствует в мантии и очень редко встречается в земной коре. Закисное железо FeO — основная форма нахождения железа в мантии и земной коре. Окисное железо Fe2O3 характерно для самых верхних, наиболее окисленных, частей земной коры, в частности, осадочных пород.
Закисное железо FeO — основная форма нахождения железа в мантии и земной коре. Окисное железо Fe2O3 характерно для самых верхних, наиболее окисленных, частей земной коры, в частности, осадочных пород.
По кристаллохимическим свойствам ион Fe2+ близок к ионам Mg2+ и Ca2+ — другим главным элементам, составляющим значительную часть всех земных пород. В силу кристаллохимического сходства железо замещает магний и, частично, кальций во многих силикатах. При этом содержание железа в минералах переменного состава обычно увеличивается с уменьшением температуры.
Минералы железа
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O), а также шпатовый железняк (сидерит, карбонат железа(II), FeCO3; содержит около 48 % Fe). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe(3PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
В природе также широко распространены сульфиды железа — пирит FeS2 (серный или железный колчедан) и пирротин. Они не являются железной рудой — пирит используют для получения серной кислоты, а пирротин часто содержит никель и кобальт.
Они не являются железной рудой — пирит используют для получения серной кислоты, а пирротин часто содержит никель и кобальт.
По запасам железных руд Россия занимает первое место в мире. Содержание железа в морской воде — 1×10−5—1×10−8 %.
Получение
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (Fe3O4).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
В печи углерод кокса окисляется до монооксида углерода (угарного газа) кислородом воздуха:

В свою очередь, угарный газ восстанавливает железо из руды:
Флюс добавляется для извлечения нежелательных примесей из руды, в первую очередь силикатов, таких как кварц (диоксид кремния). Типичный флюс содержит известняк (карбонат кальция) и доломит (карбонат магния). Против других примесей используют другие флюсы.
Действие флюса: карбонат кальция под действием тепла разлагается до оксида кальция (негашёная известь):
Оксид кальция соединяется с диоксидом кремния, образуя шлак:
Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности, и его можно сливать отдельно от металла. Шлак затем употребляется в строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит довольно много углерода (чугун). Кроме случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Кроме случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишний углерод и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используют и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, содержащими водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями как сера и фосфор — обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах.
Химически чистое железо получается электролизом растворов его солей.
Физические свойства
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Для железа характерен полиморфизм, он имеет четыре кристаллические модификации:
- до 769 °C существует α-Fe (феррит) с объёмноцентрированной кубической решёткой и свойствами ферромагнетика (769 °C ≈ 1043 K — точка Кюри для железа)
- в температурном интервале 769—917 °C существует β-Fe, который отличается от α-Fe только параметрами объёмноцентрированной кубической решётки и магнитными свойствами парамагнетика
- в температурном интервале 917—1394 °C существует γ-Fe (аустенит) с гранецентрированной кубической решёткой
- выше 1394 °C устойчив δ-Fe с объёмоцентрированной кубической решёткой
Металловедение не выделяет β-Fe как отдельную фазу[4], и рассматривает её как разновидность α-Fe. При нагреве железа или стали выше точки Кюри (769 °C ≈ 1043 K) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком — происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит.
При нагреве железа или стали выше точки Кюри (769 °C ≈ 1043 K) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком — происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит.
Для чистого железа при нормальном давлении, с точки зрения металловедения, существуют следующие устойчивые модификации:
- От абсолютного нуля до 910 °C устойчива α-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой. Твёрдый раствор углерода в α-железе называется ферритом.
- От 910 до 1400 °C устойчива γ-модификация с гранецентрированной кубической (ГЦК) кристаллической решёткой. Твёрдый раствор углерода в γ-железе называется аустенитом.
-
От 910 до 1539 °C устойчива δ-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой.
 Твёрдый раствор углерода в δ-железе (также как и в α-железе) называется ферритом. Иногда различают высокотемпературный δ-феррит и низкотемпературный α-феррит (или просто феррит), хотя их атомные структуры одинаковы.
Твёрдый раствор углерода в δ-железе (также как и в α-железе) называется ферритом. Иногда различают высокотемпературный δ-феррит и низкотемпературный α-феррит (или просто феррит), хотя их атомные структуры одинаковы.
Наличие в стали углерода и легирующих элементов существенным образом изменяет температуры фазовых переходов (см. фазовую диаграмму железо — углерод).
- В области высоких давлений (свыше 104 МПа, 100 тыс. атм.) возникает модификация ε-железа с гексагональной плотноупакованной (ГПУ) решёткой.
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α—γ переходам кристаллической решётки происходит термообработка стали. Без этого явления железо как основа стали не получило бы такого широкого применения.
Железо тугоплавко, относится к металлам средней активности. Температура плавления железа 1539 °C, температура кипения — 2862 °C.
Химические свойства
Основные степени окисления железа — +2 и +3.
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2O3·xH2O.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe3O4, при сгорании в чистом кислороде — оксид Fe2O3. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeO. При нагревании порошка серы и железа образуется сульфид, приближённую формулу которого можно записать как FeS.
Железо при нагревании реагирует с галогенами. Так как FeF3 нелетуч, железо устойчиво к действию фтора до температуры 200—300 °C. При хлорировании железа (при температуре около 200 °C) образуется летучий FeCl3. Если взаимодействие железа и брома протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется FeBr3. При нагревании FeCl3 и, особенно, FeBr3 отщепляют галоген и превращаются в галогениды железа(II). При взаимодействии железа и иода образуется иодид Fe3I8.
При хлорировании железа (при температуре около 200 °C) образуется летучий FeCl3. Если взаимодействие железа и брома протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется FeBr3. При нагревании FeCl3 и, особенно, FeBr3 отщепляют галоген и превращаются в галогениды железа(II). При взаимодействии железа и иода образуется иодид Fe3I8.
При нагревании железо реагирует с азотом, образуя нитрид железа Fe3N, с фосфором, образуя фосфиды FeP, Fe2P и Fe3P, с углеродом, образуя карбид Fe3C, с кремнием, образуя несколько силицидов, например, FeSi.
При повышенном давлении металлическое железо реагирует с оксидом углерода(II) CO, причём образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава (η5-C5H5)2Fe.
Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава (η5-C5H5)2Fe.
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. В концентрированной серной и азотной кислотах железо не растворяется, так как прочная оксидная плёнка пассивирует его поверхность.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II):
Fe + 2HCl → FeCl2 + H2↑;
Fe + H2SO4 → FeSO4 + H2↑.
При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа(III):
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O.
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами:
Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Гидроксид железа(III) Fe(OH)3 проявляет слабо амфотерные свойства, он способен реагировать только с концентрированными растворами щелочей:
Fe(OH)3 + 3КОН → K3[Fe(OH)6].
Образующиеся при этом гидроксокомплексы железа(III) устойчивы в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
Соединения железа(III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3 → 3FeCl2.
При хранении водных растворов солей железа(II) наблюдается окисление железа(II) до железа(III):
4FeCl2 + O2 + 2H2O → 4Fe(OH)Cl2.
Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O.
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
При действии газообразного хлора или озона на щелочные растворы соединений железа(III) образуются соединения железа(VI) — ферраты, например, феррат(VI) калия K2FeO4. Имеются сообщения о получении под действием сильных окислителей соединений железа(VIII).
Для обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионами SCN–. При взаимодействии ионов Fe3+ с анионами SCN– образуется ярко-красный роданид железа Fe(SCN)3. Другим реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтой кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок берлинской лазури:
Другим реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтой кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок берлинской лазури:
4K4[Fe(CN)6] + 4Fe3+ → 4KFeIII[FeII(CN)6]↓ + 12K+.
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3− выпадает осадок турнбулевой сини:
3K3[Fe(CN)6] + 3Fe2+ → 3KFeII[FeIII(CN)6]↓ + 6K+.
Интересно, что берлинская лазурь и турнбулева синь — две формы одного и того же вещества, так как в растворе устанавливается равновесие:
KFeIII[FeII(CN)6] ↔ KFeII[FeIII(CN)6].
Применение
Железная руда
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
-
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется в черно-белых лазерных принтерах в качестве тонера.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.

Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Биологическое значение железа
В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). В организме взрослого человека содержится около 3,5 грамма железа (около 0,02 %), из которых 75 % являются главным действующим элементом гемоглобина крови, остальное входит в состав ферментов других клеток, катализируя процессы дыхания в клетках. Недостаток железа проявляется как болезнь организма (хлороз у растений и анемия у животных).
Обычно железо входит в ферменты в виде комплекса, называемого гемом. В частности, этот комплекс присутствует в гемоглобине — важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. И именно он окрашивает кровь в характерный красный цвет.
И именно он окрашивает кровь в характерный красный цвет.
Комплексы железа, отличные от гема, встречаются, например, в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК.
Неорганические соединения железа встречается в некоторых бактериях, иногда используется ими для связывания азота воздуха.
В организм животных и человека железо поступает с пищей (наиболее богаты им печень, мясо, яйца, бобовые, хлеб, крупы, свёкла). Интересно, что некогда шпинат ошибочно был внесён в этот список (из-за опечатки в результатах анализа — был потерян «лишний» ноль после запятой).
Суточная потребность человека в железе следующая: дети — от 4 до 18 мг, взрослые мужчины — 10 мг, взрослые женщины — 18 мг, беременные женщины во второй половине беременности — 33 мг. У женщин потребность несколько выше, чем у мужчин. Как правило, железа, поступающего с пищей, вполне достаточно, но в некоторых специальных случаях (анемия, а также при донорстве крови) необходимо применять железосодержащие препараты и пищевые добавки (гематоген, ферроплекс).
Содержание железа в воде больше 1—2 мг/л значительно ухудшает её органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования, вызывает у человека аллергические реакции, может стать причиной болезни крови и печени (гемохроматоз). ПДК железа в воде 0,3 мг/л.
Избыточная доза железа (200 мг и выше) может оказывать токсическое действие. Передозировка железа угнетает антиоксидантную систему организма, поэтому употреблять препараты железа здоровым людям не рекомендуется.
Соединения железа
Оксиды железа
Гидроксиды железа
Железнение
Железо самородное
Превышение железа в воде – незримый враг вашего здоровья — BWT
Превышение железа в воде – незримый враг вашего здоровья — BWTГлавная > Статьи > Вода и здоровье человека > Превышение железа в воде – незримый враг вашего здоровья
Статьи
27. 08.2020
08.2020
Превышение железа в воде – проблема, с которой сталкиваются все люди без исключения каждый день, употребляя в хозяйственно-бытовых целях воду не прошедшую водоподготовку.
Широко известен такой элемент таблицы Менделеева, как ferrum или железо. Все знают, что это очень полезный микроэлемент для организма, поэтому он входит в состав современных поливитаминов. Железо в больших количествах содержится в говядине, яблоках, гранатах и других фруктах и овощах красного цвета.
Беременным назначают препарата железа, если клинические анализы крови показывают низкий уровень гемоглобина, снижение его до критического уровня может вызывать такое заболевание, как анемия. Суточная потребность человека в железе: для женщин – 20 мг, мужчин -10, у детей колеблется от 4-18 мг, а во время беременности потребность увеличивается до 30-35 мг.
Решения BWT для обезжелезивания воды:
Смотреть все Получить консультацию
Железо в организме выполняет ряд важных функций: участвует в процессе кровообращении, оказывает прямое воздействие на состояние кожи, волос и ногтей, влияет на работу щитовидной железы, играет важную роль в процессе роста ребенка и формировании иммунитета. Его нехватка сказывается на работе организма и может привести к ряду заболеваний.
Его нехватка сказывается на работе организма и может привести к ряду заболеваний.
Однако переизбыток железа, так же отрицательно влияет на человека. Это может привести к заболеванию сердца, развитию онкологических заболеваний, доза, превышающая 200 мг/сутки может вызвать серьезное отравление, а доза в 3-35гр привести даже к летальному исходу.
И взрослые, и дети знают, что полезное для здоровья железо содержится во всяких вкусных овощах и фруктах. А вот не совсем полезное железо поступает в организм с неочищенной должным образом питьевой водой. Допустимое содержание железа регулируется таким документом как ГОСТ, в котором закреплено допустимое содержание железа на уровне не более 0,3 мг/литр. А если взять для примера страны Европы, там этот показатель не должен превышать 0,1 мг/литр.
Все знают полезные свойства железа, а вот какой вред наносит организму превышение железа в воде, мало кто задумывается. Повышенное содержание железа сказывается на органолептических свойствах воды, когда у нее появляется посторонний запах и металлический вкус. При концентрации железа в воде 1 мг/литр на поверхностях ванны, раковины и унитаза можно наблюдать ржавые подтеки, а при стирке на белье могут появиться ржавые пятна. После купания в такой воде на коже может появиться раздражение, зуд, шелушение или покраснение. Железо в тех соединениях, в которых оно содержится в питьевой воде, не усваивается организмом человека и может привести к расстройству или даже заболеваниям желудочно-кишечного тракта. Но если всю сантехнику можно заменить, то здоровье человека не купишь.
При концентрации железа в воде 1 мг/литр на поверхностях ванны, раковины и унитаза можно наблюдать ржавые подтеки, а при стирке на белье могут появиться ржавые пятна. После купания в такой воде на коже может появиться раздражение, зуд, шелушение или покраснение. Железо в тех соединениях, в которых оно содержится в питьевой воде, не усваивается организмом человека и может привести к расстройству или даже заболеваниям желудочно-кишечного тракта. Но если всю сантехнику можно заменить, то здоровье человека не купишь.
А если в доме ребенок!? В первые месяцы жизни малыша воду для его купания врачи рекомендуют кипятить, да в дальнейшем чувствительная кожа малыша серьезней реагирует на содержание примесей в воде.Чтобы устранить превышение железа в воде раньше отстаивали воду, однако, попробуйте отстоять воду для детской ванночки, в зависимости от ее размеров, это от 20 до 40 литров. Можно подойти к решению этой проблемы с другой стороны и приобрести домашнюю установку – фильтр обезжелезивания и деманганации.
В настоящее время они стали все более популярными и доступными для каждого, потому что имеют широкий ценовой диапазон. Приобрести такую установку гораздо дешевле, чем лечить проблемы, вызванные превышением железа в воде, ведь лечение и лекарственные препараты стоят намного дороже фильтров, к тому же цены на таблетки растут с каждым днем. Можно доверить решение данной проблемы коммунальным службам и надеяться, что они будут контролировать уровень содержания примесей и не допускать их превышения, но все знают, в каком сложном положении, находятся эти службы. А если факт допущения превышения концентрации и был, то доказать это простому человеку практически не возможно, и как следствие делается невозможным привлечение к ответственности виновные службы и возмещение ущерба или оплаты лечения.
Сегодня просто необходимо взять все в свои руки и приобрести фильтры водоочистки. Лучше потратить средства сегодня на фильтрацию, чтобы превышение железа в воде не сказывалось на вашем здоровье, чем в будущем потратить гораздо больше средств на лечение.
Флагманский магазин BWT в ТРЦ “Рига молл” работает для всех, кто ценит высокое качество во…
Самая распространенная проблема для воды в частных бассейнах. И, мы расскажем как с ней бороться.
Так как аквапарк является одной из сложнейших развлекательных систем среди бассейнов, его обслуживан…
Все статьи
Мы используем файлы “cookie”, чтобы обеспечить максимальное удобство пользователям. Продолжая использовать сайт, вы соглашаетесь с условиями использования файлов cookie. Согласен
Вход на сайт
Восстановить пароль
Введите код авторизации из письма, после чего Вы будете перенаправлены в «Личный кабинет» для изменения пароля.
Регистрация
Получать новости об акциях и скидках
Сообщить о поступлении
Получить консультацию по товару, снятому с производства
Получите предложение по аренде диспенсеров
Купить товар у дилера
Заказать оптом
Получить консультацию
Частное лицоСообщить о поступлении
Нажимая на кнопку «Отправить», вы соглашаетесь с политикой конфиденциальности
Спасибо!
Ошибка!
–>
Железо. Химия железа и его соединений
Железо Fe: химические свойства, способы получения железа, взаимодействие с простыми веществами (кислород, сера) и со сложными веществами (кислоты, вода, сильные окислители). Оксид железа (II) FeO, оксид железа (III) Fe2O3, железная окалина (Fe3O4) — способы получения и химические свойства. Гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3 — способы получения и химические свойства.
Оксид железа (II) FeO, оксид железа (III) Fe2O3, железная окалина (Fe3O4) — способы получения и химические свойства. Гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3 — способы получения и химические свойства.
Положение железа в периодической системе химических элементов
Электронное строение железа
Физические свойства
Нахождение в природе
Способы получения
Качественные реакции
Химические свойства
1. Взаимодействие с простыми веществами
1.1. Взаимодействие с галогенами
1.2. Взаимодействие с серой
1.3. Взаимодействие с фосфором
1.4. Взаимодействие с азотом
1.5. Взаимодействие с углеродом
1.6. Горение
2. Взаимодействие со сложными веществами
2.1. Взаимодействие с водой
2.2. Взаимодействие с минеральными кислотами
2.3. Взаимодействие с серной кислотой
2.4. Взаимодействие с азотной кислотой
2.5. Взаимодействие с сильными окислителями
2. 6. Взаимодействие с оксидами и солями
6. Взаимодействие с оксидами и солями
Оксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами
2. Взаимодействие с кислотами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Взаимодействие с кислотами
6. Взаимодействие с восстановителями
Оксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с щелочами и основными оксидами
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (III)
6. Взаимодействие с солями более летучих кислот
Оксид железа (II, III)
Способы получения
Химические свойства
1. Взаимодействие с кислотными оксидами и кислотами
2. Взаимодействие с сильными кислотами-окислителями
3. Взаимодействие с водой
4. Взаимодействие с окислителями
5. Окислительные свойства оксида железа (II, III)
Окислительные свойства оксида железа (II, III)
Гидроксид железа (II)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
3. Восстановительные свойства
4. Разложение при нагревании
Гидроксид железа (III)
Способы получения
Химические свойства
1. Взаимодействие с кислотами
2. Взаимодействие с кислотными оксидами
3. Взаимодействие с щелочами
4. Разложение при нагревании
Соли железа
Железо
Положение в периодической системе химических элементов
Элемент железо расположен в побочной подгруппе VIII группы (или в 8 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома железа
Электронная конфигурация железа в основном состоянии:
+26Fe 1s22s22p63s23p64s23d6
Железо проявляет ярко выраженные магнитные свойства.
Физические свойства
Железо – металл серебристо-белого цвета, с высокой химической активностью и высокой ковкостью. Обладает высокой тепло- и электропроводностью.
(изображение с портала vchemraznica.ru)
Температура плавления 1538оС, температура кипения 2861оС.
Нахождение в природе
Железо довольно распространено в земной коре (порядка 4% массы земной коры). По распространенности на Земле железо занимает 4-ое место среди всех элементов и 2-ое место среди металлов. Содержание в земной коре — около 8%.
В природе железо в основном встречается в виде соединений:
Красный железняк Fe2O3 (гематит).
(изображение с портала karatto.ru)
Магнитный железняк Fe3O4 или FeO·Fe2O3 (магнетит).
(изображение с портала emchi-med.ru)
В природе также широко распространены сульфиды железа, например, пирит FeS2.
(изображение с портала livemaster.ru)
Встречаются и другие минералы, содержащие железо.
Способы получения
Железо в промышленности получают из железной руды, гематита Fe2O3 или магнетита (Fe3O4или FeO·Fe2O3).
1. Один из основных способов производства железа – доменный процесс. Доменный процесс основан на восстановлении железа из оксида углеродом в доменной печи.
В печь загружают руду, кокс и флюсы.
Шихта – смесь исходных материалов, а в некоторых случаях и топлива в определённой пропорции, которую обрабатывают в печи.
Каменноугольный кокс – это твёрдый пористый продукт серого цвета, получаемый путем коксования каменного угля при температурах 950—1100 °С без доступа воздуха. Содержит 96—98 % углерода.
Флюсы – это неорганические вещества, которые добавляют к руде при выплавке металлов, чтобы снизить температуру плавления и легче отделить металл от пустой породы.
Шлак – расплав (а после затвердевания – стекловидная масса), покрывающий поверхность жидкого металла. Шлак состоит из всплывших продуктов пустой породы с флюсами и предохраняет металл от вредного воздействия газовой среды печи, удаляет примеси.
В печи кокс окисляется до оксида углерода (II):
2C + O2 → 2CO
Затем нагретый угарный газ восстанавливает оксид железа (III):
3CO + Fe2O3 → 3CO2 + 2Fe
Процесс получения железа – многоэтапный и зависит от температуры.
Наверху, где температура обычно находится в диапазоне между 200 °C и 700 °C, протекает следующая реакция:
3Fe2O3 + CO → 2Fe3O4 + CO2
Ниже в печи, при температурах приблизительно 850 °C, протекает восстановление смешанного оксида железа (II, III) до оксида железа (II):
Fe3O4 + CO → 3FeO + CO2
Встречные потоки газов разогревают шихту, и происходит разложение известняка:
CaCO3 → CaO + CO2
Оксид железа (II) опускается в область с более высоких температур (до 1200oC), где протекает следующая реакция:
FeO + CO → Fe + CO2
Углекислый газ поднимается вверх и реагирует с коксом, образуя угарный газ:
CO2 + C → 2CO
(изображение с портала 900igr. net)
net)
2. Также железо получают прямым восстановлением из оксида водородом:
Fe2O3 + 3H2 → 2Fe + 3H2O
При этом получается более чистое железо, т.к. получаемое железо не загрязнено серой и фосфором, которые являются примесями в каменном угле.
3. Еще один способ получения железа в промышленности – электролиз растворов солей железа.
Качественные реакции
Качественные реакции на ионы железа +2.
– взаимодействие солей железа (II) с щелочами. При этом образуется серо-зеленый студенистый осадок гидроксида железа (II).
Например, хлорид железа (II) реагирует с гидроксидом натрия:
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Видеоопыт взаимодействия раствора сульфата железа (II) с раствором гидроксида натрия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Гидроксид железа (II) на воздухе буреет, так как окисляется до гидроксида железа (III):
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
– ионы железа +2 окрашивают раствор в светлый желто-зеленый цвет.
– взаимодействие с красной кровяной солью K3[Fe(CN)6] – также качественная реакция на ионы железа +2. При этом образуется синий осадок «турнбулева синь».
Видеоопыт взаимодействия раствора хлорида железа (II) с раствором гексацианоферрата (III) калия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Качественные реакции на ионы железа +3
– взаимодействие солей железа (III) с щелочами. При этом образуется бурый осадок гидроксида железа (III).
Например, хлорид железа (III) реагирует с гидроксидом натрия:
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гидроксида натрия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
– ионы железа +3 окрашивают раствор в светлый желто-оранжевый цвет.
– взаимодействие с желтой кровяной солью K4[Fe(CN)6] ионы железа +3. При этом образуется синий осадок «берлинская лазурь».
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
В последнее время получены данные, которые свидетельствуют, что молекулы берлинской лазури идентичны по строению молекулам турнбулевой сини. Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
– при взаимодействии солей железа (III) с роданидами раствор окрашивается в кроваво-красный цвет.
Например, хлорид железа (III) взаимодействует с роданидом натрия:
FeCl3 + 3NaCNS → Fe(CNS)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором роданида калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
Химические свойства
1. При обычных условиях железо малоактивно, но при нагревании, в особенности в мелкораздробленном состоянии, оно становится активным и реагирует почти со всеми неметаллами.
1.1. Железо реагирует с галогенами с образованием галогенидов. При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2 → 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
Fe + I2 → FeI2
1.2. Железо реагирует с серой с образованием сульфида железа (II):
Fe + S → FeS
1.3. Железо реагирует с фосфором. При этом образуется бинарное соединения – фосфид железа:
Fe + P → FeP
1.4. С азотом железо реагирует в специфических условиях.
1.5. Железо реагирует с углеродом и кремнием с образованием карбида и силицида.
1.6. При взаимодействии с кислородом железо образует окалину – двойной оксид железа (II, III):
3Fe + 2O2 → Fe3O4
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe + O2 → 2FeO
2. Железо взаимодействует со сложными веществами.
2.1. При обычных условиях железо с водой практически не реагирует. Раскаленное железо может вступать в реакцию при температуре 700-900оС с водяным паром:
3Fe0 + 4H2+O → Fe+33O4 + 4H20
В воде в присутствии кислорода или во влажном воздухе железо медленно окисляется (корродирует):
4Fe + 3O2 + 6H2O → 4Fe(OH)3
2. 2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
Например, железо бурно реагирует с соляной кислотой:
Fe + 2HCl → FeCl2 + H2↑
2.3. При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
2Fe + 6H2SO4(конц.) → Fe2(SO4)3 + 3SO2 + 6H2O
2.4. Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2↑ + 3H2O
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
Fe + 4HNO3(разб.гор.) → Fe(NO3)3 + NO + 2H2O
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
8Fe + 30HNO3(оч. разб.) → 8Fe(NO3)3 + 3NH4NO3 + 9H2O
2.5. Железо может реагировать с щелочными растворами или расплавами сильных окислителей. При этом железо окисляет до степени окисления +6, образуя соль (феррат).
Например, при взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
Fe + 2KOH + 3KNO3 → 3KNO2 + K2FeO4 + H2O
2.6. Железо восстанавливает менее активные металлы из оксидов и солей.
Например, железо вытесняет медь из сульфата меди (II). Реакция экзотермическая:
Fe + CuSO4 → FeSO4 + Cu
Еще пример: простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2Fe(NO3)3 + Fe → 3Fe(NO3)2
2FeCl3 + Fe → 3FeCl2
Fe2(SO4)3 + Fe → 3FeSO4
Оксид железа (II)
Оксид железа (II) – это твердое, нерастворимое в воде вещество черного цвета.
Способы получения
Оксид железа (II) можно получить различными методами:
1. Частичным восстановлением оксида железа (III).
Например, частичным восстановлением оксида железа (III) водородом:
Fe2O3 + H2 → 2FeO + H2O
Или частичным восстановлением оксида железа (III) угарным газом:
Fe2O3 + CO → 2FeO + CO2
Еще один пример: восстановление оксида железа (III) железом:
Fe2O3 + Fe → 3FeO
2. Разложение гидроксида железа (II) при нагревании:
Fe(OH)2 → FeO + H2O
Химические свойстваОксид железа (II) — типичный основный оксид.
1. При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
Например, оксид железа (II) взаимодействует с оксидом серы (VI):
FeO + SO3 → FeSO4
2. Оксид железа (II) взаимодействует с растворимыми кислотами. При этом также образуются соответствующие соли.
Например, оксид железа (II) взаимодействует с соляной кислотой:
FeO + 2HCl → FeCl2 + H2O
3. Оксид железа (II) не взаимодействует с водой.
4. Оксид железа (II) малоустойчив, и легко окисляется до соединений железа (III).
Например, при взаимодействии с концентрированной азотной кислотой образуются нитрат железа (III), оксид азота (IV) и вода:
FeO + 4HNO3(конц. ) → NO2 + Fe(NO3)3 + 2H2O
) → NO2 + Fe(NO3)3 + 2H2O
При взаимодействии с разбавленной азотной кислотой образуется оксид азота (II). Реакция идет при нагревании:
3FeO + 10HNO3(разб.) → 3Fe(NO3)3 + NO + 5H2O
5. Оксид железа (II) проявляет слабые окислительные свойства.
Например, оксид железа (II) реагирует с угарным газом при нагревании:
FeO + CO → Fe + CO2
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами:
1. Окисление оксида железа (II) кислородом.
4FeO + O2 → 2Fe2O3
2. Разложение гидроксида железа (III) при нагревании:
Разложение гидроксида железа (III) при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Химические свойства
Оксид железа (III) – амфотерный.
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например, оксид железа (III) взаимодействует с азотной кислотой:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит).
Например, оксид железа (III) взаимодействует с гидроксидом натрия:
Fe2O3 + 2NaOH → 2NaFeO2 + H2O
3. Оксид железа (III) не взаимодействует с водой.
Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например, хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Fe2O3 + KClO3 + 4KOH → 2K2FeO4 + KCl + 2H2O
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + 3KNO2 + 2H2O
5. Оксид железа (III) проявляет окислительные свойства.
Например, оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II) или железной окалины:
Fe2O3 + 3СO → 2Fe + 3CO2
Также оксид железа (III) восстанавливается водородом:
Fe2O3 + 3Н2 → 2Fe + 3H2O
Железом можно восстановить оксид железа только до оксида железа (II):
Fe2O3 + Fe → 3FeO
Оксид железа (III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
Fe2O3 + 2Al → 2Fe + Al2O3
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например, с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Fe2O3 + Na2CO3 → 2NaFeO2 + CO2
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами:
1. Горение железа на воздухе:
3Fe + 2O2 → Fe3O4
2. Частичное восстановление оксида железа (III) водородом или угарным газом:
3Fe2O3 + Н2 → 2Fe3O4 + H2O
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
3Fe + 4H2O(пар) → Fe3O4 + 4H2
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например, оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Еще пример: оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
Fe3O4 + 4H2SO4(разб.) → Fe2(SO4)3 + FeSO4 + 4Н2О
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например, железная окалина окисляется концентрированной азотной кислотой:
Fe3O4 + 10HNO3(конц. ) → NO2↑ + 3Fe(NO3)3 + 5H2O
) → NO2↑ + 3Fe(NO3)3 + 5H2O
Разбавленной азотной кислотой окалина окисляется при нагревании:
3Fe3O4 + 28HNO3(разб.) → 9Fe(NO3)3 + NO + 14H2O
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
2Fe3O4 + 10H2SO4(конц.) → 3Fe2(SO4)3 + SO2 + 10H2O
Также окалина окисляется кислородом воздуха:
4Fe3O4 + O2(воздух) → 6Fe2O3
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
выше).
5. Железная окалина проявляет окислительные свойства.
Например, оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Fe3O4 + 4CO → 3Fe + 4CO2
Также железная окалина восстанавливается водородом:
Fe3O4 + 4H2 → 3Fe + 4H2O
Оксид железа (II, III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
3Fe3O4 + 8Al → 9Fe + 4Al2O3
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например, с йодоводородом:
Fe3O4 + 8HI → 3FeI2 + I2 + 4H2O
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например, хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
FeCl2 + 2NH3 + 2H2O → Fe(OH)2 + 2NH4Cl
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например, хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства, а именно реагирует с кислотами. При этом образуются соответствующие соли.
При этом образуются соответствующие соли.
Например, гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2HBr → FeBr2 + 2H2O
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
Fe(OH)2 + SO3 → FeSO4 + 2H2O
3. Гидроксид железа (II) проявляет сильные восстановительные свойства, и реагирует с окислителями. При этом образуются соединения железа (III).
При этом образуются соединения железа (III).
Например, гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
Гидроксид железа (II) взаимодействует с пероксидом водорода:
2Fe(OH)2 + H2O2 → 2Fe(OH)3
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
2Fe(OH)2 + 4H2SO4(конц.) → Fe2(SO4)3 + SO2 + 6H2O
4. Гидроксид железа (II) разлагается при нагревании:
Fe(OH)2 → FeO + H2O
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например, хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
FeCl3 + 3NH3 + 3H2O = Fe(OH)3 + 3NH4Cl
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
2Fe(OH)2 + H2O2 → 2Fe(OH)3
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например, хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов. Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
2FeBr3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + CO2↑ + 6NaBr
Но есть исключение! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
2FeCl3 + Na2SO3 + H2O = 2FeCl2 + Na2SO4 + 2HCl
Также допустима такая запись:
2FeCl3 + Na2SO3 + H2O = FeSO4 + 2NaCl + FeCl2 + 2HCl
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами.
Например, гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Fe(OH)3 + 3HBr → FeBr3 + 3H2O
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот.
Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
2Fe(OH)3 + 3SO3 → Fe2(SO4)3 + 3H2O
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например, гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
KOH + Fe(OH)3 → KFeO2 + 2H2O
4. Гидроксид железа (III) разлагается при нагревании:
Гидроксид железа (III) разлагается при нагревании:
2Fe(OH)3 → Fe2O3 + 3H2O
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Соли железа
Нитраты железа
Нитрат железа (II) при нагревании разлагается на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Нитрат железа (III) при нагревании разлагается также на оксид железа (III), оксид азота (IV) и кислород:
4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2
Гидролиз солей железа
Растворимые соли железа, образованные кислотными остатками сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. частично:
Гидролиз протекает ступенчато и обратимо, т.е. частично:
I ступень: Fe3+ + H2O ↔ FeOH2+ + H+
II ступень: FeOH2+ + H2O ↔ Fe(OH)2+ + H+
III ступень: Fe(OH)2+ + H2O ↔ Fe(OH)3 + H+
Однако сульфиты и карбонаты железа (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Fe2(SO4)3 + 6NaHSO3 → 2Fe(OH)3 + 6SO2 + 3Na2SO4
2FeBr3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + CO2↑ + 6NaBr
2Fe(NO3)3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaNO3 + 3CO2↑
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2↑
Fe2(SO4)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 3K2SO4
При взаимодействии соединений железа (III) с сульфидами протекает ОВР:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Окислительные свойства железа (III)
Соли железа (III) под проявляют довольно сильные окислительные свойств. Так, при взаимодействии соединений железа (III) с сульфидами протекает окислительно-восстановительная реакция.
Например: хлорид железа (III) взаимодействует с сульфидом натрия. При этом образуется сера, хлорид натрия и либо черный осадок сульфида железа (II) (в избытке сульфида натрия), либо хлорид железа (II) (в избытке хлорида железа (III)):
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + Na2S → 2FeCl2 + S + 2NaCl
По такому же принципу соли железа (III) реагируют с сероводородом:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
Соли железа (III) также вступают в окислительно-восстановительные реакции с йодидами.
Например, хлорид железа (III) взаимодействует с йодидом калия. При этом образуются хлорид железа (II), молекулярный йод и хлорид калия:
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Интерес представляют также реакции солей железа (III) с металлами. Мы знаем, что более активные металлы вытесняют из солей менее активные металлы. Иначе говоря, металлы, которые стоят в электрохимическом ряду левее, могут взаимодействовать с солями металлов, которые расположены в этом ряду правее. Исходя из этого правила, соли железа могут взаимодействовать только с металлами, которые расположены до железа. И они взаимодействуют.
Однако, соли железа со степенью окисления +3 в этом ряду являются небольшим исключением. Ведь для железа характерны две степени окисления: +2 и +3. И железо со степенью окисления +3 является более сильным окислителем. Таким образом, условно говоря, железо со степенью окисления +3 расположено в ряду активности после меди. И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И еще один момент. Соединения железа (III) с этими металлами реагировать будут, а вот соединения железа (II) с ними реагировать не будут. Таким образом, металлы, расположенные в ряду активности между железом и медью (включая медь) при взаимодействии с солями железа (III) восстанавливают железо до степени окисления +2. А вот металлы, расположенные до железа в ряду активности, могут восстановить железо и до простого вещества.
Например, хлорид железа (III) взаимодействует с медью. При этом образуются хлорид железа (II) и хлорид меди (II):
2FeCl3 + Cu → 2FeCl2 + CuCl2
А вот реакция нитрата железа (III) с цинком протекает уже по привычному механизму. И железо восстанавливается до простого вещества:
2Fe(NO3)3 + 3Zn → 2Fe + 3Zn(NO3)2
Понравилось это:
Нравится Загрузка. ..
..
Активные металлы – список в химии, таблица ряда
4.4
Средняя оценка: 4.4
Всего получено оценок: 1148.
4.4
Средняя оценка: 4.4
Всего получено оценок: 1148.
Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
Рис. 1. Активные металлы в таблице Менделеева.Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.

К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.
Рис. 2. Электрохимический ряд напряжений металлов.К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция | Уравнение | Исключение |
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом | K + O2 → KO2 | Литий реагирует с кислородом только при высокой температуре |
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются | 2Ca + O2 → 2CaO | |
Реагируют с простыми веществами, образуя соли | – Ca + Br2 → CaBr2; | Алюминий не вступает в реакцию с водородом |
Бурно реагируют с водой, образуя щёлочи и водород | – 2Na + 2H2O → 2NaOH + H2; | Реакция с литием протекает медленно. |
Реагируют с кислотами, образуя соли | – Ca + 2HCl → CaCl2 + H2; – 2K + 2HMnO4 → 2KMnO4 + H2 | |
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью | 2Na + CuCl2 + 2H2O: – 2Na + 2H2O → 2NaOH + H2; |
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.
Рис. 3. Минералы и чистые металлы.Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Руслан Катылов
5/5
Александр Котков
5/5
Илья Ударцев
5/5
Инесса Медведева
4/5
Александр Котков
5/5
Лидия Маслова
5/5
Александр Котков
5/5
Сергей Ефремов
2/5
Дима Мухтаров
5/5
Сергей Макаров
5/5
Оценка доклада
4.4
Средняя оценка: 4.4
Всего получено оценок: 1148.
А какая ваша оценка?
Fe ferrum – элемент периодической таблицы роялти бесплатно векторное изображение
Fe ferrum – элемент периодической таблицы роялти бесплатно векторное изображениеЛицензияПодробнее
Стандарт Вы можете использовать вектор в личных и коммерческих целях. Расширенный Вы можете использовать вектор на предметах для перепродажи и печати по требованию.Тип лицензии определяет, как вы можете использовать этот образ.
| Станд. | Расшир. | |
|---|---|---|
| Печатный/редакционный | ||
| Графический дизайн | ||
| Веб-дизайн | ||
| Социальные сети | ||
| Редактировать и изменить | ||
| Многопользовательский | ||
| Предметы перепродажи | ||
| Печать по запросу |
Способы покупкиСравнить
Плата за изображение € 14,99 Кредиты € 1,00 Подписка € 0,69 Оплатить стандартные лицензии можно тремя способами. Цены евро евро .
Цены евро евро .
| Оплата с помощью | Цена изображения |
|---|---|
| Плата за изображение € 14,99 Одноразовый платеж | |
| Предоплаченные кредиты € 1 Загружайте изображения по запросу (1 кредит = 1 евро). Минимальная покупка 30р. | |
| План подписки От 0,69 € Выберите месячный план. Неиспользованные загрузки автоматически переносятся на следующий месяц. | |
Способы покупкиСравнить
Плата за изображение € 39,99 Кредиты € 30,00Существует два способа оплаты расширенных лицензий. Цены евро евро .
| Оплата с помощью | Стоимость изображения |
|---|---|
Плата за изображение € 39,99 Оплата разовая, регистрация не требуется. | |
| Предоплаченные кредиты € 30 Загружайте изображения по запросу (1 кредит = 1 евро). | |
Дополнительные услугиПодробнее
Настроить изображение Доступно только с оплатой за изображение € 85,00Нравится изображение, но нужны лишь некоторые модификации? Пусть наши талантливые художники сделают всю работу за вас!
Мы свяжем вас с дизайнером, который сможет внести изменения и отправить вам изображение в выбранном вами формате.
Примеры
- Изменить текст
- Изменить цвета
- Изменение размера до новых размеров
- Включить логотип или символ
- Добавьте свою компанию или название компании
файлов включены
Загрузка сведений…
- Идентификатор изображения
- 29251876
- Цветовой режим
- RGB
- Художник
- фон
стоковых иллюстраций – Железо.
 железо. переходные металлы. химический элемент периодической таблицы Менделеева. Стоковый клипарт gg98043926
железо. переходные металлы. химический элемент периодической таблицы Менделеева. Стоковый клипарт gg98043926Стоковые иллюстрации – Железо. железо. переходные металлы. химический элемент периодической таблицы Менделеева. железо в творческой концепции квадратного куба. Векторный клипарт gg98043926
Связанные ключевые слова
- утюг
- железо
- переходные металлы
- исследовательская работа
- наука
- научный
- ученый
- периодический
- периодическая таблица
- структура
- символ
- химический символ
- химия
- химический
- атомный
- атомная масса
- электрон
- элемент
- куб
- площадь
- коробка
- переход
- металлы
- из
- менделеевский
- стол
- в
- творческий
- концепция
- бесплатные иллюстрации
- графика
- клип арт
- стоковый клипарт
- фондовая иллюстрация
- логотип
- штриховая графика
- картина
- графика
- Рисование
- рисунки
- произведение искусства
more keywords
Save up to 50% when you buy with Credits
More Info
Save more than 50% with an Image Subscription
More Info
- Добавить в избранное Удалить из Избранного
- Посмотреть портфолио исполнителя
- Делиться
Ferrum Element – Bilder und Stockfotos
736. 745Bilder
745Bilder
- Bilder
- Fotos
- Grafiken
- Vektoren
- Videos
Niedrigster Preis
SignatureBeste Qualität
Durchstöbern Sie 736.745
ferrum element Stock -Фотография и фотографии. Oder starten Sie eine neuesuche, um noch mehr Stock-Photografie und Bilder zu entdecken. einfarbige aluminium-dosen – железный элемент фото и изображенияEinfarbige Aluminium-dosen
лагер для металлических деталей viele packungen metallstangen in den regalen – ferrum element stock-fotos und bilderLager für gewalztes Metall. Viele Packungen Metallstangen in den…
чистый феррониоб (fe-hinweis – ferrum element stock-fotos und bilder)чистый феррониоб (Fe-Hinweis
hinterhof – ferrum element stock-fotos und bilderHinterhof
Ein baufälliger Hinterhof mit Hütten в Ханое, der Hauptstadt Vietnams
промышленная абстракция для внутренних, внутренних, schweißen und fertigung. – ferrum element stock-fotos und bilder
– ferrum element stock-fotos und bilderIndustrial Abstract für Hintergrund, Hintergrund, Schweißen und…
erz – ferrum element stock-fotos und bilderErz
Metall-Öffnungszeiten die
vektorillusionssatz is aufrückidenkoverzen грех. – ferrum element stock-grafiken, -clipart, -cartoons und -symboleVektorillusionssatz von verschiedenen schwarzen Kohlestücken,…
Набор векторных иллюстраций для различных Steinkohlestücken, isoliert auf weißem Hintergrund – Sammlung von Bodenschätzen. Ikonen von geschnittenen Stücken von Gesteinsgraphitkohle im flachen Stil.
stichprobe von eisenerz Mineral Isoliert auf Weißem Hintergrund. – запасные фотографии и фотографии элемента железаStichprobe von Eisenerz Mineral isoliert auf weißem Hintergrund.
Металлопрофиль и решетка из нержавеющей стали. verschiedene 3d-stahlträger und -rohre – ferrum element stock-grafiken, -clipart, -cartoons und -symbole Metallprofil und Rohre auf weißem Hintergrund isoliert. …
…
Industrie Arbeiter mit Werkzeug
Metallarbeiter beim Schneiden eines Metallgegenstandes mit Kreissäge in rkeisäge.
schwarze linie geschmolzenes gold, das gegossen wird, symbol auf weißemhintergrund isoliert. geschmolzenes metall aus schöpfkelle gegossen. вектор – железный элемент сток-графика, -клипарт, -мультфильмы и -символSchwarze Linie Geschmolzenes Gold, das gegossen wird, Symbol auf…
haufen von heißen stahlteilen – ferrum element stock-fotos und bilderHaufen von heißen Stahlteilen
Stapel heißer Stahlteile Hintergrund
gym hanteln mit schwarzem metall wiegt 1 kg und 2kg auf schwarzem hintergrund mit kopie space, foto von oben. – железный элемент стоковые фотографии и изображенияТренажерный зал Hanteln mit schwarzem Metall wiegt 1 kg und 2kg auf…
realistische glänzende metall-banner-set. gebürstete stahlplatte mit schrauben. polierte silber metalloberfläche. вектор-иллюстрация – железный элемент сток-графика, -клипарт, -мультфильмы и -символ
gebürstete stahlplatte mit schrauben. polierte silber metalloberfläche. вектор-иллюстрация – железный элемент сток-графика, -клипарт, -мультфильмы и -символRealistische glänzende Metall-Banner-Set. Gebürstete Stahlplatte…
industrielle schweißer mit fackel – ferrum element stock-fotos und bilderIndustrielle Schweißer mit Fackel
werksarbeiter betriebsbandsägenmaschine – ferrum element stock-fotos und bilderWerksarbeiter Betriebsbandsägenmaschine
Fabrikarbeiter, der eine Bandsägenschneidemaschine für Stahlstangen in der Industriefabrik bedient
rostigen stahl diamant platte textur – ferrum element стоковые фотографии и изображенияRostigen Stahl Diamant Platte Textur
industrieschweißer mit fackel – ferrum element stock-fotos und bilderIndustrieschweißer mit Fackel
Industrieschweißgerät mit Taschenlampe und Schutzhelm in großer Halle beim Schweißen von Metallprofilen
maschinengetriebe – ferrum element stock-fotos und bilderMaschinengetriebe
Mechanische Getriebekombination Nahaufnahme; Draufsicht
реалистичный металлический баннер-набор. gebürstete stahlplatte mit schrauben. polierte silber metalloberfläche. вектор-иллюстрация – железный элемент сток-графика, -клипарт, -мультфильмы и -символ
gebürstete stahlplatte mit schrauben. polierte silber metalloberfläche. вектор-иллюстрация – железный элемент сток-графика, -клипарт, -мультфильмы и -символRealistische glänzende Metall-Banner-Set. Gebürstete Stahlplatte…
lebensmittel mit hohem eisengehalt. лебер, брокколи, каки, эпфель, нюссе, хюльзенфрюхте, шпинат, гранатапфель. ansicht von oben flach legen. – фотоэлементы и изображенияLebensmittel mit hohem Eisengehalt. Leber, Brokkoli, Kaki, Äpfel,
dunkle metallische Carbon-textur. металлстальгиттерхинтергрунд. – железный элемент стоковой графики, -клипарта, -мультфильмов и -символовМеталлический углерод-текстур Dunkle. Metallstahlgitterhintergrund.
dersuche nach dem richtigen winkel zu befahren. – элемент железа фото и изображенияDersuche dem richtigen Winkel zu befahren.
Electric Schleifmaschine – ferrum element стоковые фотографии и изображения – стоковые фотографии и изображения железных элементовModerne Rohr-Roll-Anlage mit Stahlrohren
funken fliegen machine rasterung und veredelung von metall – ferrum element stock-fotos und bilderFunken fliegen Maschine Rasterung und Veredelung von Metall
ферритин-тест с пробойным зондом в реагенизированном медицинском оборудовании и руке work – ferrum element stock-fotos und bilder Ferritin-Testergebnis mit Blutprobe im Reagenzglas an der Hand. ..
..
Dunkler Küchenutensilien Hintergrund mit gusseisernen schwarzen Kü
Dunkler Küchenutensilien Hintergrund mit gusseisernem schwarzem Küchengeschirr, Draufsicht, Leerraum für einen Text
schrott-recycling-anlage. – фотоэлементы и изображенияSchrott-Recycling-Anlage.
ржавый рорбрух в бакинском ботаническом саду – железный элемент сток-фотографии и фотографииржавый рорбрух в бакинском ботаническом саду
Ein altes Rohr bricht bei eisigem Wetter в Баку, Aserbaidschan
silber metall texturhintergrund-design – ferrum element stock-fotos und bilderSilber Metall Textur Hintergrund-Design
holz geheizten ofen und verbrennung – ferrum element stock-fotos und bilderHolz geheizten Ofen und verbrerennung
Holzofen, Brennholzueisen, Briketts aus Rinde
eisen-symbol Aus Pillen Auf Lila Hintergrund. top-ansicht mit kopierbereich. флах лиген. – элемент железа стоковые фотографии и изображения
top-ansicht mit kopierbereich. флах лиген. – элемент железа стоковые фотографии и изображенияEisen-Symbol aus Pillen auf lila Hintergrund. Top-Ansicht мит…
eine große, gebrauchte schraube mit mutter auf weißem grund. – элемент железа стоковые фотографии и изображенияБольшая, gebrauchte Schraube mit Mutter auf weißem Grund.
sechseckige abstrakte metallhintergrund mit licht – ferrum element stock-grafiken, -clipart, -cartoons und -symboleSechseckige abstrakte Metallhintergrund mit Licht
Sechseckiger abstrakter Metallhintergrund mit Licht im Vektor
die grunge vintage rostigen stahl strukturierten hintergrund – ferrum element stock-fotos и изображениеDie Grunge Vintage rostigen Stahl structurierten Hintergrund
bügeleisen-profile und stahl duschstange – ferrum element stock-fotos und bilderBügeleisen-Profile und Stahl Duschstange
stahlblech-spulen – ferrum element stock-fotos und bilderStahlt1 blerotsch0Spulen a
Schrott Metall auf weißem Hintergrund -Close Up Stahlspäne
0010 Weibliche Hand hält einen Haarlockenwickler in schwarz auf einem. ..
..Weibliche Hand hält einen Lockenwickler in Schwarz auf einem rosa isolierten Hintergrund Nahaufnahme.
Küchenutensilien kulinarisches konzept, top-down-ansicht, kopierraum für einen text – ferrum element stock-fotos und bilderKüchenutensilien kulinarisches Konzept, Top-Down-Ansicht,…
Юнгер Манн Эрклиммт Клеттерштайгванд
Металлопрофиль и изображения металлических элементовМеталлопрофиль и профиль металлического профиля
verschieden edelstahl-produkte. – фотоэлементы и изображения
Metall-Profilen und Rohren. Verschiedene Edelstahl-Produkte.
Metallarbeiter mit schleifmaschine — фото и изображения металлических элементовMetallarbeiter mit Schleifmaschine
dunkelblaue metallmuster hintergrund — железные элементы стоковые фотографии и изображенияdunkelblaue Metallmuster Hintergrund
Hintergrund Metallmuster
alte verlassene erzmine. Ростигерская тележка. gewinnung von Mineralien. – элемент железа фото и изображения
gewinnung von Mineralien. – элемент железа фото и изображенияСтарая версия Erzmine. Тележка Ростигер. Gewinnung von…
späne – ferrum element stock-fotos und bilderSpäne
Stahlspäne
zwei chrom-hanteln isoliert auf weißemhintergrund. спорт – железный элемент, стоковые фотографии и фотографииZwei Chrom-Hanteln isoliert auf weißem Hintergrund. Спортаусрюстун
Zwei verchromte Hanteln isoliert auf weißem Hintergrund. Sportausrüstung. 3D-рендеринг
schlichte fabrikwand aus metallplatten – ferrum element stock-fotos und bilderschlichte Fabrikwand as Metallplatten
Eine directe Frontalansicht aus eine Fabrikwand aus schweren Metallplatten, die mit Nieten zusammengehalten wird. Das Bild шляпа ein Seitenverhältnis фон 16:9.
blaues Hintergrund-Metalmuster – железный элемент стоковые фото и изображенияblaues Hintergrund-Metallmuster
autoikgetriebe im querschnitt. – фотоэлементы и изображения
– фотоэлементы и изображенияAutomatikgetriebe im Querschnitt.
Automatikgetriebe im Querschnitt. Automobilgetriebe auf weißem Hintergrund.
silber rohre isoliert auf weißemhintergrund mit reflexion boden. 3 d – ferrum element stock-fotos und bilderSilber Rohre isoliert auf weißem Hintergrund mit Reflexion Boden.
flansch aus edelstahl – железный элемент стоковые фото и изображенияFlansch aus Edelstahl
Studioaufnahme von Edelstahl-Flanschring, Blautönen
hervorhebung des chemischen elements eisen im periodensystem der elemente. 3D-рендеринг – фото и изображения металлических элементовХимические элементы Eisen im Periodensystem der…
viele arten von metalldetails industriedesign hintergrund, engineering-technologie-konzept – ferrum element stock-fotos und bilderViele Arten von MetallDetails Industriedesign Hintergrund,…
Металлургический рынок вторичной переработки. – ferrum element Stock-grafiken, -clipart, -cartoons und -symbole
– ferrum element Stock-grafiken, -clipart, -cartoons und -symboleРесайклинг-Металлмаркет.
stahlarbeiter auf cnc-plasmaschneidermaschine – ferrum element stock-fotos und bilderStahlarbeiter auf CNC-Plasmaschneidermaschine
nahaufnahme von schmiedeeisernen arbeiten auf einem friedhof – ferrum element stock-fotos und bilderNahaufnahme von schmiedeeisernen Arbeiten auf einem Friedhof
von 100Fe Информация об элементе железа: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура железа
Твердотельная структура железа Объемно-центрированная кубическая .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | b | c |
|---|---|---|
| 286,65 пм | 286,65 пм | 286,65 пм |
и углы между ними Углы решетки (альфа, бета и гамма).
| Alpha | Beta | Gamma |
|---|---|---|
| π/2 | π/2 | π/2 | Номер пространственной группы | 229 |
| Кристаллическая структура | Объемно-центрированная кубическая |
Атомные и орбитальные свойства железа (Квантовые числа)
5 D 4 .
| Атомный номер | 26 | |
| Число электронов (бесплатно) | 26 | |
| Количество протонов | 26 | |
| Массовый номер | 56 | |
| Количество нейтронов | 30 | |
| Структура Shell (электроны на энергетический уровень) | 4 2, | |
| . | Электронная конфигурация | [AR] 3D6 4S2 |
| Валентные электроны | 3D6 4S2 | |
| Валентность (валентность) | 3 | |
| GAINTATE.0025 | 2, 3 | |
| Степени окисления | -4, -2, -1, 0, 1, 2, 3, 4, 5, 6, 7 | |
| Символ атомного термина (квантовые числа) | 5 D 4
БОР Атомная модель железа – Электроны на уровне энергии
Основное состояние Электронная конфигурация железного атом
Abbrevied Electronic Abstiend Abbrevicated Electronic Absired Abbrevicated a Arne -Abstiend Abbrevicatied a Arne -Abstiend Abbrevatied a Arne -Abstiend Abbrevatied of Artom
169. электронная конфигурация атома нейтрального железа [Ar] 3d6 4s2. Часть конфигурации железа, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 3d6 4s2, электроны в самой внешней оболочке, определяют химические свойства элемента.
электронная конфигурация атома нейтрального железа [Ar] 3d6 4s2. Часть конфигурации железа, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 3d6 4s2, электроны в самой внешней оболочке, определяют химические свойства элемента.Полная электронная конфигурация нейтрального железа
Полная электронная конфигурация основного состояния атома железа. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d6 4s2
Принцип запрета Паули и правило Хунда.

Атомная структура железа
Атомный радиус железа составляет 156 пм, а ковалентный радиус — 125 пм.
| Вычисленный атомный радиус | 156 пм (1,56 Å) |
| Радиус атомного радиуса. Waals Radius | – |
| Neutron Cross Section | 2.56 |
| Neutron Mass Absorption | 0.0015 |
Atomic Spectrum of Iron
Химические свойства железа: Энергия ионизации железа и сродство к электрону
Сродство к электрону железа составляет 15,7 кДж/моль.
| Valence | 3 |
| Electronegativity | 1.83 |
| ElectronAffinity | 15.7 kJ/mol |
Ionization Energy of Iron
Refer to table below for Ionization energies of Iron
| Ionization energy number | Enthalpy – kJ/mol |
|---|---|
| 1st | 762. 5 5 |
| 2nd | 1561.9 |
| 3rd | 2957 |
| 4th | 5290 |
| 5th | 7240 |
| .0025 | 22540 |
| 10th | 25290 |
| 11th | 28000 |
| 12th | 31920 |
| 13th | 34830 |
| 14th | 37840 |
| 15th | 44100 |
| 16th | 47206 |
| 17th | 122200 |
| 18th | 131000 |
| 131000 | |
| 0024 19th | 140500 |
| 20th | 152600 |
| 21st | 163000 |
| 22nd | 173600 |
| 23rd | 188100 |
| 24th | 195200 |
| 25th | 851800 |
| 26th | 895161 |
Физические свойства железа
Физические свойства железа см. в таблице ниже
в таблице ниже
| Density | 7.874 g/cm3(when liquid at m.p density is $6.98 g/cm3) |
| Molar Volume | 7.0923 cm3/mol |
Elastic Properties
| Young Modulus | 211 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 82 GPA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль Bulk Modulus | 170 GPA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ratio | .9.29 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ratio | .9.29 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
.0072Hardness of Iron – Tests to Measure of Hardness of Element
Iron Электрические свойстваЖелезо является проводником электричества. Электрические свойства железа
Iron Heat and Conduction Properties
Магнитные свойства железа
Optical Properties of Iron
Акустические свойства железа
Термические свойства железа – энтальпии и термодинамика См.
Этальпии железа
|
