Таблица Менделеева online – Ga
Ga
31
3
18
8
2
69.723±4
4s24p1
Галлий
| Относительная электроотрицательность (по Полингу): | 1,82 |
| Температура плавления: | 302,93 К (29,8 °C) |
| Температура кипения: | 2 477 K |
| Теплопроводность: | 0 |
| Плотность: | 5,91 г/см3 |
| Открыт: | А. Гиосо и др. |
| Цвет в твёрдом состоянии: | |
| Тип: | Переходный металл |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f145s25p65d105f146s26p66d27s2 |
| Электронная формула: |
Ga – 1s2 2s2 2p6 Ga – [Ar] 4s2 3d10 4p1 |
| Валентность: | (+2). +3 +3 |
| Степени окисления: | 0, +III |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | |
| Электропроводность в тв. фазе: | |
| Ковалентный радиус: | |
| Атомный объем: | |
| Атомный радиус: | |
| Теплота распада: | |
| Теплота парообразования: | |
| Кристаллическая структура: |
Реклама
Изотопы
| Символ нуклида |
Z(p) | N(n) | Масса изотопа (а. е. м.) |
Период полураспада (T1/2) |
Спин и чётность ядра |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 56 |
31 | 25 | 55,99491 | 3+ | |
| 57Ga | 31 | 26 | 56,98293 | 1/2- | |
| 58Ga | 31 | 27 | 57,97425 | 2+ | |
| 59Ga | 31 | 28 | 58,96337 | 3/2- | |
| 60Ga | 31 | 29 | 59,95706 | 70 мс | 2+ |
| 61Ga | 31 | 30 | 60,94945 | 168 мс | 3/2- |
| 62Ga | 31 | 31 | 61,944175 | 116,18 мс | 0+ |
| 63Ga | 31 | 32 | 62,9392942 | 32,4 с | 3/2- |
| 64Ga | 31 | 33 | 63,9368387 | 2,627 мин | 0+ |
| 64mGa | 42,85 кэВ | 21,9 мкс | 2+ | ||
| 65Ga | 31 | 34 | 64,9327348 | 15,2 мин | |
| 66Ga | 31 | 35 | 65,931589 | 9,49 ч | 0+ |
| 67Ga | 31 | 36 | 66,9282017 | 3,2612 d | 3/2- |
| 68Ga | 31 | 37 | 67,9279801 | 67,71 мин | 1+ |
| 69Ga | 31 | 38 | 68,9255736 | стабилен | 3/2- |
| 70Ga | 31 | 39 | 69,9260220 | 21,14 мин | 1+ |
| 71 |
31 | 40 | 70,9247013 | стабилен | 3/2- |
| 72Ga | 31 | 41 | 71,9263663 | 14,095 ч | 3- |
| 72mGa | 119,66 кэВ | 39,68 мс | 0+ | ||
| 73Ga | 31 | 42 | 72,9251747 | 4,86 ч | 3/2- |
| 74Ga | 31 | 43 | 73,926946 | 8,12 мин | 3- |
| 74mGa | 59,571 кэВ | 9,5 с | |||
| 75Ga | 31 | 44 | 74,9265002 | 126 с | 3/2- |
| 76Ga | 31 | 45 | 75,9288276 | 32,6 с | 2+ |
| 77Ga | 31 | 46 | 76,9291543 | 13,2 с | 3/2- |
| 78Ga | 31 | 47 | 77,9316082 | 5,09 с | 3+ |
| 79Ga | 31 | 48 | 78,93289 | 2,847 с | 3/2- |
| 31 | 49 | 79,93652 | 1,697 с | 3 | |
| 81Ga | 31 | 50 | 80,93775 | 1,217 с | 5/2- |
| 82Ga | 31 | 51 | 81,94299 | 599 мс | 2 |
| 83Ga | 31 | 52 | 82,94698 | 308 мс | 3/2- |
| 84Ga | 31 | 53 | 83,95265 | 85 мс | |
| 85Ga | 31 | 84,95700 | 50 мс | 3/2- | |
| 86Ga | 31 | 55 | 85,96312 | 30 мс | |
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65. 38
38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
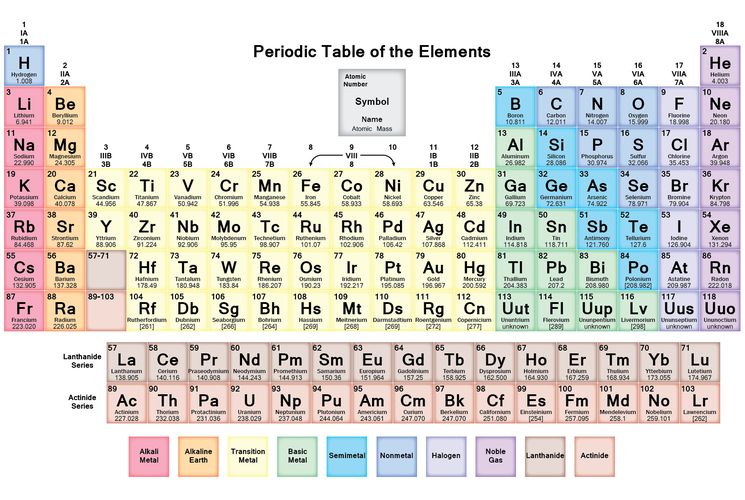
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree. ru • Электронный учебник
ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Галлий | Использование, свойства и факты
кристаллы галлия
Посмотреть все СМИ
- Ключевые люди:
- Поль-Эмиль Лекок де Буабодран
- Похожие темы:
- химический элемент элемент группы бора
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
галлий (Ga) , химический элемент, металл основной группы 13 (IIIa, или группы бора) периодической таблицы. Он сжижается чуть выше комнатной температуры.
Галлий был открыт (1875 г.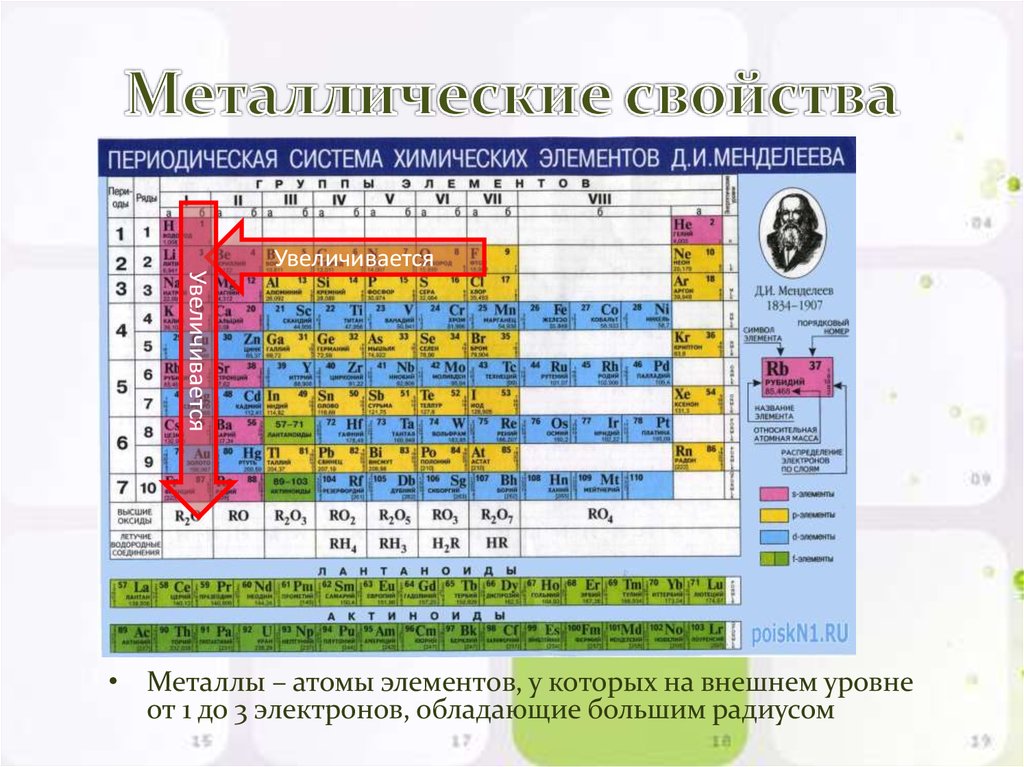 ) французским химиком Полем-Эмилем Лекоком де Буабодраном, который наблюдал его основные спектральные линии при исследовании материала, выделенного из цинковой обманки. Вскоре после этого он выделил металл и изучил его свойства, которые совпали с теми, которые русский химик Дмитрий Иванович Менделеев предсказал несколькими годами ранее для экаалюминия, тогда еще не открытого элемента, лежащего между алюминием и индием в его периодической таблице.
) французским химиком Полем-Эмилем Лекоком де Буабодраном, который наблюдал его основные спектральные линии при исследовании материала, выделенного из цинковой обманки. Вскоре после этого он выделил металл и изучил его свойства, которые совпали с теми, которые русский химик Дмитрий Иванович Менделеев предсказал несколькими годами ранее для экаалюминия, тогда еще не открытого элемента, лежащего между алюминием и индием в его периодической таблице.
Britannica Quiz
Периодическая таблица элементов
Хотя галлий широко распространен на поверхности Земли, он не встречается в свободном виде или в виде отдельных минералов, за исключением галлита CuGaS 2 , редкого и экономически незначительного. Его извлекают как побочный продукт из цинковой обманки, железного колчедана, боксита и германита.
Галлий серебристо-белого цвета и достаточно мягкий, чтобы его можно было разрезать ножом. Он приобретает голубоватый оттенок из-за поверхностного окисления. Галлий, необычный своей низкой температурой плавления (около 30 ° C [86 ° F]), также расширяется при затвердевании и легко переохлаждается, оставаясь жидким при температурах до 0 ° C (32 ° F). Галлий остается в жидкой фазе в диапазоне температур около 2000 ° C (около 3600 ° F) с очень низким давлением паров примерно до 1500 ° C (около 2700 ° F), что является самым длинным полезным диапазоном жидкости. любой элемент. Жидкий металл прилипает (смачивает) к стеклу и подобным поверхностям. Кристаллическая структура галлия орторомбическая. Природный галлий состоит из смеси двух стабильных изотопов: галлия-69.(60,4 процента) и галлия-71 (39,6 процента). Галлий рассматривался как возможная теплообменная среда в ядерных реакторах, хотя он имеет высокое сечение захвата нейтронов.
Галлий, необычный своей низкой температурой плавления (около 30 ° C [86 ° F]), также расширяется при затвердевании и легко переохлаждается, оставаясь жидким при температурах до 0 ° C (32 ° F). Галлий остается в жидкой фазе в диапазоне температур около 2000 ° C (около 3600 ° F) с очень низким давлением паров примерно до 1500 ° C (около 2700 ° F), что является самым длинным полезным диапазоном жидкости. любой элемент. Жидкий металл прилипает (смачивает) к стеклу и подобным поверхностям. Кристаллическая структура галлия орторомбическая. Природный галлий состоит из смеси двух стабильных изотопов: галлия-69.(60,4 процента) и галлия-71 (39,6 процента). Галлий рассматривался как возможная теплообменная среда в ядерных реакторах, хотя он имеет высокое сечение захвата нейтронов.
Металлический галлий стабилен в сухом воздухе. По химическому составу галлий несколько похож на алюминий, но медленно окисляется во влажном воздухе до образования защитной пленки. При горении на воздухе или в кислороде образует белый оксид Ga 2 O 3 .![]() Этот оксид можно восстановить до металла при нагревании при высоких температурах в водороде, а с металлическим галлием при 700 ° C (1300 ° F) он дает низший оксид Ga 9.0035 2 О. Не растворяется в холодной азотной кислоте, т. к., как и на влажном воздухе, образует защитную пленку из оксида галлия. Галлий не реагирует с водой при температуре до 100 ° C (212 ° F), но медленно реагирует с соляной и другими минеральными кислотами с образованием иона галлия Ga 3 + . Металл действительно растворяется в других кислотах с образованием солей галлия и растворяется в щелочах с выделением водорода с образованием галлатов, таких как [Ga(OH) 4 ] – , в котором в анионе появляется галлий. Галлий является амфотерным (т. е. реагирует либо как кислота, либо как основание, в зависимости от обстоятельств), реагируя с растворами гидроксида натрия и калия с образованием галлата и газообразного водорода. Галогены атакуют его энергично.
Этот оксид можно восстановить до металла при нагревании при высоких температурах в водороде, а с металлическим галлием при 700 ° C (1300 ° F) он дает низший оксид Ga 9.0035 2 О. Не растворяется в холодной азотной кислоте, т. к., как и на влажном воздухе, образует защитную пленку из оксида галлия. Галлий не реагирует с водой при температуре до 100 ° C (212 ° F), но медленно реагирует с соляной и другими минеральными кислотами с образованием иона галлия Ga 3 + . Металл действительно растворяется в других кислотах с образованием солей галлия и растворяется в щелочах с выделением водорода с образованием галлатов, таких как [Ga(OH) 4 ] – , в котором в анионе появляется галлий. Галлий является амфотерным (т. е. реагирует либо как кислота, либо как основание, в зависимости от обстоятельств), реагируя с растворами гидроксида натрия и калия с образованием галлата и газообразного водорода. Галогены атакуют его энергично.
В большинстве своих соединений галлий имеет степень окисления +3, а в некоторых +1 (например, оксид Ga 2 O). Нет никаких доказательств наличия подлинных соединений галлия в его состоянии +2. «Дигалогениды», например, содержат Ga + и Ga 3+ в соотношении один к одному. С элементами группы 15 (Va) азотом, фосфором, мышьяком и сурьмой и элементами группы 13 алюминием и индием галлий образует соединения, например, нитрид галлия, GaN, арсенид галлия, GaAs и фосфид арсенида индия-галлия, InGaAsP, которые обладают ценными полупроводниковыми и оптоэлектронными свойствами. Некоторые из этих соединений используются в твердотельных устройствах, таких как транзисторы и выпрямители, а некоторые составляют основу светоизлучающих диодов и полупроводниковых лазеров. Нанопроволоки GaN были синтезированы и использованы в электронных и оптоэлектронных наносистемах (то есть в очень маленьких электронных устройствах, использующих свет в своей работе). Из галогенидов только трифторид галлия является ионным; другие имеют молекулярные решетки, содержащие димерные молекулы, с формулой Ga 2 Х 6 .
Нет никаких доказательств наличия подлинных соединений галлия в его состоянии +2. «Дигалогениды», например, содержат Ga + и Ga 3+ в соотношении один к одному. С элементами группы 15 (Va) азотом, фосфором, мышьяком и сурьмой и элементами группы 13 алюминием и индием галлий образует соединения, например, нитрид галлия, GaN, арсенид галлия, GaAs и фосфид арсенида индия-галлия, InGaAsP, которые обладают ценными полупроводниковыми и оптоэлектронными свойствами. Некоторые из этих соединений используются в твердотельных устройствах, таких как транзисторы и выпрямители, а некоторые составляют основу светоизлучающих диодов и полупроводниковых лазеров. Нанопроволоки GaN были синтезированы и использованы в электронных и оптоэлектронных наносистемах (то есть в очень маленьких электронных устройствах, использующих свет в своей работе). Из галогенидов только трифторид галлия является ионным; другие имеют молекулярные решетки, содержащие димерные молекулы, с формулой Ga 2 Х 6 . Сульфид (GaS), селенид (GaSe) и теллурид (GaTe), полученные непосредственно комбинацией элементов при высокой температуре, являются диамагнитными и содержат галлий-галлиевые звенья с четырьмя положительными зарядами (Ga-Ga) 4+ , в решетке слоев. Гидроксид формулы Ga(OH) 3 является амфотерным; его осаждают из растворов солей галлия гидроксидами щелочных металлов.
Сульфид (GaS), селенид (GaSe) и теллурид (GaTe), полученные непосредственно комбинацией элементов при высокой температуре, являются диамагнитными и содержат галлий-галлиевые звенья с четырьмя положительными зарядами (Ga-Ga) 4+ , в решетке слоев. Гидроксид формулы Ga(OH) 3 является амфотерным; его осаждают из растворов солей галлия гидроксидами щелочных металлов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
| atomic number | 31 |
|---|---|
| atomic weight | 69.723 |
| melting point | 29.78 °C (85.6 °F) |
| boiling point | 2,403 ° C (4357 °F) |
| удельный вес | 5,904 (при 29,6 °C [85,3 °F]) |
| степень окисления | +3 |
| [Ar]3 d 10 4 s 2 4 p 1 |
The Editors of Encyclopaedia Britannica This article was most recently revised and updated by Erik Gregersen.
Факты о галлии | Live Science
Когда вы совершаете покупку по ссылкам на нашем сайте, мы можем получать партнерскую комиссию. Вот как это работает.
Кристаллы 99,999% галлия, выращенные в лаборатории (Изображение предоставлено: foobar/Creative Commons)Галлий — мягкий металл серебристого цвета, используемый в основном в электронных схемах, полупроводниках и светоизлучающих диодах (СИД). Он также полезен в высокотемпературных термометрах, барометрах, фармацевтических препаратах и тестах ядерной медицины. Элемент не имеет известной биологической ценности.
Природный элемент
В природе галлий никогда не встречается в виде свободного элемента и не может быть обнаружен в значительных количествах ни в каких минералах. Скорее, он присутствует в следовых количествах в различных соединениях, включая цинковые руды и бокситы. По весу галлий составляет около 0,0019процентов земной коры, согласно PeriodicTable.com. Однако его легко получить плавлением, и, согласно Chemicool, большая часть коммерческого галлия извлекается как побочный продукт производства алюминия и цинка. Крупнейшими производителями галлия являются Австралия, Россия, Франция и Германия.
Однако его легко получить плавлением, и, согласно Chemicool, большая часть коммерческого галлия извлекается как побочный продукт производства алюминия и цинка. Крупнейшими производителями галлия являются Австралия, Россия, Франция и Германия.
Только факты
- Атомный номер (количество протонов в ядре): 31
- Атомный символ (в периодической таблице элементов): Ga
- Атомный вес (средняя масса атома): 69.723
- Плотность: 5,91 г на кубический сантиметр
- Фаза при комнатной температуре: твердая
- Температура плавления: 85,57 градусов по Фаренгейту (29,76 градусов по Цельсию)
- атомы одного и того же элемента с разным числом нейтронов): 24, периоды полураспада которых известны
- Наиболее распространенные изотопа: Два стабильных изотопа Ga-69 (естественное содержание 60,1 процента) и Ga-71 (естественное содержание 39,9 процента).
Уникальный металл
В периодической таблице элементов галлий относится к семейству боров (группа 13). ), который включает полуметаллический бор (B) и металлы алюминий (Al), галлий, индий (In) и таллий (Tl), согласно Chemistry LibreTexts. Все пять из этих элементов имеют три электрона на внешнем энергетическом уровне.
), который включает полуметаллический бор (B) и металлы алюминий (Al), галлий, индий (In) и таллий (Tl), согласно Chemistry LibreTexts. Все пять из этих элементов имеют три электрона на внешнем энергетическом уровне.
Галлий — это постпереходный металл. Это металлические элементы, расположенные между переходными металлами и металлоидами (неметаллами) в периодической таблице. Постпереходные металлы обладают некоторыми чертами переходных металлов, но имеют тенденцию быть более мягкими и иметь более плохую проводимость. К постпереходным металлам относятся некоторые элементы семейства бора — алюминий, индий и таллий, а также олово (Sn), свинец (Pb) и висмут (Bi).
Галлий обладает уникальными свойствами. Например, хотя при комнатной температуре (около 77 F/22 C) он твердый, он все же настолько мягкий, что его можно резать ножом. Кроме того, он имеет низкую температуру плавления 85,57 F (290,76 C) — менее чем на 10 градусов выше комнатной температуры — поэтому, если бы вы взяли в руки кусок галлия, он бы буквально растаял от тепла вашей руки. Затем, если вы поставите его обратно, он снова затвердеет.
Затем, если вы поставите его обратно, он снова затвердеет.
Даже при такой низкой температуре плавления температура кипения галлия довольно высока и составляет 3 999 F (2 204 C), что дает ему одно из самых высоких соотношений между температурой плавления и температурой кипения среди всех элементов. При низких температурах галлий представляет собой хрупкое твердое тело, которое довольно легко ломается и, подобно стеклу, разбивается раковисто (не следует естественным плоскостям разделения).
Использование
Галлий в основном используется в электронике. Фактически, около 95 процентов всего произведенного галлия используется для производства арсенида галлия (GaAs), соединения, используемого в микроволновых и инфракрасных цепях, полупроводниках и синих и фиолетовых светодиодах, согласно объяснению химии. Арсенид галлия может производить лазерный свет непосредственно из электричества и используется в солнечных панелях, в том числе в марсоходе Mars Exploration Rover. Соединение нитрида галлия (GaN) используется в качестве полупроводника в технологии Blu-ray, мобильных телефонах и датчиках давления для сенсорных переключателей.
Галлий легко связывается с большинством металлов и обычно используется для изготовления легкоплавких сплавов. Это один из четырех металлов (включая ртуть, рубидий и цезий), которые находятся в жидком состоянии при комнатной температуре или близкой к ней. Из этих четырех металлов галлий наименее реакционноспособен и наименее токсичен, что делает его наиболее безопасным и экологически чистым выбором для высокотемпературных термометров, барометров, систем теплопередачи, а также охлаждающих и нагревательных устройств.
Однако с жидким галлием довольно сложно работать, так как он прилипает к стеклу, коже и большинству других материалов (кроме графита, кварца и тефлона). Он также расширяется при замерзании, поэтому его нельзя хранить в стеклянных контейнерах.
Галлий также используется в некоторых фармацевтических и радиофармацевтических препаратах. Например, радиоактивный изотоп Ga-67 используется в качестве теста ядерной медицины для выявления воспаления, инфекции или рака в организме.
Нитрат галлия используется во многих фармацевтических препаратах и для лечения гиперкальциемии, заболевания, которое может привести к росту опухолей костей. Галлий также был предложен для лечения рака, инфекционных заболеваний и воспалительных заболеваний. Тем не менее, согласно Chemistry LibreTexts, воздействие большого количества галлия может вызвать раздражение горла или грудной клетки, а пары могут привести к некоторым серьезным заболеваниям.
Открытие
До открытия галлия его предсказал русский химик и изобретатель Дмитрий Менделеев, создатель периодической таблицы элементов. Он назвал отсутствующий элемент эка-алюминием, потому что знал, что в таблице Менделеева он будет находиться ниже алюминия в ячейке 31, согласно Chemicool.
Этот элемент был впервые открыт французским химиком Полем-Эмилем Лекоком де Буабодраном в 1875 году, который изучал спектры химических элементов в течение 15 лет (спектры — это линии, образующиеся при нагревании химических элементов), согласно объяснению химии. . Поскольку каждый элемент создает свой собственный характерный набор линий или спектров, этот метод был надежным способом идентификации элементов.
. Поскольку каждый элемент создает свой собственный характерный набор линий или спектров, этот метод был надежным способом идентификации элементов.
Лекок де Буабодран задался вопросом, можно ли найти элемент 31 в цинковых рудах. Цинк, имеющий атомный номер 30, находится рядом с галлием в периодической таблице. В августе 1875 г. с помощью спектроскопа Лекок де Буабодран действительно обнаружил некоторое количество галлия, но только в очень небольших количествах. Он сообщил, что спектр нового элемента состоит из узкого, хорошо видимого фиолетового луча, согласно «Объяснению химии».
Позднее в том же году Лекок де Буабодран получил чистый галлий путем электролиза гидроксида галлия в гидроксиде калия, согласно данным лаборатории Джефферсона. Затем горняки передали Лекоку де Буабодрану несколько тонн цинковой руды для его исследований. Из этой руды он смог произвести несколько граммов почти чистого галлия, согласно объяснению химии. Лекок де Буабодран предложил для нового элемента название «галлий», которое происходит от латинского слова «Gallia», означающего «Франция».
Кто знал?
- Жидкий галлий нельзя хранить в стеклянных или металлических контейнерах, поскольку при замерзании он расширяется на 3,1 процента.
- Галлий имеет самый большой запас жидкости среди всех металлов.
- Нейтринная обсерватория в Италии использует большое количество трихлорида галлия для изучения солнечных нейтрино, образующихся на Солнце. По данным Университета Висконсин-Мэдисон, нейтрино — это частицы, созданные в первую секунду существования Вселенной — даже раньше атомов — и постоянно образующиеся в результате ядерных реакций Солнца и других звезд.
- В чистом виде галлий имеет ярко-серебристый цвет. В твердом состоянии он сине-серый.
- Еще одной необычной особенностью галлия является то, что он довольно легко переохлаждается. Переохлаждение – это охлаждение вещества ниже точки его замерзания без превращения его в твердое состояние.
- По данным LibreTexts, примерно 95 процентов потребления галлия приходится на электронную промышленность.


