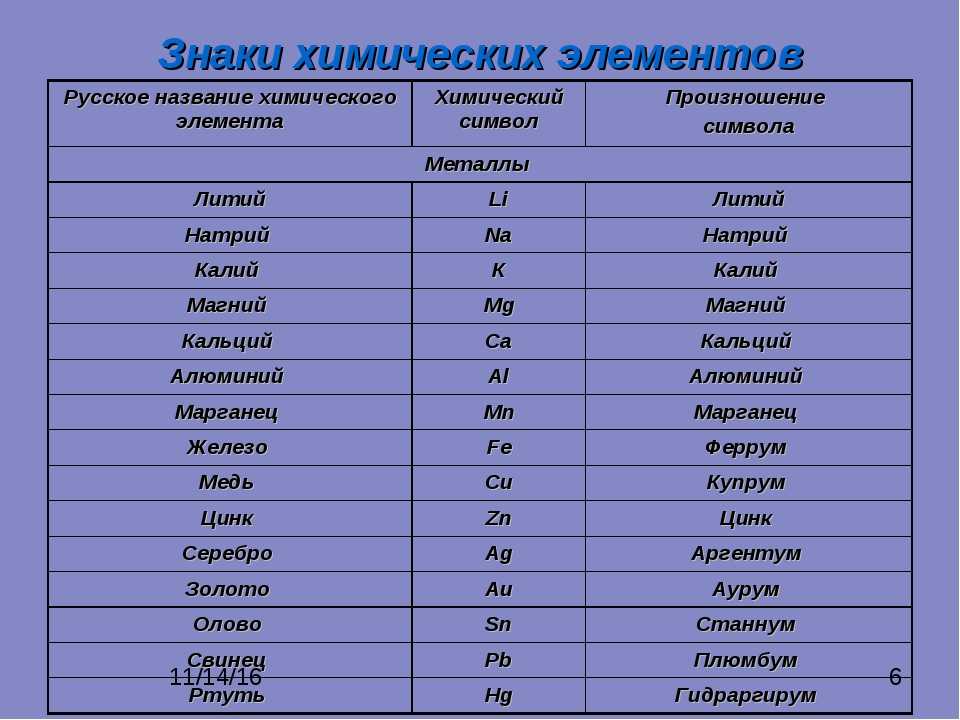
названия, символы и произношение символов
Ниже приведены русские и латинские названия химических элементов, символы химических элементов и произношение символов. Чтобы правильно произносить названия и символы химических элементов на русском языке в таблице приведены названия с проставленными ударениями.
Символ | Произношение | По-русски | По-латински |
| N | эн | Азо́т | Nitrogenium |
| Ac | акти́ний | Акти́ний | Actinium |
| Al | алюми́ний | Алюми́ний | Aluminium |
| Am | амери́ций | Амери́ций | Americium |
| Ar | арго́н | Арго́н | Argon |
| At | аста́т | Аста́т | Astatum |
| Ba | ба́рий | Barium | |
| Be | бери́ллий | Бери́ллий | Beryllium |
| Bk | бе́рклий | Бе́рклий | Berkelium |
| B | бор | Бор | Borum |
| Bh | бо́рий | Бо́рий | Bohrium |
| Br | бром | Бром | Bromium |
| V | вана́дий | Вана́дий | Vanadium |
| Bi | ви́смут | Ви́смут | Bismuthum |
| H | аш | Водоро́д | Hydrogenium |
| W | вольфра́м | Вольфра́м | Wolframium |
| Gd | гадоли́ний | Гадоли́ний | Gadolinium |
| Ga | га́ллий | Га́ллий | Gallium |
| Hf | га́фний | Га́фний | Hafnium |
| He | ге́лий | Ге́лий | Helium |
| Ge | герма́ний | Герма́ний | Germanium |
| Ho | го́льмий | Го́льмий | Holmium |
| Ds | дармшта́дтий | Дармшта́дтий | Darmstadtium |
| Dy | диспро́зий | Диспро́зий | Dysprosium |
| Db | ду́бний | Ду́бний | Dubnium |
| Eu | евро́пий | Евро́пий | Europium |
| Fe | фе́ррум | Желе́зо | Ferrum |
| Au | а́урум | Зо́лото | Aurum |
| In | и́ндий | И́ндий | Indium |
| I | йод | Йод | Iodium |
| Ir | ири́дий | Ири́дий | Iridium |
| Yb | итте́рбий | Итте́рбий | Ytterbium |
| Y | и́ттрий | И́ттрий | Yttrium |
| Cd | ка́дмий | Ка́дмий | Cadmium |
| K | ка́лий | Ка́лий | Kalium |
| Cf | калифо́рний | Калифо́рний | Californium |
| Ca | ка́льций | Ка́льций | Calcium |
| O | о | Кислоро́д | Oxygenium |
| Co | ко́бальт | Ко́бальт | Cobaltum |
| Cn | коперни́ций | Коперни́ций | Copernicium |
| Si | сили́циум | Кре́мний | Silicium |
| Kr | крипто́н | Крипто́н | Krypton |
| Xe | ксено́н | Ксено́н | Xenon |
| Cm | кю́рий | Кю́рий | Curium |
| La | ланта́н | Ланта́н | Lanthanum |
| Lv | ливермо́рий | Ливермо́рий | Livermorium |
| Li | ли́тий | Ли́тий | Lithium |
| Lr | лоуре́нсий | Лоуре́нсий | Lawrencium |
| Lu | люте́ций | Люте́ций | Lutetium |
| Mg | ма́гний | Ма́гний | Magnesium |
| Mn | ма́рганец | Ма́рганец | Manganum |
| Cu | ку́прум | Медь | Cuprum |
| Mt | мейтне́рий | Мейтне́рий | Meitnerium |
| Md | менделе́вий | Менделе́вий | Mendelevium |
| Mo | молибде́н | Молибде́н | Molybdaenum |
| Mc | моско́вий | Моско́вий | Moscovium |
| As | арсе́никум | Мышья́к | Arsenicum |
| Na | на́трий | На́трий | |
| Nd | неоди́м | Неоди́м | Neodymium |
| Ne | нео́н | Нео́н | Neon |
| Np | непту́ний | Непту́ний | Neptunium |
| Ni | ни́кель | Ни́кель | Niccolum |
| Nb | нио́бий | Нио́бий | Niobium |
| Nh | нихо́ний | Нихо́ний | Nihonium |
| No | нобе́лий | Нобе́лий | Nobelium |
| Og | оганесо́н | Оганесо́н | Oganesson |
| Sn | ста́ннум | О́лово | Stannum |
| Os | о́смий | О́смий | Osmium |
| Pd | палла́дий | Палла́дий | Palladium |
| Pt | пла́тина | Пла́тина | Platinum |
| Pu | плуто́ний | Плуто́ний | Plutonium |
| Po | поло́ний | Поло́ний | Polonium |
| Pr | празеоди́м | Празеоди́м | Praseodymium |
| Pm | проме́тий | Проме́тий | Promethium |
| Pa | протакти́ний | Протакти́ний | Protactinium |
| Ra | ра́дий | Ра́дий | Radium |
| Rn | радо́н | Радо́н | Radon |
| Rf | резерфо́рдий | Резерфо́рдий | Rutherfordium |
| ре́ний | Ре́ний | Rhenium | |
| Rg | рентге́ний | Рентге́ний | Roentgenium |
| Rh | ро́дий | Ро́дий | Rhodium |
| Hg | гидра́ргирум | Ртуть | Hydrargyrum |
| Rb | руби́дий | Руби́дий | Rubidium |
| Ru | руте́ний | Руте́ний | Ruthenium |
| Sm | сама́рий | Сама́рий | Samarium |
| Pb | плю́мбум | Свине́ц | Plumbum |
| Se | селе́н | Селе́н | Selenium |
| S | эс | Се́ра | Sulfur |
| арге́нтум | Серебро́ | Argentum | |
| Sg | сибо́ргий | Сибо́ргий | Seaborgium |
| Sc | ска́ндий | Ска́ндий | Scandium |
| Sr | стро́нций | Стро́нций | Strontium |
| Sb | сти́биум | Сурьма́ | Stibium |
| Tl | та́ллий | Та́ллий | Thallium |
| Ta | танта́л | Танта́л | Tantalum |
| Te | теллу́р | Теллу́р | Tellurium |
| Ts | теннесси́н | Теннесси́н | Tennessium |
| Tb | те́рбий | Те́рбий | Terbium |
| Tc | техне́ций | Техне́ций | Technetium |
| Ti | тита́н | Тита́н | Titanium |
| Th | то́рий | То́рий | Thorium |
| Tm | ту́лий | Ту́лий | Thulium |
| C | цэ | Углеро́д | Carboneum |
| U | ура́н | Ура́н | Uranium |
| Fm | фе́рмий | Фе́рмий | Fermium |
| Fl | флеро́вий | Флеро́вий | Flerovium |
| P | пэ | Фо́сфор | Phosphorus |
| Fr | фра́нций | Фра́нций | Francium |
| F | фтор | Фтор | Fluorum |
| Hs | га́ссий | Ха́ссий | Hassium |
| Cl | хлор | Хлор | Chlorum |
| Cr | хром | Хром | Chromium |
| Cs | це́зий | Це́зий | Caesium |
| Ce | це́рий | Це́рий | Cerium |
| Zn | цинк | Цинк | Zincum |
| Zr | цирко́ний | Цирко́ний | Zirconium |
| Es | эйнште́йний | Эйнште́йний | Einsteinium |
| Er | э́рбий | Э́рбий | Erbium |
Периодическая система химических элементов Д.
 И. Менделеева. Знаки химических элементов
И. Менделеева. Знаки химических элементовЧасть 1
1. По горизонтали таблица Д.И. Менделеева делится на периоды, которые подразделяются на
а) малые, это периоды – 1, 2, 3
б) большие, это периоды – 4, 5, 6, 7
2. По вертикали таблица Д.И. Менделеева делится на группы, каждая из которых подразделяется на:
а) главную, или А группу
б) побочную, или В группу
3. Допишите
IA группа – это группа щелочных металлов
IIA группа – это группа щелчноземельных металлов
VIIA группа – это группа галогенов
VIIIA группа – это группа благородных или инертных газов
4. Аналогии языка химии с русским языком.
Русский язык Химический язык Буквы Химические знаки (символы) Слова Названия веществ Предложения Уравнения химических реакций
5. Дополните таблицу “Названия и знаки элементов”.
Дополните таблицу “Названия и знаки элементов”.
6. Примеры названий химических элементов (в скобках укажите химический знак) в соответствии с этимологическими источниками.
1) Свойства простых веществ
Водород (H), Кислород (O), Фтор (F)
2) Астрономия
Селен (Se), Теллур (Te), Уран (U)
3) География
Германий (Ge), Галлий (Ga), Полоний (Po)
4) Древнегреческие мифы
Тантар (Ta), Прометий (Pm), Лютеций (Lu)
5) Великие ученые
Кюрий (Cm), Менделевий (Md), Резерфордий (Rt)
Часть 2
1. Установите соответствие между положением химического элемента в Периодической системе Д.И. Менделеева и химическим знаком.
Ответ: А-5, Б-1, В-2, Г-4
2. Выберите символы или названия химических элементов одного большого периода. Из букв, соответствующих правильным ответам, вы составите названия металла, который используется для изготовления бенгальских огней: магний.
3. Впишите в соответствующие столбцы названия следующих химических элементов: Cl, He, Br, Ne, Li, I, K, Ba, Ca, Na, Xe, Sr.
Щелочные металлы Щелочноземельный металлы Галогены Благородные газы Литий Барий Хлор Гелий Калий Кальций Бром Неон Натрий Стронций Йод Ксенон
4. Заполните пропуски в логической схеме.
Химический элемент (H, O) – химическая реакция (H2O) – химическое получение (2H2O = 2H2 + O2)
5. Сделайте обощение:
Химические элементы – углерод, кремний, олово, свинец – относятся к IVA группе.
6. В левую колонку таблицы запишите, по какому признаку химические элементы разделены на две группы.
Металлы Цинк, медь, натрий, золото, серебро, железо Неметаллы Хлор, фтор, водород, кремний, углерод, азот
7. Установите соответствие между произношением и химическим знаком (символом).
Ответ: А-4, Б-6, В-2, Г-7, Д-5, Е-1
8. Вычеркните лишнее:
кюрий, менделевий, бром, эйнштейний
9. Общий этимологический источник названий химических элементов:
U, Te, Se – это планетарий
10. В честь различных государств или частей света названы элементы:
Германий, галлий, франций, дубний
Элементаль – Элемент Гелий
Предыдущий элемент
(водород)
Периодическая таблица элементов
Следующий элемент
(литий)
Таблица элементов
Элемент гелий
[щелчок для данных изотопа]
Helium
2Hehelium4. 002602
002602Атомный номер: 2
Атомный вес: 4.002602
. Точка смешанного: 0,95 K (-27772.22.222.22.222.122.22.122.22.12.2.22.222.22.12.2.22.22.22.22.22.2.22.2.2.22.22.22.22.22.22.22.22.22.22.22.2.22.22.2.22.22.22.22.2. -458,0°F)
Температура кипения: 4,22 K (-268,93°C или -452,07°F)
Плотность: 0,0001785 грамм на кубический сантиметр
Фаза при комнатной температуре: Газ
Классификация элемента: Неметалл
30 Номер периода: 0Номер группы: 18
Название группы: Благородный газ
Что в названии? Для греческого бога солнца Гелиос .
Что сказать? Гелий произносится как HEE-lee-em .
История и использование:
Гелий, второй по распространенности элемент во Вселенной, был обнаружен на Солнце раньше, чем на Земле. Пьер-Жюль-Сезар Янссен, французский астроном, заметил желтую линию в солнечном спектре при изучении полного солнечного затмения в 1868 году. Сэр Норман Локьер, английский астроном, понял, что эта линия с длиной волны 587,49нанометров, не мог быть получен ни одним известным в то время элементом.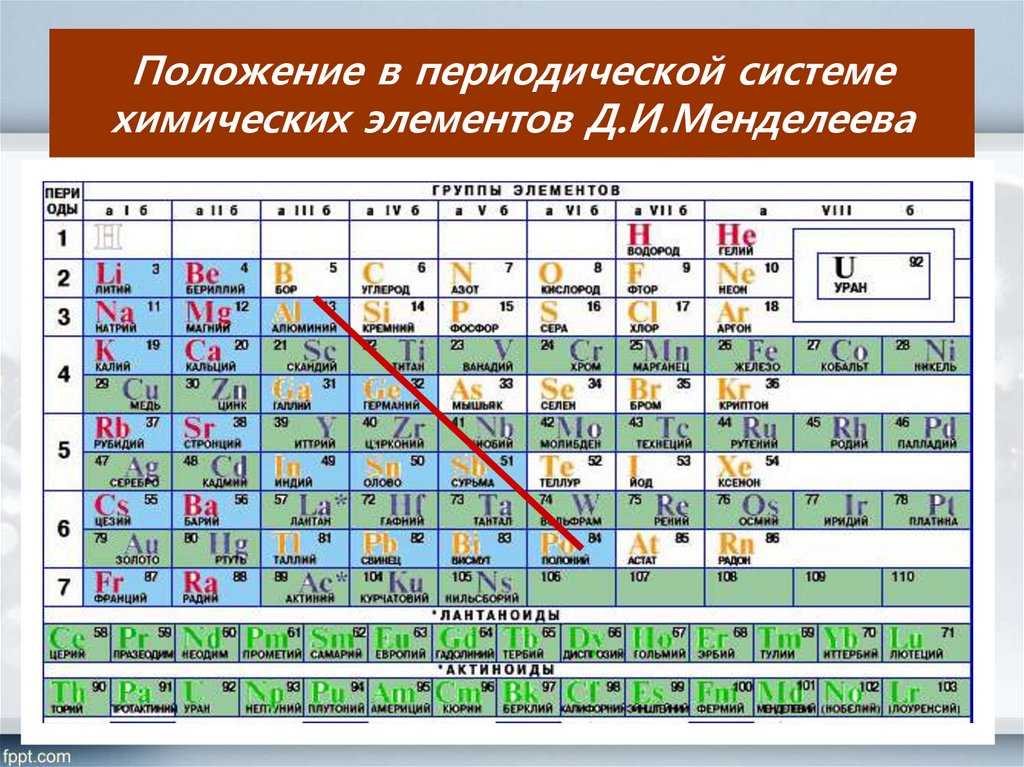 Была выдвинута гипотеза, что за это загадочное желтое излучение ответственен новый элемент на Солнце. Этот неизвестный элемент Локьер назвал гелием.
Была выдвинута гипотеза, что за это загадочное желтое излучение ответственен новый элемент на Солнце. Этот неизвестный элемент Локьер назвал гелием.
Поиски гелия на Земле закончились в 1895 году. Сэр Уильям Рамсей, шотландский химик, провел эксперимент с минералом, содержащим уран, под названием клевит. Он подверг клевит воздействию минеральных кислот и собрал образовавшиеся газы. Затем он отправил образец этих газов двум ученым, Локьеру и сэру Уильяму Круксу, которые смогли идентифицировать в нем гелий. Два шведских химика, Нильс Ланглет и Пер Теодор Клив, независимо друг от друга обнаружили гелий в клевите примерно в то же время, что и Рамзи.
Гелий составляет около 0,0005% земной атмосферы. Это следовое количество гелия не связано гравитацией с Землей и постоянно теряется в космосе. Земной атмосферный гелий заменяется распадом радиоактивных элементов в земной коре. Альфа-распад, один из видов радиоактивного распада, производит частицы, называемые альфа-частицами. Альфа-частица может стать атомом гелия, если захватит два электрона из своего окружения.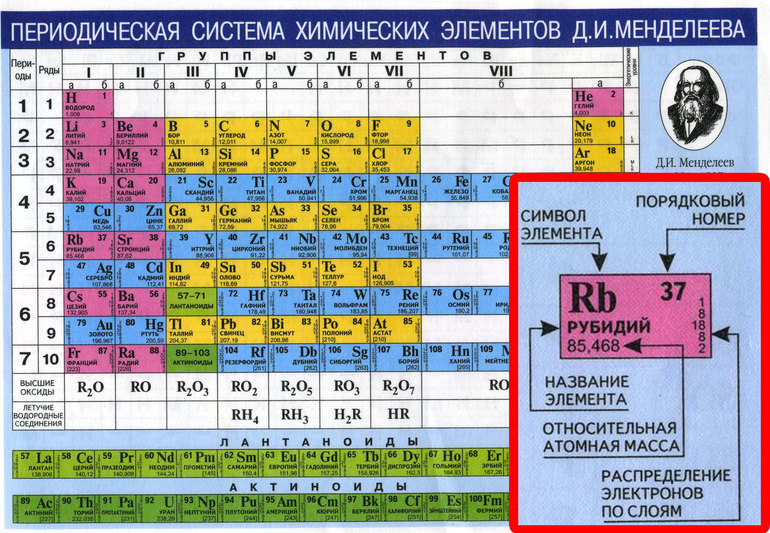 Этот новообразованный гелий в конечном итоге может попасть в атмосферу через трещины в земной коре.
Этот новообразованный гелий в конечном итоге может попасть в атмосферу через трещины в земной коре.
Гелий добывается в коммерческих целях из месторождений природного газа, в основном из Техаса, Оклахомы и Канзаса. Газообразный гелий используется для надувания дирижаблей, научных шаров и шаров для вечеринок. Он используется в качестве инертного экрана при дуговой сварке, для герметизации топливных баков ракет на жидком топливе и в сверхзвуковых аэродинамических трубах. Гелий в сочетании с кислородом создает безазотную атмосферу для глубоководных дайверов, чтобы они не страдали от состояния, известного как азотный наркоз. Жидкий гелий является важным криогенным материалом и используется для изучения сверхпроводимости и создания сверхпроводящих магнитов. Лаборатория Джефферсона Министерства энергетики использует большое количество жидкого гелия для работы своего сверхпроводящего ускорителя электронов.
Гелий — инертный газ, который трудно сочетается с другими элементами. Нет известных соединений, содержащих гелий, хотя предпринимаются попытки получить дифторид гелия (HeF 2 ).
Оценочное содержание в земной коре: 8×10 -3 миллиграмм на килограмм
Расчетное количество в океане: 7×10 -6 миллиграмм на литр
Количество стабильных изотопов: 2 (Просмотреть все данные по энергии ионизации)
: 24,587 эВСостояния окисления: 0
Конфигурация электронной оболочки: | 1S 2 |
Цитата и связывания информации
Для вопросов об этой странице, пожалуйста, свяжитесь с Steve Gagnon.
Простая английская Википедия, бесплатная энциклопедия
Переключить оглавлениеИз простой английской Википедии, бесплатной энциклопедии
Поскольку гелий очень легкий, его выбирают для наполнения дирижаблей, таких как дирижабль Goodyear
Гелий — химический элемент. Он имеет химический символ He , атомный номер 2 и атомный вес около 4,002602. Существует 9 изотопов гелия, из которых только два стабильны. Это 3 He и 4 He. 4 Он, безусловно, самый распространенный изотоп.
Это 3 He и 4 He. 4 Он, безусловно, самый распространенный изотоп.
Гелий называют благородным газом, потому что он не смешивается регулярно с другими химическими веществами и не образует новых соединений. Он имеет самую низкую температуру кипения из всех элементов. Это второй по распространенности элемент во Вселенной после водорода, не имеющий ни цвета, ни запаха. Однако гелий светится красно-оранжевым цветом, если его поместить в электрическое поле. Гелий обычно ни с чем не реагирует. Астрономы обнаружили присутствие гелия в 1868 году, когда его спектр был идентифицирован в свете Солнца. [5] Это было до его открытия на Земле.
Гелий используется для наполнения воздушных шаров и дирижаблей, потому что его плотность легче воздуха. Он не горит, поэтому безопасен для такого использования. Он также используется в некоторых видах лампочек. Люди могут дышать гелием: из-за него их голоса звучат выше, чем обычно. Это шутка, но это опасно, так как если они слишком много вдохнут, гипоксия может их травмировать или убить, так как они не дышат нормальным воздухом. Вдыхание слишком большого количества гелия также может вызвать долгосрочные последствия для голосовых связок.
Вдыхание слишком большого количества гелия также может вызвать долгосрочные последствия для голосовых связок.
Гелий образуется в процессе ядерного синтеза на Солнце и в подобных ему звездах. Во время этого процесса два атома водорода сливаются вместе, образуя один атом гелия. На Земле это происходит в результате естественного радиоактивного распада тяжелых радиоактивных элементов, таких как торий и уран, хотя есть и другие примеры. Альфа-частицы, испускаемые при таких распадах, состоят из ядер гелия-4.
Гелий был открыт французским астрономом Пьером Жансеном 18 августа 1868 года в виде ярко-желтой линии в спектре хромосферы Солнца. [6] [7] Предполагалось, что это натрий. В том же году английский астроном Норман Локьер также наблюдал его и обнаружил, что он вызван новым элементом. [7] [8] [9] Локьер и английский химик Эдвард Франкленд назвали элемент гелий, от греческого слова для Солнца, ἥλιος ( helios ). [9] [10]
[9] [10]
Гелий является вторым наименее реактивным благородным газом после неона. Это второй наименее реактивный из всех элементов. [11] Химически инертен и одноатомен во всех стандартных условиях. [7] Гелий является наименее растворимым в воде одноатомным газом. [12]
Гелий используется в качестве защитного газа при выращивании кристаллов кремния и германия, при получении титана и циркония, а также в газовой хроматографии, поскольку он инертен. [13] Гелий используется в качестве защитного газа при дуговой сварке. [7]
Гелий смешивают с кислородом и другими газами при глубоководных погружениях, поскольку он не вызывает азотного наркоза.
Гелий также используется для конденсации водорода и кислорода для производства ракетного топлива. Он используется для удаления топлива и окислителя из наземного вспомогательного оборудования перед запуском ракеты. Он используется для охлаждения жидкого водорода в космических аппаратах перед запуском ракеты. [13]
[13]
Гелий используется в качестве теплоносителя в некоторых ядерных реакторах, охлаждаемых газом. [14] Гелий также используется в некоторых жестких дисках. [15] Гелий при низких температурах используется в криогенике. [16]
Гелий стал редкостью на Земле. Если он попадет в воздух, он покинет планету. В отличие от водорода, который реагирует с кислородом с образованием воды, гелий не является реакционноспособным. Он остается газом. В течение многих лет после Закона о гелии 1925 г. США собирали гелий в Национальном гелиевом резерве. Американский гелий поступает из скважин в районе Великих равнин. В настоящее время Катар поставляет больше гелия, чем США.
Гелий-неоновый лазер
Несколько исследовательских организаций опубликовали заявления о нехватке и сохранении гелия. [17] [18] Эти организации выпустили политические рекомендации еще в 1995 г. и еще в 2016 г. , призывающие правительство Соединенных Штатов хранить и сохранять гелий из-за естественных ограничений на поставки гелия и уникальной природы элемента. . [17] [18] Для исследователей гелий незаменим, поскольку он необходим для получения очень низких температур. Гелий при низких температурах используется в криогенике и в некоторых криогенных приложениях. Жидкий гелий используется для охлаждения некоторых металлов до чрезвычайно низких температур, необходимых для сверхпроводимости, например, в сверхпроводящих магнитах для магнитно-резонансной томографии. [18]
, призывающие правительство Соединенных Штатов хранить и сохранять гелий из-за естественных ограничений на поставки гелия и уникальной природы элемента. . [17] [18] Для исследователей гелий незаменим, поскольку он необходим для получения очень низких температур. Гелий при низких температурах используется в криогенике и в некоторых криогенных приложениях. Жидкий гелий используется для охлаждения некоторых металлов до чрезвычайно низких температур, необходимых для сверхпроводимости, например, в сверхпроводящих магнитах для магнитно-резонансной томографии. [18]
- ↑ «Стандартный атомный вес: гелий». CIAAW. 1983.
- ↑ Шуен-Чен Хван, Роберт Д. Лейн, Дэниел А. Морган (2005). “Благородные газы”. Энциклопедия химической технологии Кирка Отмера . Уайли. стр. 343–383. дои: 10.1002/0471238961.07011230114.a01.
- ↑ Магнитная восприимчивость элементов и неорганических соединений, в Справочнике по химии и физике, 81-е издание, CRC press.

- ↑ Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4 .
- ↑ Исходя из этого местоположения, его название произошло от греческого слова «Солнце», гелиос .
- ↑ Кочхар, Раджеш (04 апреля 2013 г.). «Естественная история в Индии в 18 и 19 веках». Журнал биологических наук . 38 (2): 201–224. doi: 10.1007/s12038-013-9316-9. ISSN 0250-5991. PMID 23660654. S2CID 26271510. Архивировано из оригинала 26 мая 2022 г. Проверено 19 сентября 2020 г. .
- ↑ 7,0 7,1 7,2 7,3 Эмсли, Джон. (2001). Строительные блоки природы: руководство по элементам от А до Я . Оксфорд: Издательство Оксфордского университета. ISBN 0-19-850341-5 . OCLC 46984609 . Проверено 19 сентября 2020 г.
- ↑ «VIII. Уведомление о наблюдении спектра солнечного протуберанца Дж.
 Н. Локьером, эсквайром, в письме секретарю. Сообщено доктором Шарпи». Труды Лондонского королевского общества . 17 : 91–92. 1869-12-31. doi: 10.1098/rspl.1868.0011. ISSN 0370-1662. Архивировано из оригинала 08.08.2020. Проверено 19 сентября 2020 г. .
Н. Локьером, эсквайром, в письме секретарю. Сообщено доктором Шарпи». Труды Лондонского королевского общества . 17 : 91–92. 1869-12-31. doi: 10.1098/rspl.1868.0011. ISSN 0370-1662. Архивировано из оригинала 08.08.2020. Проверено 19 сентября 2020 г. . - ↑ 9.0 9.1 «гелий | Происхождение и значение гелия в онлайн-словаре этимологии» . www.etymonline.com . Архивировано из оригинала 27 августа 2020 г. Проверено 19 сентября 2020 г. .
- ↑ «Собрание Британской ассоциации в Эдинбурге». Природа . 4 (92): 261–278. 1871. Бибкод: 1871Natur…4..261.. doi:10.1038/004261a0. ISSN 0028-0836. S2CID 3963038. Архивировано из оригинала 08 мая 2020 г. Проверено 19 сентября 2020 г. .
- ↑ Леварс, Эррол. (2008). Чудеса моделирования: компьютерное предсказание новых молекул . [Дордрехт]: Спрингер. ISBN 978-1-4020-6973-4 . OCLC 314371890 . Проверено 19 сентября 2020 г.

- ↑ Вайс, Рэй Ф. (1971). «Растворимость гелия и неона в воде и морской воде». Журнал химических и инженерных данных . 16 (2): 235–241. дои: 10.1021/je60049a019. ISSN 0021-9568. Архивировано из оригинала 07 августа 2020 г. Проверено 19 сентября 2020 г. .
- ↑ 13.0 13.1 CRC справочник по химии и физике . Лиде, Дэвид Р., 1928– (86-е изд., 2005–2006 г.). Бока-Ратон: CRC Press. 2005 г. ISBN 0-8493-0486-5 . OCLC 61108810.
{{цитировать книгу}}: CS1 maint: другие (ссылка) - ↑ {{Cite book|url=https://www.worldcat.org/oclc/56111623%7Ctitle=Химическая энциклопедия Ван Ностранда.|others=Considine, Glenn D.|date=3 февраля 2005|isbn=0- 471-61525-0|издание=5th|местоположение=Хобокен, Нью-Джерси|oclc=56111623|дата доступа=20 сентября 2020 г.}
- ↑ Галлахер, Шон (04.11.2013). «HGST увеличивает емкость диска с наполненным гелием диском емкостью 6 ТБ» .
 Арс Техника . Архивировано из оригинала 07 июля 2017 г. Проверено 20 сентября 2020 г. .
Арс Техника . Архивировано из оригинала 07 июля 2017 г. Проверено 20 сентября 2020 г. . - ↑ “Руководство по LHC” (PDF). ЦЕРН. 2011-07-06. Архивировано из оригинала (PDF) 06 июля 2011 г. Проверено 9 сентября 2020 г.-20.
- ↑ 17,0 17,1 Американское физическое общество (1995). «Национальная политика». https://www.aps.org/policy/statements/95_3.cfm Архивировано 31 декабря 2017 г. в Wayback Machine.
- ↑ 18,0 18,1 18,2 Эппл, Деннис (1982). «Спор о хранении гелия: моделирование поставок природных ресурсов: сложный вопрос о хранении гелия представляет собой тематическое исследование сложных решений, связанных с использованием природных ресурсов». Американский ученый .
Периодическая таблица | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Н | Он | ||||||||||||||||||||||||||||||
| Ли | Быть | Б | С | Н | О | Ф | Не | ||||||||||||||||||||||||
| Нет данных | мг | Ал | Си | Р | С | Кл | Ар | ||||||||||||||||||||||||
| К | Са | СК | Ти | В | Кр | Мн | Фе | Ко | никель | медь | цинк | млрд лет | ГЭ | как | Се | руб.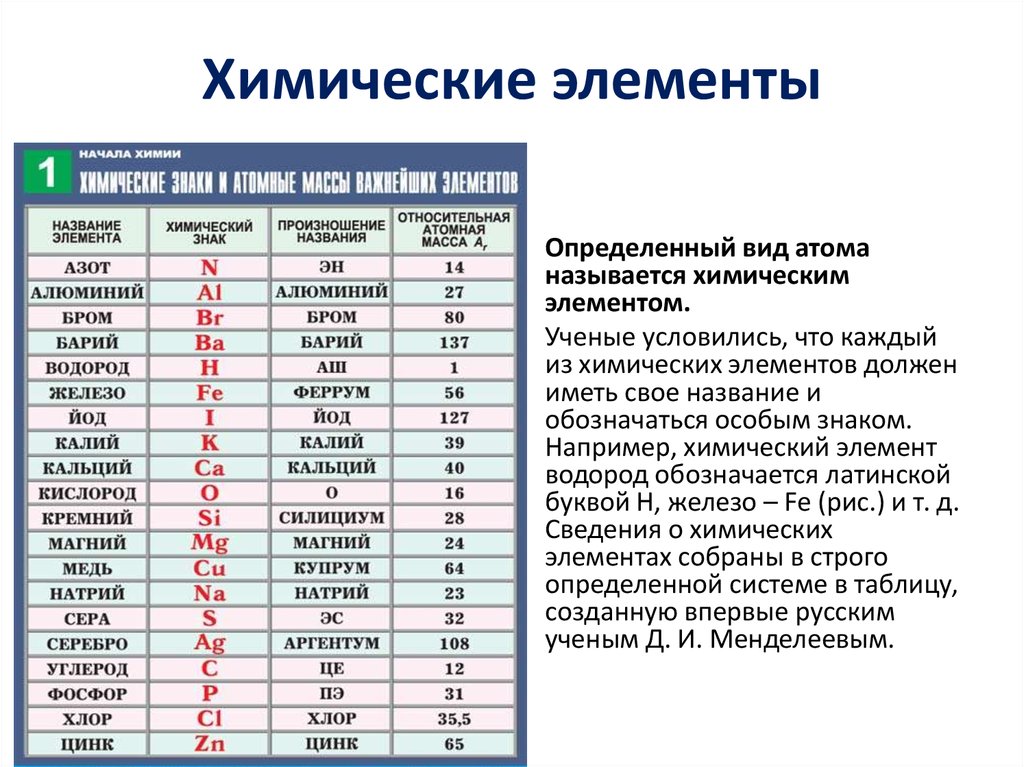 | Кр | ||||||||||||||
| руб. | старший | Д | Зр | Нб | Мо | Тс | Ру | Род | палладий | Аг | компакт-диск | В | Сн | Сб | Те | я | Хе | ||||||||||||||
| Цс | Ба | Ла | CE | Пр | Нд | часов | См | ЕС | Гд | Тб | Дай | Хо | Эр | тм | Ыб | Лу | Гф | Та | Вт | Ре | ОС | Ир | Пт | Ау | рт.ст. | Тл | Пб | Би | По | В | Рн |
| Пт | Ра | Ак | тыс. чел. | Па | У | Нп | Пу | утра | см | Бк | Ср | Эс | FM | Мд | Нет | Лр | Рф | Дб | Сг | Бх | часов | млн тонн | Дс | гр | Сп | Нх | Фл | Мак | ур. | ||


 Н. Локьером, эсквайром, в письме секретарю. Сообщено доктором Шарпи». Труды Лондонского королевского общества . 17 : 91–92. 1869-12-31. doi: 10.1098/rspl.1868.0011. ISSN 0370-1662. Архивировано из оригинала 08.08.2020. Проверено 19 сентября 2020 г. .
Н. Локьером, эсквайром, в письме секретарю. Сообщено доктором Шарпи». Труды Лондонского королевского общества . 17 : 91–92. 1869-12-31. doi: 10.1098/rspl.1868.0011. ISSN 0370-1662. Архивировано из оригинала 08.08.2020. Проверено 19 сентября 2020 г. . 
 Арс Техника . Архивировано из оригинала 07 июля 2017 г. Проверено 20 сентября 2020 г. .
Арс Техника . Архивировано из оригинала 07 июля 2017 г. Проверено 20 сентября 2020 г. .