Характеристика водорода | Периодическая таблица химических элементов Д. И. Менделеева с историческими сведениями
Общая характеристика водорода как элемента
Химический знак – Н
Относительная атомная масса – 1,008
В соединениях водород одновалентен, степень окисления в соединениях с неметаллами равна +1, в соединениях с металлами равна –1.
Водород как вещество
Химическая формула – Н2
Относительная молекулярная масса – 2,016
Способы получения водорода:
В лабораторных условиях водород получают несколькими способами:
· Действием кислот (серной, соляной) на некоторые металлы, в частности на цинк и железо;
· Действием раствора щелочи на металлический алюминий;
· Вытеснением активными металлами (Na, Ca и др.) из воды.
В промышленности основным видом сырья для получения водорода являются природные и нефтезаводские газы. В СССР водород получали в небольших масштабах методом неполного окисления метана при температуре 850 – 900°С в присутствии катализатора – никеля, нанесенного на оксид алюминия:
В СССР водород получали в небольших масштабах методом неполного окисления метана при температуре 850 – 900°С в присутствии катализатора – никеля, нанесенного на оксид алюминия:
2CH4 + O2 → 2CO↑ + 4H2↑ + 71,4 кдж
Отделить водород от оксида углерода (II) можно путем его окисления водяным паром при температуре 200 – 250°С и в присутствии катализатора:
CO + H2O ↔ H2 + CO2 + 42 кдж
В местах с дешевой электрической энергией водород получают электролизом воды, к которой для увеличения ее электропроводности прибавляют какой-либо электролит, обычно щелочь или кислоту.
Физические свойства водорода:
- Неметалл
- Бесцветный, легкий (в 14,5 раз легче воздуха), трудно сжижаемый газ
- Очень мало растворяется в воде, лучше – в органических растворителях
- Наибольшая среди газообразных веществ скорость диффузии – молекулы водорода быстрее любых иных распространяются в среде другого вещества
- Температура плавления равна -259,2°С, температура кипения равна -252,9°С.

Химические свойства водорода:
При комнатной температуре водород мало активен и реагирует только с фтором, а на свету – с хлором. В смесях с кислородом и воздухом водород при содержании более 4,5% образует взрывчатые смеси («гремучий газ»). Взрыв может произойти даже от маленькой искры.
1. Водород соединяется с кислородом
2H2 + O2 → 2H2O
2. Водород реагирует с оксидами некоторых металлов (при нагревании)
H2 + CuO → H2O + Cu
3. Водород соединяется с некоторыми неметаллами и активными металлами
H2 + Cl2 → 2HCl
H2 + 2Na → 2NaH
Применение водорода:
Большое количество водорода используется для синтеза аммиака, который, в свою очередь, применяется для производства удобрений, азотной кислоты и как рабочее вещество холодильных машин. Много водорода расходуют на такие важные химические производства, как получение синтетической соляной кислоты, превращение жидких растительных жиров в твердые, преобразования низкосортных углей в жидкое топливо, получение метилового спирта из оксида углерода (II) и т.д. В металлургии его используют для получения таких металлов, как молибден и вольфрам восстановлением их оксидов.
Много водорода расходуют на такие важные химические производства, как получение синтетической соляной кислоты, превращение жидких растительных жиров в твердые, преобразования низкосортных углей в жидкое топливо, получение метилового спирта из оксида углерода (II) и т.д. В металлургии его используют для получения таких металлов, как молибден и вольфрам восстановлением их оксидов.
Источники
1. Барков, С. А. Галогены и подгруппа марганца. Элементы VII группы периодической системы Д. И. Менделеева. Пособие для учащихся / С. А. Барков // М.: Просвещение, 1976.
2. Кузнецова, Н. Е. Химия: 8 класс. Учебник для учащихся общеобразовательных учреждений / Н. Е. Кузнецова, И. М. Титова, Н. Н. Гара, А. Ю. Жегин // М.: Вентана-Граф, 2008.
3. Леенсон, И. А. Путеводитель по химическим элементам. Из чего состоит Вселенная? / И. А. Леенсон // М.: АСТ, 2014. – 168 с.: ил.
4. Лидин, Р. А. Химические свойства неорганических веществ / Р. А. Лидин, В. А. Молочко, Л.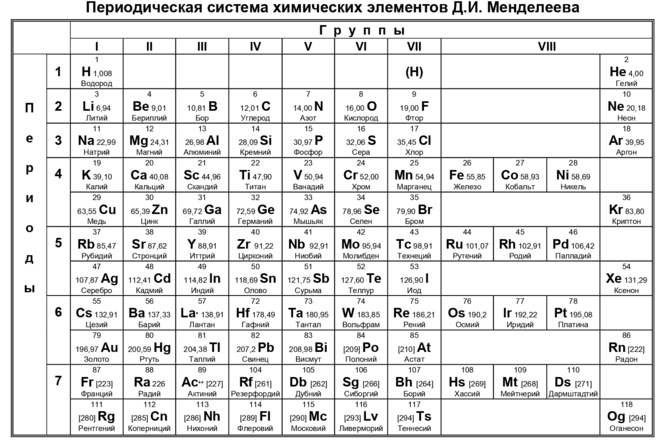
5. Рудзитис, Г. Е. Химия. Учебное пособие для 7 – 11 классов вечерней (сменной) общеобразовательной школы. Часть 1 // Г. Е. Рудзитис, Ф. Г. Фельдман // М.: Просвещение, 1985.
115 элемент таблицы Менделеева: характеристика
115 элемент таблицы Менделеева – московий (moscovium) – сверхтяжелый синтетический элемент с символом Mc и атомным номером 115. Он был впервые получен в 2003 году совместной командой российских и американских ученых в Объединенном институте ядерных исследований (ОИЯИ) в Дубне, Россия. В декабре 2015 года признан одним из четырех новых элементов Объединенной рабочей группой международных научных организаций IUPAC/IUPAP. 28 ноября 2016 года он был официально назван в честь Московского региона, в котором находится ОИЯИ.
Характеристика
115 элемент таблицы Менделеева является чрезвычайно радиоактивным веществом: его наиболее стабильный известный изотоп, moscovium-290 имеет период полураспада всего 0,8 секунды. Ученые относят московий к непереходным металлам, по ряду характеристик схожим с висмутом. В периодической таблице относится к трансактинидным элементам p-блока 7-го периода и помещен в группу 15 как самый тяжелый пниктоген (элемент подгруппы азота), хотя и не подтверждено, что он ведет себя, как более тяжелый гомолог висмута.
Ученые относят московий к непереходным металлам, по ряду характеристик схожим с висмутом. В периодической таблице относится к трансактинидным элементам p-блока 7-го периода и помещен в группу 15 как самый тяжелый пниктоген (элемент подгруппы азота), хотя и не подтверждено, что он ведет себя, как более тяжелый гомолог висмута.
Согласно расчетам, элемент обладает некоторыми свойствами, схожими с более легкими гомологами: азотом, фосфором, мышьяком, сурьмой и висмутом. При этом демонстрирует несколько существенных отличий от них. На сегодня синтезировано около 100 атомов московия, которые имеют массовые числа от 287 до 290.
Физические свойства
Валентные электроны 115 элемента таблицы Менделеева московия делятся на три подоболочки: 7s (два электрона), 7p1/2 (два электрона) и 7p3/2 (один электрон). Первые два из них релятивистски стабилизируются и, следовательно, ведут себя, как инертные газы, а последние релятивистски дестабилизируются и могут легко участвовать в химических взаимодействиях. Таким образом, первичный потенциал ионизации московия должен составлять около 5,58 эВ. Согласно расчетам, moscovium должен быть плотным металлом из-за его высокого атомного веса с плотностью около 13,5 г/см3.
Таким образом, первичный потенциал ионизации московия должен составлять около 5,58 эВ. Согласно расчетам, moscovium должен быть плотным металлом из-за его высокого атомного веса с плотностью около 13,5 г/см3.
Предполагаемые расчетные характеристики:
- Фаза: твердая.
- Температура плавления: 400°С (670°К, 750°F).
- Точка кипения: 1100°С (1400°К, 2000°F).
- Удельная теплота плавления: 5,90-5,98 кДж/моль.
- Удельная теплота парообразования и конденсации: 138 кДж/моль.
Химические свойства
115-й элемент таблицы Менделеева стоит третьим в ряду химических элементов 7p и является самым тяжелым членом группы 15 в периодической таблице, располагаясь ниже висмута. Химическое взаимодействие московия в водном растворе обусловлено характеристиками ионов Mc+ и Mc3+. Первые, предположительно, легко гидролизуются и образуют ионную связь с галогенами, цианидами и аммиаком. Гидроксид московия (I) (McOH), карбонат (Mc2CO3), оксалат (Mc2C2O4) и фторид (McF) должны растворяться в воде. Сульфид (Мс2S) должен быть нерастворимым. Хлорид (McCl), бромид (McBr), йодид (McI) и тиоцианат (McSCN) – слаборастворимые соединения.
Сульфид (Мс2S) должен быть нерастворимым. Хлорид (McCl), бромид (McBr), йодид (McI) и тиоцианат (McSCN) – слаборастворимые соединения.
Фторид московия (III) (McF3) и тиозонид (McS3), предположительно, нерастворимы в воде (аналогично соответствующим соединениям висмута). В то время, как хлорид (III) (McCl3), бромид (McBr3) и иодид (McI3) должны быть легко растворимы и легко гидролизованы с образованием оксогалогенидов, таких как McOCl и McOBr (также аналогично висмуту). Оксиды московия (I) и (III) обладают схожими состояниями окисления, и их относительная стабильность в значительной степени зависит от того, с какими элементами они взаимодействуют.
Неопределенность
Вследствие того, что 115 элемент таблицы Менделеева синтезируется единичными атомами, определить экспериментально его точные характеристики проблематично. Ученым приходится ориентироваться на теоретические расчеты и сравнивать с более стабильными элементами, схожими по свойствам.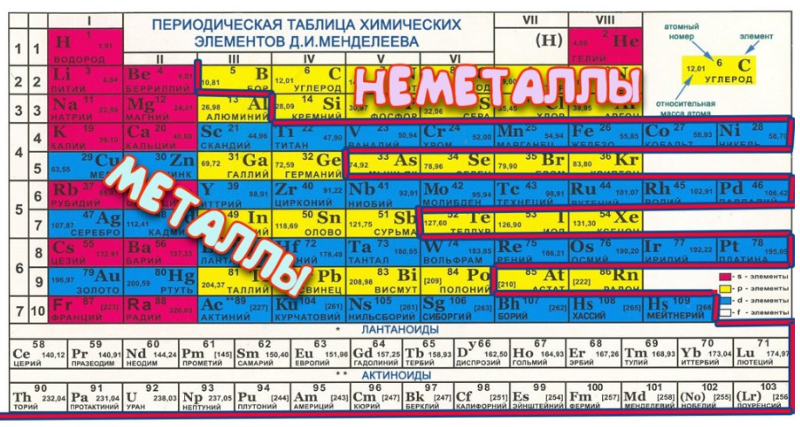
В 2011 году были проведены эксперименты по созданию изотопов нихония, флеровия и московия в реакциях между «ускорителями» (кальцием-48) и «мишенями» (америцием-243 и плутонием-244) для исследования их свойств. Однако «мишени» включали примеси свинца и висмута и, следовательно, были получены в реакциях переноса нуклонов некоторые изотопы висмута и полония, что осложнило проведение эксперимента. Между тем, полученные данные помогут в будущем ученым более детально исследовать тяжелые гомологи висмута и полония, такие как moscovium и livermorium.
Открытие
Первым успешным синтезом 115 элемента таблицы Менделеева была совместная работа российских и американских ученых в августе 2003 года в ОИЯИ в Дубне. В команду во главе с физиком-ядерщиком Юрием Оганесяном, помимо отечественных специалистов, вошли коллеги из Ливерморской национальной лаборатории Лоуренса. Исследователи 2 февраля 2004 года опубликовали в издании Physical Review информацию, что они бомбардировали америций-243 ионами кальция-48 на циклотроне У-400 и получили четыре атома нового вещества (одно ядро 287Mc и три ядра 288Mc).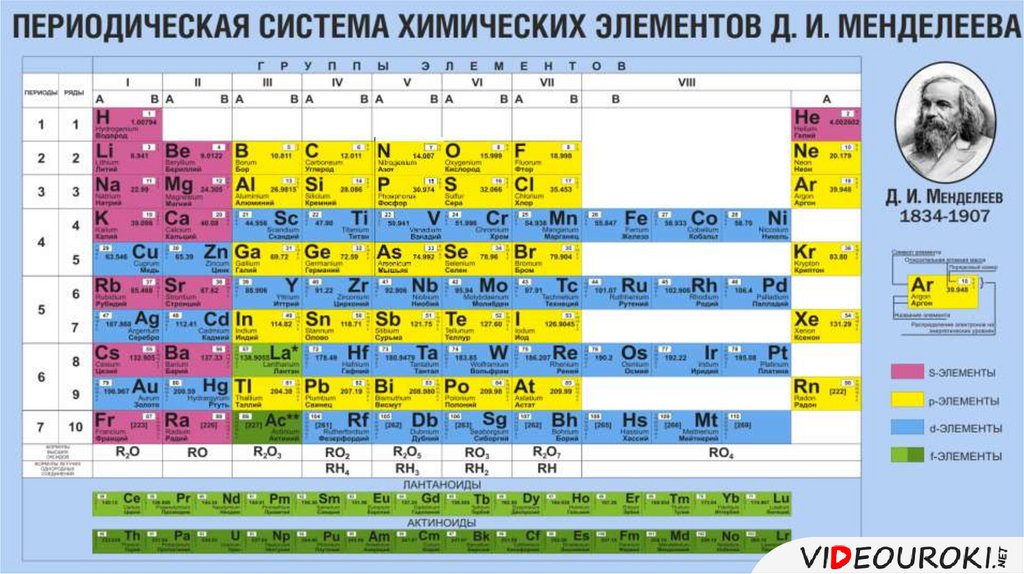 Эти атомы затухают (распадаются) за счет эмиссии альфа-частиц до элемента нихония примерно за 100 миллисекунд. Два более тяжелых изотопа московия, 289Mc и 290Mc, были обнаружены в 2009-2010 годах.
Эти атомы затухают (распадаются) за счет эмиссии альфа-частиц до элемента нихония примерно за 100 миллисекунд. Два более тяжелых изотопа московия, 289Mc и 290Mc, были обнаружены в 2009-2010 годах.
Первоначально IUPAC не могла утвердить открытие нового элемента. Требовалось подтверждение из других источников. В течение следующих нескольких лет была проведена еще одна оценка более поздних экспериментов, и еще раз выдвинуто заявление дубненской команды об открытии 115-го элемента.
В августе 2013 года группа исследователей из Университета Лунда и Института тяжелых ионов в Дармштадте (Германия) объявили, что они повторили эксперимент 2004 года, подтвердив результаты, полученные в Дубне. Еще одно подтверждение было опубликовано командой ученых, работавших в Беркли в 2015 году. В декабре 2015 года совместная рабочая группа IUPAC/IUPAP признала обнаружение этого элемента и отдала приоритет в открытии российско-американской команде исследователей.
Название
115 элемент таблицы Менделеева в 1979 году согласно рекомендации IUPAC было решено назвать «унунпентий» и обозначать соответствующим символом UUP. Несмотря на то, что данное название с тех пор широко использовалось в отношении неоткрытого (но теоретически предсказанного) элемента, в сообществе физиков оно не прижилось. Чаще всего вещество так и называли – элемент №115 или E115.
Несмотря на то, что данное название с тех пор широко использовалось в отношении неоткрытого (но теоретически предсказанного) элемента, в сообществе физиков оно не прижилось. Чаще всего вещество так и называли – элемент №115 или E115.
30 декабря 2015 года обнаружение нового элемента было признано Международным союзом чистой и прикладной химии. Согласно новым правилам, первооткрыватели имеют право предложить собственное название нового вещества. Сначала предполагалось назвать 115 элемент таблицы Менделеева «лангевиний» в честь физика Поля Ланжевена. Позднее команда ученых из Дубны, как вариант, предложила наименование «московий» в честь Московской области, где и было совершено открытие. В июне 2016 года IUPAC одобрил инициативу и 28 ноября 2016 официально утвердил название «moscovium».
Характеристики периодической таблицы – 864 слова
Эта таблица является важным аспектом современной науки. Он не только группирует элементы на основе сопоставимых характеристик, но также показывает как атомную, так и молекулярную структуру элементов, что облегчает изучение.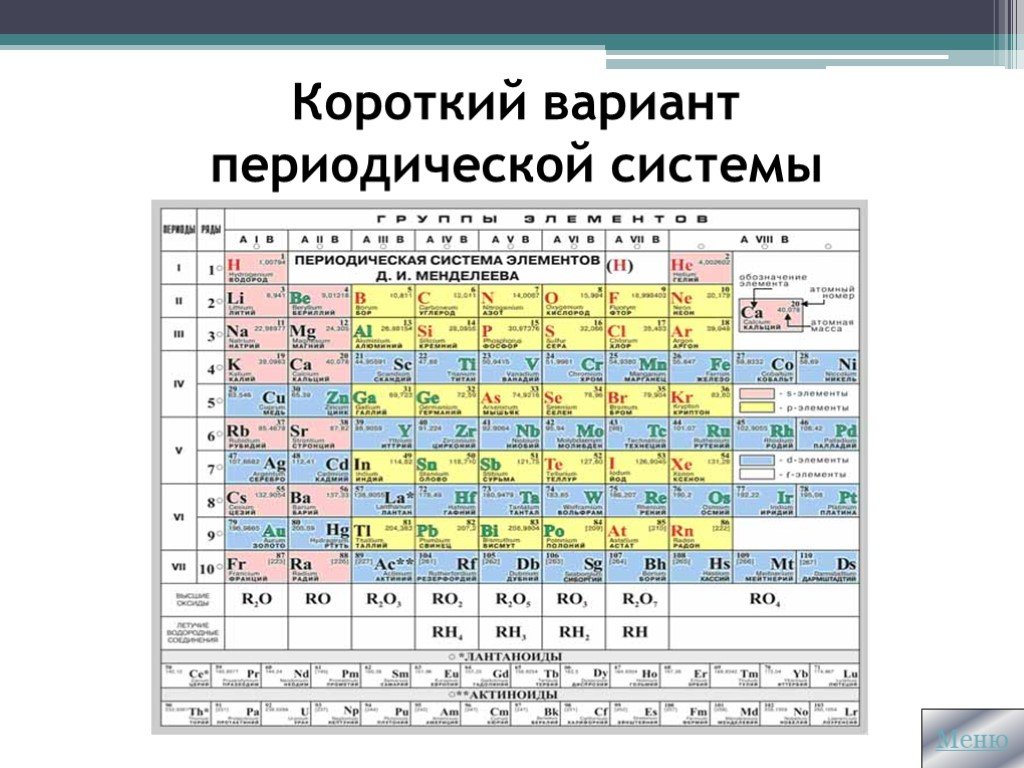
Это упорядоченное табличное расположение всех известных элементов по атомным числам по мере их увеличения. Таблицу лучше всего иллюстрируют вертикальные и горизонтальные линии элементов, причем последние называются группами, а первые называются элементами (Lengler & Eppler 2008). Примечательно, что между второй и тринадцатой группами встречаются различные элементы, то есть переходные металлы. Это также химически аналогичные соединения. Хотя все группы имеют похожий набор характеристик, элементы в некоторых группах имеют большее сходство друг с другом, чем в других группах.
Периодическая таблица возникла благодаря коллективным усилиям многих ученых. Все началось в 1817 году, когда Иоганн Доберейнер обнаружил, что элементы присутствуют в триадах. Средний элемент в каждой триаде имел средние свойства двух других. В 1862 г. французский геолог А. Э. Бегуйе де Шанкуртуа создал диаграмму, сложив элементы на цилиндре, основываясь на увеличении атомной массы (Scerri, 2007). Он смог выяснить, что свойства вновь проявляются у каждых семи элементов, таким образом предсказав стехиометрию нескольких оксидов, которые по своей природе были металлическими (Carpi, 2003).
Будучи профессором химии между 1860 и 1890 годами, Менделеев написал книгу, в которой классифицировал элементы по группам со сходными свойствами. Он начал с галогенов, а затем перешел к металлам в зависимости от их комбинированной способности. Он пришел к выводу, что некоторые металлы проявляют несколько свойств, поэтому их нельзя легко классифицировать. Он расположил элементы в таблице в порядке возрастания атомной массы (Carpi, 2003). Эта таблица показала, что элементы демонстрируют сходство на разных фронтах, таких как вертикальные, диагональные сети, горизонтальные, а не только в мельчайших триадах.
Мой интерес к таблице основан на полном понимании того, как использовать таблицу в данный момент. Ранее мне было трудно понять таблицу. Металлы слева, неметаллы справа. В средних рядах полуметаллы; кроме того, элементы расположены в порядке возрастания атомного номера.
Различные элементы таблицы могут быть синтезированы в искусственном режиме. Рассмотрим элементы восьмой группы, которые могут быть синтезированы в результате реакций, вызванных соединениями металлов, и элементы пятой группы, особенно те, которые связаны с полимерными комплексами (West, 2007). Примечательно, что этот процесс происходит при прямом связывании металла с указанными элементами. Во время этого процесса пригодится восстановитель (West, 2007).
С момента создания этой таблицы в 1869 г. Менделеевым она служит инструментом для иллюстрации повторяющихся или периодических трендов элементов. Он проигнорировал массовый порядок и поместил элементы, демонстрирующие вновь появляющиеся химические свойства, оставив пробелы для других неоткрытых элементов (Lengler & Eppler 2008).
Вертикальное расположение (группами) — самый заметный способ сортировки. Элементы с сравнимыми характеристиками элементов сгруппированы друг над другом, таким образом проявляя реакционную способность в сочетании с электронами, которые принимают форму квантовых электронов. В первой группе, например, калий идет после натрия. Несмотря на то, что они оба реагируют с водой, калий реагирует бурно, выделяя при этом энергию (Адам, 2003). Примечательно, что оболочки электронов калия можно вывести как три, тогда как у натрия их две; кроме того, каждый из них имеет по одному делокализованному электрону для связывания (Lengler & Eppler 2008).
Горизонтальное расположение (точки) используется редко. Единственные категории, в которых периоды кажутся более значительными по сравнению с группами, очевидны для лантаноидов и актиноидов. В конце концов, периоды играют важную роль в отображении категорий элементов с равной оболочкой (Lengler & Eppler 2008).
Составы представляют собой важные процессы в обществе. Химики сообщают, что перед выполнением любого из них необходимо знать химическое поведение. Для наблюдения за молекулярными реакциями важно иметь представление о молекулярных величинах (Adam, 2003). Это позволит нам определить другие факторы, такие как уровни равновесия. Учитывая, что молекулярная масса равна атомной массе составляющих атомов, таблица Менделеева облегчает такие расчеты. Его также можно использовать для определения подходящих альтернатив для определенных компонентов, поскольку он группирует элементы по сходству характеристик (Adam, 2003).
Химики сообщают, что перед выполнением любого из них необходимо знать химическое поведение. Для наблюдения за молекулярными реакциями важно иметь представление о молекулярных величинах (Adam, 2003). Это позволит нам определить другие факторы, такие как уровни равновесия. Учитывая, что молекулярная масса равна атомной массе составляющих атомов, таблица Менделеева облегчает такие расчеты. Его также можно использовать для определения подходящих альтернатив для определенных компонентов, поскольку он группирует элементы по сходству характеристик (Adam, 2003).
Периодическая таблица важна для современной науки. Это потому, что без него было бы невозможно отслеживать различные металлы и их соединения. Изучение элементов было бы трудным, поэтому важные открытия в медицине, химии и многих других областях были бы невозможны (Carpi, 2003).
Адам, Х. (2003). Как вы используете периодическую таблицу в повседневной жизни? Сеть Madsci: Химия. Веб.
Веб.
Карпи, А. (2003). Периодическая таблица элементов . Зрение Обучение. Веб.
Ленглер, Р. и Эпплер, М. (2008) На пути к периодической таблице методов визуализации для управления. Лугано, Швейцария: Институт корпоративных коммуникаций Университета Лугано, Интернет.
Шерри, Э. (2007). Периодическая таблица: история и значение . Нью-Йорк: Издательство Оксфордского университета, США.
Запад, Р. (2007). Достижения в металлоорганической химии . Лондон: Академическая пресса.
Этот отчет о характеристиках периодической таблицы был написан и представлен вашим коллегой
студент. Вы можете использовать его для исследовательских и справочных целей, чтобы написать свою собственную статью; однако ты
должны цитировать его соответственно.
Запрос на удаление
Если вы являетесь владельцем авторских прав на эту статью и больше не хотите, чтобы ваша работа публиковалась на IvyPanda.
Запросить удаление
Требуется пользовательский образец отчета , написанный с нуля
профессиональный специально для вас?
807 сертифицированных писателей онлайн
ПОЛУЧИТЬ ПИСЬМЕННУЮ ПОМОЩЬ
Каковы основные характеристики последних элементов в периодах таблицы Менделеева Что такое…
Перейти к
- Упражнение 5А
- Упражнение 5Б
- Упражнение 5С
- Глава 1.
 Язык химии
Язык химии - Глава 2 Химические изменения и реакции
- Глава 3 Вода
- Глава 4. Атомная структура и химическая связь
- Глава 5 Периодическая таблица
- Глава 6 Изучение первого элемента водорода
- Глава 7 Изучение газовых законов
- Глава 8.
 Загрязнение атмосферы
Загрязнение атмосферы
Главная > Селина Солюшнс Класс 9 Химия > Глава 5 – Глава 5 Периодическая таблица > Упражнение 5Б > Вопрос 2
Вопрос 2. Упражнение 5B
Каковы основные характеристики последних элементов в периодах таблицы Менделеева? Каково общее название таких элементов?
Ответ:
Главный герой последнего элемента таблицы Менделеева в их самых внешних оболочках полностью заполнен либо двумя, либо 8 электронами. Эти элементы известны как инертные газы.
Связанные вопросы
**а) Укажите современный закон Периодической таблицы.****б) Сколько периодов и групп в современном…
Что означает в периодической таблице: (а) группа и (б) период
**a) Как называются следующие группы? ****(i) Группа 1** **(ii) Группа 17** **(iii) Группа _18** .


 Язык химии
Язык химии Загрязнение атмосферы
Загрязнение атмосферы