Знаменитая таблица Менделеева
ДМИТРИЙ ИВАНОВИЧ МЕНДЕЛЕЕВ
Автор: Сергей НЕЧАЕВ30.12.2021
История науки знает множество открытий, однако немногие из них можно сопоставить с тем, что было сделано Дмитрием Ивановичем Менделеевым. В самом деле, хотя со времени открытия периодического закона химических элементов прошло немало лет, никто не может сказать, когда будет до конца понято все глубочайшее содержание знаменитой «таблицы Менделеева». Только вот вопрос: а кто же все-таки придумал ее первым?
Дмитрий Иванович Менделеев родился 27 января (8 февраля) 1834 года в Тобольске. В январе 1865 года он защитил докторскую диссертацию и был утвержден профессором кафедры технической химии Петербургского университета.
ОТКРЫТИЕ, СДЕЛАННОЕ «ВО СНЕ»
Принято считать, что свою периодическую таблицу Менделеев увидел во сне, и ему оставалось лишь записать ее и обосновать.
Дмитрий Иванович говорил своему другу философу И.И. Лапшину, посетившему его незадолго перед открытием: «Все в голове сложилось, а выразить таблицей не могу».
Получается, что Менделеев работал, как сумасшедший, три дня и три ночи не ложась спать. Доведя себя до крайней степени нервного истощения, он, как сейчас говорят, «отключился», и тут-то его и посетило «озарение».
Скорее всего, вся эта история с вещим сном лишь подтверждает тот факт, что люди, которые очень интенсивно работают над какой-либо проблемой, просто продолжают решать ее и во сне, только в этом случае к мыслительной деятельности подключается уже подсознание. Именно оно способно на такие величайшие научные «подвиги».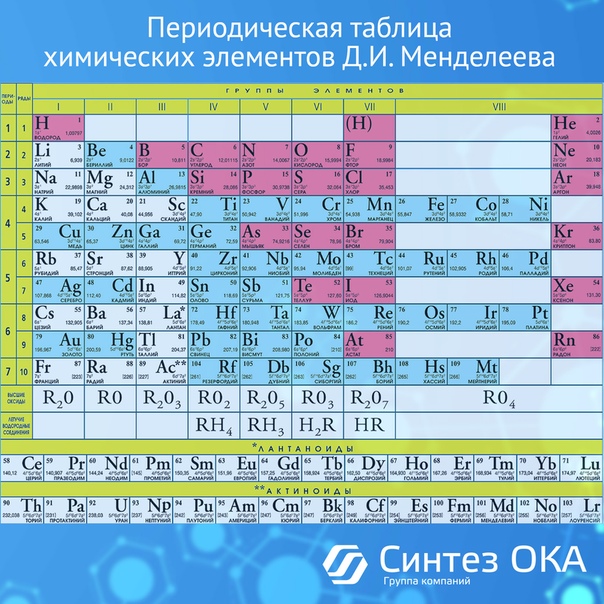
Конечно же, открытие Менделеева было совершено им не случайно, и уж точно не во сне. Всему этому предшествовала огромная работа, основанная на сочетании знаний физической стороны исследуемого явления, математической интуиции и философского осмысления. 17 февраля (1 марта) 1869 года Менделеев отправил в типографию рукопись, в которой был изложен его «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». Уже через две недели он представил в Русское химическое общество статью «Соотношение свойств с атомным весом элементов».
В конечном итоге, Менделеев составил несколько вариантов периодической системы и на ее основе исправил атомные веса некоторых известных элементов.
С этого момента все другие проблемы отошли для него на задний план. В частности, он забросил работу над учебником «Основы химии» (труд этот будет закончен лишь в 1871 году). Распределение элементов в составленной им таблице каждый раз казалось ему несовершенным.
Закончилось все это тем, что Менделеев сумел предсказать существование нескольких до того неизвестных элементов. Более того, в одной из своих статей он подробно описал свойства трех из них: он назвал эти элементы «экабором», «экаалюминием» и «экакремнием» (или «экасилицием»). Чтобы было понятно: «эка» – на санскрите означает «первый», так что название, например, «экаалюминий» означает «первый аналог алюминия».
Так на свет появилась фундаментальная схема, которой до сих пор пользуются как школьники, так и ученые во всем мире.
ЮЛИУС ЛОТАР МЕЙЕР
И все же, справедливости ради, возвращаясь к знаменитой таблице Менделеева, необходимо отметить, что у нее был еще один «автор». Его звали Юлиус Лотар Мейер, и был он доктором медицины, занимавшимся вопросами теоретической и физической химии.
Этот человек родился 19 августа 1830 года в семье врача в маленьком городке Фарель, что в провинции Ольденбург.![]() После школы по примеру своего отца Мейер стал изучать медицину и в 1854 году окончил Вюрцбургский университет, получив степень доктора медицины. Затем он изучал естественные науки в Гейдельбергском и Кёнигсбергском университетах, а также в университете Бреслау. В 1858 году он стал доктором наук. С 1866 года он работал профессором университета в Эбесвальде, в 1868–1876 гг. был профессор в университете Карлсруэ, а с 1876 года – в Тюбингенском университете. В 1888 году Мейер стал член-корреспондентом Берлинской академии наук.
После школы по примеру своего отца Мейер стал изучать медицину и в 1854 году окончил Вюрцбургский университет, получив степень доктора медицины. Затем он изучал естественные науки в Гейдельбергском и Кёнигсбергском университетах, а также в университете Бреслау. В 1858 году он стал доктором наук. С 1866 года он работал профессором университета в Эбесвальде, в 1868–1876 гг. был профессор в университете Карлсруэ, а с 1876 года – в Тюбингенском университете. В 1888 году Мейер стал член-корреспондентом Берлинской академии наук.
Работая в Гейдельберге, Мейер поддерживал научные контакты с химиками-органиками Августом Кекуле и Фридрихом Бейльштейном, и это привело Мейера к решению серьезно заняться химией.
В 1859 году Мейер защитил как диссертацию на право чтения лекций историко-критическую работу «Химические теории от Бертолле до Берцелиуса».
В 1860 году Мейер, как и Д.И. Менделеев, принял участие в Международном конгрессе химиков в Карлсруэ, на котором обсуждались определения основных понятий химии..jpg) На этом конгрессе, в частности, было решено четко разграничить понятия «атом», «молекула» и «эквивалент». В результате, была в основном решена проблема атомных масс, что открыло дорогу для систематизации химических элементов и создания периодического закона.
На этом конгрессе, в частности, было решено четко разграничить понятия «атом», «молекула» и «эквивалент». В результате, была в основном решена проблема атомных масс, что открыло дорогу для систематизации химических элементов и создания периодического закона.
ТАБЛИЦА МЕЙЕРА 1864 ГОДА
В «Краткой истории химии» Айзека Азимова сказано: «Мейер опубликовал свою работу в 1870 году. А за год до этого русский химик Дмитрий Иванович Менделеев (1834–1907) установил порядок изменения длины периодов элементов и наглядно продемонстрировал значение своего открытия».
Это не совсем так. На самом деле, Менделеев не был первым человеком, который построил научную классификацию элементов. Юлиус Лотар Мейер на основании данных об атомных весах предложил таблицу, показывающую соотношение атомных весов для нескольких характерных групп элементов, намного раньше – в 1864 году.
В таблице Мейера было 28 элементов, размещенных в шесть столбцов согласно их валентностям.
Специалисты совершенно справедливо считают эту таблицу Мейера сокращенной, ибо в ней ученый отобразил только те 28 элементов, в свойствах которых он был уверен. Всего 28 элементов, а это – меньше половины известных в то время. Расположение остальных элементов оставалось неясным, и что делать с ними, Мейер не знал.
Более того, в 1864 году Мейер предложил располагать элементы по группам, но дальше этого предложения не пошел и понятие «группа элементов» не раскрыл.
ТАБЛИЦА МЕЙЕРА 1870 ГОДА
В 1870 году Мейер опубликовал еще одну работу, называвшуюся «Природа химических элементов как функция их атомного веса» и содержавшую новую таблицу, состоявшую уже из девяти вертикальных столбцов (сходные элементы располагались в горизонтальных рядах, а некоторые ячейки таблицы Мейер оставил незаполненными). В новой таблице отображалось уже 55 элементов, и она была понятна и удобна для отображения в книгах.
В новой таблице отображалось уже 55 элементов, и она была понятна и удобна для отображения в книгах.
В своей работе Мейер систематизировал элементы и изобразил их в виде кривой, где атомные объемы являются периодической функцией от значений атомных масс. Он так характеризовал эту зависимость: «Правильно определив различные атомные веса (из плотностей их соединений в газообразном состоянии или из теплоемкостей), можно в этой схеме расположить все известные до настоящего времени элементы».
ТАБЛИЦА МЕЙЕРА И ТАБЛИЦА МЕНДЕЛЕЕВА: ЗА КЕМ ПРИОРИТЕТ?
Как уже говорилось, Д.И. Менделеев составил и опубликовал свою знаменитую таблицу в феврале-марте 1869 года. Точнее, это был некий отдаленный прототип ныне всем известной периодической системы элементов. Он выстроил символы известных ему 63 элементов в прообраз периодической таблицы элементов вертикальной формы, а потом эту свою таблицу он корректировал и совершенствовал всю жизнь.
Мейер опубликовал свою редакцию периодической таблицы химических элементов в 1864 году, то есть на пять лет раньше Менделеева.
В 1870 году, то есть уже после опубликования Менделеевым периодического закона, появилась статья Мейера, в которой он рассмотрел общую систему химических элементов, расположив их по возрастанию атомных масс. По мнению ряда специалистов, таблица Мейера 1870 года была в некоторых отношениях совершеннее первых вариантов таблицы Менделеева. При этом сам Дмитрий Иванович в одной из своих статей заявил, что таблица Мейера представляла собой только простое сопоставление элементов, на что Мейер отвечал, что его таблица «в существенном идентична данной Менделеевым».
Дмитрий Иванович возмущенно писал: «Господин Мейер раньше меня не имел в виду периодического закона, а после меня ничего нового к нему не прибавил».
Более того, согласно Менделееву, Мейер не стал развивать свое открытие и даже не сделал попыток на его основе дать предсказания свойств еще не открытых элементов. Свое мнение по этому вопросу Дмитрий Иванович сформулировал так: «По праву творцом научной идеи должно того считать, кто понял не только философскую, но и практическую сторону дела, сумел так его поставить, что в новой истине все могли убедиться, и она стала всеобщим достоянием. Тогда только идея, как материя, не пропадет».
Свое мнение по этому вопросу Дмитрий Иванович сформулировал так: «По праву творцом научной идеи должно того считать, кто понял не только философскую, но и практическую сторону дела, сумел так его поставить, что в новой истине все могли убедиться, и она стала всеобщим достоянием. Тогда только идея, как материя, не пропадет».
Получается, что Мейер был все еще очень далек даже от понимания истинного смысла периодической системы. Менделеев же открывал элементы и предсказывал их свойства, опираясь на пустые клетки в созданной им таблице.
На самом деле, Мейер был очень осторожен в оглашении своих научных суждений. И поначалу он избегал публиковать свои прогнозы свойств еще неоткрытых элементов. И именно отсутствие у Мейера успешных научных прогнозов свойств еще неоткрытых элементов некоторые ученые расценили как намного меньшую научную достоверность его периодической таблицы по сравнению с таблицей Менделеева.
Тем не менее, Мейер уже через несколько месяцев после появления первых сообщений Менделеева об открытом им периодическом законе выступил с претензией на свой приоритет.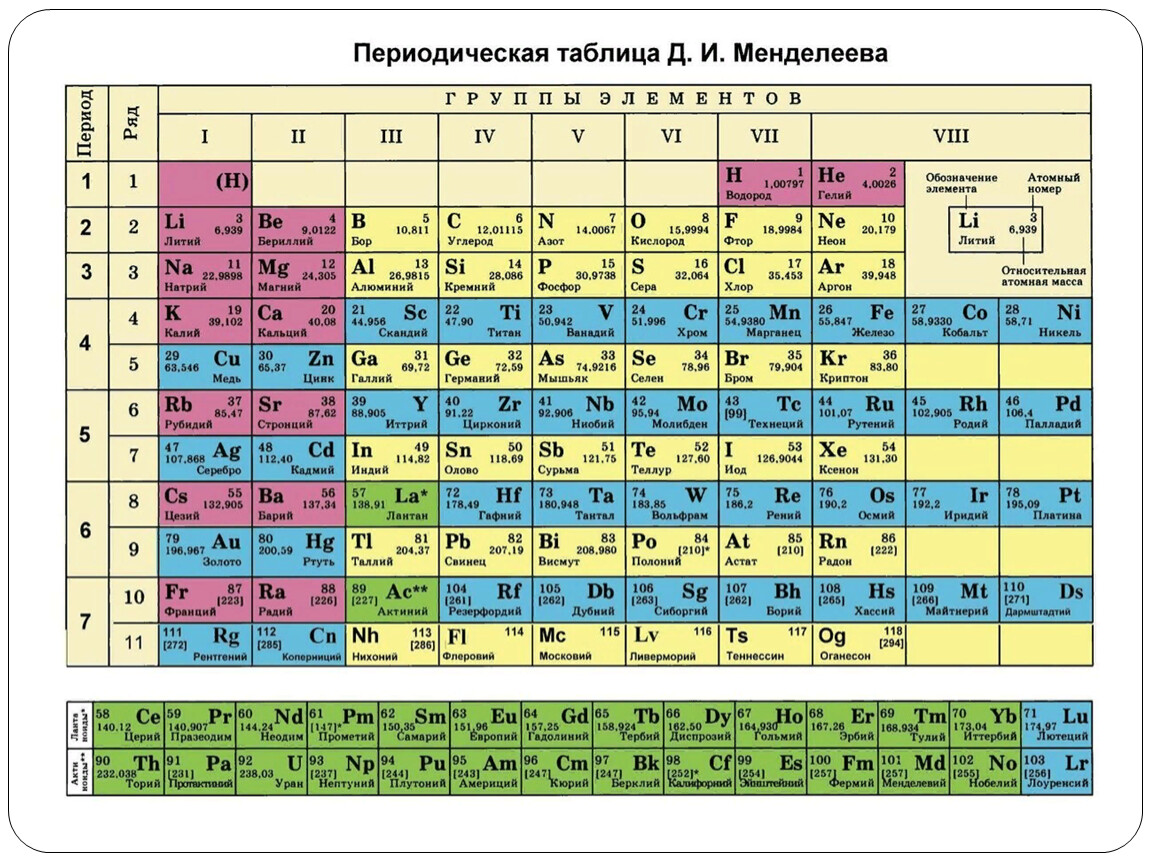 И многие, особенно в Германии (это и понятно), до сих пор считают именно Мейера первооткрывателем периодической системы.
И многие, особенно в Германии (это и понятно), до сих пор считают именно Мейера первооткрывателем периодической системы.
В свое время вокруг имен Мейера и Менделеева разгорелась весьма острая дискуссия, кто же из них первым сделал великое открытие. И до сих пор в зарубежных изданиях имена Менделеева и Мейера ставят рядом там, где речь идет о периодическом законе и периодической системе химических элементов, причем имя Мейера выдвигают на «полкорпуса вперед».
Кстати
Фигура Менделеева всегда была окружена всевозможными мифами. Один из самых распространенных – якобы Менделеев сделал научное обоснование стандарта русской водки в 40 градусов. Связано это с тем, что тема его докторской диссертации звучала так: «Рассуждение о соединении спирта с водою». Но к водке это не имело никакого отношения. Работа была посвящена очень узкой научной проблематике, связанной с теорией растворов.
А в 1882 году Лондонское королевское общество присудило золотые медали совместно Менделееву и Мейеру. Наградам сопутствовала формулировка: «За открытие периодических соотношений атомных весов».
Наградам сопутствовала формулировка: «За открытие периодических соотношений атомных весов».
ГЛАВНОЕ – ОТКРЫТИЕ ПЕРИОДИЧЕСКОЙ ЗАВИСИМОСТИ
Дмитрий Иванович Менделеев умер 20 января (2 февраля) 1907 года. Юлиус Лотар Мейер умер намного раньше – в апреле 1895 года.
Юлиус Лотар Мейер
Когда Менделеев придумывал свою таблицу, было известно лишь 63 химических элемента. В год смерти ученого был открыт «лютеций», получивший 71-й номер. Сотым элементом стал «фермий», впервые полученный в конце 1952 года. А в 1955 году американские ученые синтезировали элемент № 101, и ему было дано название «менделевий» (Md) – в честь Д.И. Менделеева.
Интересно отметить, что на сегодняшний день официально известно уже 118 химических элементов, из них 94 было обнаружено в природе, а остальные получены искусственно, и это уже исключительно ядерная физика.
Химические элементы делятся на металлы и неметаллы, причем к металлам относятся 85% из них. 99% земной коры по массе составляют лишь восемь химических элементов: кислород, калий, натрий, магний, кальций, железо, алюминий, кремний. Водород и гелий – элементы, преобладающие в космосе. В живых организмах наиболее распространенные элементы – это азот, водород, кислород, углерод.
99% земной коры по массе составляют лишь восемь химических элементов: кислород, калий, натрий, магний, кальций, железо, алюминий, кремний. Водород и гелий – элементы, преобладающие в космосе. В живых организмах наиболее распространенные элементы – это азот, водород, кислород, углерод.
Джон Ньюлендс
Как видим, наука шагнула очень далеко вперед. В свое время Менделеев так сформулировал текст предполагаемого им периодического закона: «Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Современная формулировка такова: «Свойства химических элементов, а также формы и свойства, образуемых ими простых веществ и соединений, находятся в периодической зависимости от величины зарядов ядер их атомов».
Что же касается Мейера, то он в свое время опубликовал кривую изменения атомных объемов элементов.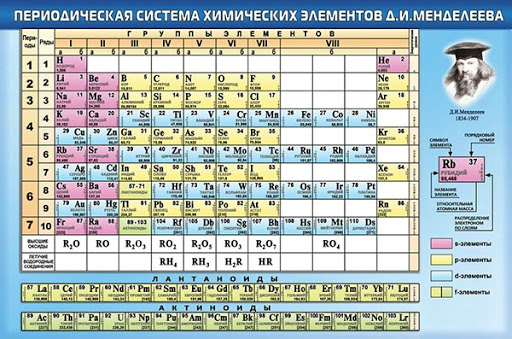 Она действительно отражала одно из свойств периодического закона, и этим Мейер существенно содействовал систематизации элементов. Но все дело в том, что сам Мейер не смог разглядеть общей закономерности природы – периодичности. Менделеев же совершенно правильно предположил, что свойствами элементов управляет периодический закон, и алгоритм этого периодического закона был реализован им в графической форме в виде его периодической таблицы элементов.
Она действительно отражала одно из свойств периодического закона, и этим Мейер существенно содействовал систематизации элементов. Но все дело в том, что сам Мейер не смог разглядеть общей закономерности природы – периодичности. Менделеев же совершенно правильно предположил, что свойствами элементов управляет периодический закон, и алгоритм этого периодического закона был реализован им в графической форме в виде его периодической таблицы элементов.
А ВЕДЬ БЫЛ ЕЩЕ И ДЖОН НЬЮЛЕНДС
В данном контексте следует также упомянуть о британском химике Джоне Ньюлендсе (1837–1898). В 1864 году он тоже составил таблицу, в которой расположил все известные тогда элементы в порядке увеличения их атомных весов. Пронумеровав элементы (элементы, имевшие одинаковые веса, имели у него один и тот же номер), Ньюлендс сделал следующий вывод: «Разность в номерах наименьшего члена группы и следующего за ним равна семи; иначе говоря, восьмой элемент, начиная с данного элемента, является своего рода повторением первого, подобно восьмой ноте октавы в музыке».
Через год Ньюлендс опубликовал новую таблицу, назвав ее «законом октав», который формулировался следующим образом: «Номера аналогичных элементов, как правило, отличаются или на целое число семь, или на кратное семи; другими словами, члены одной и той же группы соотносятся друг с другом в том же отношении, как и крайние точки одной или больше октав в музыке».
После 1866 года Джон Ньюлендс больше не предпринимал попыток дальнейшей разработки своей систематики, тем не менее, именно его в Великобритании считают тем, кто впервые высказал идею о периодичности изменения свойств элементов. В любом случае, в 1887 году, через пять лет после Менделеева и Мейера, Лондонское королевское общество вручило свою медаль и ему. Награде сопутствовала формулировка: «За открытие периодического закона химических элементов».
Дмитрий Иванович Менделеев на это отреагировал следующей оценкой работы Ньюлендса: «В этих трудах видны некоторые зародыши периодического закона».
ТАК КТО ЖЕ ВСЕ-ТАКИ?
И все же у знаменитого русского естествоиспытателя К.А. Тимирязева мы читаем: «Едва ли не самым выдающимся шагом вперед собственно химии явилась возможность естественной классификации элементов в периодическую систему (Ньюлендс, Лотар Мейер и особенно Менделеев), дозволяющих рассматривать все свойства как функции их атомного веса».
Ключевыми для нас тут являются слова: «особенно Менделеев»…
А вот мнение Лотара Кольдица, известного немецкого химика, издателя учебников по химии и профессора Берлинского университета: «Никто из ученых, занимавшихся до Менделеева или одновременно с ним исследованиями соотношений между атомными весами и свойствами элементов, не смог сформулировать эту закономерность так ясно, как это сделал он. В частности, это относится к Ньюлендсу и Мейеру. Предсказание еще неизвестных элементов, их свойств и свойств их соединений является исключительно заслугой Д. И. Менделеева».
И. Менделеева».
Тем не менее, чтобы не путаться во взаимных претензиях, в большинстве химических сообществ западного мира периодическая таблица не носит имени первооткрывателя, а словосочетание «таблица Менделеева» существует только в России.
Фото предоставлены
сайтом Wikipedia.org
Авторы: Сергей НЕЧАЕВ
Таблица Менделеева появилась на фасаде вокзала в Дубне
На фасаде здания дубненского вокзала появилось изображение таблицы Менделеева.
Дубний, Флеровий, Оганессон — названия этих элементов таблицы Менделеева знает каждый дубненец. Их синтезировали ученые Объединенного института ядерных исследований в Дубне. Всего за последние 60 лет в ОИЯИ было открыто десять элементов. Поэтому для жителей это событие — настоящий праздник. На вокзал пришли сотни дубненцев, играла живая музыка.
Сорвать покрывало с изображения таблицы доверили авторам идеи, которые и воплотили ее в жизнь. Неравнодушные жители — Сергей Муравьев и Александр Прохоров — впервые предложили создать в Дубне памятник таблице еще пять лет назад на дубненском форуме. Для них ОИЯИ — с детства главный символ города. Спустя годы они осуществили свою задумку. После согласования с различными инстанциями, мужчины на свои средства изготовили изображение таблицы, которое нанесли на плитки на фасаде здания.
Неравнодушные жители — Сергей Муравьев и Александр Прохоров — впервые предложили создать в Дубне памятник таблице еще пять лет назад на дубненском форуме. Для них ОИЯИ — с детства главный символ города. Спустя годы они осуществили свою задумку. После согласования с различными инстанциями, мужчины на свои средства изготовили изображение таблицы, которое нанесли на плитки на фасаде здания.
«Сейчас у нас в городе все типовое стало. Раньше было кафе „Нейтрино“, книжный магазин „Эврика“, были символы, который создавали неповторимый облик наукограда. Хотелось создать что-то, что напоминало бы о том, что мы живем в наукограде», — рассказал инициатор установки таблицы Менделеева Александр Прохоров.
Источник фото: телеканал «360»Открытие символично прошло 1 Мая: элемент Дубний, названный в честь города, располагается в таблице как раз под номером 105. Символичен и год. 2019-й в ЮНЕСКО объявили Международным годом Периодической таблицы имени Менделеева. Ученые по достоинству оценили новую достопримечательность наукограда.
Военные мемориалы и памятники в Дубне приведут в порядок ко Дню Победы
Подробнее«В этом году работы по синтезу начались с чистого листа. Недавно мы открыли Фабрику сверхтяжелых элементов, на которой будут продолжены работы и, мы уверены, будут синтезированы новые элементы. И тогда здесь придется продолжать эту таблицу, заменяя новые и новые плиточки на этой стене», — отметил представитель ОИЯИ, руководитель управления социальной инфраструктуры института Андрей Тамонов.
В преддверии такого события сотрудники РЖД привели вокзал в порядок. На память об этом дне дубненцы унесли с собой символичные открытки, на которых нарисован вокзал. На каждой — марка с изображением химических элементов. Идея такого сувенира также принадлежит жителям муниципалитета.
Источник фото: телеканал «360»Напомним, летом в Дубне начнутся работы по благоустройству набережной имени Менделеева. Планируется, что там появится аллея химических элементов.
youtube.com/embed/3T3eJAf5Zek” title=”iframe-responsive”/>Поделиться статьей
Химики готовятся отпраздновать юбилей таблицы Менделеева
В конце прошлого года ООН приняла
специальную резолюцию, посвященную науке, технологии и инновациям, и
провозгласила 2019 год Международным годом Периодической таблицы
химических элементов.
Этого события давно ждали и за него боролись исследователи, судьба которых неразрывна с судьбой российской науки. Колоссальная работа, которую на протяжении последнего года вели Международный союз по теоретической и прикладной химии (IUPAC), Российская академия наук, Министерство образования и науки РФ, Министерство иностранных дел РФ, Российское химическое общество им. Д.И.Менделеева, многие российские и зарубежные ученые, завершилась триумфом.
Проведение Международного года Периодической таблицы
химических элементов в 2019 году имеет принципиальное значение для нашей
страны. Ведь почти 150 лет тому назад, в 1869 году, именно великий
русский ученый Дмитрий Иванович Менделеев опубликовал свою первую схему
Периодической таблицы в статье “Соотношение свойств с атомным весом
элементов” в журнале Русского химического общества. А до того, в феврале
1869 года, им было разослано научное извещение об этом важнейшем
открытии ведущим химикам мира. Тогда многие известные химики отнеслись к
сообщению Д.Менделеева об открытии Периодического закона и создании
Периодической таблицы химических элементов с напыщенным равнодушием. Ни
одна европейская страна не включала информацию о Периодической системе
химических элементов в учебные планы по химии вплоть до ХХ века.
А до того, в феврале
1869 года, им было разослано научное извещение об этом важнейшем
открытии ведущим химикам мира. Тогда многие известные химики отнеслись к
сообщению Д.Менделеева об открытии Периодического закона и создании
Периодической таблицы химических элементов с напыщенным равнодушием. Ни
одна европейская страна не включала информацию о Периодической системе
химических элементов в учебные планы по химии вплоть до ХХ века.
Мировое научное сообщество в разных частях света по-разному восприняло систему Д.Менделеева. Проведенный анализ статей в научных журналах, справочниках, химических учебниках, средствах массовой информации показал, что введение Периодического закона в образовательную систему во многих странах было осложнено по разным причинам.
С интересным
обзором восприятия Периодической системы в разных странах выступил
японский историк химии профессор Масанори Кадзи на Международной
научно-практической конференции и школе молодых ученых и студентов
“Образование и наука для устойчивого развития”, которая проходила в
Институте химии и проблем устойчивого развития Российского
химико-технологического университета им. Д.И.Менделеева. Например, когда
в Швеции в конце XIX века, после открытия Менделеевым Периодического
закона, были впервые получены новые химические элементы (тулий (1879),
гольмий (1879), скандий (1879)), их не соотносили с Периодической
таблицей Менделеева, хотя о ней уже было известно. Более того, открытый
шведским химиком Нильсоном скандий был до него предсказан Д.Менделеевым и
описан как “экабор”.
Д.И.Менделеева. Например, когда
в Швеции в конце XIX века, после открытия Менделеевым Периодического
закона, были впервые получены новые химические элементы (тулий (1879),
гольмий (1879), скандий (1879)), их не соотносили с Периодической
таблицей Менделеева, хотя о ней уже было известно. Более того, открытый
шведским химиком Нильсоном скандий был до него предсказан Д.Менделеевым и
описан как “экабор”.
В Норвегии Периодическая система долгое
время даже не упоминалась в научных журнальных публикациях, только в
1888 году информация о ней появилась в учебнике по химии. Опираться на
Периодическую систему в научных публикациях норвежцы начали только в
1910-е годы, благодаря открытиям в области радиоактивности и атомной
теории. А как педагогический инструмент в учебный процесс в
университетах этой страны Периодическая система была введена только в
1940 году. Кстати, в норвежских гимназических учебниках информации о
Периодической системе не существовало вплоть до начала 1970-х годов.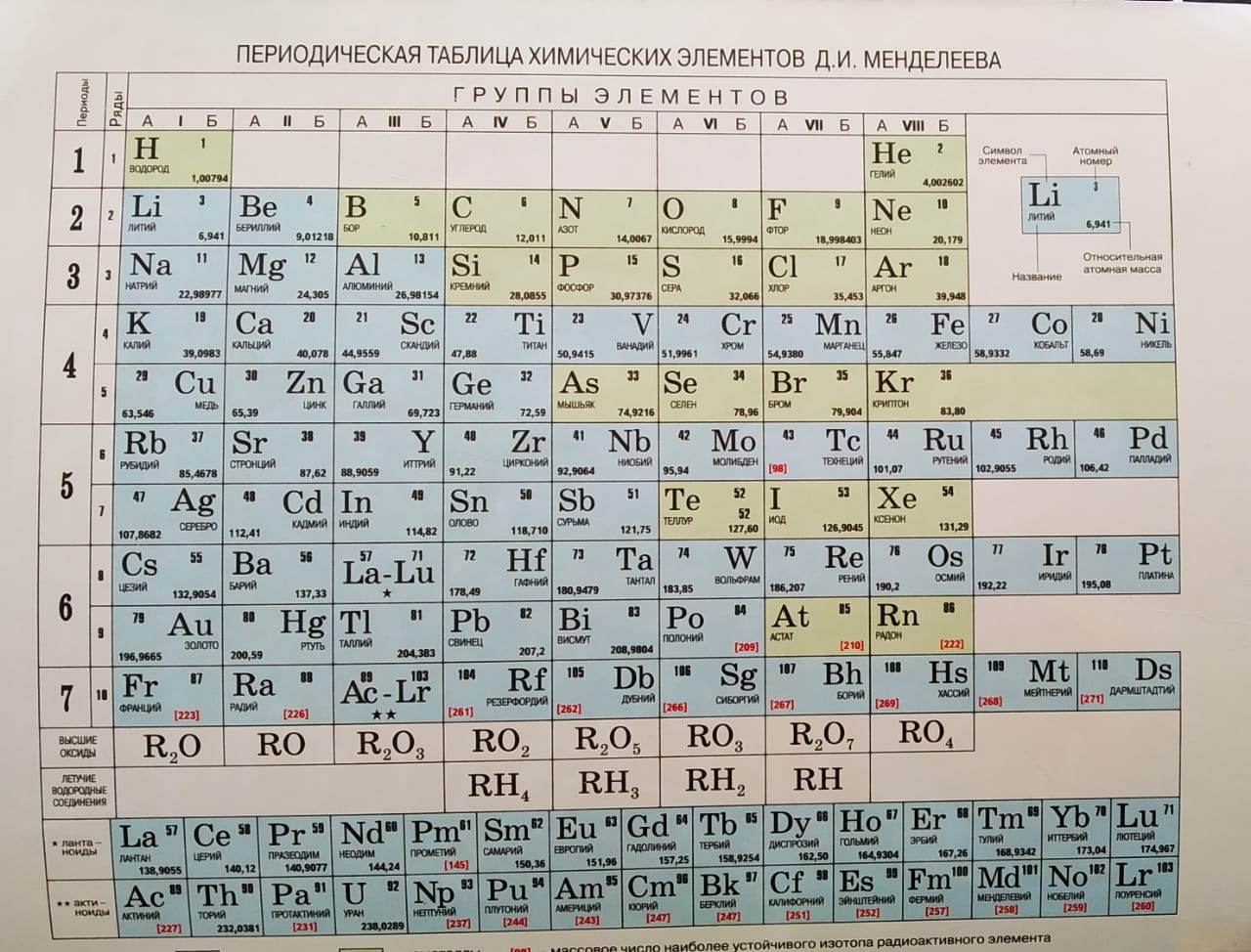
В Испании были предприняты многочисленные попытки классификации химических элементов и соединений, здесь предлагали искусственные, естественные и гибридные классификации. Поэтому испанские авторы учебников не были впечатлены Периодической системой Менделеева. Даже после открытия новых элементов, предсказанных Менделеевым, Периодическая таблица появилась в испанских учебниках, но рассматривалась не как основа классификации элементов, а лишь как способ введения теоретических аспектов в учебный материал.
В Германии информация о Периодической системе Менделеева долгое время встречалась только в научных публикациях, а не в учебных пособиях. Слишком тверды и непоколебимы были традиционные учебные программы по химии в этой стране. Периодический закон вошел в немецкие учебники только после появления квантовой химии.
И хотя в настоящее время все учебники по
неорганической химии базируются на логике Периодической системы
химических элементов Дмитрия Менделеева, приоритет русского ученого
продолжает замалчиваться или оспариваться авторами учебных пособий и
научных публикаций. Так, французские историки науки порой не упоминают
имя Д.Менделеева, но указывают на работы своего соотечественника
Александра Эмиля Бегуйе де Шанкуртуа от 1862 года, который также
занимался систематизацией химических элементов.
Так, французские историки науки порой не упоминают
имя Д.Менделеева, но указывают на работы своего соотечественника
Александра Эмиля Бегуйе де Шанкуртуа от 1862 года, который также
занимался систематизацией химических элементов.
Немецкие ученые утверждают, что основателем систематизации химических элементов стал в 1864 году Юлиус Лотар Мейер, более расширенная редакция системы элементов была опубликована Мейером в 1870 году.
Приоритет Менделеева оспаривают и англичане, пытаясь доказать, что Уильям Одлинг и Джон Александр Рейн Ньюлендс создали свою систему еще в 1864 году.
В
зарубежных химических лабораториях очень часто присутствует
Периодическая таблица химических элементов, на которой не указано имя
великого Д.Менделеева. Иногда называются имена местных химиков,
занимавшихся классификацией элементов, в надежде увековечить их труд,
напечатав красивые таблицы, которые по своей сути всегда повторяют ту,
что была впервые предложена русским ученым Д.Менделеевым.
В 1997 году японский историк химии Масанори Кадзи опубликовал на японском языке научную биографию Менделеева. Впоследствии он написал много статей на английском, японском и русском языках, посвященных различным сторонам жизни и творчества великого русского ученого. В 2005 году Кадзи был удостоен награды отделения истории химии Американского химического общества за выдающееся исследование “Система химических элементов Д.И.Менделеева и основы химии”, опубликованное в 2002 году.
Комментируя
объявление Международного года Периодической таблицы химических
элементов, президент Международного союза по теоретической и прикладной
химии, директор Института химии и проблем устойчивого развития
Российского химико-технологического университета им. Д.И.Менделеева
член-корреспондент РАН Наталия Тарасова отметила, что IUPAC с
воодушевлением воспринял это известие. “2019 год – год 150-летия
Периодического закона Дмитрия Менделеева. Величие и философское значение
этого открытия подчеркиваются недавними выдающимися достижениями в
области синтеза новых сверхтяжелых элементов. Напомню, что 115-й элемент
получил название московий. 118-й элемент, оганесон, назван в честь
выдающегося ученого, нашего современника академика Юрия Оганесяна”, –
сказала она.
Напомню, что 115-й элемент
получил название московий. 118-й элемент, оганесон, назван в честь
выдающегося ученого, нашего современника академика Юрия Оганесяна”, –
сказала она.
По словам Наталии Тарасовой, резолюция, принятая Генеральной Ассамблеей ООН, затрагивает обширный круг вопросов науки, технологии и инноваций для развития. “Я глубоко убеждена, что мероприятия в рамках Международного года ярко продемонстрируют роль фундаментальной науки и естественнонаучного образования в достижении целей устойчивого развития и послужат популяризации научных знаний в широких слоях общества”, – добавила ученый.
В Резолюции ООН
подчеркивается, что Международный год Периодической таблицы химических
элементов должен привлечь внимание мировой общественности к развитию
фундаментальных наук, к углублению и расширению образования для
устойчивого развития, к грандиозным проблемам современности, решить
которые без активного использования последних достижений “зеленой” химии
невозможно. Качество повседневной жизни нынешних и будущих поколений
человечества напрямую связано с успехами химической науки и технологии.
Качество повседневной жизни нынешних и будущих поколений
человечества напрямую связано с успехами химической науки и технологии.
Празднование
в 2019 году Международного года Периодической таблицы химических
элементов позволит акцентировать ряд очень важных вех в истории химии:
за 800 лет до нашей эры арабский алхимик по имени Джабир ибн Хайян сумел
впервые получить чистые мышьяк и сурьму; 350 лет назад, в 1669 году,
немецкий алхимик Хенниг Брандт открыл фосфор, который сначала был принят
за философский камень; 230 лет назад, в 1789 году, французский
естествоиспытатель Антуан Лавуазье издал “Начальный учебник химии”,
который тотчас же был переведен на многие иностранные языки и положил
конец эпохе флогистона, объяснил состав воздуха, воды, многих
органических соединений. Лавуазье первым дал классификацию веществ, он
издал список 33 химических соединений, сгруппированных в газы, металлы,
неметаллы и земли, заложил основы химической номенклатуры, очистив язык
химиков от запутанных и мистических алхимических формулировок и
названий. 190 лет назад, в 1829 году, немецкий ученый Йохан Вольфганг
Доберайнер занялся систематизацией химических элементов по триадам,
положив в основу своей классификации, помимо атомных весов, аналогию
свойств и характерных признаков элементов и их соединений.
190 лет назад, в 1829 году, немецкий ученый Йохан Вольфганг
Доберайнер занялся систематизацией химических элементов по триадам,
положив в основу своей классификации, помимо атомных весов, аналогию
свойств и характерных признаков элементов и их соединений.
Закон триад Доберайнера подготовил почву для систематизации элементов, завершившейся созданием Периодического закона Д.И.Менделеевым. 100 лет назад был создан Международный союз теоретической и прикладной химии – IUPAC, самый главный законодательный орган в области химии и химической технологии. 80 лет назад, в 1939 году, французская исследовательница Маргарита Катрин Перей при изучении актиния-227 обнаружила среди продуктов его распада нуклид нового элемента с порядковым номером 87, который был предсказан Д.Менделеевым и назван им “экацезием”. Впоследствии новый элемент, открытый Перей, получил название франций.
В
рамках Международного года Периодической таблицы химических элементов
намечено празднование Международного дня женщин в науке 11 февраля 2019
года, ведь в открытии новых химических элементов Периодической системы
выдающиеся женщины-химики сыграли очень важную роль. Здесь стоит
вспомнить Марию Кюри, которая была награждена Нобелевскими премиями в
1903 и 1911 годах за открытие радия и полония, Иду Ноддак, открывшую
рений (Rе), Маргариту Катрин Перей, открывшую франций, Лизу Мейтнер, в
честь которой был назван 109-й элемент таблицы Менделеева – мейтнерий, и
многих других выдающихся женщин в истории химии.
Здесь стоит
вспомнить Марию Кюри, которая была награждена Нобелевскими премиями в
1903 и 1911 годах за открытие радия и полония, Иду Ноддак, открывшую
рений (Rе), Маргариту Катрин Перей, открывшую франций, Лизу Мейтнер, в
честь которой был назван 109-й элемент таблицы Менделеева – мейтнерий, и
многих других выдающихся женщин в истории химии.
Запланированы и другие мероприятия, в частности специальный симпозиум IUPAC “Периодической таблице – 150” в Париже, а также посвященный юбилею Менделеевский съезд в Санкт-Петербурге.
Международный год Периодической таблицы химических элементов и открытие самого закона о периодичности свойств химических элементов еще раз подчеркивают важность системности в нашем хаотичном мире. Ведь именно Система дает нам шанс понять саму идею закономерности, а значит, вооружает нас способностью к предвидению.
Дмитрий Мустафин, доктор химических наук, профессор РХТУ им. Д.И.Менделеева
Mn в таблице менделеева.
 Периодическая система химических элементов
Периодическая система химических элементовДевятнадцатый век в истории человечества – век, в который многие науки реформировались, в том числе и химия. Именно в это время появилась периодическая система Менделеева, а вместе с ней – и периодический закон. Именно он стал основой современной химии. Периодическая система Д. И. Менделеева представляет собой систематизацию элементов, которая устанавливает зависимость химических и физических свойств от строения и заряда атома вещества.
История
Начало периодической положила книга «Соотношение свойств с атомным весом элементов», написанная в третьей четверти XVII века. В ней были отображены основные понятия относительно известных химических элементов (на тот момент их насчитывалось всего 63). К тому же у многих из них атомные массы были определены неправильно. Это сильно мешало открытию Д. И. Менделеева.
Дмитрий Иванович начал свою работу со сравнения свойств элементов. В первую очередь он занялся хлором и калием, а уж потом перешёл к работе со щелочными металлами.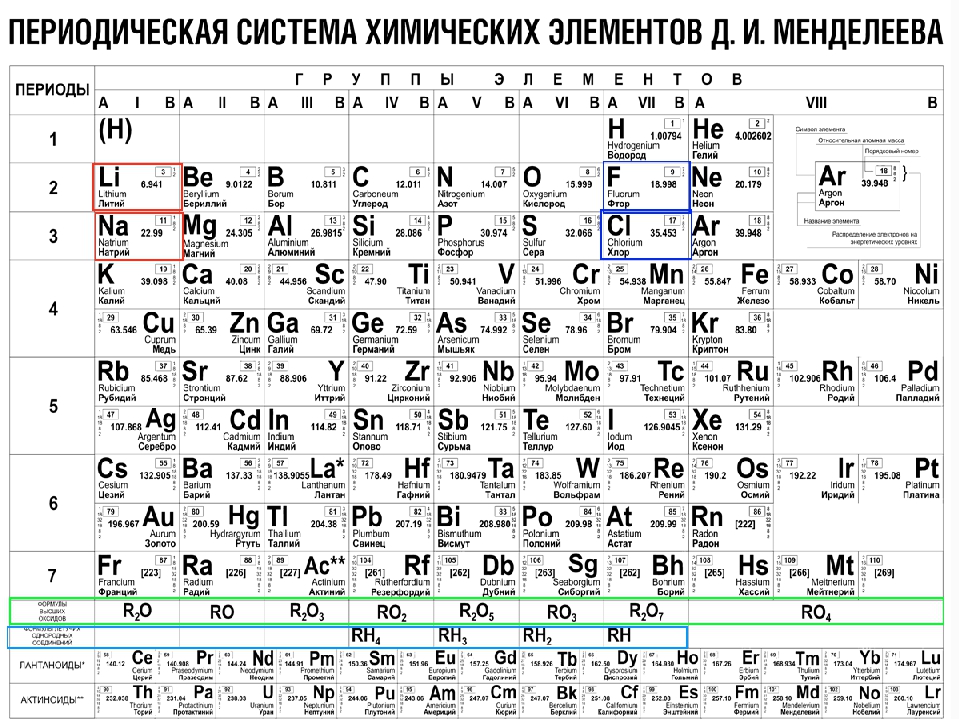 Вооружась специальными карточками, на которых были изображены химические элементы, он многократно пытался собрать эту «мозаику»: раскладывал на своем столе в поисках нужных комбинаций и совпадений.
Вооружась специальными карточками, на которых были изображены химические элементы, он многократно пытался собрать эту «мозаику»: раскладывал на своем столе в поисках нужных комбинаций и совпадений.
После долгих стараний Дмитрий Иванович все же нашёл ту закономерность, которую искал, и выстроил элементы в периодические ряды. Получив в результате пустые ячейки между элементами, учёный понял, что русским исследователям известны не все химические элементы, и что именно он должен дать этому миру те знания в области химии, которые ещё не были даны его предшественниками.
Всем известен миф о том, что Менделееву периодическая таблица явилась во сне, и он по памяти собрал элементы в единую систему. Это, грубо говоря, ложь. Дело в том, что Дмитрий Иванович довольно долго и сосредоточенно работал над своим трудом, и его это сильно выматывало. Во время работы над системой элементов Менделеев однажды заснул. Проснувшись, он понял, что не закончил таблицу, и скорее продолжил заполнение пустых ячеек. Его знакомый, некий Иностранцев, университетский педагог, решил, что таблица Менделееву приснилась во сне и распространил данный слух среди своих студентов. Так и появилась данная гипотеза.
Его знакомый, некий Иностранцев, университетский педагог, решил, что таблица Менделееву приснилась во сне и распространил данный слух среди своих студентов. Так и появилась данная гипотеза.
Известность
Химических элементов Менделеева является отображением созданного Дмитрием Ивановичем ещё в третьей четверти XIX века (1869 год) периодического закона. Именно в 1869 году на заседании русского химического сообщества было зачитано уведомление Менделеева о создании им определённой структуры. И в этом же году была выпущена книга «Основы химии», в которой впервые была опубликована периодическая система химических элементов Менделеева. А в книге «Естественная система элементов и использование её к указанию качеств неоткрытых элементов» Д. И. Менделеев впервые упомянул понятие «периодический закон».
Структура и правила размещения элементов
Первые шаги в создании периодического закона были сделаны Дмитрием Ивановичем еще в 1869-1871 годах, в то время он усиленно работал над установлением зависимости свойств данных элементов от массы их атома. Современный вариант представляет собой сведённые в двумерную таблицу элементы.
Современный вариант представляет собой сведённые в двумерную таблицу элементы.
Положение элемента в таблице несёт определённый химический и физический смысл. По местонахождению элемента в таблице можно узнать, какая у него валентность, определить и другие химические особенности. Дмитрий Иванович пытался установить связь между элементами, как сходными между собой по свойствам, так и отличающимися.
В основу классификации известных на тот момент химических элементов он положил валентность и атомную массу. Сопоставляя относительные свойства элементов, Менделеев пытался найти закономерность, которая объединила бы все известные химические элементы в одну систему. Расположив их, основываясь на возрастании атомных масс, он всё-таки добился периодичности в каждом из рядов.
Дальнейшее развитие системы
Появившаяся в 1969 году таблица Менделеева ещё не раз дорабатывалась. С появлением благородных газов в 1930 годах получилось выявить новейшую зависимость элементов – не от массы, а от порядкового номера. Позднее удалось установить число протонов в атомных ядрах, и оказалось, что оно совпадает с порядковым номером элемента. Учёными XX века было изучено электронное Оказалось, что и оно влияет на периодичность. Это сильно меняло представления о свойствах элементов. Данный пункт был отражён в более поздних редакциях периодической системы Менделеева. Каждое новое открытие свойств и особенностей элементов органично вписывалось в таблицу.
Позднее удалось установить число протонов в атомных ядрах, и оказалось, что оно совпадает с порядковым номером элемента. Учёными XX века было изучено электронное Оказалось, что и оно влияет на периодичность. Это сильно меняло представления о свойствах элементов. Данный пункт был отражён в более поздних редакциях периодической системы Менделеева. Каждое новое открытие свойств и особенностей элементов органично вписывалось в таблицу.
Характеристики периодической системы Менделеева
Таблица Менделеева поделена на периоды (7 строк, расположенных горизонтально), которые, в свою очередь, подразделяются на большие и малые. Начинается период со щелочного металла, а заканчивается элементом с неметаллическими свойствами.
Вертикально таблица Дмитрия Ивановича поделена на группы (8 столбцов). Каждая из них в периодической системе состоит из двух подгрупп, а именно – главной и побочной. После долгих споров по предложению Д. И. Менделеева и его коллеги У. Рамзая было решено ввести так называемую нулевую группу. В неё входят инертные газы (неон, гелий, аргон, радон, ксенон, криптон). В 1911 году учёным Ф. Содди было предложено поместить в периодической системе и неразличимые элементы, так называемые изотопы, – для них были выделены отдельные ячейки.
В неё входят инертные газы (неон, гелий, аргон, радон, ксенон, криптон). В 1911 году учёным Ф. Содди было предложено поместить в периодической системе и неразличимые элементы, так называемые изотопы, – для них были выделены отдельные ячейки.
Несмотря на верность и точность периодической системы, научное общество долго не хотело признавать данное открытие. Многие великие учёные высмеивали деятельность Д. И. Менделеева и считали, что невозможно предсказать свойства элемента, который ещё не был открыт. Но после того как предполагаемые химические элементы были открыты (а это были, например, скандий, галлий и германий), система Менделеева и его периодический закон стали науки химии.
Таблица в современности
Периодическая система элементов Менделеева – основа большинства химических и физических открытий, связанных с атомно-молекулярным учением. Современное понятие элемента сложилось как раз благодаря великому учёному. Появление периодической системы Менделеева внесло кардинальные изменения в представления о различных соединениях и простых веществах. Создание ученым периодической системы оказало огромное влияние на развитие химии и всех наук, смежных с ней.
Создание ученым периодической системы оказало огромное влияние на развитие химии и всех наук, смежных с ней.
Вероятно, все вы видели периодическую таблицу элементов. Возможно, что она и по сей день преследует вас в ваших снах, а может быть, она пока для вас всего лишь визуальный фон, украшающий стенку школьного класса. Однако в этой, казалось бы, случайной коллекции клеток кроется значительно больше, чем это кажется на первый взгляд.
Периодическая таблица (или ПТ, как мы будем периодически называть её в этой статье), а также те элементы, которые входят в неё, обладают чертами, о которых вы, возможно, никогда не догадывались. Вот десять фактов, начиная от создания таблицы и до внесения в неё последних элементов, которые большинству людей не известны.
10. Менделееву помогали
Периодическая таблица стала использоваться, начиная с 1869 года, когда она была составлена заросшим густой бородой Димитрием Менделеевым. Большинство людей думает, что Менделеев был единственным, кто работал над этой таблицей, и благодаря этому он стал самым гениальным химиком столетия. Однако его усилиям помогали несколько европейских учёных, которые внесли важный вклад в завершение этого колоссального набора элементов.
Однако его усилиям помогали несколько европейских учёных, которые внесли важный вклад в завершение этого колоссального набора элементов.
Менделеев широко известен как отец периодической таблицы, но, когда он её составлял, ещё не все элементы таблицы были уже открыты. Как такое стало возможно? Учёные славятся своим безумием…
9. Последние добавленные элементы
Верьте или нет, периодическая таблица не сильно менялась с 1950-х годов. Однако 2 декабря 2016 года было добавлено сразу четыре новых элемента: нихоний (элемент №113), московий (элемент №115), тенессин (элемент №117) и оганесон (элемент №118). Эти новые элементы получили свои названия только в июне 2016 года, так как потребовалась пятимесячная экспертиза, прежде чем их официально добавили в ПТ.
Три элемента получили свои названия в честь городов или государств, в которых их удалось получить, а оганесон был назван в честь российского физика-ядерщика Юрия Оганесяна за его вклад в получение этого элемента.
8. Какой буквы нет в таблице?
В латинском алфавите есть 26 букв, и каждая из них важна. Однако Менделеев решил этого не замечать. Взгляните на таблицу и скажите, какой букве не повезло? Подсказка: ищите по порядку и загибайте при этом пальцы после каждой найденной буквы. В итоге вы найдёте «пропавшую» букву (если у вас на руках присутствуют все десять пальцев). Догадались? Это буква под номером 10, буква «J».
Говорят, что «единица» – это цифра одиноких. Так, может, стоило бы назвать букву «J» буквой одиноких? Но вот забавный факт: большинство мальчиков, родившихся в США в 2000 году, получили имена, начинавшиеся с этой буквы. Таким образом, эта буква не осталась без должного внимания.
7. Синтезированные элементы
Как вы, возможно, уже знаете, на сегодняшний день в периодической таблице присутствует 118 элементов. Можете ли вы догадаться, сколько элементов из этих 118 были получены лабораторным путём? Из всего общего списка в природных условиях можно найти лишь 90 элементов.

Вам кажется, что 28 искусственно созданных элементов – это много? Ну, просто поверьте на слово. Их синтезируют, начиная с 1937 года, и учёные продолжают это делать и сейчас. Все эти элементы вы можете найти в таблице. Посмотрите на элементы с 95 по 118, все эти элементы отсутствуют на нашей планете и были синтезированы в лабораториях. То же касается и элементов под номерами 43, 61, 85 и 87.
6. 137-й элемент
В середине 20-го века известный учёный по имени Ричард Фейнман сделал довольно громкое заявление, которое повергло в изумление весь научный мир нашей планеты. По его словам, если мы когда-нибудь обнаружим 137-й элемент, то мы не сможем определить количество в нём протонов и нейтронов. Число 1/137 примечательно тем, что это значение константы тонкой структуры, которая описывает вероятность поглощения или излучения электроном фотона. Теоретически элемент №137 должен иметь 137 электронов и 100-процентную вероятность поглощения фотона. Его электроны будут вращаться со скоростью света.
 Ещё более невероятно, что электроны элемента 139, чтобы существовать, должны вращаться быстрее, чем скорость света.
Ещё более невероятно, что электроны элемента 139, чтобы существовать, должны вращаться быстрее, чем скорость света.Вы ещё не устали от физики? Возможно, вам будет интересно узнать, что число 137 объединяет три важнейших области физики: теорию о скорости света, квантовую механику и электромагнетизм. С начала 1900-х годов физики предполагают, что цифра 137 может быть основой Великой единой теории, в которую войдут все три вышеуказанных области. По общему признанию, это звучит так же невероятно, как легенды о НЛО и о Бермудском треугольнике.
5. Что можно сказать о названиях?
Почти все названия элементов имеют какой-то смысл, хотя он и не сразу понятен. Названия новым элементам даются не произвольно. Я бы назвал элемент просто первым пришедшим мне в голову словом. Например, «керфлумп». По-моему, неплохо.
Как правило, названия элементов относятся к одной из пяти основных категорий. Первая – это имена известных учёных, классический вариант – эйнштейний. Кроме того, элементы могут получить свои имена в зависимости от тех мест, где они были впервые зарегистрированы, например, германий, америций, галлий и т. д. В качестве дополнительной опции используются названия планет. Элемент уран был впервые обнаружен вскоре после того, как была открыта планета Уран. Элементы могут носить имена, связанные с мифологией, например, существует титан, названный так в честь древнегреческих титанов, и торий, названный по имени скандинавского бога-громовержца (или звёздного «мстителя», в зависимости от того, что вы предпочитаете).
д. В качестве дополнительной опции используются названия планет. Элемент уран был впервые обнаружен вскоре после того, как была открыта планета Уран. Элементы могут носить имена, связанные с мифологией, например, существует титан, названный так в честь древнегреческих титанов, и торий, названный по имени скандинавского бога-громовержца (или звёздного «мстителя», в зависимости от того, что вы предпочитаете).
И, наконец, есть названия, описывающие свойства элементов. Аргон происходит от греческого слова «аргос», что означает «ленивый» или «медленный». Из названия следует предположение, что этот газ не отличается активностью. Бром – это ещё один элемент, название которого происходит от греческого слова. «Бромос» означает «зловоние», и это довольно точно описывает запах брома.
4. Было ли создание таблицы «озарением»
Если вы любите карточные игры, то этот факт для вас. Менделееву требовалось каким-то образом упорядочить все элементы и найти систему для этого.
 Естественно, что для создания таблицы по категориям он обратился к пасьянсу (ну, а к чему же ещё?) Менделеев записал атомный вес каждого элемента на отдельной карточке, а затем приступил к раскладке своего передового пасьянса. Он укладывал элементы в соответствии с их специфическими свойствами, а затем упорядочивал их в каждом столбце в соответствии с их атомным весом.
Естественно, что для создания таблицы по категориям он обратился к пасьянсу (ну, а к чему же ещё?) Менделеев записал атомный вес каждого элемента на отдельной карточке, а затем приступил к раскладке своего передового пасьянса. Он укладывал элементы в соответствии с их специфическими свойствами, а затем упорядочивал их в каждом столбце в соответствии с их атомным весом.Многие не могут сложить и обычный пасьянс, так что этот пасьянс впечатляет. Что будет дальше? Наверное, кто-нибудь с помощью шахмат сделает переворот в астрофизике или создаст ракету, способную долететь до окраин галактики. Представляется, что в этом не будет ничего необычного, если учесть, что Менделеев сумел получить такой гениальный результат всего лишь с помощью колоды обычных игральных карт.
3. Невезучие инертные газы
Помните, как мы классифицировали аргон как самый «ленивый» и «медленный» элемент в истории нашей вселенной? Похоже, что Менделеевым овладели такие же чувства. Когда в 1894 году впервые удалось получить чистый аргон, он не вписывался ни в один из столбцов таблицы, поэтому, вместо того чтобы заняться поисками решения, учёный решил просто отрицать его существование.
Ещё более поразительно, что аргон был не единственным элементом, который изначально постигла эта судьба. Помимо аргона, без классификации остались ещё пять других элементов. Это коснулось радона, неона, криптона, гелия и ксенона – и все отрицали их существование просто потому, что Менделеев не смог найти для них места в таблице. После нескольких лет перегруппировки и переклассификации этим элементам (названных инертными газами) всё-таки посчастливилось присоединиться к достойному клубу признанных реально существующими.
2. Атомная любовь
Совет для всех тех, кто считает себя романтиком. Возьмите бумажную копию периодической таблицы и вырежьте из неё все сложные и относительно ненужные средние столбцы так, чтобы у вас осталось 8 колонок (вы получите «короткую» форму таблицы). Сложите её посредине IV группы – и вы узнаете, какие элементы могут образовывать соединения друг с другом.
Элементы, которые «целуются» при складывании, способны образовывать стабильные соединения. Эти элементы имеют комплементарные электронные структуры, и они будут сочетаться друг с другом. И, если это не настоящая любовь, как у Ромео с Джульеттой или у Шрека с Фионой – тогда я не знаю, что такое любовь.
Эти элементы имеют комплементарные электронные структуры, и они будут сочетаться друг с другом. И, если это не настоящая любовь, как у Ромео с Джульеттой или у Шрека с Фионой – тогда я не знаю, что такое любовь.
1. Углерод рулит
Углерод пытается быть в центре игры. Вы думаете, что всё знаете об углероде, но это не так, он занимает намного более важное место, чем вы это себе представляете. Знаете ли вы, что он присутствует более чем в половине всех известных соединений? И как насчёт того факта, что 20 процентов веса всех живых организмов приходится на углерод? Это действительно странно, но приготовьтесь: каждый атом углерода в вашем теле был когда-то частью фракции углекислого газа в атмосфере. Углерод является не только суперэлементом нашей планеты, он четвёртый по численности элемент во всей Вселенной.
Если периодическую таблицу сравнить с вечеринкой, то углерод – её главный ведущий. И кажется, что он единственный знает, как нужно всё правильно организовать. Ну и, помимо прочего, это основной элемент всех бриллиантов, так что при всей своей назойливости он ещё и блестит!
Ну и, помимо прочего, это основной элемент всех бриллиантов, так что при всей своей назойливости он ещё и блестит!
Открытие Дмитрием Менделеевым периодической таблицы химических элементов в марте 1869 года стало настоящим прорывом в химии. Российскому ученому удалось систематизировать знания о химических элементах и представить их в виде таблицы, которую и сейчас обязательно изучают школьники на уроках химии. Периодическая таблица стала фундаментом для бурного развития этой сложной и интересной науки, а история ее открытия окутана легендами и мифами. Для всех увлекающихся наукой будет интересно узнать правду о том, как Менделеев открыл таблицу периодических элементов.
История таблицы Менделеева: как все начиналось
Попытки классифицировать и систематизировать известные химические элементы предпринимались задолго до Дмитрия Менделеева. Свои системы элементов предлагали такие известные ученые, как Деберейнер, Ньюлендс, Мейер и другие. Однако из-за нехватки данных о химических элементах и их правильных атомных массах предложенные системы были не совсем достоверными.
История открытия таблицы Менделеева начинается в 1869 году, когда российский ученый на заседании Русского химического общества рассказал своим коллегам о сделанном им открытии. В предложенной ученым таблице химические элементы располагались в зависимости от их свойств, обеспечивающихся величиной их молекулярной массы.
Интересной особенностью таблицы Менделеева было также наличие пустых клеток, которые в будущем были заполнены открытыми химическими элементами, предсказанными ученым (германий, галлий, скандий). После открытия периодической таблицы в нее много раз вносились добавления и поправки. Совместно с шотландским химиком Уильямом Рамзаем Менделеев добавил в таблицу группу инертных газов (нулевую группу).
В дальнейшем история периодической таблицы Менделеева была напрямую связана с открытиями в другой науке – физике. Работа над таблицей периодических элементов продолжается до сих пор, и современные ученые добавляют новые химические элементы по мере их открытия. Значение периодической системы Дмитрия Менделеева сложно переоценить, так как благодаря ей:
- Систематизировались знания о свойствах уже открытых химических элементов;
- Появилась возможность прогнозирования открытия новых химических элементов;
- Начали развиваться такие разделы физики, как физика атома и физика ядра;
Существует множество вариантов изображения химических элементов согласно периодическому закону, однако наиболее известный и распространенный вариант – это привычная для каждого таблица Менделеева.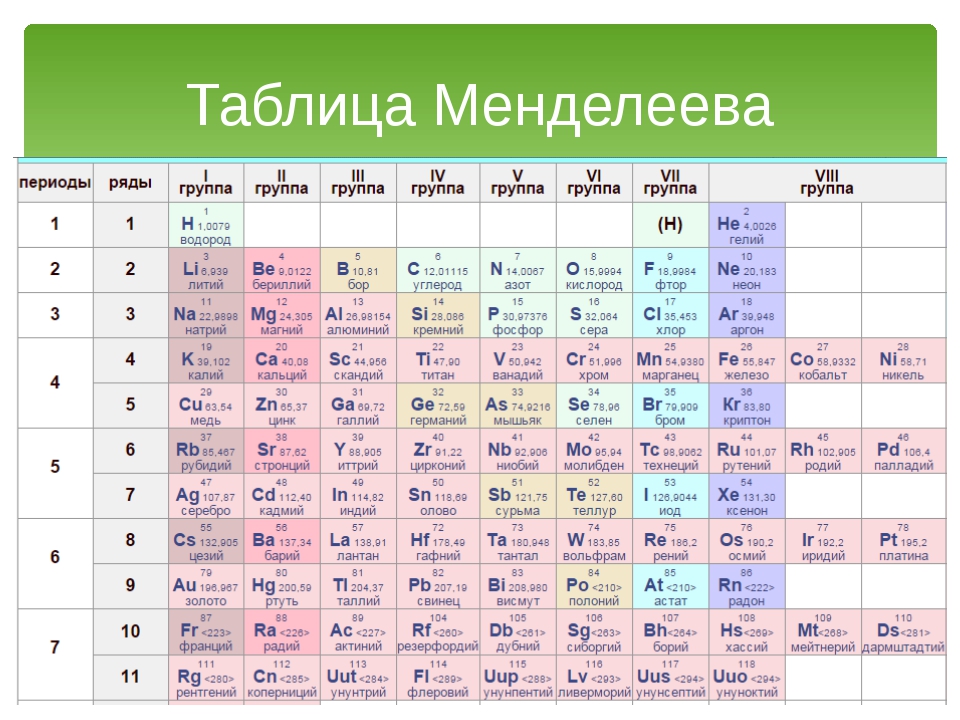
Мифы и факты о создании периодической таблицы
Самым распространенным заблуждением в истории открытия таблицы Менделеева является то, что ученый увидел ее во сне. На самом деле сам Дмитрий Менделеев опроверг этот миф и заявил, что размышлял над периодическим законом на протяжении многих лет. Чтобы систематизировать химические элементы он выписывал каждый из них на отдельную карточку и многократно комбинировал их между собой, расставляя в ряды в зависимости от их схожих свойств.
Миф о «вещем» сне ученого можно объяснить тем, что Менделеев работал над систематизацией химических элементов сутками напролет, прерываясь на непродолжительный сон. Однако только упорный труд и природный талант ученого дал долгожданный результат и обеспечил Дмитрию Менделееву всемирную известность.
Многих учащихся в школе, а иногда и в университете, заставляютзаучивать или хотя бы примерно ориентироваться в таблице Менделеева. Для этого человек должен не только иметь хорошую память, но и логически мыслить, связывая элементы в отдельные группы и классы. Изучение таблицы легче всего дается тем людям, которые постоянно поддерживают мозг в тонусе, проходя тренинги на BrainApps.
Изучение таблицы легче всего дается тем людям, которые постоянно поддерживают мозг в тонусе, проходя тренинги на BrainApps.
Любой, кто ходил в школу, помнит, что одним из обязательных для изучения предметов была химия. Она могла нравиться, а могла и не нравиться – это не важно. И вполне вероятно, что многие знания по этой дисциплине уже забыты и в жизни не применяются. Однако таблицу химических элементов Д. И. Менделеева наверняка помнит каждый. Для многих она так и осталась разноцветной таблицей, где в каждый квадратик вписаны определённые буквы, обозначающие названия химических элементов. Но здесь мы не будем говорить о химии как таковой, и описывать сотни химических реакций и процессов, а расскажем о том, как вообще появилась таблица Менделеева – эта история будет интересна любому человеку, да и вообще всем тем, кто охоч до интересной и полезной информации.
Небольшая предыстория
В далёком 1668 году выдающимся ирландским химиком, физиком и богословом Робертом Бойлем была опубликована книга, в которой было развенчано немало мифов об алхимии, и в которой он рассуждал о необходимости поиска неразложимых химических элементов. Учёный также привёл их список, состоящий всего из 15 элементов, но допускал мысль о том, что могут быть ещё элементы. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Учёный также привёл их список, состоящий всего из 15 элементов, но допускал мысль о том, что могут быть ещё элементы. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов. 23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учёными по всему миру. И главную роль в этом процессе сыграл знаменитый русский химик Дмитрий Иванович Менделеев – он впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
Благодаря кропотливому труду и сопоставлению химических элементов Менделеев смог обнаружить связь между элементами, в которой они могут быть одним целым, а их свойства являются не чем-то само собой разумеющимся, а представляют собой периодически повторяющееся явление. В итоге, в феврале 1869 года Менделеев сформулировал первый периодический закон, а уже в марте его доклад «Соотношение свойств с атомным весом элементов» был представлен на рассмотрение Русского химического общества историком химии Н.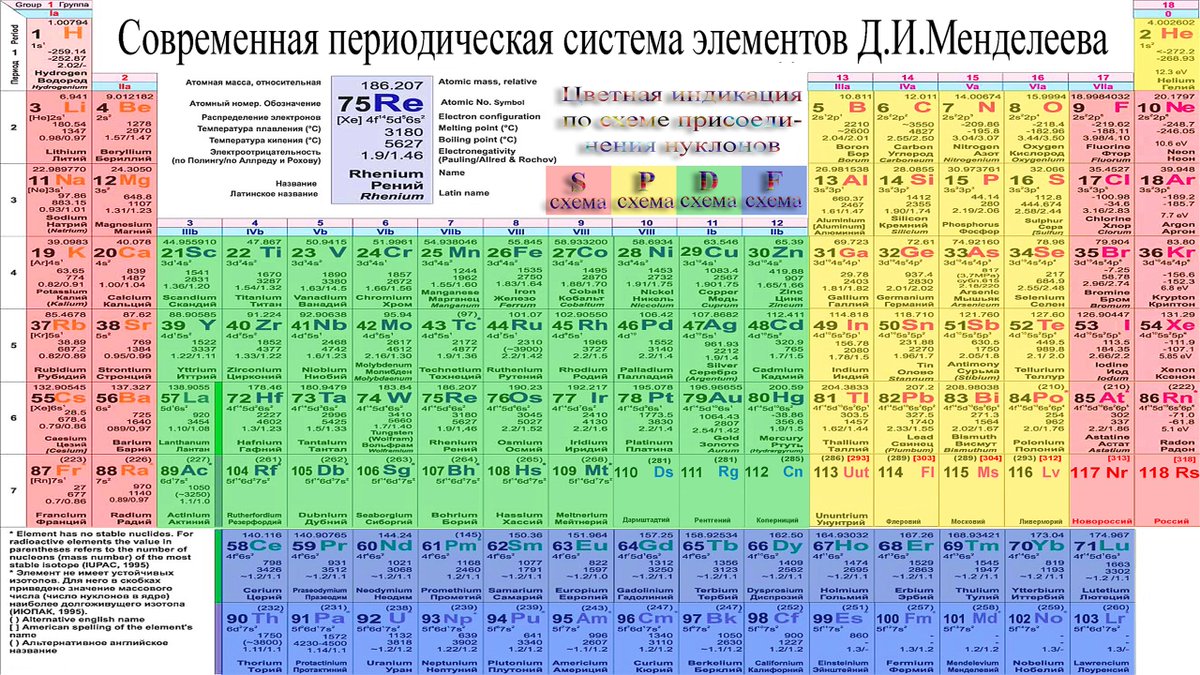 А. Меншуткиным. Затем в том же году публикация Менделеева была напечатана в журнале «Zeitschrift fur Chemie» в Германии, а в 1871 году новую обширную публикацию учёного, посвящённую его открытию, опубликовал другой немецкий журнал «Annalen der Chemie».
А. Меншуткиным. Затем в том же году публикация Менделеева была напечатана в журнале «Zeitschrift fur Chemie» в Германии, а в 1871 году новую обширную публикацию учёного, посвящённую его открытию, опубликовал другой немецкий журнал «Annalen der Chemie».
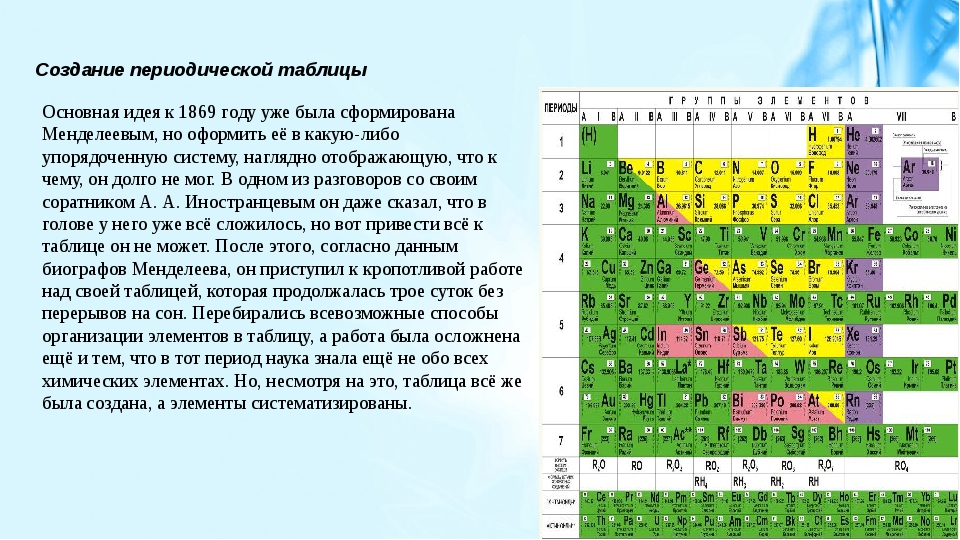
Создание периодической таблицы
Основная идея к 1869 году уже была сформирована Менделеевым, причём за довольно короткое время, но оформить её в какую-либо упорядоченную систему, наглядно отображающую, что к чему, он долго не мог. В одном из разговоров со своим соратником А. А. Иностранцевым он даже сказал, что в голове у него уже всё сложилось, но вот привести всё к таблице он не может. После этого, согласно данным биографов Менделеева, он приступил к кропотливой работе над своей таблицей, которая продолжалась трое суток без перерывов на сон. Перебирались всевозможные способы организации элементов в таблицу, а работа была осложнена ещё и тем, что в тот период наука знала ещё не обо всех химических элементах. Но, несмотря на это, таблица всё же была создана, а элементы систематизированы.
Легенда о сне Менделеева
Многие слышали историю, что Д. И. Менделееву его таблица приснилась. Эта версия активно распространялась вышеупомянутым соратником Менделеева А. А. Иностранцевым в качестве забавной истории, которой он развлекал своих студентов. Он говорил, что Дмитрий Иванович лёг спать и во сне отчётливо увидел свою таблицу, в которой все химические элементы были расставлены в нужном порядке. После этого студенты даже шутили, что таким же способом была открыта 40° водка. Но реальные предпосылки для истории со сном всё же были: как уже упоминалось, Менделеев работал над таблицей без сна и отдыха, и Иностранцев однажды застал его уставшим и вымотанным. Днём Менделеев решил немного передохнуть, а некоторое время спустя, резко проснулся, сразу же взял листок бумаги и изобразил на нём уже готовую таблицу. Но сам учёный опровергал всю эту историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.
Дальнейшая работа
В период с 1869 по 1871 годы Менделеев развивал идеи периодичности, к которым склонялось научное сообщество. И одним из важных этапов данного процесса стало понимание того, что любой элемент в системе должно располагать, исходя из совокупности его свойств в сравнении со свойствами остальных элементов. Основываясь на этом, а также опираясь на результаты исследований в изменении стеклообразующих оксидов, химику удалось внести поправки в значения атомных масс некоторых элементов, среди которых были уран, индий, бериллий и другие.
Пустые клетки, остававшиеся в таблице, Менделеев, конечно же, хотел скорее заполнить, и в 1870 году предсказал, что в скором времени будут открыты неизвестные науке химические элементы, атомные массы и свойства которых он сумел вычислить. Первыми из них стали галлий (открыт в 1875 году), скандий (открыт в 1879 году) и германий (открыт в 1885 году). Затем прогнозы продолжили реализовываться, и были открыты ещё восемь новых элементов, среди которых: полоний (1898 год), рений (1925 год), технеций (1937 год), франций (1939 год) и астат (1942-1943 годы).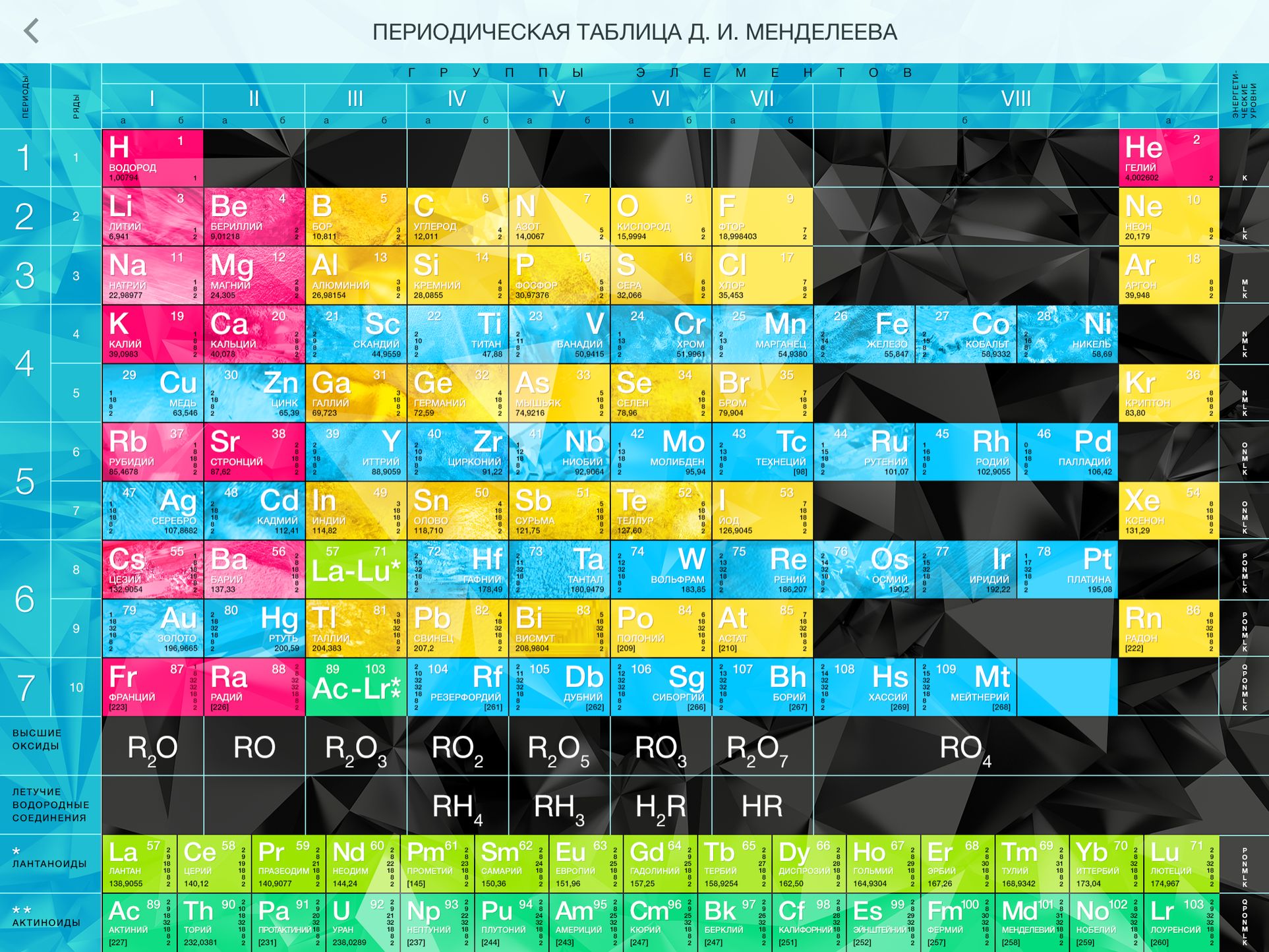 Кстати, в 1900 году Д. И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
Кстати, в 1900 году Д. И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
Организация периодической системы
Химические элементы в таблице Д. И. Менделеева расположены по рядам, в соответствии с возрастанием их массы, а длина рядов подобрана так, чтобы находящиеся в них элементы имели схожие свойства. Например, благородные газы, такие как радон, ксенон, криптон, аргон, неон и гелий с трудом вступают в реакции с другими элементами, а также имеют низкую химическую активность, из-за чего расположены в крайнем правом столбце. А элементы левого столбца (калий, натрий, литий и т.д.) отлично реагируют с прочими элементами, а сами реакции носят взрывной характер. Говоря проще, внутри каждого столбца элементы имеют подобные свойства, варьирующиеся при переходе от одного столбца к другому. Все элементы, вплоть до №92 встречаются в природе, а с №93 начинаются искусственные элементы, которые могут быть созданы лишь в лабораторных условиях.
В своём первоначальном варианте периодическая система понималась только как отражение существующего в природе порядка, и никаких объяснений, почему всё должно обстоять именно так, не было. И лишь когда появилась квантовая механика, истинный смысл порядка элементов в таблице стал понятен.
Уроки творческого процесса
Говоря о том, какие уроки творческого процесса можно извлечь из всей истории создания периодической таблицы Д. И. Менделеева, можно привести в пример идеи английского исследователя в области творческого мышления Грэма Уоллеса и французского учёного Анри Пуанкаре. Приведём их вкратце.
Согласно исследованиям Пуанкаре (1908 год) и Грэма Уоллеса (1926 год), существует четыре основных стадии творческого мышления:
- Подготовка – этап формулирования основной задачи и первые попытки её решения;
- Инкубация – этап, во время которого происходит временное отвлечение от процесса, но работа над поиском решения задачи ведётся на подсознательном уровне;
- Озарение – этап, на котором находится интуитивное решение.
 Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации; - Проверка – этап испытаний и реализации решения, на котором происходит проверка этого решения и его возможное дальнейшее развитие.
Как мы видим, в процессе создания своей таблицы Менделеев интуитивно следовал именно этим четырём этапам. Насколько это эффективно, можно судить по результатам, т.е. по тому, что таблица была создана. А учитывая, что её создание стало огромным шагом вперёд не только для химической науки, но и для всего человечества, приведённые выше четыре этапа могут быть применимы как к реализации небольших проектов, так и к осуществлению глобальных замыслов. Главное помнить, что ни одно открытие, ни одно решение задачи не могут быть найдены сами по себе, как бы ни хотели мы увидеть их во сне и сколько бы ни спали. Чтобы что-то получилось, не важно, создание это таблицы химических элементов или разработка нового маркетинг-плана, нужно обладать определёнными знаниями и навыками, а также умело использовать свои потенциал и упорно работать.
Мы желаем вам успехов в ваших начинаниях и успешной реализации задуманного!
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
Периодическая система химических элементов Д. И. Менделеева
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства.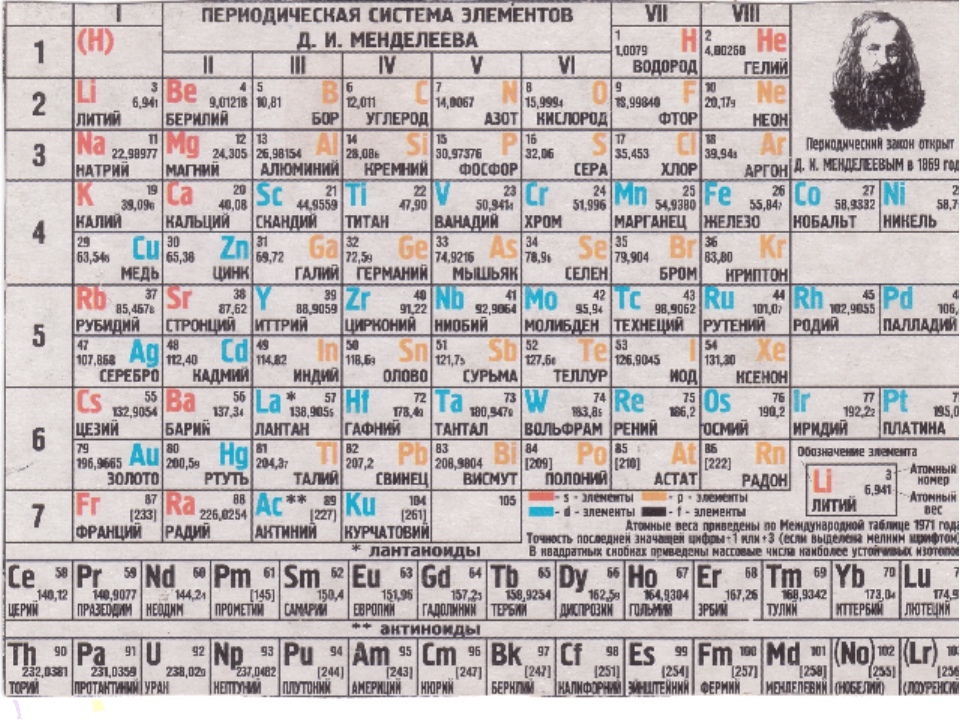 Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов .
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера) .
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом – 32, а в седьмом (пока незавершенном) – 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R 2 O, RO, R 2 O 3 , RO 2 , R 2 O 5 , RO 3 , R 2 O 7 , RO 4 , где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R 2 O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO 2 , R 2 O 5 , RO 3 , R 2 O 7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH 4 , RH 3 , RH 2 , RH.
Соединения RH 4 имеют нейтральный характер; RH 3 – слабоосновный; RH 2 – слабокислый; RH – сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.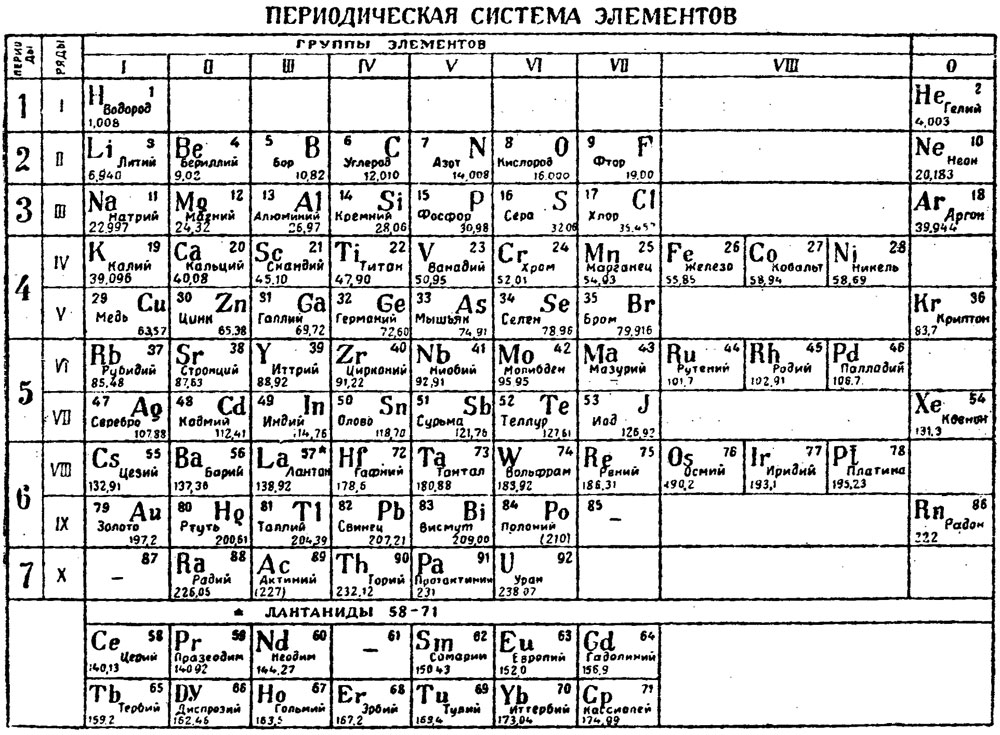
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы – мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды – это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газах все электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
Переходные металлы
Переходные металлы занимают группы 3-12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13-16 периодической таблицы.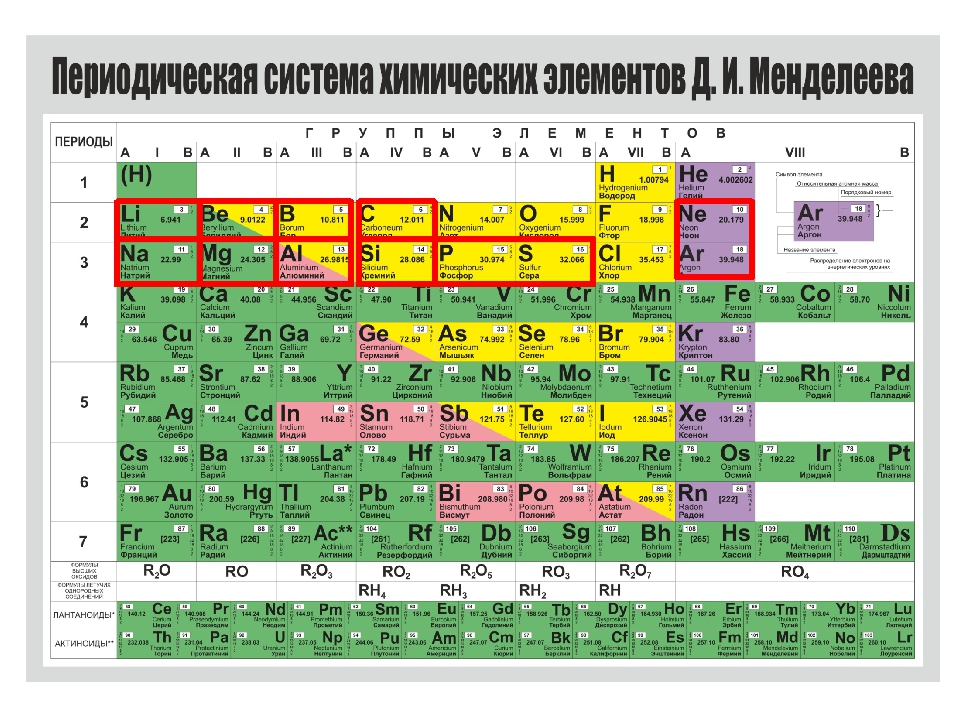 Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
Постпереходными металлами
Элементы, называемые постпереходными металлами , относятся к группам 13-15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.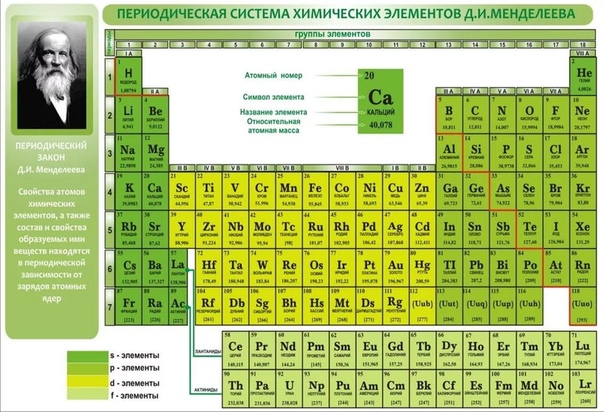
Ученые выбрали имя для нового химического элемента: Наука и техника: Lenta.ru
Группа немецких ученых под руководством профессора Зигурда Хофмана, которая принимала участие в синтезировании 112-го элемента таблицы Менделеева, предложила название своему детищу. Физики считают, что новый элемент должен называться коперникием (Сopernicium) в честь Николая Коперника. Информация об этом появилась в пресс-релизе на сайте Ассоциации немецких исследовательских центров.
Официально новое имя будет утверждено примерно через полгода. Обозначаться коперникий предполагается как Cp. Ранее учеными для данного элемента уже предлагалось несколько названий – Виксхаузий, Гельмгольций, Венусий, Фриший, Штрассманий и Гейзенбергий.
112-элемент является самым тяжелым из официально признанных Международным химическим союзом (признание произошло в июне 2009 года). В настоящее время известны трансурановые элементы с номерами 113-116 и 118, полученные в Объединенном институте ядерных исследований в Дубне, однако они официально пока не признаны.
Новый элемент, который сейчас носит временное имя унунбий, был впервые синтезирован в феврале 1996 года на ускорителе тяжелых ионов в Институте тяжелых ионов (Gesellschaft für Schwerionenforschung, GSI) в Дармштадте, Германия. В получении элемента принимал участие профессор GSI Зигурд Хофман, который и выступил с предложением назвать новый элемент в честь Николая Коперника. Сотрудники немецкого центра уже не в первый раз выбирают имена для химических элементов – благодаря им в таблице Менделеева появились борий, хассий, мейтнерий, дармштадтий и рентгений.
Сверхтяжелые элементы не встречаются (в частности, из-за малого периода полураспада) в природе и обычно получаются в ускорителях элементарных частиц. Например, унунбий был получен при бомбардировке свинцовой мишени ядрами цинка. Период полураспада данного элемента составляет примерно 34 секунды.
Совсем недавно в Ульяновской области приступили к изготовлению новой мишени, которую планируется использовать для получения на ускорителе в Дубне 117-го элемента периодической таблицы. Мишень представляет собой диск диаметром 14 сантиметров, на котором закреплены элементы из титановой фольги, покрытые берклием. На синтезирование необходимого количества данного элемента (25 миллиграммов) у специалистов ушло более двух лет.
Мишень представляет собой диск диаметром 14 сантиметров, на котором закреплены элементы из титановой фольги, покрытые берклием. На синтезирование необходимого количества данного элемента (25 миллиграммов) у специалистов ушло более двух лет.
Таблица Менделеева появилась на фасаде вокзала в Дубне — Рамблер/новости
На фасаде здания дубненского вокзала появилось изображение таблицы Менделеева.
Дубний, Флеровий, Оганессон — названия этих элементов таблицы Менделеева знает каждый дубненец. Их синтезировали ученые Объединенного института ядерных исследований в Дубне. Всего за последние 60 лет в ОИЯИ было открыто десять элементов. Поэтому для жителей это событие — настоящий праздник. На вокзал пришли сотни дубненцев, играла живая музыка.
Сорвать покрывало с изображения таблицы доверили авторам идеи, которые и воплотили ее в жизнь. Неравнодушные жители — Сергей Муравьев и Александр Прохоров — впервые предложили создать в Дубне памятник таблице еще пять лет назад на дубненском форуме. Для них ОИЯИ — с детства главный символ города. Спустя годы они осуществили свою задумку. После согласования с различными инстанциями, мужчины на свои средства изготовили изображение таблицы, которое нанесли на плитки на фасаде здания.
Для них ОИЯИ — с детства главный символ города. Спустя годы они осуществили свою задумку. После согласования с различными инстанциями, мужчины на свои средства изготовили изображение таблицы, которое нанесли на плитки на фасаде здания.
«Сейчас у нас в городе все типовое стало. Раньше было кафе „Нейтрино“, книжный магазин „Эврика“, были символы, который создавали неповторимый облик наукограда. Хотелось создать что-то, что напоминало бы о том, что мы живем в наукограде», — рассказал инициатор установки таблицы Менделеева Александр Прохоров.
Источник фото: телеканал «360»
Открытие символично прошло 1 Мая: элемент Дубний, названный в честь города, располагается в таблице как раз под номером 105. Символичен и год. 2019-й в ЮНЕСКО объявили Международным годом Периодической таблицы имени Менделеева. Ученые по достоинству оценили новую достопримечательность наукограда.
«В этом году работы по синтезу начались с чистого листа. Недавно мы открыли Фабрику сверхтяжелых элементов, на которой будут продолжены работы и, мы уверены, будут синтезированы новые элементы.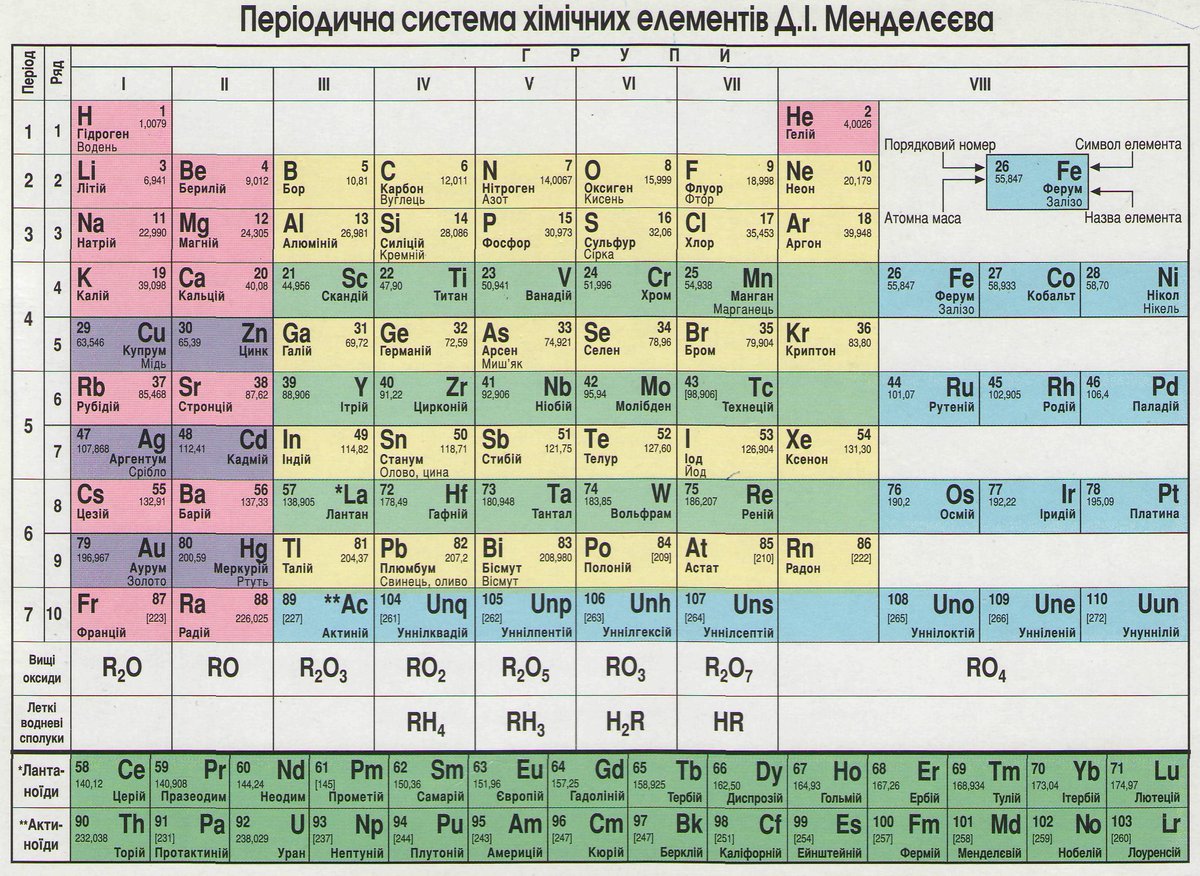 И тогда здесь придется продолжать эту таблицу, заменяя новые и новые плиточки на этой стене», — отметил представитель ОИЯИ, руководитель управления социальной инфраструктуры института Андрей Тамонов.
И тогда здесь придется продолжать эту таблицу, заменяя новые и новые плиточки на этой стене», — отметил представитель ОИЯИ, руководитель управления социальной инфраструктуры института Андрей Тамонов.
В преддверии такого события сотрудники РЖД привели вокзал в порядок. На память об этом дне дубненцы унесли с собой символичные открытки, на которых нарисован вокзал. На каждой — марка с изображением химических элементов. Идея такого сувенира также принадлежит жителям муниципалитета.
Источник фото: телеканал «360»
Напомним, летом в Дубне начнутся работы по благоустройству набережной имени Менделеева. Планируется, что там появится аллея химических элементов.
ВЗГЛЯД / Таблица Менделеева расширилась :: Общество
Российские ученые из Объединенного института ядерных исследований открыли новые, самые тяжелые элементы Периодической системы Д. И. Менделеева. 28 мая был завершен эксперимент по химической идентификации элементов 115 и 113 по конечному продукту распада – элементу, названному «Дубний-105», и теперь российские ученые смело могут заявить, что открыли элементы в таблице с атомарными номерами 112, 113, 114, 115 и 116.
Как уверяют ученые, это открытие может существенно повлиять на знания ученых всего мира о формировании Вселенной и процессах, формирующих атомные элементы таблицы Менделеева.
Ошибка Нильса Бора
Это открытие может существенно повлиять на знания ученых всего мира о формировании ВселеннойВ 1941 году, когда были открыты первые искусственные элементы – нептуний и плутоний, – появилось новое направление ядерной физики и химии, которое исследовало свойства трансурановых элементов и возможность их применения в науке и технике. Именно с того времени вопрос о верхней границе в таблице Менделеева стал предметом горячего обсуждения в Германии, США, Японии, Франции и Советском Союзе. В нашей стране эксперименты в этой области проводились в Дубне, где находится Объединенный институт ядерных исследований, и за много лет работы было синтезировано 20 новых элементов, вплоть до 112-го.
Выяснилось, что чем больше атомный номер элемента, тем меньше он живет, – например, уран (№ 92) живет около миллиарда лет, а неназванный 112-й элемент всего 0,00002 секунды.
В середине 60-х годов прошлого века появилась гипотеза о существовании очень тяжелых долгоживущих атомных ядер, которым принадлежат так называемые «острова стабильности». (Напомним, что небезызвестный Нильс Бор предрекал, что последним элементом в Периодической системе станет № 104, поскольку следующие за ним элементы «живут» так мало времени, что говорить о них как о стабильной материи бессмысленно.)
Экспериментальное подтверждение гипотеза получила в ОИЯИ во время исследований, которые проводила группа российских и американских ученых. Им удалось синтезировать 112, 113, 114, 115 и 116-й элементы и показать, что на самом деле они живут в сотни раз дольше, чем их более легкие предшественники. Однако для независимого подтверждения открытия новых элементов требовалось определение атомного номера какого-либо из изотопов химическим методом.
Открытие и подлог
Главный научный сотрудник Института теоретической и экспериментальной физики Минатома РФ Юрий Абов |
Впервые такой эксперимент удался химикам ОИЯИ совместно с их коллегами из швейцарского Института Пауля Шерера и американской Ливерморской национальной лаборатории в 2004 году. В ходе эксперимента были химически идентифицированы элементы 115 и 113 по конечному продукту их распада элементу дубнию-105, который «жил» около 30 часов. Успех был настолько весомым в научных кругах, что 8-я Международная конференция «Ядро-ядерные столкновения», в которой участвовали физики-ядерщики из 34 стран, прошла в Москве. Член-корреспондент РАН, главный научный сотрудник Института теоретической и экспериментальной физики Минатома РФ Юрий Абов заявил, что речь идет о «понимании строения атомного ядра как основы всех веществ нашего материального мира». «Мы как бы исследуем «кирпичики», из которых состоит Вселенная, или их сочетание при формировании той или иной области Вселенной», – пояснил Абов. После проверки предположений российских ученых о том, что после 105–110 элемента таблицы Менделеева должна существовать область сверхтяжелых стабильных атомов, эти атомы были открыты после бомбардировки тяжелых атомов атомными ядрами. Тогда же, в 2004 году, в российских лабораториях были получены устойчивые 114, 116 и 118-й атомные элементы, которые, по словам Абова, могут оказать решающее влияние на процесс образования звездных веществ.
В ходе эксперимента были химически идентифицированы элементы 115 и 113 по конечному продукту их распада элементу дубнию-105, который «жил» около 30 часов. Успех был настолько весомым в научных кругах, что 8-я Международная конференция «Ядро-ядерные столкновения», в которой участвовали физики-ядерщики из 34 стран, прошла в Москве. Член-корреспондент РАН, главный научный сотрудник Института теоретической и экспериментальной физики Минатома РФ Юрий Абов заявил, что речь идет о «понимании строения атомного ядра как основы всех веществ нашего материального мира». «Мы как бы исследуем «кирпичики», из которых состоит Вселенная, или их сочетание при формировании той или иной области Вселенной», – пояснил Абов. После проверки предположений российских ученых о том, что после 105–110 элемента таблицы Менделеева должна существовать область сверхтяжелых стабильных атомов, эти атомы были открыты после бомбардировки тяжелых атомов атомными ядрами. Тогда же, в 2004 году, в российских лабораториях были получены устойчивые 114, 116 и 118-й атомные элементы, которые, по словам Абова, могут оказать решающее влияние на процесс образования звездных веществ.
Следует отметить, что не всегда открытия ученых в этой области увенчиваются успехом. Семь лет назад в американском городе Беркли лаборатория имени Лоуренса заявила об удачном синтезе 118-го элемента, который был назван «унуноктикум». По американским технологиям аналогичные опыты пытались повторить физики из Германии и Японии, однако успеха не добились, после чего унуноктикум прозвали «элементом-невидимкой». Однако три года спустя американские ученые аннулировали открытие, публично заявив о научном мошенничестве одного из членов группы, проводившей опыт.
Химия: Периодическая таблица | Encyclopedia.com
Введение
Как ученые пришли к идее периодической таблицы? Как она изменилась, когда мы узнали больше об атомной структуре? И почему в нем так много полезной химической информации?
Древнегреческий философ Аристотель (384–322 до н. э.), британский естествоиспытатель Роберт Бойль (1627–1691) и французский химик Антуан Лоран Лавуазье (1743–1794) сыграли важную роль в этой истории, но ученый, открывший Периодической системой был Дмитрий Иванович Менделеев (1834–1907).По иронии судьбы, он понятия не имел об истинной основе своей таблицы. Он считал, что химические характеристики элемента зависят от его атомного веса, хотя теперь мы знаем, что его ключевым понятием является атомный номер. Тем не менее, следование процессам рассуждений таких людей, как Менделеев, даже если их результат не совсем правильный ответ, многое объясняет в научном прогрессе.
э.), британский естествоиспытатель Роберт Бойль (1627–1691) и французский химик Антуан Лоран Лавуазье (1743–1794) сыграли важную роль в этой истории, но ученый, открывший Периодической системой был Дмитрий Иванович Менделеев (1834–1907).По иронии судьбы, он понятия не имел об истинной основе своей таблицы. Он считал, что химические характеристики элемента зависят от его атомного веса, хотя теперь мы знаем, что его ключевым понятием является атомный номер. Тем не менее, следование процессам рассуждений таких людей, как Менделеев, даже если их результат не совсем правильный ответ, многое объясняет в научном прогрессе.
Историческая справка и научные основы
Греческая теория четырех элементов
Современная наука берет свое начало в том, как древнегреческие философы, такие как Аристотель, думали о мире природы.Более ранние цивилизации, такие как вавилоняне, проводили тщательные астрономические наблюдения; древние египтяне разработали сложные металлургические методы рафинирования меди и изготовления сплавов золота.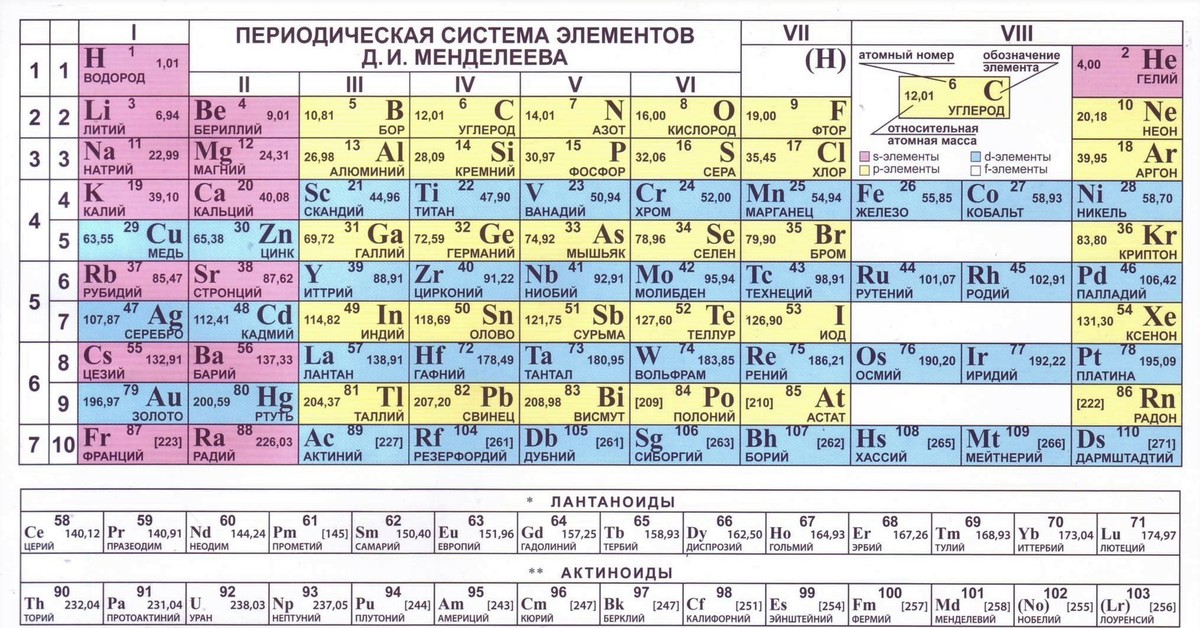 К этому практическому знанию греки приложили любопытство к глубинным причинам явлений природы.
К этому практическому знанию греки приложили любопытство к глубинным причинам явлений природы.
Аристотель пытался найти основные элементы материалов, таких как твердые тела, жидкости и газы. В «О зарождении и разложении», , написанном в 350 г. до н. э., он выразил свою цель так: «мы ищем «первоисточники» воспринимаемых тел», чтобы понять происхождение их свойств и то, как происходят изменения в их внешнем виде.Он предполагал, что их будет всего несколько, хотя сейчас мы знаем, что существует более сотни химических элементов.
Аристотель утверждал, что существует четыре элемента: земля, воздух, огонь и вода. Были также две пары противоположных качеств: горячее/холодное и влажное/сухое. Каждый элемент был связан с двумя из этих основных качеств. Так, например, огонь ассоциировался с жаром и сухостью. Его противоположность, вода, была холодной и влажной. Добавление воды к огню умерило бы его горячие и сухие качества; результат будет чем-то средним.Аристотель подчеркивал, что эти четыре элемента обычно не встречались в чистом виде. Например, и металлы, и песок были «земными», но пластичный металл, такой как золото, вероятно, был комбинацией чистого элемента земли с чистым элементом воды. Кровь была жидкостью, что указывало на присутствие воды, но из-за ее роли в поддержании жизни она, вероятно, содержала необычное количество стихийного огня.
Например, и металлы, и песок были «земными», но пластичный металл, такой как золото, вероятно, был комбинацией чистого элемента земли с чистым элементом воды. Кровь была жидкостью, что указывало на присутствие воды, но из-за ее роли в поддержании жизни она, вероятно, содержала необычное количество стихийного огня.
Теория Аристотеля сегодня кажется ужасно упрощенной и фантастической, но на протяжении столетий она господствовала в научной мысли.Тем не менее, его попытка объяснить разнообразие химических материалов с точки зрения ограниченного числа активных ингредиентов до сих пор направляет исследования. Однако аристотелевская версия также допускала возможность того, что один материал может трансмутироваться (изменяться) в другой.
Рассмотрим аристотелевскую версию того, что сегодня мы назвали бы круговоротом воды. Когда солнце освещает воду, холодная влажная вода превращается в горячий влажный воздух или пар. Если убрать тепло, мы снова получим воду.В очень холодный и сухой день (редко встречающийся в Средиземноморье) вода может превратиться в лед, материал, обладающий свойствами холода и сухости
земли. Эта идея запечатления свойств материи сформировала философскую основу для алхимии, раннего научного поиска по превращению неблагородных металлов, таких как свинец, в золото.
Эта идея запечатления свойств материи сформировала философскую основу для алхимии, раннего научного поиска по превращению неблагородных металлов, таких как свинец, в золото.
Алхимические принципы
Когда Римская империя распалась, многие древние знания и наука были утеряны. Например, большая библиотека в Александрии, основанная одним из учеников Аристотеля, несколько раз сжигалась и в конце концов была уничтожена.Поскольку арабские преемники Мухаммеда (570–632 гг.) заняли большую часть Римской и Персидской империй, интерес к натурфилософии сместился на восток и сосредоточился в таких исламских городах, как Багдад. Важные греческие тексты были переведены на сирийский и арабский языки. Были заново открыты древние тексты, намекающие на легендарный Философский камень и возможность превращения неблагородных металлов в золото.
Алхимия привела ко многим важным химическим открытиям. Ранние алхимики разработали сложную стеклянную посуду и научились перегонять жидкости. Они синтезировали соляную, серную и азотную кислоты и использовали их для растворения металлов и взаимодействия с содой, поташем и известью.
Они синтезировали соляную, серную и азотную кислоты и использовали их для растворения металлов и взаимодействия с содой, поташем и известью.
Ранние алхимики восхищались Аристотелем и продолжали работать в его рамках четырех элементов. Но аристотелевские качества горячего и холодного, влажного и сухого казались далекими от свойств новых химических веществ, которые они открыли. Поэтому они постулировали три дополнительных фундаментальных принципа: сера, соль и ртуть.
Подобно элементам Аристотеля, они, по их мнению, никогда не встречались в чистом виде.«Философская сера» была не желтым порошком, которым окуривали нездоровые помещения, а отвечала за горючесть материалов. «Солевой» принцип лежал в основе реакционной способности кислот (при нейтрализации кислоты образуют обычные соли), а «философская ртуть» объясняла ковкость металлов и блестящую поверхность.
Неудивительно, что обычная ртуть была популярным исходным материалом при попытках получить золото. Легко смеяться над историями об алхимиках, которые смешивали ртуть, свинец и какой-то ярко-желтый материал, такой как шафран, закапывали его в навоз, а затем нагревали весь ансамбль в печи в течение нескольких недель. И все же за этим кажущимся безумием скрывался метод.
И все же за этим кажущимся безумием скрывался метод.
Было широко распространено мнение, что металлы «вырастают» в рудниках, и золотые самородки часто находили в руде, содержащей медь. Возможно, рассуждали они, медь или другие металлы были просто незрелыми формами золота. Если бы они могли только ускорить процесс роста, рассуждали алхимики, возможно, они смогли бы воспроизвести в лаборатории то, что природа делает медленнее в недрах земли. Навоз оказался вероятным катализатором. В конце концов, они считали, что в навозе образуются маленькие насекомые и личинки, что придает ему сильную репродуктивную способность.
Когда мусульманские завоеватели двинулись через Северную Африку и вошли в Испанию в 711 году нашей эры, они принесли научные труды на арабском языке, как переведенные тексты древних греков, так и нововведения их арабских преемников. В двенадцатом и тринадцатом веках многие из этих сочинений были переведены на латынь, часто еврейскими учеными. Приток этих сохраненных и заново открытых греческих текстов, наряду с арабским вкладом в натурфилософию, ускорил возрождение обучения в европейских университетах. Немецко-швейцарский врач и алхимик Парацельс (1493–1541) был особенно увлечен тремя новыми алхимическими принципами и продвигал их как часть новых доктрин, которые в конечном итоге вытеснили старые древнегреческие догмы.
Немецко-швейцарский врач и алхимик Парацельс (1493–1541) был особенно увлечен тремя новыми алхимическими принципами и продвигал их как часть новых доктрин, которые в конечном итоге вытеснили старые древнегреческие догмы.
Парацельс, которого иногда называют «Лютером врачей», был довольно радикальным. Однажды он сжег копии книг Аристотеля и греческого врача Галена (129–216) на общественном костре в Базельском университете, чтобы показать, насколько опасно устарели их теории.Парацельс ввел понятие химических лекарств и рекомендовал соединение ртути для лечения сифилиса. (К счастью, прописывались только небольшие порции этого яда!)
Теория флогистона
Почти через 200 лет после Парацельса немецкий химик и врач Георг Эрнст Шталь (1660–1734) модифицировал теорию трех принципов и использовал ее для систематизации целый ряд важных реакций. Он переименовал сернистый принцип во «флогистон» (от греческого phlogistos «горючий») и заявил, что он содержится в каждом горючем материале и принудительно выбрасывается во всех реакциях горения, производящих тепло и свет. Чтобы объяснить, почему горение не произойдет, если вокруг не будет много воздуха, Шталь утверждал, что необходимо унести флогистон.
Чтобы объяснить, почему горение не произойдет, если вокруг не будет много воздуха, Шталь утверждал, что необходимо унести флогистон.
Теперь мы знаем, что у Шталя все было наоборот: когда горят такие материалы, как древесный уголь или сера, они не разлагаются. Вместо этого добавляется что-то из воздуха. Воздух является пассивным вместилищем для чего-то, что выделяется; он поставляет кислород, который соединяется со всем, что горит. Испускаемое тепло и свет представляют собой энергию, полученную в результате быстрой реакции окисления.
Тем не менее Шталь успешно использовал теорию флогистона для систематизации некоторых важных химических реакций — хороший пример того, как ученые могут добиться прогресса, даже если их исходные предположения неверны. Первым прозрением Шталя было отметить параллели между тем, что происходит, когда металлы нагреваются на воздухе и превращаются в порошок (процесс, который он назвал «прокаливанием»), и обычным горением, например, при горении дерева.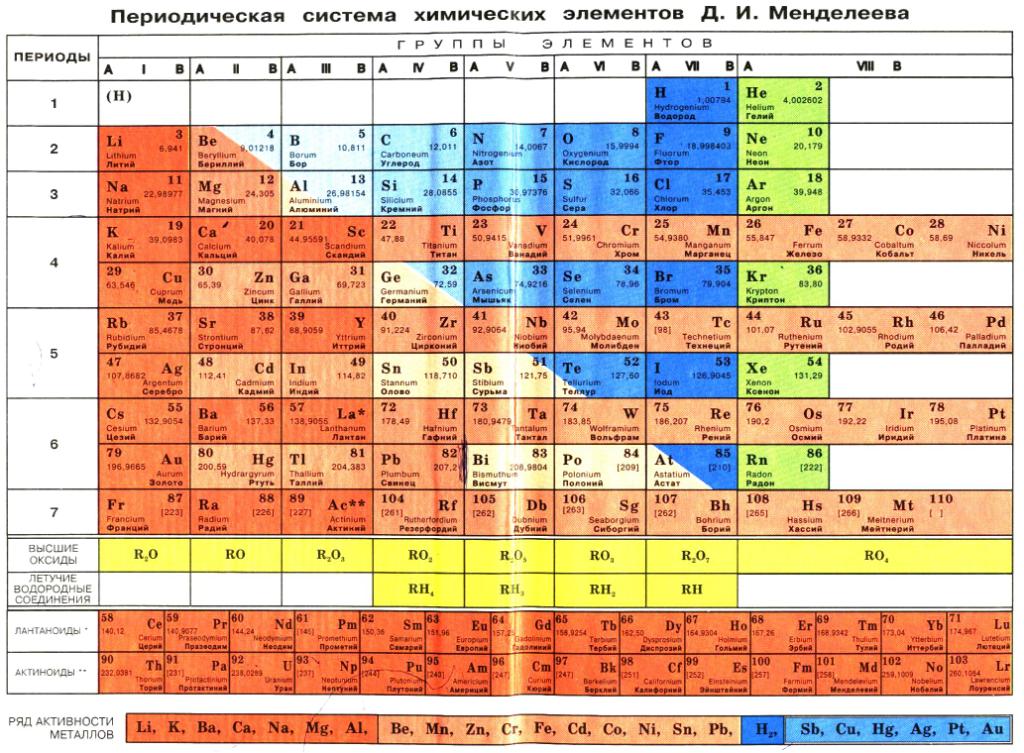 Шталь заметил, что в обоих случаях могут выделяться тепло и свет (возможно, вы видели искры, когда в пламя сыплются железные опилки), и что для поддержания реакции требуется воздух.(Он сказал бы, что флогистон улетучивается, в то время как мы знаем, что кислород соединяется, но мы также признаем параллель между горением металлов и неметаллов. Оба являются реакциями окисления.)
Шталь заметил, что в обоих случаях могут выделяться тепло и свет (возможно, вы видели искры, когда в пламя сыплются железные опилки), и что для поддержания реакции требуется воздух.(Он сказал бы, что флогистон улетучивается, в то время как мы знаем, что кислород соединяется, но мы также признаем параллель между горением металлов и неметаллов. Оба являются реакциями окисления.)
Затем Шталь использовал свою систему, чтобы описать, что происходит, когда металл руды были восстановлены до металлов. Он отметил, что добытчики меди часто смешивали добытые из земли минералы с древесным углем и нагревали их, перемешивая расплавленные результаты зеленой палочкой. Шталь рассудил, что металлические руды утратили свой флогистон.Они были порошкообразными, как и металлические окалины, являющиеся продуктами прокаливания. Чтобы превратить их в блестящие металлы, нужно было добавить флогистон. Но он был убежден, что древесный уголь — богатый источник флогистона, потому что он так хорошо горит. Поэтому, хотя они этого и не осознавали, горняки переводили флогистон из древесного угля в металлическую руду и, таким образом, производили металлы. Поскольку горняки рассматривали древесный уголь только как топливо, а не как компонент химической реакции, они иногда не добавляли достаточного количества древесного угля, чтобы восстановить весь металл, присутствующий в руде.Поэтому Шталь объяснил им необходимость этого.
Поскольку горняки рассматривали древесный уголь только как топливо, а не как компонент химической реакции, они иногда не добавляли достаточного количества древесного угля, чтобы восстановить весь металл, присутствующий в руде.Поэтому Шталь объяснил им необходимость этого.
Шталь говорил о приведенных выше реакциях как об анализах и синтезах. При прокаливании металл анализировали (разделяли) на металлический порошок и флогистон. Шахтеры синтезировали металл, комбинируя металлическую руду с флогистоном, полученным из древесного угля. Один из учеников Шталя предложил аксиому, согласно которой за каждым анализом должен следовать синтез, если кто-то хочет доказать, что понимает состав материала.Шталь определенно считал, что доказал, что металлы представляют собой соединения, а не элементы. Вскоре Лавуазье использовал те же методы анализа и синтеза, чтобы доказать свою неправоту!
Научный критерий химических элементов Лавуазье
Аристотель считал элементы «первоначальными принципами». Почти 2000 лет спустя в году (1661) ирландский химик Роберт Бойль определил элементы как «определенные примитивные и простые или совершенно несмешанные тела; которые, не состоящие ни из каких других тел, ни друг из друга, являются составными частями, из которых непосредственно слагаются все так называемые совершенно смешанные тела и на которые они в конце концов распадаются.
Почти 2000 лет спустя в году (1661) ирландский химик Роберт Бойль определил элементы как «определенные примитивные и простые или совершенно несмешанные тела; которые, не состоящие ни из каких других тел, ни друг из друга, являются составными частями, из которых непосредственно слагаются все так называемые совершенно смешанные тела и на которые они в конце концов распадаются.
Но как химики могли точно определить, что это были за примитивные и простые материалы? Аристотель предложил четыре элемента: землю, воздух, огонь и воду; алхимики добавляли соль, серу и ртуть. Однако ни один из этих так называемых элементов нельзя было поместить в бутылку или использовать в экспериментах. (Помните, что третьим элементом алхимиков была «философская ртуть», а не ртуть, которая использовалась в барометрах.)
Именно французский химик и государственный служащий Антуан Лоран Лавуазье (1743–1794) наконец дал работающее определение химический элемент в 1789 году.Поскольку было невозможно прийти к соглашению о невидимых составных частях тел, Лавуазье предложил в Traité élémentaire de chimie ( Elements of Chemistry; 1789): «мы применяем термин элементы или принципы тел, чтобы выразить нашу идею из последнего пункта, которого способен достичь анализ, мы должны признать в качестве элементов все субстанции, до которых мы способны любым способом свести тела путем разложения».
Лавуазье понял, что список элементов может измениться, поскольку химики выяснили, как дальше разлагать сложные материалы.Таким образом, он предварительно включил в свой список известь и магнезию, но отметил, что они могут быть не простыми веществами. (Теперь мы знаем, что это были оксиды кальция и магния.) Потребовался еще один шаг, прежде чем химики смогли однозначно договориться о списке элементов. Шталь был мертв к тому времени, когда Лавуазье предложил свое определение, но будь он жив, он мог бы утверждать, что металлы не являются элементами — они содержат флогистон, который затем высвобождается при нагревании. Так флогистонисты считали металлическую окалину более простым веществом, чем металл.
Лавуазье предложил прямой способ показать, что металлы действительно являются элементами. Он взвешивал образец металла, нагревал его на воздухе, а затем взвешивал порошкообразный продукт. Так как известняк был тяжелее, должно было быть что-то добавлено при прокаливании. С помощью более сложных экспериментов Лавуазье выделил из атмосферы газ, который поглощался как при прокаливании, так и при сжигании, и назвал его кислородом, от греческого oxys, , что означает кислый или резкий.
Химики быстро приняли определение элемента, данное Лавуазье, и приняли полезную стратегию отслеживания веса продуктов и ингредиентов.Когда Лавуазье опубликовал свои « элементов химии», в его списке было 33 элемента, включая обычные металлы, серу, мышьяк, фосфор, кислород и азот. Вскоре с помощью электролиза были открыты водород и хлор; к тому времени, когда Менделеев начал свой учебник, их было более 60, каждый из которых обладал набором отличительных химических свойств.
Присвоение атомного веса
На протяжении всей истории естествоиспытатели и химики размышляли о существовании атомов.Поскольку и Аристотель, и (намного позже) французский математик
Рене Декарт (1596–1650) считали, что вакуум физически невозможен, они оба отвергли теорию Демокрита (ок. 460–370 до н.э.) об атомах в пустоте. Однако практически каждый был готов принять идею о том, что материя может состоять из крошечных невидимых «корпускул». Однако, как и в случае с элементами до Лавуазье, выяснить что-либо конкретное об этих частицах казалось невозможным. Именно Джон Дальтон (1766–1844), британский метеоролог и школьный учитель, сделал важные выводы, которые сделали современную атомную теорию жизнеспособной.
Именно Джон Дальтон (1766–1844), британский метеоролог и школьный учитель, сделал важные выводы, которые сделали современную атомную теорию жизнеспособной.
В книге под названием Новая система химической философии (1808) Дальтон отметил, что хорошо известно, что когда элементы объединяются для образования нового соединения, они почти всегда делают это в одной и той же весовой пропорции. (Исключение составляли сплавы.) Таким образом, казалось разумным предположить, что соединение всегда содержит одно и то же соотношение атомов. Дальтон выразил это так:
Следовательно, мы можем заключить, что первичные частицы всех однородных тел совершенно одинаковы по весу, форме и т. д.Другими словами, каждая частица воды подобна любой другой частице воды; каждая частица водорода подобна любой другой частице водорода и т. д.
Знание формулы соединения, как постулировал Дальтон, позволит ему рассчитать относительный вес атомов. Но как он мог определить формулу? Чтобы решить эту проблему, Дальтон предпринял смелый шаг, постулировав правила построения предположений о формулах соединений:
Следующие общие правила могут быть приняты в качестве руководства во всех наших исследованиях, касающихся химического синтеза.
1-й. Когда может быть получена только одна комбинация двух тел, она должна считаться бинарной, если только какая-либо другая причина не покажет обратное.
2д. Когда наблюдаются две комбинации, следует предположить, что они являются бинарными и троичными.
Например, если углерод и кислород образуют только одно соединение, Дальтон предположил, что оно содержит только два атома. Следовательно, его формула должна быть CO. Итак, если образец окиси углерода (используя для него наше название) состоит из 3 граммов углерода в сочетании с 4 граммами кислорода, мы предполагаем, что отношение их атомных весов составляет 3 к 4.Если же углерод и кислород образуют два разных соединения (что на самом деле и так), то одно из соединений есть СО, а другое состоит из трех атомов. Следовательно, его формула должна быть либо CO 2 , либо C 2 O. Если он анализирует 3 грамма углерода на каждые 8 граммов кислорода, то мы знаем, что правильная формула — это то, что мы теперь называем двуокисью углерода.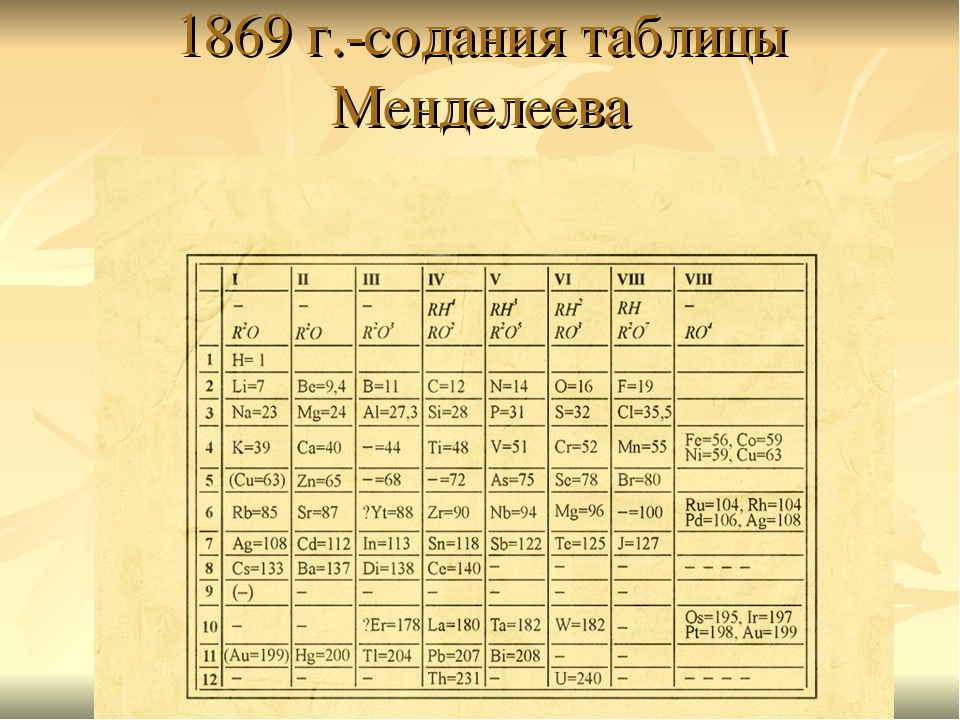
Этот пример иллюстрирует ход рассуждений Дальтона, но из-за него работа по созданию всеобъемлющей и последовательной системы относительных атомных весов выглядит намного проще, чем она была на самом деле.Во-первых, экспериментальные данные по объединению весов были не очень точными. Во-вторых, Дальтон ошибся, потому что, поскольку в то время было известно только одно соединение водорода и кислорода, его правила заставили его присвоить воде формулу HO вместо H 2 O, и когда он установил атомный вес водород как 1, кислород оказался вдвое меньше правильного значения!
Почти 50 лет спустя на конференции 1860 года в Карлсруэ, Германия, итальянский химик Станислао Канниццаро (1826–1910) наконец представил метод определения атомного веса, который все химики сочли приемлемым.На этой конференции присутствовал молодой русский химик, учившийся в Германии. Его звали Дмитрий Иванович Менделеев (1834–1907).
Периодическая таблица Менделеева и Периодический закон
Менделеев родился в маленьком сибирском городке в 1300 милях (2092 км) от Москвы в 1834 году. Московский университет. Не сумев получить стипендию, они проехали еще 400 миль (644 км) на восток, в Сент-Луис.Петербург. Вскоре после выпуска первым в своем классе Менделеев поступил в аспирантуру Гейдельбергского университета в Германии.
Московский университет. Не сумев получить стипендию, они проехали еще 400 миль (644 км) на восток, в Сент-Луис.Петербург. Вскоре после выпуска первым в своем классе Менделеев поступил в аспирантуру Гейдельбергского университета в Германии.
Поскольку Германия в то время была домом для многих известных химиков, а Россия была чем-то вроде научной заводи, когда Менделеев вернулся в Россию, чтобы занять академическую должность в Санкт-Петербургском университете, одним из первых, что он сделал, было написать учебник химии на 500 страниц. Это был огромный успех как в финансовом, так и в интеллектуальном плане, и Менделеев начал писать еще одну, охватывающую химию всех элементов.
Он начал рукопись, намереваясь написать главу, в которой обсуждались бы химические свойства каждого элемента. Но вскоре стало очевидно, что он не может сделать это для каждого из 60 с лишним элементов, известных в то время. Кроме того, ему нужен был какой-то рациональный способ упорядочить обсуждения. На конференции в Карлсруэ Менделеев пришел к убеждению, что ключевым свойством элемента является его атомный вес. Поэтому он сделал карточку для каждого элемента и начал раскладывать их на своем столе в порядке атомного веса, а затем сгруппировал те, которые имели схожие химические свойства.(Легенда гласит, что Менделеев любил раскладывать в карты пасьянс, в котором карты выстраиваются в ряды по масти и по порядку номеров, и этот опыт помог ему сделать открытие.)
На конференции в Карлсруэ Менделеев пришел к убеждению, что ключевым свойством элемента является его атомный вес. Поэтому он сделал карточку для каждого элемента и начал раскладывать их на своем столе в порядке атомного веса, а затем сгруппировал те, которые имели схожие химические свойства.(Легенда гласит, что Менделеев любил раскладывать в карты пасьянс, в котором карты выстраиваются в ряды по масти и по порядку номеров, и этот опыт помог ему сделать открытие.)
Другие до Менделеева заметили, что некоторые элементы могут быть объединены в семьи. Немецкий химик Иоганн Вольфганг Доберейнер (1780–1849) даже указал, что в таких триадах, как литий (7),
натрий (23) и калий (39), атомный вес среднего члена находится примерно посередине между атомные веса экстремумов.В том же ключе британский химик Джон Ньюлендс (1837–1898) предложил закон октав, потому что он заметил, что при упорядочении по атомному весу химические свойства элементов повторяются с восьмикратным периодом — точно так же, как ноты в музыкальной гамме. . Однако мало кто уделял этому паттерну большое внимание, отчасти потому, что он разрушался на элементах с более высоким атомным весом.
. Однако мало кто уделял этому паттерну большое внимание, отчасти потому, что он разрушался на элементах с более высоким атомным весом.
Менделеев был убежден, что существует периодический закон, управляющий свойствами элементов. Поскольку масса играла центральную роль в законах Исаака Ньютона (1642–1727), Менделеев считал, что атомный вес определяет химические свойства каждого элемента и что периодическое сходство между ними не случайно.(Теперь мы знаем, что это действительно не совпадение — каждая строка периодической таблицы представляет собой заполненную электронами оболочку; однако во времена Менделеева никто ничего не знал о строении атома.) Он был так убежден, что в основе лежит естественный закон. свою таблицу, что он сделал несколько смелых предсказаний, основанных на ней.
Во-первых, он предсказал существование трех новых элементов, основываясь на пробелах в своей таблице. Менделеев был убежден, что между цинком и мышьяком появятся два новых элемента, потому что свойства мышьяка показывали, что он должен принадлежать к семейству фосфора. Кроме того, скачок атомного веса был необычно большим. Используя известные свойства соседей отсутствующих элементов, Менделеев предсказал не только их атомный вес, но также плотность и температуру плавления. Когда несколько лет спустя был открыт галлий, его реальные свойства оказались чрезвычайно близки к предсказаниям Менделеева. Когда в короткие сроки были открыты другие элементы с пробелами, химики всего мира были убеждены, что таблица Менделеева отражает глубокую правду о мире.
Кроме того, скачок атомного веса был необычно большим. Используя известные свойства соседей отсутствующих элементов, Менделеев предсказал не только их атомный вес, но также плотность и температуру плавления. Когда несколько лет спустя был открыт галлий, его реальные свойства оказались чрезвычайно близки к предсказаниям Менделеева. Когда в короткие сроки были открыты другие элементы с пробелами, химики всего мира были убеждены, что таблица Менделеева отражает глубокую правду о мире.
Менделеев также использовал свою таблицу, чтобы предсказать, что некоторые текущие экспериментальные значения атомного веса, такие как 128, первоначально присвоенные теллуру (Te), были неверными. Если бы он расположил элементы в этом ряду строго по возрастанию атомного веса, то йод (I) с атомным весом 127 стоял бы перед теллуром (128). Но Менделеев знал, что йод по своим химическим свойствам стоит в одном горизонтальном ряду с фтором, хлором и бромом, а теллур больше похож на своего соседа слева селена.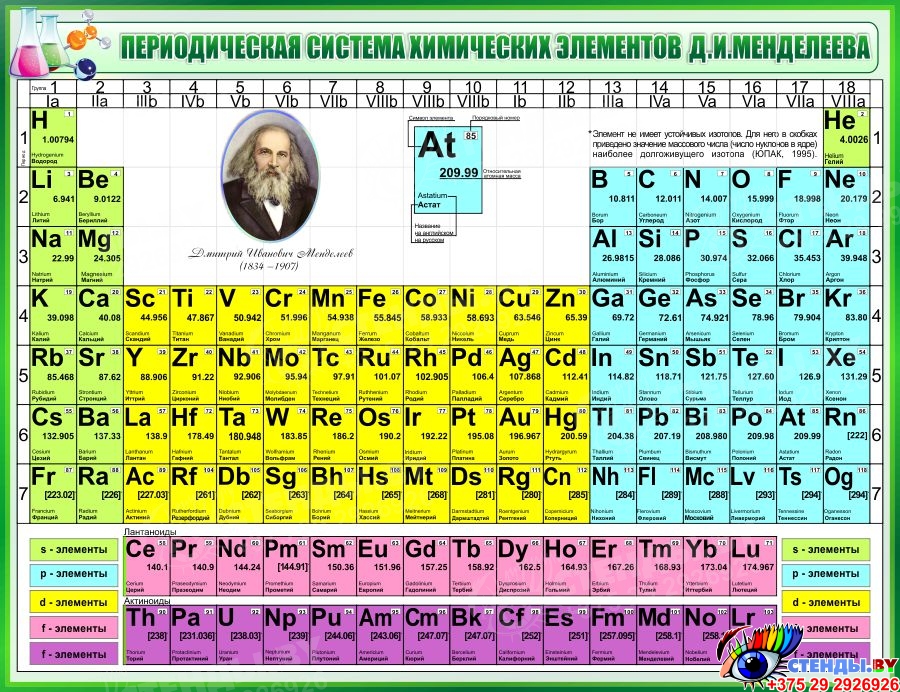 Поэтому он поместил эти элементы на свои места, основываясь на их химическом составе, и призвал химиков переопределить значения атомных весов.
Поэтому он поместил эти элементы на свои места, основываясь на их химическом составе, и призвал химиков переопределить значения атомных весов.
Во многих случаях предсказание Менделеева о небольшой ошибке в атомном весе было верным. Но так называемая обратная пара теллура и йода осталась аномалией. Найдите сегодняшние значения атомных весов теллура (127,6) и йода (126,904), помня, что теперь мы помещаем такие семейства, как фтор, хлор, бром и йод, в вертикальные столбцы, а Менделеев — в горизонтальные ряды.
Химики продолжают находить новые элементы. Одни заполнили пробелы в таблице Менделеева, а другие, похоже, вообще не подходили. Гелий был впервые обнаружен с помощью спектрографического анализа солнечного света, а затем выделен из урановой руды. (Теперь мы знаем, что уран испускает альфа-частицы, которые являются ядрами гелия.) Сначала Менделеев не думал, что в его таблице есть место для гелия, но после того, как в атмосфере были обнаружены другие инертные газы, такие как аргон и неон, он просто вставил в таблицу целое новое семейство. Эти газы образовывали полезный буфер между высокореакционноспособными щелочными металлами, такими как литий и натрий, и газообразными галогенами, такими как газообразные фтор и хлор; поскольку они не образуют соединений, он присвоил им нулевую валентность. Но Менделеев так и не смог понять, что делать с так называемыми редкоземельными металлами, ныне называемыми лантаноидами.
Эти газы образовывали полезный буфер между высокореакционноспособными щелочными металлами, такими как литий и натрий, и газообразными галогенами, такими как газообразные фтор и хлор; поскольку они не образуют соединений, он присвоил им нулевую валентность. Но Менделеев так и не смог понять, что делать с так называемыми редкоземельными металлами, ныне называемыми лантаноидами.
Согласно их атомному весу, все эти металлы должны идти сразу после бария. Но проблема была в том, что каждый из этих 14 элементов имеет одинаковую валентность (+3) и очень похожие химические свойства.Это нарушало принцип периодичности, на котором основывалась таблица Менделеева. В конце концов он пришел к выводу, что редкоземельные металлы «нарушили» периодический закон.
В современной периодической таблице и лантаноиды, и актиноиды отображаются как постскриптум под таблицей, хотя в соответствии с атомным номером они должны стоять вверху! Современники Менделеева понятия не имели, как редкоземельные элементы могут вписаться в структуру, представленную периодической таблицей. Теперь мы знаем, что теория квантовых чисел предсказывает их существование, и что они идеально вписываются в современную теорию элементов, основанную на атомном числе.
Теперь мы знаем, что теория квантовых чисел предсказывает их существование, и что они идеально вписываются в современную теорию элементов, основанную на атомном числе.
К концу XIX века само понятие химического элемента, разработанное Бойлем, Лавуазье и Дальтоном и лежавшее в основе системы Менделеева, должно было претерпеть глубокие изменения. С открытием радиоактивности ученые узнали, что атомы не являются мельчайшими частицами материи. А открытие изотопов доказало, что не все атомы данного элемента одинаковы. Тем не менее, несмотря на эти революционные изменения, основная форма таблицы Менделеева осталась неизменной.Давайте посмотрим, как это было возможно.
От атомного веса к атомному номеру
Менделеев впервые узнал о катодных, рентгеновских лучах и радиоактивности за несколько лет до своей смерти в 1907 году. флуоресцентные экраны, вызванные невидимыми лучами, напомнили ему о ложных заявлениях спиритов того времени об оккультных явлениях. Фактически Менделеев развенчал практику нескольких русских медиумов, утверждавших, что они могут общаться с мертвыми, раскрывая при этом их обманчивые и недобросовестные методы.
Однако вскоре появились убедительные доказательства того, что атомы состоят из положительных частиц и отрицательных электронов. Британский физик Эрнест Резерфорд (1871–1937), родившийся в Новой Зеландии, в 1911 году показал, что положительные частицы сосредоточены в ядре. В 1913 году его британский студент Фредерик Содди (1877–1956) обнаружил, что не все атомы чистого элемента идентичны. Например, хотя вещество, которое тогда называли мезоторием (поскольку его находили в ториевых рудах), имело атомный вес 228, его химические свойства были идентичны свойствам радия, атомный вес которого равнялся 226.(Теперь мы знаем, что торий подвергается радиоактивному распаду с образованием радия.) Содди называл атомы, химически идентичные, но имеющие разный атомный вес, «изотопами». Используя масс-спектрограф, ученые смогли разделить все виды элементов на составляющие их изотопы.
Эти открытия заставили химиков пересмотреть определение химических элементов. Бойль утверждал, что элементы — это простейшие вещества, из которых состоят все материалы, но теперь стало ясно, что фундаментальными строительными блоками материи являются субатомные частицы, такие как протоны и электроны. Лавуазье определил
Лавуазье определил
элементов как последние продукты анализа, но теперь ученые могли разделить образцы того, что считалось однородным материалом, на изотопы.
Фактически, в 1920 году британский физик Фрэнсис Астон (1877–1945) сообщил, что газообразный неон состоит из Ne-20, Ne-21 и Ne-22, тогда как хлор состоит в основном из Cl-35 и Cl-37 со следами Cl-36 и Cl-38. Джон Дальтон был бы потрясен, если бы узнал, что все атомы элемента НЕ имеют одинаковую атомную массу.И если бы тождественность элементов не зависела от их атомного веса, то упорядочение по атомному весу вряд ли могло бы послужить основой для периодической таблицы Менделеева.
Решение, которое сегодня может показаться очевидным, состоит в том, чтобы определять химические элементы по их атомному номеру. Химические свойства зависят от положительного заряда ядра и соответствующего количества электронов вокруг него. Атомы с одинаковым атомным номером имеют разный атомный вес, если в их ядрах содержится разное количество нейтронов. Периодическая таблица Менделеева работала так хорошо, потому что существует очень близкое соответствие между порядком по атомному весу и порядком по атомному номеру. Иногда порядок не тот (вспомните обратный порядок теллура и йода), но поскольку ядра, в которых нейтронов намного больше, чем протонов, нестабильны, идея Менделеева об упорядочении элементов по весу оказалась очень близким приближением к истинному принципу упорядочения. : атомный номер.
Периодическая таблица Менделеева работала так хорошо, потому что существует очень близкое соответствие между порядком по атомному весу и порядком по атомному номеру. Иногда порядок не тот (вспомните обратный порядок теллура и йода), но поскольку ядра, в которых нейтронов намного больше, чем протонов, нестабильны, идея Менделеева об упорядочении элементов по весу оказалась очень близким приближением к истинному принципу упорядочения. : атомный номер.
Некоторые химики отказались принять это новое определение, утверждая, что каждый изотоп следует рассматривать как отдельный элемент.Ведь атом урана-235 гораздо более радиоактивен, чем атом урана-238. Между обычным водородом Н-1 и дейтерием Н-2 есть и химически значимые различия. Ведь оксид дейтерия (так называемая тяжелая вода) ядовит для животных. Следуя этой логике, определяющим свойством оставался бы атомный вес.
Однако химическое сообщество мудро решило использовать атомный номер. Вы можете себе представить, насколько сложной была бы таблица Менделеева, если бы у каждого отдельного изотопа была своя коробка? Но даже со всей этой новой информацией об атомах оставалась одна главная загадочная черта периодической таблицы: ее периодичность.
Почему химические свойства повторяются через каждые восемь, а в некоторых случаях через 18 элементов? Почему упорядоченная по номерам цепочка элементов закручивается так, что если натрий (Na) помещается под литием, где ему, очевидно, и место, то хлор автоматически занимает свое место под фтором? Почему одни периоды длиннее других? А как насчет тех надоедливых редкоземельных элементов, у которых валентность оставалась +3, несмотря на то, что атомный номер продолжал увеличиваться? Ответы были даны в 1920-х годах квантовой теорией.
Квантовые числа и периодическая таблица
При нагревании каждый элемент испускает свет с характерным спектром. (Если вы посыпаете голубое пламя обычной поваренной солью, вы увидите характерный красновато-оранжевый цвет натрия.) Когда этот испускаемый свет анализируется с помощью спектроскопа, спектр распадается на резкие линии. Поскольку солнечный свет содержал линии, которые не соответствовали ни одному известному на Земле элементу, спектроскописты поняли, что Солнце содержит ранее неизвестный элемент, который они назвали гелием, от греческого helios, для солнца.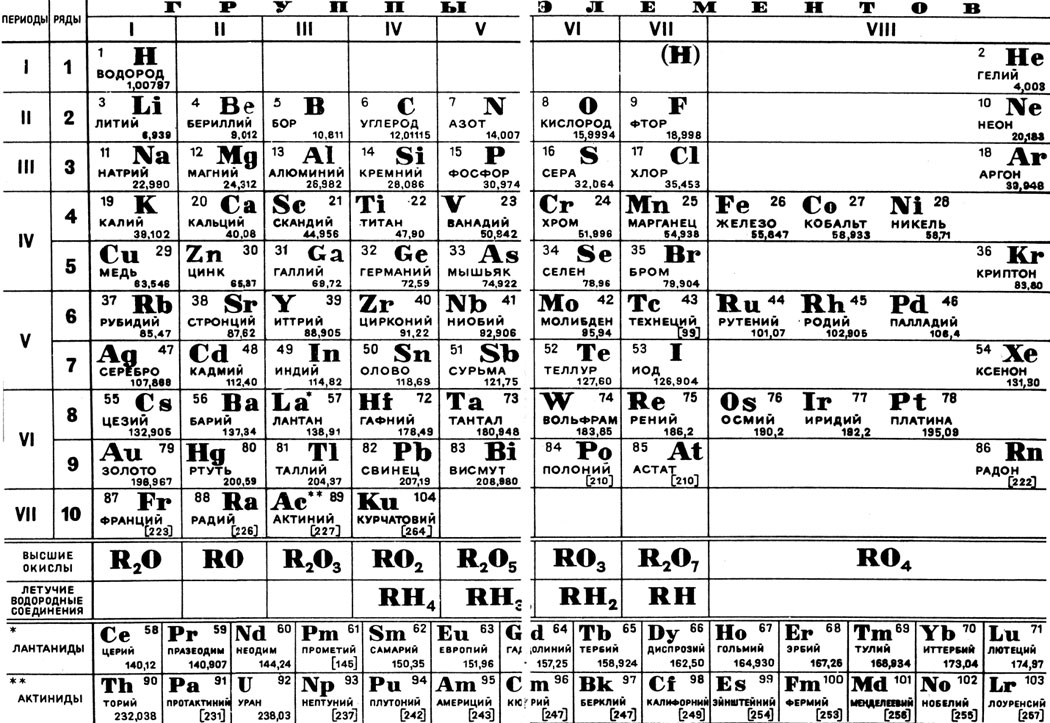
Но почему излучаются только определенные длины волн? Этот и многие другие вопросы привели таких физиков, как Нильс Бор (1885–1962), к выводу, что электроны, окружающие ядро, занимают орбиты на определенных дискретных расстояниях. Когда отдельный атом поглощал энергию, скажем, от пламени, электрон в одной из этих оболочек перескакивал на новую орбиту, которая была дальше от ядра. Когда он в конце концов упал, он излучал свет с одной длиной волны, определяемой разницей энергий между двумя орбитами.В случае очень простого атома, такого как водород, Бор даже смог вычислить из своей теории, каким должен быть спектр возбужденного водорода.
Согласно квантовой теории, орбиты, доступные любому электрону в атоме, описываются целыми числами, называемыми квантовыми числами. В невозбужденном атоме (тот, который не подвергается бомбардировке внешним источником энергии) электроны тяготеют к орбитам с наименьшей энергией. Но только два электрона могут занимать заданную орбиту. Если мы применим принципы квантовой механики к периодической таблице, то обнаружим, что в первой строке может быть только два элемента, потому что в первой оболочке есть место только для двух электронов.
Квантовая механика, однако, говорит нам, что во второй оболочке может быть восемь электронов, потому что она содержит четыре доступных орбиты — и мы действительно находим восемь элементов во второй строке периодической таблицы. Литий (атомный номер 3) имеет два внутренних электрона и один электрон на внешней оболочке. В химических реакциях он может потерять этот электрон и стать ионом Li + 1 . Фтор (атомный номер 9) имеет два внутренних электрона и семь внешних электронов. Поскольку полная внешняя оболочка представляет собой особенно устойчивую структуру (именно поэтому инертные газы инертны), в реакциях атомы фтора часто приобретают электрон и становятся отрицательными ионами F ‒ 1 .
По мере того, как мы переходим к большему количеству оболочек, описание количества орбиталей и их относительных энергий становится более сложным, но существование горизонтальных семейств элементов (таких как лантаноиды и актиноиды) предсказывается теорией. Все лантаноиды имеют три электрона на самой внешней оболочке (отсюда валентность +3), но они различаются по количеству электронов в оболочке чуть ниже. Следовательно, по мере увеличения атомного номера свойства внешних электронов, которые обычно вступают в химическую связь, изменяются незначительно.
Следовательно, по мере увеличения атомного номера свойства внешних электронов, которые обычно вступают в химическую связь, изменяются незначительно.
Современные культурные связи
Посмотрите на стены кабинетов химии или лабораторий в любой стране мира, и вы увидите стол примерно из 100 элементов, расставленных так, что он выглядит как кровать. Ящики с буквами H (водород) и He (гелий) сложены, как стойки кровати, поверх столбцов, помеченных как I и VIII соответственно. Атомный номер каждого элемента говорит о том, сколько протонов содержится в ядре; римская цифра столбца указывает на валентность (или сочетающую способность) элемента.Поскольку литий находится в столбце I (под водородом), а бериллий — в столбце II, мы ожидаем, что формула хлорида лития будет LiCl, а хлорида бериллия — BeCl2. Мы также ожидаем семейного сходства между элементами в одном столбце. Например, в столбце II через пару квадратов под Be мы находим Ca для кальция и прямо под ним Sr для стронция. Зная, что кальций является важным компонентом костей, мы не удивляемся, узнав, что его сосед стронций также обнаружен в скелете. Эти семейные отношения объясняют, почему в период испытаний атомной бомбы ученые были очень обеспокоены тем, что радиоактивный изотоп стронция (называемый Sr-90) может оказаться в молоке так же, как кальций, и впитаться в кости растущих детей.
Эти семейные отношения объясняют, почему в период испытаний атомной бомбы ученые были очень обеспокоены тем, что радиоактивный изотоп стронция (называемый Sr-90) может оказаться в молоке так же, как кальций, и впитаться в кости растущих детей.
Связь с Первичным Источником
Мир, созданный Атомами
Маленькие Атомы сами по себе могут создать Мир, Будучи тонкими и любой формы: И когда они танцуют, подходящие места находят, Такие Формы, которые лучше всего согласуются друг с другом , сделать каждый kinde.Ибо, когда мы строим дом из кирпича и камня, [5]
Мы кладем их ровно, каждый один за другим: И когда мы находим щель, большую или маленькую, Мы ищем камни, чтобы соответствовать этому месту со всем. Потому что, когда они не подходят, слишком велики или малы, Они отпадают и не могут оставаться, как мы видим. [10] Так Атомы, когда они танцуют, находят подходящие места, Они там остаются, лежат близко, и быстро прилипнут. Те, кто непригоден, остальные, которые скитаются, Никогда не уходите, пока они не выгонят их.
Таким образом, своими отдельными движениями и своими формами [15]
Как несколько рабочих обслуживают друг друга по очереди.И так, случайно, может создать Новый Мир: Или же предначертано исполнить мою Судьбу.
Маргарет Кавендиш
Кавендиш, Маргарет. атомные стихи Маргарет (Лукас) Кавендиш, герцогини Ньюкасл, из ее стихов и фантазий, 1653 г., транскрибированные и отредактированные Ли Тиллманом Партингтоном. атланта: ресурсный проект женщин-писателей, университет Эмори, 1996.
См. также Химия: химические связи; Химия: химические реакции и сохранение массы и энергии; Химия: молекулярная структура и стереохимия; Химия: состояния вещества: твердые тела, жидкости, газы и плазма; Химия: практика алхимии.
библиография
Книги
Болл, Филип. Элементы: очень краткое введение. Оксфорд и Нью-Йорк: Oxford University Press, 2004.
Болл, Филип. Ингредиенты: экскурсия по элементам. Оксфорд и Нью-Йорк: Oxford University Press, 2002.
Бойл, Роберт. Скептический химик; или химикофизические сомнения и парадоксы, касающиеся экспериментов, посредством которых вульгарные спагиристы имеют обыкновение пытаться доказать, что их соль, сера и ртуть являются истинными принципами вещей.К которым в этом издании присоединяются различные эксперименты и заметки о воспроизводимости химических принципов. Оксфорд: 1680.
Брок, Уильям Х. История химии Нортона. Нью-Йорк и Лондон: W.W. Norton & Co., 1992.
Кавендиш, Маргарет. Атомные стихи Маргарет (Лукас) Кавендиш, герцогини Ньюкасл, из ее стихов и фантазий, 1653 г. Расшифровано и отредактировано Ли Тиллманом Партингтоном. Атланта: Ресурсный проект женщин-писателей, Университет Эмори, 1996.
Далтон, Джон. Новая система химической философии. Нью-Йорк: Философская библиотека, 1964.
Гордин, Майкл Д. Хорошо организованная вещь: Дмитрий Менделеев и тень периодической таблицы. Нью-Йорк: Basic Books, 2004.
Лавуазье, Антуан Лоран. Элементы химии. Нью-Йорк: Dover Publications, 1965.
Элементы химии. Нью-Йорк: Dover Publications, 1965.
Менделеев, Дмитрий. Основы химии Д. Менделеева. Перевод с русского Георгия Каменского.6-е изд. Под редакцией Т.А. Лоусон. Лондон, Нью-Йорк: Longmans, Green, and Co., 1897.
Моррис, Ричард. Последние колдуны: Путь от алхимии к таблице Менделеева. Вашингтон, округ Колумбия: Джозеф Генри Пресс, 2003.
Стратерн, Пол. Сон Менделеева: В поисках элементов. Нью-Йорк: St. Martin’s Press, 2001.
Веб-сайты
AUS-e-TUTE. «История периодической таблицы элементов». http://www.ausetute.com.au/pthistor.html (по состоянию на 8 июня 2006 г.).
Фонд химического наследия. «Chemical Achievers: Human Face of the Chemical Sciences». http://www.chemheritage.org/classroom/chemach/index.html/ (по состоянию на 8 июня 2006 г.).
Королевское химическое общество. «История периодической таблицы». http://www.chemsoc.org/networks/learnnet/periodictable/pre16/develop/mendeleev. htm (по состоянию на 8 июня 2006 г.).
htm (по состоянию на 8 июня 2006 г.).
Noretta Koertge
История периодической таблицы
Разработка периодической таблицы элементов идет параллельно развитию науки и нашего понимания физической вселенной.Это центральное место в нашем нынешнем понимании «вещества», из которого мы все сделаны. Самые ранние попытки понять материю носили прежде всего философский характер, не прибегая к строгой экспериментальной проверке. Таким образом, хотя некоторые химические элементы были известны с древних времен, не предпринималось попыток систематизировать их по свойствам.
По мере развития науки в восемнадцатом и девятнадцатом веках скорость открытия новых элементов возрастала. К 1809 г. было открыто 47 элементов, а к 1863 г. было известно 56.По мере роста числа известных элементов ученые начали распознавать закономерности в их свойствах и начали разрабатывать способы их классификации.
Предварительная работа
Антуан-Лоран де Лавуазье
Анотуан Лоран де Лавуазье
Traité Élémentaire de Chimie Лавуазье (Элементарный трактат по химии, 1789, переведенный на английский язык Робертом Керром) считается первым современным учебником по химии. Он содержал список элементов или веществ, которые нельзя было разложить дальше, включая кислород, азот, водород, фосфор, ртуть, цинк и серу.Он также составляет основу современного списка элементов. Однако в его список также входили легкие и калорийные вещества, которые он считал материальными веществами. В то время как многие ведущие химики того времени отказывались верить новым откровениям Лавуазье, Elementary Treatise был написан достаточно хорошо, чтобы убедить молодое поколение.
Он содержал список элементов или веществ, которые нельзя было разложить дальше, включая кислород, азот, водород, фосфор, ртуть, цинк и серу.Он также составляет основу современного списка элементов. Однако в его список также входили легкие и калорийные вещества, которые он считал материальными веществами. В то время как многие ведущие химики того времени отказывались верить новым откровениям Лавуазье, Elementary Treatise был написан достаточно хорошо, чтобы убедить молодое поколение.
Йонс Якоб Берцелиус
Статуя Берцелиуса в центре парка Берцели, Стокгольм Берцелиус — шведский химик. В 1828 году он составил таблицу относительных атомных весов, в которой кислород был принят за 100 и которая включала все элементы, известные в то время.Для периодической таблицы важно то, что он изобрел современную систему химических обозначений и установил основные символы для элементов, которые используются сегодня. В этой системе элементам присваиваются символы, а соединения представляются сочетанием символов элементов и чисел, представляющих пропорции. Студентам, работающим в лаборатории Берцелиуса, приписывают открытие лития и ванадия. Другими элементами, приписываемыми Берцелиусу, являются кремний, селен, торий и церий. Вместе с Джоном Дальтоном и Антуаном Лавуазье он считается отцом современной химии.
Студентам, работающим в лаборатории Берцелиуса, приписывают открытие лития и ванадия. Другими элементами, приписываемыми Берцелиусу, являются кремний, селен, торий и церий. Вместе с Джоном Дальтоном и Антуаном Лавуазье он считается отцом современной химии.
Иоганн Вольфганг Доберейнер
Доберейнер — немецкий химик. Как сын кучера, у него было мало возможностей для формального образования, но он был отдан в ученики к аптекарю, много читал и посещал научные лекции. В конце концов с 1810 года он был профессором Йенского университета. Он открыл фурфурол, работал над использованием платины в качестве катализатора и изобрел зажигалку, известную как лампа Доберейнера. Что касается периодической таблицы, он особенно известен своим открытием триад элементов в 1829 году.Он определил группы из трех химически сходных элементов, которые, как мы понимаем сегодня, попадают в одну и ту же группу или семейство периодической таблицы.
| Элемент | Молярная масса (г/моль) | Плотность (г/см³) | Коэффициент (см³/моль) |
|---|---|---|---|
| хлор | 35. 4527 4527 | 0,003214 | 11030 |
| бром | 79,904 | 3.122 | 25,6 |
| йод | 126. | 4,93 | 25,7 |
| кальций | 40.078 | 1,54 | 26,0 |
| стронций | 87,62 | 2,64 | 33,2 |
| барий | 137,327 | 3,594 | 38,2 |
Александр-Эмиль Бегуйе де Шанкуртуа
Александр-Эмиль Бегуйе де Шанкуртуа, французский геолог, был первым, кто заметил периодичность элементов — похожие элементы появляются через равные промежутки времени, когда они упорядочены по их атомному весу.Он разработал раннюю форму периодической таблицы, которую назвал теллурической спиралью . С элементами, расположенными по спирали на цилиндре в порядке возрастания атомного веса, де Шанкуртуа увидел, что элементы со схожими свойствами выстраиваются вертикально. Его диаграмма включала некоторые ионы и соединения в дополнение к элементам. Его статья была опубликована в 1862 году, но в ней использовались геологические, а не химические термины, и в ней не было диаграммы; в результате ему уделялось мало внимания до работы Дмитрия Менделеева.[1]
Его диаграмма включала некоторые ионы и соединения в дополнение к элементам. Его статья была опубликована в 1862 году, но в ней использовались геологические, а не химические термины, и в ней не было диаграммы; в результате ему уделялось мало внимания до работы Дмитрия Менделеева.[1]
Октавы Джона Ньюлендса
Джон Ньюлендс был английским химиком, написавшим в 1863 году статью, в которой классифицировал 56 открытых к тому времени элементов на 11 групп, основанных на схожих физических свойствах. Он отметил, что существует много пар подобных элементов, которые различаются атомным весом, кратным восьми.
Компания Newlands взяла идеи Доберейнера и расширила их. Он также организовал свои элементы по массе и свойствам, но добавил изюминку.Доберейнер работал только в небольших группах, но Ньюлендс хотел связать все элементы друг с другом.
Ньюлендс расположил известные элементы в таблице по атомным весам. При этом он заметил некоторые повторяющиеся паттерны, а паттерны были такими, что если бы он разбил свой список элементов на группы по семь, то первые элементы в каждой из этих групп были бы похожи друг на друга, как и второй элемент в каждой. группа, третья и так далее. По аналогии с тонической музыкальной гаммой из семи нот, образующих октавы, он назвал свое открытие Законом Октав .
группа, третья и так далее. По аналогии с тонической музыкальной гаммой из семи нот, образующих октавы, он назвал свое открытие Законом Октав .
Ньюлендс также заметил, что кремний и олово составляют часть триады, и поэтому предсказал третий неизвестный элемент с атомным весом около 73, предвосхитив предсказание Менделеева о германии на шесть лет, но не оставил места для нового элемента в своей таблице. .
Работа Ньюлендса подверглась резкой критике и даже насмешкам со стороны других химиков из-за отсутствия места для неоткрытых элементов и помещения двух элементов в одну коробку, но в конце концов он был награжден медалью Дэви Королевским обществом в 1887 году.
Первый стол
По мере того, как число известных элементов увеличивалось, два человека, работая независимо друг от друга, примерно в одно и то же время создали первые периодические таблицы. Этими двумя были Юлий Лотар Мейер и Дмитрий Менделеев. Мейер опубликовал некоторые данные первым, но таблицу опубликовал только через несколько месяцев после Менделеева.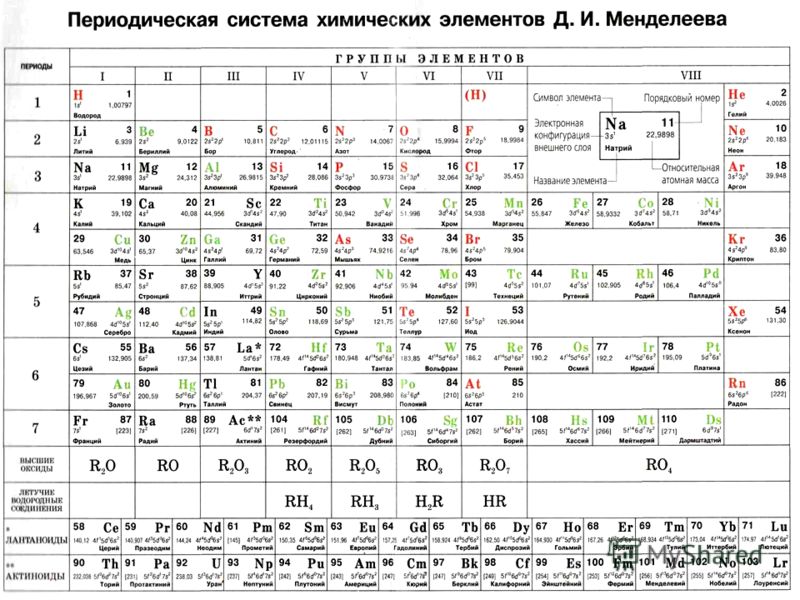 Мейера и Менделеева можно считать соавторами периодической таблицы, хотя большинство согласны с тем, что точные предсказания Менделеева приносят ему большую долю доверия. В то время именно предсказания Менделеева произвели большое впечатление на его современников, особенно когда в конце концов они оказались верными.
Мейера и Менделеева можно считать соавторами периодической таблицы, хотя большинство согласны с тем, что точные предсказания Менделеева приносят ему большую долю доверия. В то время именно предсказания Менделеева произвели большое впечатление на его современников, особенно когда в конце концов они оказались верными.
Юлиус Лотар Мейер
Мейер был современником Менделеева; он получил медицинское образование в Цюрихе, Швейцария, а затем учился и преподавал в различных немецких университетах. Хотя его первым интересом была физиология, он в первую очередь интересовался химией. Мейер изучал физические свойства элементов и заметил периодичность их молярного объема.
В 1864 году Мейер опубликовал предварительный список из 28 элементов, разделенных на 6 семейств по их валентности — это был первый случай, когда элементы были сгруппированы и упорядочены в соответствии с их валентностью.Работа по организации элементов по атомному весу до сих пор тормозилась из-за неточных измерений атомного веса. Затем в 1868 г. он подготовил расширенный вариант, а в 1870 г. опубликовал свой список в виде таблицы, во многом похожей на менделеевскую.
Затем в 1868 г. он подготовил расширенный вариант, а в 1870 г. опубликовал свой список в виде таблицы, во многом похожей на менделеевскую.
Дмитрий Менделеев
Страница из первого английского издания учебника Менделеева (1891 г., на основе русского пятого издания). Он показывает изменения химических свойств в зависимости от атомного веса, которые он использовал для составления своей периодической таблицы.Периоды представлены (правый столбец), но группы не показаны. Дмитрий Менделеев (также пишется Менделеев, второе имя (отчество) Иванович, был русским химиком сибирского происхождения. Менделеев исследовал изменение химических свойств элементов (см. изображение справа) и заметил их периодические изменения. Он организовал элементы в таблице, упорядоченной по атомной массе.6 марта 1869 г. в Русском химическом обществе была сделана официальная презентация под названием «Зависимость между свойствами атомных весов элементов ».Его таблица была первоначально опубликована в малоизвестном русском журнале, но быстро переиздана в немецком журнале Zeitschrift für Chemie в 1869 году.
Работа Менделеева заявлена
- Элементы, расположенные в соответствии с их атомным весом, проявляют кажущуюся периодичность свойств.
- Элементы, сходные по своим химическим свойствам, имеют атомный вес, который либо почти одинаков (например, Pt, Ir, Os), либо регулярно увеличивается (например, Pt, Ir, Os).г., К, Rb, Cs).
- Расположение элементов или групп элементов в порядке их атомных весов соответствует их так называемым валентностям, а также в некоторой степени их отличительным химическим свойствам; как это видно среди других серий в сериях Li, Be, Ba, C, N, O и Sn.
- Наиболее широко распространенные элементы имеют небольшой атомный вес.
- Величина атомного веса определяет характер элемента, так же как величина молекулы определяет характер сложного тела.
- Следует ожидать открытия многих еще неизвестных элементов, например элементов, аналогичных алюминию и кремнию, атомный вес которых будет между 65 и 75.
- Атомный вес элемента иногда можно исправить, зная веса смежных с ним элементов.
 Таким образом, атомный вес теллура должен лежать между 123 и 126 и не может быть равен 128.
Таким образом, атомный вес теллура должен лежать между 123 и 126 и не может быть равен 128. - Определенные характерные свойства элементов можно предсказать по их атомному весу.
Таблица Менделеева
| Группа → | я | II | III | IV | В | ВИ | VII | VIII | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Период ↓ | | ||||||||||||||||||||||||||||
| 1 | 1 Н | ||||||||||||||||||||||||||||
| 2 | 7 Ли | 9.4 Бе | 11 Б | 12 С | 14 Н | 16 О | 19 Ф | | | ||||||||||||||||||||
| 3 | 23 Нет | 24 мг | 27,3 Ал | 28 Си | 31 П | 32 С | 35,5 Кл | | | ||||||||||||||||||||
| 4 | 39 К | 40 Ка | 44 ? | 48 Ти | 51 В | 52 Кр | 55 Мн | 56, 59, 59 Fe, Co, Ni | | ||||||||||||||||||||
| 5 | 63 Медь | 65 цинк | 68 ? | 72 ? | 75 Как | 78 Се | 80 руб.  | | | ||||||||||||||||||||
| 6 | 85 руб. | 87 Старший | 88 ?Yt | 90 Zr | 94 Нб | 96 Мо | 100 ? | 104, 104, 106 Ру, Прав., Палл. | | ||||||||||||||||||||
| 7 | 108 Аг | 112 CD | 113 В | 118 Сн | 122 Сб | 125 Те | 127 я | | | ||||||||||||||||||||
| 8 | 133 Цс | 137 Ба | 138 ?Ди | 140 ?Се | | | | | | ||||||||||||||||||||
| 9 | | | | | | | | | | ||||||||||||||||||||
| 10 | | | 178 ?Эр | 180 ?Ла | 182 Та | 184 Вт | | 195, 197, 198 Os, Ir, Pt | | ||||||||||||||||||||
| 11 | 199 Золото | 200 рт.  ст. ст. | 204 Тл | 207 Pb | 208 Би | | | | | ||||||||||||||||||||
| 12 | | | | 231 ть | | 240 У | | | | ||||||||||||||||||||
| | |||||||||||||||||||||||||||||
| Группа I | Группа II | Группа III | Группа IV |
| Группа V | Группа VI | Группа VII | Группа VIII |
Менделеев использовал свою таблицу для предсказания свойств и существования других новых элементов (? в таблице выше). Он оставил место в своей таблице для этих новых элементов, эка-кремния (германия), эка-алюминия (галлия) и эка-бора (скандия). Он указал, что некоторые из тогдашних атомных весов были неправильными и предусматривали отклонение от порядка атомных весов.
Он оставил место в своей таблице для этих новых элементов, эка-кремния (германия), эка-алюминия (галлия) и эка-бора (скандия). Он указал, что некоторые из тогдашних атомных весов были неправильными и предусматривали отклонение от порядка атомных весов.
Лорд Рэлей и Уильям Рэмси
Вечером 19 апреля 1894 года Уильям Рамзи посетил лекцию лорда Рэлея. Рэлей заметил несоответствие между плотностью азота, полученного путем химического синтеза, и азота, выделенного из воздуха путем удаления других известных компонентов.После короткого обсуждения он и Рамзи решили заняться этим. К августу Рамзи мог написать Рэлею, чтобы сообщить, что он выделил ранее неизвестный тяжелый компонент воздуха, который, по-видимому, не обладал какой-либо очевидной химической активностью. Он назвал газ «аргон». В последующие годы он открыл неон, криптон и ксенон. Он также выделил гелий, который наблюдался в спектре Солнца, но не был обнаружен на Земле. В 1910 году он также выделил и охарактеризовал радон.
Эти благородные газы первоначально были включены в таблицу Менделеева как нулевая группа и помещены перед элементами группы I каждого периода.
К современному столу
В начале двадцатого века наш взгляд на структуру материи продвинулся вперед и, соответственно, произошли изменения в периодической таблице. Благородные газы помещались в конце периодов, а не в начале. Было обнаружено, что периоды четыре и выше длиннее, чем с первого по третий, поскольку переходные металлы были размещены правильно, а более короткие периоды были разделены.
В 1911 году Резерфорд продемонстрировал, что атомы имеют ядро, в котором сосредоточена большая часть массы и весь положительный заряд атома.Заряд ядра, или атомный номер (количество протонов в ядре), стал организующим принципом таблицы.
Генри Мозли
В 1913 году Генри Мозли обнаружил связь между длиной волны рентгеновского излучения элемента и его атомным номером. До этого открытия атомные номера были просто случайными числами, основанными на атомном весе элемента. Открытие Мозли показало, что атомные числа не были произвольными, а имели поддающуюся экспериментальному измерению основу.
Открытие Мозли показало, что атомные числа не были произвольными, а имели поддающуюся экспериментальному измерению основу.
Исследование Мосли показало, что порядок элементов в таблице должен соответствовать атомному номеру, а не атомному весу.Это решило некоторые проблемы, о которых знал даже Менделеев. Его работа также показала, что в таблице были пробелы под атомными номерами 43 и 61, которые теперь известны как радиоактивные и не встречающиеся в природе. Следуя по стопам Дмитрия Менделеева, Генри Мозли также предсказал новые элементы.
Глен Сиборг
Шведского происхождения Сиборг родился в Ишпеминге, штат Мичиган. В 1934 году получил степень бакалавра химии в Калифорнийском университете в Лос-Анджелесе.Он получил докторскую степень по химии (хотя его диссертация была по физике) в Калифорнийском университете в Беркли в 1937 году. В 1939 году он стал преподавателем химии в Беркли, в 1945 году получил звание профессора, а с 1958 года занимал пост канцлера. до 1961 года.
до 1961 года.
В своих ранних исследованиях он использовал циклотронную бомбардировку для создания более 50 атомных изотопов, включая несколько, которые до сих пор используются в медицине. В 1941 году ему приписывают открытие и выделение плутония, а затем и трансурановых элементов с атомным номером от 94 до 102.Его работа над трансурановыми элементами привела к реконфигурации периодической таблицы, в которой он поместил ряд актиноидов под ряд лантанидов в нижней части таблицы, чтобы придать периодической таблице тот вид, который она имеет сегодня.
В знак признания его заслуг элемент 106 был назван в его честь сиборгием.
Внешние ссылки
Все ссылки получены 11 января 2018 г.
Кредиты
New World Encyclopedia писатели и редакторы переписали и дополнили статью Wikipedia в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно быть выполнено в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Упоминание должно быть выполнено в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание. На использование отдельных изображений, которые лицензируются отдельно, могут распространяться некоторые ограничения.
Спустя 150 лет не пора ли перевернуть периодическую таблицу с ног на голову? | The Independent
Когда сэр Мартин Полякофф, химик из Ноттингемского университета, услышал об игре под названием Морской бой периодической таблицы, он не мог не представить точку зрения игрока на перевернутый флот элементов противника.
Это послужило толчком к безумной идее. В мае, что совпало с Международным годом Периодической таблицы ЮНЕСКО, отмечающим ее 150-летие, Полякофф и его сотрудники, в том числе его дочь Эллен Полякофф, психолог-экспериментатор из Манчестерского университета, опубликовали статью с рекомендацией: стол вверх ногами.
В мае, что совпало с Международным годом Периодической таблицы ЮНЕСКО, отмечающим ее 150-летие, Полякофф и его сотрудники, в том числе его дочь Эллен Полякофф, психолог-экспериментатор из Манчестерского университета, опубликовали статью с рекомендацией: стол вверх ногами.
«С 1869 года поколения химиков предлагали вариации формата, чтобы улучшить таблицу, сделать ее более понятной или просто сделать ее более увлекательной», — писали они. Периодическая таблица элементов, разработанная русским химиком Дмитрием Менделеевым, представляет собой двумерный массив химических элементов, упорядоченных по атомным номерам и расположенных по 18 орбиталям. Он представляет собой схему моделей и тенденций, которая позволяет ученым предсказывать свойства элементов, реакционную способность и даже новые элементы. Ее называют «Розеттским камнем природы», «картой химика» и «вероятно, самым компактным и содержательным сборником знаний, когда-либо созданных».
«Похоже, если я посмотрю на карту Соединенных Штатов, и я нахожусь в штате Мэн, я могу сказать, что температура там будет ниже, чем если бы я был во Флориде», — говорит Грегори Джиролами в совместном интервью. с женой Верой Майнц. Оба являются химиками-неорганиками из Университета Иллинойса в Урбана-Шампейн. Вместе с Кармен Джунта, химиком из колледжа Ле Мойн в Сиракузах, штат Нью-Йорк, они организовали симпозиум, посвященный 150-летию, который состоялся на этой неделе во время национального собрания Американского химического общества в Сан-Диего.
с женой Верой Майнц. Оба являются химиками-неорганиками из Университета Иллинойса в Урбана-Шампейн. Вместе с Кармен Джунта, химиком из колледжа Ле Мойн в Сиракузах, штат Нью-Йорк, они организовали симпозиум, посвященный 150-летию, который состоялся на этой неделе во время национального собрания Американского химического общества в Сан-Диего.
«Если вы скажете мне, что какой-то элемент находится в определенном месте, — говорит Джиролами, — я могу рассказать вам о нем многое — металл это или нет, распространен он на Земле или нет — просто отметив его место в периодической таблице».
Шорт-лист «Научный фотограф года»
Показать все 91/9 Шорт-лист «Научный фотограф года»
Шорт-лист журнала Science Photographer of the Year
Структуры мыльных пузырей, демонстрирующие световые интерференционные цвета и узоры
Мыльные пузыри хотят оптимизировать пространство и минимизировать площадь своей поверхности для заданного объема воздуха.Это уникальное явление делает их надежным и полезным инструментом во многих областях исследований.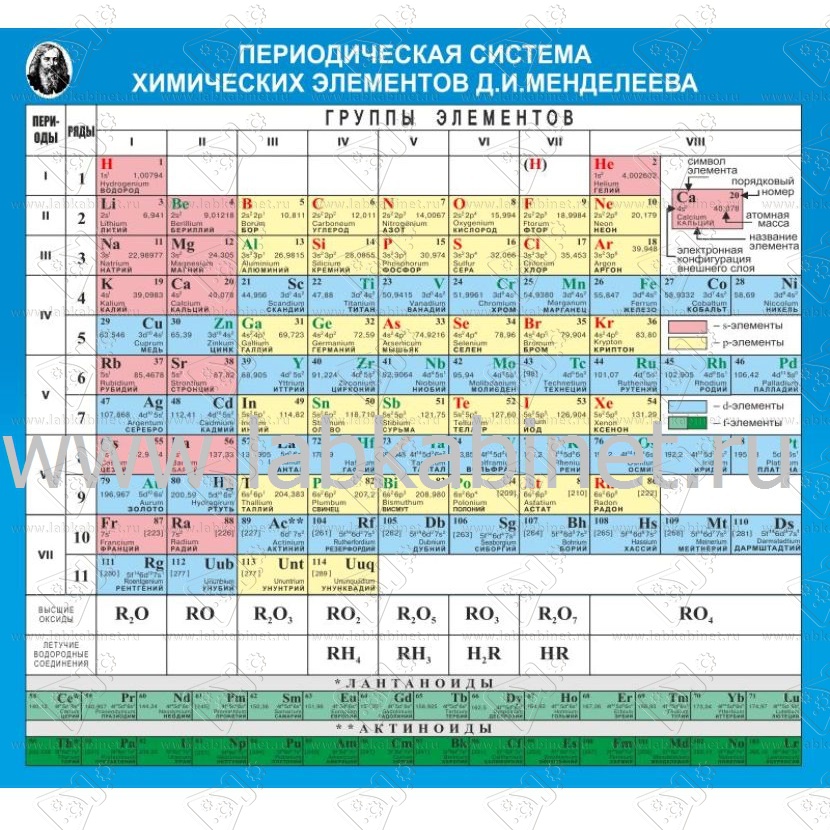 В частности, материаловедение и «упаковка» — то, как вещи сочетаются друг с другом. Стенки пузыря стекают под действием силы тяжести, тонкие вверху, толстые внизу и мешают прохождению световых волн, создавая цветные полосы. Черные точки показывают, что стенка слишком тонкая для интерференционных цветов, что указывает на то, что пузырь вот-вот лопнет! – Kym Cox
В частности, материаловедение и «упаковка» — то, как вещи сочетаются друг с другом. Стенки пузыря стекают под действием силы тяжести, тонкие вверху, толстые внизу и мешают прохождению световых волн, создавая цветные полосы. Черные точки показывают, что стенка слишком тонкая для интерференционных цветов, что указывает на то, что пузырь вот-вот лопнет! – Kym Cox
Kym Cox/RPS
Шорт-лист научного фотографа года
Перевернутая медуза, Cassiopea xamachana
Вместо того, чтобы плавать, этот вид проводит время, пульсируя вверх и вниз в воде.Их диета состоит из морского планктона, а их окраска обусловлена поглощением водорослей в воде. Задокументировано, что некоторые виды медуз поедают пластик в океане. Одна теория предполагает, что на пластике растут водоросли. Разлагаясь, водоросли создают запах диметилсульфида, привлекающий голодных животных. – Мэри Энн Чилтон
Мэри Энн Чилтон/RPS
Список лучших научных фотографов года
Tribolium confusum.
 Смущенный мучной жук.
Смущенный мучной жук.Этот мелкий жук является вредителем хранимого зерна и мучных изделий.Сканирующая электронная микрофотография, раскрашенная в Photoshop. – Дэвид Спирс
Дэвид Спирс/RPS
Список лучших научных фотографов года
NGC7000 Туманность Северной Америки
Туманность Северная Америка, NGC7000, является эмиссионной туманностью в созвездии Лебедя, недалеко от Денеба. Замечательная форма туманности напоминает континент Северной Америки с видным Мексиканским заливом. Стена Лебедя, термин, обозначающий «мексиканскую и центральноамериканскую часть» туманности Северная Америка, демонстрирует наиболее концентрированные звездные образования в туманности.- Дэйв Уотсон
Дэйв Уотсон/RPS
Список лучших научных фотографов года
Safety Corona
Английская булавка подключена к генератору переменного тока высокого напряжения. Булавка ионизирует воздух вокруг себя. Когда электроны падают обратно на атом, избыточная энергия излучается в виде фотонов, которые создают свечение короны вокруг штифта. Нечеткость булавки связана с тем, что камера на самом деле фиксирует не свет, отраженный от булавки, а свет, излучаемый ионизированным светом вокруг нее.- Ричард Жермен
Нечеткость булавки связана с тем, что камера на самом деле фиксирует не свет, отраженный от булавки, а свет, излучаемый ионизированным светом вокруг нее.- Ричард Жермен
Ричард Жермен/RPS
Список лучших научных фотографов года
Спокойствие вечности
Гималаи, Непал. Высокогорное озеро Госайкунда. Точка съемки – 4400м. Млечный Путь — это галактика, содержащая Солнечную систему, название которой описывает внешний вид галактики с Земли: туманная полоса света, видимая в ночном небе, образованная звездами, которые невозможно различить по отдельности невооруженным глазом. Млечный Путь — спиральная галактика с перемычкой диаметром от 150 000 до 200 000 световых лет.По оценкам, он содержит 100‚ 400 миллиардов звезд Евгений Самученко
Евгений Самученко/RPS
Шорт-лист журнала Science Photographer of the Year
Жук-олень
Жук-олень. Световая микроскопия. Увеличение 5x. – Виктор Сикора
Виктор Сикора/RPS
Шорт-лист научного фотографа года
Mapping1_OxygenIb_PEM
Заключительный крупный проект для магистра фотографии Фалмутского университета. Проект: Картирование 1, Недомогание после физической нагрузки.Карта 1 посвящена исследованию миалгического энцефаломиелита. Благодаря исследованию перспективы, сложностей и научного междисциплинарного сотрудничества я создаю образы, которые объясняют, раскрывают и сознательно связывают нас с неоднозначным и неизвестным. – Ясмин Кроуфорд
Проект: Картирование 1, Недомогание после физической нагрузки.Карта 1 посвящена исследованию миалгического энцефаломиелита. Благодаря исследованию перспективы, сложностей и научного междисциплинарного сотрудничества я создаю образы, которые объясняют, раскрывают и сознательно связывают нас с неоднозначным и неизвестным. – Ясмин Кроуфорд
Ясмин Кроуфорд/RPS
Список лучших научных фотографов года
Телескоп Ловелла, серия 1c
Я всегда был очарован телескопом Ловелла в Джодрелл-Банке с тех пор, как в детстве ездил в школьную поездку.Здесь я хотел сделать серию более близких, более подробных и более честных снимков, чем мы часто видим. Исследуя множество форм и показывая износ телескопа, каждая фотография в серии стоит отдельно или может быть просмотрена вместе, в любом случае, они представляют мощное изображение машины, которая помогает человечеству в его усилиях понять пространство и время. – Мардж Брэдшоу
Мардж Брэдшоу/RPS
Майнц добавляет: «Если вы хотите общаться с инопланетной расой, установите периодическую таблицу.
Интернет-база данных периодических таблиц насчитывает более 1000 версий, включая таблицу нехватки элементов, а также кексы, часы, вариации Lego и хайку и другие технические адаптации. Математик и музыкант Том Лерер положил его на музыку (Гилберта и Салливана), а итальянский химик, писатель и выживший в Освенциме Примо Леви использовал его как основу для своеобразных мемуаров ( The Periodic Table ).
«Похоже, что многие люди верят, что существует только одна настоящая периодическая таблица, которая либо существует, либо ждет открытия, и идут на многое, чтобы обсудить достоверность различных типов», — говорит Полякофф, автор YouTube. личность с его периодическими видео.«Я чувствую, что большинство типов одинаково действительны, и это просто зависит от того, что вы пытаетесь показать».
Перевернутая версия призвана показать ценность свежего взгляда. «Мы не утверждаем, что наша версия в чем-то «более правильная», чем традиционная таблица», — написали авторы.
Почему не по алфавиту?
Периодическая таблица придала основательность области исследований, которая долгое время была слабой. Сэр Исаак Ньютон в Query 31, разделе его работы 1717 года Opticks , перечислил и ранжировал химические соединения в соответствии с их реакционной способностью.В 1718 году французский химик Этьен Франсуа Жоффруа составил первую «таблицу сходства», в которой реакционная способность материалов оценивалась в графической форме. Внимательные наблюдатели за природой заметили, что некоторые химические элементы, такие как литий, натрий и калий, известные сегодня как щелочные металлы, были мягкими и плавали в воде. Но такие качественные классификации давали лишь шаткое основание.
Прорывы начались в 1860 году, когда Станислао Канниццаро, итальянский химик, обосновал обсуждение атомного веса.Были в обращении противоречивые списки атомных весов и различные предположения о том, что представляет собой атом по сравнению с молекулой. Канниццаро составил список атомных весов известных элементов вместе с обоснованием значений, которые он раздал в виде брошюры на конференции в Карлсруэ, Германия.
Канниццаро составил список атомных весов известных элементов вместе с обоснованием значений, которые он раздал в виде брошюры на конференции в Карлсруэ, Германия.
«Это открыло дверь для того, что я называю одновременным открытием шести человек в течение примерно семи лет, кульминацией которого стал Менделеев», — говорит Эрик Шерри, историк и философ науки из Калифорнийского университета в Лос-Анджелесе. Анхелес и эксперт по истории таблицы Менделеева.(Обновленное издание его книги Периодическая таблица: ее история и ее значение будет опубликовано в октябре издательством Oxford University Press.) В 1862 году французский геолог Александр-Эмиль Бегуйе де Шанкуртуа составил трехмерную таблицу, вписав элементы вокруг металлический цилиндр. Джон Ньюлендс, химик-сахар из Лондона, расположил элементы в порядке их атомного веса группами по восемь штук. «Над этим посмеялись и отвергли», — говорит Шерри.
Таблица спирали Теодора Бенфея, 1964 год
Британский химик Уильям Одлинг открыл «периодический закон» — свойства семейства элементов, которые приблизительно повторяются через равные промежутки времени. Густав Хинрихс предложил радиальное упорядочение. «Я называю это периодической таблицей велосипедного колеса», — говорит Шерри.
Густав Хинрихс предложил радиальное упорядочение. «Я называю это периодической таблицей велосипедного колеса», — говорит Шерри.
Лотар Мейер, немецкий химик, создал частичную периодическую таблицу в 1864 году и более полную версию в 1869 году. «Структурно таблицы Мейера и Менделеева были очень похожи», — говорит Алан Рок, историк науки из Университета Кейс Вестерн Резерв выступил с докладом о Мейере на юбилейном симпозиуме ACS.
Менделеев предусмотрительно оставил место для неизвестных элементов
Поначалу периодичность и предсказательная сила таблицы казались «нумерологической загадкой», говорит Рок.В 20-м веке периодичность была объяснена квантовой физикой, в частности, физикой того, как электроны вращаются вокруг ядра. Литий, натрий и калий, которые хорошо выровнены в первом вертикальном столбце таблицы — первая группа, щелочные металлы, рубидий, цезий и франций — все имеют один электрон на своей внешней электронной оболочке.
Оба химика за многие годы составили множество таблиц, корректируя их в соответствии с новыми открытиями и более точными данными. В конце концов Менделеев победил.Когда в шаблонах его таблиц появлялись пробелы, он предсказывал, что должно появиться. Некоторые ошибались, но он точно предсказал существование трех элементов: галлия, германия и скандия. «Предсказание психологически драматично, — говорит Шерри. «Если ученый что-то предсказывает, и это сбывается, в некотором смысле этот ученый знает тайны природы или почти знает будущее».
В конце концов Менделеев победил.Когда в шаблонах его таблиц появлялись пробелы, он предсказывал, что должно появиться. Некоторые ошибались, но он точно предсказал существование трех элементов: галлия, германия и скандия. «Предсказание психологически драматично, — говорит Шерри. «Если ученый что-то предсказывает, и это сбывается, в некотором смысле этот ученый знает тайны природы или почти знает будущее».
Но наука редко развивается путем революции, говорит Шерри: «Наука — это деятельность, осуществляемая сотнями тысяч исследователей, каждый из которых вносит свой вклад в общую картину, которая в конечном итоге возникает.
Спираль Генриха Баумхауэра 1870 года
(Американское химическое общество)
Это была тема юбилейного симпозиума. Бриджит Ван Тиггелен, историк химии из Института истории науки в Филадельфии, обсудила работу Иды Ноддак, немецкого химика, открывшего рений, и Лизы Мейтнер, австрийско-шведского физика, которая вместе с Отто Ганом открыла протактиний. Тиггелен является редактором новой книги « Женщины в их стихии », в которой исследуется более 30 подобных историй, в том числе, конечно же, история Марии Кюри, которая открыла два элемента, радий и полоний, и дважды получила Нобелевскую премию.«Мы представляем эту историю как коллективное предприятие, — говорит Тиггелен.
Тиггелен является редактором новой книги « Женщины в их стихии », в которой исследуется более 30 подобных историй, в том числе, конечно же, история Марии Кюри, которая открыла два элемента, радий и полоний, и дважды получила Нобелевскую премию.«Мы представляем эту историю как коллективное предприятие, — говорит Тиггелен.
До свидания, алхимия
Среди своих достижений периодическая таблица позволила химии избавиться от порока алхимии. Ньютон мало чем мог помочь в этом отношении: он был одержим «химией» — синонимом алхимии, согласно Оксфордскому словарю английского языка, — и идентификацией философского камня, который превращал неблагородные металлы в золото.
В течение нескольких лет Уильям Ньюман, историк науки из Университета Индианы, копировал работу Ньютона, а совсем недавно пытался определить ингредиенты ньютоновского варева.«Некоторых соединений, полученных Ньютоном, нет в наших библиотеках данных», — говорит Ньюман, недавно опубликовавший книгу «Ньютон-алхимик: наука, загадка и поиски «тайного огня» природы» . «Он синтезировал новые материалы, которые, возможно, еще не были обнаружены».
«Он синтезировал новые материалы, которые, возможно, еще не были обнаружены».
Даже в ярком свете современной науки химические реакции остаются чрезвычайно увлекательными, говорит Шерри: «В физической смеси вы получаете сумму частей, когда смешиваете А с В. В химии вы смешиваете А и В, и вы получаете что-то качественно новое.»
Рассмотрим реакцию между натрием, серебристым ядовитым металлом, и хлором, зеленым ядовитым газом. «Когда они реагируют вместе, они производят нечто совершенно другое, не только неядовитое, но и необходимое для жизни, а именно соль», — говорит Шерри. «Это магия».
И своего рода алхимия работает в сумеречных зонах таблицы Менделеева, где физики-ядерщики и радиохимики раздвигают границы с новыми элементами. Самый тяжелый природный элемент в таблице — это уран с атомным номером 92 (потому что в его ядре 92 протона).Но периодическая таблица содержит еще больше; самым тяжелым на данный момент является элемент 118, оганесон, «сверхтяжелый» элемент со 118 протонами и периодом полураспада в полмиллисекунды. Впервые он был синтезирован в 2002 году Юрием Оганесяном и российско-американской группой в Объединенном институте ядерных исследований в Дубне, к северу от Москвы.
Впервые он был синтезирован в 2002 году Юрием Оганесяном и российско-американской группой в Объединенном институте ядерных исследований в Дубне, к северу от Москвы.
Начиная с 2020 года, ученые попытаются синтезировать элементы 119 и 120 с помощью недавно открытого Фабрики сверхтяжелых элементов и экспериментального оборудования, которое в 100 раз более чувствительно.Они надеются добраться до «острова стабильности», легендарной области периодической таблицы, населенной сверхтяжелыми элементами с большей продолжительностью жизни. По словам Оганесяна, сверхтяжелые элементы представляют собой каверзные вопросы. Будут ли эти элементы вести себя так, как предсказывает периодическая таблица? Пока ожидаются лишь некоторые отклонения в поведении. Но по мере увеличения атомных номеров отклонения будут увеличиваться.
Итак, таблица Менделеева выдержит? Или, как Пекка Пьюкко, химик-вычислитель из Хельсинкского университета, выразился в заголовке статьи 2016 года: «С периодической таблицей все в порядке («ПТ в порядке»)?» Наверное, с доработками, заключил он. Пюйкко сформулировал периодическую таблицу, которая химически классифицирует элементы до атомного номера 172.
Пюйкко сформулировал периодическую таблицу, которая химически классифицирует элементы до атомного номера 172.
Поддерживайте свободомыслящую журналистику и посещайте независимые мероприятия
Однако он отметил, что вероятность найти самые тяжелые элементы меньше, чем вероятность удара Токио и сделать дыру в одном из них на вершине горы Фудзи. Если ученым повезет, у получившихся супер-сверхтяжелых элементов могут даже быть ядра экзотической формы, например, у пончика.
«Никто в это не верит», — говорит Пюйкко.— Но это одна теоретическая возможность. Другой вариант — ядро, содержащее магическое число протонов или нейтронов, а в идеале и того, и другого — то есть достаточное количество, чтобы образовать полные субатомные оболочки. «Вдвойне магические ядра, которых существует множество, как правило, обладают наибольшей стабильностью», — говорит он. «Если бы вы могли найти двойное магическое ядро, у вас были бы лучшие шансы».
© New York Times
Периодическая таблица все еще влияет на современные исследования — ScienceDaily
В этом году исполняется 150 лет Периодической таблице, и принципы, побудившие Дмитрия Менделеева построить свою таблицу, до сих пор влияют на современные исследования.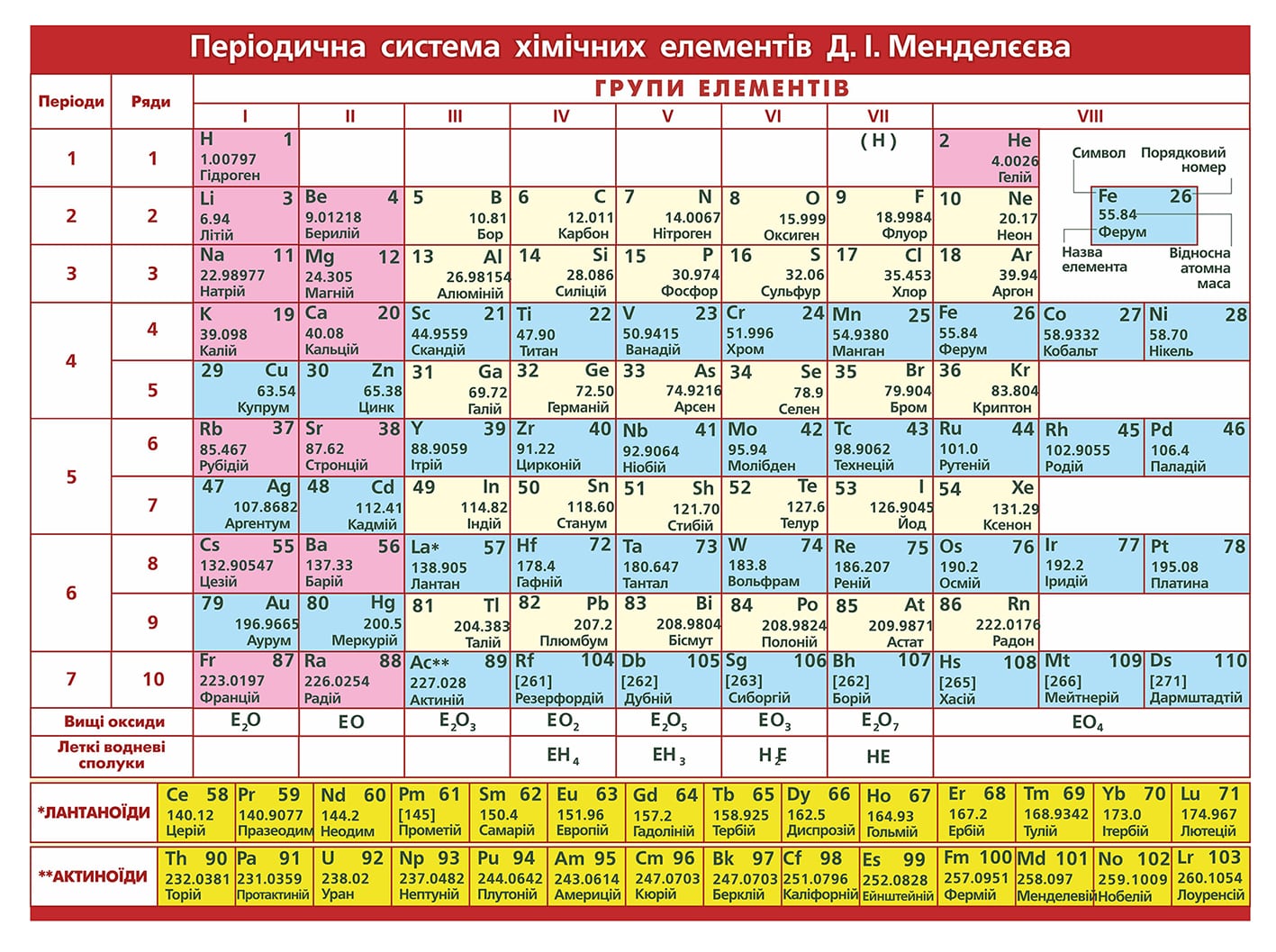
В специальном выпуске журнала Science , посвященном этому полуторавековому юбилею, ученый из Мичиганского государственного университета освещает некоторые текущие исследования по всему миру, проводимые под влиянием Менделеева.
«Наша цель состояла в том, чтобы продемонстрировать современные исследования, проводимые во всем мире, в том числе исследования в МГУ, проводимые при поддержке Министерства энергетики США, которые работают над реализацией новых подходов к фотоиндуцированным химическим процессам», — сказал Джеймс Маккаскер, химик МГУ и автор обзора.
Вклад Маккаскера сосредоточен на процессе поглощения света, который включает элементы из так называемого «переходного блока» Периодической таблицы. Соединения этого класса участвуют во всем, от солнечной энергии до органического синтеза.
«Эффективное улавливание и использование солнечного света — неиссякаемого, доступного во всем мире и экологически чистого источника энергии — имеет решающее значение для замены ископаемого топлива и смягчения последствий изменения климата», — сказал Маккаскер. «Чтобы реализовать эту цель, одним из ключевых процессов, которые должны происходить после поглощения света, является передача электронов, подобно тому, что растения делают при фотосинтезе.”
«Чтобы реализовать эту цель, одним из ключевых процессов, которые должны происходить после поглощения света, является передача электронов, подобно тому, что растения делают при фотосинтезе.”
Но реализовать эту возможность оказалось непросто. Частично это связано с тем, что соединения, которые очень эффективно преобразовывают свет в полезный заряд, требуют использования некоторых из наименее распространенных элементов на планете. Возьмем, к примеру, рутений и иридий, которые широко используются в хромофорах, способных осуществлять химические процессы, активируемые светом.
«Рутений является одним из пяти или шести наименее распространенных элементов в земной коре и просто не является приемлемым вариантом в качестве светособирающего компонента для такой глобальной проблемы, как производство солнечного топлива», — сказал Маккаскер.«Нам нужно найти заменители, которыми изобилует Земля, такие как железо, чтобы сделать возможным глобальное масштабирование. Это не инженерная или производственная проблема, а проблема фундаментальной науки, которая берет свое начало в тех самых концепциях, которые Менделеев открыл, когда он построил периодическая таблица».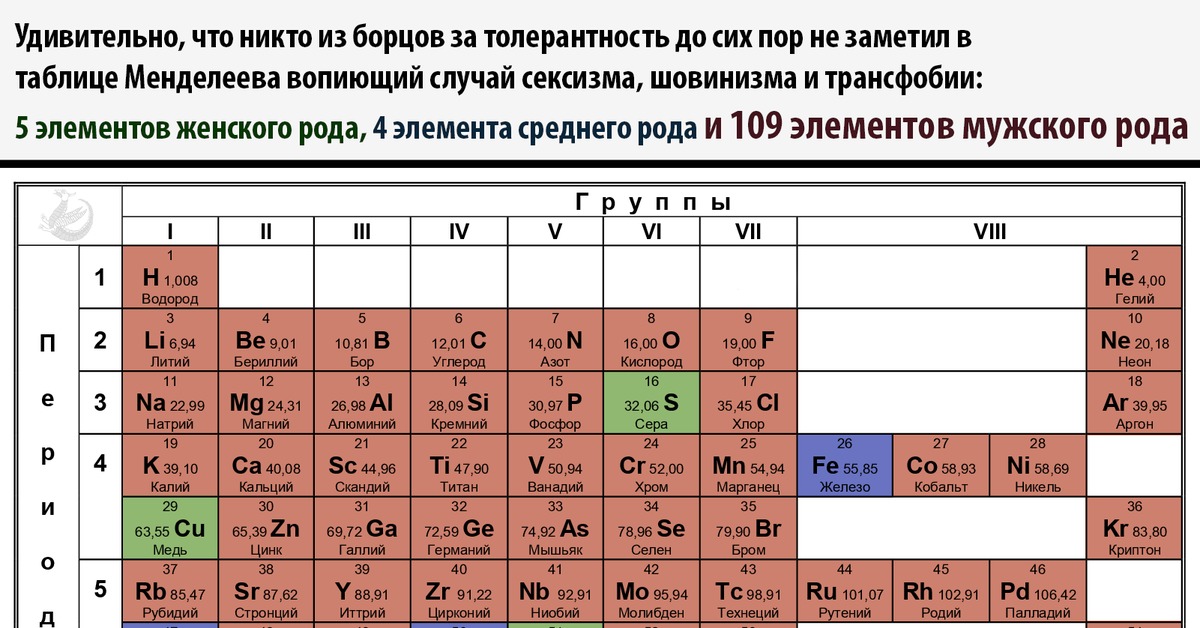
Вот где в игру вступают некоторые из исследований МГУ, поддерживаемых Министерством энергетики. Исследования Маккаскера основаны на слиянии синтетической органической и неорганической химии, а также на ряде спектроскопических методов.
«Особое значение в наших усилиях по преобразованию солнечной энергии имеет сверхбыстрая лазерная спектроскопия с временным разрешением, которая позволяет нам отслеживать эволюцию химической системы менее чем за одну триллионную долю секунды после поглощения света», — сказал Маккаскер. «Возможность совмещать синтез и сверхбыструю спектроскопию в одной лаборатории является критически важным аспектом исследования, поскольку позволяет моим студентам и мне устанавливать непосредственные связи между составом молекул, которые мы готовим, и их светоиндуцированными свойствами.”
Перспективы этой области сильны, добавил он.
«Хотя многое еще предстоит сделать, понимание периодического характера проблемы в сочетании с творческой работой растущего числа исследовательских групп по всему миру предвещает, что перспектива сейсмического сдвига в том, как мы связываем молекулярную неорганическую химию с наука о захвате и преобразовании света действительно блестящая», — сказал Маккаскер.
Источник истории:
Материалы предоставлены Университетом штата Мичиган . Примечание. Содержимое можно редактировать по стилю и длине.
Как поместить новый элемент в периодическую таблицу: NPR
В 2006 году элемент 111 получил официальное название рентгений. Квадрат элемента в периодической таблице был открыт министром науки Германии Аннетт Шаван. Майкл Пробст/AP скрыть заголовок
переключить заголовок Майкл Пробст/AP В 2006 году элемент 111 получил официальное название рентгений.Квадрат элемента в периодической таблице был открыт министром науки Германии Аннетт Шаван.
Два новых элемента были официально добавлены в периодическую таблицу в этом месяце. Элементы были обнаружены много лет назад, но им требовалось одобрение международного комитета, прежде чем их можно было разместить на знаменитой карте. Мы попросили Яна Чиллага и Майка Дэнфорта, продюсеров NPR Подожди, подожди, не говори мне и ведущих подкаста How To Do Everything , изучить, как работает этот процесс:
Как создать новый элемент
Начнем с того, что элементы 114 и 116 не встречаются в природе.Так что не ищите их на заднем дворе. Это потому, что они были сделаны в лаборатории. Это может показаться мошенничеством, но именно так это и делается в наши дни.
Мы позвонили Полу Каролю, председателю Объединенной рабочей группы по открытию новых элементов, которая дала официальное одобрение элементам, чтобы узнать, как работает этот процесс. И он предложил отличное объяснение, которое было действительно длинным и сложным, поэтому мы резюмируем его так:
И он предложил отличное объяснение, которое было действительно длинным и сложным, поэтому мы резюмируем его так:
- Соедините вместе атомы двух элементов.
- Надеюсь, их ядра сольются.
- Если это так, у вас есть новый элемент. Поздравляем!
Теперь, прежде чем вы начнете сталкивать атомы, обратите внимание, что это не так просто, как кажется из нашего невероятно упрощенного объяснения. В частности, с элементами 114 и 116 конечный продукт крошечный — и существует менее секунды, прежде чем он распадется.
Значит, у тебя нет куска металла, чтобы хвастаться.Вместо этого вы получаете страницы и страницы компьютерных данных от продвинутых датчиков.
«Эти два вида объединяются, возможно, один раз из миллиарда столкновений», — говорит Кароль. «Это миллиард миллиардов. Эксперименты обычно длятся месяц, и, может быть, они получат один или два признака того, что сделали что-то интересное».
Итак, после того, как вы сделаете свой выстрел один на миллиард, другим ученым придется проверить вашу работу, повторив ее. Вы можете видеть, как этот процесс может занять некоторое время.
Вы можете видеть, как этот процесс может занять некоторое время.
Возможные названия для новых элементов
Как только комитет Кароля решит, что ваш элемент легитимен, вы получите приглашение от ИЮПАК дать вашему элементу настоящее имя.
С момента открытия элементы 114 и 116 носили названия-заполнители унунквадиум и унунгексий. И химики сплетничают о возможных названиях новых элементов.
Как говорит Сэм Кин, автор книги «Исчезающая ложка » о периодической таблице: «Судя по слухам, один из элементов собираются назвать в честь ученого по имени Георгий Флеров. , и еще один после Москвы.”
Химик Кен Муди, вероятно, будет одним из первых, кто узнает новые имена. Он работает в команде Ливерморской национальной лаборатории Лоуренса, которая открыла элементы 114 и 116 совместно с российской командой.
Муди также тренирует спортивные команды старших классов.
«Один из игроков моей команды по имени Ханна сказал мне, что я должен назвать его Ханнайум, — говорит Грюм. «И Николь хотела, чтобы его назвали Николиум. Неважно, как его назовут, будет много маленьких девочек, которые будут разочарованы.”
«И Николь хотела, чтобы его назвали Николиум. Неважно, как его назовут, будет много маленьких девочек, которые будут разочарованы.”
Старый спор и предложение
Процесс присвоения имен может стать конкурентным. Во время холодной войны лаборатории Соединенных Штатов и Советского Союза утверждали, что открыли один и тот же новый элемент. Ученые называют последовавшую за этим многолетнюю битву за имена «Трансфермиевыми войнами».
Это было похоже на «Звездных войн», , за исключением того, что Дарт Вейдер и Чубакка спорили о судьбе галактики, а русские и американцы спорили о том, называть ли элемент курчатовиумом или резерфордиумом.И световых мечей было меньше. Наконец, в 1997 году вмешался ИЮПАК, и Рутерфордиум победил.
(Почему Резерфордий и Курчатовий? Эрнест Резерфорд был уроженцем Новой Зеландии, лауреатом Нобелевской премии, пионером атомных исследований. Игорь Васильевич Курчатов был советским физиком-ядерщиком, который руководил развитием советской ядерной программы, от атомных бомб до ядерных реакторов. .)
Игорь Васильевич Курчатов был советским физиком-ядерщиком, который руководил развитием советской ядерной программы, от атомных бомб до ядерных реакторов. .)
Что касается 114 и 116, то официальные названия еще не определены.
Это вызвало у Пола Кароля вопрос: можем ли мы оказаться на пороге эры продажи корпоративных прав на наименование новых элементов?
«Ненавижу говорить, что не могу этого представить, потому что я слишком много раз удивлялся, — говорит он, — и я также слышал выражение: «У каждого есть своя цена».
Итак: пепсий? Виагриум? Группониум? Или, может быть, периодическая таблица химических элементов Tostitos?
«Возможно, — говорит Кароль. этой истории
Эти исследователи хотят изменить таблицу Менделеева, и это выглядит странно
Организовать химические элементы в разумную систему — непростая задача.Сегодня мы принимаем периодическую таблицу (проклятие многих старшеклассников) как нечто само собой разумеющееся, но когда она была впервые изобретена, она была поистине революционной. Русский химик Дмитрий Менделеев не только нашел способ расположить элементы по их свойствам, но даже предсказал свойства еще не открытых элементов.
Русский химик Дмитрий Менделеев не только нашел способ расположить элементы по их свойствам, но даже предсказал свойства еще не открытых элементов.
Когда Менделеев впервые опубликовал свою таблицу в 1869 году, в ней было много пробелов — ведь доказательства существования атомов появились совсем недавно. Таким образом, в дополнение к структурированию зарождающейся науки химии, таблица также помогла предсказать появление новых элементов.
В недавней статье исследователи предлагают новый способ расположения химических элементов таким образом, который также облегчил бы открытие новых материалов в наше время.
Фрагмент из периодической таблицы Менделеева. Изображение предоставлено Международным научным советом. Исследователи любят упорядочивать и сортировать вещи. Но в химии эту моду найти было сложно. Например, благородные газы (гелий, неон, аргон, криптон, ксенон, радон) имеют разные массы, но все они благородные газы: бесцветные газы без запаха, которые не любят вступать в реакцию с «простолюдинами» таблицы Менделеева. .Поэтому Менделеев расположил благородные газы один под другим, чтобы обозначить это как вертикальное сходство.
.Поэтому Менделеев расположил благородные газы один под другим, чтобы обозначить это как вертикальное сходство.
Есть и горизонтальное сходство. По горизонтали элементы располагаются по количеству протонов в ядре. Между некоторыми группами вертикальное сходство сильнее, в то время как в других случаях группу описывают горизонтальные сходства. Вот почему, как правило, таблица Менделеева также окрашена, чтобы обозначить отличительные группы.
Все это может немного сбивать с толку, но если вы пытаетесь упорядочить все элементы в известной вселенной, все обязательно усложнится.
Новый атомный стол из России
Теперь, в новом исследовании, исследователи подумали: «Что, если мы сделаем еще один шаг вперед». Через сто пятьдесят лет после Менделеева исследователи Захед Аллахьяри и Артем Оганов из Сколковского института науки и технологий в Москве, опираясь на более раннюю работу, перестроили периодическую таблицу. Вместо количества протонов они используют два других свойства: атомный радиус и свойство, называемое электроотрицательностью, которое измеряет тенденцию атома притягивать другой атом и делить пару электронов.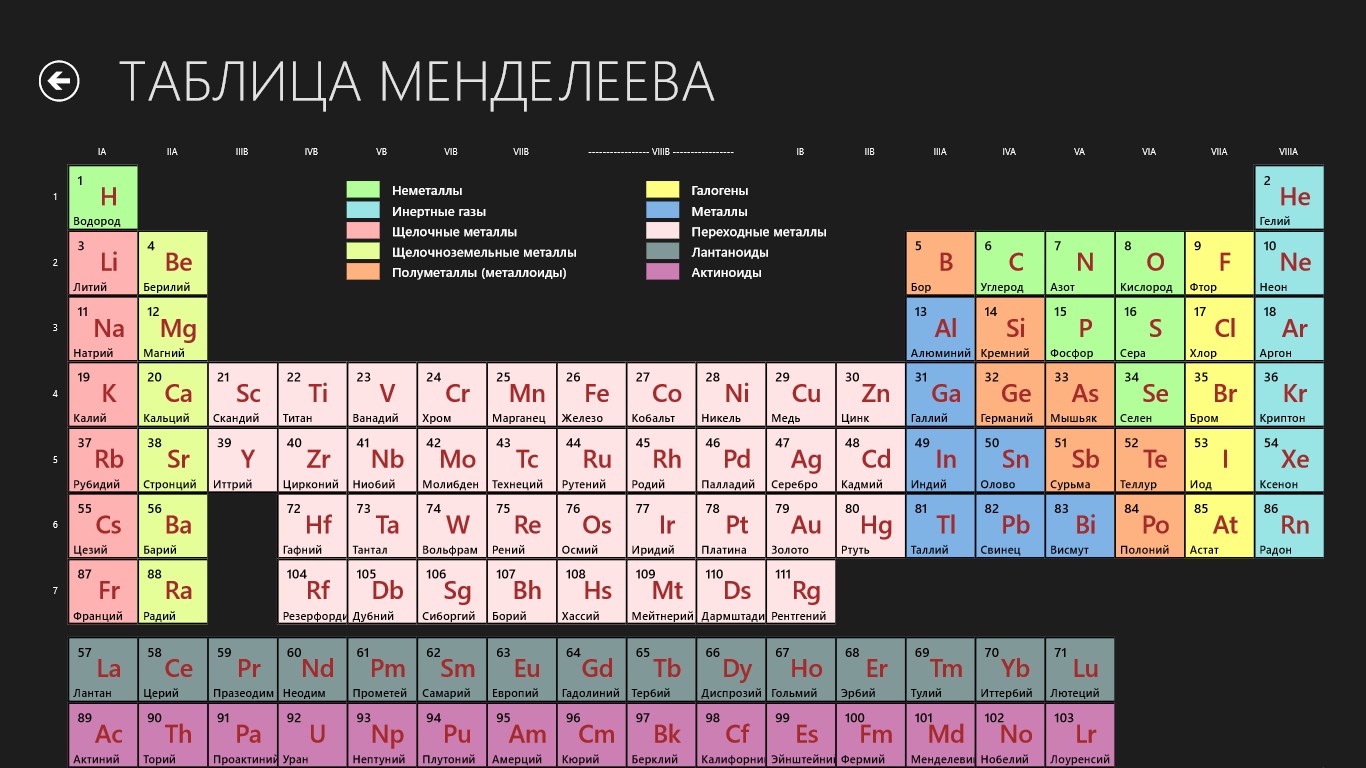
Если вы используете эти два свойства и объедините их в одно, вы получите то, что называется числом Менделеева (или MN). Если затем упорядочить элементы по их MN, неудивительно, что соседние химические элементы будут иметь аналогичный MN. Но если вы пойдете дальше и построите тот же список для двухэлементных соединений (соединений, состоящих из двух элементов), вы получите что-то вроде этого:
Изображение предоставлено: Аллахьяри и др., Журнал физической химии, 2020 г.Если вы понятия не имеете, что это значит — не волнуйтесь. Таблица предназначена не для любителей химии или студентов, а скорее для специализированных химиков и материаловедения. Подобно тому, как таблица Менделеева предсказывает свойства элементов, эта триповая таблица предсказывает свойства материалов. Здесь представлены такие свойства, как твердость или намагниченность, и это может быть полезно материаловедам для создания новых материалов.
Это может пригодиться, например, если вы ищете замену одному материалу (который может быть дорогим или дефицитным). Вы просто ищете что-то с похожими свойствами и смотрите, что может быть более доступным или более дешевым. Например, вы можете найти альтернативу редким элементам, используемым в батареях или электронике.
Вы просто ищете что-то с похожими свойствами и смотрите, что может быть более доступным или более дешевым. Например, вы можете найти альтернативу редким элементам, используемым в батареях или электронике.
Подобные идеи обсуждались и раньше. Например, одна из таких таблиц показывает изобилие различных элементов на Земле и вероятность их дефицита в ближайшем будущем.
Модифицированная периодическая таблица, показывающая относительное содержание элементов. Изображение предоставлено: Европейское химическое общество/Википедия/CC BY-SA.В конечном счете, это показывает, что таблицы полезны не только для запоминания и структурирования вещей. Подобно тому, как периодическая таблица проложила путь к будущим открытиям, новые таблицы, подобные этой, могут помочь исследователям понять и разработать материалы нового поколения.
.

 Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
 Таким образом, своими отдельными движениями и своими формами [15]
Таким образом, своими отдельными движениями и своими формами [15] Таким образом, атомный вес теллура должен лежать между 123 и 126 и не может быть равен 128.
Таким образом, атомный вес теллура должен лежать между 123 и 126 и не может быть равен 128.