Кто же создал Периодическую таблицу элементов? | Мир вокруг нас
Всем известно из истории ученого, что в феврале-марте 1869 года Дмитрий Менделеев разработал свою знаменитую таблицу, вернее некий отдалённый прототип всем известной Периодической системы элементов, где не просматривались четко окончания периодов на элемент с конкретным типом свойств.
Свою систему Менделеев корректировал и совершенствовал всю жизнь. Причём лишь в 1871 году он построил периодическую таблицу элементов, в которой ясно просматривались периоды без неизвестных тогда благородных газов. Периоды в той таблице оканчивались галогеном.
Во всём мире химии никто не оспаривает то, что ныне повсеместно принятая Периодическая система элементов, где все периоды оканчиваются благородным газом, является научной истиной в последней инстанции, где все элементы расположены абсолютно правильно и ничего невозможно сколько-нибудь существенно исправить или улучшить.
Инетерсный факт: приоритет Дмитрия Менделеева робко и безуспешно пытаются оспаривать французы (приоритетом Александра Эмиля Бегуйе де Шанкуртуа от 1862 года). Оспаривают англичане (приоритетом Уильяма Одлинга и Джона Александра Рейна Ньюлендс от 1864 года).
Оспаривают и немцы (приоритетом Юлиуса Лотара Мейера от 1864 года).
Более расширенная редакция ПСЭ опубликована Мейером в 1870 году.
Но никто в мире не смеет оспаривать того, что Менделеев открыл Периодический закон, гласящий, что по мере роста заряда ядра атома свойства элементов повторяются, — без приведения меры, опорного пункта, конкретных ориентиров граничных параметров периодов повторения свойств элементов.
То есть совершенно очевидно то, что формулировка «периодического закона» в редакции самого Менделеева и в современной редакции есть формула не строго научного периодического закона, а весьма размытого описания уже открытого, но ещё основательно не изученного научного периодического явления!
Из такого «периодического закона» невозможно извлечь ключевое, фундаментальное научное положение о том, элементом с каким конкретным типом свойств должен начинаться и (или) должен оканчиваться каждый период!
Как выяснилось теперь, надо честно признать то, что Дмитрий Иванович Менделеев не был тем первым человеком на Земле, который построил по-настоящему научную классификацию элементов.
Раньше Менделеева оказался всё-таки великий немецкий врач и известный химик
Только опираясь на Периодическую систему элементов Мейера, можно было открыть настоящие периодические законы, которые описывают строение и порядок формирования электронного облака атома по мере роста заряда ядра атома.
Таблица Мейера 1864 года
Фото: ru.wikipedia.org
При этом свыше пятнадцати настоящих периодических законов и фундаментальных научных положений были действительно открыты и записаны словесными формулами, а многие были воплощены также в простые математические формулы москвичом, простым российским врачом, ныне пенсионером Александром Константиновичем Макеевым.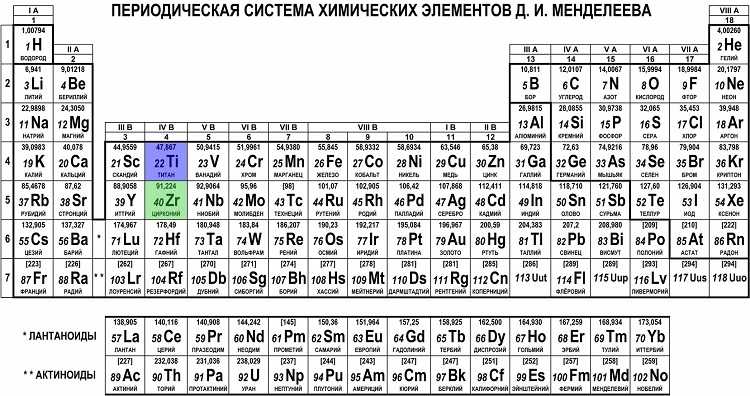
И именно при опоре на разработанную им независимо от Ю. Л. Мейера, К. Е. Цименса и В. М. Клечковского Периодическую систему элементов, где все периоды оканчиваются щёлочноземельным металлом!
В этой Периодической системе элементов Макеев поместил символы четырёх гипотетических элементов, предшествующих водороду. В качестве предэлементов Александр Макеев предположил квантовые вихри времени-пространства, квантовые вихри движения-изменения (в частности, фотоны) и квантовые вихри структуры ядер атомов и электронных облаков атомов.
Какая же форма периодической таблицы элементов более правильная?
Мейеровская, где все периоды оканчиваются на щёлочноземельный металл?
Или менделеевская, где все периоды оканчиваются на благородный газ, при этом первый период начинается с неметалла, химически активного газа водорода, а все остальные периоды начинаются с химически активного щелочного металла, хотя заявляется, что все периоды начинаются со щелочного металла?
Про Периодический закон везде пишут, что его первую редакцию сформулировал великий российский химик Дмитрий Менделеев.
Посему в подавляющем большинстве стран Периодическая система элементов называется просто: «Периодическая система элементов».
И никаких имен её автора или авторов!
Что еще почитать по теме?
Сколько «Периодических систем химических элементов» существует в природе?
Кого Менделеев назвал «укрепителем Периодического закона»?
Что раздвигает границы Периодической системы? Ядерная химия
Теги: интересный факт, история ученого, Дмитрий Менделеев, периодическая таблица элементов, химия, известный химик
Когда была открыта периодическая система Менделеева: дата и интересные факты
- 25 Января, 2020
- События
- Юлия Толок
Дмитрий Иванович Менделеев был поистине выдающимся химиком. Его вклад в изучение природы химических элементов значителен и до сих пор высоко оценивается учеными и историками во всем мире. Однако многие люди уверены, что периодическая система Менделеевым была открыта, когда она просто приснилась ему во сне.
Его вклад в изучение природы химических элементов значителен и до сих пор высоко оценивается учеными и историками во всем мире. Однако многие люди уверены, что периодическая система Менделеевым была открыта, когда она просто приснилась ему во сне.
На самом же деле она являлась результатом работы не только Дмитрия Ивановича, но и многих других выдающихся ученых-химиков, а история ее создания начинается еще с появления этой науки.
История открытия
Попытки систематизировать химические элементы начались задолго до открытия таблицы Менделеева. Многие естествоиспытатели столкнулись на пути с трудностями – часть элементов была не до конца открыта, а значение атомных масс некоторых из остальных было не точное, что объясняется ограниченностью данных теоретических и экспериментальных исследований в то время.
Триады Деберейнера
Первая попытка систематизировать элементы была сделана еще в 1829 году немецким химиком Деберейнером. Он объединил некоторые элементы с общими свойствами в группы по три, назвав их триадами. Смысл этого закона заключался в том, что в каждой триаде масса среднего элемента была приблизительно равна среднему арифметическому между массами крайних элементов.
Смысл этого закона заключался в том, что в каждой триаде масса среднего элемента была приблизительно равна среднему арифметическому между массами крайних элементов.
Такое представление было слишком далеко от совершенства, но уже являлось прообразом менделеевской системы. Проблема заключалась в ограничении групп всего тремя элементами, что подошло не для всех из них, даже известных на тот момент. Однако этот закон показал, что имеется какая-то связь между массами элементов и их химическими свойствами.
Спираль де Шанкуртуа
Александр де Шанкуртуа расположил все элементы в один ряд по атомным массам и нанес его на цилиндр по линии под углом 45 градусов, получив таким образом спираль.
При развертывании этого цилиндра оказывалось что на вертикальных линиях, параллельных оси, находились элементы со схожими свойствами. Однако на этой же линии оказывались и совсем отличающиеся химические элементы.
Октавы Ньюлендса
Очередную попытку систематизировать химические элементы по массам и свойствам, еще до того времени, когда была открыта периодическая система Менделеева, сделал ученый из Великобритании Ньюлендс. Он расположил их в порядке увеличения масс и заметил, что свойства повторяются через каждые семь. Такой закономерности он дал название закон октав, проведя аналогию с музыкальной гаммой.
Он расположил их в порядке увеличения масс и заметил, что свойства повторяются через каждые семь. Такой закономерности он дал название закон октав, проведя аналогию с музыкальной гаммой.
Однако эта зависимость распространялась только на элементы с небольшой атомной массой. В конечном итоге более тяжелые элементы пришлось расположить по несколько в одну ячейку, что было принято скептически.
Таблицы Одлинга и Мейера
В 1864 году увидела свет еще одна таблица, в которой элементы располагались согласно их атомным весам и сходству химических свойств. Однако никакого описания к ней не было. В это же время появилась и другая таблица Мейера. В нее было включено 28 элементов, расположенных согласно их валентности.
В 1870 году вышла еще одна таблица Мейера которая насчитывала 9 вертикальных столбцов. Элементы с похожими свойствами были расположены в горизонтальных рядах, а некоторые ячейки так и остались пустыми. Таблица сопровождалась графиком зависимости объема атома от его веса, который имел пилообразный вид и указывал на периодичность, правда, это произошло уже после того, как Менделеев открыл таблицу химических элементов.
Открытие Менделеевым периодической системы
История создания таблицы Менделеева начинается в 1869 году. Когда химик работал над учебником «Основы химии», он столкнулся со сложностью систематизации материала. В ходе обдумывания этой проблемы он постепенно пришел к выводу, что между атомной массой элементов и их свойствами есть некая закономерность.
Он не первым ее увидел, это был результат кропотливой работы химиков всего мира. Менделеев выписал все элементы на отдельные карточки и расположил их в порядке групп и рядов, что стало итогом многолетней работы.
17 февраля (1 марта) 1869 года рукопись статьи, которая содержала эту таблицу, была сдана в печать. Считается, что это и есть та дата, которая отвечает на вопрос, в каком году Менделеев открыл таблицу. Через несколько дней, 22 марта, профессором Меншуткиным на заседании общества было объявлено о том, что Менделееву удалось открыть общий закон для описания химических элементов. Первый вариант периодической системы имел 19 горизонтальных рядов и 6 вертикальных столбцов.
Этот период, когда была открыта периодическая система Менделеева, только положил начало разработке. В 1870 году был опубликован второй вариант системы – горизонтальные ряды превратились в восемь расположенных групп, а вертикальные столбцы в периоды.
Открытие Менделеева показало, что рост атомной массы химических элементов приводит к изменению их свойств периодически, то есть повторению через определенное количество элементов. Если ответом на вопрос, в каком году открыта таблица Менделеева, является 1869 год, то сформулировал периодический закон ученый только в 1871-м.
Таким образом, периодическая система, разработанная Менделеевым, позволила не только провести параллели между атомными массами и свойствами известных элементов, но и предсказать свойства тех, которые еще не были открыты.
В дальнейшем, с открытием все новых элементов, система получала все большую популярность и универсальность, но признание она нашла не сразу. Научное сообщество приняло ее в качестве базового закона химии только в 1880 году.
Интересные факты
В те времена не только заниматься химией было не популярно, но и большинство людей считали это занятие сродни колдовству или вовсе преступлением. Поэтому в свое время деятельность Менделеева обросла большим количеством легенд. Одна из них, которая считается наиболее популярной, гласит о том, что периодическая система Менделеевым была открыта, когда ученому она просто приснилась.
Такие случаи в истории не были едиными, такие же слухи ходили относительно многих научных открытий. Но эта гипотеза была опровергнута самим Менделеевым, который указывал на то, что он работал над созданием таблицы несколько десятков лет.
Еще одна не менее популярная история гласит о том, что Менделеев был изобретателем водки. Связано это было с его диссертационной работой, в которой он рассуждал на тему смеси воды и спирта. Современники часто подшучивали над ним на эту тему, а уже следующие поколения были точно уверены – именно Менделеев и является первооткрывателем этого напитка.
Ходили слухи и о том, что Менделеев оборудовал свою лабораторию в дупле дуба. Нередко звучали шутки и относительно любительского хобби ученого – плетения чемоданов. Часто даже звучало прозвище Чемоданных дел мастер.
Переоценить вклад этого великого ученого в историю развития химической науки невозможно. Ему обязаны не только выведением общего закона для всех элементов, существующих в природе, но и дальнейшими исследованиями. Опираясь на данные Менделеева, ученые проводили все больше экспериментов, пытаясь не только найти но и синтезировать недостающие элементы для изучения их свойств.
Похожие статьи
События
Как Цезарь пришел к власти: события и исторические факты
События
Когда ввели погоны в Великой Отечественной войне, в каком году?
События
Любечский съезд князей: причины и последствия
События
Взятие Казани Иваном Грозным: дата и исторические факты
События
Русские стрельцы: век появления
События
Какое событие произошло 27 января 1904 года?
Таблица Менделеева – предсказание без магии – Мир Знаний
Во время контрольной или экзаменов списывать и пользоваться шпаргалками нельзя — это знает каждый школьник. И тем не менее, шпаргалка по химии висит на стене каждого химического кабинета и называется она Периодическая система, или таблица Менделеева. Конечно же, эту таблицу создавали не для того, чтобы она служила подсказкой на экзамене, но в ней на видном месте действительно сконцентрировано большинство знаний о химии. Давай посмотрим, как появилась и развивалась визитная карточка химии, полуторавековой юбилей которой человечество отмечало в том году.
И тем не менее, шпаргалка по химии висит на стене каждого химического кабинета и называется она Периодическая система, или таблица Менделеева. Конечно же, эту таблицу создавали не для того, чтобы она служила подсказкой на экзамене, но в ней на видном месте действительно сконцентрировано большинство знаний о химии. Давай посмотрим, как появилась и развивалась визитная карточка химии, полуторавековой юбилей которой человечество отмечало в том году.
У ИСТОКОВ СОВРЕМЕННОЙ ХИМИИ
В древности и в Средние века люди знали лишь несколько химических элементов, поэтому без особого труда придумали, как систематизировать их. Так, алхимики, усмотрев мистическую связь между семью известными в то время металлами и семью самыми яркими объектами на небе, свели систематизацию к стишку: «Семь металлов создал Свет по числу семи планет», и на этом успокоились, долго считая, что больше семи металлов в мире существовать не может. Зачастую это приводило к нелепым ситуациям: испанские конкистадоры, найдя в золотоносных копях Южной Америки платину, посчитали, В 1789 году французский химик Антуан Лавуазье ввел в науку понятие «элемент», определив его как вещество, которое нельзя разложить на более простые составляющие. Были найдены основные элементы, входящие в состав воздуха — азот и кислород. Химия стала очень быстро развиваться, и к середине XIX века ученые знали о существовании уже шестидесяти химических элементов.
Были найдены основные элементы, входящие в состав воздуха — азот и кислород. Химия стала очень быстро развиваться, и к середине XIX века ученые знали о существовании уже шестидесяти химических элементов.
ЧТОБЫ СТАТЬ НАУКОЙ
С начала XIX века химики пытались найти закономерности в свойствах химических элементов и образованных ими веществах. Зачем это делалось?
Не секрет, что наука становится наукой только тогда, когда в ней появляется набор закономерностей, и конечно же, химикам хотелось, чтобы в их любимой науке тоже нашлась какая-то основополагающая закономерность. Так, немецкий химик Иоганн Дёберейнер сгруппировал элементы, близкие по свойствам, в триады-тройки, но его система не работала, если появлялся четвертый химический элемент с близкими свойствами. Французский геолог Александр Шанкуртуа построил свою систему, расположив элементы по порядку от более легких к тяжелым, и увидел, что элементы, массы которых отличаются на 16 атомных единиц массы, близки по физическим свойствам и реакциям, в которые они вступают. Однако из-за сложности построения (элементы Шанкуртуа расположил по спирали) и того, что этот ученый был не химиком, а геологом, его работы не были замечены современниками.
Однако из-за сложности построения (элементы Шанкуртуа расположил по спирали) и того, что этот ученый был не химиком, а геологом, его работы не были замечены современниками.
Наконец, к 1869 году появилось два очень близких подхода к систематизации химических элементов — таблица Дмитрия Ивановича Менделеева и таблица немецкого химика Лотара Юлиуса Мейера. В обеих таблицах элементы располагались в соответствии с увеличением атомного веса, при этом близкие по свойствам элементы стояли в одних и тех же вертикальных рядах (сейчас мы называем их группами), и оставались пустые ячейки для элементов, которые еще не были известны ученым. Какое-то время вклад Менделеева и Мейера в систематизацию элементов считали равным: в 1882 году Лондонское королевское общество присудило сразу две золотые медали «За открытие периодических соотношений атомных весов» — и Менделееву, и Мейеру. Почему же сейчас химики всего мира связывают периодический закон только с Менделеевым?
ПРЕДСКАЗАНИЕ БЕЗ МАГИИ
Дело в том, что Менделеев, в отличие от Мейера, не просто оставил пустые клетки в таблице, чтобы поместить в них новые элементы тогда, когда их найдут, а выявив закономерности между свойствами уже открытых элементов, предсказал свойства элементов ещё неизвестных: оценил их атомные веса, температуры плавления, сделал прогнозы относительно внешнего вида и химических реакций, в которые они должны вступать. Поначалу к предсказаниям Менделеева отнеслись скептически — многие даже советовали ему «заняться настоящим делом». В те времена считалось, что ученый должен изучать и описывать то, существование чего строго доказано, а предсказания и прогнозы — удел фокусников и гадалок.
Поначалу к предсказаниям Менделеева отнеслись скептически — многие даже советовали ему «заняться настоящим делом». В те времена считалось, что ученый должен изучать и описывать то, существование чего строго доказано, а предсказания и прогнозы — удел фокусников и гадалок.
Однако оказалось, что Менделеев прав: свойства галлия, скандия и германия — металлов, открытых после создания таблицы, были именно такими, как предсказывал Дмитрий Иванович. Именно это и изменило отношение к открытию Менделеева. Стало ясно, что периодический закон — не просто способ систематизировать уже известные элементы, а мощный инструмент, позволяющий обобщить не только информацию о элементах известных, но и о тех, которые еще скрыты от взора ученых. После того как открытие предсказанных Менделеевым элементов доказало верность его рассуждений, изменилась и сама наука: химики, физики, астрономы, биологи стали использовать законы науки для прогнозов свойств и поведения объектов своих исследований, не боясь, что их упрекнут в том, что они занимаются «не тем».
Менделеев добавлял в таблицу новые, не известные ранее элементы. Самой сложной проверкой на прочность периодического закона стало открытие целой семьи элементов — инертных, или, как их еще называют, благородных газов. Уильям Рамзай, первым обнаруживший аргон и гелий на Земле (кстати, поначалу не все ученые считали эти газы новыми элементами), с помощью периодического закона предсказал температуры кипения остальных членов этой «химической семьи» и в течение года открыл недостающие неон, криптон и ксенон. После этого открытия Дмитрий Иванович провел последнюю прижизненную редакцию своей таблицы, добавив в нее дополнительную группу со свежеоткрытыми элементами.
ОТ ТАБЛИЦЫ К СИСТЕМЕ
Почему же сейчас чаще говорят «Периодическая система», а не «таблица Менделеева»? Это произошло из-за того, что после смерти Менделеева в 1907 году его детище продолжило меняться, но уже силами других ученых. Начнем с того, что, открыв периодический закон, Дмитрий Иванович, справедливо полагал, что должны быть какие-то причины, объясняющие, почему этот закон работает. Увы, понять это ученые смогли только в 1920 году, после смерти Менделеева, когда выяснились принципы строения атомов и было установлено, что свойства химического элемента определяются числом электронов, расположенных в оболочках атома. Современное отображение периодического закона — Периодическая система — значительно отличается от менделеевской таблицы не только количеством химических элементов (сейчас их 118), но и своей структурой, которая делает её еще более понятной и удобной в использовании. Правда ООН Международный союз теоретической и прикладной химии планирует увековечить память создателя периодического закона в названии «Периодическая система химических элементов имени Дмитрия Менделеева». Но как бы ни называлась таблица, она и дальше будет помогать школьникам и студентам изучать химию, а ученым — делать новые открытия.
Увы, понять это ученые смогли только в 1920 году, после смерти Менделеева, когда выяснились принципы строения атомов и было установлено, что свойства химического элемента определяются числом электронов, расположенных в оболочках атома. Современное отображение периодического закона — Периодическая система — значительно отличается от менделеевской таблицы не только количеством химических элементов (сейчас их 118), но и своей структурой, которая делает её еще более понятной и удобной в использовании. Правда ООН Международный союз теоретической и прикладной химии планирует увековечить память создателя периодического закона в названии «Периодическая система химических элементов имени Дмитрия Менделеева». Но как бы ни называлась таблица, она и дальше будет помогать школьникам и студентам изучать химию, а ученым — делать новые открытия.
Почему авторство в открытии периодического закона химических элементов принадлежит именно Д. И. Менделееву, хотя свои варианты таблицы элементов предлагали (одновременно с ним и даже ранее него) другие ученые?
Почему авторство в открытии периодического закона химических элементов принадлежит именно Д.
Открытие Д. И. Менделеевым периодического закона химических элементов датируется 17 февраля 1869 года, когда он составил таблицу, озаглавленную «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». Это был результат долголетних поисков. Однажды на вопрос, как он открыл периодическую систему, Менделеев ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». У Менделеева были предшественники. В 1862 году итальянский химик С. Канниццаро выступил с докладом о роли атомных весов элементов как важнейшем химическом инструменте. В том же 1862 году французский геолог А. де Шантуркуа установил, что элементы можно разместить в порядке возрастания атомных весов в специальной таблице, причем в вертикальные столбцы попадают элементы со сходными свойствами. Независимо от Шантуркуа к тому же выводу пришел и английский химик Д.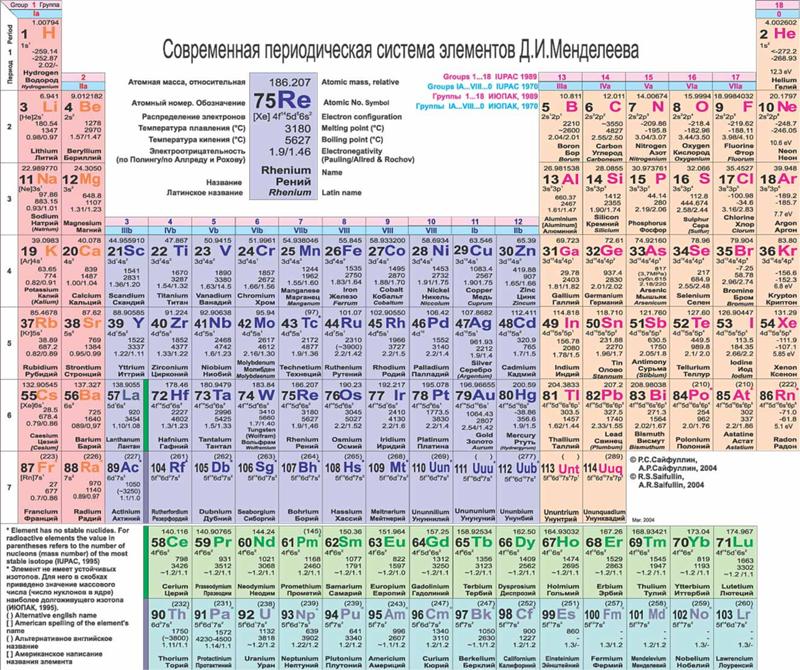 Ньюлендс. Практически одновременно с Менделеевым предложил свой вариант таблицы элементов немецкий ученый Л. Мейер. Признание получила именно таблица Менделеева, который не только проявил смелость и умение при доказательстве своих взглядов, но и развил их дальше своих коллег. Во-первых, периодическая таблица Менделеева (названная так за периодическое чередование элементов со сходными химическими свойствами) имела более полный вид, чем аналогичные таблицы его вышеупомянутых коллег, и более сходную форму с той, которая повсеместно принята в наше время. Во-вторых, когда свойства того или иного элемента заставляли Менделеева помещать элемент вне принятой последовательности атомных весов, он смело шел на изменение формального порядка, исходя из определяющей роли химических свойств, а не атомного веса. И всякий раз он оказывался абсолютно прав. И в-третьих, самое важное: там, где в таблице не хватало элементов для заполнения ячеек, Менделеев оставил свободные места, дерзко предвосхитив будущие открытия новых элементов.
Ньюлендс. Практически одновременно с Менделеевым предложил свой вариант таблицы элементов немецкий ученый Л. Мейер. Признание получила именно таблица Менделеева, который не только проявил смелость и умение при доказательстве своих взглядов, но и развил их дальше своих коллег. Во-первых, периодическая таблица Менделеева (названная так за периодическое чередование элементов со сходными химическими свойствами) имела более полный вид, чем аналогичные таблицы его вышеупомянутых коллег, и более сходную форму с той, которая повсеместно принята в наше время. Во-вторых, когда свойства того или иного элемента заставляли Менделеева помещать элемент вне принятой последовательности атомных весов, он смело шел на изменение формального порядка, исходя из определяющей роли химических свойств, а не атомного веса. И всякий раз он оказывался абсолютно прав. И в-третьих, самое важное: там, где в таблице не хватало элементов для заполнения ячеек, Менделеев оставил свободные места, дерзко предвосхитив будущие открытия новых элементов. Основываясь на свойствах соседей по периодической таблице, он даже довольно точно описал три элемента, которым еще только предстояло занять свободные ячейки. Здесь ему сопутствовала явная удача: все три элемента (галлий, скандий и германий) были открыты еще при жизни Менделеева, и он дожил до триумфа своей периодической системы. Периодический закон получил всеобщее признание как один из основных законов химии. Так сбылось предвидение Менделеева: «Периодическому закону – будущее не грозит разрушением, а только надстройки и развитие обещает».
Основываясь на свойствах соседей по периодической таблице, он даже довольно точно описал три элемента, которым еще только предстояло занять свободные ячейки. Здесь ему сопутствовала явная удача: все три элемента (галлий, скандий и германий) были открыты еще при жизни Менделеева, и он дожил до триумфа своей периодической системы. Периодический закон получил всеобщее признание как один из основных законов химии. Так сбылось предвидение Менделеева: «Периодическому закону – будущее не грозит разрушением, а только надстройки и развитие обещает».
Данный текст является ознакомительным фрагментом.
Кто был единственным жителем Земли, почтовый адрес которого можно было составить из названий химических элементов?
Кто был единственным жителем Земли, почтовый адрес которого можно было составить из названий химических элементов? Международный союз фундаментальной и прикладной химии узаконил в сентябре 1997 года названия шести искусственных сверхтяжелых элементов: резерфордий,
№ 17: Количество элементов
№ 17: Количество элементов
Количество примеров, использованных в отдельном предложении или статье, несет определенный смысл. Совестливый автор не имеет другого выхода, кроме как тщательно отбирать количество примеров или элементов в предложении или абзаце. Автор
Совестливый автор не имеет другого выхода, кроме как тщательно отбирать количество примеров или элементов в предложении или абзаце. Автор
6.6. Обслуживание элементов КРУ
6.6. Обслуживание элементов КРУ Обслуживание элементов КРУ 6-10 кВ. КРУ и КРУН поставляются в готовом виде шкафами со встроенными в них электрическим оборудованием, устройствами РЗиА, измерения, сигнализации и управления.Шкаф КРУ — часть КРУ, являющаяся законченным
Распространенность химических элементов в земной коре (% массы)
Распространенность химических элементов в земной коре (%
6. Десять элементов романа
6. Десять элементов романа
Лекция, прочитанная автором в Школе стилистики и мастерства прозаика по работам Т.Т. Давыдовой, В. А. Пронина “Теория литературы”, О.И. Федотова “Теория литературы”, Н.В. Басова “Творческое саморазвитие, или Как написать роман”.
Конфликт —
А. Пронина “Теория литературы”, О.И. Федотова “Теория литературы”, Н.В. Басова “Творческое саморазвитие, или Как написать роман”.
Конфликт —
Почему авторство в открытии периодического закона химических элементов принадлежит именно Д. И. Менделееву, хотя свои варианты таблицы элементов предлагали (одновременно с ним и даже ранее него) другие ученые?
Почему авторство в открытии периодического закона химических элементов принадлежит именно Д. И. Менделееву, хотя свои варианты таблицы элементов предлагали (одновременно с ним и даже ранее него) другие ученые? Открытие Д. И. Менделеевым периодического закона химических
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Открытие, сделанное Русским химиком Менделеевым, сыграло (безусловно) наиболее важную роль в развитии науки, а именно в развитии атомно-молекулярного учения. Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Разработанная в ХIХ веке, периодическая таблица Менделеева в интересах науки химии, дала готовую систематизацию типов атомов, для развития ФИЗИКИ в ХХ веке (физика атома и ядра атома). В начале ХХ века, ученые физики, путем исследований установили, что порядковый номер, (он же атомный), есть и мера электрического заряда атомного ядра этого элемента. А номер периода (т.е. горизонтального ряда), определяет число электронных оболочек атома. Так же выяснилось, что номер вертикального ряда таблицы определяет квантовую структуру внешней оболочки элемента, (этим самым, элементы одного ряда, обязаны сходством химических свойств).
Открытие Русского ученого, ознаменовало собой, новую эру в истории мировой науки, это открытие позволило не только совершить огромный скачек в химии, но так же было бесценно для ряда других направлений науки. Таблица Менделеева дала стройную систему сведений об элементах, на основе её, появилась возможность делать научные выводы, и даже предвидеть некоторые открытия.
Таблица МенделееваОдна из особенностей периодической таблицы Менделеева, состоит в том, что группа (колонка в таблице), имеет более существенные выражения периодической тенденции, чем для периодов или блоков. В наше время, теория квантовой механики и атомной структуры объясняет групповую сущность элементов тем, что они имеют одинаковые электронные конфигурации валентных оболочек, и как следствие, элементы которые находятся в пределах одой колонки, располагают очень схожими, (одинаковыми), особенностями электронной конфигурации, со схожими химическими особенностями. Так же наблюдается явная тенденция стабильного изменения свойств по мере возрастания атомной массы. Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Таблица Менделеева содержит группы, которым присваиваются порядковые номера от 1 до 18 (с лева, на право), согласно международной системе именования групп. В былое время, для идентификации групп, использовались римские цифры. В Америке существовала практика ставить после римской цифры, литер «А» при расположении группы в блоках S и P, или литер «В» – для групп находящихся в блоке D. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время (на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA – это 14 группа элементов). В Европейских странах того времени, использовалась похожая система, но тут, литера «А» относилась к группам до 10, а литера «В» – после 10 включительно. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в 1988 году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас.
Многие группы получили несистематические названия травиального характера, (к примеру – «щелочноземельные металлы», или «галогены», и другие подобные названия). Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы (титановая, кобальтовая и тому подобно).
Химические элементы относящиеся к одной группе таблицы Менделеева проявляют определенные тенденции по электроотрицательности, атомному радиусу и энергии ионизации. В одной группе, по направлению сверху вниз, радиус атома возрастает, по мере заполнения энергетических уровней, удаляются, от ядра, валентные электроны элемента, при этом снижается энергия ионизации и ослабевают связи в атоме, что упрощает изъятие электронов. Снижается, так же, электроотрицательность, это следствие того, что возрастает расстояние между ядром и валентными электронами. Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
В таблице Менделеева есть строка, которая называется «Период».
Среди групп, есть и такие у которых более значимыми являются горизонтальные направления (в отличии от других, у которых большее значение имеют вертикальные направления), к таким группам относится блок F, в котором лантаноиды и актиноиды формируют две важные горизонтальные последовательности.
Элементы показывают определенные закономерности в отношении атомного радиуса, электроотрицательности, энергии ионизации, и в энергии сродства к электрону. Из-за того, что у каждого следующего элемента количество заряженных частиц возрастает, а электроны притягиваются к ядру, атомный радиус уменьшается в направлении слева направо, вместе с этим увеличивается энергия ионизации, при возрастании связи в атоме – возрастает сложность изъятия электрона. Металлам, расположенным в левой части таблицы, характерен меньший показатель энергии сродства к электрону, и соответственно, в правой части показатель энергии сродства к электрону, у не металлов, этот показатель больше, (не считая благородных газов).
Разные области периодической таблицы Менделеева, в зависимости от того на какой оболочке атома, находится последний электрон, и в виду значимости электронной оболочки, принято описывать как блоки.
В S-блок, входит две первые группы элементов, (щелочные и щелочноземельные металлы, водород и гелий).
В P-блок, входят шест последних групп, с 13 по 18 (согласно ИЮПАК, или по системе принятой в Америке – с IIIA до VIIIA), этот блок так же включает в себя все металлоиды.
Блок – D, группы с 3 по 12 (ИЮПАК, или с IIIB до IIB по-американски), в этот блок включены все переходные металлы.
Блок – F, обычно выносится за пределы периодической таблицы, и включает в себя лантаноиды и актиноиды.
Бесс Руфф – аспирантка из Флориды, работает над получением степени PhD по географии. Получила степень магистра экологии и менеджмента в Бренской школе экологии и менеджмента Калифорнийского университета в Санта-Барбаре в 2016 году.
Количество источников, использованных в этой статье: . Вы найдете их список внизу страницы.
Вы найдете их список внизу страницы.
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. И наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
Шаги
Часть 1
Структура таблицы
Как видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент. Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение.
 Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
Узнайте, почему в таблице присутствуют пустые ячейки. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.

- Элементы с атомными номерами с 57 по 102 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода – 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами.
 Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними.
Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними. Часть 2
Обозначения элементовКаждый элемент обозначается одной или двумя латинскими буквами. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
Обратите внимание на полное название элемента, если оно приведено в таблице.
 Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.
Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента. Элементы имеют атомные номера от 1 до 118.
- Атомный номер всегда является целым числом.
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!
- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.

- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.
Обычно количество электронов равно числу протонов. Исключением является тот случай, когда атом ионизирован. Протоны имеют положительный, а электроны – отрицательный заряд. Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.
- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс». Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
- Знаки «плюс» и «минус» не ставятся, если атом не является ионом.
Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу).
Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
Химия – увлекательный, но сложный предмет. А если в школе еще и не было принадлежностей для проведения экспериментов, то можно сказать, что она и вовсе прошла мимо. Но есть то, в чём должен хотя бы минимально ориентироваться каждый человек. Это таблица Менделеева.
Это таблица Менделеева.
Для школьников выучить ее – настоящая пытка. Если они видят ее в снах, то только кошмарных. Так много элементов, у каждого свой номер… Но одна многодетная мать придумала занимательный способ, как выучить таблицу Менделеева . Он подойдет как для детей, так и для взрослых, и о нём тебе с радостью расскажет реакция «Так Просто!» .
Периодическая таблица химических элементов
Как показывает опыт матери четверых детей Карин Трипп, при правильном подходе возможно выучить всё. Чтобы приобщить к изучению химии даже маленьких детей, она решила превратить периодическую таблицу элементов в поле для морского боя.
Игра содержит четыре страницы с таблицей Менделеева – по две для каждого игрока. Каждому игроку на одной таблице необходимо нарисовать свои корабли, а на другой – обозначать точками свои выстрелы и подбитые корабли соперника.
Правила морского боя такие же, как в классической игре. Только для того, чтобы подстрелить кораблик соперника, нужно назвать не букву c цифрой, а соответствующий химический элемент.
Такая методика позволит детям не только усвоить названия химических элементов. Она способствует развитию памяти и логического мышления. Ведь дети будут анализировать порядковые номера и цвета.
Для того чтобы детям на первых порах было проще найти нужный элемент, ряды и столбцы следует пронумеровать цифрами. Но, по словам Карин, ее дети уже через несколько дней игры в «химический морской бой» стали прекрасно ориентироваться в таблице Менделеева. Они знали даже атомные массы и порядковые номера элементов.
Со временем правила игры можно усложнить. Например, размещать корабль только в пределах одного семейства химических элементов.
В эту игру с удовольствием играет даже восьмилетняя дочь изобретательной матери, которая еще не изучала химию в школе. Да и для взрослых это отличный способ занимательно провести время.
Все страницы таблицы Менделеева для игры в морской бой можно распечатать на обычном или цветном принтере и использовать неограниченное количество раз.
Таблицу менделеева кто придумал
Главная » Raznoe » Таблицу менделеева кто придумал
Кто же создал Периодическую таблицу элементов?
Всем известно из истории ученого, что в феврале-марте 1869 года Дмитрий Менделеев разработал свою знаменитую таблицу, вернее некий отдалённый прототип всем известной Периодической системы элементов, где не просматривались четко окончания периодов на элемент с конкретным типом свойств.
Свою систему Менделеев корректировал и совершенствовал всю жизнь. Причём лишь в 1871 году он построил периодическую таблицу элементов, в которой ясно просматривались периоды без неизвестных тогда благородных газов. Периоды в той таблице оканчивались галогеном.
Во всём мире химии никто не оспаривает то, что ныне повсеместно принятая Периодическая система элементов, где все периоды оканчиваются благородным газом, является научной истиной в последней инстанции, где все элементы расположены абсолютно правильно и ничего невозможно сколько-нибудь существенно исправить или улучшить.
Инетерсный факт: приоритет Дмитрия Менделеева робко и безуспешно пытаются оспаривать французы (приоритетом Александра Эмиля Бегуйе де Шанкуртуа от 1862 года). Оспаривают англичане (приоритетом Уильяма Одлинга и Джона Александра Рейна Ньюлендс от 1864 года). Прототип Периодической системы элементов Менделеева без строгого разделения на периоды, рукописная вертикальная форма, 1869 годФото: Источник
Оспаривают и немцы (приоритетом Юлиуса Лотара Мейера от 1864 года).
Более расширенная редакция ПСЭ опубликована Мейером в 1870 году.
Но никто в мире не смеет оспаривать того, что Менделеев открыл Периодический закон, гласящий, что по мере роста заряда ядра атома свойства элементов повторяются, — без приведения меры, опорного пункта, конкретных ориентиров граничных параметров периодов повторения свойств элементов.
То есть совершенно очевидно то, что формулировка «периодического закона» в редакции самого Менделеева и в современной редакции есть формула не строго научного периодического закона, а весьма размытого описания уже открытого, но ещё основательно не изученного научного периодического явления!
Из такого «периодического закона» невозможно извлечь ключевое, фундаментальное научное положение о том, элементом с каким конкретным типом свойств должен начинаться и (или) должен оканчиваться каждый период!
Как выяснилось теперь, надо честно признать то, что Дмитрий Иванович Менделеев не был тем первым человеком на Земле, который построил по-настоящему научную классификацию элементов.
Раньше Менделеева оказался всё-таки великий немецкий врач и известный химик Юлиус Лотар Мейер. Именно он в 1864 году опубликовал в научной печати фрагмент таблицы, где периоды оканчиваются щёлочноземельным металлом.
Только опираясь на Периодическую систему элементов Мейера, можно было открыть настоящие периодические законы, которые описывают строение и порядок формирования электронного облака атома по мере роста заряда ядра атома. Таблица Мейера 1864 годаФото: ru.wikipedia.org
При этом свыше пятнадцати настоящих периодических законов и фундаментальных научных положений были действительно открыты и записаны словесными формулами, а многие были воплощены также в простые математические формулы москвичом, простым российским врачом, ныне пенсионером Александром Константиновичем Макеевым.
И именно при опоре на разработанную им независимо от Ю. Л. Мейера, К. Е. Цименса и В. М. Клечковского Периодическую систему элементов, где все периоды оканчиваются щёлочноземельным металлом! Таблица Мейера 1870 годаФото: Источник
В этой Периодической системе элементов Макеев поместил символы четырёх гипотетических элементов, предшествующих водороду. В качестве предэлементов Александр Макеев предположил квантовые вихри времени-пространства, квантовые вихри движения-изменения (в частности, фотоны) и квантовые вихри структуры ядер атомов и электронных облаков атомов.
В качестве предэлементов Александр Макеев предположил квантовые вихри времени-пространства, квантовые вихри движения-изменения (в частности, фотоны) и квантовые вихри структуры ядер атомов и электронных облаков атомов.
Какая же форма периодической таблицы элементов более правильная?
Мейеровская, где все периоды оканчиваются на щёлочноземельный металл? Таблица Макеева 2012 годаФото: Источник
Или менделеевская, где все периоды оканчиваются на благородный газ, при этом первый период начинается с неметалла, химически активного газа водорода, а все остальные периоды начинаются с химически активного щелочного металла, хотя заявляется, что все периоды начинаются со щелочного металла?
Про Периодический закон везде пишут, что его первую редакцию сформулировал великий российский химик Дмитрий Менделеев. Хотя формулировка периодического, якобы, закона на самом деле есть формулировка периодического явления, которое не даёт однозначных сведений о том, как следует определять свойства элемента в периодах ПСЭ: от начала к окончанию либо от окончания к началу периода, или равно и от начала к окончанию, и от окончания к началу периода.
Посему в подавляющем большинстве стран Периодическая система элементов называется просто: «Периодическая система элементов».
И никаких имен её автора или авторов!
Что еще почитать по теме?
Сколько «Периодических систем химических элементов» существует в природе?Кого Менделеев назвал «укрепителем Периодического закона»?Что раздвигает границы Периодической системы? Ядерная химия
shkolazhizni.ru
История открытия таблицы Менделеева
Открытие Дмитрием Менделеевым периодической таблицы химических элементов в марте 1869 года стало настоящим прорывом в химии. Российскому ученому удалось систематизировать знания о химических элементах и представить их в виде таблицы, которую и сейчас обязательно изучают школьники на уроках химии. Периодическая таблица стала фундаментом для бурного развития этой сложной и интересной науки, а история ее открытия окутана легендами и мифами. Для всех увлекающихся наукой будет интересно узнать правду о том, как Менделеев открыл таблицу периодических элементов.
История таблицы Менделеева: как все начиналось
Попытки классифицировать и систематизировать известные химические элементы предпринимались задолго до Дмитрия Менделеева. Свои системы элементов предлагали такие известные ученые, как Деберейнер, Ньюлендс, Мейер и другие. Однако из-за нехватки данных о химических элементах и их правильных атомных массах предложенные системы были не совсем достоверными.
История открытия таблицы Менделеева начинается в 1869 году, когда российский ученый на заседании Русского химического общества рассказал своим коллегам о сделанном им открытии. В предложенной ученым таблице химические элементы располагались в зависимости от их свойств, обеспечивающихся величиной их молекулярной массы.
Интересной особенностью таблицы Менделеева было также наличие пустых клеток, которые в будущем были заполнены открытыми химическими элементами, предсказанными ученым (германий, галлий, скандий). После открытия периодической таблицы в нее много раз вносились добавления и поправки. Совместно с шотландским химиком Уильямом Рамзаем Менделеев добавил в таблицу группу инертных газов (нулевую группу).
Совместно с шотландским химиком Уильямом Рамзаем Менделеев добавил в таблицу группу инертных газов (нулевую группу).
В дальнейшем история периодической таблицы Менделеева была напрямую связана с открытиями в другой науке – физике. Работа над таблицей периодических элементов продолжается до сих пор, и современные ученые добавляют новые химические элементы по мере их открытия. Значение периодической системы Дмитрия Менделеева сложно переоценить, так как благодаря ей:
- Систематизировались знания о свойствах уже открытых химических элементов;
- Появилась возможность прогнозирования открытия новых химических элементов;
- Начали развиваться такие разделы физики, как физика атома и физика ядра;
Существует множество вариантов изображения химических элементов согласно периодическому закону, однако наиболее известный и распространенный вариант – это привычная для каждого таблица Менделеева.
Мифы и факты о создании периодической таблицы
Самым распространенным заблуждением в истории открытия таблицы Менделеева является то, что ученый увидел ее во сне. На самом деле сам Дмитрий Менделеев опроверг этот миф и заявил, что размышлял над периодическим законом на протяжении многих лет. Чтобы систематизировать химические элементы он выписывал каждый из них на отдельную карточку и многократно комбинировал их между собой, расставляя в ряды в зависимости от их схожих свойств.
На самом деле сам Дмитрий Менделеев опроверг этот миф и заявил, что размышлял над периодическим законом на протяжении многих лет. Чтобы систематизировать химические элементы он выписывал каждый из них на отдельную карточку и многократно комбинировал их между собой, расставляя в ряды в зависимости от их схожих свойств.
Миф о «вещем» сне ученого можно объяснить тем, что Менделеев работал над систематизацией химических элементов сутками напролет, прерываясь на непродолжительный сон. Однако только упорный труд и природный талант ученого дал долгожданный результат и обеспечил Дмитрию Менделееву всемирную известность.
Многих учащихся в школе, а иногда и в университете, заставляютзаучивать или хотя бы примерно ориентироваться в таблице Менделеева. Для этого человек должен не только иметь хорошую память, но и логически мыслить, связывая элементы в отдельные группы и классы. Изучение таблицы легче всего дается тем людям, которые постоянно поддерживают мозг в тонусе, проходя тренинги на BrainApps.
brainapps.ru
Почему на Западе считают, что периодическую таблицу придумал не Менделеев
Французы больше склоняются к своему земляку Александру Эмилю Бегуйе де Шанкуртуа. Свою систематизацию химических элементов этот ученый вывел еще в 1862 году, то есть за 9 лет до Менделеева. Периодическую систему французского химика назвали «земной спиралью» или «цилиндром Бегуйе».
Англичане предпочитают отмечать заслуги Уильяма Одлинга и Джона Александра Рейна Ньюлендса. Оба ученых предприняли попытки систематизировать химические элементы в 1864 году. Уильям Одлинг изобрел таблицу, с которой, кстати, был знаком и Менделеев и не скрывал этого. Дмитрий Иванович признавал, что в системе Одлинга есть «зачатки» его Периодического закона.
Ньюлендс назвал свою таблицу химических элементов «системой октав». Однако через 2 года англичанин забросил научную деятельность и больше не занимался усовершенствованием своей системы.
В том же 1864 году другой ученый, только уже из Германии, Юлиус Лотар Мейер обнародовал свою периодическую таблицу. Интересно, что в 1882 году и Менделеев, и Мейер получили по золотой медали «За открытие периодических соотношений атомных весов». Хотя Менделеев утверждал, что немецкий исследователь «не имел в виду периодического закона», и вообще ничего нового в него не привнес.
Интересно, что в 1882 году и Менделеев, и Мейер получили по золотой медали «За открытие периодических соотношений атомных весов». Хотя Менделеев утверждал, что немецкий исследователь «не имел в виду периодического закона», и вообще ничего нового в него не привнес.
russian7.ru
Чем известен Дмитрий Менделеев: 10 фактов из жизни русского учёного
8 февраля 1834 года в Тобольске родился русский учёный Дмитрий Менделеев, успешно работавший во многих областях науки. Одно из наиболее известных его открытий — периодический закон химических элементов. АиФ.ru предлагает читателям подборку интересных фактов из жизни Дмитрия Менделеева.
Семнадцатый ребёнок в семье
Дмитрий Менделеев был семнадцатым ребёнком в семье Ивана Павловича Менделеева, который занимал должность директора Тобольской гимназии. На то время многодетная семья была нетипичной для русской интеллигенции, даже в деревнях такие семьи редко встречались. Впрочем, ко времени рождения будущего великого учёного в семье Менделеевых осталось в живых двое мальчиков и пять девочек, восемь детей умерли ещё в младенческом возрасте, и троим из них родители не успели дать даже имени.
Двоечник и золотой медалист
Памятник Дмитрию Менделееву и его периодической таблице, расположенной на стене ВНИИ метрологии им. Менделеева в Санкт-Петербурге. Фото: Commons.wikimedia.org / Heidas
В гимназии Дмитрий Менделеев учился плохо, не любил латынь и Закон Божий. Во время обучения в Главном педагогическом институте Петербурга будущий учёный остался на второй год. Учёба вначале давалась нелегко. На первом курсе института он умудрился по всем предметам, кроме математики, получить неудовлетворительные отметки. Да и по математике он имел всего лишь «удовлетворительно»… Но на старших курсах дело пошло по-другому: среднегодовой балл у Менделеева был равен 4,5 при единственной тройке — по Закону Божьему. Менделеев окончил институт в 1855 году с золотой медалью и был назначен старшим учителем гимназии в Симферополь, но из-за подорванного во время учёбы здоровья и начавшейся Крымской войны перевёлся в Одессу, где работал учителем в Ришельевском лицее.
Признанный мастер чемоданных дел
Менделеев любил переплетать книги, клеить рамки для портретов, а также изготовлять чемоданы. В Петербурге и в Москве его знали как лучшего в России чемоданных дел мастера. «От самого Менделеева», — говорили купцы. Его изделия были добротными и качественными. Учёный изучил все известные в то время рецепты приготовления клея и придумал свою особую клеевую смесь. Способ её приготовления Менделеев держал в секрете.
Учёный-разведчик
Мало кто знает, что знаменитому учёному приходилось участвовать в промышленном шпионаже. В 1890 году к Дмитрию Менделееву обратился морской министр Николай Чихачёв и попросил помочь добыть секрет изготовления бездымного пороха. Поскольку покупать такой порох было довольно дорого, великого химика попросили разгадать секрет производства. Приняв просьбу царского правительства, Менделеев заказал в библиотеке отчёты железных дорог Британии, Франции и Германии за 10 лет. По ним он составил пропорцию, сколько было привезено угля, селитры и т. д. к пороховым заводам. Через неделю после того, как были сделаны пропорции, он изготовил два бездымных пороха для России. Таким образом, Дмитрию Менделееву удалось получить секретные данные, которые он добыл из открытых отчётов.
д. к пороховым заводам. Через неделю после того, как были сделаны пропорции, он изготовил два бездымных пороха для России. Таким образом, Дмитрию Менделееву удалось получить секретные данные, которые он добыл из открытых отчётов.
Весы, сконструированные Д. И. Менделеевым для взвешивания газообразных и твёрдых веществ. Фото: Commons.wikimedia.org / Serge Lachinov
«Русский стандарт» водки придуман не Менделеевым
Дмитрий Менделеев не изобретал водку. Идеальная крепость в 40 градусов и сама водка были изобретены до 1865 года, когда Менделеев защитил докторскую диссертацию на тему «Рассуждение о соединении спирта с водою». Про водку в его диссертации нет ни слова, она посвящена свойствам смесей спирта и воды. В своей работе учёный установил пропорции соотношения водки и воды, при которых происходит предельное уменьшение объёма смешиваемых жидкостей. Это раствор с концентрацией спирта около 46 % веса. Соотношение не имеет никакого отношения к 40 градусам. Сорокаградусная водка в России появилась в 1843 году, когда Дмитрию Менделееву было 9 лет. Тогда российское правительство в борьбе с разбавленной водкой установило минимальный порог — водка должна быть крепостью не менее 40 градусов, погрешность допускалась в 2 градуса.
Сорокаградусная водка в России появилась в 1843 году, когда Дмитрию Менделееву было 9 лет. Тогда российское правительство в борьбе с разбавленной водкой установило минимальный порог — водка должна быть крепостью не менее 40 градусов, погрешность допускалась в 2 градуса.
«Менделеевский» порох Россия покупала у американцев
В 1893 году Дмитрий Менделеев наладил производство изобретённого им бездымного пороха, но российское правительство, возглавляемое тогда Петром Столыпиным, не успело его запатентовать, и изобретением воспользовались за океаном. В 1914 году Россия купила у США несколько тысяч тонн этого пороха за золото. Сами американцы, смеясь, не скрывали, что продают русским «менделеевский порох».
Д. И. Менделеев. Попытка химического понимания мирового эфира. С.-Петербург. 1905 г. Фото: Commons.wikimedia.org / Newnoname
Изобретатель аэростата
19 октября 1875 года в докладе на заседании физического общества при Петербургском университете Дмитрий Менделеев выдвинул идею аэростата с герметичной гондолой для исследования высотных слоёв атмосферы. Первый вариант установки подразумевал возможность подъёма в верхние слои атмосферы, но уже позже учёный спроектировал управляемый аэростат с двигателями. Однако денег у учёного не нашлось даже на постройку одного высотного аэростата. В итоге предложение Менделеева так и не было реализовано. Первый в мире стратостат — так стали называть герметичные аэростаты, предназначенные для полёта в стратосферу (высоту более 11 км), — совершил полёт лишь в 1931 году из немецкого города Аугсбурга.
Первый вариант установки подразумевал возможность подъёма в верхние слои атмосферы, но уже позже учёный спроектировал управляемый аэростат с двигателями. Однако денег у учёного не нашлось даже на постройку одного высотного аэростата. В итоге предложение Менделеева так и не было реализовано. Первый в мире стратостат — так стали называть герметичные аэростаты, предназначенные для полёта в стратосферу (высоту более 11 км), — совершил полёт лишь в 1931 году из немецкого города Аугсбурга.
Менделеев придумал использовать трубопровод для перекачки нефти
Дмитрием Менделеевым была создана схема дробной перегонки нефти и сформулирована теория неорганического происхождения нефти. Он первым заявил о том, что сжигать нефть в топках — преступление, поскольку из неё можно получить множество химических продуктов. Он также предложил нефтяным предприятиям перевозить нефть не на арбах и не в бурдюках, а в цистернах, и чтобы перекачивалась она по трубам. Учёный на цифрах доказал, насколько целесообразнее перевозить нефть наливом, а заводы для переработки нефти строить в местах потребления нефтепродуктов.
Трижды номинант на Нобелевскую премию
Дмитрий Менделеев номинировался на Нобелевскую премию, присуждаемую с 1901 года, трижды — в 1905, 1906 и 1907 годах. Однако номинировали его только иностранцы. Члены Императорской академии наук при тайном голосовании неоднократно отвергали его кандидатуру. Менделеев был членом многих зарубежных академий и учёных обществ, но так и не стал членом родной Российской академии.
Имя Менделеева носит химический элемент № 101
Именем Менделеева назван химический элемент — менделевий. Полученный искусственно в 1955 году, элемент был назван в честь химика, который первым начал использовать периодическую систему элементов для предсказания химических свойств ещё не открытых элементов. На самом деле Менделеев не первый, кто создал периодическую таблицу элементов, и не первый, кто предположил периодичность химических свойств элементов. Достижением Менделеева было определение периодичности и на её основе составление таблицы элементов. Учёный оставил пустые клетки для ещё не открытых элементов. В результате, используя периодичность таблицы, было возможным определить все физические и химические свойства пропущенных элементов.
В результате, используя периодичность таблицы, было возможным определить все физические и химические свойства пропущенных элементов.
Н. А. Ярошенко. Д. И. Менделеев. 1886. Масло. Фото: Commons.wikimedia.org
www.aif.ru
Глава 3.4: История периодической таблицы
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 19881
Цели обучения
- Познакомиться с историей периодической таблицы.

Современная периодическая таблица возникла благодаря длительной истории попыток химиков расположить элементы в соответствии с их реакционной способностью и другими свойствами, чтобы помочь в предсказании химического поведения. Теперь, когда мы расположили таблицу в соответствии с электронной структурой, имеет смысл вернуться назад и посмотреть на более ранние попытки в свете того, что мы знаем об электронной структуре
. Одним из первых, кто предложил такое устройство, был немецкий химик Йоханнес Доберейнер (1780–1849 гг.).), который заметил, что многие из известных элементов можно сгруппировать в триады: набор из трех элементов, обладающих сходными свойствами, наборы из трех элементов, обладающих сходными свойствами, например, хлор, бром и йод; или медь, серебро и золото. Доберейнер предложил сгруппировать все элементы в такие триады, но последующие попытки расширить его концепцию не увенчались успехом. Теперь мы знаем, что части периодической таблицы — в частности, блок d — содержат триады элементов с существенным сходством. Средние три члена большинства других столбцов, такие как сера, селен и теллур в группе 16 или алюминий, галлий и индий в группе 13, также имеют удивительно похожий химический состав.
Средние три члена большинства других столбцов, такие как сера, селен и теллур в группе 16 или алюминий, галлий и индий в группе 13, также имеют удивительно похожий химический состав.
К середине 19 века были определены атомные массы многих элементов. Английский химик Джон Ньюлендс (1838–1898), предположив, что химический состав элементов может быть связан с их массой, расположил известные элементы в порядке возрастания атомной массы и обнаружил, что каждый седьмой элемент обладает сходными свойствами (рис. 3.4.1). . (Благородные газы были еще неизвестны.) Поэтому Ньюлендс предположил, что элементы можно классифицировать по октавам. Группа из семи элементов, соответствующих горизонтальным рядам в основных элементах группы (не считая неизвестных в то время инертных газов), соответствующих 9 элементам.0032 горизонтали строки в основной группе элементов. К сожалению, «закон октав» Ньюлендса, похоже, не работал для элементов тяжелее кальция, и его идея была публично высмеяна. На одном научном собрании Ньюлендса спросили, почему он не расположил элементы в алфавитном порядке, а не по атомной массе, поскольку это имело бы такой же смысл! На самом деле Ньюлендс был на правильном пути — за несколькими исключениями, атомная масса действительно увеличивается с атомным номером, и подобные свойства проявляются каждый раз, когда набор из ns 2 np 6 подоболочки заполнены. Несмотря на то, что в таблице Ньюлендса не было логического места для d -блочных элементов, он был отмечен за свою идею Лондонским королевским обществом в 1887 году.
На одном научном собрании Ньюлендса спросили, почему он не расположил элементы в алфавитном порядке, а не по атомной массе, поскольку это имело бы такой же смысл! На самом деле Ньюлендс был на правильном пути — за несколькими исключениями, атомная масса действительно увеличивается с атомным номером, и подобные свойства проявляются каждый раз, когда набор из ns 2 np 6 подоболочки заполнены. Несмотря на то, что в таблице Ньюлендса не было логического места для d -блочных элементов, он был отмечен за свою идею Лондонским королевским обществом в 1887 году.
Джон Ньюлендс (1838–1898)
Ньюлендс заметил, что свойства элементов повторяются через каждый седьмой (или кратный семи) элемент, а музыкальные ноты повторяются через каждую восьмую ноту.
Рисунок 3.4.1 Расположение элементов в октавах, предложенное Newlands Приведенная здесь таблица сопровождала письмо 27-летнего Ньюлендса редактору журнала Chemical News , в котором он писал: «Если элементы расположены в порядке их эквивалентов, с небольшими перестановками, как в прилагаемой таблице, можно заметить, что элементы, принадлежащие к одной и той же группе, обычно появляются на одной и той же горизонтальной линии. Также будет видно, что числа аналогичных элементов обычно различаются либо на 7, либо на некоторое число, кратное семи; другими словами, члены одной и той же группы стоят друг к другу в том же отношении, что и крайние точки одной или нескольких октав в музыке. Так, в группе азота между азотом и фосфором находится 7 элементов; между фосфором и мышьяком — 14; между мышьяком и сурьмой — 14; и, наконец, между сурьмой и висмутом также 14. Эти своеобразные отношения я предлагаю условно назвать Закон Октав . Я и т. д. Джон А. Р. Ньюлендс, FCS Лаборатория, 19, Грейт-Сент-Хелен, ЕС, 8 августа 1865 года».
Также будет видно, что числа аналогичных элементов обычно различаются либо на 7, либо на некоторое число, кратное семи; другими словами, члены одной и той же группы стоят друг к другу в том же отношении, что и крайние точки одной или нескольких октав в музыке. Так, в группе азота между азотом и фосфором находится 7 элементов; между фосфором и мышьяком — 14; между мышьяком и сурьмой — 14; и, наконец, между сурьмой и висмутом также 14. Эти своеобразные отношения я предлагаю условно назвать Закон Октав . Я и т. д. Джон А. Р. Ньюлендс, FCS Лаборатория, 19, Грейт-Сент-Хелен, ЕС, 8 августа 1865 года».
Периодическая таблица приобрела свою современную форму благодаря работам немецкого химика Юлиуса Лотара Мейера (1830–1895) и русского химика Дмитрия Менделеева (1834–1907), оба из которых сосредоточились на взаимосвязях между атомной массой и различными физическими и химическими характеристики. В 1869 году они независимо друг от друга предложили практически одинаковое расположение элементов. Мейер расположил элементы в своей таблице в соответствии с периодическими изменениями простых атомных свойств, таких как «атомный объем» (рис. 3.4.2), который он получил путем деления атомной массы (молярной массы) в граммах на моль на плотность элемента в граммах на кубический сантиметр. Это свойство эквивалентно тому, что сегодня определяется как молярный объемМолярная масса элемента, деленная на его плотность. (измеряется в кубических сантиметрах на моль): 9{3}/моль \справа ) \tag{3.4.1}\)
Мейер расположил элементы в своей таблице в соответствии с периодическими изменениями простых атомных свойств, таких как «атомный объем» (рис. 3.4.2), который он получил путем деления атомной массы (молярной массы) в граммах на моль на плотность элемента в граммах на кубический сантиметр. Это свойство эквивалентно тому, что сегодня определяется как молярный объемМолярная масса элемента, деленная на его плотность. (измеряется в кубических сантиметрах на моль): 9{3}/моль \справа ) \tag{3.4.1}\)
Как показано на рис. 3.4.2, щелочные металлы имеют самые высокие молярные объемы твердых элементов. На графике зависимости атомного объема от атомной массы Мейера неметаллы находятся на восходящей части графика, а металлы — на пиках, впадинах и нисходящих участках.
Дмитрий Менделеев (1834–1907)
Когда стекольный завод его семьи был уничтожен пожаром, Менделеев переехал в Санкт-Петербург, Россия, чтобы заниматься наукой. Он заболел, и не ожидалось, что он выздоровеет, но он защитил докторскую диссертацию с помощью своих профессоров и сокурсников. Помимо периодической таблицы, еще одним вкладом Менделеева в науку был выдающийся учебник, Основы химии , который использовался в течение многих лет.
Помимо периодической таблицы, еще одним вкладом Менделеева в науку был выдающийся учебник, Основы химии , который использовался в течение многих лет.
Рисунок 3.4.2 Изменение атомного объема в зависимости от атомного номера, адаптировано из графика Мейера 1870 Обратите внимание на периодическое увеличение и уменьшение атомного объема. Поскольку инертные газы еще не были открыты на момент составления этого графика, пики соответствуют щелочным металлам (группа 1).
Периодическая таблица Менделеева
Менделееву, впервые опубликовавшему свою периодическую таблицу в 1869 году (рис. 3.4.3), обычно приписывают происхождение современной периодической таблицы. Ключевое отличие его расположения элементов от расположения Мейера и других состоит в том, что Менделеев не предполагал, что все элементы были открыты (фактически в то время было известно только около двух третей встречающихся в природе элементов). Вместо этого он намеренно оставил пробелы в своей таблице для атомных масс 44, 68, 72 и 100, ожидая, что будут обнаружены элементы с такими атомными массами. Эти пробелы соответствуют элементам, которые мы теперь знаем как скандий, галлий, германий и технеций.
Вместо этого он намеренно оставил пробелы в своей таблице для атомных масс 44, 68, 72 и 100, ожидая, что будут обнаружены элементы с такими атомными массами. Эти пробелы соответствуют элементам, которые мы теперь знаем как скандий, галлий, германий и технеций.
Рис. 3.4.3 Периодическая таблица Менделеева, опубликованная в немецком журнале Annalen der Chemie und Pharmacie в 1872 г. Заголовки столбцов «Reihen» и «Gruppe» по-немецки означают «ряд» и «группа». ” Формулы указывают тип соединений, образованных каждой группой, где «R» означает «любой элемент», а верхние индексы используются там, где мы сейчас используем нижние индексы. Атомные массы показаны после знаков равенства и увеличиваются в каждой строке слева направо.
Группы в таблице Менделеева определяются тем, сколько атомов кислорода или водорода необходимо для образования соединений с каждым элементом. Например, в группе I два атома водорода, лития, лития, натрия, натрия и калия образуют соединения с одним атомом кислорода. В группе VII один атом фтора F, хлора Cl и брома Br взаимодействует с одним атомом водорода. Обратите внимание, как у этого подхода возникают проблемы с переходными металлами. Примерно до 1960 года прямоугольная таблица, разработанная на основе таблицы Менделеева и основанная на реактивности, была стандартной перед лекционными залами химии.
В группе VII один атом фтора F, хлора Cl и брома Br взаимодействует с одним атомом водорода. Обратите внимание, как у этого подхода возникают проблемы с переходными металлами. Примерно до 1960 года прямоугольная таблица, разработанная на основе таблицы Менделеева и основанная на реактивности, была стандартной перед лекционными залами химии.
Наиболее убедительным свидетельством в пользу менделеевского расположения элементов было открытие двух ранее неизвестных элементов, свойства которых близко соответствовали его предсказаниям (табл. 3.4.1). Два пробела, которые Менделеев оставил в своей исходной таблице, находились под алюминием и кремнием, ожидая открытия двух пока еще неизвестных элементов, эка — алюминия и эка — кремния (от санскритского эка , что означает « один», как в «один за алюминием»). Наблюдаемые свойства галлия и германия соответствовали свойствам eka — алюминий и eka — кремний настолько хорошо, что после их открытия периодическая таблица Менделеева быстро получила признание.
Табл. т. п.н.* = 201°C Когда химические свойства элемента свидетельствовали о том, что ему, возможно, было отведено неправильное место в более ранних таблицах, Менделеев тщательно пересмотрел его атомную массу. Он обнаружил, например, что ранее сообщавшиеся атомные массы бериллия, индия и урана были неверными. Первоначально сообщалось, что атомная масса индия составляет 75,6, исходя из предполагаемой стехиометрии InO для его оксида. Если бы эта атомная масса была правильной, то индий должен был бы быть помещен в середину неметаллов, между мышьяком (атомная масса 75) и селеном (атомная масса 78). Поскольку элементарный индий — серебристо-белый металл , однако Менделеев постулировал, что стехиометрия его оксида действительно In 2 O 3 , а не InO. Одной из групп элементов, отсутствующих в таблице Менделеева, являются благородные газы, все они были открыты более чем 20 лет спустя, между 1894 и 1898 годами, сэром Уильямом Рамзи (1852–1916; Нобелевская премия по химии 1904 года). Изначально Рамзи не знал, где разместить эти элементы в периодической таблице. Аргон, открытый первым, имел атомную массу 40. Это было больше, чем у хлора, и сравнимо с массой калия, поэтому Рамзай, используя те же рассуждения, что и Менделеев, решил поместить инертные газы между галогенами и атомами калия. щелочные металлы. Несмотря на свою полезность, периодическая таблица Менделеева была полностью основана на эмпирических наблюдениях, подкрепленных очень небольшим пониманием. Только в 1913 году молодой британский физик Х. Г. Дж. Мозли (1887–1915), анализируя частоты рентгеновских лучей, испускаемых элементами, обнаружил, что в основе порядка элементов лежит атомный номер . До его открытия в 1999 году некоторые теоретики считали, что элемент с Z из 114 существующих в природе. Дано: атомный номер Запрошено: имя с использованием префикса eka – 9 Стратегия: Имущество eka -Алюминий (прогноз) Галлий (наблюдаемый) eka -кремний (прогноз) Германий (наблюдается) атомная масса 68 69.723 72 72,64 элемент металл металл грязно-серый металл серо-белый металл низкий т.п.* т.пл. = 29,8°С высокий т.пл. т.пл. = 938°С d = 5,9 г/см 3 d = 5,91 г/см 3 d = 5,5 г/см 3 d = 5,323 г/см 3 оксид Е 2 О 3 Га 2 О 3 ЭО 2 ГеО 2 d = 5,5 г/см 3 d = 6,0 г/см 3 d = 4,7 г/см 3 d = 4,25 г/см 3 хлорид ECl 3 GaCl 3 ECl 4 GeCl 4 летучий  пл. = 78°С
пл. = 78°С п.н. < 100°C п.н. = 87°C *т.пл. = температура плавления; кп = точка кипения.  Это означает, что атомная масса индия на самом деле равна 113, что ставит этот элемент между двумя другими металлами, кадмием и оловом.
Это означает, что атомная масса индия на самом деле равна 113, что ставит этот элемент между двумя другими металлами, кадмием и оловом. Роль атомного числа в периодической таблице
 , а не атомная масса. Мозли предположил, что расположение каждого элемента в его ряду соответствует его атомному номеру 9.0032 Z , количество положительных зарядов (протонов) в его ядре. Например, аргон, хотя и имеет атомную массу больше, чем у калия (39,9 а.е.м. против 39,1 а.е.м. соответственно), в периодической таблице занимал место перед калием. Анализируя частоты испускаемых рентгеновских лучей, Мозли заметил, что атомный номер аргона равен 18, тогда как атомный номер калия равен 19, что указывает на то, что они действительно расположены правильно. Мозли также заметил три пробела в своей таблице частот рентгеновского излучения, поэтому он предсказал существование трех неизвестных элементов: технеция ( Z = 43), обнаружен в 1937 г.; прометий ( Z = 61), открытый в 1945 г.; и рений ( Z = 75), открытый в 1925 году. был убит во время битвы при Галлиполи в Турции.
, а не атомная масса. Мозли предположил, что расположение каждого элемента в его ряду соответствует его атомному номеру 9.0032 Z , количество положительных зарядов (протонов) в его ядре. Например, аргон, хотя и имеет атомную массу больше, чем у калия (39,9 а.е.м. против 39,1 а.е.м. соответственно), в периодической таблице занимал место перед калием. Анализируя частоты испускаемых рентгеновских лучей, Мозли заметил, что атомный номер аргона равен 18, тогда как атомный номер калия равен 19, что указывает на то, что они действительно расположены правильно. Мозли также заметил три пробела в своей таблице частот рентгеновского излучения, поэтому он предсказал существование трех неизвестных элементов: технеция ( Z = 43), обнаружен в 1937 г.; прометий ( Z = 61), открытый в 1945 г.; и рений ( Z = 75), открытый в 1925 году. был убит во время битвы при Галлиполи в Турции. Пример 3.4.1
 Используйте рассуждение Менделеева, чтобы назвать элемент 114 как eka -______; затем определите известный элемент, химический состав которого, как вы предполагаете, будет наиболее близок к химическому составу элемента 114.
Используйте рассуждение Менделеева, чтобы назвать элемент 114 как eka -______; затем определите известный элемент, химический состав которого, как вы предполагаете, будет наиболее близок к химическому составу элемента 114.5
A Используя периодическую таблицу, найдите строку n = 7. Определите местоположение неизвестного элемента с помощью Z = 114; затем идентифицируйте известный элемент, который находится непосредственно над этим местоположением.
B Назовите неизвестный элемент, используя префикс eka – перед именем известного элемента.
Решение:
A Строка n = 7 может быть заполнена, если предположить существование элементов с атомными номерами больше 112, которые находятся под ртутью (Hg). Считая три клетки вправо, мы получаем элемент 114, который находится непосредственно под свинцом (Pb). B Если бы Менделеев был жив сегодня, он бы назвал элемент 114 эка -свинец.
Считая три клетки вправо, мы получаем элемент 114, который находится непосредственно под свинцом (Pb). B Если бы Менделеев был жив сегодня, он бы назвал элемент 114 эка -свинец.
Упражнение
Используя рассуждения Менделеева, назовите элемент 112 как эка -______; затем назовите известный элемент, химический состав которого, как вы предполагаете, будет наиболее похож на химический состав элемента 112.
Ответ: эка -ртуть
Резюме
Периодическая таблица упорядочивает элементы в соответствии с их электронными конфигурациями, так что элементы в одном и том же столбце имеют одинаковые конфигурации валентных электронов. Периодические изменения размера и химических свойств являются важными факторами, определяющими типы химических реакций, которым подвергаются элементы, и виды химических соединений, которые они образуют. Современная периодическая таблица была основана на эмпирических корреляциях таких свойств, как атомная масса; ранние модели с использованием ограниченных данных отмечали существование триады и октавы элементов со схожими свойствами. Периодическая таблица приобрела свой нынешний вид благодаря работе Дмитрия Менделеева и Юлиуса Лотара Мейера, которые оба сосредоточились на взаимосвязи между атомной массой и химическими свойствами. Мейер расположил элементы по их атомному объему, который сегодня эквивалентен молярным объемам , определяемым как молярная масса, деленная на молярную плотность. Корреляция с электронной структурой атомов была установлена, когда Г. Г. Дж. Мозли показал, что периодическое расположение элементов определяется атомным номером, а не атомной массой.
Периодическая таблица приобрела свой нынешний вид благодаря работе Дмитрия Менделеева и Юлиуса Лотара Мейера, которые оба сосредоточились на взаимосвязи между атомной массой и химическими свойствами. Мейер расположил элементы по их атомному объему, который сегодня эквивалентен молярным объемам , определяемым как молярная масса, деленная на молярную плотность. Корреляция с электронной структурой атомов была установлена, когда Г. Г. Дж. Мозли показал, что периодическое расположение элементов определяется атомным номером, а не атомной массой.
Key Takeaway
- Элементы в таблице Менделеева расположены в соответствии с их свойствами, и таблица Менделеева помогает предсказать химическое поведение.
Концептуальные проблемы
Йоханнесу Доберейнеру приписывают разработку концепции химических триад. Какие из элементов группы 15, по вашему мнению, составят триаду? Ожидаете ли вы, что B, Al и Ga выступят в роли триады? Обоснуйте свои ответы.

Несмотря на то, что Доберейнер, Ньюлендс, Мейер и Менделеев внесли свой вклад в разработку современной таблицы Менделеева, ее происхождение приписывают Менделееву. Почему периодическая таблица Менделеева была принята так быстро?
Как вклад Мозли в разработку периодической таблицы объяснил местонахождение инертных газов?
Для описания неоткрытых элементов использовалась схема наименования эка , разработанная Менделеевым.
- Используйте этот метод именования, чтобы предсказать атомный номер eka – ртуть, eka – астат, eka – таллий и eka – гафний.
- Используя префикс eka , определите элементы с этими атомными номерами: 79, 40, 51, 117 и 121.
Численная задача
На основании приведенных данных заполните таблицу.
Виды Молярная масса (г/моль) Плотность (г/см 3 ) Молярный объем (см 3 /моль) А 40.  078
07825,85 Б 39,09 0,856 С 32.065 16,35 Д 1,823 16,98 Е 26,98 9,992 Ф 22,98 0,968 Постройте график зависимости молярного объема от молярной массы этих веществ.
 По Мейеру, что считать металлами, а что неметаллами?
По Мейеру, что считать металлами, а что неметаллами?
Ответить
Виды Молярная масса (г/моль) Плотность (г/см 3 ) Молярный объем (см 3 /моль) А 40.078 1,550 25,85 Б 39,09 0,856 45,67 С 32.065 1,961 16,35 Д 30,95 1,823 16,98 Е 26,98 2.  700
7009,992 Ф 22,98 0,968 23,7 Мейер обнаружил, что щелочные металлы имеют самые высокие молярные объемы и что молярные объемы неуклонно уменьшаются с увеличением атомной массы, затем выравниваются и, наконец, снова возрастают. Элементы, расположенные на восходящей части графика зависимости молярного объема от молярной массы, обычно были неметаллами. Если посмотреть на график данных в таблице, то можно сразу идентифицировать те элементы с наибольшими молярными объемами (А, В, F) как металлы, расположенные в левой части таблицы Менделеева. Элемент с наименьшим молярным объемом (Е) — это алюминий. График показывает, что последующие элементы (C, D) имеют молярные объемы больше, чем у E, но меньше, чем у A и B.
 Таким образом, C и D, скорее всего, являются неметаллами (что имеет место: C = сера, D = фосфор).
Таким образом, C и D, скорее всего, являются неметаллами (что имеет место: C = сера, D = фосфор).
Участники
- Анонимно
Изменено Джошуа Халперном
Видео с TED-Ed Lou Serocp
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Встроить Hypothes.is?
- да
- Лицензия
- CC BY-NC-SA
- Показать страницу TOC
- да на странице
- Сцена
- Финал
- Теги
- атомный номер
- Менделеева
- Мосли
- Ньюлендс
- периодическая таблица
Эволюция периодической таблицы
Рон Б.
 Дэвис мл., Джорджтаунский университет
Дэвис мл., Джорджтаунский университетДавайте посмотрим, когда люди впервые начали открывать и понимать каждый элемент периодической таблицы. Периодическая таблица — это гораздо больше, чем просто справочный инструмент для химиков. Если внимательно посмотреть на эволюцию таблицы, то можно обнаружить, что имена, символы, положения элементов и даже форма самой таблицы менялись по-разному.
Современная периодическая таблица отличается от того, что было столетие назад. (Изображение: Ranoris/Shutterstock)Открытие элементов
В доисторические времена люди, вероятно, знали как минимум три элемента: медь, углерод и серу. Серебро и золото, вероятно, стали частью человеческой жизни примерно к 5000 г. до н.э. Около 3000 г. до н.э. широкое использование железа положило начало тому, что мы называем «железным веком». Позже к этим элементам присоединились олово, затем сурьма, затем ртуть, а затем свинец.
Прошло более двух тысяч лет, прежде чем появилось широкое понимание дополнительных элементов. Цинк, например, был замечен древними римлянами. Но только около 1100 г. н.э. цинк начали очищать в Индии. Точно так же соединения мышьяка были обнаружены в медных рудах за тысячи лет до открытия элементарного мышьяка, которое обычно приписывают средневековому алхимику около 1250 года. пора легировать свинцом, чтобы сделать литой шрифт для печатного станка. Фосфор был открыт в 1669 г.алхимиком, который думал, что нашел «философский камень» для превращения других элементов в золото. Но только в 1700-х годах современные поиски того, что мы сейчас признаем элементами, действительно начались — и пошли в гору!
Цинк, например, был замечен древними римлянами. Но только около 1100 г. н.э. цинк начали очищать в Индии. Точно так же соединения мышьяка были обнаружены в медных рудах за тысячи лет до открытия элементарного мышьяка, которое обычно приписывают средневековому алхимику около 1250 года. пора легировать свинцом, чтобы сделать литой шрифт для печатного станка. Фосфор был открыт в 1669 г.алхимиком, который думал, что нашел «философский камень» для превращения других элементов в золото. Но только в 1700-х годах современные поиски того, что мы сейчас признаем элементами, действительно начались — и пошли в гору!
К 1776 году количество известных элементов (23) было вдвое больше, чем в древнем мире. К 1800 году количество известных элементов (33) уже в три раза превышало количество, известное древнему миру. К 1870 году, когда появилась первая периодическая таблица, у нас было более пяти десятков элементов (62). А к началу ХХ века у нас в руках было почти семь десятков элементов (83). К 1950 были обнаружены все встречающиеся в природе элементы. А в последние десятилетия люди создали двадцать дополнительных элементов, которых вообще никогда не было в природе.
А в последние десятилетия люди создали двадцать дополнительных элементов, которых вообще никогда не было в природе.
Эта статья взята непосредственно из серии видеороликов Understanding the Periodic Table . Смотрите прямо сейчас на Wondrium .
Ранняя версия Периодической таблицы
Когда Дмитрием Менделеевым впервые была создана периодическая таблица, расположение элементов в периодической таблице выглядело как ежемесячный настенный календарь, где строки обозначают недели, а столбцы – дни недели.
Расположение элементов в периодической таблице Менделеева было очень похоже на ежемесячный настенный календарь. (Изображение: Дмитрий Ивановит Менделеев/общественное достояние) В периодической таблице строки называются «периодами», а столбцы — «группами». В отличие от современной таблицы Менделеева, периодическая таблица Менделеева более века назад имела почти одинаковые периоды одинакового размера, что делало ее более прямоугольной, чем сегодняшняя версия таблицы.
Однако по мере того, как ученые продолжали узнавать больше об элементах — из чего они сделаны, как устроены атомы и что придает им уникальные свойства — форма стола превратилась в знакомую, более сложную форму, которую мы видим сегодня.
Современная периодическая таблица
Сегодняшняя таблица представляет собой карту строения атома. По мере того, как атомы становятся все больше и больше, эти более крупные атомы имеют больше слоев субструктуры. Отображение этой более сложной атомарной структуры создает потребность в большем количестве столбцов элементов для поддержания периодичности в таблице.
Четыре блока, которые мы видим на современном столе, дают нам карту того, как устроены все атомы. Вот почему верхние строки, содержащие наименьшие и простейшие элементы, содержат меньше элементов, чем строки под ними.
На самом деле, шестая и седьмая строки периодической таблицы содержат так много элементов с такими сложными атомными структурами, что мы даже не можем уместить их все за один проход! Здесь мы обычно видим две серии элементов, перемещенных из строки под остальную часть таблицы.
Подумайте о том, как Аляска и Гавайи изображены на многих картах США — часто в отдельных ячейках внизу. Это просто для экономии места. На самом деле, чтобы поставить Аляску и Гавайи на свои места, требуется гораздо более широкий взгляд, что иногда может быть непрактичным.
Такая же экономия места обычно используется для частей двух нижних строк периодической таблицы. Когда мы расставляем все эти элементы по своим местам, становится ясно, что в строках 6 и 7 на самом деле по 32 элемента на период!
Хорошо организованное меню
Периодическая таблица — это дорожная карта элементов, в которой элементы со сходными свойствами группируются близко друг к другу. Например, «Металлы» начинаются в крайнем левом углу и тянутся за центр. Металлы классической чеканки, медь, серебро и золото – все это соседи по столу. Как и печально известные токсичные тяжелые металлы, ртуть, таллий и свинец. «Неметаллы» отсортированы вместе справа.
Когда мы переходим от металлов к неметаллам, есть элементы с промежуточными свойствами, такие как «слабые металлы» и «металлоиды». Радиоактивные элементы торий, уран и плутоний, которые помогли вступить в ядерную эру, расположены близко друг к другу в одном очень длинном ряду полностью радиоактивных элементов в нижней части таблицы.
Радиоактивные элементы торий, уран и плутоний, которые помогли вступить в ядерную эру, расположены близко друг к другу в одном очень длинном ряду полностью радиоактивных элементов в нижней части таблицы.
Подобные группы помогают нам определить, какие элементы могут быть полезны для той или иной цели. Это позволяет нам делать всевозможные предсказания о материи, даже о веществах, которые еще предстоит открыть. Это удивительно хорошо организованное меню для всего обычного вещества, из которого состоит наша Вселенная.
Общие вопросы об эволюции Периодической таблицы
В: Какие элементы были известны к 1000 г. до н.э.?
К 1000 г. до н.э. было известно около дюжины элементов. К ним относятся медь, углерод, сера, серебро, золото, железо, олово, сурьма, ртуть и свинец.
В: Как выглядела периодическая таблица элементов во времена Дмитрия Менделеева?
Когда Дмитрий Менделеев впервые создал периодическую таблицу, она была похожа на месячный настенный календарь, в котором в столбцах указаны дни, а в строках — недели. В периодической таблице строки называются «периодами», а столбцы — «группами». Периодическая таблица Менделеева была более прямоугольной, чем сегодняшняя версия таблицы.
В периодической таблице строки называются «периодами», а столбцы — «группами». Периодическая таблица Менделеева была более прямоугольной, чем сегодняшняя версия таблицы.
В: Каковы особенности современной периодической таблицы?
Современная периодическая таблица представляет собой дорожную карту для различных химических элементов, группируя элементы на основе их свойств. Эти группировки помогают определить, какие элементы могут быть полезны для каких целей. Таблица также позволяет делать самые разные предсказания о материи, даже о еще не обнаруженных веществах.
Продолжайте читать
Значение и последствия Периодической таблицы
Завершение периодической таблицы Менделеева
Построение периодической таблицы
Великая карта истории науки
Периодическая таблица — это, проще говоря, метод организации всех элементов, известных в настоящее время науке, на основе их размеров, электронных конфигураций, и химические свойства.
Вопреки распространенному мнению, Дмитрий Менделеев, которого часто называют «отцом» таблицы Менделеева, не был первым, кто составил таблицу. Его нынешняя форма, по сути, является кульминацией работы многих ученых на протяжении веков.
В следующей статье мы совершим экскурсию по основным событиям в истории, которые внесли свой вклад в современную периодическую таблицу.
Поскольку эта статья больше посвящена истории таблицы, чем объяснению ее науки, вы можете посмотреть это видео, чтобы получить представление о периодичности элементов.
Не было бы таблицы Менделеева без элементов
Прежде чем предпринимать какие-либо реальные попытки упорядочить элементы, начинающие «организаторы» должны были выяснить, что они организуют и сколько их.
Такие металлы, как золото, олово, медь, свинец, ртуть и серебро, были известны с древних времен, но только в эпоху Возрождения было сделано первое истинное научное открытие веществ, которые мы сейчас называем элементами.
Широко признано, что первым научно идентифицированным, технически выделенным элементом был фосфор. Это открытие было сделано Хеннингом Брэндом в году 17 века, и вскоре за ним последуют многие другие.
Хеннинг был обанкротившимся немецким торговцем, которому удалось изолировать элемент, пытаясь создать легендарный философский камень. В то время многие люди экспериментировали с алхимией с конечной целью превратить неблагородные металлы в золото.
Он хранил свое открытие при себе до 1680 , пока Роберт Бойль не «заново открыл» этот элемент и не представил его научному миру.
Бойль ранее предложил определение этих новых «элементов» как:
«те примитивные и простые Тела, из которых, как говорят, состоят смешанные и на которые они в конечном счете распадаются».
В течение следующих нескольких сотен лет ранние химики накопили большой объем знаний о свойствах элементов и их соединений.
К 1869 году было найдено в общей сложности 63 элемента . Ученые начали замечать некоторые закономерности в свойствах этих элементов.
Ученые начали замечать некоторые закономерности в свойствах этих элементов.
Итак, методы классификации этих элементов начали использоваться всерьез.
“Элементарный трактат по химии” Лавуазье заложил основу0033 (
Элементарный трактат по химии ). Позже это было переведено на английский язык Робертом Керром.И оригинал, и перевод считаются первым настоящим учебником по химии. В своей основополагающей работе Лавуазье определил элемент как вещество, которое нельзя разложить на более простое вещество с помощью химической реакции.
Это определение будет использоваться более века, пока не будут открыты субатомные частицы.
Книга Лавуазье содержала исчерпывающий список этих «простых веществ», которые легли в основу нашего современного списка элементов.
В его списке элементы разделены на металлы и неметаллы. Его система встретила сопротивление со стороны коллег, но была быстро принята следующим поколением ученых. Система Лавуазье со временем оказалась неадекватной, поскольку использовала только эти две классификации.
Закон триад делает нас на один шаг ближе
Когда ранние химики начали экспериментировать и записывать свойства элементов, вскоре были сделаны некоторые интересные наблюдения.
[см. также]
Уильям Праут, английский врач и химик, сделал важное наблюдение, что атомный вес кажется кратным атомному весу водорода в 1815 . Позже это стало известно как гипотеза Праута и проложило путь для более поздних исследований атомного веса и атомной теории.
Несколько лет спустя произошло одно важное продвижение к периодической таблице.
Иоганн Доберейнер, в 1817 , вскоре заметил, что атомный вес стронция находится где-то между атомным весом кальция и бария.
Как оказалось, эти элементы также имели некоторые схожие химические свойства.
Чуть позже, в 1829 , он изобрел свой «Закон триад». Он заметил, что группы элементов, такие как хлор, бром и йод (так называемая триада галогенов, образующих соли) и литий, натрий и калий (так называемая триада щелочных [образующих] металлов), имеют сходные химические свойства.
Самый популярный
Иоганн отметил, что средний элемент в этих «триадах» обладал свойствами, которые были средними по сравнению с двумя другими, если их упорядочить по атомному весу. Он считал, что это может быть просто универсальный закон природы.
Он определил их как «химически аналогичные элементы, расположенные в порядке возрастания их атомных весов, образующие хорошо заметные группы из трех, называемые триадами, в которых атомный вес среднего элемента обычно является средним арифметическим атомного веса атомного веса два других элемента триады».
В то время этот закон стал очень популярен среди его сверстников. Между 1829 и 1858 годами многие известные ученые вскоре обнаружили, что химические связи этих триад действительно выходят за их пределы.
В течение этого периода: –
– Фтор был добавлен к группе галогенов,
– Кислород, сера, селен и теллур были сгруппированы вместе,
– Азот, фосфор, мышьяк, сурьма и висмут были сгруппированы вместе .
Казалось, были достигнуты большие успехи, но возникла проблема. Исследованиям в этой области серьезно мешали точные значения, а некоторые из них не всегда были доступны.
Первая попытка Шанкуртуа составить периодическую таблицу
Французский геолог Александр-Эмиль Бегуйе де Шанкуртуа широко известен как первый человек, который действительно заметил периодичность элементов. По этой причине составленную им таблицу, построенную на основе этого наблюдения, вероятно, следует признать самой первой периодической таблицей элементов.
Он отметил, что элементы проявляют сходные свойства при упорядочении по атомному весу. Таким образом, его Vis Tellunque (Telluric Helix) был опубликован в 1862 . Название происходит от элемента Теллур, который попал в центр его диаграммы.
В его «таблице» элементы располагались по спирали внутри цилиндра в порядке атомного веса. Этот цилиндр был сконструирован так, что за один оборот на нем можно было записать 16 единиц массы. Таким образом близко связанные элементы выстраиваются вертикально.
Таким образом близко связанные элементы выстраиваются вертикально.
Это привело его к предположению, что «свойства элементов — это свойства чисел». Он был бы первым, кто осознал, что свойства элементов повторяются через каждые семь элементов.
Используя свою диаграмму, он даже предсказал стехиометрию нескольких оксидов металлов. К несчастью для Шанкуртуа, он включил в свою схему ионы и соединения, а также некоторую геологическую, а не химическую терминологию.
По этой причине его идея в то время так и не была реализована. Его работа также была реализована только после того, как несколько лет спустя Менделеев обнародовал свою таблицу.
Оригинальный V Шанкуртуа – это Tellurique . Источник: Alexandre-Emile Béguyer de Chancourtois/Wikimedia Commons. Джон, английский химик, опубликовал свою статью, в которой классифицировал 62 установленных элемента в 11 группах. Эта группировка, как и его предшественники, основывалась на их сходных физических свойствах. Он также отметил, что атомный вес многих пар сходных элементов, по-видимому, изменился в 8 раз. Закон Джона гласит, что любой данный элемент ведет себя аналогично восьми элементам, следующим за ним в таблице.
Он также отметил, что атомный вес многих пар сходных элементов, по-видимому, изменился в 8 раз. Закон Джона гласит, что любой данный элемент ведет себя аналогично восьми элементам, следующим за ним в таблице.
Таким образом, его таблица организовала существующие элементы в 8 групп. Таблица Джона также была первой, в которой отображался атомный номер каждого элемента.
Закон октав Ньюленда был встречен некоторыми насмешками со стороны его сверстников, отчасти из-за ссылки на музыкальную шкалу закона. Его положение не улучшилось, когда Химическое общество также не смогло напечатать его лекцию от 1 марта 1866 по этому вопросу.
К сожалению, его проницательность была оценена только спустя пять лет после того, как таблица Менделеева была напечатана тем же Химическим обществом. Также потребуется еще 50 лет или около того значение периодичности числа восемь было заново открыто, когда были разработаны Теория валентных связей (1916) и Теория октетов химической связи (1919) .
Позже он будет удостоен синей таблички 2008 на его старом месте жительства Королевским химическим обществом. Возможно, это небольшое утешение, что еще при жизни он официально ввел термин «периодический» в химический лексикон.
Место рождения Джона Ньюлендса в Лондоне с почетной синей табличкой. Источник: Kafuffle/Wikimedia CommonsКто был «отцом» периодической таблицы?
Что касается периодической таблицы, то только русский химик Дмитрий Менделеев сформулировал ту, с которой мы знакомы сегодня. Или так обычно рассказывают историю.
На самом деле, существуют некоторые разногласия по поводу того, кто на самом деле заслуживает почетного звания «Отец Периодической таблицы». Для некоторых это явно был Менделеев, но есть и те, кто утверждает, что, по крайней мере, равное признание должно достаться немцу Лотару Мейеру. Оба этих человека создали очень похожие таблицы примерно в одно и то же время.
Мейер опубликовал свой учебник 1864 , Modern Theory of Chemistry, с сокращенной версией таблицы Менделеева. Он состоял только из примерно половины известных тогда элементов, которые были перечислены в порядке их валентности.
Он состоял только из примерно половины известных тогда элементов, которые были перечислены в порядке их валентности.
Он также, в силу этого порядка, продемонстрировал периодическое изменение валентности по мере увеличения веса. Он так и не смог предсказать новые элементы по своей таблице, в отличие от Менделеева.
Он расширил это в 1868 , который он передал коллеге для ознакомления перед публикацией. К несчастью для Мейера, Менделеев опубликовал свою более полную таблицу в 1869 за целый год до того, как он наконец появился в печати в 1870 .
Таблица Менделеева в конечном итоге победила таблицу Мейера. Но, самое главное, система Менделеева смогла удовлетворительно предсказать свойства неизвестных элементов. Только по этой причине его широко считают «отцом» периодической таблицы больше, чем Мейера.
Лотар Мейер, 11 января 1883 г. Источник: Юлий Вильгельм Хорнунг/Wikimedia CommonsМенделеев: бесспорный «отец» периодической таблицы тот, с которым большинство из нас знакомо сегодня.
 Как и другие до него, он расположил элементы по атомной массе.
Как и другие до него, он расположил элементы по атомной массе.Говорят, что он изобрел свой стол, раскладывая «химический пасьянс» во время долгих поездок на поезде. Каждая карта представляла собой отдельный элемент с различными фактами и цифрами, такими как химический символ, атомный вес и другие химические и физические свойства, собранные на ней.
Когда Менделеев разложил карты на столе в порядке возрастания атомного веса, совершенно ясно стала четкая группировка элементов со сходными свойствами. Так родился его ныне знаменитый стол.
Вдохновившись этим, Менделеев опубликовал свой основополагающий труд О связи свойств элементов с их атомными весами в 1869 .
В этой публикации он сделал следующие наблюдения:
Элементы проявляют периодичность свойств при упорядочении по атомной массе,
– Элементы со схожими химическими свойствами имеют атомный вес одинакового значения или регулярно увеличиваются,
– Упорядочивание по весу также соответствует их так называемой валентности,
– Широко распространенные элементы имеют тенденцию быть меньшими атомами,
– Величина атомного веса определяет характер элемента, точно так же, как величина молекулы определяет характер составного тела,
– Есть некоторые еще не открытые элементы,
– Атомный вес некоторых элементов кажется неправильным и должен быть исправлен, например. Теллерий должен быть между 123 и 126 (а не 128, как тогда),
Теллерий должен быть между 123 и 126 (а не 128, как тогда),
. Из их атомных масс можно сделать некоторые предсказания о химических свойствах элементов.
Большим преимуществом его таблицы перед предшественниками было то, что она выявляла закономерности в элементах в небольших единицах, таких как триады, а также в более крупных вертикальных, горизонтальных и диагональных отношениях между ними. К сожалению, он проиграл с разницей в один голос и получил Нобелевскую премию за свой вклад в химию.
Однако его стол был не без проблем. Хотя он оставил пробелы для еще не найденных элементов, он совершенно не смог предсказать существование благородных газов. Следует отметить, что впоследствии у Уильяма Рэмси не было особых проблем с их установкой.
Водород также оказался проблематичным. Его можно поместить либо в группу щелочных металлов, либо в группу галогенов, либо полностью отдельно вверху таблицы.
Другие группы, такие как лантаноиды, было очень трудно поместить в существующий формат таблицы. Полоний и радий, найденные Марией Кюри в 9 г.0054 1898 , тоже с трудом вписались в таблицу.
Полоний и радий, найденные Марией Кюри в 9 г.0054 1898 , тоже с трудом вписались в таблицу.
Таблица Менделеева даже предсказала появление новых элементов
Другим великим открытием, которое сделал Менделеев, было его наблюдение, что ранее определенные атомные веса не всегда были точными. Его таблица время от времени требовала, чтобы он переупорядочивал элементы, казалось бы, в нарушение предпосылки последовательного увеличения атомного веса.
Хорошим примером был бериллий. Его атомный вес в то время был принят равным 14, но что-то казалось неправильным, его химические свойства не соответствовали общей картине.
Он определил, что он должен иметь атомный вес, более близкий к 9. Он также поместил его в группу 2 над магнием, чьи химические свойства были более похожими, чем его предыдущее положение над азотом.
Таким образом, он обнаружил, что 17 элементов необходимо переместить в новые положения из исходных, если просто упорядочить их по атомному весу. Даже после того, как было показано, что он был прав в отношении многих из этих элементов, после переоценки их веса некоторые из них нужно было разместить в таблице не в порядке веса, например, аргон.
Даже после того, как было показано, что он был прав в отношении многих из этих элементов, после переоценки их веса некоторые из них нужно было разместить в таблице не в порядке веса, например, аргон.
После того, как все известные элементы были собраны таким образом, появились явные зазоры. Менделеев понял, что это места для еще не открытых элементов.
Некоторые из них, которые он назвал эка-алюминием, эка-бором и эка-кремнием, позже будут называться галлием, скандием и германием. Они вполне соответствовали его предсказаниям.
Даже сегодня новые элементы находят и добавляют в периодическую таблицу.
Всего Менделеев смог предсказать будущее открытие 10 новых элементов. Семь из них в конце концов были обнаружены, но три с атомным весом, 45, 146 и 175, либо не существуют, либо еще предстоит открыть.
Интересно, что другой человек, Уильям Одлинг, в 1864 нарисовал аналогичную таблицу Менделеева. Ему удалось решить проблему теллура и йода и успешно поместить таллий, свинец, ртуть и платину в нужные группы, чего Менделееву не удалось сделать с первой попытки.
Одлинг так и не получил признания за свою работу, потому что он был секретарем Лондонского химического общества, что привело к обвинениям в плагиате. Кроме того, он сыграл важную роль в дискредитации более ранней периодической таблицы Ньюлендса.
Бесполезные благородные газы всколыхнули вещи, и Мозли приказывает под атомным номером
Лорд Рэлей в 1895 обнаружил и сообщил, что нашел новый газообразный элемент, который оказался химически инертным. Он назывался Аргон и логически не вписывался в существующую таблицу Менделеева.
Три года спустя Уильям Рэмси предположил, что, возможно, аргон следует поместить между хлором и калием в семье с гелием. И это несмотря на то, что атомный вес аргона больше, чем у калия.
Рэмси назвал эту группу «нулевой» группой, поскольку они имели нулевую валентность, отсюда и их инертность. Он также точно предсказал будущее открытие элемента, который мы сейчас называем неоном.
Сегодня мы называем их благородными газами. Работа Рэмси была поддержана новаторской работой Генри Мозли.
Его работа с использованием рентгеновских лучей для изучения атомной структуры привела к более точному расположению элементов в таблице. К сожалению, позже Генрих был убит, сражаясь на отдаленных пляжах полуострова Галлиполи (Гелиболу на турецком языке) в 9 г.0054 1915.
По сей день благодаря работе Мозли элементы упорядочиваются по атомному номеру (количеству протонов в ядре), а не по атомному весу. Это также устранило множество предполагаемых «проблем» с упорядоченными атомными массами элементов, к большому облегчению химиков.
Газоразрядная трубка, заполненная аргоном, образующая атомный символ аргона. Источник: Pslawinski/Wikimedia CommonsАктиноиды и лантаноиды добавлены в периодическую таблицу
Последние существенные изменения в периодической таблице элементов были внесены Гленном Т. Сиборгом. Это произошло во время его исследований в рамках Манхэттенского проекта в 1943 годах.
Ему было трудно выделить элементы америций и кюрий, и он задался вопросом, могут ли они принадлежать к другой серии, чем в настоящее время. Он, вопреки совету своих коллег, решил внести изменения в таблицу Менделеева, добавив ряд актинидов.
Он также в ходе своих исследований обнаружил все трансурановые элементы из 9с 4 по 102.
Эти новые элементы необходимо было вписать в существующую таблицу, поэтому он изменил ее конфигурацию, поместив серию актинидов под серию элементов лантанидов. Практика, широко принятая сегодня и представленная в современных периодических таблицах.
Ему (и его коллегам) также удалось идентифицировать более 100 изотопов других элементов в таблице. Они также смогли теоретизировать ряд сверхтяжелых элементов от 104 до 121 (в настоящее время в значительной степени идентифицированных) и ряд суперактинидов элементов от 122 до 153.
За это ему была присуждена Нобелевская премия по физике. Элемент 106, сиборгий (Sg), также был назван в его честь.
Как мы видим, периодическая таблица, хотя ее обычно приписывают Дмитрию Менделееву, на самом деле является кульминацией столетий постепенных экспериментов и открытий. Несмотря на это, было бы неуместно лишить его почетного титула «отца» стола.
Хотя технически он не был первым, таблица Менделеева была первой лучшей попыткой систематизировать известные элементы. Он также смог сделать некоторые предсказания, которые со временем оправдались.
Таким образом, современная периодическая таблица представляет собой совокупность знаний великих научных умов, чье происхождение почти так же старо, как и сама химия.
Еще новости
культура
7 мгновенных камер для сбора воспоминаний на фотографиях Polaroid
Ceren Uysal| 09.05.2022
наука
У будущего энергетики есть удивительная «большая проблема», раскрывает эколог Карл Поуп
Лукия Пападопулос| 25.08.2022
здоровье
Итальянец стал первым, у кого одновременно был положительный результат на COVID, ВИЧ и оспу обезьян
Лукия Пападопулос | 28. 08.2022
08.2022
Улучшение Периодической таблицы — журнал Science Connected Magazine
Узнайте, почему Периодическая таблица элементов систематически блестящая. Кроме того, получите две бесплатные периодические таблицы, которые вы можете скачать и распечатать для стены в классе или столовой.
Автор Steven Spence
Серия: Периодическая таблица и сортировка элементов. Часть 3
Шляпа сортировки: дома
Периодическая таблица великолепно предоставляет систематизированную информацию о каждом элементе. Атомный номер говорит нам, сколько протонов (положительно заряженных компонентов ядра) и сколько электронов (отрицательно заряженных частиц вне ядра) имеет каждый элемент. Глядя на атомный вес, мы можем быстро понять, сколько нейтронов может быть в ядре наряду с протонами. С дробными атомными весами мы знаем, что существует несколько изотопов атома.
Ряды связаны с увеличением количества протонов, нейтронов и электронов. Как правило, чем дальше вниз по периодической таблице, тем более вероятно, что элемент является радиоактивным.
Организация периодической таблицы в строках и столбцах не случайна. Для поклонников Гарри Поттера подумайте об этом как об алгоритмической версии сортировочной шляпы. Хммм, это элемент Рейвенкло или Хаффлпаффа?
Версии Периодической таблицы
Хотя информация о каждом элементе Периодической таблицы одинакова, для организации Периодической таблицы использовались разные форматы. Периодическая таблица также эволюционировала. Давайте кратко рассмотрим как историю, так и наиболее распространенные версии, используемые сегодня.
Джон Ньюлендс упорядочил элементы по весу. Он заметил, что каждые восемь элементов имеют одинаковые свойства, поэтому он организовал свою таблицу с восемью столбцами. Он не оставил пробелов в своей таблице.
В 1863 году Дмитрий Менделеев составил первую из своих 60 версий Периодической таблицы. Он использовал атомные веса для сортировки элементов; однако он переупорядочивал их на основе наблюдаемых свойств, если казалось, что они не находятся в правильных местах. Это было точно, хотя и спекулятивно. Менделеев больше доверял экспериментальным свидетельствам химических реакций, чем измеренным весам. Он был прав, потому что в то время многие элементы было трудно выделить в образцах. Часто сообщалось о неправильных весах, которые позже исправлялись, когда можно было анализировать более чистые образцы.
Это было точно, хотя и спекулятивно. Менделеев больше доверял экспериментальным свидетельствам химических реакций, чем измеренным весам. Он был прав, потому что в то время многие элементы было трудно выделить в образцах. Часто сообщалось о неправильных весах, которые позже исправлялись, когда можно было анализировать более чистые образцы.
Менделеев оставил пробелы там, где не было известного элемента, соответствующего ожидаемому весу и свойствам. Зазор Менделеева для галлия ( Eka-Aluminium ) является хорошо известным примером. К 1871 году у Менделеева была периодическая таблица, состоящая из восьми групп, связанных со степенями окисления. Этот 8-колоночный формат использовался десятилетиями, даже после того, как были разработаны другие форматы.
Переходя к 1913 году, Антон ван ден Брук предположил, что ядерный заряд определяет место в Периодической таблице. В 1914 Иоганн Ридберг определил зависимость атомных номеров инертных газов. Это привело к правилу октетов и теориям валентных связей. Это было дополнительно адаптировано к модели Bohr . В сочетании с принципом запрета Паули было определено квантовое правило заполнения электронных оболочек. Наконец, Гленн Сиборг предложил f-серию (серию актинидов) на основе своих исследований америция и кюрия.
Это было дополнительно адаптировано к модели Bohr . В сочетании с принципом запрета Паули было определено квантовое правило заполнения электронных оболочек. Наконец, Гленн Сиборг предложил f-серию (серию актинидов) на основе своих исследований америция и кюрия.
«Я полагаю, что главное отличие состоит в том, что вы [Гленн Сиборг] используете периодическую таблицу для выражения вероятной конфигурации электронных оболочек, в то время как я и несколько других химиков в первую очередь озабочены представлением химического характера электронных оболочек. элементы». – Ф.А.Панет Г.Т.Сиборгу, 14 июля 19 г.50, Box 342, Glenn Theodore Seaborg Papers, Отдел рукописей, Библиотека Конгресса, Вашингтон, округ Колумбия; ср. Докторская диссертация, Создание символа науки: разработка стандартной периодической таблицы элементов Энн Робинсон, с. 247
Открытие гораздо большего количества элементов, чем изначально было в таблице Менделеева, более глубокое понимание ядра (протонов и нейтронов), а также электронных орбиталей привело к современной периодической таблице.
В XIX веке в учебниках использовалось несколько форм Периодической таблицы.50-е годы. Некоторые из них были таблицами с 8 колонками, 18 колонками и 32 колонками. Другие были приспособлениями, называемыми «ракетными кораблями», основанными на ранних Периодических таблицах Нильса Бора.
Наиболее часто используемая на сегодняшний день версия Периодической таблицы возникла на основе учебника Горация Г. Деминга 1923 Общая химия . Он содержит 18 столбцов и сам является производным от 18-колоночного «блочного» макета Альфреда Вагнера 1905 года, отражающего s-, d- и p-блоков (вложенных оболочек) [1] . Длинная версия с f-блок «inline» имеет 32 столбца.
Таблица Деминга совершила прорыв в 1928 году, потому что издатель распространял распечатки формата Letter в США в рамках рекламной кампании. Они продолжали снабжаться новыми изданиями в течение нескольких десятилетий. Широкое распространение этих материалов в западных странах и практичный формат привели к тому, что эта 18-колоночная форма стала самой популярной версией.
18-колоночная версия Периодической таблицы не превосходит другие версии. Действительно, 32-колоночный формат имеет множество преимуществ; однако у него есть существенный недостаток: пространство для макета. Версия с 18 столбцами более компактна и имеет благоприятное соотношение сторон, что позволяет легко разместить ее на страницах учебников или раздаточных материалах. Формат с 32 столбцами требует раскладок или гораздо более длинных печатных диаграмм. Даже в нашем цифровом мире соотношение сторон на веб-страницах, компьютерных мониторах или смартфонах обычно благоприятствует 18-колоночному дизайну.
Таким образом, официальной версии Периодической таблицы, одобренной Международным союзом теоретической и прикладной химии (IUPAC) или другими организациями, не существует. Широко используемая версия Периодической таблицы в формате с 18 столбцами используется с 1950-х годов, и ее использование можно проследить до «Общей химии» Деминга (1923 г.) и даже до этого до «блочной» схемы Альфреда Вегнера 1905 г.
В настоящее время периодическая таблица в основном используется в образовании. Были внесены изменения, чтобы лучше отразить различные аспекты элементов: иногда они были сосредоточены на химических характеристиках, а иногда – на физических аспектах.
Улучшение Периодической таблицы для учащихся
На мой взгляд, какой бы блестящей ни была Периодическая таблица, ее можно улучшить, используя наше нынешнее понимание атомов. Небольшая модификация расположения блоков, лежащих в основе Периодической таблицы Деминга, позволяет обеспечить более последовательное представление с точки зрения подоболочек и связанных с ними свойств элементов.
Предлагаемое представление периодической таблицы в виде подоболочки. © 2021 Стивен СпенсTweak 1
Условно гелий [He; Элемент 2] находится в крайнем правом столбце (18) стандартного изображения Периодической таблицы. Почему? Потому что он завершает «Период», который совпадает со строкой. Обычно все элементы с полным периодом заканчиваются в столбце 18 (также известном как группа 18). Это также соглашение, связанное с «правилом октетов» и «благородными» газами. Однако это создает несоответствие субоболочки в табличном представлении.
Это также соглашение, связанное с «правилом октетов» и «благородными» газами. Однако это создает несоответствие субоболочки в табличном представлении.
- Ряд (точка) в Периодической таблице отражает ряд электронных подоболочек. Период завершается, когда все подоболочки в ряду заполнены электронами. Первый Период (строка) состоит только из s подоболочка , которая закрыта при наличии двух электронов. Разделение представления подоболочки s на столбцы 1 и 18 для периода 1, в то время как все остальные периоды s подоболочки находятся в столбцах 1 и 2, визуально вводит в заблуждение.
- Когда все валентные подоболочки (s- и p-) Периода заполнены, последний элемент этого Периода имеет тенденцию оставаться несвязанным с другими атомами, поэтому все «благородные» газы находятся в столбце 18. Гелий химически ведет себя как «благородный» газ, потому что у него есть только одна подоболочка. Это легко объяснить учащимся как частный случай, т.
 е. период 1 не имеет р- подоболочка . Учащимся полезно, чтобы гелий находился в естественном положении с другими элементами s2 .
е. период 1 не имеет р- подоболочка . Учащимся полезно, чтобы гелий находился в естественном положении с другими элементами s2 .
Подстройка 2
В некоторых версиях Периодической таблицы я вижу пробелы в строке 6 и строке 7 в столбце 3 (под 39 иттрием), относящиеся к сериям лантанидов и актинидов, которые обычно изображаются в строках ниже основного Периодическая таблица в версии с 18 столбцами. В версии с 32 столбцами в этом нет необходимости, так как для субоболочки f требуется 14 столбцов.0033 можно изобразить «встроенным».
В этих 18-столбцовых версиях Периодической таблицы ряд включает 15 элементов серий лантанидов (строка 6) и актинидов (строка 7). Хотя это не является серьезной проблемой, потому что очень немногим учащимся когда-либо придется работать с этими элементами, другое изображение будет более совместимо с подоболочками. Подоболочка f содержит 14 электронов, а не 15, как учащийся может сделать неправильный вывод из представления ряда лантанидов и актинидов.
Я предлагаю добавить справочный столбец, который позволит f суб-оболочке четко развернуться под основной периодической таблицей. Пересмотренная форма серии лантанидов состоит из 14 элементов в подоболочке f , начиная от лантана [элемент 57] и заканчивая иттербием [элемент 70]. Лютеций [Элемент 71] находится в столбце 3 как элемент d-оболочки .
Аналогично, серия актинидов состоит из 14 элементов в подоболочке f , начиная с актиния [элемент 89] в нобелий [элемент 102]. Лоуренсий [элемент 103} находится в столбце 3 как элемент d-оболочки .
Из-за схожих уровней энергии в f и d подоболочках существуют аномалии в порядке заполнения рядов лантанидов и актиноидов. К моменту достижения элементов 71 и 103 подоболочка f завершена. Значение проиллюстрированного общего принципа перевешивает исключения в порядке заполнения электронами при классификации элементов.
Tweak 3
Я предпочитаю не использовать цветовое кодирование и толстые линии, показывающие щелочные металлы, переходные металлы и т. д. Многие изображения периодической таблицы имеют высокую информационную плотность из-за такого цветового кодирования, но это также может сбивать с толку.
д. Многие изображения периодической таблицы имеют высокую информационную плотность из-за такого цветового кодирования, но это также может сбивать с толку.
Я чувствую, что чем проще, тем лучше. Как и в случае с любым инструментом, важно понимать его назначение. В моей измененной версии Периодической таблицы основное внимание уделяется электронным подоболочкам как ключу к раскрытию химических свойств. Распознавание элемента как щелочного металла или «благородного» газа становится производной функцией конфигурации валентных электронов в подоболочках, а не запоминается цветовым кодированием.
Существуют веские и практические причины для широко используемых сегодня представлений периодической таблицы. В то же время я думаю, что есть место и для более последовательного описания подоболочек, чтобы лучше донести основные принципы до учащихся. Как только основы станут ясными, учащимся будет легче понять, как и почему изменяются химические свойства элементов.
Заключение
Периодическая таблица — мощное учебное пособие. Он развился, чтобы систематически отражать и систематизировать данные об элементах. В прошлом пробелы в Периодической таблице указывали на элементы, которые еще предстояло открыть. Периодическая таблица также позволила ученым делать прогнозы о характеристиках новых элементов до их открытия.
Он развился, чтобы систематически отражать и систематизировать данные об элементах. В прошлом пробелы в Периодической таблице указывали на элементы, которые еще предстояло открыть. Периодическая таблица также позволила ученым делать прогнозы о характеристиках новых элементов до их открытия.
На сегодняшний день наиболее часто используемой формой Периодической таблицы является версия с 18 столбцами, широко принятая в 1950-х и 1960-х годах. Он происходит от «блочных» представлений Периодической таблицы 1905 и 1923 годов. Блочное представление отражает лежащие в основе подоболочки s, f, d и p. Используемая в настоящее время версия имеет несколько незначительных репрезентативных несоответствий, которые могут затруднить понимание учащимся субоболочек и связанной с ними химии. Предлагаемая редакция сопровождает этот пост для рассмотрения читателем.
Спекулятивный бонус
Основываясь на более последовательном представлении в исправленной версии, я также предложил гипотетическую Периодическую таблицу, включающую элементы Периода 8. Предполагается, что субоболочка 5g будет следовать принципу «Aufbau» в отношении заполнения субоболочек. Мы знаем, что есть некоторые исключения из этого правила для серий лантанидов и актинидов. Я полностью ожидаю исключений в субоболочке 5g, которую я называю серией «Super Actinide» как легко запоминающуюся стенографию.
Предполагается, что субоболочка 5g будет следовать принципу «Aufbau» в отношении заполнения субоболочек. Мы знаем, что есть некоторые исключения из этого правила для серий лантанидов и актинидов. Я полностью ожидаю исключений в субоболочке 5g, которую я называю серией «Super Actinide» как легко запоминающуюся стенографию.
По мере того, как физики продолжают добиваться прогресса в синтезе элементов, серии Периода 8 перейдут от гипотетических к экспериментально значимым. Характеристики, стабильность (остров стабильности?) и порядок заполнения электронных орбит этих новых элементов скажут нам эмпирически, каким должно быть правильное размещение подоболочки 5g. Мне не терпится увидеть результаты эксперимента.
Читать серию
Разница между химическими и ядерными реакциями
Поднимите стул и сядьте за Периодическую таблицу и сортировку элементов. Часть 1: Разница между химическими и ядерными реакциями.
Часть 1: Разница между химическими и ядерными реакциями.
Химические реакции: Periodic Genius
Химические реакции необходимы. Они добавляют кислород в нашу кровь, соль в нашу еду и батарейки в наши телефоны. Узнайте, почему периодическая таблица такая блестящая.
Улучшение Периодической таблицы
Узнайте, почему Периодическая таблица элементов систематически блестящая. Кроме того, получите две бесплатные периодические таблицы, которые вы можете скачать и распечатать для стены в классе или столовой.
Endnotes
Если вам интересно (как и мне), почему подоболочки помечены буквами s, p, d и f, это связано с устаревшим методом классификации спектральных линий как «резких», «основных», « диффузный», или «фундаментальный». Сегодня подоболочки после f будут следовать за алфавитом. Следующей подоболочкой будет g-подоболочка с 18 электронами, затем h-подоболочка с 22 электронами, i-подоболочка с 26 электронами, «j» будет пропущено из-за схожести с буквой «i» ; подоболочка k с 30 электронами и так далее. Синтез элементов может никогда не продвинуться настолько далеко, чтобы нуждаться в подоболочке за пределами g-подоболочки из-за задействованных энергий. Кроме того, некоторые расчеты атомных ядер и орбит электронов показывают, что существует предел для теоретического Элемента 173. Найдите уравнения Дирака и модель Бора, чтобы узнать больше.
Синтез элементов может никогда не продвинуться настолько далеко, чтобы нуждаться в подоболочке за пределами g-подоболочки из-за задействованных энергий. Кроме того, некоторые расчеты атомных ядер и орбит электронов показывают, что существует предел для теоретического Элемента 173. Найдите уравнения Дирака и модель Бора, чтобы узнать больше.
- Превосходным единственным источником информации об истории и эволюции периодической таблицы является: Докторская диссертация, Создание символа науки: разработка стандартной периодической таблицы элементов , Энн Робинсон. Онлайн-версия доступна по адресу: https://core.ac.uk/download/pdf/220129765.pdf
- Вот мое предложение для представления Периодической таблицы в формате PDF
Periodic-TableDownload
- Вот мое гипотетическое расширение предложенной Периодической таблицы для элементов Периода 8, включая 5-граммовую подоболочку в формате PDF.
Hypothetical-g-sub-shell-Periodic-TableDownload
Разработка современной таблицы Менделеева: от спиралей к звездам
Таблица Менделеева — одно из самых знаковых изображений в науке, путеводитель по химии нашего мира . Но это только один из многих визуальных способов классификации элементов.
Но это только один из многих визуальных способов классификации элементов.
Существуют тысячи альтернативных периодических таблиц или систем, некоторые из которых появились еще до изобретения ставшей теперь стандартной версии, которую вы, возможно, знаете из школьной химической лаборатории.
© IUPAC (Международный союз теоретической и прикладной химии), 2018 г. Источник изображения для стандартной периодической таблицы Международного союза теоретической и прикладной химии 2018 г.
Стандартная периодическая таблица, 2018 г.Первые попытки классификации элементов
Самые ранние попытки классифицировать материю, от металлов до минералов, основывались на идее существенных качеств или элементов. У древнегреческих философов их было четыре: воздух (горячий и влажный), вода (холодная и влажная), земля (холодная и сухая) и огонь (сухой и горячий).
Объединение химических веществ в группы по схожим свойствам имело практическую ценность для алхимиков и аптекарей, но единого мнения или основного порядка не существовало.
Групповая коллекция Музея науки
Антуан Лавуазье и Мари-Анн Поль Лавуазье, 1788 г.Ситуация начала меняться в конце 18 века, когда химики ввели классификацию, основанную на измеримых величинах, таких как вес.
В 1789 году один из ведущих модернизаторов, знаменитый французский химик Антуан Лавуазье, составил список из 33 «простых веществ», которые составляли около 300 химических веществ, известных в то время, разделенных на газы, металлы, неметаллы и земли.
Джон Дальтон, школьный учитель из Манчестера, представил идею классификации элементов по относительному весу их атомов в 1806 году — революционную концепцию в то время, которая имела решающее значение для изобретения периодической таблицы.
Сегодня нам известно о 118 элементах, которые могут быть объединены в более чем 70 миллионов различных химических соединений, поэтому крайне важно иметь систему для их классификации на уровне элементов.
Групповая коллекция Музея науки
Таблица элементов Дальтона, 1808 г.Что такое периодическая таблица?
Групповая коллекция Музея науки
Менделеевская рукопись таблицы Менделеева, 1869 год.
“Периодические” таблицы названы так, потому что они упорядочивают элементы таким образом, что их химические свойства периодически повторяются. через равные промежутки времени.
Фигура, наиболее тесно связанная с периодической таблицей, — это Дмитрий Менделеев, русский химик, который разработал свою первую таблицу в 1869 году. через.
Но таблица Менделеева не была первой. До него было еще пятеро.
До него было еще пятеро.
Эта идея витала в воздухе с первой международной конференции по химии в 1860 году в Карлсруэ, Германия. На этом совещании ведущими химиками мира были согласованы стандартные значения атомных весов 60 известных тогда элементов.
Однако первым пионером периодики не был химик.
Периодические пионеры
Дмитрий Менделеев, изображенный здесь примерно в 1905 году, разработал свою первую периодическую таблицу в 1869 году.
Групповая коллекция Музея наукиПервая таблица Менделеева, опубликованная в журнале вновь образованного Русского химического общества, не похожа на современную форму, которую мы знаем сегодня.
Групповая коллекция Музея наукиВ 1864 году Джон Ньюлендс разделил известные элементы на восемь групп, которые стали известны как Закон Октав.
Общественное достояние Юлиус Лотар Мейер опубликовал раннюю версию периодической таблицы в 1864 году, которая содержала 28 элементов.
Как выглядела первая периодическая таблица?
В 1862 году французский геолог Александр-Эмиль Бегуйе де Шанкуртуа опубликовал статью с описанием классификации элементов.
«Теллурический винт» де Шанкуртуа, как он его называл, расположил элементы в порядке атомного веса по спирали вокруг цилиндра.
Подобно таблице Менделеева, но за семь лет до этого де Шанкуртуа наткнулся на периодическое повторение химических свойств в своей аранжировке.
К несчастью для него, новаторская статья десятилетиями ускользала от внимания химиков, главным образом потому, что издатель не включил наглядную схему его винтовой системы.
В 1926 году Музей науки изготовил действующую модель периодического винта де Шанкуртуа.
Повернув ручку, вы увидите химические группы элементов, таких как литий, натрий и калий (три щелочных металла), выровненные вертикально по вращающейся колонне.
Атомная масса, вес или число?
- Элемент может быть в разных формах (изотопах), в зависимости от того, сколько нейтронов он содержит.
 Атомный вес — это средняя масса элемента по всем его изотопам.
Атомный вес — это средняя масса элемента по всем его изотопам. - Атомная масса — это масса определенного атома или изотопа.
- Атомный номер элемента — это количество протонов, которые он имеет. Атомный номер заменил атомный вес как значение, определяющее порядок элементов в периодической таблице.
Могут ли периодические таблицы работать в трех измерениях?
Первая периодическая таблица — винт де Шанкуртуа — была вовсе не таблицей, а трехмерной системой расположения элементов.
Определяющей чертой, которая объединяет винт де Шанкуртуа с таблицей Менделеева и многими другими, является периодическая картина химических свойств, которая позволяет химикам предсказывать, как элементы ведут себя и реагируют в зависимости от их положения в системе.
Хотя стандартной формой стала двумерная таблица Менделеева, состоящая из строк и столбцов (что сбивает с толку, он всегда использовал термин «система» вместо «таблицы»), это не помешало химикам более позднего времени вводить альтернативы.
Помимо визуальной привлекательности, некоторые трехмерные периодические системы содержали дополнительную информацию об элементах.
Посмотрите, как система де Шанкуртуа работала на практике:
Войдите в хранилище объектов Музея науки и посмотрите, как работала трехмерная спиральная периодическая система Де Шанкуртуа.Что альтернативные периодические системы могут рассказать нам об элементах?
Коллекция Wellcome, CC BY 4.0
Крукс и его модель Гарри Фернисса, 1906 год.
Возможно, самой важной периодической системой после Менделеева была трехмерная двойная спиральная система английского ученого Уильяма Крукса в 1888 году.
Крукс добавил недавно открытые благородные газы (гелий, неон, аргон, криптон, ксенон, радон) к его системе, которая помогла убедить Менделеева, что его таблица может быть приспособлена для их размещения.
Но что более интересно, периодическая система Крукса иллюстрирует его теорию эволюции элементов. При этом элементы образовывались в плазме (горячем состоянии вещества) внутри звезд. Когда температура понизилась, они эволюционировали от самого легкого элемента, водорода, в верхней части его спирали, до самого тяжелого, урана, в нижней части.
При этом элементы образовывались в плазме (горячем состоянии вещества) внутри звезд. Когда температура понизилась, они эволюционировали от самого легкого элемента, водорода, в верхней части его спирали, до самого тяжелого, урана, в нижней части.
Оригинальная модель Крукса физически воплощает одну из первых эволюционных теорий элементов.
Модель спиральной периодической системы Уильяма Крукса, 1888 г.
Группа музея науки Дополнительная информация о модели, сделанной Уильямом Круксом его спиральной периодической системы, 1888 г.Является ли знаменитая периодическая таблица последней?
В погоне за окончательной таблицей было опубликовано около 700 альтернативных версий в столетие после таблицы Менделеева 1869 г..
Какой бы ни была их форма, от спиралей и спиралей до зигзагов, кругов и капель, их объединяет периодический закон — элементы распадаются на повторяющиеся группы, когда они упорядочены по возрастанию их атомных номеров.
В этой периодической таблице Химического общества ЕС элементы шкалы упорядочиваются по их относительной редкости.
CC BY-NDРасположение элементов по Александеру, разработанное Роем Александром в 1965 году.
Бастианов, CC BY-SA 4.0Версия периодической таблицы Джеймса Франклина Хайда, около 1975 г., с кремнием в центре.
Резмасон, CC BY-SA 4.0Периодическая таблица ADOMAH, составленная Валерием Циммерманом (2006 г.), основана на более ранней таблице Джанет (1928 г.).
ДеПиеп, CC BY-SA 3.0Но ни одна из них не завоевала звание окончательной таблицы.
Даже известная вам известная версия вызывает ожесточенные споры среди химиков о том, где следует размещать определенные группы или элементы, такие как водород. И по мере добавления новых элементов он будет продолжать развиваться.
В последние десятилетия Интернет открыл для широкой публики практику составления периодической таблицы. Помимо альтернативных форм, есть и альтернативное содержание: вы можете найти периодические таблицы почти всего, от вина до футбола.
Помимо альтернативных форм, есть и альтернативное содержание: вы можете найти периодические таблицы почти всего, от вина до футбола.
Такое распространение периодических таблиц не только отражает текущие научные усилия по классификации окружающего нас мира.
Это также показывает, как эти таблицы прошли путь от учебника до дизайна чайной кружки, насколько наука укоренилась в нашей культурной жизни.
Узнайте больше о периодических таблицах
Книги
- Шерри, Эрик Р. «Периодическая таблица: очень краткое введение». Оксфорд: ОУП, 2011. .
- Шерри, Эрик Р. Периодическая таблица: ее история и значение. Оксфорд: ОУП, 2007. .
- Мазурс, Эдвард Г. Графические изображения периодической системы за сто лет. Университет Алабамы, 1974. .
Онлайн
- Блог Музея науки, Периодическая таблица в трех измерениях
- Королевское химическое общество, Разработка периодической таблицы
- Природа, прославьте женщин, стоящих за периодической таблицей
- New Scientist, Up and atom: Борьба за помещение людей в периодическую таблицу
- BBC Bitesize, самые странные и удивительные элементы периодической таблицы
Узнать больше
Видео-урок: История периодической таблицы
Расшифровка видео
В этом видео мы узнаем, как
описать историю и развитие таблицы Менделеева, назвать ключевых людей
участвовали и обозначить их вклад.
Многие ученые пытались организовать известные элементы, чтобы понять их свойства и отношения. В 1789 году французский ученый Антуан Лавуазье опубликовал первый современный список элементов. Лавуазье выделил 33 элемента. на газы, металлы, неметаллы и земли. В 1817 году немецкий физик Иоганн Вольфганг Доберейнер сгруппировал элементы со схожими свойствами. Он назвал эти группы, которые часто содержал три элемента, триады.
В 1864 году британский химик Джон
Ньюлендс упорядочил 62 известных элемента, увеличив атомный вес. Ньюлендс заметил, что когда
элементы были перечислены в порядке атомной массы, каждый восьмой элемент имел аналогичную
поведение. Итак, он расположил элементы в
ряды и столбцы так, чтобы элементы все еще располагались в порядке атомного веса, но
элементы со схожими свойствами были сгруппированы вместе. Пять лет спустя новый периодический
будет предложена таблица, которая создаст основу для того, что в конечном итоге
стать современной версией периодической таблицы.
Пять лет спустя новый периодический
будет предложена таблица, которая создаст основу для того, что в конечном итоге
стать современной версией периодической таблицы.
В 1869 году русский химик Дмитрий
Менделеев опубликовал свою первую периодическую таблицу. Подобно Ньюлендсу, Менделеев организовал
элементы в строки и столбцы. Элементы увеличились в атомарном
вес вниз по колонке. И элементы, которые имели подобные
свойства были сгруппированы в одну строку. При построении этого периодического
В таблице Менделеев отметил, что теллур имеет сходные свойства с элементами кислорода,
сера и селен. Он также отметил, что йод
схожими свойствами с элементами брома, хлора и фтора. В результате он пришел к выводу, что
теллур и йод не следует перечислять в порядке возрастания атомного веса, поэтому
что теллур и йод стояли в одном ряду с элементами с аналогичными
характеристики. Теллур оказался постоянным
дилемма для Менделеева, так как атомный вес менялся несколько раз, пока он
составление его периодических таблиц.
Теллур оказался постоянным
дилемма для Менделеева, так как атомный вес менялся несколько раз, пока он
составление его периодических таблиц.
Менделеев тоже заметил, когда
упорядочив элементы, которые оказались отсутствующими. Когда не было элемента с
свойства, которые он ожидал, он оставил пробел для этих еще не открытых элементов. первая таблица Менделеева
не было совершенным, и все еще существовала некоторая неопределенность, особенно по мере того, как элементы
тяжелее. В 1871 году Менделеев пересмотрел свою
периодическая таблица. В его исправленной таблице было 12 строк и 8
столбцы. Он назвал каждую горизонтальную
строки – это период, а каждый из вертикальных столбцов – это группа. Современные периодические таблицы все еще используют
это различие. Элементы по-прежнему перечислены в
порядке возрастания атомного веса, на этот раз слева направо по периоду. И элементы, которые имели схожие
свойства были объединены в одну группу. Эта пересмотренная периодическая таблица до сих пор
были пробелы для элементов, которые еще предстояло открыть.
И элементы, которые имели схожие
свойства были объединены в одну группу. Эта пересмотренная периодическая таблица до сих пор
были пробелы для элементов, которые еще предстояло открыть.
Менделеев перечислил ожидаемые атомные веса этих элементов и даже предсказал их свойства на основе свойства элементов рядом с ними в его периодической таблице. Три наиболее заметных элемента Менделеев предсказал, что они должны иметь атомный вес 44, 68 и 72. Он назвал эти элементы эка-бором, эка-алюминий и эка-кремний. Каждый из этих элементов позже обнаружены и были обнаружены атомные веса и свойства, подобные тем, которые Менделеев предсказал. Помимо оставления пробелов для некоторых неоткрытых элементов, Менделеев также предложил новые атомные веса для нескольких элементы, которые, казалось, не подходили к его таблице.
Принятый атомный вес бериллия
в то время было 14, то же, что и азот. А вот у бериллия были похожие
свойствами элементов магния и кальция. Итак, Менделеев предложил атомную
вес 9,4 для того, чтобы эти элементы были сгруппированы вместе. Точно так же уран имел общепринятое
атомный вес 120. Но Менделеев предположил, что уран
должен иметь атомный вес 240, чтобы его можно было сгруппировать с элементом
вольфрам. Предложенные Менделеевым атомные веса
близки к принятым сегодня значениям. Бериллий имеет относительное атомное
масса 9, а относительная атомная масса урана 238,9.0024
А вот у бериллия были похожие
свойствами элементов магния и кальция. Итак, Менделеев предложил атомную
вес 9,4 для того, чтобы эти элементы были сгруппированы вместе. Точно так же уран имел общепринятое
атомный вес 120. Но Менделеев предположил, что уран
должен иметь атомный вес 240, чтобы его можно было сгруппировать с элементом
вольфрам. Предложенные Менделеевым атомные веса
близки к принятым сегодня значениям. Бериллий имеет относительное атомное
масса 9, а относительная атомная масса урана 238,9.0024
Хотя несколько аранжировок
элементы предшествовали периодической таблице Менделеева, его таблица часто получает
наибольшая заслуга и часто упоминается как первая таблица Менделеева. Но в таблице Менделеева были некоторые
недостатки. Менделеев оставил пробелы в своих
периодическая таблица неоткрытых элементов. Но он не оставил места ни для
предсказать существование элементов инертного газа. Кроме того, элементы медь,
серебро и золото имеют общие свойства с элементами первой группы, а некоторые
свойства с элементами восьмой группы. Итак, Менделеев перечислил каждое из этих
элементы дважды.
Но он не оставил места ни для
предсказать существование элементов инертного газа. Кроме того, элементы медь,
серебро и золото имеют общие свойства с элементами первой группы, а некоторые
свойства с элементами восьмой группы. Итак, Менделеев перечислил каждое из этих
элементы дважды.
Другая потенциальная проблема должна была сделать с разницей в атомных весах последовательных элементов. Атомный вес бора и углерода отличается на одну единицу. Но атомный вес углерода и азота отличались на две единицы. Это заставило некоторых ученых усомниться были ли еще неоткрытые элементы, которые принадлежали между некоторыми из элементов периодической таблицы Менделеева.
Больше недостатков стало очевидным по мере
были сделаны дальнейшие научные открытия. По мере открытия новых элементов
и атомные веса были измерены более точно, произошло больше случаев, подобных
Проблема с теллуром и йодом. Для каждой из этих пар
элемент с более высоким атомным весом должен быть указан первым, чтобы оба
элементы должны находиться в той же группе, что и элементы с аналогичными свойствами.
Для каждой из этих пар
элемент с более высоким атомным весом должен быть указан первым, чтобы оба
элементы должны находиться в той же группе, что и элементы с аналогичными свойствами.
О существовании изотопов еще не было другое осложнение. Изотопы – это атомы одного и того же элемент с разной атомной массой. Например, некоторые атомы элемент водород имеет атомную массу один, некоторые имеют атомную массу два, а другие имеют атомную массу три. Если периодическая таблица организована по атомному весу, то, возможно, потребуется перечислить каждый изотоп элемента отдельно. Основные открытия в начале 1900s поможет решить многие из этих проблем.
В 1911 г. по итогам
В эксперименте с золотой фольгой Эрнест Резерфорд предложил новую модель атома. В этой модели отрицательно заряженные
электроны вращаются вокруг центрального ядра. Ядро было заряжено положительно
и содержал большую часть массы атома. Вскоре после того, как Эрнест Резерфорд
предложение, голландский физик Антониус ван ден Брук предположил, что заряд
ядро было точно равно атомному номеру элемента. Атомный номер был положением
номер элемента в периодической таблице, где первый элемент в списке имел
атомный номер один, второй элемент имел атомный номер два и так далее.
Ядро было заряжено положительно
и содержал большую часть массы атома. Вскоре после того, как Эрнест Резерфорд
предложение, голландский физик Антониус ван ден Брук предположил, что заряд
ядро было точно равно атомному номеру элемента. Атомный номер был положением
номер элемента в периодической таблице, где первый элемент в списке имел
атомный номер один, второй элемент имел атомный номер два и так далее.
Теория Ван ден Брука была бы
доказано в 1913 году молодым британским физиком Генри Мозли. Генри Мозли разработал
эксперимент, чтобы наблюдать, как рентгеновские лучи, испускаемые элементом, дифрагировали. Когда питание было включено
элементный образец испускал рентгеновские лучи, которые дифрагировали на
фотопластинка. Каждый испытанный элемент произвел
уникальный рисунок линий на фотопластинке. По некоторым расчетам Мосли
смог напрямую связать рисунок линий с атомным строением элемента. количество.
количество.
Мозли провел свой эксперимент с элементами алюминия через золото и обнаружил, что дифракция рентгеновских лучей была непосредственно связано с атомным номером для всех известных элементов. Основываясь на своих выводах, Мозли предложил упорядочить элементы по возрастанию атомного номера, а не по атомный вес. Здесь мы показали элементы перечислены в порядке возрастания атомного номера в три строки. Но в оригинальной статье Мозли они были перечислены в одной колонке.
Организация элементов по атомарным
Число решило недостатки периодической таблицы Менделеева. Эта организация учитывала и
включены элементы инертного газа. И ни один элемент не повторялся больше
чем один раз. В отличие от атомного веса,
разница между атомными номерами последовательных элементов всегда была равна единице. Ед. изм. Кроме того, пары элементов
которые нужно было поменять местами при перечислении по атомному весу, были в правильном порядке, когда
перечислены по атомному номеру. Наконец, изотопы перестали быть
проблема, если элементы были перечислены по атомному номеру. Это связано с тем, что изотопы
элементы имеют разный атомный вес, у них одинаковый заряд ядра и
поэтому тот же атомный номер.
Ед. изм. Кроме того, пары элементов
которые нужно было поменять местами при перечислении по атомному весу, были в правильном порядке, когда
перечислены по атомному номеру. Наконец, изотопы перестали быть
проблема, если элементы были перечислены по атомному номеру. Это связано с тем, что изотопы
элементы имеют разный атомный вес, у них одинаковый заряд ядра и
поэтому тот же атомный номер.
Помимо устранения недостатков
с периодической таблицей Менделеева открытие Мозли имело важное значение еще для двух
причины. Как и Менделеев, Мозли предсказал
существование четырех неоткрытых элементов. Все четыре элемента будут
позже были обнаружены и названы технецием, прометием, гафнием и рением. Кроме того, эксперименты Мозли
предоставил конкретный способ определить, действительно ли вещество является новым элементом. Каждый элемент создавал уникальный
узор из линий на фотопластинке. Итак, если линии, произведенные
вещества отличались от известных элементов, то появился новый элемент.
обнаруженный. Работа Генри Мозли проложила путь
для современной таблицы Менделеева. Но еще больше открытий о
природа атома привела бы к периодической таблице, которую мы знаем сегодня.
Каждый элемент создавал уникальный
узор из линий на фотопластинке. Итак, если линии, произведенные
вещества отличались от известных элементов, то появился новый элемент.
обнаруженный. Работа Генри Мозли проложила путь
для современной таблицы Менделеева. Но еще больше открытий о
природа атома привела бы к периодической таблице, которую мы знаем сегодня.
В том же году, когда Мозли
предложил организовать элементы по атомному номеру, Нильс Бор предложил новую модель
атома. Бор предположил, что электроны в
атом вращается вокруг ядра в дискретных областях, называемых энергетическими уровнями. Модель Бора будет расширена
с годами, чтобы включить энергетические подуровни и орбитали. Затем, в 1920 г., Эрнест Резерфорд
опубликовал еще одно открытие. Он открыл новый субатомный
частица, называемая протоном. Протоны находятся в ядре
атом и имеют положительный заряд. Количество протонов в атоме
элемент равен заряду ядра, который равен атомному номеру.
Протоны находятся в ядре
атом и имеют положительный заряд. Количество протонов в атоме
элемент равен заряду ядра, который равен атомному номеру.
Современная версия периодического Таблица составлена на основе всех этих открытий. Современная таблица Менделеева организованы в 18 столбцов и семь строк. Так же, как и периодическая Менделеева. таблицы, вертикальные столбцы называются группами, а горизонтальные строки называются периоды. Основанный на работе Генри Мозли, элементы перечислены в порядке возрастания атомного номера слева направо по период. Можно также сказать, что элементы перечислены в порядке возрастания количества протонов слева направо в период.
Элементы также организованы
по тому, как электроны заполняют различные энергетические уровни и подуровни. Элементы, находящиеся в одной группе
имеют аналогичные свойства. Это связано с тем, что электроны в
атомы элементов одной группы имеют одинаковое электронное расположение. Кроме того, атомы элементов
найденные в один и тот же период, имеют одинаковое количество электронных оболочек или энергию
уровни.
Это связано с тем, что электроны в
атомы элементов одной группы имеют одинаковое электронное расположение. Кроме того, атомы элементов
найденные в один и тот же период, имеют одинаковое количество электронных оболочек или энергию
уровни.
Прежде чем подвести итог всему, что мы узнали об истории периодической таблицы, давайте взглянем на вопрос.
Символы и информация для пять элементов показаны ниже. Как бы эти элементы были упорядочены по периодической таблице Мозли?
Генри Мозли был британцем
ученый, который изучал, как дифрагируют рентгеновские лучи, испускаемые элементом. В своих экспериментах фотограф
пластина подверглась воздействию рентгеновских лучей. Рентгеновские лучи произвели линии на
пластина. Произведенные группы были уникальными для
каждый элемент. По некоторым расчетам Мозли
обнаружил, что образующиеся линии были напрямую связаны с атомным строением элемента. количество. Затем Мозли предположил, что
элементы в периодической таблице должны быть упорядочены по возрастанию атомного номера вместо
за счет увеличения атомного веса.
количество. Затем Мозли предположил, что
элементы в периодической таблице должны быть упорядочены по возрастанию атомного номера вместо
за счет увеличения атомного веса.
Итак, чтобы организовать пять элементов согласно периодической таблице Мозли, мы должны расположить их в порядке возрастания атомный номер. Атомный номер написан выше химический символ в каждой ячейке. Рассматривая варианты ответов, мы можно увидеть, что вариант ответа, который правильно перечисляет элементы, увеличивая атомный номер – вариант ответа (A). Поэтому правильный порядок элементов в соответствии с периодической таблицей Мозли является выбором ответа (А).
Теперь давайте подытожим то, что мы
научился. Раньше было много попыток
организовать элементы, чтобы понять их свойства и отношения. Дмитрий Менделеев, русский
ученый, часто приписывают создание первой таблицы Менделеева. Он организовал элементы по
увеличение атомного веса. Он также сгруппировал элементы с
похожие свойства в один и тот же столбец. Он назвал столбцы группами и
периоды строк, термины, которые мы до сих пор используем в современной периодической таблице.
Он организовал элементы по
увеличение атомного веса. Он также сгруппировал элементы с
похожие свойства в один и тот же столбец. Он назвал столбцы группами и
периоды строк, термины, которые мы до сих пор используем в современной периодической таблице.
Таблица Менделеева была особенный, потому что он оставил пробелы для неоткрытых элементов и предложил новые атомные веса для элементов, которые не подходили к его таблице. В периодической таблице Менделеева действительно было несколько недостатков, в том числе то, что он не учитывал инертные газы или изотопы и некоторые пары элементов нужно было записать в обратном порядке, чтобы они были сгруппированы с элементами, имеющими схожие свойства.
Генри Мозли был британцем
ученый, обнаруживший прямую связь между дифракцией рентгеновских лучей
структуру элемента и атомный номер элемента.



 Кстати, в 1900 году Д. И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
Кстати, в 1900 году Д. И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
 Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
 Каждый тип присоединения придает атому свойства, характерные для этого типа связи, поэтому в составе периодов таблицы Д.И. Менделеева давно выделены подгруппы, по типу S, P, D и F связи.
Каждый тип присоединения придает атому свойства, характерные для этого типа связи, поэтому в составе периодов таблицы Д.И. Менделеева давно выделены подгруппы, по типу S, P, D и F связи. При этом оказалось, что законы присоединения нуклонов исполняются настолько точно, что нам не составило большого труда рассчитать состав ядра конечных элементов VII периода, которые в таблице Д.И. Менделеева имеют номера 113, 114, 115, 116 и 118.
При этом оказалось, что законы присоединения нуклонов исполняются настолько точно, что нам не составило большого труда рассчитать состав ядра конечных элементов VII периода, которые в таблице Д.И. Менделеева имеют номера 113, 114, 115, 116 и 118.
 Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). Всего предложено несколько сотен вариантов изображения периодической системы (аналитических кривых, таблиц, геометрических фигур и т. п.). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.