J в таблице менделеева. Периодическая система химических элементов
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
Периодическая система химических элементов Д. И. Менделеева
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства.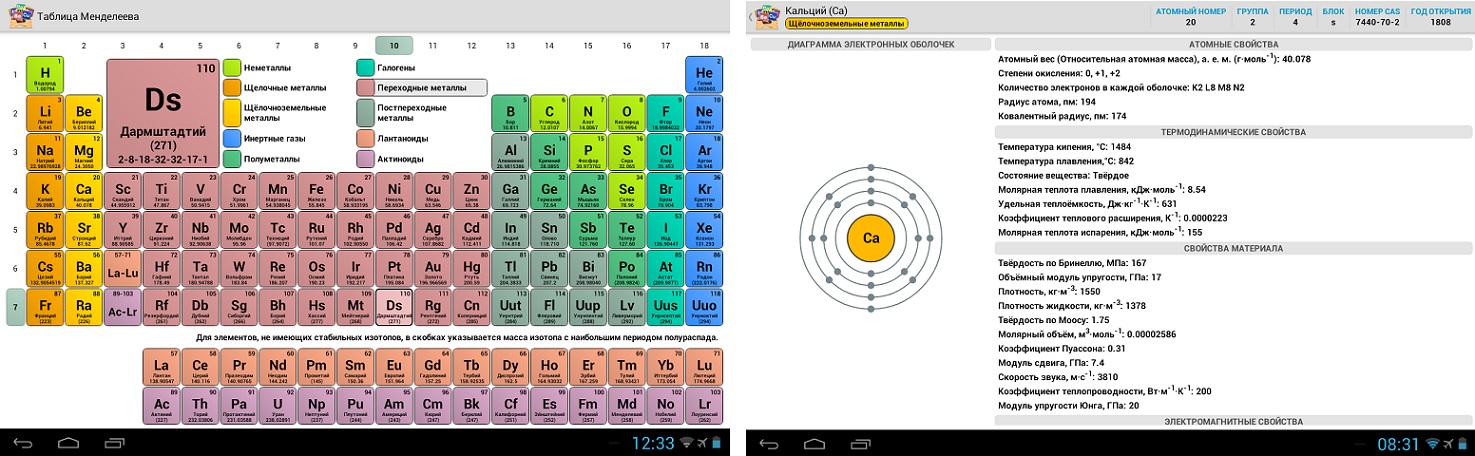 Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов .
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера) .
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом – 32, а в седьмом (пока незавершенном) – 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R 2 O, RO, R 2 O 3 , RO 2 , R 2 O 5 , RO 3 , R 2 O 7 , RO 4 , где символом R обозначают элемент данной группы.
Оксиды состава R 2 O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO 2 , R 2 O 5 , RO 3 , R 2 O 7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH 4 , RH 3 , RH 2 , RH.
Соединения RH 4 имеют нейтральный характер; RH 3 – слабоосновный; RH 2 – слабокислый; RH – сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.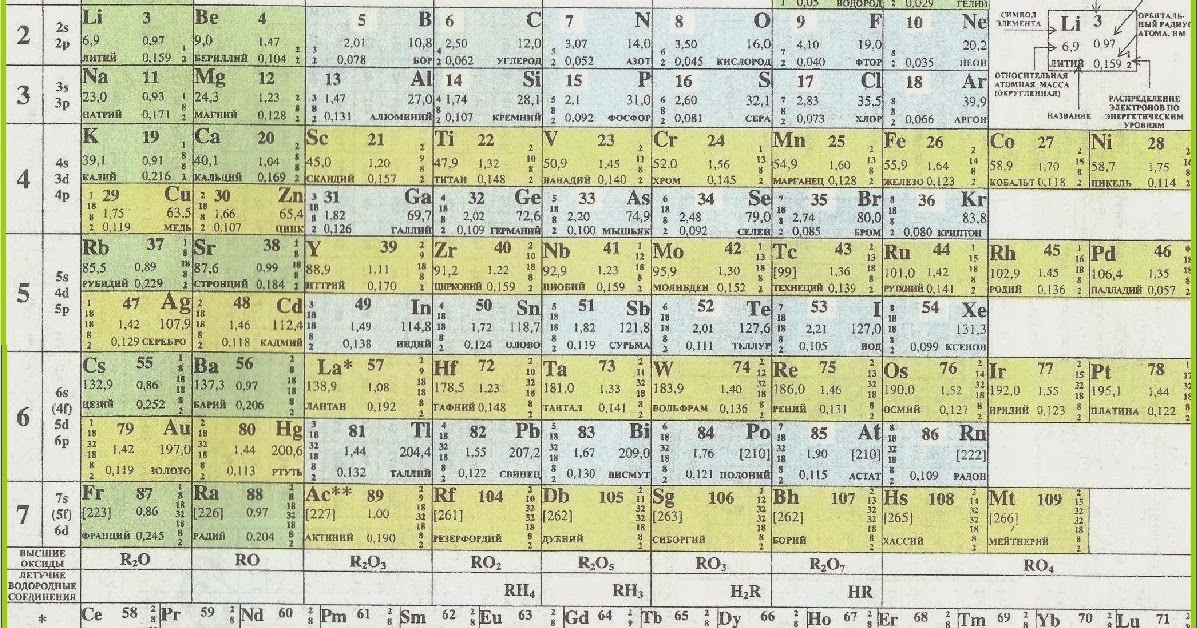
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы – мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию.
Показать / Скрыть текст
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды – это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и
Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и
Показать / Скрыть текст
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газах все электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
Переходные металлы
Переходные металлы занимают группы 3-12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13-16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
Постпереходными металлами
Элементы, называемые постпереходными металлами , относятся к группам 13-15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. И наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
Шаги
Часть 1
Структура таблицы
Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу).
Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
Как видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент. Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов.
 В некоторых таблицах его указывают в обеих группах.
В некоторых таблицах его указывают в обеих группах. - В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
Узнайте, почему в таблице присутствуют пустые ячейки. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 102 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.

Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода – 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними.
Часть 2
Обозначения элементовКаждый элемент обозначается одной или двумя латинскими буквами.
 Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
Обратите внимание на полное название элемента, если оно приведено в таблице. Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.

- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента. Элементы имеют атомные номера от 1 до 118.
- Атомный номер всегда является целым числом.
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!
Как пользоваться таблицей Менделеева?Для непосвященного человека читать таблицу Менделеева – все равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева, между прочим, если ей правильно пользоваться, может рассказать о мире очень многое. Помимо того, что сослужит Вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Помимо того, что сослужит Вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов. Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств. Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически. Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Современный вид таблицы Менделеева
Ниже приведем саму таблицу
Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды.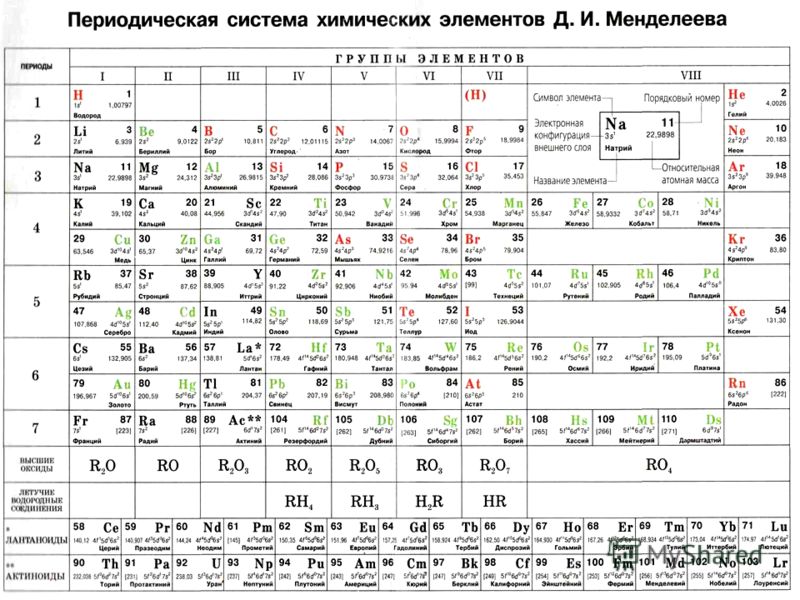 В таблице 18 групп и 8 периодов.
В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.
- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваютс я.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.
Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс “Таблица Менделеева для чайников”. В завершение, предлагаем Вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал Вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника. Именно поэтому, никогда не стоит забывать о , которые с радостью поделятся с Вами своими знаниями и опытом.
На данное время, в официально содержится 118 химических . Из них 94 обнаружены в природе, остальные 24 получены искусственно в результате ядерных реакций. Из всех химических в природе найдено 88; такие элементы, как технеций Tc , прометий Pm , астат At и франций Fr , а также все элементы, следующие за ураном U, впервые получены искусственно.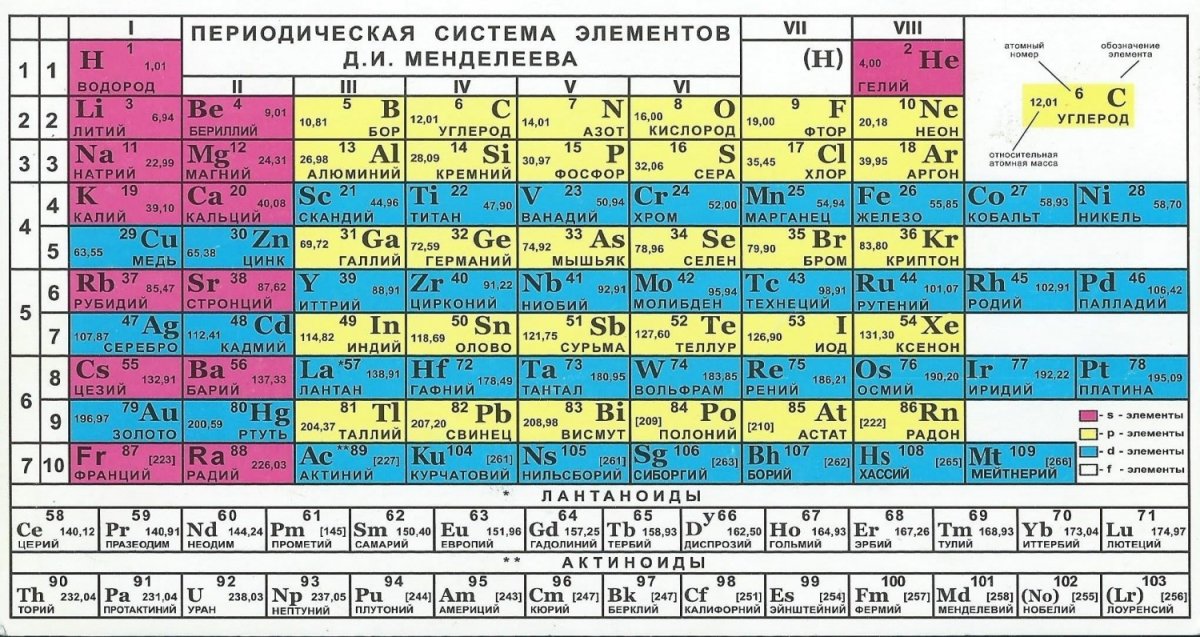 В обычных условиях соответствующие простые вещества для 11 элементов являются газами, для 2 – жидкостями, для остальных элементов – твёрдыми телами.
В обычных условиях соответствующие простые вещества для 11 элементов являются газами, для 2 – жидкостями, для остальных элементов – твёрдыми телами.
Стоит прочитать
Дмитрий Иванович Менделеев – русский учёный-энциклопедист, общественный деятель. Химик, физикохимик, физик, метролог, экономист, технолог, геолог, метеоролог, педагог, воздухоплаватель, приборостроитель. Профессор Санкт-Петербургского университета; член-корреспондент по разряду «физический» Императорской Санкт-Петербургской Академии наук. Среди наиболее известных открытий – периодический закон химических элементов, один из фундаментальных законов мироздания, неотъемлемый для всего естествознания.
Периодическая система химических элементов – классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д.И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869-1871 годах и устанавливал зависимость свойств элементов от их атомного веса. Всего предложено несколько сотен вариантов изображения периодической системы. В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу. К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно. Распространённее других являются 3 формы таблицы Менделеева: «короткая», «длинная» и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. Периодическая система Д.И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения.
И. Менделеевым в 1869-1871 годах и устанавливал зависимость свойств элементов от их атомного веса. Всего предложено несколько сотен вариантов изображения периодической системы. В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу. К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно. Распространённее других являются 3 формы таблицы Менделеева: «короткая», «длинная» и «сверхдлинная». В «сверхдлинном» варианте каждый период занимает ровно одну строчку. Периодическая система Д.И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения.
В таблицу Менделеева вписан новый элемент
Mn в таблице менделеева. Периодическая система химических элементов
Девятнадцатый век в истории человечества – век, в который многие науки реформировались, в том числе и химия.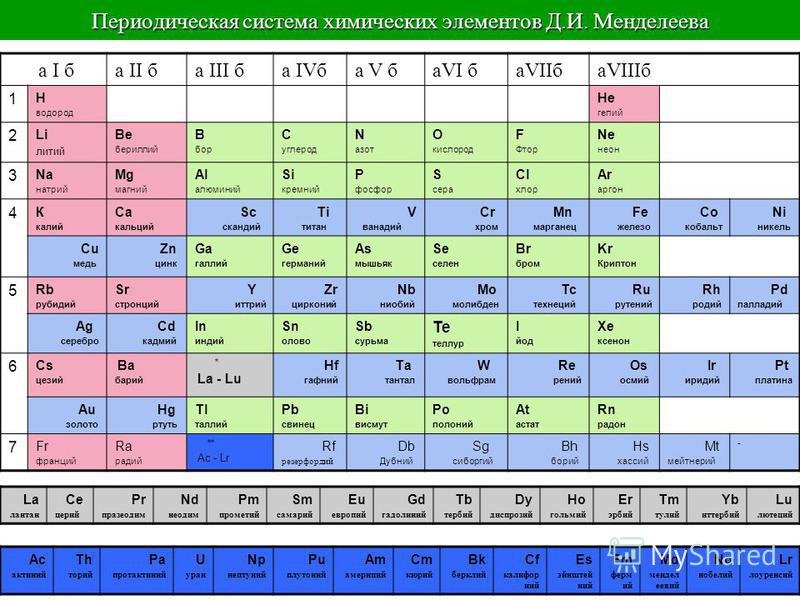 Именно в это время появилась периодическая система Менделеева, а вместе с ней – и периодический закон. Именно он стал основой современной химии. Периодическая система Д. И. Менделеева представляет собой систематизацию элементов, которая устанавливает зависимость химических и физических свойств от строения и заряда атома вещества.
Именно в это время появилась периодическая система Менделеева, а вместе с ней – и периодический закон. Именно он стал основой современной химии. Периодическая система Д. И. Менделеева представляет собой систематизацию элементов, которая устанавливает зависимость химических и физических свойств от строения и заряда атома вещества.
История
Начало периодической положила книга «Соотношение свойств с атомным весом элементов», написанная в третьей четверти XVII века. В ней были отображены основные понятия относительно известных химических элементов (на тот момент их насчитывалось всего 63). К тому же у многих из них атомные массы были определены неправильно. Это сильно мешало открытию Д. И. Менделеева.
Дмитрий Иванович начал свою работу со сравнения свойств элементов. В первую очередь он занялся хлором и калием, а уж потом перешёл к работе со щелочными металлами. Вооружась специальными карточками, на которых были изображены химические элементы, он многократно пытался собрать эту «мозаику»: раскладывал на своем столе в поисках нужных комбинаций и совпадений.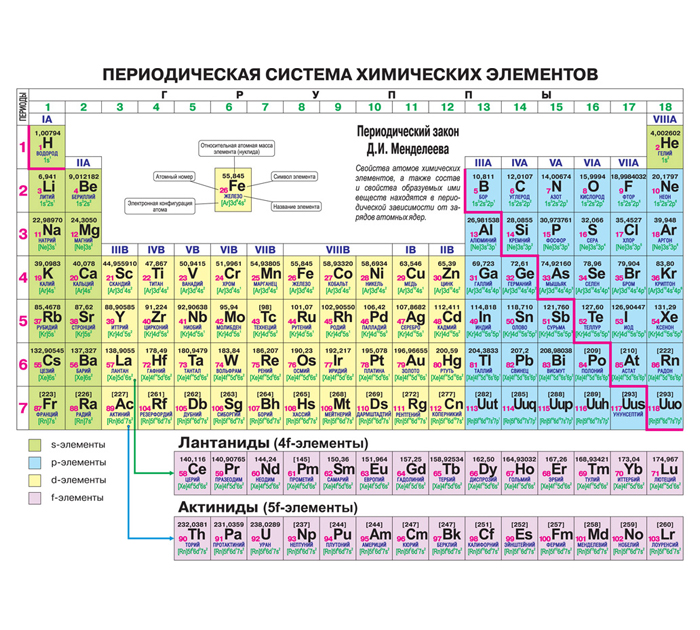
После долгих стараний Дмитрий Иванович все же нашёл ту закономерность, которую искал, и выстроил элементы в периодические ряды. Получив в результате пустые ячейки между элементами, учёный понял, что русским исследователям известны не все химические элементы, и что именно он должен дать этому миру те знания в области химии, которые ещё не были даны его предшественниками.
Всем известен миф о том, что Менделееву периодическая таблица явилась во сне, и он по памяти собрал элементы в единую систему. Это, грубо говоря, ложь. Дело в том, что Дмитрий Иванович довольно долго и сосредоточенно работал над своим трудом, и его это сильно выматывало. Во время работы над системой элементов Менделеев однажды заснул. Проснувшись, он понял, что не закончил таблицу, и скорее продолжил заполнение пустых ячеек. Его знакомый, некий Иностранцев, университетский педагог, решил, что таблица Менделееву приснилась во сне и распространил данный слух среди своих студентов. Так и появилась данная гипотеза.
Известность
Химических элементов Менделеева является отображением созданного Дмитрием Ивановичем ещё в третьей четверти XIX века (1869 год) периодического закона. Именно в 1869 году на заседании русского химического сообщества было зачитано уведомление Менделеева о создании им определённой структуры. И в этом же году была выпущена книга «Основы химии», в которой впервые была опубликована периодическая система химических элементов Менделеева. А в книге «Естественная система элементов и использование её к указанию качеств неоткрытых элементов» Д. И. Менделеев впервые упомянул понятие «периодический закон».
Структура и правила размещения элементов
Первые шаги в создании периодического закона были сделаны Дмитрием Ивановичем еще в 1869-1871 годах, в то время он усиленно работал над установлением зависимости свойств данных элементов от массы их атома. Современный вариант представляет собой сведённые в двумерную таблицу элементы.
Положение элемента в таблице несёт определённый химический и физический смысл. По местонахождению элемента в таблице можно узнать, какая у него валентность, определить и другие химические особенности. Дмитрий Иванович пытался установить связь между элементами, как сходными между собой по свойствам, так и отличающимися.
По местонахождению элемента в таблице можно узнать, какая у него валентность, определить и другие химические особенности. Дмитрий Иванович пытался установить связь между элементами, как сходными между собой по свойствам, так и отличающимися.
В основу классификации известных на тот момент химических элементов он положил валентность и атомную массу. Сопоставляя относительные свойства элементов, Менделеев пытался найти закономерность, которая объединила бы все известные химические элементы в одну систему. Расположив их, основываясь на возрастании атомных масс, он всё-таки добился периодичности в каждом из рядов.
Дальнейшее развитие системы
Появившаяся в 1969 году таблица Менделеева ещё не раз дорабатывалась. С появлением благородных газов в 1930 годах получилось выявить новейшую зависимость элементов – не от массы, а от порядкового номера. Позднее удалось установить число протонов в атомных ядрах, и оказалось, что оно совпадает с порядковым номером элемента. Учёными XX века было изучено электронное Оказалось, что и оно влияет на периодичность. Это сильно меняло представления о свойствах элементов. Данный пункт был отражён в более поздних редакциях периодической системы Менделеева. Каждое новое открытие свойств и особенностей элементов органично вписывалось в таблицу.
Это сильно меняло представления о свойствах элементов. Данный пункт был отражён в более поздних редакциях периодической системы Менделеева. Каждое новое открытие свойств и особенностей элементов органично вписывалось в таблицу.
Характеристики периодической системы Менделеева
Таблица Менделеева поделена на периоды (7 строк, расположенных горизонтально), которые, в свою очередь, подразделяются на большие и малые. Начинается период со щелочного металла, а заканчивается элементом с неметаллическими свойствами.
Вертикально таблица Дмитрия Ивановича поделена на группы (8 столбцов). Каждая из них в периодической системе состоит из двух подгрупп, а именно – главной и побочной. После долгих споров по предложению Д. И. Менделеева и его коллеги У. Рамзая было решено ввести так называемую нулевую группу. В неё входят инертные газы (неон, гелий, аргон, радон, ксенон, криптон). В 1911 году учёным Ф. Содди было предложено поместить в периодической системе и неразличимые элементы, так называемые изотопы, – для них были выделены отдельные ячейки.
Несмотря на верность и точность периодической системы, научное общество долго не хотело признавать данное открытие. Многие великие учёные высмеивали деятельность Д. И. Менделеева и считали, что невозможно предсказать свойства элемента, который ещё не был открыт. Но после того как предполагаемые химические элементы были открыты (а это были, например, скандий, галлий и германий), система Менделеева и его периодический закон стали науки химии.
Таблица в современности
Периодическая система элементов Менделеева – основа большинства химических и физических открытий, связанных с атомно-молекулярным учением. Современное понятие элемента сложилось как раз благодаря великому учёному. Появление периодической системы Менделеева внесло кардинальные изменения в представления о различных соединениях и простых веществах. Создание ученым периодической системы оказало огромное влияние на развитие химии и всех наук, смежных с ней.
Вероятно, все вы видели периодическую таблицу элементов. Возможно, что она и по сей день преследует вас в ваших снах, а может быть, она пока для вас всего лишь визуальный фон, украшающий стенку школьного класса. Однако в этой, казалось бы, случайной коллекции клеток кроется значительно больше, чем это кажется на первый взгляд.
Возможно, что она и по сей день преследует вас в ваших снах, а может быть, она пока для вас всего лишь визуальный фон, украшающий стенку школьного класса. Однако в этой, казалось бы, случайной коллекции клеток кроется значительно больше, чем это кажется на первый взгляд.
Периодическая таблица (или ПТ, как мы будем периодически называть её в этой статье), а также те элементы, которые входят в неё, обладают чертами, о которых вы, возможно, никогда не догадывались. Вот десять фактов, начиная от создания таблицы и до внесения в неё последних элементов, которые большинству людей не известны.
10. Менделееву помогали
Периодическая таблица стала использоваться, начиная с 1869 года, когда она была составлена заросшим густой бородой Димитрием Менделеевым. Большинство людей думает, что Менделеев был единственным, кто работал над этой таблицей, и благодаря этому он стал самым гениальным химиком столетия. Однако его усилиям помогали несколько европейских учёных, которые внесли важный вклад в завершение этого колоссального набора элементов.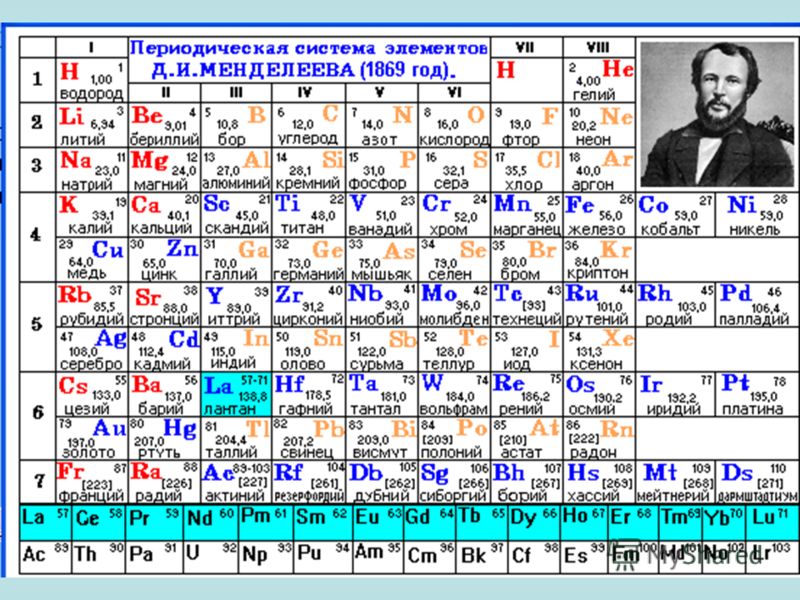
Менделеев широко известен как отец периодической таблицы, но, когда он её составлял, ещё не все элементы таблицы были уже открыты. Как такое стало возможно? Учёные славятся своим безумием…
9. Последние добавленные элементы
Верьте или нет, периодическая таблица не сильно менялась с 1950-х годов. Однако 2 декабря 2016 года было добавлено сразу четыре новых элемента: нихоний (элемент №113), московий (элемент №115), тенессин (элемент №117) и оганесон (элемент №118). Эти новые элементы получили свои названия только в июне 2016 года, так как потребовалась пятимесячная экспертиза, прежде чем их официально добавили в ПТ.
Три элемента получили свои названия в честь городов или государств, в которых их удалось получить, а оганесон был назван в честь российского физика-ядерщика Юрия Оганесяна за его вклад в получение этого элемента.
8. Какой буквы нет в таблице?
В латинском алфавите есть 26 букв, и каждая из них важна. Однако Менделеев решил этого не замечать. Взгляните на таблицу и скажите, какой букве не повезло? Подсказка: ищите по порядку и загибайте при этом пальцы после каждой найденной буквы. В итоге вы найдёте «пропавшую» букву (если у вас на руках присутствуют все десять пальцев). Догадались? Это буква под номером 10, буква «J».
Однако Менделеев решил этого не замечать. Взгляните на таблицу и скажите, какой букве не повезло? Подсказка: ищите по порядку и загибайте при этом пальцы после каждой найденной буквы. В итоге вы найдёте «пропавшую» букву (если у вас на руках присутствуют все десять пальцев). Догадались? Это буква под номером 10, буква «J».
Говорят, что «единица» – это цифра одиноких. Так, может, стоило бы назвать букву «J» буквой одиноких? Но вот забавный факт: большинство мальчиков, родившихся в США в 2000 году, получили имена, начинавшиеся с этой буквы. Таким образом, эта буква не осталась без должного внимания.
7. Синтезированные элементы
Как вы, возможно, уже знаете, на сегодняшний день в периодической таблице присутствует 118 элементов. Можете ли вы догадаться, сколько элементов из этих 118 были получены лабораторным путём? Из всего общего списка в природных условиях можно найти лишь 90 элементов.
Вам кажется, что 28 искусственно созданных элементов – это много? Ну, просто поверьте на слово. Их синтезируют, начиная с 1937 года, и учёные продолжают это делать и сейчас. Все эти элементы вы можете найти в таблице. Посмотрите на элементы с 95 по 118, все эти элементы отсутствуют на нашей планете и были синтезированы в лабораториях. То же касается и элементов под номерами 43, 61, 85 и 87.
Их синтезируют, начиная с 1937 года, и учёные продолжают это делать и сейчас. Все эти элементы вы можете найти в таблице. Посмотрите на элементы с 95 по 118, все эти элементы отсутствуют на нашей планете и были синтезированы в лабораториях. То же касается и элементов под номерами 43, 61, 85 и 87.
6. 137-й элемент
В середине 20-го века известный учёный по имени Ричард Фейнман сделал довольно громкое заявление, которое повергло в изумление весь научный мир нашей планеты. По его словам, если мы когда-нибудь обнаружим 137-й элемент, то мы не сможем определить количество в нём протонов и нейтронов. Число 1/137 примечательно тем, что это значение константы тонкой структуры, которая описывает вероятность поглощения или излучения электроном фотона. Теоретически элемент №137 должен иметь 137 электронов и 100-процентную вероятность поглощения фотона. Его электроны будут вращаться со скоростью света. Ещё более невероятно, что электроны элемента 139, чтобы существовать, должны вращаться быстрее, чем скорость света.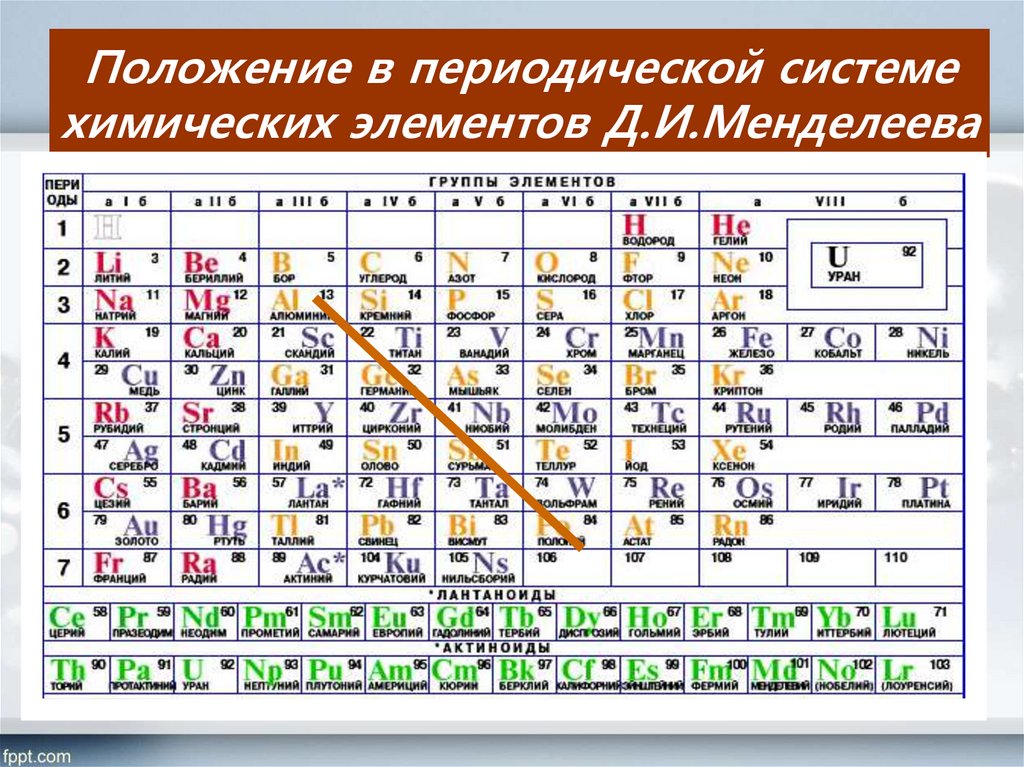
Вы ещё не устали от физики? Возможно, вам будет интересно узнать, что число 137 объединяет три важнейших области физики: теорию о скорости света, квантовую механику и электромагнетизм. С начала 1900-х годов физики предполагают, что цифра 137 может быть основой Великой единой теории, в которую войдут все три вышеуказанных области. По общему признанию, это звучит так же невероятно, как легенды о НЛО и о Бермудском треугольнике.
5. Что можно сказать о названиях?
Почти все названия элементов имеют какой-то смысл, хотя он и не сразу понятен. Названия новым элементам даются не произвольно. Я бы назвал элемент просто первым пришедшим мне в голову словом. Например, «керфлумп». По-моему, неплохо.
Как правило, названия элементов относятся к одной из пяти основных категорий. Первая – это имена известных учёных, классический вариант – эйнштейний. Кроме того, элементы могут получить свои имена в зависимости от тех мест, где они были впервые зарегистрированы, например, германий, америций, галлий и т. д. В качестве дополнительной опции используются названия планет. Элемент уран был впервые обнаружен вскоре после того, как была открыта планета Уран. Элементы могут носить имена, связанные с мифологией, например, существует титан, названный так в честь древнегреческих титанов, и торий, названный по имени скандинавского бога-громовержца (или звёздного «мстителя», в зависимости от того, что вы предпочитаете).
д. В качестве дополнительной опции используются названия планет. Элемент уран был впервые обнаружен вскоре после того, как была открыта планета Уран. Элементы могут носить имена, связанные с мифологией, например, существует титан, названный так в честь древнегреческих титанов, и торий, названный по имени скандинавского бога-громовержца (или звёздного «мстителя», в зависимости от того, что вы предпочитаете).
И, наконец, есть названия, описывающие свойства элементов. Аргон происходит от греческого слова «аргос», что означает «ленивый» или «медленный». Из названия следует предположение, что этот газ не отличается активностью. Бром – это ещё один элемент, название которого происходит от греческого слова. «Бромос» означает «зловоние», и это довольно точно описывает запах брома.
4. Было ли создание таблицы «озарением»
Если вы любите карточные игры, то этот факт для вас. Менделееву требовалось каким-то образом упорядочить все элементы и найти систему для этого. Естественно, что для создания таблицы по категориям он обратился к пасьянсу (ну, а к чему же ещё?) Менделеев записал атомный вес каждого элемента на отдельной карточке, а затем приступил к раскладке своего передового пасьянса. Он укладывал элементы в соответствии с их специфическими свойствами, а затем упорядочивал их в каждом столбце в соответствии с их атомным весом.
Естественно, что для создания таблицы по категориям он обратился к пасьянсу (ну, а к чему же ещё?) Менделеев записал атомный вес каждого элемента на отдельной карточке, а затем приступил к раскладке своего передового пасьянса. Он укладывал элементы в соответствии с их специфическими свойствами, а затем упорядочивал их в каждом столбце в соответствии с их атомным весом.
Многие не могут сложить и обычный пасьянс, так что этот пасьянс впечатляет. Что будет дальше? Наверное, кто-нибудь с помощью шахмат сделает переворот в астрофизике или создаст ракету, способную долететь до окраин галактики. Представляется, что в этом не будет ничего необычного, если учесть, что Менделеев сумел получить такой гениальный результат всего лишь с помощью колоды обычных игральных карт.
3. Невезучие инертные газы
Помните, как мы классифицировали аргон как самый «ленивый» и «медленный» элемент в истории нашей вселенной? Похоже, что Менделеевым овладели такие же чувства. Когда в 1894 году впервые удалось получить чистый аргон, он не вписывался ни в один из столбцов таблицы, поэтому, вместо того чтобы заняться поисками решения, учёный решил просто отрицать его существование.
Когда в 1894 году впервые удалось получить чистый аргон, он не вписывался ни в один из столбцов таблицы, поэтому, вместо того чтобы заняться поисками решения, учёный решил просто отрицать его существование.
Ещё более поразительно, что аргон был не единственным элементом, который изначально постигла эта судьба. Помимо аргона, без классификации остались ещё пять других элементов. Это коснулось радона, неона, криптона, гелия и ксенона – и все отрицали их существование просто потому, что Менделеев не смог найти для них места в таблице. После нескольких лет перегруппировки и переклассификации этим элементам (названных инертными газами) всё-таки посчастливилось присоединиться к достойному клубу признанных реально существующими.
2. Атомная любовь
Совет для всех тех, кто считает себя романтиком. Возьмите бумажную копию периодической таблицы и вырежьте из неё все сложные и относительно ненужные средние столбцы так, чтобы у вас осталось 8 колонок (вы получите «короткую» форму таблицы).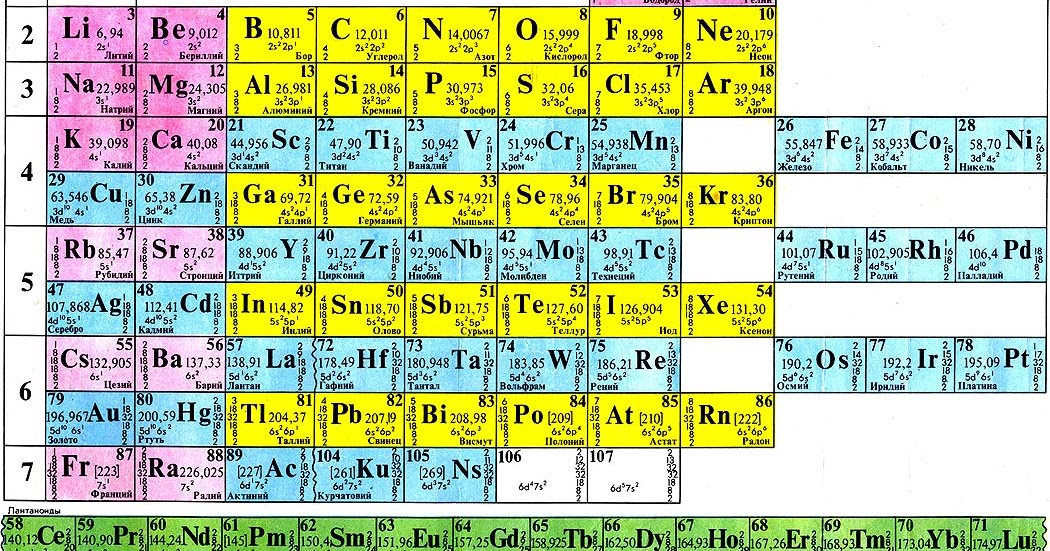 Сложите её посредине IV группы – и вы узнаете, какие элементы могут образовывать соединения друг с другом.
Сложите её посредине IV группы – и вы узнаете, какие элементы могут образовывать соединения друг с другом.
Элементы, которые «целуются» при складывании, способны образовывать стабильные соединения. Эти элементы имеют комплементарные электронные структуры, и они будут сочетаться друг с другом. И, если это не настоящая любовь, как у Ромео с Джульеттой или у Шрека с Фионой – тогда я не знаю, что такое любовь.
1. Углерод рулит
Углерод пытается быть в центре игры. Вы думаете, что всё знаете об углероде, но это не так, он занимает намного более важное место, чем вы это себе представляете. Знаете ли вы, что он присутствует более чем в половине всех известных соединений? И как насчёт того факта, что 20 процентов веса всех живых организмов приходится на углерод? Это действительно странно, но приготовьтесь: каждый атом углерода в вашем теле был когда-то частью фракции углекислого газа в атмосфере. Углерод является не только суперэлементом нашей планеты, он четвёртый по численности элемент во всей Вселенной.
Если периодическую таблицу сравнить с вечеринкой, то углерод – её главный ведущий. И кажется, что он единственный знает, как нужно всё правильно организовать. Ну и, помимо прочего, это основной элемент всех бриллиантов, так что при всей своей назойливости он ещё и блестит!
Открытие Дмитрием Менделеевым периодической таблицы химических элементов в марте 1869 года стало настоящим прорывом в химии. Российскому ученому удалось систематизировать знания о химических элементах и представить их в виде таблицы, которую и сейчас обязательно изучают школьники на уроках химии. Периодическая таблица стала фундаментом для бурного развития этой сложной и интересной науки, а история ее открытия окутана легендами и мифами. Для всех увлекающихся наукой будет интересно узнать правду о том, как Менделеев открыл таблицу периодических элементов.
История таблицы Менделеева: как все начиналось
Попытки классифицировать и систематизировать известные химические элементы предпринимались задолго до Дмитрия Менделеева. Свои системы элементов предлагали такие известные ученые, как Деберейнер, Ньюлендс, Мейер и другие. Однако из-за нехватки данных о химических элементах и их правильных атомных массах предложенные системы были не совсем достоверными.
Свои системы элементов предлагали такие известные ученые, как Деберейнер, Ньюлендс, Мейер и другие. Однако из-за нехватки данных о химических элементах и их правильных атомных массах предложенные системы были не совсем достоверными.
История открытия таблицы Менделеева начинается в 1869 году, когда российский ученый на заседании Русского химического общества рассказал своим коллегам о сделанном им открытии. В предложенной ученым таблице химические элементы располагались в зависимости от их свойств, обеспечивающихся величиной их молекулярной массы.
Интересной особенностью таблицы Менделеева было также наличие пустых клеток, которые в будущем были заполнены открытыми химическими элементами, предсказанными ученым (германий, галлий, скандий). После открытия периодической таблицы в нее много раз вносились добавления и поправки. Совместно с шотландским химиком Уильямом Рамзаем Менделеев добавил в таблицу группу инертных газов (нулевую группу).
В дальнейшем история периодической таблицы Менделеева была напрямую связана с открытиями в другой науке – физике. Работа над таблицей периодических элементов продолжается до сих пор, и современные ученые добавляют новые химические элементы по мере их открытия. Значение периодической системы Дмитрия Менделеева сложно переоценить, так как благодаря ей:
Работа над таблицей периодических элементов продолжается до сих пор, и современные ученые добавляют новые химические элементы по мере их открытия. Значение периодической системы Дмитрия Менделеева сложно переоценить, так как благодаря ей:
- Систематизировались знания о свойствах уже открытых химических элементов;
- Появилась возможность прогнозирования открытия новых химических элементов;
- Начали развиваться такие разделы физики, как физика атома и физика ядра;
Существует множество вариантов изображения химических элементов согласно периодическому закону, однако наиболее известный и распространенный вариант – это привычная для каждого таблица Менделеева.
Мифы и факты о создании периодической таблицы
Самым распространенным заблуждением в истории открытия таблицы Менделеева является то, что ученый увидел ее во сне. На самом деле сам Дмитрий Менделеев опроверг этот миф и заявил, что размышлял над периодическим законом на протяжении многих лет. Чтобы систематизировать химические элементы он выписывал каждый из них на отдельную карточку и многократно комбинировал их между собой, расставляя в ряды в зависимости от их схожих свойств.
Чтобы систематизировать химические элементы он выписывал каждый из них на отдельную карточку и многократно комбинировал их между собой, расставляя в ряды в зависимости от их схожих свойств.
Миф о «вещем» сне ученого можно объяснить тем, что Менделеев работал над систематизацией химических элементов сутками напролет, прерываясь на непродолжительный сон. Однако только упорный труд и природный талант ученого дал долгожданный результат и обеспечил Дмитрию Менделееву всемирную известность.
Многих учащихся в школе, а иногда и в университете, заставляютзаучивать или хотя бы примерно ориентироваться в таблице Менделеева. Для этого человек должен не только иметь хорошую память, но и логически мыслить, связывая элементы в отдельные группы и классы. Изучение таблицы легче всего дается тем людям, которые постоянно поддерживают мозг в тонусе, проходя тренинги на BrainApps.
Любой, кто ходил в школу, помнит, что одним из обязательных для изучения предметов была химия. Она могла нравиться, а могла и не нравиться – это не важно. И вполне вероятно, что многие знания по этой дисциплине уже забыты и в жизни не применяются. Однако таблицу химических элементов Д. И. Менделеева наверняка помнит каждый. Для многих она так и осталась разноцветной таблицей, где в каждый квадратик вписаны определённые буквы, обозначающие названия химических элементов. Но здесь мы не будем говорить о химии как таковой, и описывать сотни химических реакций и процессов, а расскажем о том, как вообще появилась таблица Менделеева – эта история будет интересна любому человеку, да и вообще всем тем, кто охоч до интересной и полезной информации.
И вполне вероятно, что многие знания по этой дисциплине уже забыты и в жизни не применяются. Однако таблицу химических элементов Д. И. Менделеева наверняка помнит каждый. Для многих она так и осталась разноцветной таблицей, где в каждый квадратик вписаны определённые буквы, обозначающие названия химических элементов. Но здесь мы не будем говорить о химии как таковой, и описывать сотни химических реакций и процессов, а расскажем о том, как вообще появилась таблица Менделеева – эта история будет интересна любому человеку, да и вообще всем тем, кто охоч до интересной и полезной информации.
Небольшая предыстория
В далёком 1668 году выдающимся ирландским химиком, физиком и богословом Робертом Бойлем была опубликована книга, в которой было развенчано немало мифов об алхимии, и в которой он рассуждал о необходимости поиска неразложимых химических элементов. Учёный также привёл их список, состоящий всего из 15 элементов, но допускал мысль о том, что могут быть ещё элементы. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов. 23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учёными по всему миру. И главную роль в этом процессе сыграл знаменитый русский химик Дмитрий Иванович Менделеев – он впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
Благодаря кропотливому труду и сопоставлению химических элементов Менделеев смог обнаружить связь между элементами, в которой они могут быть одним целым, а их свойства являются не чем-то само собой разумеющимся, а представляют собой периодически повторяющееся явление. В итоге, в феврале 1869 года Менделеев сформулировал первый периодический закон, а уже в марте его доклад «Соотношение свойств с атомным весом элементов» был представлен на рассмотрение Русского химического общества историком химии Н. А. Меншуткиным. Затем в том же году публикация Менделеева была напечатана в журнале «Zeitschrift fur Chemie» в Германии, а в 1871 году новую обширную публикацию учёного, посвящённую его открытию, опубликовал другой немецкий журнал «Annalen der Chemie».
Создание периодической таблицы
Основная идея к 1869 году уже была сформирована Менделеевым, причём за довольно короткое время, но оформить её в какую-либо упорядоченную систему, наглядно отображающую, что к чему, он долго не мог. В одном из разговоров со своим соратником А. А. Иностранцевым он даже сказал, что в голове у него уже всё сложилось, но вот привести всё к таблице он не может. После этого, согласно данным биографов Менделеева, он приступил к кропотливой работе над своей таблицей, которая продолжалась трое суток без перерывов на сон. Перебирались всевозможные способы организации элементов в таблицу, а работа была осложнена ещё и тем, что в тот период наука знала ещё не обо всех химических элементах. Но, несмотря на это, таблица всё же была создана, а элементы систематизированы.
Легенда о сне Менделеева
Многие слышали историю, что Д. И. Менделееву его таблица приснилась. Эта версия активно распространялась вышеупомянутым соратником Менделеева А. А. Иностранцевым в качестве забавной истории, которой он развлекал своих студентов. Он говорил, что Дмитрий Иванович лёг спать и во сне отчётливо увидел свою таблицу, в которой все химические элементы были расставлены в нужном порядке. После этого студенты даже шутили, что таким же способом была открыта 40° водка. Но реальные предпосылки для истории со сном всё же были: как уже упоминалось, Менделеев работал над таблицей без сна и отдыха, и Иностранцев однажды застал его уставшим и вымотанным. Днём Менделеев решил немного передохнуть, а некоторое время спустя, резко проснулся, сразу же взял листок бумаги и изобразил на нём уже готовую таблицу. Но сам учёный опровергал всю эту историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.
А. Иностранцевым в качестве забавной истории, которой он развлекал своих студентов. Он говорил, что Дмитрий Иванович лёг спать и во сне отчётливо увидел свою таблицу, в которой все химические элементы были расставлены в нужном порядке. После этого студенты даже шутили, что таким же способом была открыта 40° водка. Но реальные предпосылки для истории со сном всё же были: как уже упоминалось, Менделеев работал над таблицей без сна и отдыха, и Иностранцев однажды застал его уставшим и вымотанным. Днём Менделеев решил немного передохнуть, а некоторое время спустя, резко проснулся, сразу же взял листок бумаги и изобразил на нём уже готовую таблицу. Но сам учёный опровергал всю эту историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.
Дальнейшая работа
В период с 1869 по 1871 годы Менделеев развивал идеи периодичности, к которым склонялось научное сообщество. И одним из важных этапов данного процесса стало понимание того, что любой элемент в системе должно располагать, исходя из совокупности его свойств в сравнении со свойствами остальных элементов. Основываясь на этом, а также опираясь на результаты исследований в изменении стеклообразующих оксидов, химику удалось внести поправки в значения атомных масс некоторых элементов, среди которых были уран, индий, бериллий и другие.
И одним из важных этапов данного процесса стало понимание того, что любой элемент в системе должно располагать, исходя из совокупности его свойств в сравнении со свойствами остальных элементов. Основываясь на этом, а также опираясь на результаты исследований в изменении стеклообразующих оксидов, химику удалось внести поправки в значения атомных масс некоторых элементов, среди которых были уран, индий, бериллий и другие.
Пустые клетки, остававшиеся в таблице, Менделеев, конечно же, хотел скорее заполнить, и в 1870 году предсказал, что в скором времени будут открыты неизвестные науке химические элементы, атомные массы и свойства которых он сумел вычислить. Первыми из них стали галлий (открыт в 1875 году), скандий (открыт в 1879 году) и германий (открыт в 1885 году). Затем прогнозы продолжили реализовываться, и были открыты ещё восемь новых элементов, среди которых: полоний (1898 год), рений (1925 год), технеций (1937 год), франций (1939 год) и астат (1942-1943 годы). Кстати, в 1900 году Д. И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
Организация периодической системы
Химические элементы в таблице Д. И. Менделеева расположены по рядам, в соответствии с возрастанием их массы, а длина рядов подобрана так, чтобы находящиеся в них элементы имели схожие свойства. Например, благородные газы, такие как радон, ксенон, криптон, аргон, неон и гелий с трудом вступают в реакции с другими элементами, а также имеют низкую химическую активность, из-за чего расположены в крайнем правом столбце. А элементы левого столбца (калий, натрий, литий и т.д.) отлично реагируют с прочими элементами, а сами реакции носят взрывной характер. Говоря проще, внутри каждого столбца элементы имеют подобные свойства, варьирующиеся при переходе от одного столбца к другому. Все элементы, вплоть до №92 встречаются в природе, а с №93 начинаются искусственные элементы, которые могут быть созданы лишь в лабораторных условиях.
В своём первоначальном варианте периодическая система понималась только как отражение существующего в природе порядка, и никаких объяснений, почему всё должно обстоять именно так, не было. И лишь когда появилась квантовая механика, истинный смысл порядка элементов в таблице стал понятен.
Уроки творческого процесса
Говоря о том, какие уроки творческого процесса можно извлечь из всей истории создания периодической таблицы Д. И. Менделеева, можно привести в пример идеи английского исследователя в области творческого мышления Грэма Уоллеса и французского учёного Анри Пуанкаре. Приведём их вкратце.
Согласно исследованиям Пуанкаре (1908 год) и Грэма Уоллеса (1926 год), существует четыре основных стадии творческого мышления:
- Подготовка – этап формулирования основной задачи и первые попытки её решения;
- Инкубация – этап, во время которого происходит временное отвлечение от процесса, но работа над поиском решения задачи ведётся на подсознательном уровне;
- Озарение – этап, на котором находится интуитивное решение.
 Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации; - Проверка – этап испытаний и реализации решения, на котором происходит проверка этого решения и его возможное дальнейшее развитие.
Как мы видим, в процессе создания своей таблицы Менделеев интуитивно следовал именно этим четырём этапам. Насколько это эффективно, можно судить по результатам, т.е. по тому, что таблица была создана. А учитывая, что её создание стало огромным шагом вперёд не только для химической науки, но и для всего человечества, приведённые выше четыре этапа могут быть применимы как к реализации небольших проектов, так и к осуществлению глобальных замыслов. Главное помнить, что ни одно открытие, ни одно решение задачи не могут быть найдены сами по себе, как бы ни хотели мы увидеть их во сне и сколько бы ни спали. Чтобы что-то получилось, не важно, создание это таблицы химических элементов или разработка нового маркетинг-плана, нужно обладать определёнными знаниями и навыками, а также умело использовать свои потенциал и упорно работать.
Мы желаем вам успехов в ваших начинаниях и успешной реализации задуманного!
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
Периодическая система химических элементов Д. И. Менделеева
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства.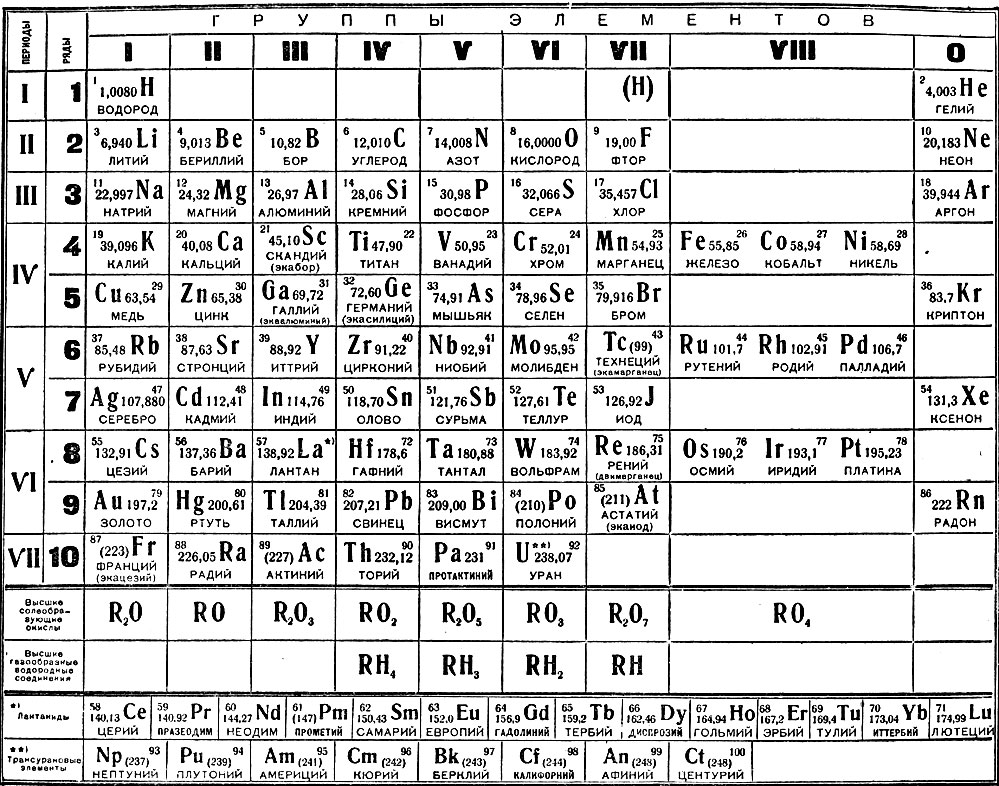 Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов .
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера) .
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов.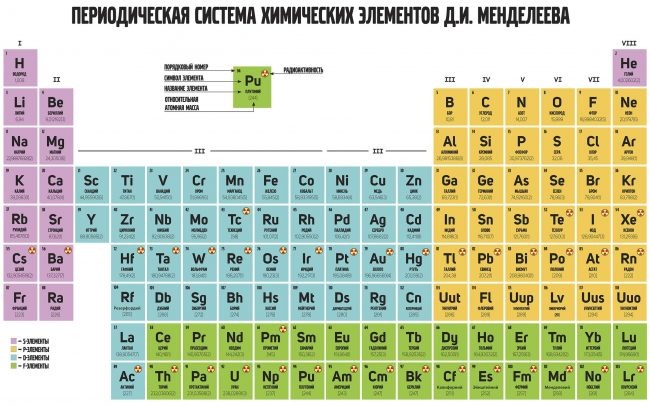 Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом – 32, а в седьмом (пока незавершенном) – 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R 2 O, RO, R 2 O 3 , RO 2 , R 2 O 5 , RO 3 , R 2 O 7 , RO 4 , где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R 2 O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO 2 , R 2 O 5 , RO 3 , R 2 O 7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH 4 , RH 3 , RH 2 , RH.
Соединения RH 4 имеют нейтральный характер; RH 3 – слабоосновный; RH 2 – слабокислый; RH – сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы – мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды – это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы.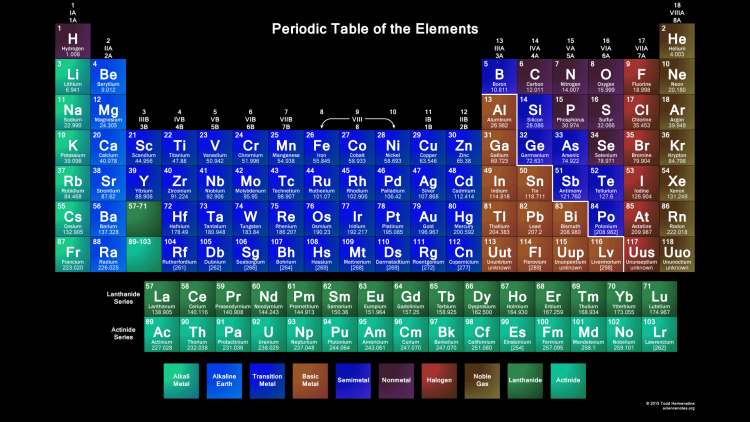 Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газах все электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
Переходные металлы
Переходные металлы занимают группы 3-12 в периодической таблице.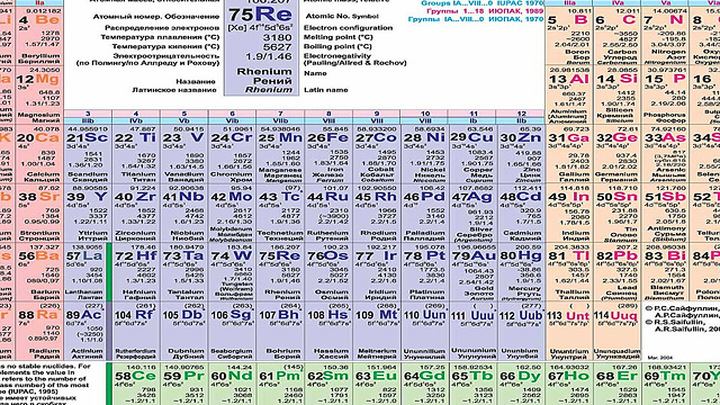 Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13-16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
Постпереходными металлами
Элементы, называемые постпереходными металлами , относятся к группам 13-15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Как расположены металлы в периодической таблице менделеева
Главная » Разное » Как расположены металлы в периодической таблице менделеева
Таблица Менделеева для чайников – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
Периодическая система химических элементов Д. И. Менделеева
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов.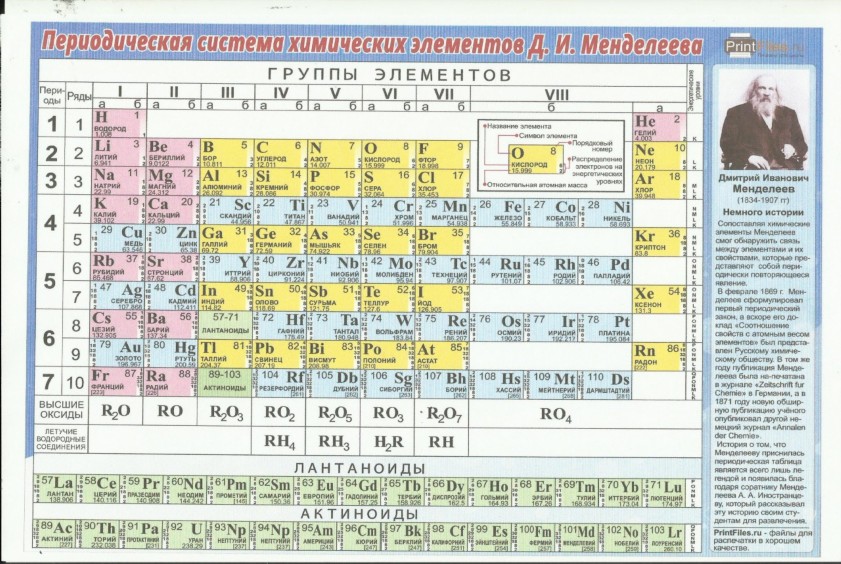 Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2 O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Как элементы сгруппированы в Периодической таблице?
В конце 19 века русский химик Дмитрий Менделеев опубликовал свою первую попытку сгруппировать химические элементы по их атомному весу. В то время было известно только около 60 элементов, но Менделеев понял, что, когда элементы были организованы по весу, определенные типы элементов возникали через равные промежутки времени или периоды.
Сегодня, 150 лет спустя, химики официально признают 118 элементов (после добавления четырех новичков в 2016 году) и до сих пор используют периодическую таблицу элементов Менделеева для их организации.Таблица начинается с простейшего атома, водорода, а затем упорядочиваются остальные элементы по атомному номеру, который представляет собой количество протонов, содержащихся в каждом. За некоторыми исключениями порядок элементов соответствует возрастающей массе каждого атома.
За некоторыми исключениями порядок элементов соответствует возрастающей массе каждого атома.
В таблице семь строк и 18 столбцов. Каждая строка представляет один период; номер периода элемента показывает, сколько из его энергетических уровней содержат электроны. Натрий, например, находится в третьем периоде, что означает, что атом натрия обычно имеет электроны на первых трех энергетических уровнях.Двигаясь вниз по таблице, периоды становятся длиннее, потому что для заполнения более крупных и сложных внешних уровней требуется больше электронов.
Столбцы таблицы представляют группы или семейства элементов. Элементы в группе часто выглядят и ведут себя одинаково, потому что у них одинаковое количество электронов во внешней оболочке – лице, которое они показывают миру. Элементы группы 18, например, в крайней правой части таблицы, имеют полностью сплошные внешние оболочки и редко участвуют в химических реакциях.
Элементы обычно классифицируются как металлические или неметаллические, но разделительная линия между ними нечеткая. Металлические элементы обычно являются хорошими проводниками электричества и тепла. Подгруппы металлов основаны на схожих характеристиках и химических свойствах этих коллекций. Согласно данным Лос-Аламосской национальной лаборатории, в нашем описании периодической таблицы элементов используются общепринятые группы элементов.
Металлические элементы обычно являются хорошими проводниками электричества и тепла. Подгруппы металлов основаны на схожих характеристиках и химических свойствах этих коллекций. Согласно данным Лос-Аламосской национальной лаборатории, в нашем описании периодической таблицы элементов используются общепринятые группы элементов.
Щелочные металлы: Щелочные металлы составляют большую часть Группы 1, первого столбца таблицы.Эти блестящие и достаточно мягкие, чтобы разрезать ножом, эти металлы начинаются с лития (Li) и заканчиваются францием (Fr). Они также чрезвычайно реактивны и воспламеняются или даже взрываются при контакте с водой, поэтому химики хранят их в маслах или инертных газах. Водород с одним электроном также находится в группе 1, но газ считается неметаллом.
Щелочно-земельные металлы: Щелочноземельные металлы составляют 2-ю группу периодической таблицы, от бериллия (Be) до радия (Ra).Каждый из этих элементов имеет два электрона на внешнем энергетическом уровне, что делает щелочноземельные земли достаточно реактивными, поэтому их редко можно найти в природе в одиночку. Но они не так реактивны, как щелочные металлы. Их химические реакции обычно протекают медленнее и выделяют меньше тепла по сравнению с щелочными металлами.
Но они не так реактивны, как щелочные металлы. Их химические реакции обычно протекают медленнее и выделяют меньше тепла по сравнению с щелочными металлами.
Lanthanides: Третья группа слишком длинна, чтобы поместиться в третий столбец, поэтому она вырывается и переворачивается боком, чтобы стать верхней строкой острова, который плавает в нижней части таблицы.Это лантаноиды, элементы с 57 по 71 – от лантана (La) до лютеция (Lu). Элементы этой группы имеют серебристо-белый цвет и тускнеют при контакте с воздухом.
Актиниды: Актиниды выстилают нижний ряд острова и включают элементы от 89, актиний (Ac) до 103, лоуренсий (Lr). Из этих элементов только торий (Th) и уран (U) встречаются на Земле в значительных количествах. Все радиоактивны. Актиниды и лантаноиды вместе образуют группу, называемую внутренними переходными металлами.
Переходные металлы: Возвращаясь к основной части таблицы, остатки групп с 3 по 12 представляют остальные переходные металлы. Твердые, но пластичные, блестящие и обладающие хорошей проводимостью, эти элементы – это то, о чем вы обычно думаете, когда слышите слово «металл». Здесь живут многие из лучших хитов металлического мира, включая золото, серебро, железо и платину.
Твердые, но пластичные, блестящие и обладающие хорошей проводимостью, эти элементы – это то, о чем вы обычно думаете, когда слышите слово «металл». Здесь живут многие из лучших хитов металлического мира, включая золото, серебро, железо и платину.
Металлы после перехода: В преддверии перехода в мир неметаллов общие характеристики не разделены четко по вертикальным групповым линиям.Постпереходными металлами являются алюминий (Al), галлий (Ga), индий (In), таллий (Tl), олово (Sn), свинец (Pb) и висмут (Bi), и они охватывают группы с 13 по 17. Эти элементы обладают некоторыми из классических характеристик переходных металлов, но они, как правило, более мягкие и проводят хуже, чем другие переходные металлы. Во многих периодических таблицах жирным шрифтом будет выделена линия «лестницы» под диагональю, соединяющей бор с астатом. Постпереходные металлы расположены в нижнем левом углу этой линии.
Металлоиды: Металлоиды – это бор (B), кремний (Si), германий (Ge), мышьяк (As), сурьма (Sb), теллур (Te) и полоний (Po). Они образуют лестницу, символизирующую постепенный переход от металлов к неметаллам. Эти элементы иногда ведут себя как полупроводники (B, Si, Ge), а не как проводники. Металлоиды также называют «полуметаллами» или «бедными металлами».
Они образуют лестницу, символизирующую постепенный переход от металлов к неметаллам. Эти элементы иногда ведут себя как полупроводники (B, Si, Ge), а не как проводники. Металлоиды также называют «полуметаллами» или «бедными металлами».
Неметаллы: Все остальное в правом верхнем углу лестницы – плюс водород (H), скрученный назад в Группе 1 – является неметаллом.К ним относятся углерод (C), азот (N), фосфор (P), кислород (O), сера (S) и селен (Se).
Галогены: Четыре верхних элемента Группы 17, от фтора (F) до астата (At), представляют собой одно из двух подмножеств неметаллов. Галогены довольно химически реактивны и имеют тенденцию образовывать пары со щелочными металлами с образованием различных типов солей. Например, поваренная соль на вашей кухне – это смесь щелочного металла натрия и галогенового хлора.
Благородные газы: Бесцветные, без запаха и почти полностью инертные, инертные или благородные газы завершают таблицу в группе 18. Многие химики ожидают, что оганессон, один из четырех недавно названных элементов, будет обладать этими характеристиками; однако, поскольку этот элемент имеет период полураспада в миллисекундах, никто не смог проверить его напрямую. Оганессон завершает седьмой период периодической таблицы, поэтому, если кому-то удастся синтезировать элемент 119 (а гонка за это уже ведется), он перейдет в цикл, чтобы начать восьмую строку в столбце щелочного металла.
Многие химики ожидают, что оганессон, один из четырех недавно названных элементов, будет обладать этими характеристиками; однако, поскольку этот элемент имеет период полураспада в миллисекундах, никто не смог проверить его напрямую. Оганессон завершает седьмой период периодической таблицы, поэтому, если кому-то удастся синтезировать элемент 119 (а гонка за это уже ведется), он перейдет в цикл, чтобы начать восьмую строку в столбце щелочного металла.
Из-за цикличности, создаваемой периодичностью, дающей название таблице, некоторые химики предпочитают визуализировать таблицу Менделеева в виде круга.
Дополнительные ресурсы :
.
Периодическая таблица
Периодическая таблица
«Если все элементы расположены в порядке их атомного веса, получается периодическое повторение свойств. Это выражается законом периодичности».
Дмитрий Менделеев, Основы химии, Vol. 2, 1902, П. Ф. Кольер, стр. 17. “У нас есть доказательство того, что в атоме есть фундаментальная величина, которая постепенно увеличивается по мере перехода от одного элемента к другому. Этой величиной может быть только заряд центрального положительного ядра, существование которого мы уже имеем определенное доказательство.”
2, 1902, П. Ф. Кольер, стр. 17. “У нас есть доказательство того, что в атоме есть фундаментальная величина, которая постепенно увеличивается по мере перехода от одного элемента к другому. Этой величиной может быть только заряд центрального положительного ядра, существование которого мы уже имеем определенное доказательство.”
Генри Мозли, Philosophical Magazine, Vol. 26, 1913, стр. 1030. «Химический состав атома зависит только от количества электронов, которое равно количеству протонов и называется атомным номером. Химия – это просто числа, идея, которая понравилась бы Пифагору. Если вы атом с одним протоном, вы водород; два, гелий; ….. ”
Карл Саган, Космос, 1980, Рэндом Хаус, стр. 223. Фото: НАСА.
Электронные оболочки
Атом лития имеет два электрона, вращающихся на внутренней оболочке, и только один электрон, вращающийся на его внешней оболочке.Внешняя оболочка неполная, а значит, нестабильная. Атомы Li легко отдают один электрон с образованием положительно заряженных ионов Li + . Эти ионы имеют ту же стабильную электронную конфигурацию, что и благородный газ гелий.
Эти ионы имеют ту же стабильную электронную конфигурацию, что и благородный газ гелий.
Все атомы группы 1 могут потерять один электрон с образованием положительно заряженных ионов. Например, атомы калия делают это, чтобы образовать ионы с одним и тем же электроном. конфигурация как благородный газ аргон.
Атомы группы 2 теряют два электрона, образуя положительно заряженные ионы. Например, атомы магния образуют ионы Mg 2+ .Они имеют ту же электронную конфигурацию, что и благородный газ неон.
Большинство элементов в группе 3 теряют три электрона с образованием ионов 3+. Однако бор мало склонен к образованию ионов. Он получает структуру благородного газа, разделяя электроны с другими атомами. Это называется ковалентным связыванием.
Элементам групп 15, 16 и 17 легче получить электроны, чем потерять их. Например, атомы кислорода получают два электрона с образованием ионов O 2-. Они имеют ту же электронную конфигурацию, что и благородный газ неон.
Элементы в группе 14 могут потерять четыре или получить четыре электрона для получения структуры благородного газа. Фактически, если они собираются образовывать ионы, элементы группы 14 образуют положительные ионы. Углерод и кремний образуют ковалентные связи. Все миллионы органических соединений углерода основаны на общих электронах в ковалентных связях.
Многие элементы могут образовывать ковалентные связи в зависимости от обстоятельств. Например, связывание в воде H 2 0 в основном ковалентное; и в то время как хлор ионно связан с натрием в хлориде натрия, он связывается с углеродом ковалентно в четыреххлористом углероде.
Автор: Дуг Стюарт
Периодическая таблица, которую мы используем сегодня, основана на таблице, разработанной и опубликованной Дмитрием Менделеевым в 1869 году.
Менделеев обнаружил, что может расположить 65 элементов, известных на тот момент, в сетке или таблице так, чтобы каждый элемент имел:
1. Более высокий атомный вес, чем тот, что слева. Например, магний (атомный вес 24,3) помещен справа от натрия (атомный вес 23,0):
Например, магний (атомный вес 24,3) помещен справа от натрия (атомный вес 23,0):
Менделеев понял, что стол перед ним лежит в самом сердце химии.Более того, Менделеев увидел, что его таблица неполная – были места, где должны были быть элементы, но их никто не обнаружил.
Точно так же, как можно сказать, что Адамс и Леверье открыли планету Нептун на бумаге, Менделеев можно было сказать, что он открыл германий на бумаге. Он назвал этот новый элемент эка-кремний , после наблюдения зазора в периодической таблице между кремнием и оловом:
Аналогичным образом Менделеев открыл на бумаге галлий ( eka – алюминий) и скандий ( eka – бор), потому что он предсказал их существование и их свойства еще до их фактических открытий.
Хотя Менделеев совершил решающий прорыв, он почти не продвинулся дальше. Оглядываясь назад, мы знаем, что периодическая таблица Менделеева была основана на ложных рассуждениях. Менделеев ошибочно полагал, что химические свойства определяются атомным весом. Конечно, это было совершенно разумно, если принять во внимание научное знание 1869 года.
Конечно, это было совершенно разумно, если принять во внимание научное знание 1869 года.
В 1869 году сам электрон не был открыт – это произошло 27 лет спустя, в 1896 году.
Фактически, потребовалось 44 года, чтобы найти правильное объяснение закономерностей в периодической таблице Менделеева.
Объяснение найдено
Объяснение было дано в 1913 году Генри Мозли, который стрелял электронами по атомам, что привело к испусканию рентгеновских лучей. Мозли обнаружил, что каждый элемент, который он изучал, излучает рентгеновские лучи с уникальной частотой.
Когда он посмотрел на частоты, излучаемые рядом элементов, он обнаружил закономерность, которая лучше всего объяснялась, если положительный заряд в ядре увеличивался ровно на одну единицу от элемента к элементу.
График, обобщающий результаты Мозли
Другими словами, Мозли обнаружил, что элементы отличаются друг от друга, потому что их атомы имеют разное количество протонов. Он обнаружил, что положение элементов в периодической таблице лучше предсказывается их атомным номером , чем их атомным весом. (Атомный номер элемента равен количеству протонов и, следовательно, электронов в одном из его атомов.)
Он обнаружил, что положение элементов в периодической таблице лучше предсказывается их атомным номером , чем их атомным весом. (Атомный номер элемента равен количеству протонов и, следовательно, электронов в одном из его атомов.)
Открытие Мозли прояснило проблемы кобальт-никелевого и аргонно-калиевого.
При рассмотрении проблемы аргона и калия было известно, что аргон имеет более высокий атомный вес, чем калий. Согласно рассуждению Менделеева, аргон следует поместить после калия в периодической таблице.Но делать это не имело смысла с точки зрения химических свойств.
Работа Мозли показала, что атомный номер аргона равен 18, а калия – 19. Поэтому аргон следует поставить перед калием в периодической таблице на основе атомных номеров. Химики всего мира вздохнули с облегчением, потому что это согласуется с наблюдаемыми химическими свойствами этих элементов.
Мозли также подражал достижению Менделеева открытия новых элементов на бумаге, найдя четыре атомных номера без совпадающих элементов. Он предсказал существование элементов с атомными номерами 43, 61, 72 и 75. Эти элементы действительно были обнаружены; мы теперь называем их технецием, прометием, гафнием и рением.
Он предсказал существование элементов с атомными номерами 43, 61, 72 и 75. Эти элементы действительно были обнаружены; мы теперь называем их технецием, прометием, гафнием и рением.
Сегодня химические элементы по-прежнему расположены в порядке возрастания атомного номера (Z), если смотреть на периодическую таблицу слева направо. Мы называем горизонтальные ряды периодами . Например, вот Период 4:
.
Мы называем вертикальные ряды группами .
Например, вот группа 2:
Теперь мы также знаем, что химический состав элемента определяется тем, как расположены его электроны – его электронная конфигурация .
Электроны в атомах можно представить как занимающие слои или оболочки, окружающие атомное ядро. Это показано на схеме атома лития в левой части страницы. Мы представляем электроны как маленькие планеты, вращающиеся вокруг солнечного ядра, в котором расположены протоны и нейтроны. Это называется боровским представлением атома. На самом деле это приблизительное значение, но это хорошая отправная точка для понимания химических свойств элементов.
На самом деле это приблизительное значение, но это хорошая отправная точка для понимания химических свойств элементов.
Если мы исключим элементы переходных металлов, мы можем сказать, что атомы, которые занимают одну и ту же группу периодической таблицы, имеют одинаковое количество внешних электронов.Например, все элементы в группе 2, показанные слева, имеют два внешних электрона.
Эти внешние электроны называются валентными электронами .
Валентные электроны
Именно валентные электроны вызывают химическую реактивность.
Все элементы в группе 1 имеют один валентный электрон; Группа 2 – два валентных электрона; Группа 13 – три валентных электрона; Группа 14 – четыре валентных электрона; Группа 15 – пять валентных электронов; Группа 16 – шесть валентных электронов; Группа 17, семь валентных электронов; и Группа 18 – восемь валентных электронов, кроме гелия, у которого их два.
Группа 18 – это группа инертных газов, группа инертных элементов. Нежелание благородных газов вступать в химическую реакцию является ключом, который открывает нам понимание того, почему другие элементы действительно реагируют.
Нежелание благородных газов вступать в химическую реакцию является ключом, который открывает нам понимание того, почему другие элементы действительно реагируют.
Нереактивные частицы: если атом имеет электронную конфигурацию благородного газа, он будет химически неактивным или будет реагировать с трудом.
Реактивные частицы: если атом не имеет той же электронной конфигурации, что и благородный газ, он будет иметь тенденцию реагировать, чтобы достичь этого.
Благородные газы неактивны, потому что их внешние электронные оболочки заполнены. Полная оболочка внешних электронов – особенно стабильное устройство. Это означает, что атомы благородных газов не получают и не теряют электроны легко; они реагируют с другими атомами с большим трудом или не реагируют вовсе.
Другие атомы теряют электроны, приобретают электроны или делятся электронами, чтобы достичь той же электронной конфигурации, что и благородный газ – при этом они образуют химические связи и производят новые вещества.
Атом натрия реагирует с атомом хлора с образованием хлорида натрия
Например, на диаграмме выше атом натрия теряет свой единственный валентный электрон в пользу атома хлора. Когда атом теряет или приобретает один или несколько электронов, его уже нельзя описать как атом – он называется ионом .
Все ионы заряжены положительно или отрицательно.
Поскольку наш атом натрия потерял отрицательно заряженный электрон, он становится положительно заряженным ионом натрия: Na + .Этот ион натрия, у которого на один электрон меньше, чем у атома натрия, имеет ту же электронную конфигурацию, что и благородный газ неон, и химически стабилен.
Атом хлора, который начинается с семи валентных электронов, получает один электрон и становится отрицательно заряженным ионом хлора: Cl – . Этот ион имеет ту же электронную конфигурацию, что и благородный газ аргон, и его количество составляет
.
Периодическая таблица – Simple English Wikipedia, бесплатная энциклопедия
Периодическая таблица химических элементов – это список известных химических элементов. В таблице элементы расположены в порядке их атомных номеров, начиная с наименьшего номера, равного единице, водорода. Атомный номер элемента совпадает с числом протонов в этом конкретном ядре атома. В периодической таблице элементы расположены в периодов, и групп. Строка элементов в таблице называется периодом . У каждого периода есть номер; от 1 до 8. В периоде 1 всего 2 элемента: водород и гелий. Период 2 и период 3 имеют по 8 элементов. Остальные периоды длиннее. Элементы в периоде имеют последовательные атомные номера.
Стандартная вариация таблицы Менделеева
Столбец элементов в таблице называется группой . В стандартной периодической таблице 18 групп. У каждой группы есть номер: от 1 до 18.Элементы в группе имеют электроны, расположенные аналогичным образом в соответствии с числом валентных электронов, что придает им аналогичные химические свойства (они ведут себя аналогичным образом). Например, группа 18 известна как благородные газы, потому что все они являются газами и не соединяются с другими атомами.
Например, группа 18 известна как благородные газы, потому что все они являются газами и не соединяются с другими атомами.
Есть две системы групповых номеров; один с арабскими цифрами (1,2,3), а другой с римскими цифрами (I, II, III). Римские цифровые имена использовались на протяжении большей части 20-го века.В 1990 году Международный союз теоретической и прикладной химии (IUPAC) решил использовать новую систему с арабскими цифрами, чтобы заменить две старые групповые системы, в которых использовались римские цифры.
Периодическая таблица Менделеева использовалась химиками для наблюдения закономерностей и взаимосвязей между элементами. В Периодической таблице есть 3 основные группы; металлы, металлоиды и неметаллы. Например, элементы внизу и слева от таблицы являются наиболее металлическими, а элементы в правом верхнем углу – наименее металлическими.(например, цезий намного более металлический, чем гелий). Есть также много других закономерностей и взаимосвязей.
Периодическая таблица Менделеева была изобретена русским химиком Дмитрием Ивановичем Менделеевым (1834–1907). В его честь 101 элемент был назван в его честь – менделевий.
В его честь 101 элемент был назван в его честь – менделевий.
- Химическая серия Периодической таблицы.
- Состояние при стандартной температуре и давлении. Цвет числа (атомного номера) над символом элемента показывает состояние элемента при нормальных условиях.
- синим цветом обозначены газы
- зеленые – жидкости
- черные – сплошные
- Радиоактивность
Пунктирные границы содержат только радиоактивные изотопы природного происхождения
- Элементы с пунктирными границами не встречаются в природе (синтетические элементы)
те, у кого нет границ, слишком радиоактивны, чтобы их еще обнаружили.
Другие методы отображения химических элементов [изменить | изменить источник]
Версия периодической таблицы, показанная выше, является наиболее используемой.Другие распространенные версии показаны ниже:
Теодор Бенфей расположил элементы по спирали вокруг водорода.
 Атомный вес определяет положение элемента.
Атомный вес определяет положение элемента.Дмитрий Иванович Менделеев использовал цветочную композицию; Актиниды, лантаноиды показаны петлями рядом с основной группой.
Беттерман упорядочил элементы по их изоэлектрическим свойствам, которые можно преобразовать в полиномиальную форму.
Треугольная версия от Змачинского и Бейли
.
Периодическая таблица элементов Чтение и понимание
Элемент – это вещество, состоящее из атомов, которые больше не могут распадаться на другие вещества, которые все имеют одинаковое количество протонов, что переводится в его атомный номер. Поскольку этих элементов более 100, химикам и другим ученым нужен был метод их классификации. Это привело к первоначальной таблице Менделеева, которая была впервые предложена русским химиком Дмитрием Менделеевым в 1869 году. Сегодня она называется Периодической таблицей элементов .
Текущая Периодическая таблица – это метод для перечисления около 115 различных элементов. Элементы перечислены по структуре каждого элемента. Атомы состоят из протонов, нейтронов и электронов. В Периодической таблице указано количество протонов и электронов, которые каждый атом имеет в своей внешней оболочке, расположенной вне ядра.
В Периодической таблице элементов атомы перечислены слева направо и сверху вниз. Все элементы перечислены в порядке их атомного номера, который соответствует количеству протонов в ядре каждого атома.
Элементы выстроены в циклы или периоды, поэтому ее называют «периодической» таблицей. Сначала они выстраиваются в ряды на основе их атомных номеров, но затем некоторые столбцы пропускаются, поэтому элементы с одинаковым числом электронов выстраиваются в один столбец. Тогда элементы в тех же столбцах будут иметь одинаковые свойства.
Семь или восемь горизонтальных строк Периодической таблицы называются периодами. Первый период самый короткий и состоит всего из двух элементов: водорода и гелия. Шестая горизонтальная строка или период содержит 32 элемента. Самый левый элемент в точке или строке имеет только один электрон во внешней оболочке, а самый правый элемент имеет полную оболочку.
Шестая горизонтальная строка или период содержит 32 элемента. Самый левый элемент в точке или строке имеет только один электрон во внешней оболочке, а самый правый элемент имеет полную оболочку.
Восемнадцать вертикальных столбцов представляют собой разные группы, каждая из которых имеет разные свойства. Примером группы являются газы, называемые благородными или инертными. Они выстраиваются в последнюю (18 -е ) колонку или группу Периодической таблицы. Каждый из этих элементов имеет полную внешнюю оболочку из электронов, что означает, что они очень стабильны.Когда элемент стабилен, они обычно не реагируют на другие элементы. Они плохо или легко смешиваются.
Второй пример – металлы, называемые щелочами. Они выстраиваются в первом столбце или группе, и все они очень похожи, имея только один электрон во внешней оболочке. Эти элементы очень реактивны, что означает, что они легко смешиваются с другими элементами.
Классификация группирования этих элементов помогает химикам и другим ученым понять, предвидеть и предсказать, как различные элементы будут реагировать друг с другом во время экспериментов или в других ситуациях.
Наконец, у каждого элемента есть имя и одно- или двухбуквенное сокращение, чтобы ученым было проще пользоваться таблицей. Некоторые из однобуквенных сокращений легко запомнить, например, H для водорода, O для кислорода и C для углерода. Некоторые могут быть немного сложнее, потому что имя элемента происходит на другом языке. Например, AU – это сокращение для золота, потому что золото происходит от латинского слова aurum .
Таким образом, Периодическая таблица элементов – полезный и полезный инструмент для химиков и ученых. Он используется как быстрый способ узнать, как разные элементы будут реагировать друг на друга.
.
Классические названия периодических элементов Flashcards
Похожие Flashcards
Пожалуйста, войдите, чтобы добавить в папки.
Войти
Вы создали 2 папки. Пожалуйста, обновитесь до Cram Premium, чтобы создавать сотни папок!
Обновление
- Перемешать
Включить
Выключить
- Алфавит
Включить
Выключить
- Передний Первый
Включить
Выключить
- Обе стороны
Включить
Выключить
- Читать
Включить
Выключить
Чтение…
Фронт
Диапазон карт для изучения
через
Кнопка воспроизведения
Кнопка воспроизведения
Прогресс
1/16
Нажмите, чтобы перевернуть
Используйте клавиши со стрелками ВЛЕВО и ВПРАВО для перемещения между карточками;
Используйте клавиши со стрелками ВВЕРХ и ВНИЗ, чтобы перевернуть карту;
H показать подсказку;
A читает текст в речь;
- Делиться
- Распечатать
- Экспорт
- Клон
16 карт в этом наборе
- Передняя часть
- Спина
- 3-я сторона (подсказка)
Ион меди | Ион меди (i) | ||
Ион меди | Ион меди (ii) | ||
Ион железа | Ион железа (ii) | ||
Ион железа | Ион железа (iii) | ||
Ион ртути | Ион ртути (i) | рт. | |
Ион ртути | Ион ртути (ii) | Hg(2) бесплатно | |
Ион свинца | Ион свинца (ii) | ||
Ион свинца | Ион свинца (в/в) | ||
Ион двухвалентного олова | Ион олова (ii) | ||
Ион олова | Олово (в/в) ион | ||
Ион хрома | Ион хрома (ii) | ||
Ион хрома | Ион хрома (iii) | ||
Ион марганца | Ион марганца (ii) | ||
Ион марганца | Ион марганца (iii) | ||
Ион кобальта | Ион кобальта (ii) | ||
Ион кобальта | Ион кобальта (iii) |
Периодическая таблица: от классического дизайна до использования в популярной культуре — Институт молекулярной биологии
Марк Бласкович, Университет Квинсленда
Периодическая таблица — одно из тех классических изображений, которые можно найти во многих научных лабораториях и учебных классах. . Это картина, которую хоть раз в жизни видел почти каждый.
. Это картина, которую хоть раз в жизни видел почти каждый.
Таблицу Менделеева можно также найти на футболках, кружках, пляжных полотенцах, наволочках и пододеяльниках и многих других предметах. Это даже вдохновило на создание сборника рассказов.
Кто может забыть периодическую таблицу, наложенную на музыку американцем Томом Лерером, профессором математики из Гарварда, который также был певцом, автором песен и сатириком. Его песня The Elements включает в себя все элементы, которые были известны на момент ее написания в 1959 году. Международный союз теоретической и прикладной химии (IUPAC).
Но что именно показывает периодическая таблица?
Вкратце, это попытка организовать коллекцию элементов – все известные чистые соединения, состоящие из атома одного типа.
Есть два способа взглянуть на то, как устроена таблица Менделеева, основанные либо на наблюдаемых свойствах элементов, содержащихся в ней, либо на субатомном строении атомов, образующих каждый элемент.
Элементы
Когда ученые начали собирать элементы в 1700-х и 1800-х годах, медленно выявляя новые в течение десятилетий исследований, они начали замечать закономерности и сходство в их физических свойствах. Одни были газами, другие — блестящими металлами, третьи бурно реагировали с водой и так далее.
В то время, когда впервые были открыты элементы, структура атомов не была известна. Ученые начали искать способы систематизировать их, чтобы сходные свойства можно было сгруппировать вместе, подобно тому, как собиратель морских ракушек может попытаться упорядочить их по форме или цвету.
Задача усложнялась тем, что не все элементы были известны. Это оставляло пробелы, из-за чего расшифровка паттернов немного напоминала попытку собрать головоломку из недостающих частей.
Разные ученые придумали разные типы таблиц. Первая версия текущей таблицы обычно приписывается русскому профессору химии Дмитрию Менделееву в 1869 году, а обновленная версия – в 1871 году.
Важно отметить, что Менделеев оставил пробелы в таблице, где, по его мнению, должны быть размещены недостающие элементы. Со временем эти пробелы были заполнены, и появилась окончательная версия, какой мы ее знаем сегодня.
Атомы
Чтобы действительно понять окончательную структуру периодической таблицы, нам нужно немного понять атомы и то, как они построены. Атомы имеют центральное ядро (ядро), состоящее из более мелких частиц, называемых протонами и нейтронами.
Это количество протонов, которое дает элементу его атомный номер — число, которое обычно находится в верхнем левом углу каждой клетки в периодической таблице.
Свойства водорода, отмеченные в периодической таблице. Shutterstock/Дунтаро Таблица Менделеева расположена в порядке возрастания атомного номера (слева направо, сверху вниз). Он варьируется от элемента 1 (водород H) в левом верхнем углу до недавно утвержденного элемента 118 (оганесон Og) в правом нижнем углу.
Количество нейтронов в ядре может варьироваться. Это приводит к различным изотопам для каждого элемента.
Например, вы, возможно, слышали о датировании по углероду-14 для определения возраста объектов. Этот изотоп представляет собой радиоактивную версию обычного углерода C (или углерода-12), который имеет два дополнительных нейтрона.
Но почему под основной таблицей находится отдельная коробка с элементами, и почему главная таблица странной формы, с надкушенным верхом? Это сводится к тому, как устроен другой компонент атома — электроны.
Электроны
Мы склонны думать об атомах как о луковицах, с семью слоями электронов, называемыми «оболочками», обозначенными K, L, M, N, O, P и Q, окружающими основное ядро.
Подумайте об атоме с центральным ядром, содержащим все протоны и нейтроны, окруженным рядом оболочек, содержащих электроны. Разговор, CC BY-ND Каждая строка в периодической таблице соответствует заполнению одной из этих оболочек электронами. У каждой оболочки есть подоболочки, и порядок заполнения оболочек/подоболочек зависит от требуемой энергии, хотя это сложный процесс. Мы вернемся к ним позже.
У каждой оболочки есть подоболочки, и порядок заполнения оболочек/подоболочек зависит от требуемой энергии, хотя это сложный процесс. Мы вернемся к ним позже.
Проще говоря, первый элемент в каждой строке запускает новую оболочку, содержащую один электрон, в то время как последний элемент в каждой строке имеет две (или одну для первой строки) полностью занятых подоболочек во внешней оболочке. Эти различия в электронах также объясняют некоторое сходство свойств между элементами.
С одной или двумя подоболочками во внешнем слое, заполненными электронами, последние элементы каждого ряда совершенно нереакционноспособны, так как во внешней оболочке нет отверстий или зазоров для взаимодействия с другими атомами.
Вот почему элементы последней колонки, такие как гелий He, неон (Ne), аргон (Ar) и т. д., называются инертными газами (или инертными газами). Все они газы, и они «благородны», потому что редко связываются с другими элементами.
Напротив, элементы первой колонки, за исключением водорода (как и в английской грамматике, всегда есть исключение!), называются щелочными металлами. Элементы первого столбца по своему характеру похожи на металлы, но с одним электроном во внешней оболочке они очень реакционноспособны, поскольку этот одинокий электрон очень легко вступает в химическую связь. При добавлении в воду они быстро реагируют, образуя щелочной (основной) раствор.
Элементы первого столбца по своему характеру похожи на металлы, но с одним электроном во внешней оболочке они очень реакционноспособны, поскольку этот одинокий электрон очень легко вступает в химическую связь. При добавлении в воду они быстро реагируют, образуя щелочной (основной) раствор.
Каждая оболочка может вместить все большее количество электронов. В первую оболочку (К) помещаются только два, поэтому в первой строке периодической таблицы всего два элемента: водород (Н) с одним электроном и гелий (Не) с двумя.
Вторая оболочка (L) вмещает восемь электронов. Таким образом, вторая строка периодической таблицы содержит восемь элементов с промежутком между водородом и гелием, чтобы разместить дополнительные шесть.
В третьей оболочке (М) помещается 18 электронов, но в третьем ряду по-прежнему всего восемь элементов. Это связано с тем, что дополнительные десять электронов не добавляются к этому слою до тех пор, пока первые два электрона не будут добавлены к четвертой оболочке (N) (позже мы поймем, почему).
Таким образом, разрыв в четвертой строке увеличивается для размещения дополнительных десяти элементов, что приводит к «откусыванию» верхней части таблицы. Дополнительные десять соединений в средней части называются переходными металлами.
Четвертая оболочка содержит 32 электрона, но опять же дополнительные электроны не добавляются к этой оболочке до тех пор, пока некоторые из них не будут добавлены к пятой (O) и шестой (P) оболочкам, а это означает, что и четвертый, и пятый ряды содержат по 18 элементов. .
Для следующих двух строк (шестой и седьмой) вместо дальнейшего расширения таблицы в сторону, чтобы включить эти дополнительные 14 элементов, что сделало бы ее слишком широкой для удобного чтения, они были вставлены в виде блока из двух строк, называемого лантаноиды (элементы с 57 по 71) и актиноиды (элементы 89до 103) под основной таблицей.
Периодическая таблица выглядела бы совсем иначе, если бы в нее были вставлены лантаноиды и актиноиды. The Conversation, CC BY Вы можете увидеть, где они поместились бы, если бы периодическая таблица была расширена, если вы посмотрите на два нижних квадрата в третьем столбце таблицы выше.
По столбцам
Есть еще один фактор, усложняющий окончательную форму таблицы. Как упоминалось ранее, по мере того, как электроны добавляются к каждому слою, они переходят на разные подоболочки (или орбитали), что описывает места вокруг ядра, где их можно найти с наибольшей вероятностью. Они известны буквами s, p, d и f.
Буквы, используемые для обозначения орбиталей, на самом деле получены из описания излучения или поглощения света электронами, движущимися между орбиталями: s арфа, p rincipal, d диффузный и f ундаментальный.
Каждая оболочка имеет собственную конфигурацию подоболочек, названных от 1s до 7p, что дает общее количество электронов в каждой оболочке по мере продвижения по периодической таблице.
The Conversation, CC BY-ND Как упоминалось ранее, порядок, в котором подоболочки заполняются электронами, не так прост. Вы можете увидеть порядок, в котором они заполняются, на изображении ниже, просто следуйте порядку, как если бы вы читали слева направо.
Существует интерактивная периодическая таблица, которая также хорошо иллюстрирует последовательность заполнения, если щелкнуть по атомам.
Элементы в столбце обычно имеют схожие свойства, но в некоторых местах рядом расположенные элементы также могут быть похожими. Например, в переходных металлах группы драгоценных металлов вокруг меди (Cu), серебра (Ag), золота (Au), палладия (Pd) и платины (Pt) совершенно одинаковы.
Большинство существующих элементов с высокими атомными номерами, включая четыре сверхтяжелых элемента, добавленных в прошлом году, очень нестабильны и никогда не были обнаружены в природе или выделены из нее.
Вместо этого они создаются и анализируются в ничтожных количествах в очень искусственных условиях. Теоретически могут существовать и другие элементы, кроме 118, известных сейчас (есть дополнительные суборбитали g, h и i), но мы пока не знаем, будет ли какой-либо из них достаточно стабильным, чтобы его можно было изолировать.
Классический дизайн
Таблица Менделеева имеет много красочных и информативных версий, созданных на протяжении многих лет.
Периодическая таблица украшает такси в Великобритании. Flickr/Fr Гаурав Шрофф, CC BY-NC-NDОдна из моих любимых — художественная версия с оригинальными рисунками для каждого элемента, заказанная Королевским химическим институтом Австралии в честь Международного года химии в 2011 году.
Еще одна любимая — интерактивная версия с изображениями элементов. Создатели этого сайта также опубликовали журнальный столик под названием «Элементы» и приложение Apple с видеороликами о каждом элементе.
Интерактивные версии также были созданы Королевским химическим обществом (их также можно загрузить в виде приложения) и ChemEd DL среди прочих.
Классический дизайн таблицы Менделеева можно использовать для игры в версию игры Морской бой.
Игра в боевые корабли с периодической таблицей на первом Всемирном фестивале науки в Брисбене в 2016 году. The Conversation, CC BY-NC-ND
The Conversation, CC BY-NC-ND. Также существует множество забавных версий, созданных для организации множества объектов, включая еду, пиво, смайлики, приложения для iPad. и птицы.
Что касается «The Elements» Тома Лерера, песня еще не была обновлена, чтобы включить в нее все элементы, известные сегодня, но на протяжении многих лет на нее делали каверы другими людьми.
Актер Дэниел Рэдклифф, прославившийся Гарри Поттером, исполнил версию во время выступления в качестве гостя на шоу Грэма Нортона BBC.
Существуют и другие музыкальные версии элементов, но их тоже еще предстоит обновить, чтобы включить все элементы периодической таблицы.
Таким образом, периодическая таблица — это химическая таксономия всех элементов. Его триумф заключается в том, что он по-прежнему актуален для ученых, а также встраивается в популярную культуру.
Марк Бласкович, старший научный сотрудник, Университет Квинсленда
Первоначально эта статья была опубликована на The Conversation. Прочитайте оригинальную статью.
Изображение баннера: Периодическая таблица элементов на футболке. Дэймон Харт Дэвис.
Помощь в исследованиях IMB
Дайте сейчас
6.3: Блоки периодической таблицы
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 408057
 jpg(открывается в новом окне); Лицензия: Public Domain )
jpg(открывается в новом окне); Лицензия: Public Domain )Что делает эти ноты уникальными?
Мы все любим музыку в той или иной степени. Кому-то нравится классическая музыка, кому-то джаз или кантри. Музыкальные стили меняются от одного периода времени к другому и от одного региона к другому. Каждый тип музыки имеет свой язык, который его описывает. Классическая музыка имеет определенную структуру, стиль и содержание. Есть разные выражения классической музыки – симфония, концерт, соната. У нас есть балет и опера, а также хоровая музыка. Джаз отличается набором характеристик от классики и разными стилями исполнения. Каждый тип музыки можно описать и сравнить с другими типами на основе определенных общих качеств, таких как ноты, аккорды и мелодические стили.
Элементы периодической таблицы можно считать похожими на типы музыки. Каждый набор элементов имеет свой уникальный набор свойств, при этом разные наборы элементов имеют некоторые общие характеристики с точки зрения расположения электронов. Мы можем видеть закономерности электронной структуры и реактивности в периодической таблице, что позволяет нам лучше понять поведение отдельных элементов.
Мы можем видеть закономерности электронной структуры и реактивности в периодической таблице, что позволяет нам лучше понять поведение отдельных элементов.
Периоды и блоки
В периодической таблице есть семь горизонтальных строк, называемых периодов . Продолжительность каждого периода определяется количеством электронов, способных занять подуровней , которые заполняются в течение этого периода, как показано в таблице ниже.
| Период | Количество элементов в периоде | Подуровни в порядке заполнения |
|---|---|---|
| 1 | 2 | \(1с\) |
| 2 | 8 | \(2п\) \(2п\) |
| 3 | 8 | \(3п\) \(3п\) |
| 4 | 18 | \(4с\) \(3п\) \(4п\) |
| 5 | 18 | \(5s\) \(4d\) \(5p\) |
| 6 | 32 | \(6s\) \(4f\) \(5d\) \(6p\) |
| 7 | 32 | \(7s\) \(5f\) \(6d\) \(7s\) |
Напомним, что каждый из четырех различных подуровней состоит из разного количества орбиталей. Подуровень \(s\) имеет одну орбиталь, подуровень \(p\) – три орбитали, подуровень \(d\) – пять орбиталей, подуровень \(f\) – семь орбиталей. В первом периоде заполняется только подуровень \(1s\). Поскольку все орбитали могут содержать два электрона, весь первый период состоит всего из двух элементов. Во втором периоде заполняются подуровень \(2s\) с двумя электронами и подуровень \(2p\) с шестью электронами. Следовательно, второй период содержит восемь элементов. Третий период аналогичен второму, заполняя подуровни \(3s\) и \(3p\). Обратите внимание, что подуровень \(3d\) на самом деле не заполняется до тех пор, пока не заполнится подуровень \(4s\). Это приводит к четвертому периоду, содержащему 18 элементов из-за дополнительных 10 электронов, внесенных подуровнем \(d\). Пятый период аналогичен четвертому. После заполнения подуровня \(6s\) заполняется подуровень \(4f\) с его 14 электронами. Далее следуют \(5d\) и \(6p\). Общее количество элементов в шестом периоде равно 32. Более поздние элементы в седьмом периоде все еще создаются.
Подуровень \(s\) имеет одну орбиталь, подуровень \(p\) – три орбитали, подуровень \(d\) – пять орбиталей, подуровень \(f\) – семь орбиталей. В первом периоде заполняется только подуровень \(1s\). Поскольку все орбитали могут содержать два электрона, весь первый период состоит всего из двух элементов. Во втором периоде заполняются подуровень \(2s\) с двумя электронами и подуровень \(2p\) с шестью электронами. Следовательно, второй период содержит восемь элементов. Третий период аналогичен второму, заполняя подуровни \(3s\) и \(3p\). Обратите внимание, что подуровень \(3d\) на самом деле не заполняется до тех пор, пока не заполнится подуровень \(4s\). Это приводит к четвертому периоду, содержащему 18 элементов из-за дополнительных 10 электронов, внесенных подуровнем \(d\). Пятый период аналогичен четвертому. После заполнения подуровня \(6s\) заполняется подуровень \(4f\) с его 14 электронами. Далее следуют \(5d\) и \(6p\). Общее количество элементов в шестом периоде равно 32. Более поздние элементы в седьмом периоде все еще создаются. Таким образом, хотя в периоде может быть 32 элемента, текущее число немного меньше. 92\) часть конфигурации. Следовательно, никель можно найти в четвертом периоде таблицы Менделеева.
Таким образом, хотя в периоде может быть 32 элемента, текущее число немного меньше. 92\) часть конфигурации. Следовательно, никель можно найти в четвертом периоде таблицы Менделеева.
На основе электронных конфигураций периодическую таблицу можно разделить на блоков, обозначающих, какой подуровень находится в процессе заполнения. Блоки \(s\), \(p\), \(d\) и \(f\) показаны ниже.
Рисунок \(\PageIndex{2}\) (Источник: Christopher Auyeung и Joy Sheng; Источник: CK-12 Foundation; Лицензия: CC BY-NC 3.0(opens in new window))На рисунке также показано, как \( г\) подуровень всегда на один главный уровень отстает от периода, в котором этот подуровень встречается. Другими словами, подуровень \(3d\) заполняется в течение четвертого периода. Подуровень \(f\) всегда отстает на два уровня. Подуровень \(4f\) принадлежит шестому периоду.
youtube.com/embed/hJ0WwAGSjlc?vq=hd1080″ frameborder=”0″ allowfullscreen=”true”>Сводка
- Горизонтальные строки периодической таблицы называются периодами.
- Длина периода зависит от того, сколько электронов необходимо, чтобы занять подуровни, заполняющие период.
- Блоки указывают, какой подуровень заполняется.
Обзор
- Как называются горизонтальные ряды периодической таблицы?
- Какой подуровень заполняется в периоде 1?
- Какой подуровень заполняется в периоде 7?
- Как электронная конфигурация элемента дает информацию о периоде, в котором он находится?
- Какой блок элементов имеет заполненные подуровни \(d\)?
Эта страница под названием 6.3: Блоки периодической таблицы публикуется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts. ; подробная история редактирования доступна по запросу.
; подробная история редактирования доступна по запросу.
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Фундамент СК-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу Содержание
- нет на странице
- Включено
- да
- Теги
- источник@https://flexbooks.

- источник@https://flexbooks.

 В некоторых таблицах его указывают в обеих группах.
В некоторых таблицах его указывают в обеих группах.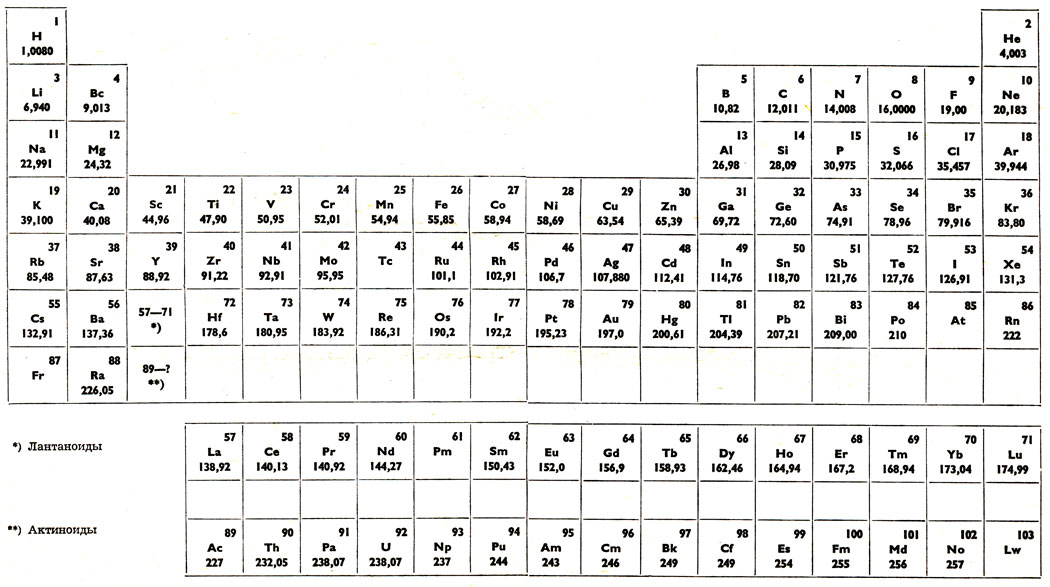
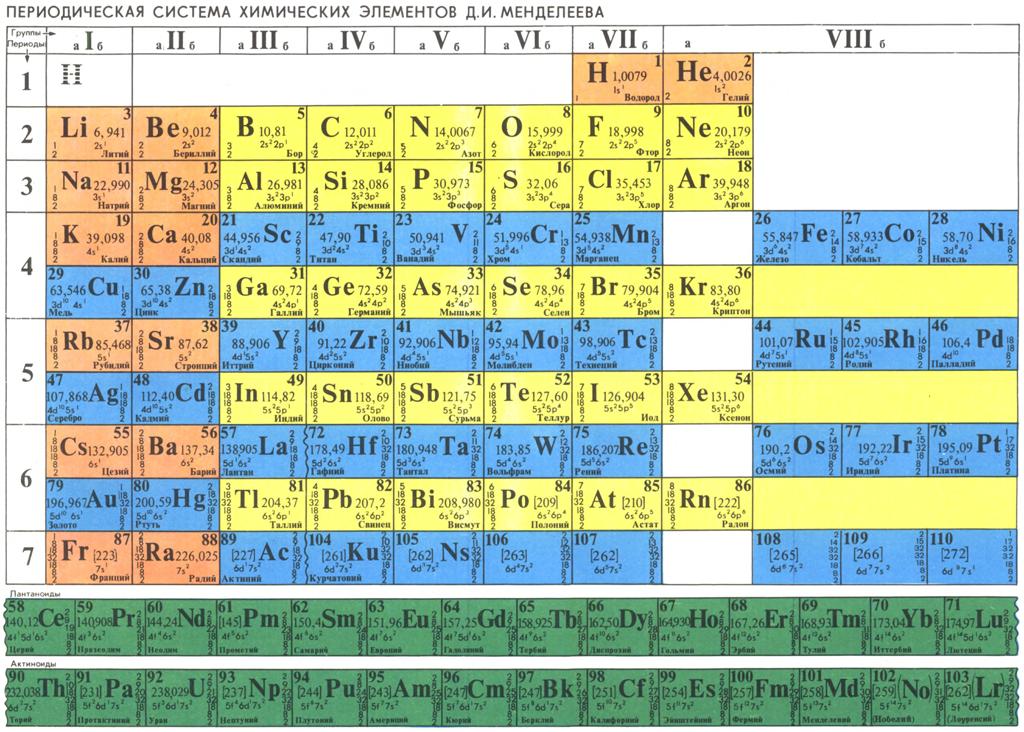 Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
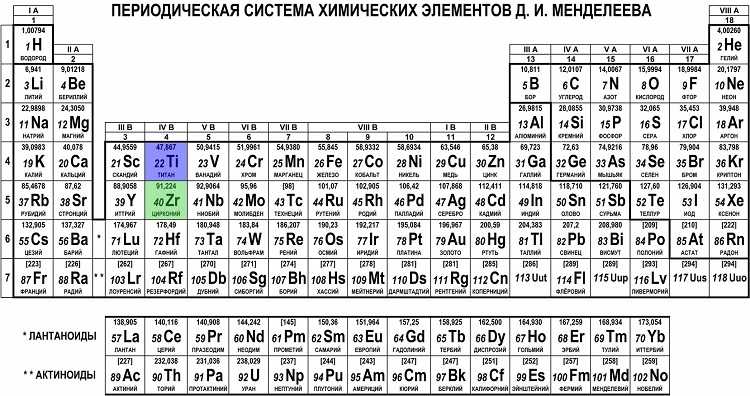 Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;