Доклад Таблицы менделеева (история и создания) сообщение
- Энциклопедия
- Разное
- Таблицы менделеева (история и создания)
Один из обязательных предметов в школе является химия. Большинство знаний, полученных по этой дисциплине, в жизни не применяются. Но знаменитую таблицу Менделеева знает каждый человек. Мало кто догадывается, как она была создана.
Предыстория.
В 1668 году талантливым ученым в области химии и биологии Робертом Бойлером была выпущена статья, в которой он делился своим мнением о надобности открытия свежих химических составляющих. В перечень он внес более10 новых элементов.
Спустя 100 лет ученый Антуан Лавузье из Франции решил увеличить этот список до 35 элементов. Однако основной вклад в развитии химических элементов вложил русский ученый-химик Дмитрий Иванович Менделеев. Он первый высказался о том, что атомная масса элементов имеет связь с их расстановкой в системе.
Так получилось, что в 1869 году русский ученый смог сформулировать самый первый периодический закон, и написать доклад про соотношение свойств с атомным весом элементов.
История создания.
Идея создания периодической таблицы была уже придумана в голове у Менделеева. Но правильно упорядочить ее он долгое время не мог. Более трех суток без сна химик работал над расстановкой химических элементов, перебирая различные методы. В итоге процесс был выполнен, и таблица была создана.
Миф о сне Менделеева.
Почти каждый человек слышал историю о том, что ученому таблица элементов приснилась. Эта легенда придумал помощник ученого А.А. Иностранцев. Это была просто веселая история для студентов. В ней говорилось, что Менделеев во сне смог увидеть свою таблицу, в которой все химические составляющие были уже сформированы в правильном порядке. Но на самом деле химик много работал, не отвлекаясь на еду и сон. Сам Менделеев говорил, что всего лишь шутка. Таблица была создана с помощью тяжелого труда.
Последующая работа.
Ученый продолжал проводить различные эксперименты и вносил поправки в свой труд.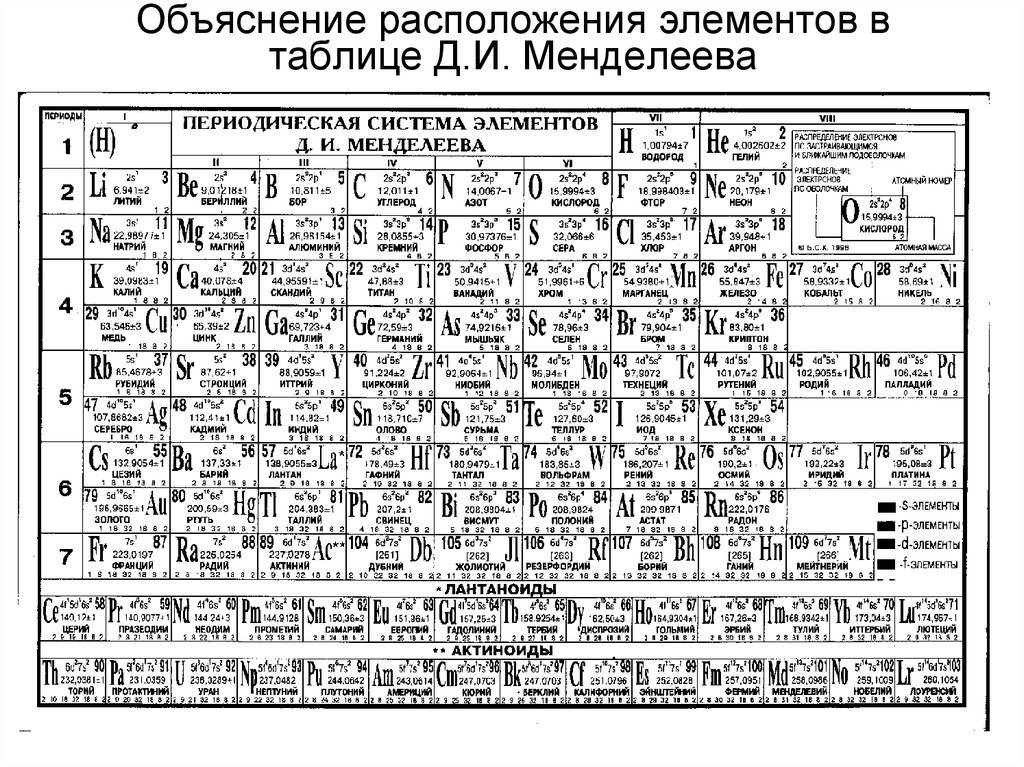 Химик изменил значения атомных масс некоторых элементов. Менделеев основывался на результатах своих исследований.
Химик изменил значения атомных масс некоторых элементов. Менделеев основывался на результатах своих исследований.
Для новых элементов ученый оставил пустые клетки, однако их свойства он смог заранее просчитать. Менделеев предсказал открытие галлия, скандий и германия.
Организация периодической системы Менделеева.
Д.И. Менделеев расположил все элементы в ряд по массовому росту, а длина рядов была сформирована так, чтобы все элементы имели похожие качества.
В самом начале создания системы она считалась как отображение уже существующего порядка в природе. Никаких пояснений, почему все элементы должны стоять так, не было. Лишь после создания квантовой механики обществу стало хоть немного понятно расположение химических составляющих в таблице. Во время работы над своим проектом Менделеев придерживался 4 этапах: подготовка, инкубация, озарение и проверка. За качественность такого процесса можно судить по окончательным итогам.
Вывод.
Создание периодической таблицы Менделеева стало большим открытием не только для химии как для науки, но и для всего человечества. Главное, что нужно запомнить – это то, в реальной жизни ничего не происходит само по себе. Не нужно ждать, что какое-то открытие или решение в жизни произойдет случайным образом. Для того, чтобы добиться желаемого в жизни нужно иметь некоторые познания и навыки, а также правильно уметь пользоваться своим потенциалом. И совсем не важно, будь это открытие нового химического элемента или же что-то другое…
Главное, что нужно запомнить – это то, в реальной жизни ничего не происходит само по себе. Не нужно ждать, что какое-то открытие или решение в жизни произойдет случайным образом. Для того, чтобы добиться желаемого в жизни нужно иметь некоторые познания и навыки, а также правильно уметь пользоваться своим потенциалом. И совсем не важно, будь это открытие нового химического элемента или же что-то другое…
Таблицы менделеева (история и создания)
Популярные темы сообщений
- Созвездие Большой медведицы
Рассматривая ночное небо, мы видим огромное количество маленьких светящихся точек. Называются они звёздами. На самом деле звезды совсем не маленькие, а даже очень большие. Просто они расположены на огромном расстоянии от нашей планеты.
- Творчество Бианки
Виталий Валентинович Бианки является знаменитым русским писателем. Настолько сильная любовь к своей родине и природе запечатлена практически во всех произведениях писателя, которые очень любят
- Трудовое законодательство РФ
На сегодняшний день Трудовое законодательство РФ опирается на трудовой кодекс, документы, акты и указы Президента касающиеся трудовой деятельности граждан.
 Трудовой кодекс – это свод законов связанных
Трудовой кодекс – это свод законов связанных - Яшин Лев
Лев Яшин – наилучший легендарный советский футбольный вратарь. Его фамилия входит в список лучших игроков 20 века. Он первый и единственный, кто получил награду «Золотой мяч».
- Круговорот воды в природе
С тех пор как образовалась планета на которой мы живем прошло очень много времени. Но общее число вод на ней, можно сказать осталось без изменения. Но поскольку вода все время совершает движение на земной поверхности
Как создавалась периодическая таблица химических элементов Д.И. Менделеева » Kupuk.net
Химия — это наука о веществах, одна из основоположных в естествознании. Знания по этому предмету, полученные в школе, некоторые уже позабыли, а вот периодическую таблицу Д. И. Менделеева запомнил каждый, хотя у многих в памяти она так и осталась таблицей с разноцветными квадратами и вписанными в них буквами. Наверняка каждому творчески мыслящему человеку будет интересно узнать, как создавалась таблица Менделеева.
Необходимость систематизации элементов
Веками человек стремился раскрыть тайну состава частиц, но его методы, как и само представление о строении вещества, были слишком запутаны. Началом изучения химических элементов можно считать 1668 год, когда ирландский химик Роберт Бойль в своей книге описал 15 таких частиц и предположил, что их может быть гораздо больше.
Через сто лет французский химик Антуа н Лавуазье составил новый список, состоящий из 35 элементов. 23 из них позже признали неразложимыми.
Основа для понимания была заложена только в начале XIX века, когда атомы были признаны базовыми строительными кирпичиками природы. Элемент — это вещество, состоящее из одного вида атомов. Атомы разных частиц отличаются друг от друга весом.
К середине XIX века ученые открыли 63 химических элемента. Многие исследователи пытались определить хоть какую-нибудь закономерность в этом подборе:
- в 1829 году немецкий химик Иоганн Дёберейнер;
- в 1862 году французский геолог и химик Александр Эмиль Шанкуртуа;
- в 1866 году английский химик Джон Александр Ньюлендс.

С помощью весов химики определяли соотношение веса у разных атомов, но результаты не совпадали. В 1860 году был созван конгресс химиков в Карлсруэ (Германия), чтобы положить конец неподобающей ситуации с определением атомных и молекулярных весов.
Он наметил путь к более комплексной систематизации состава веществ. Два участника конгресса Дмитрий Менделеев из России и Лотар Мейер из Германии понимали, что атомные веса — ключ классификации элементов. Менделеев первым предположил, то между атомной массой элементов и их расположением в системе может существовать взаимосвязь.
Как заполнялась периодическая таблица
В 1867 году Менделеев стал профессором химии Санкт-Петербургского университета. В окрестных карьерах он искал минералы, чтобы показать студентам, в какой форме элементы могут встречаться в природе. Менделеев, как преподаватель написал классический учебник «Основы химии». При его написании он углубился в отношения между свойствами частиц, пытаясь создать систему для их классификации.
При его написании он углубился в отношения между свойствами частиц, пытаясь создать систему для их классификации.
В 1869 год члены российского химического общества прослушали доклад Менделеева, подводящий итоги его исследований. Ему удалось разработать стройную систему химических элементов. Но как он пришел к этой системе? «Искать что-либо, хотя бы грибы или какую-либо зависимость нельзя иначе, как наблюдая и пробуя», — писал он.
Менделеев стал подбирать вещества, записывая в отдельных карточках их атомный вес и характерные свойства. Схожие частицы и близкие атомные веса позволили ему сделать заключение, что свойства элементов состоят в периодической зависимости от их атомного веса.
Менделеев заполнил пробелы в таблице карточками ещё не открытых химических веществ. Он даже предсказал их свойства. Многие коллеги решили, что его выводы несостоятельны.
Тем не менее, Менделеев стремился как можно быстрее заполнить пустые клетки еще неизвестными науке химическими веществами, свойства и атомные массы которых, он сумел вычислить. И процесс начался. Один за одним стали открываться новые элементы. Первым открыли галлий в 1875 году, затем стали открываться и остальные:
И процесс начался. Один за одним стали открываться новые элементы. Первым открыли галлий в 1875 году, затем стали открываться и остальные:
- скандий в 1879 году;
- германий в 1885 году;
- полоний — 1898 год;
- рений —1925 год;
- технеций —1937 год;
- франций —1939 год;
- астат в 1942—1943 годы.
Периодическая система, которую сегодня знает каждый школьник, состоит из колонок и рядов. В рядах элементы выстроены по увеличению числа атомов. Они примерно пропорциональны их атомному весу. Колонки содержат химические вещества со сходными свойствами, которые варьируют при переходе от одного столбца к другому.
Влияние изучения строения атома
В 1886 году Клеменс Винклер, немецкий химик-технолог заполнил один из пробелов, оставленных Менделеевым — он открыл элемент германий. Его химические свойства совпали с предсказаниями Менделеева.
Германий относится к той же группе элементов, что и уголь, кремний, олово и свинец. Точность периодической системы подтвердили открытия шотландского химика Уильяма Рамзая. В период между 1894 и 1898 годами он открыл несколько благородных газов — новую отдельную группу элементов.
Точность периодической системы подтвердили открытия шотландского химика Уильяма Рамзая. В период между 1894 и 1898 годами он открыл несколько благородных газов — новую отдельную группу элементов.
Рамзай открыл благородные газы в атмосфере, где из-за химически инертного поведения они долго оставались не обнаруженными. Эта группа легко вошла в таблицу. Но по-настоящему периодическую систему поняли только тогда, когда выяснилось, что атом состоит из ядра и электронов.
Электроны расположены в оболочках атомов согласно определенным законам. Когда одна из них заполняется, создается новая, поэтому химические свойства зависят, в частности, от числа электронов во внешней оболочке. В каждой новой оболочке эти свойства повторяются, а в таблице начинается новый ряд.
Первым в таблице стоит водород, атом которого самый легкий из всех. Атомы азота и кислорода — двух главных составляющих атмосферы, во много раз тяжелее его. Атомный вес водорода примерно равен единице. Атомы самого тяжёлого, из встречающихся в природе химических веществ — урана более, чем в 200 раз тяжелее водорода.
Атомы самого тяжёлого, из встречающихся в природе химических веществ — урана более, чем в 200 раз тяжелее водорода.
К сороковому году были обнаружены все девяносто два элемента — от водорода до урана за исключением прометия. В конце тридцатых годов группы ученых пытались искусственно получить из урана более тяжелые частицы. В 1938 году немецкий химик Отто Ган почти случайно открыл ядерное деление. Он вместе с помощником Фрицем Штрассманом изучал образцы урана, которые бомбардировал нейтронами.
Но вместо нового тяжелого элемента Ган получил только более легкие, образованные при распаде ядра урана. Так Отто Ган впервые доказал деление ядра.
youtube.com/embed/oSGSavWn-Kg”/>Через два года, выполняя похожие опыты, американские ученые создали первое искусственное химическое вещество — нептуний. Год спустя к нему добавился плутоний. Обе эти частицы тяжелее урана. Они легко вошли, в существующую таблицу элементов.
Роль плутония в расширении таблицы
Таким образом, 92 элемента встречаются в природе, а начиная с 93-го могут быть созданы лишь в лаборатории и являются искусственными. Изначально таблица отражала лишь порядок, существующий в природе, не объясняя почему должно быть именно так. Лишь появление квантовой механики раскрыло истинный смысл порядка элементов в таблице.
Практика показывала, что должны быть и другие трансурановые элементы. Когда стало известно, что изотоп плутония-239 легко делится, им заинтересовались военные. Их привлекала огромная взрывная сила, которую он может создать.
Плутоний, имеющий атомное число 94, продолжил процесс расширения таблицы Менделеева. Он образуется, когда природный уран бомбардируют нейтронами в ядерном реакторе. Критическая масса плутония, нужная для атомной бомбы, — пять килограммов. До тех пор плутоний удавалось создавать в таких малых количествах, что взвешивать его можно было только с помощью тонкой стеклянной нити.
Несмотря на это, ученые все же смогли определить его физические и химические свойства. Война с Германией стала важной предпосылкой для производства плутония килограммами. Его планировали использовать для создания сверхоружия против гитлеровской Германии.
Работая над бомбой, ученые и инженеры открывали новые горизонты. Невозможное стало реальностью. Хотя бомбу так и не сбросили на Германию, между двумя сверхдержавами — США и СССР началась гонка, кто откроет больше элементов, которые можно производить искусственно.
Пример плутония показал, что открытие новых элементов может означать военное превосходство. Так холодная война внесла вклад в расширение таблицы Менделеева.
Значение для мировой науки
В начале восьмидесятых годов из Германии поступали сообщения о новых, искусственно созданных химических веществах. К 1996 году полдюжины новых элементов были созданы в институте по исследованию тяжёлых ионов в немецком городе Дармштадте.
Эксперименты были сложными и дорогими. Образцы неделями бомбардировали ионами. Для непосвященного выход нового элемента кажется крайне низким. Таблица постоянно расширяется. Последний элемент теннессин открыт в 2010 году, а всего открыто 118 частиц.
Значение таблицы Д. Менделеева для мировой науки:
- она явилась наиболее важным этапом в развитии атомно-молекулярного учения;
- с её помощью стало возможным предсказание ранее неизвестных химических элементов;
- частицы, обнаруженные позже, точно стали на свободные места таблицы, предсказанные Менделеевым;
- таблица помогла составить понятие о химическом элементе в современном понимании;
- таблица дала возможность систематизировать типы атомов, для вновь созданных разделов физики (атомной физики и физики ядра).
Вначале периодическую систему пополняли новыми частицами химики, а сейчас эту задачу выполняют физики. Периодическая система элементов, созданная Дмитрием Менделеевым больше века назад, оказалось настолько универсальной, что каждое новое открытие только подтверждает ее верность.
Периодическая таблица Менделеева. Таблица менделеева сколько элементов в таблице
Автор Historian Просмотров 114 Опубликовано
Это можно объяснить расщеплением и химической связью. Достижение темы напоминает нам о межмолекулярных HF и водородных связях, которые делают эту кислоту самой слабой. Пока мы примем это как исключение: HF — самая слабая из этих кислот, а HI — самая сильная.
Содержание
- Сколько элементов в таблице Менделеева: 118 или 126?
- Почему была выбрана именно таблица Менделеева?
- Сколько элементов в таблице Менделеева
- Классический вид периодической таблицы Менделеева
- Периодический закон Менделеева
- «Башня» из химических элементов
- Цветок Менделеева
- Лента периодических химических элементов
- Группы элементов с похожими свойствами
- Цветовое определение групп
- Различение металлов, металлоидов и неметаллов
- Обозначение элементов
- Буквенное, название
- Атомный номер
- Массовое число
- Валентность
- Периодическая таблица элементов Менделеева длинная форма
- Таблица Менделеева для печати в хорошем качестве скачать
- Периодический закон
Сколько элементов в таблице Менделеева: 118 или 126?
Одной из самых популярных картин в мире является картина Менделеева. Название химического вещества указано в каждой ячейке. На их разработку было затрачено много усилий. В конце концов, это не просто список веществ. Они классифицируются в соответствии с их свойствами и характеристиками. И легко увидеть, как много информации содержится в картине Менделеева.
Название химического вещества указано в каждой ячейке. На их разработку было затрачено много усилий. В конце концов, это не просто список веществ. Они классифицируются в соответствии с их свойствами и характеристиками. И легко увидеть, как много информации содержится в картине Менделеева.
Менделеев не был первым ученым, решившим структурировать данные. Многие люди пробовали это. Никто не смог объединить их все в одну таблицу. Датой открытия периодического закона можно считать 17 февраля 1869 года. В этот день Менделеев представил свое творение — целую систему элементов, классифицированных в соответствии с их атомным весом и химическими свойствами.
Стоит отметить, что в одну счастливую ночь, когда он работал, блестящая идея не была доведена до сведения ученых. Это действительно работало около 20 лет. Он много раз смотрел на карту данных и изучал ее свойства. В это же время работали другие ученые.
От его имени химик Канизаро предложил теорию атомных величин. Он утверждал, что именно данные могут расставить все материи в правильном порядке. Более того, ученые Чантуркуа и Ньюлендса, работавшие в разных частях света, пришли к выводу, что, расположив элементы в соответствии с их атомным весом, они начнут объединяться дальше по другим свойствам.
Более того, ученые Чантуркуа и Ньюлендса, работавшие в разных частях света, пришли к выводу, что, расположив элементы в соответствии с их атомным весом, они начнут объединяться дальше по другим свойствам.
Почему была выбрана именно таблица Менделеева?
В 1869 году вместе с Менделеевым были опубликованы примеры других картин. Однако сегодня мы не помним даже имен их авторов. Как это произошло — все связано с превосходством ученых над конкурентами.
- Таблица имела большее количество открытых элементов, чем у других.
- Если какой-то элемент не подходил по атомному весу, ученый помещал его на основе других свойств. И это было правильным решением.
- В таблице было много пустых мест. Менделеев сделал пропуски осознано, забрав тем самым частичку славы тех, кто в будущем найдет эти элементы. Он даже дал описание некоторых еще неведомых веществ.
Самым важным достижением является то, что этот стол не разрушается. Она так искусно создана, что будущие открытия обогатят ее.
Сколько элементов в таблице Менделеева
Каждый человек хотя бы раз в жизни видел этот стол. Однако точное количество веществ назвать сложно. Два возможных правильных ответа — 118 и 126. Давайте рассмотрим, почему это происходит.
Люди открыли в природе 94 элемента. Они ничего с ними не делали. Следует изучать только их свойства и характеристики. Большинство из них были в оригинальном настольном журнале.
Остальные 24 элемента были созданы в лаборатории. Таким образом, их общее число достигло 118. Остальные восемь элементов — это просто выдуманные вариации. Их только предстоит изобрести или приобрести. Таким образом, пока можно смело называть как 118-элементный вариант, так и 126-элементный.
От его имени химик Канизаро предложил теорию атомных величин. Он утверждал, что именно данные могут расставить все материи в правильном порядке. Более того, ученые Чантуркуа и Ньюлендса, работавшие в разных частях света, пришли к выводу, что, расположив элементы в соответствии с их атомным весом, они начнут объединяться дальше по другим свойствам.
Классический вид периодической таблицы Менделеева
Ниже приведена таблица, имеющаяся в CHEMISTRYAPPLICATION, входящей в лицензионный пакет.
Периодический закон Менделеева
Периодический закон химических элементов имеет две формулировки — классическую и современную.
Классический Менделеев, высказанный первооткрывателем Д.И.:.
‘Свойства простых объектов, а также формы и свойства соединений элементов регулярно зависят от значения атомной массы элемента’.
Современный:.
Свойства простых веществ, а также свойства и формы соединений элементов периодически зависят от заряда (порядкового номера) ядер атомов элементов».
Появление журнальной системы положило начало новой, подлинно научной эре в истории химии и многих смежных наук. Вместо разрозненной информации о данных и соединениях появились целостные системы, позволяющие обобщать и делать выводы и прогнозы.
«Башня» из химических элементов
Периодическая таблица Adma была разработана Валерием Циммерманом в 2006 году. Вместо того чтобы основываться на атомных номерах, он перелистывает четыре квантовых числа конфигурации электронов, используемых для описания расположения и движения электронов внутри отдельного человека. Согласно статье в журнале Science Alert, идея возникла у старого инженера и биолога Чарльза Джанета. В его работе элементы были переставлены в соответствии с занятостью орбиталей — базовой вероятностью того, что электрон находится на определенном расстоянии от ядра.
Вместо того чтобы основываться на атомных номерах, он перелистывает четыре квантовых числа конфигурации электронов, используемых для описания расположения и движения электронов внутри отдельного человека. Согласно статье в журнале Science Alert, идея возникла у старого инженера и биолога Чарльза Джанета. В его работе элементы были переставлены в соответствии с занятостью орбиталей — базовой вероятностью того, что электрон находится на определенном расстоянии от ядра.
То же самое относится и к регулярной системе Адомаха
Читайте больше интересных статей о физике, химии и новостях мировой науки на канале Google News.
Цветок Менделеева
Сочетание химических веществ в системе может сбить с толку, особенно если смотреть на нее с разных сторон.
Стоит отметить, что в этой периодической таблице нет ни водорода, ни солнца. Первая секция (или лепесток) бирюзового цвета содержит щелочные металлы на лицевой стороне и щелочные металлы земли на обратной стороне. Остальные лепестки содержат остальные элементы, сгруппированные в соответствии с присущими им свойствами.
Остальные лепестки содержат остальные элементы, сгруппированные в соответствии с присущими им свойствами.
Лента периодических химических элементов
Варианты перемещения смотрите ниже. Таблица под названием «Периодическая таблица скрученных лент» была создана секцией Джеймса Франклина Хайда в середине двух циклов.
В циклической системе химических веществ каждый элемент имеет символ, название, порядковый номер и относительный индивидуальный вес.
Далее приведена таблица химических веществ и их взаимодействий
Однако панель начинается из центра правого круга с водорода, а затем расширяется на различные группы. Множество цветов подчеркивает регулярную взаимосвязь элементов. Красивые изгибы становятся одним из наших любимых вариантов, но они также очень напряженные. Чтобы увидеть, как все это действует, посмотрите периодическую таблицу, показывающую, как используются эти предметы.
Таким образом, рубид обладает самыми сильными металлическими свойствами, в то время как неметаллические свойства у него слабее.
Сера обладает самыми слабыми металлическими свойствами, а с другой стороны, Бог — самый сильный неметалл.
Группы элементов с похожими свойствами
Группы — это вертикальные ряды в периодической таблице, которые определяют основные природные и химические свойства элементов. Вещества, принадлежащие к одной группе, имеют сходные химические свойства и демонстрируют одинаковую картину изменения при увеличении их индивидуального количества.
Все группы (столбцы таблицы) имеют номера 1-18 — слева направо (от щелочных металлов до благородных). Эта система вступила в силу в 1988 году по инициативе ИЮПАК. Все предыдущие названия групп, использовавшиеся в разных странах, больше не используются.
Предметы, принадлежащие к одной группе, располагаются сверху вниз по следующей схеме.
- Возрастает радиус атома элементов в рамках одной группы.
- Усиливаются металлические свойства элементов и ослабевают неметаллические.
- Падает электроотрицательность.

Цветовое определение групп
Вещества в каждой группе делятся на вещества главной подгруппы и вещества вторичной подгруппы. В таблице элементы боковых групп выделены синим цветом и включают только элементы с большой продолжительностью (начиная с четвертого периода). Основная подгруппа может включать как краткосрочные, так и долгосрочные элементы (начиная с первого или второго периода).
Различение металлов, металлоидов и неметаллов
Все химические элементы можно разделить на три типа в соответствии с их химическими и физическими свойствами
Металлы (например, медь, алюминий, золото): свойства металлов.
- Хорошая электро- и теплопроводность.
- Способность отражать свет (яркий внешний вид).
- Высокая температура плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Пластичность и податливость.
Неметаллы встречаются в природе в трех состояниях: газообразном (например, водород), жидком (например, бром) и твердом (например, фосфор). Характеризуется:.
Характеризуется:.
- Неспособность проводить тепло и электричество.
- Разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Значительно более низкая температура плавления в сравнении с металлами.
- Хрупкость и ломкость.
Металлоиды обладают смешанными свойствами металлов и неметаллов (например, кремний). Их основными особенностями являются.
- Средняя тепло- и электропроводность.
- Внешний вид может быть схож с металлами или неметаллами.
- Различаются между собой по температуре плавления, плотности, цвету и форме.
Обозначение элементов
Каждая запись в периодической таблице Менделеева имеет свое название.
Буквенное, название
Таблица может содержать полное название вещества (например, углерод). В этом случае он помещается под химическим символом.
Символ — это сокращенное название элемента (например, солнце — это он).
В некоторых случаях название вещества в таблице не указывается, только химический символ. Символы обычно состоят из одной или двух латинских букв. Символ элемента находится в центре соответствующей ячейки таблицы.
Символы обычно состоят из одной или двух латинских букв. Символ элемента находится в центре соответствующей ячейки таблицы.
Атомный номер
Атомный номер элемента обычно находится в верхней, центральной или угловой части соответствующей ячейки. Атомный номер всех элементов варьируется от 1 до 118. Атомный номер всегда является целым числом.
Массовое число
Массовое число — это общее количество протонов и нейтронов в ядре. Его легко определить, округлив атомный вес элемента до ближайшего целого числа.
Атомная масса написана в нижней части клетки, под символом элемента. Атомная масса представляет собой сумму масс частиц (протонов и нейтронов), составляющих ядро атома, и является средним значением, выраженным десятичной дробью для большинства элементов.
Например, атомная масса фосфора (P) составляет 30,97376, поэтому его массовое число (количество протонов и нейтронов в ядре) равно 31.
Валентность
Интенсивность — это свойство элемента, образующего химические связи.
Определить число валентных электронов из таблицы Менделеева несложно.
- Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
- Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 (всего 8 групп в таблице) вычесть № группы, в которой находится вещество.
Например, вещества первой группы главных подгрупп (Li, K) имеют валентность I, а элементы второй группы главных подгрупп (Mg, Ca) — валентность II. Мышьяк (As) относится к V группе главной подгруппы, поэтому его атомный показатель также равен V. Кроме того, вещество имеет еще одно атомное значение. Этот показатель определяется по приведенной выше формуле и равен III.
Если у вас есть трудности в обучении не только по химии, но и по другим предметам, обратитесь за помощью к образовательным ресурсам Phoenix.Help. Ни один предмет или задача не являются для нас слишком сложными!
Например, сравните значения EO атомов Te, In, Al и P.
Индий принадлежит к той же группе, что и алюминий, с увеличением значений EO In→Al (снизу вверх). Алюминий находится в том же цикле, что и сера, и EO-ост увеличивает Al→S (слева направо). Если сравнивать серу и теллур, то сера находится в группе выше теллура и поэтому также имеет более высокую электроотрицательность.
Периодическая таблица элементов Менделеева длинная форма
Длинная форма (или форма длинного периода) картины Менделеева состоит из 18 групп, от щелочных металлов до благородных газов, слева направо, и считается официальной версией с 1989 года.
Таблица Менделеева для печати в хорошем качестве скачать
Картины Менделеева можно скачать в малом или большом формате в цветном или черно-белом исполнении, открыв и сохранив изображения на своем компьютере по ссылке ниже.
____________
Источники.
1. большой химический справочник / А.И. Волков, — М.: 2005.
Большая энциклопедия химических элементов. Периодическая таблица Менделеева/И.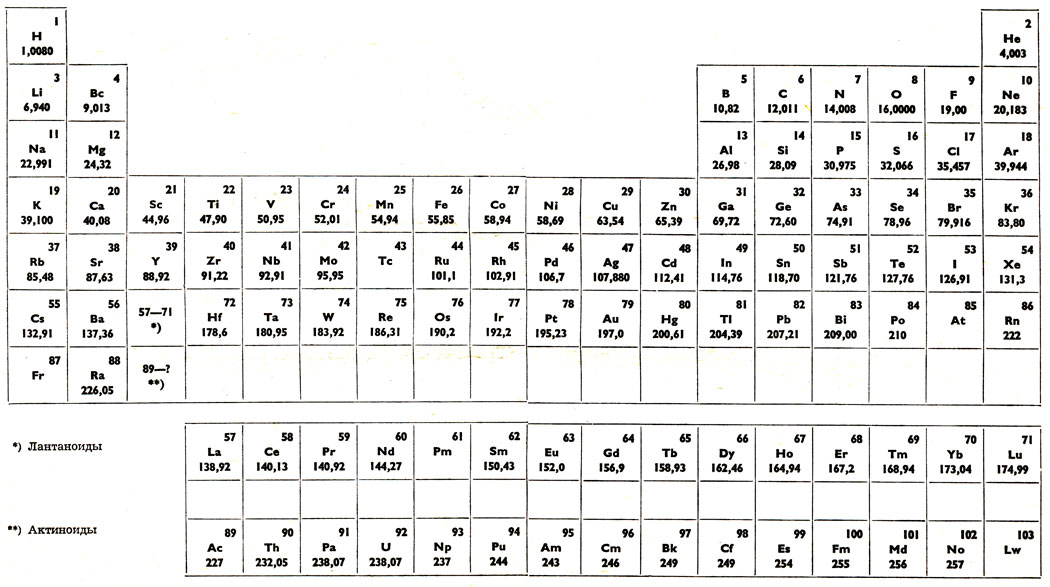 А. Леенсон. -Москва: 2014.
А. Леенсон. -Москва: 2014.
Металлы — это главные подгруппы (подгруппы IA, IIA, IIIA, исключая бор) с номерами электронов интенсивности 1-3, а также элементы германий, олово, свинец, сурьма, висмут и полоний.
Периодический закон
Периодический закон был открыт Д.-И. Менделеева в 1868 году. Его современная формулировка выглядит следующим образом. Свойства химических элементов и образующихся из них соединений (простых и сложных) периодически зависят от величины заряда ядра.
Периодические законы лежат в основе современных учений о строении материи. Периодическая таблица Д. Менделеева является наглядным отражением периодического закона.
В периодической таблице элементы расположены в порядке возрастания атомной нагрузки и сгруппированы в «ряды и столбцы» (циклы и группы).
Периоды — это ряд химических элементов, расположенных горизонтально. Периоды 1, 2 и 3 называются короткими периодами и состоят из ряда элементов. Периоды 4, 5 и 6 называются длительными и состоят из двух серий химических элементов.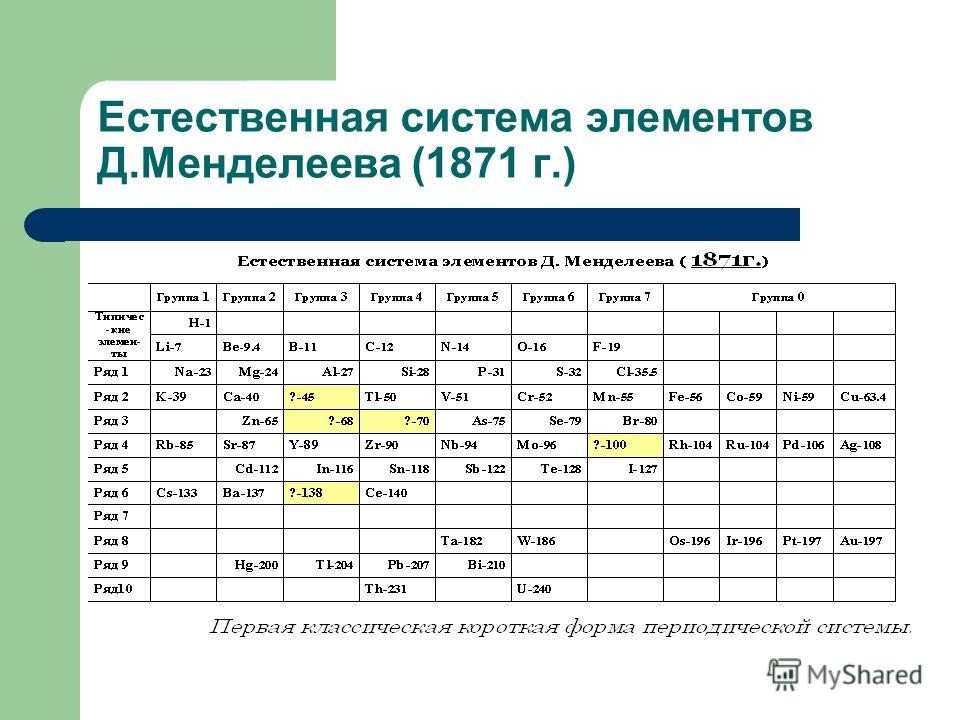
Группа — это вертикальный ряд химических элементов в периодической таблице. Элементы группируются по степени окисления до высшего оксида. Каждая из восьми групп состоит из главной подгруппы (a) и второстепенной подгруппы (b).
Периодическая таблица Д. Менделеева дает огромное количество ответов на самые разные вопросы. При правильном использовании его можно использовать для вывода структуры и свойств веществ, а также для успешной записи химических реакций при решении задач.
Атомный радиус
Атомный радиус — это расстояние между ядром и самым дальним орбитальным электроном. Он не является определенным, а представляет собой фиктивный предел, указывающий на наиболее вероятное положение электрона.
В данном периоде, по мере увеличения числа порядков элементов, атомный радиус уменьшается (‘→’ слева направо). Это происходит потому, что с увеличением числа групп увеличивается и число электронов на внешней поверхности. Обратите внимание, что для элементов главной подгруппы номер группы равен числу электронов на внешней поверхности.
По мере увеличения числа электронов их становится больше, поскольку они сильнее притягиваются друг к другу. Именно поэтому радиус атома мал.
Чем меньше электронов, тем больше степеней свободы и тем больше радиус атома, поэтому радиус увеличивается справа налево в течение периода ‘←’.
В группах радиус атома увеличивается по мере загрузки ядра — ‘↓’ сверху вниз. Чем длиннее период, тем больше электронных орбиталей вокруг атома, что приводит к увеличению радиуса атома.
По мере уменьшения нагрузки на индивида в группе, уменьшается его радиус — ‘↑’ снизу вверх. Это происходит из-за уменьшения числа орбитальных электронов вокруг атома. Возьмем для примера атомы элементов бора и алюминия, которые принадлежат к одной группе.
Периоды, группы и конфигурации электронов
И снова мы хотели бы подчеркнуть важную деталь. Одна и та же группа (главная подгруппа!) ) элементы, принадлежащие к одной группе, имеют схожие конфигурации внешнего слоя. Таким образом, бор имеет три электрона на своей внешней поверхности, и алюминий также имеет три электрона на своей внешней поверхности. Оба относятся к группе III.
Оба относятся к группе III.
Такие детали могут значительно облегчить жизнь, но не присутствуют в элементах подгрупп. В подгруппах электроны должны быть размещены на электронных орбиталях и измерены «вручную».
Фармацевтическая таблица Менделеева | Бизнес-журнал Status
Придумав и воплотив в жизнь концепцию аптеки «Менделеевъ», бизнесмены-строители Павел Стасевич и Павел Кимсоздали нечто большее, чем банальные точки торговли лекарственными средствами. Аптека «Менделеевъ», устроенная по европейскому образцу, стала уникальным уголком в Новосибирске. Интерьером она напоминает музей, а атмосферой — уютное кафе. Предприниматели надеются, что их пример вдохновит коллег, ведь,по их мнению, чтобы добиться успеха, важно не столько профильное образование,сколько желаниесделать что-то полезноеикомфортное для людей.
Исторические диковинки с аукциона
Первое упоминание об аптекарях в России относится к временам Ивана Грозного. Именно тогда была создана Государева аптека, которая затем преобразовалась в Аптекарский приказ. Дальнейшему развитию сферыспособствовали реформы Петра I, а настоящего расцветаотечественная фармацевтика достигла в девятнадцатом веке. С аптеками традиционно связывали мистические истории. Так, об известной аптеке Вильгельма Пеля в Петербурге, которая сейчас действует в качестве музея,говорят, что она была лабораторией алхимика. Городские легенды утверждают, что знаменитый химик Дмитрий Иванович Менделеев частенько захаживал в гости к аптекарю Пелю и совместно с ним пришёл к открытию периодическойтаблицы химических элементов.Мы назвали нашу аптеку в честь Менделеева во многом потому, что именно с его именем связывают всю химическую и фармацевтическую отрасль. И именно таблица Менделеева украшает интерьер нашей аптеки. Мы нашли старое учебное пособие на специальном аукционе, где оно продавалось вместе со всевозможными аутентичными аптекарскими склянками: колбами, бутылками для микстур и прочим. Всё это отлично вписалось в наш дизайн.
Дальнейшему развитию сферыспособствовали реформы Петра I, а настоящего расцветаотечественная фармацевтика достигла в девятнадцатом веке. С аптеками традиционно связывали мистические истории. Так, об известной аптеке Вильгельма Пеля в Петербурге, которая сейчас действует в качестве музея,говорят, что она была лабораторией алхимика. Городские легенды утверждают, что знаменитый химик Дмитрий Иванович Менделеев частенько захаживал в гости к аптекарю Пелю и совместно с ним пришёл к открытию периодическойтаблицы химических элементов.Мы назвали нашу аптеку в честь Менделеева во многом потому, что именно с его именем связывают всю химическую и фармацевтическую отрасль. И именно таблица Менделеева украшает интерьер нашей аптеки. Мы нашли старое учебное пособие на специальном аукционе, где оно продавалось вместе со всевозможными аутентичными аптекарскими склянками: колбами, бутылками для микстур и прочим. Всё это отлично вписалось в наш дизайн.
Оригинальная идея Master Project
Мы никогда не были связаны с фармацевтикой, наш вид деятельности— строительный бизнес. В этом есть плюс: когда у предпринимателя есть незашоренный взгляд на новую сферу деятельности, то появляются такие свежие идеи. Людям надо быть смелее в реализации своих задумок.Мы убедились, что для начала нового дела не нужно иметь специальное образование, достаточно желания сделать что-то хорошее для людей. Узнав о проекте, многие советовали нам взять стандартную аптечную франшизу с проработанной линейкой товаров. Но нам не интересно делать проект, который не будет отличаться от других.
В этом есть плюс: когда у предпринимателя есть незашоренный взгляд на новую сферу деятельности, то появляются такие свежие идеи. Людям надо быть смелее в реализации своих задумок.Мы убедились, что для начала нового дела не нужно иметь специальное образование, достаточно желания сделать что-то хорошее для людей. Узнав о проекте, многие советовали нам взять стандартную аптечную франшизу с проработанной линейкой товаров. Но нам не интересно делать проект, который не будет отличаться от других.
В разработке визуальной концепции нам очень помог наш опыт общения с архитекторами и проектировщиками, в частности в Данилой Хазовым, руководителем архитектурного бюро Master Project. Среди его работ—интерьеры бань«Паровозовъ», Федоровских бань, ресторанаVinoZerno и других заведений. Дизайн «Менделеева» мы придумали совместно, проработаввсе детали: нам хотелось дистанцироваться от ассоциаций с обычными аптеками —одинаковымиказённымиучреждениямив холодныхбелых тонах.
Всё для людей
Аптека «Менделеевъ» — это европейский тип аптеки с открытым доступом к продукции в торговом зале. Когда мы рассматривали эту концепцию, то отталкивались от ментальности жителей «Европейского берега»— жилого комплекса, где расположена наша аптека. Это молодые, продвинутые люди, ориентированные на здоровье, комфорт и целесообразность, которые они видели за границей и привыкли к ним.
Когда мы рассматривали эту концепцию, то отталкивались от ментальности жителей «Европейского берега»— жилого комплекса, где расположена наша аптека. Это молодые, продвинутые люди, ориентированные на здоровье, комфорт и целесообразность, которые они видели за границей и привыкли к ним.
Наша идея была в том, чтобы создать уютный уголок. Мы хотим, чтобы, приходя в аптеку, люди отвлекались от своих болезней и просто получали удовольствие от комфортного проведения времени.У нас позитивная обстановка, приятная фоновая музыка, удобные диваны и столики в зоне отдыха и даже есть пункт буккроссинга. Каждое утро можно попробовать свежезаваренные алтайские чаи. В торговом зале выделены специальные зоны под витамины, косметику и товары для младенцев. В «Менделееве» есть детский уголок, ведь к нам приходит много мамочек с детьми. Мы даже придумали специальные маленькие корзиночки, чтобы клиентам было удобнее совершать покупки.Мы уверены, что все эти приятные мелочи формируют лояльное отношение покупателей.
Мы максимально чувствительны к спросу клиентов и, прислушиваясь к мнению каждого посетителя, регулярно дополняем наш ассортимент в «ручном» режиме. Это очень сильно отличает нас от сетевых аптек. Мы стремимся создать что-то вроде «семейной» аптеки, где всегда помогут и подскажут, что приобрести для здоровья, а если чего-то нет, то фармацевты оперативно закажут необходимое. Наша миссия заключается в гибкости подхода и удовлетворении потребностей клиентов на 100%.
Бесконтактное обслуживание и уникальные товары
Наши провизоры избегают навязчивости в продажах, мы не берём премиальные от поставщиков, ведь это стимулирует продавать не то, что нужно покупателям, а то, что хотят фармкомпании. Показатель того, что людям нравится наш проект— это растущее количество постоянных клиентов и увеличение сумм покупок по картам лояльности.
«Менделеевъ» — это аптека самообслуживания, поэтому наши клиенты могут совершать покупки без прямого контакта с провизором. Разумеется, всё в аптеке тщательно обрабатывается атнисептиками, а сейчас, специальнодля тех, кто остается дома, мы дополнительно ввели доставку нерецептурных препаратов.
Разумеется, всё в аптеке тщательно обрабатывается атнисептиками, а сейчас, специальнодля тех, кто остается дома, мы дополнительно ввели доставку нерецептурных препаратов.
Вообще, мы делаем акцент на здоровье и укреплении иммунитета. Поэтому мы привезли в Новосибирск уникальный южно-корейский красный женьшень, а также алтайский пантогематоген. Мы понимаем, что сегодня хороший иммунитет особенно важен, и, побывав вмараловодческом хозяйстве на заимке «Камза», лично убедились в качестве продукта.Мы стремимся к тому, чтобы человек купил у нас всё необходимое и подольше не возвращался в аптеку, как бы это ни было грустно для нас, как для бизнесменов.
Аптека «Менделеевъ»
ул. Владимира Заровного, 26
пер. Твардовского, 13
тел. +7-913-000-13-63
@apteka_mendeleev
Текст: Софья Колотова
Фото: Сергей Мордвинов
Комментарии (0)
Учреждена Главная палата мер и весов
8 (20) июня 1893 г. в Санкт-Петербурге по инициативе Дмитрия Ивановича Менделеева, учёного-хранителя Депо образцовых мер и весов, «для сохранения в государстве единообразия, верности и взаимного соответствия мер и весов» была учреждена Главная палата мер и весов — научный метрологический центр России.
в Санкт-Петербурге по инициативе Дмитрия Ивановича Менделеева, учёного-хранителя Депо образцовых мер и весов, «для сохранения в государстве единообразия, верности и взаимного соответствия мер и весов» была учреждена Главная палата мер и весов — научный метрологический центр России.
Главная палата мер и весов являлась центральным учреждением Министерства финансов; она заведовала поверочной частью в Российской империи и подчинялась отделу торговли.
Под руководством Менделеева в Главной палате мер и весов была создана система национальных эталонов, соответствующих мировому уровню науки и техники, установлены точные соотношения между русскими и метрическими мерами, что дало возможность подготовить страну к постепенному переходу на международную метрическую систему единиц.
В обязанности Главной палаты входило: хранение основных образцов (прототипов) единиц веса и меры, принятых в России, а также копий с образцов иностранных единиц веса и меры; изготовление точных копий с основных образцов мер и весов, служащих областным и губернским поверочным учреждениям для поверки торговых мер и весов, а также периодическая поверка этих копий с основными образцами; выверка доставленных правительственными местами, общественными и частными учреждениями и лицами копий с основных образцов единиц мер и веса, принятых в России и за границей; испытания и выверки разного рода специальных измерительных приборов, применяемых в торговле и промышленности, за исключением спиртомеров и других снарядов, служащих для учёта акциза; составление сравнительных таблиц русских и иностранных мер, установление наибольших погрешностей, допускаемых в образцовых и торговых мерах, а также решение различных метрологических вопросов.
По заданию Д. И. Менделеева в 1893-1897 гг. инспекторы Главной палаты произвели внезапные ревизии в поверочных учреждениях, а также на почтамтах, фабриках, заводах, в таможнях, кустарных мастерских и в различных торговых заведениях. Как показали ревизии, в 15-ти губерниях поверка мер и весов вообще не производилась, а в 56-ти — производилась на крайне низком уровне. Недоставало образцовых мер, а те, которыми пользовались, были неисправны, зачастую на применяемых мерах клейма о поверке либо отсутствовали совсем, либо были двадцатилетней давности.
По закону 1901 г. на Главную палату было возложено заведование местными поверочными палатками и их временными отделениями, распределение по тем и другим состоявших при Палате поверителей, а также ведение отчётности по поступлению в казну сборов за клеймение мер и весов.
После Октябрьской революции Главная палата мер и весов была подчинена Народному комиссариату торговли и промышленности, а декретом СНК РСФСР от 19 октября 1920 г. она была передана в ведение научно-технического отдела ВСНХ. В 1922 г. было принято новое Положение о Главной палате, в соответствии с которым она была разделена на два института: метрологический и поверочный, объединённые единым руководством президента.
она была передана в ведение научно-технического отдела ВСНХ. В 1922 г. было принято новое Положение о Главной палате, в соответствии с которым она была разделена на два института: метрологический и поверочный, объединённые единым руководством президента.
В 1931 г. Главная палата была реорганизована во Всесоюзный институт метрологии и стандартизации (ВИМС), на базе которого в 1934 г. был образован Всесоюзный научно-исследовательский институт метрологии им. Д. И. Менделеева (ВНИИМ, им. Д. И. Менделеева).
В годы Великой Отечественной войны часть сотрудников института и ряд государственных эталонов были эвакуированы в Свердловск. Деятельность оставшихся в Ленинграде лабораторий (электрической, манометрической, радиологической, химической и др.) была направлена на выполнение заказов фронта и оборонной промышленности. Служба времени института и эталон времени не прекращали свою работу даже в период блокады города.
10 января 1945 г. ВНИИМ было присвоено имя основоположника научной метрологии Д. И. Менделеева.
И. Менделеева.
В 1971 г. ВНИИМ был награждён орденом Трудового Красного Знамени. Важной вехой в истории института было создание в 1977 г. на его базе научно-производственного объединения (НПО «ВНИИМ им. Д. И. Менделеева»).
В 1994 г. объединение было реорганизовано в Государственное предприятие «Всероссийский научно-исследовательский институт метрологии им. Д. И. Менделеева». В июле 1994 г. Постановлением Правительства РФ ВНИИМ был присвоен статус Государственного научного центра РФ. Как Государственный научный центр РФ ВНИИМ подчинён Министерству образования и науки России и входит в Ассоциацию государственных научных центров.
Сегодня ВНИИМ является одним из крупнейших мировых центров научной и практической метрологии, головной организацией страны по фундаментальным исследованиям в метрологии и главным центром государственных эталонов России.
Лит.: Высшие и центральные государственные учреждения России 1801—1917. Т. 2. СПб., 2001. Из содерж. : Главная палата мер и весов 08.06.1893—[…] 1931. С. 160—161; Гинак Е. Б. Меры и весы [Электронный ресурс] // Метрологический музей Госстандарта России при ВНИИМ им. Д. И. Менделеева. 2003. URL: http://museum.vniim.ru/files/mer.pdf; Гинак Е. Б. «Тут чистая наука тесно переплеталась с практической» // Санкт-Петербургский университет. 2009. № 17; История ВНИИМ [Электронный ресурс] // ВНИИМ им. Д. И. Менделеева. 2001-2019. URL: http://www.vniim.ru/history.html; Младенцев М. Н. Учреждение Главной палаты мер и весов и её деятельность // Временник Главной палаты мер и весов. Ч. 8. СПб., 1907.
: Главная палата мер и весов 08.06.1893—[…] 1931. С. 160—161; Гинак Е. Б. Меры и весы [Электронный ресурс] // Метрологический музей Госстандарта России при ВНИИМ им. Д. И. Менделеева. 2003. URL: http://museum.vniim.ru/files/mer.pdf; Гинак Е. Б. «Тут чистая наука тесно переплеталась с практической» // Санкт-Петербургский университет. 2009. № 17; История ВНИИМ [Электронный ресурс] // ВНИИМ им. Д. И. Менделеева. 2001-2019. URL: http://www.vniim.ru/history.html; Младенцев М. Н. Учреждение Главной палаты мер и весов и её деятельность // Временник Главной палаты мер и весов. Ч. 8. СПб., 1907.
Всероссийский научно-исследовательский институт метрологии имени Д. И. Менделеева: сайт. 2001-2019. URL: http://www.vniim.ru.
См. также в Президентской библиотеке:
Менделеев Д. И. К познанию России: с приложением карты России. СПб., 1907;
Менделеев Д. И. Толковый тариф, или Исследование о развитии промышленности России в связи с её общим таможенным тарифом 1891 года. СПб., 1892;
СПб., 1892;
Палата (главная) мер и весов // Энциклопедический словарь / Под ред. проф. И. Е. Андреевского. Т. 22а. СПб., 1897. С. 603;
Полное собрание законов Российской империи. Т. 13 (1893). СПб., 1897. № 9747. С. 420.
150 лет периодической таблице Менделеева
У каждой области науки есть свой любимый юбилей. Для физики это «Принципы Ньютона» 1687 года, книга, которая ввела законы движения и гравитации. Биология празднует дарвиновское «Происхождение видов» (1859) вместе с его днем рождения (1809). Поклонники астрономии отмечают 1543 год, когда Коперник поместил Солнце в центр Солнечной системы.
А что касается химии, ни одна причина для празднования не превосходит происхождение периодической таблицы элементов, созданной 150 лет назад в марте 1869 года русским химиком Дмитрием Ивановичем Менделеевым.
Таблица Менделеева стала такой же привычной для студентов-химиков, как электронные таблицы для бухгалтеров. Она суммирует всю науку в чуть более 100 квадратах, содержащих символы и числа.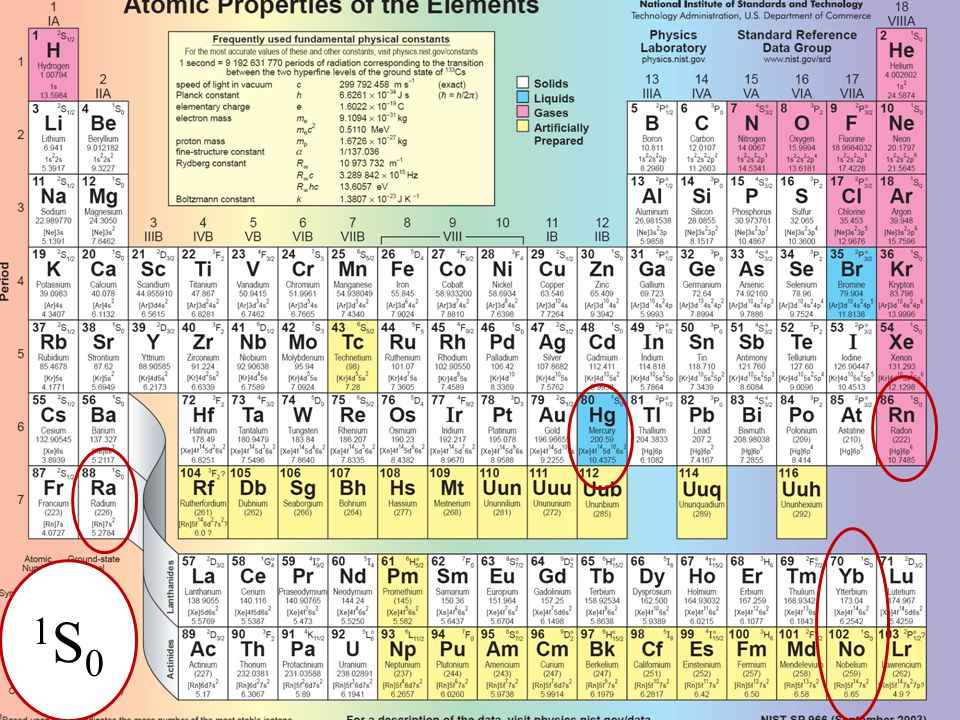
Она перечисляет элементы, из которых состоят все земные вещества, устроенные таким образом, чтобы выявить закономерности в их свойствах, направляя химическое исследование как в теории, так и на практике.
Таблица Менделеева выглядела как специальная таблица, но ученый хотел, чтобы таблица отражала глубокую научную истину, которую он открыл: периодический закон.
Его закон выявил глубокие «семейные отношения» между известными химическими элементами — они проявляли подобные свойства через регулярные промежутки (или периоды), когда были расположены в порядке их атомного веса — что позволило Менделееву предсказать существование элементов, которые еще не были обнаружены.
«До обнародования закона химические элементы были просто фрагментарными, случайными фактами в Природе», — заявил Менделеев. «Закон периодичности сначала позволил нам увидеть неоткрытые элементы на расстоянии, которое раньше было недоступно для химического зрения».
Таблица Менделеева не только предсказала существование новых элементов. Она подтвердила противоречивую веру в реальность атомов. Она намекала на существование субатомной структуры и предвидела математический аппарат, лежащий в основе правил, управляющих материей, которые в конечном итоге проявили себя в квантовой теории.
Она подтвердила противоречивую веру в реальность атомов. Она намекала на существование субатомной структуры и предвидела математический аппарат, лежащий в основе правил, управляющих материей, которые в конечном итоге проявили себя в квантовой теории.
Таблица завершила превращение химической науки из средневекового магического мистицизма и алхимии в область современной научной строгости. Периодическая таблица символизирует не только составляющие части материи, но и логическую убедительность и принципиальную рациональность всей науки.
Периодическая таблица Менделеева, опубликованная в 1869 году, представляла собой вертикальную диаграмму, которая организовывала 63 известных элемента по атомному весу. Такое расположение помещает элементы с похожими свойствами в горизонтальные ряды.Заложить фундаментЛегенда гласит, что Менделеев задумал и создал свою таблицу за один день: 17 февраля 1869 года по старому стилю (1 марта). Но это, наверное, преувеличение. Менделеев годами думал о группировке элементов, а другие химики несколько раз рассматривали понятие связей между элементами в предыдущие десятилетия.
На самом деле немецкий химик Иоганн Вольфганг Доберейнер заметил особенности группирования элементов еще в 1817 году. В те дни химики еще не полностью поняли природу атомов, как это описано в теории атома, предложенной английским школьным учителем Джоном Далтоном в 1808 году.
В своей «Новой системе химической философии» Далтон объяснил химические реакции, предположив, что каждое элементарное вещество состоит из атома определенного типа.
Химические реакции, предложил Далтон, производят новые вещества, когда атомы разъединяются или соединяются. Любой данный элемент, рассуждал он, полностью состоял из атома одного вида, отличающегося от других по весу.
Атомы кислорода весили в восемь раз больше атомов водорода; атомы углерода были в шесть раз тяжелее водорода, полагал Далтон. Когда элементы объединяются для создания новых веществ, количество реагирующих веществ может быть рассчитано с учетом этих атомных весов.
Далтон ошибался насчет некоторых весов — кислород действительно в 16 раз больше веса водорода, а углерод в 12 раз тяжелее водорода. Но его теория сделала идею об атомах полезной, вдохновив на исследования других ученых. Измерение точного атомного веса стало основной проблемой для химиков в последующие десятилетия.
Но его теория сделала идею об атомах полезной, вдохновив на исследования других ученых. Измерение точного атомного веса стало основной проблемой для химиков в последующие десятилетия.
Размышляя об атомных массах, Иоганн Доберейнер отметил, что определенные наборы из трех элементов (он назвал их триадами) показали своеобразную связь. Например, бром имел атомную массу на полпути между массами хлора и йода, и все три элемента демонстрировали сходное химическое поведение. Литий, натрий и калий также были триадой.
Другие химики тоже понимали связь между атомным весом и химическими свойствами, но только в 1860-х годах атомные веса были достаточно хорошо поняты и измерены, чтобы появилось более глубокое понимание.
В Англии химик Джон Ньюландс заметил, что расположение известных элементов в порядке увеличения атомного веса приводило к повторению химических свойств каждого восьмого элемента, модель, которую он назвал «законом октав» в статье 1865 года.
Но модель Ньюландса не очень хорошо работала после первых двух октав, что заставило критиков предложить ему вместо этого расположить элементы в алфавитном порядке. Очевидно, что взаимосвязь свойств элементов и атомных весов была немного более сложной, как вскоре понял Менделеев.
Очевидно, что взаимосвязь свойств элементов и атомных весов была немного более сложной, как вскоре понял Менделеев.
Менделеев родился в городе Тобольске, в Сибири, в 1834 году (17-й ребенок в семье). Во время получения своего высшего образования в педагогическом институте в Санкт-Петербурге он чуть не умер от тяжелой болезни.
После окончания он преподавал в средних школах (требование для получения стипендии в учебном институте), а во время преподавания математики и естественных наук он проводил исследования для получения степени магистра.
Затем он работал преподавателем и лектором, пока не получил стипендию для стажировки в самых известных университетских химических лабораториях Европы.
По возвращению в Санкт-Петербург, он вернулся к исследованиям, получив докторскую степень в 1865 году, а затем становится профессором в Петербургском университете.
Вскоре после этого Менделеев начал преподавать неорганическую химию. Готовясь освоить это новое (для него) поле, он не был впечатлен имеющимися учебниками. Поэтому он решил написать свой. Организация текста требовала упорядочения элементов, поэтому вопрос о том, как лучше их расположить, постоянно занимал его.
Готовясь освоить это новое (для него) поле, он не был впечатлен имеющимися учебниками. Поэтому он решил написать свой. Организация текста требовала упорядочения элементов, поэтому вопрос о том, как лучше их расположить, постоянно занимал его.
К началу 1869 года Менделеев добился достаточного прогресса, чтобы понять, что некоторые группы подобных элементов демонстрировали регулярное увеличение атомных весов; другие элементы с примерно одинаковыми атомными весами имеют общие свойства. Оказалось, что упорядочение элементов по их атомному весу было ключом к их классификации.
По собственным словам Менделеева, он структурировал свое мышление, записав каждый из 63 известных элементов в индивидуальной записной карточке.
Затем, посредством своего рода игры в химический пасьянс, он нашел образец, который искал. Располагая карточки в вертикальных столбцах с атомными весами от низкого до более высокого, он размещал элементы с похожими свойствами в каждом горизонтальном ряду.
1 марта Менделеев включил таблицу в свой учебник, который скоро будет опубликован и подготовил доклад для представления российскому химическому обществу.
«Элементы, упорядоченные по размеру их атомных весов, показывают четкие периодические свойства», — заявил Менделеев в своей статье. «Все сравнения, которые я провел … привели меня к выводу, что размер атомного веса определяет природу элементов».
Менделеев использовал свою таблицу, чтобы сделать смелые прогнозы о неоткрытых элементах. Готовя ее, Менделеев должен был оставить пустые места, чтобы заставить известные элементы правильно расположиться. В течение его жизни три из этих пустых мест были заполнены ранее неизвестными элементами галлия, скандия и германия.
Менделеев не только предсказал существование этих элементов, но также правильно описал их свойства в деталях. Например, галлий, открытый в 1875 году, имел атомный вес (измеренный тогда) 69,9 и плотность, в шесть раз превышающую плотность воды.
Менделеев предсказал элемент (он назвал его eka-aluminium) с той же плотностью и атомным весом 68. Его предсказания для eka-кремния близко соответствовали германию (обнаруженному в 1886 году) в атомном весе (72 против 72. 3 по факту) и плотности (5,5 против 5,469). Он также правильно предсказал плотность соединений германия с кислородом и хлором.
3 по факту) и плотности (5,5 против 5,469). Он также правильно предсказал плотность соединений германия с кислородом и хлором.
К 1890-м годам химики широко признали таблицу Менделеева как веху в химическом знании. В 1900 году будущий нобелевский лауреат по химии Уильям Рамсей назвал ее «величайшим обобщением, которое до сих пор было сделано в химии».
К моменту смерти Менделеева в 1907 году ученые знали, что атомы имеют части: электроны, которые несут отрицательный электрический заряд, плюс некоторый положительно заряженный компонент, делающий атомы электрически нейтральными.
Ключевой ключ к тому, как эти части были расположены, появился в 1911 году, когда физик Эрнест Резерфорд, работающий в Манчестерском университете в Англии, обнаружил атомное ядро.
Вскоре после этого Генри Мозли, физик, который работал с Резерфордом, продемонстрировал, что количество положительного заряда в ядре (количество протонов, которые оно содержит, или его «атомный номер») определяет правильный порядок элементов в периодической таблице.
Атомный вес был тесно связан с атомным номером Мозли — достаточно близко, чтобы упорядочение элементов по весу отличалось всего в нескольких точках от упорядочения по номеру. Менделеев настаивал на том, что эти веса были неправильными и нуждались в повторном измерении, и в некоторых случаях он был прав. Некоторые расхождения остались, но атомный номер Мозли привел таблицу в порядок.
Примерно в то же время датский физик Нильс Бор понял, что квантовая теория управляет расположением электронов вокруг ядра и что внешние электроны определяют химические свойства элемента.
В версии периодической таблицы датского физика Нильса Бора 1922 года, адаптированной из таблицы химика Юлиуса Томсена, элементы с аналогичными свойствами занимают горизонтальные ряды, соединенные линиями. Пустое поле справа отмечает ожидаемое вхождение группы элементов, которые химически похожи на редкоземельные элементы (номера 58–70) в предыдущем столбце.Подобные расположения внешних электронов будут периодически повторяться, объясняя закономерности, которые первоначально обнаружила таблица Менделеева.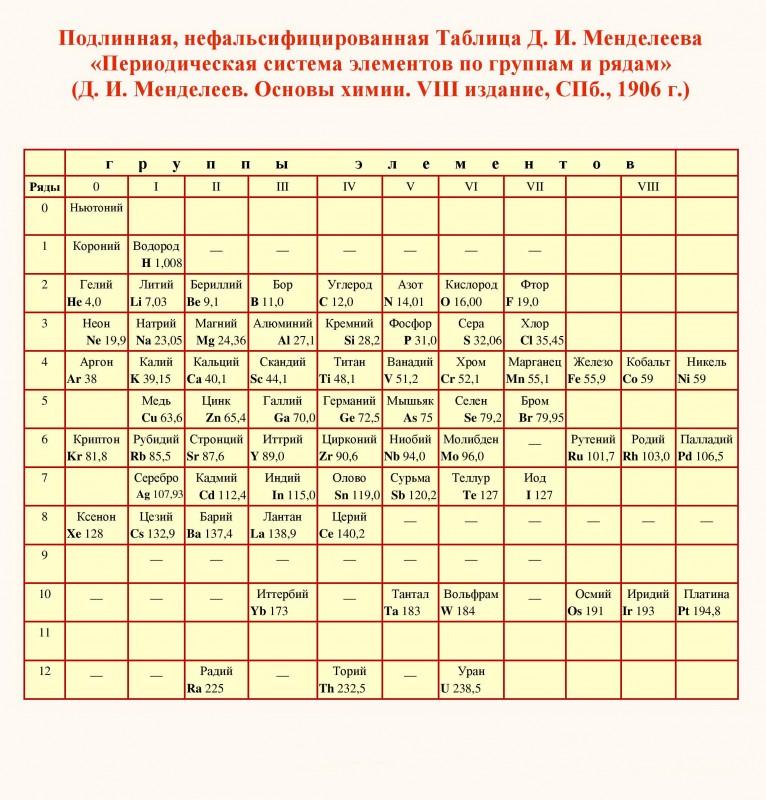 Нильс Бор создал свою собственную версию таблицы в 1922 году, основываясь на экспериментальных измерениях энергий электронов (наряду с некоторыми указаниями из периодического закона).
Нильс Бор создал свою собственную версию таблицы в 1922 году, основываясь на экспериментальных измерениях энергий электронов (наряду с некоторыми указаниями из периодического закона).
Таблица Бора добавила элементы, открытые с 1869 года, но, по сути, это был периодический механизм, который открыл Менделеев. Не имея тогда ни малейшего понятия о квантовой теории, Менделеев создал таблицу, отражающую атомную архитектуру, которую диктовала квантовая физика.
Периодическая система Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях.
По решению ООН, 2019 год объявлен Международным годом периодической таблицы химических элементов.
История периодической таблицы
Коротко об изобретении периодической таблицы:
В 1869 году Дмитрий Менделеев создал первую вариацию периодической таблицы в том виде, в каком мы ее знаем сегодня. Он был первым человеком, который упорядочил элементы, увеличив атомную массу, и оставил места открытыми для элементов, которые еще не были открыты.
Он был первым человеком, который упорядочил элементы, увеличив атомную массу, и оставил места открытыми для элементов, которые еще не были открыты.
Почему история периодической таблицы имеет значение:
История периодической таблицы — увлекательная история и прекрасный пример того, как «хорошие дела требуют времени». Размышляя о процессе разработки, возможно, самой важной таблицы, известной человеку, мы можем многое узнать о том, что делать (и чего не делать), если человечество захочет изобретать подобные замечательные вещи в будущем.
Возможно, просто невозможно перечислить каждый вклад, внесенный в разработку периодической таблицы, но в этой статье мы выделяем наиболее важный и интересный поворот событий в появлении периодической таблицы.
Кто первым создал периодическую таблицу элементов?
В 16 и 17 веках ученых интересовали свойства различных материалов. По мере того, как постепенно открывалось все больше элементов, ученые начали отходить от древнегреческого представления об элементе как об абстрактной субстанции со свойствами к более современному представлению об элементах как о мельчайших строительных блоках Вселенной. Это оставило открытым несколько важных вопросов, которые будут занимать ученых всего мира на протяжении столетий. Сколько элементов? Существует ли естественный закон, по которому могут располагаться элементы?
По мере того, как постепенно открывалось все больше элементов, ученые начали отходить от древнегреческого представления об элементе как об абстрактной субстанции со свойствами к более современному представлению об элементах как о мельчайших строительных блоках Вселенной. Это оставило открытым несколько важных вопросов, которые будут занимать ученых всего мира на протяжении столетий. Сколько элементов? Существует ли естественный закон, по которому могут располагаться элементы?
Ученые 16-го и 17-го века были готовы на все, чтобы найти ответы на эти жизненно важные вопросы.
Краткая история периодической таблицы элементов: инфографикаСкачать:
Начало битвы за периодическую таблицу
1669
Немецкий торговец и алхимик-любитель Хенниг Бранд попытался создать философский камень. Как и многие другие, потерпевшие неудачу, Брэнд тоже, но он и не подозревал, что его действия принесут ему место в книгах по истории науки. Он кипятил горшок с мочой в течение нескольких дней, пока в процессе не образовалось загадочное светящееся вещество, которое было чрезвычайно легко воспламеняющимся. Он был одним из первых, кто открыл фосфор.
Как и многие другие, потерпевшие неудачу, Брэнд тоже, но он и не подозревал, что его действия принесут ему место в книгах по истории науки. Он кипятил горшок с мочой в течение нескольких дней, пока в процессе не образовалось загадочное светящееся вещество, которое было чрезвычайно легко воспламеняющимся. Он был одним из первых, кто открыл фосфор.
1789
Антуан Лавуазье, французский дворянин и химик, составил список из тридцати трех элементов. Возможно, это первая создаваемая таблица элементов. Многие из элементов в его списке больше не считаются элементами.
1801
Джон Дальтон начал опираться на работы Лавуазье и немецкого химика Иеремии Бенджамина Рихтера. Он опубликовал свою работу, ставшую началом современной атомной теории, где он оценил относительные веса элементов.
1809
Александр фон Гумбольдт и Жозеф Луи Гей-Люссак открыли двухатомные молекулы, которые поставили под сомнение часть теорий Дальтона.
1813
Шведский химик Йонс Якоб Берцелиус впервые ввел буквенные символы для обозначения химических элементов. Такой подход только сейчас кажется логичным, но в то время он был замечательным нововведением.
1817
Немецкий химик Иоганн Вольфганг Доберейнер открыл существование групп элементов со сходными химическими свойствами. Он назвал эти группы «трайдами».
1862
Александр-Эмиль Бегуйе де Шанкуртуа, французский геолог, первым обнаружил, что подобные элементы появляются периодически. Он создал трехмерную спираль, выгравировав элементы вокруг металлического цилиндра. Теллурический винт располагал элементы по возрастанию атомного веса, так что один полный оборот соответствовал увеличению атомного веса на 16. При его расположении элементы со сходными химическими свойствами располагались на вертикальной линии.
В том же году Лотар Мейер создал две таблицы элементов, одна из которых состояла из двадцати восьми элементов, расположенных в порядке возрастания атомного веса.
1863
Английский химик Джон Ньюлендс разделил известные на тот момент 56 элементов на 11 групп на основе химических свойств. Ньюлендс заметил, что между элементами с атомным весом, различающимся на восемь или несколько кратных восьми, есть сходство. Он назвал эту систему Законом Октав, проводя сравнение с октавами музыки. Ньюлендс не оставлял в своей таблице пробелов для неоткрытых элементов, и иногда ему приходилось втискивать два элемента в одно поле, чтобы сохранить закономерность. Королевское химическое общество отказалось публиковать его статьи из-за неорганизованного характера его таблицы, а один профессор сказал, что он мог бы точно так же перечислить элементы в алфавитном порядке.
1868
В обновлении своего учебника Лотар Мейер создал таблицу, в которой элементы перечислены в порядке атомного веса, где элементы с одинаковой валентностью расположены вертикальными линиями. Он даже оставил пробелы для еще не открытых в то время элементов, что поразительно похоже на модель, построенную Менделеевым всего год спустя. К несчастью для Мейера, таблица не вошла в последнее издание его книги и была опубликована лишь через несколько лет, после его смерти в 189 г.5.
К несчастью для Мейера, таблица не вошла в последнее издание его книги и была опубликована лишь через несколько лет, после его смерти в 189 г.5.
Периодическая таблица, какой мы ее знаем сегодня
1869
Русский химик Дмитрий Иванович Менделеев создал первый вариант периодической таблицы в том виде, в каком мы ее знаем сегодня. 17 февраля 1869 года Менделеев решил отменить поездку на сыроварню для работы над своей таблицей Менделеева. Той ночью он перечислил символы элементов на обратной стороне своего приглашения на сыроварню, пока не набросал всю периодическую таблицу элементов. Настоящая гениальность творения Менделеева заключалась в том, что он оставил пробелы для неоткрытых элементов и чрезвычайно точно предсказал их существование и свойства. В то время было известно всего шестьдесят три элемента, и Менделеев правильно предсказал открытие еще нескольких. Его таблица даже скорректировала атомный вес существующих элементов и переместила другие на их правильные позиции в периодической таблице. Его периодическая таблица была обнародована 6 марта 1869 года.на заседании Русского химического общества.
Его периодическая таблица была обнародована 6 марта 1869 года.на заседании Русского химического общества.
1894
Сэр Уильям Рамсей и лорд Рэлей открыли первый благородный газ, аргон. Газ, казалось, не вписывался в таблицу Менделеева и беспокоил ученых в течение шести лет, пока, наконец, не было осознано, что он является дополнительным доказательством существующей системы периодической таблицы, вписываясь в последнюю группу в периодической таблице.
1913
Через шесть лет после смерти Менделеева последний фрагмент головоломки встал на свои места. Английский физик Генри Мозли наконец определил, почему некоторые элементы в таблице Менделеева не вписываются в предсказанные ею группы. Когда Мозли начал упорядочивать элементы по атомному номеру, а не по атомному весу, структура современной периодической таблицы была на месте.
1932
Джеймс Чедвик открыл нейтрон. Открытие нейтрона быстро изменило взгляд ученых на атом, и в 1935 году Чедвик был удостоен Нобелевской премии за это открытие.
1945
Американский химик Гленн Т. Сиборг предложил классификацию лантаноидов и актинидов (атомные номера > 92), которые обычно располагаются под таблицей Менделеева.
2016
В периодическую таблицу были добавлены четыре новых элемента, элементы со 113 по 118.
Каково будущее Периодической таблицы?
Ученые считают, что можно было бы создать элементы 119 и 120, и не видят причин, по которым мы не смогли бы пойти дальше этого. Кто знает, может быть, 119-й элемент будет назван в вашу честь.
Что мы узнали из истории периодической таблицы элементов:
Люди обладают невероятными способностями к открытиям и изобретениям, но мы могли бы работать намного эффективнее, если бы работали вместе. В 1860-х годах по крайней мере 5 химиков работали над одной и той же проблемой создания периодической таблицы элементов.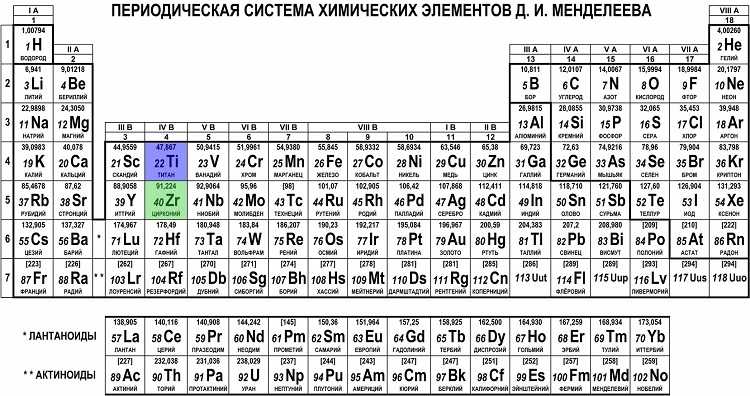 Если бы только два из этих блестящих умов собрались вместе и поделились своими знаниями, мы могли бы сделать этот мир научным изобретением за много лет до того, как Менделеев наткнулся на него в 1869 году.
Если бы только два из этих блестящих умов собрались вместе и поделились своими знаниями, мы могли бы сделать этот мир научным изобретением за много лет до того, как Менделеев наткнулся на него в 1869 году.
Смешные анекдоты и каламбуры про Периодическую таблицу:
Когда элементы видят кражу, кому они сообщают о преступлении? The Copper
Нейтрон спрашивает бармена, сколько стоит напиток. Бармен говорит: «Для вас бесплатно».
Кто изобрел периодическую таблицу?
Эта запись была опубликована Анной Хельменстин (обновлено )
Химики обычно приписывают Дмитрию Менделееву изобретение периодической таблицы, которая привела к современной версии.
Если вы спросите химика, который изобрел периодическую таблицу, то обычно ответом будет русский химик Дмитрий Менделеев в 1869 году. Его таблица больше всего напоминает современную периодическую таблицу.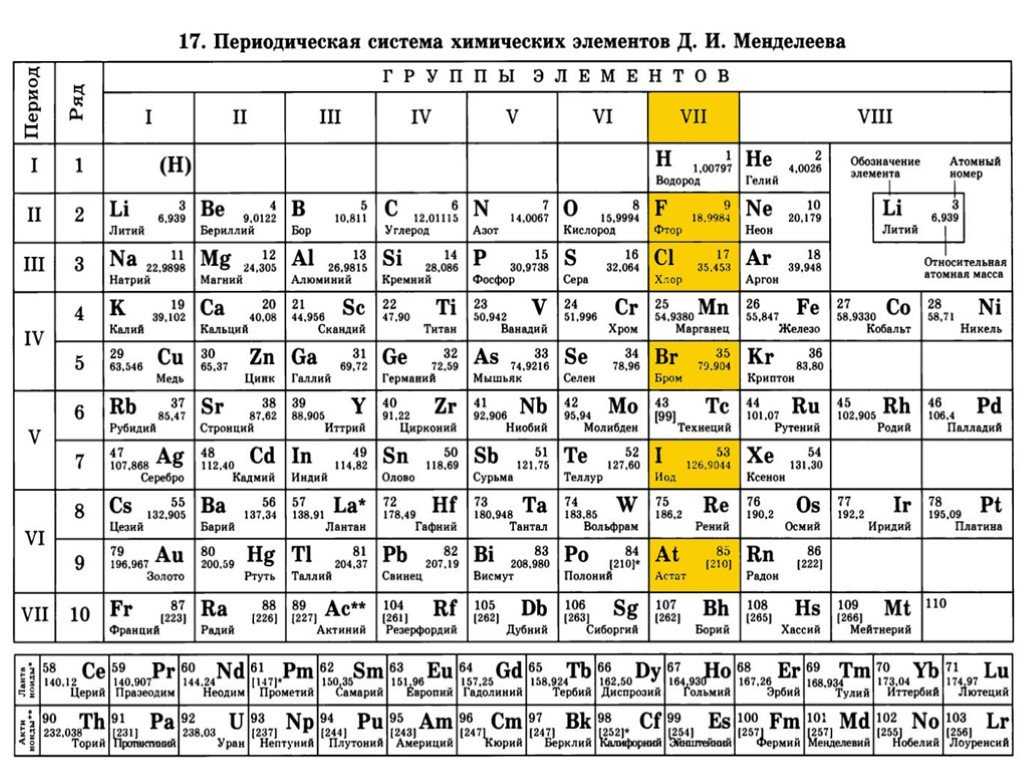 Таблица Менделеева упорядочивала элементы по возрастанию атомного веса и группировала их по повторяющимся или «периодическим» свойствам. Разница между его таблицей и современной таблицей заключается в том, что в современной периодической таблице элементы перечислены в порядке возрастания атомного номера (количества протонов в атоме). Во времена Менделеева протоны и атомные номера были неизвестны, поэтому наилучшим вариантом было использование атомного веса.
Таблица Менделеева упорядочивала элементы по возрастанию атомного веса и группировала их по повторяющимся или «периодическим» свойствам. Разница между его таблицей и современной таблицей заключается в том, что в современной периодической таблице элементы перечислены в порядке возрастания атомного номера (количества протонов в атоме). Во времена Менделеева протоны и атомные номера были неизвестны, поэтому наилучшим вариантом было использование атомного веса.
Однако другие люди составляли таблицы, упорядочивающие элементы по возрастанию атомного веса или по общим свойствам до Менделеева. Эти ученые тоже заслуживают уважения. Вот взгляд на их вклад в развитие периодической таблицы.
- Большинство химиков приписывают Дмитрию Менделееву изобретение периодической таблицы в 1869 году.
- Периодическую таблицу открыли и другие ученые, в том числе де Шанкуртуа, Ньюлендс и Мейер.
- В периодической таблице Менделеева элементы организованы по атомному весу и периодичности.
 Пробелы в таблице позволяли прогнозировать новые элементы и их свойства.
Пробелы в таблице позволяли прогнозировать новые элементы и их свойства. - Современная периодическая таблица похожа на таблицу Менделеева, за исключением того, что элементы упорядочиваются по атомному номеру, а не по атомному весу.
Ученые, открывшие Периодическую таблицу
1789 – Антуан Лавуазье
Лавуазье часто называют «отцом химии». В 1789 году он сгруппировал элементы в соответствии с их свойствами как металлы, земли, неметаллы и газы.
1829 – Иоганн Доберейнер
Иоганн Доберейнер признал, что триады элементов имеют сходные химические свойства. Например, литий, натрий и калий имеют общие свойства. Доберейнер продемонстрировал возможность предсказания свойств одного элемента на основе свойств двух других.
1862 – Александр Бегуйе де Шанкуртуа
Французский геолог де Шанкуртуа в 1862 году опубликовал периодическую таблицу, которую он назвал «vistellurique» или теллурический винт. Его таблица располагала элементы в соответствии с атомным весом на внешней стороне цилиндра так, чтобы элементы с общими свойствами образовывали вертикальную линию. Это была первая настоящая периодическая таблица, в которой элементы располагались в соответствии с повторяющимися тенденциями в их свойствах. Однако трехмерная таблица так и не прижилась.
Это была первая настоящая периодическая таблица, в которой элементы располагались в соответствии с повторяющимися тенденциями в их свойствах. Однако трехмерная таблица так и не прижилась.
1864 – Джон Ньюлендс
В 1864 году Джон Ньюлендс описал взаимосвязь между атомным весом и свойствами периодического элемента. Он назвал это Законом Октав, где свойства отображали периодичность для каждой 8-й группы элементов. Ньюлендс опубликовал свои открытия в 1865 году. Используя закон октав, Ньюлендс предсказал существование германия и других элементов. Однако Ньюлендс не оставлял пробелов для неоткрытых элементов в своей таблице и иногда имел два элемента в одном месте. Химическое общество отказалось опубликовать его статью, поэтому он получил признание за свои открытия намного позже.
1868 – Юлиус Лотар Мейер
Мейер составил несколько различных периодических таблиц между 1864-1870 годами. Его первая таблица организовала элементы в соответствии с валентностью и содержала 28 элементов.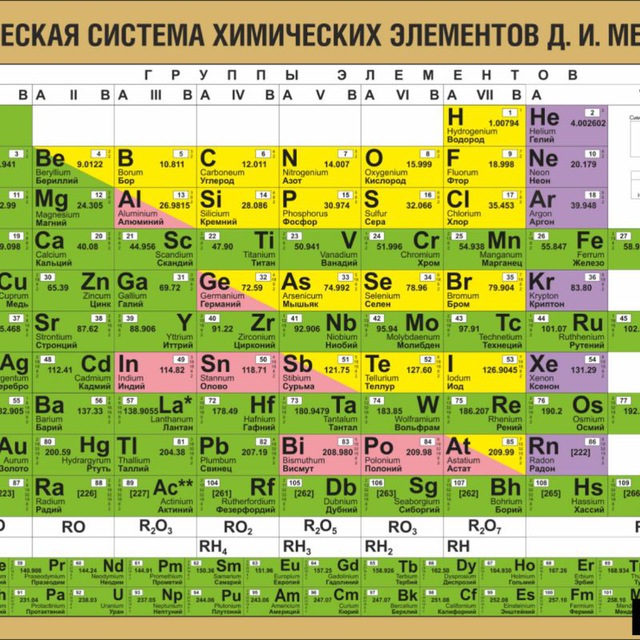 Его таблица 1868 года включала больше элементов и упорядочивала их по атомному весу. Кроме того, элементы располагались в вертикальных линиях в соответствии с их валентностью, подобно таблице Менделеева и современной таблице. Мейер также изобразил периодические тенденции свойств элементов в зависимости от атомного веса. Его работа не была опубликована до 1870 года (через год после Менделеева), поэтому он не получил признания за изобретение периодической таблицы.
Его таблица 1868 года включала больше элементов и упорядочивала их по атомному весу. Кроме того, элементы располагались в вертикальных линиях в соответствии с их валентностью, подобно таблице Менделеева и современной таблице. Мейер также изобразил периодические тенденции свойств элементов в зависимости от атомного веса. Его работа не была опубликована до 1870 года (через год после Менделеева), поэтому он не получил признания за изобретение периодической таблицы.
1869 – Дмитрий Менделеев
Ученые знали о 56 элементах в 1863 году и поняли концепцию периодичности из закона октав Ньюленда. Менделеев использовал эту информацию, когда писал « Основы химии» между 1868 и 1870 годами в качестве учебника для курса. По мнению некоторых историков, Менделеев видел во сне расположение элементов в таблице. Он представил свою таблицу Русскому химическому обществу 6 марта 1869 года. В его таблице элементы были упорядочены по атомному весу и организованы по периодичности свойств.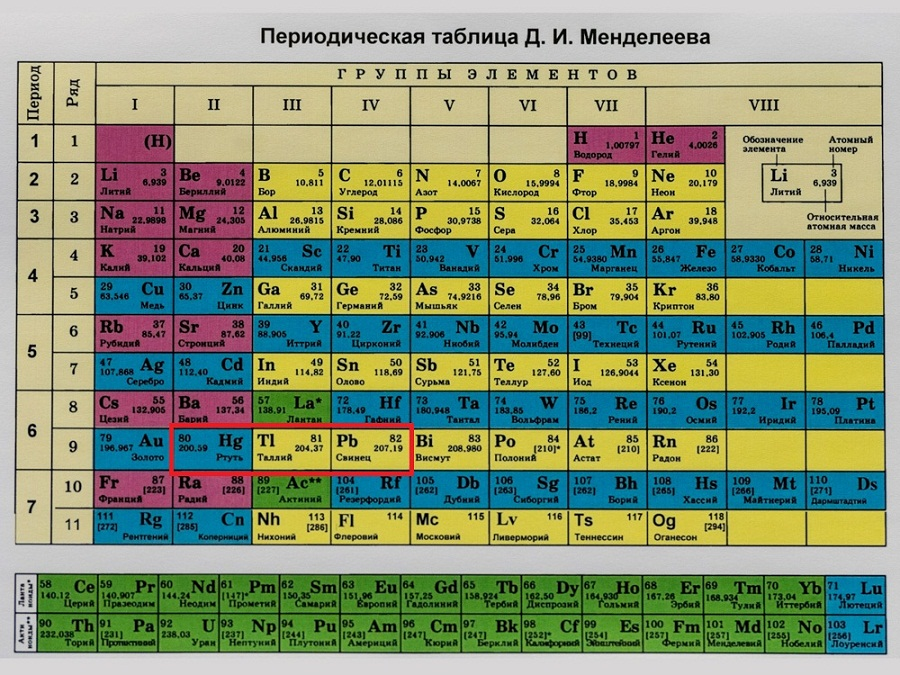 Он отметил эти свойства, связанные с валентностью элемента. Как и Ньюлендс, Менделеев предсказал существование новых элементов, основываясь на «дырах» в своей периодической таблице.
Он отметил эти свойства, связанные с валентностью элемента. Как и Ньюлендс, Менделеев предсказал существование новых элементов, основываясь на «дырах» в своей периодической таблице.
1913 – Генри Мозли
Генри Мозли не изобретал периодическую таблицу, но он нашел способ измерения атомного числа. Мозли обнаружил, что рентгеновские спектры соответствуют количеству протонов в атомном ядре. Число протонов является константой для всех атомов элемента, поэтому оно является атомным номером этого элемента. Химики поняли, что упорядочение элементов по атомному весу в основном дает ту же таблицу, что и упорядочение элементов по атомному номеру. Исключения включают размещение элементов йода и теллура. Изменение порядка элементов с атомного веса на атомный номер дало таблице форму, которую мы используем сегодня.
Ссылки
- Эгделл, Рассел Г.; Брутон, Элизабет (2020). «Генри Мозли, рентгеновская спектроскопия и периодическая таблица». Философские труды Королевского общества A: Математические, физические и технические науки .
 378 (2180). doi:10.1002/chem.202004775
378 (2180). doi:10.1002/chem.202004775 - Мазурс, Э. Г. (1974). Графические изображения периодической системы за сто лет . Таскалуса, Алабама: Издательство Алабамского университета.
- Рувре, Д.Х.; Кинг, РБ (ред.). Математика периодической таблицы . Nova Science Publishers, 2006, Hauppauge, NY
- Scerri, E.; Рестрепо, Г., ред. (2018). От Менделеева до Оганесона: мультидисциплинарный взгляд на периодическую таблицу . Материалы 3-й Международной конференции по Периодической таблице, Куско, Перу, 14–16 августа 2012 г. Оксфорд: Oxford University Press. ISBN 978-0-86380-292-8.
- Тиссен, П.; Биннеманс, К., Гшнайднер-младший, К.А.; Бюнцли, JCG; Вечерский, Бюнзли, ред. (2011). Размещение редкоземельных элементов в периодической таблице: исторический анализ. Справочник по физике и химии редкоземельных элементов . Амстердам: Эльзевир.
- Ван Спронсен, Дж. В. (1969). Периодическая система химических элементов: история первых ста лет .
 Амстердам: Эльзевир.
Амстердам: Эльзевир. - Венейбл, Ф. П. (1869 г.). Развитие периодического закона. Истон, Пенсильвания: Chemical Publishing Company.
История Периодической таблицы | Химия [Магистр] |
Разработка периодической таблицы
Периодическая таблица представляет собой методическое расположение химических элементов, организованное на основе их электронных конфигураций.
Цели обучения
Расскажите о происхождении и истории периодической таблицы.
Ключевые выводы
Ключевые моменты
- Хотя изначально работа алхимиков была ошибочной попыткой превратить свинец в серебро и золото, их исследования заложили фундамент, который впоследствии помог фундаментальному пониманию материи.
- Современная периодическая таблица была разработана Дмитрием Менделеевым и представляет собой полезную основу для организации и анализа химического и физического поведения элементов.

- Обозначения в периодической таблице включают ссылки на атомную массу и атомный номер.
Ключевые термины
- протон : Положительно заряженная субатомная частица, составляющая часть ядра атома и определяющая атомный номер элемента; ядро наиболее распространенного изотопа водорода, состоящее из двух верхних кварков и нижнего кварка.
- Элемент : Любое из простейших химических веществ, которое не может быть разложено в результате химической реакции или каким-либо химическим способом, состоящее из атомов, имеющих одинаковое количество протонов.
- алхимия : Древние поиски универсальной панацеи и философского камня. Процесс в конечном итоге превратился в химию.
В современной периодической таблице известные элементы организованы несколькими способами: они перечислены в порядке атомного веса, электронной конфигурации, реакционной способности и электроотрицательности. Это настолько хороший метод организации и представления известных элементов, что его успешно использовали для предсказания существования определенных элементов. Сегодня он применяется не только химиками, но и во всех смежных науках для понимания свойств и реакционной способности атомов и молекул. Таблица имеет узнаваемое происхождение в 17 веке и основана на знаниях и опыте средневековья и более ранних эпох.
Это настолько хороший метод организации и представления известных элементов, что его успешно использовали для предсказания существования определенных элементов. Сегодня он применяется не только химиками, но и во всех смежных науках для понимания свойств и реакционной способности атомов и молекул. Таблица имеет узнаваемое происхождение в 17 веке и основана на знаниях и опыте средневековья и более ранних эпох.
Краткая история периодической таблицы — YouTube : От древнегреческих философов до Дмитрия Менделеева, профессор Дэвис описывает, как понимание человечеством элементов и способов их каталогизации изменилось на протяжении веков.
История периодической таблицы
Атомная теория восходит к древнегреческим философам и философам эллинистического Египта. Они предположили, что все вещества состоят из фундаментальных строительных блоков; однако природа этих блоков была предметом ожесточенных споров.
Фундаментальные блоки назывались атомами, происходящими от греческого слова «атмос», что означает «неделимый». Ранняя атомная теория пыталась объяснить свойства материи, приписывая атомам атрибуты, которые могли бы соответствовать атрибутам различной материи, которую они объединяли, например скользкость, текучесть, цвет и связность. Философы классифицировали окружающий мир по свойствам и функциям, тип подхода, который позже привел к разработке периодической таблицы элементов.
В Средние века алхимики стремились получить золото и серебро из свинца. Хотя их усилия были напрасными, их исследования в конечном итоге привели к систематическому пониманию химического мира. Это также сформировало мышление, которое дало нам периодическую таблицу элементов.
На алхимиков повлияла международная торговля, особенно вдоль Шелкового пути между Китаем и Европой. Химические знания распространились по культурам, и примерно к середине 18 века было известно уже 33 элемента. В начале 1920 века Джозеф Пруст и другие экспериментально продемонстрировали закон определенных пропорций.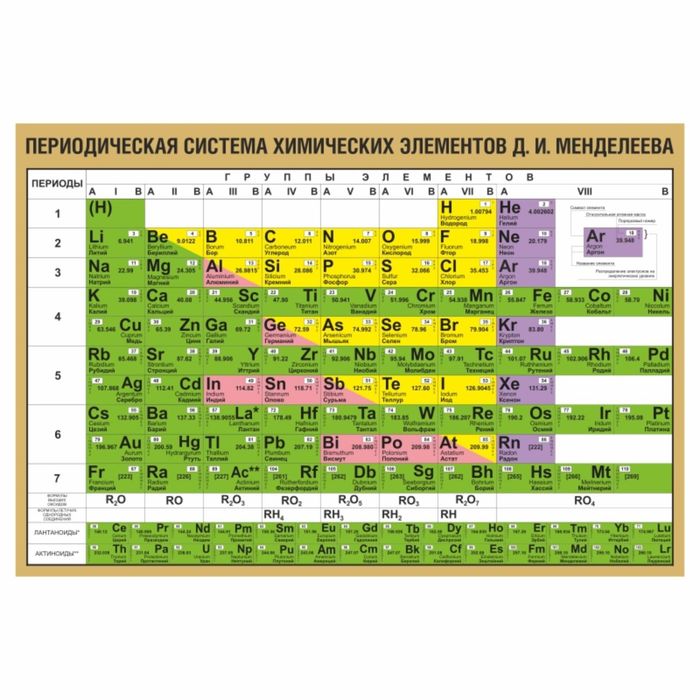 Это предоставило фундаментальное доказательство того, что материя существует в виде чистых соединений, а не просто смесей в любой пропорции. Эти наблюдения укрепили атомную теорию и потребовали систематического метода организации элементов.
Это предоставило фундаментальное доказательство того, что материя существует в виде чистых соединений, а не просто смесей в любой пропорции. Эти наблюдения укрепили атомную теорию и потребовали систематического метода организации элементов.
Обозначения в периодической таблице : Обозначения в периодической таблице включают ссылки на атомную массу и атомный номер.
Современный взгляд на периодическую таблицу
Ученые начали замечать сходства и закономерности среди известных элементов, и большой исследовательский интерес 19 века заключался в разработке систематического метода для их регистрации и классификации. Русский профессор химии Дмитрий Менделеев и немецкий химик Юлиус Мейер независимо друг от друга представили свои собственные версии периодической таблицы в 1869 и 1870 годах. Подход Менделеева в конечном итоге был принят по нескольким причинам: во-первых, он оставил пробелы для элементов, которые еще предстоит открыть. При этом он предсказал появление галлия и германия. Он также размещал атомы, основываясь главным образом на их химических свойствах, а не на атомной массе. Как оказалось, организация по химическим семействам правильно сортирует большинство элементов по их атомным номерам; атомная масса не полностью коррелирует с атомным номером.
При этом он предсказал появление галлия и германия. Он также размещал атомы, основываясь главным образом на их химических свойствах, а не на атомной массе. Как оказалось, организация по химическим семействам правильно сортирует большинство элементов по их атомным номерам; атомная масса не полностью коррелирует с атомным номером.
Периодическая таблица элементов : Современное представление периодической таблицы, показывающее организацию по атомному номеру и валентности. Обратите внимание, что атомные массы не включены в эту конкретную периодическую таблицу, однако обычно они указываются под символом элемента.
Современная версия периодической таблицы Менделеева теперь содержит около 118 различных элементов. В периодической таблице число над символом элемента является атомным номером, который представляет количество протонов в ядре. Атомная масса определяется суммой нейтронов и протонов.
Периоды с 1 по 3
Элементы одного периода имеют одинаковое количество электронных оболочек.
Цели обучения
Обсудите взаимосвязь между электронной структурой атома и его периодом (строкой) в периодической таблице.
Ключевые выводы
Ключевые моменты
- По мере продвижения по периоду (по таблице справа) электронные оболочки элементов в этот период заполняются, приближаясь к стабильной конфигурации благородного газа в конце того ряда.
- Для любого элемента в периодах 1, 2 и 3 элементы непосредственно выше и ниже него являются членами одной и той же группы и имеют сходные химические свойства, основанные на сходном расположении валентных электронов.
- Принцип Ауфбау описывает, как электроны помещаются на орбитали в определенном порядке для заполнения.
Ключевые термины
- атом : Наименьшее возможное количество вещества, которое все еще сохраняет свою идентичность как химический элемент, который, как теперь известно, состоит из ядра, окруженного электронами.

- электрон : субатомная частица, имеющая отрицательный заряд и вращающаяся вокруг ядра; поток электронов в проводнике представляет собой электричество.
- электронная оболочка : Коллективные состояния всех электронов в атоме, имеющие одно и то же главное квантовое число (представленное как орбита, по которой движутся электроны).
Ранние философы и ученые понимали, что материя состоит из атомов и что многие элементы взаимодействуют друг с другом в предсказуемых пропорциях. Периодическая таблица была построена для организации этих наблюдений и измерений. Возник принцип валентности, связанный с наличием или отсутствием электронов и энергией этих электронов в объеме вокруг ядра атома. Электроны, отрицательно заряженные субатомные частицы, определяют химическую активность атома. Электроны организованы по энергетическим уровням или электронным оболочкам, которые соответствуют периодам периодической таблицы.
Атом Бора
Нильс Бор предложил упрощенную картину атома с центральным ядром, окруженным электронами на определенных энергетических уровнях (n). Периодическая таблица кодирует уровни энергии в периоды, строки в таблице. Простейшие атомы водорода и гелия находятся в ряду 1, или первом периоде. Эти атомы имеют электроны, занимающие энергетический уровень n=1. Двигаясь вниз, строка 2 или период 2 содержит элементы от Li (литий) до Ne (неон). Энергия уровня n=1 элементов в периоде 2 полностью заполнена; они продолжают заполнять свой уровень n=2, двигаясь по таблице вправо. Аналогичным образом, перемещаясь на один период вниз к строке 3, есть элементы от Na (натрий) до Ar (аргон). Атомы с периодом 3 имеют заполненные уровни n=1 и n=2; они заполняют уровень n=3, перемещаясь по таблице.
Упрощенное изображение атомной структуры : С ядром в центре с положительным зарядом электроны «организуются» в энергетические уровни или оболочки на увеличивающемся расстоянии от ядра. Расстояние между оболочками n = 2 и n = 3 на этом рисунке представляет собой разницу в энергии между ними.
Расстояние между оболочками n = 2 и n = 3 на этом рисунке представляет собой разницу в энергии между ними.
Важно помнить, что периодическая таблица представляет собой представление атомов с нулевым суммарным зарядом; у них столько электронов вокруг ядра, сколько протонов в ядре.
Периодическая таблица : Элементы расположены в соответствии с электронной конфигурацией с периодичностью валентности.
Принцип Ауфбау
На энергетических уровнях n=1, n=2 и n=3 электроны организованы в орбитали, обозначаемые как s, p, d и f. Например, атомный номер Ne (неона) равен 10 и содержит 5 орбиталей (1s, 2s, 2p x , 2p y и 2p z ). На каждой полной орбитали есть 2 электрона, что дает в общей сложности 10, чтобы уравновесить положительный заряд, обеспечиваемый 10 протонами в ядре.
Заполненные орбитали атома неона : Изображение орбиталей и их симметрии для атома неона (Ne).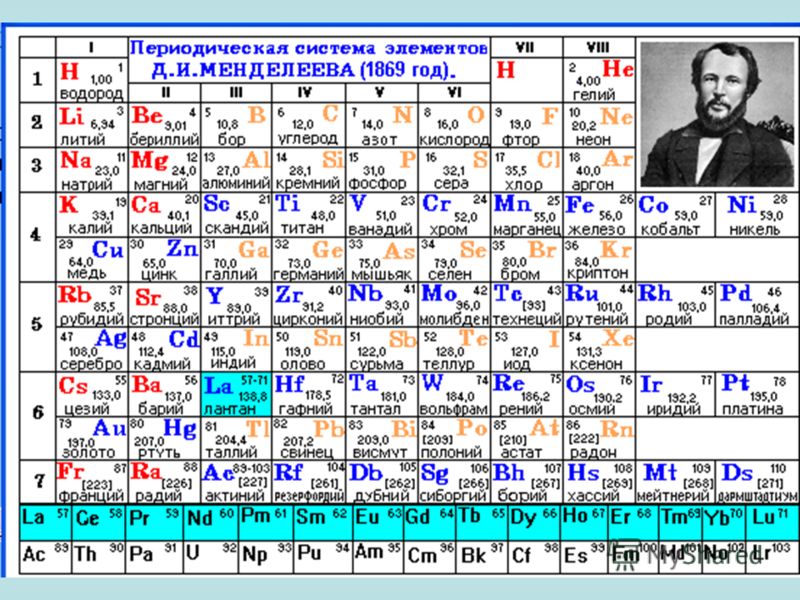 Уровни 1s и 2s показаны в виде сфероидов, а три 2p-орбитали показаны в виде расщепленных сфероидов. Каждая полная орбиталь имеет 2 электрона, что дает всего 10 для этого элемента.
Уровни 1s и 2s показаны в виде сфероидов, а три 2p-орбитали показаны в виде расщепленных сфероидов. Каждая полная орбиталь имеет 2 электрона, что дает всего 10 для этого элемента.
В периодической таблице в периоде 1 находится 2 электрона, а в периоде 2 и 3 на заполненном уровне находится по 8 электронов. Для атомов с атомными номерами менее примерно 20 применяется правило октетов добавления электронов и заполнения орбиты. Это просто утверждает, что уровни n=2 и n=3, в частности, заполнены, когда есть 8 электронов. Принцип Ауфбау описывает, как электроны помещаются на орбитали в определенном порядке для заполнения.
Принцип Ауфбау : Принцип Ауфбау описывает постепенное заполнение орбиталей и построение атомов с известными электронными конфигурациями.
Переходные металлы
Элементы d-блока широко известны как переходные металлы или переходные элементы.
Цели обучения
Определите отличительные и характерные свойства переходных металлов.
Ключевые выводы
Ключевые моменты
- Переходные металлы — это элементы десяти средних групп четвертого, пятого, шестого и седьмого периодов таблицы Менделеева.
- Переходные металлы и их соединения могут иметь окраску из-за внутреннего переноса dd-электронов.
- Переходные металлы и их соединения могут проявлять ферромагнетизм, парамагнетизм и диамагнетизм.
- Переходные металлы и их соединения хорошо известны своей каталитической активностью.
Ключевые термины
- парамагнетик : проявляющий парамагнетизм; тенденция магнитных диполей выравниваться с внешним магнитным полем.
- Степень окисления : Состояние атома, имеющего определенную степень окисления.
- диамагнетик : проявляющий диамагнетизм; отталкивается магнитом.
D-блок периодической таблицы
Переходные металлы также известны как переходные элементы или элементы d-блока. Как следует из названия, химический состав этой группы определяется степенью заполнения суборбитальных уровней d-электронов. Химическое сходство и периодичность можно легко увидеть по горизонтали в d-блоке периодической таблицы.
Как следует из названия, химический состав этой группы определяется степенью заполнения суборбитальных уровней d-электронов. Химическое сходство и периодичность можно легко увидеть по горизонтали в d-блоке периодической таблицы.
D-блок периодической таблицы : D-блок состоит из групп 3–12 и периодов 4–7.
Однако химия далеко не проста, и есть много исключений из упорядоченного заполнения электронной оболочки. Принцип Ауфбау обеспечивает методическую основу для предсказания порядка, в котором большинство атомов будут заселять свои электронные оболочки.
Принцип Ауфбау : Это иллюстрирует порядок, в котором большинство атомов заселяют свои электронные оболочки.
Химические свойства в периодической таблице организованы вертикально по группам для сходных химических и физических свойств. Например, металлы группы 11 имеют схожие характеристики электропроводности, блеска, кристаллической структуры, пластичности и прочности на растяжение. При горизонтальном перемещении по периодической таблице наблюдаются тенденции таких свойств, как атомный радиус, электроотрицательность и сродство к электрону.
При горизонтальном перемещении по периодической таблице наблюдаются тенденции таких свойств, как атомный радиус, электроотрицательность и сродство к электрону.
Характеристические свойства переходных металлов
Можно сказать, что переходные металлы обладают следующими характеристиками, обычно не встречающимися в основной группе периодической таблицы. В основном их можно объяснить неполным заполнением электронных d-уровней:
- Образование соединений, окраска которых обусловлена d – d электронными переходами.
- Образование соединений во многих степенях окисления из-за относительно низкой реакционной способности неспаренных d электронов.
- Образование многих парамагнитных соединений из-за присутствия неспаренных d электронов. Некоторые соединения элементов главной группы также являются парамагнитными (например, окись азота, кислород).
Переход с переносом заряда лиганда на металл (LMCT)
Цвет в соединениях металлов переходного ряда обычно обусловлен электронными переходами двух основных типов переходов с переносом заряда. Электрон может перепрыгнуть с преимущественно лигандной орбитали на преимущественно металлическую орбиталь, что приведет к переходу с переносом заряда лиганда к металлу (LMCT). Это может наиболее легко произойти, когда металл находится в высокой степени окисления. Например, цвет ионов хромата, дихромата и перманганата обусловлен переходами LMCT. Другим примером является йодид ртути (HgI 2 ) красного цвета из-за перехода LMCT.
Электрон может перепрыгнуть с преимущественно лигандной орбитали на преимущественно металлическую орбиталь, что приведет к переходу с переносом заряда лиганда к металлу (LMCT). Это может наиболее легко произойти, когда металл находится в высокой степени окисления. Например, цвет ионов хромата, дихромата и перманганата обусловлен переходами LMCT. Другим примером является йодид ртути (HgI 2 ) красного цвета из-за перехода LMCT.
Комплексы с переносом заряда : I 2 •PPh 3 комплексы с переносом заряда в CH 2 Cl 2 . Слева направо: (1) I 2 , растворенный в дихлорметане – комплекс CT отсутствует. (2) Через несколько секунд после добавления избытка PPh 3 – формируется комплекс CT. (3) Через минуту после добавления избытка PPh 3 образовался комплекс CT [Ph 3 PI] + I – . (4) Сразу после превышения I 2 был добавлен, который содержит [Ph 3 PI] + [I 3 ] – .
Переход с переносом заряда металл-лиганд (MLCT) наиболее вероятен, когда металл находится в низкой степени окисления, а лиганд представляет собой легко восстанавливаемый переход d – d . Электрон перескакивает с одной d-орбитали на другую. В комплексах переходных металлов не все орбитали d имеют одинаковую энергию.
Парамагнитные и диамагнитные соединения
Соединения переходных металлов являются парамагнитными, если они имеют один или несколько неспаренных d электронов. Некоторые соединения диамагнитны. К ним относятся октаэдрические, низкоспиновые, d 6 и квадратно-плоские d 8 комплексы. В этих случаях расщепление кристаллического поля таково, что все электроны спариваются. Ферромагнетизм возникает, когда отдельные атомы являются парамагнитными, а векторы спина выровнены параллельно друг другу в кристаллическом материале. Металлическое железо и сплав альнико являются примерами ферромагнитных материалов, содержащих переходные металлы. Антиферромагнетизм – еще один пример магнитного свойства, возникающего из-за определенного выравнивания отдельных спинов в твердом состоянии.
Металлическое железо и сплав альнико являются примерами ферромагнитных материалов, содержащих переходные металлы. Антиферромагнетизм – еще один пример магнитного свойства, возникающего из-за определенного выравнивания отдельных спинов в твердом состоянии.
Переходные металлы и их соединения известны своей гомогенной и гетерогенной каталитической активностью. Эта активность объясняется их способностью принимать несколько степеней окисления и образовывать комплексы.
Нижняя часть таблицы Менделеева
Периодическая таблица в настоящее время содержит 7 периодов, но теоретики предсказывают, что могут существовать два дополнительных периода.
Цели обучения
Определите ключевые характеристики элементов f-блока.
Ключевые выводы
Ключевые моменты
- Ряды лантанидов и актиноидов получают свойства от электронов f-блока.
- Четыре элемента актинидного ряда встречаются в природе, пять других изотопов иногда образуются при распаде урана, а остальные трансурановые соединения были получены синтетическим путем.

- Самый высокий атомный номер, синтезированный на сегодняшний день, – 118, элемент ununoctium (Uuo).
Основные термины
- лантанид : Любой из 14 редкоземельных элементов от лантана до лютеция в периодической таблице. Поскольку их внешние орбитали пусты, у них очень похожий химический состав. Под ними находятся актиниды.
- актинид : любой из 14 радиоактивных элементов периодической таблицы, расположенных под лантаноидами, с которыми они имеют схожий химический состав.
- трансурановый : трансурановый. Трансурановый элемент — это любой синтетический элемент, имеющий атомный номер больше, чем у урана (92).
Есть несколько способов подойти к этой конкретной теме, и все они относятся к тому, как представлены элементы в самой таблице.
Наиболее классическое представление периодической таблицы показывает взаимное расположение известных элементов в таблице. Сама таблица состоит из 7 периодов и 18 групп, причем последним известным элементом является номер 118, унуноктий. Тем не менее, в таблице очевидна явная неоднородность. В строке 6 столбца 3 между Ba и Hf появляется пустое место. Атомный номер, который должен быть здесь, 57, расположен внизу таблицы в строке, называемой лантаноиды. Непосредственно под местом в ряду 6, в ряду 7 находится еще одно пустое место, которое заполнено рядом, называемым актинидами, также видимым в нижней части диаграммы.
Сама таблица состоит из 7 периодов и 18 групп, причем последним известным элементом является номер 118, унуноктий. Тем не менее, в таблице очевидна явная неоднородность. В строке 6 столбца 3 между Ba и Hf появляется пустое место. Атомный номер, который должен быть здесь, 57, расположен внизу таблицы в строке, называемой лантаноиды. Непосредственно под местом в ряду 6, в ряду 7 находится еще одно пустое место, которое заполнено рядом, называемым актинидами, также видимым в нижней части диаграммы.
Периодическая таблица : Это стандартное представление элементов в таблице с относительным расположением, которое знакомо химикам и физикам.
Расширение периодической таблицы элементов
Увеличивая горизонтальные размеры таблицы, ряды актинидов и лантаноидов могут быть помещены в их правильные относительные положения. Поскольку химия этой группы в значительной степени основана на электронах f-оболочки и взаимодействиях на этом энергетическом уровне, это называется f-блоком. Это изображение, каким бы неуклюжим оно ни было, правильно показывает элементы, известные на сегодняшний день, вплоть до z = 118, уноноктий. Фактически, это представление предсказывает, поскольку оно показывает химические семейства (группы) и периодичности (периоды) в их правильных относительных положениях.
Это изображение, каким бы неуклюжим оно ни было, правильно показывает элементы, известные на сегодняшний день, вплоть до z = 118, уноноктий. Фактически, это представление предсказывает, поскольку оно показывает химические семейства (группы) и периодичности (периоды) в их правильных относительных положениях.
Расширенная периодическая таблица : Лантаниды и актиниды добавляются как отдельные, но связанные строки, образуя так называемый f-блок.
Продолжая расширять периодическую таблицу, рассмотрим элемент с атомным номером 92 в ряду актинидов, называемый ураном. Когда в конце 19 века были открыты элементы с этим диапазоном атомных номеров, изотопы урана были самыми большими и тяжелыми элементами, известными в природе. В 1934 году Энрико Ферми предсказал существование трансуран элементы — элементы с атомным номером (z) больше или равным 93. В 1934 году было известно только 4 актиноида, все меньше урана, поэтому не было известно, что они образуют период или семейство, подобное лантаноидам . Первый трансурановый элемент, Np (нептуний), был получен синтетическим путем в 1940 году путем бомбардировки урана медленными нейтронами. В течение следующих двух десятилетий было произведено очень много изотопов актинидов, как правило, путем бомбардировки другими атомами или субатомными частицами. Вместе с лантанидами добавляли актиноиды.
Первый трансурановый элемент, Np (нептуний), был получен синтетическим путем в 1940 году путем бомбардировки урана медленными нейтронами. В течение следующих двух десятилетий было произведено очень много изотопов актинидов, как правило, путем бомбардировки другими атомами или субатомными частицами. Вместе с лантанидами добавляли актиноиды.
Два новых периода
Используя прогностические свойства периодической таблицы, а также растущий опыт в атомной и субатомной теории, были предсказаны два совершенно новых периода. По совету Гленна Сиборга и других в периодическую таблицу были добавлены периоды 8 и 9, составляющие g-блок. Позиционирование g-блока в таблице (слева от f-блока, справа или между ними) является умозрительным. Позиции в таблице соответствуют предположению, что правило Маделунга (что орбитали с более низким значением суммы n и l квантовых чисел будут заполнены раньше, чем орбитали с более высокими значениями n + l) будет продолжать выполняться для более высоких атомных номеров. В элементе 118 орбитали 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 5f, 6s, 6p, 6d, 7s и 7p считаются заполненными, с оставшимися орбиталями незаполненными. Предполагается, что орбитали восьмого периода будут заполнены в порядке 8s, 5g, 6f, 7d, 8p. Однако примерно после 120-го элемента близость электронных оболочек делает проблематичным размещение в простой таблице.
В элементе 118 орбитали 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 5f, 6s, 6p, 6d, 7s и 7p считаются заполненными, с оставшимися орбиталями незаполненными. Предполагается, что орбитали восьмого периода будут заполнены в порядке 8s, 5g, 6f, 7d, 8p. Однако примерно после 120-го элемента близость электронных оболочек делает проблематичным размещение в простой таблице.
Расширенная периодическая таблица с предсказанными периодами 8 и 9 : Периодическая таблица со всеми группами и периодами на месте. Размещение неоткрытого g-блока является спекулятивным.
Существование элементов с такими высокими атомными номерами является спекулятивным, и ожидается, что изотопы будут иметь мимолетно короткие периоды полураспада. Различные эксперты предсказывают, что z = примерно 130 является максимальным, в то время как другие считают, что эффективного верхнего предела нет. Эксперименты по синтезу трансурановых элементов продолжаются.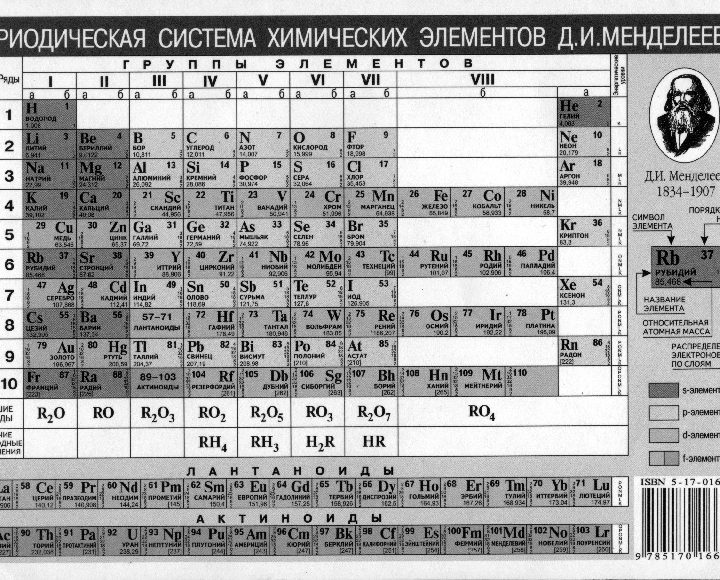
Позиция в периодической таблице и конфигурация электронов
Положение элементов в периодической таблице напрямую связано с их электронной конфигурацией.
Цели обучения
Используйте периодическую таблицу для определения свойств атома, таких как группы и электронные конфигурации.
Ключевые выводы
Ключевые моменты
- Элементы организованы по периодам и группам, причем период соответствует основному уровню энергии, а группа относится к степени заполнения подоболочек.
- Свойства атома напрямую связаны с количеством электронов на различных орбиталях, и периодическая таблица очень похожа на дорожную карту среди этих орбиталей, так что химические свойства можно вывести по положению элемента на таблице.
- Электроны на самой внешней или валентной оболочке особенно важны, потому что они могут участвовать в обмене и обмене, который отвечает за химические реакции.

Ключевые термины
- квантовое число : Одно из определенных целых или полуцелых чисел, определяющих состояние квантово-механической системы (например, электрона в атоме).
- орбиталь : Спецификация энергии и плотности вероятности электрона в любой точке атома или молекулы.
- электронная оболочка : Коллективные состояния всех электронов в атоме, имеющие одно и то же главное квантовое число (представленное как орбита, по которой движутся электроны).
Основные подразделения Периодической таблицы
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Элементы представлены в возрастающем атомном номере. Основная часть таблицы представляет собой сетку 18×7. Элементы с одинаковым числом валентных электронов объединяются в группы, такие как галогены и благородные газы. Есть четыре различных прямоугольных области или блока. F-блок обычно не включается в основную таблицу, а перемещается ниже, поскольку встроенный f-блок часто делает таблицу непрактично широкой. Используя периодические тенденции, периодическая таблица может помочь предсказать свойства различных элементов и отношения между свойствами. Таким образом, он обеспечивает полезную основу для анализа химического поведения и широко используется в химии и других науках.
Есть четыре различных прямоугольных области или блока. F-блок обычно не включается в основную таблицу, а перемещается ниже, поскольку встроенный f-блок часто делает таблицу непрактично широкой. Используя периодические тенденции, периодическая таблица может помочь предсказать свойства различных элементов и отношения между свойствами. Таким образом, он обеспечивает полезную основу для анализа химического поведения и широко используется в химии и других науках.
Атомные орбиты
Электроны в частично заполненной внешней оболочке (или оболочках) определяют химические свойства атома; она называется валентной оболочкой. Каждая оболочка состоит из одной или нескольких подоболочек, а каждая подоболочка состоит из одной или нескольких атомных орбиталей.
Свойства атома в конечном счете зависят от числа электронов на различных орбиталях и от заряда ядра, определяющего компактность орбиталей. Чтобы связать свойства элементов с их положением в периодической таблице, часто бывает удобно использовать упрощенное представление об атоме, в котором ядро окружено одной или несколькими концентрическими сферическими «оболочками», каждая из которых состоит из орбиталей с наибольшим главным квантовым числом, которые содержат по крайней мере один электрон; это s- и p-орбитали и могут включать d- или f-орбитали, что зависит от атома. Модель оболочки, как и любая научная модель, является не столько описанием мира, сколько упрощенным взглядом на него, помогающим нам понять и сопоставить различные явления.
Модель оболочки, как и любая научная модель, является не столько описанием мира, сколько упрощенным взглядом на него, помогающим нам понять и сопоставить различные явления.
Мы рассмотрим несколько визуализаций периодической таблицы. Однако сначала было бы поучительно посмотреть, как он строится с логической точки зрения. Сегодняшняя таблица является результатом продолжающихся более чем 100 лет наблюдений, измерений, предсказаний и доказательств связи химических и физических явлений с электронными конфигурациями и зарядами.
Периоды 1, 2 и 3
Начиная с простых элементов, первые три строки периодической таблицы, называемые периодами 1, 2 и 3, соответствуют уровням n=1, n=2 и n=3.
Конфигурации электронных оболочек первых 18 элементов : Конфигурации электронных оболочек первых 18 элементов периодической таблицы. Соответствующие энергетические уровни (n) указаны зелеными цифрами слева. Количество электронов на внешней оболочке представлено самой правой цифрой в номерах групп.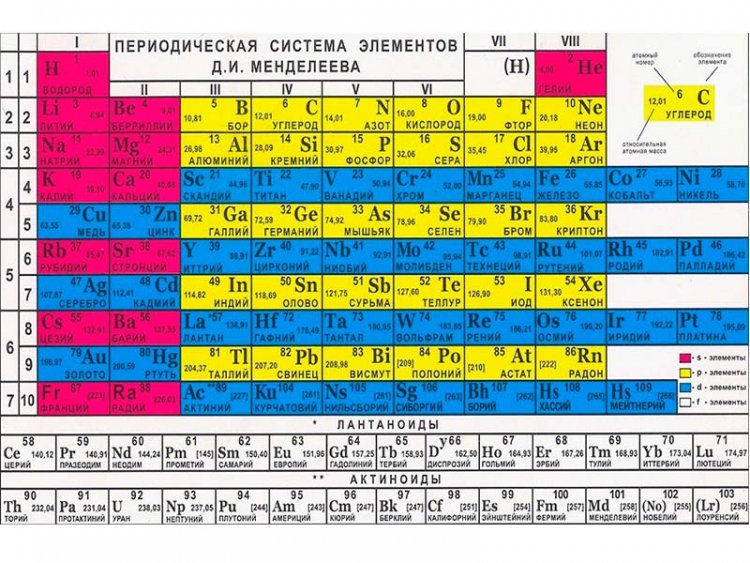
Водород имеет 1 электрон на уровне 1s, а правее гелий в 18 группе имеет 2 электрона на уровне 1s, полностью заполненная оболочка, правило дуэта. Гелий — первый в ряду благородных газов. Переходя к периоду 2, литий является первым элементом в ряду с заполненной конфигурацией 1s. В течение периода сначала заполняются 2s, а затем 2p-орбитали, достигая конфигурации для неона в соответствии с правилом октетов. Третий период проходит по аналогичной схеме. Обратите внимание, что количество электронов на внешней оболочке является основным фактором, определяющим валентность элемента.
Конфигурация электронной оболочки элементов : Позиция в периодической таблице на основе конфигурации электронной оболочки. На этом изображении показана вся таблица Менделеева с схематическими атомами и электронными оболочками, заполняющимися при движении по таблице. На этом изображении численно показана электронная конфигурация, показывающая популяцию электронов в каждой подоболочке, начиная каждый период с полностью заполненным благородным газом.
Периодическая таблица с электронными оболочками : Элементы в этой таблице расположены в стандартной конфигурации периодов и групп. Каждый блок включает представления структуры электронной оболочки элемента.
Электронная конфигурация катионов и анионов
Элементы в периодической таблице демонстрируют различные уровни реактивности в зависимости от количества электронов в их высших энергетических оболочках.
Цели обучения
Предсказать, будет ли атом подвергаться ионизации с образованием аниона или катиона, на основе электронной конфигурации его валентной оболочки.
Ключевые выводы
Ключевые моменты
- Электронная конфигурация многих ионов аналогична электронной конфигурации ближайшего к ним инертного газа в периодической таблице.
- Анион — это ион, который присоединил к себе один или несколько электронов, приобретя отрицательный заряд.

- Катион — это ион, который потерял один или несколько электронов, приобретя положительный заряд.
Ключевые термины
- анион : Отрицательно заряженный ион, в отличие от катиона
- ионизация : Любой процесс, приводящий к диссоциации нейтрального атома или молекулы на заряженные частицы (ионы).
- катион : положительно заряженный ион, в отличие от аниона.
Катионы и анионы образуются из нейтральных атомов
Каждый атом в своем основном состоянии не заряжен. У него, согласно его атомному номеру, одинаковое количество протонов и электронов. Однако электроны довольно лабильны, и атом часто приобретает или теряет их в зависимости от своей электроотрицательности. Движущей силой такого приобретения или потери электронов является энергетически оптимальное состояние полной валентной (самой внешней) оболочки электронов. В таком состоянии образующийся заряженный атом имеет электронную конфигурацию благородного газа.
Добавление электрона нарушит протонно-электронный баланс и оставит атом отрицательно заряженным. Удаление электрона, наоборот, оставит атом положительно заряженным. Эти заряженные атомы известны как ионов .
Образование одноатомных ионов
Одноатомные ионы образуются путем добавления или удаления электронов из валентной оболочки атома. Внутренние оболочки атома заполнены электронами, которые прочно связаны с положительно заряженным атомным ядром и поэтому не участвуют в такого рода химическом взаимодействии, но валентная оболочка может быть очень реактивной в зависимости от атома и его электронной конфигурации. Процесс приобретения или потери электронов нейтральным атомом или молекулой называется ионизация .
Атомы могут быть ионизированы бомбардировкой излучением, но более чисто химический процесс ионизации представляет собой перенос электронов между атомами или молекулами. Этот перенос обусловлен стабилизацией, которая достигается за счет получения стабильных (полных) электронных конфигураций. Атомы будут приобретать или терять электроны в зависимости от того, какое действие требует наименьшей энергии.
Атомы будут приобретать или терять электроны в зависимости от того, какое действие требует наименьшей энергии.
Например, элемент группы 1 натрий (Na) имеет один электрон в своей валентной оболочке, а под ней полные оболочки из 2 и 8 электронов. Удаление этого одного электрона делает натрий стабильным: его внешняя оболочка теперь содержит восемь электронов, что придает натрию электронную конфигурацию неона. Получив положительный заряд, ион натрия называется катион . Ионизацию натрия можно химически проиллюстрировать следующим образом:
Na → Na + + e −
Натрий может получить электроны, но для достижения полной валентной оболочки потребуется еще семь. Удалить один электрон намного проще, чем получить семь, и поэтому натрий в каждом химическом сценарии достигает своего октета, становясь катионом.
С другой стороны, атом хлора (Cl) имеет семь электронов на своей валентной оболочке, что на один меньше, чем у стабильной полной оболочки с 8 электронами. Так, атом хлора стремится к приобретают дополнительный электрон и достигают стабильной 8-электронной конфигурации (такой же, как у аргона), становясь при этом отрицательным анионом хлорида :
Так, атом хлора стремится к приобретают дополнительный электрон и достигают стабильной 8-электронной конфигурации (такой же, как у аргона), становясь при этом отрицательным анионом хлорида :
Cl + e- → Cl когда натрий теряет электрон, а хлорид приобретает электрон, мы наблюдаем комплиментарную реакционную способность. При объединении незаряженные атомы могут обмениваться электронами и при этом достигать полных валентных оболочек. Образовавшиеся ионы слипаются благодаря ионным связям (противоположные заряды притягиваются), образуя структуру кристаллической решетки NaCl, более известную как каменная соль. Реакция выглядит следующим образом:
Na + + Cl − → NaCl
Многоатомные и молекулярные ионы
Ионизация не ограничивается отдельными атомами; также могут образовываться многоатомные ионы. Многоатомные и молекулярные ионы часто создаются путем добавления или удаления элементарных ионов, таких как H + , в нейтральных молекулах. Например, когда аммиак NH 3 принимает протон H + , он образует ион аммония NH 4 + . Аммиак и аммоний имеют одинаковое количество электронов в практически одинаковой электронной конфигурации, но у аммония есть дополнительный протон (H + ), что придает ему чистый положительный заряд.
Например, когда аммиак NH 3 принимает протон H + , он образует ион аммония NH 4 + . Аммиак и аммоний имеют одинаковое количество электронов в практически одинаковой электронной конфигурации, но у аммония есть дополнительный протон (H + ), что придает ему чистый положительный заряд.
Химическое обозначение
При написании химической формулы иона его суммарный заряд пишется надстрочным индексом сразу после химической структуры молекулы или атома. Чистый заряд записывается с величиной перед знаком , то есть двухзарядный катион указывается как 2 + вместо +2 . Однако величина заряда не указывается для однократно заряженных молекул или атомов; например, катион натрия обозначается как Na + и не Na 1+ .
Альтернативным способом изображения молекулы или атома с несколькими зарядами является многократное рисование знаков; это часто наблюдается с переходными металлами. Химики иногда обводят знак кружком; это просто украшение и не меняет химического значения. Дважды положительно заряженный атом железа можно также выразить как Fe 2+ или Fe ++ .
Химики иногда обводят знак кружком; это просто украшение и не меняет химического значения. Дважды положительно заряженный атом железа можно также выразить как Fe 2+ или Fe ++ .
В случае переходных металлов степени окисления могут быть указаны римскими цифрами; например, Fe 2+ иногда называют Fe(II) или Fe II . Римская цифра обозначает формальную степень окисления элемента, тогда как цифры в верхнем индексе обозначают чистый заряд. Таким образом, эти два обозначения можно заменить для одноатомных ионов, но римские цифры нельзя применять к многоатомным ионам. Однако можно смешивать обозначения для отдельного металлического центра с многоатомным комплексом, как показано с использованием иона уранила (UO 2 ) в качестве примера.
Следует отметить, что из атома можно удалить много электронов. Энергия, необходимая для этого, может быть записана на диаграмме энергии последовательной ионизации.
Первая энергия ионизации : Периодические тенденции зависимости энергии ионизации (IE) от атомного номера: обратите внимание, что в каждом из семи периодов IE (цветные кружки) элемента начинается как минимум с первого столбца Периодической таблицы. (щелочные металлы) и достигает максимума в последней колонке (благородные газы), которые обозначены вертикальными линиями и помечены символом элемента благородных газов, а также служат линиями, разделяющими 7 периодов. Обратите внимание, что максимальная энергия ионизации для каждой строки уменьшается по мере продвижения от строки 1 к строке 7 в данном столбце из-за увеличения расстояния внешней электронной оболочки от ядра по мере добавления внутренних оболочек.
(щелочные металлы) и достигает максимума в последней колонке (благородные газы), которые обозначены вертикальными линиями и помечены символом элемента благородных газов, а также служат линиями, разделяющими 7 периодов. Обратите внимание, что максимальная энергия ионизации для каждой строки уменьшается по мере продвижения от строки 1 к строке 7 в данном столбце из-за увеличения расстояния внешней электронной оболочки от ядра по мере добавления внутренних оболочек.
Лицензии и атрибуты
Периодической таблице исполняется 150 лет: как она возникла и что будет дальше | В центре внимания
- Новости
- 2019 Истории
- Истории
- В центре внимания Уэллсли
Периодической таблице в этом году исполнилось 150 лет, и в ознаменование этой вехи ЮНЕСКО и Генеральная Ассамблея ООН провозгласили этот год «Международным годом Периодической таблицы химических элементов».
Крис Аруманаягам, профессор химии в Уэллсли, называет таблицу «возможно, венцом неустанных поисков человечества по обнаружению закономерностей в нашем окружении».
В сентябре он отправился в Санкт-Петербург, Россия, чтобы отметить годовщину Менделеевского съезда, названного в честь русского химика Дмитрия Менделеева, которому приписывают разработку таблицы. Ниже Аруманаягам отвечает на вопросы о происхождении и истории периодической таблицы, о том, как добавляются новые элементы и как изменилась ее роль в качестве учебного пособия за последние 150 лет.
В: До появления периодической таблицы существовали ли подобные организационные модели или это были первые?
Крис Аруманаягам: Несколько ученых, в том числе Дмитрий Менделеев и Лотар Мейер, работали над упорядочением элементов примерно в 1860-х годах. С тех пор в печати появились сотни различных таблиц, но ни одна из них не сохранилась в такой степени, как таблица Менделеева. Интересно, что самые последние результаты показывают, что периодическую таблицу можно воссоздать на основе методов машинного обучения, которые просеивают огромное количество экспериментальных данных, чтобы найти связи между элементами.
В: Почему Менделеев получает кредит за таблицу?
Аруманаягам: В то время, когда Менделеев начал работать над своей таблицей, было известно, что элементы, расположенные в соответствии с атомным весом, проявляют периодичность в химических и физических свойствах. Скорректировав атомные веса с учетом возможных экспериментальных неопределенностей, Менделеев смог создать таблицу с гораздо меньшим количеством аномалий по сравнению с предыдущими попытками других. Кроме того, Менделеев использовал свою таблицу в 1869 г.правильно предсказать свойства ранее неизвестных элементов, в том числе германия и скандия, за годы до их открытия (1886 и 1879 соответственно).
В: Сейчас таблица используется скорее как средство обучения, чем для прогнозирования, и скоро она будет только средством обучения. Можете ли вы объяснить эту эволюцию?
Аруманаягам: Периодическая таблица, возможно, лучше всего иллюстрирует то, что утверждал статистик Джордж Бокс: «Все модели ошибочны, но некоторые из них полезны». Есть много исключений из периодических тенденций, потому что основной принцип, электронная конфигурация (например, 1s 2 2s 2 2p 2 для углерода), в лучшем случае является приблизительным. Ожидать, что квантовая механика, управляющая свойствами элементов, будет соответствовать предсказаниям периодической таблицы, являющейся организационным инструментом, изобретенным людьми, — это принять желаемое за действительное. Тем не менее преподавание химии было бы невозможно без таблицы Менделеева. Периодическая таблица для студентов-химиков то же, что чертежный стол для архитекторов.
Есть много исключений из периодических тенденций, потому что основной принцип, электронная конфигурация (например, 1s 2 2s 2 2p 2 для углерода), в лучшем случае является приблизительным. Ожидать, что квантовая механика, управляющая свойствами элементов, будет соответствовать предсказаниям периодической таблицы, являющейся организационным инструментом, изобретенным людьми, — это принять желаемое за действительное. Тем не менее преподавание химии было бы невозможно без таблицы Менделеева. Периодическая таблица для студентов-химиков то же, что чертежный стол для архитекторов.
В: Как изобретаются новые элементы?
Аруманаягам: Трансмутация одного ядра в другое может быть вызвана бомбардировкой ядра энергичными частицами, такими как нейтроны. Синтез новых элементов — сбывшаяся мечта алхимика! Недавно синтезированные сверхтяжелые элементы являются выбросами из таблицы Менделеева, потому что в этих элементах участвуют электроны, которые движутся со скоростями, близкими к скорости света. Создание и характеристика новых элементов требует весьма поразительных технических подвигов. Поиск элементов 119и 120 начали в этом году на новом Российском заводе сверхтяжелых элементов (ШЭФ), строительство которого обошлось более чем в 60 миллионов долларов. Часто создается всего несколько атомов вновь синтезированных элементов, потому что через доли секунд после их создания сверхтяжелые ядра расщепляются на множество более легких ядер.
Создание и характеристика новых элементов требует весьма поразительных технических подвигов. Поиск элементов 119и 120 начали в этом году на новом Российском заводе сверхтяжелых элементов (ШЭФ), строительство которого обошлось более чем в 60 миллионов долларов. Часто создается всего несколько атомов вновь синтезированных элементов, потому что через доли секунд после их создания сверхтяжелые ядра расщепляются на множество более легких ядер.
В: В сентябре вы выступили с докладом на симпозиуме «Периодическая таблица в пространстве и времени» на Менделеевском съезде в Санкт-Петербурге, посвященном юбилею. Как это было?
Аруманаягам: Место было подходящим, потому что Дмитрий Менделеев был профессором Санкт-Петербургского университета. Доклады на этом конкретном симпозиуме варьировались от «Нуклеосинтеза Большого Взрыва» до «Астрохимии к семенам жизни». Мой доклад назывался «Космическая химия: фотохимия против радиационной химии». В этой презентации я обсуждал, как пребиотические молекулы (например, глицин) могут образовываться во льдах, окружающих микроскопические пылинки, обнаруженные в межзвездных темных облаках, месте рождения звезд, в триллионах миль от Земли.
В: У вас есть любимый элемент?
Аруманаягам: Оганесон, последний элемент в текущей таблице Менделеева, мой любимый, потому что это элемент, который нарушает большинство правил, которые мы изучаем в химии. Согласно периодической таблице этот элемент должен быть благородным газом (например, гелием), одноатомным газообразным веществом, обладающим крайне низкой химической реакционной способностью. Вместо этого, основываясь на высокоуровневых квантово-механических расчетах, Оганесон предсказывается как полупроводник — твердое вещество, электрическая проводимость которого находится между изолятором и проводником! Кроме того, электроны у Оганессона кажутся размытыми, а не группируются в оболочки (орбитали) вокруг ядра, как в других элементах.
Фото: Двое студентов Уэллсли сидят перед Периодической таблицей элементов размером со стену, расположенной в новом L-крыле Научного центра.
Периодическая таблица – Блоги и журналы St Mary’s Calne
- Сообщение опубликовано: 22 июня 2017 г.

- Категория сообщения: Блог Head Girl’s Team
Есть несколько научных разработок и открытий, которые изменили науку для нас сегодня. К ним относятся открытие пенициллина Александром Флемингом и открытие процесса пастеризации Луи Пастером, а также многое другое. Научная разработка, которую я нахожу особенно интересной, — это периодическая таблица элементов.
Русский химик Дмитрий Менделеев составил первую периодическую таблицу Менделеева в 1869 году. Будучи молодым ученым, он не хотел ничего, кроме систематизации предмета. Однажды Менделеев провел свой день, раскладывая карточки с символами и атомными массами различных элементов. Благодаря этому он смог обнаружить закономерности. Проделав это несколько часов, он заснул за своим столом. Менделеев позднее писал: « Во сне я увидел таблицу, где все элементы встали на свои места, как и требовалось, я сразу же записал это на листе бумаги .’
Большинство ученых могут часто ссылаться на Менделеева, обсуждая разработку Периодической таблицы, потому что он официально записал элементы на бумаге. Однако другие ученые, такие как Джон Ньюлендс, Генри Мозли, Лотар Мейер и Антуан Лавуазье, внесли свой вклад в его успех. Менделеев был наиболее популярен среди упомянутых, потому что его изобретенная таблица не ограничивалась отображением организации элементов; он предположил существование 8 новых элементов, которые еще предстоит открыть.
Однако другие ученые, такие как Джон Ньюлендс, Генри Мозли, Лотар Мейер и Антуан Лавуазье, внесли свой вклад в его успех. Менделеев был наиболее популярен среди упомянутых, потому что его изобретенная таблица не ограничивалась отображением организации элементов; он предположил существование 8 новых элементов, которые еще предстоит открыть.
Как химик, я осознал важность Периодической таблицы, так как часто обращаюсь к ней, чтобы решать проблемы. Как однажды сказал британский педагог-химик Деннис Генри Руврей, « Химию без периодической таблицы так же трудно представить, как плавание без компаса» . Цифры, приведенные в таблице, позволяют ученым производить расчеты, которые могут быть очень полезны в промышленных процессах. Элементы со схожими свойствами группируются вместе; следовательно, прогнозы относительно реакционной способности выбранного элемента можно делать исключительно на основе его положения в таблице. Менделеев первоначально создал таблицу, которая состояла из 8 столбцов и 12 строк.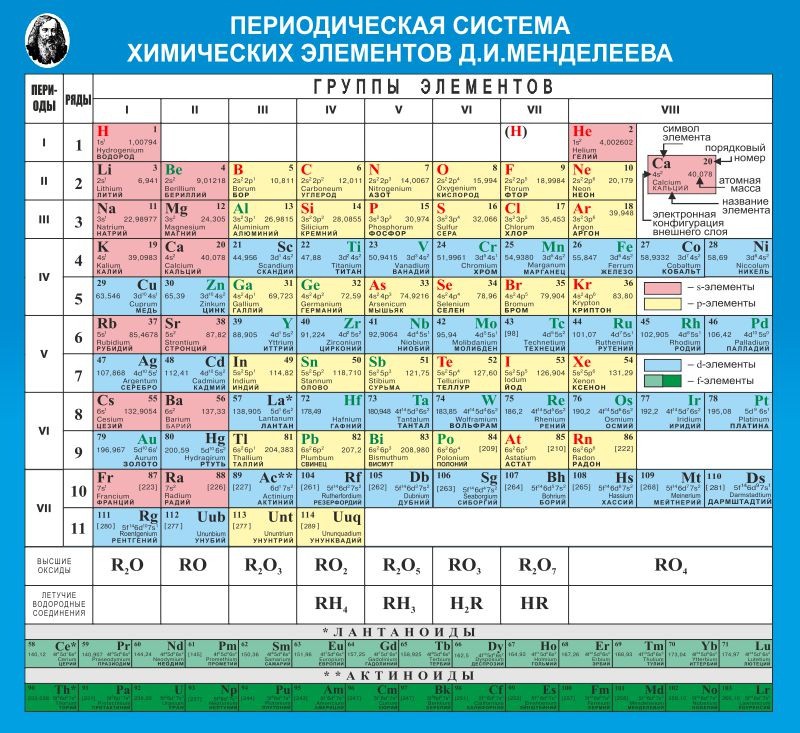 Он понял, что химические свойства элементов связаны с их атомной массой. Это позволило ему расположить элементы с одинаковыми атомными номерами в одних и тех же вертикальных столбцах. Менделеев оставил пробелы в своей исходной таблице, так как считал, что некоторые элементы еще предстоит открыть. Он умело вычислил атомные номера этих загадочных элементов, отметив их положение на столе. Другие ученые позже открыли эти элементы; Расчеты Менделеева оказались правильными. Например, он правильно поместил неоткрытый элемент под алюминием в периодической таблице; этот элемент, галлий, был открыт шестью годами позже, в 1875 году, и его химические и физические свойства совпали с предсказаниями Менделеева.
Он понял, что химические свойства элементов связаны с их атомной массой. Это позволило ему расположить элементы с одинаковыми атомными номерами в одних и тех же вертикальных столбцах. Менделеев оставил пробелы в своей исходной таблице, так как считал, что некоторые элементы еще предстоит открыть. Он умело вычислил атомные номера этих загадочных элементов, отметив их положение на столе. Другие ученые позже открыли эти элементы; Расчеты Менделеева оказались правильными. Например, он правильно поместил неоткрытый элемент под алюминием в периодической таблице; этот элемент, галлий, был открыт шестью годами позже, в 1875 году, и его химические и физические свойства совпали с предсказаниями Менделеева.
Наука постоянно меняется и развивается. Внешний вид диаграммы изменился. Изначально таблица Менделеева содержала 63 элемента. Однако современные Периодические таблицы содержат 118 элементов. Современные ученые сохранили менделеевское использование столбцов и строк. Строки сегодняшних таблиц показывают элементы в порядке менделеевских столбцов. Элементы, находящиеся в одном столбце (группе) Периодической таблицы, имеют одинаковое количество электронов на внешней оболочке и, следовательно, обладают сходными химическими свойствами. Например, такие элементы, как литий и калий, имеют 1 электрон на внешней оболочке, и они оба реагируют с водой с образованием гидроксида металла и газообразного водорода. Элементы в одном ряду (периоде) имеют одинаковое количество орбиталей. По мере продвижения вниз по периодам каждая строка добавляет дополнительную орбиталь. Другое изменение, которое было внесено в таблицу, появилось позже в 19 г.13; Британский химик Генри Мозли считал, что лучше расположить элементы в порядке возрастания атомного номера, а не атомной массы. Периодическая таблица логична, что показывает, что Менделеев достиг своей цели, тщательно систематизировав свои химические знания.
Элементы, находящиеся в одном столбце (группе) Периодической таблицы, имеют одинаковое количество электронов на внешней оболочке и, следовательно, обладают сходными химическими свойствами. Например, такие элементы, как литий и калий, имеют 1 электрон на внешней оболочке, и они оба реагируют с водой с образованием гидроксида металла и газообразного водорода. Элементы в одном ряду (периоде) имеют одинаковое количество орбиталей. По мере продвижения вниз по периодам каждая строка добавляет дополнительную орбиталь. Другое изменение, которое было внесено в таблицу, появилось позже в 19 г.13; Британский химик Генри Мозли считал, что лучше расположить элементы в порядке возрастания атомного номера, а не атомной массы. Периодическая таблица логична, что показывает, что Менделеев достиг своей цели, тщательно систематизировав свои химические знания.
Работа Менделеева, несомненно, произвела революцию в химии. Его достижения были отмечены медалью Копли в 1905 году. Британское королевское общество присудило ему эту награду за новаторское открытие Периодической таблицы. Периодическая таблица показывает нам широкий спектр существующих веществ: около 98 элементов существуют в природе, в то время как другие были созданы только в ядерных реакторах. Вещества всегда пересматриваются и анализируются, поскольку потенциально они могут быть новыми элементами. Как человек, глубоко увлеченный химией, мое понимание элементов и предмета в целом сильно поддерживается этим развитием.
Периодическая таблица показывает нам широкий спектр существующих веществ: около 98 элементов существуют в природе, в то время как другие были созданы только в ядерных реакторах. Вещества всегда пересматриваются и анализируются, поскольку потенциально они могут быть новыми элементами. Как человек, глубоко увлеченный химией, мое понимание элементов и предмета в целом сильно поддерживается этим развитием.
Чтобы узнать больше, нажмите на следующую ссылку https://www.youtube.com/watch?v=0RRVV4Diomg .
Фарида (LVI)
История периодической таблицы
Разработка периодической таблицы элементов идет параллельно развитию науки и нашего понимания физической вселенной. Это центральное место в нашем нынешнем понимании «вещества», из которого мы все сделаны. Самые ранние попытки понять материю носили прежде всего философский характер, не прибегая к строгой экспериментальной проверке. Таким образом, хотя некоторые химические элементы были известны с древних времен, не предпринималось попыток систематизировать их по свойствам.
Содержание
- 1 Предварительная работа
- 1.1 Антуан-Лоран де Лавуазье
- 1.2 Йонс Якоб Берцелиус
- 1.3 Иоганн Вольфганг Доберейнер
- 1.4 Александр-Эмиль Бегуйе де Шанкуртуа
- 1,5 Октавы Джона Ньюлендса
- 2 Первый стол
- 2.1 Юлиус Лотар Мейер
- 2.2 Дмитрий Менделеев
- 2.3 Лорд Рэлей и Уильям Рэмси
- 3 К современному столу
- 3.1 Генри Мозли
- 3.2 Глен Сиборг
- 4 Внешние ссылки
- 5 кредитов
По мере развития науки в восемнадцатом и девятнадцатом веках скорость открытия новых элементов увеличивалась. К 1809 г. было открыто 47 элементов, а к 1863 г. было известно 56. По мере роста числа известных элементов ученые начали распознавать закономерности в их свойствах и начали разрабатывать способы их классификации.
Предварительная работа
Antoine-Laurent de Lavoisier
Anotoine Laurent de Lavoisier
Lavoisier’s Traité Élémentaire de Chimie («Элементарный трактат по химии») считается первым химическим, переведенным на английский язык Робертом Кербером 1789, учебник. Он содержал список элементов или веществ, которые нельзя было разложить дальше, включая кислород, азот, водород, фосфор, ртуть, цинк и серу. Он также составляет основу современного списка элементов. Однако в его список также входили легкие и калорийные вещества, которые он считал материальными веществами. В то время как многие ведущие химики того времени отказывались верить новым открытиям Лавуазье, Elementary Treatise был написан достаточно хорошо, чтобы убедить молодое поколение.
Он содержал список элементов или веществ, которые нельзя было разложить дальше, включая кислород, азот, водород, фосфор, ртуть, цинк и серу. Он также составляет основу современного списка элементов. Однако в его список также входили легкие и калорийные вещества, которые он считал материальными веществами. В то время как многие ведущие химики того времени отказывались верить новым открытиям Лавуазье, Elementary Treatise был написан достаточно хорошо, чтобы убедить молодое поколение.
Йонс Якоб Берцелиус
Статуя Берцелиуса в центре парка Берцели, Стокгольм
Берцелиус был шведским химиком. В 1828 году он составил таблицу относительных атомных весов, в которой кислород был принят за 100 и которая включала все элементы, известные в то время. Для периодической таблицы важно то, что он изобрел современную систему химических обозначений и установил основные символы для элементов, которые используются сегодня. В этой системе элементам присваиваются символы, а соединения представляются сочетанием символов элементов и чисел, представляющих пропорции. Студентам, работающим в лаборатории Берцелиуса, приписывают открытие лития и ванадия. Другими элементами, приписываемыми Берцелиусу, являются кремний, селен, торий и церий. Вместе с Джоном Дальтоном и Антуаном Лавуазье он считается отцом современной химии.
Студентам, работающим в лаборатории Берцелиуса, приписывают открытие лития и ванадия. Другими элементами, приписываемыми Берцелиусу, являются кремний, селен, торий и церий. Вместе с Джоном Дальтоном и Антуаном Лавуазье он считается отцом современной химии.
Иоганн Вольфганг Доберейнер
Доберейнер был немецким химиком. Как сын кучера, у него было мало возможностей для формального образования, но он был отдан в ученики к аптекарю, много читал и посещал научные лекции. В конце концов с 1810 года он был профессором Йенского университета. Он открыл фурфурол, работал над использованием платины в качестве катализатора и изобрел зажигалку, известную как лампа Доберейнера. Что касается периодической таблицы, он особенно известен своим открытием триад элементов в 1829 году.. Он определил группы из трех химически сходных элементов, которые, как мы понимаем сегодня, попадают в одну и ту же группу или семейство периодической таблицы.
| Элемент | Молярная масса (г/моль) | Плотность (г/см³) | Коэффициент (см³/моль) |
|---|---|---|---|
| хлор | 35. 4527 4527 | 0,003214 | 11030 |
| бром | 79,904 | 3,122 | 25,6 |
| йод | 126. | 4,93 | 25,7 |
| кальций | 40.078 | 1,54 | 26,0 |
| стронций | 87,62 | 2,64 | 33,2 |
| барий | 137,327 | 3,594 | 38,2 |
Александр-Эмиль Бегуйер де Шанкуртуа
Александр-Эмиль Бегуйе де Шанкуртуа, французский геолог, был первым, кто заметил периодичность элементов — похожие элементы появляются через равные промежутки времени, когда они упорядочены по их атомному весу. Он разработал раннюю форму периодической таблицы, которую назвал теллурической спиралью . С элементами, расположенными по спирали на цилиндре в порядке возрастания атомного веса, де Шанкуртуа увидел, что элементы со схожими свойствами выстраиваются вертикально.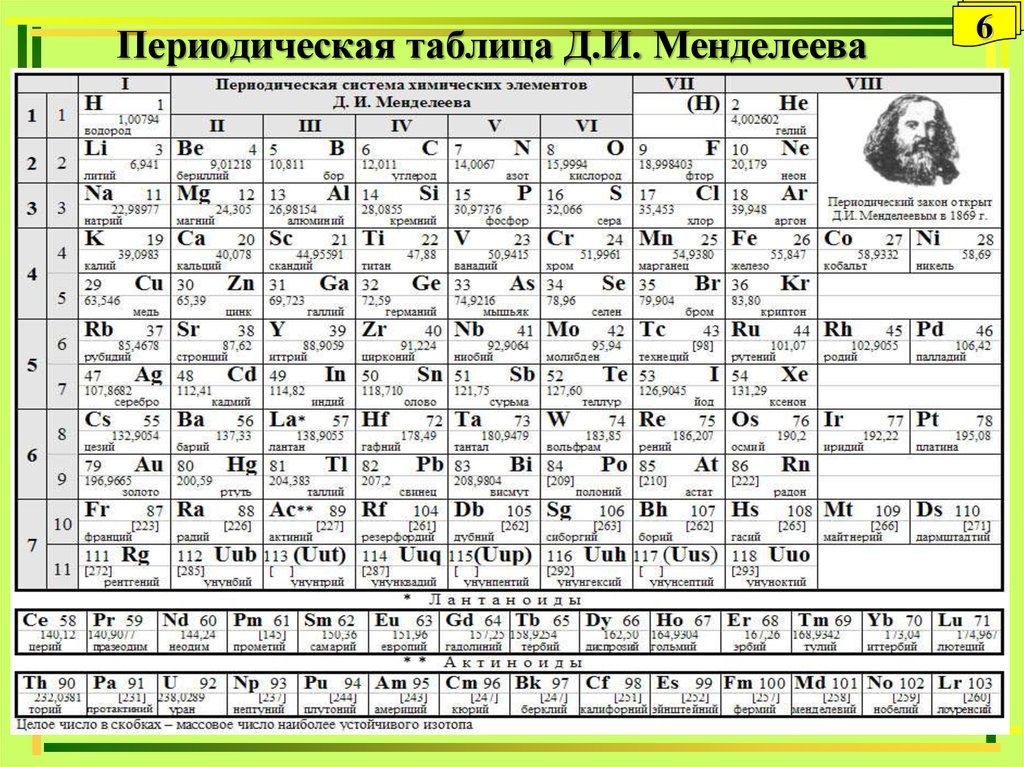 Его диаграмма включала некоторые ионы и соединения в дополнение к элементам. Его статья была опубликована в 1862 году, но в ней использовались геологические, а не химические термины, и в ней не было диаграммы; в результате ему уделялось мало внимания до работы Дмитрия Менделеева. [1]
Его диаграмма включала некоторые ионы и соединения в дополнение к элементам. Его статья была опубликована в 1862 году, но в ней использовались геологические, а не химические термины, и в ней не было диаграммы; в результате ему уделялось мало внимания до работы Дмитрия Менделеева. [1]
Октавы Джона Ньюлендса
Джон Ньюлендс был английским химиком, написавшим в 1863 году статью, в которой классифицировал 56 открытых к тому времени элементов на 11 групп, основанных на схожих физических свойствах. Он отметил, что существует много пар подобных элементов, которые различаются атомным весом, кратным восьми.
Компания Newlands взяла идеи Доберейнера и расширила их. Он также организовал свои элементы по массе и свойствам, но добавил изюминку. Доберейнер работал только в небольших группах, но Ньюлендс хотел связать все элементы друг с другом.
Ньюлендс расположил известные элементы в таблице по атомным весам. При этом он заметил некоторые повторяющиеся паттерны, а паттерны были такими, что если бы он разбил свой список элементов на группы по семь, то первые элементы в каждой из этих групп были бы похожи друг на друга, как и второй элемент в каждой. группа, третья и так далее. По аналогии с тонической музыкальной гаммой из семи нот, образующих октавы, он назвал свое открытие Законом Октав .
группа, третья и так далее. По аналогии с тонической музыкальной гаммой из семи нот, образующих октавы, он назвал свое открытие Законом Октав .
Ньюлендс также заметил, что кремний и олово составляют часть триады, и поэтому предсказал третий неизвестный элемент с атомным весом около 73, предвосхитив предсказание Менделеева о германии на шесть лет, но не оставил места для нового элемента в своей таблице. .
Работа Ньюлендса подверглась резкой критике и даже насмешкам со стороны других химиков из-за отсутствия места для неоткрытых элементов и помещения двух элементов в одну коробку, но в конце концов он был награжден медалью Дэви Королевским обществом в 1887 году.
Первая таблица
По мере того, как число известных элементов увеличивалось, два человека, работая независимо друг от друга, примерно в одно и то же время создали первые периодические таблицы. Этими двумя были Юлий Лотар Мейер и Дмитрий Менделеев. Мейер опубликовал некоторые данные первым, но таблицу опубликовал только через несколько месяцев после Менделеева. Мейера и Менделеева можно считать соавторами периодической таблицы, хотя большинство согласны с тем, что точные предсказания Менделеева приносят ему большую долю доверия. В то время именно предсказания Менделеева произвели большое впечатление на его современников, особенно когда в конце концов они оказались верными.
Мейера и Менделеева можно считать соавторами периодической таблицы, хотя большинство согласны с тем, что точные предсказания Менделеева приносят ему большую долю доверия. В то время именно предсказания Менделеева произвели большое впечатление на его современников, особенно когда в конце концов они оказались верными.
Юлий Лотар Мейер
Мейер был современником Менделеева; он получил медицинское образование в Цюрихе, Швейцария, а затем учился и преподавал в различных немецких университетах. Хотя его первым интересом была физиология, он в первую очередь интересовался химией. Мейер изучал физические свойства элементов и заметил периодичность их молярного объема.
В 1864 году Мейер опубликовал предварительный список из 28 элементов, разделенных на 6 семейств по их валентности — это был первый случай, когда элементы были сгруппированы и упорядочены в соответствии с их валентностью. Работа по организации элементов по атомному весу до сих пор тормозилась из-за неточных измерений атомного веса. Затем в 1868 г. он подготовил расширенный вариант, а в 1870 г. опубликовал свой список в виде таблицы, во многом похожей на менделеевскую.
Затем в 1868 г. он подготовил расширенный вариант, а в 1870 г. опубликовал свой список в виде таблицы, во многом похожей на менделеевскую.
Дмитрий Менделеев
Страница из первого английского издания учебника Менделеева (1891 г., на основе пятого русского издания). Он показывает изменения химических свойств в зависимости от атомного веса, которые он использовал для составления своей периодической таблицы. Периоды представлены (правый столбец), но группы не показаны.
Дмитрий Менделеев (также пишется Менделеев, второе имя (отчество) Иванович, был русским химиком сибирского происхождения. Менделеев исследовал изменение химических свойств элементов (см. Изображение справа) и заметил их периодические изменения. Он расположил элементы в таблице, упорядоченной по атомной массе 6 марта 1869 г., в Русском химическом обществе была сделана официальная презентация под названием Зависимость между свойствами атомных весов элементов .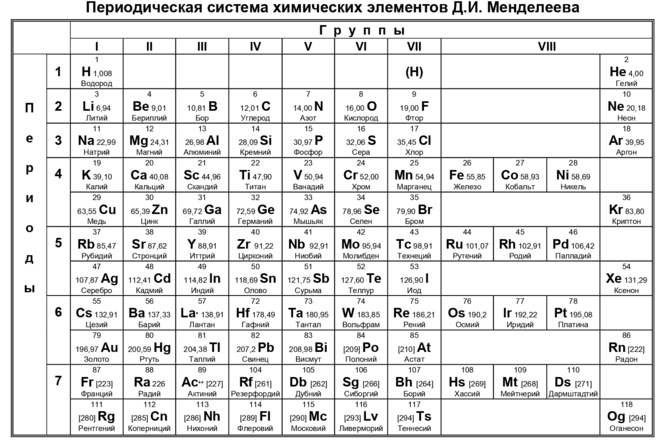 Его таблица была первоначально опубликована в малоизвестном русском журнале, но быстро переиздана в немецком журнале Zeitschrift für Chemie в 1869 году.
Его таблица была первоначально опубликована в малоизвестном русском журнале, но быстро переиздана в немецком журнале Zeitschrift für Chemie в 1869 году.
Работа Менделеева заявлена
- Элементы, расположенные в соответствии с их атомным весом, проявляют кажущуюся периодичность свойств.
- Элементы, сходные по своим химическим свойствам, имеют атомный вес, который либо почти одинаков (например, Pt, Ir, Os), либо регулярно увеличивается (например, K, Rb, Cs).
- Расположение элементов или групп элементов в порядке их атомных весов соответствует их так называемым валентностям, а также в некоторой степени их отличительным химическим свойствам; как это видно среди других серий в сериях Li, Be, Ba, C, N, O и Sn.
- Наиболее широко распространенные элементы имеют небольшой атомный вес.
- Величина атомного веса определяет характер элемента, так же как величина молекулы определяет характер сложного тела.
- Следует ожидать открытия многих еще неизвестных элементов, например элементов, аналогичных алюминию и кремнию, атомный вес которых будет между 65 и 75.

- Атомный вес элемента иногда можно исправить, зная веса смежных с ним элементов. Таким образом, атомный вес теллура должен лежать между 123 и 126 и не может быть равен 128.
- Определенные характерные свойства элементов можно предсказать по их атомному весу.
Таблица Менделеева
| Группа → | я | II | III | IV | В | VI | VII | VIII | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Период ↓ | | ||||||||||||||||||||||||||||
| 1 | 1 Н | ||||||||||||||||||||||||||||
| 2 | 7 Ли | 9,4 Бе | 11 Б | 12 С | 14 Н | 16 О | 19 Ф | | | ||||||||||||||||||||
| 3 | 23 Нет | 24 мг | 27,3 Ал | 28 Си | 31 П | 32 С | 35,5 Кл | | | ||||||||||||||||||||
| 4 | 39 К | 40 Ка | 44 ? | 48 Ти | 51 В | 52 Кр | 55 Мн | 56, 59, 59 Fe, Co, Ni | | ||||||||||||||||||||
| 5 | 63 Медь | 65 Цинк | 68 ? | 72 ? | 75 Как | 78 Се | 80 Бр | | | ||||||||||||||||||||
| 6 | 85 руб.  | 87 Старший | 88 ?Yt | 90 Зр | 94 Нб | 96 Пн | 100 ? | 104, 104, 106 Ру, Права, Палладия | | ||||||||||||||||||||
| 7 | 108 Аг | 112 CD | 113 В | 118 Сн | 122 Сб | 125 Те | 127 Я | | | ||||||||||||||||||||
| 8 | 133 цезия | 137 Ба | 138 ?Ди | 140 ?Се | | | | | | ||||||||||||||||||||
| 9 | | | | | | | | | | ||||||||||||||||||||
| 10 | | | 178 ?Эр | 180 ?Ла | 182 Та | 184 Вт | | 195, 197, 198 Os, Ir, Pt | | ||||||||||||||||||||
| 11 | 199 Золото | 200 рт.  ст. ст. | 204 Тл | 207 Pb | 208 Би | | | | | ||||||||||||||||||||
| 12 | | | | 231 Т-й | | 240 У | | | | ||||||||||||||||||||
| | |||||||||||||||||||||||||||||
| Группа I | Группа II | Группа III | Группа IV |
| Группа V | Группа VI | Группа VII | Группа VIII |
Менделеев использовал свою таблицу для предсказания свойств и существования других новых элементов (? в таблице выше). Он оставил место в своей таблице для этих новых элементов, эка-кремния (германия), эка-алюминия (галлия) и эка-бора (скандия). Он указал, что некоторые из тогдашних атомных весов были неправильными и предусматривали отклонение от порядка атомных весов.
Он оставил место в своей таблице для этих новых элементов, эка-кремния (германия), эка-алюминия (галлия) и эка-бора (скандия). Он указал, что некоторые из тогдашних атомных весов были неправильными и предусматривали отклонение от порядка атомных весов.
Лорд Рэлей и Уильям Рэмси
Вечером 19 апреляВ 1894 году Уильям Рамзи посетил лекцию лорда Рэлея. Рэлей заметил несоответствие между плотностью азота, полученного путем химического синтеза, и азота, выделенного из воздуха путем удаления других известных компонентов. После короткого обсуждения он и Рамзи решили заняться этим. К августу Рамзи мог написать Рэлею, чтобы сообщить, что он выделил ранее неизвестный тяжелый компонент воздуха, который, по-видимому, не обладал какой-либо очевидной химической активностью. Он назвал газ «аргон». В последующие годы он открыл неон, криптон и ксенон. Он также выделил гелий, который наблюдался в спектре Солнца, но не был обнаружен на Земле. В 1910 он также выделил и охарактеризовал радон.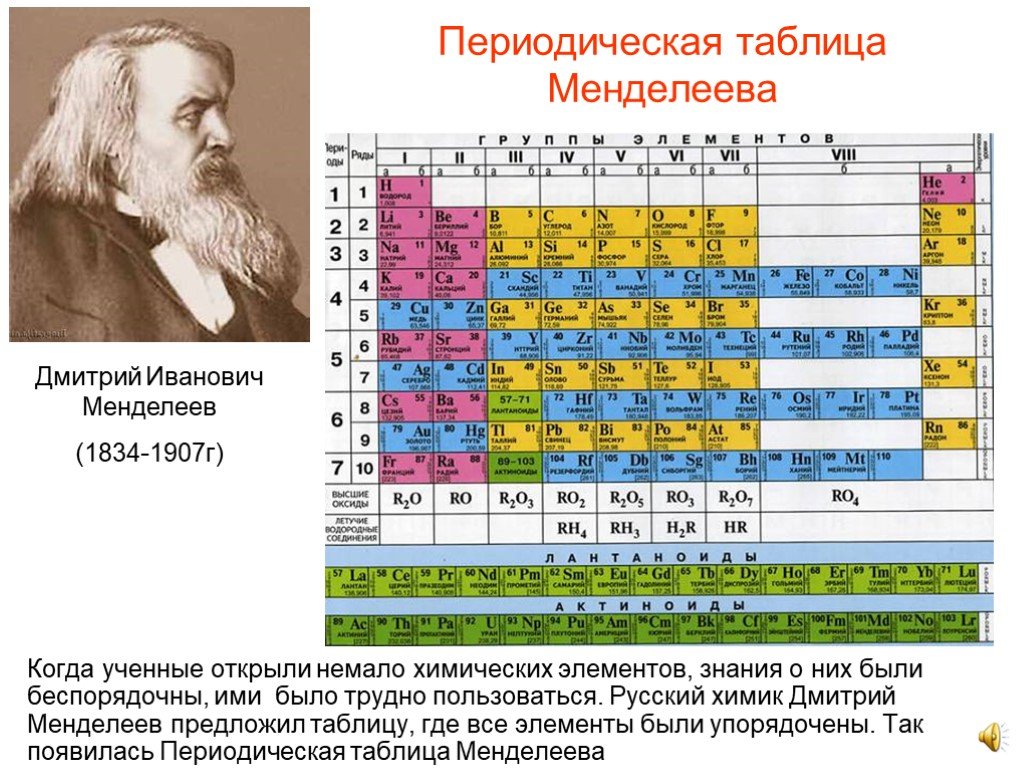
Эти благородные газы первоначально были включены в таблицу Менделеева как нулевая группа и помещены перед элементами группы I каждого периода.
На пути к современной таблице
В начале двадцатого века мы увидели быстрый прогресс в нашем понимании структуры материи и сопутствующие изменения в периодической таблице. Благородные газы помещались в конце периодов, а не в начале. Было обнаружено, что периоды четыре и выше длиннее, чем с первого по третий, поскольку переходные металлы были размещены правильно, а более короткие периоды были разделены.
В 1911 году Резерфорд продемонстрировал, что атомы имеют ядро, в котором сосредоточена большая часть массы и весь положительный заряд атома. Заряд ядра, или атомный номер (количество протонов в ядре), стал организующим принципом таблицы.
Генри Мозли
В 1913 году Генри Мозли обнаружил связь между длиной волны рентгеновского излучения элемента и его атомным номером. До этого открытия атомные номера были просто случайными числами, основанными на атомном весе элемента. Открытие Мозли показало, что атомные числа не были произвольными, а имели поддающуюся экспериментальному измерению основу.
Открытие Мозли показало, что атомные числа не были произвольными, а имели поддающуюся экспериментальному измерению основу.
Исследование Мосли показало, что порядок элементов в таблице должен соответствовать атомному номеру, а не атомному весу. Это решило некоторые проблемы, о которых знал даже Менделеев. Его работа также показала, что в таблице были пробелы под атомными номерами 43 и 61, которые теперь известны как радиоактивные и не встречающиеся в природе. Следуя по стопам Дмитрия Менделеева, Генри Мозли также предсказал новые элементы.
Глен Сиборг
Сиборг шведского происхождения родился в Ишпеминге, штат Мичиган. В 1919 году он получил степень бакалавра химии в Калифорнийском университете в Лос-Анджелесе.34. Он защитил докторскую диссертацию по химии (хотя диссертация была по физике) в Калифорнийском университете в Беркли в 1937 году. с 1958 по 1961 год.
В своих ранних исследованиях он использовал циклотронную бомбардировку для создания более 50 атомных изотопов, включая несколько, которые до сих пор используются в медицине. В 1941 году ему приписывают открытие и выделение плутония, а впоследствии и трансурановых элементов с атомным номером 9.с 4 по 102. Его работа над трансурановыми элементами привела к реконфигурации периодической таблицы, в которой он поместил ряд актиноидов под ряд лантанидов в нижней части таблицы, чтобы придать периодической таблице тот вид, который она имеет сегодня.
В 1941 году ему приписывают открытие и выделение плутония, а впоследствии и трансурановых элементов с атомным номером 9.с 4 по 102. Его работа над трансурановыми элементами привела к реконфигурации периодической таблицы, в которой он поместил ряд актиноидов под ряд лантанидов в нижней части таблицы, чтобы придать периодической таблице тот вид, который она имеет сегодня.
В знак признания его заслуг элемент 106 был назван в его честь сиборгием.
Внешние ссылки
Все ссылки получены 11 января 2018 г.
- Периодическая таблица WebElements
- Классификация элементов
- Веб-страница, содержащая несколько научных и полупопулярных статей о различных аспектах периодической системы и основных теоретических концепциях. Некоторые из них доступны для скачивания.
Периодические таблицы |
| Стандартный стол | Вертикальный стол | Таблица с именами | Имена и атомные массы (большие) | Имена и атомные массы (маленькие) | Имена и атомные массы (только текст) | Встроенный F-блок | Элементы до 218 | Электронные конфигурации | Металлы и неметаллы | Таблица по блокам | Список элементов по названию |
| Группы: 1 – 2 – 3 – 4 – 5 – 6 – 7 – 8 – 9 – 10 – 11 – 12 – 13 – 14 – 15 – 16 – 17 – 18 |
| Периоды: 1 – 2 – 3 – 4 – 5 – 6 – 7 – 8 |
| Серия: Щелочи – Щелочные земли – Лантаниды – Актиниды – Переходные металлы – Бедные металлы – Металлоиды – Неметаллы – Галогены – Инертные газы |
| Блоки: s-блок – p-блок – d-блок – f-блок – g-блок |
| Общие разделы естественных наук |
|---|
| Астрономия | Биология | Химия | Науки о Земле | Экология | Физика |
Авторы
Энциклопедия Нового Света писатели и редакторы переписали и дополнили статью Википедии в соответствии со стандартами New World Encyclopedia .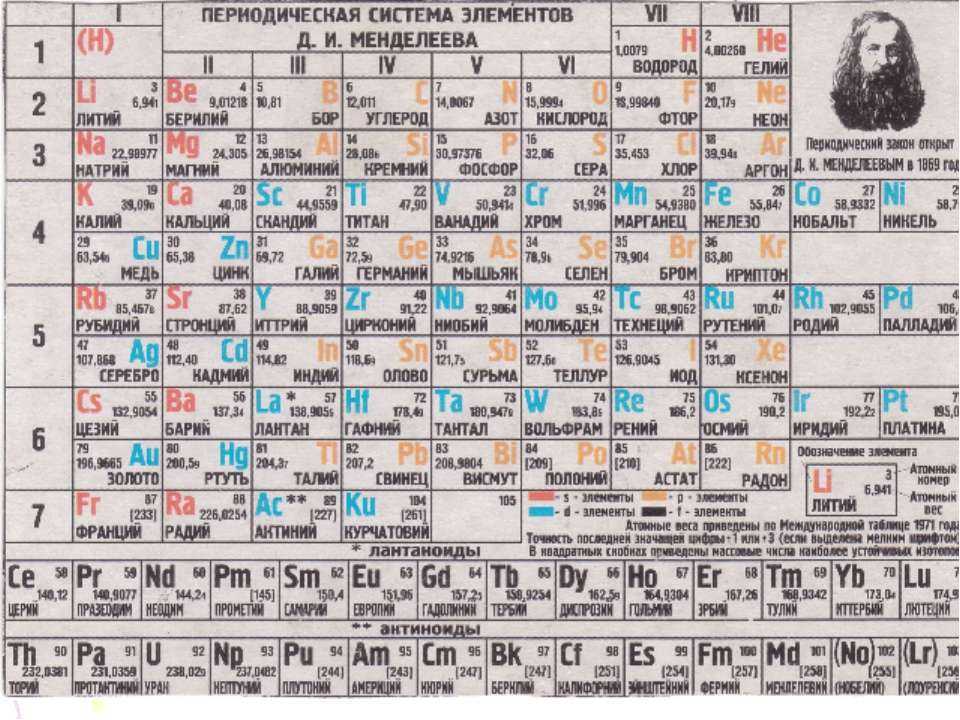

 Трудовой кодекс – это свод законов связанных
Трудовой кодекс – это свод законов связанных
 Сера обладает самыми слабыми металлическими свойствами, а с другой стороны, Бог — самый сильный неметалл.
Сера обладает самыми слабыми металлическими свойствами, а с другой стороны, Бог — самый сильный неметалл.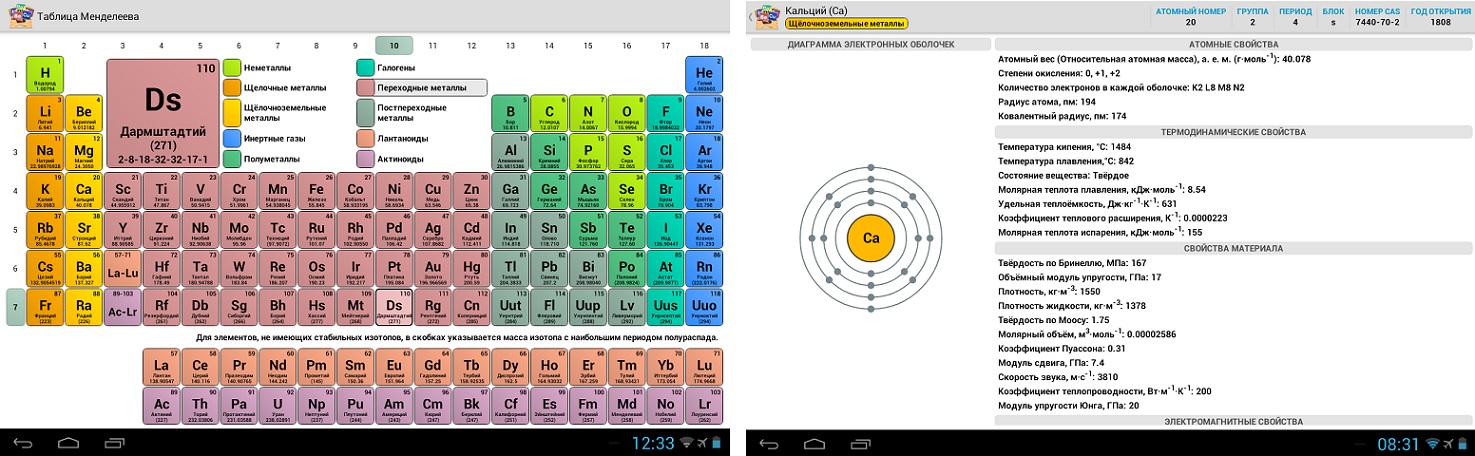
 Индий принадлежит к той же группе, что и алюминий, с увеличением значений EO In→Al (снизу вверх). Алюминий находится в том же цикле, что и сера, и EO-ост увеличивает Al→S (слева направо). Если сравнивать серу и теллур, то сера находится в группе выше теллура и поэтому также имеет более высокую электроотрицательность.
Индий принадлежит к той же группе, что и алюминий, с увеличением значений EO In→Al (снизу вверх). Алюминий находится в том же цикле, что и сера, и EO-ост увеличивает Al→S (слева направо). Если сравнивать серу и теллур, то сера находится в группе выше теллура и поэтому также имеет более высокую электроотрицательность. Пробелы в таблице позволяли прогнозировать новые элементы и их свойства.
Пробелы в таблице позволяли прогнозировать новые элементы и их свойства. 378 (2180). doi:10.1002/chem.202004775
378 (2180). doi:10.1002/chem.202004775 Амстердам: Эльзевир.
Амстердам: Эльзевир.





