Таблица менделеева – Электронный учебник K-tree
Электронный учебник
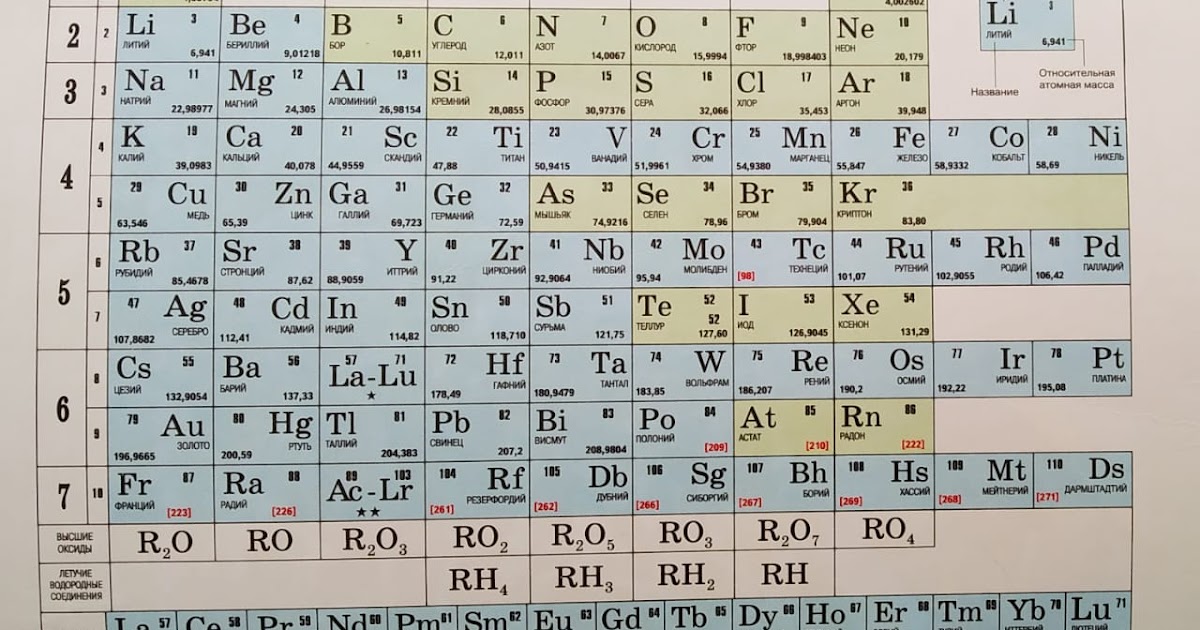
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.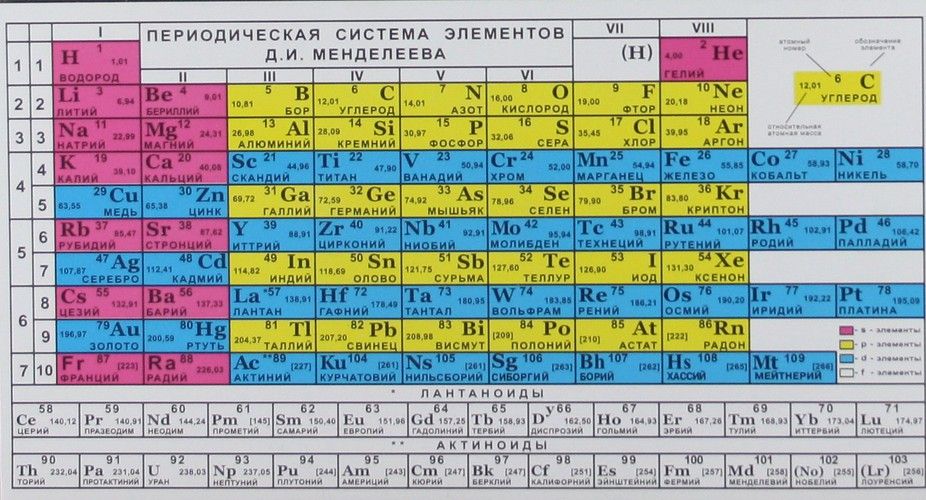
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
ЛАНТАН (La)
Основные параметры и свойства Лантан
Свойства атома Лантана |
|
|
Название |
Лантан / Lanthanum |
|
Символ |
La |
|
Номер |
57 |
|
Атомная масса (молярная масса) |
138,90547 (7) а. |
|
Электронная конфигурация |
[Xe] 5d1 6s2 |
|
Радиус атома |
187 пм |
Химические свойства Лантана |
|
|
Ковалентный радиус |
169 пм |
|
Радиус иона |
101 (+3e) 6 пм |
|
Электроотрицательность |
1,10 (шкала Полинга) |
|
Электродный потенциал |
La←La3+ -2,38В |
|
Степени окисления |
3 |
|
Энергия ионизации (первый электрон) |
541,1(5,61) кДж/моль (эВ) |
Термодинамические свойства простого вещества |
|
|
Плотность (при н. |
6,162-6,18 (альфа-модификация) г/см3 |
|
Температура плавления |
920 K |
|
Температура кипения |
3447-3469 K |
|
Уд. теплота плавления |
8,5 кДж/моль |
|
Уд. теплота испарения |
402 кДж/моль |
|
Молярная теплоёмкость |
27,11 Дж/(K·моль) |
|
Молярный объём |
22,5 см3/моль |
Кристаллическая решётка простого вещества |
|
|
Структура решётки |
гексагональная |
|
Параметры решётки |
a=3,772 c=12,14 Å |
|
Отношение c/a |
3,22 |
|
Температура Дебая |
132 K |
Прочие характеристики Лантана |
|
|
Теплопроводность |
|
лантан | химический элемент | Британика
лантан
Посмотреть все СМИ
- Ключевые люди:
- Карл Густав Мосандер
- Похожие темы:
- химический элемент редкоземельный элемент
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
лантан (La) , химический элемент, редкоземельный металл группы 3 периодической таблицы, который является прототипом элементов лантанидного ряда.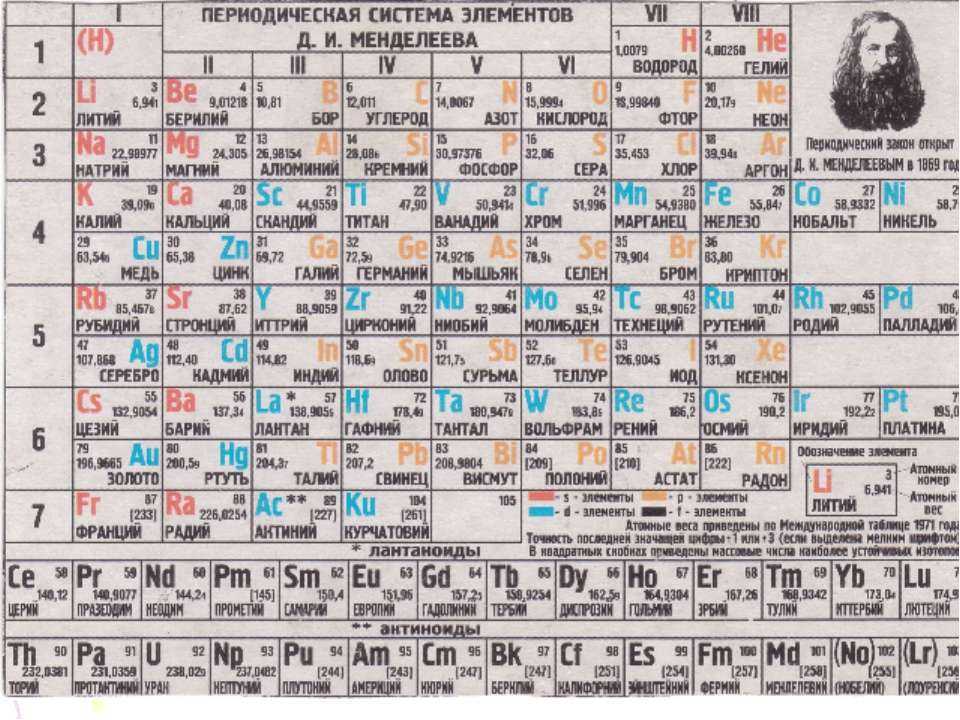
Лантан — пластичный и ковкий серебристо-белый металл, достаточно мягкий, чтобы его можно было резать ножом. Это второй по реакционной способности редкоземельный металл после европия. Лантан окисляется на воздухе при комнатной температуре с образованием La
Britannica Викторина
118 Имена и символы периодической таблицы Викторина
Элементарная викторина по фундаментальным вопросам.
Этот элемент был открыт в виде оксида (лантана) в 1839 году Карлом Густавом Мосандером, который отличил его от оксида церия (церия). Его название происходит от греческого lanthanein , что означает «быть скрытым», что указывает на то, что его трудно изолировать. Лантан встречается в редкоземельных минералах монаците и бастназите. Его так же много, как кобальта, в верхней части континентальной коры Земли.
В природе встречаются два изотопа: стабильный лантан-139 (99,9119%) и очень долгоживущий радиоактивный лантан-138 (0,0888%). Всего было охарактеризовано 38 радиоактивных изотопов лантана (за исключением ядерных изомеров) с массой от 117 до 155 и периодом полураспада от 23,5 миллисекунд (лантан-117) до 1,02 × 10 11 лет (лантан-138). . Изотоп лантан-140 был обнаружен в виде продукта деления в снегу после испытательных ядерных взрывов.
Лантан концентрируется в промышленных масштабах путем кристаллизации нитрата лантана аммония. Ионообменные методы и методы экстракции растворителем используются, когда требуется высокая чистота. Металл получают электролизом расплавленных безводных галогенидов или металлотермическим восстановлением его галогенидов щелочными или щелочноземельными металлами (например, восстановление фторида кальцием).
Металл получают электролизом расплавленных безводных галогенидов или металлотермическим восстановлением его галогенидов щелочными или щелочноземельными металлами (например, восстановление фторида кальцием).
Лантан существует в трех аллотропных (структурных) формах. α-фаза представляет собой гексагональную двойную плотную упаковку с a = 3,7740 Å и c = 12,171 Å при комнатной температуре. β-фаза представляет собой гранецентрированную кубическую форму с a = 5,303 Å при 325 ° C (617 ° F). γ-фаза является объемно-центрированной кубической с a = 4,26 Å при 887 ° C (1629 ° F).
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Высокоочищенный оксид лантана используется в производстве стекол с низкой дисперсией и высоким преломлением для компонентов линз. Лантан часто используется как LaNi 9.0029 5 Сплавы для хранения водорода и никель-металлогидридные аккумуляторы в гибридных автомобилях. Лантан добавляют в сплавы черных металлов (для удаления кислорода, серы и других примесей) и в сплавы цветных металлов, такие как суперсплавы, сплавы магния и сплавы алюминия. Соединения лантана используются в качестве основы для люминофоров в флуоресцентном освещении и детекторах рентгеновского излучения, а также в катализаторах крекинга нефти, что является одним из его основных применений. Миш-металл (обычно 50 процентов церия, 25 процентов лантана, 18 процентов неодима, 5 процентов празеодима и 2 процента других редкоземельных элементов) в основном используется для изготовления более легких кремней и легирующих добавок. В сочетании с железом и кремнием лантан образует кубические интерметаллиды с общей химической формулой La(Fe 1− x Si x ) 13 проявляющие гигантский магнитокалорический эффект. Когда эти соединения гидрируются примерно до 1,2–1,5 атомов водорода на формульную единицу, они имеют температуры магнитного упорядочения, близкие к комнатной температуре, и поэтому их можно использовать в качестве магнитных охлаждающих материалов для применений, близких к комнатной температуре.
Лантан добавляют в сплавы черных металлов (для удаления кислорода, серы и других примесей) и в сплавы цветных металлов, такие как суперсплавы, сплавы магния и сплавы алюминия. Соединения лантана используются в качестве основы для люминофоров в флуоресцентном освещении и детекторах рентгеновского излучения, а также в катализаторах крекинга нефти, что является одним из его основных применений. Миш-металл (обычно 50 процентов церия, 25 процентов лантана, 18 процентов неодима, 5 процентов празеодима и 2 процента других редкоземельных элементов) в основном используется для изготовления более легких кремней и легирующих добавок. В сочетании с железом и кремнием лантан образует кубические интерметаллиды с общей химической формулой La(Fe 1− x Si x ) 13 проявляющие гигантский магнитокалорический эффект. Когда эти соединения гидрируются примерно до 1,2–1,5 атомов водорода на формульную единицу, они имеют температуры магнитного упорядочения, близкие к комнатной температуре, и поэтому их можно использовать в качестве магнитных охлаждающих материалов для применений, близких к комнатной температуре.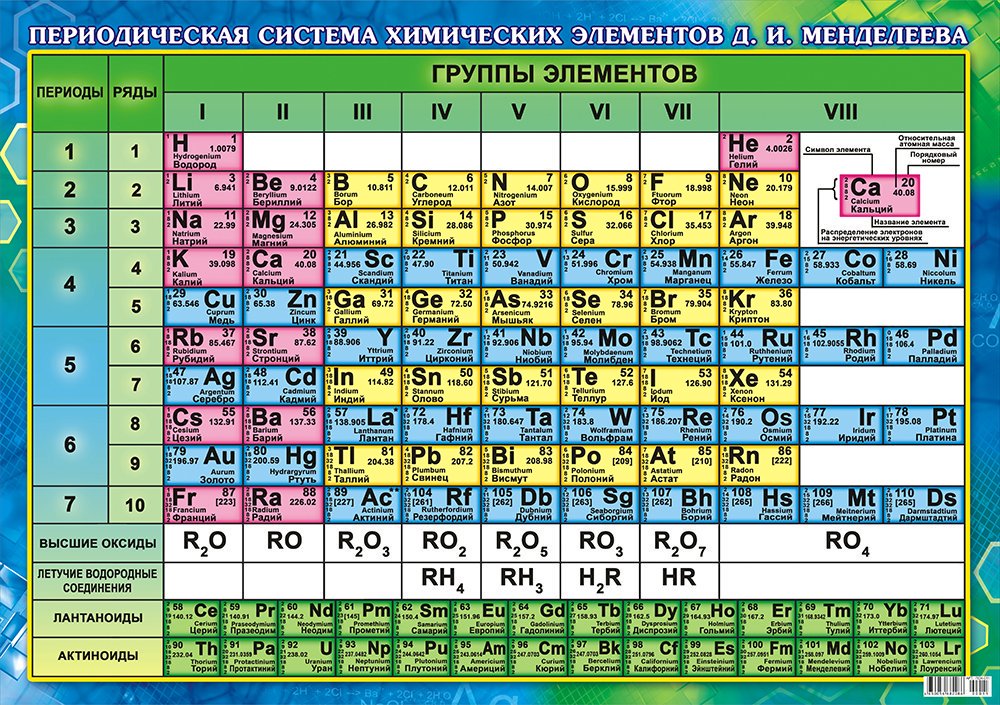
В соединениях лантан проявляет только одну степень окисления +3. Ионный радиус – самый большой из редкоземельных элементов R 9.0047 3+ и, как следствие, белый оксид La 2 O 3 является наиболее щелочным оксидом редкоземельных элементов.
| atomic number | 57 |
|---|---|
| atomic weight | 138.9055 |
| melting point | 918 °C (1,684 °F) |
| boiling point | 3,464 ° C (6 267 °F) |
| удельный вес | 6,146 (24 °C или 75 °F) |
| oxidation state | +3 |
| electron configuration | [Xe]5 d 1 6 s 2 |
Эта статья была недавно пересмотрена и обновлена Эриком Грегерсеном.
Лантан (La) – Химические свойства, Воздействие на окружающую среду
- Дом
- Периодическая таблица
- Элементы
- Лантан
|
Когда лантан попадает в окружающую среду, он связывается с карбонатами и фосфатами. |

 е. м. (г/моль)
е. м. (г/моль)
 моль -1
моль -1  4 x 10-34 моль5/л5 при 25°C и I = 0 моль/дм3, согласно Martell & Smith (1974).
4 x 10-34 моль5/л5 при 25°C и I = 0 моль/дм3, согласно Martell & Smith (1974).