Таблица Менделеева online – Li
Li
3
1
2
6.941±2
2s1
Литий
| Относительная электроотрицательность (по Полингу): | 0,97 |
| Температура плавления: | 180,54°C |
| Температура кипения: | 1342°C |
| Теплопроводность: | 71 |
| Плотность: | 0,53 г/см3 |
| Открыт: | Йоханн Арфведсон |
| Цвет в твёрдом состоянии: | Серебристо-белый |
| Тип: | Щелочной металл |
| Орбитали: | 1s22s1 |
| Электронная формула: |
Li – 1s2 2s1 Li – [He] 2s1 |
| Валентность: | +1 |
| Степени окисления: | 0, +I |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | 5,392 В 76,638 В 122,451 В |
Электропроводность в тв. 3/моль 3/моль |
|
| Атомный радиус: | 2,05 Å |
| Теплота распада: | 3 Кдж/моль |
| Теплота парообразования: | 145,92 Кдж/моль |
| Кристаллическая структура: | Объемоцентрированный куб. Высота, ширина, длина равны. Все углы прямые. По атому имеется в каждой вершине, а также атом в центре куба |
Реклама
Изотопы
| Символ нуклида | Z(p) | N(n) | Масса изотопа (а. е. м.) |
Период полураспада (T1/2) |
Моды распада | Спин и чётность ядра |
|---|---|---|---|---|---|---|
| Энергия возбуждения (кэВ) | ||||||
| 4Li | 3 | 1 | 4,02719(23) | 91(9)·10?24 с [6,03 МэВ] |
p | 2- |
| 5Li | 3 | 2 | 5,01254(5) | 370(30)·10?24 с [~1,5 МэВ] |
p | 3/2- |
| 6Li | 3 | 3 | 6,015122795(16) | стабилен | 1+ | |
| 7Li | 3 | 4 | 7,01600455(8) | стабилен | 3/2- | |
| 8Li | 5 | 8,02248736(10) | 840,3(9) мс | β– | 2+ | |
| 9Li | 3 | 6 | 9,0267895(21) | 178,3(4) мс | β–+n (50,8%), β– (49,2%) | 3/2- |
| 10Li | 3 | 7 | 10,035481(16) | 2,0(5)·10?21 с [1,2(3) МэВ] |
n | (1-,2-) |
| 10m1Li | 200(40) кэВ | 3,7(15)·10-21 с | 1+ | |||
| 10m2Li | 480(40) кэВ | 1,35(24)·10-21 с | 2+ | |||
| 11Li | 3 | 8 | 11,043798(21) | 8,75(14) мс | β–+n (84,9%), β– (8,07%), β–+2n (4,1%), β–+3n (1,9%), β–+деление (1,027%) | 3/2- |
| 12Li | 3 | 9 | 12,05378(107)# | <10 нс | n | |
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
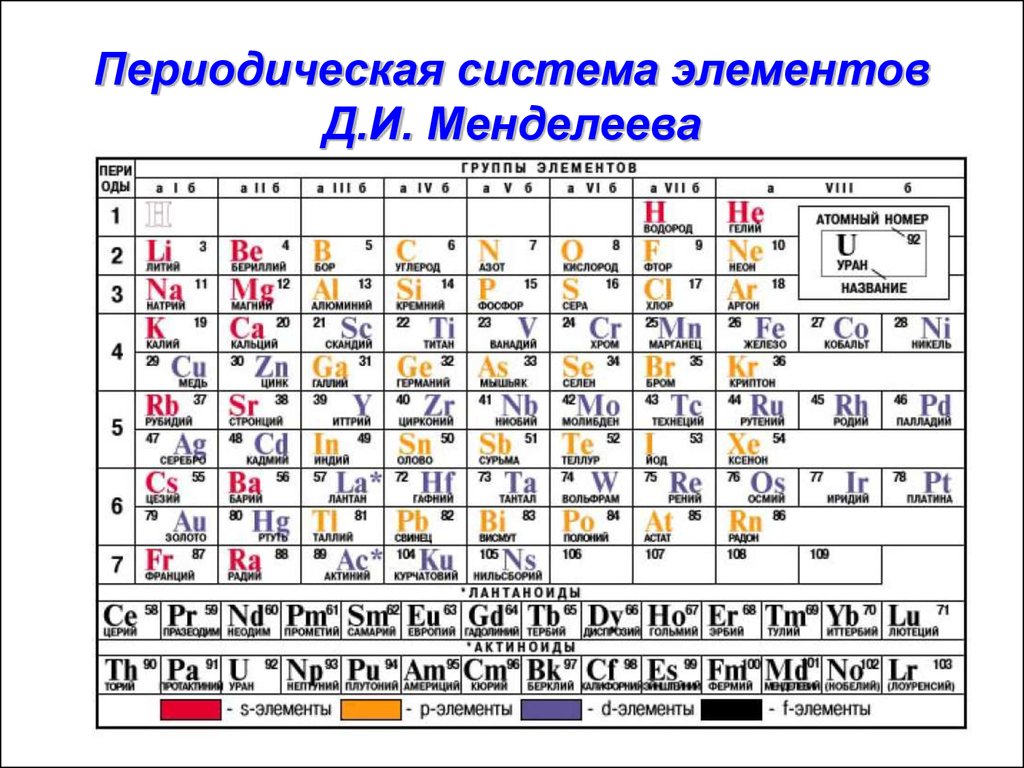 И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65. 38
38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195. 084
084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.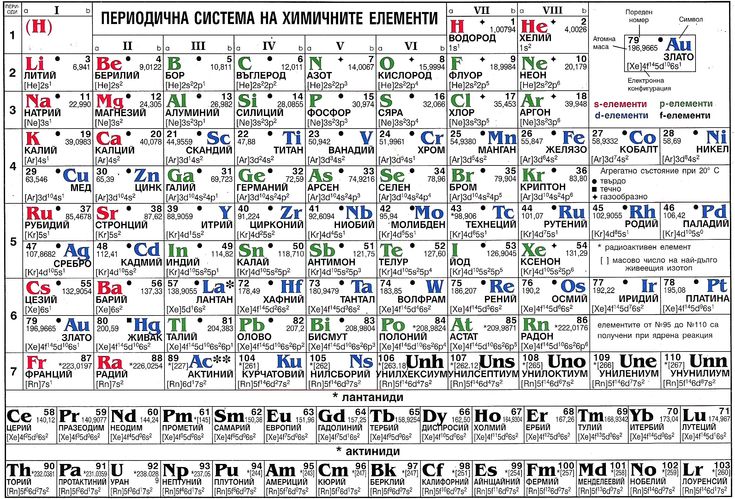 ru • Электронный учебник
ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Литий (Li) – Химические свойства, влияние на здоровье и окружающую среду
Литий является первой щелочью в периодической таблице. В природе встречается как смесь изотопов Li 6 и Li 7 . Это самый легкий твердый металл, он мягкий, серебристо-белый, с низкой температурой плавления и реактивный. Многие из его физических и химических свойств больше похожи на свойства щелочноземельных металлов, чем на свойства его собственной группы.
Среди наиболее значимых свойств лития мы находим его высокую удельную теплоемкость (теплотворность), огромный температурный интервал в жидком состоянии, высокую теплопроводность, низкую вязкость и очень низкую плотность. Металлический литий растворим в короткоцепочечных алифатических аминах, таких как этиламин. Не растворяется в углеводородах.
Металлический литий растворим в короткоцепочечных алифатических аминах, таких как этиламин. Не растворяется в углеводородах.
Литий принимает участие в огромном количестве реакций как с органическими, так и с неорганическими реагентами. Реагирует с кислородом с образованием монооксида и пероксида. Это единственный щелочной металл, который реагирует с азотом при температуре окружающей среды с образованием черной нитруры. Он легко реагирует с водородом почти при 500ºC (930ºF) с образованием гидрида лития. Реакция металлического лития с водой протекает чрезвычайно энергично. Литий вступает в реакцию непосредственно с углеродом, образуя карбюратор. Он легко связывается с галогенами и образует галогениды со световым излучением. Хотя он не реагирует с парафиновыми углеводородами, он экспериментирует с реакциями присоединения с алкенами, замещенными арильной и диеновой группами. Он также реагирует с ацетиленовыми соединениями, образуя ацетилуры лития, которые играют важную роль в синтезе витамина А.
Области применения
Основным соединением лития является гидроксид лития. Это белый порошок; изготовленный материал представляет собой моногидрат гидроксида лития. Карбонат можно использовать в гончарной промышленности и в медицине в качестве антидепрессанта. И бром, и хлорид лития образуют концентрированный рассол, обладающий свойством поглощать влагу в широком интервале температур; эти рассолы используются в производимых системах кондиционирования воздуха.
Литий в основном используется в промышленности в форме стеарата лития в качестве загустителя консистентной смазки. Другие важные применения соединений лития находятся в гончарном деле, особенно в глазури для фарфора; в качестве добавки для продления срока службы и производительности щелочных аккумуляторных батарей, а также при автогенной сварке и сварке латуни.
Сплавы металла с алюминием, кадмием, медью и марганцем используются для изготовления деталей самолетов с высокими эксплуатационными характеристиками.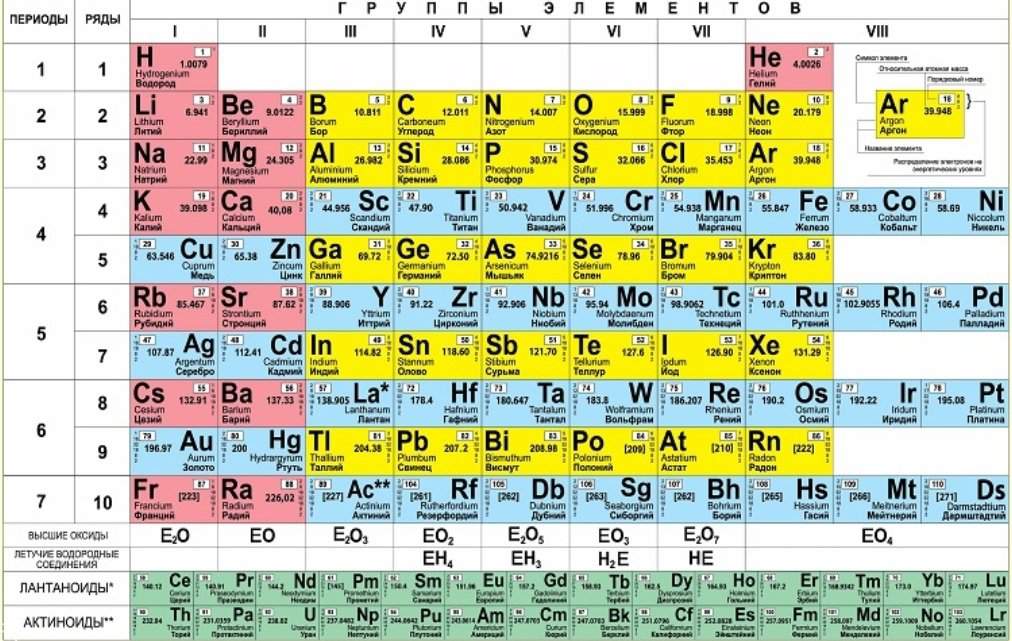
Литий в окружающей среде
Как и все щелочные металлы, литий легко вступает в реакцию в воде и не встречается свободно в природе из-за своей активности. за миллион). Это ставит литий ниже никеля, меди и вольфрама и выше церия и олова, что означает изобилие.
В Соединенных Штатах литий извлекают из бассейнов с соляным раствором в Неваде. Сегодня большая часть коммерческого лития извлекается из солевых источников в Чили. Мировое производство литиевых руд и солей бронзы составляет около 40 000 тонн в год, а запасы оцениваются примерно в 7 миллионов тонн.
Литий легко усваивается растениями. Количество лития в растениях колеблется в широких пределах, достигая в некоторых случаях 30 ppm.
Последствия воздействия лития: Огонь: легко воспламеняется. Многие реакции могут привести к возгоранию или взрыву. При пожаре выделяет раздражающие или токсичные пары (или газы). Взрыв: Опасность возгорания и взрыва при контакте с горючими веществами и водой. Вдыхание: Ощущение жжения. Кашель. Затрудненное дыхание. Сбивчивое дыхание. Больное горло. Симптомы могут проявиться позже. Кожа: покраснение. Кожа горит. Боль. волдыри. Глаза: покраснение. Боль. Тяжелые глубокие ожоги. Проглатывание: Спазмы в животе. Боль в животе. Обжигающее ощущение. Тошнота. Шок или коллапс. Рвота. Слабость.
Вдыхание: Ощущение жжения. Кашель. Затрудненное дыхание. Сбивчивое дыхание. Больное горло. Симптомы могут проявиться позже. Кожа: покраснение. Кожа горит. Боль. волдыри. Глаза: покраснение. Боль. Тяжелые глубокие ожоги. Проглатывание: Спазмы в животе. Боль в животе. Обжигающее ощущение. Тошнота. Шок или коллапс. Рвота. Слабость.
Последствия кратковременного воздействия : Вещество разъедает глаза, кожу и дыхательные пути. Разъедает при проглатывании. Вдыхание вещества может вызвать отек легких. Симптомы отека легких часто проявляются только через несколько часов и усиливаются при физической нагрузке. Поэтому необходимы покой и медицинское наблюдение. Следует рассмотреть вопрос о немедленном применении соответствующего спрея врачом или уполномоченным им лицом.
Пути воздействия : Вещество может проникать в организм при вдыхании аэрозоля и при приеме внутрь. Риск при вдыхании: Испарение при 20°C незначительно; однако опасная концентрация частиц в воздухе может быть быстро достигнута при распылении.
Химическая опасность: Нагревание может привести к сильному воспламенению или взрыву. Вещество может самовозгораться при контакте с воздухом в мелкодисперсном состоянии. При нагревании образуются ядовитые пары. Реагирует бурно с сильными окислителями, кислотами и многими соединениями (углеводороды, галогены, галоны, бетон, песок и асбест) с опасностью пожара и взрыва. Реагирует бурно с водой с образованием легковоспламеняющегося газообразного водорода и едких паров гидроксида лития.
Металлический литий вступает в реакцию с азотом, кислородом и парами воды в воздухе. Следовательно, поверхность лития покрывается смесью гидроксида лития (LiOH), карбоната лития (Li 2 CO3) и нитрида лития (Li 3 N). Гидроксид лития представляет собой потенциально значительную опасность, поскольку он чрезвычайно коррозионно-активен. Особое внимание следует уделить водным организмам.
Подробнее о литии в воде
Вернуться к периодической таблице элементов .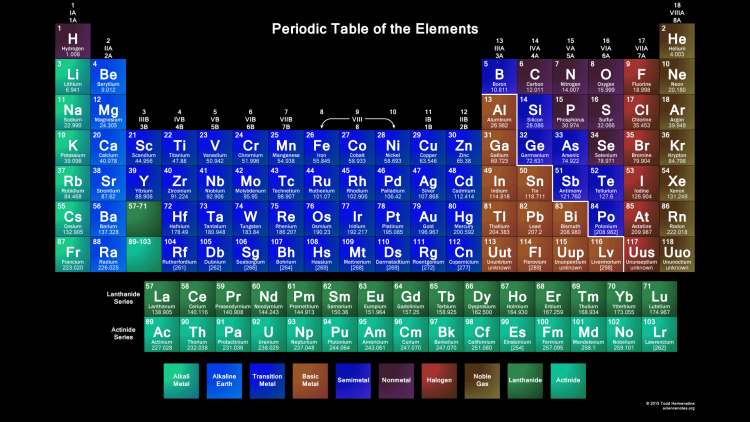
Элемент Литий — Атом лития
Литий является химическим элементом в периодической таблице, который имеет символ Li и атомный номер 3. В периодической таблице он находится в группе 1, среди щелочные металлы. Литий в чистом виде представляет собой мягкий серебристый белый металл, который очень быстро тускнеет и окисляется в воздух и вода. Это самый легкий твердый элемент и в первую очередь используется в теплообменных сплавах, в батареях и служит компонент некоторых препаратов, известных как стабилизаторы настроения.
| ||||||||||||||||||||||||||||
| Общий | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Имя, символ, номер | Литий, Li, 3 | |||||||||||||||||||||||||||
| Серия | Щелочной металл | |||||||||||||||||||||||||||
| Группа, период, блок | 1(ИА), 2 , с | |||||||||||||||||||||||||||
| Плотность, твердость | 535 кг/м 3 , 0,6 | |||||||||||||||||||||||||||
| Внешний вид | серебристо-белый/серый | |||||||||||||||||||||||||||
| Атомный свойства | ||||||||||||||||||||||||||||
| Атомный вес | 6,941 а. е.м. е.м. | |||||||||||||||||||||||||||
| Атомный радиус (расч.) | 145 (167) тел. | |||||||||||||||||||||||||||
| Ковалентный радиус | 134 вечера | |||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 182 вечера | |||||||||||||||||||||||||||
| Электронная конфигурация | [He]2s 1 | |||||||||||||||||||||||||||
| e – на уровень энергии | 2, 1 | |||||||||||||||||||||||||||
| Степени окисления (оксид) | 1 (сильное основание) | |||||||||||||||||||||||||||
| Кристаллическая структура | Кубическое тело центрировано | |||||||||||||||||||||||||||
| Физический свойства | ||||||||||||||||||||||||||||
| Состояние вещества | твердый (немагнитный) | |||||||||||||||||||||||||||
| Температура плавления | 453,69 К (356,97 F) | |||||||||||||||||||||||||||
| Точка кипения | 1615 К (2448 Ж) | |||||||||||||||||||||||||||
| Молярный объем | 13,02 10 -6 м 3 /моль | |||||||||||||||||||||||||||
| Теплота парообразования | 145,92 кДж/моль | |||||||||||||||||||||||||||
| Теплота плавления | 3 кДж/моль | |||||||||||||||||||||||||||
| Давление пара | 1,63 Е-8 Па (453,7 К) | |||||||||||||||||||||||||||
| Скорость звука | 6000 м/с (293,15K) | |||||||||||||||||||||||||||
| Разное | ||||||||||||||||||||||||||||
| Электроотрицательность | 0,98 (шкала Полинга) | |||||||||||||||||||||||||||
| Удельная теплоемкость | 3582 Дж/(кг*К) | |||||||||||||||||||||||||||
| Электропроводность | 10,8 10 6 /м Ом | |||||||||||||||||||||||||||
| Теплопроводность | 84,7 Вт/(м*К) | |||||||||||||||||||||||||||
| 1 st потенциал ионизации | 520,2 кДж/моль | |||||||||||||||||||||||||||
| 2 nd потенциал ионизации | 7298,1 кДж/моль | |||||||||||||||||||||||||||
| 3 rd потенциал ионизации | 11815,0 кДж/моль | |||||||||||||||||||||||||||
| Большинство стабильные изотопы | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Единицы СИ и СТП используются, если не указано иное. | ||||||||||||||||||||||||||||
Примечательные характеристики
Литий — самый легкий металл, плотность которого
только вдвое меньше воды. Как и все щелочные металлы, литий
легко реагирует в воде и не встречается в свободном виде в природе
благодаря своей активности, тем не менее, он еще менее реактивен
чем химически аналогичный натрий. Помещенный над пламенем, этот металл испускает поразительный
малинового цвета, но при сильном горении пламя становится
блестящий белый. Это тоже одновалентный элемент.
Помещенный над пламенем, этот металл испускает поразительный
малинового цвета, но при сильном горении пламя становится
блестящий белый. Это тоже одновалентный элемент.
Применение
Из-за большой удельной теплоемкости (самая большая из всех твердый), литий используется в приложениях теплопередачи. Это также является важным материалом анода батареи из-за его высокой электрохимический потенциал. Другое применение:
- Соли лития, такие как карбонат лития (Li 2 CO 3 ), литий цитрат и оротат лития используются в качестве стабилизаторов настроения. при лечении биполярного расстройства. Литий также может обладают антидепрессивным действием.
- Хлорид лития и бромид лития чрезвычайно гигроскопичны.
и часто используются в качестве осушителей.

- Стеарат лития является распространенным универсальным высокотемпературным смазка.
- Литий — легирующий агент, используемый для синтеза органических соединений, а также имеет ядерное применение.
- Литий иногда используется в очках и керамике, включая стекло для 200-дюймового телескопа на горе Паломар.
- Гидроксид лития используется для извлечения диоксида углерода с воздуха на космических кораблях и подводных лодках.
- Сплавы металлов с алюминием, кадмием, медью, и марганец используются для изготовления самолетов с высокими характеристиками. части.
История
Литий (греч. lithos , что означает «камень») был
обнаружен Иоганном Арфведсоном в 1817 году. Арфведсон нашел
новый элемент в минералах сподумен и лепидолит
в петалитовой руде LiAl(Si 2 О 5 ) 2 ,
он анализировал с острова Ут в Швеции. В 1818 г.
Кристиан Гмелин был первым, кто заметил, что литий
соли дают ярко-красную окраску пламени. Оба мужчины пытались
однако не удалось выделить элемент из его солей.
Арфведсон нашел
новый элемент в минералах сподумен и лепидолит
в петалитовой руде LiAl(Si 2 О 5 ) 2 ,
он анализировал с острова Ут в Швеции. В 1818 г.
Кристиан Гмелин был первым, кто заметил, что литий
соли дают ярко-красную окраску пламени. Оба мужчины пытались
однако не удалось выделить элемент из его солей.
Элемент не был выделен до тех пор, пока У. Т. Бранде и сэр Позже Хамфри Дэви использовал электролиз оксида лития. Промышленное производство металлического лития было достигнуто в 1923 немецкой компанией Metallgesellschaft AG с использованием электролиз расплавленных хлоридов лития и хлорида калия.
Название «литий», по-видимому, было дано потому, что
обнаружен из минерала, в то время как другие распространенные щелочные металлы
впервые были обнаружены в растительных тканях.
Возникновение
Литиевые гранулы
Литий широко распространен, но не встречается в природе в свободной форме. Из-за своей реактивности он всегда найдены связанными с одним или несколькими другими элементами или соединениями. Он составляет незначительную часть почти всех магматических пород и также встречается во многих природных рассолах.
После окончания Второй мировой войны производство лития значительно увеличилось. вырос. Металл отделен от других элементов в магматических пород, а также добывают из воды минеральные пружины. Лепидолит, сподумен, петалит и амблигонит являются более важными минералами, содержащими его.
В США литий извлекается из бассейнов с соляным раствором
в высохшем озере Сирлс, в Калифорнии, и из мест
в Неваде и других местах. Металл, серебристый в
внешний вид, как натрий, калий и другие члены
ряд щелочных металлов, получают электролитическим путем из
смесь расплавленного лития и хлорида калия. Этот металл
стоит около 300 долларов США за фунт в 1997.
Металл, серебристый в
внешний вид, как натрий, калий и другие члены
ряд щелочных металлов, получают электролитическим путем из
смесь расплавленного лития и хлорида калия. Этот металл
стоит около 300 долларов США за фунт в 1997.
Изотопы
Встречающийся в природе литий состоит из 2 стабильных изотопов Li-6 и Li-7, причем Li-7 является наиболее распространенным (92,5% природного избыток). Шесть радиоизотопов были охарактеризованы с наиболее стабильным является Li-8 с периодом полураспада 838 мс и Li-9 с периодом полураспада 178,3 мс. Все остальные Период полураспада радиоактивных изотопов меньше 8,5 мс или неизвестно.
Изотопы лития с атомным весом от 4,027
а.е.м. (Li-4) до 11,0438 а.е.м. (Li-11). Первичный режим распада
до того, как самый распространенный стабильный изотоп, Li-7, станет протоном
излучение (с одним случаем альфа-распада) и первичный
режим после – бета-излучение (с некоторым излучением нейтронов). Первичными продуктами распада до Li-7 является элемент 2 (гелий).
изотопы и первичные продукты после них – элемент 4 (бериллий)
изотопы.
Первичными продуктами распада до Li-7 является элемент 2 (гелий).
изотопы и первичные продукты после них – элемент 4 (бериллий)
изотопы.
Литий-7 — один из первичных элементов (производится в нуклеосинтез большого взрыва). Изотопы лития фракционированные в значительной степени во время самых разнообразных природных процессов, включая минералообразование (химическое осаждение), обмен веществ, ионный обмен (Li заменяет магний и железо в октаэдрических участки в глинистых минералах, где Li-6 предпочтительнее, чем Li-7), гиперфильтрация и изменение породы.
Меры предосторожности
Как и другие щелочные металлы, литий в чистом виде
является легковоспламеняющимся и слегка взрывоопасным при
подвергается воздействию воздуха и особенно воды. Этот металл также
вызывает коррозию и требует особого обращения во избежание контакта с кожей.
При хранении его следует поместить в нереакционноспособную жидкость.
углеводород, такой как нафта. Литий
не играет естественной биологической роли и считается
слегка токсичен. Это означает, что когда это
используется в качестве лекарственного средства, концентрации в крови должны быть тщательно
контролируется.
Этот металл также
вызывает коррозию и требует особого обращения во избежание контакта с кожей.
При хранении его следует поместить в нереакционноспособную жидкость.
углеводород, такой как нафта. Литий
не играет естественной биологической роли и считается
слегка токсичен. Это означает, что когда это
используется в качестве лекарственного средства, концентрации в крови должны быть тщательно
контролируется.
Ссылки
- Лос-Аламосская национальная лаборатория Литий ( http://periodic.lanl.gov/elements/.html )
Внешние ссылки
- USGS: литий Статистика и информация ( http://minerals.usgs.gov/minerals/pubs/commodity/lithium/)
- EnvironmentalChemistry.com
Литий ( http://environmentalchemistry.


 }
}
