Таблица менделеева – Электронный учебник K-tree
Электронный учебник
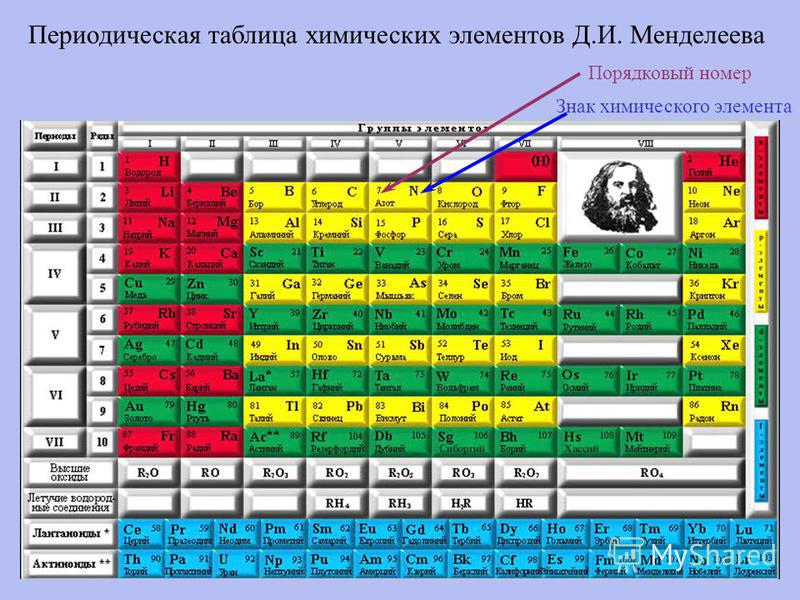
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Магний Mg в Таблице Менделеева, его важность для здоровья
До сегодняшнего дня магнию по сравнению с другими металлами столько внимания, как сейчас, никогда не уделялось. Это связано со сложностью установления его концентрации в плазме крови. Магний достаточно сложно распределяется в организме, он находится и в органах, и в тканях, вне клеток и внутри них.
Магний (Mg в Таблице Менделеева) является четвертым по счету из важнейших химических элементов. Всего их 12. Первые места занимают калий, кальций и натрий.
Всего их 12. Первые места занимают калий, кальций и натрий.
Магний и его функции
Магний участвует в процессе усвоения витаминов группы B, C 4,5; участвует в фосфорном и углеводном обмене, а также в передаче нервно-мышечного импульса. Он оказывает влияние на количество кальция в крови.
Препараты магния действуют на снижение повышенного давления, рост и укрепление костей, используется при стрессах и мигренях. Действие препаратов магния достаточно разнообразно.
Роль магния в системе органов кровообращения
Магний влияет на пласт клеток, называемых эндотелием – они покрывают внутреннюю поверхность сердечных полостей кровеносных и лимфатических сосудов. Было проведено исследование, в котором участвовали две группы людей, в одной из них проводилось использование препарата магния, а в другой – плацебо. В ходе этого исследования выяснено, что через полгода приема препарата магния результаты анализов у пациентов улучшились. Можно сделать вывод, что пренебрегать этими препаратами не следует.
В связи с исследованиями, которые проводились на протяжении нескольких лет, были сделаны выводы о развитии ишемической болезни сердца вследствие недостаточного содержания в организме магния. Гипомагниемия наблюдается у пациентов с высоким давлением, с сахарным диабетом второго типа, его недостаток может сказываться на прогрессировании атеросклероза, появляются пролапс митрального клапана, аритмия и тахикардия. Показатель магния в крови может говорить о тяжести заболевания, о его прогрессировании.
Как проявляется недостаток магния в организме
Недостаточное содержание магния проявляется как в проблемах опорно-двигательной системы, сердечно-сосудистой и в проблемах различных органов. Пациенты жалуются: на судороги, нервозность, утомляемость, кошмары, бессонницу, головокружения, снижение внимания, выпадение волос, диарею, запоры, тошноту, повышение давления. Во время тщательного обследования могут выявиться такие заболевания, как иммунодефицитные состояния, сахарный диабет, мочекаменная и желчекаменная болезни.
Назначение препаратов магния
Препараты магния назначаются в качестве восстановления процессов, в которых принимает непосредственное участие сам магний. Препараты назначаются как внутривенно, так и перорально при сердечных патологиях.
«Магнерот» назначается в кардиологической практике, состоит он из оротовой кислоты и соли магния. Синтезируется кислота в печени человека, свойства ее были открыты в 60-х годах. Назначение магния в те годы снизило летальность от инфаркта миокарда, далее его применение расширилось и стало незаменимым в кардиологической практике. Также оротовая кислота активно используется спортсменами, так как повышает выносливость.
«Магнерот» применяется при ИБС, вследствие чего сокращается прием нитроглицерина, он также достаточно благоприятно влияет на количество сахара в крови. Препараты магния на самом деле очень эффективны и отлично переносятся пациентами.
В чем причина недостаточного содержания магния?
В организме человека находится 24 г магния, из которых 60% входит в состав костей, 20% – в состав мышечной ткани, 0. 8% – в эритроциты и плазму крови, 39% находится внутри клеток. Суточная доза составляет: для мужчин – 350 мг, для женщин – 300 мг.
8% – в эритроциты и плазму крови, 39% находится внутри клеток. Суточная доза составляет: для мужчин – 350 мг, для женщин – 300 мг.
Дефицит магния может быть связан с жизненными условиями. Организм исчерпывает свои ресурсы при алкоголизме, неправильном питании, беременности, потливости, гормональной контрацепции, физических нагрузках.
Усвояемость магния из продуктов питания составляет 30-35%, уменьшению его всасывания могут способствовать заболевания органов пищеварения. Продукты, богатые магнием, которые необходимо по возможности употреблять каждому, это: шоколад, орехи, зелень, бобовые, каши.
Также дефицит магния может развиваться при определенных заболеваниях. Это инфаркт миокарда, нефротический синдром, ожирение, гипертиреоз, артериальная гипертензия, длительный прием антибиотиков.
Как выяснилось, магний– это непросто химическое соединение, а очень важный элемент, который играет одну из главных ролей в состоянии здоровья человека. От магния зависит количество кальция, он также участвует в синтезе белка, и еще в более 300-х процессах в организме человека.
Магний | Описание, свойства и соединения
магний
Посмотреть все СМИ
- Ключевые люди:
- сэр Хамфри Дэви Иоганн Вольфганг Доберейнер
- Похожие темы:
- химический элемент щелочноземельный металл переработка магния дефицит магния магнезит
Просмотреть весь связанный контент →
Сводка
Прочтите краткий обзор этой темы
магний (Mg) , химический элемент, один из щелочноземельных металлов группы 2 (IIa) периодической таблицы и самый легкий структурный металл. Его соединения широко используются в строительстве и медицине, а магний является одним из элементов, необходимых для всей клеточной жизни.
| атомный номер | 12 |
|---|---|
| atomic weight | 24.305 |
| melting point | 650 °C (1,202 °F) |
| boiling point | 1,090 °C (1,994 °F) |
| specific gravity | 1. |
| oxidation state | +2 |
| electron configuration | 1 s 2 2 s 2 2 p 6 3 s 2 |
Возникновение, свойства и использование
Известный первоначально в виде соединений, таких как соли Эпсома (сульфат), магнезия или белая магнезия (оксид) и магнезит (карбонат), серебристо-белый элемент сам по себе не встречается в природе в свободном виде. Впервые он был выделен в 1808 году сэром Хамфри Дэви, который испарил ртуть из амальгамы магния, полученной путем электролиза смеси влажной магнезии и оксида ртути. Название
Магний является восьмым по распространенности элементом в земной коре (около 2,5 процента) и третьим по распространенности конструкционным металлом после алюминия и железа. Его космическое содержание оценивается как 9,1 × 10 5 атомов (по шкале, где содержание кремния = 10 6 атомов). Встречается в виде карбонатов — магнезита MgCO 3 и доломита CaMg(CO 3 ) 2 — и во многих обычных силикатах, включая тальк, оливин и большинство видов асбеста. Он также встречается в виде гидроксида (бруцит), хлорида (карналлит, KMgCl
Его космическое содержание оценивается как 9,1 × 10 5 атомов (по шкале, где содержание кремния = 10 6 атомов). Встречается в виде карбонатов — магнезита MgCO 3 и доломита CaMg(CO 3 ) 2 — и во многих обычных силикатах, включая тальк, оливин и большинство видов асбеста. Он также встречается в виде гидроксида (бруцит), хлорида (карналлит, KMgCl
Магний в промышленных масштабах производится электролизом расплавленного хлорида магния (MgCl 2 ), перерабатываемый в основном из морской воды и путем прямого восстановления ее соединений подходящими восстановителями, например, в результате реакции оксида магния или прокаленного доломита с ферросилицием (процесс Пиджена).
Когда-то магний использовался для фотовспышек и порошка, потому что в мелкоизмельченном виде он горит на воздухе интенсивным белым светом; он до сих пор находит применение во взрывных и пиротехнических устройствах. Из-за своей низкой плотности (всего две трети плотности алюминия) он нашел широкое применение в аэрокосмической промышленности. Однако, поскольку чистый металл имеет низкую структурную прочность, магний в основном используется в виде сплавов — в основном с 10 или менее процентами алюминия, цинка и марганца — для улучшения его твердости, прочности на растяжение и способности к литью, сварке. , и обработаны. Со сплавами применяются методы литья, прокатки, экструзии и ковки, а дальнейшее изготовление полученных листов, пластин или экструзии осуществляется путем обычных операций формования, соединения и механической обработки. Магний является самым легким конструкционным металлом для обработки и часто используется, когда требуется большое количество операций механической обработки.
Тепло- и электропроводность магния и его температура плавления очень схожи с алюминием. В то время как алюминий подвергается воздействию щелочей, но устойчив к большинству кислот, магний устойчив к большинству щелочей, но легко подвергается воздействию большинства кислот с выделением водорода (хромовая и плавиковая кислоты являются важными исключениями). При нормальных температурах он стабилен на воздухе и в воде из-за образования тонкой защитной пленки из оксида, но подвергается воздействию пара. Магний является сильным восстановителем и используется для получения других металлов из их соединений (например, титана, циркония и гафния). Он непосредственно реагирует со многими элементами.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Магний встречается в природе в виде смеси трех изотопов: магния-24 (79,0%), магния-26 (11,0%) и магния-25 (10,0%). Было приготовлено 19 радиоактивных изотопов; магний-28 имеет самый длинный период полураспада, 20,9 часов, и является бета-излучателем. Хотя магний-26 не радиоактивен, это дочерний нуклид алюминия-26 с периодом полураспада 7,2×10 5 лет. В некоторых метеоритах были обнаружены повышенные уровни магния-26, и для определения их возраста использовалось отношение магния-26 к магнию-24.
Было приготовлено 19 радиоактивных изотопов; магний-28 имеет самый длинный период полураспада, 20,9 часов, и является бета-излучателем. Хотя магний-26 не радиоактивен, это дочерний нуклид алюминия-26 с периодом полураспада 7,2×10 5 лет. В некоторых метеоритах были обнаружены повышенные уровни магния-26, и для определения их возраста использовалось отношение магния-26 к магнию-24.
В число крупнейших производителей магния ко второму десятилетию 21 века вошли Китай, Россия, Турция и Австрия.
Основные соединения
В соединениях магний практически всегда проявляет степень окисления +2 из-за потери или совместного использования двух своих 3 s электронов. Однако известно небольшое количество координационных соединений со связью магний-магний, LMg-MgL, в которых центры магния имеют формальную степень окисления +1. Карбонат магния, MgCO 3 , встречается в природе в виде минерального магнезита и является важным источником элементарного магния. Его можно получить искусственно, воздействуя углекислым газом на различные соединения магния. Белый порошок без запаха имеет множество промышленных применений, например, в качестве теплоизолятора для котлов и труб, а также в качестве добавки к продуктам питания, фармацевтическим препаратам, косметике, каучукам, чернилам и стеклу. Поскольку карбонат магния гигроскопичен и нерастворим в воде, он был оригинальной добавкой, используемой для придания поваренной соли сыпучести даже в условиях высокой влажности.
Его можно получить искусственно, воздействуя углекислым газом на различные соединения магния. Белый порошок без запаха имеет множество промышленных применений, например, в качестве теплоизолятора для котлов и труб, а также в качестве добавки к продуктам питания, фармацевтическим препаратам, косметике, каучукам, чернилам и стеклу. Поскольку карбонат магния гигроскопичен и нерастворим в воде, он был оригинальной добавкой, используемой для придания поваренной соли сыпучести даже в условиях высокой влажности.
Гидроксид магния, Mg(OH) 2 , представляет собой белый порошок, получаемый в больших количествах из морской воды путем добавления известкового молока (гидроксида кальция). Это основное сырье для производства металлического магния, которое используется в качестве огнезащитной добавки. В воде он образует суспензию, известную как магнезиальное молоко, которое издавна используется как антацид и слабительное.
Действие соляной кислоты на гидроксид магния дает хлорид магния, MgCl 2 , бесцветное расплывающееся (водопоглощающее) вещество, используемое в производстве металлического магния, в производстве цемента для тяжелых полов и в качестве добавки в текстильном производстве. Он также используется для коагуляции соевого молока при производстве тофу.
Он также используется для коагуляции соевого молока при производстве тофу.
При обжиге карбоната магния или гидроксида магния образуется кислородное соединение оксида магния, обычно называемое магнезией, MgO. Это белое твердое вещество, используемое в производстве жаропрочных огнеупорных кирпичей, электрических и теплоизоляционных материалов, цементов, удобрений, резины и пластмасс. Он также используется в медицине как слабительное и антацид.
Сульфат магния, MgSO 4 , представляет собой бесцветное кристаллическое вещество, образованное реакцией гидроксида магния с диоксидом серы и воздухом. Гидратная форма сульфата магния, называемая кизеритом, MgSO 4 ∙H 2 O, встречается в виде месторождения полезных ископаемых. Синтетически полученный сульфат магния продается в виде английской соли MgSO 4 ∙7H 2 O. В промышленности сульфат магния используется при производстве цемента и удобрений, при дублении и окрашивании; в медицине он служит слабительным. Из-за способности легко поглощать воду безводная форма используется в качестве осушителя (осушителя).
Из-за способности легко поглощать воду безводная форма используется в качестве осушителя (осушителя).
Среди металлоорганических соединений магния важные реагенты Гриньяра, состоящие из органической группы (например, алкилов и арилов), атома галогена, отличного от фтора, и магния. Они используются в производстве многих других видов органических и металлоорганических соединений.
Магний необходим для всех живых клеток, поскольку ион Mg 2+ связан с критически важными биологическими полифосфатными соединениями ДНК, РНК и аденозинтрифосфатом (АТФ). Функционирование многих ферментов зависит от магния. Содержащийся примерно в шесть раз меньше, чем калий в клетках человеческого тела, магний необходим в качестве катализатора ферментативных реакций в углеводном обмене. Магний также является важным компонентом зеленого пигмента хлорофилла, присутствующего практически во всех растениях, водорослях и цианобактериях. Фотосинтетическая функция растений зависит от действия пигментов хлорофилла, которые содержат магний в центре сложной азотсодержащей системы колец (порфирин). Эти соединения магния позволяют энергии света управлять преобразованием углекислого газа и воды в углеводы и кислород и, таким образом, прямо или косвенно обеспечивают ключ почти ко всем жизненным процессам.
Эти соединения магния позволяют энергии света управлять преобразованием углекислого газа и воды в углеводы и кислород и, таким образом, прямо или косвенно обеспечивают ключ почти ко всем жизненным процессам.
Магний (Mg) – Химические свойства, влияние на здоровье и окружающую среду
Химический элемент, металл, обозначение Mg, расположенный в группе IIa периодической таблицы, атомный номер: 12, атомный вес: 24,312. Магний серебристо-белый и очень легкий. Его относительная плотность составляет 1,74, а плотность 1740 кг/м 3 (0,063 фунта/дюйм 3 или 108,6 фунта/фут 3 ). Магний давно известен как самый легкий конструкционный металл в промышленности из-за его малого веса и способности образовывать механически стойкие сплавы.
Магний очень химически активен, он заменяет водород в кипящей воде, и большое количество металлов может быть получено термическим восстановлением его солей и окисленных форм с магнием. Он соединяется с большинством неметаллов и почти со всеми кислотами. Магний слабо реагирует или совсем не реагирует с большинством щелочей и многими органическими веществами, такими как углеводороды, альдегиды, спирты, фенолы, амины, сложные эфиры и большинство масел. Используемый в качестве катализатора, магний способствует органическим реакциям конденсации, восстановления, присоединения и дегалогенизации. Его долгое время использовали для синтеза специальных и сложных органических компонентов по известной реакции Гриньяра. Основными компонентами сплавов являются: алюминий, марганец, циркон, цинк, редкоземельные металлы и торий.
Магний слабо реагирует или совсем не реагирует с большинством щелочей и многими органическими веществами, такими как углеводороды, альдегиды, спирты, фенолы, амины, сложные эфиры и большинство масел. Используемый в качестве катализатора, магний способствует органическим реакциям конденсации, восстановления, присоединения и дегалогенизации. Его долгое время использовали для синтеза специальных и сложных органических компонентов по известной реакции Гриньяра. Основными компонентами сплавов являются: алюминий, марганец, циркон, цинк, редкоземельные металлы и торий.
Применение
Соединения магния используются в качестве огнеупорного материала в футеровке печей для производства металлов (чугун и сталь, цветные металлы), стекла и цемента.
Обладая плотностью всего в две трети плотности алюминия, он имеет бесчисленное множество применений в тех случаях, когда важно снижение веса, например, в конструкции самолетов и ракет. Он также обладает многими полезными химическими и металлургическими свойствами, что делает его подходящим для многих других неструктурных применений.
Компоненты магния широко используются в промышленности и сельском хозяйстве.
Другие области применения включают: удаление серы из железа и стали, фотогравированные пластины в полиграфической промышленности; восстановитель для получения чистого урана и других металлов из их солей; фотовспышка, сигнальные ракеты и пиротехника.
Магний в окружающей среде
Магний является восьмым по распространенности элементом, составляющим около 2% массы земной коры, и третьим по распространенности элементом, растворенным в морской воде.
Его очень много в природе, и он содержится в значительных количествах во многих горных породах, таких как доломит, магнетит, оливин и серпентин. Он также содержится в морской воде, подземных рассолах и соленых слоях. Это третий по распространенности конструкционный металл в земной коре, уступающий только алюминию и железу.
Соединенные Штаты традиционно были основным мировым поставщиком этого металла, обеспечивая 45% мирового производства еще в 1995 году. Доломит и магнезит добываются в объеме 10 миллионов тонн в год в таких странах, как Китай, Турция, Северная Корея, Словакия, Австрия, Россия и Греция.
Доломит и магнезит добываются в объеме 10 миллионов тонн в год в таких странах, как Китай, Турция, Северная Корея, Словакия, Австрия, Россия и Греция.
Люди потребляют от 250 до 350 мг магния в день и нуждаются как минимум в 200 мг, но организм очень эффективно справляется с этим элементом, принимая его из пищи, когда это возможно, и перерабатывая то, что у нас уже есть, когда это необходимо. не могу.
Нет никаких доказательств того, что магний вызывает системное отравление, хотя постоянное злоупотребление магниевыми добавками и лекарствами может привести к мышечной слабости, вялости и спутанности сознания.
Последствия воздействия порошка магния: малотоксичен и не считается опасным для здоровья. Вдыхание: пыль может раздражать слизистые оболочки или верхние дыхательные пути. Глаза: механическое повреждение или частицы могут попасть в глаза. Наблюдение за горящим порошком магния без противопожарных очков может привести к «сварочной вспышке» из-за интенсивного белого пламени.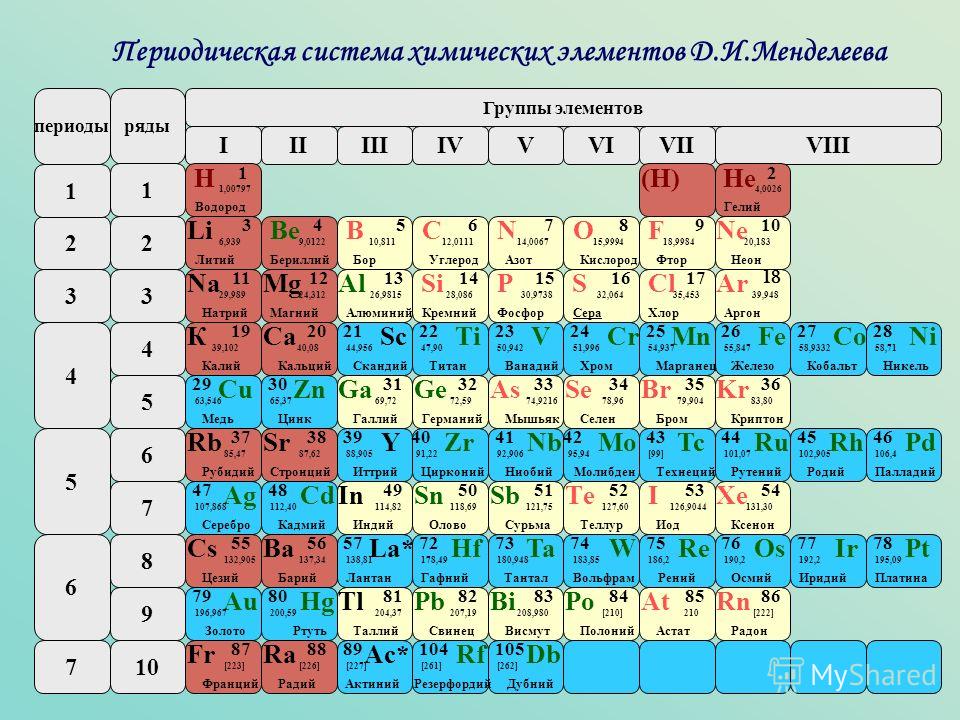 Кожа: внедрение частицы в кожу. Проглатывание: маловероятно; однако проглатывание большого количества порошка магния может привести к травме.
Кожа: внедрение частицы в кожу. Проглатывание: маловероятно; однако проглатывание большого количества порошка магния может привести к травме.
Магний не тестировался, но не подозревается, что он является канцерогенным, мутагенным или тератогенным. Воздействие паров оксида магния после горения, сварки или работы с расплавленным металлом может привести к лихорадке металлических паров со следующими временными симптомами: лихорадка, озноб, тошнота, рвота и мышечная боль. Обычно они возникают через 4-12 часов после воздействия и длятся до 48 часов. Дым оксида магния является побочным продуктом сжигания магния.
Физическая опасность: Возможен взрыв пыли, если порошок или гранулы смешаны с воздухом. В сухом состоянии может быть заряжен электростатически при вращении, пневматической транспортировке, выливании и т. д.
C Химическая опасность: Вещество может самовозгораться при контакте с воздухом или влагой с образованием раздражающих или токсичных паров.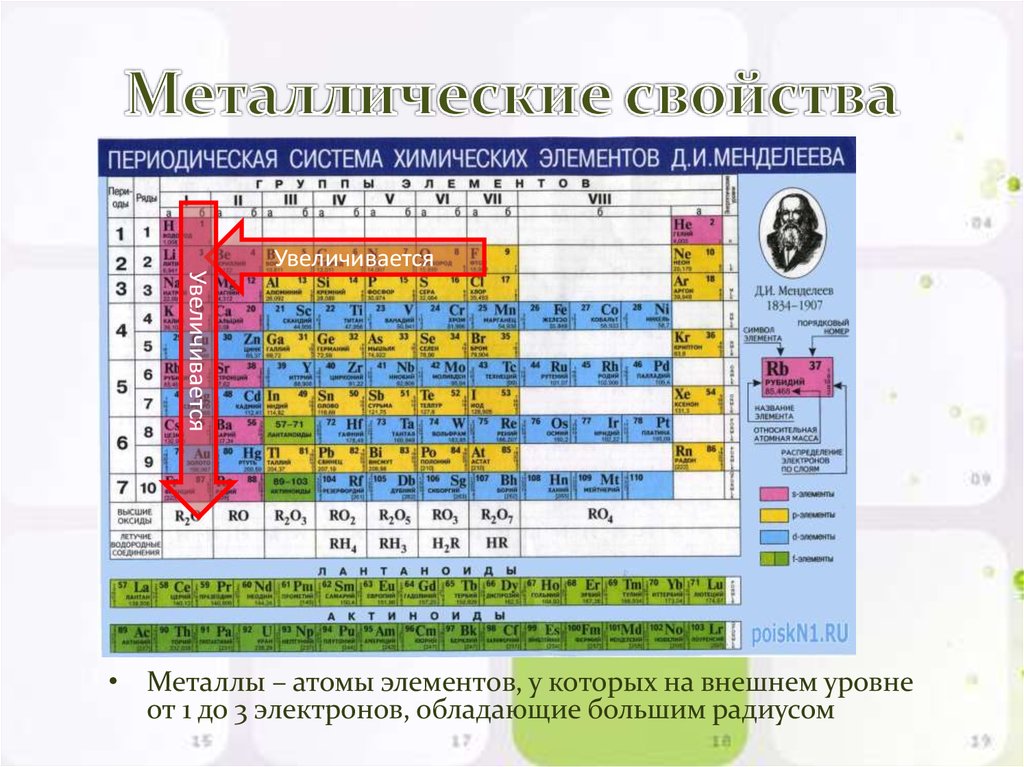 Интенсивно Реагирует с сильными окислителями. Реагирует бурно со многими веществами с опасностью пожара и взрыва. Реагирует с кислотами и водой с образованием легковоспламеняющегося газообразного водорода (см. ICSC0001), что может привести к пожару и взрыву.
Интенсивно Реагирует с сильными окислителями. Реагирует бурно со многими веществами с опасностью пожара и взрыва. Реагирует с кислотами и водой с образованием легковоспламеняющегося газообразного водорода (см. ICSC0001), что может привести к пожару и взрыву.
Первая помощь: При вдыхании: вывести на свежий воздух. Глаза: тщательно промыть глаза водой. Проконсультируйтесь с врачом. Кожа: тщательно промойте водой с мылом, чтобы удалить частицы. Проглатывание: при проглатывании большого количества порошка магния вызвать рвоту и обратиться к врачу.
Примечание для врача: нет специфического лечения или антидота. Рекомендуется поддерживающая терапия. Лечение должно основываться на реакции больного.
Имеется очень мало информации о воздействии паров оксида магния на окружающую среду. Если другие млекопитающие вдыхают пары оксида магния, они могут испытывать такие же последствия, как и люди.
В спектре окружающей среды 0–3 Регистры паров оксида магния 0,8.
