Молярная масса вещества – формула, как найти (8 класс, химия)
4.2
Средняя оценка: 4.2
Всего получено оценок: 834.
4.2
Средняя оценка: 4.2
Всего получено оценок: 834.
Атомы и молекулы – мельчайшие частицы вещества, поэтому в качестве единицы измерения можно выбрать массу одного из атомов и выражать массы других атомов в соотношении с выбранной. Так что же такое молярная масса, и какова ее размерность?
Что такое молярная масса?
Основоположником теории атомных масс был ученый Дальтон, который составил таблицу атомных масс и принял массу атома водорода за единицу.
Молярная масса – это масса одного моля вещества. Моль, в свою очередь, – количество вещества, в котором содержится определенное количество мельчайших частиц, которые участвуют в химических процессах. Количество молекул, содержащихся в одном моле, называют числом Авогадро. Эта величина является постоянной и не изменяется.
Рис. 1. Формула числа Авогадро. 23 элементарных частиц.
23 элементарных частиц.Число Авогадро получило свое название в честь итальянского ученого Амедео Авагадро, который доказал, что число молекул в одинаковых объемах газов всегда одинаково
Молярная масса в Международной системе СИ измеряется в кг/моль, хотя обычно эту величину выражают в грамм/моль. Эта величина обозначается английской буквой M, а формула молярной массы выглядит следующим образом:
M=m/v,
где m – масса вещества, а v – количество вещества.
Рис. 2. Расчет молярной массы.Как найти молярную массу вещества?
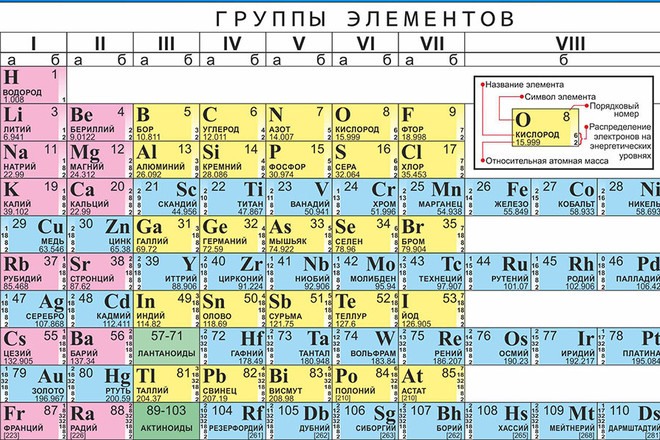
Вычислить молярную массу того или иного вещества поможет таблица Д. И. Менделеева. Возьмем любое вещество, например, серную кислоту.Ее формула выглядит следующим образом: H2 SO4. Теперь обратимся к таблице и посмотрим, какова атомная масса каждого из входящих в состав кислоты элементов. Серная кислота состоит из трех элементов – водород, сера, кислород. Атомная масса этих элементов соответственно – 1, 32, 16.
Молярная масса вещества численно равна относительной молекулярной массе, если структурными единицами вещества являются молекулы. Молярная масса вещества также может быть равна относительной атомной массе, если структурными единицами вещества являются атомы.
Вплоть до 1961 года за атомную единицу массы принимали атом кислорода, но не целый атом а его 1/16 часть. При этом химическая и физическая единицы массы не были одинаковыми. Химическая была на 0,03% больше, чем физическая.
В настоящее время в физике и химии принята единая система измерения. В качестве стандартной е.а.м. выбрана 1/12 часть массы атома углерода.
Рис. 3. Формула единицы атомной массы углерода.Молярная масса любого газа или пара измеряется очень легко. Достаточно использовать контроль. Один и тот же объем газообразного вещества равен по количеству вещества другому при одинаковой температуре.
Понятие молярной массы является очень важным для химии. Ее расчет необходим для создания полимерных комплексов и множества других реакций. В фармацевтике с помощью молярной массы определяют концентрацию данного вещества в субстанции. Также молярная масса важна при провидении биохимических исследований (обменный процесс в элементе).
В наше время благодаря развитию науки известны молекулярные массы практически всех составляющих крови, в том числе и гемоглобина.
Что мы узнали?
В 8 классе по химии важной темой является «молярная масса вещества». Молярная масса – важное физическое и химическое понятие. Молярная масса — характеристика вещества, отношение массы вещества к количеству молей этого вещества, то есть масса одного моля вещества. измеряется она в кг/моль или грамм/моль.
Тест по теме
Чтобы попасть сюда – пройдите тест.
Александр Котков
10/10
Регина Медникова
10/10
Юля Владимировна
10/10
Ольга Королёва
8/10
Дима Торопов
10/10
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 834.
А какая ваша оценка?
Урок 9. Молярная масса и молярный объем – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.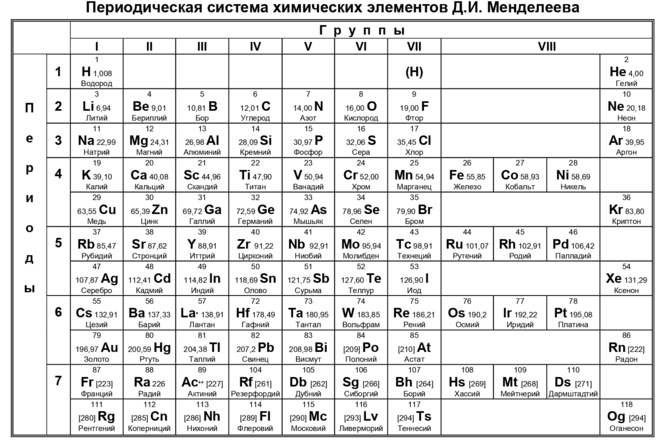
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер
[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер
[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер
[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер
[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Урок 10. Признаки химических реакций →
← Урок 8. Химическое количество вещества и моль
Периодическая таблица и калькулятор молярной массы
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 1 H Водород 1.008 | Химическая формула (обозначения Хилла)Молярная масса (г/моль) | Число Символ Имя Масса | 2 Не Гелий 4.  | ||||||||||||||||
| 3 Li Литий 6,94 | 4 Бе Бериллий 9.0121831 | 5 B Бор 10,81 | 6 C Углерод 12.011 | 7 N Азот 14.007 | 8 O Кислород 15,999 | 9 F Фтор 18.998403163 | 10 Неон Неон 20.1797 | ||||||||||||
| 11 Na Натрий 22,98976928 | 12 Мг Магний 24.305 | 13 Алюминий Алюминий | 14 Si Кремний 28.085 | 15 P Фосфор 30,973761998 | 16 S Сера 32.06 | 17 Cl Хлор 35,45 | 18 Аргон Аргон 39,948 | ||||||||||||
| 19 К Калий 39.  0983 0983 | 20 Ca Кальций 40.078 | 21 Sc Скандий 44.955908 | 22 Титан Титан 47,867 | 23 В Ванадий 50,9415 | 24 Cr Хром 51.9961 | 25 Mn Марганец 54.938044 | 26 Fe Железо 55,845 | 27 Co Кобальт 58.933194 | 28 Ni Никель 58.6934 | 29 Cu Медь 63,546 | 30 Цинк Цинк 65,38 | 31 Ga Галлий 69,723 | 32 Ge Германий 72.630 | 33 Ас Мышьяк 74.921595 | 34 Se Селен 78,971 | 35 Br Бром 79.904 | 36 Кр Криптон 83,798 | ||
| 37 руб.  рубидий 85.4678 | 38 Sr Стронций 87,62 | 39 Y Иттрий 88, | 40 Цирконий Цирконий 91.224 | 41 Nb Ниобий 92. | 42 Мо Молибден 95,95 | 43 Tc Технеций [97] | 44 Ru Рутений 101.07 | 45 Родий Родий 102. | 46 Pd Палладий 106,42 | 47 Аг Серебро | 48 Cd Кадмий 112.414 | 49 Ин Индий 114.818 | 50 Sn Олово 118.710 | 51 Sb Сурьма 121.760 | 52 Те Теллур 127,60 | 53 I Йод 126. | 54 Хе Ксенон 131.  293 293 | ||
| 55 Cs Цезий 132. | 196 | 56 Ва Барий 137,327 | 57 Ла Лантан 138. | 72 Hf Гафний 178,49 | 73 Та Тантал 180.94788 | 74 Вт Вольфрам 183,84 | 75 Re Рений 186.207 | 76 Ос Осмий 190.23 | 77 Ir Иридий 192.217 | 78 Pt Платина 195.084 | 79 Золото Золото 196,966569 | 80 Hg Ртуть 200.592 | 81 Tl Таллий 204,38 | 82 Pb Свинец 207,2 | 83 Би Висмут 208.98040 | 84 По Полоний [209] | 85 В Астатин [210] | 86 Рн Радон [222] | |
| 87 Fr Франций [223] | 88 Ра Радий [226] | 89 Ас Актиний [227] | 104 Rf Резерфордий [267] | 105 Дб Дубний [270] | 106 Sg Сиборгиум [271] | 107 Bh Борий [270] | 108 Hs Хассиум [277] | 109 Гора Мейтнерий [276] | 110 Ds Дармштадтиум [281] | 111 Rg Рентгений [282] | 112 Cn Копернициум [285] | 113 Nh Нигоний [285] | 114 Fl Флеровиум [289] | 115 Mc Московиум [289] | 116 Ур.  Ливермориум [293] | 117 ТС Теннессин [294] | 118 Ог Оганесон [294] | ||
| 58 Се Церий 140.116 | 59 Пр Празеодим 140. | 60 Nd Неодим 144,242 | 61 Пм Прометий [145] | 62 См Самарий 150,36 | 63 Eu Европий 151,964 | 64 Gd Гадолиний 157,25 | 65 Тб Тербий 158,92535 | 66 Dy Диспрозий 162.500 | 67 Ho Гольмий 164.93033 | 68 Er Эрбий 167,259 | 69 Tm Тулий 168,93422 | 70 Yb Иттербий 173,054 | 71 Lu Лютеций 174,9668 | ||||||
| 90 Th Торий 232.  0377 0377 | 91 Па Протактиний 231.03588 | 92 У Уран 238.02891 | 93 Np Нептуний [237] | 94 Pu Плутоний [244] | 95 Ам Америций [243] | 96 См Кюриум [247] | 97 Bk Берклиум [247] | 98 Cf Калифорния [251] | 99 Es Эйнштейний [252] | 100 Fm Фермиум [257] | 101 Md Менделевий [258] | 102 № Нобелий [259] | 103 Lr Лоренсиум [262] | ||||||
Ссылки
Атомные массы указаны в соответствии с IUPAC © 2013 ( Pure Appl. Chem. , Vol. 85, pp. 1047-1078, 2013).
Пересмотренные значения для алюминия, мышьяка, бериллия, кадмия, цезия, кобальта, фтора, золота, гольмия, марганца, молибдена, ниобия, фосфора, празеодима, скандия, селена, тория,
тулий и иттрий взяты с сайта IUPAC.
Условные атомные массы используются для бора, брома, углерода, хлора, водорода, лития, магния, азота, кислорода, кремния, серы и таллия.
Для радиоактивных элементов, не содержащих стабильных изотопов, в скобках указано массовое число наиболее стабильного изотопа.
Молярная масса
Коэффициенты пересчета молярной массы
Молярная масса для Элементы Масса в граммах одного моля вещества называется
молярная масса.
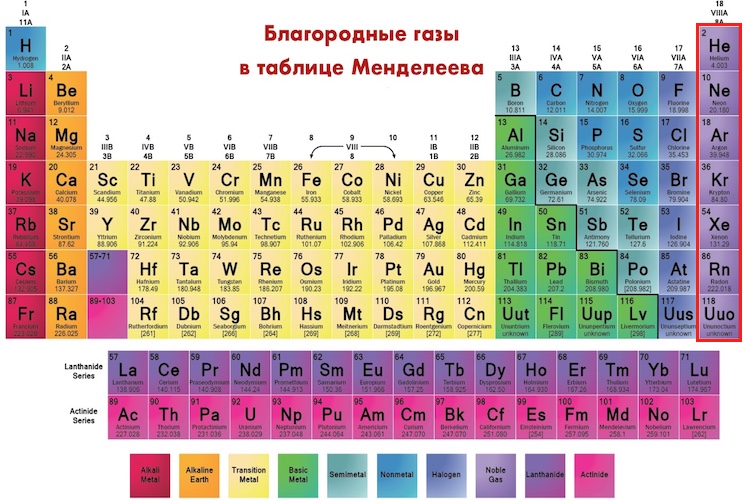
Каждый элемент имеет свою уникальную молярную массу. Например, молярная масса углерода
12,011 г/моль, молярная масса магния 24,3050 г/моль. Чтобы понять, почему эти
элементы имеют разные молярные массы, нужно помнить, что атомы
разные элементы содержат разное количество протонов, нейтронов и
электронов, поэтому они имеют разные массы. Атомные массы, данные
в периодической таблице на передней обложке этой книги представляют различные взвешенные
средние массы встречающихся в природе атомов каждого элемента. Например, атомная масса магния (24,3050) показывает нам, что среднее масса атомов магния примерно в два раза больше средней массы атомов углерода (12,011), поэтому масса 6,022 х 10 23 атомов магния (количество атомов в 1 моле магния) примерно в два раза больше массы 6,022 x 10 23 атомы углерода (количество атомов в 1 моле углерода). Таким образом, молярная масса магния составляет 24,3050 г/моль по сравнению с молекулярной массой углерода 12,011 г/моль. 907:15Количество граммов в молярной массе элемента то же, что атомная масса. Переводя атомные массы в молярные массы, можно построить коэффициенты преобразования, которые преобразуют массу элемента в число молей элемента. Например, атомная масса элемента неона, указанного в периодическом
Таблица на внутренней стороне обложки этой книги равна 20,1797, что дает молярную массу
20,1797 г/моль. Это измерение обеспечивает следующие коэффициенты преобразования для
преобразование между граммами и молями неона. Атомная масса лития составляет 6,941, поэтому коэффициенты пересчета для преобразования между массой и молями лития | Молярная масса молекулярных соединений Первый шаг в определение молярной массы молекулярного соединения состоит в том, чтобы определить молекулярная масса соединения, которая представляет собой средневзвешенную массу встречающиеся в природе молекулы соединения. Это находится путем добавления атомные массы атомов в каждой молекуле.
Следовательно, молекулярная масса воды, H 2 O, равна сумме атомных масс двух атомов водорода и одного атома кислорода, которые можно найти в периодической таблице.
Обратите внимание, что атомная масса
каждого элемента умножается на число атомов этого элемента в
молекула соединения. Количество граммы в молярной массе (граммы на моль) молекулярного соединения одинаковы как его молекулярная масса.
Молярная масса Ионные соединения Первый шаг в определение молярной массы ионного соединения заключается в том, чтобы определить его формула массы, которая является средневзвешенное значение массы природной формулы единиц вещества. (Это аналогично атомной массе элемента и молекулярная масса молекулярного вещества.)
Формула массы натрия хлорид равен сумме атомных масс натрия и хлора, которые можно найти в периодической таблице.
Количество граммов в
молярная масса (граммы на моль) любого ионного соединения совпадает с его формулой
масса. |

 Другой
атомные массы приводят к разным молярным массам.
Другой
атомные массы приводят к разным молярным массам.