Сама старая таблица Менделеева всё-таки в России!
Таблица, находящаяся в аудитории СПбГУ, не только на восемь лет старше таблицы из Сент-Эндрюса, но и изготовлена по личному указанию самого Менделеева.
Недавно мир облетела новость о находке в закромах одного шотландского университета, как говорилось, самой старой настенной таблицы Менделеева. Мы тогда подробно разбирали, что есть правда, а что – вымысел и недомолвки в этих сообщениях. И хоть возраст шотландской таблицы и вправду весьма почтенный, в действительности самый старый демонстрационный вариант Периодической системы хранится не в Туманном Альбионе, а в Большой химической аудитории Санкт-Петербургского государственного университета.
Оригинал демонстрационного варианта Периодического закона, хранящийся в здании Менделеевского центра СПбГУ. Фото: СПбГУ
В отличие от таблицы из Сент-Эндрюсского университета, которая долгие годы, никому не нужная, пылилась на полках и сильно обветшала, состоянию таблицы, хранящейся в СПбГУ, можно только позавидовать.
Примечательно, что таблица находится в действующей учебной аудитории Менделеевского центра, расположившегося в историческом здании Химической лаборатории Императорского Санкт-Петербургского университета. Это здание, как и сама таблица, тоже обязано своим появлением Дмитрию Ивановичу, по инициативе которого оно и было построено в 1894 году. Правда, сам Менделеев в этом здании лекций уже не читал, но председательствовал на заседаниях Русского физико-химического общества.
Так что отрадно, что именно на родине великого учёного в таком прекрасном состоянии сохранилась созданная по его же указанию демонстрационная таблица. Поэтому в негласном соревновании, у кого самый старый вариант таблицы, можно с уверенностью ставить точку. Более старого варианта, чем тот, что хранится в СПбГУ, просто не существует в природе.
Отдельную благодарность за предоставленную информацию выражаем старшему преподавателю СПбГУ Евгению Олеговичу Калинину.
Источник: Наука и жизнь (nkj.ru)
В Дубне создали самую большую в Евразии таблицу Менделеева
+ A –
Академик РАН Юрий Оганесян прокомментировал событие
Самая большая в Евразии Периодическая таблица Менделеева, почти в два раза больше той, что находится в Испании, открылась в подмосковной Дубне. Событие приурочено к 65-летию расположенного здесь Объединенного института ядерных исследований и самого города.
Событие приурочено к 65-летию расположенного здесь Объединенного института ядерных исследований и самого города.
Как сообщили «МК» в ОИЯИ, площадь таблицы составляет более 284 кв. м, ее разместили на стене плавательного бассейна «Архимед» на набережной Волги. Таблица хорошо просматривается и со стороны города, и с проплывающих мимо круизных теплоходов.
Примечательно, что именно в ОИЯИ, в Лаборатории ядерных реакций им. Г.Н.Флёрова под руководством академика РАН Юрия Оганесяна, были получены все известные к настоящему времени сверхтяжелые элементы — от 113-го до 118-го (последний даже назван в честь ученого — «оганесон Og»). Юрий Цалакович является вторым в мире ученым, в честь которого новый элемент Периодической таблицы назван при его жизни (первым был американский ученый Гленн Теодор Сиборг).
— Если вы посмотрите таблицу Менделеева в Интернете, там их огромное количество, по-моему, 1500 видов, — говорит сам Юрий Цалакович. — Мы выбрали не просто декоративный вариант, но и содержательный с точки зрения науки.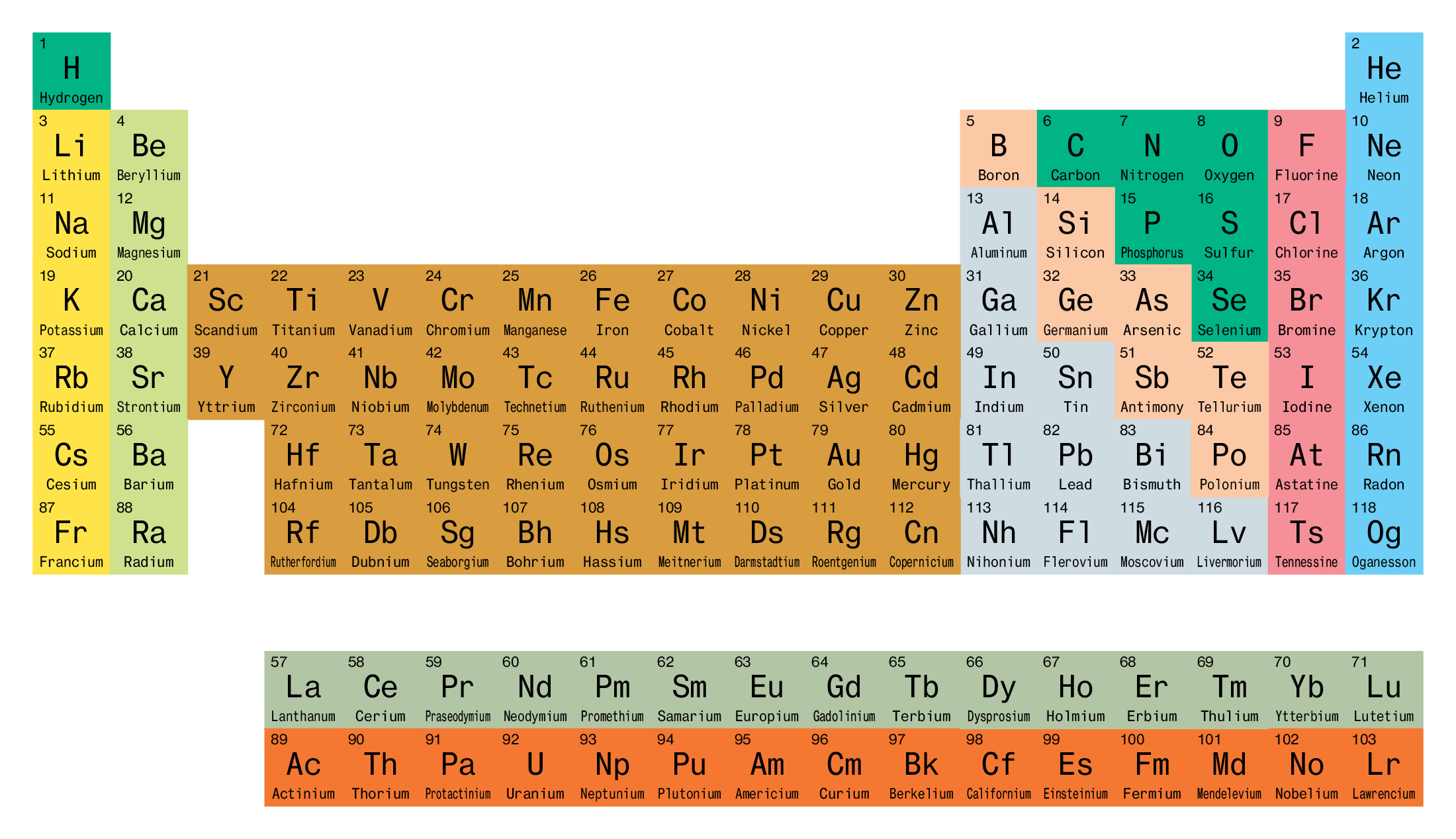
СПРАВКА “МК”
Ученые Объединенного института ядерных исследований (ОИЯИ) внесли выдающийся вклад в открытие наиболее тяжелых элементов Периодической таблицы. Всего со дня образования ОИЯИ (1956 год) таблица пополнилась 18 новыми элементами (со 101-го по 118-й), из которых в ОИЯИ синтезировано 10, в том числе 5 самых тяжелых элементов. Названия двух из открытых в ОИЯИ элементов: дубний и московий — связаны с местом расположения института, а еще двух: флеровий и оганесон — с именами выдающихся ученых.
Опубликован в газете “Московский комсомолец” №28586 от 23 июля 2021
Заголовок в газете: Таблицу Менделеева можно будет рассмотреть даже в темноте
А теперь о “Таблице Менделеева”
Каждый советский школьник, знавший химию на отлично (я, например), был уверен в следующем факте: Периодический закон и Периодическая система химических элементов были изобретены великим русским ученым Менделеевым, и точка. Первенство, уникальность и гений Менделеева не подлежали никакому сомнению.
Первенство, уникальность и гений Менделеева не подлежали никакому сомнению.
Но на первом курсе университета, в учебнике немецкого языка мной с удивлением был обнаружен текст под названием Lothar Meyer, из которого я узнал, что у периодической системы как минимум два автора, которые сделали открытия вроде бы как независимо друг от друга. И это зародило серьезные сомнения в уникальности гения, тем более что своё открытие немец Лотар Мейер опубликовал… в 1864 году, на 5 лет раньше Менделеева (1869).
Сегодня вы можете узнать настоящую историю открытия Периодического Закона.
Немаловажным является тот факт, что оба ученых – и Лотар Мейер, и Дмитрий Менделеев, в 1860-м году посетили съезд химиков в Карлсруэ, Германия. На этом съезде идея зависимости свойств химических элементов от их атомных весов просто витала в воздухе.
Но еще задолго до этого съезда попытка систематизации элементов была сделана Дёберайнером (в 1829 году). Идеи Дёберайнера в 1843 году развил другой немецкий химик Леопольд Гмелин, который показал, что взаимосвязь между свойствами элементов и их атомными массами значительно сложнее, чем триады Дёберайнера.
Француз де Шанкуртуа в 1862 предложил систематизацию химических элементов, основанную на закономерном изменении атомных масс – «земную спираль». Де Шанкуртуа был одним из первых учёных, отметивших периодичность свойств элементов; его винтовой график действительно фиксирует закономерные отношения между атомными массами элементов.
Таблица де Шанкуртуа (1862):
Химик Джон Ньюлендс в августе 1864 года составил таблицу, в которой расположил все известные элементы в порядке увеличения их атомных весов. Он, безусловно, первым дал ряд элементов, расположенных в порядке возрастания атомных масс, присвоил химическим элементам соответствующий порядковый номер и заметил систематическое соотношение между этим порядком и физико-химическими свойствами элементов. Но его таблица имела ряд недостатков (напр. в некоторых ячейках было по два элемента), поэтому была воспринята научным обществом скептически.
Таблица Ньюлендса:
В 1864 же году Уильям Одлинг опубликовал таблицу, в которой элементы были размещены согласно их атомным весам и сходству химических свойств, однако не сопроводил её какими-либо комментариями.
И в том же 1864 году опубликована книга Лотара Мейера “Die modernen Theorien der Chemie” (Современная Теория Химии), и его первая таблица из 28 элементов, размещённых в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное изменение атомной массы в рядах сходных элементов. Мейер указал, что если элементы располагаются в порядке их атомных весов, они попадают в группы, в которых подобные химические и физические свойства повторяются через определенные промежутки.
Ранняя версия таблицы Мейера (1862):
Доработанная версия таблицы (1870):
Через пять лет после Мейера, в 1969 году Менделеев опубликовал доклад, в котором сообщил об открытии им зависимости между атомными весами элементов и их химическими свойствами. В том же году он опубликовал «Основы химии», в которых был приведен первый вариант его таблицы, содержащей 19 горизонтальных рядов и 6 вертикальных. Таблица Менделеева весьма значительно отличались от той, которую Вы видели на уроках химии. На то время было известно только 63 элемента, из которых один – дидим – оказался смесью празеодима и неодима.
На то время было известно только 63 элемента, из которых один – дидим – оказался смесью празеодима и неодима.
Первый вариант таблицы Менделеева (1869):
В 1870 году вышла работа Мейера, содержащая обновленную таблицу под названием «Природа элементов как функция их атомного веса», состоявшая из девяти вертикальных столбцов. Сходные элементы располагались в горизонтальных рядах таблицы; некоторые ячейки Мейер оставил незаполненными. Таблица сопровождалась графиком зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид, прекрасно иллюстрирующий термин «периодичность».
В ноябре 1870 года Менделеев опубликовал статью «Естественная система элементов и применение её к указанию свойств неоткрытых элементов», в которой он впервые употребил термин «периодический закон» и указал на существование нескольких не открытых ещё элементов и предсказал их свойства (так же, как и у Мейера, таблица Менделеева имела незаполненные ячейки).
В 1871-м году Менделеев сформулировал закон как: «Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
В 1882 году Мейер и Менделеев одновременно получили медали от Royal Society (Королевского общества) за их исследования в области Периодического закона. Необходимо знать, что таблицы Мейера и Менделеева и в 1870-м, и в 1871-м, и в 1891-м годах все еще значительно отличались от привычной нам и по форме, и по содержанию: даже в 1891-м году, к примеру, там не было благородных газов.
Таблица элементов версии 1871 года:
Доработанная таблица Менделеева, 1891 год, благородные газы все еще отсутствуют, зато есть дидим:
Еще одна версия таблицы 1891 года (напоминает таблицу де Шанкуртуа, не находите?):
Но самое главное заключается в том, что заблуждались и Мейер, и Менделеев. Современный закон звучит так: «Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от ЗАРЯДА ЯДЕР атомов элементов». То есть не от атомного веса (массы), а от заряда ядер. Это в корне меняет всю суть закона. Ведь существуют изотопы – атомы одного элемента с одним зарядом ядер, практически одинаковыми химическими свойствами, но разной атомной массой (водород, дейтерий и тритий; уран 235 и уран 238 и т. п.).
п.).
Для того, чтобы прийти к этой формулировке Закона и современному виду Таблицы элементов, потребовались многие годы работы и исследования Рамзая, Браунера, Сведберга, Содди, Мозли и других ученых.
В 1911 году голландец Ван Дер Брук предположил совпадение атомного номера с величиной положительного заряда ядра атома, что стало основой современной классификации химических элементов. В 1920-м году англичанин Чедвик экспериментально подтвердил гипотезу Ван ден Брука; тем самым был раскрыт физический смысл порядкового номера элемента в Периодической системе, а закон приобрел современную формулировку (зависимость от заряда ядер).
И, наконец, в 1923 году Нильс Бор заложил основы современного представления о теории Периодического закона: причина периодичности свойств элементов заключается в периодическом повторении строения внешнего электронного уровня атома.
Нужно ли говорить, что на сегодня в Таблице присутствуют (существуют в природе и синтезированы) 118 химических элементов, в отличие от 63-х, известных во второй половине 19 века; а короткая версия Таблицы, которую вы видели в школе, официально отменена на международном уровне в 1989 году (хоть и продолжает приводиться в большом числе российских справочников и пособий и после этого времени). Кроме основного общепринятого вида таблицы, существует множество форм (иногда довольно вычурных), предложенных разными учеными.
Кроме основного общепринятого вида таблицы, существует множество форм (иногда довольно вычурных), предложенных разными учеными.
Современная таблица:
Резюме: при всем уважении к Менделееву и его работам, он внес важный вклад, но был лишь одним из многих, приложивших руку к тому, что мы сегодня называем Периодическим законом и Периодической системой химических элементов. И да, в тех исследованиях Мейер его в общем-то опередил, хотя в 19 веке разница в пять лет считалась «практически одновременно» 🙂 Сравнив вид таблиц Менделеева и современной (и формулировки законов), становится понятно, почему во всем мире таблицу и закон называют просто Периодической таблицей элементов и Периодическим законом – из уважения к огромному труду большого количества ученых.
Если Вы дочитали до этого места – Вы молодец 🙂
Долгосрочный рейтинг в иностранной и национальной валюте подтвержден на уровн telecom.kz |
The long-term rating in foreign and national currency was confirmed at “BB” level. telecom.kz |
| RSPO0069 BC–XDC: запрос статуса/запрос […] формата/список принтеров . enjoyops.de enjoyops.de |
RSPO0069 BC-XDC: Query Status/Format/Printer List . enjoyops.de enjoyops.de |
| Используйте сигна внешнего синхронизирующего сигнала. service.jvcpro.eu |
Make use of BB signal or HDTV 3 level synchronizing signal as the external […] synchronizing signal. service.jvcpro.eu |
BC SOLAR специализируется [. ..] ..]в сфере возобновляемых источников энергии, в частности на солнечной энергии, энергии ветра, геотермии […]на африканском континенте . europages.com.ru |
BC SOLAR specialises in renewable […] energies and in particular solar, wind power and geothermal power on the African continent. europages.cz |
| bb) Место производства, свободное […] от вредного организма – место производства, где данный вредный организм отсутствует, и […]где оно официально поддерживается, cc) Участок производства, свободный от вредного организма – Определённая часть места производства, для которой отсутствие данного вредного организма научно доказано, и где в случае необходимости оно официально поддерживается в течение определённого периода времени, и которая управляется как отдельная единица, но таким же образом, как и свободное место производства. fsvfn.ru |
bb) Pest free place of production […] denotes to a place of production where a specific type of pest is not present and the […]place is officially protected, 3 cc) Pest free production site denotes to a production area where a specific type of pest is not present and this status is officially protected for a certain period of time and to a certain part of production area administered as a separate unit as in the case of place of production free from pests. fsvfn.ru |
S&P также понизило оценку риска перевода и […]конвертации валюты для украинских […] несуверенных заемщиков с «BB» до «BB–», однако подтвердило краткосрочные […]рейтинги Украины по […]обязательствам в иностранной и национальной валюте на уровне «В», рейтинг по национальной шкале «uaAA» и рейтинг покрытия внешнего долга на уровне «4». ufc-capital.com.ua |
S&P also downgraded the risk of currency transfer and […]conversion for Ukrainian non-sovereign […] borrowers from BB to BB-, but confirmed the short-term ratings […]of Ukraine for liabilities […]denominated in foreign and domestic currencies – at B level, its national scale rating — uaAA and foreign debt coverage rating – at the level 4. ufc-capital.com.ua |
Для целей повышения безопасности и защиты корпоративной информации, СКУД bb guard является не просто профессиональным устройством контроля доступа с распознаванием лица, а предоставляет возможность интеграции как с системой bb time-management (с последующим формированием различных отчетов о посещаемости сотрудников [. ..] ..]для целей финансовой мотивации), […]так и c третьими устройствами, такими как: электрические замки, сигнализация, датчики и т.д. moscow-export.com |
In order to increase security of corporate information, bb guard is not only a professional device for access control with face recognition, it also presents the possibility of integration with system bb time-management (with subsequent formation of various reports of staff attendance for their motivation) […] and with outside devices such as electric locks, alarms, sensors, etc. moscow-export.com |
| Система bb workspace относится к […] классу ECM-систем (Enterprise Content Management) и поддерживает полный жизненный цикл […]управления документами от создания и регистрации, до архивного хранения в отдельных базах данных за каждый календарный год. moscow-export.com |
Bb workspace system belongs to ECM-systems […] (Enterprise Content Management) and supports full lifecycle of document management […]starting from creation and registration to archival storage in separate databases for each calendar year. moscow-export.com |
Самостоятельная […]финансовая позиция Самрук-Энерго на […] уровне рейтинговой категории BB отражает преимущество вертикальной […]интеграции, так как деятельность […]компании включает весь процесс выработки энергии, начиная от добычи угля и заканчивая генерацией и распределением электрической и тепловой энергии. halykfinance.kz |
SE’s standalone business and financial profile […] is assessed at BB rating category, which benefits [.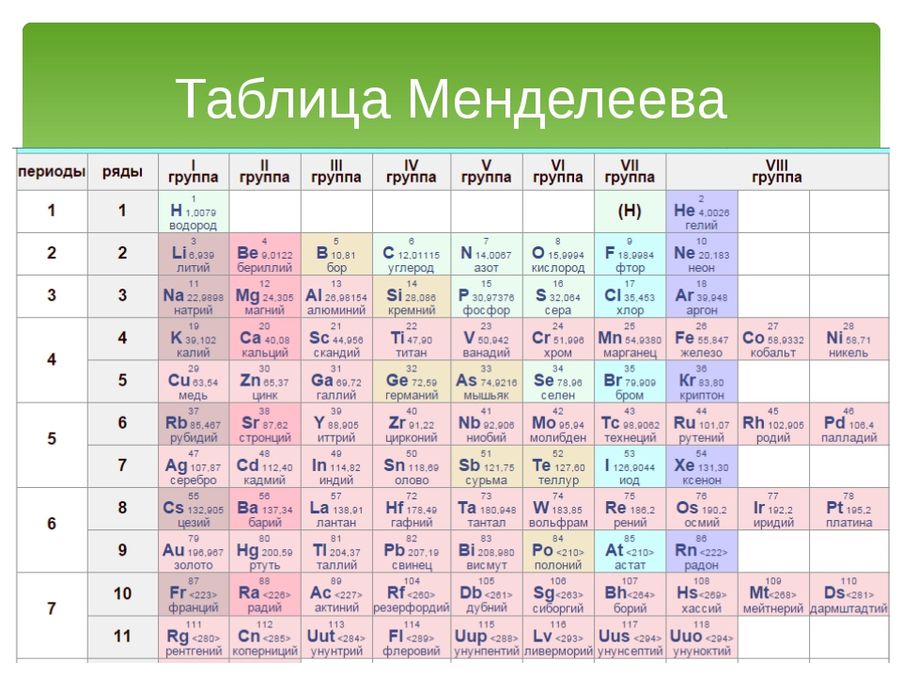 ..] ..]from its vertical integration as its […]activities range from coal mining to generation and distribution of power and heat. halykfinance.kz |
Насос типа MSD имеет самый широкий спектр гидравлических характеристик из всех […] многоступенчатых насосов класса BB3 на рынке.sulzer.com |
The MSD pump has the broadest […] hydraulic coverage of any BB3 type multistage pump […]in the market. sulzer.com |
| bb) проводить регулярный […] обзор процесса дальнейшего осуществления Пекинской платформы действий и в 2015 году в установленном […]порядке собрать все заинтересованные стороны, включая гражданское общество, для оценки прогресса и проблем, уточнения задач и рассмотрения новых инициатив через 20 лет после принятия Пекинской платформы действий daccess-ods. |
(bb) To review regularly […] the further implementation of the Beijing Platform for Action and, in 2015, to bring together all […]relevant stakeholders, including civil society, to assess progress and challenges, specify targets and consider new initiatives as appropriate twenty years after the adoption of the Beijing Platform for Action daccess-ods.un.org |
| bb) содействовать созданию […] у женщин и девочек положительного представления о профессиональной деятельности в области науки […]и техники, в том числе в средствах массовой информации и социальных средствах информации и через информирование родителей, учащихся, преподавателей, консультантов по вопросам профориентации и разработчиков учебных программ, а также посредством разработки и расширения других стратегий, призванных стимулировать и поддерживать их участие в этих областях daccess-ods. |
(bb) Promote a positive image […] of careers in science and technology for women and girls, including in the mass media and […]social media and through sensitizing parents, students, teachers, career counsellors and curriculum developers, and devising and scaling up other strategies to encourage and support their participation in these fields daccess-ods.un.org |
Также нельзя не упомянуть, что серьезным прорывом Банка стало получение самого высокого рейтинга среди всех частных банков страны со 100%-ным местным капиталом (одновременно это и второй лучший рейтинг среди всех частных банков Азербайджана) от […]международного рейтингового агентства Standard & […] Poor’s – долгосрочный ‘BB–‘ и краткосрочный […]‘B’, прогноз изменения рейтинга – «стабильный». pashabank.az |
It should be also noted that receiving highest rating among all private banks of the country with 100 % local capital (simultaneously ranking second in rating among all private banks of Azerbaijan) from the [.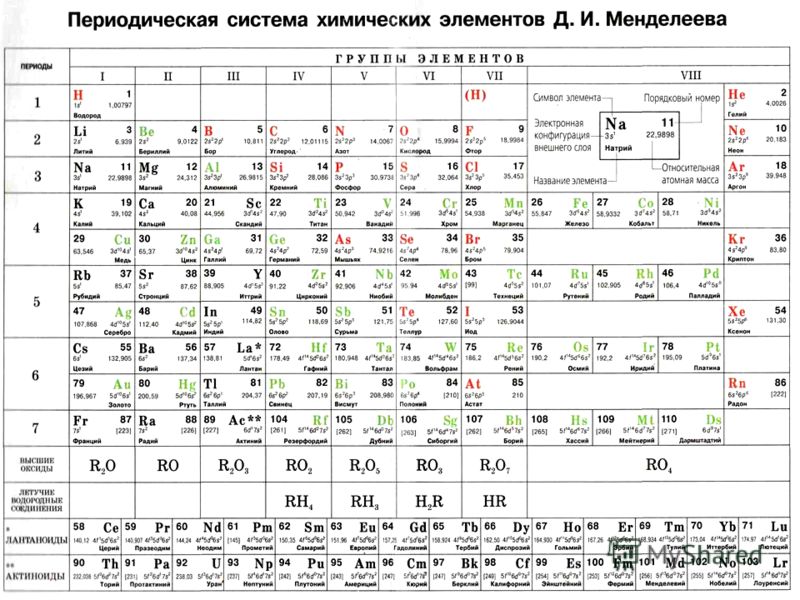 ..] ..]International Rating Agency Standard & […] Poor’s: long-term and short-term BB– B with […]“stable” outlook has become a significant breakthrough of the Bank. pashabank.az |
| Политика управления денежными средствами Компании ограничивает суммы финансовых активов, которые можно содержать в каком-либо из банков, в зависимости от размера капитала уровня такого банка и его долгосрочного кредитного рейтинга, присвоенного агентством Standard & Poors (например, не более 40% для банка с рейтингом «BB» на 31 декабря 2010 года). kmgep.kz |
The Company’s treasury policy limits the amount of financial assets held at any one bank to the lower of a stipulated maximum threshold or a percentage of the bank’s Tier I capital, which is linked to the banks long term counterparty credit rating, as measured by Standard and Poor’s rating agency, (e. g. not greater than 40% for a BB rated bank at December 31, 2010). g. not greater than 40% for a BB rated bank at December 31, 2010).kmgep.kz |
| bb) меморандум о взаимопонимании […] между национальным управлением Румынии по противодействию отмыванию денежных средств и […]секретариатом по противодействию отмыванию денег и имущества Парагвая о сотрудничестве в области обмена данными финансовой разведки об отмывании денег и финансировании терроризма, подписанный в Бухаресте, декабрь 2008 года, и Асунсьоне, декабрь 2008 года daccess-ods.un.org |
(bb) Memorandum of understanding […] between the Romanian National Office for Preventing and Combating Money-laundering and […]the Paraguayan Secretariat for Prevention of Money-laundering or Property on cooperation in financial intelligence exchange related to money-laundering and terrorist financing, signed in Bucharest, December 2008, and in Asunción, December 2008 daccess-ods. |
AccessBank признан самым надежным банком в […]Азербайджане международным […] рейтинговым агентством Fitch (“BB+ прогноз – стабильный”), […]а также на ежегодных наградах компании […]Global Finance (2011) и Издательской Группы Euromoney (в 2012, 2011 и 2010 году) назван “Лучшим Банком Азербайджана” и получил награду The Banker “Банк года” (2011). anskommers.ws |
AccessBank is recognized as the Most Reliable […]bank in Azerbaijan by Fitch […] International Ratings (‘BB+ Outlook Stable‘), and as “The […]Best Bank in Azerbaijan” by Global […]Finance (2011) and Euromoney (2012, 2011 and 2010) in their annual awards as well as “The Bank of the Year” by The Banker (2011). anskommers.ws |
Еще больше положение компании в [. ..]
[…]
глазах рынка было ухудшено решением рейтингового агентства S&P поместить кредитный рейтинг ENRC BB+ на “credit watch negative”, что подразумевает повышенную вероятность падения рейтинга компании в ближайшие […] ..]
[…]
глазах рынка было ухудшено решением рейтингового агентства S&P поместить кредитный рейтинг ENRC BB+ на “credit watch negative”, что подразумевает повышенную вероятность падения рейтинга компании в ближайшие […]три месяца. halykfinance.kz |
To make things even worse, S&P placed ENRC’s BB+ credit rating on “credit watch negative”, which implies a higher probability of a downgrade into junk territory over the next three months. halykfinance.kz |
| В июне 2012 года Международным рейтинговым агентством Fitch Ratings повышены долгосрочные рейтинги Краснодарского края, а также выпуски облигаций в иностранной и национальной валюте с уровня BB до BB+. pwc.ru |
In June 2012 international ratings agency Fitch Ratings upgraded the long-term ratings for Krasnodar Territory, as well as foreign and national currency long-term issuer default ratings from ‘BB’ to ‘BB+’, and affirmed Krasnodar’s short-term rating at ‘B’. pwc.ru |
| 1BB 2 b iii 2 Добыча Летучие выбросы (исключая удаление газа и сжигание в факелах) из газовых скважин через входные отверстия на устройствах переработки газа или, если обработка не требуется, в точках стыковки систем транспортировки […] газа. ipcc-nggip.iges.or.jp |
1B 2 b iii 2 Production Fugitive emissions (excluding venting and flaring) from the gas wellhead through to the inlet of gas processing plants, or, where processing is not required, to the tie-in points on gas transmission systems. ipcc-nggip.iges.or.jp |
Если ‘Быстрый ответ’ разрешен, поле для ответа появится после сообщений на странице, но Вы […]должны напечатать Ваше сообщение, также […] можно использовать BB Код и Смайлы вручную, […]если Вы выберете использование этого. ipribor.com.ua |
If ‘Quick Reply’ has been enabled, a simple reply field will also appear [. ..] ..]after the post(s) on a page, but you’ll have to […] type your Bulletin Board Code and Smileys […]manually if you choose to use it. ipribor.com |
| Модели BJ и BB стали первыми марками холдинга […] Mack, построенными под влиянием новых транспортных веяний – машины способные […]перевозить более тяжелые и объемные грузы с большей скоростью. trucksplanet.com |
The Models BJ and BB were the first trucks of Mack […] Company, built under the influence of new transport trends – machines […]capable of carrying heavy and bulky loads with greater speed. trucksplanet.com |
В мае 2012 года рейтинговое агентство Fitch Rating повысило долгосрочные рейтинги Новосибирской […]области в иностранной и национальной […] валюте с уровня «BB» до «BB+», а также долгосрочный […]рейтинг по национальной шкале – […]с уровня «AA-(rus)» до «AA(rus)». pwc.ru |
In May 2012, Fitch Ratings changed its long-term rating for the Novosibirsk […]Region (in foreign and local currency) […] from BB to BB+, and its long-term national-scale […]rating from AA-(rus) to AA(rus). pwc.ru |
| Вторая категория (BBB, BB, B) — стартап имеет готовый […] или почти готовый (тестирующийся) продукт и начал привлекать первых […]клиентов, однако пока не демонстрирует высоких темпов роста клиентской базы и доходов. digitaloctober.ru |
Second category (BBB, BB, B) — the startup has […] a finished or almost finished (at the testing stage) product and has started […]attracting its first clients, but has not get demonstrated a high income or client base growth rate. digitaloctober.com:80 |
16.11.2009 МРСК Центра присвоен […] кредитный рейтинг S&P «BB–/B/ruAA-» прогноз «Стабильный», […]свидетельствующий о способности […]и готовности Компании своевременно и в полном объеме выполнять свои финансовые обязательства. euroland.com |
16.11.2009 IDGC of […] Centre was assigned a BB-/B/ruAA– credit rating […](“Stable”) by S&P, thus testifying to the Company’s capability […]and readiness in the performance of its financial obligations. euroland.com |
| Международное рейтинговое агентство Fitch повысило приоритетный необеспеченный рейтинг эмиссии еврооблигаций TNK-BP International Ltd /ТНК-ВР/ на сумму 700 млн долл. с уровня «BB+» до «BBB-, а также приоритетный необеспеченный рейтинг гарантированной программы по выпуску долговых обязательств объемом 5 млрд долл. и существующего выпуска облигаций в рамках программы в размере 1,5 млрд долл. с уровня «BB+» до «BBB-. tnk-bp.com |
The international rating agency Fitch raised the priority unsecured rating of the issue of eurobonds of TNK-BP International Ltd. (TNK-BP) by $700 million from the level BB+ to BBB- and the priority unsecured rating of the issue of debt securities for $5 billion and the current issue of bonds for program implementation for $1.5 billion from the level BB+ to BBB-. tnk-bp.com |
| bb) должны быть упакованы […] в закрытые контейнеры, которые были официально опечатаны и имеют регистрационный номер зарегистрированного […]питомника; этот номер должен быть также указан в фитосанитарном сертификате в разделе «Дополнительная декларация. fsvfn.ru |
bb) be packed in closed containers […] which have been officially sealed and bear the registration number of the registered […]nursery; this number shall also be indicated under the rubric “Additional Declaration” on the Phytosanitary Certificate. fsvfn.ru |
После того как вы загрузите изображение, вы […]сможете поместить его в своих сообщениях, […] используя специальный BB код, который отображается […]под изображением при просмотре на полный экран. forum.miramagia.ru |
When you have uploaded a picture, you can place it in your […] posts by using the BB code text that is displayed […]below the image when you view it at full size. forum.miramagia.com |
В нее входят 6 базовых […] шасси с дополнительным индексом BB и колесными формулами 4×4, 6х6 и 8×8 (модели от 16.33ОBB до 41.460BB) с полезной нагрузкой 8-27 т и […]рядными 6-цилиндровыми […]двигателями мощностью 326-460 л.с. Эту гамму замыкают седельные тягачи BBS (6×6/8×8) с допустимой нагрузкой на седло от 12 до 30 т, приспособленные для работы в составе автопоездов полной массой до 120 т и развивающие максимальную скорость 90 км/ч. Их оснащают 660-сильным дизелем V10, а наиболее тяжелые машины комплектуют автоматизированной 12-ступенчатой коробкой передач ZF. trucksplanet.com |
It has a bolster payload from 12 to 30 […]tons and GCVW is up […] to 120 tons. Maximum speed is 90 km/h. The semi-tractors are equipped with a 660 hp diesel engine V10, and the most heavy trucks are […]used an automatic 12-speed transmission ZF. trucksplanet.com |
Оба этих варианта добавляют связь к оригинальному сообщению, […]показывая имя автора, дату и время […] сообщения, в то время как BB Код тэг Цитировать указывает […]нужное сообщение без этой дополнительной информации. ipribor.com.ua |
Both these options add a link to the original post showing the name of the poster and the date and […]time of the post, whereas the […] Bulletin Board Code quote tag simply quotes the relevant post […]without this additional information. ipribor.com |
Самую большую в Евразии таблицу Менделеева установили в Дубне – Общество
МОСКВА, 24 июля. /ТАСС/. Самая большая в Евразии периодическая таблица химических элементов Д. И. Менделеева открыта в Дубне как символ выдающегося вклада российских ученых в открытие новых химических элементов. Трансляция открытия велась в пятницу на портале “Научная Россия”.
“Символично, что это событие происходит в Год науки и технологий именно в Дубне – городе, где синтезированы новые химические элементы, имеющие русские корни – флеровий, московий, дубний, оганесон. Благодаря Объединенному институту ядерных исследований (ОИЯИ) Дубна уже 65 лет является точкой притяжения мировой науки и объединяет в своих проектах тысячи ученых из 64 стран”, – заявил в видеообращении глава Минобрнауки России Валерий Фальков.
Площадь панно более 284 кв. м. Оно расположено на стене здания на набережной Волги, его будет хорошо видно как жителям и гостям города, так и пассажирам многочисленных круизных теплоходов, проплывающих по реке.
“Гениальное творение Дмитрия Ивановича Менделеева становится нашей достопримечательностью. Отныне и далее с берегов великой русской реки Волги, с кораблей , плывущих по ней, мы будем видеть это большое панно. <…> Наша таблица будет очень хорошо смотреться ночью с подсветкой. Кроме того, рядом с таблицей слева есть свободное поле, на нем можно транслировать лекции, рассказывать об истории открытия элементов, об их химических свойствах, а на правой стороне демонстрировать различные элементы в таблице”, – заявил ученый ОИЯИ Юрий Оганесян, в честь которого при жизни назван один из элементов.
ОИЯИ – крупный международный научный центр, которым руководит комитет представителей 18 стран-участниц. На долю института приходится более 40 открытий в области ядерной физики. Учеными Дубны синтезировано десять, в том числе пять самых тяжелых, элементов. Названия двух из открытых в ОИЯИ элементов – дубний и московий – связаны с местом расположения института, а еще двух – флеровий и оганесон – с именами выдающихся ученых ОИЯИ, внесших определяющий вклад в развитие данного направления науки.
Карта на стене лаборатории
Некоторые первичные вещества в природе — теперь их называют элементами — были известны еще в античные времена. Однако только за последнее столетие было определено их число и объяснены причины их сходства или различий.
Генрих Тетерин и Клер Терлон
В астрономии подобный прогресс принято связывать с именами Коперника и Галилея, в механике — с именем Ньютона, в биологии — с именами Дарвина и Павлова; выдающийся вклад в развитие физики атома внесли Бор и Эйнштейн. В развитии химической науки один из основных поворотных моментов наступил в 1869 году, когда русский ученый Дмитрий Иванович Менделеев сформулировал закон периодичности свойств химических элементов.
Закон Менделеева позволил отказаться от архаического метода проб и ошибок в химических исследованиях в пользу современных методов, позволяющих предсказывать существование ранее неизвестных элементов.
Открытие Менделеевым периодического закона явилось как бы завершением многочисленных попыток ученых из различных стран привести в систему свойства элементов. Периодическая таблица Менделеева явилась качественным шагом вперед по сравнению с таблицей элементов, предложенной в XVIII веке французским химиком Антуаном Лавуазье. Отметим, что Лавуазье считал элементами также свет и тепло, выделяющееся при горении. Они получили у него название «невесомых флюидов».
Работы Лавуазье были ранними предвестниками строго логичной систематики Менделеева и способствовали отказу от теории флогистона — старой концепции химии, возникшей еще в Древней Греции и признававшей огонь одним из основных начал Природы. В 1803 году английским химиком Джоном Дальтоном была предложена атомистическая теория, согласно которой каждому из 23 элементов, известных Лавуазье, соответствовал присущий только ему относительный «атомный вес». Другим английским химиком — Вильямом Волластоном — было введено понятие «эквивалентного веса». С помощью этих понятий удалось установить некоторый порядок среди известных тогда элементов. Однако до эпохи Менделеева даже само понятие элемента продолжало оставаться нечетким и допускало различные толкования.
К 1850 году общее число известных элементов приблизилось к шестидесяти. Многие ученые пытались обнаружить их взаимосвязь. К их числу относятся Иоган Доберайнер, Леопольд Гмелин, Ленсен, Макс фон Петтснкофер, Жан Батист Дюма, Вильям Гиббс, Джон Гладстон и многие другие. В 1817 году Доберайнер объединил некоторые известные тогда элементы в «триады» в порядке увеличения их атомного веса. В 1850 году Гмелин увеличил число элементов в этих группах до четырех или пяти: принцип расположения оставался прежним.
Среди ученых, оказавших, по словам Д. И. Менделеева, наибольшее влияние на его научную деятельность, надо выделить французских химиков Дюма и Ленсена. Дюма предложил метод определения атомных весов элементов, а Ленсену принадлежит первая попытка предсказания атомных весов еще не открытых элементов.
В 1860 году появились новые системы классификации. Так, Александр Шанкартруа предложил располагать элементы по винтовой линии, проходящей по поверхности воображаемого цилиндра. Интересно отметить формальное сходство этого способа классификации с «двойной спиралью» современной генетики. Другой точки зрения придерживался английский химик Ньюлендс. Он в 1864 году предложил закон октав, согласно которому элементы объединялись по группам, причем восьмые элементы в этих группах имели сходные свойства.
Возможно, что систематика, предложенная немецким ученым Лотаром Мейером, в наибольшей мере способствовала возникновению новых идей. В 1864 году Мейер опубликовал таблицу, включающую 44 из 62 известных к тому времени элементов, расположенных, однако, в соответствии с их «валентностью», а не с атомным весом. Оставляя в стороне современный смысл этого термина, отметим, что валентность определяет способность атома элемента образовывать химические соединения. Так, в воде — Н2О — валентность кислорода равна двум, поскольку один атом кислорода способен соединяться с двумя атомами водорода. В первом варианте таблицы Мейера в качестве исходной величины была взята валентность водорода. Последующий вариант таблицы Мейера был основан уже на атомных весах. Эти работы, равно как и работы Других ученых — Одлинга, Хинриха и Баумгауэр, — способствовали разрешению проблемы, хотя большинство современников воспринимали их лишь как игру воображения. У Ньюлендса, во время его выступления в Британском химическом обществе, иронически спрашивали, не считает ли он, что те же самые результаты можно было бы получить, расположив элементы в алфавитном порядке.
Что же, собственно говоря, составляет сущность теории Менделеева? Коротко говоря, Менделеев предложил расположить элементы по строкам и столбцам, они называются также «периодами» и «группами», составляющим прямоугольник в порядке возрастания атомного веса слева направо в пределах одной строки. Соответствующие строки располагаются друг под другом, столбцы заполняются элементами с одинаковыми свойствами, например образующими окислы одинакового состава и строения. В этом случае число атомов соответствующего элемента в окисле возрастает от первого к седьмому столбцу. Необходимо отметить, что возможности системы, находящей широкое применение и в наше время, были сформулированы Менделеевым, когда еще было известно немногим более половины образующих ее элементов.
С самого начала Менделеев был убежден, что ему удалось обнаружить научный принцип классификации химических элементов. Более того, он понял, что открыл объективный закон.
Подобно тому как, согласно известным анекдотам, Ньютон открыл закон всемирного тяготения в тот момент, когда ему на голову упало яблоко, а Уатт, рассматривая кипящий чайник, пришел к мысли о создании паровой машины, широко бытует утверждение, что Менделеев открыл периодический закон во сне. Люди, как правило, не замечают, что хотя иногда научное открытие может, подобно вспышке света, озарить ум ученого, ему часто приходится затрачивать годы на неприметную для посторонних работу над объектом исследования. Пастер позднее заметил, что только подготовленный ум может воспользоваться представившимся случаем. Если познакомиться с деятельностью Менделеева до 1869 года, то станет совершенно ясно, что открытие периодического закона не было случайностью.
Хотя многие рассматривали таблицу Менделеева как ординарное явление в длинном ряду сомнительных гипотез, важнейшим достоинством ее является смелость научного предвидения. Прогресс, достигнутый в химии за прошедшее столетие, подтвердил правильность теории Менделеева. Менделеев утверждал, что будут открыты новые элементы, Для которых он специально оставил незаполненные клетки в таблице, и что атомные веса некоторых элементов, значения которых не отвечали требованиям системы, определены неточно.
Довольно скоро Менделеев получил доказательства своей правоты, когда в результате более точных определений были исправлены значения атомных весов церия, индия, титана, урана, итрия и некоторых других элементов. Если вес элемента заведомо не соответствовал требованиям таблицы, Менделеев смело исправлял его. Так он произвольно увеличил атомный вес урана вдвое — до 240. Сейчас мы знаем, что атомный вес урана действительно равен 238,04.
В другом, и более важном, случае Менделеев предсказал 3 новых элемента, которые были открыты и описаны в течение 16 лет после его знаменитого доклада перед собранием русских химиков.
Элементы, существование которых было предсказано Менделеевым, были первоначально названы им эка-алюминием, эка-бором и эка-кремнием (приставка «эка» означает на санскрите «за»). В дальнейшем они получили свои названия в честь стран, где жили открывшие их ученые. Эка-алюминий был получен в 1875 году французским химиком Полем Эмилем Лекоком де Буабодраном и был назван галлием, атомный вес — 69,72. Галлий занял место между алюминием и индием. Эка-бор, согласно предсказанию Менделеева, должен был иметь атомный вес, средний между кальцием и титаном, 40 и 48. Этот элемент был открыт в 1879 году шведским ученым Ларсом Фредериком Нильсеном. Окончательно атомный вес этого элемента был установлен в 1955 году. Третий элемент — эка-кремний — был открыт в 1886 году немецким химиком Клементом Александром Винклером, профессором химии Фрейбургской горной академии. Он был назван германием. Его свойства и атомный вес 72,59 совпали с предсказаниями Менделеева.
Дмитрий Иванович Менделеев был не только выдающимся химиком-теоретиком, но и прекрасным практиком. Он исследовал нефть бакинских месторождений и Пенсильванских промыслов США. Он занимался также изучением свойств парафинов, получаемых из бакинской нефти.
Уже после смерти Менделеева в 1907 году были открыты еще два элемента, существование которых было им предсказано. В 1925 году немецкие химики, супруги Вальтер и Ида Ноддак, получили рений, названный Менделеевым би-марганец. Рений — тяжелый серый металл, применяемый для изготовления термопар. Его атомный вес —186,20. Затем, через 70 лет после открытия Менделеева, в Париже, в Радиевом институте, Профессором Маргерит Перей был получен эка-цезий, названный францием. Атомный номер франция равен 87.
Венцом периодического закона является одно из самых выдающихся открытий прошлого века — открытие «инертного» газа аргона. Аргон был получен английским химиком Вильямом Рамсеем и лордом Релеем. Рамсей в частном письме в 1894 году сообщил Релею, что «в конце первого столбца периодической таблицы есть место для газообразного элемента». Оба химика официально заявили об открытии нового элемента позднее, при встрече в Оксфорде. Сейчас мы знаем, что аргон и подобные ему газы не являются инертными и могут вступать во взаимодействие с другими элементами. Отсутствие реакционной способности у инертных газов в обычных условиях не позволило Менделееву предсказать их существование. Спустя два года, в 1896 году, Рамсей в Англии и шведский химик Пер Теодор Клезе независимо друг от друга открыли гелий. Наличие гелия — название его происходит от греческого слова «солнце» — уже в течение нескольких лет обнаруживалось в солнечной атмосфере методом спектрального анализа. Исходя из периодического закона, Рамсей пришел к выводу, что должны существовать и другие инертные газы. И в самом деле, в 1898 году ему совместно с Теодором Траверсом удалось открыть еще три газа — неон, ксенон и криптон. Все эти элементы образовали нулевой столбец в периодической таблице.
В том же 1898 году Пьером Кюри и его женой Марией Склодовской было открыто явление радиоактивности. Это открытие поколебало одну из опор закона Менделеева — неизменность атома. Однако сам Менделеев не усмотрел противоречия между открытым им законом и наличием радиоактивных элементов.
Уже после смерти Менделеева, когда число радиоактивных элементов достигло 37, возникли опасения относительно дальнейшего использования периодической таблицы, поскольку в ней уже не было места для новых элементов.
В 1913 году, накануне первой мировой войны, английский физик Генри Мозли сделал важное уточнение, касающееся строения атомов элемента и его места в периодической таблице. Он исследовал спектры рентгеновского излучения пятидесяти одного элемента и пришел к выводу, что существует связь между атомным номером и частотой рентгеновского излучения, которое испускается элементом при воздействии на него катодных лучей; атомный номер элемента указывает на число электронов, вращающихся вокруг ядра атома. В результате работ этого выдающегося ученого — сам он погиб в 1915 году на войне — было заполнено еще 7 пустых клеток в периодической таблице. Помимо уже открытых рения и франция, были открыты технеций, гафний, астатин и протактиний. Открытие этих элементов, ставшее возможным благодаря достижениям технического прогресса, было невозможно при жизни Менделеева и, разумеется, не повлияло на первоначальное расположение элементов в таблице. Вскоре другой английский ученый Фредерик Содди ввел понятие изотопии — от греческого слова «занимающие одно и то же место». Изотопы одного элемента обладают совершенно одинаковыми химическими свойствами. Их физические свойства также совпадают, за исключением различий в весе или массе атома. Почти вся масса атома заключена в его ядре, состоящем из положительно заряженных протонов и нейтральных нейтронов. Отрицательно заряженное «облако» планетарных элементов состоит из частиц, имеющих массу примерно 1/1836 от массы протона. Содди пришел к выводу, что от типа радиоактивного распада атомов материнского элемента зависит место, которое займут в периодической таблице атомы дочерних элементов. К аналогичному выводу в том же 1913 году пришел и польский химик Казимир Фаянс.
В результате альфа-распада (распад с потерей альфа-частиц) происхоит сдвиг элемента в периодической таблице на две клетки влево, а в результате бета-распада — на одну клетку вправо.
В первоначальном расположении элементов, предложенном Менделеевым, существовали аномалии. В некоторых случаях более «тяжелые» элементы предшествовали более «легким». Так, теллур 127,6 был помещен впереди йода 126,9, кобальт 58,9 впереди никеля 58,7 и торий 232,0 впереди протактиния 231. После стандартизации атомных номеров стало ясно, что если расположить элементы в порядке возрастания заряда их ядер, то в этом случае их расположение точно отвечает предложенному Менделеевым. Именно так и читают нынешние студенты-химики таблицу Менделеева, которую справедливо уподобляют «карте на стене лаборатории».
Дополнительная информация
Дмитрий Менделеев: уроки пророка, «Курьер ЮНЕСКО», апрель-июнь 2019
Таблица Менделеева, «Курьер ЮНЕСКО», январь-март 2011
Дмитрий Менделеев, «Курьер ЮНЕСКО», июнь 1971
Юрий Оганесян: мы хотим узнать, где кончается таблица Менделеева
По мере того как мы продвигаемся ко все более тяжелым элементам, может (а скорее всего, и будет) меняться их химическое поведение. Произойдет это вследствие того, что по мере увеличения заряда ядра квадратично растет энергия вращающихся вокруг него электронов. Скорость наиболее близких к ядру так называемых К-электронов постепенно приближается к скорости света. И, согласно теории относительности, возникают так называемые релятивистские эффекты, ведущие к изменению электронной структуры атома. Изменяются также энергия связи, квантовые характеристики последнего электрона, который определяет химические свойства данного элемента.Возьмем самый тяжелый из ныне синтезированных элементов — 118-й. Согласно периодическому закону, он должен быть благородным газом. Но будет ли он таковым? Если окажется, что нет, то это будет означать конец периодичности или предел применимости этого закона. Тогда не исключено, что уже на 118-м элементе мы сможем увидеть его “выход” из своей клетки в таблице Менделеева.
Естественно, что последующие, более тяжелые элементы тем более будут вести себя не так, как предсказывает периодическая система. Поэтому мы остро озабочены этой проблемой. К сожалению, химические исследования известного нам изотопа 118-го элемента представляют большие трудности в силу его короткого времени жизни, составляющей около одной миллисекунды. Поэтому мы пытаемся получить другие, более долгоживущие изотопы 118-го элемента. Эти эксперименты уже начались.
— Как они идут?
— Наши американские коллеги смогли наработать в ядерном реакторе нужное количество более тяжелых изотопов 98-го элемента — калифорния с массой 250 и 251. Из смеси изотопов калифорния была впервые в мировой практике изготовлена мишень, которую доставили в Дубну. Мишень уже облучалась длительное время пучком ядер кальция-48.
Не входя в подробности, можно сказать, что по всем параметрам мы достигли запланированного уровня чувствительности эксперимента. По результатам этого полномасштабного облучения, после дополнительной доработки мишени, которая сейчас проводится в Ок-Риджской Национальной лаборатории, она вновь прибудет в Дубну в мае. Всю вторую половину этого года будет продолжено ее облучение пучком кальция-48.
Наряду с этим интерес и усилия теоретиков в настоящее время нацелены на расчеты электронной структуры 118-го элемента. Это уже начало исследований сверхтяжелых атомов.
— Сейчас в ОИЯИ идет строительство нового уникального экспериментального комплекса — “Фабрики сверхтяжелых элементов”. Как она поможет в ваших новых поисках?
— Все наши исследования, связанные с синтезом сверхтяжелых элементов, весьма трудоемки. Мы счастливы, когда в результате синтеза получаем один желанный атом в день. Мы чувствуем себя еще бодро, когда получаем один атом в неделю. 118-й элемент получался по одному атому в месяц!
Вместе с тем приобретенные знания о реакциях синтеза сверхтяжелых элементов и свойствах их радиоактивного распада, а также прогресс в смежных науках и новые возможности современной техники позволяют принципиально поднять эффективность нашей работы в сто раз! Эти возможности будут реализованы в “Фабрике сверхтяжелых элементов”.
Здание готово в такой степени, что в нем уже идет монтаж нового, более мощного ускорителя ДЦ-280. Мы планируем его пуск на конец нынешнего года.
Затем нам понадобится еще год, чтобы все проверить в работе, оттестировать аппаратуру, провести контрольные опыты, и тогда первый полноценный эксперимент мы сможем поставить уже в конце 2018 года.
— А какой эксперимент планируется на новой установке в качестве пилотного?
История Периодической таблицы
Развитие Периодической таблицы
Периодическая таблица Менделеева представляет собой систематическое расположение химических элементов, организованное на основе их электронных конфигураций.
Цели обучения
Обсудите происхождение и историю периодической таблицы Менделеева.
Основные выводы
Ключевые моменты
- Хотя работа алхимиков изначально была ошибочной попыткой превратить свинец в серебро и золото, их исследования заложили основу, которая помогла более позднему фундаментальному пониманию материи.
- Современная таблица Менделеева была разработана Дмитрием Менделеевым и представляет собой полезную основу для организации и анализа химического и физического поведения элементов.
- Обозначения в периодической таблице включают ссылки на атомную массу и атомный номер.
Ключевые термины
- протон : положительно заряженная субатомная частица, составляющая часть ядра атома и определяющая атомный номер элемента; ядро наиболее распространенного изотопа водорода, состоящее из двух верхних кварков и нижнего кварка.
- элемент : любое одно из простейших химических веществ, которое не может быть разложено в химической реакции или каким-либо химическим способом, состоящее из атомов, имеющих одинаковое количество протонов.
- алхимия : Древние поиски универсальной панацеи и философского камня. В конечном итоге этот процесс перерос в химию.
В современной периодической таблице известные элементы организованы несколькими способами: они перечислены в порядке атомного веса, электронной конфигурации, реакционной способности и электроотрицательности.Это настолько хороший метод организации и представления известных элементов, что его использовали для успешного прогнозирования существования определенных элементов. Сегодня его применяют не только химики, но и во всех смежных науках, чтобы понять свойства и реакционную способность атомов и молекул. Эта таблица известна своим происхождением из 17 века и основана на знаниях и опыте средневековья и более ранних эпох.
Краткая история Периодической таблицы – YouTube : От древнегреческих философов до Дмитрия Менделеева профессор Дэвис описывает, как человечество понимает элементы и как их каталогизировать с течением времени.
История Периодической таблицы
Атомная теория восходит к древнегреческим философам и философам эллинистического Египта. Они предположили, что все вещества состоят из фундаментальных строительных блоков; однако природа этих блоков была предметом ожесточенных споров.
Основные блоки были названы атомами, происходящими от греческого слова «атмосфера», что означает «неделимый». Ранняя атомная теория пыталась объяснить свойства материи, приписывая атомам атрибуты, которые могли бы соответствовать атрибутам различной материи, которую они объединяли в форму, например скользкость, текучесть, цвет и сплоченность.Философы классифицировали мир вокруг себя по свойствам и функциям – тип подхода, который позже привел к разработке периодической таблицы элементов.
В средние века практикующие алхимию стремились сделать золото и серебро из свинца. Хотя их усилия были напрасными, их исследование в конечном итоге привело к систематическому пониманию химического мира. Это также установило образ мышления, который дал нам периодическую таблицу элементов.
Алхимики находились под влиянием международной торговли, особенно вдоль Великого шелкового пути между Китаем и Европой.Химические знания распространились по культурам, и примерно к середине 18 века уже было 33 известных элемента. В начале XIX века Джозеф Пруст и другие экспериментально демонстрировали закон определенных пропорций. Это предоставило фундаментальное свидетельство того, что вещество существует в чистых соединениях, а не в смесях любых пропорций. Эти наблюдения укрепили атомную теорию и потребовали систематического метода организации элементов.
Обозначения в периодической таблице Менделеева : Обозначения в периодической таблице Менделеева включают ссылки на атомную массу и атомный номер.
Современный взгляд на Периодическую таблицу
Ученые начали замечать сходства и закономерности среди известных элементов, и большой исследовательский интерес XIX века заключался в разработке систематического метода их определения и классификации. Русский профессор химии Дмитрий Менделеев и немецкий химик Юлиус Мейер независимо друг от друга представили свои собственные версии таблицы Менделеева в 1869 и 1870 годах. В конечном итоге подход Менделеева был принят по нескольким причинам: во-первых, он оставил пробелы для элементов, которые еще не были обнаружены.При этом он предсказал элементы галлий и германий. Он также разместил атомы, основываясь в основном на их химических свойствах, а не на атомной массе. Как оказалось, организация по химическому семейству правильно сортирует большинство элементов по их атомным номерам; атомная масса не совсем коррелирует с атомным номером.
Периодическая таблица элементов : Современное представление периодической таблицы, показывающее организацию по атомному номеру и валентности. Обратите внимание, что атомные массы не включены в эту конкретную таблицу Менделеева, однако они обычно указываются под символом элемента.
Современная версия периодической таблицы Менделеева теперь содержит около 118 различных элементов. В периодической таблице число над символом элемента – это атомный номер, который представляет количество протонов в ядре. Атомная масса определяется суммой нейтронов и протонов.
Периоды с 1 по 3
Элементы одного периода имеют одинаковое количество электронных оболочек.
Цели обучения
Обсудите взаимосвязь между электронной структурой атома и его периодом (строкой) в периодической таблице.
Основные выводы
Ключевые моменты
- По мере того, как вы перемещаетесь через период (через таблицу вправо), электронные оболочки элементов в этот период заполняются, приближаясь к стабильной конфигурации благородного газа в конце этой строки.
- Для любого элемента в периодах 1, 2 и 3 элементы, расположенные непосредственно над и под ним, являются членами одной группы и имеют аналогичные химические свойства, основанные на аналогичном расположении валентных электронов.
- Принцип Ауфбау описывает, как электроны помещаются на орбитали в определенном порядке для заполнения.
Ключевые термины
- атом : Наименьшее возможное количество вещества, которое все еще сохраняет свою идентичность как химический элемент, который, как теперь известно, состоит из ядра, окруженного электронами.
- электрон : субатомная частица, имеющая отрицательный заряд и вращающаяся вокруг ядра; поток электронов в проводнике составляет электричество.
- электронная оболочка : Коллективные состояния всех электронов в атоме с одинаковым главным квантовым числом (визуализируются как орбита, по которой движутся электроны).
Ранние философы и ученые понимали, что материя состоит из атомов и что многие элементы реагируют друг с другом в предсказуемых пропорциях. Периодическая таблица была создана для того, чтобы организовать эти наблюдения и измерения. Возник принцип валентности, связанный с наличием или отсутствием электронов и энергией этих электронов в объеме вокруг ядра атома. Электроны, отрицательно заряженные субатомные частицы, определяют химическую реакционную способность атома.Электроны организованы в энергетические уровни или электронные оболочки, которые соответствуют периодам в периодической таблице.
Атом Бора
Нилс Бор предложил упрощенную картину атома с центральным ядром, окруженным электронами на определенных энергетических уровнях (n). Таблица Менделеева систематизирует уровни энергии в периодах, строках таблицы. Самые простые атомы, водород и гелий, находятся в строке 1 или первом периоде. Эти атомы имеют электроны, занимающие уровень энергии n = 1.Спускаясь вниз, строка 2 или период 2 содержит элементы от Li (литий) до Ne (неон). Элементы в периоде 2 полностью заполнены энергией уровня n = 1; они продолжают заполнять свои n = 2 уровня, перемещаясь по таблице вправо. Аналогичным образом, переходя на один период вниз к строке 3, появляются элементы от Na (натрий) до Ar (аргон). Атомы периода-3 имеют заполненные уровни n = 1 и n = 2; они заполняют уровень n = 3, перемещаясь по таблице.
Упрощенное изображение атомной структуры : С ядром в центре с положительным зарядом электроны «организованы» в энергетические уровни или оболочки на увеличивающихся расстояниях от ядра.Расстояние между оболочками n = 2 и n = 3 на этом рисунке – это разница в энергии между ними.
Важно помнить, что периодическая таблица представляет собой представление атомов с нулевым чистым зарядом; у них столько электронов вокруг ядра, сколько протонов в ядре.
Таблица Менделеева : Элементы расположены в соответствии с электронной конфигурацией с периодичностью по валентности.
Принцип Aufbau
На уровнях энергии n = 1, n = 2 и n = 3 электроны организованы в орбитали, обозначенные как s, p, d и f.Например, атомный номер Ne (неон) равен 10 и содержит 5 орбиталей (1s, 2s, 2p x , 2p y и 2p z ). На каждой полной орбитали есть 2 электрона, что в сумме дает 10 для уравновешивания положительного заряда, обеспечиваемого 10 протонами в ядре.
Заполненные орбитали атома неона : Изображение орбиталей и их симметрии для атома неона (Ne). Уровни 1s и 2s показаны сфероидами, а три орбитали 2p показаны как разделенные сфероиды.Каждая полная орбиталь имеет 2 электрона, что дает всего 10 для этого элемента.
В периодической таблице есть 2 электрона в периоде 1, в то время как периоды 2 и 3 имеют 8 электронов на заполненном уровне. Для атомов с атомными номерами менее 20 применяется правило октетов добавления электронов и заполнения орбиталей. Это просто означает, что уровни n = 2 и n = 3, в частности, заполнены, когда есть 8 электронов. Принцип Ауфбау описывает, как электроны помещаются на орбитали в определенном порядке для заполнения.
Принцип Ауфбау : Принцип Ауфбау описывает постепенное заполнение орбиталей и построение атомов с известными электронными конфигурациями.
Переходные металлы
Элементы d-блока широко известны как переходные металлы или переходные элементы.
Цели обучения
Определите отличительные и характерные свойства переходных металлов.
Основные выводы
Ключевые моменты
- Переходные металлы – это элементы в десяти средних группах четвертого, пятого, шестого и седьмого периодов периодической таблицы.
- Переходные металлы и их соединения могут проявлять цвет из-за внутренних переходов электронов d-d.
- Переходные металлы и их соединения могут проявлять ферромагнетизм, парамагнетизм и диамагнетизм.
- Переходные металлы и их соединения хорошо известны своей каталитической активностью.
Ключевые термины
- парамагнетик : проявляющий парамагнетизм; тенденция магнитных диполей выравниваться с внешним магнитным полем.
- Степень окисления : Состояние атома с определенной степенью окисления.
- диамагнитный : проявляющий диамагнетизм; отталкивается магнитом.
D-блок периодической таблицы
Переходные металлы также известны как переходные элементы или элементы d-блока. Как следует из названия, химический состав этой группы определяется степенью заполнения суборбитальных уровней d-электронов. Химическое сходство и периодичность можно легко увидеть по горизонтали через d-блок периодической таблицы.
D-блок периодической таблицы : D-блок состоит из групп 3-12 и периодов 4-7.
Однако химия далеко не проста, и есть много исключений из упорядоченного заполнения электронной оболочки. Принцип Ауфбау обеспечивает методическую основу для предсказания порядка, в котором большинство атомов будет заполнять свои электронные оболочки.
Принцип Ауфбау : Это иллюстрирует порядок, в котором большинство атомов заполняют свои электронные оболочки.
Химические свойства в периодической таблице сгруппированы по схожим химическим и физическим свойствам по вертикали. Например, металлы в группе 11 имеют схожие характеристики электропроводности, блеска, кристаллической структуры, пластичности и прочности на разрыв. При движении по горизонтали через периодическую таблицу наблюдаются тенденции таких свойств, как атомный радиус, электроотрицательность и сродство к электрону.
Характерные свойства переходных металлов
Переходные металлы, можно сказать, обладают следующими характеристиками, которые обычно не встречаются в основной группе периодической таблицы.В основном это связано с неполным заполнением электронных d-уровней:
- Образование соединений, цвет которых обусловлен d – d электронными переходами.
- Образование соединений во многих степенях окисления из-за относительно низкой реакционной способности неспаренных d электронов.
- Образование многих парамагнитных соединений из-за наличия непарных электронов. Некоторые соединения элементов основной группы также являются парамагнитными (например,г., оксид азота, кислород).
Переход лиганда с переносом заряда на металл (LMCT)
Цвет в соединениях металлов переходного ряда обычно возникает из-за электронных переходов двух основных типов переходов с переносом заряда. Электрон может перескакивать с орбитали, в которой преобладает лиганд, на орбиталь, в которой преобладает металл, что приводит к переходу с переносом заряда лиганда на металл (LMCT). Это наиболее легко может произойти, когда металл находится в высокой степени окисления. Например, цвет ионов хромата, дихромата и перманганата обусловлен переходами LMCT.Другой пример – йодид ртути (HgI 2 ) имеет красный цвет из-за перехода LMCT.
Комплексы с переносом заряда : I 2 • PPh 3 Комплексы с переносом заряда в CH 2 Cl 2 . Слева направо: (1) I 2 , растворенный в дихлорметане – нет комплекса CT. (2) Через несколько секунд после добавления избытка PPh 3 – формируется комплекс CT. (3) Через минуту после добавления избытка PPh 3 образовался комплекс CT [Ph 3 PI] + I – .(4) Сразу после добавления избытка I 2 , который содержит [Ph 3 PI] + [I 3 ] –.
Переход с переносом заряда металл-лиганд (MLCT) наиболее вероятен, когда металл находится в низкой степени окисления, а лиганд представляет собой легко восстанавливаемый переход d – d . Электрон перескакивает с одной d-орбитали на другую. В комплексах переходных металлов не все орбитали d имеют одинаковую энергию.
Парамагнитные и диамагнитные соединения
Соединения переходных металлов являются парамагнитными, если они имеют один или несколько неспаренных d электронов. Некоторые соединения диамагнитны. К ним относятся октаэдрические, низкоспиновые, d 6 и квадратно-плоские d 8 комплексы. В этих случаях расщепление кристаллического поля таково, что все электроны спарены. Ферромагнетизм возникает, когда отдельные атомы парамагнитны, а векторы спина выровнены параллельно друг другу в кристаллическом материале.Металлическое железо и сплав альнико являются примерами ферромагнитных материалов, содержащих переходные металлы. Антиферромагнетизм – еще один пример магнитного свойства, возникающего из-за определенного выравнивания отдельных спинов в твердом состоянии.
Переходные металлы и их соединения известны своей гомогенной и гетерогенной каталитической активностью. Эта активность объясняется их способностью принимать несколько степеней окисления и образовывать комплексы.
Нижняя часть периодической таблицы
Периодическая таблица Менделеева в настоящее время содержит 7 периодов, но теоретики предсказывают, что могут существовать два дополнительных периода.
Цели обучения
Определите ключевые характеристики элементов f-блока.
Основные выводы
Ключевые моменты
- Ряды лантанидов и актинидов получают свойства от электронов f-блока.
- Четыре элемента в ряду актинидов встречаются в природе, пять изотопов других иногда образуются при распаде урана, в то время как остальные трансурановые соединения были произведены синтетическим путем.
- Наибольший атомный номер, синтезированный на сегодняшний день, составляет 118, элемент унунокций (Uuo).
Ключевые термины
- лантаноид : Любой из 14 редкоземельных элементов от лантана до лютеция в периодической таблице. Поскольку их внешние орбитали пусты, у них очень похожий химический состав. Под ними – актиниды.
- актинид : Любой из 14 радиоактивных элементов периодической таблицы, которые расположены под лантаноидами, с которыми они имеют схожий химический состав.
- трансуран : трансурановый.Трансурановый элемент – это любой синтетический элемент, атомный номер которого больше, чем у урана (92).
Есть несколько способов подойти к этой конкретной теме, и все они относятся к тому, как представлены элементы в самой таблице.
Самое классическое представление таблицы Менделеева показывает взаимное расположение известных элементов в таблице. Сама таблица состоит из 7 периодов и 18 групп, из которых самым последним известным элементом является номер 118, ununoctium.Однако в таблице наблюдается явный разрыв. В строке 6, столбце 3, пустое пространство появляется между Ba и Hf. Атомный номер, который должен быть здесь, 57, находится внизу таблицы в строке, называемой лантаноидами. Непосредственно под пространством в строке 6 в строке 7 находится еще одно пустое пространство, которое заполнено строкой, называемой актинидами, также видимой в нижней части диаграммы.
Периодическая таблица : это стандартное представление элементов в таблице с относительным расположением, знакомым химикам и физикам.
Расширение измерений Периодической таблицы
Увеличивая горизонтальные размеры стола, ряды актинидов и лантаноидов могут быть размещены в их правильных относительных положениях. Поскольку химический состав этой группы основан в основном на электронах f-оболочки и взаимодействиях на этом уровне энергии, это называется f-блоком. Это неуклюжее представление правильно показывает элементы, известные на сегодняшний день, вплоть до z = 118, unonoctium. Фактически, это представление является предсказательным, поскольку оно показывает химические семейства (группы) и периодичности (периоды) в их правильных относительных положениях.
Расширенная таблица Менделеева : лантаноиды и актиниды добавляются в виде отдельных, но связанных строк, образуя так называемый f-блок.
Продолжая расширение периодической таблицы, рассмотрим элемент с атомным номером 92 в ряду актинидов, называемый ураном. Когда в конце 19 века были обнаружены элементы этого диапазона атомных номеров, изотопы урана были самыми крупными и тяжелыми элементами, известными в природе. В 1934 году Энрико Ферми предсказал существование трансурановых, , элементов – элементов с атомным номером (z) больше или равным 93.В 1934 году было известно только 4 актинида, все меньше урана, поэтому не было известно, образуют ли они период или семейство, подобное лантаноидам. Первый трансурановый элемент, Np (нептуний), был синтетически произведен в 1940 году путем бомбардировки урана медленными нейтронами. В течение следующих двух десятилетий было произведено очень много изотопов актинидов, как правило, путем бомбардировки другими атомами или субатомными частицами. Актиниды добавляли вместе с лантаноидами.
Два новых периода
Используя предсказательные свойства периодической таблицы, наряду с растущим опытом в атомной и субатомной теории, были предсказаны два совершенно новых периода.По совету Гленна Сиборга и других, периоды 8 и 9 были добавлены в таблицу Менделеева, включая g-блок. Расположение g-блока в таблице (слева от f-блока, справа или между ними) является предположительным. Позиции в таблице соответствуют предположению, что правило Маделунга (что орбитали с более низким значением суммы квантовых чисел n и l будут заполнены раньше, чем орбитали с более высокими значениями n + l) будет продолжать выполняться для более высоких атомных номеров. В элементе 118 предполагается, что заполнены орбитали 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 5f, 6s, 6p, 6d, 7s и 7p, с незаполненными оставшимися орбиталями.Орбитали восьмого периода будут заполнены в порядке 8s, 5g, 6f, 7d, 8p. Однако после элемента 120 близость электронных оболочек делает проблематичным размещение в простом столе.
Расширенная периодическая таблица с предсказанными периодами 8 и 9 : Периодическая таблица со всеми группами и периодами. Размещение неоткрытого G-блока является спекулятивным.
Существование элементов с такими высокими атомными номерами является спекулятивным, и ожидается, что изотопы будут иметь очень короткие периоды полураспада.Различные эксперты предсказывают, что z = приблизительно 130 является максимумом, в то время как другие считают, что эффективного верхнего предела нет. Эксперименты по синтезу трансурановых элементов продолжаются.
Положение таблицы Менделеева и электронная конфигурация
Положение элементов в периодической таблице напрямую связано с их электронной конфигурацией.
Цели обучения
Используйте периодическую таблицу для определения свойств атомов, таких как группы и электронные конфигурации.
Основные выводы
Ключевые моменты
- Элементы организованы по периодам и группам, причем период соответствует основному уровню энергии, а группа – степени заполнения подоболочек.
- Свойства атома напрямую связаны с количеством электронов на различных орбиталях, и периодическая таблица очень похожа на дорожную карту для этих орбиталей, так что химические свойства могут быть выведены по положению элемента на таблице.
- Электроны во внешней или валентной оболочке особенно важны, потому что они могут участвовать в совместном использовании и обмене, который отвечает за химические реакции.
Ключевые термины
- квантовое число : Одно из определенных целых или полуцелых чисел, определяющих состояние квантово-механической системы (например, электрона в атоме).
- орбиталь : Спецификация энергии и плотности вероятности электрона в любой точке атома или молекулы.
- электронная оболочка : Коллективные состояния всех электронов в атоме с одинаковым главным квантовым числом (визуализируются как орбита, по которой движутся электроны).
Основные деления периодической таблицы
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Элементы представлены в возрастающем атомном номере. Основная часть таблицы представляет собой сетку 18 × 7.Элементы с одинаковым числом валентных электронов хранятся вместе в группах, таких как галогены и благородные газы. Есть четыре различных прямоугольных области или блока. F-блок обычно не включается в основную таблицу, а размещается ниже, поскольку встроенный f-блок часто делает таблицу непрактично широкой. Используя периодические тенденции, таблица Менделеева может помочь предсказать свойства различных элементов и отношения между свойствами. Таким образом, он обеспечивает полезную основу для анализа химического поведения и широко используется в химии и других науках.
Атомные орбитали
Электроны в частично заполненной самой внешней оболочке (или оболочках) определяют химические свойства атома; ее называют валентной оболочкой. Каждая оболочка состоит из одной или нескольких подоболочек, а каждая подоболочка состоит из одной или нескольких атомных орбиталей.
Свойства атома зависят в конечном итоге от числа электронов на различных орбиталях и от заряда ядра, который определяет компактность орбиталей. Чтобы связать свойства элементов с их расположением в периодической таблице, часто удобно использовать упрощенный вид атома, в котором ядро окружено одной или несколькими концентрическими сферическими «оболочками», каждая из которых состоит из орбиталей с наивысшим главным квантовым числом, содержащих по крайней мере один электрон; это s- и p-орбитали и могут включать d- или f-орбитали, которые зависят от атома.Модель оболочки, как и любая научная модель, – это не столько описание мира, сколько упрощенный взгляд на него, который помогает нам понимать и соотносить различные явления.
Мы рассмотрим несколько визуализаций таблицы Менделеева. Однако сначала было бы поучительно посмотреть, как это устроено с логической точки зрения. Сегодняшняя таблица является результатом более чем 100-летних усилий по наблюдениям, измерениям, предсказаниям и доказательству взаимосвязи химических и физических явлений с конфигурациями и зарядами электронов.
Периоды 1, 2 и 3
Начиная с простых элементов, первые три строки периодической таблицы, называемые периодами 1, 2 и 3, соответствуют уровням n = 1, n = 2 и n = 3.
Конфигурации электронных оболочек первых 18 элементов : Конфигурации электронных оболочек первых 18 элементов периодической таблицы. Соответствующие уровни энергии (n) указаны зелеными цифрами слева. Число электронов внешней оболочки представлено крайней правой цифрой в номерах групп.
Водород имеет 1 электрон на уровне 1s, а справа, гелий в Группе 18, имеет 2 электрона на уровне 1s, полностью заполненная оболочка, правило дуэта. Гелий – первый из благородных газов. Переходя к периоду 2, литий является первым элементом в строке с заполненной конфигурацией единиц. В течение периода сначала заполняются 2s, а затем 2p орбитали, достигая конфигурации для неона, следуя правилу октетов. Период 3 следует аналогичной схеме. Обратите внимание, что количество электронов внешней оболочки является основным фактором, определяющим валентность элемента.
Конфигурации электронных оболочек элементов : Положение в периодической таблице на основе конфигурации электронных оболочек. На этом изображении показана вся таблица Менделеева с диаграммами атомов и электронных оболочек, заполняемых движением по таблице. На этом изображении численно показана электронная конфигурация, показывающая населенность электронов в каждой подоболочке, начиная каждый период с полностью заполненного благородного газа.
Периодическая таблица с отображением электронных оболочек : Элементы в этой таблице расположены в стандартной конфигурации периодов и групп.Каждый блок включает представление структуры электронной оболочки элемента.
Электронная конфигурация катионов и анионов
Элементы периодической таблицы демонстрируют разные уровни реактивности в зависимости от количества электронов в их оболочках с наивысшей энергией.
Цели обучения
Предсказать, подвергнется ли атом ионизации с образованием аниона или катиона, на основе его электронной конфигурации валентной оболочки.
Основные выводы
Ключевые моменты
- Электронная конфигурация многих ионов аналогична наиболее близкому к ним благородному газу в периодической таблице.
- Анион – это ион, который приобрел один или несколько электронов и приобрел отрицательный заряд.
- Катион – это ион, который потерял один или несколько электронов и приобрел положительный заряд.
Ключевые термины
- анион : отрицательно заряженный ион, в отличие от катиона
- ионизация : любой процесс, который приводит к диссоциации нейтрального атома или молекулы на заряженные частицы (ионы).
- катион : положительно заряженный ион, в отличие от аниона.
Катионы и анионы образуются из нейтральных атомов
Каждый атом в основном состоянии незаряжен. В соответствии с его атомным номером, он имеет такое же количество протонов и электронов. Однако электроны довольно лабильны, и атом часто приобретает или теряет их в зависимости от своей электроотрицательности. Движущей силой для такого увеличения или уменьшения количества электронов является энергетически оптимальное состояние наличия полной валентной (самой внешней) оболочки электронов. В таком состоянии образующийся заряженный атом имеет электронную конфигурацию благородного газа.
Добавление электрона нарушит протонно-электронный баланс и оставит атом с отрицательным зарядом. Удаление электрона, наоборот, оставит атом положительно заряженным. Эти заряженные атомы известны как иона .
Образование одноатомных ионов
Одноатомные ионы образуются путем добавления или удаления электронов из валентной оболочки атома. Внутренние оболочки атома заполнены электронами, которые прочно связаны с положительно заряженным атомным ядром и поэтому не участвуют в таком химическом взаимодействии, но валентная оболочка может быть очень реактивной в зависимости от атома и его электронной конфигурации.Процесс получения или потери электронов нейтральным атомом или молекулой называется ионизацией .
Атомы можно ионизировать путем бомбардировки излучением, но более чисто химический процесс ионизации – это перенос электронов между атомами или молекулами. Этот перенос осуществляется за счет стабилизации, которая достигается за счет получения стабильных (полностью покрытых оболочкой) электронных конфигураций. Атомы будут получать или терять электроны в зависимости от того, какое действие требует наименьшей энергии.
Например, элемент натрия группы 1 (Na) имеет один электрон в валентной оболочке с полными оболочками из 2 и 8 электронов под ним.Удаление этого одного электрона делает натрий стабильным: его внешняя оболочка теперь содержит восемь электронов, что придает натрию электронную конфигурацию неона. Получив положительный заряд, ион натрия называется катионом . Ионизацию натрия можно проиллюстрировать химически следующим образом:
Na → Na + + е –
Натрий может получать электроны, но для достижения полной валентной оболочки потребуется еще семь. Удалить один электрон намного проще, чем получить семь, и поэтому натрий в каждом химическом сценарии достигнет своего октета, превратившись в катион.
С другой стороны, атом хлора (Cl) имеет семь электронов в валентной оболочке, что на один меньше стабильной полной оболочки с 8 электронами. Таким образом, атом хлора стремится к , получить дополнительных электронов и достичь стабильной 8-электронной конфигурации (такой же, как у аргона), становясь в процессе отрицательным анионом хлорида :
Cl + e− → Cl –
Сочетая склонность натрия терять электрон и хлорида приобретать электрон, мы наблюдаем дополнительную реакционную способность.При объединении незаряженные атомы могут обмениваться электронами и при этом достигать полных валентных оболочек. Образующиеся ионы слипаются за счет ионных связей (притягиваются противоположные заряды), образуя структуру кристаллической решетки NaCl, более известную как каменная соль. Реакция следующая:
Na + + Cl – → NaCl
Многоатомные и молекулярные ионы
Ионизация не ограничивается отдельными атомами; также могут образовываться многоатомные ионы. Многоатомные и молекулярные ионы часто создаются добавлением или удалением элементарных ионов, таких как H + , в нейтральных молекулах.Например, когда аммиак NH 3 принимает протон H + , он образует ион аммония NH 4 + . Аммиак и аммоний имеют одинаковое количество электронов в одной и той же электронной конфигурации, но у аммония есть дополнительный протон (H + ), который дает ему чистый положительный заряд.
Химическое обозначение
При написании химической формулы иона его суммарный заряд записывается в верхнем индексе сразу после химической структуры молекулы или атома.Чистый заряд записывается с величиной перед знаком , то есть двухзарядный катион обозначается как 2 + вместо +2 . Однако величина заряда не указана для однозарядных молекул или атомов; например, катион натрия обозначается как Na + и , а не как Na 1+ .
Альтернативный способ показать молекулу или атом с несколькими зарядами – это нарисовать знаки несколько раз; это часто наблюдается с переходными металлами.Химики иногда обводят знак; это просто орнамент и не меняет химического значения. Дважды положительно заряженный атом железа также может быть выражен как Fe 2+ или Fe ++ .
В случае переходных металлов степени окисления могут быть указаны римскими цифрами; например, Fe 2+ иногда называют Fe (II) или Fe II . Римская цифра обозначает формальную степень окисления элемента , тогда как цифры с надстрочным индексом обозначают чистый заряд.Таким образом, эти два обозначения можно заменить на одноатомные ионы, но римские цифры не могут применяться к многоатомным ионам. Однако можно смешивать обозначения для отдельного металлического центра с многоатомным комплексом, как показано на примере уранил-иона (UO 2 ).
Следует отметить, что из атома можно удалить много электронов. Энергия, необходимая для этого, может быть записана на диаграмме последовательной энергии ионизации.
Первая энергия ионизации : Периодические тенденции для энергии ионизации (IE) vs.атомный номер: обратите внимание, что в каждом из семи периодов IE (цветные кружки) элемента начинается с минимума для первого столбца Периодической таблицы (щелочные металлы) и увеличивается до максимума для последнего столбца (благородный газы), которые обозначены вертикальными линиями и помечены символом элемента благородного газа, а также служат линиями, разделяющими 7 периодов. Обратите внимание, что максимальная энергия ионизации для каждой строки уменьшается по мере перехода от строки 1 к строке 7 в данном столбце из-за увеличения расстояния внешней электронной оболочки от ядра по мере добавления внутренних оболочек.
Когда была изобретена Периодическая таблица?
© JacobH / iStock.comПериодическая таблица Менделеева была изобретена русским химиком Дмитрием Менделеевым в 1869 году. Однако до Менделеева химики десятилетиями размышляли о том, как классифицировать элементы. Начиная с 1789 года Антуан Лавуазье начал классифицировать элементы по их свойствам. Иоганн Вольфганг Доберейнер показал в 1817 году, что элементы могут быть организованы по их атомному весу в триады, так что, например, стронций имеет атомный вес между кальцием и барием.
В 1862 году французский геолог Александр-Эмиль-Бегайе де Шанкуртуа предложил периодическую таблицу элементов, в которой атомный вес элементов можно было бы нанести на цилиндр с окружностью 16 единиц – атомный вес кислорода. Атомные веса использовались английским химиком Джоном Ньюлендсом в 1864 году при классификации элементов. Расставив элементы по атомному весу, Ньюлендс заметил, что каждый восьмой элемент, похоже, имеет схожие химические свойства. По аналогии с семизначной музыкальной шкалой он назвал это законом октав.
Менделеев опирался на эту работу, располагая элементы в соответствии с атомным весом и их свойствами, но он также уделял особое внимание валентности элемента (количеству одинарных связей, которые элемент может образовывать). Его таблица 1869 года содержала 17 столбцов (или групп, как они теперь называются). Он переработал это в таблицу из восьми групп в 1871 году. В своей таблице 1871 года Менделеев правильно предсказал, что известные тогда атомные веса 17 элементов были неправильными. Он также предсказал существование трех тогда неизвестных элементов, скандия, галлия и германия, и их свойства, основываясь на пробелах в его таблице.В таблице Менделеева элементы не располагались в порядке возрастания атомного веса в зависимости от их свойств. Только в начале 20 века было обнаружено, что положение элемента в периодической таблице определяется его атомным номером (количеством протонов в его атомном ядре).
Философский камень – Bubble Haven
Станьте одним из немногих людей на Земле, которые обладают всеми стабильными элементами UNIVERSE в своем офисе или в классе.
Самые узнаваемые элементы Земли , все для исследования. Познакомьтесь с химическими элементами науки с помощью нашей современной 3D таблицы Менделеева.
✔ Периодическая таблица – это удивительная коллекция из 83 НАСТОЯЩИХ образцов, составляющих нашу вселенную ✔ Незаменимый подарок любителям химии и искушенным коллекционерам ✔ Ваши коллеги, друзья и семья поражаются каждый раз, когда они смотрят на 83 увлекательных элемента. ✔ Золото, Серебро, Платина, Уран, Все благородные газы, Редкоземельные металлы ✔ Наш новый процесс делает все включенные элементы безопасными для хранения и использования
Отлично подходит для размещения на столах и полках.Он идеально подходит для украшения дома, офиса или школьного класса . Прекрасный подарок для студентов, учителей и профессионалов.
Специально разработан для студентов, преподавателей, а также для специалистов различных инженерных и научных отраслей. Он идеально подходит для обучения и вдохновения.
* В магазинах не продается *
О продукте:
✔️Ручная работа
✔️150 x 114 x 20 мм “
✔️83 Настоящие элементы, отлитые из кристально чистого акрила
Водород, гелий, литий, бериллий, бор, углерод, азот, кислород, фтор, неон, натрий, магний, алюминий, кремний, фосфор, сера, хлор, аргон, калий, кальций, скандий, титан, ванадий, хром, марганец , Железо, кобальт, никель, медь, цинк, галлий, германий, мышьяк, селен, бром, криптон, рубидий, стронций, иттрий, цирконий, ниобий, молибден, рутений, родий, палладий, серебро, кадмий, индий, олово, сурьма , Теллур, йод, ксенон, цезий, барий, гафний, тантал, вольфрам, рений, осмий, иридий, платина, золото, ртуть, таллий, свинец, висмут, лантан, церий, празеодим, неодим, самарий, европий, гадолиний, тербий , Диспрозий, гольмий, эрбий, тулий, иттербий и лютеций.
Элементы, не перечисленные выше, исключены из-за редкости и радиоактивности, однако вы все равно можете найти подробную информацию об этих элементах, например их атомные номера.
Взгляд на первую опубликованную таблицу Менделеева
Гостевая статья Мелинды Болдуин
Мелинда Болдуин – историк науки и старший редактор Physics Today , ведущего ежемесячного журнала Американского института физики.Эта статья впервые появилась в журнале Physics Today.
***
В этом году исполняется 150 лет первой периодической таблице элементов, которая, возможно, является самым известным научным изображением в мире. В классах естественных наук по всему миру висят плакаты с периодической таблицей. Вы можете купить кофейные кружки, наволочки, даже купальники, украшенные столиком. Ни одно из этих изображений не очень похоже на первую таблицу Менделеева, опубликованную в 1869 году. Копия учебника с этой исходной таблицей хранится в Библиотеке и архивах Нильса Бора в Колледж-Парке, штат Мэриленд.(Библиотека является частью Американского института физики, который издает Physics Today .)
Периодическая таблица Менделеева была создана русским химиком Дмитрием Менделеевым, в то время профессором Санкт-Петербургского университета. В октябре 1867 года Менделеев начал читать большой университетский курс общей химии. Ему быстро понадобился учебник. Как пишет историк науки Майкл Гордин в книге A Well-Ordered Thing: Дмитрий Менделеев и тень Периодической таблицы (см. Обзор в Physics Today, июнь 2005 г., стр. 60), большинство русскоязычных учебников химии были переводами западных Европейские.Однако в 1860-х годах химия была быстро развивающейся областью, и к тому времени, когда книгу можно было перевести с немецкого на русский, ее наука уже устарела.
Менделеев решил решить проблему, написав собственный учебник русского языка. Он подписал контракт, обещавший своим издателям два тома к 1869 году. Первый том Менделеева Принципы химии был представлен точно по графику в конце 1868 года. Но когда в январе 1869 года он сел писать второй том, Менделеев понял, что у него есть проблема. .Из 63 известных химических элементов только 8 – углерод, водород, кислород, азот, хлор, фтор, бром и йод – были охвачены в томе 1. Как бы он обсудил химические свойства других 55 элементов в оставшемся томе ?
Его решением, пишет Гордин, была периодическая система элементов. Менделеев знал, что определенные подмножества элементов, включая щелочные металлы и галогены, обладают сходными свойствами, включая отношения, в которых они образуют соединения с кислородом.Он начал систематизировать известные элементы по их атомному весу и химическим свойствам. Химики недавно стандартизировали ранее хаотическую систему атомных весов, определив атомный вес элемента в соответствии с законом Авогадро, который гласит, что равные объемы газов при одинаковой температуре и давлении содержат равное количество молекул. Атомный вес водорода был установлен равным 1, а все остальные атомные веса рассчитывались как отношение массы элемента к массе водорода.
Конечным результатом стала таблица из шести столбцов, в которой элементы перечислены в порядке возрастания атомного веса. Менделеев расположил его так, чтобы элементы с похожими химическими свойствами располагались в одном ряду (в отличие от современной периодической таблицы, в которой группы элементов находятся в одном столбце). Поскольку в то время не существовало известных элементов с атомным весом 45, 68, 70 и 180, Менделеев вставил вместо них вопросительные знаки.
Сначала Менделеев не думал об этих заполнителях как о явных предсказаниях неизвестных элементов; они были просто способом сделать его обучающий инструмент функциональным.Но чем больше он думал о значениях своей таблицы, тем больше он убеждался в том, что он открыл естественный закон, предсказывающий химические свойства элемента на основе атомного веса, и что открытие этих неизвестных элементов подтвердит важность его системы. . Более поздние итерации таблицы отбрасывали предсказанный элемент с атомным весом 180, оставляя три пропущенных элемента. Менделеев назвал их эка-бором (атомный вес 44), эка-алюминием (68) и эка-кремнием (72), назвав их в честь элементов, с которыми, как он думал, они будут иметь общие химические свойства.
Первое подтверждение системы Менделеева произошло в 1875 году, когда Поль-Эмиль Лекок де Буабодран открыл галлий – новый элемент с атомной массой 69,7, который образовывал оксиды в том же соотношении, что и алюминий. Открытие скандия (атомный вес 44,96) в 1879 году и германия (атомный вес 72,63) в 1886 году еще раз подтвердило силу и проницательность таблицы Менделеева.
Периодическая таблица наследия– Инженерные лаборатории
Патент № D893,619
Ссылка на наш патент
✔️ Сделано в США (остерегайтесь мошеннических веб-сайтов и фальшивых подделок)
✔️4.5 дюймов x 6,0 дюймов x 1,0 дюймов
✔️83 Настоящие элементы, отлитые из кристально чистого акрила
✔️Сертификат подлинности включен
✔️Мешок из микроволокна в комплекте
✔️Сделает лучший научный подарок!
✔️Бесплатная доставка по США
Представляем первую в мире портативную Периодическую таблицу с фактическими элементами в ней! За последний год мы успешно собрали все стабильные элементы. После значительных исследований и разработок мы наконец разработали метод встраивания каждого элемента в акрил, и мы должны сказать, что результат потрясающий!
Периодическая таблица наследия говорит сама за себя.Коллекция отлично смотрится на столе, в ваших руках и где угодно еще
Что отличает нас
Есть бесчисленное множество китайских подделок наших периодических таблиц, но они очень низкого качества. Большинство этих подделок периодической таблицы не содержат реальных элементов, что, пожалуй, является самой важной особенностью дисплея! Превосходная оптическая четкость, тщательное размещение элементов в произведении искусства и настоящие, чистые элементы – вот что нас отличает.Это самая качественная и самая полная коллекция элементов на рынке. Мы производим наши периодические таблицы здесь, в США, с использованием акрила Lucite, который не желтеет со временем и является наиболее оптически прозрачным акрилом. Это идеальный подарок для любителя науки или химии в вашей жизни. Получите свой сегодня!
Технические характеристики и детали
Периодическая таблица наследия имеет размеры приблизительно 114 мм x 152,4 мм x 25,4 мм. Коллекция содержит 83 отдельных образца элементов.Технеций, как и прометий, был исключен из коллекции из-за его редкости и радиоактивности. За исключением урана и тория, элементы с 84 (полоний) по 118 (Оганессон) также были исключены (по понятным причинам).
Хотя некоторые элементы в Периодической таблице являются опасными, с коллекцией безопасно обращаться и хранить.
Чтобы получить правильные размеры для Периодической таблицы, элементы ломаются, режутся, обрабатываются, расплавляются или разбиваются молотком. Размер образцов элементов обычно не превышает 5 мм в любом направлении.
Периодическая таблица Heritage содержит чистые пузырьки газообразных элементов (ксенон, криптон, аргон, неон, гелий, кислород, азот и водород).
* Международные покупатели несут ответственность за уплату таможенных пошлин / налогов в своих странах.
Скидки на дефекты
У нас часто есть периодические таблицы, в которых выборка одного элемента отсутствует или немного выходит за пределы квадрата. Мы продаем их со скидкой в разделе «Товары со скидкой» на сайте.Вы можете использовать код скидки DEFECT98 на кассе, чтобы получить небольшую таблицу Менделеева с небольшим дефектом. Или, если вы предпочитаете видеть конкретные дефекты, которые у нас есть, щелкните эту ссылку: https://engineeredlabs.com/collections/discounted-items
Плакат с самой старой таблицей Менделеева в мире появился на складе в Шотландии
Периодическая таблица элементов – знакомое зрелище для любого, кто когда-либо сидел в классе химии – и, по-видимому, так было уже почти 150 лет.
Консерваторы в университете Св.Эндрюс из Шотландии объявил об открытии того, что, по их словам, является старейшим в мире сохранившимся образцом периодической таблицы элементов в классе, датируемой 1885 годом.
Старый школьный плакат, напечатанный на немецком языке на льняной бумаге, был обнаружен в 2014 году, когда сотрудники из университетской школы химии убирали свои складские помещения, согласно пресс-релизу университета. Среди беспорядка устаревшего лабораторного оборудования и флаконов с химическими веществами сотрудники обнаружили старый тайник с огромными свернутыми учебными таблицами.
Один из свитков содержал вышеупомянутую таблицу Менделеева – чернилами на бумаге, настолько старой, что она начала крошиться от прикосновения.
Школьные записи показали, что диаграмма была куплена в Вене профессором химии Сент-Эндрюс в 1888 году, и стол, вероятно, висел в его классе до его выхода на пенсию в 1909 году. Исследователи смогли еще больше сузить дату печати плаката, просмотрев элементы, представленные (и те, что не указаны) на диаграмме. Например, «присутствуют и галлий, и скандий, открытые в 1875 и 1879 годах соответственно, а германий, открытый в 1886 году, – нет», – говорится в пресс-релизе.
По данным университета, эта таблица кажется единственной сохранившейся в Европе того периода.
В любом случае, старая диаграмма тесно связана с концепцией самой таблицы Менделеева. Русский химик Дмитрий Менделеев разработал первую в мире таблицу Менделеева, когда после нескольких дней работы и яркой мечты он упорядочил известные элементы в соответствии с их атомной массой и способностью связываться с другими элементами. Менделеев представил свои открытия Русскому химическому обществу в 1869 году, и вскоре после этого были опубликованы первые периодические таблицы.
По словам профессора Дэвида О’Хагана, бывшего главы химического факультета Университета Сент-Эндрюс, «замечательная» таблица будет доступна для исследований в университете и будет выставлена на всеобщее обозрение в конце этого года.
«У нас запланирован ряд мероприятий на 2019 год, который был объявлен [] международным годом периодической таблицы Менделеева ООН, чтобы совпасть со 150-летием создания таблицы Дмитрием Менделеевым», – сказал О’Хаган. в заявлении.
Первоначально опубликовано на Live Science .
Разработка периодической таблицы Менделеева – Science Learning Hub
Хотя такие элементы, как золото, серебро, олово, медь, свинец и ртуть были известны с давних времен, первое научное открытие элемента произошло около 1669 года. Хенниг Бранд, немец Алхимик обработал мочу с помощью ряда процессов, в результате которых был получен элемент фосфор.
За следующие 200 лет было получено много знаний об элементах и соединениях.К середине 19 века было открыто около 60 элементов.
Ученые начали распознавать закономерности в свойствах этих элементов и приступили к разработке схем классификации.
1862
Французский геолог Александр-Эмиль Бегуйе де Шанкуртуа нанес атомный вес элементов на бумажную ленту и намотал их спиралевидно вокруг цилиндра. Дизайн поместил аналогичные элементы в соответствующие точки друг над другом. Он назвал свою модель теллурической спиралью или винтом.
1864
Английский химик Джон Ньюлендс заметил, что если элементы расположены в порядке их атомного веса, то периодическое сходство будет наблюдаться через каждые 7 элементов. Он предложил свой «закон октав» – аналог октав в музыке. Благородные газы еще не были открыты, поэтому таблица Ньюленда имела периодичность 7, а не 8.
1868
Лотар Мейер составил периодическую таблицу из 56 элементов, основанную на регулярной повторяющейся схеме физических свойств, таких как молярный объем.И снова элементы были расположены в порядке возрастания атомного веса. (Работа Мейера не была опубликована до 1870 года.)
1869
Русский химик Дмитрий Менделеев создал периодическую таблицу, основанную на атомных весах, но организованную «периодически». Элементы с похожими свойствами оказались друг под другом. Были оставлены пробелы для еще не обнаруженных элементов.
Природа науки
Наука – это смесь логики и воображения. Менделеев продемонстрировал эти атрибуты при разработке периодической таблицы элементов.
1894
Уильям Рамзи открыл благородные газы и понял, что они представляют новую группу в периодической таблице. Благородные газы еще раз подтвердили точность таблицы Менделеева.
1913
Генри Мозли определил атомный номер каждого из известных элементов. Он понял, что, если элементы расположены в порядке возрастания атомного номера, а не атомного веса, они лучше вписываются в «периодическую таблицу».
1928
Французский ученый-любитель Шарль Жане использует математические модели для исследования электронной конфигурации элементов.Он группирует элементы в блоки, названные в честь их атомных орбиталей: s-блок (острый), p-блок (главный), d-блок (диффузный) и f-блок (основной).
1944
Гленн Сиборг предложил «гипотезу актинидов» и опубликовал свою версию таблицы в 1945 году. Ряды лантанидов и актинидов образуют две строки под периодической таблицей элементов.
Периодическая таблица Менделеева сегодня
В большинстве школьных научных лабораторий есть копия таблицы Менделеева, прикрепленная где-нибудь к стене.
При внимательном рассмотрении таблицы видно следующее распределение типов элементов.
Большинство элементов – металлы. Металлоиды – это элементы, которые обладают некоторыми физическими свойствами металлов, но некоторыми химическими свойствами неметаллов. Сурьма, например, проводит электричество, но по химическому составу напоминает неметаллический фосфор.
Ученые постоянно работают над открытием новых материалов и дальнейшим исследованием свойств существующих элементов.Периодическую таблицу можно просматривать и добавлять новые элементы, но только после тщательного научного исследования. Международный союз теоретической и прикладной химии (IUPAC) проверяет добавление новых элементов, и в конце 2015 года был завершен 7-й период Периодической таблицы элементов.
Сопутствующие материалы
Просмотр Te taka pūmotu – Периодическая таблица элементов. В нем перечислены атомный номер (tua iraho), атомная масса (tau karihi), символ элемента (tohu), английские имена (kupu ingarihi) и имена маори (kupu Māori) для первых 103 элементов.
Команда Центра научного обучения подготовила коллекцию ресурсов, связанных с периодической таблицей элементов. Войдите, чтобы сделать эту коллекцию частью вашей частной коллекции, просто нажмите на значок копии. Затем вы можете добавить дополнительный контент, примечания и внести другие изменения. Зарегистрировать учетную запись в Science Learning Hubs легко и бесплатно – зарегистрируйтесь, используя свой адрес электронной почты или учетную запись Google. Найдите кнопку “Войти” вверху каждой страницы.
Полезные ссылки
Сайт Международного союза теоретической и прикладной химии (IUPAC).
Официальное объявление об открытии и присвоении новых элементов с атомными номерами 113, 115, 117 и 118 в 2015 году.
Новостная статья BBC о 4 новых элементах, о которой было объявлено 30 декабря 2015 года.
Radio New Zealand отмечает 2019 Международный год периодической таблицы Менделеева с серией Elemental. Каждую пятницу в «Ночах с Брайаном Крампом» есть элемент недели.


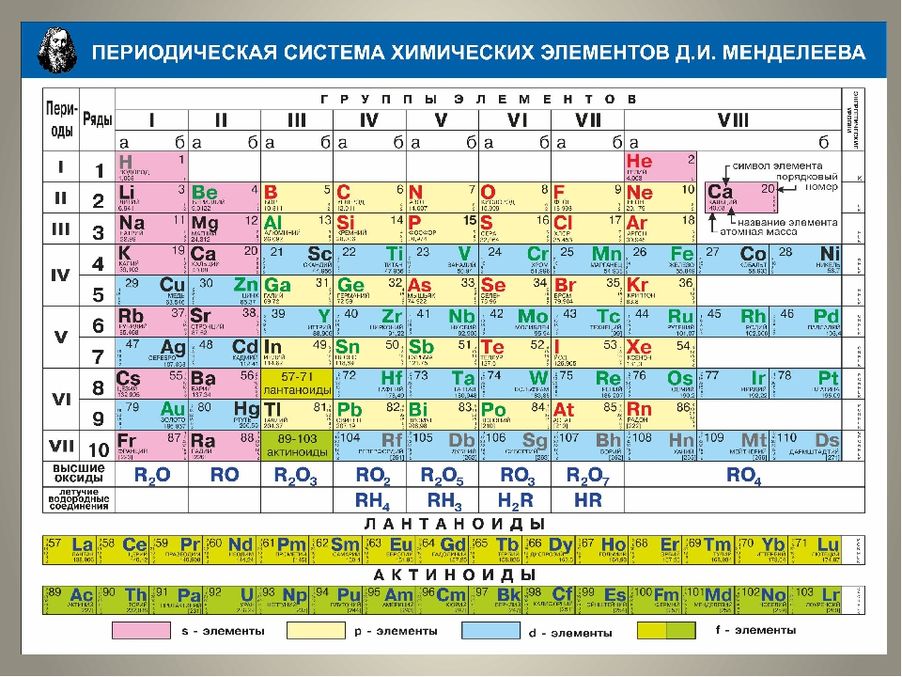
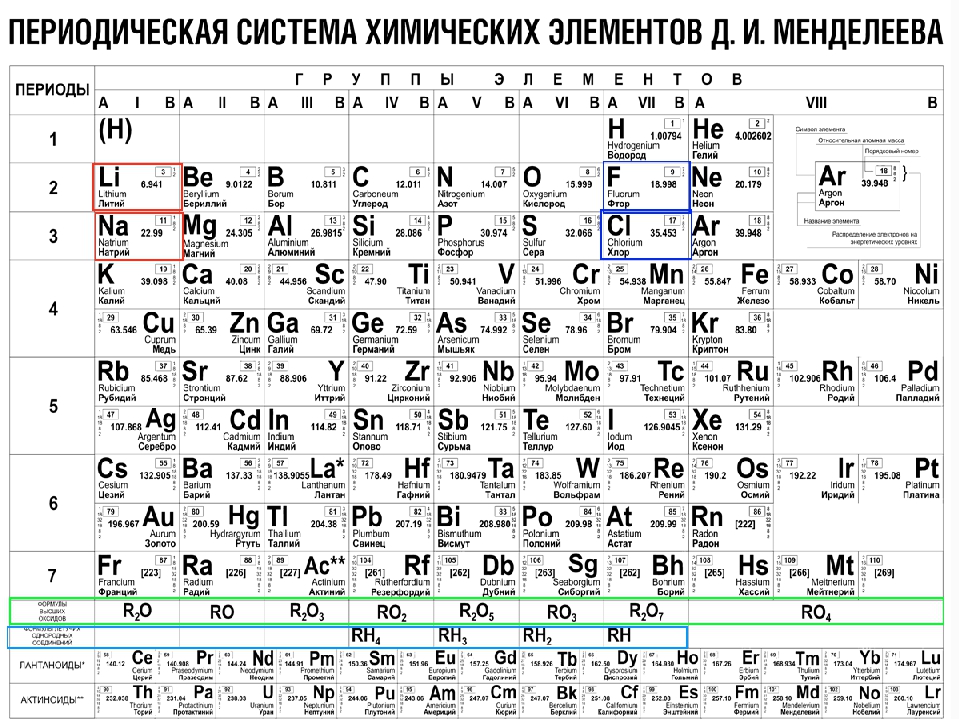
 un.org
un.org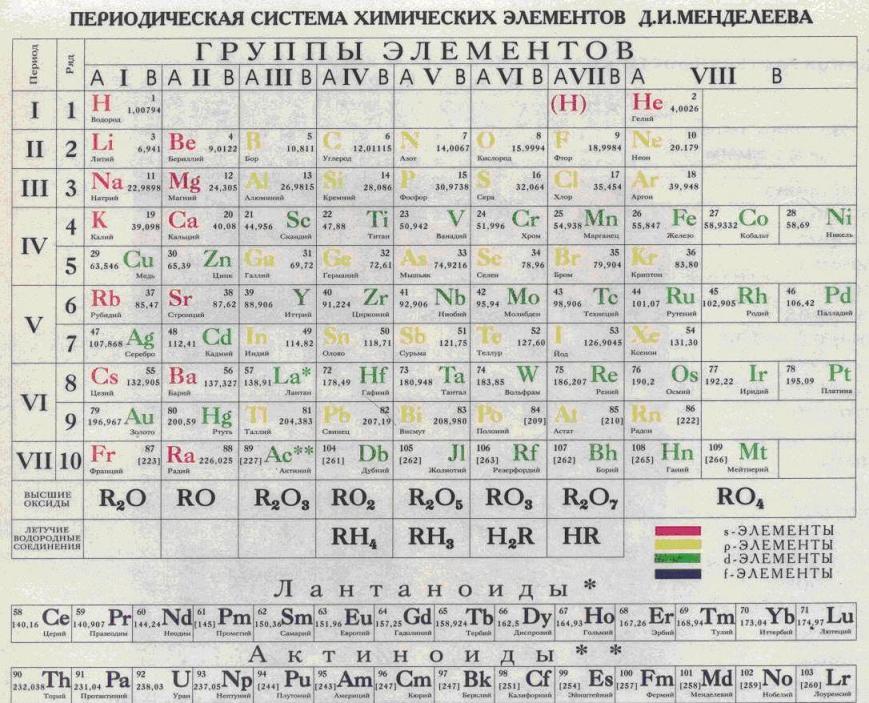 un.org
un.org