Свинец в таблице Менделеева, химический элемент
Свинец (Pb от лат. Plumbum) – химический элемент, который находится в IV группе Таблицы Менделеева. Свинец имеет множество изотопов, среди которых более 20 обладают радиоактивными свойствами. Изотопы свинца являются продуктами распада урана и тория, поэтому содержание свинца в литосфере постепенно увеличивалось в течение миллионов лет и сейчас составляет около 0,0016% по массе, но он более распространен, чем его ближайшие родственники, такие как золото и ртуть. Свинец легко выделяется из рудных месторождений. Основные источники свинца — галенит, англезит и церуссит. В руде со свинцом очень часто соседствуют другие металлы, например, цинк, кадмий и висмут. В самородном виде свинец встречается исключительно редко.
Свинец — интересные исторические факты
Этимология слова «свинец» до сих пор точно не выяснена и является предметом очень интересных исследований. Свинец очень похож на олово, очень часто их путали, поэтому в большинстве западнославянских языков свинец это олово. Зато слово “свинец” встречается в литовском (svinas) и латышском (svin) языках. Свинец в переводе на английский lead, на голландский lood. Видимо отсюда и пошло слово “лудить”, т.е. покрывать изделие слоем олова (или свинца). Не до конца понятно также происхождение латинского слова Plumbum, от которого произошло английское слово plumber – водопроводчик. Дело в том, что когда-то водопроводные трубы “запечатывали” свинцом, “пломбировали” (франц. plomber “запечатывать свинцом”). Кстати, отсюда же всем известное слово “пломба”. Но на этом путаница не заканчивается, греки всегда называли свинец «молибдос», отсюда и латинское «molibdaena», незнающему человеку легко спутать это название с наименованием химического элемента молибден. Так в древности называли блестящие минералы оставляющие тёмный след на светлой поверхности. Этот факт оставил свой след в немецком языке: “карандаш” по-немецки называется Bleistift, т.е. свинцовый стержень.
Зато слово “свинец” встречается в литовском (svinas) и латышском (svin) языках. Свинец в переводе на английский lead, на голландский lood. Видимо отсюда и пошло слово “лудить”, т.е. покрывать изделие слоем олова (или свинца). Не до конца понятно также происхождение латинского слова Plumbum, от которого произошло английское слово plumber – водопроводчик. Дело в том, что когда-то водопроводные трубы “запечатывали” свинцом, “пломбировали” (франц. plomber “запечатывать свинцом”). Кстати, отсюда же всем известное слово “пломба”. Но на этом путаница не заканчивается, греки всегда называли свинец «молибдос», отсюда и латинское «molibdaena», незнающему человеку легко спутать это название с наименованием химического элемента молибден. Так в древности называли блестящие минералы оставляющие тёмный след на светлой поверхности. Этот факт оставил свой след в немецком языке: “карандаш” по-немецки называется Bleistift, т.е. свинцовый стержень.
Человечество знакомо со свинцом с незапамятных времен. Археологами найдены свинцовые изделия выплавленные 8000 лет тому назад. В Древнем Египте из свинца даже отливали статуи. В Древнем Риме из свинца были изготовлены водопроводные трубы, именно он предопределил первую в истории экологическую катастрофу. Римляне не имели никакого представления о вреде свинца, им нравился податливый, прочный и простой в работе металл. Считалось даже, что свинец, добавленный в вино, улучшает его вкус. Поэтому почти каждый римлянин был отравлен свинцом. О симптомах отравления свинцом мы расскажем ниже, а пока лишь укажем, что одним из них является расстройство рассудка. Видимо отсюда и берут свое начало все эти безумные выходки знатных римлян и бесчисленные сумасшедшие оргии. Некоторые исследователи даже считают, что свинец явился чуть ли основной причиной падения Древнего Рима.
Археологами найдены свинцовые изделия выплавленные 8000 лет тому назад. В Древнем Египте из свинца даже отливали статуи. В Древнем Риме из свинца были изготовлены водопроводные трубы, именно он предопределил первую в истории экологическую катастрофу. Римляне не имели никакого представления о вреде свинца, им нравился податливый, прочный и простой в работе металл. Считалось даже, что свинец, добавленный в вино, улучшает его вкус. Поэтому почти каждый римлянин был отравлен свинцом. О симптомах отравления свинцом мы расскажем ниже, а пока лишь укажем, что одним из них является расстройство рассудка. Видимо отсюда и берут свое начало все эти безумные выходки знатных римлян и бесчисленные сумасшедшие оргии. Некоторые исследователи даже считают, что свинец явился чуть ли основной причиной падения Древнего Рима.
В древности гончары мололи свинцовую руду, разводили водой и обливали полученной смесью глиняные предметы. После обжига такие сосуды покрывались тонким слоем блестящего свинцового стекла.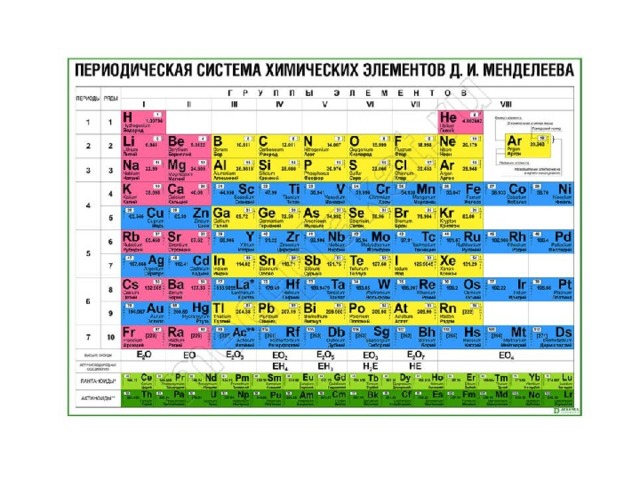
Англичанин Джордж Равенскрофт в 1673 году усовершенствовал состав стекла, добавив к исходным компонентам оксид свинца и таким образом получил легкоплавкое блестящее стекло, которое было очень похоже на натуральный горный хрусталь. А в конце 18 века Георг Страсс при производстве стекла сплавил вместе белый песок, поташ и оксид свинца, получив такое чистое и блестящее стекло, что его сложно было отличить от алмаза. Отсюда и пошло название “стразы”, по сути подделка под драгоценные камни. К сожалению, среди современников Страсс прослыл мошенником и его изобретение находилось в забвении до тех пор, пока в начале XX века Даниэль Сваровски не смог сделать из производства страз целую индустрию моды и направление искусства.
После появления и широкого распространения огнестрельного оружия, свинец начал использоваться для производства пуль и дроби. Из свинца изготавливали типографские литеры. Свинец ранее входил в состав белой и красной красок, ими писали почти все старинные художники.
Химические свойства свинца кратко
Свинец — металл матового серого цвета. Однако его свежий срез хорошо блестит, но к сожалению почти моментально покрывается грязноватой оксидной плёнкой. Свинец очень тяжелый металл, он тяжелее железа в полтора раза, а алюминия в четыре. Недаром в русском языке слово “свинцовый” является в некоторой мере синонимом тяжести. Свинец очень легкоплавкий металл, он плавится уже при 327 ° С. Ну, этот факт известен всем рыбакам, которые с легкостью выплавляют нужные по весу грузила. Также свинец очень мягок, его можно резать обычным стальным ножом. Свинец очень малоактивный металл, провести с ним реакцию или растворить его не составляет никакого труда даже при комнатной температуре.
Однако его свежий срез хорошо блестит, но к сожалению почти моментально покрывается грязноватой оксидной плёнкой. Свинец очень тяжелый металл, он тяжелее железа в полтора раза, а алюминия в четыре. Недаром в русском языке слово “свинцовый” является в некоторой мере синонимом тяжести. Свинец очень легкоплавкий металл, он плавится уже при 327 ° С. Ну, этот факт известен всем рыбакам, которые с легкостью выплавляют нужные по весу грузила. Также свинец очень мягок, его можно резать обычным стальным ножом. Свинец очень малоактивный металл, провести с ним реакцию или растворить его не составляет никакого труда даже при комнатной температуре.
Органические производные свинца являются очень ядовитыми веществами. К сожалению, одно из них, тетраэтилсвинец, широко использовалось как присадка к бензину, позволяющая повысить октановое число. Но зато к счастью, тетраэтилсвинец больше не применяется в такой ипостаси, химики и производственники научились повышать октановое число более безопасными способами.
Влияние свинца на организм человека и симптомы отравления
Любые соединения свинца очень ядовиты. Металл проникает в организм вместе с едой или со вдыхаемым воздухом и разносится кровью. Причем вдыхание паров свинцовых соединений и пыли намного более опасно, чем присутствие его в пище. Свинец имеет свойство накапливаться в костях, частично замещая в этом случае кальций. При повышении концентрации свинца в организме развивается анемия, поражается головной мозг, что приводит к снижению интеллекта, а у детей может вызвать необратимые задержки в развитии. Достаточно растворить один миллиграмм свинца в литре воды и она станет не только непригодной, но и опасной для питья. Такое низкое количество свинца представляет также определенную опасность, ни цвет ни вкус воды не изменяется. Основные симптомы отравления свинцом:
- серая кайма на деснах,
- вялость,
- апатия,
- потеря памяти,
- слабоумие,
- проблемы со зрением,
- раннее старение.

Применение свинца
Всё же, несмотря на токсичность, отказаться от использования свинца пока нет никакой возможности ввиду его исключительных свойств и дешевизны. Свинец в основном используется для производства аккумуляторных пластин, на эти нужды в настоящее время тратится около 75% добываемого на планете свинца. Свинец используется как оболочка для электрических кабелей, благодаря своей пластичности и неподверженности коррозии. Этот металл широко используется в химической и нефтеперерабатывающей промышленности, например, для облицовки реакторов в которых получают серную кислоту. Свинец обладает свойством задерживать радиоактивное излучение, этим тоже широко пользуются в энергетике, медицине и химии. В свинцовых контейнерах, к примеру, транспортируют радиоактивные элементы. Свинец идет в производство сердечников пуль и шрапнели. Также этот металл находит свое применение в производстве подшипников.
Свинцовая статуя Святого Мартина в БратиславеТаблица Д. И. Менделеева
82 Pb Plumbum
Свинец принадлежит семейству «Постпереходные металлы».
Атомная масса:
207.2
Расположение
Расширенная таблица: Свинец располагается в 14 группе, 6 периоде.
Сокращенная таблица: Свинец располагается в IV группе, 6(II) периоде, главной подгруппе.
Формула уровней:
1s22s22p63s23p63d104s24p64d104f125s25p64f145d106s26p2
Дополнительная информация:
Свинец- ковкий, сравнительно легкоплавкий металл серебристо-белого цвета с синеватым отливом.
Свинец используется многие тысячелетия, поскольку он широко распространён, легко добывается и обрабатывается.
Самым крупным производителем свинца доиндустриальной эпохи был Древний Рим, с годовым производством 80 000 тонн. Добыча римлянами свинца происходила в Центральной Европе, римской Британии, на Балканах, в Греции, Малой Азии и Испании.
Список химических реакций с Pb
Список химических соединений с Pb
Pb(CH3COO)2·3H2O — ацетат свинца — тригидрат
PbCO3 — lead carbonatecerussite
Pb(C2H5)4 — tetraethyllead
PbC2O4 — lead oxalate
PbCrO4 — lead chromate
PbF2 — lead fluoride
Pb(IO3)2 — lead iodate
PbI2 — lead(II) iodide
Pb(NO3)2 — lead(II) nitrate lead dinitrate plumbous nitrate
Pb(N3)
PbO — lead(II) oxide litharge
Pb(OH)2 — plumbous hydroxide
Pb(OH)4 — plumbic hydroxideplumbic acid
Pb(OH)62− — plumbate ion
PbO2 — lead(IV) oxidelead dioxide
PbS — сульфид свинцагаленит
PbSO4 — сульфат свинца(II)
Pb3(SbO4)2 — lead antimonate
Разработано и воплощено в МБОУ СОШ №30 г. Пензы
Пензы
Авторский коллектив: Баканов Владислав, Глухова Анастасия, Тургенева Александра, Хасянова Зульфия
Руководитель проекта: Адамский С.С., +7(987)508-99-37, [email protected]
2016 год
свинец | Определение, использование, свойства и факты
ведущий
Посмотреть все СМИ
- Ключевые люди:
- Георг Рафаэль Доннер
- Похожие темы:
- обработка свинца Месторождение типа долины Миссисипи свинец-207 общий провод свинец-206
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
свинец (Pb) , мягкий серебристо-белый или сероватый металл в группе 14 (IVa) периодической таблицы. Свинец очень податлив, пластичен, плотен и является плохим проводником электричества. Известный в древности и считавшийся алхимиками старейшим из металлов, свинец очень прочен и устойчив к коррозии, о чем свидетельствует продолжающееся использование свинцовых водопроводных труб, установленных древними римлянами.
| atomic number | 82 | |
|---|---|---|
| atomic weight | 207.19 | |
| melting point | 327.5 °C (621.5 °F) | |
| boiling point | 1,744 ° C (3171,2 °F) | |
| плотность | 11,29 г/см 3 при 20 °C (68 °F) | |
| степени окисления | 59 904+2,0036 electron configuration | [Xe]4 f 14 5 d 10 6 s 2 6 p 2 or 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 |
Occurrence and distribution
Свинец часто упоминается в ранних библейских рассказах. Вавилоняне использовали металл в качестве пластин для записи надписей. Римляне использовали его для изготовления таблеток, водопроводных труб, монет и даже кухонной утвари; действительно, в результате последнего употребления отравление свинцом было признано во времена Августа Цезаря. Соединение, известное как свинцовые белила, по-видимому, было приготовлено в качестве декоративного пигмента по крайней мере еще в 200 г. до н. э. Современные разработки относятся к разработке в конце 1700-х годов месторождений в районе Миссури-Канзас-Оклахома в Соединенных Штатах.
Вавилоняне использовали металл в качестве пластин для записи надписей. Римляне использовали его для изготовления таблеток, водопроводных труб, монет и даже кухонной утвари; действительно, в результате последнего употребления отравление свинцом было признано во времена Августа Цезаря. Соединение, известное как свинцовые белила, по-видимому, было приготовлено в качестве декоративного пигмента по крайней мере еще в 200 г. до н. э. Современные разработки относятся к разработке в конце 1700-х годов месторождений в районе Миссури-Канзас-Оклахома в Соединенных Штатах.
По весу свинец имеет почти такое же содержание в земной коре, как и олово. В космосе на 10 6 атомов кремния приходится 0,47 атома свинца. Космическое изобилие сравнимо с изобилием цезия, празеодима, гафния и вольфрама, каждый из которых считается достаточно дефицитным элементом.
Хотя свинца не так уж много, процессы естественной концентрации привели к значительным месторождениям, имеющим коммерческое значение, особенно в Соединенных Штатах, а также в Канаде, Австралии, Испании, Германии, Африке и Южной Америке.
Викторина «Британника»
Викторина «118 названий и символов периодической таблицы»
Свинец может быть извлечен путем обжига руды и последующей плавки в доменной печи или путем прямой плавки без обжига. Дополнительная очистка удаляет примеси, присутствующие в слитках свинца, произведенных любым способом. Почти половина всего рафинированного свинца извлекается из переработанного лома.
Использование металла
Известна только монокристаллическая модификация с плотноупакованной металлической решеткой. Свойства, которые обуславливают множество применений элементарного свинца, включают его пластичность, легкость сварки, низкую температуру плавления, высокую плотность и способность поглощать гамма-излучение и рентгеновское излучение. Расплавленный свинец является отличным растворителем и собирателем элементарного серебра и золота. Конструкционные применения свинца ограничены его низкой прочностью на растяжение и усталостной прочностью, а также его тенденцией к течению даже при небольшой нагрузке.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Свежевырезанный свинец быстро окисляется, образуя тускло-серое покрытие, ранее считавшееся субоксидом свинца, Pb 2 O, но теперь признанным смесью свинца и монооксида свинца, PbO, который защищает металл от дальнейшей коррозии. Точно так же, хотя свинец растворим в разбавленной азотной кислоте, соляная или серная кислоты разрушают его только поверхностно, поскольку нерастворимый хлорид (PbCl
Точно так же, хотя свинец растворим в разбавленной азотной кислоте, соляная или серная кислоты разрушают его только поверхностно, поскольку нерастворимый хлорид (PbCl
Элементарный свинец также может быть окислен до иона Pb 2+ ионами водорода, но нерастворимость большинства солей Pb 2+ делает свинец устойчивым к воздействию многих кислот. Окисление в щелочных условиях легче осуществить, и ему способствует образование растворимых частиц свинца в степени окисления +2. Оксид свинца (PbO 2 , со свинцом в виде иона Pb 4+ ) относится к числу более сильных окислителей в кислом растворе, но сравнительно слаб в щелочном растворе.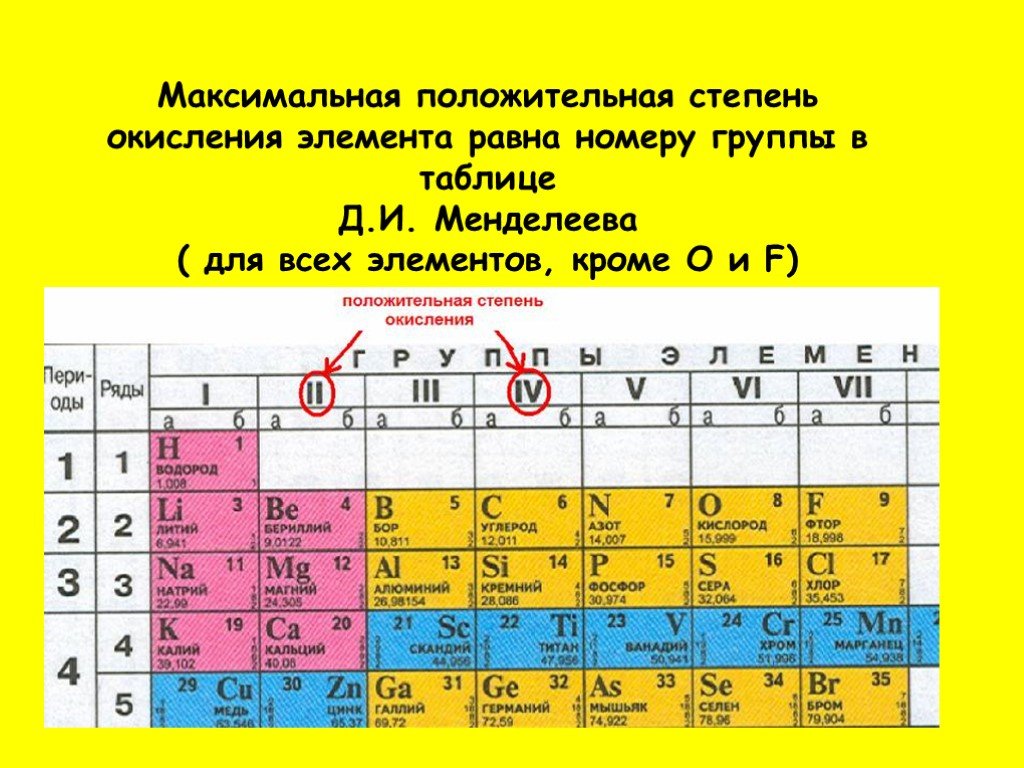 Легкость окисления свинца повышается за счет комплексообразования. Электроосаждение свинца лучше всего осуществляется из водных растворов, содержащих гексафторсиликат свинца и гексафторкремниевую кислоту.
Легкость окисления свинца повышается за счет комплексообразования. Электроосаждение свинца лучше всего осуществляется из водных растворов, содержащих гексафторсиликат свинца и гексафторкремниевую кислоту.
Свинец имеет множество других применений, самое крупное из которых — производство аккумуляторных батарей. Применяется в боеприпасах (дробях и пулях), а также в составе припоев, типографских металлов, подшипниковых сплавов, легкоплавких сплавов и оловянных сплавов. В тяжелом и промышленном оборудовании листы и другие детали, изготовленные из соединений свинца, могут использоваться для гашения шума и вибрации. Поскольку свинец эффективно поглощает коротковолновое электромагнитное излучение, его используют в качестве защитного экрана вокруг ядерных реакторов, ускорителей частиц, рентгеновского оборудования и контейнеров, используемых для транспортировки и хранения радиоактивных материалов. Вместе с составным оксидом свинца (PbO 2 ) и со свинцово-сурьмяными или свинцово-кальциевыми сплавами он используется в обычных аккумуляторных батареях.
Свинец (Pb) – Периодическая таблица (информация об элементе и многое другое)
от Admin
Это СУПЕР простое руководство по элементу свинца.
Фактически, таблица, упомянутая ниже, представляет собой идеальное информационное поле (которое дает вам все подробности об элементе Свинец в периодической таблице.)
Итак, если вы хотите узнать что-нибудь об элементе Свинец, то это руководство для вас.
Давайте погрузимся прямо в это!
Lead Element (Pb) Information| Appearance | Metallic gray appearance | |
| State (at STP) | Solid | |
| Position in Periodic table | Группа: 14 , Период: 6 , Блок: p | |
| Категория | Carbon group | |
| Atomic number or Protons | 82 | |
| Neutrons | 125 | |
| Electrons | 82 | |
| Symbol | Pb | |
| Атомная масса | 207.  2 u 2 u | |
| Расположение электронов или 2 Бор модель0026 | 2, 8, 18, 32, 18, 4 | |
| Электронная конфигурация | . Atomic radius | 202 picometers (van der Waals radius) |
| Valence electrons | 4 | |
| 1st Ionization energy | 7.417 eV | |
| Electronegativity | 2.33 (Pauling scale) | |
| Crystal structure | FCC (face centered cubic) | |
| Melting point | 600.6 K or 327.4 °C or 621.4 °F | |
| Boiling point | 2022 K or 1749 °C or 3180 °F | |
| Density | 11. 34 g/cm 3 34 g/cm 3 | |
| Основной изотоп | 208 PB | |
| CAS Number | 7439-92-1 |
. Посмотрите на то, как этот интерактивный период. об элементах из этой единственной интерактивной периодической таблицы.
Посещение ➢ Периодическая таблица
ВЫДЕЛА В ПЕРИОНАЛЬНОЙ ТАБЛИЦЕСвященный элемент в ГРУППА 14 и период СИЗЕР 6
. Свинец является элементом p-блока и принадлежит к группе углерода .
Нажмите на указанные выше элементы (в периодической таблице), чтобы просмотреть информацию о них, или посетите интерактивную периодическую таблицу (в которой показаны названия, символы, атомная масса, конфигурация электронов, расположение электронов и т. д. всех элементов )
Нажмите на элемент выше (в Периодической таблице), чтобы просмотреть информацию о нем
←Перейти к: Элемент таллия (Tl) – Периодическая таблица
→Перейти к: Элемент висмута (Bi) – Периодическая таблица
Знаете ли вы, сколько электронов может разместиться на первой оболочке, второй оболочке, третьей оболочке, четвертой оболочке и т. д.?
Вот таблица, показывающая способность орбит удерживать электроны.
Количество электронов в оболочках.
| Орбита/Оболочка (n) | Макс.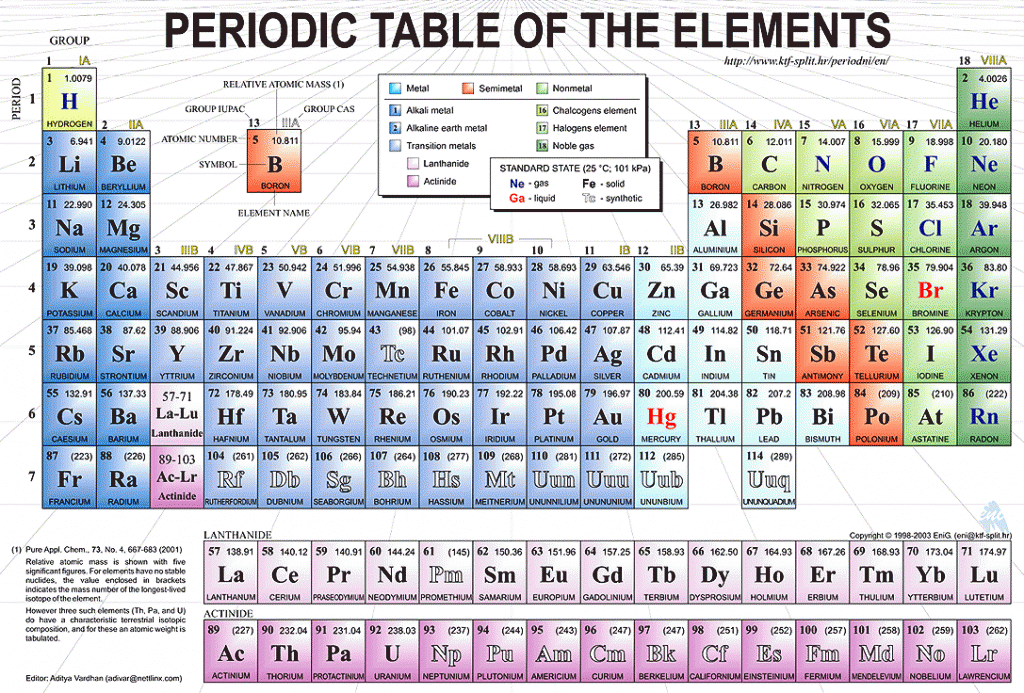 электронов, которые может удерживать эта орбита (2 × n 2 ) электронов, которые может удерживать эта орбита (2 × n 2 ) |
| К-оболочка, n = 1, | 2 × 1² = 2 |
| L Shell, n = 2 | 2 × 2² = 8 |
| M Shell, n = 3 | 2 × 3² = 18 | 333 2 × 32 = 18 | 3533333333333333333333333333333333333333 3 | 3 2 × 3 × 3 × 3 × 3 × 3 × 3 × 3 × 3 | 353 3 | 3 2 × 3 × 3. 4 | 2 × 4² = 32 |
| . . . | . . . |
Таким образом,
- 1-я оболочка может содержать 2 электрона.
- 2-я оболочка может содержать 8 электронов.

- 3-я оболочка может содержать 18 электронов.
- 4-я оболочка может содержать 32 электрона.
Теперь атомный номер свинца (Pb) равен 82 .
Следовательно, элемент Свинца имеет расположение электронов 2, 8, 18, 32, 18, 4.
Такое расположение электронов указывает на то, что самая внешняя орбита элемента Свинца (Pb) имеет 4 электрона.
Следовательно, он находится в группе 14.
Почему свинец в периоде 6?Позвольте задать вам вопрос.
Сколько снарядов у свинца?
Сейчас 6. Верно?
Вы уже видели боровскую модель атома свинца в приведенной выше таблице.
Из модели Бора можно найти, что количество орбит или оболочек в свинце равно 6. Следовательно, поскольку у свинца 6 орбит, он находится в периоде 6 Периодической таблицы.
Почему свинец в p-блоке? Прежде чем узнать эту причину, прежде всего я хочу задать вам простой вопрос.
Как определить положение элементов по блокам?
Простой ответ: Элементы будут лежать в блоках s, p, d или f, это будет полностью зависеть от подоболочки, в которую войдет последний электрон.
Например; электронная конфигурация свинца [Xe] 4f 14 5d 10 6s 2 6p 2 .
Итак, последний электрон свинца попадает на p-подоболочку или p-орбиталь.
Следовательно, свинец является элементом p-блока.
5 Интересные факты о свинцеНиже приведены интересные факты о свинцовом элементе.
- Концентрация свинца в земной коре составляет около 114 частей на миллион по весу.
- Свинец в основном получают из руды сульфида свинца (PbS). свинец получают также из руд меди, серебра и цинка.
- Свинец — один из элементов, открытых с древних времен.
- Свинец – мягкий металл, его можно резать ножом.
- Свинец является ядовитым элементом.
 Слишком большое количество свинца в организме человека может вызвать проблемы с нервной системой, а также повлиять на такие органы, как почки, сердце, кишечник и т. д.
Слишком большое количество свинца в организме человека может вызвать проблемы с нервной системой, а также повлиять на такие органы, как почки, сердце, кишечник и т. д.
Физические и химические свойства свинца указаны ниже.
Физические свойства свинцаФизические свойства свинца указаны ниже.
- Свинец представляет собой твердый металл при STP и имеет металлический серый цвет.
- Свинец плохо проводит электричество.
- Свинец является пластичным, а также ковким металлом. Это означает, что его можно вытягивать в тонкую проволоку и тонкие листы.
- Существует много изотопов свинца, но из этих изотопов изотоп 208 Pb является наиболее распространенным (с содержанием примерно 52,4%).
- Свинцовый элемент имеет более низкую температуру плавления 327,4 °C. А его температура кипения составляет 1749 °С.
- Кристаллическая структура свинца ГЦК (т.
 е. гранецентрированная кубическая).
е. гранецентрированная кубическая).
Химические свойства свинца указаны ниже.
- Когда грифель только что срезан, его поверхность голубовато-серая. Но если его держать открытым на воздухе, то он вступает в реакцию с кислородом и начинает тускнеть (что образует на нем серый оксидный слой).
- Электронная конфигурация свинца [Xe] 4f 14 5d 10 6s 2 6p 2 , что показывает, что последний электрон выходит на p-орбиталь. По этой причине он классифицируется как элемент p-блока в периодической таблице.
- В форме соединения свинец существует в наиболее распространенных степенях окисления +2 и +4. Помимо этих степеней окисления, существуют и другие степени окисления.
- 1-я энергия ионизации свинца 7,417 эВ.
- Электроотрицательность свинца равна 2,33 по шкале Полинга.
Использование свинца указано ниже.
- Большая часть производимого в настоящее время свинца используется в производстве свинцовых аккумуляторов.
- Свинец также используется в припоях и материалах для покрытия кабелей.
- В древние времена свинец использовался в сантехнике (поскольку он не вызывает коррозии). Но из-за своей токсичности в настоящее время не используется.
- Свинец также используется в производстве радиационных экранов, пуль и т. д.
- Свинец действует как сверхпроводник при температуре ниже 7,2 К. [1]
Позвольте мне рассказать вам, как эта Интерактивная таблица Менделеева поможет вам в учебе.
1). Вы можете легко найти каждую деталь об элементах из этой единственной интерактивной периодической таблицы.
(Для интерактивной периодической таблицы просмотрите ее на ноутбуке/настольном компьютере для лучшего восприятия.



 Слишком большое количество свинца в организме человека может вызвать проблемы с нервной системой, а также повлиять на такие органы, как почки, сердце, кишечник и т. д.
Слишком большое количество свинца в организме человека может вызвать проблемы с нервной системой, а также повлиять на такие органы, как почки, сердце, кишечник и т. д. е. гранецентрированная кубическая).
е. гранецентрированная кубическая).