Первоначальная периодическая таблица Д.И.Менделеева – презентация онлайн
Похожие презентации:
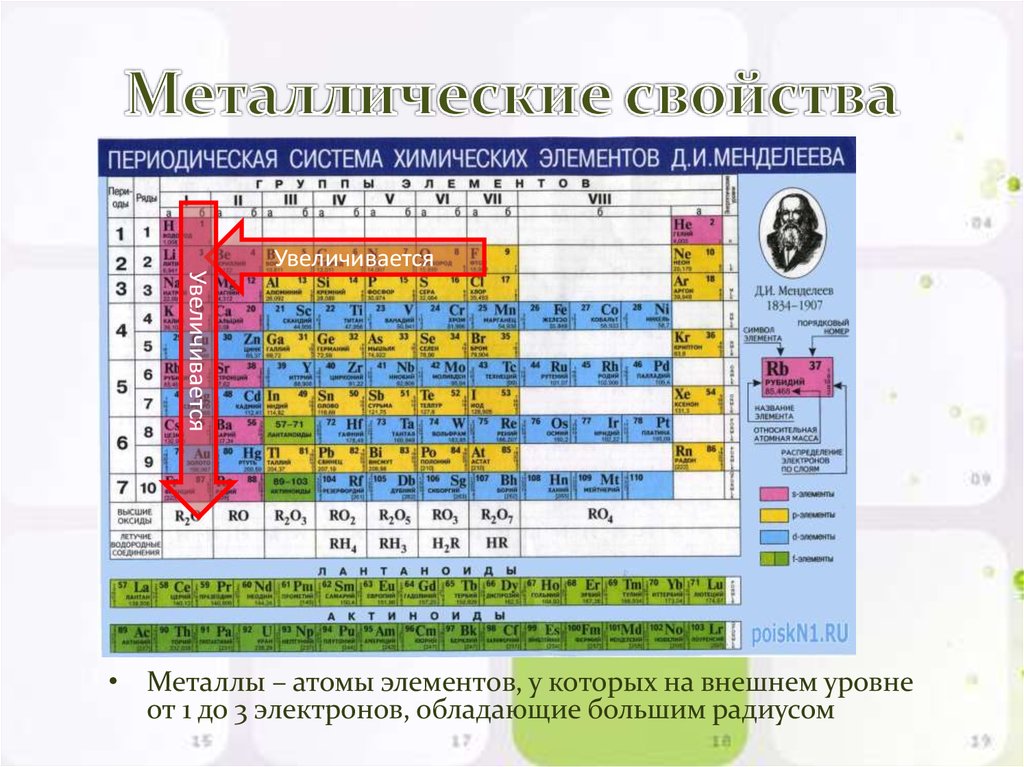
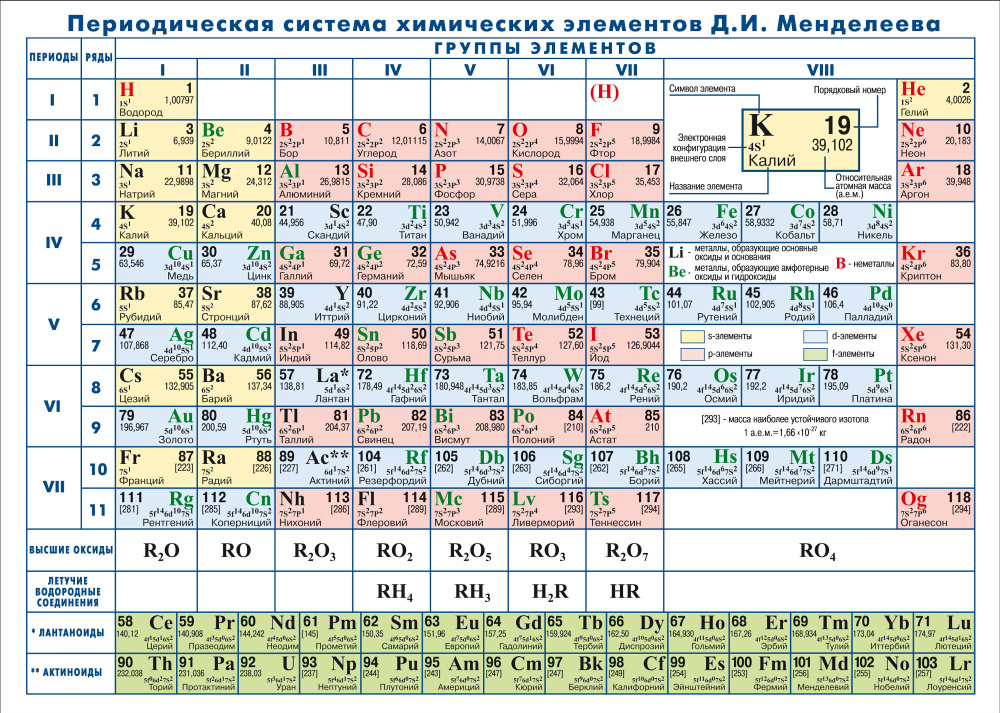
Периодическая система химических элементов Д.И. Менделеева
Периодический закон и Периодическая система химических элементов
Периодический закон и периодическая система химических элементов Д.И. Менделеева
Значение периодического закона Д. И. Менделеева
Тайна великого открытия периодической таблицы
Периодический закон и периодическая система химических элементов
Классификация химических элементов. Периодический закон
Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон Д.И. Менделеева (лекция 3)
Периодический закон и периодическая система химических элементов Д.И. Менделеева
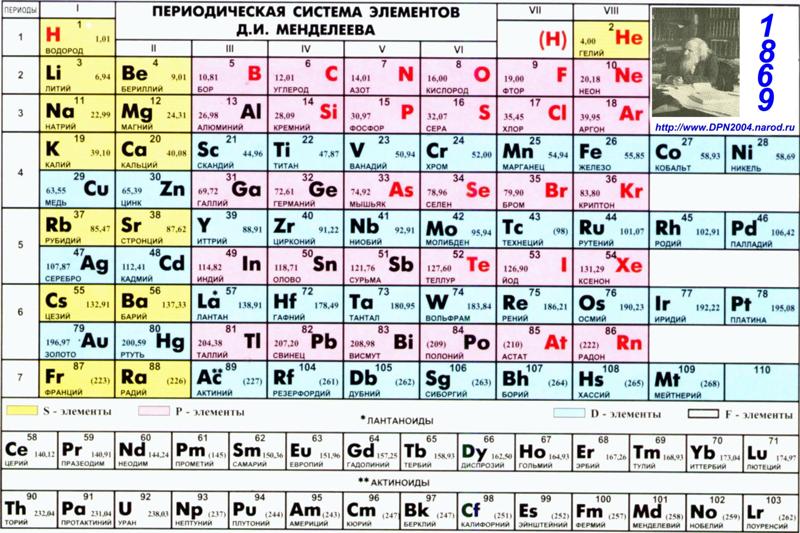
1. Первоначальная периодическая таблица Д.И.Менделеева
2. Одна из первых таблиц (1878г.)
Нетрудно заметить, что группы группировались в ряды, а не в колонки.
Неоткрытые элементы обозначаются прочерком.
3. Немного о предсказанных элементах
Чтобы дать предсказанным элементам«временные» названия, Менделеев использовал
приставки «эка», «дви» и «три», в зависимости от того,
на сколько позиций вниз от уже открытого
элемента с похожими свойствами находился
предсказанный элемент. Так, германий до своего
открытия в 1886 году носил название «экасилиций», а
рений, открытый в 1926 году, назывался
«двимарганец».
Первоначально, в 1870 году, он предсказал экабор (Eb), экаалюминий (Ea),
экамарганец (Em) и экасилиций (Es), в последствии они стали известны, как
скандий, галлий, технеций и германий соответственно.
Его предсказания, почти полностью совпали. Экабор по его предсказанию,
должен был иметь массу около 44, а атомная масса скандия оказалась равна 44,955910.
Для экамарганца, что атомная масса около 100, а у технеция, наиболее
стабильным изотопом является 98Tc
Свойство
Экаалюминий
Галлий
Атомная масса
68
69,72
Плотность (г/см³)
6,0
5,904
Темп.
 плавления
плавления(°C)
низкая
29,78
Формула оксида
Ea2O3 (плотность 5,5 г см−3, растворяется и
в кислотах, и в основаниях)
Ga2O3 (плотность 5,88 г см−3, раствор.
и в кислотах, и в основаниях)
Формула хлорида
Ea2Cl6 (летучий)
Ga2Cl6 (летучий)
Свойство
Экасилиций
Германий
Атомная масса
72
72,61
Плотность (г/см³)
5,5
5,35
Температура плавления (°C)
высокая
947
Цвет
серый
серый
Тип оксида
тугоплавкий диоксид
тугоплавкий диоксид
Плотность оксида (г/см³)
4,7
4,7
Реакция оксида
слабое основание
слабое основание
Температура кипения хлорида
ниже 100 °C
86 °C (GeCl4)
Плотность хлорида (г/см³)
1,9
1,9
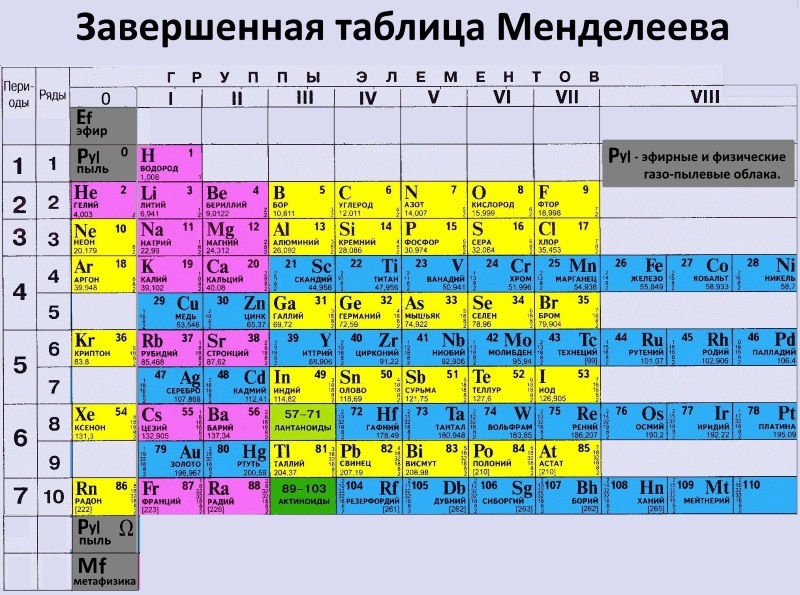
5. Интересная теория
В некоторых источниках считается, что всеми привычная периодическаятаблица – фальшивка и то что это сплошной заговор. Согласно, этой
теории всё состоит из мирового эфира, это некая частица идущая
перед водородом.

Небольшая вырезка из «правдивой» статьи:
После скоропостижной смерти Д.И. Менделеева и ухода из жизни его верных научных коллег по Русскому ФизикоХимическому Обществу, впервые поднял руку на бессмертное творение Менделеева сын друга и соратника Д.И.
Менделеева по Обществу — Борис Николаевич Меншуткин. Конечно, тот Борис Николаевич тоже действовал не в
одиночку — он лишь выполнял заказ. Ведь новая парадигма релятивизма требовала отказа от идеи мирового эфира;
и потому это требование было возведено в ранг догмы, а труд Д.И. Менделеева был фальсифицирован.
Главное искажение Таблицы — перенос «нулевой группы» Таблицы в её конец, вправо, и введение т.н. «периодов».
сознательное устранение главного методологического звена в открытии Менделеева: периодическая система
элементов в своём начале, истоке, т.е. в верхнем левом углу Таблицы, должна иметь нулевую группу и нулевой ряд,
где
располагается
элемент
«Х»
(по
Менделееву
—
«Ньютоний»),
—
т.
 е.
е.мировой
эфир.
Более того, являясь единственным системообразующим элементом всей Таблицы производных элементов, этот
саму
идею
этой
первоосновы
всей
системы
элементов
по
Менделееву.
Чтобы вытравить из сознания всех последующих поколений учёных идею исключительной роли мирового эфира (а
этого как раз и требовала новая парадигма релятивизма), специально были перенесены элементы нулевой группы из
левой части Таблицы Менделеева в правую часть, сместив на ряд ниже соответствующие элементы и совместив
нулевую группу с т.н. «восьмой». Разумеется, ни элементу «у», ни элементу «х» в фальсифицированной таблице
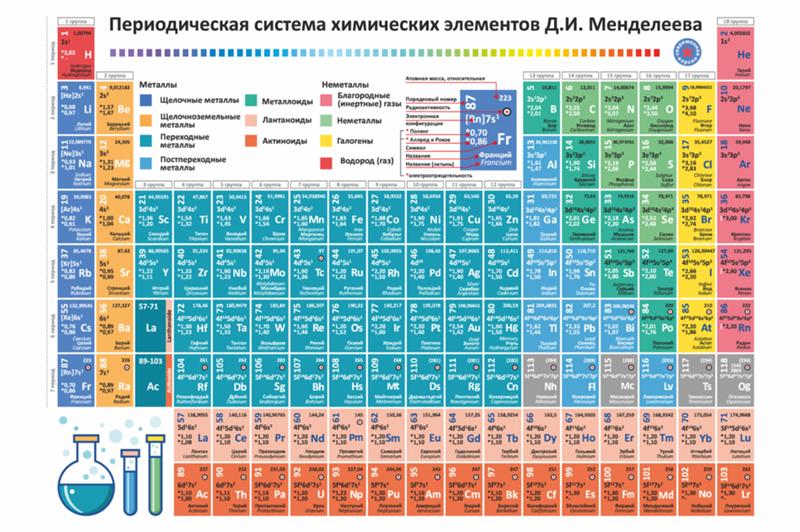
Гипотетически,
последняя
правильная
таблица.
Можно заметить,
что инертные
газы находятся в
0-ой группе и то
что присутствуют
Короний и
Ньютоний
Наиболее вероятные
последние таблицы
English Русский Правила
Периодический закон и периодическая система химических элементов Д.
 И. Менделеева
И. Менделеева
ЦЕЛИ УРОКА:
- Познакомить учащихся с историей открытия ПЗ и создания ПС, показать роль русских ученых в процессе становления химии как науки.
- Развивать умения анализировать, сравнивать, делать выводы.
- Воспитывать уважение к труду.
ХОД УРОКА
Открытие ПЗ.
В середине 19столетия проблема систематизации химических элементов стала очень острой. (Шанкартуа, Ньюленндс, Мейер) Наиболее близко к открытию ПЗ подошел немецкий химик Лотар Мейер. Несмотря на то, что он опубликовал свою таблицу из 27 элементов, проблема систематизации химических элементов не была решена, т.к. ученому не удалось открыть закон, который можно было бы положить в основу систематизации.
ИСТОРИЯ ПРО ТАБЛИЦУ МЕНДЕЛЕЕВА И ПРО ТО, КАК НЕПРОСТО УТВЕРЖДАЮТСЯ ВЕЛИКИЕ ОТКРЫТИЯ
Мир сложен.
Он полон событий, сомнений
И тайн бесконечных и смелых догадок.
Как чудо природы является гений и в хаосе этом наводит порядок…
Весь мир большой: жара и стужа, планет круженья, свет зари –
Все то, что видим мы снаружи, законом связано внутри.
Найдется ль правило простое, что целый мир объединит?
Таблицу Менделеев строит. Природы ищет алфавит.
О ТОМ, КАК СОН МЕНДЕЛЕЕВА
РАССТАВИЛ ВСЕ ЭЛЕМЕНТЫ ПО СВОИМ МЕСТАМ
С.Петербург, 1868 – 1869 гг.
Случилось в Петербурге это.
Профессор университета писал учебник для студентов…
Задумался невольно он:
“Как рассказать про элементы? Нельзя ли тут найти закон?”
Искали многие решенья, но, проходя лишь полпути – бросали.
Мучило сомненье: “А можно ли закон найти?”
Мир состоит из элементов (в то время знали 60).
А сколько их всего? На это нельзя ответить наугад.
Но не гадал, а верил он: “Тут должен, должен быть закон!”
Упрямо он искал решенье. Был ТРУД, НАДЕЖДА И ТЕРПЕНЬЕ
И ВЕРА в то, что он найдет! Он так работал целый год.
Когда Менделеева спрашивали, как он открыл ПЗ, ученый отвечал: “Искать чего-либо, хотя бы грибов или какую-либо закономерность, нельзя иначе, как смотря или пробуя. Вот я и стал подбирать, написав на отдельных карточках элементы с их атомными весами и свойствами, сходные элементы и близкие атомные массы”. Долгая и кропотливая работа имела свой результат.
УНИВЕРСИТЕТСКАЯ КВАРТИРА МЕНДЕЛЕЕВА
17 февраля 1869 г.
Но вот дела отложены, расчеты проверяются.
С утра в поездку дальнюю ученый собирается.
Все чемоданы собраны, на козлах кучер мается:
“Поспеть бы надо к поезду, а барин все копается!”
А барин одевается и к двери направляется.
Он к двери на-прав-ля-ет-ся…
И вдруг! Шляпа брошена в углу. Он бросается к столу
И строчит карандашом. Наконец-то он нашел!
Он на чем попало пишет, ничего вокруг не слышит.
Наконец-то понял он, в чем разгадка, в чем закон!
В любом труде, в любом творенье необходимо вдохновенье.
И озарения момент – порой важнейший элемент!
Из кабинета не выходит: “Не упустить бы мысли той!”
Он элементы ставит в строй, но все ж таблица не выходит…
Тогда усталостью сражен, лег на диван и видит сон…
То кружились, то мелькали, то водили хоровод,
То взрывались, то пылали, то шипели, то сверкали
То в покое пребывали алюминий, натрий, калий, фтор, бериллий, водород…
Перепутались все свойства, недалеко до беды.
Вдруг команда: “Войско, стройся!” – стали строиться в ряды.
Во втором ряду волненье: все бояться окисленья.
“Поглядите, – злится Литий. – Фтор – ужасный окислитель!
Я не встану в этот ряд. Пусть другие здесь горят!”
И Бериллий мрачно мыслит: “Кислород нас всех окислит!
И, простите за повтор – как несносен этот Фтор!”
Бор кивает головой, но не рвется сразу в бой.
Азот не лезет в спор, но зато взорвался Фтор:
“Ах, так мы для вас не пара! Кислород, поддай им жару!
Окисляй! За мной! Вперед!” –“Стойте! – крикнул Углерод.-
Я и уголь, и алмаз. И за них я, и за вас!
Я сражаться не горю, я вас лучше помирю.
Встану я посередине. Третий ряд! Трубите сбор!”
Натрий, магний, алюминий, кремний, фосфор, сера, хлор.
По порядку, по закону элементы встали в ряд.
И выходит, что в колонну все похожие стоят.
Кремний встал под углеродом, сера схожа с кислородом.
Алюминий встал под бор – замечательный подбор!
Ряд пристраивается к ряду, а рядов-то 10 кряду.
Металлы под металлами, едкие под едкими,
Ковкие под ковкими. Идут своими клетками.
По порядку все стоит – вои Природы алфавит!
Кому-то сон веселый снится, кому-то снится страшный сон,
А Менделееву таблица приснилась. Он открыл закон.
А также правило простое: “Ученый должен отдыхать
Но и во сне не знать покоя, тогда открытие любое
Вовек не сможет он проспать”
Результатом долгой кропотливой работы, которая не прекращалась даже во сне, стало открытие закона, согласно которому: “Свойства элементов стоят в периодической зависимости от их атомного веса”.
Любой закон требует фактического подтверждения.
КАК МЕНДЕЛЕЕВ ДОКАЗАО, ЧТО ЕГО ТАБЛИЦА ПРАВИЛЬНАЯ.
Был четвертый ряд нарушен, элемент не обнаружен.
Элемент не обнаружен, тот, что в этом месте нужен.
Но напрасно беспокойство – существует где-то он.
“Я найду сначала свойства, а поможет мне закон!”
Удельный вес назвал и цвет, летуч на воздухе иль нет,
Как плавится, в чем растворим…
Законом пользуясь своим, три элемента предсказал
Как будто их в глаза видал!
В 1871 г. Менделеев выступает со статьей “Естественная система элементов и применение ее к указанию свойств неоткрытых элементов”. В ней он описывает свойства неизвестных элементов, условно называя их “экакремний”, “экабор”, “экаалюминий”.
Быть может раз в тысячелетье свершить подобное дано,
Но мир открытья не заметил, иль не поверил – все равно.
И кто-то говорит по-свойски: “Забудь об этой ерунде,
Как можно обнаружить свойства веществ, не найденных нигде!”
ПАРИЖ, КВАРТИРА ЛЕКОКА ДЕ БУАБОДРАНА, 1875 Г.
Вот как-то раз узнали ученые всех стран –
Металл чудесный галлий – в честь Франции назвали – открыл Буабодран.
Довольный и счастливый рассматривал металл
И писем из России никак не ожидал.
Он взял письмо, прочел его. От русского ученого?!
“Галлий – это предсказанный мною экаалюминий. Его атомный вес близок к 68, удельный вес – около 5,9. исследуйте, проверяйте”.
“Ошибся я! Слыхали! – француз был удивлен.
В глаза не видел галлий, а знает свойства он.
Вес высчитал удельный точней, чем я стократ
Какой-то Менделеев еще пять лет назад!”
Глаза его сверкали, топорщились усы.
И вот метал свой галлий он бросил на весы…
Ответ в Россию мчится:
“Прекрасная таблица! Я вами восхищен!
Проверен мной практически закон периодический.
И я категорически приветствую закон!”
У химиков переполох – ведь галлий был одним из трех, предсказанных заранее
И следом, как из-под земли вдруг скандий в Швеции нашли.
На свет германий извлекли (естественно, в Германии).
Открытие галлия было первым триумфом периодического закона, а за ним последовало открытие Нильсоном “экабора” – скандия и не менее триумфальное открытие “экакремния” - германия.
В 1886 г. немецкий ученый Винклер пишет Менделееву следующее письмо: “милостивый государь, разрешить мне при сем передать Вам оттиск сообщения, из которого следует, что мною обнаружен новый элемент “германий”…
Я надеюсь вскоре сообщить Вам более подробно об этом интересном веществе; сегодня я ограничиваюсь лишь тем, что уведомляю Вас о весьма возможном новом триумфе Вашего гениального исследования и свидетельствую Вам свое почтение и глубокое уважение.
Преданный Клеменс Винклер.
Фрейбург, Саксония. 29 февраля 1886г.”
Заслуги Менделеева признал даже Л.Мейер,
которого многие считают автором (немецкая школа
химиков) или соавтором (Меншуткин)
периодического закона. Мейер пишет: “В 1869 г.,
раньше, чем я высказал свои мысли о периодичности
свойств элементов, появился реферат статьи
Менделеева… Это все было опубликовано
Менделеевым до меня и вообще впервые. Я открыто
сознаюсь, что у меня не хватило смелости для
таких дальновидных предположений, какие с
уверенностью высказывал Менделеев”. А ведь
Дмитрию Ивановичу было всего 35 лет!
Мейер пишет: “В 1869 г.,
раньше, чем я высказал свои мысли о периодичности
свойств элементов, появился реферат статьи
Менделеева… Это все было опубликовано
Менделеевым до меня и вообще впервые. Я открыто
сознаюсь, что у меня не хватило смелости для
таких дальновидных предположений, какие с
уверенностью высказывал Менделеев”. А ведь
Дмитрию Ивановичу было всего 35 лет!
Потом дополнилась таблица, узнали новые частицы…
Прославят, подтвердят закон открытья будущих времен.
Е.С.Ефимовский
Ракета и травинка. Истории в стихах.
Менделеев считал этих ученых “истинными
укрепителями закона. Без них он не был бы признан
в такой мере, как это случилось ныне”. В такой же
мере укрепителем закона Менделеев считал и
английского ученого Уильяма Рамзая, который,
используя закономерности ПС, открыл целую группу
элементов: гелий, неон, аргон, ксенон.
Инертные газы. Положение в ПС – нулевая группа. Название. 1962 г. – получены соединения ксенона и криптона с кислородом и фтором, в которых эти элементы проявляли степень окисления +8. перенесены в восьмую группу, чаще называются благородными, а не инертными.
Открытие радиоактивности. Время готовило новые испытания ПЗ. В 1896 г. французский ученый Анри Беккерель открыл явление радиоактивности, и к его изучению приступили его соотечественники Мария Склодовская-Кюри и Пьер Кюри.
Получив 8 т отходов урановой руды, они начали ее обработку. Вскоре ученые заметили, что один из продуктов переработки испускает лучи в 400 раз сильнее, чем уран. Причину этого Кюри видят в новом элементе, который они просят назвать полонием – в честь родины Марии – Польши.
В 1902 г., проведя более 10000 опытов в обыкновенном
сарае, служившим им лабораторией, ученые
наконец-то получили 0,1 г хлорида радия.
История науки еще не знала такого титанического труда. В 1903 г. за выдающиеся исследования в области радиоактивности Анри Беккерель, Мария Склодовская-Кюри и Пьер Кюри были удостоены Нобелевской премии по физике. В своей речи по поводу получения премии Пьер Кюри сказал: “Можно думать, что в преступных руках радий станет очень опасным. Я отношусь к числу тех, кто думает, что человечество извлечет из новых открытий больше блага, чем зла…”. Так и произошло. После смерти мужа Мария продолжила исследования, и в 1911 г. она была удостоена второй Нобелевской премии, на сей раз по химии, за получение чистого радия. Получив чистый радий, Мария Склодовская подарила его своей второй родине – Франции для лечения раковых больных. Это было первое практическое мирное применение радиоактивного вещества. К этому звали ученые.
Почему же явление радиоактивности было
воспринято как крушение ПЗ? При распаде атомов
химических элементов образовывались атомы уже
известных элементов, но с другими массами. В это
трудно было поверить. В 1902 г. Менделеев выехал в
Париж. Он побывал в лаборатории Марии и Пьера,
познакомился с их работой, но так и не поверил в
превращаемость элементов друг в друга.
В это
трудно было поверить. В 1902 г. Менделеев выехал в
Париж. Он побывал в лаборатории Марии и Пьера,
познакомился с их работой, но так и не поверил в
превращаемость элементов друг в друга.
Система является выражением закона природы. Задача человека – открыть его, создать или уничтожить его невозможно. И в конце своей жизни в дневнике Менделеев пишет фразу, ставшую в последствие крылатой: “периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает”.
Теория строения атома. В 1911 г. выдающийся
английский физик Резерфорд открыл атомное ядро.
Все усилия лаборатории направлены на его
изучение. Один из молодых сотрудников Резерфорда
Генри Мозли изучает зависимость между величиной
заряда ядра и порядковым номером элемента.
Экспериментально подтвердит гипотезу Ван дер
Брука. Именно тогда появляется новая
формулировка ПЗ, объясняющая все несостыковки 19
– начала 20 веков: “Свойства элементов и
образуемых ими соединений находятся в
периодической зависимости заряда ядра атома”. Перестановка элементов: аргон – калий, кобальт –
никель, теллур – йод.
Перестановка элементов: аргон – калий, кобальт –
никель, теллур – йод.
О Мозли заговорили как о будущем физике №1. этим
прогнозам не суждено сбыться. В 1915 г. во время
атаки турок английского десанта офицер связи
Генри Мозли погиб. Другой ученик Резерфорда –
Нильс Бор разгадал 2 загадки, связанные с
лантаноидами: почему их свойства так похожи
(заполняется четвертый слой, а 5 и 6 построены
одинаково) и сколько их всего. Элемент № 72. 1923г.
Нильс Бор поднимается по ступеням лестницы
Стокгольмского королевского дворца, чтобы
получить Нобелевскую премию за разработанную им
теорию строения атома… Ему вручают телеграмму
из Копенгагена, в которой говорилось, что двое
сотрудников его лаборатории обнаружили элемент
№72 именно в циркониевых рудах. Бор срочно вносит
дополнение в свой доклад: “Свойства элемента
№72 говорят о явном и сильном отличии от
редкоземельных элементов”. Так практика
впервые успешно подтвердила теорию строения
атома. Новый элемент был назван в честь родного
города великого физика.
Новый элемент был назван в честь родного
города великого физика.
В науке уже много известно о ПЗ и ПС, но новое определение химического элемента как вида атомов с одинаковым зарядом ядра после открытия Мозли еще не нашло широкого признания.
1934 г. Ирен Кюри и Фредерик Жолио-Кюри открывают явление искусственной радиоактивности, за что и были удостоены Нобелевской премии. Это открытие доказало, что изотопы могут существовать у всех элементов. Новое определение химического элемента нашло свое признание.
Жизнь обоих поколений Кюри в прямом смысле
слова была принесена в жертву науки Мария
Склодовская, ее дочь Ирен и зять Фредерик умерли
от лучевой болезни, возникшей от многолетней
работы с радиоактивными веществами. Посетители
всемирной выставки в Брюсселе в 1958 г. столбенели,
когда смотрели на обычные дамские перчатки.
Перчатки, которые даже спустя полвека после
смерти своей хозяйки – Марии Склодовской,-
испускали не аромат духов, а смертоносные лучи
радия, “голос” которого бесстрастно фиксировал
счетчик Гейгера.
Деятельность этих ученых была направлена на благо, на мирное использование радиоактивности. Но их благие помыслы не у всех нашли отклик. Нильс Бор – побег из оккупированной Дании в США, понимание того, что сделанные им и другими учеными открытия направляются на уничтожение людей. Деятельности Бора и других прогрессивных деятелей в борьбе против нового оружия не увенчалась успехом. 6 августа 1945 г. атомная бомба упала ни Хиросиму, а 9 августа – на Нагасаки. 80 тыс. человек в Хиросиме и 87 тыс. в Нагасаки погибли сразу. Еще столько же было ранено. На самом деле количество пострадавших и умирающих значительно больше – люди умирали от лучевой болезни.
Значение ПЗ.
- Исправлены атомные массы некоторых элементов.
- Дана научная классификация химических элементов.
- Предсказано открытие новых элементов.
- Открыты инертные газы.

ПЗ не утратил своего значения и в современной науке.
- Создана теория строения атома.
- Определены естественные границы ПС.
- Открыты новые элементы.
- Синтезированы элементы № 93 – 109.
- Открытия в физике, биологии, геологи.
Достижения.
- Синтез трансурановых элементов (Беркли, Дубна, Дармштадт)
- Рекордсмены-ученые: К.В.Шееле (7), Рамзай (инертные газы), Г.Дэви (калий, натрия, кальций, магний).
- Рекордсмены-страны: Швеция (28), Англия (20), Франция (15), германия (10) – самые развитые страны 18-19 веков.
Домашнее задание: §3, творческая работа “Открытие периодического закона”. Сообщения “Биография Д.И.Менделеева”, “Научная деятельность Д.И.Менделеева”
Дополнительная информация:
- Жизнь Менделеева.
 Х\ш №6/99 с.71
Х\ш №6/99 с.71 - Детство Менделеева. Х №7/02
- Открытие радия. Х №12/96.
- Х\ш №10/02 с. 45 (карточки)
- Х\ш № 3/01 с. 93(о периодическом законе).
Видео с вопросами: Описание Периодической таблицы как развивающейся научной модели
Стенограмма видео
Периодическая таблица является примером модель. Это позволяет ученым делать предсказания путем выделения закономерностей в свойствах элементов. Открытие новых элементов позволило ученым заполнить пробелы и исправить ошибки в исходном периодическом стол. Какое из следующих слов лучше всего описывает модель, использованную для построения исходной таблицы Менделеева?
Вероятно, самый первый периодический
стол пришел в 1863 году от Александра-Эмиля Бегуйе де Шанкуртуа, который поставил элементы на
спираль на листе бумаги. Элементы располагались на
цилиндр слева направо по относительной атомной массе и расположен вертикально с помощью
спираль по химическому поведению. Однако эта версия не
обычно считается традиционным столом.
Однако эта версия не
обычно считается традиционным столом.
Традиционно оригинал
Периодическая таблица принадлежит Дмитрию Ивановичу Менделееву в 1869 году., который устроил
элементов снизу вверх по относительной атомной массе и слева направо в периодическом
химическое поведение. В 1871 году Менделеев произвел
исправленная версия, в которой периоды располагались сверху вниз, а группы — слева направо.
как наша современная таблица Менделеева. Ключевой признак, отличавший
Система Менделеева от предыдущих систем заключалась в том, что он оставлял пробелы, используя существующие данные
предсказывать свойства неизвестных элементов. Это сделало таблицу Менделеева очень
хорошая модель, потому что она позволяла делать точные прогнозы. Новые элементы любят скандий,
галлий и германий были обнаружены позже и естественным образом вставлены в щели,
очень точно соответствует предсказаниям.
Теперь давайте посмотрим на вопрос. Нам нужно посмотреть на пять слов и найдите тот, который лучше всего описывает модель, использованную в исходной периодической таблице. Эти три принципа организации составляют модель, используемую для изготовления стола. Вот это было бы совершенно точно сказать, что таблица Менделеева неверна. Было много вещей, которые с момента изменения.
Но вопрос не в том, чтобы просто задать
для любого описания. Мы ищем лучших
описание, которое отдает должное великой работе, которой это было. Таким образом, исходная таблица была неправильной в
некоторые отношения. Но это также было правильно во многих
уважает. Также было бы справедливо сказать, что
Таблицы Менделеева были в корне ошибочны, потому что в них использовалась относительная атомная масса.
а не атомный номер, как мы используем сегодня.
Однако на основании данных время теллур и йод были единственной парой элементов, последовательность. У теллура был более высокий родственник атомная масса, но его химическое поведение означало, что он лучше подходил, если он был до йода а не после. Что было бы несправедливо, так это называть Таблицы Менделеева ненаучны, потому что они отражают понимание данных доступны в то время.
То, что Менделеев оставил пробелы на это указывают данные и тот факт, что он поменял местами теллур и йод несмотря на то, что это не соответствует принципу относительной атомной массы, предполагается, что он был искренне думал о том, что он делает. Он не хотел просто делать данные соответствуют его теории.
Последнее слово, которое мы могли применить
разумно для таблиц Менделеева просто «неполна». Это было сделано до того, как мы поняли
атомов более подробно и до того, как мы поняли протоны и их влияние на
химическое поведение.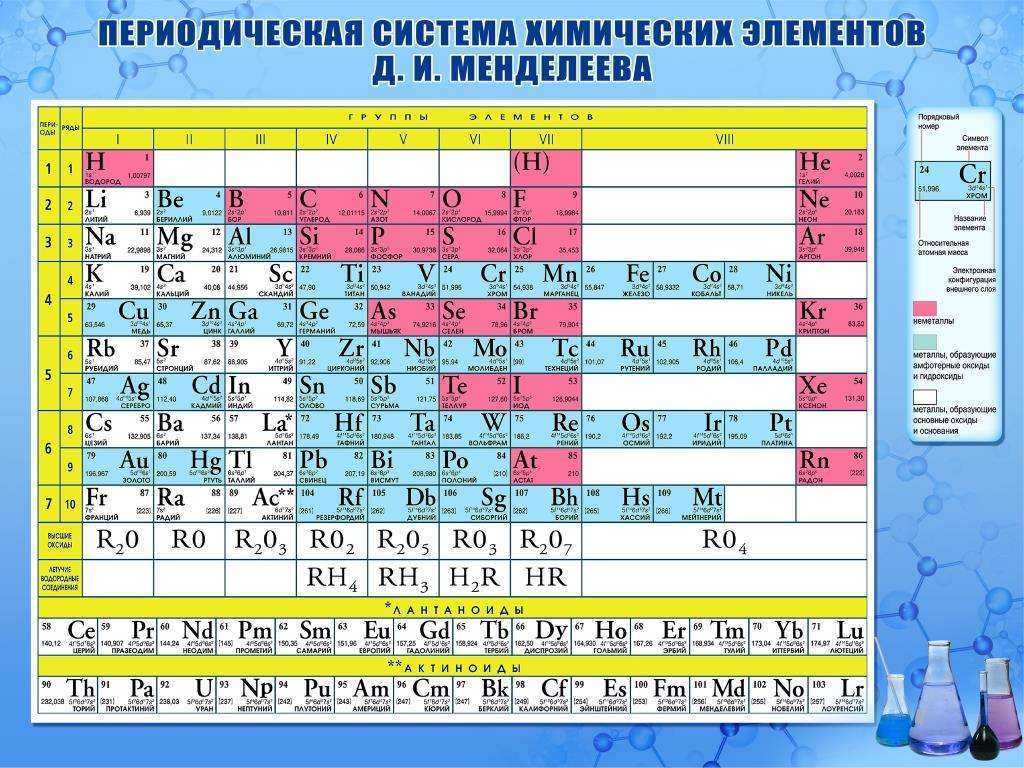 Из всех ответов это самый
прекраснейший. Пока были неправильные и правильные
и недостатки в таблице, это был шаг в правильном направлении, решающий
поворот в нашем понимании элементов.
Из всех ответов это самый
прекраснейший. Пока были неправильные и правильные
и недостатки в таблице, это был шаг в правильном направлении, решающий
поворот в нашем понимании элементов.
Как и многие научные модели и теории, развитие происходит поэтапно. И нам не обязательно отказаться от модели только потому, что она не идеальна. Итак, из пяти слов, которые мы заданной, которая лучше всего описывает модель, используемую для построения исходного периодического таблица «неполная».
Какое из следующих утверждений о современной таблице Менделеева верно a В ней 18 горизонтальных строк …
Перейти к
- Упражнение
- Глава 1 Химические реакции и уравнения
- Глава 2 Кислоты, основания и соли
- Глава 3 Металлы и неметаллы
- Глава 4 Углерод и его соединения
- Глава 5 Периодическая классификация элементов
Главная > Лахмир Сингх Солюшнс Класс 10 Химия > Глава 5 – Глава 5 Периодическая классификация элементов >
Вопрос 25 Упражнение
Какое из следующих утверждений о современной периодической таблице верно?
(a) Он состоит из 18 горизонтальных рядов, называемых точками
(b) Он состоит из 7 вертикальных столбцов, называемых периодами
(c) Он имеет 18 вертикальных столбцов, известных как группы
(d) Он имеет 7 горизонтальных рядов, известных как группы
Ответ:
Вариант (c) является ответом.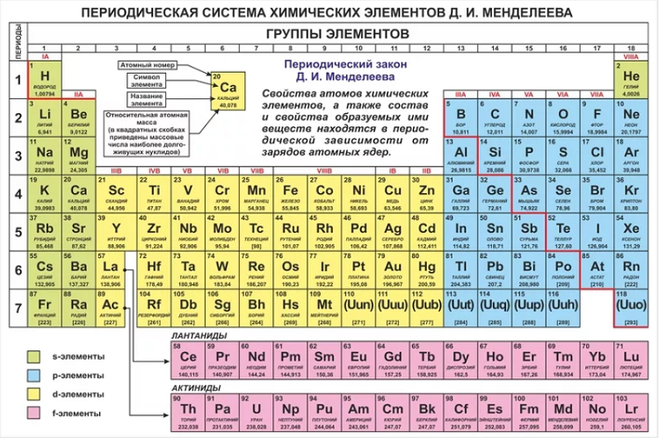

 Он полон событий, сомнений
Он полон событий, сомнений


 Х\ш №6/99 с.71
Х\ш №6/99 с.71