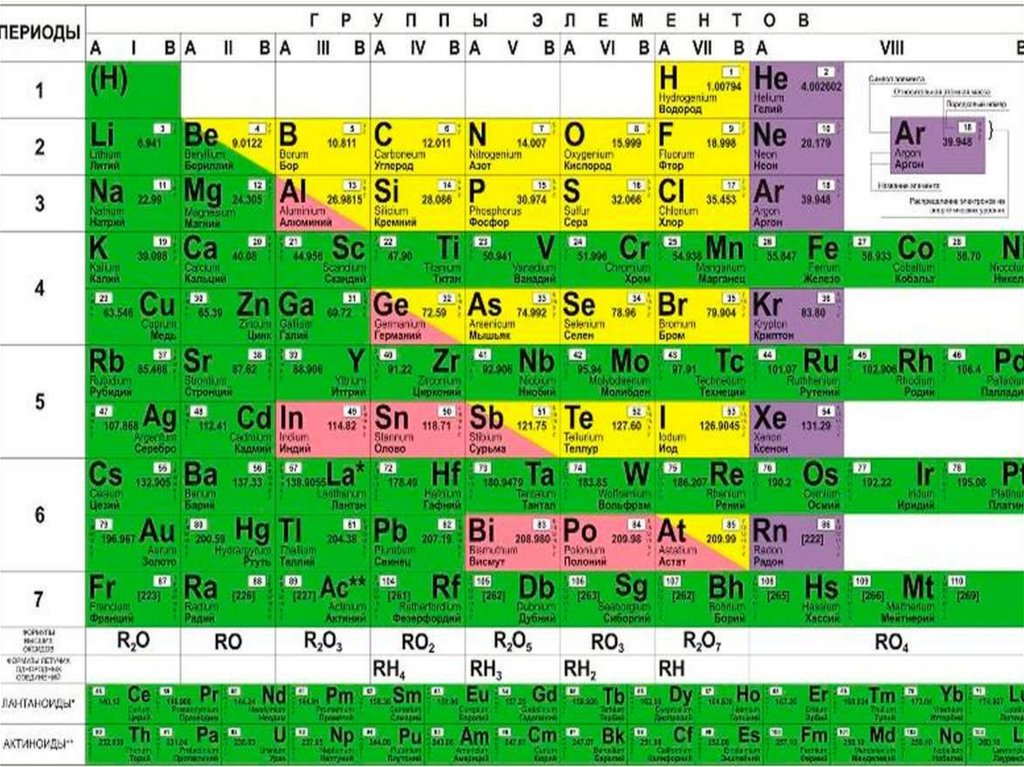
Электронные формулы и графические схемы атомов химических элементов
Здесь Вы можете познакомится с подробной информацией по электронной конфигурации атома любого элемента из периодической системы Менделеева. Эта информация включает в себя электронные формулы (в порядке возрастания энергий орбиталей и в порядке следования уровней), графические схемы распределения электронов по энергетическим уровням, а также таблицы квантовых чисел (главное, орбитальное, магнитное, спин) валентных электронов.
Список всех химических элементов
[1] H (водород)
[2] He (гелий)
[3] Li (литий)
[4] Be (бериллий)
[5] B (бор)
[6] C (углерод)
[7] N (азот)
[8] O (кислород)
[9] F (фтор)
[10] Ne (неон)
[11] Na (натрий)
[12] Mg (магний)
[13] Al (алюминий)
[14] Si (кремний)
[15] P (фосфор)
[16] S (сера)
[17] Cl (хлор)
[18] Ar (аргон)
[19] K (калий)
[20] Ca (кальций)
[21] Sc (скандий)
[22] Ti (титан)
[23] V (ванадий)
[24] Cr (хром)
[25] Mn (марганец)
[26] Fe (железо)
[27] Co (кобальт)
[28] Ni (никель)
[29] Cu (медь)
[30] Zn (цинк)
[31] Ga (галлий)
[32] Ge (германий)
[33] As (мышьяк)
[34] Se (селен)
[35] Br (бром)
[36] Kr (криптон)
[37] Rb (рубидий)
[38] Sr (стронций)
[39] Y (иттрий)
[40] Zr (цирконий)
[41] Nb (ниобий)
[42] Mo (молибден)
[43] Tc (технеций)
[44] Ru (рутений)
[45] Rh (родий)
[46] Pd (палладий)
[47] Ag (серебро)
[48] Cd (кадмий)
[49] In (индий)
[50] Sn (олово)
[51] Sb (сурьма)
[52] Te (теллур)
[53] I (йод)
[54] Xe (ксенон)
[55] Cs (цезий)
[56] Ba (барий)
[57] La (лантан)
[58] Ce (церий)
[59] Pr (празеодим)
[60] Nd (неодим)
[61] Pm (прометий)
[62] Sm (самарий)
[63] Eu (европий)
[64] Gd (гадолиний)
[65] Tb (тербий)
[66] Dy (диспрозий)
[67] Ho (гольмий)
[68] Er (эрбий)
[69] Tm (тулий)
[70] Yb (иттербий)
[71] Lu (лютеций)
[72] Hf (гафний)
[73] Ta (тантал)
[74] W (вольфрам)
[75] Re (рений)
[76] Os (осмий)
[77] Ir (иридий)
[78] Pt (платина)
[79] Au (золото)
[80] Hg (ртуть)
[81] Tl (таллий)
[82] Pb (свинец)
[83] Bi (висмут)
[84] Po (полоний)
[85] At (астат)
[86] Rn (родон)
[87] Fr (франций)
[88] Ra (радий)
[89] Ac (актиний)
[90] Th (торий)
[91] Pa (протактиний)
[92] U (уран)
[93] Np (нептуний)
[94] Pu (плутоний)
[95] Am (амерций)
[96] Cm (кюрий)
[97] Bk (берклий)
[98] Cf (калифорний)
[99] Es (эйнштейний)
[100] Fm (фермий)
[101] Md (менделевий)
[102] No (нобелий)
[103] Lr (лоуренсий)
[104] Rf (резерфордий)
[105] Db (дубний)
[106] Sg (сиборгий)
[107] Bh (борий)
[108] Hs (хассий)
[109] Mt (мейтнерий)
[110] Ds (дармштадтий)
[111] Rg (рентгений)
[112] Cn (коперниций)
[113] Nh (нихоний)
[114] Fl (флеровий)
[115] Mc (московий)
[116] Lv (ливерморий)
[117] Ts (теннесcин)
[118] Og (оганесон)
Таблица электронных формул химических элементов
Здесь представлены электронные формулы химических элементов периодической таблицы Менделеева. Более подробную информацию о структуре каждого элемента
(электронные формулы, графические схемы, распределение электронов по энергетическим уровням) можно посмотреть здесь.
Более подробную информацию о структуре каждого элемента
(электронные формулы, графические схемы, распределение электронов по энергетическим уровням) можно посмотреть здесь.
| № | Элемент | Электронная формула |
|---|---|---|
| 1 | H (водород) | 1s1 |
| 2 | He (гелий) | |
| 3 | Li (литий) | [He] 2s1 |
| 4 | Be (бериллий) | [He] 2s2 |
| 5 | B (бор) | [He] 2s2 2p1 |
| 6 | C (углерод) | [He] 2s2 2p2 |
| 7 | N (азот) | [He] 2s2 2p3 |
| 8 | O (кислород) | [He] 2s2 2p4 |
| 9 | F (фтор) | [He] 2s2 2p5 |
| 10 | Ne (неон) | [He] 2s2 2p6 |
| 11 | Na (натрий) | [Ne] 3s1 |
| 12 | Mg (магний) | [Ne] 3s2 |
| 13 | Al (алюминий) | [Ne] 3s2 3p1 |
| 14 | Si (кремний) | [Ne] 3s2 3p2 |
| 15 | P (фосфор) | [Ne] 3s2 3p3 |
| 16 | S (сера) | [Ne] 3s2 3p4 |
| 17 | Cl (хлор) | [Ne] 3s2 3p5 |
| 18 | Ar (аргон) | [Ne] 3s2 3p6 |
| 19 | K (калий) | [Ar] 4s1 |
| 20 | Ca (кальций) | [Ar] 4s2 |
| 21 | Sc (скандий) | [Ar] 3d |
| 22 | Ti (титан) | [Ar] 3d2 4s2 |
| 23 | V (ванадий) | [Ar] 3d3 4s2 |
| 24 | Cr (хром) | [Ar] 3d5 4s1 |
| 25 | Mn (марганец) | [Ar] 3d5 4s2 |
| 26 | Fe (железо) | [Ar] 3d6 4s2 |
| 27 | Co (кобальт) | [Ar] 3d7 4s2 |
| 28 | Ni (никель) | [Ar] 3d8 4s2 |
| 29 | Cu (медь) | [Ar] 3d10 4s1 |
| 30 | Zn (цинк) | [Ar] 3d10 4s2 |
| 31 | Ga (галлий) | [Ar] 3d10 4s2 4p1 |
| 32 | Ge (германий) | [Ar] 3d10 4s2 4p2 |
| 33 | As (мышьяк) | [Ar] 3d10 4s2 4p3 |
| 34 | Se (селен) | [Ar] 3d10 4s2 4p4 |
| 35 | Br (бром) | [Ar] 3d10 4s2 4p5 |
| 36 | Kr (криптон) | [Ar] 3d10 4s2 4p6 |
| 37 | Rb (рубидий) | [Kr] 5s1 |
| 38 | Sr (стронций) | [Kr] 5s2 |
| 39 | Y (иттрий) | [Kr] 4d1 5s2 |
| 40 | Zr (цирконий) | [Kr] 4d2 5s2 |
| 41 | Nb (ниобий) | [Kr] 4d4 5s1 |
| 42 | Mo (молибден) | [Kr] 4d5 5s1 |
| 43 | Tc (технеций) | [Kr] 4d5 5s2 |
| 44 | Ru (рутений) | [Kr] 4d7 5s1 |
| 45 | Rh (родий) | [Kr] 4d8 5s1 |
| 46 | Pd (палладий) | |
| 47 | Ag (серебро) | [Kr] 4d10 5s1 |
| 48 | Cd (кадмий) | [Kr] 4d10 5s2 |
| 49 | In (индий) | [Kr] 4d10 5s2 5p1 |
| 50 | Sn (олово) | [Kr] 4d10 5s2 5p2 |
| 51 | Sb (сурьма) | [Kr] 4d10 5s2 5p3 |
| 52 | Te (теллур) | [Kr] 4d10 5s2 5p4 |
| 53 | I (йод) | [Kr] 4d10 5s2 5p5 |
| 54 | Xe (ксенон) | [Kr] 4d10 |
| 55 | Cs (цезий) | [Xe] 6s1 |
| 56 | Ba (барий) | [Xe] 6s2 |
| 57 | La (лантан) | [Xe] 5d1 6s2 |
| 58 | Ce (церий) | [Xe] 4f1 5d1 6s2 |
| 59 | Pr (празеодим) | [Xe] 4f3 6s2 |
| 60 | Nd (неодим) | [Xe] 4f4 6s2 |
| 61 | Pm (прометий) | [Xe] 4f5 6s2 |
| 62 | Sm (самарий) | [Xe] 4f6 6s2 |
| 63 | [Xe] 4f7 6s2 | |
| 64 | Gd (гадолиний) | [Xe] 4f7 5d1 6s2 |
| 65 | Tb (тербий) | [Xe] 4f9 6s2 |
| 66 | Dy (диспрозий) | [Xe] 4f10 6s2 |
| 67 | Ho (гольмий) | [Xe] 4f11 6s2 |
| 68 | Er (эрбий) | [Xe] 4f12 6s2 |
| 69 | Tm (тулий) | [Xe] 4f13 6s2 |
| 70 | Yb (иттербий) | [Xe] 4f14 6s2 |
| 71 | [Xe] 4f14 5d1 6s2 | |
| 72 | Hf (гафний) | [Xe] 4f14 5d2 6s2 |
| 73 | Ta (тантал) | [Xe] 4f14 5d3 6s2 |
| 74 | W (вольфрам) | [Xe] 4f14 5d4 6s2 |
| 75 | Re (рений) | [Xe] 4f14 5d5 6s2 |
| 76 | Os (осмий) | [Xe] 4f14 5d6 6s2 |
| 77 | Ir (иридий) | [Xe] 4f14 5d7 6s2 |
| 78 | Pt (платина) | [Xe] 4f14 5d9 6s1 |
| 79 | Au (золото) | [Xe] 4f14 5d10 6s1 |
| 80 | Hg (ртуть) | [Xe] 4f14 5d10 6s2 |
| 81 | Tl (таллий) | [Xe] 4f14 5d10 6s2 6p1 |
| 82 | Pb (свинец) | [Xe] 4f14 5d10 6s2 6p2 |
| 83 | Bi (висмут) | [Xe] 4f14 5d10 6s2 6p3 |
| 84 | Po (полоний) | [Xe] 4f14 5d10 6s2 6p4 |
| 85 | At (астат) | [Xe] 4f14 5d10 6s2 6p5 |
| 86 | Rn (родон) | [Xe] 4f14 5d10 6s2 6p6 |
| 87 | Fr (франций) | [Rn] 7s1 |
| 88 | Ra (радий) | [Rn] 7s2 |
| 89 | Ac (актиний) | [Rn] 6d1 7s2 |
| 90 | Th (торий) | [Rn] 6d2 7s2 |
| 91 | Pa (протактиний) | [Rn] 5f2 6d1 7s2 |
| 92 | U (уран) | [Rn] 5f3 6d1 7s2 |
| 93 | Np (нептуний) | [Rn] 5f4 6d1 7s2 |
| 94 | Pu (плутоний) | [Rn] 5f6 7s2 |
| 95 | Am (амерций) | [Rn] 5f7 7s2 |
| 96 | Cm (кюрий) | [Rn] 5f7 6d1 7s2 |
| 97 | Bk (берклий) | [Rn] 5f9 7s2 |
| 98 | Cf (калифорний) | [Rn] 5f10 7s2 |
| 99 | Es (эйнштейний) | [Rn] 5f11 7s2 |
| 100 | Fm (фермий) | [Rn] 5f12 7s2 |
| 101 | Md (менделевий) | [Rn] 5f13 7s2 |
| 102 | No (нобелий) | [Rn] 5f14 7s2 |
| 103 | Lr (лоуренсий) | [Rn] 5f14 6d1 7s2 |
| 104 | Rf (резерфордий) | [Rn] 5f14 6d2 7s2 |
| 105 | Db (дубний) | [Rn] 5f14 6d3 7s2 |
| 106 | Sg (сиборгий) | [Rn] 5f14 6d4 7s2 |
| 107 | Bh (борий) | [Rn] 5f14 6d5 7s2 |
| 108 | Hs (хассий) | [Rn] 5f14 6d6 7s2 |
| 109 | Mt (мейтнерий) | [Rn] 5f14 6d7 7s2 |
| 110 | Ds (дармштадтий) | [Rn] 5f14 6d8 7s2 |
| 111 | Rg (рентгений) | [Rn] 5f14 6d9 7s2 |
| 112 | Cn (коперниций) | [Rn] 5f14 6d10 7s2 |
| 113 | Nh (нихоний) | [Rn] 5f14 6d10 7s2 7p1 |
| 114 | Fl (флеровий) | [Rn] 5f14 6d10 7s2 7p2 |
| 115 | Mc (московий) | [Rn] 5f14 6d10 7s2 7p3 |
| 116 | Lv (ливерморий) | [Rn] 5f14 6d10 7s2 7p4 |
| 117 | Ts (теннесcин) | [Rn] 5f14 6d10 7s2 7p5 |
| 118 | Og (оганесон) | [Rn] 5f14 6d10 7s2 7p6 |
Электронная конфигурация — элементы периодической таблицы
Электронная конфигурация элементов периодической таблицы
Электронная конфигурация или общая электронная конфигурация или электронная структура атомов или ионов — это расположение орбитальных энергетических уровней для s, p, d и элементы f-блока периодической таблицы. В химии или химической науке электрон держит ключ к химическому миру для изучения свойств и положения элементов в периодической таблице. Электронная конфигурация или формула электронного расположения элементов периодической таблицы используется для лучшего понимания химических свойств.
В химии или химической науке электрон держит ключ к химическому миру для изучения свойств и положения элементов в периодической таблице. Электронная конфигурация или формула электронного расположения элементов периодической таблицы используется для лучшего понимания химических свойств.
Окислительно-восстановительные свойства, степень окисления, энергия ионизации, сродство к электрону, экранирующий эффект, полярность химических связей, свойства кислот и оснований можно объяснить электронной конфигурацией.
Реакцией достижения химического равновесия является изменение электронной конфигурации атомов реагента и продукта. Следовательно, органические и неорганические химические реакции лучше понимаются электронной конфигурацией элементов.
Как найти электронную конфигурацию?
Чтобы найти формулу конфигурации электрона, сначала мы находим порядок электронных энергетических уровней s, p, d и f орбиталей или подуровней. Например, 3s-орбиталь имеет более низкую энергию, чем 3p-орбитали, которые также имеют более низкую энергию, чем 3d-уровень.
Современная классификация элементов таблицы Менделеева, такая как блоки s, p, d и f, основана на свойствах и общей электронной или электронной конфигурации элементов.
Что такое энергетические уровни электрона?
Энергетические уровни — это фиксированные расстояния, на которых электроны вращаются вокруг ядра с определенной энергией. Энергия, связанная с определенным энергетическим уровнем, увеличивается с увеличением его расстояния от ядра.
Атом водорода содержит только один электрон на энергетических уровнях водорода 1s с электронной конфигурацией 1s 1 .
Но читателям трудно запомнить диаграмму уровней энергии электрона для многих электронных конфигураций. Поэтому тривиальный, но наиболее удобный способ запомнить эти электронные энергетические уровни приведен ниже на диаграмме.
- Различные электронные орбитали, происходящие из одних и тех же электронных уровней энергии, написаны горизонтальными линиями.
- Теперь через электронные орбитали проведены наклонные параллельные линии, как показано на рисунке выше.

- Заполнение различных орбиталей по количеству электронов будет соответствовать конфигурации этих линий. Согласно приведенной выше структуре диаграммы, энергетические уровни конфигурации с электроном построены в следующем порядке: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f…
Количество электронов на энергетических уровнях
Заполнение электронных орбиталей электронами вокруг ядер атомов происходит по определенным правилам. Максимальное число электронов на основных энергетических уровнях = 2n 2 , где n = главное квантовое число.
Максимальное количество электронов в подоболочках типа s, p, d и f орбиталей = 2(2l + 1). Где l = 0, 1, 2, 3 для s, p, d, f орбиталей. Следовательно, энергетические уровни s, p, d, f имеют максимум 2, 6, 10, 14 электронов соответственно.
Принцип Ауфбау и электронная конфигурация
Немецкий ученый Ауфбау сформулировал принцип построения процесса электронной конфигурации на различных электронных орбиталях атомов. По этому принципу электроны заполняются в порядке убывания энергии.
По этому принципу электроны заполняются в порядке убывания энергии.
Орбитали с самой низкой энергией заполняются первыми, а орбитали с самой высокой энергией заполняются в конце. Электрон будет стремиться к максимальному спину. Электроны с одинаковым спином настраиваются первыми.
Что такое правило Хунда?
Согласно правилу Хунда, электроны заполняют орбитали с максимальной множественностью спинов. Спаривание спинов происходит только тогда, когда вакантные орбитали с одинаковой энергией недоступны для заполнения.
Электронная конфигурация и периодическая таблица
Формула электронной конфигурации используется для получения некоторых основных свойств, таких как электромагнитный спектр, химическая связь, электрическая поляризация, дипольный момент, водородная связь и т. д. Современные периодические таблицы классифицируются на основе химического поведения и электронная конфигурация элементов.
Формула электронной конфигурации элементов должна быть связана с таблицей Менделеева.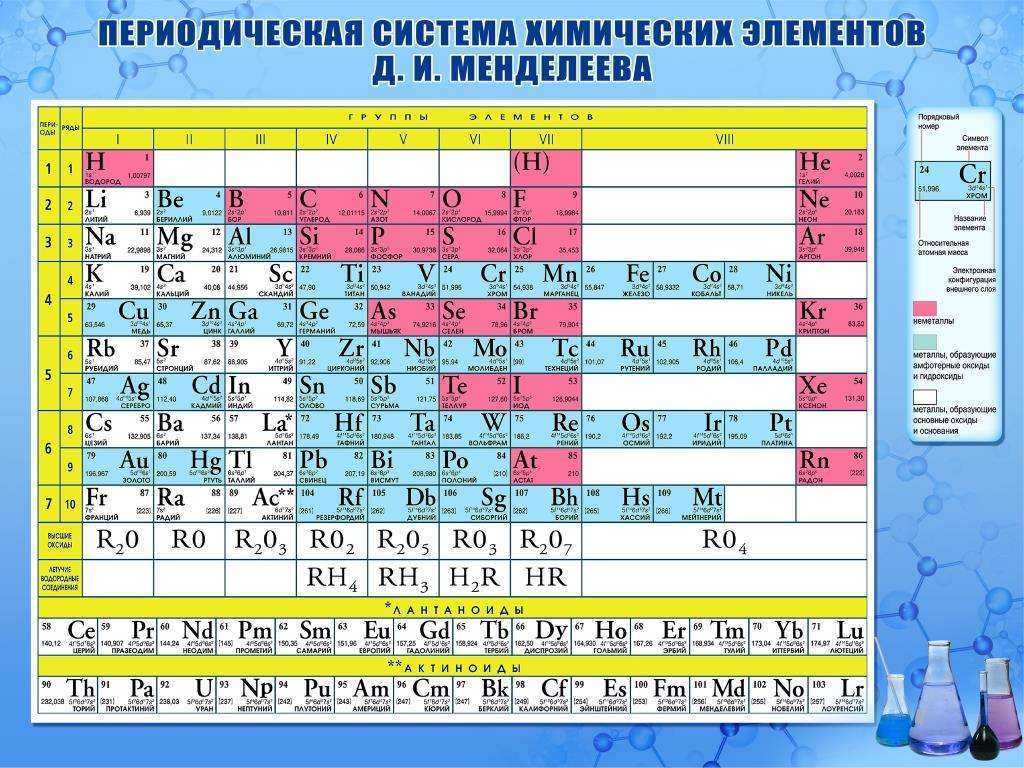 В соответствии с электронной конфигурацией элементы периодической таблицы подразделяются на четыре блока s, p, d и элементы f-блока.
В соответствии с электронной конфигурацией элементы периодической таблицы подразделяются на четыре блока s, p, d и элементы f-блока.
Электронная конфигурация элементов s-блока
Для элементов s-блока электрон входит на ns-орбитали и постепенно заполняется атомным номером.
Группа-1 и 2 относятся к элементам s-блока в периодической таблице с общей электронной конфигурацией ns 1→2 , где n = количество электронных оболочек или количество периодов, в которых присутствует элемент.
Электронная конфигурация элементов группы 1
Группа 1 или IA в периодической таблице содержит семь элементов, таких как водород, литий, натрий, калий, рубидий, цезий и франций.
Общая электронная конфигурация валентного электрона = ns 1 , где n = от 1 до 7. Благодаря наличию одного электрона во внешней электронной структуре они имеют очень низкую энергию ионизации, но очень высокое сродство к электрону.
| Атомный номер | Символ | Имя | Электронная конфигурация |
| 1 | Х | Водород | 1 с 1 |
| 3 | Ли | Литий | 1 с 2 2 с 1 |
| 11 | Нет | Натрий | [Не] 3s 1 |
| 19 | К | Калий | [Ar] 4 с 1 |
| 37 | руб | Рубидий | [Кр] 5 с 1 |
| 55 | Cs | Цезий | [Хе] 6с 1 |
| 87 | Пт | Франций | [Rn] 7s 1 |
Электронная конфигурация элементов группы 2
Элементы группы 2 или IIA в периодической таблице: бериллий, магний, кальций, стронций, барий и радий. Их еще называют щелочноземельными металлами.
Их еще называют щелочноземельными металлами.
Электронная конфигурация валентной оболочки элементов группы 2 или щелочноземельных металлов имеет вид ns 2 , где n = от 1 до 6.
| Атомный номер | Символ | Имя | Электронная конфигурация |
| 4 | Быть | Бериллий | 1 с 2 2 с 2 |
| 12 | мг | Магний | [Не] 3s 2 |
| 20 | Са | Кальций | [Ar] 4s 2 |
| 38 | Старший | Стронций | [Кр] 5 с 2 |
| 56 | Ба | Барий | [Хе] 6с 2 |
| 88 | Ра | Радий | [Rn] 7s 2 |
Электронная конфигурация элементов p-блока
Элементы, в которых p-орбиталь постепенно заполняется электронами, называются p-блоком в периодической таблице. Гелий, электронная конфигурация которого 1s 2 , но гелий является членом элементов p-блока.
Гелий, электронная конфигурация которого 1s 2 , но гелий является членом элементов p-блока.
p-блок содержит шесть групп от группы-13 до группы-18. Общая формула электронной конфигурации для нахождения внешней электронной конфигурации элемента p-блока: ns 2 нп 1→6 .
Электронная конфигурация элементов группы 13
Группа 13 или IIIA содержит пять элементов: бор, алюминий, галлий, индий и таллий. Электронная конфигурация валентной оболочки элементов группы 13: ns 2 np 1 .
| Атомный номер | Символ | Имя | Электронная конфигурация |
| 5 | Б | Бор | 1с 2 2с 2 2п 1 |
| 13 | Ал | Алюминий | [Ne] 3s 2 3p 1 |
| 31 | Га | Галиум | [Ar] 3d 10 4s 2 4p 1 |
| 49 | В | Индий | [Кр] 4d 10 5s 2 5p 1 |
| 81 | Тл | Таллий | [Xe] 4f 14 5d 10 6s 2 6p 1 |
| 113 | Нх | Нихоний | [Rn] 5f 14 6d 10 7s 2 7p 1 |
Электронная конфигурация элементов группы 14
Углерод, кремний, германий, олово и свинец в периодической таблице относятся к группе 14 или IVA. Общая электронная конфигурация элементов группы 14 ns 2 np 2 , где n = от 2 до 6.
Общая электронная конфигурация элементов группы 14 ns 2 np 2 , где n = от 2 до 6.
| Атомный номер | Символ | Имя | Электронная конфигурация |
| 6 | С | Углерод | 1с 2 2с 2 2п 2 |
| 14 | Си | Кремний | [Ne] 3s 2 3p 2 |
| 32 | Гэ | Германий | [Ar] 3d 10 4s 2 4p 2 |
| 50 | Сн | Олово | [Кр] 4d 10 5s 2 5p 2 |
| 82 | Пб | Свинец | [Xe] 4f 14 5d 10 6s 2 6p 2 |
| 114 | Фл | Флеровиум | [Rn] 5f 14 6d 10 7s 2 7p 2 |
Электронная конфигурация элементов группы 15
Пять элементов группы 15 или VA – это азот, фосфор, мышьяк, сурьма и висмут. Электронная конфигурация элементов группы 15: ns 2 np 3 , где n = от 2 до 6.
Электронная конфигурация элементов группы 15: ns 2 np 3 , где n = от 2 до 6.
| Атомный номер | Символ | Имя | Электронная конфигурация |
| 7 | Н | Азот | 1с 2 2с 2 2п 3 |
| 15 | Р | Фосфор | [Ne] 3s 2 3p 3 |
| 33 | Как | Мышьяк | [Ar] 3d 10 4s 2 4p 3 |
| 51 | Сб | Сурьма | [Кр] 4d 10 5s 2 5p 3 |
| 83 | Би | Висмут | [Xe] 4f 14 5d 10 6s 2 6p 3 |
| 115 | Мак | Московиум | [Rn] 5f 14 6d 10 7s 2 7p 3 |
Электронная конфигурация элементов группы 16
Кислород, сера, селен, теллур и полоний в периодической таблице относятся к группе-16 или VIA. Общая электронная конфигурация элементов группы 16: ns 2 np 4 , где n = от 2 до 6.
Общая электронная конфигурация элементов группы 16: ns 2 np 4 , где n = от 2 до 6.
| Атомный номер | Символ | Имя | Электронная конфигурация |
| 8 | О | Кислород | 1 с 2 2с 2 2п 4 |
| 16 | С | Сера | [Ne] 3s 2 3p 4 |
| 34 | Se | Селен | [Ar] 3d 10 4s 2 4p 4 |
| 52 | Те | Теллурий | [Кр] 4d 10 5s 2 5p 4 |
| 84 | По | Полоний | [Xe] 4f 14 5d 10 6s 2 6p 4 |
| 116 | ур. | Ливермориум | [Rn] 5f 14 6d 10 7s 2 7p 4 |
Электронная конфигурация элементов группы 17
Фтор, хлор, бром, йод и астат в периодической таблице относятся к группе 17 или VIIA. Общая электронная конфигурация элементов группы 17: ns 2 np 5 , где n = от 2 до 6.
| Атомный номер | Символ | Имя | Электронная конфигурация |
| 9 | Ф | Фтор | 1с 2 2с 2 2п 5 |
| 17 | Кл | Хлор | [Ne] 3s 2 3p 5 |
| 35 | Бр | Бром | [Ar] 3d 10 4s 2 4p 5 |
| 53 | я | Йод | [Кр] 4d 10 5s 2 5p 5 |
| 85 | Как | Астатин | [Xe] 4f 14 5d 10 6s 2 6p 5 |
| 117 | Ц | Теннесси | [Rn] 5f 14 6d 10 7s 2 7p 5 |
Электронная конфигурация благородных газов
Неон, аргон, криптон, ксенон и радон в периодической таблице относятся к группе 18 или благородным газам. Общая электронная конфигурация благородных газов или элементов группы 18: ns 2 np 6 , где n = от 1 до 6.
Общая электронная конфигурация благородных газов или элементов группы 18: ns 2 np 6 , где n = от 1 до 6.
| Атомный номер | Символ | Имя | Электронная конфигурация |
| 2 | Он | Гелий | 1с 2 |
| 10 | Не | Неон | [He] 2s 2 2p 6 |
| 18 | Ар | Аргон | [Ne] 3s 2 3p 6 |
| 36 | Кр | Криптон | [Ar] 3d 10 4s 2 4p 6 |
| 54 | Хе | Ксенон | [Кр] 4d 10 5s 2 5p 6 |
| 86 | Р-н | Радон | [Xe] 4f 14 5d 10 6s 2 6p 6 |
| 118 | ОС | Оганесон | [Rn] 5f 14 6d 10 7s 2 7 шт.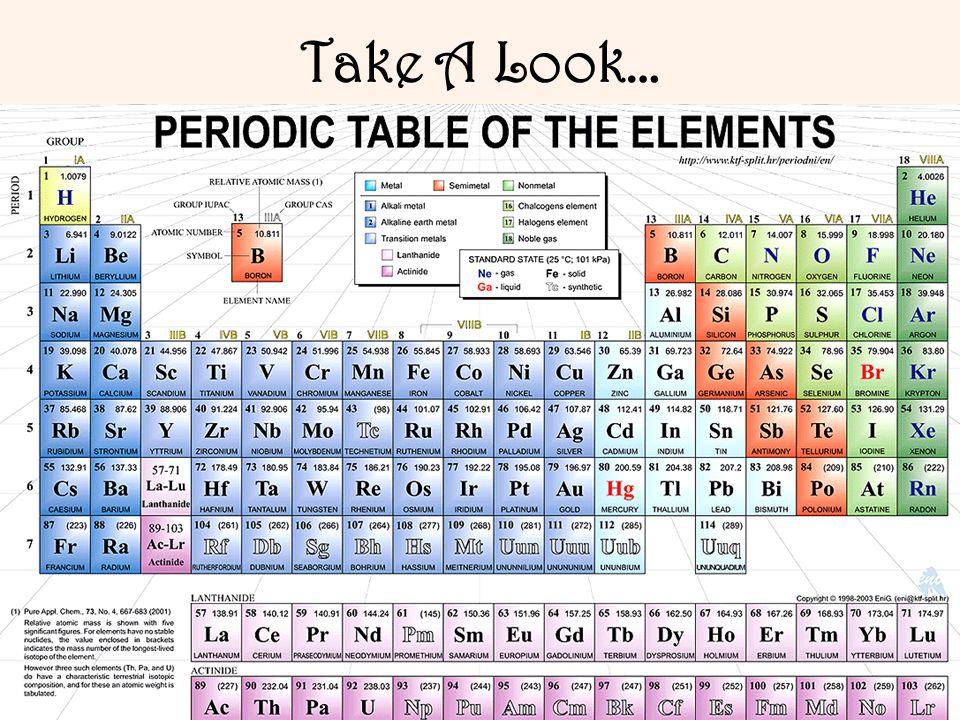 6 6 |
Электронная конфигурация элементов d-блока
Элементы, в которых электрон находится на (n−1)d-орбитали, называются элементами d-блока. Они помещены в середину таблицы Менделеева, между элементами s- и p-блока из-за их химического поведения, такого как точка Боинга, удельная теплоемкость плавления, плотность, энергия ионизации, связь и т. д.
Общая электронная конфигурация валентного электрона элементов 3d, 4d, 5d, 6d, представленных как ns 0,1,2 (n−1)d 1→10 .
Эти элементы называются переходными металлами или элементами. Названия, символы и электронная конфигурация валентной оболочки всех элементов d-блока или переходных металлов приведены под рисунком.
Электронная конфигурация элементов 3d-блока
первый переходный ряд начинается со скандия и заканчивается цинком. Когда двадцать первый электрон переходит на следующую доступную 3d-орбиталь с более высокой энергией, пять подоболочек 3d заполняются десятью электронами.
Общая электронная конфигурация валентного электрона 3d-серии или первой переходной серии, такой как скандий, титан, ванадий, хром, марганец, железо, кобальт, никель, медь и цинк, представляет собой [Ar] 4S 1→2 3d 1 →10 .
| Атомный номер | Символ | Имя | Электронная конфигурация |
| 21 | Sc | Скандий | [Ar] 4s 2 3d 1 |
| 22 | Ти | Титан | [Ar] 4s 2 3d 2 |
| 23 | В | Ванадий | [Ar] 4s 2 3d 3 |
| 24 | Кр | Хром | [Ar] 4s 1 3d 5 |
| 25 | Мн | Марганец | [Ar] 4s 2 3d 5 |
| 26 | Фе | Железо | [Ar] 4s 2 3d 6 |
| 27 | Ко | Кобальт | [Ar] 4s 2 3d 7 |
| 28 | Ni | Никель | [Ar] 4s 2 3d 8 |
| 29 | Медь | Медь | [Ar] 4s 1 3d 10 |
| 30 | Цинк | Цинк | [Ar] 4s 1 3d 10 |
Элементы 4d-блока
| Атомный номер | Символ | Имя | Электронная конфигурация |
| 39 | Д | Иттрий | [Кр] 4д 1 5 с 2 |
| 40 | Зр | Цирконий | [Кр] 4d 2 5s 2 |
| 41 | № | Ниобий | [Кр] 4d 3 5s 2 |
| 42 | Пн | Молибден | [Кр] 4d 5 5s 1 |
| 43 | Тс | Технеций | [Кр] 4д 5 5 с 2 |
| 44 | Ру | Рутений | [Kr] 4d 7 5s 1 |
| 45 | Rh | Родий | [Kr] 4d 8 5s 1 |
| 46 | ПД | Палладий | [Kr] 4d 10 5s 0 |
| 47 | Аг | Серебро | [Кр] 4д 10 5 с 1 |
| 48 | CD | Кадмий | [Kr] 4d 10 5s 2 |
Элементы 5d-блока
| Атомный номер | Символ | Имя | Электронная конфигурация |
| 57 | Ла | Лантан | [Хе] 5д 1 6с 2 |
| 72 | Хф | Гафний | [Xe] 4f 14 5d 2 6s 2 |
| 73 | Та | Тантал | [Xe] 4f 14 5d 3 6s 2 |
| 74 | Вт | Вольфрам | [Xe] 4f 14 5d 4 6s 2 |
| 75 | Ре | Рений | [Xe] 4f 14 5d 5 6s 2 |
| 76 | ОС | Осмий | [Xe] 4f 14 5d 6 6s 2 |
| 77 | Ир | Иридий | [Xe] 4f 14 5d 7 6s 2 |
| 78 | Пт | Платина | [Xe] 4f 14 5d 9 6s 1 |
| 79 | Золото | Золото | [Xe] 4f 14 5d 10 6s 1 |
| 80 | рт. ст. ст. | Меркурий | [Xe] 4f 14 5d 10 6s 2 |
Элементы 6d-блока
| Атомный номер | Символ | Имя | Электронная конфигурация |
| 89 | Ас | Актиний | [Rn] 6d 1 7s 2 |
| 104 | РФ | Резерфордий | [Rn] 5f 14 6d 2 7s 2 |
| 105 | Дб | Дубниум | [Rn] 5f 14 6d 3 7s 2 |
| 106 | Сг | Сиборгиум | [Rn] 5f 14 6d 4 7s 2 |
| 107 | Бх | Борий | [Rn] 5f 14 6d 5 7s 2 |
| 108 | Гс | Хассиум | [Rn] 5f 14 6d 6 7s 2 |
| 109 | Мт | Мейтнерий | [Rn] 5f 14 6d 7 7s 2 |
| 110 | Дс | Дармштадтиум | [Rn] 5f 14 6d 9 7s 1 |
| 111 | Рг | Рентгений | [Rn] 5f 14 6d 10 7s 1 |
| 112 | Сп | Коперниций | [Rn] 5f 14 6d 10 7s 2 |
Исключительная электронная конфигурация
Хром и медь, трехмерные элементы нашей окружающей среды, раскрывают свою общую форму тенденций электронной или электронной конфигурации в периодической таблице. Общая электронная конфигурация валентного электрона хрома и меди: [Ar]4s 2 3d 4 и [Ar] 4s 2 3d 9 .
Общая электронная конфигурация валентного электрона хрома и меди: [Ar]4s 2 3d 4 и [Ar] 4s 2 3d 9 .
В элементах периодической таблицы формула конфигурации электронов с частично заполненными и заполненными орбитами относительно более стабильна, чем частично заполненные орбитали. Таким образом, 3d-орбиталь хрома и меди записывается с образованием новой электронной конфигурации, подобной [Ar]4s 1 3d 5 и [Ar] 4s 1 3d 10 для получения дополнительной химической стабильности за счет обменной энергии.
Электронная конфигурация элементов f-блока
Элементов 4f-блока
| Атомный номер | Символ | Имя | Электронная конфигурация |
| 58 | Се | Церий | [Хе] 4f 1 5д 1 6с 2 |
| 59 | Пр | Празеодим | [Xe] 4f 3 6s 2 |
| 60 | Нд | Неодим | [Xe] 4f 4 6s 2 |
| 61 | вечера | Прометий | [Xe] 4f 5 6s 2 |
| 62 | См | Самарий | [Xe]4f 6 6s 2 |
| 63 | ЕС | Европий | [Xe] 4f 7 6s 2 |
| 64 | Гд | Гадолиний | [Xe] 4f 7 5d 1 6s 2 |
| 65 | Тб | Тербий | [Xe] 4f 9 6s 2 |
| 66 | Дай | Диспрозий | [Xe] 4f 10 6s 2 |
| 67 | Хо | Гольмий | [Xe] 4f 11 6s 2 |
| 68 | Er | Эрбий | [Xe] 4f 12 6s 2 |
| 69 | Тм | Тулий | [Xe]4f 13 6s 2 |
| 70 | Ыб | Иттербий | [Xe] 4f 14 6s 2 |
| 71 | Лу | Лютеций | [Xe] 4f 14 5d 1 6s 2 |
Элементы 5f-блока
| Атомный номер | Символ | Имя | Электронная конфигурация |
| 90 | Торий | [Rn] 6d 2 7s 2 | |
| 91 | Па | Протактиний | [Rn] 5f 2 6d 1 7s 2 |
| 92 | У | Уран | [Rn] 5f 3 6d 1 7s 2 |
| 93 | № | Нептуний | [Rn] 5f 4 6d 1 7s 2 |
| 94 | Пу | Плутоний | [Rn] 5f 6 7s 2 |
| 95 | Ам | Америций | [Rn] 5f 7 7s 2 |
| 96 | См | Кюриум | [Rn] 5f 7 6d 1 7s 2 |
| 97 | Бк | Берклиум | [Rn] 5f 9 7s 2 |
| 98 | См. | Калифорния | [Rn] 5f 10 7s 2 |
| 99 | Эс | Эйнштейний | [Rn] 5f 11 7s 2 |
| 100 | Fm | Фермиум | [Rn] 5f 12 7s 2 |
| 101 | Мд | Менделевий | [Rn] 5f 13 7s 2 |
| 102 | № | Нобелий | [Rn] 5f 14 7s 2 |
| 103 | Lw | Лоуренсиум | [Rn] 5f 14 7s 2 7p 1 |
Электронные конфигурации атомов элементов
Здесь вы можете ознакомиться с подробной информацией об электронной конфигурации атома любого элемента из таблицы Менделеева.
Эта информация включает электронные формулы (в порядке возрастания орбитальных энергий и в порядке уровней), графические диаграммы
распределение электронов по энергетическим уровням, а также таблицы квантовых чисел (энергии, углового момента, магнитного момента, спина) валентных электронов.