Название химических элементов и их произношение таблица. Алфавитный список химических элементов
«Химический элемент – сера» – Природный сросток кристаллов самородной серы. Возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Серные руды добывают разными способами – в зависимости от условий залегания. Природные минералы серы. Нельзя забывать о возможности ее самовозгорания. Добыча руды открытым способом. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда.
«Вопросы по химическим элементам» – Могут быть стабильными и радиактивными, естественными и искуственными. Связана с изменением числа энергетических уровней в главных подгруппах. 8. Какой элемент не имеет постоянной «прописки» в Периодической системе? Находятся в постоянном движении. Теллур, 2) селен, 3) осмий, 4) германий. Где накапливается мышьяк?
«h3O и h3S» – Cульфат-ион. Y = ? K K2 =1,23 · 10?13 моль/л. Получение: Na2SO3 + S = Na2SO3S (+t, водн.р-р).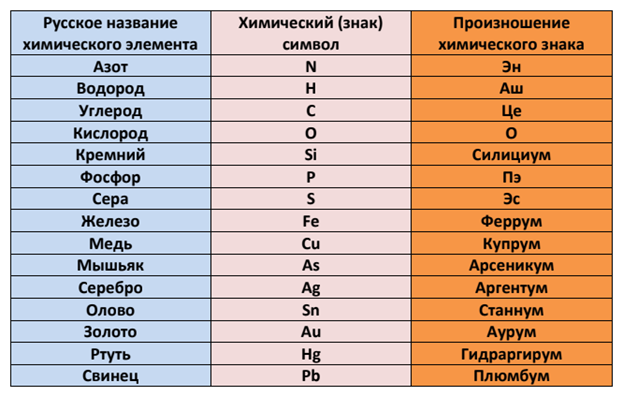
«Периодическая система химических элементов» – 8. Сколько электронов максимально может находиться на третьем энергетическом уровне? Расположить элементы в порядке возрастания металлических свойств. Название страны: «Химический элементарий». Стихи Степана Щипачева. А. 17 Б. 35 В. 35,5 Г. 52 6. Сколько электронов вращается вокруг ядра в атоме фтора?
«Кальций Сa» – Соединения Ca. Химические свойства Ca. Физические свойства Ca. Кальций относится к распространенным элементам. Применение. Получение кальция в промышленности. Кальций Ca. Опишите физические свойства Ca. Нахождение в природе. Задание для повторения. Кальций Ca серебристо белый и довольно твердый металл, легкий.
«Элемент фосфор» – Фосфор занимает 12-е место по распространенности элементов в природе. Взаимодействие с простыми веществами – неметаллами. Взаимодействие с металлами. Для связывания соединений кальция добавляют кварцевый песок. При нагревании белого фосфора в растворе щелочи он диспропорционирует. Фосфор. Черный фосфор.
Взаимодействие с металлами. Для связывания соединений кальция добавляют кварцевый песок. При нагревании белого фосфора в растворе щелочи он диспропорционирует. Фосфор. Черный фосфор.
Всего в теме 46 презентаций
Все названия химических элементов происходят из латинского языка. Это необходимо в первую очередь для того, чтобы ученые разных стран могли понимать друг друга.
Химические знаки элементов
Элементы принято обозначать химическими знаками (символами). По предложению шведского химика Берцелиуса (1813 г.) химические элементы обозначают начальной или начальной и одной из последующих букв латинского названия данного элемента; первая буква всегда прописная, вторая строчная. Например, водород (Hydrogenium) обозначается буквой H, кислород (Oxygenium) – буквой O, сера (Sulfur) – буквой S; ртуть (Hydrargyrum) – буквами Hg, алюминий (Aluminium) – Al, железо (Ferrum) – Fe и т. д.
Рис. 1. Таблица химических элементов с названиями на латинском и русском языке.
Русские названия химических элементов зачастую представляют собой латинские названия с видоизмененными окончаниями. Но также существует множество элементов, произношение которых отличается от латинского первоисточника. Это либо коренные русские слова (например, железо), либо слова, которые являются переводом (пример – кислород).
Химическая номенклатура
Химическая номенклатура – правильное наименование химических веществ. Латинское слово nomenclatura переводится как «перечень имен, названий»
На ранней стадии развития химии веществам давались произвольные, случайные наименования (тривиальные названия). Легколетучие жидкости назывались спиртами, к ним относились «соляной спирт» – водный раствор соляной кислоты, «силитряный спирт» – азотная кислота, «нашатырный спирт» – водный раствор аммиака. Маслообразные жидкости и твердые вещества назывались маслами, например, концентрированная серная кислота носила название «купоросное масло», хлорид мышьяка – «мышьяковое масло».
Рис. 2. Портрет И. Р. Глаубер.
В старинных названиях могли указываться вкус веществ, цвет, запах, внешний вид, медицинское действие. Одно вещество иногда имело несколько наименований.
К концу XVIII века химикам было известно не более 150-200 соединений.
Первую систему научных названий в химии выработала в 1787 г. комиссия химиков во главе с А. Лавуазье. Химическая номенклатура Лавуазье послужила основой для создания национальных химических номенклатур. Для того, чтобы химики разных стран понимали друг друга, номенклатура должна быть единой. В настоящее время построение химических формул и названий неорганических веществ подчиняется системе номенклатурных правил, созданной комиссией Международного союза теоретической и прикладной химии (ИЮПАК). Каждое вещество изображается формулой, в соответствии с ней строится систематическое название соединения.
Рис. 3. А. Лавуазье.
Что мы узнали?
Все химические элементы имеют латинские корни. Латинские названия химических элементов являются общепринятыми. В русский язык они переносятся с помощью калькирования или перевода. однако некоторые слова имеют изначально русское значение, например, медь или железо. Химической номенклатуре подчиняются все химические вещества, состоящие из атомов и молекул. впервые система научных названий была разработана А. Лавуазье.
Тест по теме
Оценка доклада
Средняя оценка: 4.2 . Всего получено оценок: 768.
Как пользоваться таблицей Менделеева? Для непосвященного человека читать таблицу Менделеева – всё равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева может рассказать о мире очень многое.
Помимо того, что сослужит вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Современный вид таблицы Менделеева
Ниже приведем саму таблицу
Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды.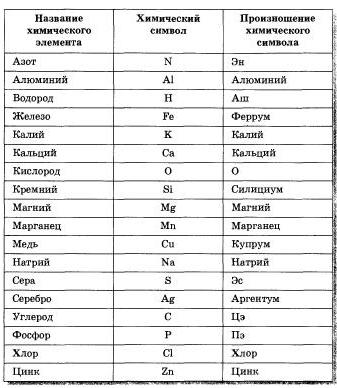 В таблице 18 групп и 8 периодов.
В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.
- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.
Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс “Таблица Менделеева для чайников”. В завершение, предлагаем вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника. Именно поэтому, никогда не стоит забывать о студенческом сервисе , который с радостью поделится с вами своими знаниями и опытом.
Инструкция
Периодическая система представляет собой многоэтажный «дом», в котором располагается большое количество квартир. Каждый «жилец» или в своей собственной квартире под определенным номером, который является постоянным. Помимо этого элемент имеет «фамилию» или название, например кислород, бор или азот..jpg) Кроме этих данных в каждой «квартире» или указана такая информация, как относительная атомная масса, которая может иметь точные или округленные значения.
Кроме этих данных в каждой «квартире» или указана такая информация, как относительная атомная масса, которая может иметь точные или округленные значения.
Как в любом доме, здесь имеются «подъезды», а именно группы. Причем в группах элементы располагаются слева и справа, образуя . В зависимости от того, с какой стороны их больше, та называется главной. Другая подгруппа, соответственно, будет побочной. Также в таблице имеются «этажи» или периоды. Причем периоды могут быть как большими (состоят из двух рядов) так и малыми (имеют только один ряд).
По таблице можно показать строение атома элемента, каждый из которых имеет положительно заряженное ядро, состоящее из протонов и нейтронов, а также вращающихся вокруг него отрицательно заряженных электронов. Число протонов и электронов численно совпадает и определяется в таблице по порядковому номеру элемента. Например, химический элемент сера имеет №16, следовательно, будет иметь 16 протонов и 16 электронов.
Чтобы определить количество нейтронов (нейтральных частиц, также расположенных в ядре) вычтите из относительной атомной массы элемента его порядковый номер. Например, железо имеет относительную атомную массу равную 56 и порядковый номер 26. Следовательно, 56 – 26 = 30 протонов у железа.
Например, железо имеет относительную атомную массу равную 56 и порядковый номер 26. Следовательно, 56 – 26 = 30 протонов у железа.
Электроны находятся на разном расстоянии от ядра, образуя электронные уровни. Чтобы определить число электронных (или энергетических) уровней, нужно посмотреть на номер периода, в котором располагается элемент. Например, алюминий находится в 3 периоде, следовательно, у него будет 3 уровня.
По номеру группы (но только для главной подгруппы) можно определить высшую валентность. Например, элементы первой группы главной подгруппы (литий, натрий, калий и т.д.) имеют валентность 1. Соответственно, элементы второй группы (бериллий, магний, кальций и т.д.) будут иметь валентность равную 2.
Также по таблице можно проанализировать свойства элементов. Слева направо металлические свойства ослабевают, а неметаллические усиливаются. Это хорошо видно на примере 2 периода: начинается щелочным металлом натрием, затем щелочноземельный металл магний, после него амфотерный элемент алюминий, затем неметаллы кремний, фосфор, сера и заканчивается период газообразными веществами – хлором и аргоном. В следующем периоде наблюдается аналогичная зависимость.
В следующем периоде наблюдается аналогичная зависимость.
Сверху вниз также наблюдается закономерность – металлические свойства усиливаются, а неметаллические ослабевают. То есть, например, цезий гораздо активнее по сравнению с натрием.
2.1. Химический язык и его части
Человечество использует много разных языков.
Кроме естественных языков (японского,
английского, русского – всего более 2,5 тысяч),
существуют еще и искусственные языки ,
например, эсперанто. Среди искусственных языков
выделяются языки различных наук . Так, в
химии используется свой, химический язык .
Химический язык – система условных
обозначений и понятий, предназначенная для
краткой, ёмкой и наглядной записи и передачи
химической информации.
Сообщение, написанное на большинстве
естественных языков, делится на предложения,
предложения – на слова, а слова – на буквы. Если
предложения, слова и буквы мы назовем частями
языка, то тогда мы сможем выделить аналогичные
части и в химическом языке (таблица 2).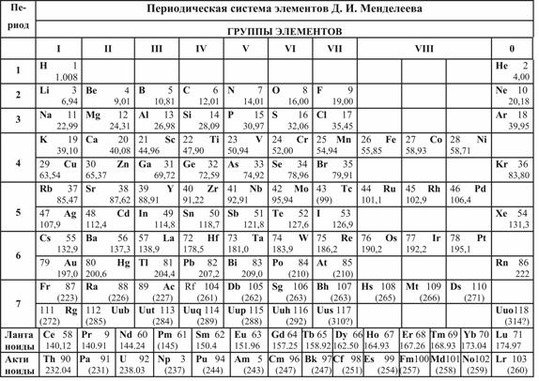
Таблица 2. Части химического языка
Любым языком овладеть сразу невозможно, это относится и к химическому языку. Поэтому пока вы познакомитесь только с основами этого языка: выучите некоторые ” буквы” , научитесь понимать смысл ” слов” и” предложений” . В конце этой главы вы познакомитесь с названиями химических веществ – неотъемлемой частью химического языка. По мере изучения химии ваше знание химического языка будет расширяться и углубляться.
ХИМИЧЕСКИЙ ЯЗЫК.
1.Какие искусственные языки вы знаете (кроме
названных в тексте учебника)?
2.Чем естественные языки отличаются от
искусственных?
3.Как вы думаете, можно ли при описании химических
явлений обходиться без использования
химического языка? Если нет, то почему? Если да, то
в чем будут заключаться преимущества, а в чем
недостатки такого описания?
2.2. Символы химических элементов
Символ химического элемента обозначает сам
элемент или один атом этого элемента.
Каждый такой символ представляет собой
сокращенное латинское название химического
элемента, состоящее из одной или двух букв
латинского алфавита (латинский алфавит см. в
приложении 1). Символ пишется с прописной буквы.
Символы, а также русские и латинские названия
некоторых элементов, приведены в таблице 3. Там же
даны сведения о происхождении латинских
названий. Общего правила произношения символов
не существует, поэтому в таблице 3 приводится и
” чтение” символа, то есть, как этот символ
читается в химической формуле.
Заменять символом название элемента в устной
речи нельзя, а в рукописных или печатных текстах
это допускается, но не рекомендуется.В настоящее
время известно 110 химических элементов, у 109 из
них есть названия и символы, утвержденные
Международным союзом теоретической и прикладной
химии (ИЮПАК).
В таблице 3 приведена информация только о 33
элементах. Это те элементы, которые при изучении
химии вам встретятся в первую очередь. Русские
названия (в алфавитном порядке) и символы всех
элементов приведены в приложении 2.
Таблица 3. Названия и символы некоторых химических элементов
Название | ||||
Латинское | Написание | |||
| – | Написание | Происхождение | – | – |
| Азот | N itrogenium | От греч. ” рождающий селитру” | ” эн” | |
| Алюминий | Al uminium | От лат. ” квасцы” | ” алюминий” | |
| Аргон | Ar gon | От греч. ” недеятельный” ” недеятельный” | ” аргон” | |
| Барий | Ba rium | От греч. ” тяжелый” | ” барий” | |
| Бор | B orum | От арабск. ” белый минерал” | ” бор” | |
| Бром | Br omum | От греч. ” зловонный” | ” бром” | |
| Водород | H ydrogenium | От греч. ” рождающий воду” | ” аш” | |
| Гелий | He lium | От греч. ” Солнце” | ” гелий” | |
| Железо | Fe rrum | От лат. ” меч” ” меч” | ” феррум” | |
| Золото | Au rum | От лат. ” горящий” | ” аурум” | |
| Йод | I odum | От греч. ” фиолетовый” | ” йод” | |
| Калий | K alium | От арабск. ” щёлочь” | ” калий” | |
| Кальций | Ca lcium | От лат. ” известняк” | ” кальций” | |
| Кислород | O xygenium | От греч. ” рождающий кислоты” | ” о” | |
| Кремний | Si licium | От лат.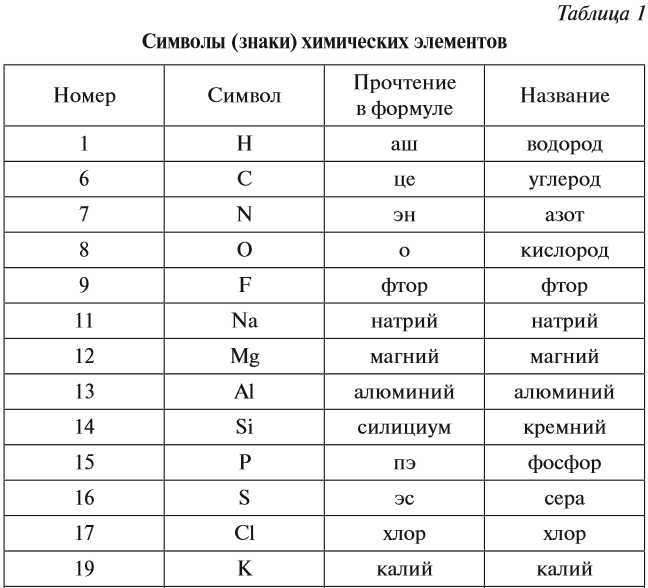 ” кремень” ” кремень” | ” силициум” | |
| Криптон | Kr ypton | От греч. ” скрытый” | ” криптон” | |
| Магний | M ag nesium | От назв. полуострова Магнезия | ” магний” | |
| Марганец | M an ganum | От греч. ” очищающий” | ” марганец” | |
| Медь | Cu prum | От греч. назв. о. Кипр | ” купрум” | |
| Натрий | Na trium | От арабск, ” моющее средство” | ” натрий” | |
| Неон | Ne on | От греч. ” новый” ” новый” | ” неон” | |
| Никель | Ni ccolum | От нем. ” медь святого Николая” | ” никель” | |
| Ртуть | H ydrarg yrum | Лат. ” жидкое серебро” | ” гидраргирум” | |
| Свинец | P lumb um | От лат. названия сплава свинца с оловом. | ” плюмбум” | |
| Сера | S ulfur | От санскриттского ” горючий порошок” | ” эс” | |
| Серебро | A rg entum | От греч. ” светлый” ” светлый” | ” аргентум” | |
| Углерод | C arboneum | От лат. ” уголь” | ” цэ” | |
| Фосфор | P hosphorus | От греч. ” несущий свет” | ” пэ” | |
| Фтор | F luorum | От лат. глагола ” течь” | ” фтор” | |
| Хлор | Cl orum | От греч. ” зеленоватый” | ” хлор” | |
| Хром | C hr omium | От греч. ” краска” | ” хром” | |
| Цезий | C aes ium | От лат.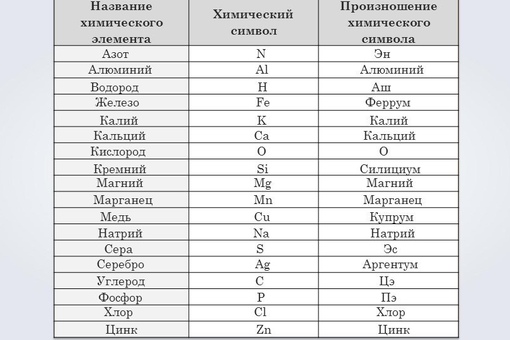 ” небесно-голубой” ” небесно-голубой” | ” цезий” | |
| Цинк | Z in cum | От нем. ” олово” | ” цинк” | |
2.3. Химические формулы
Для обозначения химических веществ используют химические формулы .
Для молекулярных веществ химическая формула
может обозначать и одну молекулу этого вещества.
Информация о веществе может быть разной, поэтому
существуют разные типы химических формул .
В зависимости от полноты информации химические
формулы делятся на четыре основных типа: простейшие , молекулярные , структурные и пространственные .
Подстрочные индексы в простейшейформуле не
имеют общего делителя.
Индекс ” 1″ в формулах не ставится.
Примеры простейших формул: вода – Н 2 О,
кислород – О, сера – S, оксид фосфора – P 2 O 5 ,
бутан – C 2 H 5 , фосфорная кислота – H 3 PO 4 ,
хлорид натрия (поваренная соль) – NaCl.
Простейшая формула воды (Н 2 О) показывает,
что в состав воды входит элемент водород (Н) и
элемент кислород (О), причем в любой порции
(порция – часть чего-либо, что может быть
разделено без утраты своих свойств.) воды число
атомов водорода в два раза больше числа атомов
кислорода.
Число частиц , в том числе и число атомов ,
обозначается латинской буквой N . Обозначив
число атомов водорода – N H , а число
атомов кислорода – N O , мы можем
записать, что
Или N H: N O = 2: 1.
Простейшая формула фосфорной кислоты (Н 3 РО 4) показывает, что в состав фосфорной кислоты входят атомы водорода , атомы фосфора и атомы кислорода , причем отношение чисел атомов этих элементов в любой порции фосфорной кислоты равно 3:1:4, то есть
N H: N P: N O = 3: 1: 4.
Простейшая формула может быть составлена для
любого индивидуального химического вещества, а
для молекулярного вещества, кроме того, может
быть составлена молекулярная формула .
Примеры молекулярных формул: вода – H 2 O, кислород – O 2 , сера – S 8 , оксид фосфора – P 4 O 10 , бутан – C 4 H 10 , фосфорная кислота – H 3 PO 4 .
У немолекулярных веществ молекулярных формул нет.
Последовательность записи символов элементов в простейших и молекулярных формулах определяется правилами химического языка, с которыми вы познакомитесь по мере изучения химии. На информацию, передаваемую этими формулами, последовательность символов влияния не оказывает.
Из знаков, отражающих строение веществ, мы будем использовать пока только валентный штрих (” черточку”). Этот знак показывает наличие между атомами так называемой ковалентной связи (что это за тип связи и каковы его особенности, вы скоро узнаете).
В молекуле воды атом кислорода связан простыми (одинарными) связями с двумя атомами водорода, а атомы водорода между собой не связаны. Именно это наглядно показывает структурная формула воды.
Другой пример: молекула серы S 8 . В этой
молекуле 8 атомов серы образуют восьмичленный
цикл, в котором каждый атом серы связан с двумя
другими атомами простыми связями. Сравните
структурную формулу серы с объемной моделью ее
молекулы, показанной на рис. 3. Обратите внимание
на то, что структурная формула серы не передает
форму ее молекулы, а показывает только
последовательность соединения атомов
ковалентными связями.
В этой
молекуле 8 атомов серы образуют восьмичленный
цикл, в котором каждый атом серы связан с двумя
другими атомами простыми связями. Сравните
структурную формулу серы с объемной моделью ее
молекулы, показанной на рис. 3. Обратите внимание
на то, что структурная формула серы не передает
форму ее молекулы, а показывает только
последовательность соединения атомов
ковалентными связями.
Структурная формула фосфорной кислоты показывает, что в молекуле этого вещества один из четырех атомов кислорода связан только с атомом фосфора двойной связью, а атом фосфора, в свою очередь, связан еще с тремя атомами кислорода простыми связями. Каждый из этих трех атомов кислорода, кроме того, связан простой связью с одним из трех имеющихся в молекуле атомов водорода./p>
Сравните приведенную ниже объемную модель молекулы метана с его пространственной, структурной и молекулярной формулой:
В пространственной формуле метана
клиновидныевалентные штрихи как бы в
перспективе показывают, какой из атомов водорода
находится ” ближе к нам” , а какой ” дальше
от нас” .
Иногда в пространственной формуле указывают длины связей и значения углов между связями в молекуле, как это показано на примере молекулы воды.
Немолекулярные вещества не содержат молекул. Для удобства проведения химических расчетов в немолекулярном веществе выделяют так называемую формульную единицу .
Примеры состава формульных единиц некоторых веществ: 1) диоксид кремния (кварцевый песок, кварц) SiO 2 – формульная единица состоит из одного атома кремния и двух атомов кислорода; 2) хлорид натрия (поваренная соль) NaCl – формульная единица состоит из одного атома натрия и одного атома хлора; 3) железо Fe – формульная единица состоит из одного атома железа.Как и молекула, формульная единица – наименьшая порция вещества, сохраняющая его химические свойства.
Таблица 4
Информация, передаваемая формулами разных типов
Тип формулы | Информация,
передаваемая формулой. | |
| Простейшая Молекулярная Структурная Пространственная |
| |
Рассмотрим теперь на примерах, какую информацию дают нам формулы разных типов.
1. Вещество: уксусная кислота . Простейшая формула – СН 2 О, молекулярная формула – C 2 H 4 O 2 , структурная формула
Простейшая формула говорит нам, что
1) в состав уксусной кислоты входит углерод,
водород и кислород;
2) в этом веществе число атомов углерода
относится к числу атомов водорода и к числу
атомов кислорода, как 1:2:1, то есть N H: N C:N O = 1:2:1.
Молекулярная формула добавляет, что
3) в молекуле уксусной кислоты – 2 атома углерода,
4 атома водорода и 2 атома кислорода.
Структурная формула добавляет, что
4, 5) в молекуле два атома углерода связаны между
собой простой связью; один из них, кроме этого,
связан с тремя атомами водорода, с каждым простой
связью, а другой – с двумя атомами кислорода, с
одним – двойной связью, а с другим – простой;
последний атом кислорода связан еще простой
связью с четвертым атомом водорода.
2. Вещество: хлорид натрия . Простейшая формула – NaCl.
1) В состав хлорида натрия входит натрий и хлор.
2) В этом веществе число атомов натрия равно числу
атомов хлора.
3. Вещество: железо . Простейшая
формула – Fe.
1) В состав этого вещества входит только железо,
то есть это простое вещество.
4. Вещество: триметафосфорная кислота . Простейшая формула – HPO 3 , молекулярная формула – H 3 P 3 O 9 , структурная формула
1) В состав триметафосфорной кислоты входит
водород, фосфор и кислород.
2) N H: N P:N O = 1:1:3.
3) Молекула состоит из трех атомов водорода, трех
атомов фосфора и девяти атомов кислорода.
4, 5) Три атома фосфора и три атома кислорода,
чередуясь, образуют шестичленный цикл. Все связи
в цикле простые. Каждый атом фосфора, кроме того,
связан еще с двумя атомами кислорода, причем с
одним – двойной связью, а с другим – простой.
Каждый из трех атомов кислорода, связанных
простыми связямис атомами фосфора, связан еще
простой связью с атомом водорода.
Фосфорная кислота – H 3 PO 4 (другое название – ортофосфорная кислота) –
прозрачное бесцветное кристаллическое вещество
молекулярного строения, плавящееся при 42 o С.
Это вещество очень хорошо растворяется в воде и
даже поглощает пары воды из воздуха
(гигроскопично). Фосфорную кислоту производят в
больших количествах и используют прежде всего в
производстве фосфорных удобрений, а также в
химической промышленности, при производстве
спичек и даже в строительстве.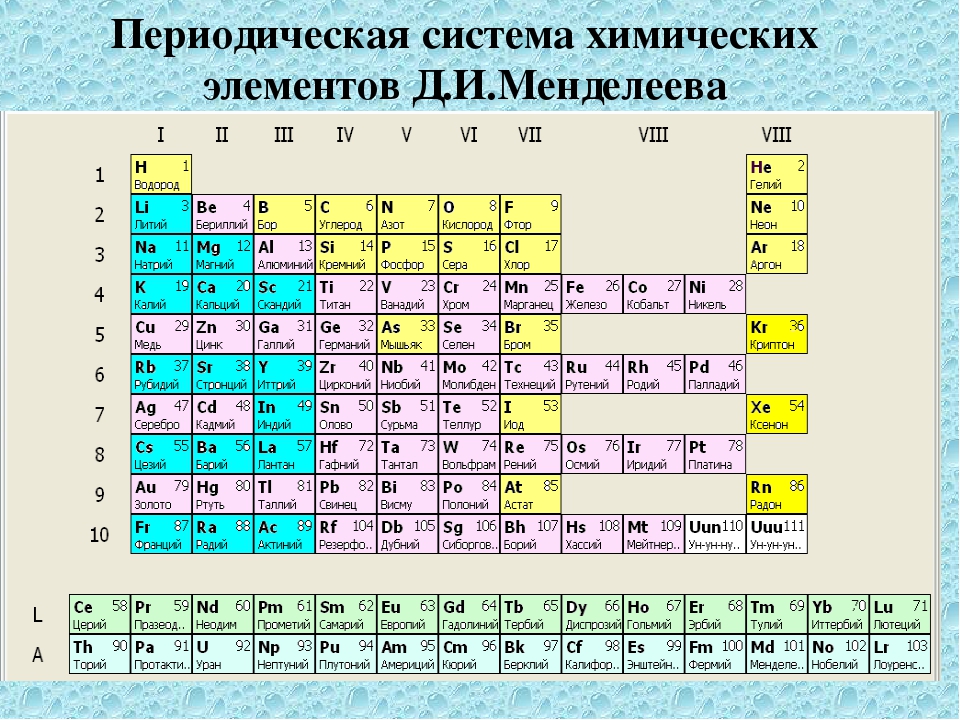 Кроме того,
фосфорная кислота применяется при изготовлении
цемента в зубоврачебной технике, входит в состав
многих лекарственных средств. Эта кислота
достаточно дешева, поэтому в некоторых странах,
например в США, очень чистая сильно разбавленная
водой фосфорная кислота добавляется в
освежающие напитки для замены дорогой лимонной
кислоты. Кроме того,
фосфорная кислота применяется при изготовлении
цемента в зубоврачебной технике, входит в состав
многих лекарственных средств. Эта кислота
достаточно дешева, поэтому в некоторых странах,
например в США, очень чистая сильно разбавленная
водой фосфорная кислота добавляется в
освежающие напитки для замены дорогой лимонной
кислоты. |
Метан – CH 4 . Если у вас
дома есть газовая плита, то с этим веществом вы
сталкиваетесь ежедневно: природный газ, который
горит в конфорках вашей плиты, на 95 % состоит из
метана. Метан – газ без цвета и запаха с
температурой кипения –161 o С. В смеси с
воздухом он взрывоопасен, этим и объясняются
происходящие иногда в угольных шахтах взрывы и
пожары (другое название метана – рудничный газ).
Третье название метана – болотный газ – связано
с тем, что пузырьки именно этого газа поднимаются
со дна болот, где он образуется в результате
деятельности некоторых бактерий. В
промышленности метан используется как топливо и
сырье для производства других веществ. Метан
является простейшим углеводородом . К этому
классу веществ относятся также этан (C 2 H 6),
пропан (C 3 H 8), этилен (C 2 H 4),
ацетилен (C 2 H 2) и многие другие
вещества. Метан
является простейшим углеводородом . К этому
классу веществ относятся также этан (C 2 H 6),
пропан (C 3 H 8), этилен (C 2 H 4),
ацетилен (C 2 H 2) и многие другие
вещества. |
Таблица 5 . Примеры формул разных типов для некоторых веществ –
Знаки металлов в химии. Обозначение, произношение, названия и символы химических элементов. Металлы, неметаллы, металлоиды
Как и в любой науке, в химии существует своя система условных обозначений, свой язык. Урок посвящен знакомству с языком химической науки, изучению символов химических элементов. Вы узнаете, когда и кем были придуманы современные символы химических элементов.
Тема: Первоначальные химические представления
Урок: Символы химических элементов
1. История развития языка химииЕще в Средневековье, во времена алхимии использовались различные знаки для обозначения веществ, в основном металлов.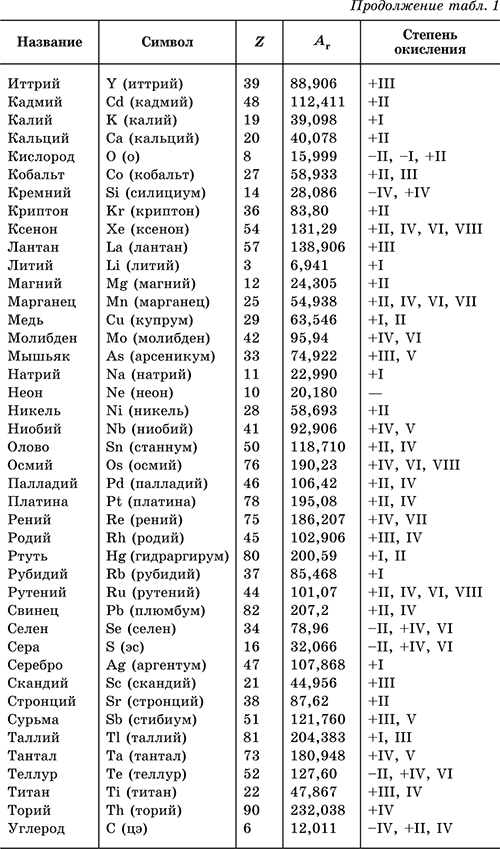 Ведь основной целью алхимиков было получение из различных металлов золота. Поэтому каждый из них использовал свою систему обозначений.
Ведь основной целью алхимиков было получение из различных металлов золота. Поэтому каждый из них использовал свою систему обозначений.
В 19 в. появилась необходимость использования понятной для всех ученых символики. И одним из первых такую символику предложил Джон Дальтон. Но его обозначениями было неудобно пользоваться.
Рис. 1. Джон Дальтон и его система обозначения химических элементов
2. Система обозначения химических элементов Й. Я. БерцелиусаСовременную систему химических знаков предложил в начале XIX в. шведский химик Йёнс Якоб Берцелиус. Ученый предложил обозначать химические элементы первой буквой их латинского названия. В те времена все научные статьи печатала на латинском языке, он был общепринятым и понятным для всех ученых.
Например, химический элемент кислород (по-латински Oxygenium) получил обозначение О.
А химический элемент водород (Hydrogenium) – Н. Если названия нескольких элементов начинались на одну и ту же букву, то в символе элемента указывали вторую или одну из последующих букв названия.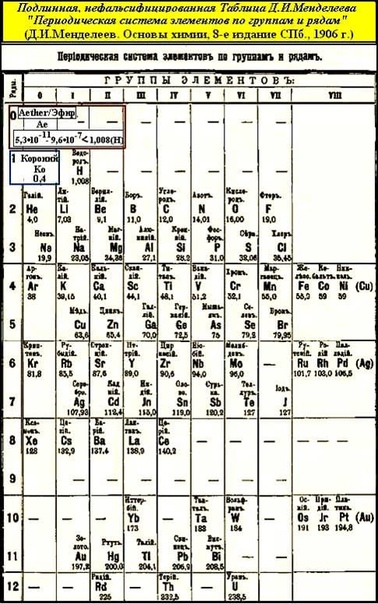 Например, ртуть (Hydrargyrum) обозначается Hg.
Например, ртуть (Hydrargyrum) обозначается Hg.
Обратите внимание, что первая буква знака химического элемента всегда заглавная, если есть вторая буква – то она строчная. Необходимо запоминать не только названия элементов и их символы, но и произношение, т. е. как эти символы читаются.
Определенных правил произношения знаков химических элементов нет. Их надо учить наизусть. Знаки некоторых химических элементов произносятся так же, как и соответствующая буква: кислород – «о», сера – «эс», фосфор – «пэ», азот – «эн», углерод – «цэ».
Знаки других элементов произносятся так же, как и называются сами элементы: «натрий», «калий», «хлор», «фтор».
Произношение некоторых знаков соответствует их латинскому названию: кремний – «силициум», ртуть – «гидраргирум», медь – «купрум», железо – «феррум».
Рис. 2. Символы и названия некоторых химических элементов
3. Значение знаков химических элементовЗнак химического элемента имеет несколько значений.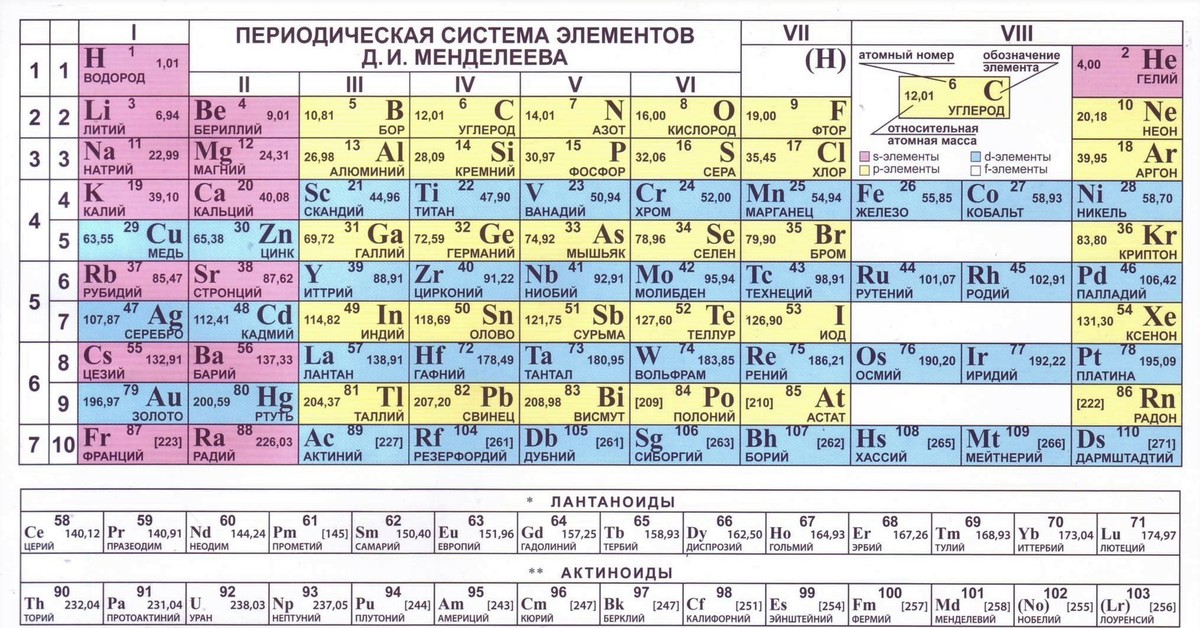 Во-первых, им обозначают все атомы данного элемента. Во-вторых, знаком химического элемента можно обозначить один или несколько атомов данного элемента. Например, запись O может означать: «химический элемент кислород» или «один атом кислорода».
Во-первых, им обозначают все атомы данного элемента. Во-вторых, знаком химического элемента можно обозначить один или несколько атомов данного элемента. Например, запись O может означать: «химический элемент кислород» или «один атом кислорода».
Чтобы обозначить несколько атомов данного химического элемента, нужно перед его знаком поставить число, соответствующее количеству атомов. Например, запись 3N означает «три атома азота».
Цифра, стоящая перед знаком химического элемента, называется коэффициентом.
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П. А. Оржековского и др. «Химия, 8 класс» / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. – М.: АСТ: Астрель, 2006.
2. Ушакова О. В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского – М.: АСТ: Астрель: Профиздат, 2006. (с.19-21)
3. Химия: 8-й класс: учеб. для общеобр.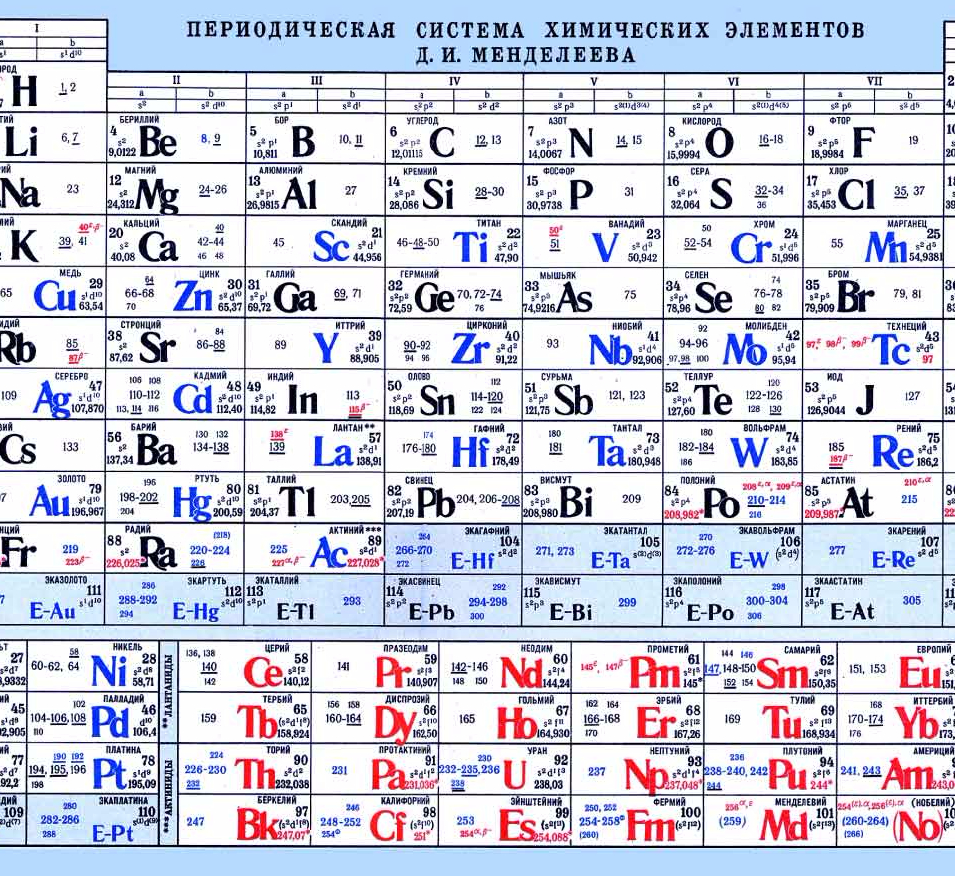 учреждений / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. М.: АСТ: Астрель, 2005.(§8)
учреждений / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. М.: АСТ: Астрель, 2005.(§8)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г. Е. Рудзитис, ФюГю Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§6)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов.
2. Электронная версия журнала «Химия и жизнь» .
3. Тесты по химии (онлайн) .
Домашнее задание
с.19-21 №№ 1-5 из Рабочей тетради по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского – М.: АСТ: Астрель: Профиздат, 2006.
Й. Я. Берцелиус Обозначение химических элементов Д. Дальтоном Таблица названий и символов некоторых химических элементов Алхимические знаки химических элементов и веществ Массовые доли химических элементов в земной коре
Муниципальное казенное общеобразовательное учреждение
«Попово-Лежачанская средняя общеобразовательная школа»
Районный семинар учителей химии
Глушковского района Курской области
Открытый урок по химии в 8 классе на тему: «Знаки химических элементов»
Подготовила:
Кондратенко Ольга Васильевна,
учитель химии и биологии
МКОУ “Попово-Лежачанская» СОШ
Глушковского района Курской области
с. Попово-Лежачи
Попово-Лежачи
Химия, 8 класс
Дата: 29.09.2015
Урок №12
Тема: Знаки химических элементов
Цель: закрепить знания и умения у обучающихся по темам «Методы познания в химии», «Чистые вещества и смеси», «Химические элементы», «Относительная атомная масса химических элементов».
Задачи урока:
Образовательн ые :
- проверить знания и умения у обучающихся по темам «Методы познания в химии», «Чистые вещества и смеси», «Химические элементы», «Относительная атомная масса химических элементов» пользуясь интерактивными средствами обучения;
- обобщить знания учащихся по изученным темам;
- выявить пробелы в усвоении учебного материала.
Развивающие:
- развивать химический язык, логическое мышление, внимание, память, интерес к современной химической науке, любознательность учащихся, умение делать выводы и обобщения;
- формировать навык работы с различными источниками информации с целью поиска и отбора необходимого материала.

Воспитательные:
- формировать положительную мотивацию учебной деятельности, научное мировозрение;
- развивать культуру умственного труда; навыки делового сотрудничества в процессе решения проблемы, работы в группах;
- воспитывать умение работать в коллективе, вежливость, дисциплинированность, аккуратность, трудолюбие;
- развивать умения формулировать и аргументировать собственное мнение, самостоятельность.
Планируемые результаты:
личностные: готовность и способность учащихся к саморазвитию, самоопределению; ответственное отношение к учению; способность ставить цели и строить жизненные планы; формирование коммуникативной культуры, ценности здорового и безопасного образа жизни;
метапредметные: уметь ставить цель и планировать пути её достижения, выбирая более рациональные способы решения данной проблемы; учиться корректировать свои действия в связи с изменением создавшейся ситуации; уметь создавать, применять и преобразовывать знаки и символы, модели и схемы для решения учебных и познавательных задач; уметь осознанно использовать речевые средства в соответствии с задачей коммуникации для выражения своих мыслей и потребностей; уметь организовывать совместную работу со сверстниками в группе; уметь находить информацию в различных источниках; владеть навыками самоконтроля, самооценки;
предметные:
знать : основные химические понятия «химический элемент», «простое вещество», «сложное вещество», знаки основных химических элементов; состав простых и сложных веществ; роль химии в жизни человека и в решении экологических проблем;
уметь: по формуле отличать простое вещество от сложного; химический элемент отличать от простого вещества; анализировать и объективно оценивать навыки безопасного обращения с веществами; устанавливать связи между реально наблюдаемыми химическими явлениями и процессами, происходящими в микромире; использовать различные методы изучения веществ.
Тип урока: контроль знаний.
Формы работы : групповая, работа в парах, игровая.
Методы обучения: проблемное изложение, частично-поисковый.
Приемы обучения : постановка проблемных вопросов.
Средства обучения: компьютер, проектор, презентация Power Point
Оборудование для учителя и учащихся: компьютер, проектор, таблица «Периодическая таблица химических элементов», лабораторный штатив, кольцо, фарфоровая чашка, спиртовка, фильтровальная бумага, ножницы, химические стаканы, стеклянная палочка, загрязненная смесь соли, вода.
Литература:
Для учителя:
- Горковенко М. Ю. Поурочные разработки по химии 8 класс к учебникам О. С. Габриеляна, Л. С. Гузея, Г. Е. Рудзитиса. – М: «ВАКО», 2004;
- Радецкий А. М., Горшкова В. П. Дидактический материал: химия 8-9 классы — М: Просвещение, 1997.
Для ученика:
Химия: неорганическая химия: учебник для 8 класса общеобразовательных учреждений/ Г. Е. Рудзитис, Ф. Г. Фельдман. – М: «Просвещение», 2014 г.
Е. Рудзитис, Ф. Г. Фельдман. – М: «Просвещение», 2014 г.
Ход урока:
I. Организационный момент (1 мин)
Учитель: Добрый день! Прошу всех садиться. Я поздравляю вас еще с одним чудесным днем. И мы с вами продолжаем творить волшебство на уроках химии.
II. Мотивация учебной деятельности (1 мин)
Учитель: Сегодня у нас необычный урок. Он будет проходить в форме игры. Оценка вашей работы в конце урока будет тем выше, чем больше баллов вы наберете. Количество заданий и их тип подобраны таким образом, что за выполнение работы вы сможете заработать более 40 баллов. Оценку вы получите согласно схемам пересчета, находящимся у вас на партах.
БЛАНК ОТВЕТОВ | |
ЗАДАНИЯ | Количество набранных баллов |
1. «Внимание, вопрос!» (7 баллов) | |
2. | |
3. «Крестики-нолики». (3 балла) | |
4. «Юные химики и химички». (15 баллов) | |
5. «Раздели меня». (4 балла) | |
6. «Ассоциации». (9 баллов) | |
7. «Я на выдумки мастак». (7 баллов) | |
8. «Парад химических элементов». (3 балла) | |
9. «Логические круги». (6 баллов) | |
10. «Пирамида». (3 балла) | |
11. Конкурс «Термины». (12 мин) | |
12. Конкурс «Последний шанс» (10 мин) | |
III. Контроль и коррекция знаний
1. Внимание, вопрос! (10 мин)
Учитель: Расскажите об этимологии названий химических элементов.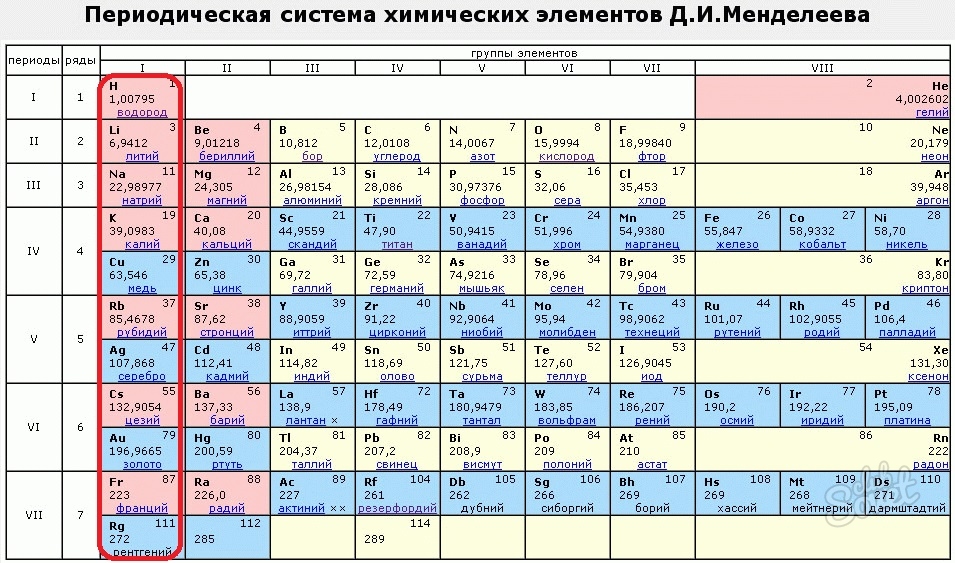
Ученик: Названия элементов имеют различную этимологию. Они происходят из:
названий стран и континентов – например, название рутений произошло от латинского названия России, а названия европий и америций – от названий континентов: Европа и Америка;
фамилий выдающихся химиков – например: менделевий, нобелий, резерфордий;
названий планет – например: уран, нептуний, плутоний;
названий рек – например, рений.
Все известные элементы имеют символы. Символьное обозначение элементов было предложено в 1814 году Й. Я. Берцелиусом. Раньше тоже использовались различные сокращенные обозначения элементов и соединений. Одним из таких видов обозначений были графические символы.
Учитель: Что мы знаем из истории развития языка химии?
Ученик: Еще в Средневековье, во времена алхимии использовались различные знаки для обозначения веществ, в основном металлов. Ведь основной целью алхимиков было получение из различных металлов золота. Поэтому каждый из них использовал свою систему обозначений. В 19 в. появилась необходимость использования понятной для всех ученых символики. И одним из первых такую символику предложил Джон Дальтон. Но его обозначениями было неудобно пользоваться.
В 19 в. появилась необходимость использования понятной для всех ученых символики. И одним из первых такую символику предложил Джон Дальтон. Но его обозначениями было неудобно пользоваться.
Учитель: Расскажите об системе обозначения химических элементов Й.Я. Берцелиуса
Ученик: Современную систему химических знаков предложил в начале XIX в. шведский химик Йёнс Якоб Берцелиус. Ученый предложил обозначать химические элементы первой буквой их латинского названия. В те времена все научные статьи печатала на латинском языке, он был общепринятым и понятным для всех ученых. Например, химический элемент кислород (по-латински Oxygenium) получил обозначение О. А химический элемент водород (Hydrogenium) – Н. Если названия нескольких элементов начинались на одну и ту же букву, то в символе элемента указывали вторую или одну из последующих букв названия. Например, ртуть (Hydrargyrum) обозначается Hg. Обратите внимание, что первая буква знака химического элемента всегда заглавная, если есть вторая буква – то она строчная. Необходимо запоминать не только названия элементов и их символы, но и произношение, т.е. как эти символы читаются. Определенных правил произношения знаков химических элементов нет. Их надо учить наизусть. Знаки некоторых химических элементов произносятся так же, как и соответствующая буква: кислород – «о», сера – «эс», фосфор – «пэ», азот – «эн», углерод – «цэ». Знаки других элементов произносятся так же, как и называются сами элементы: «натрий», «калий», «хлор», «фтор». Произношение некоторых знаков соответствует их латинскому названию: кремний – «силициум», ртуть – «гидраргирум», медь – «купрум», железо – «феррум».
Необходимо запоминать не только названия элементов и их символы, но и произношение, т.е. как эти символы читаются. Определенных правил произношения знаков химических элементов нет. Их надо учить наизусть. Знаки некоторых химических элементов произносятся так же, как и соответствующая буква: кислород – «о», сера – «эс», фосфор – «пэ», азот – «эн», углерод – «цэ». Знаки других элементов произносятся так же, как и называются сами элементы: «натрий», «калий», «хлор», «фтор». Произношение некоторых знаков соответствует их латинскому названию: кремний – «силициум», ртуть – «гидраргирум», медь – «купрум», железо – «феррум».
Учитель: Какое значение знаков химических элементов?
Ученик: Знак химического элемента имеет несколько значений. Во-первых, им обозначают все атомы данного элемента. Во-вторых, знаком химического элемента можно обозначить один или несколько атомов данного элемента. Например, запись O может означать: «химический элемент кислород» или «один атом кислорода».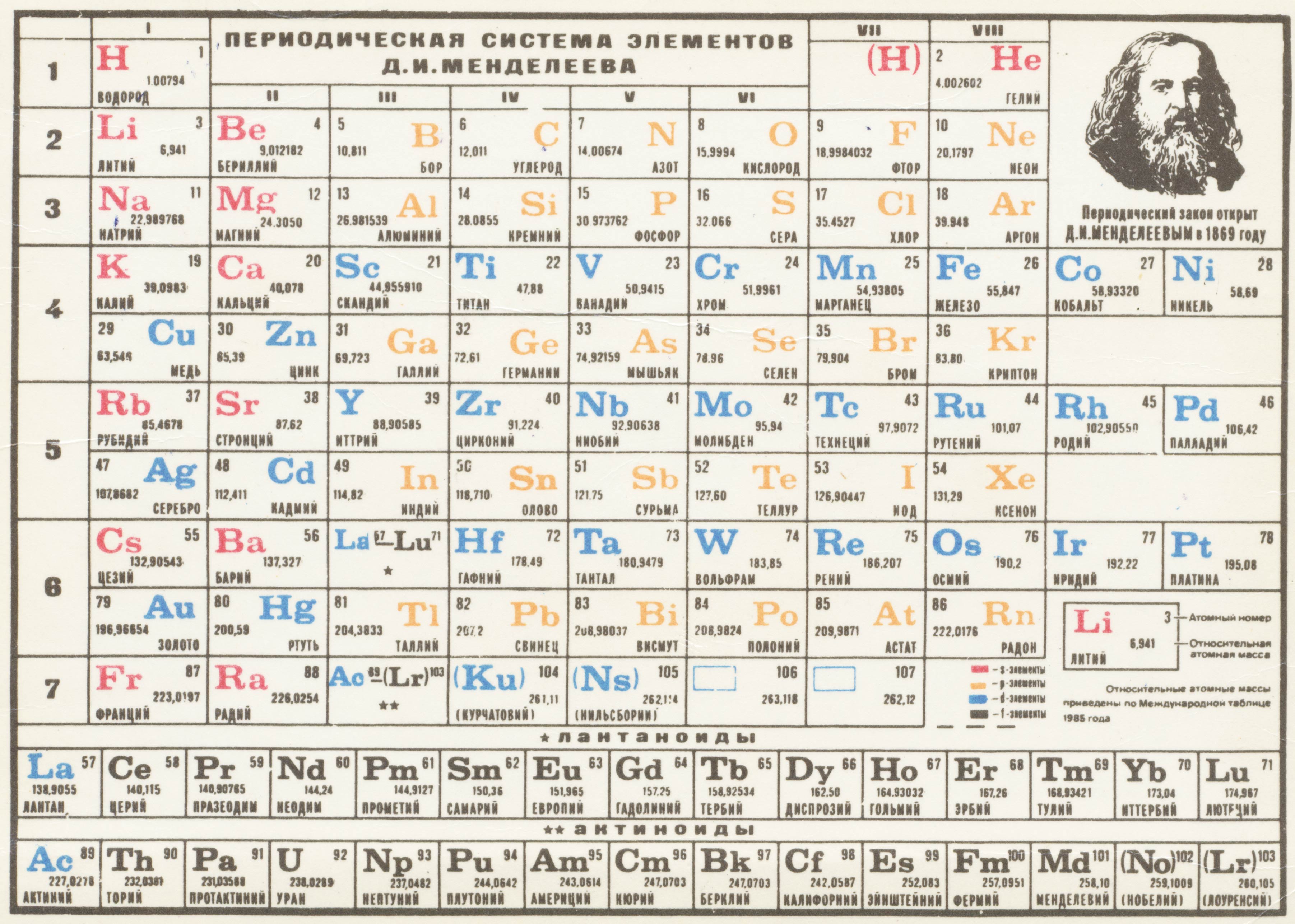
Чтобы обозначить несколько атомов данного химического элемента, нужно перед его знаком поставить число, соответствующее количеству атомов. Например, запись 3N означает «три атома азота». Цифра, стоящая перед знаком химического элемента, называется коэффициентом.
Ученик: Попытки упорядочить старинные химические знаки продолжались до конца XVIII века. В начале XIX века английский химик Дж. Дальтон предложил обозначать атомы химических элементов кружками, внутри которых помещались точки, чёрточки, начальные буквы английских названий металлов и др. Химические знаки Дальтона получили некоторое распространение в Великобритании и в Западной Европе, но вскоре были вытеснены чисто буквенными знаками, которые шведский химик Й. Я. Берцелиус предложил в 1814. Высказанные им принципы составления химических знаков сохранили свою силу до настоящего времени. В России первое печатное сообщение о химических знаках Берцелиуса сделал в 1824 московский врач И. Я. Зацепин.
Учитель: Каковы принципы обозначения?
Ученик: Современные символы химических элементов состоят из первой буквы или из первой и одной из следующих букв латинского названия элементов. При этом только первая буква — заглавная. Например, H — водород (лат. Hydrogenium), N — азот (лат. Nitrogenium), Ca — кальций (лат. Calcium), Pt — платина (лат. Platinum) и т. п. Для новооткрытых трансурановых элементов, которые пока не получили утверждённого ИЮПАК названия, используют трехбуквенные обозначения, означающие числительное — порядковый номер. Например, Uut — унунтрий (лат. Ununtrium, 113), Uuh — унунгексий (лат. Ununhexium, 116). Изотопы водорода имеют особые символы и названия: H — протий 1H, D — дейтерий 2H, T — тритий 3H. Для обозначения изобаров и изотопов перед символом химического элемента вверху ставится массовое число (напр., 14N), а слева внизу — порядковый номер элемента (атомный номер) (напр., 64Gd). В том случае, когда в химических формулах и химических уравнениях не указаны массовое число и порядковый номер, каждый химический знак выражает среднюю относительную атомную массу его изотопов в земной коре. Для обозначения заряженного атома вверху справа указывается заряд иона (напр.
При этом только первая буква — заглавная. Например, H — водород (лат. Hydrogenium), N — азот (лат. Nitrogenium), Ca — кальций (лат. Calcium), Pt — платина (лат. Platinum) и т. п. Для новооткрытых трансурановых элементов, которые пока не получили утверждённого ИЮПАК названия, используют трехбуквенные обозначения, означающие числительное — порядковый номер. Например, Uut — унунтрий (лат. Ununtrium, 113), Uuh — унунгексий (лат. Ununhexium, 116). Изотопы водорода имеют особые символы и названия: H — протий 1H, D — дейтерий 2H, T — тритий 3H. Для обозначения изобаров и изотопов перед символом химического элемента вверху ставится массовое число (напр., 14N), а слева внизу — порядковый номер элемента (атомный номер) (напр., 64Gd). В том случае, когда в химических формулах и химических уравнениях не указаны массовое число и порядковый номер, каждый химический знак выражает среднюю относительную атомную массу его изотопов в земной коре. Для обозначения заряженного атома вверху справа указывается заряд иона (напр. , Ca2+). Внизу справа указывают число атомов данного элемента в реальной или условной молекуле (напр., N2 или Fe2O3). Свободные радикалы обозначаются точкой справа (напр., Cl·).
, Ca2+). Внизу справа указывают число атомов данного элемента в реальной или условной молекуле (напр., N2 или Fe2O3). Свободные радикалы обозначаются точкой справа (напр., Cl·).
Ученик: Химики древнего мира и средних веков применяли для обозначения веществ, химических операций и приборов символические изображения, буквенные сокращения, а также сочетания тех и других. Семь металлов древности изображали астрономическими знаками семи небесных светил: Солнца (, золото), Луны (☽ , серебро), Юпитера (♃ , олово),Венеры (♀, медь), Сатурна (♄ , свинец), Меркурия (☿ , ртуть),Марса (♁ , железо). Металлы, открытые в XV—XVIII веках, — висмут, цинк, кобальт — обозначали первыми буквами их названий. Знак винного спирта (лат. spiritus vini) составлен из букв S и V. Знаки крепкой водки (лат. aqua fortis, азотная кислота) и золотой водки (лат. aqua regis, царская водка, смесь соляной и азотной кислот) составлены из знака воды Ñ и прописных букв F и R соответственно. Знак стекла (лат. vitrum) образован из двух букв V —прямой и перевёрнутой.
Учитель: Расскажите про международные и национальные символы.
Ученик: Приведённые в Периодической таблице элементов символы являются международными, но наряду с ними в некоторых странах употребительны обозначения, произведённые от национальных названий элементов. Например, во Франции вместо символов азота N, бериллия Be и вольфрама W могут использоваться Az (Azote), Gl (Glucinium) и Tu (Tungstène). В США вместо знака ниобия Nb нередко применяют Cb (Columbium). В Китае используется свой вариант химических знаков, основанный на китайских символах. Большинство символов были изобретены в XIX — XX веках. Символы для металлов (кроме ртути) используют радикал или («золото», металл вообще), для твёрдых при нормальных условиях неметаллов — радикал («камень»), для жидкостей — («вода»), для газов — («пар»). Например, символ молибдена состоит из радикала и фонетика, задающего произношение mu4.
Физкультминутка (1 мин)
2. Игра «Цветик-семицветик» (7 баллов) (2 мин. )
)
Вписать в каждый лепесток цветика-семицветика физические тела или вещества (по вариантам), которые нужно выбрать из определенного перечня.
Гвоздь, цинк, ваза, молоток, железо, поваренная соль, ложка, магний, золото, вода, льдина, яблоко, карандаш, стекло.
Физические тела Вещества
Ответы:
Тела: гвоздь, ваза, молоток, ложка, льдина, яблоко, карандаш.
Вещества: цинк, железо, поваренная соль, магний, золото, вода, стекло.
3. Игра «Крестики-нолики» (3 балла) (1 мин)
Найдите выигрышный путь в таблицах:
I вариант — однородные смеси;
II вариант — неоднородные смеси.
Ответ:
Верхняя строчка — однородные смеси;
Нижняя строчка — неоднородные смеси.
4. Конкурс «Юные химики» (15 баллов, по 1 баллу за каждое правильный ответ) (2мин)
Какая из команд больше назовет правил техники безопасности в кабинете химии.
5. Конкурс «Раздели меня» (4 балла), по 1 баллу за правильный ответ) (3 мин)
Установите соответствие между смесью и методом, которым ее можно разделить на чистые вещества.
Ответ:
I вариант
II вариант
6. Конкурс «Ассоциации». (9 баллов) (2 мин)
Участникам необходимо назвать лабораторное оборудование, которое по функции, внешнему виду или названию ассоциируется с изображенным на рисунке объектом;
7. Конкурс «Я на выдумки мастак» (7 баллов, по 1 баллу за элемент). (1 мин)
Назовите как можно больше химических элементов, используя буквы термина «Вольфрам».
Ответ: ванадий, осмий, литий, франций, родий, алюминий, магний.
8. Конкурс «Парад химических элементов» (3 балла). (1 мин)
Заполни таблицу.
Ответ:
10 . Конкурс «Пирамида» (3 балла) (2 мин)
Составьте пирамиду химических элементов по их атомным массам.
Ответ:
11. Конкурс «Термины». (12 баллов, по 1 баллу за правильный ответ) (2 мин)
Учитель диктует названия химических элементов, учащиеся записывают их символами на доске.
Ответ:
N, Na, Ba, Ca, H, O, C, Al, Mg, K, Cl, F.
12. Конкурс «Последний шанс» (10 баллов, по 1 баллу правильный ответ) (2 мин)
Команды по очереди, не повторяясь, отвечают на вопросы. Выигрывает та из них, которая последней даст ответ. Переведите с химического языка на общепринятый следующие выражения:
Не все то аурум, что блестит. (Не все то золото, что блестит).
Белый, как карбонат кальция. (Белый как мел).
Феррумный характер. (Железный характер).
Слово — аргентум, а молчание — аурум. (Слово — серебро, а молчание — золото) .
Много аш два о утекло. (Много воды утекло) .
Какой элемент всегда рад. (Радон).
Какой газ утверждает, что он не он? (Неон).
Какой элемент «вращается» вокруг Солнца? (Уран).
Какой элемент является настоящим «гигантом» (Титан).
Какой элемент назван в честь России? (Рутений).
IV. П одведение итогов. (1 мин.)
П одведение итогов. (1 мин.)
Учитель: Мы с вами все это время на протяжении двенадцати уроков старались открыть символическую дверь и войти в интересную страну, которая называется химией. Мы смогли ее немножечко приоткрыть и поглядеть, что за ней. Там интересно, там много неизвестного, которое влечет нас. Сейчас мы решим, готовы ли вы к серьезным испытаниям, которые ждут нас. Выясним, достаточно ли у вас для этого знаний, хорошо ли вы усвоили данные темы. Да не просто усвоили, а кто из вас сделал лучше.
(Объявление оценок по баллам)
V. Домашнее задание (1 мин)
§12, №1-4 с.44. Творческое задание: составить химический кроссворд.
VI. Рефлексия (1 мин)
Сегодня я узнал…
было трудно…
я понял, что…
я научился…
было интересно узнать, что…
меня удивило…
Откуда происходят названия и символы химических эле-ментов ? Уже в Древнем Египте для обозначения некоторых веществ использовали символические изображения, которые выражали целые слова или понятия (рис.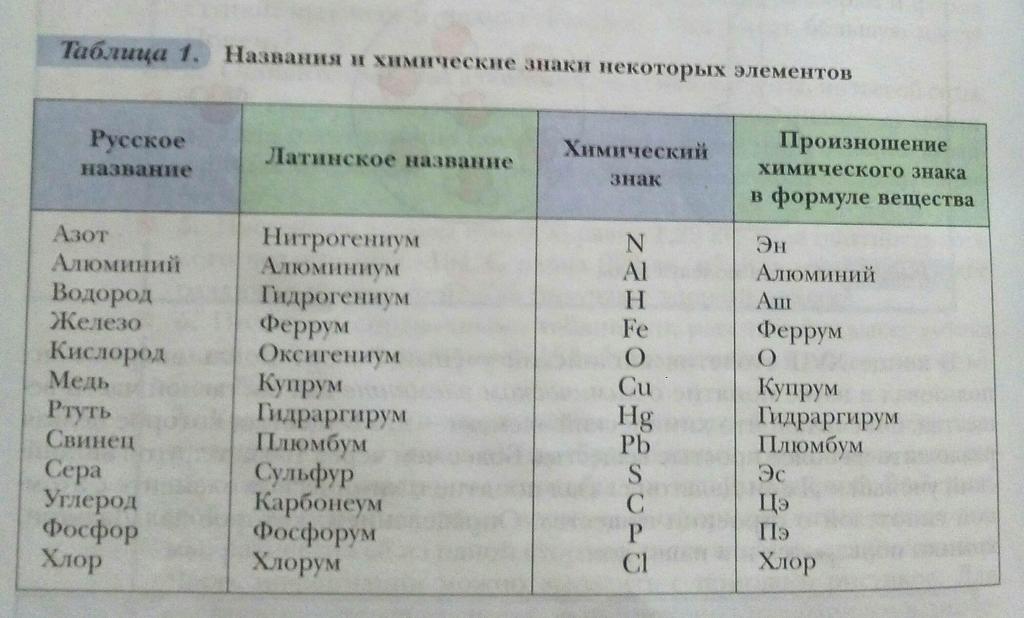 5.7).
5.7).
В средние века количество алхимических символов до-стигло нескольких тысяч. А для одного и того же вещества существовали десятки разных знаков.
Символ химического элемента — его условное обозна-чение.
Во второй половине XVIII в. ученые делали напрасные по-пытки упорядочить химические знаки. Обозначить каждое вещество отдельным символом не удавалось из-за открытия многих новых веществ. Поэтому со временем старинную алхи-мическую символику заменили химическими знаками, пред-ложенными английским химиком Дж. Дальтоном. В символи-ке Дальтона атом каждого элемента изображен кружком. На поле изображения обозначены либо черточки и точки, либо на-чальные буквы английских названий элементов. Буквенная система химических знаков является удоб-ным способом записи, хранения и передачи химической информации.
Знаки Дальтона, хотя и имели определенное распростра-нение, но были неудобны для печатания. Поэтому в 1814 г. шведский ученый Й.Я. Берцелиус предложил только буквенную систему знаков. Знаки элементов составлялись или из первой буквы их латинских названий, или из первой и од-ной из последующих букв. Так Берцелиус добился максимально возможного сближения символа химического элемента с его названием.
Знаки элементов составлялись или из первой буквы их латинских названий, или из первой и од-ной из последующих букв. Так Берцелиус добился максимально возможного сближения символа химического элемента с его названием.
Латинское на-звание химического элемента | Символ | ||
алхимичес-кий | по Дж. Дальтону | по Й. Я. Берцелиусу | |
H ydrarg yrum | |||
P lumb um | |||
Таблица. Названия и символы некоторых химических элементов
Названия и символы некоторых химических элементов
Символ | Произноше-ние | Латинское название | Современное название | |
русское | украинское | |||
H ydrogenium | Гідроген | |||
C arboneum | ||||
N itrogenium | Нітроген | |||
O xygenium | кислород | |||
M ag nesium | ||||
Алюминий | Al uminium | алюминий | Алюміній | |
Si licium | ||||
P hoshorus | ||||
Z in kum | ||||
Аргентум | A rg entum | Аргентум Материал с сайта | ||
S tan num | ||||
P lumb um | ||||
Гидраргирум | H ydrarg yrum | Меркурій | ||
Проанализируй данные, приведенные в таблице. Сравни современные русские и украинские назва-ния химических элементов. Определи, какие из них непо-средственно происходят от латинских названий.
Сравни современные русские и украинские назва-ния химических элементов. Определи, какие из них непо-средственно происходят от латинских названий.
Запомни, что русские названия химических элементов — нарицательные, их пишут со строчной буквы. Современные украинские названия химических элементов являются собственными, поэтому их пишут с прописной буквы. И в том и в другом случае нельзя в устной речи заменять назва-ние химического элемента произношением его символа. Не следует также заменять название элемента его символом в рукописях или печатных текстах.
На этой странице материал по темам:
Химические элементы и их произношение
Хим элементы знаки название произношение
Символика химических элементов реферат
Сульфур обозначение по химии
Таблица менделеева название знак произношение
Вопросы по этому материалу:
Химия, как и любая наука, требует точности. Система представления данных в этой области знаний вырабатывалась столетиями, и актуальный на сегодняшний день стандарт представляет собой оптимизированную структуру, содержащую всю необходимую информацию для дальнейшей теоретической работы с каждым конкретным элементом.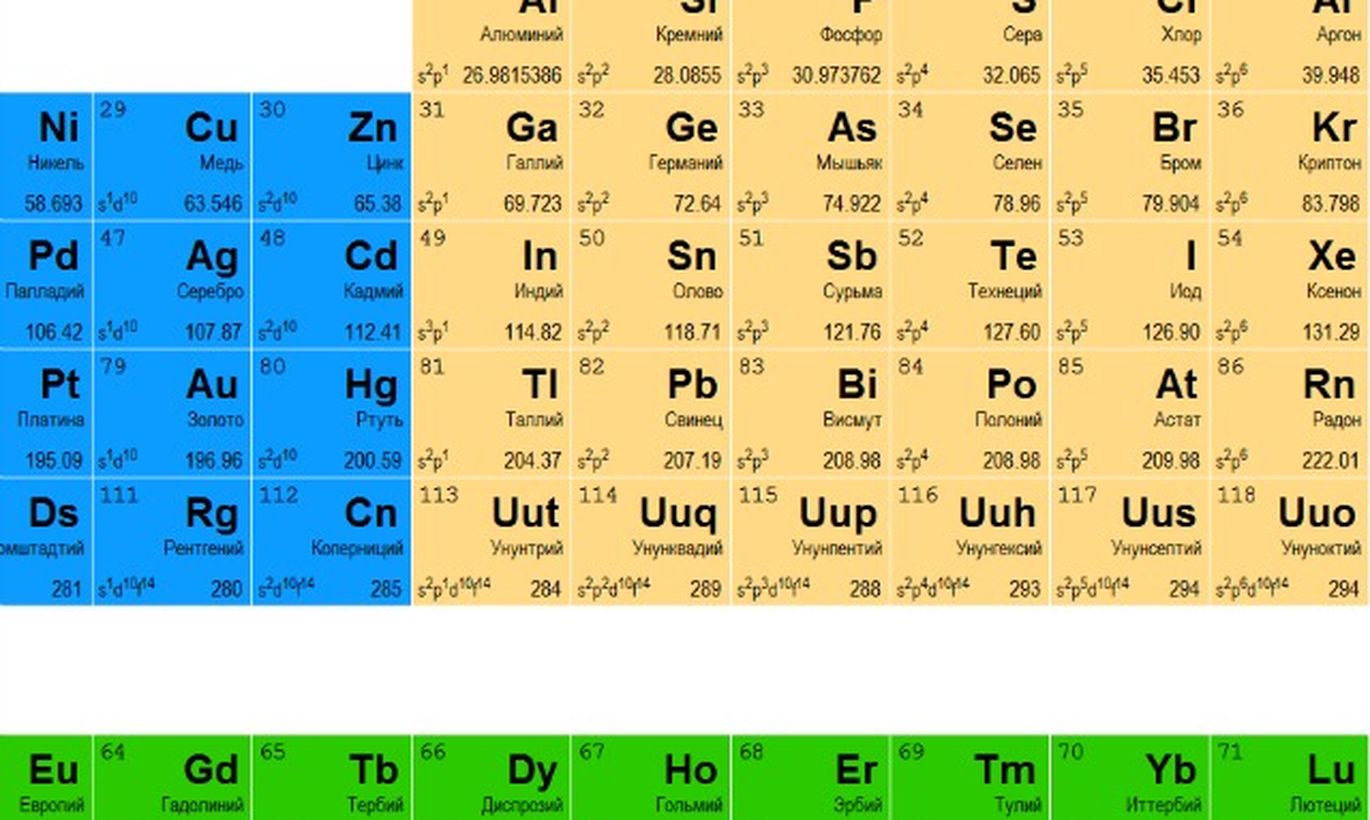
При записи формул и уравнений крайне неудобно использовать целые и сегодня для этой цели используются одна или две буквы – химические символы элементов.
История
В Древнем мире, а также в Средние века ученые применяли символические изображения для обозначения различных элементов, однако эти знаки не были стандартизованы. Лишь к XIII веку предпринимаются попытки систематизации символов веществ и элементов, а с XV века новооткрытые металлы начали обозначаться первыми буквами своих названий. Подобная стратегия наименования применяется в химии до сегодняшнего дня.
Современное состояние системы наименования
На сегодняшний день известно более ста двадцати химических элементов, часть из которых найти в природе крайне проблематично. Неудивительно, что ещё в середине XIX века наука знала о существовании лишь 63 из них, и не существовало ни единой системы наименования, ни цельной системы представления химических данных.
Последнюю задачу решил во второй половине того же века русский ученый Д. И. Менделеев, опираясь на неудачные попытки предшественников. Процесс наименования продолжается и сегодня – существует несколько элементов с номерами от 119 и выше, условно обозначенных в таблице латинским сокращением своего порядкового номера. Произношение символов химических элементов этой категории осуществляется по латинским правилам чтения числительных: 119 – унуненний (букв. «сто девятнадцатый»), 120 – унбинилий («сто двадцатый») и так далее.
И. Менделеев, опираясь на неудачные попытки предшественников. Процесс наименования продолжается и сегодня – существует несколько элементов с номерами от 119 и выше, условно обозначенных в таблице латинским сокращением своего порядкового номера. Произношение символов химических элементов этой категории осуществляется по латинским правилам чтения числительных: 119 – унуненний (букв. «сто девятнадцатый»), 120 – унбинилий («сто двадцатый») и так далее.
Большая же часть элементов имеет собственные названия, происходящие от латинских, греческих, арабских, немецких корней, в одних случаях отражающих объективные характеристики веществ, а в других выступающих в качестве ничем не мотивированных символов.
Этимология некоторых элементов
Как было сказано выше, некоторые названия и символы химических элементов базируются на объективно наблюдаемых признаках.
Название фосфора, светящегося в темноте, происходит от греческого словосочетания «нести свет». При переводе на русский язык обнаруживается достаточно много «говорящих» названий: хлор – «зеленоватый», бром – «дурно пахнущий», рубидий – «темно-красный», индий – «цвета индиго». Поскольку химические символы элементов даны латинскими буквами, прямая связь названия с веществом для носителя русского языка обычно остается незамеченной.
Поскольку химические символы элементов даны латинскими буквами, прямая связь названия с веществом для носителя русского языка обычно остается незамеченной.
Существуют и более тонкие ассоциации при наименовании. Так, название селена происходит от греческого слова, означающего «Луна». Произошло это потому, что в природе данный элемент является спутником теллура, название которого в том же греческом означает «Земля».
Сходным образом назван и ниобий. Согласно древнегреческой мифологии, Ниоба – дочь Тантала. Химический элемент тантал был открыт раньше и по своим свойствам схож с ниобием – таким образом, логическая связь «отец-дочь» была спроецирована на “взаимоотношения” химических элементов.
Более того, своё название тантал получил в честь известного мифологического персонажа не случайно. Дело в том, что получение этого элемента в чистом виде было сопряжено с большими трудностями, благодаря чему ученые и обратились к фразеологизму «Танталовы муки».
Ещё один любопытый историческиЙ факт заключается в том, что название платины буквально переводится как «серебришко», т. е. нечто похожее, но не такое ценное, как серебро. Причина заключается в том, что данный металл плавится гораздо труднее серебра, а потому долгое время не находил применения и не представлял особой ценности.
е. нечто похожее, но не такое ценное, как серебро. Причина заключается в том, что данный металл плавится гораздо труднее серебра, а потому долгое время не находил применения и не представлял особой ценности.
Общий принцип наименования элементов
При взгляде на периодическую таблицу первое, что бросается в глаза, – названия и символы химических элементов. Это всегда одна или две латинские буквы, первая из которых – заглавная. Выбор букв обусловлен латинским названием элемента. Несмотря на то что корни слов происходят и из древнегреческого, и из латинского, и из других языков, по стандарту наименования к ним добавляются латинские окончания.
Интересно, что большинство символов носителю русского языка будут интуитивно понятны: алюминий, цинк, кальций или магний школьник легко запоминает с первого раза. Сложнее обстоит дело с теми названиями, которые различаются в русском и латинском варианте. Ученик может далеко не сразу запомнить, что кремний – это силициум, а ртуть – гидраргирум. Тем не менее запомнить это придется – графическое изображение каждого элемента ориентировано на латинское название вещества, которое и будет фигурировать в химических формулах и реакциях как Si и Hg соответственно.
Тем не менее запомнить это придется – графическое изображение каждого элемента ориентировано на латинское название вещества, которое и будет фигурировать в химических формулах и реакциях как Si и Hg соответственно.
Чтобы запомнить такие названия, ученикам полезно выполнять упражнения типа: «Установите соответствие между символом химического элемента и его названием».
Иные способы наименования
Наименования некоторых элементов произошли из арабского языка и были «стилизованы» под латынь. Например, натрий получил название от корневой основы, означающей «бурлящее вещество». Арабские корни прослеживаются также у названий калия и циркония.
Своё влияние оказал и немецкий язык. Из него происходят наименования таких элементов, как марганец, кобальт, никель, цинк, вольфрам. Логическая связь при этом не всегда очевидна: например, никель – это сокращение от слова, означающего «медный дьявол».
В редких случаях названия были переведены на русский язык в виде кальки: гидрогениум (буквально «рождающий воду») превратился в водород, а карбонеум – в углерод.
Имена и топонимы
Более десятка элементов названы именами различных ученых, среди которых Альберт Эйнштейн, Дмитрий Менделеев, Энрико Ферми, Эрнест Резерфорд, Нильс Бор, Мария Кюри и другие.
Некоторые наименования произошли от других имён собственных: названий городов, штатов, стран. Например: московий, дубний, европий, тенессин. Не все топонимы покажутся знакомыми носителю русского языка: вряд ли человек без культурной подготовки узнает в слове нихоний самоназвание Японии – Нихон (букв.: Страна восходящего солнца), а в гафнии – латинский вариант Копенгагена. Узнать даже название родной страны в слове рутений – не самая простая задача. Тем не менее Россия на латинском языке именуется Рутенией, и именно в честь неё назван 44-й химический элемент.
Фигурируют в периодической таблице и названия космических тел: планет Урана, Нептуна, Плутона, Цереры, Помимо имен персонажей древнегреческой мифологии (Тантал, Ниобий), встречаются и скандинавские: торий, ванадий.
Периодическая таблица
В привычной нам сегодня периодической таблице, носящей имя Дмитрия Ивановича Менделеева, элементы представлены по рядам и периодам. В каждой ячейке химический элемент обозначается химическим символом, рядом с которым представлены другие данные: его полное название, порядковый номер, распределение электронов по слоям, относительная атомная масса. Каждая ячейка имеет свой цвет, который зависит от того, выделяется s-, p-, d- или f- элемент.
Принципы записи
При записи изотопов и изобаров слева сверху относительно символа элемента ставится массовое число – общее количество протонов и нейтронов в ядре. При этом слева снизу ставится атомный номер, представляющий собой количество протонов.
Заряд иона записывается справа сверху, и с той же стороны снизу указывается число атомов. Символы химических элементов всегда начинаются с заглавной буквы.
Национальные варианты записи
В азиатско-тихоокеанском регионе существуют свои варианты написания символов химических элементов, основанные на местных способах письма. В китайской системе обозначения используются знаки радикалов, за которыми следуют иероглифы в их фонетическом значении. Символы металлов предваряются знаком «металл» или «золото», газы – радикалом «пар», неметаллы – иероглифом «камень».
В китайской системе обозначения используются знаки радикалов, за которыми следуют иероглифы в их фонетическом значении. Символы металлов предваряются знаком «металл» или «золото», газы – радикалом «пар», неметаллы – иероглифом «камень».
В европейских странах также существуют ситуации, когда знаки элементов при записи отличаются от зафиксированных в международных таблицах. Например, во Франции азот, вольфрам и бериллий имеют собственные названия на национальном языке и обозначаются соответствующими символами.
В заключение
Обучаясь в школе или даже высшем учебном заведении, запоминать наизусть содержание всей периодической таблицы вовсе не требуется. В памяти следует держать химические символы элементов, которые чаще всего встречаются в формулах и уравнениях, а малоупотребительные время от времени смотреть в Интернете или учебнике.
Однако во избежание ошибок и путаницы необходимо знать, каким образом осуществляется структурирование данных в таблице, в каком именно источнике найти требуемые данные, чётко помнить, какие названия элементов различаются в русском и латинском варианте.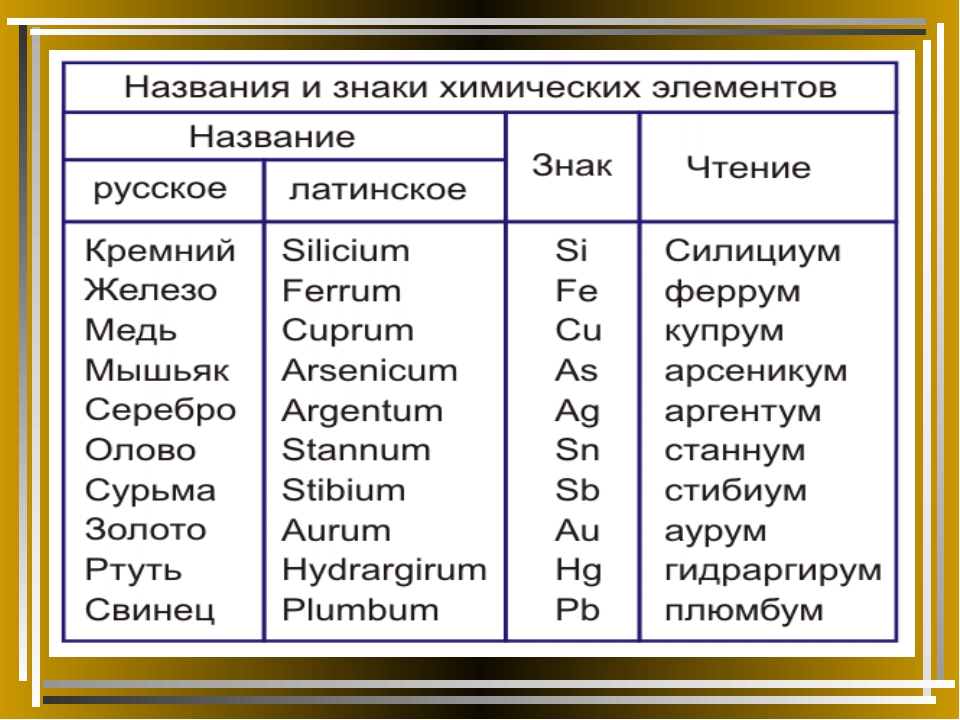 В противном случае можно случайно принять Mg за марганец, а N – за натрий.
В противном случае можно случайно принять Mg за марганец, а N – за натрий.
Чтобы получить практику на начальном этапе, выполняйте упражнения. Например, укажите символы химических элементов для случайно взятой последовательности названий из периодической таблицы. По мере получения опыта всё встанет на свои места и вопрос запоминания этой базовой информации отпадет сам собой.
Русские названия химических элементов таблицы менделеева. Произношение символа как звучит название элемента по-латыни. Периоды и группы
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Построение периодической таблицы химических элементов Менделеева отвечает характерным периодам теории чисел и ортогональных базисов. Дополнение матриц Адамара матрицами четных и нечетных порядков создает структурный базис вложенных матричных элементов: матриц первого (Odin), второго (Euler), третьего (Mersenne), четвертого (Hadamard) и пятого (Fermat) порядков.
Несложно заметить, что порядкам 4k матриц Адамара соответствуют инертные элементы с атомной массой, кратной четырем: гелий 4, неон 20, аргон 40 (39. 948) и т.п., но также и основы жизни и цифровой техники: углерод 12, кислород 16, кремний 28, германий 72.
948) и т.п., но также и основы жизни и цифровой техники: углерод 12, кислород 16, кремний 28, германий 72.
Такое впечатление, что с матрицами Мерсенна порядков 4k –1, напротив, связано все активное, ядовитое, разрушительное и разъедающее. Но это также радиоактивные элементы – источники энергии, и свинец 207 (конечный продукт, ядовитые соли). Фтор, это, конечно, 19. Порядкам матриц Мерсенна отвечает последовательность радиоактивных элементов, называемая рядом актиния: уран 235, плутоний 239 (изотоп, который является более мощным источником атомной энергии, чем уран) и т.п. Это также щелочные металлы литий 7, натрий 23 и калий 39.
Галлий – атомный вес 68
Порядкам 4k –2 матриц Эйлера (сдвоенный Мерсенн) соответствует азот 14 (основа атмосферы). Поваренная соль образована двумя “мерсенноподобными” атомами натрия 23 и хлора 35, вместе это сочетание характерно, как раз, для матриц Эйлера. Более массивный хлор с весом 35.4 немногим не добирает до адамаровой размерности 36.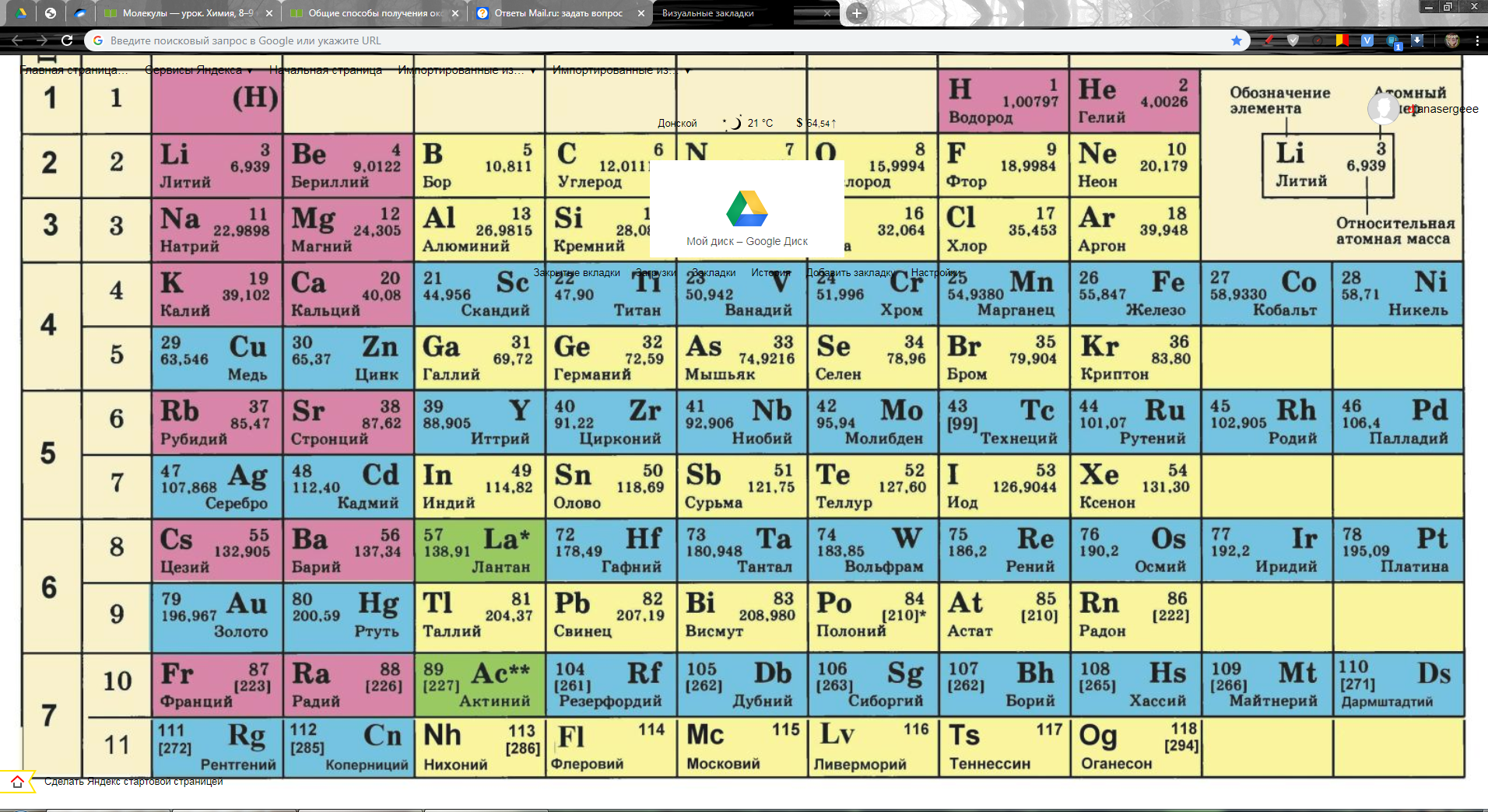 Кристаллы поваренной соли: куб (! т.е. характер смирный, адамаров) и октаэдр (более вызывающий, это несомненный Эйлер).
Кристаллы поваренной соли: куб (! т.е. характер смирный, адамаров) и октаэдр (более вызывающий, это несомненный Эйлер).
В атомной физике переход железо 56 – никель 59, это рубеж между элементами, дающими энергию при синтезе более крупного ядра (водородная бомба) и распаде (урановая). Порядок 58 знаменит тем, что для него нет не только аналогов матриц Адамара в виде матриц Белевича с нулями на диагонали, для него нет и многих взвешенных матриц – ближайшая ортогональная W(58,53) имеет 5 нулей в каждом столбце и строке (глубокий разрыв).
В ряду, соответствующем матрицам Ферма и их замещениям порядков 4k +1, стоит волею судьбы фермий 257. Ничего не скажешь, точное попадание. Здесь же золото 197. Медь 64 (63.547) и серебро 108 (107.868), символы электроники, недотягивают, как видно, до золота и соответствуют более скромным матрицам Адамара. Медь, с ее недалеко ушедшим от 63 атомным весом, химически активна – ее зеленые окислы хорошо известны.
Кристаллы бора под сильным увеличением
С золотым сечением связан бор – атомная масса среди всех прочих элементов наиболее близка к 10 (точнее 10. 8, близость атомного веса к нечетным числам тоже сказывается). Бор – достаточно сложный элемент. Бор играет запутанную роль в истории самой жизни. Строение каркаса в его структурах гораздо сложнее, чем в алмазе. Уникальный тип химической связи, которая позволяет бору поглощать любую примесь, очень плохо изучен, хотя за исследования, связанные с ним, большое количество ученых уже получили Нобелевские премии. Форма кристалла бора – икосаэдр, пять треугольников образуют вершину.
8, близость атомного веса к нечетным числам тоже сказывается). Бор – достаточно сложный элемент. Бор играет запутанную роль в истории самой жизни. Строение каркаса в его структурах гораздо сложнее, чем в алмазе. Уникальный тип химической связи, которая позволяет бору поглощать любую примесь, очень плохо изучен, хотя за исследования, связанные с ним, большое количество ученых уже получили Нобелевские премии. Форма кристалла бора – икосаэдр, пять треугольников образуют вершину.
Загадка Платины. Пятый элемент, это, без сомнения, благородные металлы, такие, как золото. Надстройка над адамаровой размерностью 4k , на 1 большие.
Стабильный изотоп уран 238
Вспомним, все же, что числа Ферма встречаются редко (ближайшее – 257). Кристаллы самородного золота имеют форму, близкую к кубу, но и пентаграмма просверкивает. Его ближайший сосед, платина, благородный металл, отстоит от золота 197 по атомному весу меньше, чем на 4. Платина имеет атомный вес не 193, а несколько повышенный, 194 (порядок матриц Эйлера). Мелочь, но это переносит ее в стан несколько более агрессивных элементов. Стоит вспомнить, в связи, что при ее инертности (растворяется, разве, в царской водке), платину используют как активный катализатор химических процессов.
Мелочь, но это переносит ее в стан несколько более агрессивных элементов. Стоит вспомнить, в связи, что при ее инертности (растворяется, разве, в царской водке), платину используют как активный катализатор химических процессов.
Губчатая платина при комнатной температуре воспламеняет водород. Характер у платины вовсе не мирный, смирнее себя ведет иридий 192 (смесь изотопов 191 и 193). Это, скорее, медь, но с весом и характером золота.
Между неоном 20 и натрием 23 нет элемента с атомным весом 22. Конечно, атомные веса – интегральная характеристика. Но среди изотопов, в свою очередь, тоже наблюдается любопытная корреляция свойств со свойствами чисел и соответствующих им матриц ортогональных базисов. В качестве ядерного топлива наибольшее применение имеет изотоп уран 235 (порядок матриц Мерсенна), в котором возможна самоподдерживающаяся цепная ядерная реакция. В природе этот элемент распространен стабильной форме уран 238 (порядок матриц Эйлера). Элемент с атомным весом 13 отсутствует. Что касается хаоса, то ограниченное количество устойчивых элементов таблицы Менделеева и сложность нахождения уровневых матриц высоких порядков ввиду замеченного у матриц тринадцатого порядка барьера коррелируют.
Что касается хаоса, то ограниченное количество устойчивых элементов таблицы Менделеева и сложность нахождения уровневых матриц высоких порядков ввиду замеченного у матриц тринадцатого порядка барьера коррелируют.
Изотопы химических элементов, островок стабильности
Все названия химических элементов происходят из латинского языка. Это необходимо в первую очередь для того, чтобы ученые разных стран могли понимать друг друга.
Химические знаки элементов
Элементы принято обозначать химическими знаками (символами). По предложению шведского химика Берцелиуса (1813 г.) химические элементы обозначают начальной или начальной и одной из последующих букв латинского названия данного элемента; первая буква всегда прописная, вторая строчная. Например, водород (Hydrogenium) обозначается буквой H, кислород (Oxygenium) – буквой O, сера (Sulfur) – буквой S; ртуть (Hydrargyrum) – буквами Hg, алюминий (Aluminium) – Al, железо (Ferrum) – Fe и т. д.
Рис. 1. Таблица химических элементов с названиями на латинском и русском языке.
Таблица химических элементов с названиями на латинском и русском языке.
Русские названия химических элементов зачастую представляют собой латинские названия с видоизмененными окончаниями. Но также существует множество элементов, произношение которых отличается от латинского первоисточника. Это либо коренные русские слова (например, железо), либо слова, которые являются переводом (пример – кислород).
Химическая номенклатура
Химическая номенклатура – правильное наименование химических веществ. Латинское слово nomenclatura переводится как «перечень имен, названий»
На ранней стадии развития химии веществам давались произвольные, случайные наименования (тривиальные названия). Легколетучие жидкости назывались спиртами, к ним относились «соляной спирт» – водный раствор соляной кислоты, «силитряный спирт» – азотная кислота, «нашатырный спирт» – водный раствор аммиака. Маслообразные жидкости и твердые вещества назывались маслами, например, концентрированная серная кислота носила название «купоросное масло», хлорид мышьяка – «мышьяковое масло».
Иногда вещества получали название по имени его первооткрывателя, например, «глауберова соль» Na 2 SO 4 *10H 2 O, открытая немецким химиком И. Р. Глаубером в XVII веке.
Рис. 2. Портрет И. Р. Глаубер.
В старинных названиях могли указываться вкус веществ, цвет, запах, внешний вид, медицинское действие. Одно вещество иногда имело несколько наименований.
К концу XVIII века химикам было известно не более 150-200 соединений.
Первую систему научных названий в химии выработала в 1787 г. комиссия химиков во главе с А. Лавуазье. Химическая номенклатура Лавуазье послужила основой для создания национальных химических номенклатур. Для того, чтобы химики разных стран понимали друг друга, номенклатура должна быть единой. В настоящее время построение химических формул и названий неорганических веществ подчиняется системе номенклатурных правил, созданной комиссией Международного союза теоретической и прикладной химии (ИЮПАК). Каждое вещество изображается формулой, в соответствии с ней строится систематическое название соединения.
Рис. 3. А. Лавуазье.
Что мы узнали?
Все химические элементы имеют латинские корни. Латинские названия химических элементов являются общепринятыми. В русский язык они переносятся с помощью калькирования или перевода. однако некоторые слова имеют изначально русское значение, например, медь или железо. Химической номенклатуре подчиняются все химические вещества, состоящие из атомов и молекул. впервые система научных названий была разработана А. Лавуазье.
Тест по теме
Оценка доклада
Средняя оценка: 4.2 . Всего получено оценок: 768.
Не потеряйте. Подпишитесь и получите ссылку на статью себе на почту.
Любой, кто ходил в школу, помнит, что одним из обязательных для изучения предметов была химия. Она могла нравиться, а могла и не нравиться – это не важно. И вполне вероятно, что многие знания по этой дисциплине уже забыты и в жизни не применяются. Однако таблицу химических элементов Д. И. Менделеева наверняка помнит каждый.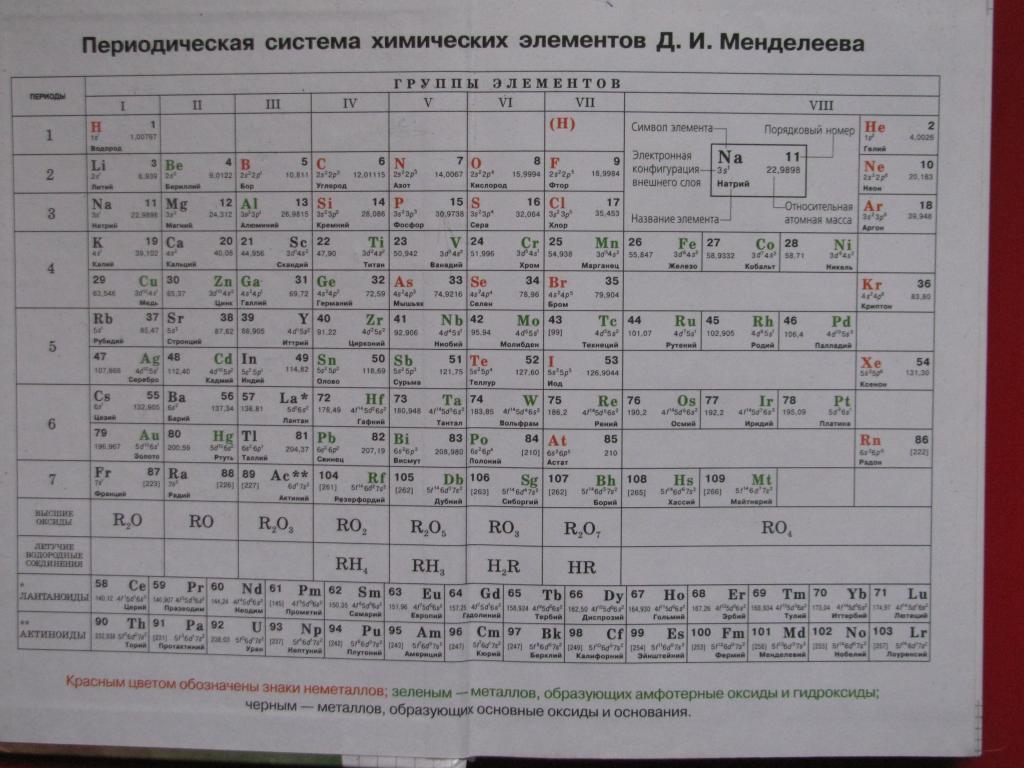 Для многих она так и осталась разноцветной таблицей, где в каждый квадратик вписаны определённые буквы, обозначающие названия химических элементов. Но здесь мы не будем говорить о химии как таковой, и описывать сотни химических реакций и процессов, а расскажем о том, как вообще появилась таблица Менделеева – эта история будет интересна любому человеку, да и вообще всем тем, кто охоч до интересной и полезной информации.
Для многих она так и осталась разноцветной таблицей, где в каждый квадратик вписаны определённые буквы, обозначающие названия химических элементов. Но здесь мы не будем говорить о химии как таковой, и описывать сотни химических реакций и процессов, а расскажем о том, как вообще появилась таблица Менделеева – эта история будет интересна любому человеку, да и вообще всем тем, кто охоч до интересной и полезной информации.
Небольшая предыстория
В далёком 1668 году выдающимся ирландским химиком, физиком и богословом Робертом Бойлем была опубликована книга, в которой было развенчано немало мифов об алхимии, и в которой он рассуждал о необходимости поиска неразложимых химических элементов. Учёный также привёл их список, состоящий всего из 15 элементов, но допускал мысль о том, что могут быть ещё элементы. Это стало отправной точкой не только в поиске новых элементов, но и в их систематизации.
Сто лет спустя французским химиком Антуаном Лавуазье был составлен новый перечень, в который входили уже 35 элементов. 23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учёными по всему миру. И главную роль в этом процессе сыграл знаменитый русский химик Дмитрий Иванович Менделеев – он впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
23 из них позже были признаны неразложимыми. Но поиск новых элементов продолжался учёными по всему миру. И главную роль в этом процессе сыграл знаменитый русский химик Дмитрий Иванович Менделеев – он впервые выдвинул гипотезу о том, что между атомной массой элементов и их расположением в системе может быть взаимосвязь.
Благодаря кропотливому труду и сопоставлению химических элементов Менделеев смог обнаружить связь между элементами, в которой они могут быть одним целым, а их свойства являются не чем-то само собой разумеющимся, а представляют собой периодически повторяющееся явление. В итоге, в феврале 1869 года Менделеев сформулировал первый периодический закон, а уже в марте его доклад «Соотношение свойств с атомным весом элементов» был представлен на рассмотрение Русского химического общества историком химии Н. А. Меншуткиным. Затем в том же году публикация Менделеева была напечатана в журнале «Zeitschrift fur Chemie» в Германии, а в 1871 году новую обширную публикацию учёного, посвящённую его открытию, опубликовал другой немецкий журнал «Annalen der Chemie».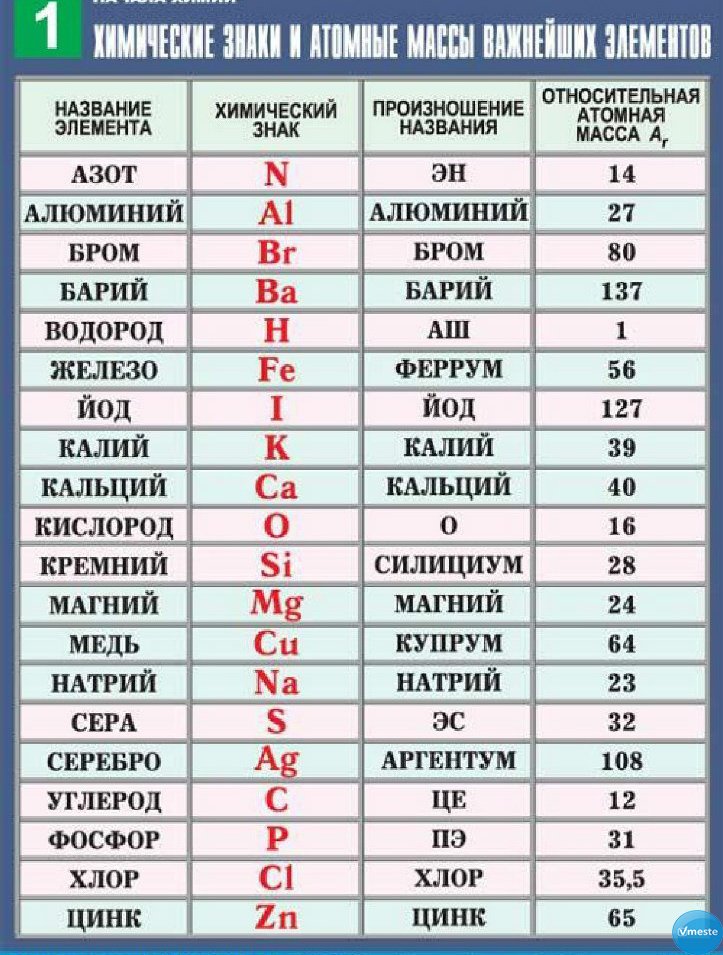
Создание периодической таблицы
Основная идея к 1869 году уже была сформирована Менделеевым, причём за довольно короткое время, но оформить её в какую-либо упорядоченную систему, наглядно отображающую, что к чему, он долго не мог. В одном из разговоров со своим соратником А. А. Иностранцевым он даже сказал, что в голове у него уже всё сложилось, но вот привести всё к таблице он не может. После этого, согласно данным биографов Менделеева, он приступил к кропотливой работе над своей таблицей, которая продолжалась трое суток без перерывов на сон. Перебирались всевозможные способы организации элементов в таблицу, а работа была осложнена ещё и тем, что в тот период наука знала ещё не обо всех химических элементах. Но, несмотря на это, таблица всё же была создана, а элементы систематизированы.
Легенда о сне Менделеева
Многие слышали историю, что Д. И. Менделееву его таблица приснилась. Эта версия активно распространялась вышеупомянутым соратником Менделеева А. А. Иностранцевым в качестве забавной истории, которой он развлекал своих студентов. Он говорил, что Дмитрий Иванович лёг спать и во сне отчётливо увидел свою таблицу, в которой все химические элементы были расставлены в нужном порядке. После этого студенты даже шутили, что таким же способом была открыта 40° водка. Но реальные предпосылки для истории со сном всё же были: как уже упоминалось, Менделеев работал над таблицей без сна и отдыха, и Иностранцев однажды застал его уставшим и вымотанным. Днём Менделеев решил немного передохнуть, а некоторое время спустя, резко проснулся, сразу же взял листок бумаги и изобразил на нём уже готовую таблицу. Но сам учёный опровергал всю эту историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.
А. Иностранцевым в качестве забавной истории, которой он развлекал своих студентов. Он говорил, что Дмитрий Иванович лёг спать и во сне отчётливо увидел свою таблицу, в которой все химические элементы были расставлены в нужном порядке. После этого студенты даже шутили, что таким же способом была открыта 40° водка. Но реальные предпосылки для истории со сном всё же были: как уже упоминалось, Менделеев работал над таблицей без сна и отдыха, и Иностранцев однажды застал его уставшим и вымотанным. Днём Менделеев решил немного передохнуть, а некоторое время спустя, резко проснулся, сразу же взял листок бумаги и изобразил на нём уже готовую таблицу. Но сам учёный опровергал всю эту историю со сном, говоря: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово». Так что легенда о сне может быть и очень привлекательна, но создание таблицы стало возможным только благодаря упорному труду.
Дальнейшая работа
В период с 1869 по 1871 годы Менделеев развивал идеи периодичности, к которым склонялось научное сообщество. И одним из важных этапов данного процесса стало понимание того, что любой элемент в системе должно располагать, исходя из совокупности его свойств в сравнении со свойствами остальных элементов. Основываясь на этом, а также опираясь на результаты исследований в изменении стеклообразующих оксидов, химику удалось внести поправки в значения атомных масс некоторых элементов, среди которых были уран, индий, бериллий и другие.
И одним из важных этапов данного процесса стало понимание того, что любой элемент в системе должно располагать, исходя из совокупности его свойств в сравнении со свойствами остальных элементов. Основываясь на этом, а также опираясь на результаты исследований в изменении стеклообразующих оксидов, химику удалось внести поправки в значения атомных масс некоторых элементов, среди которых были уран, индий, бериллий и другие.
Пустые клетки, остававшиеся в таблице, Менделеев, конечно же, хотел скорее заполнить, и в 1870 году предсказал, что в скором времени будут открыты неизвестные науке химические элементы, атомные массы и свойства которых он сумел вычислить. Первыми из них стали галлий (открыт в 1875 году), скандий (открыт в 1879 году) и германий (открыт в 1885 году). Затем прогнозы продолжили реализовываться, и были открыты ещё восемь новых элементов, среди которых: полоний (1898 год), рений (1925 год), технеций (1937 год), франций (1939 год) и астат (1942-1943 годы). Кстати, в 1900 году Д. И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
И. Менделеев и шотландский химик Уильям Рамзай пришли к мнению, что в таблицу должны быть включены и элементы нулевой группы – до 1962 года они назывались инертными, а после – благородными газами.
Организация периодической системы
Химические элементы в таблице Д. И. Менделеева расположены по рядам, в соответствии с возрастанием их массы, а длина рядов подобрана так, чтобы находящиеся в них элементы имели схожие свойства. Например, благородные газы, такие как радон, ксенон, криптон, аргон, неон и гелий с трудом вступают в реакции с другими элементами, а также имеют низкую химическую активность, из-за чего расположены в крайнем правом столбце. А элементы левого столбца (калий, натрий, литий и т.д.) отлично реагируют с прочими элементами, а сами реакции носят взрывной характер. Говоря проще, внутри каждого столбца элементы имеют подобные свойства, варьирующиеся при переходе от одного столбца к другому. Все элементы, вплоть до №92 встречаются в природе, а с №93 начинаются искусственные элементы, которые могут быть созданы лишь в лабораторных условиях.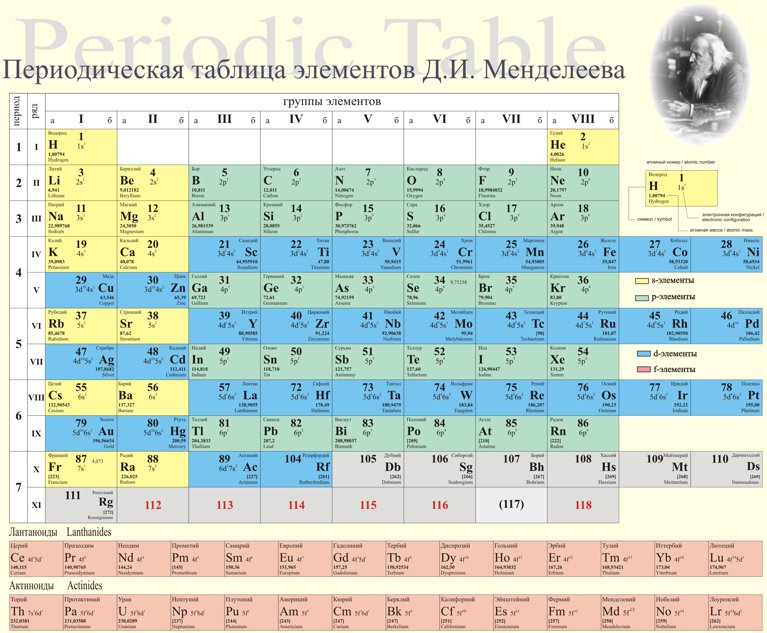
В своём первоначальном варианте периодическая система понималась только как отражение существующего в природе порядка, и никаких объяснений, почему всё должно обстоять именно так, не было. И лишь когда появилась квантовая механика, истинный смысл порядка элементов в таблице стал понятен.
Уроки творческого процесса
Говоря о том, какие уроки творческого процесса можно извлечь из всей истории создания периодической таблицы Д. И. Менделеева, можно привести в пример идеи английского исследователя в области творческого мышления Грэма Уоллеса и французского учёного Анри Пуанкаре. Приведём их вкратце.
Согласно исследованиям Пуанкаре (1908 год) и Грэма Уоллеса (1926 год), существует четыре основных стадии творческого мышления:
- Подготовка – этап формулирования основной задачи и первые попытки её решения;
- Инкубация – этап, во время которого происходит временное отвлечение от процесса, но работа над поиском решения задачи ведётся на подсознательном уровне;
- Озарение – этап, на котором находится интуитивное решение. Причём, найтись это решение может в абсолютно не имеющей к задаче ситуации;
- Проверка – этап испытаний и реализации решения, на котором происходит проверка этого решения и его возможное дальнейшее развитие.
Как мы видим, в процессе создания своей таблицы Менделеев интуитивно следовал именно этим четырём этапам. Насколько это эффективно, можно судить по результатам, т.е. по тому, что таблица была создана. А учитывая, что её создание стало огромным шагом вперёд не только для химической науки, но и для всего человечества, приведённые выше четыре этапа могут быть применимы как к реализации небольших проектов, так и к осуществлению глобальных замыслов. Главное помнить, что ни одно открытие, ни одно решение задачи не могут быть найдены сами по себе, как бы ни хотели мы увидеть их во сне и сколько бы ни спали. Чтобы что-то получилось, не важно, создание это таблицы химических элементов или разработка нового маркетинг-плана, нужно обладать определёнными знаниями и навыками, а также умело использовать свои потенциал и упорно работать.
Мы желаем вам успехов в ваших начинаниях и успешной реализации задуманного!
2.1. Химический язык и его части
Человечество использует много разных языков.
Кроме естественных языков (японского,
английского, русского – всего более 2,5 тысяч),
существуют еще и искусственные языки ,
например, эсперанто. Среди искусственных языков
выделяются языки различных наук . Так, в
химии используется свой, химический язык .
Химический язык – система условных
обозначений и понятий, предназначенная для
краткой, ёмкой и наглядной записи и передачи
химической информации.
Сообщение, написанное на большинстве
естественных языков, делится на предложения,
предложения – на слова, а слова – на буквы. Если
предложения, слова и буквы мы назовем частями
языка, то тогда мы сможем выделить аналогичные
части и в химическом языке (таблица 2).
Таблица 2. Части химического языка
Любым языком овладеть сразу невозможно, это относится и к химическому языку. Поэтому пока вы познакомитесь только с основами этого языка: выучите некоторые ” буквы” , научитесь понимать смысл ” слов” и” предложений” . В конце этой главы вы познакомитесь с названиями химических веществ – неотъемлемой частью химического языка. По мере изучения химии ваше знание химического языка будет расширяться и углубляться.
ХИМИЧЕСКИЙ ЯЗЫК.
1.Какие искусственные языки вы знаете (кроме
названных в тексте учебника)?
2.Чем естественные языки отличаются от
искусственных?
3.Как вы думаете, можно ли при описании химических
явлений обходиться без использования
химического языка? Если нет, то почему? Если да, то
в чем будут заключаться преимущества, а в чем
недостатки такого описания?
2.2. Символы химических элементов
Символ химического элемента обозначает сам
элемент или один атом этого элемента.
Каждый такой символ представляет собой
сокращенное латинское название химического
элемента, состоящее из одной или двух букв
латинского алфавита (латинский алфавит см. в
приложении 1). Символ пишется с прописной буквы.
Символы, а также русские и латинские названия
некоторых элементов, приведены в таблице 3. Там же
даны сведения о происхождении латинских
названий. Общего правила произношения символов
не существует, поэтому в таблице 3 приводится и
” чтение” символа, то есть, как этот символ
читается в химической формуле.
Заменять символом название элемента в устной
речи нельзя, а в рукописных или печатных текстах
это допускается, но не рекомендуется.В настоящее
время известно 110 химических элементов, у 109 из
них есть названия и символы, утвержденные
Международным союзом теоретической и прикладной
химии (ИЮПАК).
В таблице 3 приведена информация только о 33
элементах. Это те элементы, которые при изучении
химии вам встретятся в первую очередь. Русские
названия (в алфавитном порядке) и символы всех
элементов приведены в приложении 2.
Таблица 3. Названия и символы некоторых химических элементов
Название | ||||
Латинское | Написание | |||
| – | Написание | Происхождение | – | – |
| Азот | N itrogenium | От греч. ” рождающий селитру” | ” эн” | |
| Алюминий | Al uminium | От лат. ” квасцы” | ” алюминий” | |
| Аргон | Ar gon | От греч. ” недеятельный” | ” аргон” | |
| Барий | Ba rium | От греч. ” тяжелый” | ” барий” | |
| Бор | B orum | От арабск. ” белый минерал” | ” бор” | |
| Бром | Br omum | От греч. ” зловонный” | ” бром” | |
| Водород | H ydrogenium | От греч. ” рождающий воду” | ” аш” | |
| Гелий | He lium | От греч. ” Солнце” | ” гелий” | |
| Железо | Fe rrum | От лат. ” меч” | ” феррум” | |
| Золото | Au rum | От лат. ” горящий” | ” аурум” | |
| Йод | I odum | От греч. ” фиолетовый” | ” йод” | |
| Калий | K alium | От арабск. ” щёлочь” | ” калий” | |
| Кальций | Ca lcium | От лат. ” известняк” | ” кальций” | |
| Кислород | O xygenium | От греч. ” рождающий кислоты” | ” о” | |
| Кремний | Si licium | От лат. ” кремень” | ” силициум” | |
| Криптон | Kr ypton | От греч. ” скрытый” | ” криптон” | |
| Магний | M ag nesium | От назв. полуострова Магнезия | ” магний” | |
| Марганец | M an ganum | От греч. ” очищающий” | ” марганец” | |
| Медь | Cu prum | От греч. назв. о. Кипр | ” купрум” | |
| Натрий | Na trium | От арабск, ” моющее средство” | ” натрий” | |
| Неон | Ne on | От греч. ” новый” | ” неон” | |
| Никель | Ni ccolum | От нем. ” медь святого Николая” | ” никель” | |
| Ртуть | H ydrarg yrum | Лат. ” жидкое серебро” | ” гидраргирум” | |
| Свинец | P lumb um | От лат. названия сплава свинца с оловом. | ” плюмбум” | |
| Сера | S ulfur | От санскриттского ” горючий порошок” | ” эс” | |
| Серебро | A rg entum | От греч. ” светлый” | ” аргентум” | |
| Углерод | C arboneum | От лат. ” уголь” | ” цэ” | |
| Фосфор | P hosphorus | От греч. ” несущий свет” | ” пэ” | |
| Фтор | F luorum | От лат. глагола ” течь” | ” фтор” | |
| Хлор | Cl orum | От греч. ” зеленоватый” | ” хлор” | |
| Хром | C hr omium | От греч. ” краска” | ” хром” | |
| Цезий | C aes ium | От лат. ” небесно-голубой” | ” цезий” | |
| Цинк | Z in cum | От нем. ” олово” | ” цинк” | |
2.3. Химические формулы
Для обозначения химических веществ используют химические формулы .
Для молекулярных веществ химическая формула
может обозначать и одну молекулу этого вещества.
Информация о веществе может быть разной, поэтому
существуют разные типы химических формул .
В зависимости от полноты информации химические
формулы делятся на четыре основных типа: простейшие , молекулярные , структурные и пространственные .
Подстрочные индексы в простейшейформуле не
имеют общего делителя.
Индекс ” 1″ в формулах не ставится.
Примеры простейших формул: вода – Н 2 О,
кислород – О, сера – S, оксид фосфора – P 2 O 5 ,
бутан – C 2 H 5 , фосфорная кислота – H 3 PO 4 ,
хлорид натрия (поваренная соль) – NaCl.
Простейшая формула воды (Н 2 О) показывает,
что в состав воды входит элемент водород (Н) и
элемент кислород (О), причем в любой порции
(порция – часть чего-либо, что может быть
разделено без утраты своих свойств.) воды число
атомов водорода в два раза больше числа атомов
кислорода.
Число частиц , в том числе и число атомов ,
обозначается латинской буквой N . Обозначив
число атомов водорода – N H , а число
атомов кислорода – N O , мы можем
записать, что
Или N H: N O = 2: 1.
Простейшая формула фосфорной кислоты (Н 3 РО 4) показывает, что в состав фосфорной кислоты входят атомы водорода , атомы фосфора и атомы кислорода , причем отношение чисел атомов этих элементов в любой порции фосфорной кислоты равно 3:1:4, то есть
N H: N P: N O = 3: 1: 4.
Простейшая формула может быть составлена для любого индивидуального химического вещества, а для молекулярного вещества, кроме того, может быть составлена молекулярная формула .
Примеры молекулярных формул: вода – H 2 O, кислород – O 2 , сера – S 8 , оксид фосфора – P 4 O 10 , бутан – C 4 H 10 , фосфорная кислота – H 3 PO 4 .
У немолекулярных веществ молекулярных формул нет.
Последовательность записи символов элементов в простейших и молекулярных формулах определяется правилами химического языка, с которыми вы познакомитесь по мере изучения химии. На информацию, передаваемую этими формулами, последовательность символов влияния не оказывает.
Из знаков, отражающих строение веществ, мы будем использовать пока только валентный штрих (” черточку”). Этот знак показывает наличие между атомами так называемой ковалентной связи (что это за тип связи и каковы его особенности, вы скоро узнаете).
В молекуле воды атом кислорода связан простыми (одинарными) связями с двумя атомами водорода, а атомы водорода между собой не связаны. Именно это наглядно показывает структурная формула воды.
Другой пример: молекула серы S 8 . В этой молекуле 8 атомов серы образуют восьмичленный цикл, в котором каждый атом серы связан с двумя другими атомами простыми связями. Сравните структурную формулу серы с объемной моделью ее молекулы, показанной на рис. 3. Обратите внимание на то, что структурная формула серы не передает форму ее молекулы, а показывает только последовательность соединения атомов ковалентными связями.
Структурная формула фосфорной кислоты показывает, что в молекуле этого вещества один из четырех атомов кислорода связан только с атомом фосфора двойной связью, а атом фосфора, в свою очередь, связан еще с тремя атомами кислорода простыми связями. Каждый из этих трех атомов кислорода, кроме того, связан простой связью с одним из трех имеющихся в молекуле атомов водорода./p>
Сравните приведенную ниже объемную модель молекулы метана с его пространственной, структурной и молекулярной формулой:
В пространственной формуле метана клиновидныевалентные штрихи как бы в перспективе показывают, какой из атомов водорода находится ” ближе к нам” , а какой ” дальше от нас” .
Иногда в пространственной формуле указывают длины связей и значения углов между связями в молекуле, как это показано на примере молекулы воды.
Немолекулярные вещества не содержат молекул. Для удобства проведения химических расчетов в немолекулярном веществе выделяют так называемую формульную единицу .
Примеры состава формульных единиц некоторых веществ: 1) диоксид кремния (кварцевый песок, кварц) SiO 2 – формульная единица состоит из одного атома кремния и двух атомов кислорода; 2) хлорид натрия (поваренная соль) NaCl – формульная единица состоит из одного атома натрия и одного атома хлора; 3) железо Fe – формульная единица состоит из одного атома железа.Как и молекула, формульная единица – наименьшая порция вещества, сохраняющая его химические свойства.
Таблица 4
Информация, передаваемая формулами разных типов
Тип формулы | Информация, передаваемая формулой. | |
| Простейшая Молекулярная Структурная Пространственная |
| |
Рассмотрим теперь на примерах, какую информацию дают нам формулы разных типов.
1. Вещество: уксусная кислота . Простейшая формула – СН 2 О, молекулярная формула – C 2 H 4 O 2 , структурная формула
Простейшая формула говорит нам, что
1) в состав уксусной кислоты входит углерод,
водород и кислород;
2) в этом веществе число атомов углерода
относится к числу атомов водорода и к числу
атомов кислорода, как 1:2:1, то есть N H: N C:N O = 1:2:1.
Молекулярная формула добавляет, что
3) в молекуле уксусной кислоты – 2 атома углерода,
4 атома водорода и 2 атома кислорода.
Структурная формула добавляет, что
4, 5) в молекуле два атома углерода связаны между
собой простой связью; один из них, кроме этого,
связан с тремя атомами водорода, с каждым простой
связью, а другой – с двумя атомами кислорода, с
одним – двойной связью, а с другим – простой;
последний атом кислорода связан еще простой
связью с четвертым атомом водорода.
2. Вещество: хлорид натрия . Простейшая формула – NaCl.
1) В состав хлорида натрия входит натрий и хлор.
2) В этом веществе число атомов натрия равно числу
атомов хлора.
3. Вещество: железо . Простейшая
формула – Fe.
1) В состав этого вещества входит только железо,
то есть это простое вещество.
4. Вещество: триметафосфорная кислота . Простейшая формула – HPO 3 , молекулярная формула – H 3 P 3 O 9 , структурная формула
1) В состав триметафосфорной кислоты входит
водород, фосфор и кислород.
2) N H: N P:N O = 1:1:3.
3) Молекула состоит из трех атомов водорода, трех
атомов фосфора и девяти атомов кислорода.
4, 5) Три атома фосфора и три атома кислорода,
чередуясь, образуют шестичленный цикл. Все связи
в цикле простые. Каждый атом фосфора, кроме того,
связан еще с двумя атомами кислорода, причем с
одним – двойной связью, а с другим – простой.
Каждый из трех атомов кислорода, связанных
простыми связямис атомами фосфора, связан еще
простой связью с атомом водорода.
| Фосфорная кислота – H 3 PO 4 (другое название – ортофосфорная кислота) – прозрачное бесцветное кристаллическое вещество молекулярного строения, плавящееся при 42 o С. Это вещество очень хорошо растворяется в воде и даже поглощает пары воды из воздуха (гигроскопично). Фосфорную кислоту производят в больших количествах и используют прежде всего в производстве фосфорных удобрений, а также в химической промышленности, при производстве спичек и даже в строительстве. Кроме того, фосфорная кислота применяется при изготовлении цемента в зубоврачебной технике, входит в состав многих лекарственных средств. Эта кислота достаточно дешева, поэтому в некоторых странах, например в США, очень чистая сильно разбавленная водой фосфорная кислота добавляется в освежающие напитки для замены дорогой лимонной кислоты. |
| Метан – CH 4 . Если у вас дома есть газовая плита, то с этим веществом вы сталкиваетесь ежедневно: природный газ, который горит в конфорках вашей плиты, на 95 % состоит из метана. Метан – газ без цвета и запаха с температурой кипения –161 o С. В смеси с воздухом он взрывоопасен, этим и объясняются происходящие иногда в угольных шахтах взрывы и пожары (другое название метана – рудничный газ). Третье название метана – болотный газ – связано с тем, что пузырьки именно этого газа поднимаются со дна болот, где он образуется в результате деятельности некоторых бактерий. В промышленности метан используется как топливо и сырье для производства других веществ.Метан является простейшим углеводородом . К этому классу веществ относятся также этан (C 2 H 6), пропан (C 3 H 8), этилен (C 2 H 4), ацетилен (C 2 H 2) и многие другие вещества. |
Таблица 5 . Примеры формул разных типов для некоторых веществ –
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. И наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
Шаги
Часть 1
Структура таблицыКак видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент. Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
Узнайте, почему в таблице присутствуют пустые ячейки. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 102 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.
Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода – 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы – в правой части таблицы. Металлоиды расположены между ними.
Часть 2
Обозначения элементовКаждый элемент обозначается одной или двумя латинскими буквами. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
Обратите внимание на полное название элемента, если оно приведено в таблице. Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.
- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента. Элементы имеют атомные номера от 1 до 118.
- Атомный номер всегда является целым числом.
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!
- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.
Обычно количество электронов равно числу протонов. Исключением является тот случай, когда атом ионизирован. Протоны имеют положительный, а электроны – отрицательный заряд. Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.
- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс». Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
- Знаки «плюс» и «минус» не ставятся, если атом не является ионом.
Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу). Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
обозначающие знаки, таблица, правильное чтение
Строение веществ и их переходы из одного состояния в другое изучает химия. В первую очередь для успешного понимания науки нужно выучить названия и произношение химических элементов. Существует общепринятая система классификации. Её первоначальный вариант разработал русский учёный Дмитрий Иванович Менделеев, назвав свой свод периодической таблицей. Всего же на начало 2019-го года известно 118 элементов.
Классификация химических веществ
Вещество состоит из различных частиц. В его состав входят электроны, нейтроны и протоны. Взаимосвязи элементарных зарядов образуют атомы. В свою очередь, из них формируются молекулы и кристаллы. Из-за особенностей строения кристаллической решётки — основы вещества — тела могут находиться в твёрдом, жидком или газообразном состоянии. При этом они могут переходить из одной фазы в другую.
Каждому состоянию тела присущ набор свойств. Это характеристики, определяющие индивидуальность вещества, позволяя их отличать друг от друга.
Из наиболее интересных можно отметить: температуру плавления и кипения, строение кристаллической решётки, плотность, термодинамические и фазовые характеристики.
Вещества могут не только изменять свои агрегатные состояния, но и взаимодействовать между собой, образовывая новые соединения. Впервые классифицировать тела попробовал Д. И. Менделеев.
Его периодическая таблица, составленная им с 1869 года по 1871 год, строилась на отличии атомного веса (массы). В современном варианте его система видоизменилась. Так было выполнено сведение веществ в двумерную таблицу, в которой столбцы определяют главные физико-химические свойства, а строки являются периодами, в определённой мере подобными друг другу.
Каждый элемент, внесённый в таблицу, имеет свою историю открытия. Учёные, исследуя то или иное вещество, выделяли в нём индивидуальные особенности, что позволяло им давать названия, ассоциирующиеся с какими-то либо личными убеждениями и сравнениями.
Но перед этим в учёном мире были приняты важные термины:
- Элемент — слово произошло от латинского elementum, обозначающего какую-либо часть. Ученые античного времени говорили: «Как слова состоят из букв, так и тела — из элементов». Слово образовано из отрицательной приставки «а» и «томе» — рассечение.
- Атом — в переводе с греческого языка слово обозначает целое (неделимое).
- Молекула — термин происходит от латинского moles. На русский язык это слово можно перевести как «массив», «глыба».
Как видно из названия, химические совокупности ассоциируются с их свойствами. По этому же принципу давались названия и открытым веществам. Так как исследованиями занимались в основном Европейские учёные, то их названия записывались на латыни.
При этом у подавляющего числа элементов, звучащих на русском, они фонетически близки к латинским.
Правильное произношение
В таблице Менделеева все вещества написаны на латыни. Часто вместе с сокращённым названием указывается полное. Например, Ar — argon, Ba — barium, Au — aurum. Но для русскоязычного населения полное наименование пишут на русском. Так, Ar — аргон, Ba — барий, Au — аурум.
Произношение их что на латыни, что на русском языке одинаково. Единственное — присутствует акцент. Но существуют элементы, которые имеют двойное название. То есть, их можно произносить так же, как они и пишутся, или совсем по-другому. К таким веществам относятся:
- Золото — обозначается знаком Au и читается аурум. Слово в переводе с иностранного обозначает «жёлтое».
- Серебро — символизируется символом Ar, может произноситься как «аргентум». Слово имеет индоевропейское происхождение. Arg — обозначает светлый.
- Железо — подписывают знаком Fe, а читают как феррум. С латинского ferrum происходит от fars, что обозначает «крепкий».
- Сера — правильное название sulfur (сульфур). Обозначают её символом S. Интересно, что в древнерусском и старославянском под серой понимали любое горючее вещество, например, жир.
- Свинец — произносится как плюмбум (plumbum). Причина названия элемента доподлинно неизвестна. Сокращённое обозначение элемента — Pb.
- Олово — химический символ Sn. Элемент четырнадцатой группы пишется на латыни как stannum. Произносится также — «станниум». Происхождение записи связывают с санскритским словом, обозначающим прочность.
- Углерод — элемент, обозначающийся знаком C. Латинское название carboneum произносится как «карбон». Слово имеет в названии корень carbō обозначающий «уголь».
- Ртуть — с латинского звучит как «гидраргиум». Hydrargirum произошло от слияния слов «хюдор» — вода и «аргирос» — серебро.
- Медь — международное обозначение Сu. Пишется как cuprum, а произносится «купрум». Считается, что элемент получил название в честь острова Кипр, где находилось много рудников.
- Азот — пишется в зарубежной литературе как nitrogenium. За обозначение принят символ N. На русском языке произносится как «нитрогениум». Слово происходит от древнегреческого ἄζωτоς — «безжизненный».
Названия популярных элементов
В классической периодической таблице указано 118 элементов.
Расположены они по атомным номерам. Но вместе с этим существует и расширенный свод. Он является логическим продолжением труда русского химика и включает возможные, ещё не выявленные вещества. С учётом расширенной таблицы всего предполагается существование 218 веществ. Вот самые распространённые химические элементы таблицы Менделеева с произношением:
| Азо́т | эн | N | Nitrogenium |
| Алюми́ний | алюми́ний | Al | Aluminium |
| Ба́рий | Barium | Ba | ба́рий |
| Бери́ллий | Beryllium | Be | бери́ллий |
| Бор | Borum | B | бор |
| Бром | Bromium | Br | бром |
| Вана́дий | Vanadium | V | вана́дий |
| Ви́смут | Bismuthum | Bi | ви́смут |
| Водород | Hydrogenium | H | аш |
| Вольфра́м | Wolframium | W | вольфра́м |
| Ге́лий | Helium | He | ге́лий |
| Герма́ний | Germanium | Ge | герма́ний |
| Желе́зо | Ferrum | Fe | фе́ррум |
| Зо́лото | Aurum | Au | а́урум |
| Индий | Indium | In | и́ндий |
| Йод | Iodium | I | йод |
| Ири́дий | Iridium | Ir | ири́дий |
| Ка́дмий | Cadmium | Cd | ка́дмий |
| Ка́лий | Kalium | K | ка́лий |
| Ка́льций | Calcium | Ca | ка́льций |
| Кислоро́д | Oxygenium | O | о |
| Ко́бальт | Cobaltum | Co | ко́бальт |
| Кре́мний | Silicium | Si | сили́циум |
| Крипто́н | Krypton | Kr | крипто́н |
| Ксено́н | Xenon | Xe | ксено́н |
| Литий | Lithium | Li | ли́тий |
| Ма́гний | Magnesium | Mg | ма́гний |
| Ма́рганец | Manganum | Mn | ма́рганец |
| Медь | Cuprum | Cu | ку́прум |
| Молибде́н | Molybdaenum | Mo | молибде́н |
| Мышьяк | Arsenicum | As | арсе́никум |
| На́трий | Natrium | Na | на́трий |
| Неоди́м | Neodymium | Nd | неоди́м |
| Нео́н | Neon | Ne | нео́н |
| Ни́кель | Niccolum | Ni | ни́кель |
| Олово | Stannum | Sn | ста́ннум |
| Осмий | Osmium | Os | о́смий |
| Палла́дий | Palladium | Pd | палла́дий |
| Платина | Platinum | Pt | пла́тина |
| Плуто́ний | Plutonium | Pu | плуто́ний |
| Ра́дий | Radium | Ra | ра́дий |
| Радо́н | Radon | Rn | радо́н |
| Резерфо́рдий | Rutherfordium | Rf | резерфо́рдий |
| Ре́ний | Rhenium | Re | ре́ний |
| Ртуть | Hydrargyrum | Hg | гидра́ргирум |
| Руби́дий | Rubidium | Rb | руби́дий |
| Свине́ц | Plumbum | Pb | плю́мбум |
| Селе́н | Selenium | Se | селе́н |
| Се́ра | Sulfur | S | эс |
| Серебро́ | Argentum | Ag | арге́нтум |
| Стро́нций | Strontium | Sr | стро́нций |
| Сурьма́ | Stibium | Sb | сти́биум |
| Танта́л | Tantalum | Ta | танта́л |
| Тита́н | Titanium | Ti | тита́н |
| То́рий | Thorium | Th | то́рий |
| Углеро́д | Carboneum | C | цэ |
| Ура́н | Uranium | U | ура́н |
| Фо́сфор | Phosphorus | P | пэ |
| Фтор | Fluorum | F | фтор |
| Хлор | Chlorum | Cl | хлор |
| Хром | Chromium | Cr | хром |
| Це́зий | Caesium | Cs | це́зий |
| Цинк | Zincum | Zn | цинк |
| Цирко́ний | Zirconium | Zr | цирко́ний |
Следует отметить, что знаковое обозначение элементов принято Международным союзом теоретической и прикладной химии. Его членами являются академии наук, химические общества, и научные организации 57 стран мира.
В качестве аббревиатуры комитета используется ИЮПАК. Именно его члены занимаются стандартизацией в области химии.
Чтение формул и символов
Цифра, стоящая перед веществом, обозначает количество молекул. Элемент же записывают буквенными символами. В устной речи придерживаются правила, при котором называют последовательно, начиная справа, все знаки.
Например, h3O — формула воды, её читают как «аш два о», NaCl (хлорид натрия) — «натрий хлор». Чтобы правильно произносить химические соединения, необходимо знать, как звучат символы элементов. Не стоит забывать и то, что индекс, относящийся к скобкам (группе атомов), произносят с суффиксом -жды. Например: дважды, трижды, четырежды.
Таким образом, несмотря на то, что существуют русские и латинские обозначения каждого химического элемента, в химических формулах используется только стандартное правило. При произношении соединения употребляют латинские названия. При этом часто они соответствуют русским, особенно если в имени элемента используется более одной буквы. Если же в названии стоит один символ, то латинскому имении соответствует название этой буквы.
То есть, например, гелий, так и произносится в формулах. Но если встречаются сокращённые буквы латиницы, то нужно произносить элемент полностью, как он и называется, например, Si — сицилициум и так далее. Вот некоторые названия редких элементов:
- Сm — кюрий.
- Сf — калифорний.
- Fm — фермий.
- No — нобелий.
- Lr — лоуренций.
- Hs — хассий.
- Po — полоний.
- Pa — проктаний.
- Gd — гадолиний.
- Er — эрбий.
Интересно и то, что последние элементы, которые добавляют в таблицу Менделеева являются синтезированными. Так, 115 был получен в Дубне. Назвали его moscovium (Mc), произносится на русском — «московий». Элемент 117 назвали tennessine (TS). Имя ему было дано в честь штата Теннесси.
В честь Юрия Цолаковича Оганесяна было решено назвать 118 элемент. Пишется он как oganesson (Og), читается — «оганесон». Это пока последний элемент, добавленный в таблицу.
перевод, произношение, транскрипция, примеры использования
Химический элемент серебро является металлом.
Все инвестиции содержат в себе элемент риска.
Существенной частью её успеха является честность.
В этом унылом городишке ей было совсем не по себе.
Самая душа его строилась из одной лишь скорби.
периодическая система химических элементов (Д.И.Менделеева)
В его словах была какая-то доля (т.е. небольшое количество) истины.
A free press is an essential element of a democracy.
Свободная пресса является необходимым элементом демократии.
Often there is an element of luck in getting the right answer.
Часто в получении правильного ответа присутствует элемент удачи.
There is an element of truth in your argument.
В ваших доводах есть доля правды.
An element of surprise is important to any attack.
Для любой атаки важен элемент неожиданности.
We must include this chemical element in the group.
Мы должны включить в данную группу этот химический элемент.
Some fishes can live a long time after removal from their element.
Некоторые рыбы способны прожить довольно долгое время после изъятия их из родной стихии.
There’s an element of risk in any kind of investment.
В любого рода инвестициях существует элемент риска.
The alchemists believed that there were four elements.
Алхимики считали, что существует четыре стихии.
Water is composed of the elements hydrogen and oxygen.
Вода состоит из элементов — водорода и кислорода.
Each element is mathematically coupled to its neighbours.
Каждый элемент математически связан с соседними.
There was an element of ambiguity in the president’s reply.
В ответе президента присутствовал элемент неопределённости.
There’s always an element of risk in this kind of investment.
В подобного рода вложениях всегда есть доля риска.
The word ‘element’ contains five different types of character.
Слово “element” (элемент) содержит пять различных типов печатных символов.
They have started showing a strong soul element in their sound.
В их звучании стали заметно проглядывать элементы стиля соул.
Graham was in his element, building a fire and cooking the steaks.
Грэм был в своей стихии: развести костёр и приготовить стейки — это по его части.
There is an element of doubt as to whether the deaths were accidental.
В том, что эти смерти были случайными, присутствует доля сомнения.
Besides ability, the other essential element in political success is luck.
Помимо таланта, другой важной составляющей политического успеха является удача.
There is an element of ‘jam tomorrow’ about some of the government’s policies.
В некоторых действиях правительства присутствует доля пустых обещаний “светлого будущего”.
Our knowledge of his tragic end adds an element of pathos to the story of his early success.
То, что мы знаем о его трагической кончине, добавляет элемент пафоса в историю его раннего успеха.
Her performance contains a strong element of self-parody (=when someone makes fun of their own style).
В её игре присутствует сильный элемент самопародии (когда кто-то высмеивает свой собственный стиль).
Тест на химические элементы. Тематические тесты по химии
Самостоятельная работа по химии Знаки химических элементов Периодическая система химических элементов Д.И. Менделеева с ответами для учащихся 8 класса. Самостоятельная работа состоит из 4 вариантов в каждом по 3 задания.
1 вариант
1. Заполните таблицу
2.
Химический элемент
1) магний
2) азот
3) железо
4) гелий
А) 1-й период; VIII группа, главная подгруппа
Б) 4-й период; VIII группа, побочная подгруппа
В) 3-й период; II группа, главная подгруппа
Г) 2-й период; V группа, главная подгруппа
Химический символ
а) Fe
б) Mg
в) He
г) N
3. Предложите не менее трех классификаций, в основе которых лежат различные признаки, связанные с положением элементов: Ве, Se, V, N, As, Cr, Mg в Периодической системе.
2 вариант
1. Заполните таблицу
2. У становите соответствие между названием химического элемента, положением в Периодической системе и его символом:
Химический элемент
1) фтор
2) хром
3) бор
4) натрий
Положение в Периодической системе
А) 4-й период; VI группа, побочная подгруппа
Б) 2-й период; VII группа, главная подгруппа
В) 3-й период; I группа, главная подгруппа
Г) 2-й период; III группа, главная подгруппа
Химический символ
а) F
б) Na
в) Cr
г) B
3. Предложите не менее трех классификаций, в основе которых лежат различные признаки, связанные с положением элементов: Br, S, О, Cl, Si, Cr, Mn в Периодической системе.
3 вариант
1. Заполните таблицу
2. У становите соответствие между названием химического элемента, положением в Периодической системе и его символом:
Химический элемент
1) серебро
2) кремний
3) кислород
4) аргон
Положение в Периодической системе
А) 3-й период; IV группа, главная подгруппа
Б) 5-й период; I группа, побочная подгруппа
В) 3-й период; VIII группа, главная подгруппа
Г) 2-й период; VI группа, главная подгруппа
Химический символ
а) O
б) Ag
в) Ar
г) Si
3. Предложите не менее трех классификаций, в основе которых лежат различные признаки, связанные с положением элементов: Са, С, Al, Sc, Ti, Ве, Mg в Периодической системе.
4 вариант
1. Заполните таблицу
2. У становите соответствие между названием химического элемента, положением в Периодической системе и его символом:
Химический элемент
1) литий
2) сера
3) бериллий
4) медь
Положение в Периодической системе
А) 2-й период; II группа, главная подгруппа
Б) 2-й период; I группа, главная подгруппа
В) 4-й период; 1 группа, побочная подгруппа
Г) 3-й период; VI группа, главная подгруппа
Химический символ
а) Cu
б) S
в) Be
г) Li
3. Предложите не менее трех классификаций, в основе которых лежат различные признаки, связанные с положением элементов: Р, Si, V, Sc, Na, Ge, Си в Периодической системе.
Ответы на самостоятельную работу по химии Знаки химических элементов
Вариант 1.
1. Cu — купрум, Н — аш, К — калий, С — це, Ag — аргентум.
2.
1) В — б,
2) Г — г,
3) Б — а,
4) А — в.
3. Возможные классификации:
а) элементы главных (Ве, Se, N, As, Mg) и побочных подгрупп (V, Cr),
б) элементы малых (Ве, N, Mg) и больших (Se, V, As, Cr) периодов,
в) элементы одного периода (2 — Ве, N; 3 — Mg; 4 — Se, V, As, Cr),
г) элементы одной группы (II — Ве, Mg, V — N, As, V, VI — Se, Cr).
Вариант 2.
1. О — о, Si — силициум, Al — алюминий, S — эс, Zn — цинк.
2.
1) Б — а,
2) А — в,
3) Г — г,
4) В — б.
3. Возможные классификации:
а) элементы главных (Br, S, О, Cl, Si) и побочных подгрупп (Mn, Cr),
б) элементы малых (S, О, Cl, Si) и больших (Br, Mn, Cr) периодов,
в) элементы одного периода (2 -0; 3 — Si, S, Cl; 4 — Br, Mn, Cr),
г) элементы одной группы (IV — Si, VI — О, S, Cr, VII — Br, Cl, Mn).
Вариант 3.
1. Са — кальций, Fe — феррум, N — эн, Ag — аргентум, Р — пэ.
2.
1) Б — б,
2) А — г,
3) Г — а,
4) В — в.
3. Возможные классификации:
а) элементы главных (Са, С, Al, Ве, Mg) и побочных подгрупп (Sc, Ti),
б) элементы малых (С, Al, Ве, Mg) и больших (Са, Sc, Ti) периодов,
в) элементы одного периода (2 — С, Ве; 3 — Al, Mg; 4 — Са, Sc, Ti),
г) элементы одной группы (II — Ве, Са, Mg, III — Al, Sc, IV — С, Ti).
Вариант 4.
1. Mg — магний, Na — натрий, Mn — марганец, Cl — хлор, Si — силициум.
2.
1) Б — г,
2) Г — б,
3) А — в,
4) В — а.
3. Возможные классификации:
а) элементы главнь1х (Р, Si, Na, Ge) и побочных подгрупп (V, Sc, Cu),
б) элементы малых (Р, Si, Na) и больших (V, Sc, Ge, Cu) периодов,
в) элементы одного периода (3 — Р, Si, Na; 4 — Cu, Ge, Sc, V),
г) элементы одной группы (I — Na, Cu, III — Sc, IV — Si, Ge, V — Р, V).
Проблемы современного урока
Об организации контроля знаний по химии учащихся 8 класса.
Зайцева Л.В.
МОУ «Бакчарская средняя общеобразовательная школа»
с. Бакчар
Формы организации обучения представляют собой внешнее выражение взаимодействия учителя и учащихся, регулируемое соответствующими правилами и законами. Основной организационной формой массового обучения химии в современной школе остается урок, имеющий немало известных педагогических достоинств.
Целесообразность применения той или иной формы определяется конкретной дидактической целью, содержанием и методами учебной работы.
Каждая из форм обучения входит в общую систему образовательного процесса как составная часть, неся в себе определенную дидактическую нагрузку, имея свои сильные и слабые стороны, специфические особенности и области наилучшего применения.
Контроль и коррекция знаний и умений осуществляется на каждом уроке.
Но после изучения одной или нескольких тем учитель проводит специальные уроки контроля и коррекции, чтобы выявить уровень овладения учащимися комплексом знаний и умений и на его основе принять определенные решения по совершенствованию учебного процесса.
Определяя структуру урока контроля и коррекции, целесообразно исходить из принципа постепенного нарастания уровня знаний и умений, т.е. от уровня осознания до репродуктивного и продуктивного (конструктивного) уровней.
Контроль знаний – важная часть учебного процесса. Он выполняет три функции, присущие учебному процессу:
образовательную;
воспитывающую;
развивающую.
Основная его цель – проверка знаний, умений и навыков, которыми должны овладеть учащиеся.
Я использую различные виды контроля знаний: тесты, химические диктанты, цифровые диктанты, проверочные и контрольные работы. Задания могут иметь репродуктивный, творческий и развивающий характер.
Систематическая проверка знаний имеет большое значение: дисциплинирует учащихся, воспитывает их волю, настойчивость и упорство в достижении поставленной цели, побуждает регулярно готовиться к урокам.
Учителю контроль знаний дает возможность лучше узнать своих учеников, своевременно корректировать их знания и при необходимости оказывать действенную помощь.
К каждой теме (или даже параграфу) я разработала комплекты дидактического материала в 4 – 10 вариантах. Задания составлены в соответствии с обязательным минимумом содержания основного общего образования. Если это проверочная работа, то на ее выполнение требуется максимум 7 – 10 минут, она может быть проведена на различных этапах урока: если это урок подачи нового материала, то на этапе рефлексии, после отработки новых понятий, если это обычный урок – то на этапе проверки домашнего задания, но ее результаты сразу же говорят об усвоении знаний данного вопроса всего классного коллектива.
Контроль знаний по разделу «Введение или первоначальные химические понятия»
Весь теоретический материал курса химии для основной школы рассматривается на первом году обучения в 8 классе, поэтому важные сведения о химическом элементе, о формах его существования, химических формулах, о структуре периодической системы, которые изучаются в 1 теме, должны быть отработаны и проконтролированы. Поэтому на изучение этой темы я отвожу немного большее количество часов, чем предлагает автор (при нагрузке 2,5 часа в неделю).
Проверочная работа №1 Структура периодической системы.
ЦЕЛЬ: Выявить знания учащихся по понятиям: атом, молекула, химический элемент, простое и сложное вещество, а также способность учащихся работать со знаками химических элементов, формулами и со структурой периодической системы.
1 вариант
Задание №1 Что означают записи:
а) 4N б) 4N 2 в) 3CuO г) 3Cu д) 2C 2 H 4 O 2 е) 5О 2
Задание №2
а) фосфор б) скандий в) ниобий г) калий д) хлор
2 вариант
Задание №1 Что означают записи:
а) 4Cl б) 4Cl 2 в) 3P 2 O 5 г) 3P д) 2ZnS е) 5Zn
Задание №2 Напишите химический знак и укажите положение элемента в периодической системе (порядковый номер, период, группу, подгруппу)
а) фтор б) никель в) вольфрам г) цинк д) уран
3 вариант
Задание №1 Что означают записи:
а) 4K б) 4K 2 O в) 😯 г) 😯 2 д) 3SO 2 е) 2H 2 O
Задание №2 Напишите химический знак и укажите положение элемента в периодической системе (порядковый номер, период, группу, подгруппу)
а) магний б) индий в) барий г) неон д) нобелий
4 вариант
Задание №1 Что означают записи:
а) 4O 2 б) 4O в) 3Fe г) 3FeS д) 5N 2 е) 2CO 2
Задание №2 Напишите химический знак и укажите положение элемента в периодической системе (порядковый номер, период, группу, подгруппу)
а) бор б) кальций в) титан г) олово д) тербий
5 вариант
Задание №1 Что означают записи:
а) H б) H 2 в) 7H 2 г) 7H д) 3H 2 O е) 5FeS
Задание №2 Напишите химический знак и укажите положение элемента в периодической системе (порядковый номер, период, группу, подгруппу)
а) натрий б) медь в) криптон г) рутений д) самарий
6 вариант
Задание №1 Что означают записи:
а) 3Fe б) 3FeO в) 4F г) 4F 2 д) 5CO 2 е) 2H 2 O
Задание №2 Напишите химический знак и укажите положение элемента в периодической системе (порядковый номер, период, группу, подгруппу)
а) бериллий б) хлор в) ванадий г) ксенон д) кюрий
Цифровой диктант. Знаки химических элементов
ЦЕЛЬ : Проверка знаний знаков химических элементов.
Карточка №1
1 2 3
1) Al а) бор 1) кальций
2) Н б) купрум 2) калий
3) Cu в) аш 3) железо
4) N г) алюминий 4) азот
5) B д) бром 5) бром
6) Si е) кальций 6) кремний
7) Br ж) феррум 7) водород
8) K з) силициум 8) бор
9) Fe и) эн 9) алюминий
10) Ca к) калий 10) медь
Карточка №2
Посмотрите на знак химического элемента в 1-ой колонке и подберите к нему из 2-ой и 3-ей колонок произношение и название данного химического элемента (например: 1, в, 3)
1 2 3
1) Ag а) бор 1) магний
2) Нg б) гидраргирум 2) сера
3) C в) эс 3)фтор
4) Na г)магний 4) барий
5) Ba д) барий 5) натрий
6) S е) хлор 6) серебро
7) B ж) фтор 7) ртуть
8) Cl з) серебро 8) бор
9) F и) це 9) хлор
10) Mg к) натрий 10) ртуть
Карточка №3
Посмотрите на знак химического элемента в 1-ой колонке и подберите к нему из 2-ой и 3-ей колонок произношение и название данного химического элемента (например: 1, в, 3)
1 2 3
1)N а) бор 1) кислород
2) Н б) иод 2) иод
3)Al в) аш 3) свинец
4) Ni г) алюминий 4) азот
5) B д) бром 5) бром
6) I е) кальций 6) никель
7) Br ж) плюмбум 7) водород
8) O з) никель 8) бор
9) Ca и) азот 9) алюминий
10) Pb к) о 10) кальций
Карточка № 4
Посмотрите на знак химического элемента в 1-ой колонке и подберите к нему из 2-ой и 3-ей колонок название и произношение данного химического элемента (например: 1, в, 3)
1 2 3
1) Au а) эс 1) фосфор
2) Н б) марганец 2) калий
3) S в) аш 3) цинк
4) Na г) цинк 4) марганец
5) Pt д) аурум 5) натрий
6) P е) платина 6) золото
7) Zn ж) натрий 7) платина
8) K з) пе 8) водород
9) Mn и) калий 9) кальций
10) Ca к) кальций 10) сера
Проверочная работа № 2. Относительная молекулярная масса.
ЦЕЛЬ: Выявить способность учащихся работать с химическими формулами, знать качественный и количественный состав, а также рассчитывать относительную молекулярную массу.
1 вариант
А) CaSO 4 б) K 3 PO 4 в) Cl 2 O 7 г) ZnSiO 3 д) KMnO 4
2 вариант . Рассчитайте относительную молекулярную массу следующих веществ:
А) Br 2 O 5 б) Na 2 SiO 3 в) FeSO 4 г) AgNO 3 д) Na 2 CO 3
3 вариант . Рассчитайте относительную молекулярную массу следующих веществ:
А) Ag 2 O б) PbCO 3 в) C 2 H 4 Cl 2 г) HPO 3 д) MgSO 4
4 вариант . Рассчитайте относительную молекулярную массу следующих веществ:
А) CuSO 3 б) C 3 H 6 O 2 в) BaSiO 3 г) I 2 O 3 д) KNO 3
5 вариант . Рассчитайте относительную молекулярную массу следующих веществ:
А) K 2 CO 3 б) Fe 3 O 4 в) C 2 H 5 O 2 Na г) K 2 SO 3 д) CuCl 2
6 вариант . Рассчитайте относительную молекулярную массу следующих веществ:
А) CaSiO 3 б) B 2 O 3 в) HgSO 4 г) AlPO 4 д) K 2 Cr 2 O 7
7 вариант . Рассчитайте относительную молекулярную массу следующих веществ:
А) BaSO 4 б) Al 2 S 3 в) Ag 2 SO 4 г) C 4 H 8 Br 2 д) I 2 O 5
8 вариант . Рассчитайте относительную молекулярную массу следующих веществ:
А) CuCO 3 б) CaC 2 в) CuH 2 O 2 г) FePO 4 д) HBrO 4
9 вариант . Рассчитайте относительную молекулярную массу следующих веществ:
А) H 2 SiO 3 б) Ca 3 N 2 в) C 3 H 3 F 3 г) Ag 3 PO 4 д) KBrO 3
10 вариант . Рассчитайте относительную молекулярную массу следующих веществ:
А) HPO 3 б) Mn 2 O 3 в) BaSO 3 г) Al 4 C 3 д) C 5 H 8 I 2
Проверочная работа №3 Массовые доли элементов в соединении.
ЦЕЛЬ: Выявляет уровень умений работать с химической формулой, сравнивать, сопоставлять и выявлять, какое из предложенных соединений богаче тем или иным элементом.
1 вариант
Задание № 1 Вычислите массовые доли элементов в нитрате серебра – AgNO 3.
Задание № 2 В каком соединении – Al 2 S 3 или A 2 O 3 содержится больше алюминия?
2 вариант
Задание № 1 Вычислите массовые доли элементов в силикате меди – CuSiO 3.
Задание № 2 Какое из соединений MnF 2 или CuF 2 содержит больше фтора?
3 вариант
Задание № 1 Вычислите массовые доли элементов в сульфите меди – CuSO 3.
Задание № 2 Какой оксид MnO или FeO содержит больше кислорода?
4 вариант
Задание № 1 Вычислите массовые доли элементов в сульфате цинка – ZnSO 4.
Задание № 2 В каком соединении C 2 H 4 O 2 или C 2 H 6 O содержится больше углерода?
5 вариант
Задание № 1 Вычислите массовые доли элементов в сульфите кальция – CaSO 3.
Задание № 2 Какое соединение CuS или CuO содержит больше меди ?
6 вариант
Задание № 1 Вычислите массовые доли элементов в сульфите магния – MgSO 3.
Задание № 2 В каком соединении MgF 2 или CaF 2 больше фтора?
7 вариант
Задание № 1 Вычислите массовые доли элементов в ортофосфате алюминия – AlPO 4.
Задание № 2 Какой сульфид Cr 2 S 3 или Na 2 S содержит больше серы?
8 вариант
Задание № 1 Вычислите массовые доли элементов в карбонате калия – K 2 CO 3.
Задание № 2 В каком соединении метане CH 4 или пропане C 3 H 8 содержится больше углерода?
9 вариант
Задание № 1 Вычислите массовые доли элементов в карбонате железа – FeCO 3.
Задание № 2 Какое соединение C 2 H 4 O 2 или C 2 H 6 O содержит больше углерода?
10 вариант
Задание № 1 Вычислите массовые доли элементов в силикате калия – K 2 SiO 3.
Задание № 2 Какое соединение Mg 3 N 2 или N 2 O 5 содержит больше азота?
Контрольная работа №1 Информация по химической формуле .
ЦЕЛЬ: Проверка уровня усвоения знаний учащихся по разделу
1 вариант
Задание №1 Что означают записи:
а) 3F б) 5F 2 в) 2HF г) H 2 O д) Zn
Задание №2 Укажите место положения в периодической системе следующих химических элементов. а) алюминий б) германий в) родий г) аргон д) неодим
Задание №3 Рассчитайте относительную молекулярную массу следующих веществ:
а) H 3 PO 4 б) Al 2 S 3 в) SiH 4 г) ZnSO 3 д) AlPO 4
Задание №4
CuSO 4 (сульфат меди)?
2 вариант
Задание №1 Что означают записи:
а) 3Br б) 3Br 2 в) 2K 2 O г) 2O д) 4CuO
Задание №2 Укажите место положения в периодической системе следующих химических элементов: а) фтор б) ванадий в) стронций г) кадмий д) америций.
Задание №3
а) O 2 б) KClO 3 в) H 2 SO 3 г) Cl 2 O 3 д) FeSiO 3
Задание №4 Какую информацию о веществе несет его химическая формула
MgSiO 3 (силикат магния)?
3 вариант
Задание №1 Что означают записи:
а) 3K б) 3F 2 в) 2CO 2 г) 4H д) 4H 2
Задание №2 Укажите место положения в периодической системе следующих химических элементов: а) азот б) теллур в) платина г) медь д) торий
Задание №3 Рассчитайте относительную молекулярную массу следующих веществ
а) FeCO 3 б) AlBr 3 в) K 2 CO 3 г) Li 3 PO 4 д) H 2 SiO 3
Задание №4 Какую информацию о веществе несет его химическая формула
FeCO 3 (карбонат железа)?
4 вариант
Задание №1 Что означают записи:
а) O 3 б) 3O в) Si г) 4Si д) 3SiO 2
Задание №2 Укажите место положения в периодической системе следующих химических элементов: а) иод б) тантал в) палладий г) стронций д) эрбий
Задание №3 Рассчитайте относительную молекулярную массу следующих веществ
а) K 2 SiO 3 б) CuCO 3 в) AgNO 3 г) CaCl 2 д) C 2 H 6
Задание №4 Какую информацию о веществе несет его химическая формула
CuCO 3 (карбонат меди)?
Регулярная проверка знаний учащихся – необходимое условие успешного усвоения учебного материала. В структуре уроков различных типов проверке знаний отводится различное количество времени. Набор заданий соответствует требованиям обязательного минимума содержания образования, следовательно, он может быть использован независимо от выбранной учителем программы. При этом не исключается возможность уровневой дифференциации, индивидуального подхода к обучению отдельных учащихся или групп.
Работая с карточками, учащиеся получают дополнительную возможность для развития своих способностей: читая предложенное задание, выполняя его, они развивают внимание, память, навыки работы с печатным материалом, умение правильно понимать текст.
Литература:
О.С. Габриелян «Химия» 8 класс Дрофа., Москва 2007 год.
Муниципальное общеобразовательное учреждение лицей №1
городского округа г. Мантурово Костромской области
Конкурс «Педагогические инициативы»
Номинация «Лучшая методическая разработка»
Система заданий
как средство формирования приемов умственной деятельности
при изучении темы «Химический элемент»
в 8 классе
Работу выполнила
Соколова Ольга Евгеньевна,
учитель химии высшей категории
Мантурово, 2008 год
Система заданий
как средство формирования приемов умственной деятельности при изучении темы «Химический элемент» в 8 классе
Понятие «химический элемент» начинает формироваться с первых уроков изучения химии в 8 классе и является основополагающим звеном успешности изучения предмета на протяжении всего периода обучения.
Образовательный стандарт основного общего образования по химии одной из целей изучения химии определяет освоение важнейших знаний о химической символике, химических понятиях, фактах, основных законах и теориях. Для реализации целей в Стандарте определены вопросы, требующие тщательной проработки. Так, например, в блоке «Вещество» образовательный стандарт определяет минимум содержания образования , в который входят понятия «Атомы и молекулы. Химический элемент как вид атомов. Я зык химии . Знаки химических элементов, химические формулы»
В требованиях к уровню подготовки выпускников основной школы записано:
В результате изучения химии ученик должен
знать
уметь
называть: знаки химических элементов, соединения изученных классов, типы химических реакций.
С другой стороны, школа обязана не только вооружать учащихся определенной суммой знаний, но и развивать у них способность добывать эти знания самостоятельно. Проблема развития и совершенствования мышления учащихся – одна из важнейших задач учителя. В обучении недостаточно использовать только проблемное изложение, беседы, поисковый эксперимент, деловые и ролевые игры. Необходима система заданий, вовлекающая учащихся в разнообразную познавательную деятельность, ориентированную на применение знаний в новых нестандартных условиях.
Система таких заданий решает несколько важных задач:
Формирование высокого уровня развития приемов умственной деятельности: анализа, синтеза, обобщения, классификации
Создание условий для творческого самовыражения учащихся, высокого уровня активности, выражающегося в установке на множественность решений, способе выдвижения нестандартных идей.
При изучении химии с самых первых уроков в 8 классе необходимо учитывать:
Сформированность общеучебных умений и навыков: ученики 8 классов должны уметь обобщать, выделять главное, классифицировать предметы, явления, события, с другой стороны, совершенствование этого умения – одна из задач изучения химии
Психологические особенности данного возраста: ученики 12-13 лет обладают повышенным стремлением к самореализации, они с удовольствием принимают участие в играх, выполняют творческие задания
Эмоциональный настрой: предмет химии всегда вызывал определенный интерес у учеников младших классов, он носит элемент новизны, некоторой загадочности, поддержать этот интерес – задача учителя
Поэтому при изучении данной темы в арсенале учителя должны быть разнообразные приемы и методы обучения, способствующие реализации поставленных целей.
Предлагаемые мною задания – это задания на обобщение, классификацию, поиск закономерностей, комбинирование, развитие памяти и внимания
Задания на обобщение и конкретизацию позволяют формировать умение объединять однородные предметы, что связано с выделением признаков, присущих объекту (анализ), выяснение роли этих признаков у группы объектов (синтез) и установление сходства и различия этих объектов с другими объектами. Выполняя такие задания, учащиеся проводят поиск словесных характеристик для обозначения группы однородных предметов, что является основой формирования и совершенствования приема классификации.
Третий лишний (слайд 2)
Среди трех символов химических элементов, названия которых указаны в задании, оставьте только два, которые сходны по какому-либо признаку. Один из символов, который не обладает этим признаком, исключите.
а) B, Be, Ba; в) Hg, Mn, Mg;
б) Tl, Ta, Te; г) Li, P, Сl.
Десять элементов (слайд 3)
Дан список химических элементов: олово, фосфор, водород, рутений, ртуть, селен, кислород, кальций, мышьяк, хлор
Внимательно прочитайте следующие утверждения и после каждого утверждения вычеркивайте из списка один элемент. Какой останется?
Этот элемент назван в честь Луны
Это самый распространенный на Земле элемент
Символ этого элемента начинается с буквы «S »
Образует простое вещество – ядовитый газ желто-зеленого цвета
В названии есть буква «а»
Его химический знак Ag
Это элемент 2 группы побочной подгруппы
Элемент 4 периода
Его название в переводе означает «светоносный»
Он назван в честь России
Если вы сделали все верно, то в ответе будет самый распространенный в космосе элемент, образующий самый легкий газ – водород
Ответ:
селен
кислород
олово
хлор
кальций
ртуть
мышьяк
фосфор
рутений
водород
Задания на классификацию и группировку создают условия для того, чтобы учащиеся сами продумывали связи, которые существуют в изучаемом материале. При их выполнении формируется высокий уровень анализа и синтеза, обобщенное разностороннее видение предметов и явлений, умение сравнивать, находить черты сходства и отличия
Крестики – нолики (слайд 4)
Задание: найти ряд, в котором все элементы объединены одним признаком, каким?
А) элементы неметаллы
Na
C
Zn
H
Mg
K
P
Li
Cu
Б) произношение символа и название элемента совпадают
Na
C а
Zn
H
Mg
K
P
О
Cu
Сколько будет групп? (слайд 5)
Дан список
названий химических элементов: водород, менделевий, плутоний, уран, селен, кислород, тантал, эйнштейний, рутений, фосфор, скандий, кюрий.
Символов химических элементов: N , Al , H , Fe , K , Ca , O , Si , Mg , Cu , Na , S , Ag , C , P , Cl , Zn
Составьте из названий элементов или химических символов, похожих друг на друга по одному или нескольким признакам, группы и дайте им названия . Сколько групп получилось?
Дерево знаний (слайд 6)
Даны символы и названия химических элементов. Задача: предложить схему классификации, используя категории «металл-неметалл», «Элементы одной группы», «Элементы одного периода»
Rb Li S Ca Te Br Zn Mg Cr Si K Cu O
Rb Li S Ca Te Br Zn Mg Cr Si K Cu O
Rb Li S Ca Te Br Zn Mg Cr Si K Cu O
Химические множества
Ca
Br
Zn
Se
Fe
K
Cu
Li
Na
H
Адание: как можно назвать химические элементы, входящие в розовый круг? В синий круг? Область их пересечения?
Задание на поиск закономерностей , решение которых логически обусловлено регулярностью меняющихся признаков. Среди них можно выделить задачи на определение последовательности, позволяющие совершенствовать операции «анализ» и «синтез» и задачи на умозаключение по аналогии, в них учащиеся сравнивают предметы и понятия не только по внешним признакам, но и по смыслу, их внутренним признакам
Дополни по аналогии (слайд 7)
Продолжи ряд химических элементов:
А) Be Mg Ca … … … (элементы одной группы)
Б) H He В С … … … (элементы- неметаллы в порядке увеличения порядкового номера)
В) At Br C Dy … … … (элементы по латинскому алфавиту их знаков)
Г ) Pu Np Se U … … (элементы, названные в честь астрономических объектов)
Д) Po Os Co … … (элементы, в химических символах которых встречается буква О)
Задания на развитие памяти и внимания формируют навыки запоминания названий и символов химических элементов, развивают все виды памяти: слуховой, механической, зрительной, логической и, кроме этого, развивают внимание, умение ориентироваться в Периодической системе элементов как основном инструменте изучения предмета химии. Большинство из представленных заданий может быть использовано не только при изучении темы «Химические элементы», но и на уроках по другим темам
Шифровка (слайд 8)
1. Дополните предложенную запись (слева или справа) так, чтобы получился символ химического элемента (правильных ответов может быть несколько).
Назовите этот химический элемент (эти химические элементы) и прочитайте его (их) символ.
Знак
Название
Знак
Название
Р
Р…
Р…
…а
…а
…а
С
С…
С…
…е
…е
…е
Н
Н…
Н…
…п
…п
…п
Кто больше?(слайд 9)
2. Запишите символы элементов, которые можно составить из букв латинского названия:
а) азота – nitrogenium ;
б) углерода – сarbonium .
Примечание . Любую букву, входящую в состав латинского названия:
а) можно записывать как строчную или прописную;
б) можно использовать сколько угодно раз.
Химический алфавит (слайд 10)
Расположите символы химических элементов в алфавитном порядке их русских названий:
N, C, Zn, Ba, Fe, Na, K, Cu, Ag, Ca, S
Расположите символы химических элементов в алфавитном порядке их латинских названий
Ответы:
N , Ba , Fe , K , Ca , Cu , Na , S , Ag , C , Zn
Ag, Ba, Fe, K, Ca, C, Cu, Na, N, S, Zn
Найди пару (слайд 11)
Найти пары – знаки химических элементов и их названия
Практика показывает, что эти задания становятся любимыми для учащихся и даже после прохождения темы они с удовольствием обращаются к ним
«Построй фигуры»
Химический диктант проводят с целью проверки знания химических знаков и их изображения. Каждому ученику выдают лист бумаги с беспорядочно расставленными точками, каждой из которых соответствует знак химического элемента (рис. 1, 2).
Учитель в определенной последовательности называет химические элементы (фосфор, калий, азот, сера, фтор, кислород, магний, кальций, натрий, водород, ртуть, железо, фосфор ),
а школьники соединяют знаки этих элементов прямыми линиями в той же последовательности.
Правильность выполнения задания проверяют сами учащиеся: у них должны получиться вот такие фигурки животных
Большой интерес у учащихся вызывают задания в виде кроссвордов, чайнвордов, ребусов, которые они сами с удовольствием составляют, способствуя запоминанию символов и названий элементов и лучшей ориентации в Периодической системе химических элементов:
Вездесущая «О»
Заполните пустые клетки русскими названиями химических элементов:
Ag , Br , Fe , H , I , O , Sn
Примечание: (Вездесущая «О». xls )
Темная лошадка
Решите кроссворд, заполняя его русскими названиями химических элементов. Ключевым словом является фамилия великого русского ученого, одного из создателей атомно-молекулярного учения.1. С 2.О 3.Al 4.N 5.Zn
6. I 7.P 8.H 9.Pb
Примечание: при наличии индивидуальных компьютеров для работы учащихся можно предложить решение кроссворда на компьютере (Темная лошадка. xls )
Н
Р й
Атрибуты. Карточки с названиями химических элементов и их символами.
Задание.
Как можно быстрее соедините линией прямоугольники с названием элемента и изображением соответствующего химического знака. Чтобы обеспечить многократное использование карточек, можно линии проводить на листочках полиэтиленовой пленки соответствующего размера .Определи элемент
Задание: определите, какие химические элементы скрываются здесь
NaCaZnCl
PbSMgLi
Атрибуты. Карточки с названиями химических элементов и их символами Задание: эта игра аналогична игре «Химическая тайнопись», ее можно проводить на магнитной доске, используя «россыпь» названий и символов химических элементов. Задание: собрать пары «название + символ»
Внимательный химик
Атрибуты: карточки со знаками химических элементов на магнитной основе.
На магнитной доске карточки располагаются в разброс. Учитель называет знаки химических элементов, ученик должен как можно быстрее найти и показать их указкой. Число карточек и расположение их на доске может варьироваться в зависимости от уровня развития детей данного класса.
Задания для проверки уровня усвоения знаний по теме «Химический элемент» могут быть следующие:
. Оно позволяет учителю быстро проверить уровень усвоения темы, оценить степень сформированности общеучебных умений и навыков.
Большой интерес у учащихся вызывает «контрольная наоборот» , когда учащимся предлагается самим составить текст контрольной работы. Учитель может учитывать разнообразие заданий, их уровень, творческую и познавательную активность
Символы химических элементов. Структура Периодической системы Д.И. Менделеева
Цель: познакомить учащихся с символами химических элементов, их названиями и произношениями; познакомить с этимологическими началами их названий, познакомить со структурой Периодической системы Д.И.Менделеева.
Задачи: Обучающие. Ввести понятие о знаках химических элементов и познакомить с этимологическими началами их названий, познакомить учащихся со структурой Периодической таблицы.
Планируемые результаты обучения. Знать структуру периодической системы Д.И.Менделеева, уметь описывать положение элемента в периодической системе, знать символы химических элементов, их произношения и понимать их происхождение.
Оборудование: компьютер, видеопроектор, электронное мультимедийное приложение к УМК “Химия. 8 класс” изд “Дрофа”; шаро–стержневые модели атомов и молекул, рабочие и информационные листы,
Подготовка к уроку: на столы выдаются для каждого ученика рабочие и информационные листы. Заранее на обратной стороне доски записывается тема и план урока, на другой доске с обратной стороны делается запись: “Две молекулы воды, под действием электрического ток разлагаются с образованием одной молекулы кислорода и двух молекул водорода”.
Приложение 1
Ход урока
1. Организационный момент
Проверка готовности к уроку.
2. Проверка домашнего задания. Актуализация знаний
Ученикам сообщают, что проверка домашнего задания проходит в виде “Аукциона знаний”, за правильные ответы учащиеся получают “жетоны знаний”, по количеству которых учитель оценивает активность учащихся на уроке.
Учитель: Вы начали изучать тему “Свойства веществ. Химические знаки и формулы” Я предлагаю вам вспомнить основные понятия прошлого урока. Что называется химическим элементом?
Ученик: химический элемент – это определённый вид атомов.
Учитель: – Что называется веществом?
Ученик: Вещество – это то, из чего состоят тела.
Учитель: Давайте подумаем, чем отличаются эти два понятия: “химический элемент” и “вещество”?
Ученики: химический элемент входит в состав простых и сложных веществ, у него нет физических и химических свойств; а вещество обладает физическими и химическими свойствами. Например: простое вещество кислород – газ, поддерживает горение, входит в состав воздуха и необходим нам для дыхания. Молекула простого вещества кислорода образована двумя атомами химического элемента кислорода.
Учитель: – Из чего состоят вещества?
Ученик: вещества состоят из молекул, а молекулы состоят из атомов.
Учитель: На какие две группы делятся все вещества?
Ученик: вещества бывают простыми и сложными.
Учитель: – Какие вещества мы называем простыми веществами? (Демонстрирует шаро-стержневые модели молекул простых веществ – кислорода, озона, водорода, азота)
Ученик: простые вещества – это вещества, образованные атомами одного и того же химического элемента.
Учитель: – какие вещества мы называем сложными? (Демонстрирует шаро-стержневые модели молекул сложных веществ – воды, углекислого газа и серной кислоты)
Ученик: сложные вещества – это вещества, образованные атомами разных химических элементов.
Учитель: Итак, все вещества образованы атомами либо разными, либо одинаковыми!
– Сколько примерно этих видов атомов может быть? (Демонстрация во время вопроса– учитель разбирает несколько молекул веществ и выкладывает по одному шарику – “атому” разного цвета (вида) на демонстрационном столе)
Ученик: столько, сколько разных химических элементов в периодической системе, примерно 110.
Учитель: Молекула воды – сложное вещество (демонстрация шаростержневой модели молекулы воды). – Как можно доказать, что это сложное вещество?
Предположения ученика: из сложных веществ можно получить простые вещества -кислород и водород.
Учитель: Верно. Давайте с вами проведём пример реакции разложения на примере шаростержневых молекул. Я приглашаю к доске двух желающих, которые смогут провести это превращение: из двух молекул воды получить молекулы простых веществ.
Каждому из двух учащихся выдаётся по две
шаростержневые модели молекул воды, перестроив
которые получают две молекулы водорода и одну
молекулу кислорода.
Каждому из учащихся, выполняющих работу с
моделями задаются по два вопроса:
– Молекулы каких веществ вы получили? (Ответ: получили молекулы кислорода и водорода)
– Сколько получилось молекул каждого вещества из двух молекул воды? (Ответ: из двух молекул воды получилось две молекулы водорода и одна молекула кислорода)
– Почему для реакции мы взяли две молекулы воды? (Ответ: т.к. молекула кислорода состоит из двух атомов, а в состав молекулы воды входит один атом кислорода).
– Как вы думаете – реакция разложения воды – это химическое явление или физическое? – Что доказывает правильность вашего ответа? (Ответ: химическое явление, т.к. в результате реакции образуются новые вещества – кислород и водород).
Далее учитель обращает внимание, что при химической реакции, все связи, которые были между атомами в двух молекулах воды все израсходовались для образования молекул новых веществ.
Объяснение новой темы:
Учитель: Мы с вами грамотные люди и умеем писать. Я записала на доске реакцию разложения воды.
Демонстрация записи сделанной до урока на обратной стороне доски: “Две молекулы воды под действием электрического тока разлагаются на две молекулы водорода и одну молекулу кислорода”
– А кто является авторами славянской письменности – алфавита?
Ученик: болгарские просветитель Кирилл и Мефодий.
Учитель: мы знаем буквы алфавита, из них мы складываем слова, а из слов – пишем предложения.
Подобно русской письменности в химии есть тоже буквы – химические символы.
На доске напротив записи сделанной заранее учитель пишет в ряд символы некоторых химических элементов и демонстрирует на примере шаростержневых молекул отдельные атомы.
Учитель: Атом кислорода обозначается символом “О”, атом водорода обозначается символом “Н”. С помощью химических символов мы будем учиться писать слова – формулы химических веществ. Например: молекулу воды мы запишем “Н2О”, молекулу кислорода – “О2”, молекулу водорода – “Н2”. А дальше из них мы будем составлять уравнения химических реакций. Запись нашей реакции разложения воды на простые вещества выглядит таким образом: 2Н2О = 2Н2 + О2. Сравните одна и та же фраза записанная с помощью русского алфавита и с помощью химического языка.
Полное оформление демонстрационной записи на доске выглядит так:
|
Учитель: Итак, сегодня на уроке мы знакомимся с “буквами” химического алфавита – символами химических элементов.
Запишите тему сегодняшнего урока в своих тетрадях:
“СИМВОЛЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ”.
При изучении темы урока мы будем придерживаться следующего плана:
- Автор химической письменности.
- Принцип обозначения химических элементов.
- Периодическая система химических элементов Д.И.Менделеева.
- Этимологические начала названий химических элементов.
(Тема урока и план урока пишутся заранее, перед уроком, на обратной стороне доски.)
На протяжении всего урока во время беседы с учителем ученики, правильно отвечая на вопросы, получают такие жетоны:
Учитель: на первый и второй вопрос нашего плана я знаю, что уже некоторые учащиеся смогут ответить.
– Кто является автором химического алфавита? Как вы это узнали?
Учащийся: автором химического алфавита является Йенс Якоб Берцелиус. Я эту информацию нашёл в жетоне знаний.
Учитель: – Как Й.Я.Берцелиус предложил обозначать химические элементы?
Учитель: Шведский учёный Й.Я.Берцелиус предложил в качестве символов химических элементов использовать первую или первую и одну из последующих букв латинского названия элемента. Сейчас откройте учебник на странице 92, посмотрите на 4ю и 2ю колонки таблицы. В 4й колонке даны латинские названия некоторых химических элементов, а во второй – их химические символы
Пример:
Hidrogenium – Н – водород
Ferrum – Fe – железо
Magnium – Mg – магний
Mangants – Mn – марганец
Для чтения химических формул будем использовать произношения химических элементов. Возьмите информационный лист №1 Там у вас есть такая же таблица, но дополненная и с большим числом химических элементов. Она вам пригодится в дальнейшем. Рассмотрим её. В 3ей колонке, обратите внимание, на произношения химических элементов: некоторые из них произносятся произношением букв латинского алфавита, некоторые имеют такое же произношение как и их русское название, а некоторые произносятся латинским названием элемента. В этом информационном листе 4я и 5я колонки для вас интересная информация об этимологии названия химических элементов и названы учёные, открывшие данные химические элементы.
Таблицу, которая у вас в учебнике надо выучить наизусть первые три колонки. К следующему уроку выучите названия, символы и произношения первых 10 химических элементов (половина таблицы). Она начинается на странице 83, вы учите элементы до меди включительно, отметьте карандашом в таблице. И сразу отметьте карандашом на странице 86 до слов “Обозначение состава вещества….” второй абзац снизу – вы дома учите параграф 13 до этих слов.
Учитель: В таблице учебника вместилось всего 20 химических элементов.
– Сколько всего химических элементов? Откуда мы возьмём эти сведения?
Ученик: все известные химические элементы расположены в периодической таблице Д.И.Менделеева, их известно около 110 элементов.
Учитель: Правильно. Все известные химические элементы расположены в периодической таблице химических элементов Д.И.Менделеева. Д.И.Менделеев – великий химик, русский учёный, создатель периодической системы. На тот момент, когда он составил таблицу было известно 63 химических элемента. Дмитрий Иванович хорошо знал свойства каждого химического элемента и расположил их так, что выделил группы элементов сходных по химическим свойствам, и даже оставил места в таблице ещё не изученным химическим элементам. Дмитрий Иванович предугадал свойства некоторых ещё не открытых элементов и указал пути открытия этих элементов. О гениальности этого учёного и его открытиях можно много говорить, и для этого мы посвятим не один, а несколько уроков. Сегодня мы должны познакомиться со структурой периодической системы химических элементов Д.И.Менделеева.
Учитель демонстрирует несколько вариантов периодической системы с разными цветовыми изображениями (демонстрационную, на форзаце учебника, на обложке дневников, …) и отмечает:
В любой периодической таблице изображены одни и те же химические элементы, в одинаковой последовательности. Гениальность этого творения заключается в том, что она таит в себе очень много информации о химических элементах, о закономерностях их расположения, о строении атомов химических элементов,… Поэтому изображая периодические системы стараются выделить цветом разные смысловые категории элементов. Каждая из них удобна на разных этапах изучения химии. Каждая из них находит в своё время удобное применение.
В нашей таблице (на форзаце учебника) цветом выделены красным цветом выделения элементы–неметаллы, а черным и зелёным – элементы-металлы.
– Приведите примеры элементов-неметаллов.
– Приведите примеры элементов-металлов.
По горизонтали эта таблица состоит из периодов.
Периоды – это горизонтальные ряды в периодической таблице химических элементов.
Периоды делятся на малые и большие, малые периоды имеют только 1 ряд элементов, а большие периоды – по 2 ряда элементов.
Сейчас внимательно посмотрите один видеосюжет, и после него вам надо будет ответить на вопросы.
Демонстрация видеосюжета мультимедийного приложения к УМК “Химия. 8 класс” издание второе. Изд “Дрофа” , 2006г Раздел “Введение. Предмет химии”, урок 4 “Символы химических элементов. Периодическая система химических элементов Д.И,Менделеева”, видеосюжет №12 “структурные части Периодической системы Д.И.Менделева: период”
Учитель: Сейчас закрепим изученное понятие. В рабочих листах №1 самостоятельно допишите предложения 2,3,4. Через 2-3 минуты мы проверим ваши ответы.
Учитель спрашивает одного человека, проверяя правильность самостоятельного ответа, а учащиеся проверяют правильность своих записей.
Учитель: По вертикали периодическая система состоит из 8 групп. Группа – это вертикальный ряд элементов в Периодической системе Д. И. Менделеева.
Каждая группа, в свою очередь, подразделяется на две подгруппы: главную и побочную. Элементы главной подгруппы располагаются в малых и больших периодах, а элементы побочной подгруппы находятся только в больших периодах.
Сейчас внимательно посмотрите ещё один видеосюжет, и после него опять выполним следующие задания в рабочем листе №1.
Демонстрация видеосюжета мультимедийного приложения к УМК “Химия. 8 класс” издание второе. Изд “Дрофа” , 2006г Раздел “Введение. Предмет химии”, урок 4 “Символы химических элементов. Периодическая система химических элементов Д.И,Менделеева”, видеосюжет №13 “структурные части Периодической системы Д.И.Менделева: группы и подгруппы”
Учитель: допишите предложения 1,5,6,7 в рабочих листа №1. Через три минуты мы проверим правильность ваших ответов.
Учитель спрашивает одного человека, проверяя правильность самостоятельного ответа, а учащиеся проверяют правильность своих записей.
Учитель: А теперь, поучимся работать с периодической таблицей, ведь она не только великое творение Д.И.Менделеева, но и самая законная шпаргалка на любой контрольной, экзамене и даже ЕГЭ. Поэтому стоит научиться ей пользоваться!
– Выполните задание №1 в рабочем листе №1.
Учитель вместе с классом выполняет задание 1а, а следующие задания 1б и 1в учащиеся выполняют сами, затем учитель и класс проверяют.
– Выполните самостоятельно задание №2а и №2б. Это задания противоположные первому.
Учитель через 2 мин проверяет правильность выполнения задания.
Учитель: Мы научились называть адрес химических элементов в Периодической системе. Переходим к последнему вопросу нашего урока. Открытие каждого химического элемента воспринималось в науке как событие огромной важности. Названия, которые давались при открытии химическому элементу, никогда не были случайными.
– Каким правилам придерживались учёные, давая названия химическим элементам.
Я предлагаю вам вместе узнать этимологические начала названий химических элементов. Поэтому предлагаю работу в группах. Каждые две парты учащихся работают вместе изучая свой рабочий материал и выбирают одного отвечающего с сообщением.. На работу выделяю 4-5 минут.
Учащимся выдаётся один на парту рабочий лист с заданием. Каждые две парты учащихся выполняет свои варианты заданий: Информационный лист №2, информационный лист №3, информационный лист №4, информационный лист №5 и информационный лист №6.
Приложение_2, Приложение_3, Приложение_4
Затем учащиеся выступают со своим сообщением.
Закрепление. Обобщение. Обратная связь.
Учитель: задаёт ряд вопросов по изучаемой теме.
– Какую тему мы изучали сегодня на уроке.
– Какие понятия вы запомнили на этом уроке.
– Что вам особенно запомнилось сегодня на уроке.
– Выполните задания № 2в , № 2г и задание №3 в рабочем листе №1.
– Как вы считаете, по данной теме возникнут в дальнейшем у вас какие-нибудь сложности в изучении химии.
Я тоже думаю, что вы прекрасно справились с изучением данной темы урока. И выучив, домашний параграф и таблицу с химическими элементами, вы будете прекрасно пользоваться этими понятиями при дальнейшем изучении химии.
Домашнее задание
В дневник записываем §13 до слов “Обозначение состава вещества…” и задания на рабочем листе №2.
Список элементов на японском языке по атомному номеру
Вы когда-нибудь задумывались, совпадают ли названия элементов на других языках? В разных языках есть разные слова для обозначения одного и того же, почему элементы должны быть разными?
Эта таблица представляет собой список элементов на английском и японском языках, упорядоченный по атомным номерам. Последний столбец показывает, как произносятся эти элементы.
Если вы предпочитаете видеть этот список в форме таблицы Менделеева, ознакомьтесь с Genso no Shuuki-hyou или элементами периодической таблицы.
| НОМЕР | СИМВОЛ | АНГЛИЙСКИЙ | ЯПОНСКИЙ | ПРОИЗВОДСТВО | ||||||||||||
| 1 | H | Водород | 水11 素11 | He | Гелий | ヘ リ ウ ム | Heriumu | |||||||||
| 3 | Li | Литий | リ チ ウ ム | Richiumu | ||||||||||||
| 4 | Be | Бериллий 11Be | Бериллий 11 11 5B | Бор | ホ ウ 素 | Houso | ||||||||||
| 6 | C | Углерод | 炭素 | Tanso | ||||||||||||
| 7 | N | Азот | 窒 素 | Chisso | ||||||||||||
| 8 | O | Кислород | 9001 1 酸 素Sanso | |||||||||||||
| 9 | F | Фтор | フ ッ 素 | Fusso | ||||||||||||
| 10 | Ne | Neon | ネ オ ン | Neon | ||||||||||||
| Naodium | ナ ト リ ウ ム | Natoriumu | ||||||||||||||
| 12 | Mg | Магний | マ グ ネ シ ウ ム | Maguneshiumu | ||||||||||||
| 13 | Al | Aluminium | 11 11 | Si | 11 11 Кремний | ケ イ 素 | Keiso | |||||||||
| 15 | P | Фосфор | リ ン | Rin | ||||||||||||
| 16 | S | Сера | 硫黄 | Iou | ||||||||||||
| Iou | Хлор | 塩 素 | Enso | |||||||||||||
| 18 | Ar | Аргон | ア ル ゴ ン | Arugon | ||||||||||||
| 19 | K | Калий | カ リ ウ ム | Kariumu | ||||||||||||
| 20 | Ca | Calcium | 31 | 31 Кальций | Sc | Скандий | ス カ ン ジ ム | Sukanjiumu | ||||||||
| 22 | Ti | Титан | チ タ ン | Хитан | ||||||||||||
| 23 | V | 11 Ванадий | Ванадий | 24 | Cr | Хром | ク ロ ム | Курому | ||||||||
| 25 | Mn | Марганец | マ ン ガ ン | Марганец | ||||||||||||
| 26 | Fe | Железо | 27 | Co | Кобальт | コ バ ル ト | Кобаруто | |||||||||
| 28 | Ni | Никель | ニ ッ ケ ル | Nikkeru | ||||||||||||
| 29 | Cu | Медь | 銅 | Dou | Zinc 900 | 亜 鉛 | Aen | |||||||||
| 31 | Ga | Галлий | ガ リ ウ ム | Гариуму | ||||||||||||
| 32 | Ge | Германий | ゲ ル ウ ム | Геруманиум | Геруманский | ヒ 素 | Hiso | |||||||||
| 34 | Se | Селен | セ レ ン | Seren | ||||||||||||
| 35 | Br | Бром | 臭 素 | Shuso | Kr11 36 Криптон | ク リ プ ト ン | Курипутон | |||||||||
| 37 | Rb | Рубидий | ル ビ ジ ウ ム | Rubijiumu | ||||||||||||
| 38 | Sr | Стронций | ス ト ロ ン チ ウ ム | ン チ ウ ム | Sutoronchiumu | 9 | Zr | Цирконий | ジ ル コ ニ ウ ム | Jirukoniumu | ||||||
| 41 | Nb | Ниобий | ニ オ ブ | Niobu | ||||||||||||
| 42 | Moden 11 | Modenum | Modenum | Modenum 43 | Tc | Технеций | テ ク ネ ウ ム | Tekunechiumu | ||||||||
| 44 | Ru | Рутений | ル テ ニ ウ | Ruteniumu | ||||||||||||
| 11 | Rutiumu | ROTENIRO11 | R011 | Rо | 46 | 90 011 PdПалладий | パ ラ ジ ウ ム | Parajiumu | ||||||||
| 47 | Ag | Серебро | 銀 | Джин | ||||||||||||
| 48 | Cd | Кадмий | カ 11 | 11 | 11 | In | Индий | イ ン ジ ウ ム | Injiumu | |||||||
| 50 | Sn | Олово | ス ズ | Suzu | ||||||||||||
| 51 | Sb | Сурьма | 11 | Sb | Сурьма | ア11 52 | Te | Теллур | テ ル ル | Teruru | ||||||
| 53 | I | Йод | ヨ ウ 素 | You moto | ||||||||||||
| 54 | Xe | Xenon | is | |||||||||||||
| 55 | Cs | Цезий | セ シ ウ ム | 90 011 Сешиуму|||||||||||||
| 56 | Ba | Барий | バ リ ウ ム | Бариуму | ||||||||||||
| 57 | La | Лантан | ラ ン タ ン ン | Рантан | Рантан | Ce11 | Ce11 | Seriumu | ||||||||
| 59 | Pr | Празеодим | プ ラ セ オ ジ ム | Puraseojimu | ||||||||||||
| 60 | Nd | Неодим | ネ オ | Neoium | Pro 11プ ロ メ チ ウ ム | Puromechiumu | ||||||||||
| 62 | Sm | Самариум | サ マ リ ウ ム | Samariumu | ||||||||||||
| 63 | Eu | Europium | 900 | ガ ド リ ニ ウ ム | Gador iniumu | |||||||||||
| 65 | Tb | Тербий | テ ル ビ ウ ム | Terubiumu | ||||||||||||
| 66 | Dy | Диспрозий | ジ ス プ 14 | 14 | 14 | Jisupium | 14 | Jisupium | Хорумиуму | |||||||
| 68 | Er | Эрбий | エ ル ビ ウ ム | Эрубиуму | ||||||||||||
| 69 | Tm | Тулий | ツ リ ウ | Y | Y Y Y Y Y YY 31 Y 31 | Itterubiumu | ||||||||||
| 71 | Lu | Lutetium | ル テ チ ウ ム | Rutechiumu | ||||||||||||
| 72 | Hf | Hafnium | ハ フ ニ ニ 14 | Hafunal | Hafunium | タ ン タ ルТантару | ||||||||||
| 74 | W | Вольфрам | タ ン グ ス テ ン | Tangusuten | ||||||||||||
| 75 | Re | Рений | レ ニ ウ ム | Reniumu | Os11 76 ム | Reniumu | Os11 76 Osumiumu | |||||||||
| 77 | Ir | Iridium | イ リ ジ ウ ム | Irijiumu | ||||||||||||
| 78 | Pt | Платина | 白金 | Shirogane | 79 | Shirogane | 79 | Золото | Кин | |||||||
| 80 | Hg | Меркурий | 水銀 | Суигин | ||||||||||||
| 81 | Tl | Таллий | タ リ ウ ム | Tariumu | ||||||||||||
| 82 | Lead | Lead | Намари | |||||||||||||
| 83 | Би | 900 11 Висмутビ ス マ ス | Бисумасу | |||||||||||||
| 84 | Po | Полоний | ポ ロ ニ ウ ム | Poroniumu | ||||||||||||
| 85 | Ат | 11 | Радон | ラ ド ン | Радон | |||||||||||
| 87 | Fr | Франций | フ ラ ン シ ウ ム | Furanshiumu | ||||||||||||
| 88 | Ra | 11 11 Ac | Актиний | ア ク チ ニ ウ ム | Akuchiniumu | |||||||||||
| 90 | Th | Thorium | ト リ ウ ム | Toriumu | ||||||||||||
| 91 | 11 11 | Па | 11 11 11 1111 | U | Уран | ウ ラ ン | Уран | |||||||||
| 93 | Np | Нептуний | ネ プ ツ ニ ウ ム | Непуцуниуму | ||||||||||||
| 94 | Pu | Плутоний | Америций | ア メ リ シ ウ ム | Amerishiumu | |||||||||||
| 96 | Cm | Curium | キ ュ リ ウ ム | Kyuriumu | ||||||||||||
| 97 | Bk | 11 | Bk | 11 1111 | BakeliumBerkelium 900 Bak14 | Berkelium 900 Bak14 | Калифорний | カ リ ホ ル ニ ウ ム | Карихоруниуму | |||||||
| 99 | Es | Эйнштейний | ア イ ン ス タ イ ニ | Ainsutainiumu | 14 | 14 | 911 | Md 9001 4 | Mendelevium | メ ン デ レ ビ ウ ム | Menderebiumu | |||||
| 102 | No | Nobelium | ノ ー ベ リ ウ ム | Nouberiumu | Lr11 | Rourenium | Lr Rf | Резерфордий | ラ ザ ホ ー ジ ウ ム | Razahoujiumu | ||||||
| 105 | Db | Дубний | ド ブ ニ ウ | Dobuniumu | ||||||||||||
| Добуниум | ||||||||||||||||
| 10 11 900 | Dobuniumu | |||||||||||||||
| Bh | Bohrium | ボ ー リ ウ ム | Bouriumu | |||||||||||||
| 108 | Hs | Калий | ハ ッ シ ウ ム | Hasshiumu | ||||||||||||
| 109 | 11 Митнериум Ma11 Меин 11 Меин 11 Меин 010110 | Ds | Darmstadtium | ウ ー ム ス タ チ ウ ム | Damusutachiumu | |||||||||||
| 111 | Rg | Roentgenium | レ ン ト ゲ 14 | Ren ゲ ニ 14 | Ren ゲ ニ 14 | ゲ ウ 14 | Ren ゲ 14 | 14 ム | Ren 14 | ゲ 14 | Koperunishiumu | |||||
| 113 | Nh | Nihonium | ニ ホ ニ ウ ム | Nihoniumu | ||||||||||||
| 114 | Fl | Flerovium | フ レ ロ ビ 14 | ロ ビ ウ14 | McC11 | Мос11 | 900c 11 FureroMosukobiumu | |||||||||
| 116 | Lv | Livermorium | リ バ モ リ ム | Ribamoriumu | ||||||||||||
| 117 | Ts | Tennessine | テ ネ シ | ネ | es ネ シ | ネ シ | Teneshinガ ネ ソ ン | Оганесон |
Ученые говорят: Периодическая таблица | Новости науки для студентов
Периодическая таблица (существительное, «пи-э-э-а-х-дик-тай-бул»)Это диаграмма, на которой показаны все известные химические элементы.Таблица состоит из более чем ста квадратов. Каждый квадрат представляет собой один элемент. Квадрат содержит одну или две буквы, обозначающие имя элемента, и числа, которые говорят о свойствах этого элемента.
Расположение каждого квадрата в таблице многое говорит о каждом элементе. Во-первых, элементы организованы по атомному номеру или количеству протонов. Те, что находятся вверху диаграммы, имеют наименьшее количество протонов. Место элемента также показывает, насколько вероятно, что он отреагирует. Это также показывает, как устроены его электроны.
В середине 1800-х годов многие химики искали закономерности, объясняющие взаимодействие элементов. Тогда ученые не знали о протонах, нейтронах и электронах, из которых состоят атомы. Но они понимали, что элементы имеют разный атомный вес. Атомный вес – это средний вес одного атома элемента.
В 1869 году русский химик Дмитрий Менделеев расположил 63 известных элемента в порядке их атомного веса. Он видел тенденции в свойствах элементов, которые менялись в определенные интервалы или периоды.Другие ученые работали над своими собственными периодическими таблицами, но Менделеев первым опубликовал свою таблицу.
Периодическая таблица Менделеева продолжала расти, поскольку ученые открывали все больше элементов. К ним относятся благородные газы, идентифицированные в 1890 году. Это группа элементов, таких как гелий, которые не вступают в реакцию с другими элементами. Начиная с 1940-х годов, ученые обнаружили много новых элементов при столкновении атомов или кусочков атомов.
В конце 2018 года химики подтвердили четыре элемента, которые ранее не наблюдались.Таким образом, количество известных элементов увеличилось до 118 и завершилась седьмая строка таблицы.
В предложенииВ 2019 году исполняется 150 лет периодической таблице Менделеева, впервые созданной в 1869 году.
Ознакомьтесь с полным списком Ученые говорят .
Почему американцы произносят это слово как «алюминий»? – Затерянный в пруду
Как указано в моем постоянно растущем сборнике вариантов слов, существуют тысячи различий, когда речь идет о лексическом выборе как британцев, так и американцев.Но помимо этого есть бесчисленные вариации произношения слов. Одно из таких слов – «алюминий», произношение которого сразу же сбило с толку многих моих американских друзей, поскольку в стандартном американском эквиваленте, как известно, последняя буква «i» пропадает, чтобы составить «алюминий».
В самом деле, я тоже был немного сбит с толку, когда впервые услышал, как последний говорит: мое первое впечатление, как британца, заключалось в том, что слово «алюминий», вероятно, было своего рода отсылкой к Star Trek , которой я не был знакомые (я представил себе нового капитана, который возглавил USS Aluminium).
Но после того, как и я, и американцы, с которыми я, возможно, говорил, чтобы отряхнуть наши мозги, сели и на мгновение вздохнули, мы пришли к осознанию того, что оба произношения означают одно и то же: нерастворимый химический элемент с международно признанным периодическим символом Al.
Так почему американцы произносят это слово как «Алюминий»?
Британские прескриптивисты, то есть британцы, которые не приветствуют изменение языка, скажут вам, что U.Перепеллинг С. во многом обязан «американскому высокомерию»; что это просто очередной пример того, как «янки без нужды упрощают язык». Однако даже беглое исследование этого вопроса покажет даже самому ярому лингвистическому консерватору, что все не так просто.
Все началось, по-видимому, с того момента, когда нерешительный британский химик по имени сэр Хамфри Дэви фактически ввел в обращение уже устаревшее слово «алюминий» в 1808 году. Однако, имея в виду элемент в своей книге 1812 года Elements of Chemical Philosophy он использовал бы слово «алюминий» так же, как сегодня американцы.
Однако британские ученые того времени с прекрасным многословием решили, что: «Алюминий, потому что мы позволим себе написать это слово, а не алюминий, который имеет менее классический звук. . »
Как бы то ни было, ученые в обеих странах продолжали использовать оба варианта этого слова в начале 1800-х годов, только для промышленного бума – и начала массового производства – чтобы привлечь внимание страны к этому слову (в основном это было только изначально использовался в научных кругах).
Изобретая новый недорогой метод производства металла в 1892 году, американский химик Чарльз Мартин Холл решил включить «алюминиевый» вариант, который приобрел популярность после включения в Словарь Вебстера 1828 года, в свою рекламную литературу, несмотря на то, что он использовал “алюминий” во всех его патентах. Таким образом, можно утверждать, что слово «алюминий» на самом деле осталось в американском жаргоне совершенно случайно, если верить варианту, использованному в его рекламных материалах, не более чем опечаткой.
«Алюминий» позже будет принято в качестве официального написания Американского химического общества, и хотя Международный союз чистой и прикладной химии официально признает «алюминий», его американский аналог принят в качестве альтернативы.
Помимо истории, часть меня все еще предпочитает представлять группу клингонов, штурмующих мост USS Aluminium. Возможно, в ходе дебатов об истории этого слова это понятие окажется гораздо более кратким, хотя и неточным.
Лоуренс Браун – британец, пробивающийся через поистине причудливый мир Америки – место, которое он иногда случайно называет своим домом, и место, которое он все еще не совсем понял спустя семь лет . К счастью, его путь стал на 12% легче, потому что из-за его акцента он казался намного умнее, чем он есть на самом деле. Чтобы убедиться в этом, подпишитесь на его популярную веб-серию «Затерянные в пруду» на YouTube.
Алюминий против алюминия | Почему есть две разные версии? – Грамматик
Алюминий – это американское и канадское написание серебристо-белого металлического элемента (номер 13 в периодической таблице), присутствующего в земной коре. Алюминий – предпочтительное написание за пределами Северной Америки. Ни один термин не превосходит другой, и оба этимологически и логически оправданы. Алюминий старше, в то время как алюминий более соответствует другим названиям элементов, таким как гелий , литий , магний и так далее (хотя давайте не будем забывать, что есть другие элементы -um – молибден , тантал и платина ).
Алюминий занимает лидирующие позиции в научной литературе даже в Северной Америке. Это в первую очередь потому, что несколько влиятельных научных организаций и изданий предпочитают правописание.
Примеры
Ненаучные американские и канадские публикации предпочитают алюминий во всех контекстах – например:
Алюминий заменил сталь в панелях крыши, сэкономив еще 15 фунтов. [New York Times]
Алюминиевые щиты, сделанные из останков башен-близнецов, с 2004 года находятся на Марсе с марсоходами Spirit и Opportunity.[CTV.ca]
Внешний вид полностью покрыт алюминиевой фольгой. [USA Today]
Также важное значение для севера имеет то, что стоимость экспорта алюминия в Китай увеличилась на 176 процентов. [Vancouver Sun (статья сейчас в автономном режиме)]
И за пределами Северной Америки, алюминий предпочтительнее, например:
Оба этих элегантных дуэта изготовлены из алюминия. [Financial Times (Великобритания)]
Англичанам нелояльно указывать на то, что это чужеродная нить, нитка алюминия, пронизывающая гобелен нашего национального сознания.[Irish Times]
Г-н Хоус сказал, что контракт был на 80 тонн алюминиевых профилей. [Sydney Morning Herald]
Во вторник полиция аэропорта арестовала трех человек за кражу алюминиевых деталей на сумму 3,60 лакха. [Times of India]
Периодическая таблица звуков
В 1869 году русский химик Дмитрий Менделеев разработал первую версию хорошо известной теперь таблицы химических элементов. Это показало все элементы, которые были известны в то время, а некоторые были обнаружены позже.
Элементы показаны в порядке увеличения числа протонов в ядре, начиная с водорода (H), который имеет один протон. Строки и столбцы также расположены для выделения семейств элементов со схожими химическими свойствами, включая, например, их склонность взаимодействовать или нет с другими элементами.
Эти химические свойства повторяются по мере повторения сходства в электронном и протонном паттернах, отсюда и прилагательное «периодический».
Таким образом, положение элемента в периодической таблице многое говорит вам о том, как этот элемент создан и как он себя ведет.
То же самое и с таблицей Sound Foundations. Я не хочу зацикливаться на подобии, но есть некоторые общие черты, которые могут помочь нам продуктивно задуматься над этим. Например:
Строки и столбцы на диаграмме Sound Foundations многое расскажут о:
Семейства звуков с общими качествами (гласные, дифтонги, согласные, полугласные и т. Д.)
Как создается звук (округление губ, скольжение, фрикативные звуки, остановка, нос, жидкости, голос, длина и т. Д.)
Из каких частей рта и артикуляционного механизма он состоит (язык, зубы, губы, голос, нос и т. Д.)
Где это сделано (губы, зубы, небо, передняя, задняя, высокая, низкая и т. Д.)
И так же, как химические элементы существуют иногда сами по себе, хотя обычно в нескольких комбинациях в виде молекул и соединений, так и (элементарные) звуки / фонемы иногда используются сами по себе (I, ой, мм, ах или, э-э, шшш и т. д.), но в основном в виде комбинаций кластеров, слогов, слов и связанных высказываний.
Периодическая таблица элементов призвана показать все возможные элементы. То же самое во всех странах и, вероятно, на Марсе. Периодическая таблица звуков, возможно, может стремиться показать все звуки на разных языках или все звуки, включенные в Международный фонетический алфавит (IPA). Однако для учащихся и учителей определенного языка более полезно иметь таблицу только звуков этого языка, и даже в этом случае нужны не все звуки (аллофоны), а только те звуки, которые приводят к различию значений. (фонемы).Таким образом, можно составить таблицу «Основы звука» для отдельных языков и разновидностей этого языка.
См. Боковую панель с таблицами Sound Foundations для британского и американского английского. И смотрите книгу Sound Foundations (паб Macmillan ELT), где вы найдете дополнительные французские и немецкие чарты.
Наконец, Периодическая таблица элементов прекрасна на вид, она просто хорошо выглядит и вызывает любопытство, что, я думаю, можно сказать и о таблице Sound Foundations.
Чтобы увидеть другие поразительно разные и красивые представления Периодической таблицы элементов, щелкните здесь:
http://en.wikipedia.org/wiki/Alternative_periodic_tables
А для получения дополнительной информации о самой таблице Менделеева щелкните здесь
http://en.wikipedia.org/wiki/Periodic_table
СвязанныеАлюминий по сравнению с названиями алюминиевых элементов
Алюминий и алюминий – два названия элемента 13 в периодической таблице.В обоих случаях символ элемента – Al, хотя американцы и канадцы пишут и произносят название «алюминий», в то время как британцы (и большая часть остального мира) используют написание и произношение алюминия.
Происхождение двух имен
Происхождение двух имен может быть связано с первооткрывателем элемента, сэром Хамфри Дэви, Словарём Вебстера или Международным союзом чистой и прикладной химии (IUPAC).
В 1808 году сэр Хамфри Дэви определил наличие металла в квасцах, которые он сначала назвал «алюминий», а затем «алюминий».Дэви предложил название «алюминий» при ссылке на элемент в своей книге 1812 года « Элементы химической философии », несмотря на то, что он ранее использовал «алюминий». Официальное название «алюминий» было принято, чтобы соответствовать названиям -ium большинства других элементов. Словарь Вебстера 1828 года использовал написание «алюминий», которое сохранилось и в более поздних изданиях. В 1925 году Американское химическое общество (ACS) решило вернуться от алюминия к оригинальному алюминию, поместив Соединенные Штаты в группу «алюминиевых». .В последние годы IUPAC определил «алюминий» как правильное написание, но это не прижилось в Северной Америке, поскольку ACS использовала алюминий. В периодической таблице ИЮПАК в настоящее время перечислены оба варианта написания и говорится, что оба слова совершенно приемлемы.
История элемента
Гайтон де Морво (1761) назвал квасцы, основу, которая была известна древним грекам и римлянам, именем алюмин. Дэви определил наличие алюминия, но не изолировал элемент.Фридрих Велер выделил алюминий в 1827 году, смешав безводный хлорид алюминия с калием. На самом деле, этот металл был произведен двумя годами ранее, хотя и в нечистом виде, датским физиком и химиком Гансом Кристианом Орстедом. В зависимости от вашего источника, открытие алюминия приписывают либо Эрстеду, либо Велеру. Человек, обнаруживший элемент, получает привилегию дать ему имя; однако с этим элементом личность первооткрывателя также оспаривается, как и имя.
Правильное написание
IUPAC определил, что любое написание является правильным и приемлемым.Тем не менее, в Северной Америке принято написание «алюминий», а в остальном – «алюминий».
Периодическая таблица элементов. Выпуск
Элемент 82 был обвинен в падении Римской империи и сведении художников эпохи Возрождения с ума. Это пули и этилированный бензин. И в последние годы это вызвало кризисы в области общественного здравоохранения во Флинте, штат Мичиган, и Ньюарке, штат Нью-Джерси, в результате чего были загрязнены источники воды и повышен уровень свинца в крови у детей, которые непропорционально были из бедных общин и меньшинств.
Когда свинец связывается с белками или вытесняет важные металлы в организме, последствия могут быть катастрофическими. «Красота свинца для химика в том, что он может связываться разными способами», – говорит Марк Уилсон, доцент кафедры химии Университета Торонто. «Опасность свинца для биолога заключается в том, что он может связываться разными способами».
Но, как мог бы заметить химик, свинец – это не все плохо. Подкладки на основе свинца защищают ваши органы во время рентгеновских лучей и защищают окружающую среду от некоторых опасных материалов.Свинец делает ваши хрустальные бокалы прочными и блестящими, а автомобильный аккумулятор заряжается.
Его полезность отчасти объясняет его повсеместное распространение. Когда в 2002 году Ассоциация производителей свинца обанкротилась, сославшись на отсутствие страховки на случай судебных разбирательств, никто не стал говорить о положительных моментах. Имея это в виду, агентство Bloomberg Businessweek поговорило с Мэттом Сорреллом, креативным директором рекламного агентства Wieden + Kennedy, чтобы обсудить, может ли выгодное использование лида каким-либо образом его окупить.Интервью отредактировано для большей ясности.
Что вам нужно знать, прежде чем взять на себя ведущую роль в качестве клиента?
Вы пытаетесь обучать людей? Или какой-то ведущий магнат просто пытается очистить склад от этих вещей?
Давайте начнем с обновления бренда и продолжим продажи.
В этом случае нам нужен дальновидный подход. «Свинец – это жизнь». «Веди со свинцом». «Ведущий: постарайтесь не думать об этом слишком много.”
Второй вариант может быть трудным для понимания в печатном виде.
Может быть, это так же просто, как поставить знак ударения над буквой «е» или «а», чтобы мы получили другое произношение, чтобы сделать его перспективным.
Расскажите, как вы реализовали проект «Lead Is Life».
Свинец защищает человеческое тело – он защищает человеческие гениталии! Если посмотреть на это с другой стороны, возможно, свинец создает жизнь.
В свинце много положительного.Он дешевый, податливый и устойчивый к коррозии. Знаете ли вы, что Вселенная всегда создает больше свинца?
Я этого не знал. Это никуда не денется, так что, может быть, нам не стоит игнорировать это.
Он также имеет наивысший атомный номер среди всех стабильных элементов. Вот что делает его таким отличным щитом от радиации.
Ага! У него высокий балл, высокий показатель, но он на грани сверхопасности. Максимально сильная атмосфера Тайленола.
История рекламы знает множество примеров проблемных товаров, таких как сигареты. В чем обратная сторона более открытого признания темной стороны свинца?
Плохой PR в рекламной индустрии.
Но разве не главная задача агентства – убедить людей купить то, что им не подходит?
Продать непродаваемое? Мне это кажется скользким, старомодным способом сделать это. Человек Мальборо и [Джо] Верблюд – странные образцы поп-культуры, которых бы не существовало, если бы люди не отказались от своей морали.
Вы хотите сказать, что рекламная индустрия изменилась?
Произошли изменения на обоих концах; общественные знания также изменились. ( Пауза. ) Когда информация так легко доступна, люди поймут, что она вредна для вас. Так зачем это скрывать? Может быть, мы примем это. Сейчас у людей действительно есть что-то вроде судного дня.


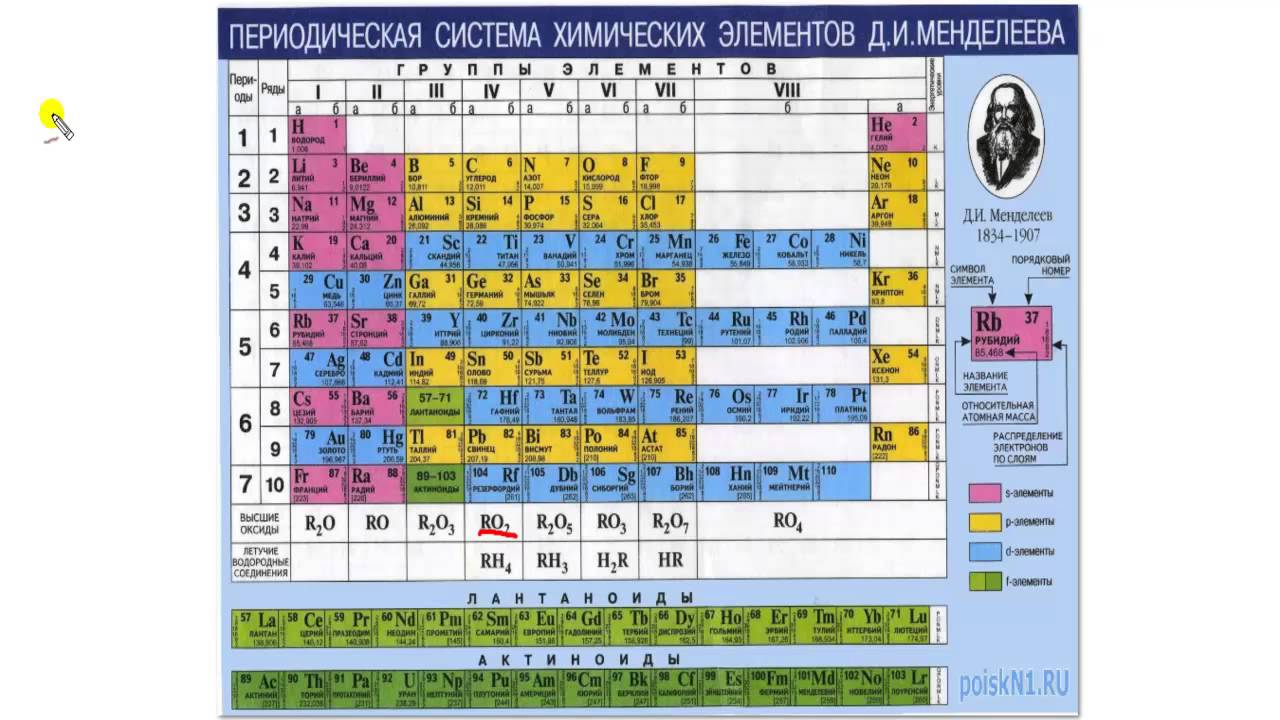
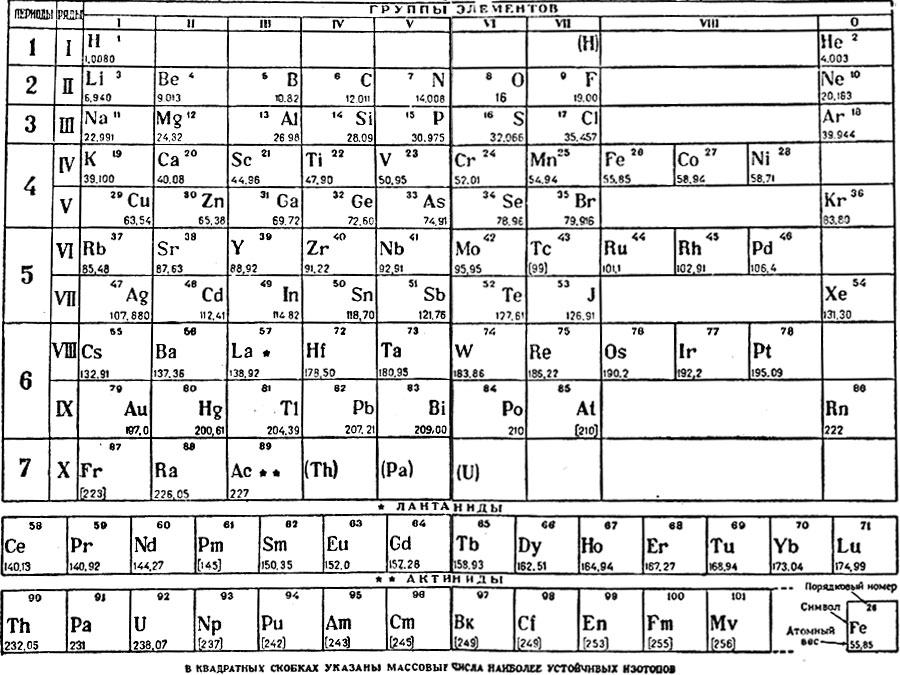 «Цветик-семицветик». (7 баллов)
«Цветик-семицветик». (7 баллов)