Распределение ⭐️ электронов по энергетическим уровням: как определить, таблица Менделеева
Электронная структура атомов — конфигурация
Ядра всех элементов состоят из положительно заряженных протонов и не имеющих заряда нейтронов. Атомный номер химического элемента, указанный в периодической системе, равен количеству протонов в нем. Сумму протонов и нейтронов называют массовым числом, оно всегда целое.
Когда атом электрически нейтрален, его ядро удерживает количество отрицательно заряженных электронов, равное количеству положительно заряженных протонов в ядре.
Электроны формируют оболочки, которые называют энергетическими уровнями. Им свойственно занимать такое положение на энергетических уровнях, при котором энергия является минимальной. Чем ближе к ядру расположены электроны, чем больше сила притяжения между ними и ядром, тем меньше суммарная энергия.
Если число электронов велико, они стремятся расположиться подальше друг от друга, чтобы уменьшить взаимное отталкивание и таким образом снизить энергию атома. Рассчитывая полную энергию атома, необходимо учитывать оба эти фактора.
Рассчитывая полную энергию атома, необходимо учитывать оба эти фактора.
На внешней электронной оболочке располагаются валентные электроны, именно они определяют, какие химические связи способен образовывать атом.
Внутри одного атома энергия орбиталей увеличивается по мере удаления от ядра. Но и для разных химических элементов энергия электронов, расположенных на одном энергетическом подуровне, не постоянна: она снижается при переходе от более легких к более тяжелым атомам. Это объясняется тем, что для легких атомов энергия определяется в основном притяжением электронов к ядру, тогда как для тяжелых велико влияние взаимного отталкивания электронов.
При столкновении атомов друг с другом или с заряженными частицами, а также при поглощении излучения электроны могут переходить на другие, более отдаленные от ядра, а значит характеризующиеся более высокой энергией, энергетические подуровни.
Графически орбитали часто изображают в виде ячеек, а находящиеся на них электроны — стрелками. Стрелки, направленные в разные стороны, указывают на противоположные спины двух электронов. На приведенной схеме можно увидеть строение трех элементов периодической таблицы — лития, натрия и калия.
Стрелки, направленные в разные стороны, указывают на противоположные спины двух электронов. На приведенной схеме можно увидеть строение трех элементов периодической таблицы — лития, натрия и калия.
Источник: yandex.by
Орбиталь представляет собой отдельное пространство вокруг ядра в котором вероятность нахождения электрона составляет не менее 90%. Орбитали имеют разные форму и энергию, в связи с чем выделяют четыре типа атомных орбиталей, обозначаемых латинскими буквами s, р, d и f.
Энергетические подуровни образованы одинаковыми орбиталями и называются аналогично: s-, р-, d- или f-подуровни:
- s-подуровень состоит из одной s-орбитали, в этом случае разницы между подуровнем и отдельной орбиталью нет;
- р-подуровень состоит из трех р-орбиталей, характеризующихся одинаковой формой, размером и энергией, но имеющих разное пространственное расположение;
- d-подуровень состоит из пяти соответствующих орбиталей;
- f-подуровень – из семи.
Энергетические подуровни формируют энергетические уровни или электронные слои атома.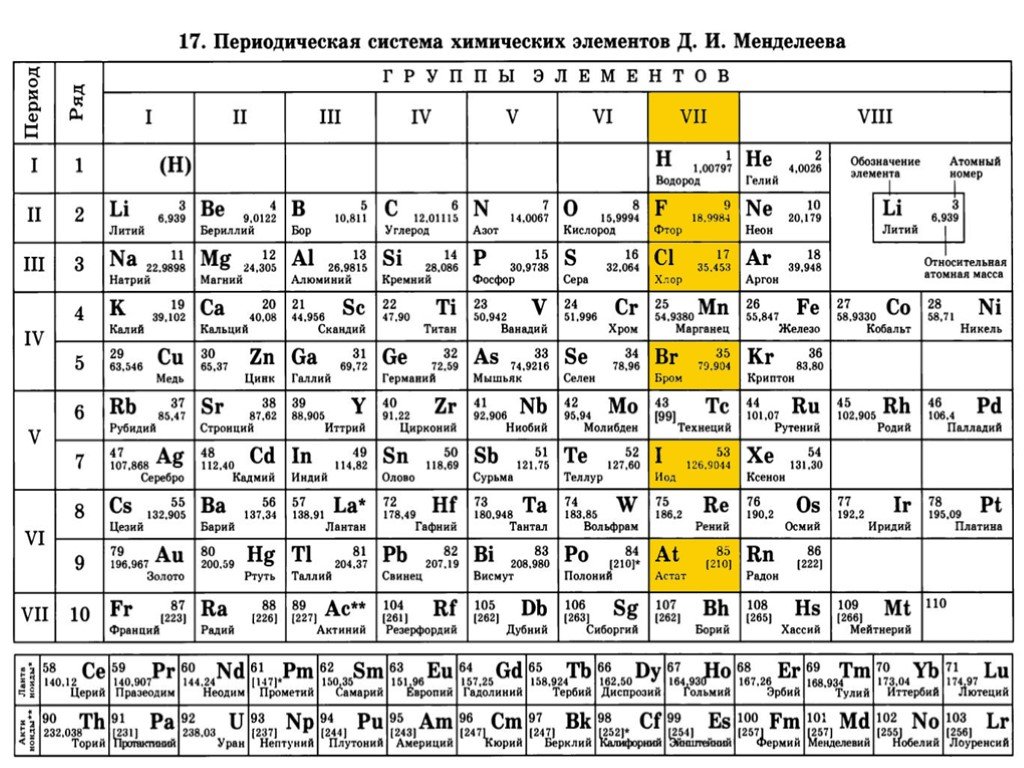
Энергетические уровни записывают буквами латинского алфавита: K, L, M, N и т. д. Число уровней в атоме химического элемента равно номеру его периода в таблице Д.И. Менделеева. Число валентных электронов равно номеру группы элемента.
Первый, самый нижний энергетический уровень (К-оболочка) состоит только из s-подуровня; на втором (L-оболочка) присутствуют s- и р-подуровни; на третьем (М-оболочка) s-, р- и d-подуровни; и т. д.
Поскольку на одной орбитали может располагаться не более двух электронов, то на каждом подуровне может поместиться строго определенное число электронов:
- на s-подуровне — 2;
- на р-подуровне — 6;
- на d-подуровне — 10;
- на f-подуровне — 14.
Используя обозначения уровней и подуровней, можно описать электронную конфигурацию любого элемента: справа вверху указывают число электронов на данном подуровне, слева порядковый номер уровня. Например, 1s1 для водорода. В специальных таблицах можно найти электронную формулу каждого элемента.
Рассмотрим атом алюминия, первого p-элемента 3-го периода. Он состоит из положительно заряженного ядра, содержащего 13 протонов и 14 нейтронов. По трем его электронным оболочкам движутся 13 электронов.
Источник: yandex.by
Его электронную конфигурацию можно записать следующим образом:
+13Al)2)8)3.
Или:
1s22s22p63s23p1.
Атом кремния состоит из положительно заряженного ядра, содержащего 14 протонов и 14 нейтронов. По трем оболочкам движутся 14 электронов.
Электронную конфигурацию кремния можно записать следующим образом:
+14Si)2)8)4.
Или:
1s22s22p63s23p2.
Атом хлора состоит из положительно заряженного ядра, содержащего 17 протонов и 18 нейтронов. По трем оболочкам движутся 17 электронов.
Электронную конфигурацию хлора можно записать следующим образом:
+17Cl)2)8)7.
Или:
1s22s22p63s23p5.
Железо — элемент 4-го периода. Его ядро содержит 26 протонов и 30 нейтронов. 26 электронов движутся по четырем оболочкам.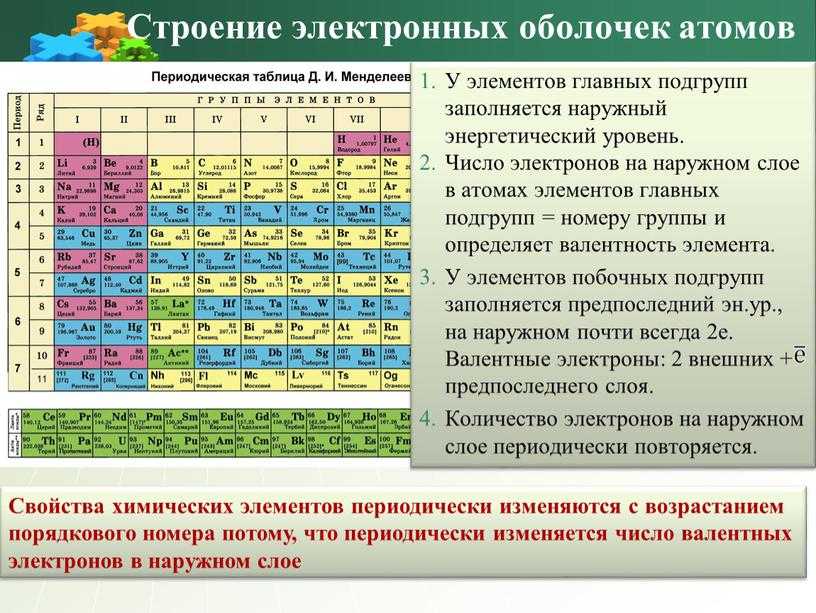
Электронная конфигурация:
+26Fe)2)8)14)2.
Или:
1s22s22p63s23p63d64s2.
Основное и возбужденное состояния атома
Когда электрон в атоме находится в основном энергетическом состоянии, его потенциальная энергия равняется нулю. Все прочие энергетические состояния электрона, в которых он обладает потенциальной энергией, считаются возбужденными.
Чем дальше электрон расположен от ядра, тем его потенциальная энергия выше. Чтобы переместить его на другой энергетический уровень, надо изменить его энергию, то есть передать ее или отнять. По мере увеличения свободной энергии атом может распределять электроны более свободно, распаривая их и перемещая на свободные орбитали.
Когда внутри атома электроны переходят с уровня на уровень, состояние атома называется возбужденным. Формула его электронной конфигурации при этом меняется. Сколько возбужденных состояний возможно для конкретного атома, зависит от количества пар электронов на внешнем энергетическом уровне. Если пара одна, возможна только одна конфигурация возбужденного состояния (всего две: одна для основного и одна для возбужденного состояний).
Если пара одна, возможна только одна конфигурация возбужденного состояния (всего две: одна для основного и одна для возбужденного состояний).
Формула углерода — 1s22s22p2.
Энергетическая диаграмма внешнего уровня в основном состоянии:
Переход электрона при возбужденном состоянии:
ПримерФормула кальция — 1s22s22p63s23p64s2.
Энергетическая диаграмма внешнего уровня в основном состоянии:
В возбужденном состоянии:
ПримечаниеСуществует ряд элементов, атомы которых не может возбудить никакое воздействие: азот, кислород, фтор и неон. У них нет свободных орбиталей, куда могли бы переместиться электроны.
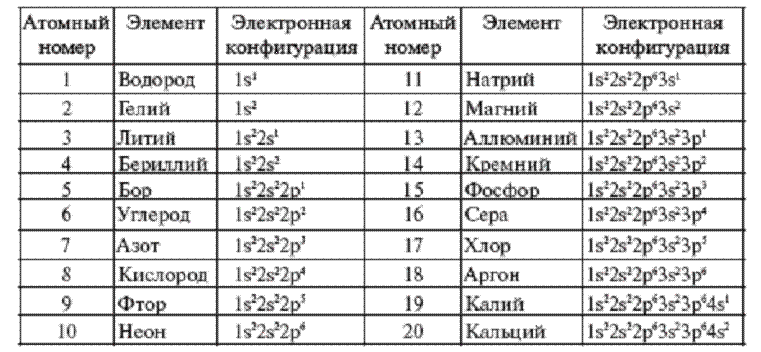
Таблица распределения электронов в атоме по энергетическим уровням и подуровням
Состояние каждого электрона можно охарактеризовать четырьмя квантовыми числами.
Источник: yandex.by
Атомные орбитали, имеющие одно и то же значение главного квантового числа n, составляют электронную оболочку. Число n всегда целое и положительное.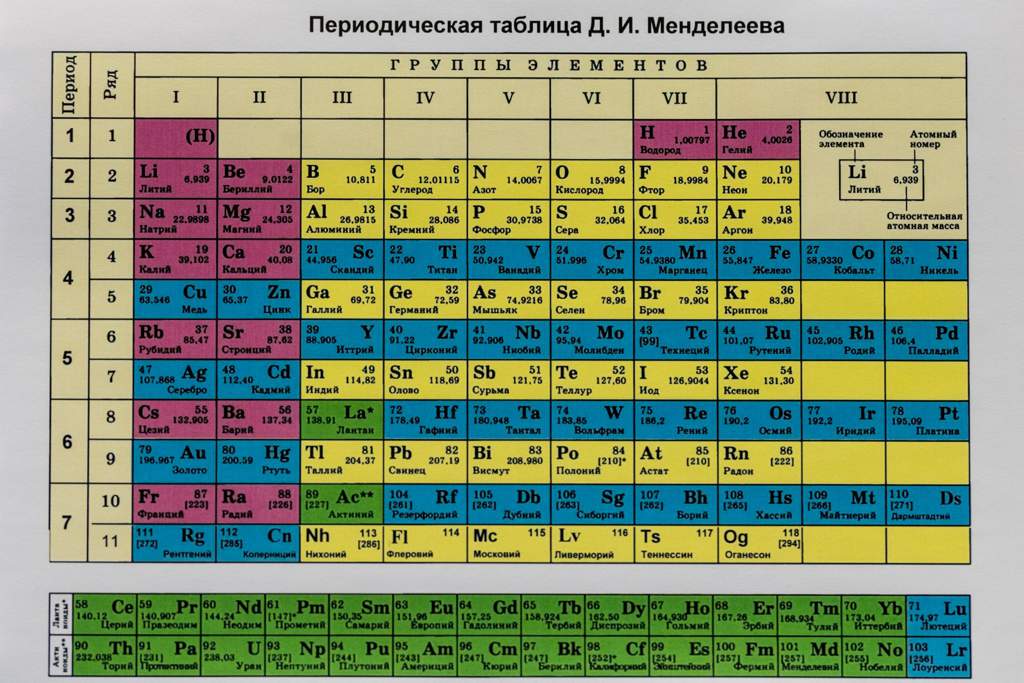 Оно определяет общую энергию электрона на конкретной орбитали, также называемую энергетическим уровнем.
Оно определяет общую энергию электрона на конкретной орбитали, также называемую энергетическим уровнем.
Орбитальное квантовое число, также известное как дополнительное и азимутальное, выражает момент импульса электрона. Оно не может быть больше n — 1. Буквы в названиях атомных орбиталей — это буквенное обозначение их орбитального числа.
Магнитное квантовое число выражает проекцию орбитального момента импульса на направление магнитного поля.
Спиновое квантовое число всех электронов равно ½ постоянной Планка и обозначается как ℏ12.
Чтобы полностью описать орбиталь, используют комбинацию трех вышеназванных чисел:
- цифру главного квантового числа n;
- букву, соответствующую орбитальному квантовому числу;
- выражение в нижнем индексе, магнитное квантовое число, обозначающее проекцию орбитали на оси x, y и z.
Таблица электронных конфигураций атомов химических элементов по периодам
Источник: yandex.by
Электронные формулы химических элементов – конфигурации атомов, заряды, формулы
4. 6
6
Средняя оценка: 4.6
Всего получено оценок: 579.
4.6
Средняя оценка: 4.6
Всего получено оценок: 579.
Расположение электронов на энергетических оболочках или уровнях записывают с помощью электронных формул химических элементов. Электронные формулы или конфигурации помогают представить структуру атома элемента.
Строение атома
Чтобы читать электронные формулы, необходимо понять строение атома.
Атомы всех элементов состоят из положительно заряженного ядра и отрицательно заряженных электронов, которые располагаются вокруг ядра.
Электроны находятся на разных энергетических уровнях. Чем дальше электрон находится от ядра, тем большей энергией он обладает. Размер энергетического уровня определяется размером атомной орбитали или орбитального облака. Это пространство, в котором движется электрон.
Рис. 1. Общее строение атома.Орбитали могут иметь разную геометрическую конфигурацию:
- s-орбитали – сферические;
- р-, d и f-орбитали – гантелеобразные, лежащие в разных плоскостях.

На первом энергетическом уровне любого атома всегда располагается s-орбиталь с двумя электронами (исключение – водород). Начиная со второго уровня, на одном уровне находятся s- и р-орбитали.
Рис. 2. s-, р-, d и f-орбитали.Орбитали существуют вне зависимости от нахождения на них электронов и могут быть заполненными или вакантными.
Запись формулы
Электронные конфигурации атомов химических элементов записываются по следующим принципам:
- каждому энергетическому уровню соответствует порядковый номер, обозначаемый арабской цифрой;
- за номером следует буква, означающая орбиталь;
- над буквой пишется верхний индекс, соответствующий количеству электронов на орбитали.
Примеры записи:
Записать электронную формулу помогает таблица Менделеева. Количеству энергетических уровней соответствует номер периода. На заряд атома и количество электронов указывает порядковый номер элемента. Номер группы показывает, сколько валентных электронов находится на внешнем уровне.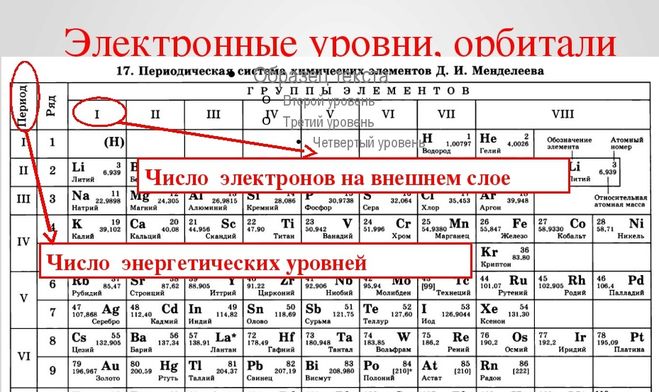
Для примера возьмём Na. Натрий находится в первой группе, в третьем периоде, под 11 номером. Это значит, что атом натрия имеет положительно заряженное ядро (содержит 11 протонов), вокруг которого на трёх энергетических уровнях располагается 11 электронов. На внешнем уровне находится один электрон.
Вспомним, что первый энергетический уровень содержит s-орбиталь с двумя электронами, а второй – s- и р-орбитали. Остаётся заполнить уровни и получить полную запись:
+11 Na )2)8)1 или 1s22s22p63s1.
Для удобства созданы специальные таблицы электронных формул элемента. В длинной периодической таблице формулы также указываются в каждой клетке элемента.
Для краткости в квадратных скобках записаны элементы, электронная формула которых совпадает с началом формулы элемента. Например, электронная формула магния – [Ne]3s2, неона – 1s22s22p6. Следовательно, полная формула магния – 1s22s22p63s2.
Следовательно, полная формула магния – 1s22s22p63s2.
Что мы узнали?
Электронные формулы элементов отражают расположение электронов в атоме на разных орбиталях. Количество электронов равно порядковому номеру элемента, количество уровней – номеру периода. На последнем уровне находятся валентные электроны, соответствующие номеру группы элемента. Цифры в электронной формуле показывают уровень, буквы – орбиталь, индексы – количество электронов на уровне.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Александр Котков
5/5
Александр Котков
5/5
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 579.
А какая ваша оценка?
электронных конфигураций
электронных конфигураций Следующее содержание является сутью лекции по общей химии 26.
Электронная конфигурация
Конфигурации электронов — это сводка того, где электроны находятся вокруг ядра. Как мы узнали ранее, каждый нейтральный атом имеет количество электронов, равное количеству его протонов. Теперь мы поместим эти электроны в такое расположение вокруг ядра, которое укажет на их энергию и форму орбитали, на которой они расположены. Вот краткое изложение типов орбиталей и количества электронов, которые каждая из них может содержать:
Итак, основываясь на том, что мы знаем о квантовых числах, и используя приведенную выше таблицу, вам нужно 2 электрона, чтобы заполнить s-орбиталь, 6 электронов, чтобы заполнить p-орбиталь, 10 электронов, чтобы заполнить d-орбиталь, и 14 электронов, чтобы заполнить f-орбиталь. НО то, что мы не обсуждали, так это то, как эти орбитали заполняются. .. порядок заполнения.
.. порядок заполнения.
Порядок заполнения
Порядок, в котором электроны размещаются на орбиталях, основан на порядке их энергии. Это называется принципом Ауфбау. Первыми заполняются самые низкоэнергетические орбитали. Как и сами квантовые числа, этот порядок был определен расчетным путем и представлен следующей диаграммой:
или вы можете просто использовать периодическую таблицу:
Как написать электронную конфигурацию
Символы, используемые для записи электронной конфигурации, начинаются с номера оболочки (n), за которым следует тип орбитали, и, наконец, верхний индекс указывает, сколько электронов находится на орбитали.
Глядя на периодическую таблицу, вы видите, что кислород имеет 8 электронов. Основываясь на приведенном выше порядке заполнения, эти 8 электронов заполнили бы следующий порядок 1s, 2s и затем 2p. Таким образом, электронная конфигурация кислорода будет O 1s 2 2s 2 2p 4 .
Основываясь на приведенном выше порядке заполнения, эти 8 электронов заполнили бы следующий порядок 1s, 2s и затем 2p. Таким образом, электронная конфигурация кислорода будет O 1s 2 2s 2 2p 4 .
Особые случаи
Конфигурации ионов представляют собой частный случай электронной конфигурации, а также в первую очередь демонстрируют причину образования этих ионов.
Если вам нужно записать полную электронную конфигурацию для аниона , то вы просто добавляете дополнительные электроны, и конфигурация просто продолжается.
Например, мы знаем, что кислород всегда образует 2-ионы, когда он образует ион. Это добавит 2 электрона к его нормальной конфигурации, создав новую конфигурацию: O 2- 1с 2 2с 2 2п 6 . Следует отметить, что с 10 электронами электронная конфигурация кислорода теперь точно такая же, как у неона. Мы говорили о том, что ионы образуются, потому что они могут стать более стабильными с присоединением или потерей электронов, чтобы стать похожими на благородные газы, и теперь вы можете увидеть, как они становятся такими же.
Мы говорили о том, что ионы образуются, потому что они могут стать более стабильными с присоединением или потерей электронов, чтобы стать похожими на благородные газы, и теперь вы можете увидеть, как они становятся такими же.
Электронные конфигурации катионов также основаны на количестве электронов, но есть небольшая разница в способе их конфигурации. Сначала вы должны написать их нормальную электронную конфигурацию, а затем, когда вы удаляете электроны, вы должны брать их с самой внешней оболочки. Обратите внимание, что это не всегда тот же способ, которым они были добавлены.
Вот пример того, что я имею в виду:
Iron имеет 26 электронов, поэтому его нормальная конфигурация электронов будет: Fe
Когда мы создаем ион 3+ для железа, нам нужно сначала взять электроны из самой внешней оболочки, чтобы это была оболочка 4s, а не оболочка 3d: Fe 3+ 1s 2 2s 2 2p 6 3s 2 3p
Еще одно замечание по записи электронных конфигураций: короткий путь. При написании некоторых конфигураций нижних таблиц общая конфигурация может быть довольно длинной. В этих случаях вы можете использовать предыдущий благородный газ для сокращения конфигурации, как показано ниже. Вам просто нужно закончить конфигурацию, откуда выходит благородный газ:
При написании некоторых конфигураций нижних таблиц общая конфигурация может быть довольно длинной. В этих случаях вы можете использовать предыдущий благородный газ для сокращения конфигурации, как показано ниже. Вам просто нужно закончить конфигурацию, откуда выходит благородный газ:
Исключения
Как и в случае с любой другой темой, которую мы рассмотрели на сегодняшний день, существуют исключения из порядка заполнения. Но, исходя из генерируемых электронных конфигураций, эти исключения легко понять.
В блоке d, особенно в группах, содержащих хром и медь, есть исключение в том, как они заполняются.
Вот актуальные конфигурации:
В этих столбцах 4s и 3d
Практика, Практика, Практика
Здесь есть множество викторин по электронным конфигурациям, с которыми вы можете попрактиковаться
Орбитальные диаграммы
Еще один способ представить порядок заполнения атома — использовать орбитальную диаграмму, которую часто называют «маленькими квадратиками»:
Прямоугольники используются для представления орбиталей и для отображения размещенных на них электронов. Порядок заполнения тот же, но, как вы можете видеть сверху, электроны помещаются в ящики по одному, прежде чем заполнить их обоими электронами. Это называется правилом Хунда: «Заполните наполовину, прежде чем заполнить полностью», и снова это правило было установлено на основе расчетов энергии, которые показали, что именно так атомы фактически распределяют свои электроны по орбиталям.
Порядок заполнения тот же, но, как вы можете видеть сверху, электроны помещаются в ящики по одному, прежде чем заполнить их обоими электронами. Это называется правилом Хунда: «Заполните наполовину, прежде чем заполнить полностью», и снова это правило было установлено на основе расчетов энергии, которые показали, что именно так атомы фактически распределяют свои электроны по орбиталям.
Периодические свойства
Одна из действительно крутых особенностей электронных конфигураций — их связь с периодической таблицей. В основном периодическая таблица была построена таким образом, чтобы элементы с одинаковыми электронными конфигурациями были выровнены в одни и те же группы (столбцы).
Периодическая таблица, показывающая последнюю заполненную орбиту для каждого элемента
Периодическая таблица, показанная выше, демонстрирует, как конфигурация каждого элемента была выровнена так, чтобы последняя заполненная орбиталь была такой же, за исключением оболочки. Причина, по которой это было сделано, заключается в том, что конфигурация элемента придает элементу его свойства, а аналогичные конфигурации дают аналогичные свойства.
Причина, по которой это было сделано, заключается в том, что конфигурация элемента придает элементу его свойства, а аналогичные конфигурации дают аналогичные свойства.
Давайте рассмотрим некоторые периодические свойства, на которые напрямую влияет электронная конфигурация:
Размер атома
Размер атомов увеличивается вниз по таблице Менделеева. Это должно быть интуитивно понятно, поскольку с каждой строкой таблицы вы добавляете оболочку (n). Что не так интуитивно понятно, так это то, почему размер уменьшается слева направо. Но опять же построение электронной конфигурации дает нам ответ. Что вы делаете, просматривая периодическую таблицу? Ответить, добавляя протоны к ядру и добавляя электроны к валентной оболочке элемента. Что не меняется, когда вы пересекаете период? Ответ: электроны внутренней оболочки. Подумайте об этом так: электроны внутренней оболочки являются защитой от притяжения ядра. Так, например, сила притяжения Sulphur будет равна Z Eff = 16 – 10 = +6 |
Электроотрицательность
Электроотрицательность может быть самым важным из периодических свойств, которые вы можете изучить и понять, так как многие другие свойства зависят от его значения. Электроотрицательность — это способность атомов притягивать к себе электроны.
Электроотрицательность — это способность атомов притягивать к себе электроны.
Электроотрицательность обычно выражается по шкале Полинга, и значения были определены экспериментально. В таблице ниже показаны значения шкалы для элементов.
Значения электроотрицательности увеличиваются слева направо и снизу вверх в периодической таблице, за исключением благородных газов. Наиболее электроотрицательным элементом является фтор.
Из этих значений электроотрицательности мы можем вывести модели двух других периодических свойств: энергии ионизации и сродства к электрону.
Энергия ионизации Энергия ионизации — это количество энергии, необходимое для отрыва электрона от атома. Все энергии ионизации являются положительными значениями, потому что все эти удаления (даже для элементов, образующих положительные ионы) требуют ввода энергии. Чем более электроотрицательный элемент, тем выше энергия ионизации. | |
Электронное сродствоЭлектронное сродство элемента — это количество энергии, полученное или высвобожденное при добавлении электрона. Электроотрицательность и сродство к электрону увеличиваются по той же схеме в периодической таблице. Слева направо и снизу вверх. |
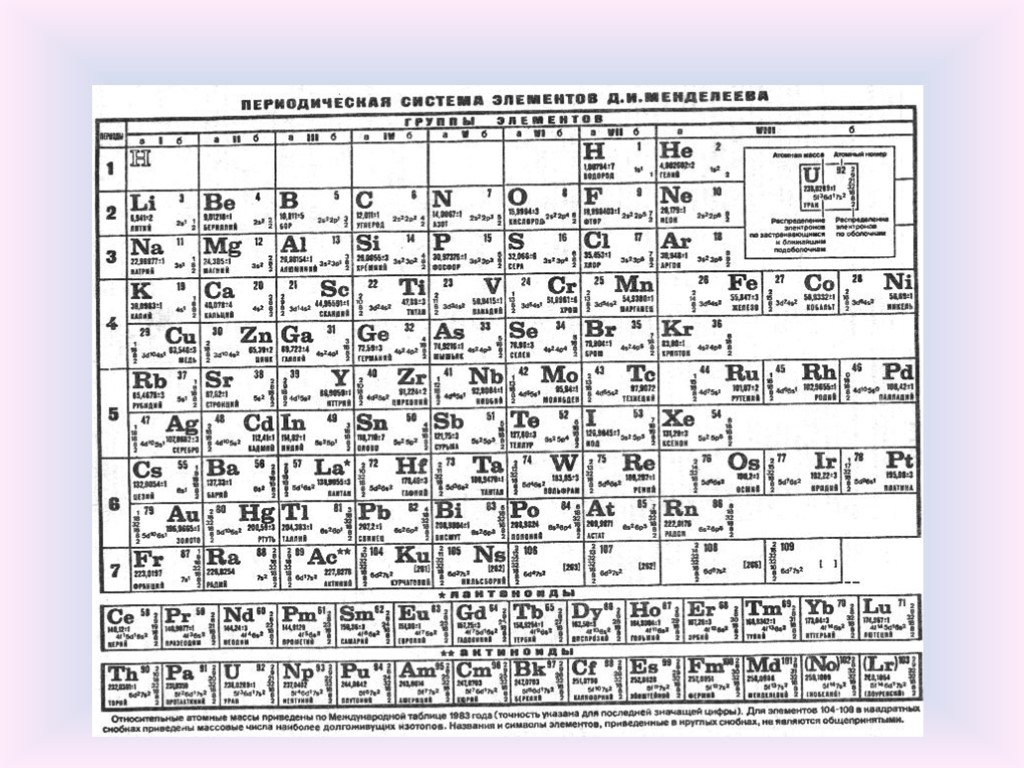
Список электронных конфигураций элементов
Эта запись была опубликована Тодд Хелменстин (обновлено )
Электронная конфигурация показывает распределение электронов по подоболочкам.
Этот список электронных конфигураций элементов содержит все элементы в порядке возрастания атомного номера.
Для экономии места конфигурации обозначены аббревиатурой благородных газов. Это означает, что часть электронной конфигурации была заменена символом элемента символа благородного газа.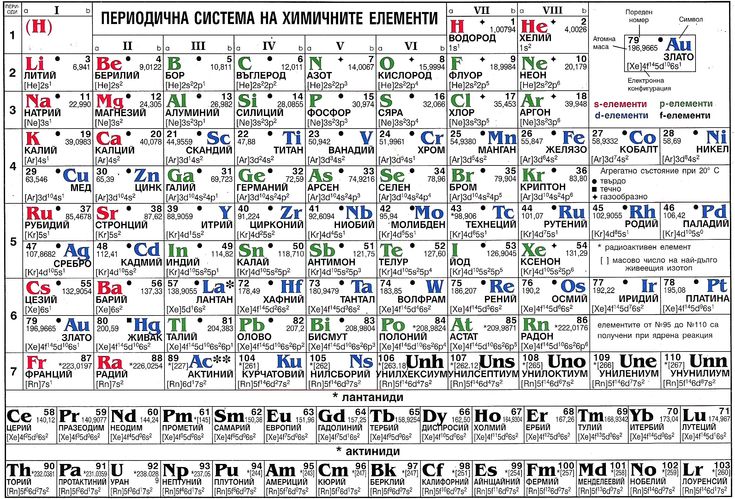 Найдите электронную конфигурацию этого благородного газа и включите это значение перед остальной частью конфигурации. Эта таблица доступна для скачивания в формате PDF для использования в качестве учебного листа.
Найдите электронную конфигурацию этого благородного газа и включите это значение перед остальной частью конфигурации. Эта таблица доступна для скачивания в формате PDF для использования в качестве учебного листа.
| NUMBER | ELEMENT | ELECTRON CONFIGURATION |
| 1 | Hydrogen | 1s 1 |
| 2 | Helium | 1s 2 |
| 3 | Lithium | [He]2s 1 |
| 4 | Beryllium | [He]2s 2 |
| 5 | Boron | [He]2s 2 2p 1 |
| 6 | Carbon | [He]2s 2 2p 2 |
| 7 | Nitrogen | [He] 2s 2 2p 3 |
| 8 | Oxygen | [He]2s 2 2p 4 |
| 9 | Fluorine | [He]2s 2 2p 5 |
| 10 | Neon | [He]2s 2 2p 6 |
| 11 | Sodium | [Ne]3s 1 |
| 12 | Magnesium | [Ne]3s 2 |
| 13 | Aluminum | [Ne]3s 2 3p 1 |
| 14 | Silicon | [Ne]3s 2 3p 2 |
| 15 | Phosphorus | [Ne]3s 2 3p 3 |
| 16 | Sulfur | [Ne]3s 2 3p 4 |
| 17 | Chlorine | [Ne]3s 2 3p 5 |
| 18 | Argon | [Ne]3s 2 3p 6 |
| 19 | Potassium | [Ar]4s 1 |
| 20 | Кальций | [Ar]4s 2 |
| 21 | Scandium | [Ar]3d 1 4s 2 |
| 22 | Titanium | [Ar]3d 2 4s 2 |
| 23 | Vanadium | [Ar]3d 3 4s 2 |
| 24 | Chromium | [Ar]3d 5 4s 1 |
| 25 | Manganese | [Ar]3d 5 4s 2 |
| 26 | Iron | [Ar]3d 6 4s 2 |
| 27 | Cobalt | [Ar]3d 7 4s 2 |
| 28 | Nickel | [Ar]3d 8 4s 2 |
| 29 | Copper | [Ar]3d 10 4s 1 |
| 30 | Цинк | [Ar]3d 10 4s 2 |
| 31 | Gallium | [Ar]3d 10 4s 2 4p 1 |
| 32 | Germanium | [Ar ]3d 10 4s 2 4p 2 |
| 33 | Arsenic | [Ar]3d 10 4s 2 4p 3 |
| 34 | Selenium | [Ar ]3d 10 4s 2 4p 4 |
| 35 | Bromine | [Ar]3d 10 4s 2 4p 5 |
| 36 | Krypton | [Ar]3d 10 4s 2 4p 6 |
| 37 | Rubidium | [Kr]5s 1 |
| 38 | Strontium | [Kr]5s 2 |
| 39 | Yttrium | [Kr]4d 1 5s 2 |
| 40 | Zirconium | [Kr]4d 2 5s 2 |
| 41 | Niobium | [Kr]4d 4 5s 1 |
| 42 | Molybdenum | [Kr]4d 5 5s 1 |
| 43 | Technetium | [Kr]4d 5 5s 2 |
| 44 | Ruthenium | [Kr]4d 7 5s 1 |
| 45 | Rhodium | [Kr]4d 8 5s 1 |
| 46 | Palladium | [Kr]4d 10 |
| 47 | Silver | [Kr]4d 10 5s 1 |
| 48 | Cadmium | [Kr]4d 10 5s 2 |
| 49 | Indium | [Kr]4d 10 5s 2 5p 1 |
| 50 | Tin | [Kr]4d 10 5s 2 5p 2 |
| 51 | Antimony | [Kr]4d 10 5s 2 5p 3 |
| 52 | Tellurium | [Kr]4d 10 5s 2 5p 4 |
| 53 | Йод | [Kr]4d 10 5s 2 5p 5 |
| 54 | Xenon | [Kr]4d 10 5s 2 5p 6 |
| 55 | Cesium | [Xe]6s 1 |
| 56 | Barium | [Xe]6s 2 |
| 57 | Lanthanum | [Xe]5d 1 6s 2 |
| 58 | Церий | [Xe]4f 1 5d 1 6s 2 |
| 59 | Praseodymium | [Xe]4f 3 6s 2 |
| 60 | Neodymium | [Xe ]4f 4 6s 2 |
| 61 | Promethium | [Xe]4f 5 6s 2 |
| 62 | Samarium | [Xe]4f 6 6s 2 |
| 63 | Europium | [Xe]4f 7 6s 2 |
| 64 | Gadolinium | [Xe]4f 7 5d 1 6s 2 |
| 65 | Terbium | [Xe]4f 9 6s 2 |
| 66 | Dysprosium | [Xe]4f 10 6s 2 |
| 67 | Holmium | [Xe]4f 11 6s 2 |
| 68 | Erbium | [Xe]4f 12 6s 2 |
| 69 | Thulium | [Xe]4f 13 6s 2 |
| 70 | Ytterbium | [Xe]4f 14 6s 2 |
| 71 | Lutetium | [Xe]4f 14 5d 1 6s 2 |
| 72 | Гафний | [Xe]4f 14 5d 2 6s 2 |
| 73 | Tantalum | [Xe]4f 14 5d 3 6s 2 |
| 74 | Tungsten | [Xe]4f 14 5d 4 6s 2 |
| 75 | Rhenium | [Xe]4f 14 5d 5 6s 2 |
| 76 | Osmium | [Хе]4f 14 5d 6 6s 2 |
| 77 | Iridium | [Xe]4f 14 5d 7 6s 2 |
| 78 | Platinum | [Xe]4f 14 5d 9 6s 1 |
| 79 | Gold | [Xe]4f 14 5d 10 6s 1 |
| 80 | Mercury | [Xe]4f 14 5д 10 6s 2 |
| 81 | Thallium | [Xe]4f 14 5d 10 6s 2 6p 1 |
| 82 | Lead | [Xe]4f 14 5d 10 6s 2 6p 2 |
| 83 | Bismuth | [Xe]4f 14 5d 10 6s 2 6p 3 |
| 84 | Полоний | [Xe]4f 14 5d 10 6s 2 6p 4 |
| 85 | Astatine | [Xe]4f 14 5d 10 6s 2 6p 5 |
| 86 | Radon | [Xe]4f 14 5d 10 6s 2 6p 6 |
| 87 | Francium | [Rn]7s 1 |
| 88 | Радий | [Rn]7s 2 |
| 89 | Actinium | [Rn]6d 1 7s 2 |
| 90 | Thorium | [Rn]6d 2 7s 2 |
| 91 | Protactinium | [Rn]5f 2 6d 1 7s 2 |
| 92 | Uranium | [Rn]5f 3 6d 1 7s 2 |
| 93 | Neptunium | [Rn]5f 4 6d 1 7s 2 |
| 94 | Plutonium | [Rn]5f 6 7s 2 |
| 95 | Americium | [Rn]5f 7 7s 2 |
| 96 | Curium | [Rn]5f 7 6d 1 7s 2 |
| 97 | Berkelium | [ рн]5f 9 7s 2 |
| 98 | Californium | [Rn]5f 10 7s 2 |
| 99 | Einsteinium | [Rn]5f 11 7s 2 |
| 100 | Fermium | [Rn]5f 12 7s 2 |
| 101 | Mendelevium | [Rn]5f 13 7s 2 |
| 102 | Nobelium | [Rn]5f 14 7s 2 |
| 103 | Lawrencium | [Rn]5f 14 7s 2 7p 1 |
| 104 | Rutherfordium | [Rn ]5f 14 6d 2 7s 2 |
| 105 | Dubnium | *[Rn]5f 14 6d 3 7s 2 |
| 106 | Seaborgium | * [Рн]5f 14 6d 4 7s 2 |
| 107 | Bohrium | *[Rn]5f 14 6d 5 7s 2 |
| 108 | Hassium | *[Rn ]5f 14 6d 6 7s 2 |
| 109 | Meitnerium | *[Rn]5f 14 6d 7 7s 2 |
| 110 | Darmstadtium | * [Рн]5f 14 6d 9 7s 1 |
| 111 | Roentgenium | *[Rn]5f 14 6d 10 7s 1 |
| 112 | Copernium | *[Rn]5f 14 6d 10 7s 2 |
| 113 | Nihonium | *[Rn]5f 14 6d 10 7s 2 7p 1 |
| 114 | Flerovium | *[Rn]5f 14 6d 10 7s 2 7p 2 |
| 115 | Moscovium | *[Rn]5f 14 6d 10 7s 2 7p 3 |
| 116 | Livermorium | *[Rn]5f 14 6d 10 7s 2 7p 4 |
| 117 | Tennessine | *[Rn]5f 14 6d 10 7s 2 7 шт. 5 5 |
| 118 | Oganesson | *[RN] 5F 14 6D 10 7S 2 7P 6 |


 Когда вы пересекаете период и увеличиваете количество протонов в ядре, вы увеличиваете его притяжение, но поскольку вы только добавляете электроны в новую оболочку, экран не увеличивается, а остается неизменным на всем протяжении. Это означает, что притяжение электронов, добавляемых к валентной оболочке, неуклонно увеличивается на всем протяжении. Что произойдет, если вы потянете электроны сильнее? Ну, они приближаются к ядру и размер атома уменьшается. Эффект притяжения ядра на электроны, добавляемые за период, называется эффективным зарядом ядра и рассчитывается как Z Eff = #протоны – Ядро # Электроны.
Когда вы пересекаете период и увеличиваете количество протонов в ядре, вы увеличиваете его притяжение, но поскольку вы только добавляете электроны в новую оболочку, экран не увеличивается, а остается неизменным на всем протяжении. Это означает, что притяжение электронов, добавляемых к валентной оболочке, неуклонно увеличивается на всем протяжении. Что произойдет, если вы потянете электроны сильнее? Ну, они приближаются к ядру и размер атома уменьшается. Эффект притяжения ядра на электроны, добавляемые за период, называется эффективным зарядом ядра и рассчитывается как Z Eff = #протоны – Ядро # Электроны.