Шпора по таблице Менделеева (Java)
- формат jar, jad
- размер 17.18 КБ
- добавлен 08 июня 2008 г.
Java шпора по химии (плохо, что DEMO, но помогает).
Смотрите также
- формат doc
- размер 411.7 КБ
- добавлен 15 июня 2009 г.
Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки. Строение атомов химических элементов на примере элементов второго периода и IV-A группы периодической системы химических элементов Д. И. Менделеева. Закономерности в изменении свойств этих химических элементов и образованных ими простых и сложных веществ (оксидов, гидроксид.
Шпаргалка
- формат pdf
- размер 1.71 МБ
- добавлен 29 октября 2010 г.
РХТУ им. Менделеева Шпарганка содержит описание некоторых насосов, отстойников, фильтров, циклонов, мешалок взятое из следующей литературы: Д-Ю. И. Дытнерский «Процессы и аппараты химической промышленности» К-А. Касаткин «Основные процессы и аппараты химической промышленности»
- формат doc
- размер 28 КБ
- добавлен 12 июля 2009 г.
Электронное строение, свойства, соединения, применение.
- формат doc
- размер 30 КБ
- добавлен
12 февраля 2009 г.

Электронное строение, свойства, соединения, применение.
Шпаргалка
- формат doc
- размер 268.5 КБ
- добавлен 15 марта 2011 г.
НТУУ “КПІ” 1 курс, інженерно-хімічний факультет, 1 семестр. шпора на 3 страницах. очень компактная. если резать будет иметь вид книжечки. ответы на конкретные вопросы (вопросы в шпоре есть).
- формат doc
- размер 182.21 КБ
- добавлен 31 марта 2009 г.
Характерные свойства (и не только! ) групп элементов ПСХЭ Д. И. Менделеева. Zip архив. Word документы, 11 штук. Здесь представленны группы элементов ПСХЭ Д.
- формат jad, jar
- размер 86.95 КБ
- добавлен 12 октября 2008 г.
Для мобильного телефона JAVA MIDP2. Неорганическая химия (1й курс) Предмет и задачи химии. Значение химии. Строение атома. Периодический закон. Химическая кинетика. Растворы. Гальванический элемент. Электролиз. Законы Фарадея.rn
- формат doc
- размер 228 КБ
- добавлен 03 января 2009 г.
Химия,Основные законы химии,Атом,Кванты и модель Бора,Квантовые числа,Электронная конфигурация атома ,Нормальное и возбужденное состояние атома,Периодическая система Д.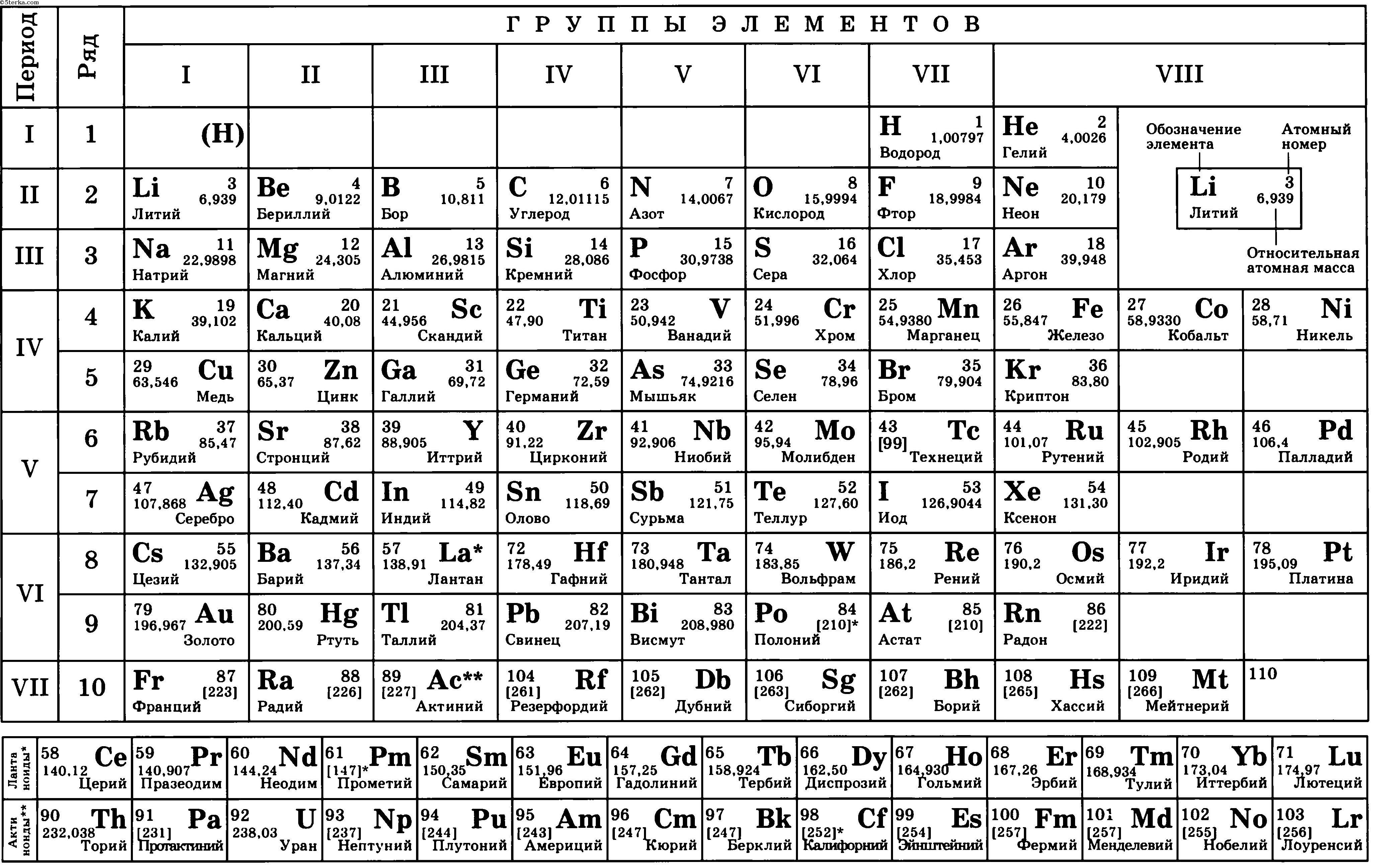 И. Менделеева, ее структура, s-, p-, d-, f-элементы, их расположение в периодической системе и т.д.
И. Менделеева, ее структура, s-, p-, d-, f-элементы, их расположение в периодической системе и т.д.
- формат doc
- размер 198.5 КБ
- добавлен 21 января 2009 г.
Химическая связь. Типы связи. Краткая характеристика. Строение атома. Модель Резерфорда-Бора. Ковалентная связь. Условия ее образования. Уравнение Шредингера. Следствие из решения уравнения Шредингера. Периодическая таблица Д.И. Менделеева в свете строения атома. ПСХЭ Д.И.Менделеева. Ионная связь. Условия ее образования и характеристика. Координационная и водородная связь. Условия их образования. Изменение радиуса атомов в пределах одного периода…
Шпаргалка
- формат doc
- размер 1.91 МБ
- добавлен
23 января 2012 г.

БГУИР, Минск, 2011 год. В этой полностью готовой для печати и “употребления” шпаргалке полностью рассматриваются возможные типовые экзаменационные вопросы по курсу “Химия”. Шпора удобна, информативна и проверена временем. Предназначена для первокурсников БГУИР (для 40-и 120-часового потоков включительно)
Памятка по периодической таблице :: Учебники по химии
Памятка по периодической таблице
Периодическая таблица
Периодическая таблица предназначена для классификации элементов в соответствии с их сходством химических и физических свойств. В этой таблице элементы упорядочены по возрастанию атомного номера. В периодической таблице вы можете увидеть атомный номер, имя, символ и массовое число элементов. Как видно из приведенной выше картинки, горизонтальные ряды называются период и вертикальные столбцы называются группа .
Орбитали в периодической таблице
s-блок: Этот блок содержит элементы, имеющие валентные электроны на s-орбитали. IA и IIA представляют собой группы блоков.
Блок p: Этот блок содержит элементы, имеющие валентные электроны на p-орбиталях. IIIA, IVA, VA, VIA, VIIA и VIIIA представляют собой п-блок-группы.
d-блок: Этот блок содержит элементы, имеющие валентные электроны на d-орбиталях. IIIB, IVB, VB, VIB, VIIB, VIIIB, IB и IIB представляют собой группы d-блоков.
f блок: Этот блок содержит элементы, имеющие валентные электроны на f орбиталях. Два элемента, упомянутые в блоке d (IIIB), и две строки, нарисованные внизу таблицы Менделеева, принадлежат блоку f.
Нахождение положения элементов в периодической таблице
а) Нахождение периода элементов:
Период элемента равен наивысшему уровню энергии электронов или главному квантовому числу.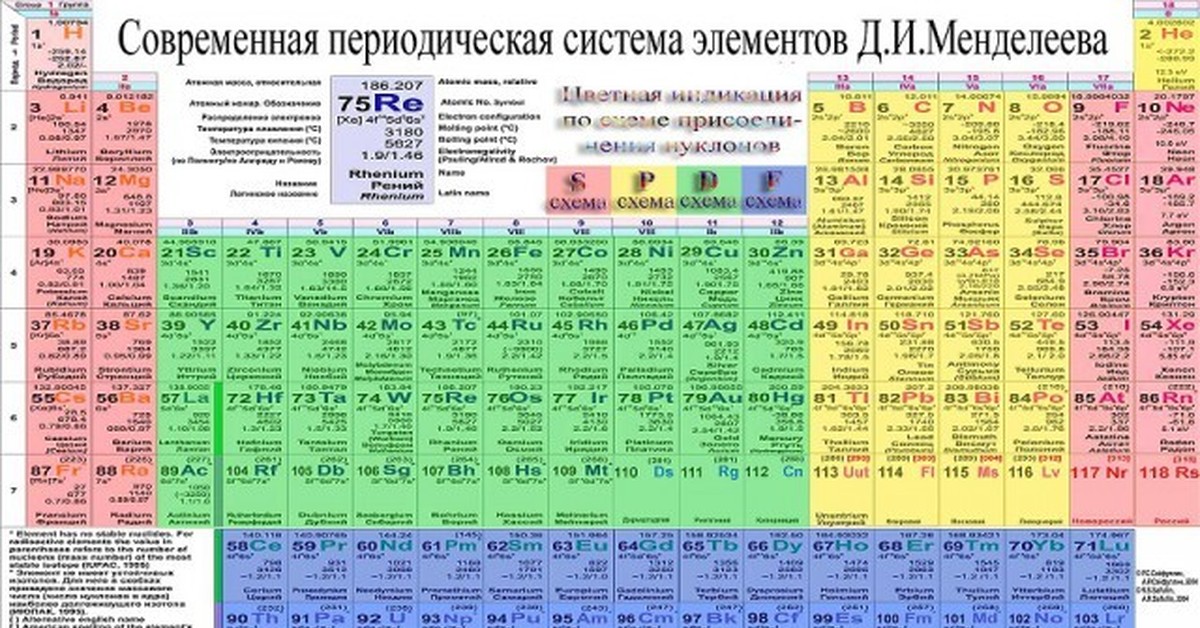
16С: 1с 2 2s 2 2p 6 3 s 2 3 p 4 3 — наивысший энергетический уровень электронов или главное квантовое число. Таким образом, период S равен 3.
б) Нахождение группы элементов:
Группа элемента равна количеству валентных электронов элемента или числу электронов на самом высоком энергетическом уровне элементов. Другой способ найти группу элементов — просмотреть вложенные оболочки. Если последней подоболочкой электронной конфигурации является «s» или «p», то группа становится A. Элементы в группе B имеют электронную конфигурацию 9.0003 нс и (n-1)d , общее количество электронов на этих орбиталях дает нам группу элемента. Посмотрите на следующие примеры.
Периодические свойства элементов
1) Атомный радиус:
Атомный радиус элементов уменьшается при движении слева направо в периодической таблице.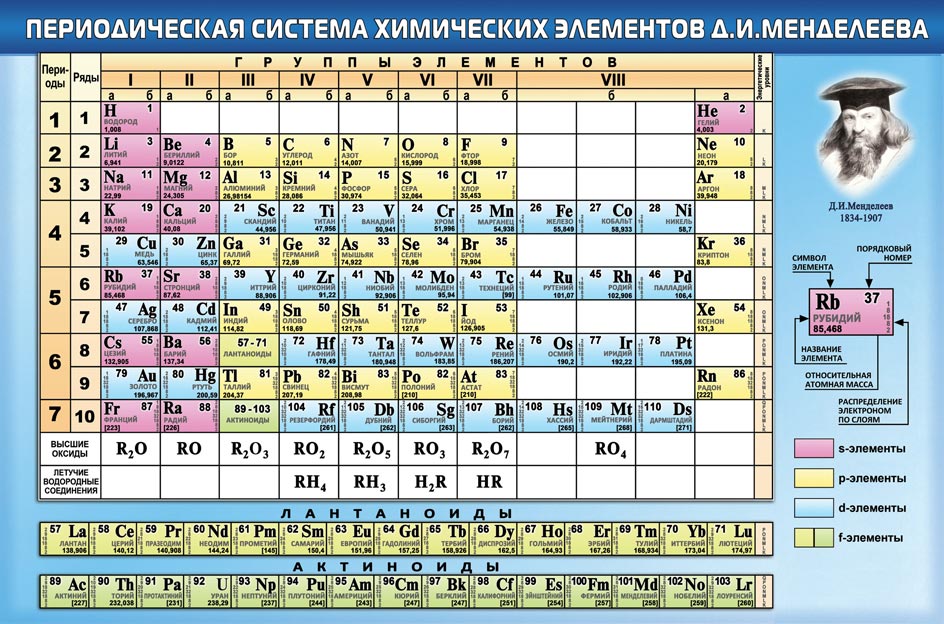 Наоборот, в той же группе, при движении сверху вниз , атомный радиус элементов увеличивается.
Наоборот, в той же группе, при движении сверху вниз , атомный радиус элементов увеличивается.
2) Энергия ионизации:
Энергия, необходимая для отрыва электрона от атомов или ионов, называется 9.0003 энергия ионизации . Увеличение силы притяжения ядра к электронам затрудняет отрыв электронов от оболочек. Энергия второй ионизации больше энергии первой ионизации, энергия второй ионизации больше энергии третьей ионизации.
Изменения энергии ионизации в периодической таблице;
I A
3) Сродство к электрону:
Если электрон присоединяется к нейтральному атому в газообразном состоянии, энергия отдается. Мы называем эту энергию « сродство к электрону ”. Сродство к электрону увеличивается при движении слева направо по периоду. Наоборот, сродство к электрону уменьшается в группе сверху вниз.
4) Электроотрицательность:
В химической связи способность атомов притягивать электроны называется электроотрицательностью. Слева направо в периоде электроотрицательность увеличивается, а сверху вниз в группе электроотрицательность уменьшается.
Слева направо в периоде электроотрицательность увеличивается, а сверху вниз в группе электроотрицательность уменьшается.
5) Свойство металл-неметалл:
Способность отдавать электрон называется свойством металла, а способность получать электрон называется неметаллическим свойством элементов. При перемещении по периоду слева направо свойства металлов увеличиваются, а свойства неметаллов уменьшаются. В группе металлов сверху вниз свойства металла возрастают. В группах неметаллов сверху вниз неметаллические свойства атомов уменьшаются.
Свойства групп
а) I A Щелочные металлы:
Кроме 1 H, все элементы этой группы металлические. Это 1 H, 3 Li, 11 Na, 19 K, 37 Rb, 55 Cs, 87 Fr.Они;
- имеют тенденцию терять один электрон на внешних оболочках и превращаются в ион +1
- очень реакционноспособны и существуют в соединениях
- хорошо проводят электричество и тепло
- все их соединения растворимы в воде
b ) II Щелочноземельные металлы:
Все элементы этой группы металлические.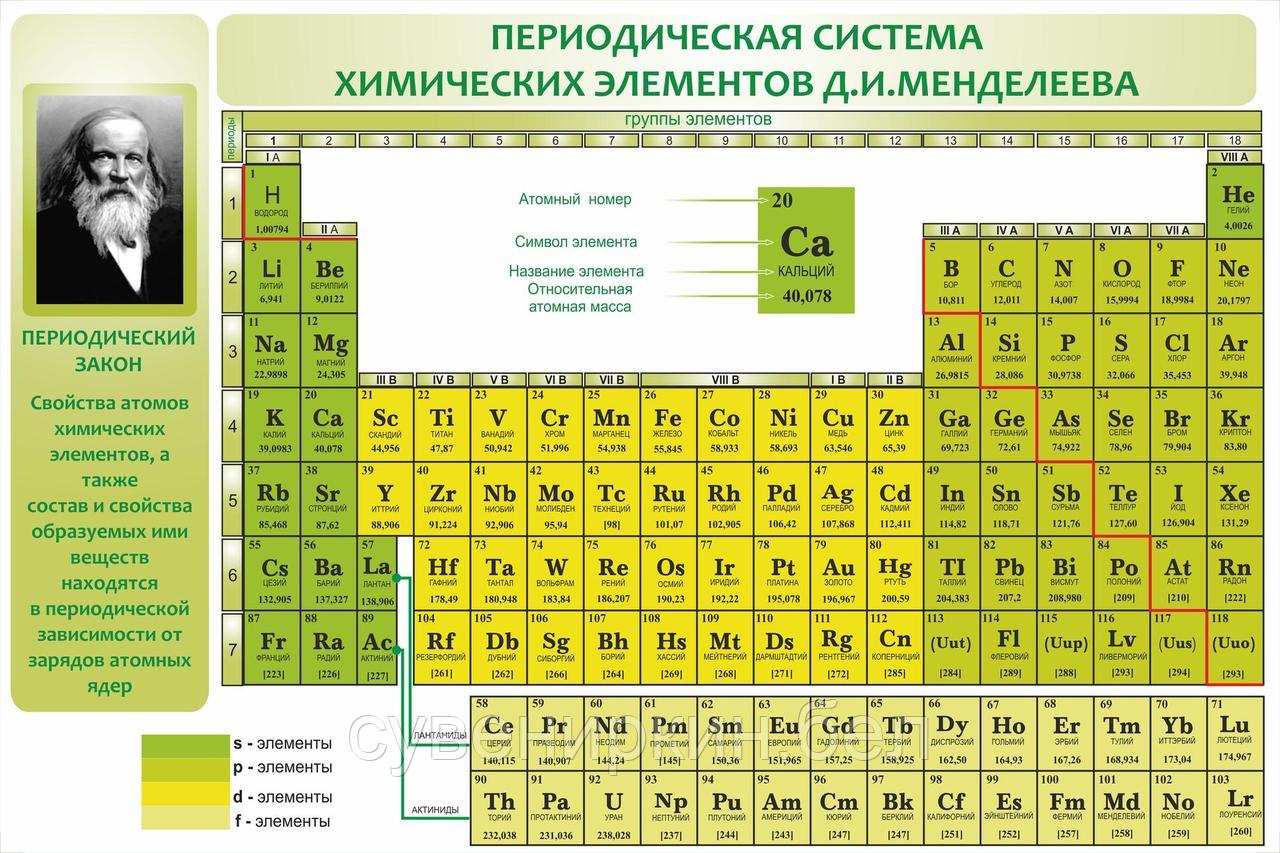 Это 4 Be, 12 Mg, 20 Ca, 38 Sr, 56 Ba, 88 Ra. Они;
Это 4 Be, 12 Mg, 20 Ca, 38 Sr, 56 Ba, 88 Ra. Они;
- имеют тенденцию терять два электрона на внешних оболочках и превращаются в ион +2
- являются хорошими проводниками электричества и тепла в твердой и жидкой фазах
- являются реакционноспособными и существуют в соединениях
c) VII A Галогены:
Все элементы этой группы неметаллы. Их 9 F, 17 Cl, 35 Br, 53 I и 85 At. Они;
- имеют более высокую склонность связывать электрон и становятся ионами -1
- имеют семь электронов на внешних оболочках, таким образом, их значения могут изменяться от +7 до -1 в соединениях
- , если они находятся в соединениях металл-неметалл, они имеют – 1 значение
- они существуют в двухатомных молекулах, таких как F 2 , Br 2
d) VIII A Благородные газы:
Они есть; 2 He, 10 Ne, 18 Ar, 36 Kr, 54 Xe, 86 Rn.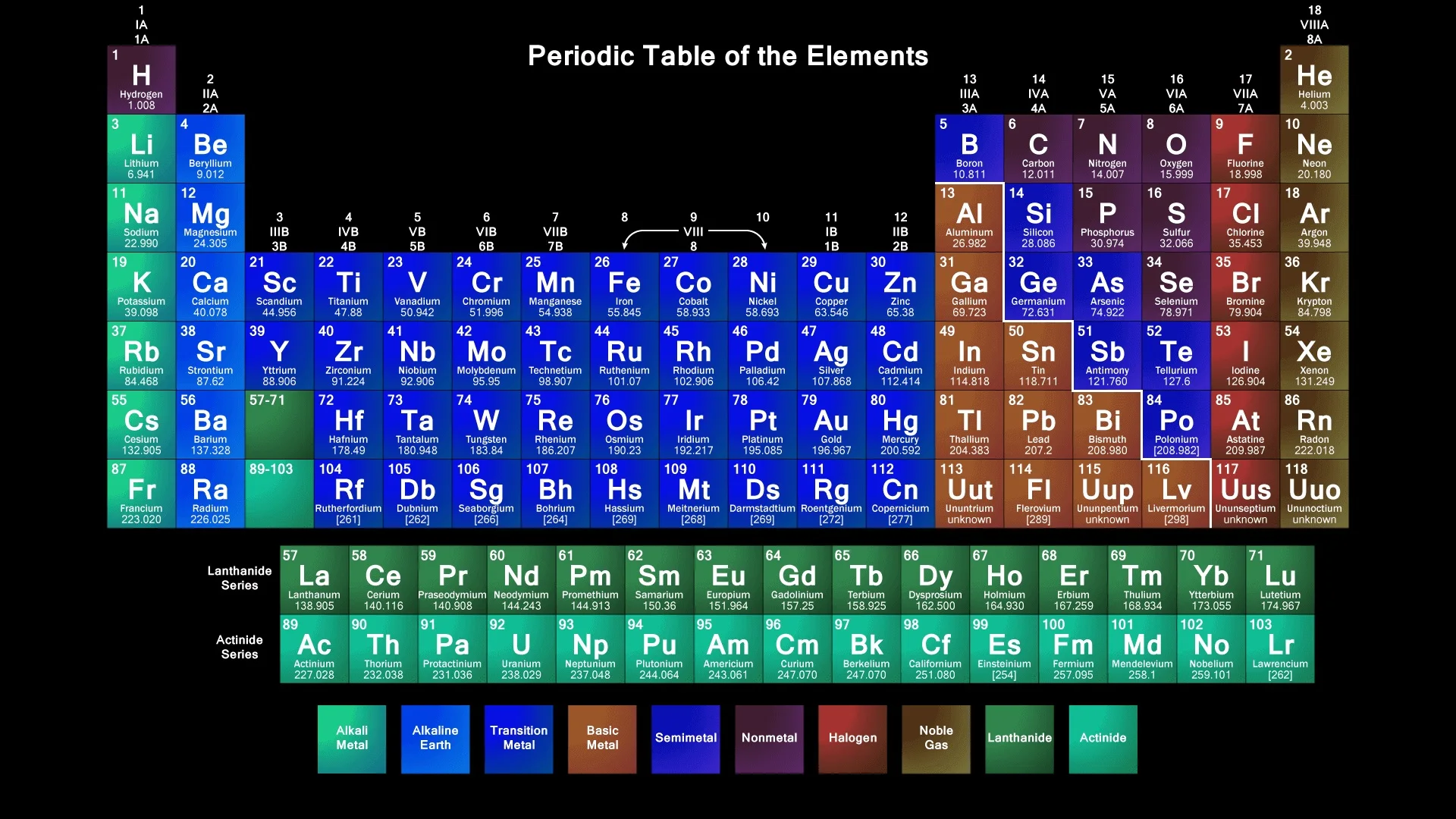
- имеют восемь электронов на внешних оболочках
- электронные конфигурации заканчиваются на ns 2 np 6
- Благородные газы являются наиболее стабильными элементами и не образуют соединений с другими элементами и друг с другом.
- В нормальных условиях существуют в газовой фазе
- Энергии ионизации их выше, чем у других элементов группы в тот же период
Периодическая Таблица Экзамены и Решения задач
© Copyright www.ChemistryTutorials.org, Воспроизведение в электронной и письменной форме категорически запрещено без письменного разрешения www.ChemistryTutorials.org. Политика конфиденциальности
Неорганическая химия для чайников Шпаргалка
Авторы: Майкл Мэтсон и Элвин В. Орбаек и
Обновлено: 25 июля 2021 г.
2
0005Неорганическая химия для чайников
Исследуйте книгу Купить на Amazon
Неорганическая химия имеет дело со всеми элементами периодической таблицы.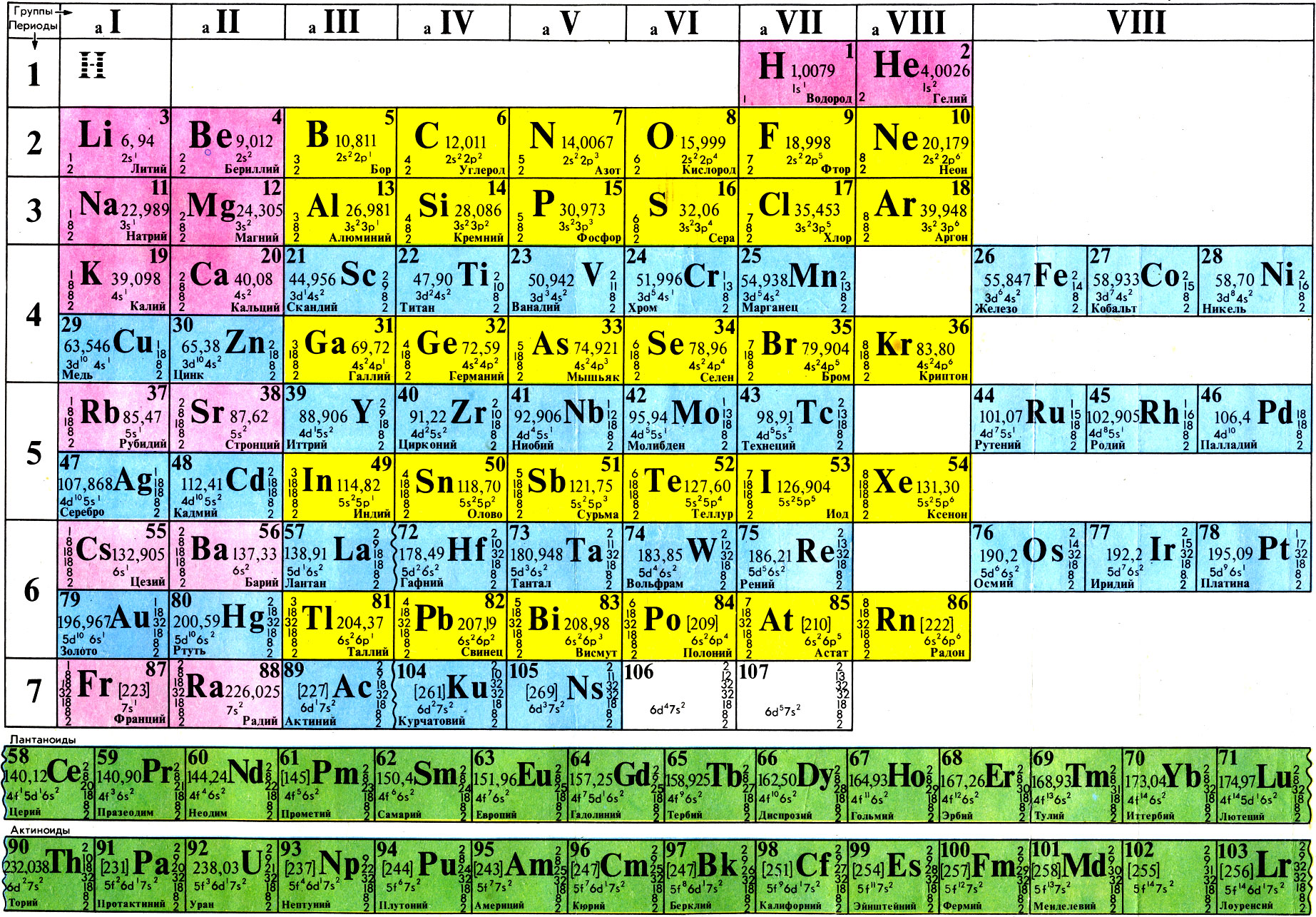 По этой причине это чрезвычайно полезно для понимания окружающего мира — всего, от химии межзвездного пространства, планет и нашей собственной среды здесь, на планете Земля, до того, как Силиконовая долина использует кремний для продвижения информационного века.
По этой причине это чрезвычайно полезно для понимания окружающего мира — всего, от химии межзвездного пространства, планет и нашей собственной среды здесь, на планете Земля, до того, как Силиконовая долина использует кремний для продвижения информационного века.Все это можно понять и объяснить, используя понятия, предлагаемые изучением неорганической химии.
Периодическая таблица
Периодическая таблица похожа на полку, которая используется для хранения всех элементов, встречающихся в природе, и даже тех, которые созданы руками человека.
Это полезно, потому что он упорядочивает каждый элемент в коробку, вроде того, как вы укладываете свою кухню, например, из острых специй, сладких специй, сахара и муки. Поэтому, когда вы хотите приготовить бурю, вы знаете, где взять необходимые ингредиенты; Вы можете думать об элементах периодической таблицы как о списке ингредиентов природы.
Изучение свойств каждого ингредиента и знание того, что происходит, когда они смешиваются в определенных концентрациях при определенных температурах и давлениях, – это то, чем занимается химик-неорганик.
Периодическую таблицу можно использовать для определения следующих свойств материалов:
Атомный номер (Z): Элементы организованы в соответствии с их атомным номером и расположены в порядке от младших атомных номеров к высоким атомным номерам. Сам атомный номер также может многое рассказать об элементе; это может помочь вам понять валентность, координационное число и положение, которое вы ожидаете найти в периодической таблице. Атомные номера находятся в диапазоне от 1 до 118. Атомный номер представляет собой количество протонов, существующих в ядре.
Количество протонов: Протон составляет часть ядра. Это положительно заряженная частица, которая уравновешивается электронами, но вместо этого электроны вращаются вокруг внешней среды. Количество протонов может определить, сколько электронов может вращаться вокруг атома; это, в свою очередь, влияет на реакционную способность и химию атома.
Реактивность: Реакционная способность элементов увеличивается слева направо в периодической таблице.

Электроотрицательность: Это свойство определяет, насколько элемент притягивает электроны. Это также хороший показатель реакционной способности, потому что чем больше элемент притягивает электронов, тем более он реактивен. Самый электроотрицательный элемент в таблице — фтор. Электроотрицательность увеличивается слева направо и уменьшается вниз по таблице.
Масса: Двигаясь слева направо и сверху вниз, вы всегда добавляете больше протонов в атом. Это имеет общую тенденцию делать более поздние элементы тяжелее, чем более ранние. Но вы должны понимать, что это только общая тенденция, и есть некоторые исключения из правил.

Плотность: По мере продвижения вниз по таблице плотность атома увеличивается; при движении слева направо плотность также увеличивается.
При перемещении слева направо по таблице Менделеева, показанной на следующем рисунке, размер атома уменьшается из-за дополнительного заряда ядра из-за добавления нейтронов и протонов в ядро. В результате этого орбитальные электроны более тесно связаны, и энергия ионизации из-за этого увеличивается.
Таблица Менделеева
Современные чудеса неорганической химии
С самого начала человечества материалы играли ключевую роль в нашем существовании. Например, возможность сделать жилье, защищающее от плохой погоды и сырости, безусловно, значительно облегчила жизнь. Но сегодня такие элементарные опоры считаются основой нашей повседневной жизни.
Материалы, которые мы используем сегодня, сильно отличаются от тех, что мы использовали в прошлом. Три элемента — углерод, алюминий и кремний — помогли процессу модернизации. Конечно, свою роль сыграли и многие другие элементы, но эти три бесспорны.
Три элемента — углерод, алюминий и кремний — помогли процессу модернизации. Конечно, свою роль сыграли и многие другие элементы, но эти три бесспорны.
Углерод — универсальный элемент, который можно смешивать со многими другими материалами для создания композитов и сплавов. Углерод — один из самых распространенных элементов периодической таблицы; это основа жизни, основа ДНК и краеугольный камень современного общества.
Все огромные здания, которые вы видите вокруг себя в современных городах, стали возможными благодаря углероду. Металл, армированный и легированный углеродом, часто прочный и легкий, что делает его более простым в использовании и долговечным. Графен, фуллерены и углеродные нанотрубки имеют большие перспективы для будущего использования в качестве добавок для усиления материалов, делая их еще более износостойкими и долговечными, а также снижая вес.
По мере того, как вы узнаете больше об этом элементе, вы можете быть уверены, что найдете его во все большем количестве бытовых приборов по мере того, как мы продвигаемся вперед во времени.
Алюминий , с другой стороны, является довольно новым материалом. Лишь совсем недавно алюминий удалось выделить из его очень стабильной и более распространенной формы оксида. Но с тех пор он стал популярным материалом для ряда приложений.
В отношении космических полетов есть поговорка: если вы хотите сделать космический корабль, вы можете выбрать любой материал, какой захотите, главное, чтобы это был алюминий. Он был опробован и протестирован до такой степени, что его трудно заменить на данном этапе. Но со временем его, скорее всего, заменят композитные материалы, сделанные из углерода.
А пока вам не потребуется много времени, чтобы найти примеры алюминия в своей повседневной жизни — его можно найти в поездах, самолетах и автомобилях, а также в кухнях, коробках для завтрака и во всех видах бытовой техники, потому что это прочный материал. , прочный, легкий и атмосферостойкий материал.
Кремний — наиболее изученный элемент на планете. Благодаря свойствам этого элемента существует многомиллиардная индустрия.
Благодаря свойствам этого элемента существует многомиллиардная индустрия.
Это полупроводник, который при легировании может стать более или менее проводящим. Это свойство дает кремнию возможность использовать его в электронных материалах и устройствах для создания единиц и нулей, которые переводят компьютерный код в электрические импульсы.
В сочетании с тем фактом, что кремний является одним из самых распространенных элементов на планете, он будет использоваться в обозримом будущем, возможно, он никогда не выйдет из моды.
Эпоха информационных технологий могла бы стать возможной без кремния, но, возможно, это заняло бы намного больше времени и не было бы столь заметным сегодня, как сейчас.
Открытие кислорода
Кислород был открыт шведским химиком Карлом Вильгельмом Шееле в 1772 году. Он обнаружил, что при нагревании оксида ртути образуется газ (позднее идентифицированный как кислород). Шееле назвал этот газ «огненным воздухом», потому что он вызывал искры при контакте с раскаленной угольной пылью.
Эта история начинается с Платона и его идей о природе материи. Платон был греческим философом, который предположил, что вся материя состоит из четырех основных элементов — огня, воздуха, земли и воды. Эта грубая идея просуществовала несколько столетий, почти не подвергаясь сомнению, и породила теорию флогистона, что в переводе с древнегреческого означало «сгорание».
Основной постулат теории Флогистона заключался в том, что огонь сам по себе является элементом, поэтому, когда что-то горит, пламя считалось свидетельством того, что огонь (как элемент) отделяется от материи.
Это было распространенное мнение, пока эксперимент Шееле не привел французского химика Антуана-Лорана Лавуазье к доказательству в 1779 году, что при выделении кислорода огонь можно рассматривать как следствие химической реакции, а не как ее элемент. Лавуазье назвал этот элемент кислородом.
Отбросив теорию флогистона, Лавуазье проложил путь современной химии. Впоследствии это привело к драматическим изменениям в науке, и во многом благодаря открытию кислорода.
Открытие гелия
После его открытия французским астрономом Пьером Ж. К. Янссеном в 1868 году считалось, что гелий существует на Солнце, но не здесь, на Земле. Наблюдая солнечное затмение в Индии, Янссен заметил ярко-желтую спектральную линию.
Солнце светит каждый день. Независимо от того, как далеко на севере или юге вы живете на этой планете, солнце все равно может достичь вас. Солнце — огромный огненный шар, находящийся в нескольких миллионах миль от нас. На самом деле это огромный ядерный реактор, наполненный взрывами, которые заставляют энергию выбрасываться и излучаться во всех направлениях.
Свет, который вы видите от солнца, исходит от всех фотонов, испускаемых солнцем в космос, и цвет света можно использовать для определения того, какие элементы присутствуют, благодаря нашему пониманию уровней энергии электронов и атомной спектроскопии. Короче говоря, теория выглядит так: электроны вращаются вокруг атома, который содержит столько электронов, сколько разрешено для этого атома.
Каждый электрон имеет определенный дискретный энергетический уровень, и когда электрон возбужден, вы можете увидеть энергетические уровни, например, с помощью призмы. Призма разделяет белый свет; он замедляет его из-за дифракции, и вы можете получить полный спектр радуги из белого света.
Но у некоторых источников белого света отсутствуют некоторые полосы цветов радуги; это зависит от источника света. Отсутствующие полосы действуют как отпечатки пальцев для химических элементов, и эти «отпечатки пальцев» уникальны, поэтому вы можете использовать их для идентификации элементов, даже если они находятся очень далеко, как звезды и другие планеты. Именно глядя на солнце с такой установки, гелий был впервые обнаружен.
В солнечном свете были полосы, состоящие из неизвестного материала, не похожего ни на что, анализируемое на Земле. Он был назван в честь солнца, Гелиос.
Первооткрыватель Янссен должен был отправиться в Индию, чтобы провести наблюдения во время солнечного затмения в 1868 году.




