Английский торговец старинными
вещами Бэйкер, считавший себя любителем естественных наук, умирая
завещал Королевскому научному обществу (английская Академия наук)
свое состояние. В завещании Бэйкера было записано следующее условие:
проценты с денежной суммы, хранящейся в банке, ежегодно выплачивать
тому, кто прочитает, в Королевском обществе доклад о каком-либо
выдающемся открытии. Подобного рода доклады о выдающихся открытиях
в области науки стали называться докладами имени Бэйкера. 19 ноября 1807 г. в Лондоне
Гэмфри Дэви выступил с докладом и сообщил о вещах, невероятных для
того времени. Опытным путем он провел разложение “нелетучих щелочей”
(продуктов взаимодействия углекислых солей натрия и калия
с гашеной известью), при ведшее “к выделению новых и необычайных
тел, лежащих в основе этих нелетучих щелочей”. Было установлено,
что “нелетучие щелочи” представляют собой не простые вещества, как
долгое время считали раньше, а сложные соединения. В 1810 г. Гильберт вместо названия “потассий” ввел название “калий” (от арабского слова “алкали” -щелочь). Шведский химик Я. Берцелиус в 1811 г. заменил “содий” названием “натрий”, произведя его от арабского слова “натрон” – сода. Русский химик Г. И. Гесс ввел в 1831 г. эти названия в русскую химическую литературу. Между прочим, названия “потассий” и “содий” сохранились в некоторых странах (Англия, США, Италия и др.) до настоящего времени. Дэви показал слушателям открытые
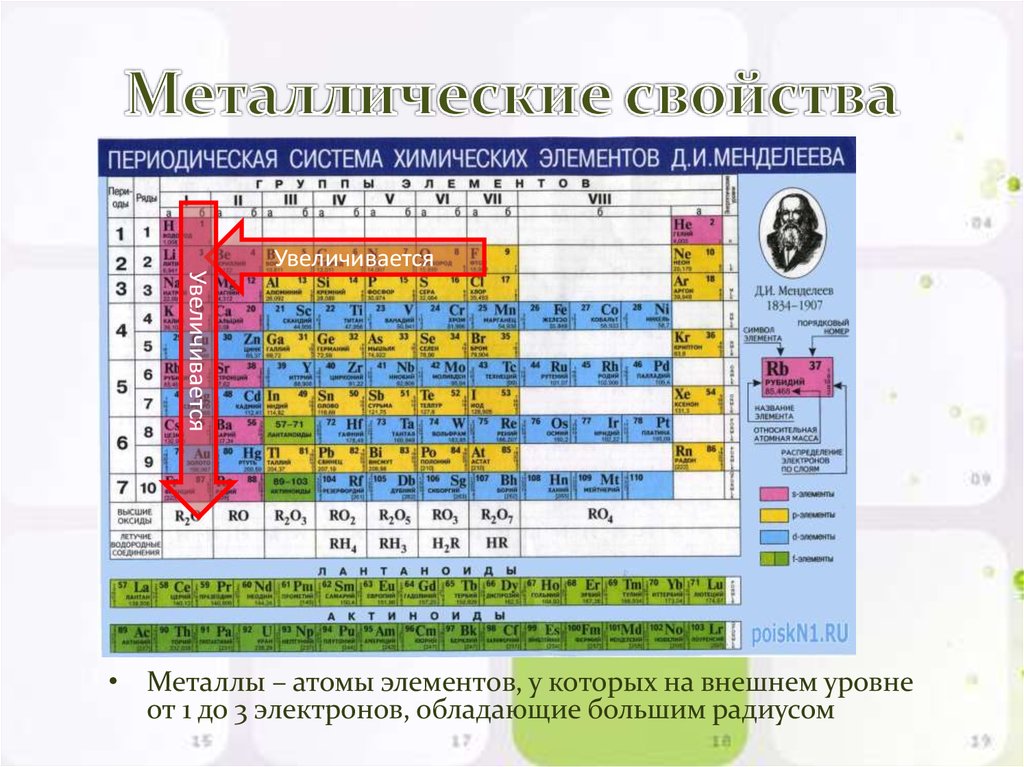
им металлы и продемонстрировал их химические свойства. Натрий – исключительно активный
металл. Вот почему, являясь одним из распространенных элементов
и составляя 2 % в общем числе атомов земной коры, он не встречается
в свободном состоянии. В год каждый человек с пищей
потребляет от 8 до 10 кг соли. Недаром говорят: “Чтобы узнать человека,
надо с ним пуд соли съесть”. Оказывается это не так уж много и по
весу и по времени: за год вдвоем и будет съеден пуд (16 кг) соли. Наибольшее количество натрия связано в соединении с хлором. Соль, или, как ее называют химики, хлористый натрий, образует мощные отложения. Огромные количества соли содержат в себе воды морей и океанов. Солью, извлеченной из морских вод, можно было бы засыпать всю сушу земного шара слоем в … 130 м. Так велико количество соли! В заключение еще несколько слов о самом натрии. Мы привыкли к тому, что металлы плавятся при высоких температурах. Попробуйте-ка, например расплавить булавку или иголку! А вот металл натрий имеет температуру плавления всего только около 98°С. Если бы натрий не был таким активным, его можно было бы плавить в кипящей воде. Натрий находит применение
в авиамоторах для отвода тепла от клапанов. С помощью натрия на расстоянии 113 тыс. км от Земли была создана искусственная комета выбрасыванием в мировое пространство натриевых паров с борта космической ракеты, впервые в истории человечества созданной руками советских людей и запущенной в просторы вселенной 2 января 1959 г. Вторая искусственная комета была создана во время полета второй космической ракеты на Луну. Выброшенное из ракеты натриевое облако достигло 600 км в диаметре за 4 мин. Свечение искусственной кометы можно было наблюдать через специальные фильтры. Оно позволило уточнить координаты ракеты и определить возможность расхождения расчетных данных с действительной траекторией.
|
Урок 25.
 Соли – HIMI4KA
Соли – HIMI4KAАрхив уроков › Химия 8 класс
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
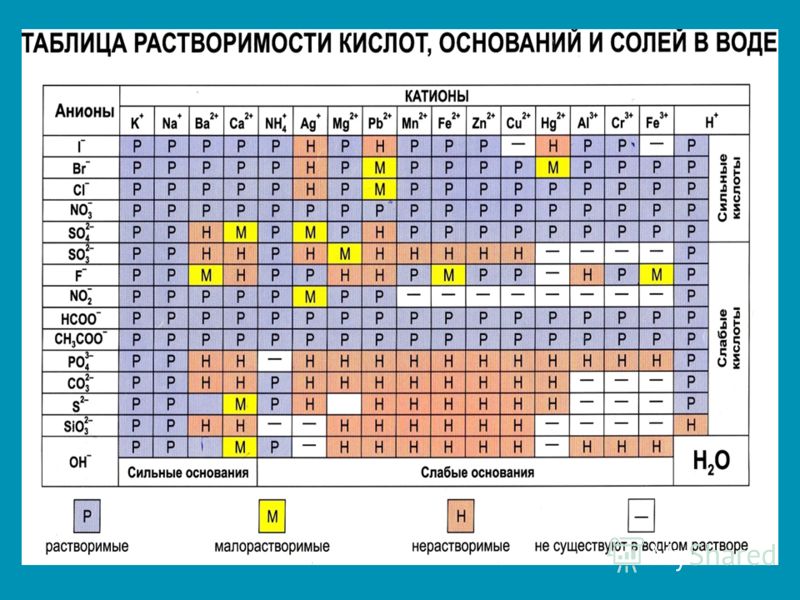
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
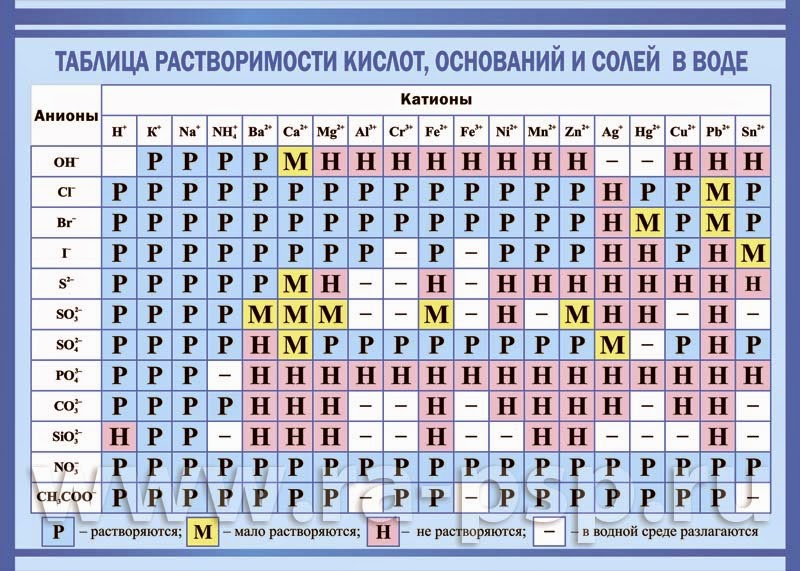
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.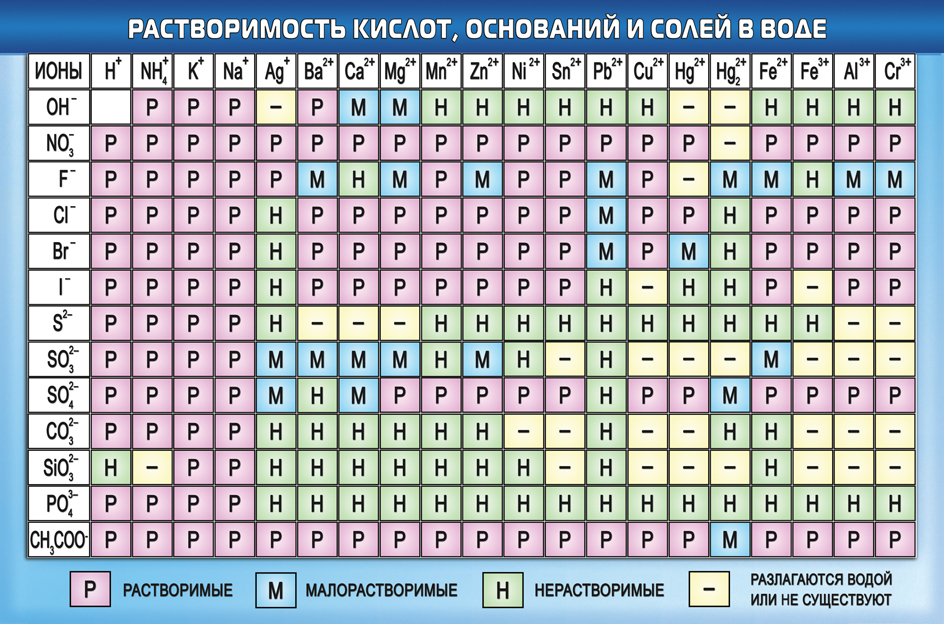
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 26. Получение водорода и его применение →
← Урок 24. Выделение водорода в реакциях кислот с металлами
5.1: Сахар и соль – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47472
Хлорид натрия, также известный как поваренная соль, представляет собой ионное соединение с химической формулой \(\ce{NaCl}\), представляющее соотношение ионов натрия и хлорида 1:1. Он широко используется в качестве приправы и консерванта пищевых продуктов. Соль можно получить, соединив вместе два очень реакционноспособных элемента: металлический натрий (\(\ce{Na (s)}\) и газообразный хлор (\(\ce{Cl2 (g)}\).0024
Он широко используется в качестве приправы и консерванта пищевых продуктов. Соль можно получить, соединив вместе два очень реакционноспособных элемента: металлический натрий (\(\ce{Na (s)}\) и газообразный хлор (\(\ce{Cl2 (g)}\).0024
\[ \ce{2Na (т) + Cl2(г) \rightarrow 2NaCl (т)} \label{eq1} \]
Элемент натрия (рис. \(\PageIndex{1a}\)) является очень активным металлом; при возможности он будет реагировать с потом на ваших руках и образовывать гидроксид натрия, который является очень едким веществом. Элемент хлор (рис. \(\PageIndex{1b}\)) представляет собой бледно-желтый едкий газ, который нельзя вдыхать из-за его ядовитой природы. Однако соедините эти два опасных вещества, и они вступят в реакцию, образуя ионное соединение хлорида натрия (рис. \(\PageIndex{1c}\)), известное просто как соль. 9{−}}\) ионы необходимы для правильного функционирования нервов и дыхания. Оба этих иона поставляются солью. Вкус соли — один из основных вкусов; соль, вероятно, самый древний известный ароматизатор и один из немногих камней, которые мы едим. Ясно, что когда элементарный натрий и хлор объединяются (уравнение \ref{eq1}), полученный продукт соли имеет радикально разные свойства (как физические, так и химические). За этой реакцией интересно наблюдать (видео \(\PageIndex{1}\)).
Ясно, что когда элементарный натрий и хлор объединяются (уравнение \ref{eq1}), полученный продукт соли имеет радикально разные свойства (как физические, так и химические). За этой реакцией интересно наблюдать (видео \(\PageIndex{1}\)).
Видео \(\PageIndex{1}\): Изготовление поваренной соли с использованием металлического натрия и газообразного хлора
Другим соединением является сахар, который является общим названием сладких растворимых углеводов, многие из которых используются в пищевых продуктах. Сахар имеет химическую формулу \(\ce{C12h32O11}\) и состоит из элементов, отличных от соли: углерода, водорода и кислорода. Хотя сахар качественно напоминает поваренную соль (которую часто путают на кухне), они имеют совершенно разные физические и химические свойства. Существуют различные виды сахара, полученные из разных источников. Хотя сахар состоит из углерода, водорода и кислорода, его значительно сложнее синтезировать из составляющих его элементов, чем поваренную соль (уравнение \ref{eq1}). Однако термическое разложение значительно проще и может быть представлено как дегидратация сахарозы до чистого углерода и водяного пара в уравнении \ref{eq2} и продемонстрировано в видео \(\PageIndex{2}\).
Хотя сахар состоит из углерода, водорода и кислорода, его значительно сложнее синтезировать из составляющих его элементов, чем поваренную соль (уравнение \ref{eq1}). Однако термическое разложение значительно проще и может быть представлено как дегидратация сахарозы до чистого углерода и водяного пара в уравнении \ref{eq2} и продемонстрировано в видео \(\PageIndex{2}\).
\[\ce{C12h32O11 (т) + тепло → 12C (т) + 11h3O (г)} \label{eq2} \]
Видео \(\PageIndex{2}\): Научный эксперимент на кухне показывает, что происходит с молекулами сахара при нагревании. Эксперимент не подвел!
Как и соль, сахар имеет совершенно иные свойства (как физические, так и химические), чем составляющие его элементы. Это различие в свойствах составляющих элементов и соединений является центральной чертой химических реакций.
- Википедия
5. 1: Sugar and Salt распространяется по лицензии CK-12, автором, ремиксом и/или куратором выступили Мариса Альвиар-Агнью и Генри Агнью.
1: Sugar and Salt распространяется по лицензии CK-12, автором, ремиксом и/или куратором выступили Мариса Альвиар-Агнью и Генри Агнью.
ЛИЦЕНЗИЯ ПОД
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СК-12
- Показать страницу TOC
- № на стр.
- Теги
- автор@Генри Эгнью
- автор@Мариса Альвиар-Агнью
- источник@https://www.
 ck12.org/c/chemistry/
ck12.org/c/chemistry/
Общая информация и повседневные товары
Когда мы начинаем наше исследование третьего периода (строки) периодической таблицы, мы находим элемент натрия (Na). Находясь в первой колонке, натрий входит в семейство щелочных металлов вместе с калием (К) и литием (Li). Большая слава натрия заключается в том, что он является одним из двух элементов в вашей поваренной соли. При соединении с хлором (Cl) два элемента образуют хлорид натрия (NaCl). Натрий также используется в качестве соли во многих удобрениях.
Несмотря на то, что люди использовали натрий в течение тысяч лет, он не был выделен до 1807 года химиком по имени Дэви. Когда вы очищаете натрий, вы на самом деле получаете серебристо-блестящий металл, довольно мягкий и ковкий. Натрий — один из немногих металлов, которые плавают в воде (H 2 O). Атомная масса натрия меньше атомной массы воды, равной 18 а.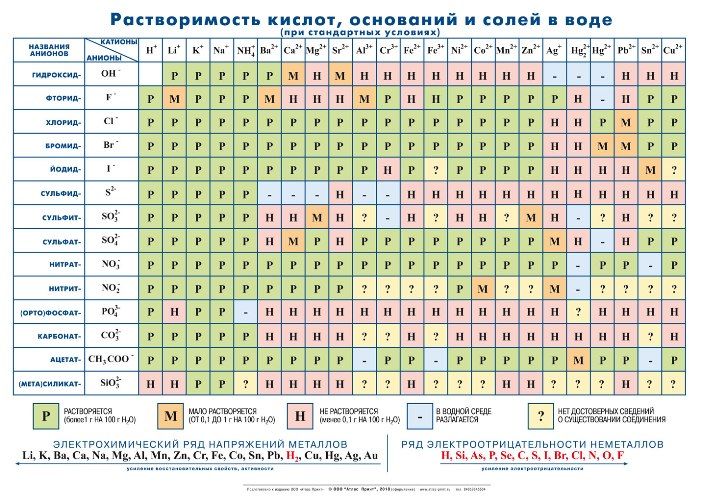 е.м.
е.м.
| Производство стекла Натрий используется для производства стекла. Вы знаете, что кремний составляет большую часть стекла. В процессе изготовления стекла также часто используется натрий. | |
| Производство бумаги В следующий раз, когда вы будете писать на листе бумаги, знайте, что для изготовления этой бумаги используется натрий. Бумага изначально из деревьев. Прежде чем он попадет к вам, для его приготовления используется много химикатов. Натрий является одним из используемых элементов. | |
| Поваренная соль Когда вы садитесь за обеденный стол, ищите солонку. Натрий и хлор соединяются, образуя соль.  |

 Чтение
Бэйкеровского доклада ученые считают для себя за честь, но, конечно,
не потому, что чтецу выплачивают проценты с завещанной суммы. Нет.
Дело не в этом. В условии завещания сказано: “доклад о выдающемся
открытии” – вот что ценит ученый, чтец Бэйкеровского доклада – признание
значимости его открытия. Бэйкеровские лекции читаются в Англии и
ныне.
Чтение
Бэйкеровского доклада ученые считают для себя за честь, но, конечно,
не потому, что чтецу выплачивают проценты с завещанной суммы. Нет.
Дело не в этом. В условии завещания сказано: “доклад о выдающемся
открытии” – вот что ценит ученый, чтец Бэйкеровского доклада – признание
значимости его открытия. Бэйкеровские лекции читаются в Англии и
ныне.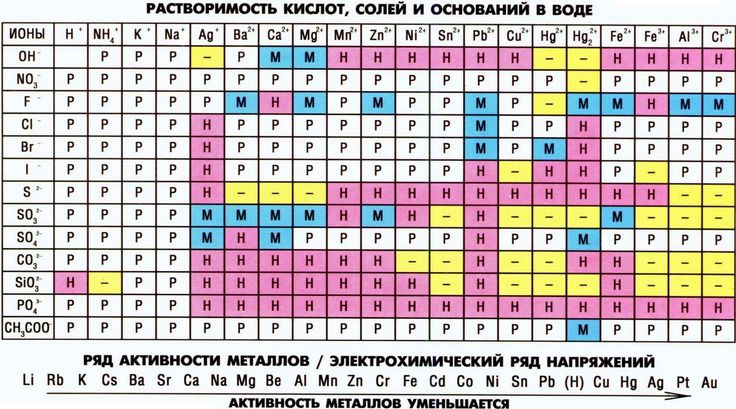
 Соединения же его весьма разнообразны, н
некоторые из них широко распространены. К их числу относится знакомая
всем поваренная соль. Соль состоит из натрия и хлора.
Натрий, как уже указывалось, один из активных металлов, хлор
является одним из активных неметаллов. В свободном состоянии оба
эти элемента обладают губительным действием на организм животных
и человека. Однако в соединении они дают соль, без которой невозможна
жизнь человека и животных. Соль необходима организму для обеспечения
важнейших физиологических процессов. Этим объясняется естественная
потребность человека и животных в соли. В крови соль создает необходимые
условия для существования красных кровяных телец, в мышцах сохраняет
способность к возбудимости, в сердце определяет его ритм, в желудке
образует соляную кислоту, без которой невозможно переваривание и
усвоение пищи.
Соединения же его весьма разнообразны, н
некоторые из них широко распространены. К их числу относится знакомая
всем поваренная соль. Соль состоит из натрия и хлора.
Натрий, как уже указывалось, один из активных металлов, хлор
является одним из активных неметаллов. В свободном состоянии оба
эти элемента обладают губительным действием на организм животных
и человека. Однако в соединении они дают соль, без которой невозможна
жизнь человека и животных. Соль необходима организму для обеспечения
важнейших физиологических процессов. Этим объясняется естественная
потребность человека и животных в соли. В крови соль создает необходимые
условия для существования красных кровяных телец, в мышцах сохраняет
способность к возбудимости, в сердце определяет его ритм, в желудке
образует соляную кислоту, без которой невозможно переваривание и
усвоение пищи.
 В качестве теплоносителя
металлический натрий используется в некоторых атомных реакторах.
В производстве искусственного каучука натрий играет роль волшебного
ускорителя реакции, соединяющего молекулы бутадиена в продукт, не
уступающий по свойствам лучшим сортам естественного каучука. Натрий
применяется в специальных газосветных лампах. Натриевая лампа наполнена
неоном и содержи г небольшое количество металлического натрия. При
включении лампы разряд начинается в неоне.
Тепло, выделяющееся при разряде, испаряет натрий, и, спустя некоторое
время, красный свет неона сменяется
желтым – натрия. Натриевые лампы являются мощными источниками света
с высоким коэффициентом полезного действия (в лабораторных условиях
до 70 %). Высокая экономичность натриевых ламп дала возможность
использовать их для освещения автострад, вокзалов, пристаней и т.
В качестве теплоносителя
металлический натрий используется в некоторых атомных реакторах.
В производстве искусственного каучука натрий играет роль волшебного
ускорителя реакции, соединяющего молекулы бутадиена в продукт, не
уступающий по свойствам лучшим сортам естественного каучука. Натрий
применяется в специальных газосветных лампах. Натриевая лампа наполнена
неоном и содержи г небольшое количество металлического натрия. При
включении лампы разряд начинается в неоне.
Тепло, выделяющееся при разряде, испаряет натрий, и, спустя некоторое
время, красный свет неона сменяется
желтым – натрия. Натриевые лампы являются мощными источниками света
с высоким коэффициентом полезного действия (в лабораторных условиях
до 70 %). Высокая экономичность натриевых ламп дала возможность
использовать их для освещения автострад, вокзалов, пристаней и т.
 ck12.org/c/chemistry/
ck12.org/c/chemistry/