СТАРЕЙШАЯ ТАБЛИЦА МЕНДЕЛЕЕВА НАХОДИТСЯ В РОССИИ, А НЕ В ШОТЛАНДИИ
Самая старая таблица Менделеева находится в России, а не в Шотландии, как считалось ранее. Обнаруженная таблица была выпущена в 1876 году по личному указанию Дмитрия Ивановича Менделеева. Старейшая таблица находится в одном из корпусов Санкт-Петербургского государственного университета на Васильевском острове. Этот корпус был построен по инициативе Дмитрия Ивановича, а таблица расположена на стене его крупнейшей аудитории. Обнаруженная в Шотландии настенная таблица, считавшаяся старейшей, была напечатана в 1885 году. В этом году также исполняется 150 лет с открытия периодического закона Дмитрием Менделеевым, в связи с чем решением Генеральной ассамблеи ООН 2019 год провозглашён Международным годом Периодической таблицы химических элементов.
Дмитрий Иванович Менделеев открыл периодический закон в 1869 году. Однако первое графическое изображение закона в виде таблицы появилось лишь спустя 7 лет, то есть в 1876 году.
На старейшей таблице отображены менее 70 химических элементов, однако существование некоторых тогда неизвестных исходят из периодического закона. Так, элемент между кальцием и титаном пропущен, однако указана его атомная масса — 44. Таким образом, Дмитрий Иванович Менделеев не только упорядочил известные на тот момент химические элементы, но и предсказал существование других и их химические свойства. На сегодняшний момент уже известно 118 химических элементов.
В январе 2019 года пресс-служба Сент-Эндрюсского университета (Шотландия) объявила, что в их архивах хранится древнейший экземпляр настенной таблицы Менделеева. Этот вариант периодической таблицы снабжён подписями на немецком языке. Предположительно, эта таблица была произведена в 1885 году в Вене. Ещё один из старейших вариантов периодической таблицы был выпущен в трёхтомнике Дмитрия Менделеева «Основы химии» 1871 года издания.
2019 год провозглашен Генеральной ассамблеей ООН Международным годом Периодической таблицы химических элементов. Это масштабное событие посвящено 150-летию открытия Периодического закона химических элементов великим русским ученым Д. И. Менделеевым. Проведение Международного года Периодической таблицы химических элементов имеет особое значение для России, так как будет способствовать международному признанию заслуг великого русского ученого Д. И. Менделеева, а также укреплению престижа и популяризации отечественной науки.
Старейшая настенная таблица Менделеева • Аркадий Курамшин • Научная картинка дня на «Элементах» • Химия
Переда вами, вероятно, самая старая из сохранившихся настенных таблиц Менделеева, изданных типографским способом. Она была отпечатана в конце XIX века в Вене и вместе с другими таблицами из этого тиража использовалась в качестве демонстрационного материала для занятий со студентами. Таблица была обнаружена в 2014 году в Сент-Эндрюсском университете и отреставрирована, однако массовый интерес к находке возник только спустя пять лет, когда 2019 год был объявлен годом Периодической таблицы химических элементов.
История находки старейшей аудиторной Периодической системы напоминает сценарий фильма, про который хочется сказать: «Нет, так не бывает, сюжет притянут за уши». В 2014 году сотрудникам химического факультета Сент-Эндрюсского университета (это самый старый шотландский университет и третий в Великобритании) было поручено навести порядок на складе, расположенном под одной из крупных лекционных аудиторий. Распоряжение об уборке появилось после визита пожарной инспекции: по мнению проверяющих, ситуация на складе никоим образом не соответствовала требованиям пожарной безопасности. Дело в том, что с момента постройки нового корпуса университета в 1968 году на складе в случайном порядке копились реактивы, оборудование и принадлежности для лабораторных и демонстрационных экспериментов. Чтобы навести порядок среди всего этого богатства и решиться наконец выкинуть то, что уже точно не будет использоваться, ушло несколько месяцев.
Ближе к окончанию этой эпической уборки участников ждал приятный сюрприз: в глубине склада была найдена стопка наглядных учебных материалов — таблицы и картинки, которые, вероятно, перекочевали на склад из здания, где до 1968 года располагался химический факультет.
Возраст таблицы и плохие условия хранения сделали свое печальное дело: бумага, на которой были отпечатаны символы химических элементов, стала хрупкой и могла рассыпаться от малейшего прикосновения. Этому способствовала тяжелая основа таблицы из льняной ткани, а также то, что таблица была свернута в рулон. Сент-Эндрюсский университет получил на реставрацию таблицы грант от Британского фонда реставрации рукописей. Ее восстановлением занялся известный в Британии реставратор предметов живописи Ричард Хокс.
Сначала реставраторы удалили с поверхности таблицы грязь и пыль, а также те участки бумаги, которые не подлежали восстановлению. Затем бумажный плакат отделили от льняной основы, промыли в деионизированной воде при нейтральных значениях pH. После промывки водой таблицу обработали раствором гидроксида кальция Ca(OH) На завершающем этапе реставрации утраченные участки бумаги были восстановлены с помощью японской бумаги васи (см. Бруссонетия бумажная и Paper mulberry) и крахмальной пасты.
На завершающем этапе реставрации утраченные участки бумаги были восстановлены с помощью японской бумаги васи (см. Бруссонетия бумажная и Paper mulberry) и крахмальной пасты.
После реставрации таблица заняла почетное место среди раритетных экспонатов библиотеки университета, а ее копию выставили на всеобщее обозрение на химическом факультете Сент-Эндрюсского университета.
Таблица подписана по-немецки: если переводить дословно — «Периодическая зависимость элементов Менделеева». Она похожа на вторую версию Периодической системы, предложенную Дмитрием Ивановичем Менделеевым в 1871 году в книге «Основы химии», но не полностью ей идентична. В свою таблицу 1871 года Менделеев внес несколько еще не открытых химических элементов, предсказав их атомные массы и свойства, и в версии самого Дмитрия Ивановича на месте предсказанных элементов стояли только их атомные веса. В Сент-Эндрюсской таблице же два элемента — скандий (Sc) и галлий (Ga) уже отпечатаны как обнаруженные.
Наиболее известна тройка предсказанных и открытых при жизни Менделеева элементов — экабор (скандий, открыт в 1879 году), экаалюминий (галлий, открыт в 1875 году) и экакремний (германий, открыт в 1886 году). Именно после того, как эти элементы были открыты и их свойства практически совпали с менделеевскими предсказаниями, о Периодической системе перестали говорить как просто о способе систематизации химических элементов. Периодический закон был признан фундаментальным естественнонаучным законом. Исполнение предсказаний Менделеева привело к тому, что Дмитрий Иванович перестал быть просто одним из трех систематизаторов химических элементов и создателей таблицы наряду с Юлиусом Лотаром Мейером и Джоном Александром Ньюлендсом. Открытие галлия, скандия и германия превратило Менделеева в создателя основного закона химии и самого известного русского химика во мире.
Таблица Менделеева, в которой были расставлены химические элементы, имела определенные черты, свойственные и для таблицы Ньюлендса, и для таблицы Мейера. Во всех трех таблицах элементы были расположены в порядке увеличения атомной массы, во всех трех таблицах оставались пустые ячейки, зарезервированные под элементы, которые еще не были открыты. Но, в отличие от коллег, Дмитрий Иванович не просто оставил в своей версии таблицы пустые ячейки — он предсказал атомные массы и свойства еще не открытых элементов. И если первое сообщение о периодическом законе было сделано Менделеевым в марте 1869 года, днем его рождения как фундаментального химического закона скорее стоит считать 1875 год, который показал, что определенные экспериментальным путем свойства открытого галлия близки предсказанным с помощью периодического закона свойствам экаалюминия.
Во всех трех таблицах элементы были расположены в порядке увеличения атомной массы, во всех трех таблицах оставались пустые ячейки, зарезервированные под элементы, которые еще не были открыты. Но, в отличие от коллег, Дмитрий Иванович не просто оставил в своей версии таблицы пустые ячейки — он предсказал атомные массы и свойства еще не открытых элементов. И если первое сообщение о периодическом законе было сделано Менделеевым в марте 1869 года, днем его рождения как фундаментального химического закона скорее стоит считать 1875 год, который показал, что определенные экспериментальным путем свойства открытого галлия близки предсказанным с помощью периодического закона свойствам экаалюминия.
В 1882 году Лондонское королевское общество присудило Менделееву и главному его конкуренту в приоритете открытия периодической системы Лотару Мейеру свои высшие награды — золотые медали Дэви — «

В таблице, обнаруженной в Сент-Эндрюсском университете, скандий и галлий уже приведены как открытые, но германий (клетка без символа элемента, но с атомным весом 72, еще пуста). Это позволяет говорить о том, что таблица отпечатана в период с 1879 по 1886 год (между открытием скандия и германия). Заметим, что еще до открытия германия надпись на немецком языке уже однозначно приписывает авторство систематизации Менделееву. Типографские отметки в левой нижней части таблицы — «
Маленькое расследование позволило сотрудникам Сент-Эндрюсского университета с большой вероятностью предположить, что найденная таблица появилась в их университете в XIX веке благодаря профессору Томасу Перди (Thomas Purdie), работавшему там с 1884-го по 1908 годы. В архивах университета были найдены детали закупки профессором Перди таблицы у поставщика научных материалов в Бонне. Покупка таблицы вместе с почтовой доставкой обошлась университету не очень дорого — в три марки (эта сумма сегодня эквивалентна примерно 1500 рублям). Собственно говоря, ситуация вполне обычная: профессор, начинающий исследовательскую и преподавательскую работу на новом месте, старается обустроить его, приобретая самое новое для своего времени исследовательское оборудование и самые свежие учебно-методические материалы.
В архивах университета были найдены детали закупки профессором Перди таблицы у поставщика научных материалов в Бонне. Покупка таблицы вместе с почтовой доставкой обошлась университету не очень дорого — в три марки (эта сумма сегодня эквивалентна примерно 1500 рублям). Собственно говоря, ситуация вполне обычная: профессор, начинающий исследовательскую и преподавательскую работу на новом месте, старается обустроить его, приобретая самое новое для своего времени исследовательское оборудование и самые свежие учебно-методические материалы.
С помощью раритетной таблицы Менделеева можно совершить путешествие во времени. Хотя основные ее очертания напоминают классическую короткопериодную версию Периодической системы, она заметно отличается от нее. Во-первых, некоторые атомные массы, приводимые в таблице, отличаются от привычных для нас значений (например, атомная масса 240 для урана, 125 — для теллура). Уточненные значения атомных масс, которые куда ближе к массам, опубликованным в современных таблицах (238,03 для урана и 127,6 для теллура), были получены немного позже — американским химиком Теодором Уильямом Ричардсом, которому присудили в 1914 году Нобелевскую премию по химии именно за «..jpg) ..точное определение атомных масс большого числа химических элементов…».
..точное определение атомных масс большого числа химических элементов…».
Во-вторых, в таблице полностью отсутствуют инертные газы, что, впрочем, и неудивительно. Сообщение об открытии первого инертного газа — аргона — было сделано в 1894 году, через восемь лет после открытия германия. Чуть позже были открыты и другие инертные газы, и из-за их инертности (нульвалентности) Менделеев предложил поместить их в нулевую группу Периодической системы, что и было сделано в последнем прижизненном издании «Основ химии». В привычной для нас восьмой группе инертные газы оказались уже после работ Генри Мозли и Нильса Бора, объяснивших причины периодичности свойств химических элементов повторяемостью электронной конфигурации. Отдельные семейства лантаноидов и актиноидов тоже появились уже в ХХ веке, а в обнаруженной таблице известные на то время лантаноиды и актиноиды (в таблице их два — уран и торий) распределены по группам.
Ну и, наконец, «пасхальное яйцо» для самых внимательных.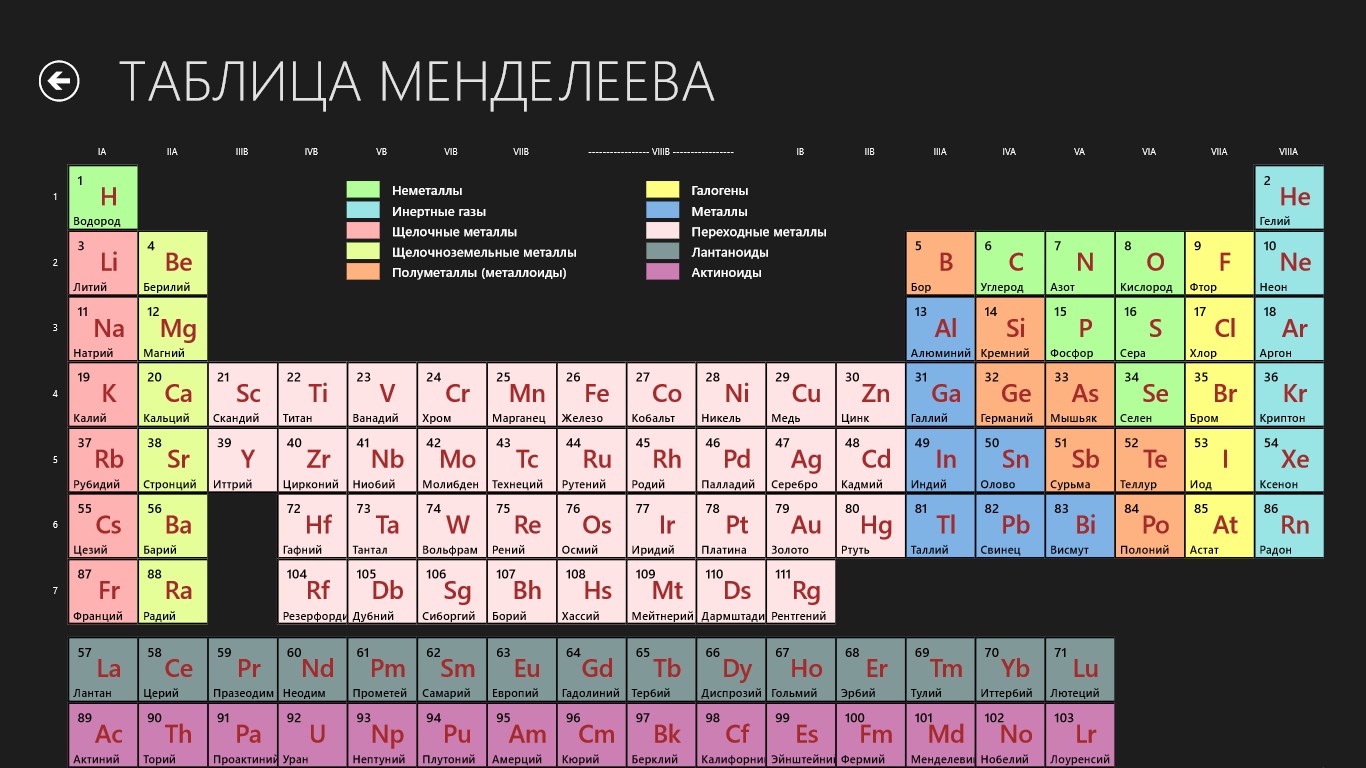 В шестой группе, восьмом ряду Сент-Эндрюсской таблицы помещен символ Di с атомной массой 145. Это не устаревший символ диспрозия, как кто-то мог подумать, а «элемент» дидим (Didymium) — смесь трудноразделяемых элементов неодима и празеодима, которая с 1839-го по 1885 год считалась индивидуальным химическим элементом. То, что «дидим» представляет собой два элемента, австрийский химик Карл Ауэр фон Вельсбах показал только в 1885 году. Кстати, это обстоятельство позволяет сузить временной интервал, в который таблица была отпечатана, до периода 1879–1885 годов.
В шестой группе, восьмом ряду Сент-Эндрюсской таблицы помещен символ Di с атомной массой 145. Это не устаревший символ диспрозия, как кто-то мог подумать, а «элемент» дидим (Didymium) — смесь трудноразделяемых элементов неодима и празеодима, которая с 1839-го по 1885 год считалась индивидуальным химическим элементом. То, что «дидим» представляет собой два элемента, австрийский химик Карл Ауэр фон Вельсбах показал только в 1885 году. Кстати, это обстоятельство позволяет сузить временной интервал, в который таблица была отпечатана, до периода 1879–1885 годов.
В заключение хотелось бы пожелать коллегам быть внимательнее и осторожнее, наводя порядок в помещениях, где долго копятся предметы, ставшие ненужными. Как показывает пример химиков Сент-Эндрюсского университета, во время такой уборки можно найти настоящий раритет.
Фото с сайта gsy.bailiwickexpress.com.
Аркадий Курамшин
В Шотландии нашли самую старую в мире таблицу Менделеева
- Николай Воронин
- Корреспондент по вопросам науки и технологий
Автор фото, University of St Andrews
Подпись к фото,Таблицу обнаружили, перебирая старые вещи в химлаборатории
В ходе генеральной уборки в химической лаборатории Университета Сент-Эндрюс в Шотландии был обнаружен настенный печатный экземпляр периодической таблицы Менделеева, который считается самым старым из всех сохранившихся в мире на сегодняшний день.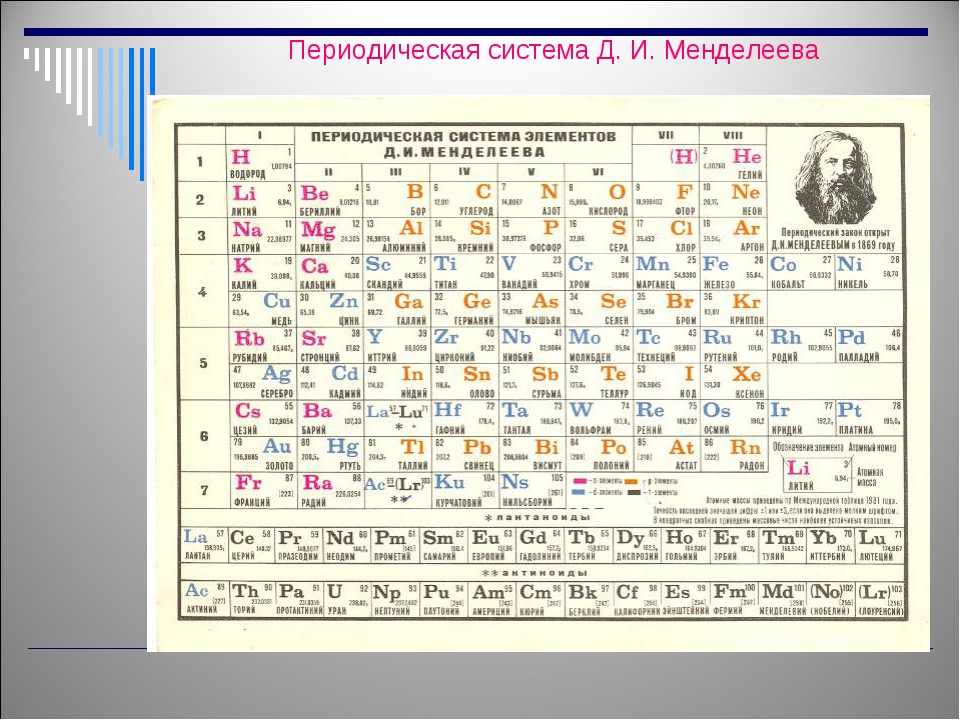
Учебное пособие для студентов, составленное на немецком языке, было отпечатано в научной типографии, работавшей в Вене между 1875 и 1888 гг.
На тот момент были открыты еще далеко не все химические элементы, и в таблице немало пропусков. Например, бросается в глаза отсутствие уже второго элемента, гелия (он был обнаружен на Земле лишь в 1895 году).
Химические элементы в таблице даже не пронумерованы, хотя на сегодняшний день атомный номер – это одна из основных характеристик, определяющая количество протонов в ядре и его заряд.
Сам русский химик Дмитрий Менделеев впервые представил свою периодическую таблицу в 1869 году.
Пустые клетки
Сент-эндрюсский экземпляр таблицы Менделеева был найден еще в 2014 году, однако с тех пор ученые пытались сохранить изрядно потрепанный временем документ и установить его точный возраст.
По словам профессора Калифорнийского университета Эрика Сцерри, скорее всего, таблица была напечатана между 1879 и 1886 гг.
Более точной датировке помогли пропуски или частично заполненные клетки таблицы. Например, там присутствуют элементы галлий и скандий, открытые в 1875 и 1879 гг. соответственно.
А вот на месте германия – расположенного в пятом ряду между галлием (Ga) и мышьяком (As) – стоит нарисованный от руки вопросительный знак, хотя его атомная масса указана верно.
Существование этого элемента Менделеев предсказал в 1870 году, однако открыт он был лишь полтора десятилетия спустя, в 1886-м.
Колонка инертных газов отсутствует полностью. Все они были открыты значительно позже.
Автор фото, Heritage Images/Getty
Подпись к фото,Дмитрий Менделеев представил свою периодическую таблицу в 1869 году
Автор фото, University of St Andrews/PA
Подпись к фото,Чтобы сохранить потрепанный временем документ, пришлось приложить немало усилий
По словам представителей руководства шотландского университета, если где-то и существует более старый настенный экземпляр таблицы, им об этом ничего не известно.
По словам профессора Дэвида О’Хэйгена, в прошлом возглавлявшего в Сент-Эндрюсе химический факультет, таблица останется в стенах университета и будет доступна для исследователей.
“У нас в университете запланирован целый ряд мероприятий, поскольку ООН признала 2019 год Международным годом периодической таблицы – ведь в этом году мы отмечаем 150-летие ее создания Дмитрием Менделеевым”, – добавляет профессор.
Точная копия самой старой таблицы уже выставлена в здании химического факультета, однако сам оригинальный документ хранится в условиях, близких к музейным, чтобы обеспечить его сохранность.
Примечание: Текст заметки был изменен 21 января. Мы добавили уточнение, что найденный экземпляр таблицы – самое старое настенное учебное пособие для студентов.
Ученый случайно нашел самую старую версию периодической таблицы Менделеева
Порой можно обнаружить по-настоящему удивительные и невероятно ценные вещи, проводя генеральную уборку помещения, где эта самая уборка никогда толком и не проводилась. Не верите? Просто спросите доктора химии Алана Айткена из Сент-Эндрюсского университета (Шотландия), который в еще в 2014 году потратил целый месяц своей жизни на то, чтобы привести в порядок складское помещение факультета химии, которое должным образом не убиралось еще с момента его открытия в 1968 году. Среди всего беспорядка, который накапливался там многие годы, Айткен обнаружил кучу свернутых учебных таблиц. Каково же было удивление ученого, когда среди всего этого хлама перед его взором предстал уникальный реликт научной истории.
Не верите? Просто спросите доктора химии Алана Айткена из Сент-Эндрюсского университета (Шотландия), который в еще в 2014 году потратил целый месяц своей жизни на то, чтобы привести в порядок складское помещение факультета химии, которое должным образом не убиралось еще с момента его открытия в 1968 году. Среди всего беспорядка, который накапливался там многие годы, Айткен обнаружил кучу свернутых учебных таблиц. Каково же было удивление ученого, когда среди всего этого хлама перед его взором предстал уникальный реликт научной истории.
Когда доктор Айткен развернул одну из свернутых таблиц, он обнаружил перед собой одну из самых ранних версий периодической системы химических элементов. В верхней части таблицы располагалась надпись на немецком: «Periodische Gesetzmässigkeit der Elemente nach Mendeleieff», что означает «Периодическая система элементов по Менделееву». Поскольку таблица пролежала в этой подсобке много лет, она стал очень хрупкой. В тот момент, когда Айткен ее первый раз развернул, от бумаги оторвалось несколько кусочков, но основной текст был не затронут. Плохое состояние бумаги дало ученому понять, что перед ним находится настоящий артефакт.
Плохое состояние бумаги дало ученому понять, что перед ним находится настоящий артефакт.
Детальный анализ таблицы и ее истории подтвердил эту догадку. Да, таблица оказалась очень старой. Согласно данным университета, ее создали в 1885 году. Дальнейшее исследование показало, что ее можно официально считать самой старой из известных учебных таблиц периодической системы химических элементов.
Российский ученый Дмитрий Иванович Менделеев опубликовал свою первую схему периодической таблицы в 1869 году в статье «Соотношение свойств с атомным весом элементов» (в журнале Русского химического общества). В 1871 году таблица была дополнена. Обнаруженная таблица в шотландском университете очень похожа на дополненную версию, но с некоторыми важными отличиями.
«Обнаруженный в Сент-Эндрюсском университете вариант является ранним образцом. Таблица имеет аннотации на немецком языке, а в нижнем левом углу подпись — «Verlag v. Lenoir & Forster, Wien», — указывающую на печатника, работавшего в Венне с 1875 по 1888 годы.
Другая подпись – «Lith. von Ant. Hartinger & Sohn, Wien» — указывает на литографа, который, как выяснилось, умер в 1890 году. В ходе работы по установлению происхождения таблицы университет обратился за помощью и консультацией ко многим международным экспертам. Проведенное исследование указывает на то, что более ранней редакции этой таблицы, кажется, не существует. Профессор Эрик Шерри, эксперт в области истории периодической таблицы элементов из Калифорнийского университета в Лос-Анджелесе считает, что этот вариант таблицы был составлен между 1879 и 1886 годами. На такой вывод ему указали сами элементы, которые в ней отражены. Например, галлий и скандий, открытые в 1875 и 1885 годах, в ней присутствуют, а германий, который открыли лишь в 1886 году – отсутствует», — сообщается в пресс-релизе Сент-Эндрюсского университета.
Последующий анализ старых финансовых отчетов университета показал, что Томас Пурди, профессор химии, работавший в университете с 1884 по 1909 годы, приобрел таблицу через немецкий научный каталог в октябре 1888 года. А сама таблица была изготовлена в Венне в 1885 году.
А сама таблица была изготовлена в Венне в 1885 году.
После установления даты изготовления и места производства таблицы руководство Сент-Эндрюсского университета прияло решение о сохранении этого удивительного реликта научной истории для потомков. Для этого университет обратился к своей команде реставраторов. Необходимое финансирование было получено от шотландского Национального фонда сохранения рукописей.
Соблюдая максимальную осторожность, чтобы еще сильнее не повредить бумагу, команда реставраторов кисточками отчистила таблицу он скопившейся за долгие годы забвения грязи и пыли. Бумага, на которой была отпечена таблица, также осторожно была откреплена от тяжелой льняной подложки. В работе также использовалась деионизированная вода, с помощью которой ученые восстановили цвет текста. А с помощью японской бумаги kozo и пасты из пшеничного крахмала специалисты смогли восстановить разрывы в бумаге.
После завершения реставрации сотрудники университета создали полноразмерную реплику таблицы элементов, которая сейчас и демонстрируется в Сент-Эндрюсском университете.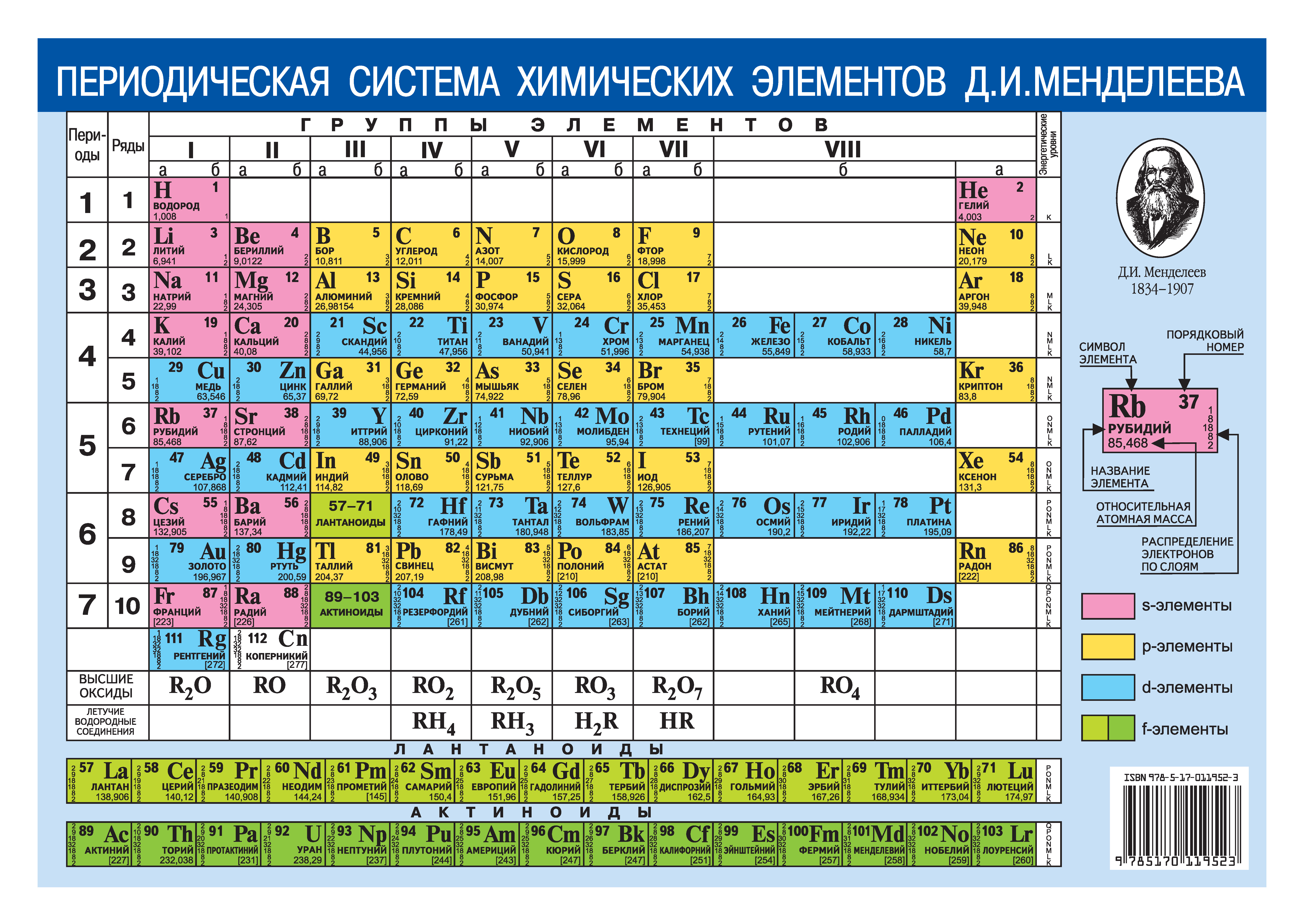 Оригинал таблицы поместили на безопасное хранение в помещение с контролируемой температурой и влажностью.
Оригинал таблицы поместили на безопасное хранение в помещение с контролируемой температурой и влажностью.
Обсудить уникальную находку можно в нашем Telegram-чате.
Где искать самую старую таблицу Менделеева?
Об этом в рамках открытой лекции «150 лет Периодической системе химических элементов Д. И. Менделеева. История создания» школьникам рассказал Евгений Олегович Калинин, старший преподаватель СПбГУ (кафедра радиохимии). «Данный демонстрационный вариант был изготовлен по указанию самого Дмитрия Ивановича в 1876 году. Недавно средства массовой информации писали о якобы найденной в Сент-Эндрюсском университете самой старой в мире Периодической таблице химических элементов. Так вот, это не так, — рассказывает Евгений Калинин. — Как выяснили эксперты, настенная таблица, обнаруженная в Шотландии, была напечатана в 1880-х годах. И хотя это, безусловно, интересная находка, по-настоящему ценный демонстрационный вариант Периодической системы находится в СПбГУ, в Большой химической аудитории».
Евгений Калинин обратил внимание школьников на разницу в датах между формулированием Периодического закона в 1869 году и созданием его графического образа в виде таблицы в 1876 году. Что происходило в течение семи лет? Почему первый публичный вариант таблицы не был создан раньше?
Когда Дмитрий Иванович сформулировал Периодическую систему, он еще и сам не был уверен в том, в каком окончательном виде следует ее подавать. На осмысление этого вопроса у него ушло несколько лет.
Старший преподаватель СПбГУ Евгений Калинин
Представленный в аудитории СПбГУ вариант не соответствует тому, к которому мы все привыкли. По словам химика, в этой таблице, например, не хватает восьмой (VIII) группы химических элементов — благородных газов. «Они к моменту создания данного варианта таблицы еще не были открыты, и, честно сказать, ни сам Менделеев, ни его современники, конечно, не предполагали, что благородные газы вообще существуют в природе. Поэтому для них места в этом варианте не отведено», — поясняет Евгений Калинин.
Поэтому для них места в этом варианте не отведено», — поясняет Евгений Калинин.
Нет в этой таблице и некоторых химических элементов. На их местах стоят прочерки. Эти элементы тогда еще не были открыты, но Дмитрий Иванович Менделеев был убежден, что они должны быть. «На это указывает и тот факт, что в некоторых клеточках нет символа химических элементов, но указан атомный вес. Например, рядом с Са стоит прочерк и цифра 44. Химического элемента нет, но четко указана, какая у него должна быть масса», — объясняет Евгений Калинин.
Менделеев не просто разложил химические элементы по полочкам в зависимости от их атомного веса и химических свойств. Он еще и предсказал, что нужно работать не только с известными на тот момент элементами, но и вести поиск новых.
Старший преподаватель СПбГУ Евгений Калинин
Лекция прошла в аудитории, которая носит название Большой химической. Она находится в здании, построенном в 1894 году по инициативе Дмитрия Ивановича Менделеева. По словам Евгения Калинина, в конце XIX века ежегодно химию в Университете изучали почти 400 человек. При этом больших аудиторий и лабораторий для занятий не было. Поэтому Дмитрий Иванович в 1880-х годах предложил построить специальный лабораторный корпус для преподавания химии в Университете. Правда, сам Менделеев в нем лекции уже не читал, но председательствовал на заседаниях Русского физико-химического общества.
По словам Евгения Калинина, в конце XIX века ежегодно химию в Университете изучали почти 400 человек. При этом больших аудиторий и лабораторий для занятий не было. Поэтому Дмитрий Иванович в 1880-х годах предложил построить специальный лабораторный корпус для преподавания химии в Университете. Правда, сам Менделеев в нем лекции уже не читал, но председательствовал на заседаниях Русского физико-химического общества.
Открытая лекция для школьников прошла в рамках цикла мероприятий, посвященных 150-летию открытия Периодического закона и 185-летию со дня рождения Дмитрия Ивановича Менделеева. На ней присутствовали учащиеся Волховской средней общеобразовательной школы № 1 и лицея № 554 Приморского района Санкт-Петербурга. Следующая лекция состоится 22 февраля.
Найдена самая старая таблица Менделеева?
Как умалчивание фактов поднимает просмотры, но искажает смысл.
На днях прошла новость о том, что в Сент-Эндрюсском университете в Шотландии обнаружили «самую старую таблицу Менделеева», по крайней мере, так об этом писало множество интернет-изданий. Кажется удивительным стечением обстоятельств, что в год, объявленный годом периодической таблицы Менделеева, в одном из старейших университетов Европы обнаруживают такую уникальную вещь. Но разве нигде в мире, особенно на родине великого учёного, не осталось более старых вариантов таблицы? Да и действительно ли это такое чудесное совпадение или СМИ что-то недоговаривают? Давайте разберём этот рояль в кустах.
Кажется удивительным стечением обстоятельств, что в год, объявленный годом периодической таблицы Менделеева, в одном из старейших университетов Европы обнаруживают такую уникальную вещь. Но разве нигде в мире, особенно на родине великого учёного, не осталось более старых вариантов таблицы? Да и действительно ли это такое чудесное совпадение или СМИ что-то недоговаривают? Давайте разберём этот рояль в кустах.
‹
›
Начнём с того, что же обнаружили шотландские химики на пыльных полках. А нашли они настенную таблицу Менделеева – такие таблицы обычно висят в химических классах. Таблица и вправду очень старая – как выяснили исследователи, она была напечатана в 1885 году в венской типографии, и спустя три года была куплена за три немецкие золотые марки профессором университета для обустройства учебной аудитории. Однако неправильно говорить, что это «самая старая таблица», по крайней мере, она может быть самой старой из сохранившихся настенных таблиц. Если же говорить просто о печатной версии таблицы, то её можно найти хотя бы в трёхтомнике «Основы химии» выпуска 1871 года, экземпляры которого прекрасно дожили до наших дней.
Если же говорить просто о печатной версии таблицы, то её можно найти хотя бы в трёхтомнике «Основы химии» выпуска 1871 года, экземпляры которого прекрасно дожили до наших дней.
Продолжим наше мини-расследование. Если мы откроем оригинальное сообщение пресс-службы Сент-Эндрюсского университета, то узнаем, что таблица была найдена ещё летом 2014 года, о чём там написано прямым текстом. Поскольку она была в весьма плачевном состоянии, то её отреставрировали и отправили на хранение в специальных условиях, а на стене химического факультета повесили фотокопию оригинала. Так бы и прошло это событие незамеченным для мировой общественности, если бы ООН не объявило 2019-й год Международным годом периодической таблицы Менделеева. Поэтому Сент-Эндрюсский университет воспользовался отличным инфоповодом и выпустил сообщение, что у них на факультете хранится самый старый вариант настенной таблицы. А дальше мы можем наблюдать классический «испорченный телефон»: при переводе оригинала сознательно или несознательно упускается пара существенных моментов, потом текст переписывается уже на основе переведённых источников, и вот мы имеем новость про обнаружение самой старой таблицы.
И напоследок пара интересных моментов, связанных с самой, ставшей знаменитой, таблице из Сент-Эндрюса. Сразу видно, насколько она отличается от таблиц из современных учебников. В ней очень много пропусков для элементов с большими порядковыми номерами, например, для группы редкоземельных металлов. Большинство из них ещё не было открыто на момент выхода таблицы. Ещё одну отсылку к возрасту таблицы дают элементы: скандий, галлий и германий. Когда Менделеев представил на суд учёной публике свой периодический закон, эта троица была ещё не известна химикам. Однако Дмитрий Иванович был настолько уверен в правильности установленного им закона, что оставил в своей таблице пустые места для элементов, которые, по его мнению, должны были быть открыты в будущем, что собственно и произошло. В 1879 году был найден скандий, в 1875 году – галлий, а в 1886 году – германий. Первые два элемента мы как раз можем видеть в сент-эндрюсской таблице, а вот германия в ней нет – вместо него указана лишь предсказанная атомная масса.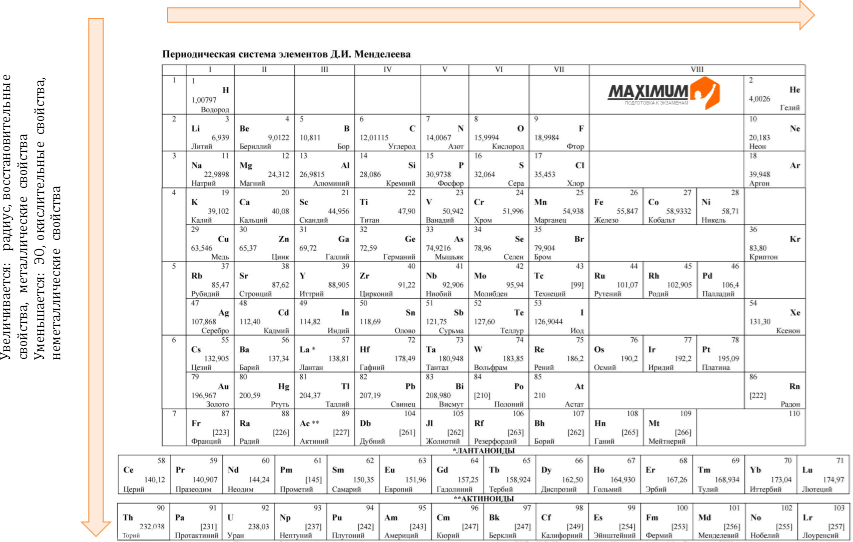 Что, собственно, и не удивительно, таблица была напечатана за год до открытия германия. Внимательный взгляд может выявить ещё много мелких расхождений между старой и современными таблицами, однако главное не в этом: несмотря на недостаток знания об элементах и их свойствах, Менделеев смог сформулировать фундаментальный закон природы, предвосхитивший достижения ядерной физики и квантовой химии.
Что, собственно, и не удивительно, таблица была напечатана за год до открытия германия. Внимательный взгляд может выявить ещё много мелких расхождений между старой и современными таблицами, однако главное не в этом: несмотря на недостаток знания об элементах и их свойствах, Менделеев смог сформулировать фундаментальный закон природы, предвосхитивший достижения ядерной физики и квантовой химии.
По материалам University of St Andrews
“Борода Менделеева”: где кончается периодическая таблица элементов
https://ria.ru/20190201/1550209465.html
“Борода Менделеева”: где кончается периодическая таблица элементов
“Борода Менделеева”: где кончается периодическая таблица элементов – РИА Новости, 01.02.2019
“Борода Менделеева”: где кончается периодическая таблица элементов
Периодическая таблица постоянно расширяется — новые элементы в ней появляются в среднем каждые четыре года. Есть ли этому предел? Юрий Оганесян, “мистер 118-й. .. РИА Новости, 01.02.2019
.. РИА Новости, 01.02.2019
2019-02-01T08:00
2019-02-01T08:00
2019-02-01T08:00
физика
наука
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn25.img.ria.ru/images/154879/00/1548790023_0:196:1036:779_1920x0_80_0_0_753034389718d1a071029647fede9470.jpg
МОСКВА, 1 фев — РИА Новости. Периодическая таблица постоянно расширяется — новые элементы в ней появляются в среднем каждые четыре года. Есть ли этому предел? Юрий Оганесян, “мистер 118-й элемент”, и его коллеги рассказывают, как Россия стала лидером в области синтеза элементов и на какие вопросы ученые пока не могут ответить.Международный год периодической таблицыВ этом году Россия и весь мир отмечают 150-летие одного из важнейших открытий, которое совершил российский ученый. Полтора века назад Дмитрий Иванович Менделеев представил первую версию периодической таблицы и закона, послужившего основой современной химии.В честь юбилея Генеральная ассамблея ООН единогласно приняла решение о проведении Международного года Периодической системы элементов Менделеева. Программа официально стартовала на прошлой неделе в штаб-квартире ЮНЕСКО в Париже.В торжественной церемонии приняли участие более 1300 человек из 80 стран мира, в том числе крупные ученые — Бен Феринга, лауреат Нобелевской премии по химии 2016 года, сэр Мартин Полякофф, один из самых известных популяризаторов науки и специалистов в области зеленой химии, а также десятки молодых исследователей разных национальностей.Помимо ученых, выступили главы важнейших научных ведомств и представители общественности — министр науки и высшего образования России Михаил Котюков, президент РАН Александр Сергеев, его французский коллега Пьер Корволь и генеральный директор ЮНЕСКО Одри Азуле. Генеральный партнер мероприятия — благотворительный фонд Алишера Усманова “Искусство, наука и спорт”.Одним из героев церемонии стал Юрий Оганесян — научный руководитель лаборатории ядерных реакций Объединенного института ядерных исследований в Дубне, где были открыты последние пять элементов периодической таблицы, в том числе и элемент-118, оганесон.
Программа официально стартовала на прошлой неделе в штаб-квартире ЮНЕСКО в Париже.В торжественной церемонии приняли участие более 1300 человек из 80 стран мира, в том числе крупные ученые — Бен Феринга, лауреат Нобелевской премии по химии 2016 года, сэр Мартин Полякофф, один из самых известных популяризаторов науки и специалистов в области зеленой химии, а также десятки молодых исследователей разных национальностей.Помимо ученых, выступили главы важнейших научных ведомств и представители общественности — министр науки и высшего образования России Михаил Котюков, президент РАН Александр Сергеев, его французский коллега Пьер Корволь и генеральный директор ЮНЕСКО Одри Азуле. Генеральный партнер мероприятия — благотворительный фонд Алишера Усманова “Искусство, наука и спорт”.Одним из героев церемонии стал Юрий Оганесян — научный руководитель лаборатории ядерных реакций Объединенного института ядерных исследований в Дубне, где были открыты последние пять элементов периодической таблицы, в том числе и элемент-118, оганесон. Ученый объяснил РИА Новости, зачем в России планируют создать еще более тяжелые ядра и к чему это может привести.Грезы алхимиковИдея превращения свинца в золото и трансмутации одних элементов в другие, отмечает он, оставалась несбыточной мечтой как для средневековых алхимиков, так и для серьезных ученых. Все изменилось только после того, как Эрнст Резерфорд, Георгий Гамов и прочие основоположники современной физики поняли, как устроен атом и его ядро.”Когда вы хотите что-то изменить, чего так жаждали алхимики, нужно понимать, что именно вам нужно поменять. Они грели свинец, проводили бесчисленное множество опытов, но ничего не добились, так как необходимо работать с ядром, а не электронными оболочками атомов. Резерфорд первым показал, что для этого требуется ядерная реакция”, — продолжает Оганесян.В данном случае российские ученые и их зарубежные партнеры и бывшие конкуренты, по словам академика, не воспроизводили природные процессы. Они сделали нечто другое, сталкивая ядра определенных легких элементов с мишенями из сверхтяжелых, но относительно стабильных изотопов.
Ученый объяснил РИА Новости, зачем в России планируют создать еще более тяжелые ядра и к чему это может привести.Грезы алхимиковИдея превращения свинца в золото и трансмутации одних элементов в другие, отмечает он, оставалась несбыточной мечтой как для средневековых алхимиков, так и для серьезных ученых. Все изменилось только после того, как Эрнст Резерфорд, Георгий Гамов и прочие основоположники современной физики поняли, как устроен атом и его ядро.”Когда вы хотите что-то изменить, чего так жаждали алхимики, нужно понимать, что именно вам нужно поменять. Они грели свинец, проводили бесчисленное множество опытов, но ничего не добились, так как необходимо работать с ядром, а не электронными оболочками атомов. Резерфорд первым показал, что для этого требуется ядерная реакция”, — продолжает Оганесян.В данном случае российские ученые и их зарубежные партнеры и бывшие конкуренты, по словам академика, не воспроизводили природные процессы. Они сделали нечто другое, сталкивая ядра определенных легких элементов с мишенями из сверхтяжелых, но относительно стабильных изотопов. В природе ядерный синтез выглядит иначе — сталкиваются протоны и нейтроны, возникает ядро, вокруг которого выстраиваются электроны. Все эти реакции происходят внутри чрезвычайно горячей плазмы, в них участвуют огромные массы материи — в лаборатории это осуществить нельзя. “По сути, мы берем готовые ядра и сталкиваем их, надеясь получить более тяжелые элементы”, — поясняет ученый.В отличие от “исследований” алхимиков, как пояснил научный секретарь лаборатории Александр Карпов, выбор ученых был далеко не случаен. Успехи российских исследователей и их зарубежных партнеров в удлинении “бороды” таблицы Менделеева напрямую связаны с решениями, принятыми еще в тяжелые для российской науки 1990-е годы.”Наша главная задача и идея — подобраться как можно ближе к предсказанному “островку стабильности” тяжелых элементов. Поэтому мы не просто пытаемся создавать новые ядра, а стремимся к определенным комбинациям в числе протонов и нейтронов. Как правило, чем больше нейтронов в атомах, тем стабильнее результат их слияния”, — уточняет физик.
В природе ядерный синтез выглядит иначе — сталкиваются протоны и нейтроны, возникает ядро, вокруг которого выстраиваются электроны. Все эти реакции происходят внутри чрезвычайно горячей плазмы, в них участвуют огромные массы материи — в лаборатории это осуществить нельзя. “По сути, мы берем готовые ядра и сталкиваем их, надеясь получить более тяжелые элементы”, — поясняет ученый.В отличие от “исследований” алхимиков, как пояснил научный секретарь лаборатории Александр Карпов, выбор ученых был далеко не случаен. Успехи российских исследователей и их зарубежных партнеров в удлинении “бороды” таблицы Менделеева напрямую связаны с решениями, принятыми еще в тяжелые для российской науки 1990-е годы.”Наша главная задача и идея — подобраться как можно ближе к предсказанному “островку стабильности” тяжелых элементов. Поэтому мы не просто пытаемся создавать новые ядра, а стремимся к определенным комбинациям в числе протонов и нейтронов. Как правило, чем больше нейтронов в атомах, тем стабильнее результат их слияния”, — уточняет физик. И российские, и зарубежные ученые достаточно давно знают, что в природе не существует стабильных или относительно долгоживущих ядер, комбинация которых гарантированно помогла бы создать сверхстабильные элементы, находящиеся в центре этого острова и содержащие в себе около 114 протонов и 184 нейтрона.”Проблемы вызывает именно второе число — природа так устроена, что чем тяжелее элемент, тем больше в нем нейтронов. Пока у нас нет ни мишеней, ни легких ионов с нужным числом частиц для выхода в эту зону. Тем не менее мне не кажется, что это нерешаемая проблема, нам просто нужно больше времени”, — рассказывает Карпов.Частичный выход из этой ситуации, по его словам, российские физики и зарубежные коллеги нашли в стабильном, но крайне редком изотопе кальция, чьи атомы содержат 20 протонов и 28 нейтронов. Оба эти числа считаются “магическими” в мире ядерной физики, что обусловливает ряд необычных и уникальных свойств этой версии металла.”Кальций-48 присутствует в любом кусочке мела или извести, однако выделить его крайне сложно и дорого, намного сложнее, чем работать с изотопами урана.
И российские, и зарубежные ученые достаточно давно знают, что в природе не существует стабильных или относительно долгоживущих ядер, комбинация которых гарантированно помогла бы создать сверхстабильные элементы, находящиеся в центре этого острова и содержащие в себе около 114 протонов и 184 нейтрона.”Проблемы вызывает именно второе число — природа так устроена, что чем тяжелее элемент, тем больше в нем нейтронов. Пока у нас нет ни мишеней, ни легких ионов с нужным числом частиц для выхода в эту зону. Тем не менее мне не кажется, что это нерешаемая проблема, нам просто нужно больше времени”, — рассказывает Карпов.Частичный выход из этой ситуации, по его словам, российские физики и зарубежные коллеги нашли в стабильном, но крайне редком изотопе кальция, чьи атомы содержат 20 протонов и 28 нейтронов. Оба эти числа считаются “магическими” в мире ядерной физики, что обусловливает ряд необычных и уникальных свойств этой версии металла.”Кальций-48 присутствует в любом кусочке мела или извести, однако выделить его крайне сложно и дорого, намного сложнее, чем работать с изотопами урана.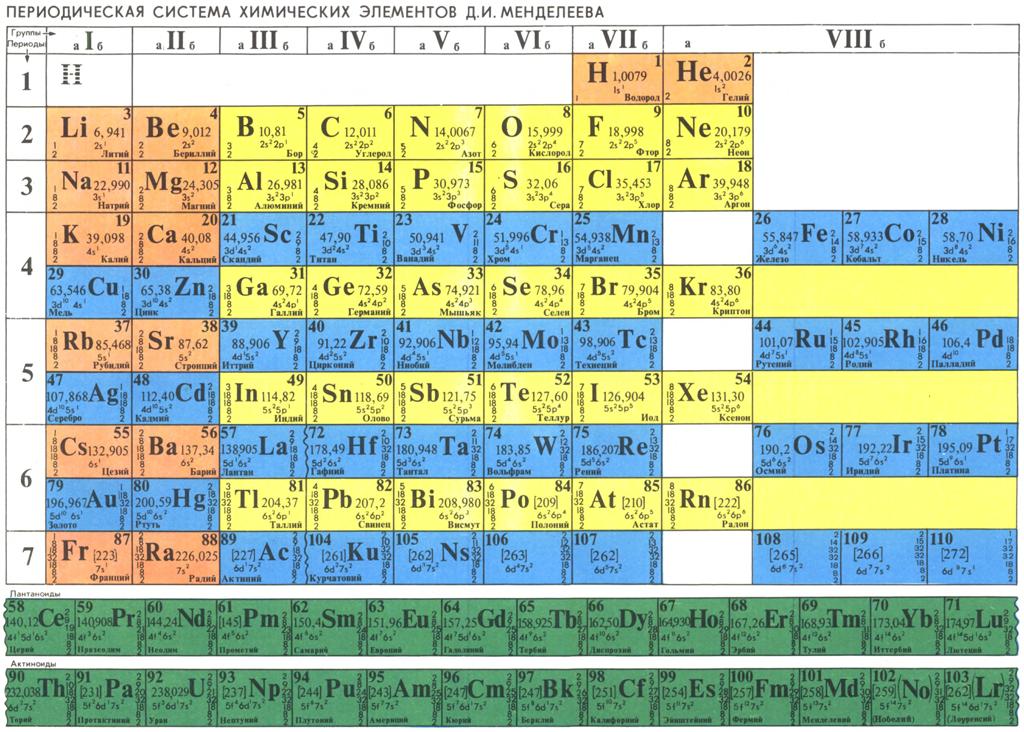 Производят его в одном месте в мире — на российском предприятии “Электрохимприбор” в Свердловской области. За год специалисты получают 10-12 граммов, что стоит примерно 2,5 миллиона долларов”, — продолжает физик.Многие экспериментаторы, добавляет ученый, пытались применять кальций-48 для подобных целей и в прошлом, но быстро отказывались от этой идеи из-за несовершенства измерительных приборов или же по другим причинам.Все ядра в одной корзинеЭто стало возможным благодаря тому, что Оганесян и его единомышленники направили все имевшиеся у ОИЯИ средства и ресурсы на работу с пучками ионов кальция и мишенями из берклия, калифорния и некоторых других тяжелых элементов, почти способных “доплыть” до островка стабильности при столкновении с кальцием-48.”Нашим успехам предшествовала масса неудач — подобные опыты проводили и в Германии, и у нас в Дубне. Ничего не выходило, причем не только из-за отсутствия технологий, позволяющих делать максимально яркие и плотные пучки, но и из-за непонимания того, как реакция происходит.
Производят его в одном месте в мире — на российском предприятии “Электрохимприбор” в Свердловской области. За год специалисты получают 10-12 граммов, что стоит примерно 2,5 миллиона долларов”, — продолжает физик.Многие экспериментаторы, добавляет ученый, пытались применять кальций-48 для подобных целей и в прошлом, но быстро отказывались от этой идеи из-за несовершенства измерительных приборов или же по другим причинам.Все ядра в одной корзинеЭто стало возможным благодаря тому, что Оганесян и его единомышленники направили все имевшиеся у ОИЯИ средства и ресурсы на работу с пучками ионов кальция и мишенями из берклия, калифорния и некоторых других тяжелых элементов, почти способных “доплыть” до островка стабильности при столкновении с кальцием-48.”Нашим успехам предшествовала масса неудач — подобные опыты проводили и в Германии, и у нас в Дубне. Ничего не выходило, причем не только из-за отсутствия технологий, позволяющих делать максимально яркие и плотные пучки, но и из-за непонимания того, как реакция происходит. В конце 1990 все сошлось в точку, и с 1999 года мы получили пять новых элементов, а также право присвоить им имена”, — заключает научный секретарь.Упорство российских ученых и их рисковое желание “положить все ядра в одну корзину” помогло вырваться вперед и стать признанными лидерами в этой области, после того как все остальные ведущие лаборатории мира забраковали кальций-48 и прекратили с ним экспериментировать.Первые результаты опытов в Дубне встретили со скепсисом — коллеги просто не верили в то, что такие опыты в принципе возможны. Проверки в других лабораториях достаточно быстро развеяли все сомнения, таблица Менделеева пополнилась, а Оганесяна и его команду каждый год называют в числе главных претендентов на Нобелевскую премию по химии и физике.Кроме того, успехи российских ученых убедили американских коллег, работающих в ведущих ускорительных центрах и лабораториях Нового Света, что с ОИЯИ нужно не конкурировать, а тесно сотрудничать. Открытие флеровия, оганесона, теннессина и прочих сверхтяжелых элементов — результат сотрудничества, а не предмет споров между ОИЯИ и учеными из США.
В конце 1990 все сошлось в точку, и с 1999 года мы получили пять новых элементов, а также право присвоить им имена”, — заключает научный секретарь.Упорство российских ученых и их рисковое желание “положить все ядра в одну корзину” помогло вырваться вперед и стать признанными лидерами в этой области, после того как все остальные ведущие лаборатории мира забраковали кальций-48 и прекратили с ним экспериментировать.Первые результаты опытов в Дубне встретили со скепсисом — коллеги просто не верили в то, что такие опыты в принципе возможны. Проверки в других лабораториях достаточно быстро развеяли все сомнения, таблица Менделеева пополнилась, а Оганесяна и его команду каждый год называют в числе главных претендентов на Нобелевскую премию по химии и физике.Кроме того, успехи российских ученых убедили американских коллег, работающих в ведущих ускорительных центрах и лабораториях Нового Света, что с ОИЯИ нужно не конкурировать, а тесно сотрудничать. Открытие флеровия, оганесона, теннессина и прочих сверхтяжелых элементов — результат сотрудничества, а не предмет споров между ОИЯИ и учеными из США. К примеру, сейчас ученые получают один атом флеровия в неделю, обстреливая мишень триллионами частиц в секунду. Более тяжелые элементы (скажем, оганесон) удается синтезировать лишь раз в месяц. Соответственно, работа на нынешних установках потребует астрономически много времени.Эти трудности российские исследователи рассчитывают преодолеть при помощи циклотрона ДЦ-280, запущенного в декабре прошлого года. Плотность вырабатываемого им пучка частиц в 10-20 раз выше, чем у предшественников, что, как надеются отечественные физики, позволит создать один из двух элементов ближе к концу года.Первым, скорее всего, синтезируют 120-й элемент, так как калифорниевая мишень, необходимая для этого, уже была подготовлена в американской Национальной лаборатории в Ок-Ридже. Пробные пуски ДЦ-280, нацеленные на решение этой задачи, пройдут в марте этого года.Ученые считают, что постройка нового циклотрона и детекторов поможет приблизиться к ответу на еще один фундаментальный вопрос: где перестает действовать периодический закон?Гадания на амальгамеАкадемик поясняет, что электроны в самых близких к ядру оболочках начинают двигаться так быстро, что разгоняются до околосветовых скоростей.
К примеру, сейчас ученые получают один атом флеровия в неделю, обстреливая мишень триллионами частиц в секунду. Более тяжелые элементы (скажем, оганесон) удается синтезировать лишь раз в месяц. Соответственно, работа на нынешних установках потребует астрономически много времени.Эти трудности российские исследователи рассчитывают преодолеть при помощи циклотрона ДЦ-280, запущенного в декабре прошлого года. Плотность вырабатываемого им пучка частиц в 10-20 раз выше, чем у предшественников, что, как надеются отечественные физики, позволит создать один из двух элементов ближе к концу года.Первым, скорее всего, синтезируют 120-й элемент, так как калифорниевая мишень, необходимая для этого, уже была подготовлена в американской Национальной лаборатории в Ок-Ридже. Пробные пуски ДЦ-280, нацеленные на решение этой задачи, пройдут в марте этого года.Ученые считают, что постройка нового циклотрона и детекторов поможет приблизиться к ответу на еще один фундаментальный вопрос: где перестает действовать периодический закон?Гадания на амальгамеАкадемик поясняет, что электроны в самых близких к ядру оболочках начинают двигаться так быстро, что разгоняются до околосветовых скоростей. В результате увеличивается масса, меняется конфигурация орбит и весь атом ведет себя совершенно не так, как предсказывает классическая теория.”На первых порах нам казалось, что периодический закон перестанет работать где-то на 123-м элементе, теперь появились намеки на то, что этот момент уже наступил. Разница небольшая, но ее вполне можно увидеть, и она, как мы считаем, как раз связана с этими релятивистскими эффектами”, — говорит ученый.Как показали первые химические эксперименты с ядрами коперниция, элемент-112 ведет себя не так, как ртуть и другие его соседи по периодической таблице. Жидкий металл, как хорошо знали средневековые алхимики, художники и зодчие, растворяет золото, серебро и многие другие металлы, образуя твердые или жидкие сплавы.”Коперниций может формировать амальгамы, однако они совершенно другие. Обычные сплавы ртути и других металлов распадаются при нагревании до 160 градусов Цельсия, а сплавы с элементом-112 теряют стабильность при нуле градусов. При этом с физической точки зрения различия в поведении электронов у ртути и коперниция крайне малы”, — рассказывает Оганесян.
В результате увеличивается масса, меняется конфигурация орбит и весь атом ведет себя совершенно не так, как предсказывает классическая теория.”На первых порах нам казалось, что периодический закон перестанет работать где-то на 123-м элементе, теперь появились намеки на то, что этот момент уже наступил. Разница небольшая, но ее вполне можно увидеть, и она, как мы считаем, как раз связана с этими релятивистскими эффектами”, — говорит ученый.Как показали первые химические эксперименты с ядрами коперниция, элемент-112 ведет себя не так, как ртуть и другие его соседи по периодической таблице. Жидкий металл, как хорошо знали средневековые алхимики, художники и зодчие, растворяет золото, серебро и многие другие металлы, образуя твердые или жидкие сплавы.”Коперниций может формировать амальгамы, однако они совершенно другие. Обычные сплавы ртути и других металлов распадаются при нагревании до 160 градусов Цельсия, а сплавы с элементом-112 теряют стабильность при нуле градусов. При этом с физической точки зрения различия в поведении электронов у ртути и коперниция крайне малы”, — рассказывает Оганесян. Еще сильнее, по его словам, различия между флеровием и свинцом. Сейчас ученые из Дубны пытаются понять, обладает ли оганесон свойствами благородных газов, однако это не удается выяснить из-за того, что 118-й элемент живет крайне недолго — меньше одной миллисекунды.Оганесян надеется, что открытие новых сверхтяжелых ядер и их изучение позволит российским физикам и их зарубежным коллегам решить эту проблему, изучить свойства оганесона и дать ответ на один из главных вопросов физики: что именно определяет устройство ядер, взаимодействия нуклонов внутри них и как эти свойства можно предсказывать.В отличие от атомов, чье поведение очень точно предсказывает квантовая электродинамика, у внутреннего устройства ядер пока нет теоретического описания. Открытие соответствующих принципов заполнит один из самых больших пробелов в современной науке.
Еще сильнее, по его словам, различия между флеровием и свинцом. Сейчас ученые из Дубны пытаются понять, обладает ли оганесон свойствами благородных газов, однако это не удается выяснить из-за того, что 118-й элемент живет крайне недолго — меньше одной миллисекунды.Оганесян надеется, что открытие новых сверхтяжелых ядер и их изучение позволит российским физикам и их зарубежным коллегам решить эту проблему, изучить свойства оганесона и дать ответ на один из главных вопросов физики: что именно определяет устройство ядер, взаимодействия нуклонов внутри них и как эти свойства можно предсказывать.В отличие от атомов, чье поведение очень точно предсказывает квантовая электродинамика, у внутреннего устройства ядер пока нет теоретического описания. Открытие соответствующих принципов заполнит один из самых больших пробелов в современной науке.
https://ria.ru/20181030/1531799904.html
https://ria.ru/20181128/1533730174.html
https://ria.ru/20181001/1529747040.html
https://ria. ru/20170803/1499719773.html
ru/20170803/1499719773.html
https://ria.ru/20170222/1488615583.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn23.img.ria.ru/images/154879/00/1548790023_0:130:1036:907_1920x0_80_0_0_085c9e14fc4e61fe5e66de850ab67a48.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
internet-group@rian. ru
ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
физика
МОСКВА, 1 фев — РИА Новости. Периодическая таблица постоянно расширяется — новые элементы в ней появляются в среднем каждые четыре года. Есть ли этому предел? Юрий Оганесян, “мистер 118-й элемент”, и его коллеги рассказывают, как Россия стала лидером в области синтеза элементов и на какие вопросы ученые пока не могут ответить.
Международный год периодической таблицы
В этом году Россия и весь мир отмечают 150-летие одного из важнейших открытий, которое совершил российский ученый. Полтора века назад Дмитрий Иванович Менделеев представил первую версию периодической таблицы и закона, послужившего основой современной химии.
В честь юбилея Генеральная ассамблея ООН единогласно приняла решение о проведении Международного года Периодической системы элементов Менделеева. Программа официально стартовала на прошлой неделе в штаб-квартире ЮНЕСКО в Париже.
В торжественной церемонии приняли участие более 1300 человек из 80 стран мира, в том числе крупные ученые — Бен Феринга, лауреат Нобелевской премии по химии 2016 года, сэр Мартин Полякофф, один из самых известных популяризаторов науки и специалистов в области зеленой химии, а также десятки молодых исследователей разных национальностей.
Помимо ученых, выступили главы важнейших научных ведомств и представители общественности — министр науки и высшего образования России Михаил Котюков, президент РАН Александр Сергеев, его французский коллега Пьер Корволь и генеральный директор ЮНЕСКО Одри Азуле. Генеральный партнер мероприятия — благотворительный фонд Алишера Усманова “Искусство, наука и спорт”.
Одним из героев церемонии стал Юрий Оганесян — научный руководитель лаборатории ядерных реакций Объединенного института ядерных исследований в Дубне, где были открыты последние пять элементов периодической таблицы, в том числе и элемент-118, оганесон. Ученый объяснил РИА Новости, зачем в России планируют создать еще более тяжелые ядра и к чему это может привести.
Грезы алхимиков
“Я никогда не думал, что буду заниматься именно синтезом новых элементов — по специальности я физик. Ядерная физика — это не только элементы, но и атомная энергия и многое другое. Но потом оказалось, что все это имеет огромное значение и для химии”, — говорит академик.
Идея превращения свинца в золото и трансмутации одних элементов в другие, отмечает он, оставалась несбыточной мечтой как для средневековых алхимиков, так и для серьезных ученых. Все изменилось только после того, как Эрнст Резерфорд, Георгий Гамов и прочие основоположники современной физики поняли, как устроен атом и его ядро.
“Когда вы хотите что-то изменить, чего так жаждали алхимики, нужно понимать, что именно вам нужно поменять. Они грели свинец, проводили бесчисленное множество опытов, но ничего не добились, так как необходимо работать с ядром, а не электронными оболочками атомов. Резерфорд первым показал, что для этого требуется ядерная реакция”, — продолжает Оганесян.
В данном случае российские ученые и их зарубежные партнеры и бывшие конкуренты, по словам академика, не воспроизводили природные процессы. Они сделали нечто другое, сталкивая ядра определенных легких элементов с мишенями из сверхтяжелых, но относительно стабильных изотопов.
В природе ядерный синтез выглядит иначе — сталкиваются протоны и нейтроны, возникает ядро, вокруг которого выстраиваются электроны. Все эти реакции происходят внутри чрезвычайно горячей плазмы, в них участвуют огромные массы материи — в лаборатории это осуществить нельзя. “По сути, мы берем готовые ядра и сталкиваем их, надеясь получить более тяжелые элементы”, — поясняет ученый.
В отличие от “исследований” алхимиков, как пояснил научный секретарь лаборатории Александр Карпов, выбор ученых был далеко не случаен. Успехи российских исследователей и их зарубежных партнеров в удлинении “бороды” таблицы Менделеева напрямую связаны с решениями, принятыми еще в тяжелые для российской науки 1990-е годы.
“Наша главная задача и идея — подобраться как можно ближе к предсказанному “островку стабильности” тяжелых элементов. Поэтому мы не просто пытаемся создавать новые ядра, а стремимся к определенным комбинациям в числе протонов и нейтронов. Как правило, чем больше нейтронов в атомах, тем стабильнее результат их слияния”, — уточняет физик.
Поэтому мы не просто пытаемся создавать новые ядра, а стремимся к определенным комбинациям в числе протонов и нейтронов. Как правило, чем больше нейтронов в атомах, тем стабильнее результат их слияния”, — уточняет физик.
И российские, и зарубежные ученые достаточно давно знают, что в природе не существует стабильных или относительно долгоживущих ядер, комбинация которых гарантированно помогла бы создать сверхстабильные элементы, находящиеся в центре этого острова и содержащие в себе около 114 протонов и 184 нейтрона.
“Проблемы вызывает именно второе число — природа так устроена, что чем тяжелее элемент, тем больше в нем нейтронов. Пока у нас нет ни мишеней, ни легких ионов с нужным числом частиц для выхода в эту зону. Тем не менее мне не кажется, что это нерешаемая проблема, нам просто нужно больше времени”, — рассказывает Карпов.
Частичный выход из этой ситуации, по его словам, российские физики и зарубежные коллеги нашли в стабильном, но крайне редком изотопе кальция, чьи атомы содержат 20 протонов и 28 нейтронов. Оба эти числа считаются “магическими” в мире ядерной физики, что обусловливает ряд необычных и уникальных свойств этой версии металла.
Оба эти числа считаются “магическими” в мире ядерной физики, что обусловливает ряд необычных и уникальных свойств этой версии металла.
“Кальций-48 присутствует в любом кусочке мела или извести, однако выделить его крайне сложно и дорого, намного сложнее, чем работать с изотопами урана. Производят его в одном месте в мире — на российском предприятии “Электрохимприбор” в Свердловской области. За год специалисты получают 10-12 граммов, что стоит примерно 2,5 миллиона долларов”, — продолжает физик.
Многие экспериментаторы, добавляет ученый, пытались применять кальций-48 для подобных целей и в прошлом, но быстро отказывались от этой идеи из-за несовершенства измерительных приборов или же по другим причинам.
Все ядра в одной корзине
“У нас была еще одна критически важная проблема — нужно было как-то растянуть эти десять граммов кальция на все время работы установки и при этом сделать пучок ионов достаточно интенсивным для того, чтобы получить какой-то результат. Грубо говоря, в 1970-е и 1980-е годы этого количества кальция хватало примерно на час работы ускорителя. Нам же — больше чем на год”, — подчеркивает Карпов.
Грубо говоря, в 1970-е и 1980-е годы этого количества кальция хватало примерно на час работы ускорителя. Нам же — больше чем на год”, — подчеркивает Карпов.
Это стало возможным благодаря тому, что Оганесян и его единомышленники направили все имевшиеся у ОИЯИ средства и ресурсы на работу с пучками ионов кальция и мишенями из берклия, калифорния и некоторых других тяжелых элементов, почти способных “доплыть” до островка стабильности при столкновении с кальцием-48.
“Нашим успехам предшествовала масса неудач — подобные опыты проводили и в Германии, и у нас в Дубне. Ничего не выходило, причем не только из-за отсутствия технологий, позволяющих делать максимально яркие и плотные пучки, но и из-за непонимания того, как реакция происходит. В конце 1990 все сошлось в точку, и с 1999 года мы получили пять новых элементов, а также право присвоить им имена”, — заключает научный секретарь.
1 октября 2018, 19:44НаукаФизики из России выяснили, что заставляет атомы ртути превращаться в “яйца”Упорство российских ученых и их рисковое желание “положить все ядра в одну корзину” помогло вырваться вперед и стать признанными лидерами в этой области, после того как все остальные ведущие лаборатории мира забраковали кальций-48 и прекратили с ним экспериментировать.
Первые результаты опытов в Дубне встретили со скепсисом — коллеги просто не верили в то, что такие опыты в принципе возможны. Проверки в других лабораториях достаточно быстро развеяли все сомнения, таблица Менделеева пополнилась, а Оганесяна и его команду каждый год называют в числе главных претендентов на Нобелевскую премию по химии и физике.
Кроме того, успехи российских ученых убедили американских коллег, работающих в ведущих ускорительных центрах и лабораториях Нового Света, что с ОИЯИ нужно не конкурировать, а тесно сотрудничать. Открытие флеровия, оганесона, теннессина и прочих сверхтяжелых элементов — результат сотрудничества, а не предмет споров между ОИЯИ и учеными из США.
“Что дальше? Понятно, что на этом таблица Менделеева не заканчивается и нужно попробовать получить 119-й и 120-й элементы. Но для этого придется совершить ту же технологическую революцию, которая помогла нам вырваться в лидеры в 1990-е годы, повысить интенсивность пучка частиц на несколько порядков и сделать детекторы настолько же более чувствительными”, — подчеркивает физик.
К примеру, сейчас ученые получают один атом флеровия в неделю, обстреливая мишень триллионами частиц в секунду. Более тяжелые элементы (скажем, оганесон) удается синтезировать лишь раз в месяц. Соответственно, работа на нынешних установках потребует астрономически много времени.
Эти трудности российские исследователи рассчитывают преодолеть при помощи циклотрона ДЦ-280, запущенного в декабре прошлого года. Плотность вырабатываемого им пучка частиц в 10-20 раз выше, чем у предшественников, что, как надеются отечественные физики, позволит создать один из двух элементов ближе к концу года.
3 августа 2017, 21:00НаукаФизики впервые увидели, как нейтрино сталкивается с ядром атомаПервым, скорее всего, синтезируют 120-й элемент, так как калифорниевая мишень, необходимая для этого, уже была подготовлена в американской Национальной лаборатории в Ок-Ридже. Пробные пуски ДЦ-280, нацеленные на решение этой задачи, пройдут в марте этого года.
Ученые считают, что постройка нового циклотрона и детекторов поможет приблизиться к ответу на еще один фундаментальный вопрос: где перестает действовать периодический закон?
Гадания на амальгаме
“Есть ли разница между синтетическим и естественным элементом? Когда мы открываем их и вписываем в таблицу, там ведь не указано, откуда они взялись. Главное, чтобы они подчинялись периодическому закону. Но сейчас об этом, как мне кажется, уже можно говорить в прошедшем времени”, — отмечает Оганесян.
Академик поясняет, что электроны в самых близких к ядру оболочках начинают двигаться так быстро, что разгоняются до околосветовых скоростей. В результате увеличивается масса, меняется конфигурация орбит и весь атом ведет себя совершенно не так, как предсказывает классическая теория.
“На первых порах нам казалось, что периодический закон перестанет работать где-то на 123-м элементе, теперь появились намеки на то, что этот момент уже наступил. Разница небольшая, но ее вполне можно увидеть, и она, как мы считаем, как раз связана с этими релятивистскими эффектами”, — говорит ученый.
22 февраля 2017, 16:41НаукаФизики из России и Европы заглянули внутрь ядер сверхтяжелых атомовКак показали первые химические эксперименты с ядрами коперниция, элемент-112 ведет себя не так, как ртуть и другие его соседи по периодической таблице. Жидкий металл, как хорошо знали средневековые алхимики, художники и зодчие, растворяет золото, серебро и многие другие металлы, образуя твердые или жидкие сплавы.
“Коперниций может формировать амальгамы, однако они совершенно другие. Обычные сплавы ртути и других металлов распадаются при нагревании до 160 градусов Цельсия, а сплавы с элементом-112 теряют стабильность при нуле градусов. При этом с физической точки зрения различия в поведении электронов у ртути и коперниция крайне малы”, — рассказывает Оганесян.
Еще сильнее, по его словам, различия между флеровием и свинцом. Сейчас ученые из Дубны пытаются понять, обладает ли оганесон свойствами благородных газов, однако это не удается выяснить из-за того, что 118-й элемент живет крайне недолго — меньше одной миллисекунды.
Оганесян надеется, что открытие новых сверхтяжелых ядер и их изучение позволит российским физикам и их зарубежным коллегам решить эту проблему, изучить свойства оганесона и дать ответ на один из главных вопросов физики: что именно определяет устройство ядер, взаимодействия нуклонов внутри них и как эти свойства можно предсказывать.
В отличие от атомов, чье поведение очень точно предсказывает квантовая электродинамика, у внутреннего устройства ядер пока нет теоретического описания. Открытие соответствующих принципов заполнит один из самых больших пробелов в современной науке.
“Я уверен, что элементы тяжелее оганесона существуют. В любом случае мы не остановимся на 119-м или 120-м элементе или их ядрах — мы продолжим двигаться дальше, пока нам будет хватать чувствительности. Потом придется создавать новые установки и искать новые пределы”, — заключает Оганесян.
История Периодической таблицы
Рисунок \ (\ PageIndex {1} \). Менделеев Дмитрий
Периодическая таблица для многих является символом химии. Это единое изображение, которое содержит все известные элементы вселенной, объединенные в легко читаемую таблицу. В таблице также присутствует множество паттернов. Кажется, что все элементы подходят друг к другу и соединяются, образуя читаемую таблицу и, в свою очередь, образ химии. Идея элементов впервые возникла в 3000 г. до н.э.В. Великий греческий философ Аристотель считал, что все на земле состоит из этих элементов. В древние времена такие элементы, как золото и серебро, были легко доступны, однако Аристотель выбрал такие элементы, как Земля, Вода, Огонь и Воздух.
В 1649 году идея элементов сделала огромный шаг вперед, когда Хенниг Бранд первым открыл новый элемент: фосфор. Бранд был алхимиком в поисках философского камня или предмета, который мог бы превратить любой обычный металл в золото.В своих поисках он перепробовал все, в том числе и перегонку человеческой мочи. Когда был проведен этот эксперимент, Бранд обнаружил светящийся белый камень. Это был новый элемент, который он назвал бы фосфором. Алхимики и ученые эпохи Просвещения добавили невероятное количество знаний к идеям об элементах. В 1869 году было открыто уже 63 элемента. С каждым новым обнаруженным элементом ученые начали понимать, что возникают закономерности, и некоторые начали складывать элементы в таблицу.
Такие ученые, как Джон Ньюлендс и Александр-Эмиль Бегайе де Шанкуртуа, создали свои собственные версии периодических таблиц. Эти версии были относительно простыми, а также несколько неясными и трудными для чтения. Ученый, который собрал все это воедино, был Дмитрий Менделеев (1834–1907). Менделеев был химиком российского происхождения и первым опубликовал современную версию таблицы Менделеева. В его таблице элементы упорядочены по атомным весам (молярным массам). Когда элементы были упорядочены по их атомному весу, они показали аналогичные химические свойства.Таблица, которую составил Менделеев, была настолько хороша, что он мог предсказать элементы, которые ему тогда даже не были известны. Эти элементы включали германий, галлий и скандий. Однако в таблице были некоторые подводные камни. Поскольку не все элементы были обнаружены на момент публикации Менделеева, он не учел важные элементы, такие как благородные газы. После публикации Менделеева будущие ученые внесли свой вклад в добавление элементов на их должных местах. Сэр Уильям Рамзи добавил благородные газы, а Генри Мосли открыл способ количественного определения атомного номера элемента и изменил порядок таблицы Менделеева, чтобы она была организована по атомным номерам.Наконец, в 1945 году Манхэттенский проект привел к открытию многих новых радиоактивных элементов. Гленн Т. Сиборг предложил изменить таблицу в виде добавления ряда актинидов и лантанидов в нижней части таблицы. Эта идея пришла с открытием Америций и Кюрия и их уникальных свойств. Изменение сначала не было принято, но теперь оно включено во все периодические таблицы.
Рисунок \ (\ PageIndex {2} \). Периодическая таблица, показывающая, когда был обнаружен каждый элемент
- До 1800 года (36 элементов): диковери в эпоху Просвещения и до нее.
- 1800-1849 (+22 элемента): импульс научной революции, теории атома и промышленной революции.
- 1850-1899 (+23 элемента): эпоха классифицирующих элементов получила импульс от спектрального анализа.
- 1900-1949 (+13 элементов): импульс старой квантовой теории, уточнения периодической таблицы и квантовой механики.
- 1950-1999 (+15 элементов): Manhattan_Project и вопросы физики элементарных частиц, для атомных номеров 97 и выше
Подробнее о Периодической таблице Менделеева
Сходство макроскопических свойств в каждом из химических семейств приводит к тому, что можно ожидать и микроскопического сходства.Атомы натрия должны быть чем-то похожи на атомы лития, калия и других щелочных металлов. Это могло объяснить родственную химическую активность и аналогичные соединения этих элементов.
Согласно атомной теории Дальтона, различные виды атомов можно различать по их относительной массе (атомной массе). Поэтому кажется разумным ожидать некоторой корреляции между этим микроскопическим свойством и макроскопическим химическим поведением. Вы можете увидеть, что такая взаимосвязь существует, перечислив символы для первой дюжины элементов в порядке увеличения относительной массы.Получив атомные веса, имеем
Элементы, которые принадлежат к семействам, которые мы уже обсуждали, обозначены штриховкой вокруг их символов. Второй, третий и четвертый элементы в списке (He, Li и Be) представляют собой благородный газ, щелочной металл и щелочно-земельный металл соответственно. Точно такая же последовательность повторяется спустя восемь элементов (Ne, Na и Mg), но на этот раз благородному газу предшествует галоген (F). Если бы список был составлен из всех элементов, мы бы нашли последовательность галоген, благородный газ, щелочной металл и щелочно-земельный металл еще несколько раз.
Дмитрий Иванович Менделеев предложил периодический закон за составление своей таблицы Менделеева. Этот закон гласит, что , когда элементы перечислены в порядке возрастания атомного веса, их свойства периодически меняются . То есть похожие элементы не имеют одинаковых атомных весов. Скорее, когда мы спускаемся по списку элементов в порядке атомных весов, соответствующие свойства наблюдаются через регулярные промежутки времени. Чтобы подчеркнуть это периодическое повторение схожих свойств, Менделеев расположил символы и атомные веса элементов в таблице, показанной ниже.Каждый вертикальный столбец периодической таблицы содержит группу или семейство связанных элементов. Щелочные металлы относятся к группе I ( Gruppe I), щелочноземельные металлы – к группе II, халькогены – к группе VI, а галогены – к группе VII. Менделеев не совсем понимал, куда девать чеканные металлы, поэтому они появляются дважды. Однако каждый раз медь, серебро и золото располагаются в вертикальном столбце. Благородные газы были открыты почти через четверть века после публикации первой таблицы Менделеева, но они тоже соответствовали периодической системе.При построении своей таблицы Менделеев обнаружил, что иногда не хватало элементов, чтобы заполнить все доступные пробелы в каждой горизонтальной строке или периоде . Когда это было правдой, он предполагал, что в конце концов кто-нибудь откроет элемент или элементы, необходимые для завершения периода. Поэтому Менделеев оставил пустые места для неоткрытых элементов и предсказал их свойства, усредняя характеристики других элементов в той же группе.
Рисунок \ (\ PageIndex {3} \) . Периодическая таблица Менделеева, перерисованная из Annalen der Chemie, дополнительный том 8, 1872 г. Немецкие слова Gruppe и Reihen обозначают, соответственно, группы и строки (или точки) в таблице. Менделеев также использовал европейское соглашение о запятой вместо точки для десятичной дроби и J вместо I для йода. Благородные газы еще не были обнаружены, когда Менделеев разработал периодическую таблицу, и поэтому не отображаются.
В качестве примера этого процесса прогнозирования рассмотрим четвертую пронумерованную строку ( Reihen ).Скандий (Sc) в 1872 г. был неизвестен; поэтому титан (Ti) следует за кальцием (Ca) в порядке атомных весов. Это поместило бы титан ниже бора (B) в группу III, но Менделеев знал, что наиболее распространенный оксид титана TiO 2 имел формулу, аналогичную оксиду углерода CO 2 , а не бору B 2 О 3 . Поэтому он поместил титан в группу IV ниже углерода. Он предположил, что неоткрытый элемент, экаборон, в конечном итоге окажется подходящим ниже бора.(Префикс eka означает «ниже».) Прогнозируемые свойства ekaboron показаны в следующей таблице. Они замечательно согласились с экспериментально измеренными для скандия, когда он был открыт 7 лет спустя. Это согласие было убедительным доказательством того, что периодическая таблица – хороший способ обобщить множество макроскопических экспериментальных фактов.
Таблица \ (\ PageIndex {1} \). Сравнение предсказаний Менделеева с наблюдаемыми свойствами элемента скандий .
| Объекты, предсказанные Менделеевым для Экаборана 1872 г. | Объекты скандия, найденные после его открытия в 1879 г. | |
| Атомный вес | 44 | 44 † |
| Формула оксида | Eb 2 O 3 | Sc 2 O 3 |
| Плотность оксида | 3,5 | 3.86 |
| Кислотность оксида | Больше, чем MgO | Больше, чем MgO |
| Формула хлорида | EbCl 3 | ScCl 3 |
| Температура кипения хлорида | Выше, чем у | Выше, чем у |
| Цвет соединений | бесцветный | бесцветный |
* Менделеев использовал название «эка» бор, потому что пустое пространство, в которое должен помещаться элемент, находилось «под» бором в его периодической таблице.
† Современное значение атомной массы скандия составляет 44,96.
Современная таблица Менделеева в некоторых отношениях отличается от первоначальной версии Менделеева. Он содержит более 40 дополнительных элементов, а его строки длиннее, а не сдвинуты друг под друга в смещенных столбцах. Например, четвертая и пятая строки Менделеева содержатся в четвертом периоде современной таблицы. В результате под бор в периодической таблице помещается галлий, а не скандий.Эта перестройка связана с теорией электронной структуры атомов, в частности с идеями об орбиталях и связи электронной конфигурации с периодической таблицей. Чрезвычайно важная идея вертикальных групп связанных элементов все еще сохраняется, как и групповые числа Менделеева. Последние появляются в виде римских цифр вверху каждого столбца в современной таблице.
Менделеев был выдающимся химиком, который смог создать величайший химический инструмент всех времен.Не он один составлял элементы, и многие другие великие химики тоже внесли свой вклад. Идея элементов зародилась более 5000 лет назад и начала окончательно оформляться всего 200 лет назад с периодической таблицей Менделеева. Тем не менее, формирование таблицы Менделеева на этом не закончилось. Со временем он изменился и продолжает трансформироваться по мере того, как обнаруживается все больше и больше элементов.
Из ChemPRIME: 4.2: Периодическая таблица
Авторы и авторство
Увлекательная предыстория таблицы Менделеева, которой скоро исполнится 150 лет
Кредит: CC0 Public DomainПериодическая таблица Менделеева стала иконой науки.Его строки и столбцы обеспечивают аккуратный способ демонстрации элементов – ингредиентов, из которых состоит Вселенная.
Сегодня это кажется очевидным, но не для поколений первых химиков. Ситуация изменилась, когда Дмитрий Менделеев начал писать учебник и обдумывал способы сгруппировать элементы вместе, чтобы облегчить свою ношу.
Русский химик обнаружил элегантную и мощную закономерность: он обнаружил, что некоторые элементы обладают схожими свойствами, и что эти черты регулярно – или периодически – меняются с увеличением атомного веса.
Итак, 17 февраля 1869 года (по юлианскому календарю, который использовался в России в то время) Менделеев опубликовал таблицу из 60 с лишним известных в то время элементов, отсортированных по их весу и свойствам. Он назвал это «Попыткой создать систему элементов, основанную на их атомном весе и химическом родстве».
Он стал считаться одним из величайших научных достижений всех времен.
Вот почему Организация Объединенных Наций и Международный союз теоретической и прикладной химии празднуют 150-летие периодической таблицы Менделеева.Празднование стартовало во вторник в Париже.
Журнал Science отмечает это событие специальным выпуском о столе, который включает эссе о его происхождении Майкла Гордина, историка науки из Принстонского университета. Гордин рассказал газете Los Angeles Times об изобретении Менделеева и его научном наследии.
В: Почему периодическая таблица Менделеева просуществовала 150 лет?
A: Это потрясающий инструмент, который может сжимать огромное количество информации в один формат.Это одна из первых вещей, которую люди узнают о химии. Это есть в каждом учебнике. Он висит на стене почти каждого класса химии в мире.
Q: Как это произошло?
A: Дмитрий Менделеев писал учебник, когда ему в голову пришла идея. Это была схема, которую он составил, чтобы помочь организовать элементы в семьях, чтобы ему не приходилось тратить время на выполнение каждого элемента по отдельности.
Q: Как это работало?
A: Таблица организована по возрастанию атомного веса, но разбита на строки.Когда Менделеев сделал это, он увидел, что определенные элементы имеют очень похожие свойства – они образуют кислоты, имеющие одинаковую силу, они образуют кристаллы, которые выглядят одинаково.
Итак, помимо увеличения атомного веса, он увидел, что есть еще одна повторяющаяся закономерность. Это он изобрел термин «периодический».«
Q: Он понимал, что зашел на что-то большое?
A: Я думаю, он уловил одну из двух закономерностей. Это просто удобный инструмент обучения или это глубокая закономерность? Он видел это обоими способами.
Со временем он еще больше убедился в том, что открыл закон природы. Это нормально для научных открытий – когда вы впервые что-то предлагаете, вы еще не знаете, что это правда.
Вопрос: Вы бы сказали, что Менделеев «открыл» современную таблицу Менделеева?
A: Я обычно говорю, что Менделеев сформулировал или придумал таблицу.Я не говорю, что обнаружил, потому что это не скала или гора. Это набор отношений между вещами, подобными скалам или горам.
Q: Но он был не единственным химиком, работавшим над столом 150 лет назад, не так ли?
A: Верно. В 1860-х годах существовало шесть различных формулировок таблицы.
Q: Что отличает его стол?
A: Во-первых, Менделеев делает все элементы. Предыдущие люди вложили много или больше всего, но не сделали все, потому что не были уверены в атомных весах.Менделеев прикидывал их вес, чтобы уместить их в таблице.
Во-вторых, он предсказал существование новых элементов. Когда эти элементы обнаруживаются, его таблица выделяется.
Третья причина в том, что он при жизни очень настаивал на том, что заслуживает уважения к таблице Менделеева.
Q: Давайте вернемся на минутку. Как Менделеев предсказал существование неоткрытых элементов?
A: Есть несколько гипотез историков, потому что он не записывал свой мыслительный процесс.
Когда Менделеев начал выстраивать элементы с похожими свойствами в столбцы, он заметил, что в некоторых местах элемент, казалось, оказался в неправильном месте и должен был быть на один столбец выше. Когда переставил, все наладилось. Но тогда есть пустой пробел. И он такой: «Хорошо, как мне объяснить, что в промежутке?»
Q: А как он это объяснил?
A: Он сказал: «Ну, его атомный вес должен быть примерно таким, потому что я могу усреднить элементы вокруг него и угадать.«И он такой:« Я знаю, какой должна быть его кристаллическая структура. И я кое-что знаю о том, какие кислоты он мог бы образовать, потому что он обладает свойствами элементов выше и ниже него ».
В течение 15 лет были обнаружены три элемента, которые он предсказал в деталях. И у них были именно те свойства, которые он сказал.
Q: Значит, другие химики не предсказывали?
A: Другие люди признали наличие закономерности. Но они не догадывались о свойствах элементов.
Главный конкурент Менделеева – немец по имени Лотар Мейер. Мейер сделал несколько версий аналогичной таблицы в 1860-х годах, но никогда не делал прогнозов. Он думал, что гадать безрассудно. Он такой: «Химики не должны этого делать, потому что мы еще недостаточно знаем».
Q: Что происходило в 1860-х годах, что вдохновило всех на создание таблиц элементов?
A: Сегодня таблица Менделеева организована по атомному номеру, который представляет собой количество протонов в ядре.Но тогда они не знали о протонах, поэтому организовали все по атомному весу. У них было то, что они считали точными атомными весами для всех элементов, но некоторые из этих весов были измерены разными системами.
Затем, в 1860 году, в Германии состоялось международное собрание химиков. Менделеев оказался там, потому что учился поблизости. Они предлагают единый способ организации атомных весов, и когда они это делают, они корректируют целую кучу атомных весов.
Через год или два люди начали замечать эти закономерности.
Q: Были ли ранее попытки организовать элементы?
А: Да. Один из методов был алфавитным, что было очень распространено.
Другие организованные элементы по их способности связываться друг с другом. Итак, вы могли бы создать таблицу и сказать, что сера очень хорошо связывается с тем, этим и этим, в этом порядке. Они похожи на периодические таблицы, но они совершенно разные. Они не перечисляют все элементы, и вещи появляются несколько раз.
Q: Знаем ли мы, что за парень был Менделеев?
A: На самом деле мы много о нем знаем. Он родился в сибирском городе Тобольск, который находится почти в самом центре России. Он оказался в Санкт-Петербурге для получения образования, и он оставался там большую часть своей жизни – он преподавал в Санкт-Петербургском университете, – но много путешествовал.
Он был очень шумным, забавным, быстро терял самообладание, но также явно очень харизматичным и обаятельным. Он также был очень политически активен.О нем много писали в газетах.
После того, как он закончил стол, он решил, что начнет хранить всю свою почту и все свои письма, потому что знал, что станет знаменитым. Он из тех людей, которые заботятся о своем наследии и хорошо о себе думают.
Q: Прославился ли он при жизни?
А: Да. Он работает за столом, когда ему исполнилось 35 лет, в 1869 году, и он живет до 1907 года. Стол становится все более и более важным в химии на протяжении его жизни, поэтому он становится всемирно известным.
Q: Ученые действительно не понимали атомы до смерти Менделеева. Как это изменило таблицу?
A: Теперь мы организуем таблицу на основе квантовой теории – о положениях электронов во внешней оболочке атома. Это объясняет их химические свойства, потому что электроны определяют, как они связываются с другими элементами.
Менделеев ничего из этого не знал. Электрон был открыт в 1897 году, и ему не понравилась эта идея. Ему не нравились многие из этих новых идей.Когда люди открывали для себя новые вещи, которые он не мог представить, он очень расстраивался. Это его беспокоило.
Но позже Нильс Бор, датский физик, который является одним из архитекторов квантовой теории, опубликовал очень интересную версию периодической таблицы, которая включает в себя идеи квантового видения атома, чтобы помочь объяснить, как работает система. Это заставило замолчать тех, кто думал, что стол был просто счастливой догадкой.
Q: Что еще изменилось за последние 150 лет?
A: Все эти новые открытые элементы, очень тяжелые элементы.В основном они являются результатом использования коллайдеров и тому подобного для их создания. Они живут очень короткий промежуток времени – микросекунды. Но заполнение таблицы научило нас многому о том, как работают ядра этих атомов.
Теперь мы понимаем, почему в таблице столько столбцов, сколько их, и сколько строк мы можем пройти, прежде чем атом станет слишком нестабильным. Теперь у нас есть таблица без пробелов, и это дает нам настоящее чувство понимания природы.
Q: Теперь таблица заполнена?
A: Я уверен, что кто-нибудь попытается создать новые элементы, чтобы вы могли строить дополнительные строки.Но вопрос о том, стоит ли вкладывать деньги в объем знаний, которые мы получаем, – это вопрос, на который ученым и политикам придется ответить. Это не мое дело решать.
Q: Есть ли что-нибудь в современной таблице Менделеева, что могло бы удивить Менделеева?
A: Я думаю, он был бы очень удивлен тем, насколько тяжелыми могут быть элементы, что мы смогли достичь 118.
Но я думаю, он был бы очень доволен, что стол все еще присутствует – то, что он сделал, все еще существует.
ЮНЕСКО отмечает 150-летие периодической таблицы химических элементов
© Лос-Анджелес Таймс, 2019
Распространяется компанией Tribune Content Agency, LLC.
Ссылка : Вопросы и ответы: увлекательная предыстория таблицы Менделеева, которой скоро исполнится 150 лет (5 февраля 2019 г.) получено 27 июля 2021 г. с https: // физ.org / news / 2019-02-qa-увлекательная-предыстория-периодическая-таблица.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Международный год Периодической таблицы Менделеева – Первые таблицы
Во второй части нашей серии, посвященной Международному году Периодической таблицы Менделеева, мы остановимся на ранних версиях, разработанных Дмитрием Менделеевым.
«Полный словарь научной биографии» предлагает хорошую статью о Менделееве размером с энциклопедию. Более короткую статью можно найти в книге Chemistry World «Отец периодической таблицы» (Майк Саттон), которая также включает ранний набросок Менделеева 1869 года, созданный, когда он работал над вторым томом своего учебника химии.
Менделеев раскладывал свои карты столбцами и рядами, как будто в пасьянсе или в пасьянсе – его любимом занятии во время железнодорожных путешествий.Вертикальные столбцы перечисляли известные элементы в порядке увеличения атомного веса, при этом новый столбец начинался всякий раз, когда это позволяло ему уместить элементы с аналогичными характеристиками в один и тот же горизонтальный ряд.
Из книги Дэвида Аллена «В поисках периодической таблицы» для Королевского химического общества:
В таблице Менделеева элементы перечислены в строках или столбцах в порядке атомного веса, начиная с новой строки или столбца, когда характеристики элементов начали повторяться.Успех его версии сделал тот факт, что он оставил пробелы там, где, по-видимому, отсутствовал элемент, который еще не был обнаружен. Он также думал иногда игнорировать порядок, предлагаемый атомными весами, и переключать соседние элементы, чтобы их можно было лучше классифицировать по химическим семействам. Атомные номера еще не были известны, но атомные веса работали достаточно хорошо, чтобы упорядочить большинство элементов, и Менделеев смог точно предсказать свойства отсутствующих элементов.
Таблица Менделеева 1869 года из реферата, опубликованного в Zeitschrift für Chemie. Всеобщее достояние.
Таблица была представлена Русскому химическому обществу в марте 1869 года, а позже в том же году была опубликована в виде реферата в Zeitschrift für Chemie. Профессор колледжа Ле Мойн Кармен Гуинта предоставила английский перевод книги «О связи свойств элементов с их атомным весом» с некоторыми дополнительными заметками о коллекции элементов и атомов на своем сайте по классической химии.Знаки вопроса, позже пробелы в версии таблицы 1871 года, включенной в его учебник, представляют те еще неоткрытые элементы, которые предсказал Менделеев, включая галлий (1875 г.), скандий (1879 г.) и германий (1885 г.). Они были добавлены в таблицу Менделеева по мере их открытия.
Иллюстрация с изображением периодической таблицы из второго тома Основы химии Дмитрия Ивановича Менделеева, 1871 г. Изображение из Института истории науки, общественное достояние.
«Периодический закон химических элементов» Менделеева, написанный для французского журнала в 1879 году, был переведен позже в том же году для The Chemical News в ответ на внимание, поскольку с тех пор были обнаружены два из предсказанных элементов.Он был опубликован в нескольких выпусках, начиная с письма Менделеева от 14 ноября 1879 года. Статья начинается в следующем выпуске, продолжается в последующих выпусках до 26 декабря, возобновляется в выпуске от 2 января 1880 года и продолжается до тех пор, пока последний раздел не будет опубликован 19 марта 1880 года.
Он был приглашен Химическим обществом (ныне Королевское химическое общество) в 1889 году для чтения лекции Фарадея. Эта лекция, также называемая «Периодический закон химических элементов», была опубликована в «Журнале химического общества», а также в более поздних изданиях его учебника.
Периодическая таблица продолжала развиваться дальше модели Менделеева. Благородные газы были добавлены после того, как большинство из них было выделено и обнаружено в 1890-х годах. Первоначально они были размещены слева от других элементов как Группа 0, как показано в 3-м английском издании 1905 года.
Из книги Тома Зигфрида «Как периодическая таблица Менделеева превратилась из эскиза в непреходящий шедевр» для Science News :
Атомный вес был тесно связан с атомным номером [Генри] Мозли – достаточно близко, чтобы упорядочение элементов по весу лишь в нескольких местах отличалось от упорядочения по номерам.Менделеев настаивал на том, что эти веса были неправильными и их нужно было повторно измерить, и в некоторых случаях он был прав. Осталось несколько неточностей, но атомный номер Мозли определил положение вещей.
… ..
Современная форма, горизонтальный дизайн в отличие от первоначальной вертикальной версии Менделеева, стала широко популярной только после Второй мировой войны, во многом благодаря работе американского химика Гленна Сиборга (давнего члена правления Science Service, первоначального издателя). научных новостей).
Сиборг и его сотрудники синтетическим путем получили несколько новых элементов с атомными номерами помимо урана, последнего встречающегося в природе элемента в таблице. Сиборг увидел, что эти элементы, трансурановые элементы (плюс три элемента, предшествующие урану), требуют новой строки в таблице, чего Менделеев не предвидел. В таблице Сиборга строка для этих элементов добавлена под аналогичной строкой для редкоземельных элементов, правильное место которых также никогда не было вполне ясным.
Другие показания:
Захватывающий рост Периодической таблицы
Периодическая таблица элементов, составленная от водорода до унунокция, является данью уважения достижениям современной химии и физики.С тех пор, как Дмитрий Менделеев разработал раннюю версию ныне повсеместного макета в 1869 году, открытие нового элемента стало для ученого верным способом занять место в учебниках истории – и на страницах Popular Science.
См. Галерею.
Показывая, насколько важны элементы для современной науки, третий выпуск журнала PopSci за август 1872 года включал в себя длинное эссе, в котором излагалась история «различных видов материи», и правильно предсказывалось, что ученые могут продолжать открывать элементы для «различных видов материи». грядущие века.”
Но это еще не все слава и слава. PopSci объявил в 1926 году, что первый американец обнаружил новый элемент, но позже объявил, что «иллиний» был подделкой. О, и было то время в 1931 году, когда мы с гордостью сообщили, что ученые могут собраться и отправиться домой: все элементы были обнаружены!
Загляните в архивную галерею на этой неделе, чтобы увидеть больше супер-ботанических драм о химии.
Новые атомные диаграммы: февраль 1950 г.
«Атомной эре» едва исполнилось пять лет, когда PopSci опубликовал эту статью о новом семействе радиоактивных элементов нептуний.Уже сейчас «открытия атомного века … делаются слишком быстро, чтобы книги по химии и физике успевали за ними». Стремление заполнить пустые места в таблице Менделеева стало навязчивой идеей после того, как ученые осознали внушающий трепет потенциал ядерной энергии. В 1950 году было 96 известных химических элементов (сегодня их 118). Комиссия по атомной энергии США только что рассекретила четыре диаграммы радиоактивных семейств элементов, которые PopSci скрупулезно воспроизвел в качестве постоянного справочника для читателей.Спорили, были ли нестабильные, созданные в лаборатории элементы, такими же законными, как и их естественные аналоги. «Поскольку прежние различия между« естественным »и« искусственным »быстро исчезают в современной науке, ответ, кажется, положительный». Читайте полный текст в «Новые атомные диаграммы, раскрывающие секреты радиоэлементов».Современная алхимия: март 1948 г.
У древних алхимиков, включая Исаака Ньютона, была одна отчаянная цель: превратить меньший материал в драгоценное золото.Согласно этой статье 1948 года, американские «волшебники» (также известные как радиохимики) в Теннесси наконец-то преуспели в производстве синтетического радиоактивного золота с использованием циклотронов и атомных завалов, хотя сокровища, как правило, быстро исчезали. PopSci также опубликовал изотопную таблицу Эмилио Сегре, которая напоминала «гигантский кроссворд». Открытие изотопов означало, что знакомые элементы могут иметь неожиданные свойства. Даже «такие благородные элементы, как железо и сера, могут превратиться во что-то еще, пока вы отвернетесь!» Читайте полную историю в U.С. Алхимики делают золото.Building Blocks of Science: ноябрь 1946 г.
Читатели PopSci уже давно любят разрезать журнал на части, чтобы сделать себе развлечение своими руками. Этот выпуск 1946 года включает полноцветную таблицу Менделеева, которую вы можете вырезать и превратить в «замок Куртин». В сопроводительной статье содержится множество забавных фактов о редкоземельных элементах, атомном весе и ядерной энергии. Идите вперед и возьмите ножницы и ленту – если вы не возражаете против периодического замка, в котором отсутствуют элементы 97–118.Читайте полный рассказ в Building Blocks of Science.Все элементы найдены: декабрь 1931 г.
Добавьте это к длинному списку высокомерных и неточных научных заявлений: в 1931 году, после открытия эка-йода, PopSci заявляет, что все элементы были обнаружены. Это язвительное письмо читателя спрашивает, что теперь «бедные» исследователи будут делать со своим временем. «Я полагаю, ученые посвятят свое свободное время поиску новых витаминов, чтобы заполнить алфавит.Все, что угодно, чтобы они не тратили зря усилия, «пытаясь доказать, что человек произошел от обезьяны». Какой яйцеголовый плюнул в кофе? Прочтите всю историю в книге «Пожалейте бедных ученых со всеми найденными элементами».Художник рисует рений: сентябрь 1931 г.
Подобно «Витрувианскому человеку» Леонардо да Винчи или «Астроному» Иоганна Вермеера, эта картина 1931 года показывает, что слияние искусства и науки – прекрасная вещь. Чарльз Биттингер нарисовал спектр элемента рения, который был открыт всего несколькими годами ранее в Германии.Уникальный спектр элемента – это «полоса цветов, возникающая, когда небольшое количество элемента нагревается до накала, а его свет разбивается призмой, давая эффект радуги». Читайте полную историю в Artist Paints Spectrum.Американцы открывают Иллиниум: июнь 1926 г.
В 1926 году профессор Б.С. Хопкинс из Университета Иллинойса стал первым американцем, открывшим новый химический элемент! Или нет. «Иллиний», названный в честь его штата, оказался зараженным дидимием.Неуловимый элемент 61 был наконец открыт в 1945 году учеными из Окриджской национальной лаборатории, которые назвали его прометием в честь храброго Титана, укравшего огонь у богов. P.S .: Хорошие новости! «Астму вылечили русские». Читайте полную историю в American Finds New Element.Наука видит, слышит, считает атомы: апрель 1924 г.
PopSci получил удивительные новости из Парижа в 1924 году: «Мадам Кюри, известная как открывшая радий, изобрела машину, более поразительную и наполненную более драматическими возможностями, чем даже телескоп, который дал человеку первое настоящее понимание возвышенных чудес света. небеса »! Уф.Эта удивительная машина позволяет слышать и подсчитывать звуки, производимые при выделении атомов гелия из полония. «Машина более удивительная, чем эта, человеческий разум неспособен вообразить». Читайте полный текст в книге «Наука видит, слышит, считает атомы».Наука взрывает атом: август 1922 г.
Эта наполовину ужасающая, наполовину веселая иллюстрация 1922 года показывает ученых из Чикагского университета, выполняющих «трансмутацию элементов» или разложение атомов вольфрама на гелий и другие элементы.Способность взорвать атом дала ученым такую мощь, что «превращение свинца в золото становится тривиальной задачей». Фактически, с помощью атомной энергии «можно представить новую индустриальную эру, которая заставляет угольный век казаться действительно средневековым». Ах да, в ту первобытную эпоху, когда мы использовали уголь. Читайте полную историю в Science, в Newest Feat, Explodes Atom.Периодический закон: июнь 1901 г.
Popular Science в 1901 году опубликовал раннюю версию таблицы Менделеева, которая содержала почти столько же вопросительных знаков, сколько и официальных элементов.Должен ли натрий падать с медью, серебром и золотом или литием и калием? И принадлежал ли кислород к группе хрома и молибдена или серы и селена? Профессор Джас. Льюис Хоу из Вашингтона и Университета Ли предсказали, что, хотя ученые очень мало знали о химических элементах, Периодический закон почти наверняка станет «самой основой химии», с таким же большим влиянием, как гравитация и эволюция в их соответствующих поля ». Полный текст читайте в Периодическом законе.На стихиях: август 1872 г.
Еще в 1872 году (год, когда Popular Science впервые была опубликована в США), Уильям Одлинг объяснял теорию элементов. «Вся материя Земли… насколько химики еще знакомы с ней, состоит из примерно 63 различных видов материи, которые считаются элементарными». Элементы – это то, чем они являются, потому что «ни в ходе Природы, ни в художественных процессах они не подвергались разложению.Одлинг справедливо предположил, что наука продолжит открывать новые элементы, «возможно, в ближайшие столетия». Читайте полный рассказ в Об открытии элементов.Разница между Менделеевым и современной периодической таблицей
Размещено Мадху
Ключевое различие между Менделеевской и современной периодической таблицей состоит в том, что основой современной периодической таблицы является в основном электронная конфигурация элементов, которую мы называем атомным номером, тогда как В периодической таблице Менделеева это атомная масса элементов.
Давайте посмотрим, что такое периодическая таблица Менделеева и что такое современная периодическая таблица, а затем сравним их, чтобы понять разницу между Менделеевской и современной периодической таблицей. Менделеев является пионером современной таблицы Менделеева после многочисленных изменений старой версии таблицы Менделеева. Обе эти попытки одинаково важны для научного сообщества; потому что без изобретения периодической взаимосвязи в элементах современные достижения в науке не достигли бы такой эпохи развития, как сегодня.
СОДЕРЖАНИЕ
1. Обзор и ключевые различия
2. Что такое периодическая таблица Менделеева
3. Что такое современная периодическая таблица
4. Сравнение бок о бок – Менделеев и современная периодическая таблица в табличной форме
5. Резюме
Что такое периодическая таблица Менделеева?
В 1869 году русский химик Дмитрий Менделеев и немецкий химик Лотар Мейер предложили таблицу периодических элементов на основе периодической повторяемости свойств. В 1864 году, до Менделеева, английский химик Джон Ньюлендс расположил элементы в порядке их атомной массы, при этом каждые восемь элементов обладают схожими свойствами.Он назвал это своеобразное отношение «законом октав». Однако мы не можем составить его закон для элементов, помимо кальция. Поэтому научное сообщество его не приняло.
Рисунок 01: Периодическая таблица Менделеева
По сравнению с классификацией Newland, система классификации Менделеева значительно улучшилась по двум причинам. Во-первых, элементы сгруппированы более точно в соответствии с их свойствами. Во-вторых, это сделало возможным предсказание свойств нескольких неоткрытых элементов.Например, Менделеев предположил существование неизвестного элемента под названием эка-алюминий и предсказал ряд его свойств. (Эка-значение на санскрите – «первый». Таким образом, эка-алюминий является первым элементом в группе алюминия). Когда через четыре года ученые открыли галлий, его свойства удивительно совпали с предсказанными свойствами эка-алюминия.
Таким образом, упомянуть о них можно было бы следующим образом;
В периодической таблице Менделеева 66 элементов.К 1900 году к этому списку ученые добавили еще 30 элементов, заполнив некоторые пустые места в таблице.
Что такое современная периодическая таблица?
В современной периодической таблице учитывается самая внешняя электронная конфигурация элементов в основном состоянии. В зависимости от типа подоболочки, которая заполняется электронами, мы можем разделить элементы на категории; типичные элементы, благородные газы, переходные элементы (или переходные металлы) и актиниды. Репрезентативные элементы – это (мы называем их основными групповыми элементами) группы от IA до 7A, все элементы которых имеют не полностью заполненные s или p подоболочки наивысшего главного квантового числа.За исключением гелия (He), все элементы 8A заполнены p-подоболочкой.
Рисунок 02: Современная периодическая таблица
Переходные металлы – это элементы с 1B и с 3B по 8B, где молекулы имеют не полностью заполненные d-подоболочки. Лантаноиды и актиниды иногда называют элементами f-блока, поскольку эти элементы имеют неполные f-орбитали.
В чем разница между Менделеевым и современной периодической таблицей?
Таблица Менделеева является основой современной таблицы Менделеева, которую мы используем сегодня.Он имеет 65 известных элементов, но с недавно обнаруженными элементами в современной периодической таблице 103 элемента. Ключевое различие между Менделеевской и современной периодической таблицей состоит в том, что в основе современной периодической таблицы в основном лежит электронная конфигурация элементов, которую мы называем атомным номером, тогда как периодическая таблица Менделеева учитывает атомную массу элементов.
В приведенной ниже инфографике подробно представлены различия между Менделеевской и современной периодической таблицей.
Резюме – Менделеев против современной периодической таблицы
Элементы с подобными химическими и физическими свойствами повторяются через определенные промежутки времени в современной периодической таблице, и в ней около 103 элементов. Когда Менделеев классифицировал их, в таблице Менделеева было всего 66 элементов. Однако Менделеев оставил пустые места в своей периодической таблице для неоткрытых элементов. Он также предположил периодическое изменение свойств элементов. Ключевое различие между Менделеевской и современной периодической таблицей состоит в том, что в основе современной периодической таблицы в основном лежит электронная конфигурация элементов, которую мы называем атомным номером, тогда как периодическая таблица Менделеева учитывает атомную массу элементов.
Артикул:
1. Либретексты. «3.1: Периодическая таблица Менделеева». Chemistry LibreTexts, Libretexts, 14 октября 2016 г. Доступно здесь
2. «Таблица Менделеева». Википедия, Фонд Викимедиа, 7 октября 2018 г. Доступно здесь
Изображение предоставлено:
1. «Периодическая таблица Менделеева, 1871 г.» Автор: NikNaks – собственная работа, (общественное достояние) через Commons Wikimedia
2. «Простая диаграмма периодической таблицы-en» Автор: Offnfopt – собственная работа, (общественное достояние) через Commons Wikimedia
Периодическая таблица
Периодическая таблицаКРАТКАЯ ИСТОРИЯ РАЗРАБОТКИ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
Хотя Дмитрия Менделеева часто считают «отцом» периодической таблицы Менделеева, работа многих ученых способствовала ее нынешней форме.
В начале
Необходимой предпосылкой к построению таблицы Менделеева было открытие отдельных элементов. Хотя такие элементы, как золото, серебро, олово, медь, свинец и ртуть известны с древних времен, это первое научное открытие элемента произошло в 1649 году, когда Хенниг Бранд открыл фосфор. В течение следующие 200 лет, обширные знания о свойствах элементов и их соединения были приобретены химиками (см. статья 1790 г. об элементах).К 1869 году было открыто 63 элемента. По мере того, как количество известных элементов росло, ученые начали распознавать закономерности в свойства и начали разрабатывать классификационные схемы.Закон триад
В 1817 году Иоганн Доберейнер заметил, что атомный вес стронция находится посередине между весами кальция и бария, элементов, обладающих схожими химическими свойствами. В 1829 году, после открытия триады галогенов, состоящей из хлора, брома и йода, и триады щелочных металлов из лития, натрия и калия, он предположил, что природа содержит триады элементов, средний элемент имел свойства, которые были средними для двух других членов, когда упорядочены по атомному весу (Закон триад).Эта новая идея триад стала популярной областью изучения. Между 1829 и 1858 годами ряд ученых (Жан Батист Дюма, Леопольд Гмелин, Эрнст Ленссен, Макс фон Петтенкофер и Дж. П. Кук) обнаружили, что эти типы химических отношений простираются за пределы триады. За это время к галогенной группе был добавлен фтор; кислород, сера, селен и теллур были сгруппированы в одно семейство, а азот, фосфор, мышьяк, сурьма и висмут были отнесены к другому. К сожалению, исследования в этой области были затруднены из-за того, что не всегда были доступны точные значения.
Первые попытки создания периодической таблицы
Если периодическая таблица рассматривается как упорядочение химических элементов, демонстрирующих периодичность химических и физических свойств, то за первую таблицу Менделеева (опубликованную в 1862 г.), вероятно, следует отдать должное французскому геологу А. Э. Бегье де Шанкуртуа. Де Шанкуртуа записал список элементов, расположенных на цилиндре, с точки зрения увеличения атомного веса. Когда цилиндр был сконструирован так, что на цилиндр можно было записать 16 единиц массы за оборот, тесно связанные элементы были выстроены вертикально.Это привело де Шанкуртуа к предположению, что «свойства элементов являются свойствами чисел». Де Шанкуртуа был первым, кто осознал, что элементные свойства повторяются каждые семь элементов, и, используя эту диаграмму, он смог предсказать стехиометрию нескольких металлических оксидов. К сожалению, в его диаграмму помимо элементов входили ионы и соединения.Закон октав
Джон Ньюлендс, английский химик, написал в 1863 году работу, в которой классифицировал 56 установленных элементы в 11 групп на основе схожих физических свойств, отмечая, что многие существовали пары одинаковых элементов, которые отличались кратностью восьми в атомный вес.В 1864 году Ньюлендс опубликовал свою версию таблицы Менделеева и предложил Закон октав (по аналогии с семью интервалами музыкального масштаб). Этот закон гласил, что любой данный элемент будет демонстрировать аналогичное поведение. к восьмому элементу, следующему за ним в таблице.Кто является отцом Периодической таблицы?
Были некоторые разногласия по поводу того, кто заслуживает похвалы за то, что он «отец». периодической таблицы, немец Лотар Мейер (на фото) или россиянин Дмитрий Менделеев.Оба химика дали удивительно похожие результаты. при этом работая независимо друг от друга. Учебник Мейера 1864 года включены довольно сокращенная версия периодической таблицы, используемой для классификации элементы. Он состоял примерно из половины известных элементов, перечисленных в порядке их атомного веса и продемонстрировали периодические изменения валентности как функцию атомной массы. В 1868 году Мейер сконструировал удлиненный стол. которую он отдал коллеге на оценку.К несчастью для Мейера, менделеевская таблица стала доступна научному сообществу через публикацию (1869 г.) до того, как Появился Мейер (1870).
Менделеев Дмитрий Иванович (1834-1907), родился младший из 17 детей. в сибирском городе Тобольске, где его отец был учителем русской литературы и философия (портрет Ильи Репина). Менделеева не считали выдающийся ученик в раннем образовании отчасти из-за его неприязни к классические языки, которые были важным образовательным требованием в то время даже при том, что он проявил мастерство в математике и естественных науках.После того, как его отец После смерти он и его мать переехали в Санкт-Петербург, чтобы получить университетское образование. После отказа в приеме как в Московский, так и в Санкт-Петербургский университет Университет из-за его провинциального происхождения и безупречного академического образования, наконец-то он получил место в Главном педагогическом институте (Санкт-Петербург). Институт). По окончании учебы Менделеев занял должность преподавателя естествознания в гимназия. Проработав учителем, он был допущен к работе в аспирантуре Св.Петербургский университет, в котором он получил степень магистра в 1856 году. Менделеев Т. на своих преподавателей произвел впечатление, что его пригласили читать лекции по химии. После проведя 1859 и 1860 гг. в Германии, продолжая свои химические исследования, он обеспечил должность профессора химии СПбГУ, должность он оставался до 1890 года. При написании учебника по систематической неорганической химии, Принципы химии , вышедшие в тринадцати изданиях последних в 1947 году Менделеев организовал свой материал в терминах семей известные элементы, обладающие аналогичными свойствами.Первая часть Текст был посвящен хорошо известной химии галогенов. Далее он выбрал чтобы охватить химию металлических элементов в порядке объединения мощности – сначала щелочные металлы (объединяющие мощность одного), щелочноземельные металлы (два) и т. д. Однако было трудно классифицировать такие металлы, как медь и ртуть, которые имел несколько объединяющих способностей, иногда одну, а иногда две. Пока пытаюсь чтобы разобраться с этой дилеммой, Менделеев заметил закономерности в свойствах и атомных свойствах. массы галогенов, щелочных и щелочных металлов.Он заметил сходство между сериями Cl-K-Ca, Br- / Rb-Sr и I-Cs-Ba. В попытке продлить это шаблон для других элементов, он создал карту для каждого из 63 известных элементов. Каждая карта содержала символ элемента, атомный вес и его характеристику. химические и физические свойства. Когда Менделеев разложил карты на столе в порядке возрастания атомного веса группируют элементы схожих свойств вместе в манере, напоминающей раскладку карт в его любимом пасьянсе. карточная игра, терпение, периодическая таблица Менделеева была сформирована.Из этой таблицы Менделеев разработал свою формулировку периодического закона и опубликовал свою работу On Связь свойств элементов с их атомным весом в 1869 г. Преимущество таблицы Менделеева над предыдущими попытками состояло в что он показал сходство не только в небольших единицах, таких как трезвучия, но и показали сходство во всей сети вертикальных, горизонтальных и диагональных отношения. В 1906 году Менделеев едва ли не одним голосом был удостоен награды. Нобелевская премия за свою работу.
В то время, когда Менделеев разработал свою таблицу Менделеева, экспериментально определенные атомные массы не всегда были точными, он переупорядочил элементы, несмотря на их принятые массы. Например, он изменил вес бериллия с С 14 по 9. Это поместило бериллий в группу 2 выше магния, свойства которого он больше походил на то, чем был расположен над азотом. В все Менделеев обнаружил, что 17 элементов пришлось переместить на новые позиции из тех указывается строго атомным весом, чтобы их свойства коррелировали с другими элементы.Эти изменения указывают на то, что в принятом атомарном веса некоторых элементов (атомные веса рассчитывались путем объединения весов, вес элемента, который сочетается с данным весом стандарта.) Однако даже после того, как были внесены поправки путем переопределения атомных весов, некоторые элементы по-прежнему необходимо было расположить вне порядка их атомных весов. Из пробелов присутствующий в его таблице, Менделеев предсказал существование и свойства неизвестных элементы, которые он назвал эка-алюминием, эка-бором и эка-кремнием.Элементы Галлий, скандий и германий были обнаружены позже, чтобы полностью соответствовать его предсказаниям. хорошо. Помимо того, что таблица Менделеева была опубликована раньше Мейерса, его работа была более обширной, предсказывая новые или отсутствующие элементы. Во всем Менделеева предсказал существование 10 новых элементов, семь из которых были в конечном итоге обнаружены – остальные три, атомные веса 45, 146 и 175 не существуют. Он также был неверно в предположении, что пары элементов аргон-калий, кобальт-никель и теллур-йод следует поменять местами из-за неточной атомной веса.Хотя эти элементы и нужно было поменять местами, это произошло потому, что недостатка в рассуждении о том, что периодичность является функцией атомного веса.
Открытие благородных газов
В 1895 году лорд Рэлей сообщил об открытии нового газообразного элемента под названием аргон, который оказался химически инертным. Этот элемент не подходил ни к одной из известных периодических групп. В 1898 году Уильям Рэмси предложил поместить аргон в периодическую таблицу между хлором и калием в семье с гелием, несмотря на то, что атомный вес аргона был больше, чем у калия.Эта группа была названа «нулевой» из-за нулевой валентности элементов. Рэмси точно предсказал будущее открытие и свойства неона.Атомная структура и периодическая таблица
Хотя таблица Менделеева продемонстрировала периодическую природу элементов, на долю открытий ученых 20 века оставалось только объяснить, почему свойства элементов периодически повторяются.В 1911 году Эрнест Резерфорд опубликовал исследования рассеяния альфа-частиц тяжелыми ядра атомов, которые привели к определению заряда ядра.Он продемонстрировал что заряд ядра на ядре был пропорционален атомному весу элемент. В том же 1911 г. А. ван ден Брук в серии из двух работ предложил что атомный вес элемента был примерно равен заряду на атом. Этот заряд, позже названный атомным номером, можно было использовать для нумерации элементы в периодической таблице. В 1913 году Генри Мозли (см. рисунок) опубликовал результаты своих измерений длин волн рентгеновские спектральные линии ряда элементов, показавшие, что упорядочение длин волн рентгеновского излучения элементов совпадали с порядком элементов по атомному номеру.С открытием изотопов элементов, стало очевидно, что атомный вес не играл существенной роли в периодической закона, как предлагали Менделеев, Мейерс и другие, но, скорее, свойства элементы периодически менялись в зависимости от атомного номера.
На вопрос, почему существует периодический закон, ответили по мере развития ученых. понимание электронной структуры элементов, начиная с Нильса Исследования Бора организации электронов в оболочки через Г.Н. Льюис (см. картинку) открытия связывающих электронных пар.
Современная периодическая таблица
Последние важные изменения в таблице Менделеева явились результатом работы Гленна Сиборга. в середине 20 века. Начиная с его открытия плутония в 1940, он открыл все трансурановые элементы от 94 до 102. Он реконфигурировал периодической таблицы, поместив ряд актинидов ниже ряда лантанидов. В 1951 году Сиборг был удостоен Нобелевской премии. Премия по химии за его работу.Элемент 106 получил название сиборгий (Sg). в его честь.Университет Западного Орегона
Авторское право и копия 1997 Университет Западного Орегона
Формы периодической таблицы Менделеева
После нашего краткого введения в историю Периодического закона и его перевода в таблицу, мы хотели бы напомнить вам, что элементы и их отношения могут быть продемонстрированы множеством различных способов.
Дело в том, что периодическая таблица Менделеева искусственно разделена на ряды, а не является континуумом, даже если ряд элементов на самом деле линейный. Более того, в верхней части таблицы были вставлены очевидные пробелы; то есть H / He, Be / B и Mg / Al должны быть ближе в космосе. Это было сделано для того, чтобы в средних строках четко отображался период 18, в ущерб периоду 8, предшествующему ему, и периоду 32, идущему после него. Следовательно, стандартная таблица Менделеева не отражает фактическую линейность свойств элементов, отсюда усилия, которые некоторые приложили для разработки других (более точных) форм того же порядка элементов.
Сейчас мы покажем вам некоторые из наших любимых альтернативных аранжировок.
Периодическая таблица ипподрома (1933)Химик и писатель-фантаст Джон Кларк создал в 1933 году стол, похожий на гоночную трассу (слева), красиво окрашенная версия которого стала популярной после выпуска журнала LIFE об Атоме в 1945 году (справа). Эта неправильная спираль представляет собой систематическое расположение естественных элементов (далее до элемента 104) по количеству их электронов. Таблица настолько аккуратна, что элементы с похожими свойствами отображаются сгруппированными в блоки или соединенными сплошными стрелками (см., Например, инертные газы слева).
Нажмите для увеличения
Спиральная периодическая таблица (1960)
Подобно предыдущей, но с большей формой улитки, Теодор Бенфей предложил эту периодическую таблицу в начале 1960-х годов, которая также подчеркивает непрерывность элементов, а не наложение искусственных разрывов (показано как «Периодическое разделение» на изображении) . Таким образом, он более наглядно иллюстрирует различные периоды 8, 18 и 32, а также позволяет вводить новые элементы (суперактиниды).
(DePiep / Wikimedia / CC-BY-3.0)
Периодическая таблица из свернутой ленты (1975)
Это особенно красиво, хотя, вероятно, не так практично для повседневного использования. Он был создан в 1975 году химиком кремнийорганического соединения Джеймсом Ф. Хайдом, хотя здесь мы показываем репродукцию, сделанную Дж. Саксом в 2016 году. Точка зрения Хайда очевидна, поскольку кремний расположен прямо посередине (между двумя кружками), показывая также связи этого элемента со многими другими на графике (пунктирные линии).Список по-прежнему начинается с водорода (центр главного круга), а затем разбивается на разные группы. Разные цвета также подчеркивают периодические отношения элементов.
(Rezmason / Wikimedia / CC-BY-3.0)
Периодическая таблица Адома (2006)Его дизайнер Валерий Циммерман также назвал «Совершенной периодической таблицей». Идея восходит к предыдущей таблице Чарльза Джанет, который расположил элементы в соответствии с их электронной конфигурацией в своей Периодической таблице Left-Step (1928).Вместо этого система Адома основана на четырех квантовых числах электронной конфигурации.
Два из четырех квантовых чисел ( n и l ) отражены в традиционной периодической таблице. Однако только первые три периода следуют за квантовым числом n . После этого узор нарушается. Основные блоки традиционной таблицы Менделеева (т.е. блоки s, f, d и p) на самом деле представлены в порядке l = 0, 3, 2, 1, подчеркивая, что такое расположение действительно нелогично.Следует отметить, что элементы H и He расположены в двух разных положениях, чтобы отразить их двойную природу с точки зрения атомной структуры и химических свойств.
(Ch2902 / Викимедиа / CC-BY-SA-3.0)
Периодическая таблица дефицита элементов (2018)Ну, этот явно основан на самой традиционной схеме, но на самом деле выдает совершенно другую информацию. Это периодическая таблица с определенной целью!
Европейское химическое общество (EuChemS) разработало этот стол, чтобы заставить людей задуматься (и, надеюсь, действовать) над проблемой нехватки элементов.90 природных элементов, составляющих все (буквально!), Нарисованы таким образом, что площадь, занимаемая каждым элементом, дает представление о количестве этого элемента в земной коре и атмосфере. В частности, указаны элементы, используемые в смартфоне (около 30!), Более половины из которых могут быть в ограниченном количестве в ближайшие годы. Это должно показать, что мы потребляем некоторые элементы очень быстро, и их доступность может стать проблемой, если мы не найдем способы их переработать.
Следует отметить гелий, единственный элемент, который действительно «теряется в космосе», поскольку он настолько легкий, что избегает гравитации планеты.
Нажмите для увеличения
Периодическая таблица химических облигаций (2019)
Этим мы обязаны математикам из Института Макса Планка, которые исследовали почти 5000 веществ, содержащих два элемента в разных пропорциях. Каждый кружок в этом гиперграфе представляет связь, которую элемент устанавливает с органическим остатком. Затем связи упорядочиваются по их поляризуемости (где более поляризованные связи помещают элемент выше на графике). Здесь два элемента можно сравнить либо по прямой стрелке (например,например, связи водорода более поляризованы, чем связи бора) или цепочкой стрелок между ними (например, связи кислорода более поляризованы, чем связи брома). Наконец, элементы в кругах одного цвета демонстрируют аналогичное поведение привязки.
(Гильермо Рестрепо, MPI для математических наук)
Как видите, споры об идеальном расположении элементов все еще продолжаются. Например, ученые не всегда соглашаются с тем, где разместить лантан и актиний.Хотя на спиральное представление гораздо приятнее смотреть, практичность должна преобладать над эстетикой, а периодическая таблица из 18 столбцов, которую мы привыкли видеть, является наиболее практичной с точки зрения размера и удобочитаемости.

 Другая подпись – «Lith. von Ant. Hartinger & Sohn, Wien» — указывает на литографа, который, как выяснилось, умер в 1890 году. В ходе работы по установлению происхождения таблицы университет обратился за помощью и консультацией ко многим международным экспертам. Проведенное исследование указывает на то, что более ранней редакции этой таблицы, кажется, не существует. Профессор Эрик Шерри, эксперт в области истории периодической таблицы элементов из Калифорнийского университета в Лос-Анджелесе считает, что этот вариант таблицы был составлен между 1879 и 1886 годами. На такой вывод ему указали сами элементы, которые в ней отражены. Например, галлий и скандий, открытые в 1875 и 1885 годах, в ней присутствуют, а германий, который открыли лишь в 1886 году – отсутствует», — сообщается в пресс-релизе Сент-Эндрюсского университета.
Другая подпись – «Lith. von Ant. Hartinger & Sohn, Wien» — указывает на литографа, который, как выяснилось, умер в 1890 году. В ходе работы по установлению происхождения таблицы университет обратился за помощью и консультацией ко многим международным экспертам. Проведенное исследование указывает на то, что более ранней редакции этой таблицы, кажется, не существует. Профессор Эрик Шерри, эксперт в области истории периодической таблицы элементов из Калифорнийского университета в Лос-Анджелесе считает, что этот вариант таблицы был составлен между 1879 и 1886 годами. На такой вывод ему указали сами элементы, которые в ней отражены. Например, галлий и скандий, открытые в 1875 и 1885 годах, в ней присутствуют, а германий, который открыли лишь в 1886 году – отсутствует», — сообщается в пресс-релизе Сент-Эндрюсского университета.