Периодическая таблица элементов Д. И. Менделеева (к 150-летию периодического закона) Текст научной статьи по специальности «История и археология»
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА (К 150-летию периодического закона)
Фаращук Н.Ф., Бабков А.В.
MENDELEEV’S PERIODIC TABLE OF ELEMENTS (For sesquicentennial of Periodic Law)
Farashchuk N.F., Babkov A.V.
Дмитрий Иванович Менделеев (1834-1907)
В конце прошлого года Генеральной ассамблеей ООН 2019 г. провозглашен Международным годом Периодической таблицы химических элементов. Это событие посвящено 150-летию открытия периодического закона и первой публикации периодической таблицы химических элементов Д.И. Менделеевым, который внес, без преувеличения, неоценимый вклад в дальнейшее развитие химии. Периодический закон химических элементов и по сей день не теряет актуальности и значения для развития науки. Последнее десятилетие ознаменовалось открытием ряда химических элементов, завершающих седьмой период таблицы. Это достаточно убедительные основания, чтобы еще раз обозреть историю открытия и последующего развития периодического закона и периодической таблицы химических элементов Д.И. Менделеева.
Периодический закон химических элементов и по сей день не теряет актуальности и значения для развития науки. Последнее десятилетие ознаменовалось открытием ряда химических элементов, завершающих седьмой период таблицы. Это достаточно убедительные основания, чтобы еще раз обозреть историю открытия и последующего развития периодического закона и периодической таблицы химических элементов Д.И. Менделеева.
К истории открытия
На протяжении XIX в. были достигнуты большие успехи в химии, которая лишь в предшествующем веке окончательно поднялась над алхимией. В 1860 г. состоялся международный химический конгресс в Карлсруэ, подведший итоги становления химии как науки. Постоянно открывались новые химические элементы. К началу XIX в. их было известно 32, а к 1869 г. – году открытия периодического закона – 63, т.е. на протяжении 69 лет XIX в. число известных элементов почти удвоилось. В этот период перспективы дальнейшего открытия
элементов были совершенно не ясны. Только теперь мы знаем, что их числу предстояло еще раз почти удвоиться до 118 элементов на конец 2016 г.
Только теперь мы знаем, что их числу предстояло еще раз почти удвоиться до 118 элементов на конец 2016 г.
Ко времени открытия периодического закона элементы первых трех периодов были известны все, кроме благородных газов гелия, неона и аргона. В четвертом периоде недоставало рассеянных элементов скандия, галлия, германия и газа криптона, а в пятом – технеция и ксенона. В шестом периоде не были известны гафний, рений и неустойчивые элементы конца периода полоний, астат и радон. Среди лантаноидов были известны только лантан, церий, эрбий и дидим, оказавшийся впоследствии смесью четырех лантаноидов. Из 32 элементов последнего седьмого периода были известны только торий и уран.
В этот период вопросы взаимосвязей между элементами и их классификации не просто интересовали химиков, но и были очень актуальны практически. Химия представлялась крайне сложной областью науки, имеющей много фактов и мало обобщений.
Наличие сходства между разными элементами было очевидно. Например, галогены хлор, бром и йод химически активны, соединяются с металлами и неметаллами, образуя одну химическую связь, имеют запах и окраску, хорошо растворяются в органических жидкостях. Среди металлов хороший пример представляют похожие один на другой кальций, стронций и барий. Они химически активны, быстро реагируют с водой, выделяя водород, тускнеют на воздухе, каждый из них присоединяет два атома любого из галогенов. Еще ряд примеров подобного сходства между элементами привели немецкого химика И. Дёберейнера к идее группировки химических элементов в «триады» (1829). Эта идея была довольно плодотворна, но не все элементы вписывались в триады. Находились и более обширные группы сходных элементов (О, Бе, Те и К, Р, АБ, БЬ, ВО.
Английский химик Дж. Ньюлендс, работавший в промышленности, заметил (1865) наличие сходства в свойствах каждого восьмого элемента при расположении их в порядке увеличения атомных весов (масс), например:
Н Ы Ве В С N О Б № М§ А1 Р Б С1 К Са. . .
1 2 3 4 5 6 7 8(1) 2 3 4 5 6 7 8(1) 2 3 . . . Элементы с одинаковым номером в октаве (восьмерке элементов) являются аналогами. Это было первым обнаружением периодичности в свойствах элементов. Ньюлендс назвал обнаруженную закономерность законом октав. В группировке элементов по октавам Ньюлендс допустил немало произвола, но все же его октавы внесли идею периодичности свойств элементов. Использование Ньюлендсом музыкального термина октава, по-видимому, помешало химикам Королевского Общества оценить его идею. Профессором Дж. Фостером был даже задан вопрос, не пробовал ли автор расположить химические элементы по алфавиту? Но через 17 лет Ньюлендсу все же была присуждена медаль Дэви Английского Королевского Общества за открытие периодичности.
До Д.И. Менделеева наибольшего успеха в построении системы элементов достиг немецкий химик Лотар Мейер (1830-1895). В своей книге [10] он поместил таблицу элементов, расположенных в порядке возрастания атомных весов, и разделенных на 6 столбцов по валентности (табл. 1).
В таблице Мейер поместил 44 элемента из 63, известных к тому времени. В ней нет водорода, группа бора вообще отсутствует. Следует обратить внимание на точки на месте неизвестных элементов под кремнием, теллуром и йодом. Фактически, эта далекая от совершенства таблица могла явиться для Мейера, и не только для него, средством предсказания неизвестных химических элементов и их свойств. Прояви этот крупный ученый необходимую интуицию, воображение и смелость, и честь создания периодической таблицы элементов и открытия периодического закона могла бы достаться ему.
Ученый, обладавший такими дарованиями, уже был в России – Д. И. Менделеев. Пятью годами позднее Мейера, 1 марта 1869 г. он опубликовал периодическую таблицу (табл. 2) [5], более логичную и полную, чем таблица Мейера.
И. Менделеев. Пятью годами позднее Мейера, 1 марта 1869 г. он опубликовал периодическую таблицу (табл. 2) [5], более логичную и полную, чем таблица Мейера.
Первая таблица Менделеева включает все известные элементы, но она еще не окончательна. Не найдены правильные места для ртути, золота, таллия и свинца. Необычна разбивка элементов на периоды. Не вписывались в таблицу индий, иттрий и уран с ошибочными атомными весами. Но Менделеев понял, что таблица отражает реальный закон периодичности в свойствах элементов, и дал формулировку закона: Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса1.
1 В современной формулировке атомный вес заменен на заряд ядра атома элемента.
229
Таблица 1. Таблица элементов Л. Мейера (1864 г.)
Мейера (1864 г.)
Валентность 4 3 2 1 1 2
Элемент ы Ве
Вес 7,03 (9,03)
Элемент С N О Б № МЕ
Элемент 81 Р 8 С1 К Са
Вес 28,5 31,0 32,0 35,46 39,13 40,0
Элемент Аэ 8е Вг ЯЬ 8г
Вес 45,6 78,8 79,97 85,4 87,0
Элемент 8п 8Ь Те I Сэ
Вес 117,6 120,6 128,3 126,8 133,0
Элемент РЬ В1 Т1 Ва
Вес 207,0 208,0 (204,0?) 137,1
Вес 55,1 58,7 58,7 65,0 63,5
Элемент Бе
Вес 56,0
Элемент Яи ЯИ ра са АЕ
Вес 104,3 104,3 106,0 111,9 107,94
Элемент Р1 1г Оэ НЕ Аи
Вес 197,1 197,1 199,0 200,2 196,7
Продолжая развивать новые идеи, Менделеев в 1870-1871 гг.
Мейер, упустивший открытие, пытался отстаивать свой приоритет. Он работал над улучшением таблицы, но дальше этого не шел. За Мейером в качестве главной заслуги в области периодичности осталось обнаружение периодической зависимости атомного объема простого вещества2 от атомного веса.
Таблица 2. Таблица Менделеева, 1 марта 1869 г.
Н = 1
Ь1 = 7
Т1 = 50 гг = 90 ? = 180
V = 51 № = 94 Та = 182
Сг = 52 Мо = 96 W = 186
Мп = 55 ЯИ = 104,4 Рг = 197,4
Бе = 56 Яи = 104,4 1г = 198
№=Со = 59 Р1 = 106,6 Оэ = 199
Си = 63,4 АЕ = 108 НЕ = 200
Ве = 9,4 МЕ = 24 гп = 65 Са = 112
В = 9,4 А1 = 27,4 ? = 68 Иг = 116 Аи = 197
С = 12 81 = 28 ? = 70 8п = 118
N = 14 Р = 31 Аэ = 75 8Ь = 122 В1 = 210?
О = 16 8 = 32 8е = 79,4 Те = 128?
Б = 19 С1 = 35,5 Вг = 80 I = 127
№ = = 23 К = 39 ЯЬ = 85,4 Сэ = 133 Т1 = 204
Са = 40 8г = 87,6 Ва = 137 РЬ = 207
? = 45 Се = 92
?Ег = 56 Ьа = 94
?уг = 60 Б1 = 95
?1п = 75,6 ТИ=118?
Примечание. Позднее были изменены символы некоторых элементов: Р1—Иг—И; I—I; Уг—У; – элемент мнимый
Позднее были изменены символы некоторых элементов: Р1—Иг—И; I—I; Уг—У; – элемент мнимый
2 Атомный объем – это отношение атомной массы к плотности простого вещества.
230
Менделеев продолжал работу по устранению вопросов, касающихся расположения элементов в таблице. Некоторые исправления были внесены Менделеевым на основе собственных экспериментов (определение теплоемкости церия).
Работа наталкивалась на трудности, связанные с неточным определением атомных весов многих элементов. Ошибки могли быть связаны с несовершенством химико-аналитических методов, наличием примесей в веществах и с принятым неправильным значением валентности элемента. Возьмем для примера атомные веса (массы) в триаде осмия, иридия и платины:
08 1г Рг
1870 г.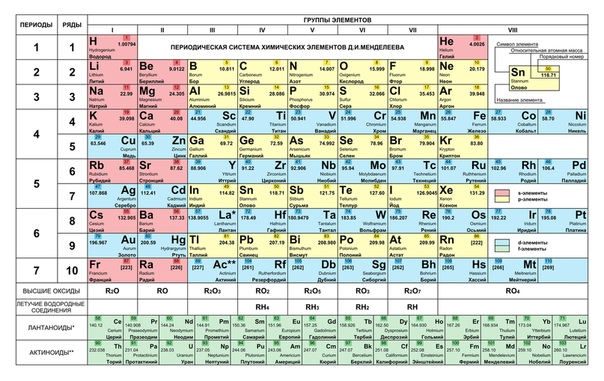 Рг, и оказался прав.
Рг, и оказался прав.
В случае принятого ошибочного значения валентности, вычисленная атомная масса отличается от истинной в несколько раз. Такие решительные изменения атомного веса сделаны для церия, иттрия, индия и урана. Для последнего принятый атомный вес 116 преобразовался в 240. Уран стал последним и самым тяжелым элементом в тогдашней таблице. По мере уточнения, все отклонения от последовательного возрастания атомных весов были устранены, за исключением пар Со-№ иТе-1. Эта неясность в таблице была объяснена с созданием теории атомного ядра и открытием изотопов.
После статей Менделеева, опубликованных в 1870-1871 гг. в науке наступил несколько затянувшийся период молчания по поводу периодического закона. Требовалось подтверждение периодического закона, и оно состоялось в результате открытия в горных породах трех предсказанных химических элементов. Первым оказался экаалюминий.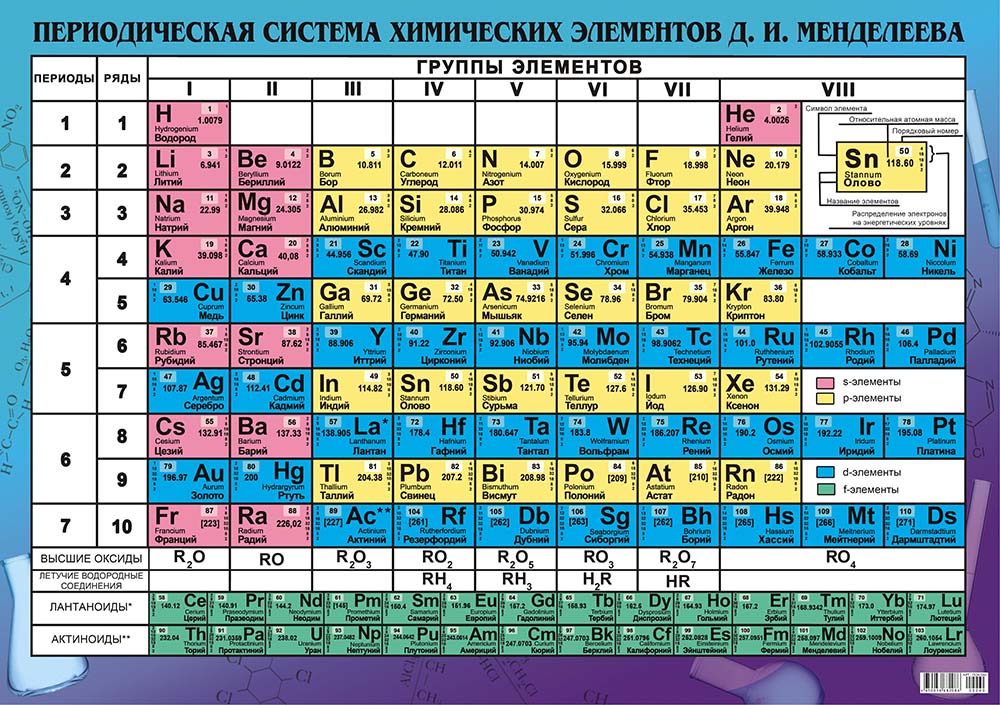 Французский химик П. Лекок де Буабодран в 1875 г. опубликовал в Докладах Парижской Академии сообщение об открытии нового элемента, названного галлием, и о важнейших его свойствах. Прочитав это сообщение и увидев, что свойства галлия практически совпадают со свойствами предсказанного им экаалюминия, Менделеев написал письмо своему французскому коллеге, и тот признал, что обнаружившееся совпадение предсказания с реальными свойствами элемента рассеивает все сомнения в справедливости предложенной системы элементов. Это было началом признания периодического закона. Затем Л. Нильсоном (1879) и К. Винклером (1886) были открыты ещё два элемента, получившие названия скандий и германий. Их свойства совпали с предсказанными Менделеевым экабором и экасилицием. Сопоставим прогнозируемые Менделеевым свойства экасилиция и определенные практически свойства германия (табл. 3).
Французский химик П. Лекок де Буабодран в 1875 г. опубликовал в Докладах Парижской Академии сообщение об открытии нового элемента, названного галлием, и о важнейших его свойствах. Прочитав это сообщение и увидев, что свойства галлия практически совпадают со свойствами предсказанного им экаалюминия, Менделеев написал письмо своему французскому коллеге, и тот признал, что обнаружившееся совпадение предсказания с реальными свойствами элемента рассеивает все сомнения в справедливости предложенной системы элементов. Это было началом признания периодического закона. Затем Л. Нильсоном (1879) и К. Винклером (1886) были открыты ещё два элемента, получившие названия скандий и германий. Их свойства совпали с предсказанными Менделеевым экабором и экасилицием. Сопоставим прогнозируемые Менделеевым свойства экасилиция и определенные практически свойства германия (табл. 3).
Таблица 3. Предсказанные свойства экасилиция и свойства германия
Экасилиций, Еб Германий (современные данные)
Атомный вес 72 Темносерый, тугоплавкий Удельный вес 5,5 Валентность 4 Удельный вес оксида Еб02 4,7 /кииЕбС14 ниже 100°С Удельный вес ЕбС14 1,9 Образует ве(С2И5)4 /кип 160°С, удельный вес 0,96 Атомная масса 72,64 Светлосерый, /пл 938°С Плотность 5,32 гсм-3 Валентность 4 и 2 Плотность ве02 4,25 гсм-3 /кипвеСЬ, 86,55°С Плотность веС14 1,88 гсм-3 /кипОе(С2И5)4 164,5°С Плотность ве(С2И5)4 1,199 гсм-3
Очевидно, что в большинстве пунктов совпадение прогноза с экспериментом очень хорошее. Германий и есть экасилиций. После этих открытий периодический закон Менделеева был безоговорочно признан химическим сообществом. Периодический закон стал и остается основным законом химии.
Германий и есть экасилиций. После этих открытий периодический закон Менделеева был безоговорочно признан химическим сообществом. Периодический закон стал и остается основным законом химии.
Ещё раз отметим, что первая таблица Менделеева была опубликована в 1869 г., а прогнозы свойств не открытых элементов в 1871 г. Еще раньше была опубликована таблица Мейера. Любой химик мог выступить с аналогичными прогнозами на основе этих таблиц на протяжении 6 лет с 1885 по 1870 г. Однако, никто не заметил возможностей, скрытых в таблицах, и предсказаний не сделал. Материал, ведущий к такому открытию, пролежал 6 лет, не привлекая внимания химиков!
Совершенно очевидно, что Менделеев как химик и мыслитель действительно стоял выше современных ему химиков, и его успех закономерен.
Заполнение периодической таблицы недостающими элементами
Формулировка периодического закона, данная Д. И. Менделеевым сохранила свой принципиальный смысл и даже словесное выражение до настоящего времени. В то же время содержание и форма таблицы Менделеева продолжали постоянно изменяться по мере открытия новых химических элементов и прогресса химии и физики, явившейся ключом к раскрытию причины периодичности, и давшей методы получения не существующих в природе (на Земле) химических элементов.
И. Менделеевым сохранила свой принципиальный смысл и даже словесное выражение до настоящего времени. В то же время содержание и форма таблицы Менделеева продолжали постоянно изменяться по мере открытия новых химических элементов и прогресса химии и физики, явившейся ключом к раскрытию причины периодичности, и давшей методы получения не существующих в природе (на Земле) химических элементов.
В 1871 г. Менделеев опубликовал короткопериодную форму таблицы, в которой все известные элементы, кроме эрбия заняли свои естественные позиции [4]. Имелись строчки (периоды, ряды) и колонки (группы) элементов. Информация об элементе состояла из его символа и атомного веса, разделенных знаком равенства. Позднее, в статье для энциклопедии в 1904 г. Менделеев дает таблицу [7] с клетками для каждого элемента.
После открытия трех предсказанных Менделеевым элементов, в XIX в. были открыты все элементы семейства лантана (редкоземельные элементы), кроме прометия и лютеция. Из-за неясности с размещением, редкоземельные элементы не спешили включать в таблицу. Австрийский (чешский) химик Б. Браунер в 1902 г. предложил размещать их в одной клетке после лантана как особую интерпериодическую группу.
Из-за неясности с размещением, редкоземельные элементы не спешили включать в таблицу. Австрийский (чешский) химик Б. Браунер в 1902 г. предложил размещать их в одной клетке после лантана как особую интерпериодическую группу.
В 1895-1898 гг. в атмосфере были открыты благородные газы аргон, неон, криптон и ксенон, а в урановых минералах открыто присутствие гелия. Эти элементы не были первоначально предсказаны на основе периодического закона. Однако, после открытия аргона и гелия было предположено, что аналогичные им элементы должны находиться в каждом периоде таблицы, что и помогло открытию неона, криптона и ксенона. Открытие совершенно новой группы элементов не подорвало доверия к таблице, а наоборот, укрепило его. Казалось вполне логичным, что переход от галогена в 7-й группе к активному щелочному металлу в первой группе происходит не с головокружительным скачком, а через находящийся между ними химически недеятельный элемент – благородный газ.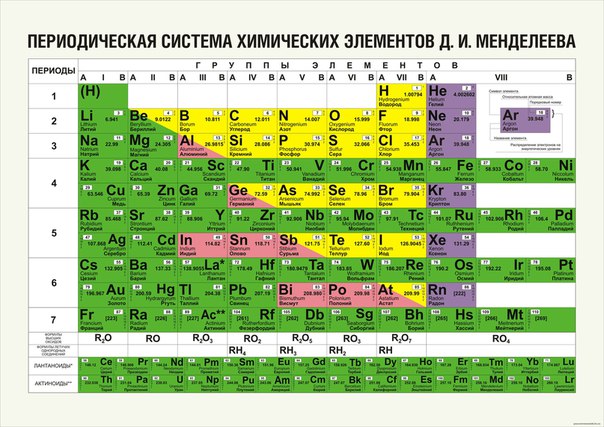 Отсутствие химической активности благородных газов ассоциировалось с нулевой валентностью. Поэтому для новых элементов создали нулевую группу, и поместили ее в таблице слева перед щелочными металлами. В результате этого, гелий оказался во втором периоде, а водород остался в одиночестве в первом периоде. Этот не очень удачный вариант таблицы был позднее исправлен переносом всей нулевой группы в концы периодов. Гелий перешел в 1-й период, неон во 2-й и т.д. Еще позднее нулевую группу включили в восьмую (после 1960 г.), и, наконец, по нумерации ИЮПАК она стала восемнадцатой.
Отсутствие химической активности благородных газов ассоциировалось с нулевой валентностью. Поэтому для новых элементов создали нулевую группу, и поместили ее в таблице слева перед щелочными металлами. В результате этого, гелий оказался во втором периоде, а водород остался в одиночестве в первом периоде. Этот не очень удачный вариант таблицы был позднее исправлен переносом всей нулевой группы в концы периодов. Гелий перешел в 1-й период, неон во 2-й и т.д. Еще позднее нулевую группу включили в восьмую (после 1960 г.), и, наконец, по нумерации ИЮПАК она стала восемнадцатой.
Неожиданное открытие целой новой группы элементов, закономерно вписавшейся в периодическую таблицу, создало возможность для Менделеева стать номинантом на присуждение Нобелевской премии [2]. Его поддерживали видные ученые в Швеции и в др. странах. Присуждение премии могло состояться в 1907 г., но в феврале этого года Менделеев умер.
В те же годы конца XIX в. А. Беккерелем было открыто явление радиоактивности. Изучая радиоактивность урана, выдающаяся французская ученый Мария Кюри в 1898 г. выделила из природного урана продукты его распада радиоактивные полоний и радий. В следующем году А. Дебьерном был открыт актиний. Открытие радиоактивных элементов имело огромные последствия, в том числе и для обнаружения новых химических элементов.
А. Беккерелем было открыто явление радиоактивности. Изучая радиоактивность урана, выдающаяся французская ученый Мария Кюри в 1898 г. выделила из природного урана продукты его распада радиоактивные полоний и радий. В следующем году А. Дебьерном был открыт актиний. Открытие радиоактивных элементов имело огромные последствия, в том числе и для обнаружения новых химических элементов.
Дальнейшее пополнение и совершенствование периодической таблицы опиралось на достижения физики в области исследования микромира. Последние годы XIX в. и начало XX отмечены великими открытиями в физике атома и природе излучения. Менее чем за 30 лет была доказана атомная структура вещества; раскрыта структура атома и его ядра, определены границы периодической системы элементов.
Атом оказался сложной частицей, образованной, как думали сначала, электронами и протонами. Первыми были открыты электроны в 1897 г.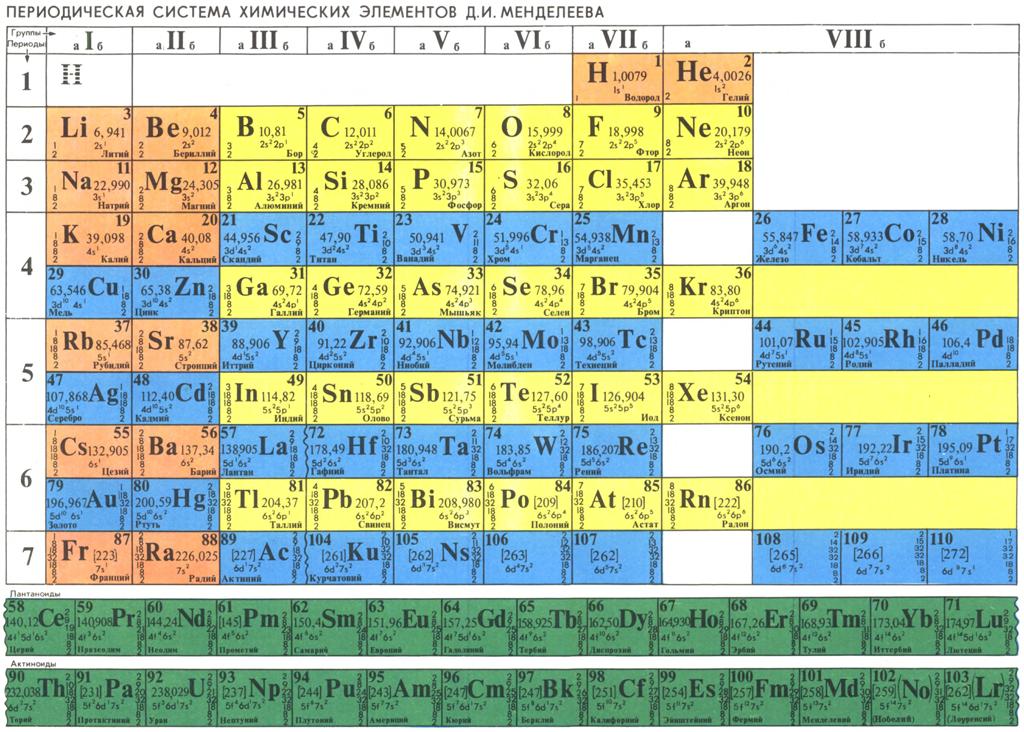 Дж. Томсоном; потом атомное ядро Э. Резерфордом в 1911 г. Резерфорд открыл также протон как составную часть ядра. Выяснилось также, что масса ядра больше, чем масса протонов, придающих ему положительный заряд. Правильное объяснение этого было найдено значительно позднее с открытием незаряженных частиц нейтронов (Чедвик, 1932). Одновременно стало понятным и явление изотопии, т.е. существование атомов одного химического элемента, имеющих разную массу. В ядрах атомов-изотопов разное число нейтронов. У элемента, имеющего несколько природных изотопов, определяемая практически атомная масса имеет среднее значение, зависящее от массы и доли отдельных изотопов. Этим объясняются случаи нарушения в последовательном возрастании атомных масс. В паре элементов Со-№ у
Дж. Томсоном; потом атомное ядро Э. Резерфордом в 1911 г. Резерфорд открыл также протон как составную часть ядра. Выяснилось также, что масса ядра больше, чем масса протонов, придающих ему положительный заряд. Правильное объяснение этого было найдено значительно позднее с открытием незаряженных частиц нейтронов (Чедвик, 1932). Одновременно стало понятным и явление изотопии, т.е. существование атомов одного химического элемента, имеющих разную массу. В ядрах атомов-изотопов разное число нейтронов. У элемента, имеющего несколько природных изотопов, определяемая практически атомная масса имеет среднее значение, зависящее от массы и доли отдельных изотопов. Этим объясняются случаи нарушения в последовательном возрастании атомных масс. В паре элементов Со-№ у
кобальта в природе один изотоп с точным значением массы 58,92. У никеля 5 изотопов, из которых только один легче кобальта, но на него приходится наибольшая доля 68%. В результате, средняя атомная масса никеля 58,69 меньше, чем у кобальта. Аналогичная ситуация и в паре Te-I.
Аналогичная ситуация и в паре Te-I.
В развитии учения о химических элементах важную роль сыграло изучение рентгеновских спектров атомов. Как установил молодой английский ученый Г. Мозли (1913), длина волны X характеристических линий излучения в рентгеновских спектрах зависит от природы атома, причем найдена линейная зависимость функции 1VX от порядкового номера элемента в таблице. Порядковый номер приобрел физический смысл. Сопоставление ряда известных фактов привело к выводу, что порядковый номер равен положительному заряду ядра и числу электронов, образующих с ядром нейтральный атом. В настоящее время порядковый номер называют атомным номером. Открытие, сделанное Мозли, позволило определить заряды ядер всех элементов, обнаружить наличие пропусков, соответствующих номерам еще неизвестных элементов, установить число элементов в каждом периоде и в семействе лантаноидов.
Неизвестным и несуществующим в природе оказался элемент №43 между молибденом и рутением.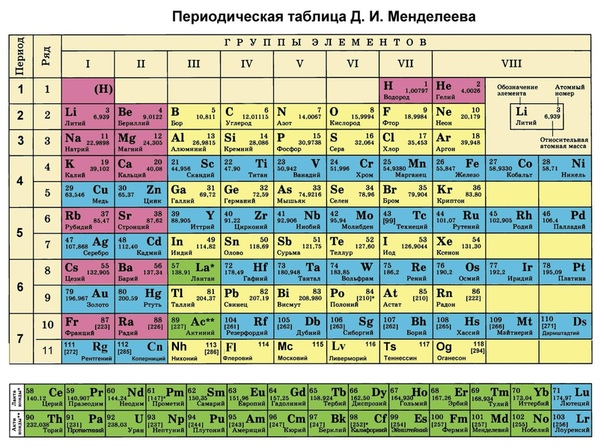 В 1937 г. его удалось обнаружить по излучению образца молибдена, облученного интенсивным потоком нейтронов. Атомы молибдена, поглотившие нейтроны, претерпевали Р-распад, превращаясь в атомы элемента-43. Этот радиоактивный элемент был назван технецием, что подчеркивает его искусственное получение.
В 1937 г. его удалось обнаружить по излучению образца молибдена, облученного интенсивным потоком нейтронов. Атомы молибдена, поглотившие нейтроны, претерпевали Р-распад, превращаясь в атомы элемента-43. Этот радиоактивный элемент был назван технецием, что подчеркивает его искусственное получение.
В свободных клетках таблицы могли оказаться как радиоактивные, так и устойчивые, но очень редкие элементы. Таковыми оказались элементы 6-го периода №72 (аналог титана и циркония) и №75 (аналог марганца и еще не известного технеция). Элемент-72 открыт в 1923 г. Костером и Хевеши в циркониевых рудах и назван гафнием. Элемент-75 был открыт в 1926 г. Ноддаком и Такке, и назван рением. Это последний по времени открытия устойчивый химический элемент. Последним радиоактивным элементом в окружении устойчивых оказался прометий №61, открытый в 1945 г. среди осколков распада урана в ядерных реакторах.
Радиохимическими методами были открыты радон (1911), протактиний (1918), франций (1939) и астат (1940) [8]. Таким образом, были заполнены все пустые клетки в таблице Менделеева до урана. В СССР, в изданиях до 1950 г. в таблице Менделеева были помещены только радиоактивные элементы, открытые ранее 1937 г.
Таким образом, были заполнены все пустые клетки в таблице Менделеева до урана. В СССР, в изданиях до 1950 г. в таблице Менделеева были помещены только радиоактивные элементы, открытые ранее 1937 г.
Существовал вполне понятный вопрос – каковы верхняя и нижняя границы периодической таблицы? До открытия сложной структуры атома допускалась возможность существования элементов более легких, чем водород. Когда обнаружилось, что у водорода атомный номер равен единице, поиск более легких элементов стал бессмысленным. Но позднее некоторыми учеными высказывалась идея о том, что химическим элементом следует считать нейтрон с атомным номером 0 (проф. Г.С. Воздвиженский, 1948 г.). Возражение против этого состояло в том, что химический элемент должен образовывать вещество. Нейтрон же неустойчив и вещества не образует. Однако, открытие звезд, состоящих из нейтронов, дает аргумент в пользу нейтрона как химического элемента. Вопрос остается открытым.
Нижняя граница таблицы Менделеева пока не может быть точно определена, т.к. зависит от возможности получения и идентификации неустойчивых тяжелых атомных ядер. Элементы, следующие, за ураном называют трансурановыми. Они получаются в результате захвата нейтронов и a-частиц (ядер гелия) тяжелыми ядрами, а также в результате воздействия ускоренных ядер легких элементов на ядра тяжелых элементов. Примеры:
В направлении от урана к более тяжелым элементам периоды полураспада быстро уменьшаются. Их ядра, состоящие из большого числа протонов и нейтронов, приближающегося к 300, становятся все менее устойчивы. Тяжелые атомы трудно накопить в большом количестве и трудно осуществлять исследование при их быстром распаде. Последним элементом, который удалось получить в граммовом количестве, является кюрий (№ 96). Следующий за ним берклий получен в количестве порядка ~10-6 мг.
У последнего элемента 7-го периода оганесона период полураспада удручающе мал – менее 0,1 мс. Вероятно, будут зарегистрированы и более тяжелые атомы, но пока мы отмечаем завершение седьмого периода.
Вероятно, будут зарегистрированы и более тяжелые атомы, но пока мы отмечаем завершение седьмого периода.
Трансурановые элементы названы в честь земель и городов, где находятся исследовательские ядерные центры, а также в честь ученых, сделавших выдающиеся научные открытия или участвовавших в получении новых элементов:
М. Кюри и П. Кюри – №96 кюрий, 1898 г. А. Эйнштейн – №99 эйнштейний, 1952 г. Э. Ферми – №100 фермий, 1952 г. Д.И. Менделеев – №101 менделевий, 1955 г. А. Нобель – №102 нобелий, 1958 г. Э. Лоуренс – №103 лоуренсий, 1961 г. Э. Резерфорд – №104 резерфордий, 1969 г. Г. Сиборг – №106 сиборгий, 1974 г. Н. Бор – №107 борий, 1981 г. Л. Мейтнер – №109 мейтнерий, 1992 г. В. Рентген – №111 рентгений, 2004 г. Н. Коперник – №112 коперниций, 2009 г. Г.Н. Флёров – №114 флеровий, 2012 г. Ю.Ц. Оганесян – №118 оганесон, 2016 г.
Физическая основа периодичности
Все химические элементы выстраиваются в ряд по увеличению заряда ядра (атомного номера) от единицы до 118. Этот ряд естественно расчленяется на отрезки разной длины, начинающиеся активным одновалентным металлом (только №1 – неметалл водород), и заканчивающиеся благородным газом. Эти отрезки, как известно, называются периодами. Причина периодичности обнаружилась в особом характере движения и изменения энергии электронов, образующих электронную оболочку атомного ядра.
Этот ряд естественно расчленяется на отрезки разной длины, начинающиеся активным одновалентным металлом (только №1 – неметалл водород), и заканчивающиеся благородным газом. Эти отрезки, как известно, называются периодами. Причина периодичности обнаружилась в особом характере движения и изменения энергии электронов, образующих электронную оболочку атомного ядра.
Для объяснения устойчивого движения электронов в атомах понадобилось создание квантовой теории, основы которой заложили М. Планк (1858-1947) и Н. Бор. Квантовая теория сначала была успешно применена к атому водорода, а потом с некоторыми дополнениями и ко всем другим атомам. Оказалось, что устойчивые (стационарные) орбиты электронов должны удовлетворять условиям квантования энергии – электрон на каждой орбите (орбитали) имеет определенную энергию.
Все электроны атома должны находиться в разных состояниях, и в порядке повышения заполнять орбитали с разными энергетическими и пространственными характеристиками. На орбитали может находиться один или два электрона. Орбитали группируются в т.н. подуровни 5 (одна орбиталь), р (три орбитали), й (пять орбиталей) и/(семь орбиталей). Подуровни объединяются в энергетические уровни, обозначаемые цифрами 1, 2, 3 и т.д. Принадлежность подуровня к определенному уровню задается цифрой. Например, 3р – это р-подуровень третьего уровня. По виду заполняющегося подуровня химические элементы группируются в 5-, р -, й-и / -блоки. Порядок возрастания энергии подуровней представлен на рисунке.
На орбитали может находиться один или два электрона. Орбитали группируются в т.н. подуровни 5 (одна орбиталь), р (три орбитали), й (пять орбиталей) и/(семь орбиталей). Подуровни объединяются в энергетические уровни, обозначаемые цифрами 1, 2, 3 и т.д. Принадлежность подуровня к определенному уровню задается цифрой. Например, 3р – это р-подуровень третьего уровня. По виду заполняющегося подуровня химические элементы группируются в 5-, р -, й-и / -блоки. Порядок возрастания энергии подуровней представлен на рисунке.
п (№ периода)
а
ы
И.
Е7-ЗВ \
Ш-1 \| | | | | | л_
шпв im.II: N11111111
35-1И
ш
. …….
…….
55-56*
у />/……
,……..
ШЗ
□ -37-3 Б*
N ы
,1 I I I ■
□ –
С™”- М
11-12*-
сш
□
5-15
“й”
/
Рис. Порядок возрастания энергии подуровней
Подуровни изображены в виде прямоугольников с разным числом клеток-орбиталей. Под фигурами вставлены атомные номера элементов, у которых данный подуровень является самым высоким по энергии, т.е. внешним; у этих элементов идет его заполнение электронами. Это стандартная последовательность, полностью соответствующая периодической системе элементов. Цифры по вертикальной оси диаграммы обозначают номера периодов. Номера й- и /-подуровней не совпадают с номером периода; их обозначения вписаны над левым углом фигуры. У отдельных элементов возможны отклонения от стандартной последовательности, но в периодической таблице они не учитываются.
Под фигурами вставлены атомные номера элементов, у которых данный подуровень является самым высоким по энергии, т.е. внешним; у этих элементов идет его заполнение электронами. Это стандартная последовательность, полностью соответствующая периодической системе элементов. Цифры по вертикальной оси диаграммы обозначают номера периодов. Номера й- и /-подуровней не совпадают с номером периода; их обозначения вписаны над левым углом фигуры. У отдельных элементов возможны отклонения от стандартной последовательности, но в периодической таблице они не учитываются.
При сопоставлении рисунка с таблицей Менделеева (табл. 4) оказывается, что атомные номера в фигурах с одинаковым фоном соответствуют элементам в блоках таблицы с таким же фоном. В последовательных группах таблицы слева направо добавляется по одному электрону, и в каждой группе элементы имеют одинаковое число внешних (валентных) электронов. В этом и кроется причина появления химически сходных элементов по мере перехода от периода к периоду.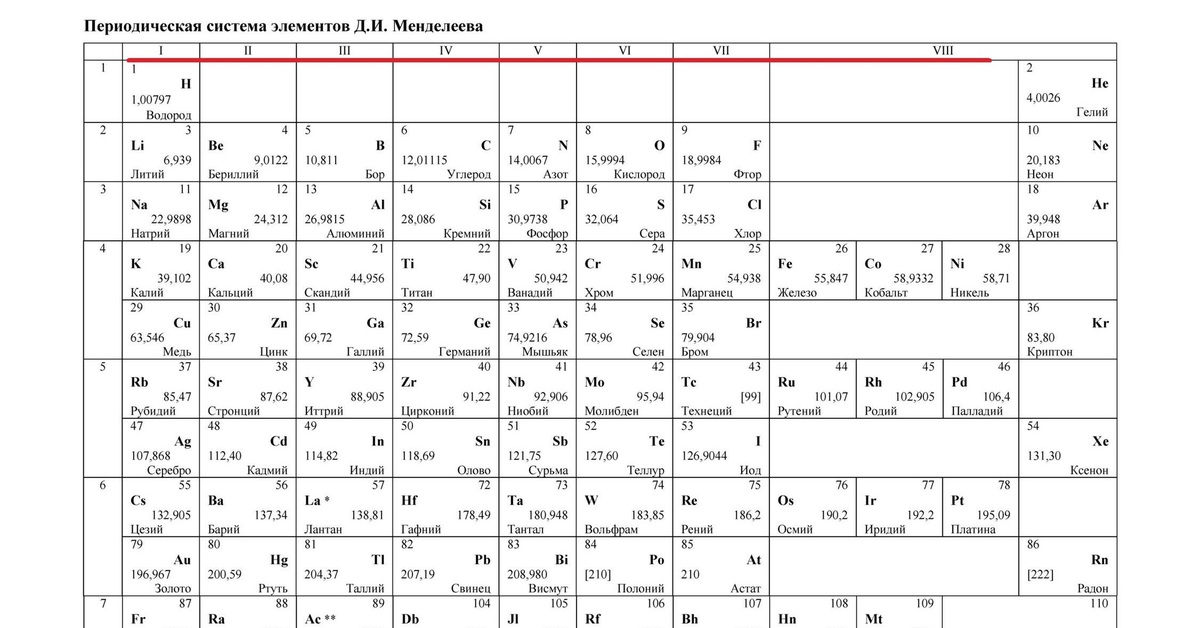
3 11 № 12 Mg 13 А1 14 Si 15 Р 16 S 17 С1 18 Аг
4 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
K Ca Sc И V Сг Мп Fe Со № Си Zn Са Се As Se Вг Кг
5 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
Rb Sr Y Zr №Ъ Мо Тс Ru Rh Ра Ag са 1п Sn Sb Те I Хе
6 55 56 * 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
Cs Ba Ьп Lu Ш Та W Re Os 1г Р1 Аи Из Т1 РЪ Bi Ро А1 Rn
7 87 88 ** 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118
Fr Ra Ап Lr Rf БЪ Sg вь № М1 Ds Rg Сп № F1 Мс Lv Ts Оз
/-блок элементов – лантаноиды (Ьп) и актиноиды (Ап)
*Ьп 57 58 59 60 61 62 63 64 65 66 67 68 69 70
Ьа Се Рг М Рт 8т Еи са ТЪ Бу Но Ег Тт УЪ
**Ап 89 90 91 92 93 94 95 96 97 98 99 100 101 102
Ас ть Ра и Кр Ри Ат Ст Вк Cf Ез Ет ма N0
Мысленно пройдем по последовательности химических элементов.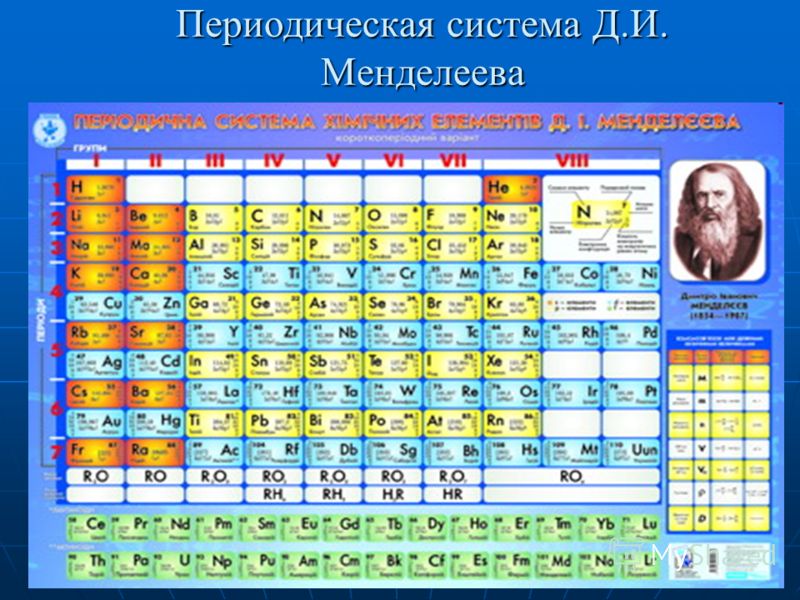 5p повторяется в пятом периоде.
5p повторяется в пятом периоде.
Шестой период, как видно из рисунка и таблицы Менделеева, удлинен еще на 14 элементов от лантана до иттербия заполнением 4/-подуровня. По предложению В. Гольдшмидта (1925) их стали называть лантаноидами (лантанидами). Аналоги лантаноидов в седьмом периоде названы актиноидами. Лантаноиды были своеобразной химической загадкой вплоть до 20-х годов прошлого столетия. Загадка сводится к проявлению всеми элементами семейства одной степени окисления +3, независимо от числа электронов на заполняющемся 4/подуровне. Это означает
235
участие в формировании валентности двух электронов 68-подуровня и только одного электрона 4/-подуровня. Лишь некоторые лантаноиды имеют добавочные менее устойчивые степени окисления +2 (8ш, Ей, УЬ) и +4 (Се, Рг, ТЬ). Из-за химического сходства разделение лантаноидов оказалось труднейшей технологической задачей. 7р с некоторыми отклонениями от стандартной последовательности.
7р с некоторыми отклонениями от стандартной последовательности.
В современной таблице Менделеева элементы /-блока заняли равноправное положение наряду с остальными элементами, и не задвигаются в «одну большую клетку» [1, 9]. Вынос лантаноидов и актиноидов в отдельные ряды под таблицей делается с единственной целью удобства печатания таблицы. В большинстве книг и отдельных изданий таблица Менделеева приводится в форме т.н. таблицы ШРАС с рекомендованной нумерацией групп от 1 до 18. Обычными сведениями об элементах, приводимыми в клетках таблицы, являются атомный номер, название, символ и атомная масса в дальтонах (Да). Эти сведения часто дополняются электронными конфигурациями атомов, степенями окисления и иногда также физическими свойствами простых веществ.
Можно уверенно утверждать, что таблица Менделеева является самой известной научной таблицей. И это вполне понятно, т.к. окружающая нас реальность, и мы сами состоим из веществ, химические элементы которых сохраняются при любых химических превращениях.
Литература (references)
1. Бабков А.В., Барабанова Т.И., Попков В.А. Общая и неорганическая химия. – М.: ГЭОТАР-Медиа., 2016. – 384 с. [Babkov A.V., Barabanova T.I., Popkov V.A. Obshhaja i neorganicheskaja himija. – M.: GJeOTAR-Media., 2016. – 384 p. (in Russian)]
2. Блох А.М. «Нобелиана» Дмитрия Менделеева // Природа. – 2002. – №2. – С. 72-77. [Bloh A.M. «Nobeliana» Dmitrija Mendeleeva // Priroda. – 2002. – №2. – P. 72-77. (in Russian)]
3. Леенсон И.А. Химические элементы за минуту. – М.: Издательство АСТ., 2017. – 159 с. [Leenson I.A. Himicheskie jelementy za minutu. – M.: Izdatel’stvo AST., 2017. – 159 p. (in Russian)]
4. Менделеев Д.И. О месте церия в системе элементов // Melanges physiques et chimiques. – 1871. – Т. 8. – С. 445-454. [Mendeleev D.I. O meste cerija v sisteme jelementov // Melanges physiques et chimiques. – 1871. -T.8. – P. 445-454. (in Russian)]
8. – С. 445-454. [Mendeleev D.I. O meste cerija v sisteme jelementov // Melanges physiques et chimiques. – 1871. -T.8. – P. 445-454. (in Russian)]
5. Менделеев Д.И. Опыт системы элементов, основанный на их атомном весе и химическом сходстве // Периодический закон. – Издательство Академии наук СССР, 1958. – С. 9. [Mendeleev D.I. Opyt sistemy jelementov, osnovannyj na ih atomnom vese i himicheskom shodstve // Periodicheskij zakon. – Izdatel’stvo Akademii nauk SSSR, 1958. – P. 9. (in Russian)]
6. Менделеев Д.И. Периодическая законность химических элементов // Liebig’ s Annalen. – 1871. – Т.8., Вып.2. – С. 133-229. [Mendeleev D.I. Periodicheskaja zakonnost’ himicheskih jelementov // Liebig’ s Annalen. – 1871. – T.8., Iss.2. – P. 133-229. (in Russian)]
7. Менделеев Д.И. Элементы (химические) // Энциклопедический словарь Брокгауза и Ефрона. – 1904. -Т.40. – Полутом 80. – С. 632-636. [Mendeleev D.I. Jelementy (himicheskie) // Jenciklopedicheskij slovar’ Brokgauza i Efrona. – 1904. – T.40. – Polutom 80. – P. 632-636. (in Russian)]
– 1904. -Т.40. – Полутом 80. – С. 632-636. [Mendeleev D.I. Jelementy (himicheskie) // Jenciklopedicheskij slovar’ Brokgauza i Efrona. – 1904. – T.40. – Polutom 80. – P. 632-636. (in Russian)]
8. Фигуровский Н.А. Открытие элементов и происхождение их названий. – М.: Наука., 1970. – 208 с. [Figurovskij N.A. Otkrytie jelementov i proishozhdenie ih nazvanij. – M.: Nauka., 1970. – 208 p. (in Russian)]
9. Эмсли Дж. Элементы. – М.: Мир., 1993. – 256 с. [Jemsli Dzh. Jelementy. – M.: Mir., 1993. – 256 p. (in Russian)]
10. Meyer L. Die modernen Theorien der Chemie und ihre Bedeutung fur die Chemische Statik. – Breslau, 1864. -137 p.
Информация об авторах
Фаращук Николай Федорович – доктор медицинских наук, профессор, заведующий кафедрой общей и медицинской химии ФГБОУ ВО «Смоленский Государственный медицинский университет» Минздрава России. E-mail: [email protected]
E-mail: [email protected]
Бабков Александр Васильевич – доктор химических наук, профессор кафедры химии ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России (Сеченовский университет). E-mail: [email protected]
Задание №2 ЕГЭ по химии
Закономерности изменения свойств.
Автор: Руслан Давыдов | Сайт: ege-rep.ru/blog/
Дмитрий Иванович Менделеев открыл периодический закон, согласно которому свойства элементов и образуемых ими изменяются периодически. Данное открытие было графически отображено в таблице Менделеева. По таблице очень хорошо и наглядно видно, как свойства элементов изменяются по периоду, после чего повторяются в следующем периоде.
Для решения задания №2 ЕГЭ по химии нам всего лишь нужно понять и запомнить, какие свойства элементов в каких направлениях изменяются и как.
Всё это отображено на рисунке ниже.
Слева направо растут электроотрицательность, неметаллические свойства, высшие степени окисления и т.д. А металлические свойства и радиусы уменьшаются.
Сверху вниз наоборот: растут металлические свойства и радиусы атомов, а электроотрицательность падает. Высшая степень окисления, соответствующая количеству электронов на внешнем энергетическом уровне, в этом направлении не меняется.
Разберём на примерах.
Пример 1. В ряду элементов Na→Mg→Al→Si
А) уменьшаются радиусы атомов;
Б) уменьшается число протонов в ядрах атомов;
В) увеличивается число электронных слоёв в атомах;
Г) уменьшается высшая степень окисления атомов;
Если посмотреть в таблицу Менделеева, то мы увидим, что все элементы данного ряда находятся в одном периоде и перечислены в том порядке, как они стоят в таблице с лева направо. Что бы ответить на вопрос такого рода нужно просто знать несколько закономерностей изменений свойств в периодической таблице. Так слева направо по периоду металлические свойства падают, неметаллические растут, электроотрицательность растёт, энергия ионизации растёт, радиус атомов уменьшается. По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
По группе сверху вниз металлические и восстановительные свойства растут, электроотрицательность падает, энергия ионизации уменьшается, радиус атомов растёт.
Если вы были внимательны, то уже поняли, что в данном случае уменьшаются радиусы атомов. Ответ А.
Пример 2. В порядке усиления окислительных свойств элементы расположены в ряду:
А. F→O→N
Б. I→Br→Cl
В. Cl→S→P
Г. F→Cl→Br
Как вы знаете, в периодической таблице Менделеева окислительные свойства растут слева направо по периоду и снизу вверх по группе. В варианте Б как раз приведены элементы одной группы в порядке снизу вверх. Значит Б подходит.
Пример 3. Валентность элементов в высшем оксиде увеличивается в ряду:
А. Cl→Br→I
Б. Cs→K→Li
В. Cl→S→P
Г. Al→C→N
В высших оксидах элементы проявляют свою высшую степень окисления, которая будет совпадать с валентностью. А высшая степень окисления растёт слева направо по таблице. Смотрим: в первом и втором вариантах нам даны элементы, находящиеся в одних группах, там высшая степень окисления и соответственно валентность в оксидах не меняется. Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
Cl→S→P – расположены справа налево, то есть у них наоборот валентность в высшем оксиде будет падать. А вот в ряду Al→C→N элементы расположены слева – направо, валентность в высшем оксиде увеличивается у них. Ответ: Г
Пример 4. В ряду элементов S→Se→Te
А) увеличивается кислотность водородных соединений;
Б) увеличивается высшая степень окисления элементов;
В) увеличивается валентность элементов в водородных соединениях;
Г) уменьшается число электронов на внешнем уровне;
Сразу смотрим на расположение этих элементов в таблице Менделеева. Сера, селен и теллур находятся в одной группе, одной подгруппе. Приведены в порядке сверху вниз. Смотрим еще раз на диаграмму выше. Сверху вниз в периодической таблице растут металлические свойства, растут радиусы, падает электроотрицательность, энергия ионизации и неметаллические свойства, количество электронов на внешнем уровне не меняется. Вариант Г сразу исключаем. Если число внешних электронов не меняется, то валентные возможности и высшая степень окисления тоже не меняется, Б и В – исключаем.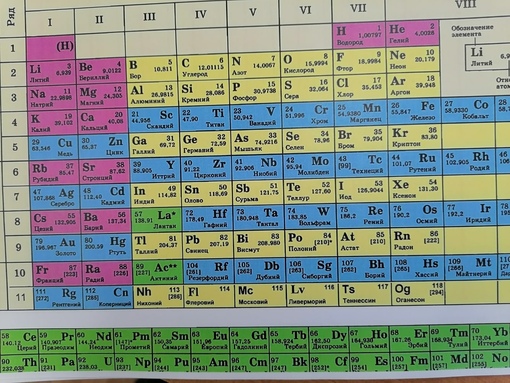
Остаётся вариант А. Проверяем для порядка. По схеме Косселя сила безкислородных кислот возрастает с уменьшением степени окисления элемента и увеличением радиуса его иона. Степень окисления у всех трёх элементов одинаковая в водородных соединениях, а вот радиус сверху вниз растёт, значит и сила кислот растёт.
Ответ – А.
Пример 5. В порядке ослабления основных свойств оксиды расположены в ряду:
А. Na2O→K2O→Rb2O
Б. Na2O→MgO→Al2O3
В. BeO→BaO→CaO
Г. SO3→P2O5→SiO2
Основные свойства оксидов ослабевают синхронно с ослабление металлических свойств элементов их образующих. А Ме- свойства ослабевают слева направо или снизу вверх. Na, Mg и Al как раз располагаются слева направо. Ответ Б.
Урок 25. классификация химических элементов.понятие о группах сходных элементов.периодический закон и периодическая таблица д. и. менделеева – Химия – 8 класс
Классификация химических элементов. Понятие о группах сходных элементов. Периодический закон и периодическая таблица Д. И. Менделеева
Понятие о группах сходных элементов. Периодический закон и периодическая таблица Д. И. Менделеева
Для ориентировки в мире окружающих нас веществ необходима их классификация. Попытки ее создать предпринимались с давних пор. Металлы уже с давних времён выделяли в отдельную группу. Михаил Васильевич Ломоносов говорил про металлы так: «Металлы – суть светлые тела, которые ковать можно». В этих словах заключено общее свойство металлов – ковкость. Если посмотреть на внешний вид металла, то мы заметим ещё одно сходство – все металлы обладают металлическим блеском. И ещё все металлы хорошо проводят тепло и электрический ток. Существуют физические свойства – общие для всех металлов, которые позволили их объединить под этим названием. А у неметаллов общих физических свойств нет. Общим в простых веществах-неметаллах является только то, что для них не характерны свойства металлов. На металлы и неметаллы стали разделять и химические элементы. Такая классификация была слишком условной, учёные не оставляли попыток боле точно классифицировать химические элементы.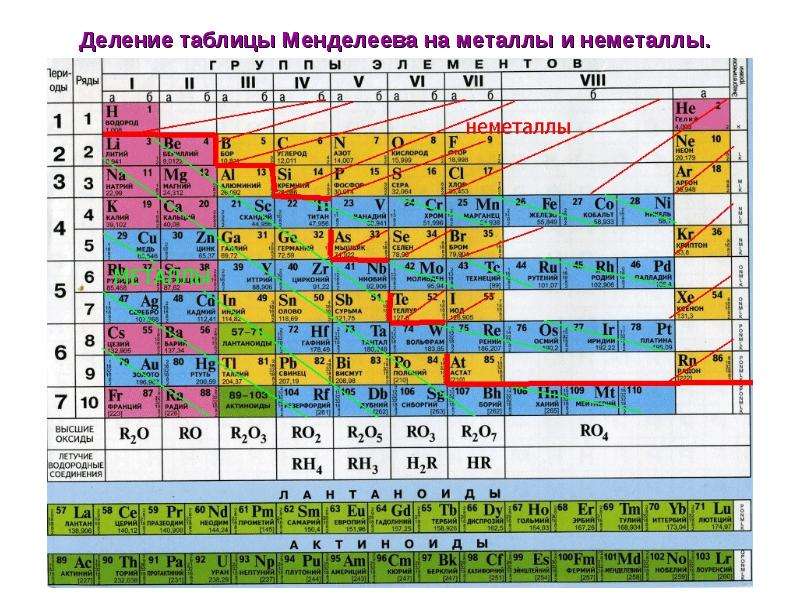
Дёберейнер Иоганн Вольфганг выявил сходство между химическими элементами, так называемое «Правило Триад»: элементы в триадах образуют сходные по составу со-единения и обладают сходными свойствами (например, общей формулой оксидов)
Li Na K;
Ca Sr Ba;
P As Sb;
S Se Te;
Cl Br I
В дальнейшем число элементов в триадах увеличилось до 4–5. Такие группы полу-чили своё название – естественные семейства химических элементов. К началу 60-х годов XIX века практически все известные химические элементы были объединены в естественные семейства.
Были предприняты и другие попытки создать единую систему химических элемен-тов. Александр Эмиль Бегье де Шанкуртуа Расположил химические элементы по спирали, пытаясь связать свойства с их атомной массой, Джон Александер Ньюлендс расположил элементы в таблицу по возрастанию их атомных масс и сформулировал закон Октав, Лотар-Юлиус Мейер рассмотрел общую систему химических элементов, расположив их по возрастанию атомных масс.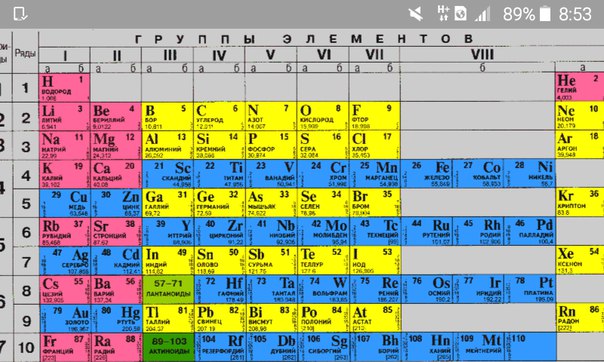
Все предложенные системы имели слишком много исключений из правил, в отли-чие от системы, созданной Дмитрием Ивановичем Менделеевым.
В основу системы были положены следующие подходы:
– расположение химических элементов в порядке возрастания их атомных масс;
учёт валентности и свойств образуемых ими соединений.
В таблице Менделеева были предусмотрены пробелы для ещё неоткрытых химиче-ских элементов. Открытие предсказанных химических элементов только подтвердило теорию Дмитрия Ивановича. С течением времени были изменены атомные массы некото-рых элементов, изменён порядок расположения элементов по сравнению с принципом возрастания атомной массы.
1869 год считается годом открытия периодического закона: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов».
Периодическую систему химических элементов можно представить в виде перио-дической таблицы. Каждый элемент занимает определённое место (клетку) и имеет свой порядковый (атомный) номер. Расположив химические элементы по возрастанию их атомных масс, Менделеев разделил эту последовательность на ряды (периоды), которые начинались щелочным металлом, а заканчивались инертным газом.
Расположив химические элементы по возрастанию их атомных масс, Менделеев разделил эту последовательность на ряды (периоды), которые начинались щелочным металлом, а заканчивались инертным газом.
Например, элементы третьего периода – 11Na 12Mg 13Al 14N 15P 16S 17Cl
В периодах постепенно увеличивается высшая валентность химических элементов, свойства металлов сменяются неметаллическими свойствами.
Вертикальные ряды химических элементов тоже получили своё название – группы.
Малые периоды состоят только из элементов главных подгрупп, символы химических элементов побочных подгрупп находятся сбоку от символов главных. Элементы одной подгруппы обладают сходными свойствами:
1. Одинаковое значение высшей валентности
2. Одинаковые общие формулы высших оксидов, летучих водородных соеди-нений, гидроксидов.
3. Сходство в свойствах простых веществ и соединениях химических элемен-тов.
Периодический закон, подготовка к ЕГЭ по химии
Периодический закон был открыт Д. И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими
соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими
соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в “строки и столбцы” – периоды и группы.
Период – ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 – называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в
высшем оксиде.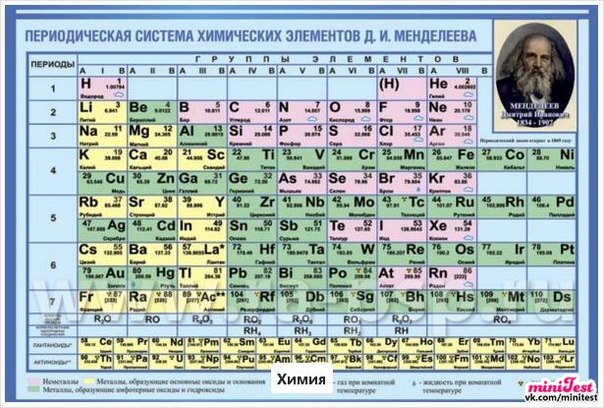 Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов (“→” слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде “←” справа налево.
В группе радиус атома увеличивается с увеличением заряда атомных ядер – сверху вниз “↓”. Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается – снизу вверх “↑”. Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.
Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня.
Так у бора на внешнем уровне расположены 3 электрона, у алюминия – тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует – там нужно считать электроны “вручную”, располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть то самое “сходство”:
- B5 – 1s22s22p1
- Al13 – 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для
бора, внешний уровень которого 2s22p1, алюминия – 3s23p1, галия – 4s24p1,
индия – 5s25p1 и таллия – 6s26p1. За “n” мы принимаем номер периода.
За “n” мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода – и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 🙂
Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных – только “вручную”.
Длина связи
Длина связи – расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую.
Чем больше радиус атома, тем больше длина связи.
Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую.
Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические – усиливаются (слева направо “→”). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические – ослабевают (сверху вниз “↓”).
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают
S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают
S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны – у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера – самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева – металлы.
Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные – возрастают. В группе с увеличением заряда атома основные
свойства усиливаются, а кислотные – ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые – убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF – самая слабая из этих кислот, а HI – самая сильная.
Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные – усиливаются. В группе с увеличением заряда
атома восстановительные свойства усиливаются, а окислительные – ослабевают.
В группе с увеличением заряда
атома восстановительные свойства усиливаются, а окислительные – ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные – с неметаллическими и кислотными. Так гораздо проще запомнить 😉
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность – способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус “-“.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома
они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д. И. Менделеева – это фтор.
И. Менделеева – это фтор.
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости “синонимичны” также понятия сродства к электрону – энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации – количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы – R2O3. Напишем высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3, Ga2O3.
На экзамене строка с готовыми “высшими” оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в “-” отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы – 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы – H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
| | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Химический справочник / / Таблица валентностей химических элементов.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Триады Дёберейнера • Иван Харитонов • Научно-популярные задачи на «Элементах» • Химия
1. С подтверждением закона всё довольно просто.
а) М = (Li, Na, K). Для первой группы справедливо, что все эти металлы имеют очень сильные восстановительные свойства — достаточные, чтобы доводить даже водород до степени окисления –1:
2M + H2 = 2MH,
и восстанавливают водород из воды:
2H2O + 2М = 2МOH + H2↑,
с галогенами образуют образует хорошо растворимые в воде соли:
2M + I2 = 2MI
2M + F2 = 2MF
2M + Cl2 = 2MCl
2M + Br2 = 2MBr
При этом металлы ВСЕГДА имеют степень окисления или +1 или 0:
2M + 2HCl (разб.) = 2MCl + H2
2M + 3H2SO4 (конц.) = 2MHSO4 + SO2↑ + 2H2O
3M + 4HNO3 (разб.) = 3MNO3 + NO↑ + 2H2O
2M + H2 = 2MH
4M + O2 = 2M2O
2M + S = M2S
6M + N2(влажн.) = 2M3N
6M + N2 = 2M3N
2M + 2C = M2C2
4M + Si = M4Si
2M + 2NH3 = 2MNH2 + H2
2M + NH3 = M2NH + H2
2NH3 + 2M = 2MNH2 + H2
NH3 + 2M = M2NH + H2.
б) M = (Ca, Sr, Ba). Металлы второй группы — тоже довольно сильные восстановители, но не такие активные, как металлы первой группы; также восстанавливают водород из воды, но при этом без взрыва:
2H2O + M = M(OH)2 + H2↑,
с галогенами они образуют соединения в степени окисления +2:
M + F2 = MF2
M + Cl2 = MCl2
M + Br2 = MBr2
M + I2 = MI2.
В принципе, металлы второй группы предпочитают соединения в степени окисления +2, степень окисления +1 встречается крайне редко; соответственно, в виде металлов они находятся в степени окисления 0:
2CO2 + 5M = MC2 + 4MO
2P (красн.)+ 3M = M3P2
2M + O2 = 2MO
V2O5 + 5M = 2V + 5MO
Cr2O3 + 3M = 2Cr + 3MO
2CrCl3 + 3M = 2Cr + 3MCl2
M + 2H2O = M(OH)2↓ + H2↑
2M + H2O (пар) = MO + MH2
M + 2HCl (разб.) = MCl2 + H2↑
4M + 10HNO3 (разб.) = 4M(NO3)2 + N2O↑ + 5H2O
4M + 10HNO3 (оч. разб.) = 4M(NO3)2 + NH4NO3 + 3H2O
M + H2 = MH2
2M + O2 = 2MO
M + S = MS
3M + N2 = M3N2
3M + 2P (красн.) = M3P2
M + 2C (графит) = MC2
6M + 2NH3 (г) = M3N2 + 3MH2
M + 6NH3 (ж)= [M(NH3)6] (син.)
M + 2NH3 (ж) = M(NH2)2↓ + H2↑
2As + M = MAs2
M + H2 = MH2
M + 2H2O = M(OH)2 + H2
3M + N2 = M3N2
M + 6NH3 = M(NH3)6
в) M = (P, As, Sb). Все три элемента третьей группы проявляют себя и как окислители, и как восстановители:
3Zn + 2M = Zn3M2
10NO + 4M = 5N2 + M4O10
10NO2 + 8M = 5N2 + 2M4O10
2M (красн.)+ 3Ca = Ca3M2
5HNO3 (конц.) + M = H3MO4 + 5NO2↑ + H2O.
Есть степени окисления –3, 0, +3, +5:
5HClO3 + 6M + 9H2O = 5HCl + 6H3MO4
2M + 3Cl2 = 2MCl3
2M + 8H2O = 2H3MO4 + 5H2
3M + 5HNO3 + 2H2O = 3H3MO4 + 5NO
4M + 10S = M4S10.
г) M = (S, Se, Te). Элементы из четвёртой группы проявляют как окислительные, так и восстановительные свойства:
H2 + M = H2M
2M + Br2 = M2Br2
M + 3F2 = MF6,
образуют устойчивые соединения в степенях окисления –2, 0, +4, +6, что является довольно характерной чертой:
M + H2 = H2M
2Ag + M = Ag2M
Zn + M = ZnM
Ni + M = NiM (черн.)
2Li + M = Li2M
2LiH + 2M = Li2M + H2M
C + 2M = CM2
CO + M = CMO
NaCN (разб.) + M = NaNCM
KCN (разб.) + M = KNCM
Mi + M = MiM
Mi + 2M = MiM2
Mn + 2M = MnM2
PbO2 + 2M = PbM + MO2
2PbCO3 + 3M = 2PbM + 2CO2 + MO2
2NO2 + 2M = N2 + 2MO2
4P (красн.) + 9M = P4M9
P4O6 + 9M = P4M6 + 3MO2
2NaH + 2M = Na2M + H2M
2Na2O2 + M = Na2MO3 + Na2O
P4M3 + 2M = P4M5
д) M = (Cl, Br, I). Для пятой группы, галогенов, предпочтительная степень окисления –1 и 0, но также есть +1, +3, +5, +7. Степени окисления +2, +4 неустойчивы. Все эти элементы — неметаллы и имеют, пожалуй, самый большой набор степеней окисления (и, соответственно, характерных соединений с другими элементами таблицы Менделеева):
Na2SO3 + 2NaOH + M2 = Na2SO4 + 2NaM + H2O
K2SO3 + 2KOH (конц.) + M2 = K2SO4 + 2KM + H2O
2Na + M2 = 2NaM
Zn + M2 = ZnM2
Ca + M2 = CaM2
Ba + M2 = BaM2
2Cr (порошок) + 3M2 = 2CrM3
2K + M2 = 2KM
2Ag + M2 = 2AgM
2Rb + M2 = 2RbM
SM + 2M2 = SMM4
2NH2OH + 2KOH (разб.) + M2 = N2↑ + 2KM + 4H2O
2NaOH (хол.) + M2 + H2S (г) = 2NaM + S↓ + 2H2O
M2 + 2NaOH (разб.) = NaM + NaMO + H2O
3M2 + 6NaOH (гор.) = 5NaM + NaMO3 + 3H2O
M2 + 5O3 + H2O = 2HMO3 + 5O2
5M2 + 2P (красн.) + 8H2O = 2H3PO4 + 10HM
M2 + 2Na = 2NaM
M2 + 7KrF2 = 2MF7 + 7Kr
M2 + 5H2O2 (конц., гор.) = 2HMO3 + 4H2O
M2 (суспензия) + H2S (насыщ.) = 2HM + S↓
M2 + SO2 + 2H2O = 2HM + H2SO4
HMO + M2 = M2•HMO
2Cr + 3M2 = 2CrM3 (черн.)
Cr + M2 = CrM2 (красн.)
Fe + M2 = FeM2
2Al (порошок) + 3M2 = 2AlM3
Na2CO3 (конц., гор.) + 3M2 = 5NaM + NaMO3 + 3CO2↑
H2 + M2 = 2HM
M2 + AgNO3 = AgM + MNO3
M2 + H2SO3 + H2O = H2SO4 + 2HM
M2 + 10HNO3 = 2HMO3 + 10NO2 + 4H2O
2M2 + 3O3 = M4O9
N2H4 + 2M2 = 4HM + N2
2. А вот с опровержением всё гораздо интереснее.
а) Для первой группы всё довольно просто, надо рассмотреть реакции с кислородом или озоном:
литий всегда будет образовывать оксиды:
4Li + O2 = 2Li2O,
натрий стремится образовывать пероксиды:
2Na + O2= Na2O2,
а калий — надпероксиды или супероксиды:
K + O2 = KO2,
а при реакции с озоном:
K + O3 = KO3.
б) Со второй группой возникают значительные проблемы, но, в общем, тоже на мелочах можно попытаться сыграть:
кальций не образует озонидов, то есть
МО2 + O3 = MO3 (M = Sr, Ba),
а Ba(OH)2 неплохо растворим в воде — в отличие от своих соседей по группе. Поскольку в неорганической химии вообще малорастворимых гидроксидов, это весьма важно.
в) Фосфор, в отличие от своих соседей по группе, представляет стабильную систему из тетраэдров P4 (в отличие от мышьяка и сурьмы, которые имеют металлическую решетку, а также образуют устойчивый оксид M4O6 (в отличие от фосфора, который мгновенно на воздухе окисляется от P4O7 до P4O9 — да, тут школьные учебники врут).
В строение высших оксидов они тоже весьма значительно различаются: сурьма стремиться образовывать октаэдрические структуры, а фосфор — тетраэдрические; мышьяк образует промежуточные варианты, то есть смесь октаэдров и тетраэдров.
Кроме того, Sb2O5 не гигроскопичен (не стремится забрать воду из воздуха) и вообще не растворяется в воде.
г) Сера в виде простого вещества устойчива в похожем на корону состоянии S8.
Селен при восстановлении тоже образует так называемый красный селен Se8, но он не устойчив и переходит в полимерные цепочки.
Теллур их сразу образует.
Кроме того, селеновая кислота образует устойчивые комплексы с золотом и имеет соединение, в котором проявляет степень окисления «5+»: Se2O5.
Теллуровые соли, как правило, ортосоли, то есть имеют остаток в виде TeO6(6–).
Показательной также является реакция сернистой, селенистой и теллуристой кислот с йодом:
H2SO3 + I2 = (реакция не идёт)
H2SeO3 + I2 = HIO3 + Se + H2O
H2TeO3 + I2=H4TeI4(OH)2
д) Ну и, наконец, с галогенами всё тоже довольно очевидно:
хлор — типичный окислитель, йод — типичный восстановитель, и относить их в одну группу, на первый взгляд, довольно странно.
Таблица Менделеева
Периодическая таблица Менделеева
Таблица Менделеева, (или периодическая система химических элементов) – это таблица, которая квалифицирует химические элементы по различным свойствам, зависящим от заряда атомного ядра. Эта система выражает, в виде таблицы, периодический закон химических элементов, который в 1869 году открыл Русский ученый химик Д.И. Менделеев. Самый первый вариант таблицы, был разработан Менделеевым в 1869-1871 годах, он определял зависимость свойств химических элементов, от атомной массы (в то время это называлось атомным весом). Было предложено несколько сотен различных вариантов изображения свойств химических элементов, от аналитических кривых графиков, и до различных геометрических фигур. Но ученые, в конце концов, сошлись во мнении, что самым удобным вариантом будет изображение в виде двухмерной таблицы, в которой каждый столбик будет указывать на физико-химические свойства того или иного элемента, а периоды элементов приближенных друг к другу, будут определять строки таблицы.
Открытие, сделанное Русским химиком Менделеевым, сыграло (безусловно) наиболее важную роль в развитии науки, а именно в развитии атомно-молекулярного учения. Это открытие позволило получить наиболее понятные, и простые в изучении, представления о простых и сложных химических соединениях. Только благодаря таблице мы имеем те понятия об элементах, которыми пользуемся в современном мире. В ХХ веке проявилась прогнозирующая роль периодической системы при оценке химических свойств, трансурановых элементов, показанная еще создателем таблицы.
Разработанная в ХIХ веке, периодическая таблица Менделеева в интересах науки химии, дала готовую систематизацию типов атомов, для развития ФИЗИКИ в ХХ веке (физика атома и ядра атома). В начале ХХ века, ученые физики, путем исследований установили, что порядковый номер, (он же атомный), есть и мера электрического заряда атомного ядра этого элемента. А номер периода (т.е. горизонтального ряда), определяет число электронных оболочек атома. Так же выяснилось, что номер вертикального ряда таблицы определяет квантовую структуру внешней оболочки элемента, (этим самым, элементы одного ряда, обязаны сходством химических свойств).
Открытие Русского ученого, ознаменовало собой, новую эру в истории мировой науки, это открытие позволило не только совершить огромный скачек в химии, но так же было бесценно для ряда других направлений науки. Таблица Менделеева дала стройную систему сведений об элементах, на основе её, появилась возможность делать научные выводы, и даже предвидеть некоторые открытия.
Одна из особенностей периодической таблицы Менделеева, состоит в том, что группа (колонка в таблице), имеет более существенные выражения периодической тенденции, чем для периодов или блоков. В наше время, теория квантовой механики и атомной структуры объясняет групповую сущность элементов тем, что они имеют одинаковые электронные конфигурации валентных оболочек, и как следствие, элементы которые находятся в пределах одой колонки, располагают очень схожими, (одинаковыми), особенностями электронной конфигурации, со схожими химическими особенностями. Так же наблюдается явная тенденция стабильного изменения свойств по мере возрастания атомной массы. Надо заметить, что в некоторых областях периодической таблицы, (к примеру, в блоках D и F), сходства горизонтальные, более заметны, чем вертикальные.
Таблица Менделеева содержит группы, которым присваиваются порядковые номера от 1 до 18 (с лева, на право), согласно международной системе именования групп. В былое время, для идентификации групп, использовались римские цифры. В Америке существовала практика ставить после римской цифры, литер «А» при расположении группы в блоках S и P, или литер «В» – для групп находящихся в блоке D. Идентификаторы, применявшиеся в то время, это то же самое, что и последняя цифра современных указателей в наше время (на пример наименование IVB, соответствует элементам 4 группы в наше время, а IVA – это 14 группа элементов). В Европейских странах того времени, использовалась похожая система, но тут, литера «А» относилась к группам до 10, а литера «В» – после 10 включительно. Но группы 8,9,10 имели идентификатор VIII, как одна тройная группа. Эти названия групп закончили свое существование после того как в 1988 году вступила в силу, новая система нотации ИЮПАК, которой пользуются и сейчас.
Многие группы получили несистематические названия травиального характера, (к примеру – «щелочноземельные металлы», или «галогены», и другие подобные названия). Таких названий не получили группы с 3 по 14, из за того что они в меньшей степени схожи между собой и имеют меньшее соответствие вертикальным закономерностям, их обычно, называют либо по номеру, либо по названию первого элемента группы (титановая, кобальтовая и тому подобно).
Химические элементы относящиеся к одной группе таблицы Менделеева проявляют определенные тенденции по электроотрицательности, атомному радиусу и энергии ионизации. В одной группе, по направлению сверху вниз, радиус атома возрастает, по мере заполнения энергетических уровней, удаляются, от ядра, валентные электроны элемента, при этом снижается энергия ионизации и ослабевают связи в атоме, что упрощает изъятие электронов. Снижается, так же, электроотрицательность , это следствие того, что возрастает расстояние между ядром и валентными электронами. Но из этих закономерностей так же есть исключения, на пример электроотрицательность возрастает, вместо того чтобы убывать, в группе 11, в направлении сверху вниз. В таблице Менделеева есть строка, которая называется «Период».
Среди групп, есть и такие у которых более значимыми являются горизонтальные направления (в отличии от других, у которых большее значение имеют вертикальные направления), к таким группам относится блок F, в котором лантаноиды и актиноиды формируют две важные горизонтальные последовательности.
Элементы показывают определенные закономерности в отношении атомного радиуса, электроотрицательности, энергии ионизации, и в энергии сродства к электрону. Из-за того, что у каждого следующего элемента количество заряженных частиц возрастает, а электроны притягиваются к ядру, атомный радиус уменьшается в направлении слева направо, вместе с этим увеличивается энергия ионизации, при возрастании связи в атоме – возрастает сложность изъятия электрона. Металлам, расположенным в левой части таблицы, характерен меньший показатель энергии сродства к электрону, и соответственно, в правой части показатель энергии сродства к электрону, у не металлов, этот показатель больше, (не считая благородных газов).
Разные области периодической таблицы Менделеева, в зависимости от того на какой оболочке атома, находится последний электрон, и в виду значимости электронной оболочки, принято описывать как блоки.
В S-блок, входит две первые группы элементов, (щелочные и щелочноземельные металлы, водород и гелий).
В P-блок, входят шест последних групп, с 13 по 18 (согласно ИЮПАК, или по системе принятой в Америке – с IIIA до VIIIA), этот блок так же включает в себя все металлоиды.
Блок – D, группы с 3 по 12 (ИЮПАК, или с IIIB до IIB по-американски), в этот блок включены все переходные металлы.
Блок – F, обычно выносится за пределы периодической таблицы, и включает в себя лантаноиды и актиноиды.
Расшифровка: Химия в ее элементе: теллур(Promo) Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества. (Окончание акции) Крис Смит Здравствуйте! На этой неделе Dr.Кто может упомянуть, поскольку мы открываем историю о слизистом элементе, от которого люди воняют чесноком и делают их пальцы черными. А вот и Питер Уотерс, рассказывающий о теллуре. Питер Уотерс Теллур, он звучит как монстр из Доктора Кто, и во многих отношениях этот элемент действительно имеет несколько свойств, которые сделали бы его подходящим для любого хорошего космического научно-фантастического фильма ужасов. Для начала, как и многие космические монстры, он происходит из слизи; если быть точным, он извлекается из анодного шлама, отходов электролитического рафинирования меди.Благодаря своей особой мощности, в форме теллурида кадмия, он может улавливать солнечную энергию. Однако это соединение не использовалось во зло, оно использовалось в некоторых из самых эффективных солнечных элементов для выработки электроэнергии. У каждого хорошего монстра должно быть секретное оружие, и теллур не исключение. Он дает своим врагам чесночное дыхание, действительно неприятный запах чеснока. Едва заметная доза в половину микрограмма даст вам чесночное дыхание на 30 часов, о! И он также оставляет своей жертве черные пятна на перепонке между пальцами, но мало кто может подойти достаточно близко, чтобы заметить это.Как и некий известный вампир, теллур был впервые обнаружен в Трансильвании. Это было в 1783 году Францем Иосифом Мюллер фон Райхенштейн, главным инспектором шахт. У него были особые проблемы с анализом необычной золотосодержащей руды. В конце концов ему удалось выделить новый металл из руды, и он назвал его aurum problematicum. Он отправил образец немецкому химику Мартину Клапроту, который подтвердил, что это новый элемент, и назвал его теллуром.Но чтобы правильно понять, почему он назвал это так, нам нужно вернуться в прошлое и заглянуть в космос. Когда древний человек взглянул на звезды ночью, он заметил некоторые небесные тела, которые двигались по фиксированной схеме звезд. Это были планеты Меркурий, Венера, Марс, Юпитер и Сатурн. Два других больших тела, казалось, также вращались вокруг Земли, а именно Солнце и Луна. Всего таких небесных тел было семь, и семь было магическим числом. Древний человек также знал всего лишь о семи металлах: золоте, серебре, меди, железе, олове, свинце и ртути; конечно, это не могло быть совпадением.Считалось, что так же, как солнечные лучи питают растения и необходимы для их роста, невидимые лучи планет помогают питать металлические руды в земле. Считалось, что каждая планета оказывает определенное влияние на один металл или его руды. Чосер описал эту связь в 14 -м веках. Солнце ассоциируется с золотом, Луна с серебром, Марс с железом, Сатурн со свинцом, Юпитер с оловом и Венера с медью, и даже сегодня мы все еще сохраняем одно и то же имя как для планеты, так и для элемента, Меркурия.Связь между золотом и Солнцем кажется довольно очевидной по их цветам, так же как и связь между серебром и Луной. Остальные связи немного более расплывчаты. В тексте 17 -го века года цитируется: « Железо названо именем Марса, независимо от того, используется ли оно для изготовления оружия войны, богом которого был Марс, или из-за влияний, от которых железо получает с этой планеты. . ” Интересно, что теперь мы знаем, что цвет этой красной планеты обусловлен оксидами железа.Химики назвали медь Венерой как из-за влияний, которые она, возможно, получает от этой планеты, так и из-за ее достоинств при болезнях, связанных с целью зарождения. Речь идет о раннем лечении венерических заболеваний, болезней Венеры. Будучи ближайшей к Солнцу планетой, Меркурий движется в космосе быстрее, чем любой другой. Меркурию требуется всего 88 дней для обращения вокруг Солнца по сравнению с нашими 365 днями. Возможно, это быстрое движение было одной из причин прочной связи между металлом и планетой, или, возможно, это так, как описано в одной книге », из-за того, что элемент имеет способность изменять свою форму, свойство, приписываемое язычники к Меркурию, одному из их ложных богов.” Связь между элементами олова и свинца с Юпитером и Сатурном была еще более сомнительной. К сожалению, магическое число 7 металлов длилось недолго. Какое-то время ранние химики просто обходились без сурьмы, мышьяка и висмута. , цинк и кобальт. В конце концов, они не были настоящими металлами, но с открытием платины они больше не могли игнорировать ее. Некоторое время платина даже называлась восьмым металлом. Было обнаружено еще больше металлов, но затем в В 1781 году была открыта новая планета Уран.Так же, как древний Бог, Сатурн или Кронос был отцом Юпитера или Зевса, новая планета должна быть названа в честь отца Сатурна, следовательно, Урана, в честь греческого бога неба. В знак признания этого открытия в 1789 году Клапрот назвал обнаруженный им новый металл в честь этого элемента – уран. Поэтому в 1798 году, когда Клапрот получил возможность назвать другой элемент, он назвал его в честь единственной известной на тот момент планеты в Солнечной системе, у которой не было элемента, названного в ее честь, – Земли. В древней мифологии Теллус, или Терра, или Гея были богиней Земли и женой Урана, бога небес.Так родился теллур. Крис Смит Химик, вдохновленный небесами, Питер Уотерс из Кембриджского университета, рассказал историю теллура. В следующий раз – поучительная история о газе, на который, как все считали, не стоит тратить время суток. Victoria Gill И изначально отсутствие реактивности означало, что у Neon не было очевидных применений. Это потребовало немного воображения от французского инженера, химика и изобретателя Жоржа Клода, который в начале 20 годов века впервые применил электрический разряд к запечатанной трубке с неоновым газом.Создаваемое им красное свечение натолкнуло Клода на идею создания источника света совершенно новым способом. Он сделал стеклянные трубки, которые можно было использовать как лампочки. Клод представил публике первую неоновую лампу 11 декабря 1910 года на выставке в Париже. Его поразительный дисплей вскружил голову, но, к сожалению, неоновые лампы не продавались. Люди просто не хотели освещать свои дома красным светом. Крис Смит Но они действительно хотели, чтобы их имена были написаны светом, и именно это сделал Жорж Клод, как Виктория Гилл нам расскажет в следующий раз.Я надеюсь, ты сможешь присоединиться к нам. Я Крис Смит, спасибо за внимание. И до свидания! (Промо) (Окончание промо) |
Факты о теллуре | Живая наука
Электронная конфигурация и элементные свойства теллура. (Изображение предоставлено Грегом Робсоном / Creative Commons, Андрей Маринкас Shutterstock)| Атомный номер: 52 Атомный символ: Te Атомный вес: 127.60 | Точка плавления: 841,1 F (449,5 C) Точка кипения: 1810,4 F (988 C) |
Происхождение слова: Теллур происходит от латинского слова tellus , что означает земля.
Открытие: Элемент был открыт Мюллером фон Райхенштейном в 1782 году. Он был назван немецким химиком Мартином Генрихом Клапротом в 1798 году.
Диск металлического теллура диаметром 3,5 см. (Изображение предоставлено: изображения элементов)Свойства теллура
Теллур – это серебристо-белый металлоид; его чистая версия имеет металлический блеск.Кристаллический теллур легко измельчается. В расплавленном состоянии теллур вызывает коррозию меди, железа и нержавеющей стали. [См. Периодическую таблицу элементов]
Известно тридцать изотопов теллура. Природный теллур состоит из восьми изотопов. Элемент и его соединения, вероятно, токсичны при обращении.
Источники теллура
Теллур обычно встречается в виде калаверита, теллурида золота, а также в сочетании с другими металлами. Он используется в промышленных масштабах при электролитическом рафинировании черновой меди из анодных растворов во время процесса.Иногда встречается в его естественном состоянии. Аморфный теллур получают путем осаждения его из раствора теллуровой кислоты.
Использование теллура
Элемент представляет собой полупроводник, который показывает большую электрическую проводимость в определенных направлениях или при воздействии света.
Теллур часто используется для улучшения обрабатываемости меди и нержавеющей стали. Из него делают капсюли-детекторы, добавляют в чугун и используют в керамике. Добавление теллура в свинец улучшает прочность и твердость металла и снижает коррозию.Многие термоэлектрические устройства изготовлены из теллурида висмута. Теллурид свинца используется в детекторах дальнего инфракрасного диапазона.
(Источник: Лос-Аламосская национальная лаборатория)
Периодическая таблица
В предыдущем разделе вы рассмотрели историческое определение атомных масс. Обратите внимание, что элементы также, кажется, расположены в порядке увеличения атомной массы. Но есть несколько исключений. Сравните атомную массу теллура (Те) и йода (I). (См. Рисунок 2.)
Рисунок 2.Сравнение теллура и йода.
Рассмотрите правильное размещение теллура и йода в периодической таблице, как показано на рисунке 2. Те имеет более тяжелую атомную массу. По химическим свойствам теллур похож на селен, потому что оба являются полуметаллическими элементами, которые образуют соединения, подобные соединениям серы. Йод похож на бром, потому что эти элементы являются неметаллическими галогенами, которые образуют соединения, подобные соединениям хлора. Следовательно, порядок в таблице не может быть основан исключительно на атомной массе.
Атомный номер , который появляется над каждым символом элемента, представляет значимый порядок в периодической таблице. Когда элемент обозначается целым числом, это число означает атомный номер, а не атомную массу. Таким образом, элемент 27 – это кобальт (атомный номер 27), а не алюминий (атомная масса 27).
Таблица Менделеева отображает структуру свойств элементов. Самые светлые – вверху диаграммы; атомные массы увеличиваются к нижней части диаграммы.Элементы вверху справа, над диагональной линией от алюминия (13) до полония (84), представляют собой неметаллов , примерно половина из которых существует в виде газов в нормальных лабораторных условиях. Все элементы в средней и левой части таблицы – это металлов , кроме газообразного водорода (1). Большинство металлов представляют собой блестящие деформируемые твердые тела, но ртуть имеет такую низкую температуру плавления, что при комнатной температуре она является жидкостью. Все металлы обладают высокой проводимостью тепла и электричества. Многие простые химические соединения образуются из металла, реагирующего с неметаллом.
В периодической таблице, показанной на следующих страницах, элементы в столбцах имеют схожие свойства, а связанные таким образом элементы (например, сера, селен и теллур) являются членами одной и той же группы или семейства и являются родственниками друг друга. .
Эта информация была получена с веб-сайта Международного союза теоретической и прикладной химии (IUPAC): www.IUPAC.org.
EniG. Периодическая таблица элементов
ЭЛЕМЕНТ ХАЛКОГЕНОВ
| Атомный номер: | 52 |
| Номера групп: | 16 |
| Период: | 5 |
| Электронная конфигурация: | [Kr] 4d 10 5s 2 5p 4 |
| Формальное число окисления: | -2 +4 +6 |
| Электроотрицательность: | 2.1 |
| Атомный радиус / мкм: | 143,2 |
| Относительная атомная масса: | 127,60 (3) |
Теллур был открыт Францем Йозефом Мюллером фон Райхштейном (AT) в 1782 году. Название происходит от латинского слова tellus , означающего земля . Это серебристо-белый хрупкий полуметалл, не реагирующий с водой или HCl, горит на воздухе или в кислороде и растворяется в HNO3. Теллур получается как побочный продукт рафинирования меди и свинца.Он используется для улучшения качества обработки изделий из меди и нержавеющей стали, а также для окрашивания стекла и керамики. Он также используется в термоэлектрических устройствах, в резиновой промышленности и является основным ингредиентом при производстве капсюлей-детонаторов. Цена битого слитка теллура чистотой 99,99% составляет 175,90 евро за 250 г.
| Плотность / г дм -3 : | 6240 | (293 K) |
| 5797 | (м.p.) | |
| Молярный объем / см 3 моль -1 : | 20,45 | (293 K) |
| 22,01 | (mp) | |
| Удельное электрическое сопротивление / мкОм · см: | 436000 | (20 ° C) |
| Теплопроводность / Вт · м -1 K -1 : | 2,35 |
| Температура плавления / ° C: | 449.51 |
| Температура кипения / ° C: | 988 |
| Теплота плавления / кДж моль -1 : | 13,5 |
| Теплота испарения / кДж моль -1 : | 104,6 |
| Теплота распыления / кДж моль -1 : | – |
| Энергия первой ионизации / кДж моль -1 : | 869,30 |
| Энергия второй ионизации / кДж моль -1 : | 1794.64 |
| Энергия третьей ионизации / кДж моль -1 : | 2697,75 |
| в атмосфере / ppm: | – |
| в земной коре / ppm: | 0,01 |
| в океанах / ppm: | – |
| Кристаллическая структура: | шестиугольная |
| Размеры элементарной ячейки / пм: | a = 445.65, c = 592,68 |
| Пространственная группа: | P3 1 21 |
| Изотоп | Относительная атомная масса | Массовый процент (%) | |
|---|---|---|---|
| 120 Te | 119. | ||
| 0,096 (2) | |||
| 122 Te | 121. | 7 (22,603 (4) | |
| 123 Te | 122. | 0.908 (2) | |
| 124 Te | 123. | 9 (2) | 4,816 (6) |
| 125 Te | 124, | 5 (2)7,139 (6) | |
| 126 Te | 125. | 6 (2)18,95 (1) | |
| 128 Te | 127. | 1 (2)31,69 (1) | |
| 130 Te | 129.3 (2) | 129.3 (2) 33,80 (1) |
| Сбалансированная полуреакция | E o / V | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Te 4+ + 4e – → Te (s) | +0.568 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Te 4+ + 2H + + 6e – → H 2 Te (г) | +0,132 | |||||||||||||||||||||||||||||||||||||||||||||||||
| TeO 4 2- + 4H + + 2e – → TeO 2 (s) + 2H 2 O | +1,509 | |||||||||||||||||||||||||||||||||||||||||||||||||
| HTeO 4 – + 3H + + 2e – → ТеО 2 (т) + 2H 2 O | +1.202 | |||||||||||||||||||||||||||||||||||||||||||||||||
| H 2 TeO 4 + 2H + + 2e – → TeO 2 (с) + 2H 2 O | +1,020 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 4 2- + 2H + + 2e – → TeO 3 2- + H 2 O | +0,892 | |||||||||||||||||||||||||||||||||||||||||||||||||
| HTeO 4 – + H + + 2e – → TeO 3 2- + H 2 O | +0.584 | |||||||||||||||||||||||||||||||||||||||||||||||||
| HTeO 4 – + 2H + + 2e – → HTeO 3 – + H 2 O | +0,813 |
Шпильщик периодической таблицы элементов – 52 Теллур Te52 Игольник для таблицы Менделеева с теллуром Игловодители незаменимы для серьезных рукодельниц.С двумя магнитами из редкоземельных элементов, один закреплен на держателе, а другой свободно движется, что позволяет вам соскользнуть с свободного магнита и прикрепить его к ткани, поместив его на ткань, а затем осторожно снова прикрепите свободный магнит. с изнанки ткани. Используется для:
Размеры и информация
Как мне достать эти иглодержатели?
target = “_blank”> http://instagram.com/unconventionalxstitch Периодическая таблица Менделеева | Химия для неосновныхЦели обучения
Один из полезных способов – использовать флеш-карты. Вы записываете словарный запас, термины на иностранном языке, математические формулы, химические реакции – все, что хотите выучить. Затем вы сортируете эти карточки по категориям, связанным друг с другом темам. Такая организация информации помогает вам увидеть закономерности в материале, чтобы вы могли связать разные идеи вместе и лучше понять их. Периодическая таблица Менделеева была впервые построена с использованием набора карточек. С помощью этой стратегии Менделеев мог систематизировать и переупорядочивать материал до тех пор, пока не возникнут закономерности. В 1869 году русский химик и педагог Дмитрий Менделеев (1836–1907) опубликовал периодическую таблицу элементов. В следующем году немецкий химик Лотар Мейер независимо опубликовал очень похожую таблицу. Менделееву обычно уделяют больше внимания, чем Мейеру, потому что его таблица была опубликована первой и из-за нескольких ключевых идей, которые он сделал относительно таблицы. Рисунок 1. Менделеев Менделеев писал учебник химии для своих учеников и хотел систематизировать все известные в то время элементы в соответствии с их химическими свойствами. Он классно организовал информацию для каждого элемента на отдельных карточках, которые затем можно было легко переставить по мере необходимости. Он обнаружил, что, когда он расположил их в порядке возрастания атомной массы, определенные сходства в химическом поведении повторялись через равные промежутки времени. Такой тип повторяющегося узора называется «периодическим».«Маятник, который качается вперед и назад в заданном временном интервале, является периодическим, как и движение Луны вокруг Земли. Рисунок 2. Периодическая таблица Менделеева 1869 года. В , рис. 2 , атомная масса увеличивается сверху вниз вертикальных столбцов, при этом следующие друг за другом столбцы идут слева направо. В результате элементы, находящиеся в одном горизонтальном ряду, представляют собой группы элементов, которые, как известно, обладают схожими химическими свойствами. Одно из открытий Менделеева иллюстрируют элементы теллур (Те) и йод (I).Обратите внимание, что теллур указан перед йодом, хотя его атомная масса выше. Менделеев изменил порядок, потому что он знал, что свойства йода намного больше похожи на свойства фтора (F), хлора (Cl) и брома (Br), чем на кислород (O), серу (S) и селен. (Se). Он просто предположил, что произошла ошибка в определении одной или обеих атомных масс. Как мы вскоре увидим, это оказалось не так, но Менделеев действительно правильно сгруппировал эти два элемента, как он это сделал. Обратите внимание, что в таблице есть несколько мест, которые не имеют химического символа, но вместо этого помечены знаком вопроса. Между цинком (Zn) и мышьяком (As) есть два таких недостающих элемента. Менделеев считал, что элементы с атомными массами 68 и 70 в конечном итоге будут открыты и что они будут химически вписываться в каждое из этих пространств. В таблице перечислены другие свойства, которые Менделеев предсказал для первого из этих двух недостающих элементов, которые он назвал «эка-алюминием», по сравнению с элементом галлием.
Элемент галлий был открыт через четыре года после публикации таблицы Менделеева, и его свойства удивительно хорошо совпадали с эка-алюминием, вписываясь в таблицу именно там, где он предсказывал.То же самое было и с элементом, который последовал за галлием, который в конечном итоге получил название германий. Периодическая таблица Менделеева получила широкое признание в научном сообществе и принесла ему признание как первооткрыватель периодического закона. Элемент № 101, синтезированный в 1955 году, назван менделевием в честь основателя периодической таблицы Менделеева. Однако пройдет несколько лет после смерти Менделеева, прежде чем можно будет объяснить некоторые расхождения с атомными массами и полностью объяснить причины, лежащие в основе повторения химических свойств. Сводка
Практика
Обзор
Глоссарий
Теллур в изюминке | Химия природыДжим Иберс рассматривает интригующие структуры и связи, обнаруженные в теллуре и его соединениях, и рассматривает их использование в различных областях, от металлургии до электроники. Резкие изменения физических свойств происходят в 16 нисходящей группе таблицы Менделеева.Кислород, конечно, представляет собой газ, полоний – металл, а промежуточные элементы, сера, селен и теллур, – все твердые вещества, которые проявляют возрастающие металлические свойства. Фактически, теллур (Те), который я считаю наиболее интересным из группы, действует очень похоже на большинство металлов. Теллур не является распространенным металлом. Присутствует в земной коре в количестве около 1 ppb, он менее распространен, чем золото, платина или так называемые «редкоземельные» элементы. Так зачем беспокоиться о таком непонятном элементе? Один ответ, конечно же, – «потому что он есть», если можно позаимствовать фразу, которую Джордж Мэллори использовал для оправдания восхождения на Эверест.Однако в наши дни, когда желательно мгновенное удовлетворение тех, кто предоставляет средства, другие причины включают важные текущие промышленные применения и потенциал для большего. Для реализации таких приложений теллур должен быть доступен для фундаментальных исследований в лаборатории и для использования в промышленности. Это приводит нас к обсуждению его источников. Добыча только теллура нерентабельна, потому что он редок и так широко распространен. Однако чаще всего он встречается в природе в сочетании с золотом, серебром, медью и другими коммерчески ценными металлами.Фактически, теллуриды золота являются наиболее распространенными золотосодержащими минералами. Напомним, теллур был обнаружен в 1782 году австрийским минералогом Францем Йозефом Мюллером фон Райхенштейном в золоте, добытом на руднике в Венгрии. Следовательно, теллур является побочным продуктом при рафинировании этих других металлов. Основным источником является анодный шлам, образующийся при электролитическом рафинировании меди. Эти шламы составляют в среднем около 2 мас.% Те. В 2007 году общее мировое производство теллура составило около 500 метрических тонн – значительное увеличение по сравнению с предыдущими годами.Более того, по мере роста спроса на теллур росла и его стоимость. Фундаментальные исследования в области синтеза, структуры и свойств теллурсодержащих соединений в последние годы заметно расширились. В качестве одной меры мы можем рассматривать те-содержащие соединения, которые были структурно охарактеризованы, чаще всего методами дифракции рентгеновских лучей. За последнее десятилетие количество неорганических соединений Te увеличилось примерно на 40%; прирост органических и металлоорганических соединений Te составляет почти 70%.Эта последняя цифра удивительна, учитывая, что теллур не является важным элементом для живых систем и что многие синтоны и продукты в химии теллура заставляют их аналоги серы пахнуть розой! С личной точки зрения, когда мы начали наши исследования тройных твердотельных теллуридов около 25 лет назад, не было известно, будут ли эти соединения напоминать тройные селениды или нет. Некоторые делают, а некоторые нет. Несходство распространяется даже на двоичные файлы. Например, NaTe существует, тогда как NaSe неизвестен.Попросите первокурсника химии описать структуру и формальные степени окисления NaTe – ответ заключается в том, что хорошо известная склонность серы, селена и теллура, в отличие от кислорода, к образованию цепей и колец, достигает своего предела в теллуре. NaTe – это, по сути, Na 6 Te (Te 5 ), который содержит катион Na + вместе с анионами Te 2− и Z-образной формы Te 5 4−. Этот Z-образный анион имеет расстояния Te-Te, равные 2.82 и 3,08 Å, и в этом заключается одно из захватывающих различий между Te и S. Структурно минеральный пирит (иногда называемый «золотом дураков» из-за его золотистого блеска) формулы FeS 2 содержит атомы S, разделенные примерно 2,08 Å, длина одинарной связи S-S. Таким образом, формальная степень окисления Fe составляет + II, а не + IV, как можно было бы заключить из формулы. Фактически, практически во всех твердотельных соединениях, в которых происходит связывание S-S, атомы S разделены одинарными связями. Напротив, в твердотельных соединениях, где есть связь Te-Te, в дополнение к обычным одинарным связям Te-Te около 2.74 Å, вполне могут быть разделения Te-Te до 3,6 Å или более, но все же меньше, чем Ван-дер-Ваальсовое разделение 4,1 Å. Это часто делает невозможным определение формальных степеней окисления. Единственный аллотроп теллура, который стабилен при комнатной температуре, – это бесконечная спираль (на фото). В этой спирали расстояния Te – Te составляют около 2,83 Å, но есть несколько коротких взаимодействий ближайших соседей при 3,49 Å. Связывание в твердотельных соединениях, содержащих Te, которое породило многочисленные теоретические исследования, гораздо интереснее, чем в его более легких родственных соединениях. Теллур в основном используется в металлургии, где он является важным легирующим агентом. Его добавляют в сталь и медь, чтобы сделать их более поддающимися обработке, в чугун, чтобы минимизировать тепловой шок, и чтобы уменьшить усталость. Еще одно важное промышленное применение теллура – ускоритель и вулканизатор в резиновой промышленности. Для этих целей не требуется теллур высокой чистоты. Однако в электронной промышленности все чаще используется теллур высокой чистоты в различных новых и развивающихся областях применения.Например, теллур используется в недавно разработанных микросхемах памяти с фазовым переходом, а также в перезаписываемых дисках CD, DVD и Blu-ray. Теллурид висмута широко используется в термоэлектрических охлаждающих устройствах. Такие устройства находят множество применений в электронике и потребительских товарах, последним из которых стало их более широкое использование в портативных холодильниках для пищевых продуктов и, хотите верьте, хотите нет, даже в системах охлаждения автомобильных сидений. Возможно, наибольшее влияние теллура на нашу жизнь могут оказать солнечные панели из теллурида кадмия – они все еще находятся на ранней стадии и являются одними из самых эффективных для выработки электроэнергии.Возможно, теллур еще может спасти человечество! Информация об автореПринадлежность
Об этой статьеЦитируйте эту статьюИберс, Дж. Теллурий в повороте. Nature Chem 1, 508 (2009). https: // doi.org / 10.1038 / nchem.350 Ссылка для скачивания Дополнительная литература
Материалы сегодня Физика (2021 год) Селективное предварительное выщелачивание теллура из золотого концентрата теллуридного типа
Границы химии (2021 год) Селен и теллур, производные кораннулена: случайное открытие одномерного кристалла полимера со стереорегулярной координацией на основе основной цепи Te-O и ароматического массива боковых цепей
Химия – Европейский журнал (2020) Металло-теллуровые батареи: растущая система накопления энергии
Малые строения (2020) Анизотропные оптические и электрические свойства деформационной инженерии в двумерном теллуре с хиральной цепью
| ||||||||||||||||||||||||||||||||||||||||||||||||
