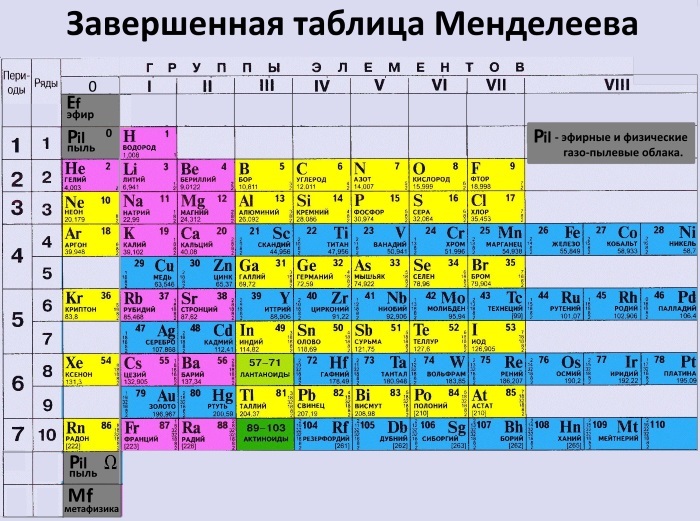
Уран – Что такое Уран?
Уран — химический элемент с атомным номером 92 в периодической системе Д.И. Менделеева
Уран (Uranium) – химический элемент с атомным номером 92 в периодической системе Д.И. Менделеева.
Атомная масса – 238,029.
Обозначается символом U (лат. Uranium).
Относится к семейству актиноидов.
В 1938 г. немецкие физики Отто Ган и Фриц Штрассман открыли непредсказанное явление, происходящее с ядром урана при облучении его нейтронами.
Захватывая свободный нейтрон, ядро изотопа урана 235U делится, при этом выделяется (в расчете на одно ядро урана) достаточно большая энергия, в основном, за счет кинетической энергии осколков и излучения.
Позднее теория этого явления была обоснована Лизой Мейтнер и Отто Фришем.
Данное открытие явилось истоком как мирного, так и военного использования внутриатомной энергии.
В 1939-1940 гг.
Уран широко распространен в природе.
Кларк урана составляет 0,0003 % (вес.), концентрация в морской воде – 3 мкг/л.
Количество урана в слое литосферы толщиной 20 км оценивается в 1,3·1014 т.
Основная масса урана находится в кислых породах с высоким содержанием кремния.
Значительная масса урана сконцентрирована в осадочных породах, особенно богатых органикой.
В больших количествах как примесь уран присутствует в ториевых и редкоземельных минералах.
Основными формами нахождений урана в природе являются уранинит, настуран (урановая смолка) и урановые черни.
Содержание урана в земной коре составляет 0,0003%, он встречается в поверхностном слое земли в виде 4х разновидностей отложений.
Во-первых, это жилы уранинита, или урановой смолки (диоксид урана UO2), очень богатые ураном, но редко встречающиеся.
Такие жилы встречаются в Демократической Республике Конго, Канаде (Большое Медвежье озеро), Чехии и Франции.
2м источником урана являются конгломераты ториевой и урановой руды совместно с рудами других важных минералов.
Большие месторождения этих руд находятся в Канаде, ЮАР, России и Австралии.
3м источником урана являются осадочные породы и песчаники, богатые минералом карнотитом (уранил-ванадат калия), который содержит, кроме урана, значительное количество ванадия и других элементов.
Такие руды встречаются в западных штатах США.
Железоурановые сланцы и фосфатные руды составляют 4й источник отложений.
Богатые отложения обнаружены в глинистых сланцах Швеции.
Некоторые фосфатные руды Марокко и США содержат значительные количества урана, а фосфатные залежи в Анголе и Центральноафриканской Республике еще более богаты ураном.
Периодическая таблица элементов: Лос-Аламосская национальная лаборатория
Вернуться к списку элементов
Оксиды урана(VI) или «желтый кек» являются промежуточным этапом переработки урановых руд. |
| Атомный номер: | 92 | Атомный радиус: | 240 часов (Ван-дер-Ваальс) |
| Атомный символ: | У | Температура плавления: | 1133 °С |
| Атомный вес: | 238 | Температура кипения: | 4131 °С |
| Электронная конфигурация: | [Rn]7s 2 5f 3 6d 1 | Степени окисления: | 6, 5, 4, 3, [2] 2, 1 |
История
Использование урана в его природной форме оксида восходит к 79 г. н.э., когда он использовался в качестве желтого красителя в керамической глазури. Желтое стекло с 1% оксидом урана было найдено на древнеримской вилле недалеко от Неаполя, Италия. В позднем средневековье настуран добывали из серебряных рудников и использовали в качестве красителя в стекольной промышленности. Идентификация урана как элемента обычно приписывается Мартину Х. Клапроту. Во время экспериментов с настураном в 1789 г., он пришел к выводу, что он содержит новый элемент, который он назвал в честь недавно открытой планеты Уран (названной в честь греческого бога неба или неба). На самом деле Клапрот определил не чистый элемент, а оксид урана. Чистый металл был впервые выделен в 1841 году Эженом-Мельхиором Пелиго, который восстановил безводный тетрахлорид урана металлическим калием.
н.э., когда он использовался в качестве желтого красителя в керамической глазури. Желтое стекло с 1% оксидом урана было найдено на древнеримской вилле недалеко от Неаполя, Италия. В позднем средневековье настуран добывали из серебряных рудников и использовали в качестве красителя в стекольной промышленности. Идентификация урана как элемента обычно приписывается Мартину Х. Клапроту. Во время экспериментов с настураном в 1789 г., он пришел к выводу, что он содержит новый элемент, который он назвал в честь недавно открытой планеты Уран (названной в честь греческого бога неба или неба). На самом деле Клапрот определил не чистый элемент, а оксид урана. Чистый металл был впервые выделен в 1841 году Эженом-Мельхиором Пелиго, который восстановил безводный тетрахлорид урана металлическим калием.
В 1896 году Антуан Х. Беккерель обнаружил, что уран излучает невидимый свет или лучи; это была радиоактивность. В 1934 году исследования Энрико Ферми и других в конечном итоге привели к использованию деления урана в первом ядерном оружии, примененном на войне, а затем в мирном использовании урана в качестве топлива для производства ядерной энергии. Последовавшая за этим гонка вооружений во время холодной войны между Соединенными Штатами и Советским Союзом произвела десятки тысяч единиц ядерного оружия, в которых использовался металлический уран и плутоний-239, полученный из урана.. Безопасность этого оружия и его расщепляющихся материалов после распада Советского Союза в 1991 году вызывает постоянную озабоченность.
Последовавшая за этим гонка вооружений во время холодной войны между Соединенными Штатами и Советским Союзом произвела десятки тысяч единиц ядерного оружия, в которых использовался металлический уран и плутоний-239, полученный из урана.. Безопасность этого оружия и его расщепляющихся материалов после распада Советского Союза в 1991 году вызывает постоянную озабоченность.
В 1972 году французский физик Фрэнсис Перрен обнаружил древние и уже не действующие доисторические природные ядерные реакторы деления в залежах урановой руды на руднике Окло в Габоне, Западная Африка, известные под общим названием реакторы ископаемых Окло. Месторождению руды 1,7 миллиарда лет; в то время уран-235 составлял около 3% всего урана на Земле (сегодня 0,72%). Это достаточно высоко, чтобы позволить произойти устойчивой цепной реакции ядерного деления, при условии, что существуют другие поддерживающие геологические условия.
Изотопы
Уран слаборадиоактивен, поскольку все встречающиеся в природе ( или первичные ) изотопы урана ( 238 U, 235 U и 234 U) нестабильны, с периодом полураспада от 0 до 92 лет. 4,5 миллиарда лет. Известно 27 изотопов урана с атомным весом 217–219, 222–240 и 242 с периодом полураспада от миллиардов лет до нескольких наносекунд. Встречающийся в природе уран состоит из трех основных изотопов: 238 U (обилие 99,28 %), 235 U (0,71 %) и 234 U (0,0054 %). (Министерство энергетики США приняло значение 0,711 как официальное процентное содержание 235 U в природном уране.) Все три изотопа радиоактивны с небольшой вероятностью спонтанного деления, но преимущественно распадаются с альфа-излучением. Период полураспада урана-238 составляет около 4,47 миллиарда лет, а урана-235 – 704 миллиона лет, что делает их полезными для определения возраста Земли. Это также предполагает, что половина урана, существовавшего с момента образования Земли, распалась на другие радиоактивные элементы и, в конечном итоге, на стабильные элементы. Считается, что большая часть внутреннего тепла Земли связана с распадом радиоизотопов урана и тория.
4,5 миллиарда лет. Известно 27 изотопов урана с атомным весом 217–219, 222–240 и 242 с периодом полураспада от миллиардов лет до нескольких наносекунд. Встречающийся в природе уран состоит из трех основных изотопов: 238 U (обилие 99,28 %), 235 U (0,71 %) и 234 U (0,0054 %). (Министерство энергетики США приняло значение 0,711 как официальное процентное содержание 235 U в природном уране.) Все три изотопа радиоактивны с небольшой вероятностью спонтанного деления, но преимущественно распадаются с альфа-излучением. Период полураспада урана-238 составляет около 4,47 миллиарда лет, а урана-235 – 704 миллиона лет, что делает их полезными для определения возраста Земли. Это также предполагает, что половина урана, существовавшего с момента образования Земли, распалась на другие радиоактивные элементы и, в конечном итоге, на стабильные элементы. Считается, что большая часть внутреннего тепла Земли связана с распадом радиоизотопов урана и тория.
Уран-238 является излучателем α-частиц (иногда он подвергается спонтанному делению), распадаясь в «урановой серии» ядерного распада, состоящей из 18 членов, каждый из которых в конечном итоге распадается на свинец-206, посредством различных разные пути распада. Ряд распада 235 U, который называется актиниевым рядом, состоит из 15 членов, каждый из которых в конечном итоге распадается на свинец-207. Постоянные скорости распада в этих рядах распада делают сравнение отношений родительских и дочерних элементов полезным при радиометрическом датировании. Уран-234 является членом «урановой серии» и распадается до свинца-206 через серию относительно короткоживущих изотопов. Уран-233 производится из тория-232 с помощью нейтронной бомбардировки, обычно в ядерном реакторе, и 233U также делящийся. Его ряд распада заканчивается таллием-205.
Источники
Уран — самый тяжелый природный элемент, доступный в больших количествах. Более тяжелые «трансурановые» элементы либо созданы человеком, либо существуют только в следовых количествах в месторождениях урановой руды как продукты активации.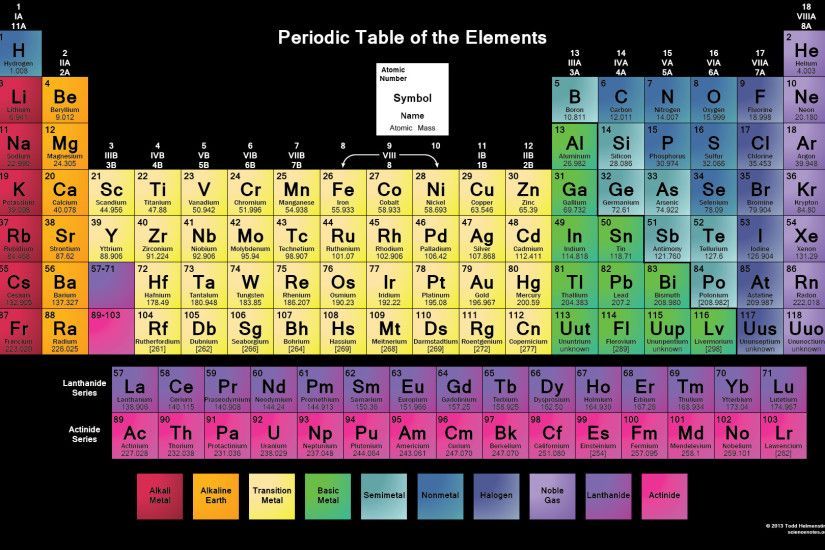 Уран встречается в природе в низких концентрациях, составляющих несколько частей на миллион, в почве, горных породах и воде, и в промышленных масштабах его извлекают из урансодержащих минералов. Уран, не такой редкий, как считалось раньше, теперь считается более распространенным, чем ртуть, сурьма, серебро или кадмий, и примерно таким же распространенным, как молибден или мышьяк. Он встречается во многих природных минералах, таких как настуран, уранинит, карнотит, аутунит, уранофан и тобернит. Он также встречается в фосфатных породах, лигните, монацитовых песках и извлекается из этих источников в коммерческих целях. Министерство энергетики США закупает уран в приемлемой форме U 9.0117 3 O 8 концентраты. Эта программа стимулирования значительно увеличила известные запасы урана.
Уран встречается в природе в низких концентрациях, составляющих несколько частей на миллион, в почве, горных породах и воде, и в промышленных масштабах его извлекают из урансодержащих минералов. Уран, не такой редкий, как считалось раньше, теперь считается более распространенным, чем ртуть, сурьма, серебро или кадмий, и примерно таким же распространенным, как молибден или мышьяк. Он встречается во многих природных минералах, таких как настуран, уранинит, карнотит, аутунит, уранофан и тобернит. Он также встречается в фосфатных породах, лигните, монацитовых песках и извлекается из этих источников в коммерческих целях. Министерство энергетики США закупает уран в приемлемой форме U 9.0117 3 O 8 концентраты. Эта программа стимулирования значительно увеличила известные запасы урана.
Свойства
Чистый уран представляет собой серебристо-белый слаборадиоактивный металл, который тверже большинства элементов. Он ковкий, пластичный, слегка парамагнитный, сильно электроположительный и является плохим проводником электричества.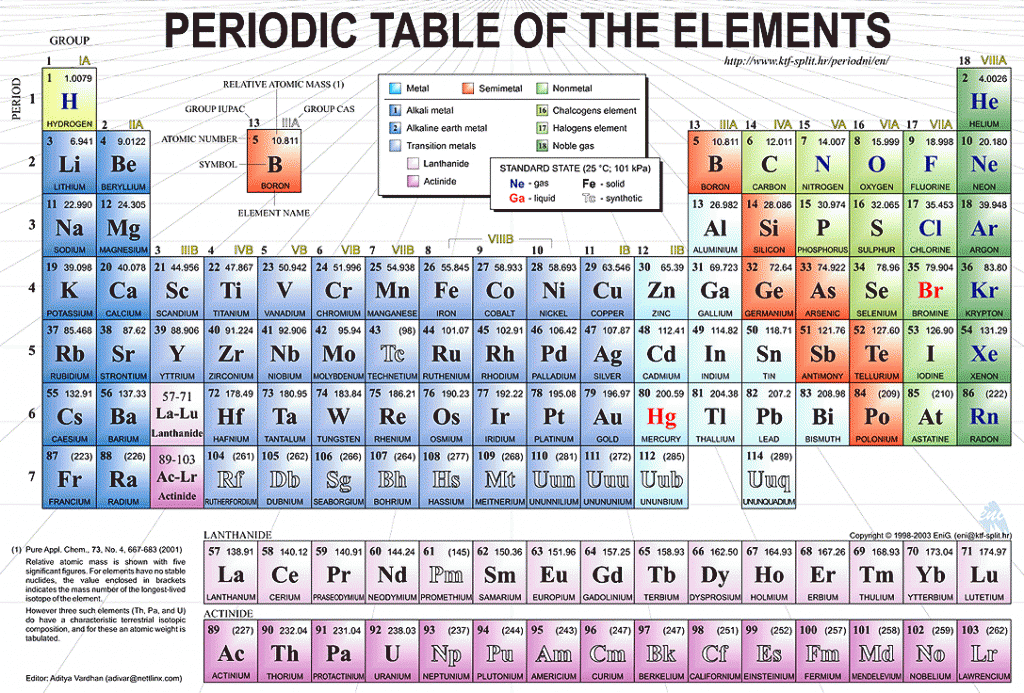 Металлический уран имеет очень высокую плотность, примерно на 70% плотнее свинца, но немного менее плотный, чем золото. Металлический уран находится в трех кристаллографических модификациях: альфа –> (688°С) –> бета –> (776°С) –> гамма. Уран пирофорен в тонкодисперсном состоянии. Он немного мягче стали и подвергается воздействию холодной воды в мелкодисперсном состоянии. На воздухе металлический уран покрывается слоем оксида. Кислоты растворяют металл, образуя степень окисления +3, которая быстро окисляется водой и воздухом с образованием более высоких степеней окисления. Металлический уран не подвержен действию щелочей. Металлический уран можно получить восстановлением галогенидов урана щелочными или щелочноземельными металлами или восстановлением оксидов урана кальцием, алюминием или углеродом при высоких температурах. Металл также может быть получен электролизом КУФ-9.0117 5 или UF 4 , растворенные в смеси расплавленных солей CaCl 2 и NaCl. Уран высокой чистоты можно получить термическим разложением галогенидов урана на горячей нити.
Металлический уран имеет очень высокую плотность, примерно на 70% плотнее свинца, но немного менее плотный, чем золото. Металлический уран находится в трех кристаллографических модификациях: альфа –> (688°С) –> бета –> (776°С) –> гамма. Уран пирофорен в тонкодисперсном состоянии. Он немного мягче стали и подвергается воздействию холодной воды в мелкодисперсном состоянии. На воздухе металлический уран покрывается слоем оксида. Кислоты растворяют металл, образуя степень окисления +3, которая быстро окисляется водой и воздухом с образованием более высоких степеней окисления. Металлический уран не подвержен действию щелочей. Металлический уран можно получить восстановлением галогенидов урана щелочными или щелочноземельными металлами или восстановлением оксидов урана кальцием, алюминием или углеродом при высоких температурах. Металл также может быть получен электролизом КУФ-9.0117 5 или UF 4 , растворенные в смеси расплавленных солей CaCl 2 и NaCl. Уран высокой чистоты можно получить термическим разложением галогенидов урана на горячей нити.
Металлический уран реагирует почти со всеми неметаллическими элементами и их соединениями, при этом реакционная способность увеличивается с повышением температуры. Соляная и азотная кислоты растворяют уран, но неокисляющие кислоты, кроме соляной кислоты, очень медленно атакуют этот элемент. В тонко измельченном виде может вступать в реакцию с холодной водой. На воздухе металлический уран окисляется и покрывается темным слоем оксида урана. Уран образует множество сплавов и соединений, наиболее важными степенями окисления которых являются уран (IV) и уран (VI), а их два соответствующих оксида представляют собой, соответственно, диоксид урана, UO 2 и триоксид урана, UO 3 . Помимо оксидов, другие важные соединения урана включают фториды, хлориды, бромиды, йодиды, карбонаты, гидриды, карбиды, нитриды, фосфаты и т. д. При комнатной температуре гексафторид урана, UF 6 , имеет высокое давление паров, что делает его полезным. в процессе газовой диффузии, используемом для отделения редкого урана-235 от обычного изотопа урана-238. Гидриды, нитриды и карбиды урана представляют собой относительно инертные полуметаллические соединения, которые минимально растворимы в кислотах и используются в качестве стабильных топливных таблеток в технологии ядерных энергетических реакторов.
Гидриды, нитриды и карбиды урана представляют собой относительно инертные полуметаллические соединения, которые минимально растворимы в кислотах и используются в качестве стабильных топливных таблеток в технологии ядерных энергетических реакторов.
Уран существует в водных растворах в степенях окисления +3, +4, +5 и +6. Степень окисления +6, так как ион UO 2 2+ (желтого цвета) является наиболее стабильным состоянием в растворе. Уран в состоянии +5 в виде иона UO 2+ бесцветен, весьма нестабилен и диспропорционирует (реагирует сам с собой) с образованием состояний +6 и +4. Состояние +4 (зеленый) достаточно стабильно в растворе, но состояние +3 (темно-зеленый или темно-красный в зависимости от источника освещения — дневной свет против флуоресцентного света) нестабилен и легко окисляется до +4. Состояние +4 в растворах с почти нейтральным рН легко гидролизуется с образованием осадка оксигидроксида черного цвета.
Применение
Уран использовался в качестве красителей для керамической глазури и стекла в Древнем Риме и в Средние века, придавая ему оттенки от оранжево-красного до лимонно-желтого. Совсем недавно он использовался в качестве апельсиновой глазури в современной посуде, но позже его производство было прекращено по состоянию здоровья. Многие современные виды использования урана используют его уникальные ядерные свойства. Уран-235 отличается тем, что является единственным встречающимся в природе делящимся изотопом. Это означает, что он может быть расщеплен на два или три фрагмента (продукта деления) тепловыми нейтронами. Уран-238 расщепляется быстрыми нейтронами и имеет плодородный , что означает, что он может быть преобразован в делящийся плутоний-239 в ядерном реакторе. Другой делящийся изотоп, уран-233, может быть получен из природного тория и также имеет важное значение в ядерных технологиях. В то время как уран-238 имеет небольшую вероятность спонтанного деления или даже индуцированного деления быстрыми нейтронами, уран-235 и, в меньшей степени, уран-233 имеют гораздо более высокое сечение деления для медленных нейтронов. В достаточной концентрации эти изотопы поддерживают устойчивую цепную ядерную реакцию.
Совсем недавно он использовался в качестве апельсиновой глазури в современной посуде, но позже его производство было прекращено по состоянию здоровья. Многие современные виды использования урана используют его уникальные ядерные свойства. Уран-235 отличается тем, что является единственным встречающимся в природе делящимся изотопом. Это означает, что он может быть расщеплен на два или три фрагмента (продукта деления) тепловыми нейтронами. Уран-238 расщепляется быстрыми нейтронами и имеет плодородный , что означает, что он может быть преобразован в делящийся плутоний-239 в ядерном реакторе. Другой делящийся изотоп, уран-233, может быть получен из природного тория и также имеет важное значение в ядерных технологиях. В то время как уран-238 имеет небольшую вероятность спонтанного деления или даже индуцированного деления быстрыми нейтронами, уран-235 и, в меньшей степени, уран-233 имеют гораздо более высокое сечение деления для медленных нейтронов. В достаточной концентрации эти изотопы поддерживают устойчивую цепную ядерную реакцию. Это вырабатывает тепло в ядерных энергетических реакторах и производит расщепляющийся материал для ядерного оружия. Эта ядерная конверсия может быть осуществлена в реакторах-размножителях, где можно произвести больше нового расщепляющегося материала, чем расщепляющегося материала, используемого для поддержания цепной реакции. Обедненный уран ( 238 U) (обедненный ураном-235) используется для пробития баллистической брони и в качестве брони.
Это вырабатывает тепло в ядерных энергетических реакторах и производит расщепляющийся материал для ядерного оружия. Эта ядерная конверсия может быть осуществлена в реакторах-размножителях, где можно произвести больше нового расщепляющегося материала, чем расщепляющегося материала, используемого для поддержания цепной реакции. Обедненный уран ( 238 U) (обедненный ураном-235) используется для пробития баллистической брони и в качестве брони.
Уран-238 не делящийся, но воспроизводящий изотоп, потому что после нейтронной активации он может производить плутоний-239, другой делящийся изотоп. Действительно, ядро 238 U может поглотить один нейтрон с образованием радиоактивного изотопа урана-239. 239 U распадается путем бета-излучения на нептуний-239, также являющийся бета-излучателем, который, в свою очередь, в течение нескольких дней распадается на плутоний-239. 239 Pu использовался в качестве расщепляющегося материала в первой атомной бомбе, взорванной во время «испытания Тринити» 15 июля 1945 года в Нью-Мексико.
Уран-235 имеет еще большее значение, поскольку он является ключом к использованию урана. 235 U, хотя он встречается в природном уране в количестве всего 0,71%, настолько расщепляется медленными нейтронами, что самоподдерживающаяся цепная реакция деления может быть осуществлена в реакторе, построенном из природного урана и подходящего замедлителя, такого как тяжелый вода или графит, отдельно.
Уран-235 при желании можно концентрировать газодиффузионным и другими физическими процессами и использовать непосредственно в качестве ядерного топлива вместо природного урана или использовать в качестве взрывчатого вещества.
Природный уран, слегка обогащенный 235 U на небольшой процент, используется в качестве топлива для ядерных энергетических реакторов для выработки электроэнергии. Природный торий можно облучить нейтронами для получения важного изотопа 233 U следующим образом: 232 Th( n , гамма) –> 233 Th(бета) –> 233 Па(бета) –> 233 U. Хотя сам по себе торий не делится, 233 U расщепляется, и таким образом может использоваться в качестве ядерного топлива. Один фунт полностью расщепленного урана имеет топливную ценность более 1500 тонн угля.
Хотя сам по себе торий не делится, 233 U расщепляется, и таким образом может использоваться в качестве ядерного топлива. Один фунт полностью расщепленного урана имеет топливную ценность более 1500 тонн угля.
Использование ядерного топлива для выработки электроэнергии, производства изотопов в мирных целях и взрывчатых веществ хорошо известно. Уран в США контролируется Комиссией по ядерному регулированию США. Находятся новые применения для обедненного урана, то есть урана с процентным содержанием 235 U снижен примерно до 0,2%. Уран используется в инерциальных устройствах наведения, в гирокомпасах, в качестве противовесов рулевых поверхностей самолетов, в качестве балласта для боеголовок ракет и в качестве экранирующего материала. Металлический уран используется в качестве рентгеновских мишеней для получения высокоэнергетического рентгеновского излучения; нитрат когда-то использовался в качестве фотографического тонера, а ацетат когда-то использовался в аналитической химии. Кристаллы нитрата урана триболюминесцентны. Соли урана также использовались для производства желтого вазелинового стекла и глазури.
Кристаллы нитрата урана триболюминесцентны. Соли урана также использовались для производства желтого вазелинового стекла и глазури.
Опасности
Уран и его соединения высокотоксичны как с химической, так и с радиологической точки зрения. Мелкодисперсный металлический уран, будучи пирофорным, представляет пожарную опасность. В природе U(VI) образует хорошо растворимые карбонатные комплексы при щелочных рН. Это приводит к увеличению подвижности и доступности урана в грунтовых водах и почве из хранилищ ядерных отходов, что создает опасность для здоровья. Работа с ураном требует знания максимально допустимых концентраций, которые можно вдыхать или проглатывать. В последнее время естественное присутствие урана во многих почвах стало беспокоить домовладельцев из-за образования радиоактивного газа радона и его дочерних продуктов, особенно в замкнутых пространствах с низкой циркуляцией, таких как подвалы.
Обновлено доктором Дэвидом Хобартом, 23 июля 2013 г.
Уран – Периодическая таблица
Группа
N/A
ПЕРИОН
7
Блок
F
Protons
Electrons
Neuretrons
Electrons
Neuretrons
Electron 92
92
146
Общие свойства
Атомный номер
92
Атомный вес
238. 02891
02891
Массовый номер
238
Категория 9000
0003
Актиниды
Цвет
Серебряный
Радиоактивный
Да
названа в честь планеты Урана
Кристаллическая структура
Основанная Орторомбическая
History
.
В 1841 году Эжен-Мельхиор Пелиго выделил первый образец металлического урана, нагревая тетрахлорид урана с калием.
Антуан Анри Беккерель открыл радиоактивность, используя уран в 1896.
Уран-235 был первым изотопом, который, как было обнаружено, было расщепляется
Физические свойства
Фаза
Сплошные
Плотность
18,95 г/см 3
Посточка для смещения
1405,35 K | 1132,2 °С | 2069,96 °F
Температура кипения
4404,15 K | 4131 °С | 7467,8 °F
Теплота плавления
14 кДж/моль
Теплота парообразования
420 кДж/моль
Удельная теплоемкость
0,116 J/g · K
Изобилие в коре Земли
0,00018 %
Обилизация во вселенной
2 × 10 -8 %
Изображение: Wikimedia Commons (zxcctypo)
.