Радиоактивные изотопы, образующиеся при делении
  Ниже рассказано о самых “популярных” изотопах, которые представляют опасность при авариях на АЭС. Радиоактивный йод
Основным источником поступления радиойода населению в зонах радионуклидного загрязнения были местные продукты питания растительного и животного происхождения. Человеку радиойод может поступать по цепочкам:
Молоко, свежие молочные продукты и листовые овощи, имеющие поверхностное загрязнение, обычно являются основным источником поступления радиойода населению. Усвоение нуклида растениями из почвы, учитывая малые сроки его жизни, не имеет практического значения. У коз и овец содержание радиойода в молоке в несколько раз
больше, чем у коров. В мясе животных накапливаются сотые доли
поступившего радиойода. Практический интерес представляют изотопы 131-135I . Их токсичность невелика по сравнению с другими радиоизотопами, особенно альфа-излучающими. Острые радиационные поражения тяжелой, средней и легкой степени у взрослого человека можно ожидать при пероральном поступлении 131I в количестве 55, 18 и 5 МБк/кг массы тела. Токсичность радионуклида при ингаляционном поступлении примерно в два раза выше, что связано с большей площадью контактного бета-облучения. В патологический процесс вовлекаются все органы и системы,
особенно тяжелые повреждения в щитовидной железе, где формируются
наиболее высокие дозы. Дозы облучения щитовидной железы у детей
вследствие малой ее массы при поступлении одинаковых количеств
радиойода значительно больше, чем у взрослых (масса железы у детей в
зависимости от возраста равна 1:5-7 г. В исходной статье И.Я. Василенко, О.И. Василенко. Радиоактивный йод про радиоактивный йод содержатся гораздо подробные сведения, которые, в частности, могут быть полезны медицинским работникам. Радиоактивный цезийРадиоактивный цезий является одним из основных дозообразующих радионуклидов продуктов деления урана и плутония. Нуклид характеризуется высокой миграционной способностью во внешней среде, включая пищевые цепочки. Основным источником поступления радиоцезия человеку являются продукты питания животного и растительного происхождения. Радиоактивный цезий, поступающий животным с загрязненным кормом, в основном накапливается в мышечной ткани (до 80 %) и в скелете (10 %). После распада радиоактивных изотопов йода основным источником внешнего и внутреннего облучения является радиоактивный цезий.
У коз и овец содержание радиоактивного цезия в молоке в несколько
раз больше, чем у коров. В значительных количествах он накапливается
в яйцах птиц. Коэффициенты накопления (превышение над содержанием в
воде) 137Cs
в мышцах рыб достигает 1000 и более, у моллюсков
– 100-700, Поступление цезия человеку зависит от характера питания. Радиоцезий, поступая в организм, относительно равномерно
распределяется, что приводит к практически равномерному облучению
органов и тканей. Этому способствует высокая проникающая способность
гамма-квантов его дочернего нуклида В исходной статье И.Я. Василенко, О.И. Василенко. Радиоактивный
цезий про радиоактивный цезий содержатся гораздо подробные
сведения, которые, в частности, могут быть полезны медицинским
работникам. Радиоактивный стронцийПосле радиоактивных изотопов йода и цезия следующим по значимости элементом, радиоактивные изотопы которого вносят наибольший вклад в загрязнение – стронций. Впрочем, доля стронция в облучении значительно меньше. Природный стронций относится к микроэлементам и состоит из смеси четырех стабильных изотопов 84Sr (0.56 %), 86Sr (9.96 %), 87Sr (7.02 %), 88Sr (82.0 %). По физико-химическим свойствам он является аналогом кальция. Стронций содержится во всех растительных и животных организмах. В организме взрослого человека содержится около 0.3 г стронция. Почти весь он находится в скелете. В условиях нормальной эксплуатации АЭС выбросы радионуклидов
незначительны. В основном они обусловлены газообразными
радионуклидами (радиоактивными благородными газами, 14С,
тритием и йодом). В условиях аварий, особенно крупных, выбросы
радионуклидов, в том числе радиоизотопов стронция, могут быть
значительными.
В начальный период 89Sr является одним из компонентов
загрязнения внешней среды в зонах ближних выпадений радионуклидов. Животным радиоактивный стронций в основном поступает с кормом и в меньшей степени с водой (около 2 %). Помимо скелета наибольшая концентрация стронция отмечена в печени и почках, минимальная – в мышцах и особенно в жире, где концентрация в 4–6 раз меньшая, чем в других мягких тканях. Содержание стронция в гидробионтах зависит от концентрации нуклида в воде и степени ее минерализации. Так у рыб Балтийского моря содержание стронция в 5 раз больше, чем у рыб Атлантического океана. Коэффициент накопления достигает 10-100, в основном стронций депонируется в скелете. Радиоактивный стронций относится к остеотропным биологически
опасным радионуклидам. Как чистый бета-излучатель основную опасность
он представляет при поступлении в организм. Населению нуклид в
основном поступает с загрязненными продуктами. Подробно все изложено в исходной статье И.Я. Василенко, О.И. Василенко. Радиоактивный стронций. |
Сайт газеты “На земле троицкой” – Страница 277 из 1325
Елена Цыгельная Оставить комментарий
По данным группы долгосрочных метеорологических прогнозов Гидрометцентра ФГБУ «Западно-Сибирское УГМС», ноябрь в Алтайском крае ожидается около нормы, со средней месячной температурой воздуха -5… -9 градусов. Во второй декаде ожидается понижение температуры ночью от -6… -11 до -18… -23 градусов, днем от -1… -6 до -12… -17 градусов. Читать полностью
Читать полностью
Елена Цыгельная Оставить комментарий
С 1 сентября директором МБОУ «Троицкая средняя общеобразовательная школа №2» назначена Наталья Михайловна Первова, которая много лет проработала в системе образования, в том числе последние несколько лет – заместителем директора ТСШ №2. Читать полностью
Елена Цыгельная Оставить комментарий
МУП ЖКУ Троицкого района информирует: в связи со сложной эпидемиологической обстановкой и заболеваниями сотрудников начисления по льготам Читать полностью
Елена Цыгельная Оставить комментарий
Еще летом агрохолдинг «Киприно» на своей производственной площадке в селе Троицком запустил новый сыродельный цех и склад для хранения продукции. Сделала компания это тихо, без торжеств. По словам гендиректора Дениса Зюзина, которые приводит «Алтапресс», поводов для веселья у сыроделов сейчас немного. Читать полностью
Сделала компания это тихо, без торжеств. По словам гендиректора Дениса Зюзина, которые приводит «Алтапресс», поводов для веселья у сыроделов сейчас немного. Читать полностью
Елена Цыгельная Оставить комментарий
Светлана Юрьевна из Барнаула интересуется:
-К родителям на дом приходили люди, представившиеся сотрудниками некой юридической конторы. Обещали увеличить размер их пенсий, если они напишут заявление именно через их специалистов. Родители, конечно, выслушали их внимательно, узнали цену и предложили этим «юристам» зайти к ним через неделю. Проясните, пожалуйста, ситуацию. Читать полностью
Елена Цыгельная Оставить комментарий
Сегодня отмечает юбилейный день рождения Валентина Георгиевна Бадикова, с которой знакомы многие жители района.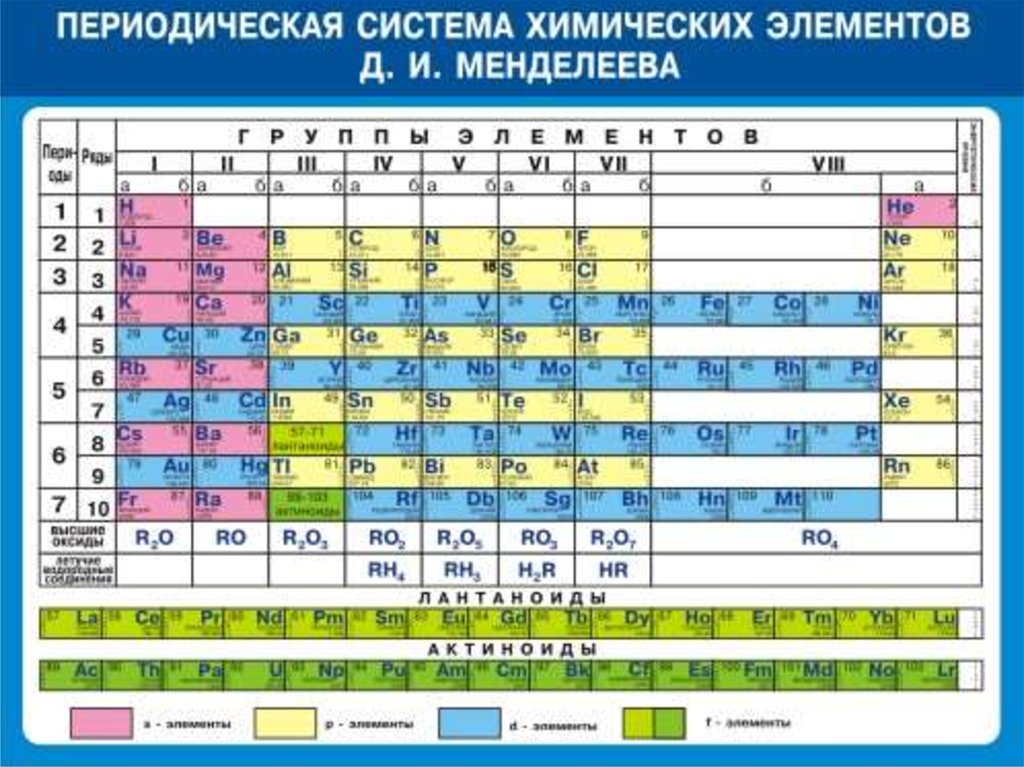
Она прошла путь от молоденькой сельской учительницы из Новоеловки до руководителя районного масштаба: районный отдел народного образования, заместитель председателя райисполкома, а позже – главы администрации. И всюду, как принято говорить, была на своем месте. Что не мешало ей все эти годы увлеченно играть в народном театре, петь в хоре. Читать полностью
Елена Цыгельная Оставить комментарий
Со 2 ноября директором Центра помощи детям, оставшимся без попечения родителей (бывший детский дом) назначена Елена Николаевна Дятлова. Ранее она шесть лет работала инспектором по опеке и попечительству, а до того 13 лет – воспитателем в детском доме. Читать полностью
Елена Цыгельная Оставить комментарий
Сельские администрации испытывают недостаток финансовых средств практически по всем бюджетным статьям, но стараются уделяют внимание освещению улиц.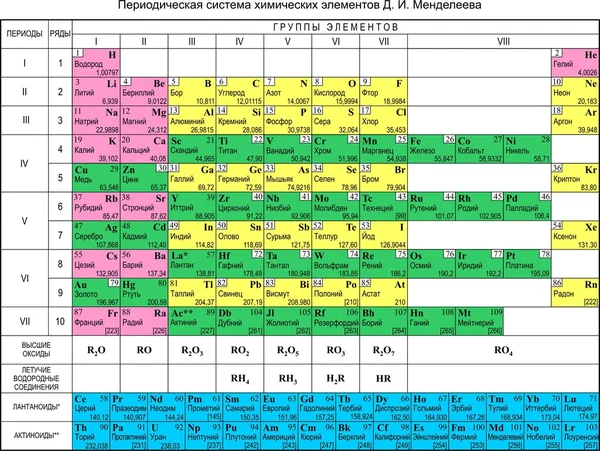
Глава администрации Хайрюзовского сельсовета Н.В. Камчатный рассказывает: Читать полностью
Елена Цыгельная Оставить комментарий
В дни осенних каникул детская библиотека проводила различные мероприятия.
Для ребят была оформлена выставка-обзор «Возьмемся за руки, друзья», проведен патриотический час ко Дню народного единства. Ребята узнали об истории праздника, все, кто приходил в этот день в библиотеку, выполняли различные задания. Читать полностью
Елена Цыгельная Оставить комментарий
Секретарь Регионального отделения «Единой России», председатель АКЗС Александр Романенко заявил о необходимости ужесточить контроль за соблюдением руководством торговых центров масочного режима. Читать полностью
Читать полностью
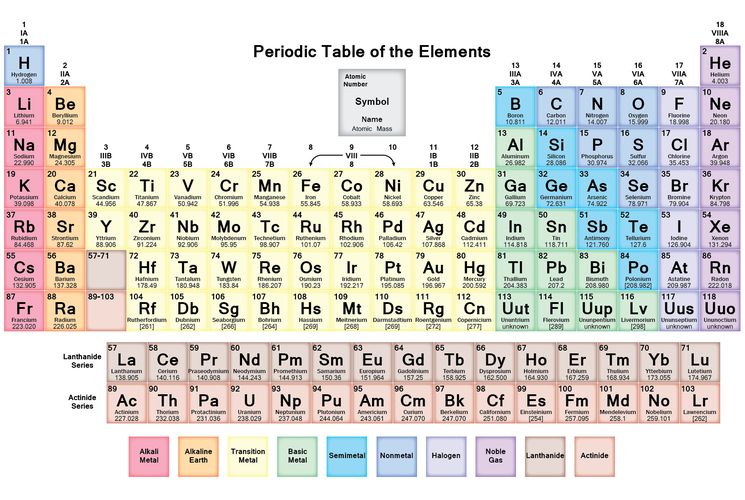
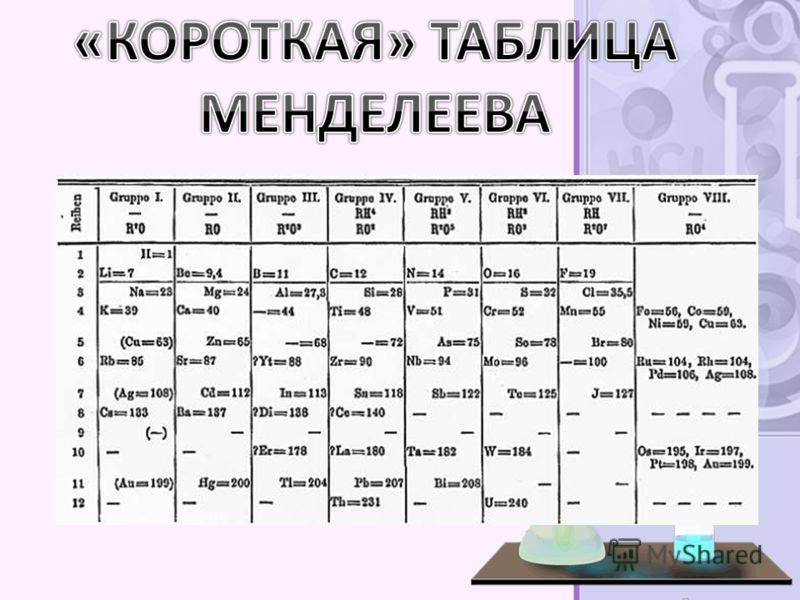
Все, что вам нужно знать о периодической таблице
Марк Бласкович
Опубликовано 3 года назад: 13 февраля 2020 г., 15:15 –
Подано в: наука
Изображение: Getty ImagesПериодическая таблица — одно из тех классических изображений, которые можно найти во многих научных лабораториях и классах. Это картина, которую хоть раз в жизни видел почти каждый.
Вы также можете найти таблицу Менделеева на футболках, кружках, пляжных полотенцах, наволочках и пододеяльниках и многих других предметах. Это даже вдохновило на создание сборника рассказов.
Кто может забыть периодическую таблицу, наложенную на музыку американцем Томом Лерером, профессором математики из Гарварда, который также был певцом, автором песен и сатириком. Его песня The Elements включает в себя все элементы, которые были известны на момент ее написания в 1959 году. Международный союз теоретической и прикладной химии (IUPAC).
Но что именно показывает периодическая таблица?
Короче говоря, это попытка организовать коллекцию элементов — все известные чистые соединения, состоящие из атома одного типа.
Есть два способа взглянуть на то, как устроена таблица Менделеева, основанные либо на наблюдаемых свойствах элементов, содержащихся в ней, либо на субатомном строении атомов, образующих каждый элемент.
Основная современная таблица Менделеева. Shutterstock/ДунтароЭлементы
Когда ученые начали собирать элементы в 1700-х и 1800-х годах, медленно выявляя новые в течение десятилетий исследований, они начали замечать закономерности и сходство в их физических свойствах. Одни были газами, другие — блестящими металлами, третьи бурно реагировали с водой и так далее.
В то время, когда впервые были открыты элементы, структура атомов не была известна. Ученые начали искать способы систематизировать их, чтобы сходные свойства можно было сгруппировать вместе, подобно тому, как собиратель морских ракушек может попытаться упорядочить их по форме или цвету.
Задача была усложнена тем, что не все элементы были известны. Это оставляло пробелы, из-за чего расшифровка паттернов немного напоминала попытку собрать головоломку из недостающих частей.
Это оставляло пробелы, из-за чего расшифровка паттернов немного напоминала попытку собрать головоломку из недостающих частей.
Разные ученые придумали разные типы таблиц. Первая версия текущей таблицы обычно приписывается русскому профессору химии Дмитрию Менделееву в 1869 году, а обновленная версия – в 1871 году.
Периодическая таблица Менделеева впервые опубликована за пределами России в Zeitschrift für Chemie (1869 г.)., страницы 405-6). (Викимедиа/Дмитрий Менделеев)Важно отметить, что Менделеев оставил пробелы в таблице, где, по его мнению, должны были быть размещены недостающие элементы. Со временем эти пробелы были заполнены, и появилась окончательная версия, какой мы ее знаем сегодня.
Атомы
Чтобы действительно понять окончательную структуру периодической таблицы, нам нужно немного понять атомы и то, как они устроены. Атомы имеют центральное ядро (ядро), состоящее из более мелких частиц, называемых протонами и нейтронами.
Это количество протонов, которое дает элементу его атомный номер — число, которое обычно находится в верхнем левом углу каждой клетки в периодической таблице.
Свойства водорода, отмеченные в периодической таблице. (Шаттерсток/Дунтаро)Таблица Менделеева расположена в порядке возрастания атомного номера (слева направо, сверху вниз). Он варьируется от элемента 1 (водород H) в левом верхнем углу до недавно утвержденного элемента 118 (оганесон Og) в правом нижнем углу.
Количество нейтронов в ядре может варьироваться. Это приводит к различным изотопам для каждого элемента.
Например, вы, возможно, слышали о датировании по углероду-14 для определения возраста объектов. Этот изотоп представляет собой радиоактивную версию обычного углерода C (или углерода-12), который имеет два дополнительных нейтрона.
Но почему под основной таблицей отдельный блок с элементами, и почему главная таблица странной формы, с надкушенным верхом? Это сводится к тому, как устроен другой компонент атома — электроны.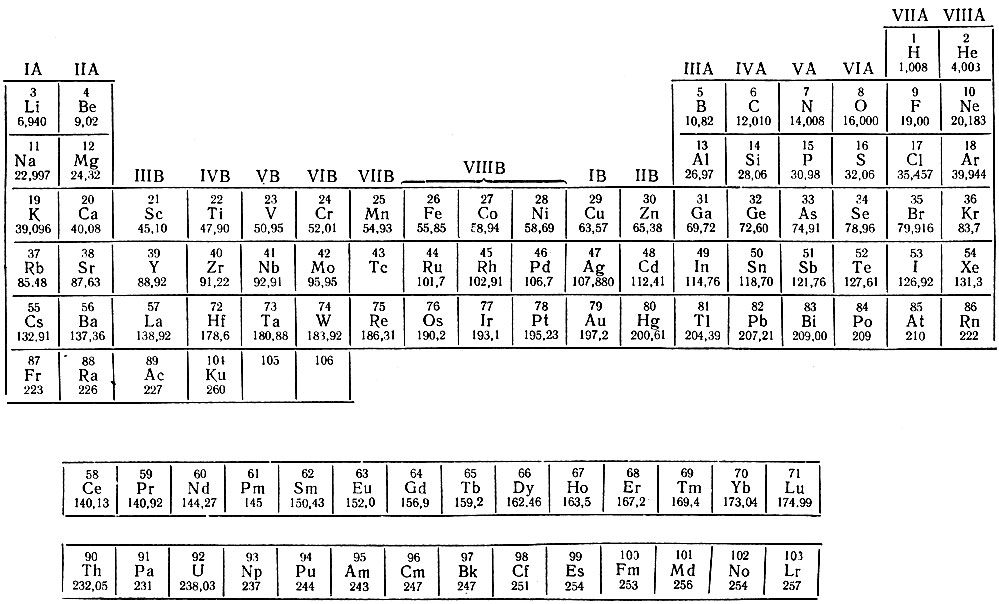
Электроны
Мы склонны думать, что атомы построены наподобие луковицы, с семью слоями электронов, называемыми «оболочками», обозначенными K, L, M, N, O, P и Q, окружающими основное ядро.
Подумайте об атоме с центральным ядром, содержащим все протоны и нейтроны, окруженным рядом оболочек, содержащих электроны. (Разговор, CC BY-ND)Каждая строка в периодической таблице соответствует заполнению одной из этих оболочек электронами. У каждой оболочки есть подоболочки, и порядок заполнения оболочек/подоболочек зависит от требуемой энергии, хотя это сложный процесс. Мы вернемся к ним позже.
Проще говоря, первый элемент в каждой строке начинает новую оболочку, содержащую один электрон, в то время как последний элемент в каждой строке имеет две (или одну для первой строки) подоболочек во внешней оболочке, полностью занятых. Эти различия в электронах также объясняют некоторое сходство свойств между элементами.
С одной или двумя подоболочками во внешнем слое, заполненными электронами, последние элементы каждого ряда совершенно неактивны, поскольку во внешней оболочке нет отверстий или зазоров для взаимодействия с другими атомами.
Вот почему элементы в последней колонке, такие как гелий He, неон (Ne), аргон (Ar) и так далее, называются благородными газами (или инертными газами). Все они газы, и они «благородны», потому что редко связываются с другими элементами.
Напротив, элементы первой колонки, за исключением водорода (точно так же, как английская грамматика, всегда есть исключение!), называются щелочными металлами. Элементы первого столбца по своему характеру похожи на металлы, но с одним электроном во внешней оболочке они очень реакционноспособны, поскольку этот одинокий электрон очень легко вступает в химическую связь. При добавлении в воду они быстро реагируют, образуя щелочной (основной) раствор.
Каждая оболочка может вместить все большее количество электронов. В первую оболочку (К) помещаются только два, поэтому в первой строке периодической таблицы всего два элемента: водород (Н) с одним электроном и гелий (Не) с двумя.
На второй оболочке (L) помещается восемь электронов.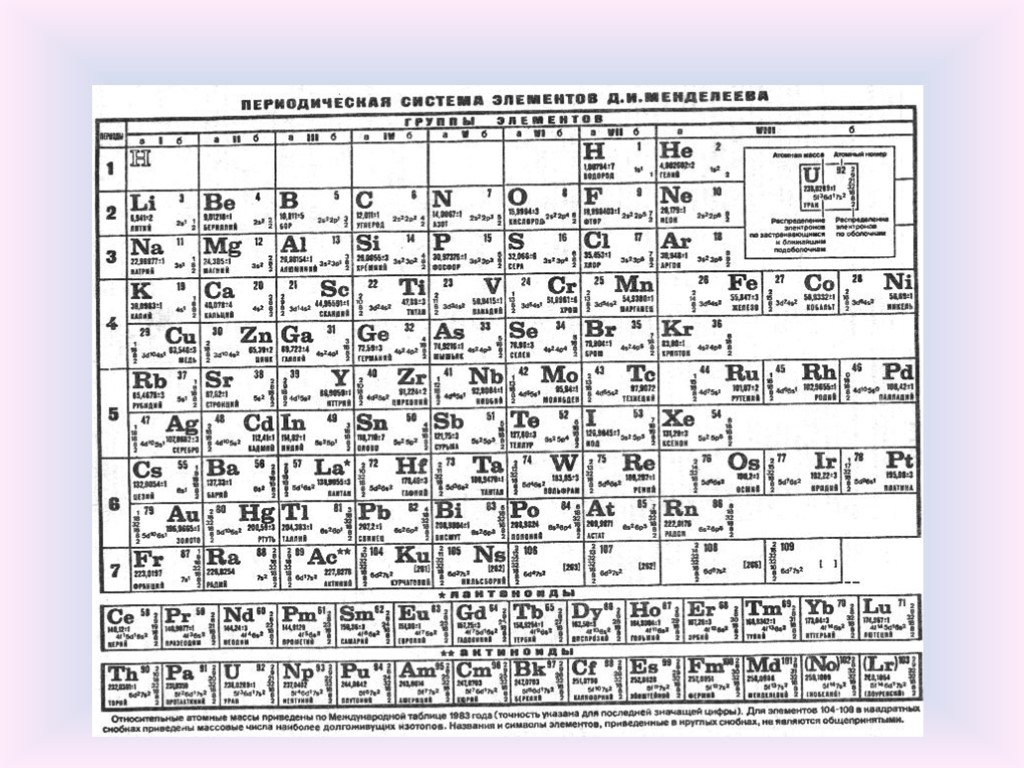 Таким образом, вторая строка периодической таблицы содержит восемь элементов с промежутком между водородом и гелием, чтобы разместить дополнительные шесть.
Таким образом, вторая строка периодической таблицы содержит восемь элементов с промежутком между водородом и гелием, чтобы разместить дополнительные шесть.
В третьей оболочке (М) помещается 18 электронов, но в третьем ряду по-прежнему всего восемь элементов. Это связано с тем, что дополнительные десять электронов не добавляются к этому слою до тех пор, пока первые два электрона не будут добавлены к четвертой оболочке (N) (позже мы поймем, почему).
Таким образом, разрыв в четвертой строке расширяется для размещения дополнительных десяти элементов, что приводит к «откусыванию» верхней части таблицы. Дополнительные десять соединений в средней части называются переходными металлами.
Четвертая оболочка содержит 32 электрона, но опять же дополнительные электроны не добавляются к этой оболочке до тех пор, пока некоторые из них не будут добавлены к пятой (О) и шестой (Р) оболочкам, что означает, что и четвертый, и пятый ряды содержат по 18 элементов.
Для следующих двух строк (шестой и седьмой) вместо дальнейшего расширения таблицы в сторону, чтобы включить эти дополнительные 14 элементов, что сделало бы ее слишком широкой для удобного чтения, они были вставлены в виде блока из двух строк, называемых лантаноидами. (элементы с 57 по 71) и актиноиды (элементы 89до 103) под основной таблицей.
(элементы с 57 по 71) и актиноиды (элементы 89до 103) под основной таблицей.
Вы можете увидеть, где они поместились бы, если бы периодическую таблицу расширили, если вы посмотрите на два нижних квадрата в третьем столбце таблицы выше.
По колоннам
Есть еще один фактор, усложняющий окончательную форму стола. Как упоминалось ранее, по мере того, как электроны добавляются к каждому слою, они переходят на разные подоболочки (или орбитали), что описывает места вокруг ядра, где их можно найти с наибольшей вероятностью. Они известны буквами s, p, d и f.
Буквы, используемые для обозначения орбиталей, на самом деле получены из описания излучения или поглощения света электронами, движущимися между орбиталями: s арфа, p rincipal, d диффузный и f ундаментальный.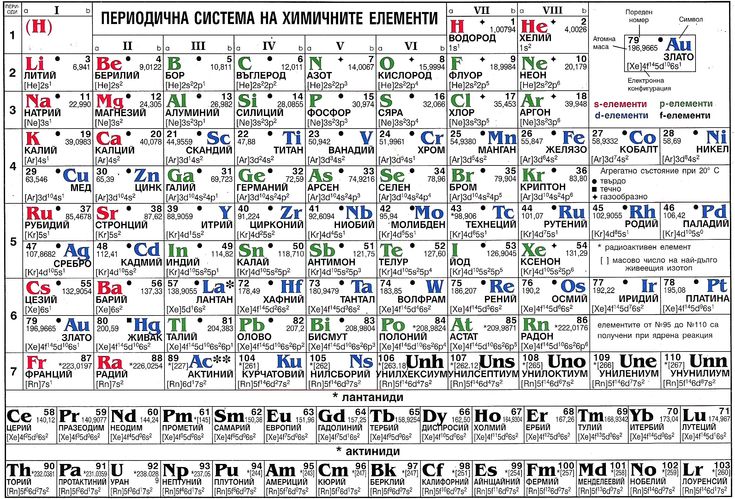
Каждая оболочка имеет собственную конфигурацию подоболочек, названных от 1s до 7p, что дает общее количество электронов в каждой оболочке по мере продвижения по периодической таблице.
(Разговор, CC BY-ND)Как упоминалось ранее, порядок заполнения подоболочек электронами не так прост. Вы можете увидеть порядок, в котором они заполняются, на изображении ниже, просто следуйте порядку, как если бы вы читали слева направо.
(Разговор, CC BY-SA)Существует интерактивная периодическая таблица, которая также хорошо иллюстрирует последовательность заполнения, если щелкнуть по атомам.
Элементы в столбце обычно имеют схожие свойства, но в некоторых местах рядом расположенные элементы также могут быть похожими. Например, в переходных металлах группы драгоценных металлов вокруг меди (Cu), серебра (Ag), золота (Au), палладия (Pd) и платины (Pt) совершенно одинаковы.
Большинство существующих элементов с высокими атомными номерами, включая четыре сверхтяжелых элемента, добавленных в прошлом году, очень нестабильны и никогда не были обнаружены в природе или выделены из нее.
Вместо этого они создаются и анализируются в ничтожных количествах в очень искусственных условиях. Теоретически могут существовать и другие элементы, кроме 118, известных сейчас (есть дополнительные суборбитали g, h и i), но мы пока не знаем, будет ли какой-либо из них достаточно стабильным, чтобы его можно было изолировать.
Классический дизайн
Таблица Менделеева имеет много красочных и информативных версий, созданных на протяжении многих лет.
Таблица Менделеева украшает такси в Великобритании. (Flickr/Fr Gaurav Shroff, CC BY-NC-ND)Одна из моих любимых — художественная версия с оригинальными рисунками для каждого элемента, заказанная Австралийским королевским химическим институтом в честь Международного года химии в 2011 году.
Другой фаворит — интерактивная версия с изображениями элементов. Создатели этого сайта также опубликовали журнальный столик под названием «Элементы» и приложение Apple с видеороликами о каждом элементе.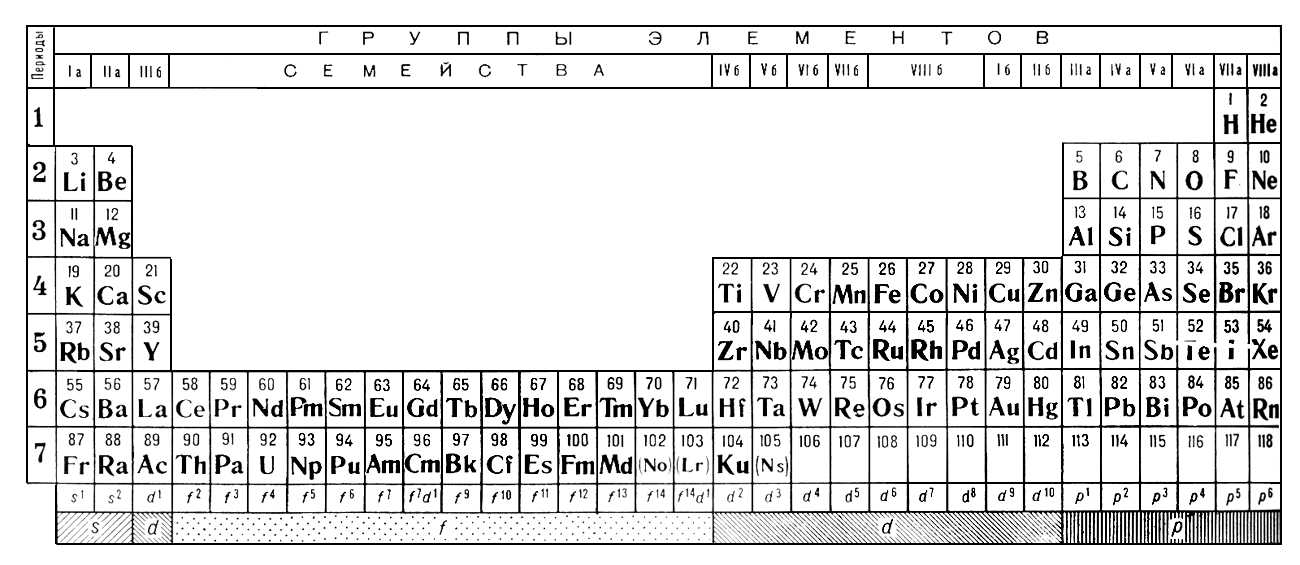
Интерактивные версии также были созданы Королевским химическим обществом (и также могут быть загружены в виде приложения) и ChemEd DL среди прочих.
Классический дизайн таблицы Менделеева можно использовать для игры в версию игры Морской бой.
Игра в боевые корабли с таблицей Менделеева на первом Всемирном фестивале науки в Брисбене в 2016 году. (Разговор, CC BY-NC-ND)Существует также множество забавных версий, созданных для организации множества объектов, включая еду, пиво, смайлики, приложения для iPad и птиц.
Что касается «The Elements» Тома Лерера, песня еще не была обновлена, чтобы включить в нее все элементы, известные сегодня, но на протяжении многих лет на нее делали каверы другими людьми.
Актер Дэниел Рэдклифф, прославившийся Гарри Поттером, исполнил версию во время выступления в качестве гостя на шоу Грэма Нортона на BBC.
Существуют и другие музыкальные версии элементов, но их тоже еще предстоит обновить, чтобы включить все элементы периодической таблицы.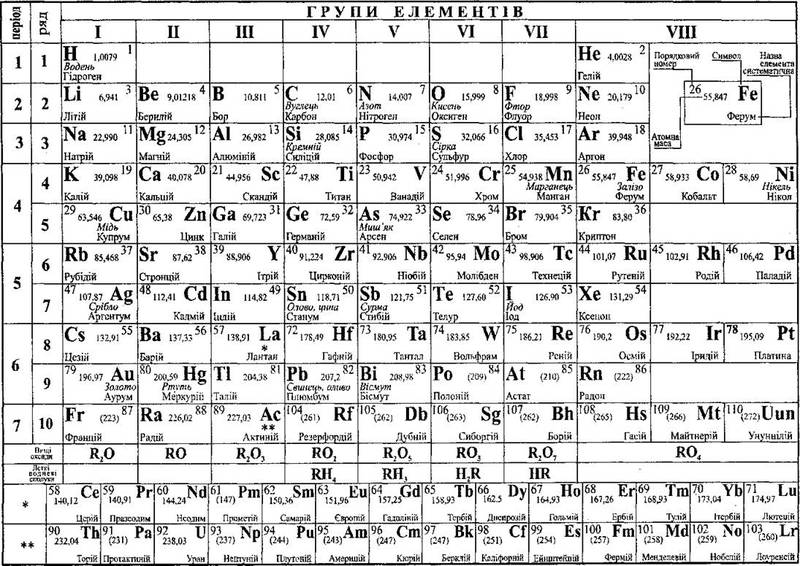
Таким образом, периодическая таблица представляет собой химическую таксономию всех элементов. Его триумф заключается в том, что он по-прежнему актуален для ученых, а также встраивается в популярную культуру.
Марк Бласкович, старший научный сотрудник, Университет Квинсленда
Эта статья переиздана из The Conversation под лицензией Creative Commons.
Еще от Lifehacker Australia
Об авторе
Атомная масса (упрощенное) Видеоруководство и практика
Атомы и периодическая таблица
Предыдущая темаСледующая тема
Атомную массу элемента можно найти в периодической таблице.
1
концепция
Атомная масса (концептуальная) Концепция 1
Видео скоро будет
Было ли это полезно?
атомных масс элементов можно найти, просто взглянув на периодическую таблицу. Итак, давайте начнем с символа H, который представляет водород.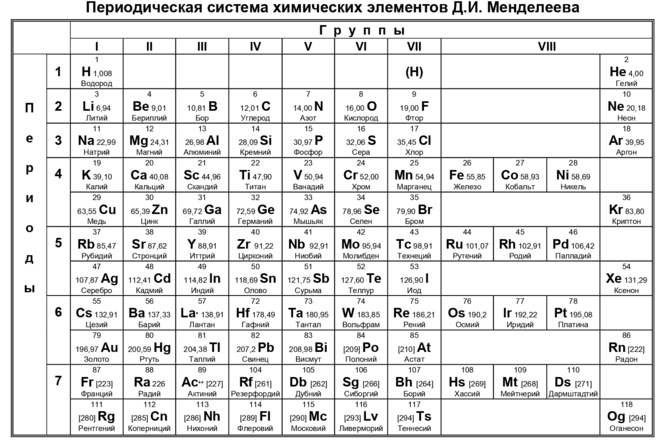 И если вы посмотрите на водород, а также на другие элементы периодической таблицы, вы увидите эти целые числа. Эти целые числа представляют наш атомный номер. Это количество протонов. Когда мы говорим атомная масса. Хотя атомная масса — это число, которое редко бывает целым числом, это и есть наша атомная масса. Таким образом, вы можете найти атомную массу любого элемента в периодической таблице. Просто посмотрев его. Теперь мы собираемся сказать, что атомная масса сама по себе является средним значением всех ее изотопов, которые используют единицы продвижения Грэма или Дальтона. И мы собираемся сказать, помните, что один час ночи равен 1,66 умножить на 10 в минус кг. Так что просто запомните эти атомные массы, которые вы видите в периодической таблице. Обычно это не целые числа. Вы должны спуститься вниз, к этим тяжелым элементам. Итак, вы видите целые числа для атомных масс и помните, что они являются средним значением всех изотопов данного элемента.
И если вы посмотрите на водород, а также на другие элементы периодической таблицы, вы увидите эти целые числа. Эти целые числа представляют наш атомный номер. Это количество протонов. Когда мы говорим атомная масса. Хотя атомная масса — это число, которое редко бывает целым числом, это и есть наша атомная масса. Таким образом, вы можете найти атомную массу любого элемента в периодической таблице. Просто посмотрев его. Теперь мы собираемся сказать, что атомная масса сама по себе является средним значением всех ее изотопов, которые используют единицы продвижения Грэма или Дальтона. И мы собираемся сказать, помните, что один час ночи равен 1,66 умножить на 10 в минус кг. Так что просто запомните эти атомные массы, которые вы видите в периодической таблице. Обычно это не целые числа. Вы должны спуститься вниз, к этим тяжелым элементам. Итак, вы видите целые числа для атомных масс и помните, что они являются средним значением всех изотопов данного элемента.
Видео скоро будет
Было ли это полезно?
так вот для этого примера вопрос. В нем говорится, что из следующего представляет собой элемент из первого столбца с наибольшей атомной массой? Итак, наша первая колонка. Если мы посмотрим на эту периодическую таблицу, наш первый столбец будет со всеми этими различными элементами. И запомните число красного цвета, которое не является целым числом. Обычно это представляет собой атомную массу любого из этих заданных элементов. Вот здесь, если мы посмотрим, у нас есть барий. Будь снова. Позже мы узнаем о том, как имена прикрепляются к элементам. Символ B. Здесь A нет в первом столбце. Это во втором вызове, так что это не может быть выбор. Тогда мы собираемся сказать, что у нас есть l A. L означает алюминий. Алюминий здесь, в третьей колонке. Ну, вообще-то здесь, в этой 13-й колонке, так что это исключено. Далее у нас есть Cs просто сеанс. Вот оно, прямо здесь. Это в первой колонке. Там довольно низко. это 1 32,91 для его атомной массы. Помните, что это может быть в граммах на моль. Атомные единицы массы или Дальтона. Пока это выглядит как самый высокий.
В нем говорится, что из следующего представляет собой элемент из первого столбца с наибольшей атомной массой? Итак, наша первая колонка. Если мы посмотрим на эту периодическую таблицу, наш первый столбец будет со всеми этими различными элементами. И запомните число красного цвета, которое не является целым числом. Обычно это представляет собой атомную массу любого из этих заданных элементов. Вот здесь, если мы посмотрим, у нас есть барий. Будь снова. Позже мы узнаем о том, как имена прикрепляются к элементам. Символ B. Здесь A нет в первом столбце. Это во втором вызове, так что это не может быть выбор. Тогда мы собираемся сказать, что у нас есть l A. L означает алюминий. Алюминий здесь, в третьей колонке. Ну, вообще-то здесь, в этой 13-й колонке, так что это исключено. Далее у нас есть Cs просто сеанс. Вот оно, прямо здесь. Это в первой колонке. Там довольно низко. это 1 32,91 для его атомной массы. Помните, что это может быть в граммах на моль. Атомные единицы массы или Дальтона. Пока это выглядит как самый высокий. Единственным, кто выше этого, будет FR. Обратите внимание, что здесь внизу поднимается. Большинство из них — целые числа. Это элементы сверхбольшой массы, которые довольно нестабильны. Как правило, они не имеют многочисленных изотопов. В результате они не имеют десятичных разрядов. Так дальше, пока. Видишь, похоже, это наш лучший выбор. Если мы посмотрим на D, то у нас есть alli, то есть здесь не наемная масса, не большая атомная масса. И тогда у нас есть то, что прямо здесь. Так что, похоже, это наш лучший выбор. Он имеет наибольшую атомную массу из столбца один из предоставленных вариантов. Так что просто помните, что у нас есть символы элементов. У нас есть наши атомные массы, которые обычно не являются целыми числами, и тогда у нас на самом деле есть целые числа. Они представляют наши атомные номера
Единственным, кто выше этого, будет FR. Обратите внимание, что здесь внизу поднимается. Большинство из них — целые числа. Это элементы сверхбольшой массы, которые довольно нестабильны. Как правило, они не имеют многочисленных изотопов. В результате они не имеют десятичных разрядов. Так дальше, пока. Видишь, похоже, это наш лучший выбор. Если мы посмотрим на D, то у нас есть alli, то есть здесь не наемная масса, не большая атомная масса. И тогда у нас есть то, что прямо здесь. Так что, похоже, это наш лучший выбор. Он имеет наибольшую атомную массу из столбца один из предоставленных вариантов. Так что просто помните, что у нас есть символы элементов. У нас есть наши атомные массы, которые обычно не являются целыми числами, и тогда у нас на самом деле есть целые числа. Они представляют наши атомные номера
В Периодической таблице атомная масса представлена числом с десятичными разрядами.
3
Задача
Какой из следующих вариантов имеет наибольшую атомную массу?
Element A (0. 283 kg)
283 kg)
Element B (3.20 x 10 24 amu)
Element C (0.350 kg)
Element D (4.14 x 10 26 Da)
4
concept
Атомная масса (упрощенная) Концепция 2
1 м
Воспроизвести видео:
Было ли это полезно?
Теперь можно рассчитать атомную массу элемента, если известны массы изотопов и процентное содержание. Теперь изотопные массы – это массы всех изотопов данного элемента и процентное содержание, которое иногда называют естественным содержанием. Эти проценты доступны для каждого из изотопов данного элемента. Теперь его иногда называют вашим процентом естественного изобилия. Я знаю, что это немного избыточно, но просто помните, что вы можете увидеть процентное изобилие, естественное изобилие или процентное естественное изобилие. Теперь изотопное изобилие также называют вашим дробным изобилием. Это ваше процентное содержание изотопа, деленное на 100. И помните, что когда вы делите процент на 100, вы меняете его процентную форму на дробную или десятичную форму. Теперь все это вместе дает нам наш изотоп, нашу формулу атомной массы. Теперь мы скажем, что формула атомной массы равна изотопной массе изотопа, умноженной на его изотопное содержание. Плюс изотопная масса изотопа, в два раза превышающая его изотопное содержание. Теперь, конечно, если у вас есть более двух изотопов для данного элемента, это просто продолжится. Вы бы продолжали добавлять, скажем, плюс массу изотопа, в три раза превышающую его изотопное содержание, плюс массу изотопа, в четыре раза превышающую его изотопное содержание. В этом примере мы просто показываем, что этот конкретный элемент, о котором мы говорим, имеет два связанных с ним изотопа, и каждый из них имеет свою собственную массу. Но опять же, эта формула может быть расширена до еще большего количества изотопов в зависимости от того, какие элементы, такие как магний, имеют различные изотопы. Таким образом, их формулы будут намного больше.
Теперь все это вместе дает нам наш изотоп, нашу формулу атомной массы. Теперь мы скажем, что формула атомной массы равна изотопной массе изотопа, умноженной на его изотопное содержание. Плюс изотопная масса изотопа, в два раза превышающая его изотопное содержание. Теперь, конечно, если у вас есть более двух изотопов для данного элемента, это просто продолжится. Вы бы продолжали добавлять, скажем, плюс массу изотопа, в три раза превышающую его изотопное содержание, плюс массу изотопа, в четыре раза превышающую его изотопное содержание. В этом примере мы просто показываем, что этот конкретный элемент, о котором мы говорим, имеет два связанных с ним изотопа, и каждый из них имеет свою собственную массу. Но опять же, эта формула может быть расширена до еще большего количества изотопов в зависимости от того, какие элементы, такие как магний, имеют различные изотопы. Таким образом, их формулы будут намного больше.
5
пример
Атомная масса (упрощенный) Пример 2
2m
Воспроизвести видео:
Было ли это полезно?
в следующем примере. Вопрос: в нем говорится: вычислите атомную массу галлия, если галеон имеет два встречающихся в природе изотопа со следующими массами и естественным содержанием. Итак, здесь мы имеем дело с галлием 69 71. Их атомные массы записаны в атомных единицах массы, и тогда здесь мы имеем 60,11% и 39,89%. Те представляют процентное содержание, чтобы теперь найти атомную массу нашего элемента галлия. Давайте последуем первому шагу. Шаг первый говорит, что если вам даны процентные содержания, как мы были, мы собираемся разделить их на 100, чтобы изолировать наши дробные содержания. Итак, разделите их оба на y 100. Когда мы это сделаем, мы получим наше дробное изобилие. Итак, теперь у нас есть это в качестве нашего шага дробного содержания, чтобы включить заданные вами переменные в формулу атомной массы, чтобы изолировать недостающую переменную. Так что это просто простая алгебраическая ситуация. Наша атомная масса нашего элемента равна массе первого изотопа, умноженной на массу. Это дробное содержание плюс масса нашего второго изотопа, умноженная на время.
Вопрос: в нем говорится: вычислите атомную массу галлия, если галеон имеет два встречающихся в природе изотопа со следующими массами и естественным содержанием. Итак, здесь мы имеем дело с галлием 69 71. Их атомные массы записаны в атомных единицах массы, и тогда здесь мы имеем 60,11% и 39,89%. Те представляют процентное содержание, чтобы теперь найти атомную массу нашего элемента галлия. Давайте последуем первому шагу. Шаг первый говорит, что если вам даны процентные содержания, как мы были, мы собираемся разделить их на 100, чтобы изолировать наши дробные содержания. Итак, разделите их оба на y 100. Когда мы это сделаем, мы получим наше дробное изобилие. Итак, теперь у нас есть это в качестве нашего шага дробного содержания, чтобы включить заданные вами переменные в формулу атомной массы, чтобы изолировать недостающую переменную. Так что это просто простая алгебраическая ситуация. Наша атомная масса нашего элемента равна массе первого изотопа, умноженной на массу. Это дробное содержание плюс масса нашего второго изотопа, умноженная на время. Это дробное изобилие. Итак, когда мы это сделаем, мы получим 69. ты? Поскольку наши изотопные массы имеют четыре десятичных знака, мы могли бы следовать здесь четырем десятичным знакам. Но у нас есть несколько вариантов ответа, и мы выберем лучший ответ, который будет вариантом А для этого конкретного вопроса. Так что использовать формулу атомной массы довольно просто. Все, что нам нужно сделать, это собрать все переменные, которые вам дали, и выделить недостающую. Оттуда вы можете найти свой окончательный ответ.
Это дробное изобилие. Итак, когда мы это сделаем, мы получим 69. ты? Поскольку наши изотопные массы имеют четыре десятичных знака, мы могли бы следовать здесь четырем десятичным знакам. Но у нас есть несколько вариантов ответа, и мы выберем лучший ответ, который будет вариантом А для этого конкретного вопроса. Так что использовать формулу атомной массы довольно просто. Все, что нам нужно сделать, это собрать все переменные, которые вам дали, и выделить недостающую. Оттуда вы можете найти свой окончательный ответ.
6
Задача
На Земле существует только три изотопа магния. 24 Mg является наиболее распространенной формой с естественным содержанием 78,70% и массой 23,98504 а.е.м., 25 Mg имеет естественное содержание 10,13%, а 26 Mg имеет естественное содержание 11,17% и массу 25,98259 а.е.м. . Какова масса изотопа 25 Mg?
24.76171 AMU
24.99030 AMU
25.00138 AMU
25.38402 AMU
7
Проблема
Серебро имеет атомную массу 107,868 AMU.



 , у взрослых
– 20 г.).
, у взрослых
– 20 г.). 2 года) и токсичностью. Он
считается одним из наиболее значимых
радионуклидов продуктов ядерного деления
2 года) и токсичностью. Он
считается одним из наиболее значимых
радионуклидов продуктов ядерного деления Так
после аварии на ЧАЭС в 1990 гю вклад различных продуктов в
среднесуточное поступление радиоцезия в наиболее загрязненных
областях Беларуси был следующим: молоко – 19 %, мясо – 9 %,
рыба – 0.5 %, картофель – 46 %, овощи – 7.5 %, фрукты и ягоды – 5 %,
хлеб и хлебопродукты – 13 %. Регистрируют повышенное содержание
радиоцезия у жителей, потребляющих в больших количествах “дары
природы” (грибы, лесные ягоды и особенно дичь).
Так
после аварии на ЧАЭС в 1990 гю вклад различных продуктов в
среднесуточное поступление радиоцезия в наиболее загрязненных
областях Беларуси был следующим: молоко – 19 %, мясо – 9 %,
рыба – 0.5 %, картофель – 46 %, овощи – 7.5 %, фрукты и ягоды – 5 %,
хлеб и хлебопродукты – 13 %. Регистрируют повышенное содержание
радиоцезия у жителей, потребляющих в больших количествах “дары
природы” (грибы, лесные ягоды и особенно дичь).

 Однако у 89Sr относительно небольшой период полураспада и
со временем начинает превалировать 90Sr.
Однако у 89Sr относительно небольшой период полураспада и
со временем начинает превалировать 90Sr. Ингаляционный путь
имеет меньшее значение. Радиостронций избирательно откладывается в
костях, особенно у детей, подвергая кости и заключенный в них
костный мозг постоянному облучению.
Ингаляционный путь
имеет меньшее значение. Радиостронций избирательно откладывается в
костях, особенно у детей, подвергая кости и заключенный в них
костный мозг постоянному облучению.