Таблица Менделеева. Такая разная. : moris_levran — LiveJournal
1 марта 1869 года Менделеев закончил свою работу “Опыт системы элементов, основанной на их атомном весе и химическом сходстве”. Этот день считается днём открытия периодического закона элементов Д.М. Менделеева. “Открытие Д.И. Менделеева относится к фундаментальным законам мироздания, таким как закон всемирного тяготения Ньютона или теория относительности Эйнштейна, а Д.М. Менделеев стоит в одном ряду с именами этих великих физиков”. Академик А.И. Русанов.“Периодическая система как была, так и осталась в самых новейших решениях проблемы о веществе главной путеводной звездой”. Проф. А. Н. Реформатский.
“Когда подходишь к оценке личностей, подобных Д. И. Менделееву, к анализу их научного творчества, невольно является желание отыскать в этом творчестве элементы, всего более отмеченные печатью гения. Из всех признаков, отличающих гениальность и ее проявление, два, кажется, являются наиболее показательными: это, во-первых, способность охватывать и объединять широкие области знания и, во-вторых, способность к резким скачкам мысли, к неожиданному сближению фактов и понятий, которые для обыкновенного смертного кажутся далеко стоящими друг от друга и ничем не связанными, по крайнем мере до того момента, когда такая связь будет обнаружена и доказана”. Л. А. Чугаев, профессор химии.
Л. А. Чугаев, профессор химии.
Да и сам Менделеев понимал огромное значение открытого им закона для науки. И верил в его дальнейшее развитие. “По видимому, периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает”. Д.И. Менделеев.
Первоначальный вид таблицы, написанный рукой Д.И. Менделеева.
Если бы все научные знания мира пропали бы, из-за какого либо катаклизма, то для возрождения цивилизации одним из главных законов стал бы периодический закон Д.И. Менделеева. Успехи атомной физики, включая ядерную энергетику и синтез искусственных элементов, стали возможными лишь благодаря Периодическому закону. В свою очередь, они расширили и углубили сущность закона Менделеева.
Периодический закон сыграл огромную роль в развитии химии и других естественных наук. Была открыта взаимная связь между всеми элементами, их физическими и химическими свойствами. Это поставило перед естествознанием научно-философскую проблемы огромной важности: эта взаимная связь должно получить объяснение.
Открытию периодического закона предшествовало 15 лет напряженной работы. Ко времени открытия периодического закона было известно 63 химических элемента, существовало около 50 различных классификаций. Большинство ученых сравнивали между собой только сходные по свойствам элементы, поэтому не смогли открыть закон. Менделеев же сравнивал между собой все, в том числе и несходные элементы. Менделеев выписал на карточки все известные сведения об открытых и изученных в то время химических элементах и их соединениях, расположил их в порядке возрастания их относительных атомных масс и всесторонне проанализировал всю эту совокупность, пытаясь найти в ней определенные закономерности. В результате напряженного творческого труда он обнаружил в этой цепочке отрезки, в которых свойства химических элементов и образованных ими веществ изменялись сходным образом – периодически – периоды. С развитием учения о строении электронной оболочки атомов стало ясно, почему свойства атомов показывают периодичность с возрастанием атомной массы. Атомы с одинаковой внешней сферой составляют одну группу. Атомы с одинаковым числом внешних сфер — составляют один ряд. Атомы с ядрами, имеющими одинаковые заряды, но разные массы, обладают одинаковыми химическими свойствами, но разными атомными весами и представляют собой изотопы одного и того же химического элемента. По существу свойства атомов отражают свойства внешних электронных оболочек, которые тесно связанны с законами квантовой физики.
Атомы с одинаковой внешней сферой составляют одну группу. Атомы с одинаковым числом внешних сфер — составляют один ряд. Атомы с ядрами, имеющими одинаковые заряды, но разные массы, обладают одинаковыми химическими свойствами, но разными атомными весами и представляют собой изотопы одного и того же химического элемента. По существу свойства атомов отражают свойства внешних электронных оболочек, которые тесно связанны с законами квантовой физики.
Сама таблица Менделеева много раз трансформировалась, отображая разную информацию о свойствах атомов. Встречаются и курьёзные таблицы.
Так называемая короткопериодная или короткая форма ТМ
Длиннопериодная или длинная форма ТМ
Сверхдлинная.
Флаги государств, обозначающие страну, где впервые открыли данный элемент.
Названия элементов, которые были отменены или оказались ошибочными, как например, история с дидимом Di — оказался в дальнейшем смесью двух вновь открытых элементов празеодима и неодима.
Здесь синим цветом обозначены элементы, образованные во время Большого Взрыва, голубым – синтезированные во время первичного нуклеосинтеза, жёлтые и зелёные цвета обозначают элементы, синтезированные соответственно в недрах “малых” и “больших” звёзд. Розовым цветом – вещества (ядра), синтезируемые во время вспышек сверхновых звёзд. Кстати, золото (Au) ещё синтезируется во время столкновений нейтронных звёзд. Фиолетовые – созданные в лабораториях искусственно. Но это ещё не вся история…
Здесь разными цветами обозначены органические, неорганические и незаменимые элементы, необходимые для построения тел живых существ, в том числе и нас.
Таблица-башня
Предложена в 2006-ом Виталием Циммерманом на основе идей Чарльза Джанета. Он изучал орбитальное заполнение атомов — то, как располагаются электроны относительно ядра. И на основе этого разделил все элементы в четыре группы, рассортировав их по конфигурациям положения электронов.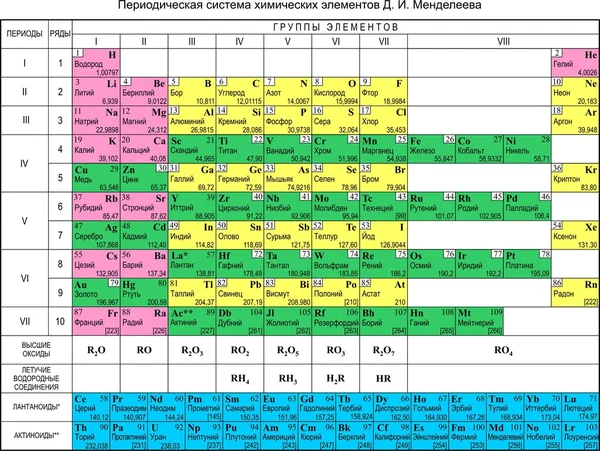 Таблица предельно проста и функциональна.
Таблица предельно проста и функциональна.
Таблица – спираль.
В 1964-ом Теодор Бенфей предложил поставить в центр таблицы водород (H), а прочие элементы разместить вокруг него по спирали, которая раскручивается по часовой стрелке. Уже на втором витке спираль вытягивается в петли, который соответствуют переходным металлам и лантаноидам с актиноидами, предусмотрено место для неизвестных пока суперактинидов. Это придает таблице вид экстравагантного дизайнерского решения.
Таблица – радужная спираль.
Изобретена в 1975 химиком Джеймсом Хайдом. Он увлекался кремнийорганическими соединениями, поэтому в основание таблицы попал именно кремень, так как у него большое число связей с другими элементами. Различные категории элементов так же объединены по секторам и отмечены нужным цветом. Таблица красивее аналогов, но из-за криволинейной формы пользоваться ею непросто.
Эти таблицы отображают последовательность заполнения электронных оболочек. Во всяком случае некоторые из них. Все эти таблицы выглядят весьма экзотично.
Во всяком случае некоторые из них. Все эти таблицы выглядят весьма экзотично.
Таблица изотопов. Здесь отображено время “жизни” различных изотопов, их стабильность в зависимости от массы ядра. Впрочем, это уже не таблица Менделеева, это совсем другая (ядерная физика) история…
В кварцевом стекле записали таблицу Менделеева
18 мая 2020
Индикаториещё 2
Исследователи из РХТУ им. Д.И. Менделеева создали изображение таблицы Менделеева в кварцевом стекле размером 3,6х2,4 мм. Для этого использовали метод фемтосекундной лазерной записи, перспективный для использования в технологиях сверхплотного хранения данных в стекле. Работа ученых опубликована в специальном номере журнала Frontiers in Chemistry.
Фото: Shakhgildyan, G. et. al./Frontiers in Chemistry/Indicator.RuShakhgildyan, G. et. al./Frontiers in Chemistry/Indicator.Ru
Стекла используются человеком уже более пяти тысяч лет, и за это время успели прочно войти в нашу жизнь.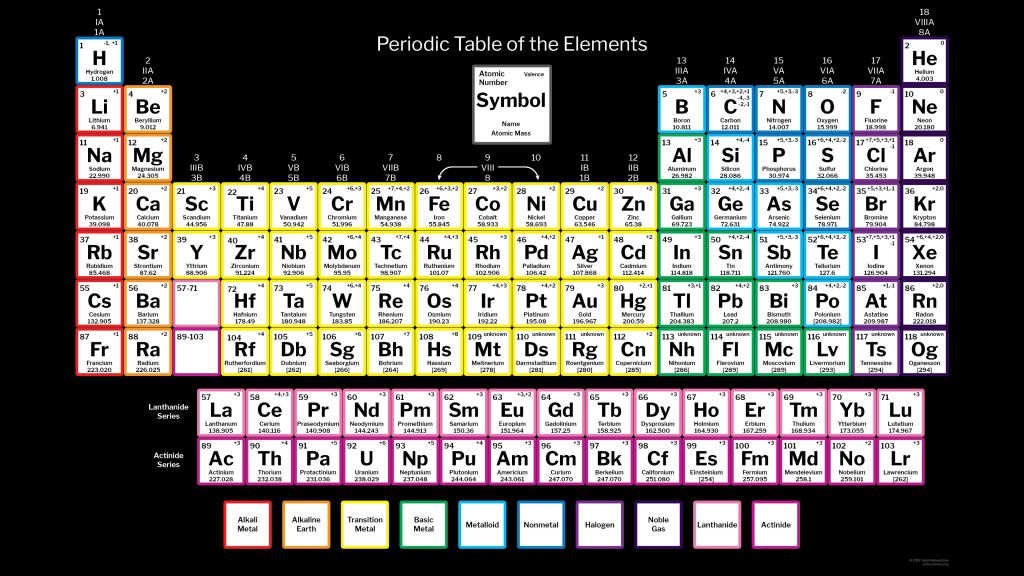 Но несмотря на такую распространенность, этот класс материалов до сих пор пополняется новыми представителями, у которых открываются новые свойства.
Но несмотря на такую распространенность, этот класс материалов до сих пор пополняется новыми представителями, у которых открываются новые свойства.
Видео дня
Почти 95% всех стекол — силикатные. Они изготавливаются из сырья, главный компонент которого — оксид кремния. Но кроме него в стеклах встречается почти вся таблица Менделеева. Для придания стеклу нужных свойств (например, прочности, химической стойкости или цвета) в него включают оксиды натрия, алюминия, бора, кальция, хрома и так далее.
Новое исследование российских ученых отражает это богатство элементов в виде миниатюрной таблицы Менделеева, выгравированной в толще стекла. Сделать это удалось благодаря использованию фемтосекундных лазеров, которые испускают очень короткие импульсы света. Такие импульсы хоть и длятся очень мало, но имеют высокую интенсивность излучения, что позволяет точечно менять структуру материала. В операциях на глазах врачи используют фемтосекундные лазеры, чтобы аккуратно разрезать и сшивать живые ткани. Применение этой технологии в стеклах позволяет создавать внутри них миниатюрные оптические элементы: волноводы, каналы, переключатели.
Применение этой технологии в стеклах позволяет создавать внутри них миниатюрные оптические элементы: волноводы, каналы, переключатели.
Авторы новой работы воспользовались фемтосекундным лазером для создания внутри кварцевого стекла нанорешеток, обладающих свойством двулучепреломления. Это значит, что луч, проходящий через область с такой периодической структурой, разделяется на две компоненты, которые идут через материал разными путями и с разной скоростью, а затем соединяются на выходе из него. Благодаря этому внутри стекла и появляется интерференционная окраска.
Цветом полученного узора можно управлять, изменяя интенсивность лазерного излучения и последовательно нанося слои нанорешеток друг на друга. Авторы изменяли эти параметры от одной ячейки таблицы к другой, что позволило сделать их цветными. Но в обычный оптический микроскоп разглядеть их нельзя, и все ячейки окрашены только в разные оттенки коричневого цвета. Увидеть всю гамму можно только если в микроскоп вставить скрещенные поляризаторы.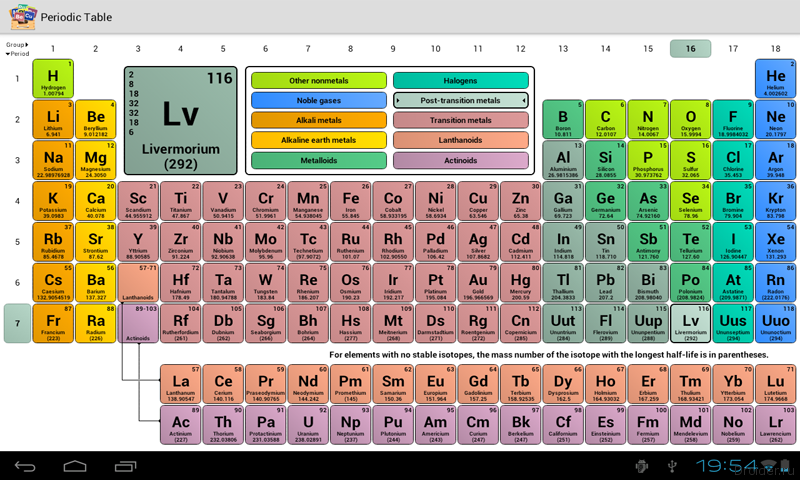 Ученые создали шесть основных типов элементов (щелочные металлы, инертные газы и др.) в шести разных оттенках коричневого и голубого.
Ученые создали шесть основных типов элементов (щелочные металлы, инертные газы и др.) в шести разных оттенках коричневого и голубого.
Общий размер таблицы получился 3,6 на 2,4 мм — ее можно поместить на кончике ногтя. Каждая ячейка с химическим элементом оказалась размером всего 200*200 микрометров. Одно из важных преимуществ такой «татуировки» на стекле — ее термическая устойчивость. Эксперименты показали, что нагрев до 900 °С и резкое охлаждение стекла не влияет на изображение записанной таблицы. Это значит, что такой метод позволяет надежно хранить информацию долгие годы, защищая ее от негативных воздействий.
Наука и техника,
1Периодическая таблица с цветовой кодировкой – Научные тенденции
Периодическая таблица с цветовой кодировкой представляет собой табличное представление различных химических элементов. Элементы в периодической таблице могут быть объединены цветовой кодировкой в соответствии с атомным номером, электронной конфигурацией и повторяющимися химическими свойствами. Поскольку существует множество способов классификации элементов, существует ряд схем цветового кодирования, которые мы могли бы использовать для обозначения конкретных свойств, общих для групп элементов.
Поскольку существует множество способов классификации элементов, существует ряд схем цветового кодирования, которые мы могли бы использовать для обозначения конкретных свойств, общих для групп элементов.
Одним из наиболее распространенных способов группировки элементов в периодической таблице является группировка, основанная на общем типе элемента, например, по категориям, металлы, неметаллы и металлоиды.
Что такое периодическая таблица?
Сначала немного общих фактов о периодической таблице. Каждая ячейка в периодической таблице имеет символ элемента, атомный номер элемента, который соответствует количеству протонов в атоме этого элемента, и средний атомный вес этого элемента. Периодическая таблица организована в виде матрицы горизонтальных строк и вертикальных столбцов, называемых 9.0009 периодов и групп соответственно. Элементы, расположенные в периоде, демонстрируют повторяющиеся химические свойства при движении слева направо. Например, элементы в самой левой части строк имеют мало внешних электронов на своих внешних оболочках, и их число увеличивается по мере продвижения слева направо.
«Чем океан был для ребенка, тем периодическая таблица для химика». — Карл Бэрри Шарплесс
Эти периодические изменения соответствуют периодическим изменениям в химическом поведении элементов по мере продвижения по ряду. В результате элементы, расположенные в одних и тех же группах, обладают сходными химическими свойствами. Например, углерод находится в той же группе, что и кремний, поскольку оба они обладают схожими химическими свойствами. И углерод, и кремний имеют 4 открытых валентных электрона, что объясняет, почему они обладают схожими химическими свойствами. Точно так же и фтор, и хлор являются галогенами и характеризуются своей тенденцией спонтанно образовывать сильные ионные связи с электроотрицательно слабыми элементами.
Теперь, когда у нас есть некоторые основы периодической таблицы, давайте перейдем к конкретным способам организации химических элементов.
Периодическая таблица с цветовой кодировкой по типу элемента
«Simple Periodic Table Chart-en» Offnfopt через Wikimedia Commons, лицензия CC0
На приведенной выше фотографии элементы имеют цветовую кодировку в соответствии с общим типом вещества, которое элемент попадает под. В целом химики делят элементы на три основных типа: металлы (фиолетовые), неметаллы (синие) и металлоиды (зеленые). Хотя эти категории широко используются, краевые классификации имеют несколько нечеткие границы. Например, в некоторых случаях мышьяк может быть классифицирован как металл из-за его сильных проводящих свойств. В других случаях мышьяк классифицируется как металлоид, поскольку он является хрупким при комнатной температуре и легко растворяется в воде. Эти нечеткие границы просто отражают тот факт, что нет единого мнения о том, какие элементы подпадают под эти категории, но в целом ученые работают с этим общим пониманием разделения типов элементов.
В целом химики делят элементы на три основных типа: металлы (фиолетовые), неметаллы (синие) и металлоиды (зеленые). Хотя эти категории широко используются, краевые классификации имеют несколько нечеткие границы. Например, в некоторых случаях мышьяк может быть классифицирован как металл из-за его сильных проводящих свойств. В других случаях мышьяк классифицируется как металлоид, поскольку он является хрупким при комнатной температуре и легко растворяется в воде. Эти нечеткие границы просто отражают тот факт, что нет единого мнения о том, какие элементы подпадают под эти категории, но в целом ученые работают с этим общим пониманием разделения типов элементов.
Металлы
Элементы, классифицируемые как металлы, объединены своей склонностью к образованию катионов, вступают в металлические химические связи с другими металлами, склонны к окислению и обычно являются хорошими проводниками тепла и электричества. Металлы представляют самую большую классификацию типов элементов, поскольку примерно 95 из 118 обнаруженных элементов являются металлами.
Когда металлические элементы образуют соединения, их связи характеризуются делокализацией электронных пар. Другими словами, соединение металла можно рассматривать как положительно заряженную решетку катионов, которая свободно делит электроны по своей структуре. Химическая природа металлических связей объясняет многие уникальные свойства металлов, такие как их прочность, долговечность, блеск и проводящие свойства. Категорию металлов можно дополнительно разделить на черные (магнитные) и цветные металлы, щелочные, переходные и неблагородные металлы и так далее. В зависимости от того, какие именно свойства металлов интересуют исследователя, они будут классифицировать их по разным подгруппам.
Неметаллы
Проще говоря, неметалл в таблице Менделеева — это элемент, у которого в основном отсутствуют какие-либо металлические свойства. Неметаллы обычно имеют низкие температуры плавления и кипения, обычно становятся хрупкими при комнатной температуре, плохо проводят тепло и электричество и обычно вступают в ковалентные или ионные связи с другими элементами.
Неметаллы можно разделить на две категории: инертные газы и химически активные неметаллы . Благородные газы, которые составляют крайнюю левую группу периодической таблицы и включают такие элементы, как неон или аргон, характеризуются своей химической инертностью. Благородные газы химически инертны, потому что они имеют полную валентную оболочку электронов и, следовательно, имеют очень стабильную электронную конфигурацию. Реакционноспособные неметаллы, как следует из названия, относятся к любым неметаллам, которые легко реагируют с другими элементами. Менее электроотрицательные неметаллы, такие как углерод или сера, склонны образовывать ковалентные связи, разделяя электроны. Более электроотрицательные неметаллы, такие как кислород или галогены (группа 7), гораздо более реакционноспособны и легко образуют прочные ионные связи с металлами.
«Чудо — самый тяжелый элемент в периодической таблице. Даже малюсенькая его частичка останавливает время».
— Дайан Акерман
Металлоиды
Средние части периодической таблицы занимают малонаселенные металлоиды (полуметаллы). Как следует из названия, металлоиды обладают уникальной смесью металлических и неметаллических свойств, так что металлоиды не попадают четко ни в категорию металлов, ни в категории неметаллов. Шесть наиболее известных металлоидов — это бор, кремний, мышьяк, германий, сурьма и теллур. Подобно металлам, металлоиды обладают характерным блеском и обычно хорошо проводят тепло и электричество. Как и неметаллы, металлоиды обычно хрупкие при комнатной температуре и обычно образуют ковалентные связи с другими элементами.
Одним из наиболее важных видов металлоидов является кремний, полупроводник, сформировавший основу современной электронной промышленности. Кремний является относительно дешевым и широко распространенным природным материалом, который обладает сильными проводящими свойствами при комнатной температуре и является идеальным проводником для использования в современной электронике.
Существует ряд других способов организации элементов в периодической таблице. Элементы можно систематизировать по их электроотрицательности, связывающим свойствам, способности растворяться в растворителях, энергии ионизации или конфигурации электронной орбиты. Организация по общему типу элементов просто представляет собой один из способов, которым химики пытались каталогизировать широкий спектр природных химических элементов.
Периодическая таблица с цветами элементов
Периодическая таблица с цветами элементовФормы периодической таблицы средней длины с цветами элементов.
Ограниченный поиск периодической таблицы с цветами
элементов еще не нашел таблицу этого типа. Однако Теодор Грей
создал много замечательных таблиц, в том числе одну с изображениями аутентичных
образцы элементов (http://periodictable.com/) и коммерчески
доступная модель, содержащая выборку большинства элементов (http://www.periodictable.co.uk/). Хотя приведенные ниже таблицы не так
увлекательными или интересными, как таблицы Грея, приведенные ниже таблицы были разработаны
чтобы зрители могли сосредоточиться на свойстве цвета. Большинство цветов имеют
были извлечены с https://www.chemicool.com/ в первую очередь потому, что часто
включает двухсловное описание цвета. Другие упомянутые сайты были
http://periodictable.com/Properties/A/Color.html Теодора Грея и Марк
https://www.webelements.com/ . Для некоторых элементов цвета, перечисленные на
Интернет-сайты не всегда согласны. Рене Вернон, автор статьи
по металлоидам, https://pubs.acs.org/doi/pdfplus/10.1021/ed3008457
дал ценные комментарии о цветах бора, фосфора, йода,
цезий и астат. Некоторые из этих проблем с цветом связаны с тем, что самые стабильные
аллотроп (например, фосфор) не всегда является самым распространенным аллотропом.
Большинство цветов имеют
были извлечены с https://www.chemicool.com/ в первую очередь потому, что часто
включает двухсловное описание цвета. Другие упомянутые сайты были
http://periodictable.com/Properties/A/Color.html Теодора Грея и Марк
https://www.webelements.com/ . Для некоторых элементов цвета, перечисленные на
Интернет-сайты не всегда согласны. Рене Вернон, автор статьи
по металлоидам, https://pubs.acs.org/doi/pdfplus/10.1021/ed3008457
дал ценные комментарии о цветах бора, фосфора, йода,
цезий и астат. Некоторые из этих проблем с цветом связаны с тем, что самые стабильные
аллотроп (например, фосфор) не всегда является самым распространенным аллотропом.
бор – наиболее стабильный аллотроп бора – бета-ромбоэдрический кристаллический состояние. Цвета, сообщаемые для этого состояния, варьируются от блестящего серебристо-серого до серого и темный до черного. В таблице он представлен темно-серым цветом.
фосфор — наиболее стабильный аллотроп — черный, но наиболее распространенная форма —
описывается как от белого до бледно-желтого.
йод – хотя иногда упоминается серебро, подавляющее большинство сходятся во мнении, что кристаллы йода окрашены в фиолетовый или фиолетовый цвет.
астатин – хотя астат был обнаружен из-за его временного существования, по-видимому, не удалось определить его цвет. Некоторые веб-сайты сделать вывод, что он должен обладать некоторыми металлическими свойствами и в результате иметь серебристый цвет. Другие веб-сайты предлагают по мере продвижения вниз по группе 7A. (17), цвет постоянно темнеет с предположением, что астат должен быть рядом черный. Он оставлен в этих таблицах как неизвестный, как франций и элементы с атомными номерами выше 99.
Приведенные выше таблицы были разработаны таким образом, чтобы содержать элементы, окрашенные так, чтобы они напоминали фактические цвета элементов. Периодические таблицы с цветами элементов могут также можно найти на нескольких веб-сайтах:
http://murov.

 — Дайан Акерман
— Дайан Акерман